| Momentum—pemviduTide 第 2 階段 肥胖試驗 第 24 週中期分析 納斯達克:ALT M. Scott Harris,醫學博士,首席醫療官 路易斯·阿隆,醫學博士,首席研究員 桑福德·威爾代謝研究教授 威爾康奈爾醫學院臨牀醫學教授 2023 年 3 月 21 日 |
| 前瞻性陳述 安全港聲明 本演示文稿由Altimmune, Inc.(“我們”、“我們的”、“Altimmune” 或 “公司”)編寫,包括某些內容 1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”,包括相關的陳述 未來的財務或業務業績、狀況、計劃、前景、趨勢或戰略以及其他財務和業務 事項,包括但不限於我們臨牀資產關鍵里程碑的時機、2期肥胖症臨牀試驗的時機 pemvidutide、我們的候選藥物在正在進行和未來的臨牀試驗中的表現以及監管部門批准的前景, 商業化或銷售任何產品或候選藥物。此外,當或如果在本新聞稿中使用 “可能”、“可以” 等字樣 “應該”、“預測”、“相信”、“估計”、“期望”、“打算”、“計劃”、“預測” 和類似的表達式及其變體,就像它們一樣 與公司有關可能會確定前瞻性陳述。公司警告説,這些前瞻性陳述是 受眾多假設、風險和不確定性的影響,這些假設、風險和不確定性會隨着時間的推移而變化。可能導致實際結果的重要因素 與前瞻性陳述中討論的結果有重大差異或歷史經驗包括風險和不確定性, 包括監管審查延遲, 生產和供應鏈中斷, 臨牀場所准入, 入院登記等風險, 對醫療系統的不利影響和全球經濟的混亂;影響對象的基線特徵,包括 體重,取決於未來試驗的成功;與人體安全和可能的不良反應有關的研究結果的可靠性 管理公司候選產品所產生的影響;公司進行臨牀試驗的能力 關於預期時間表的材料;以及未來產品進展的成功,包括未來臨牀試驗的成功。 有關可能影響公司業務、財務狀況和經營業績的因素和風險的更多信息 包含在公司向美國證券交易委員會提交的文件中,包括 “風險因素” 標題下 在公司最新的10-K表年度報告以及我們向美國證券交易委員會提交的其他文件中,這些文件可在www.sec.gov上查閲。 2 |
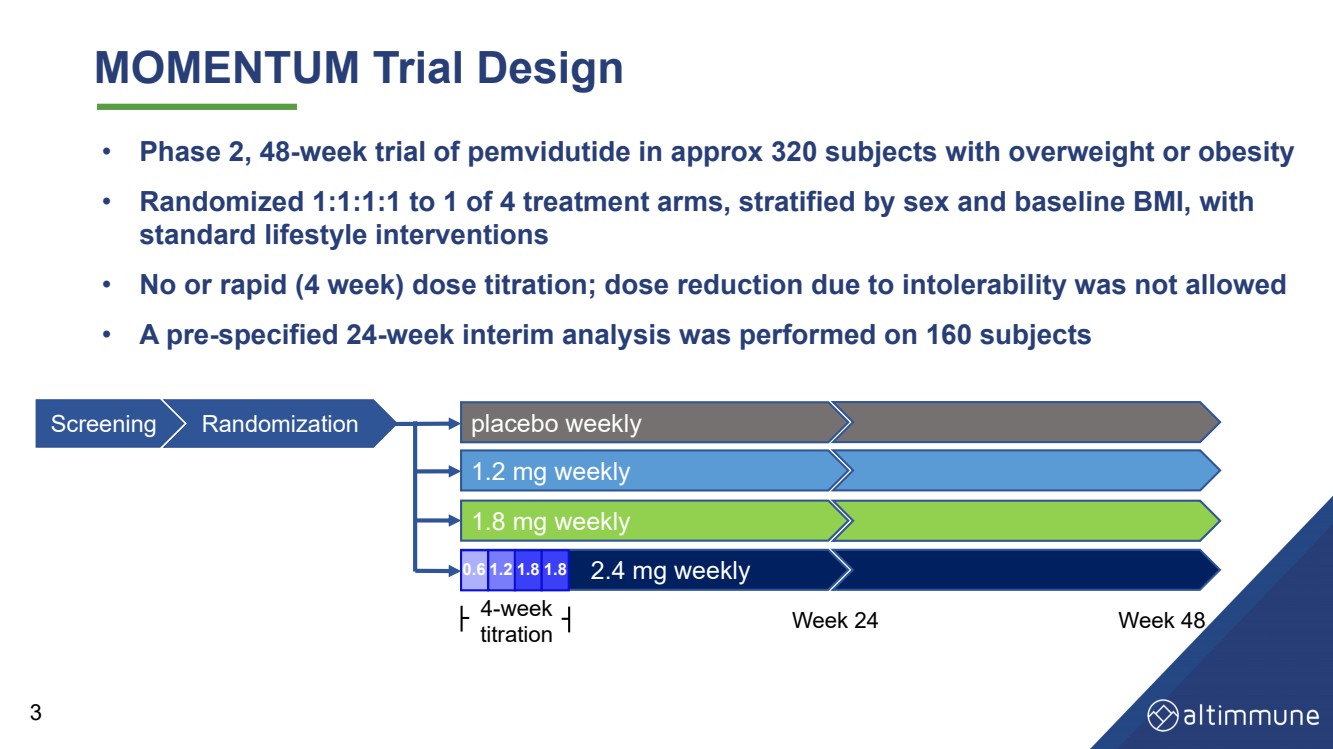
| MOMENTIM 試驗設計 • 在大約 320 名超重或肥胖受試者中進行了為期 48 周的 pemvidutide 試驗 • 4 個治療組中的 1 個隨機分組 1:1:1,按性別和基線 BMI 進行分層, 標準生活方式幹預措施 • 無劑量滴定或快速(4 周)劑量滴定;不允許因不耐受而減少劑量 • 對160名受試者進行了預先規定的為期24周的中期分析 0。 6 1.2 1.8 1.8 安慰劑週報 每週 1.8 毫克 每週 2.4 毫克 每週 1.2 毫克 4 周 滴定第 24 周第 48 周 篩選隨機化 0.6 1.2 1.8 1.8 3 |
| 研究人羣——關鍵資格標準 • 年齡 18-75 歲的男性和女性 • BMI ≥ 30 kg/m2 或 BMI ≥ 27 kg/m2 且至少存在一種肥胖相關合並症 -心血管疾病史 -高血壓 -血脂異常 -糖尿病前期 -阻塞性睡眠呼吸暫停 • 非糖尿病:HbA1c ≤ 6.5%,空腹血糖 ≤ 125 mg/dL • 至少一次減肥嘗試失敗 • 至少有大約 25% 的受試者是男性 4 |
| 研究終點 功效 • 主要終點: • 體重與基線相比的相對變化 (%) • 關鍵輔助端點: • 體重減輕≥ 5%、≥ 10% 和 ≥ 15% 的受試者比例(%) • 腰圍、血清脂質、血壓與基線相比的變化 安全 • 不良事件 (AE) • 嚴重和嚴重 AE • 導致停產的 AE • 胃腸道 (GI) AE • 心率 • 葡萄糖動態平衡 5 |
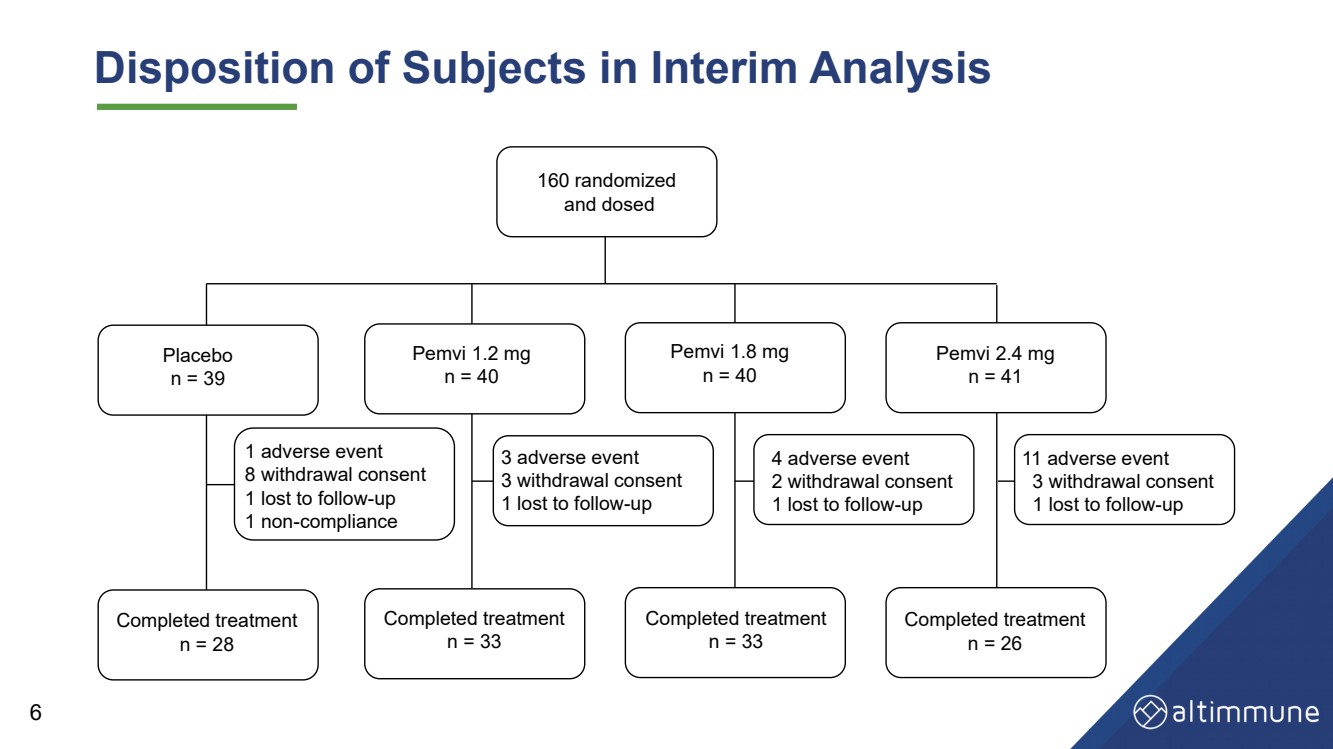
| 中期分析中受試者的處境 160 隨機化 並給藥 安慰劑 n = 39 Pemvi 1.2 毫克 n = 40 Pemvi 1.8 毫克 n = 40 Pemvi 2.4 毫克 n = 41 治療已完成 n = 28 治療已完成 n = 33 治療已完成 n = 26 3 不良事件 3 撤回同意 1 人因後續行動而丟失 4 不良事件 2 撤回同意 1 人因後續行動而丟失 2 提款 c2 治療已完成 n = 33 1 個不良事件 8 撤回同意 1 人因後續行動而丟失 1 違規行為 11 個不良事件 3 撤回同意 1 人因後續行動而丟失 6 |
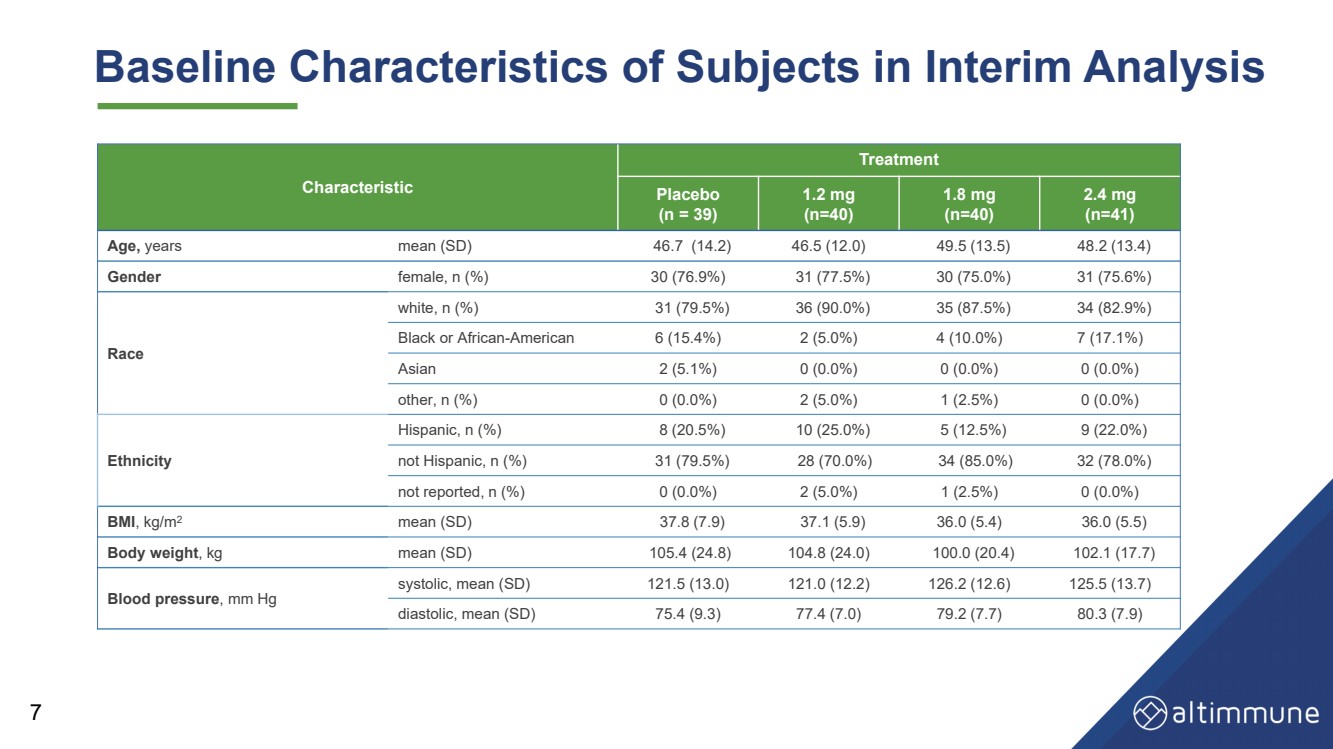
| 中期分析中受試者的基線特徵 7 特徵 治療 安慰劑 (n = 39) 1.2 毫克 (n = 40) 1.8 毫克 (n = 40) 2.4 毫克 (n = 41) 年齡、年平均值 (SD) 46.7 (14.2) 46.5 (12.0) 49.5 (13.5) 48.2 (13.4) 性別女性,n (%) 30 (76.9%) 31 (77.5%) 30 (75.0%) 31 (75.6%) 種族 白色,n (%) 31 (79.5%) 36 (90.0%) 35 (87.5%) 34 (82.9%) 黑人或非裔美國人 6 (15.4%) 2 (5.0%) 4 (10.0%) 7 (17.1%) 亞洲人 2 (5.1%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 其他,n (%) 0 (0.0%) 2 (5.0%) 1 (2.5%) 0 (0.0%) 種族 西班牙裔,n (%) 8 (20.5%) 10 (25.0%) 5 (12.5%) 9 (22.0%) 不是西班牙裔,n (%) 31 (79.5%) 28 (70.0%) 34 (85.0%) 32 (78.0%) 未報告,n (%) 0 (0.0%) 2 (5.0%) 1 (2.5%) 0 (0.0%) BMI,kg/m2 平均值 (SD) 37.8 (7.9) 37.1 (5.9) 36.0 (5.4) 36.0 (5.4) 36.0 (5.5) 體重,kg 平均值 (SD) 105.4 (24.8) 104.8 (24.0) 100.0 (20.4) 102.1 (17.7) 血壓,mm Hg 收縮壓,平均值 (SD) 121.5 (13.0) 121.0 (12.2) 126.2 (12.6) 125.5 (13.7) 舒張,平均值 (SD) 75.4 (9.3) 77.4 (7.0) 79.2 (7.7) 80.3 (7.9) |
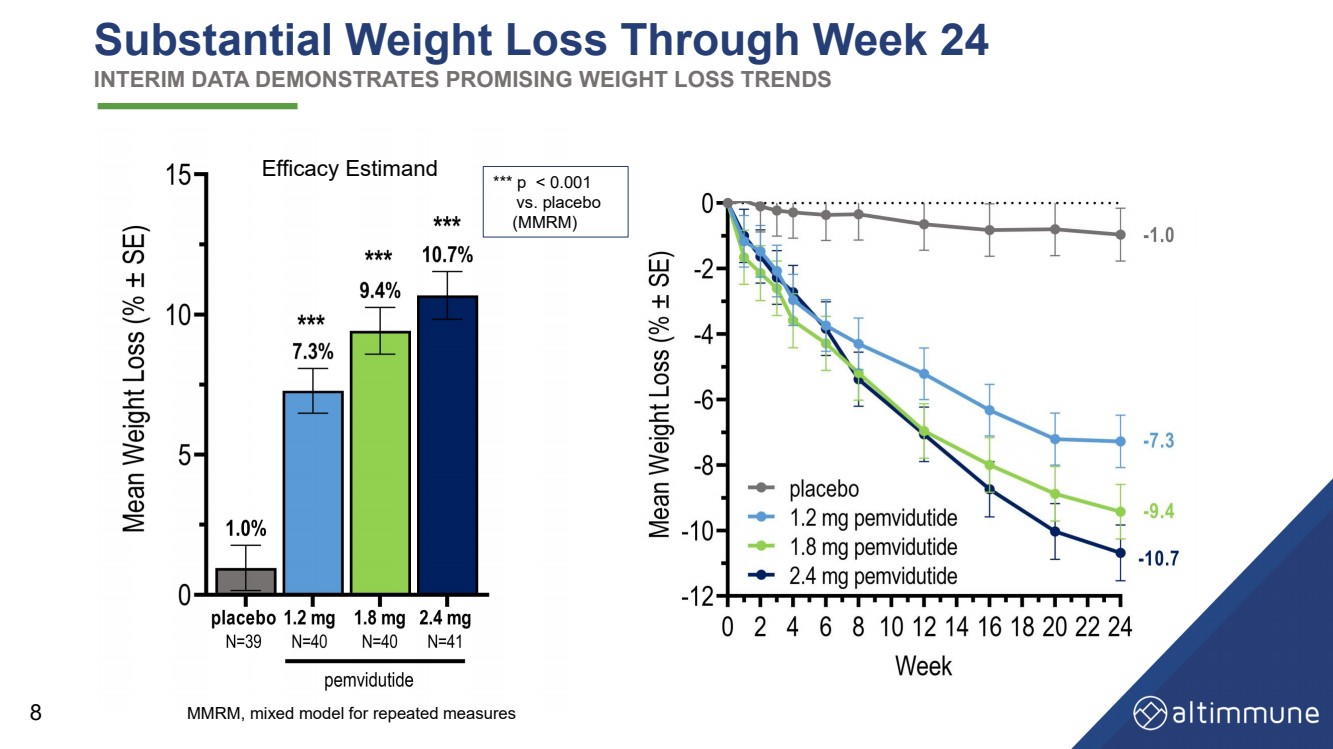
| 到第 24 周體重大幅減輕 中期數據顯示出令人鼓舞的減肥趨勢 8 功效估計 MMRM,重複測量的混合模型 *** p |
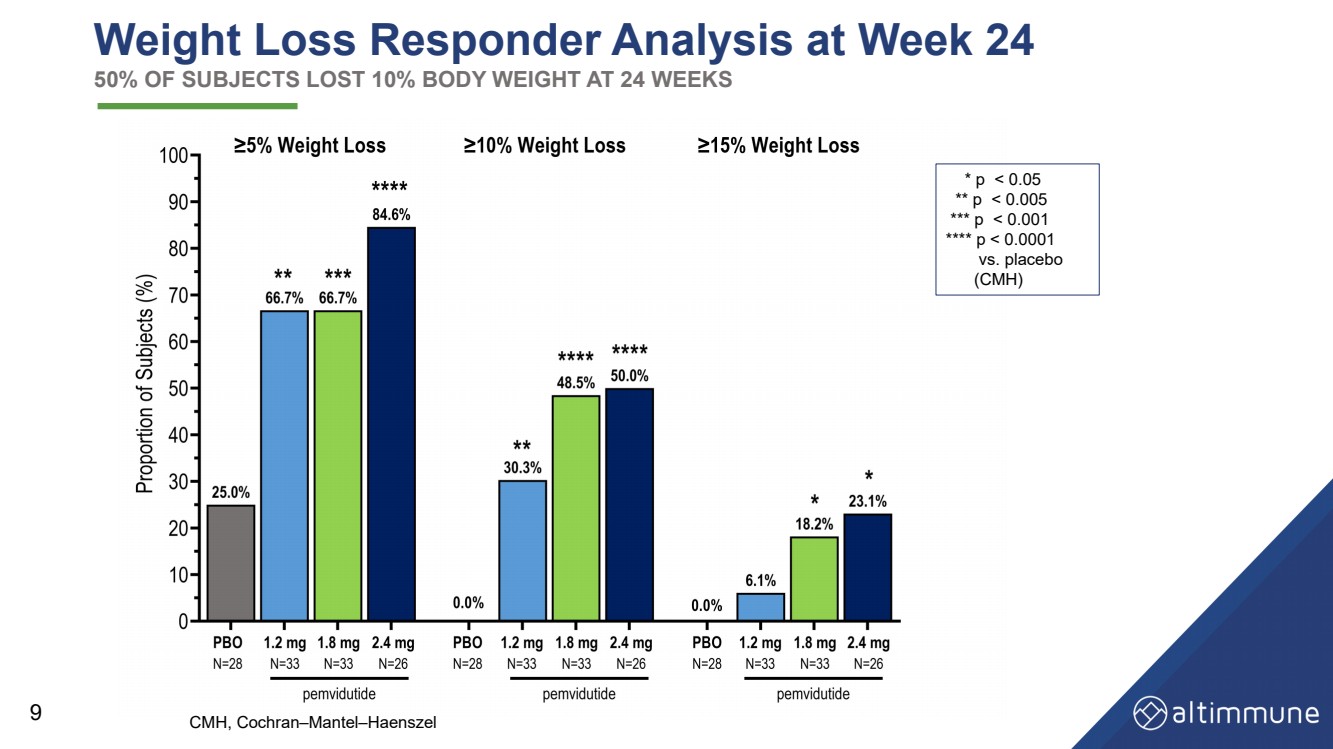
| 第 24 周的減肥響應者分析 50% 的受試者在 24 周內體重減輕了 10% 9 * p |
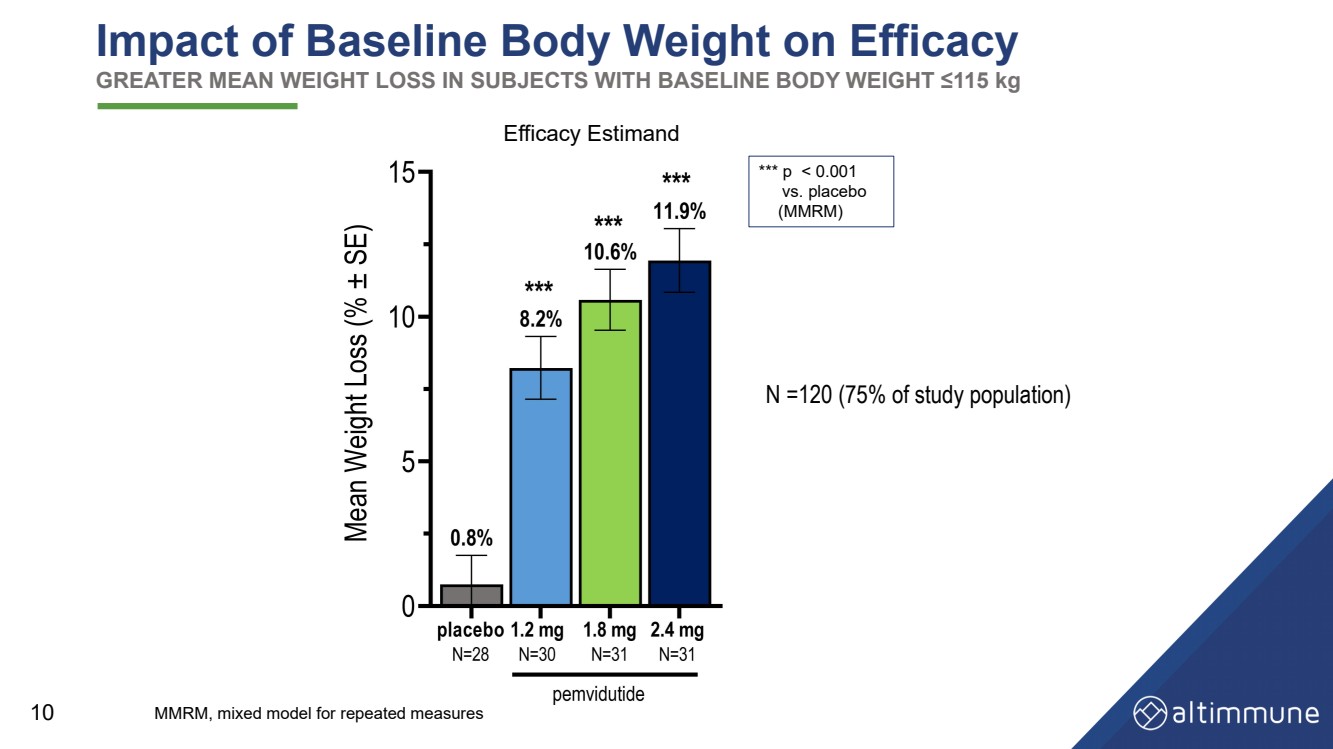
| 10 基準體重對療效的影響 基線體重 ≤115 kg 的受試者的平均體重減輕幅度更大 功效估計 N =120(佔研究人口的 75%) *** p |
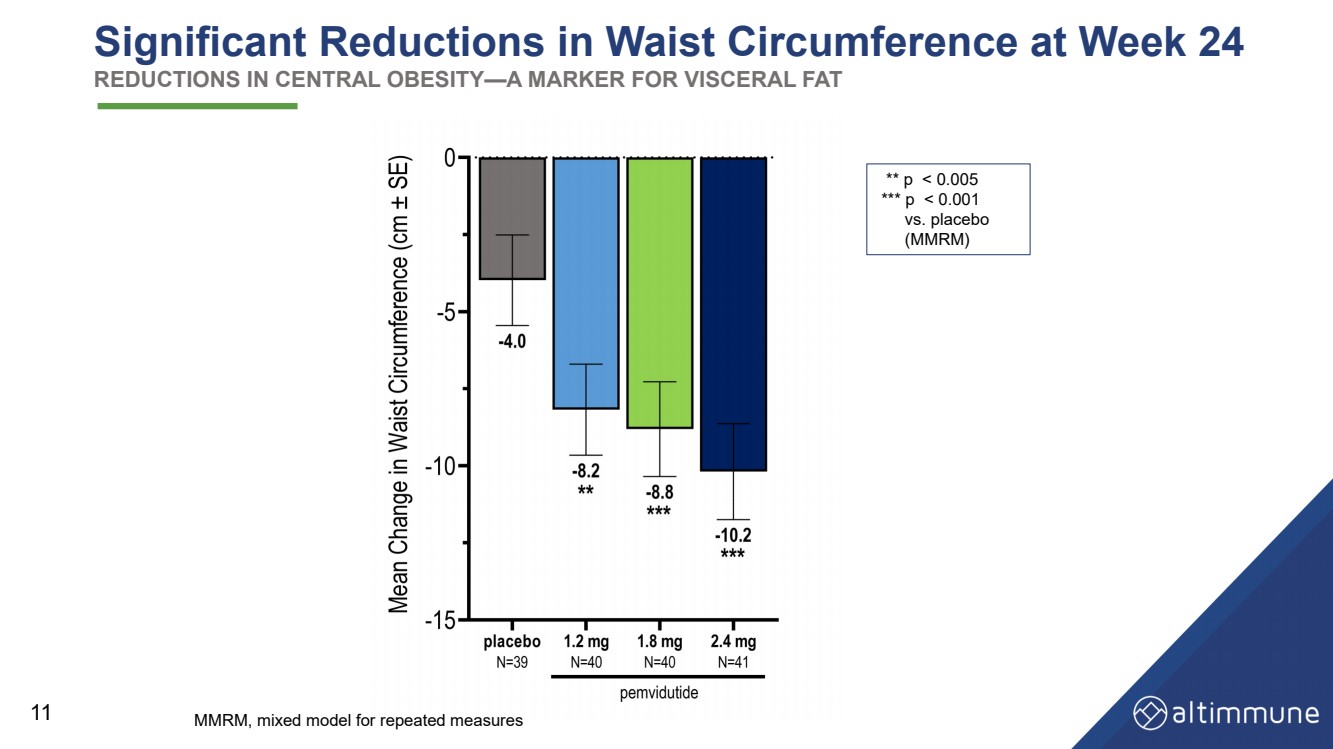
| 第 24 周腰圍顯著減少 減少中樞肥胖——內臟脂肪的標誌 11 ** p |
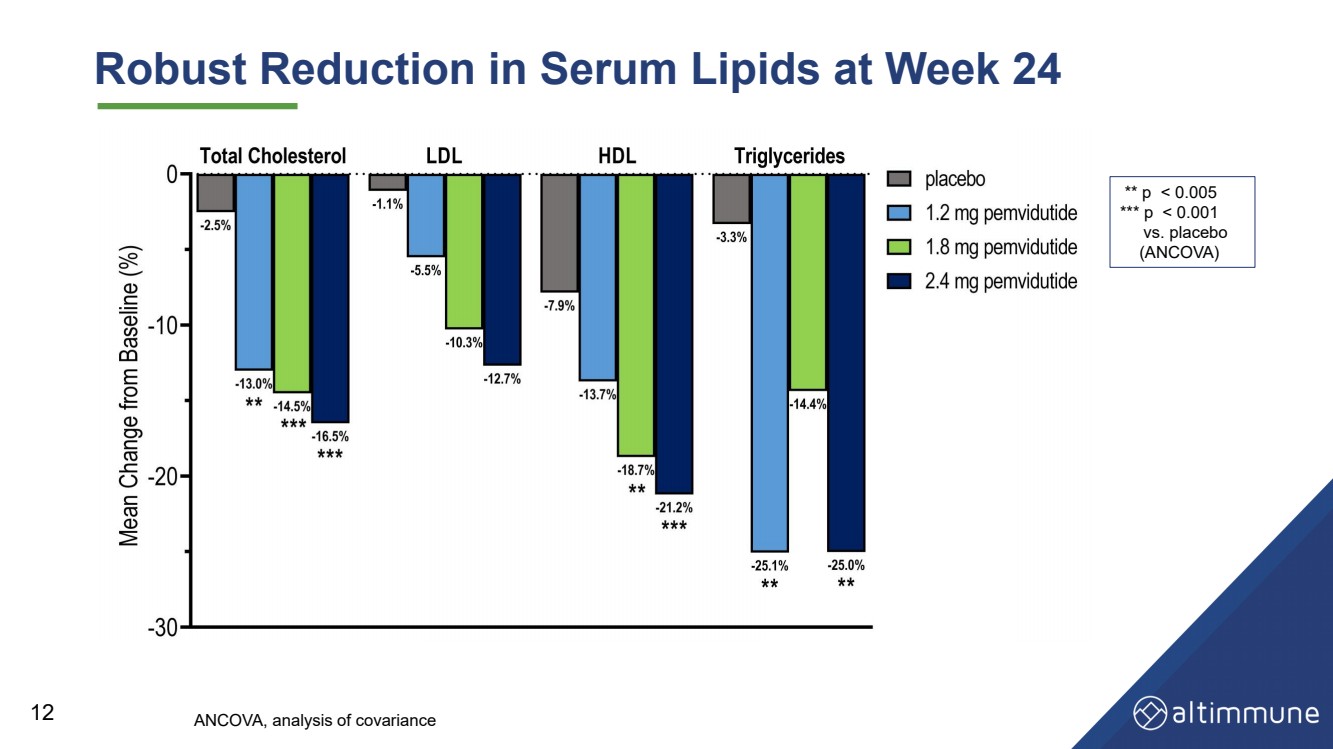
| 第 24 周血清脂質大幅減少 12 ** p |
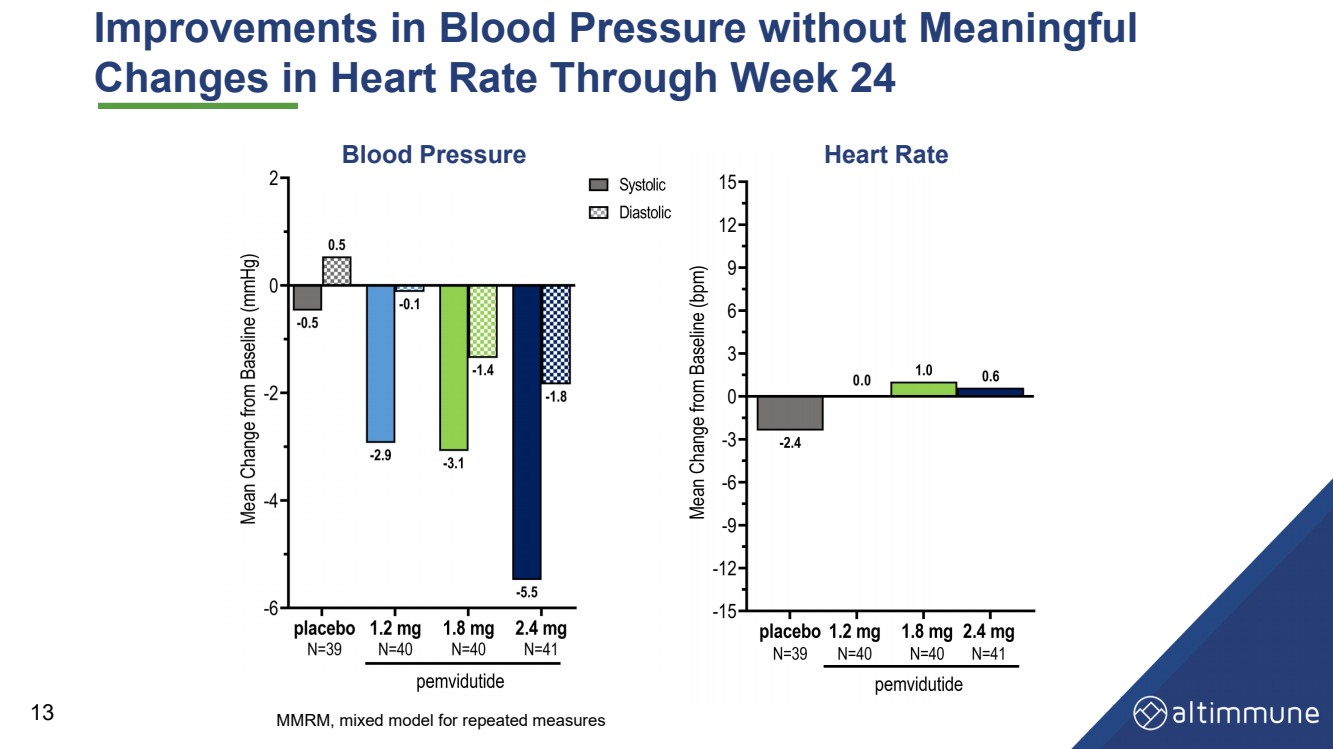
| 血壓的改善毫無意義 截至第 24 周的心率變化 13 血壓心率 MMRM,重複測量的混合模型 |
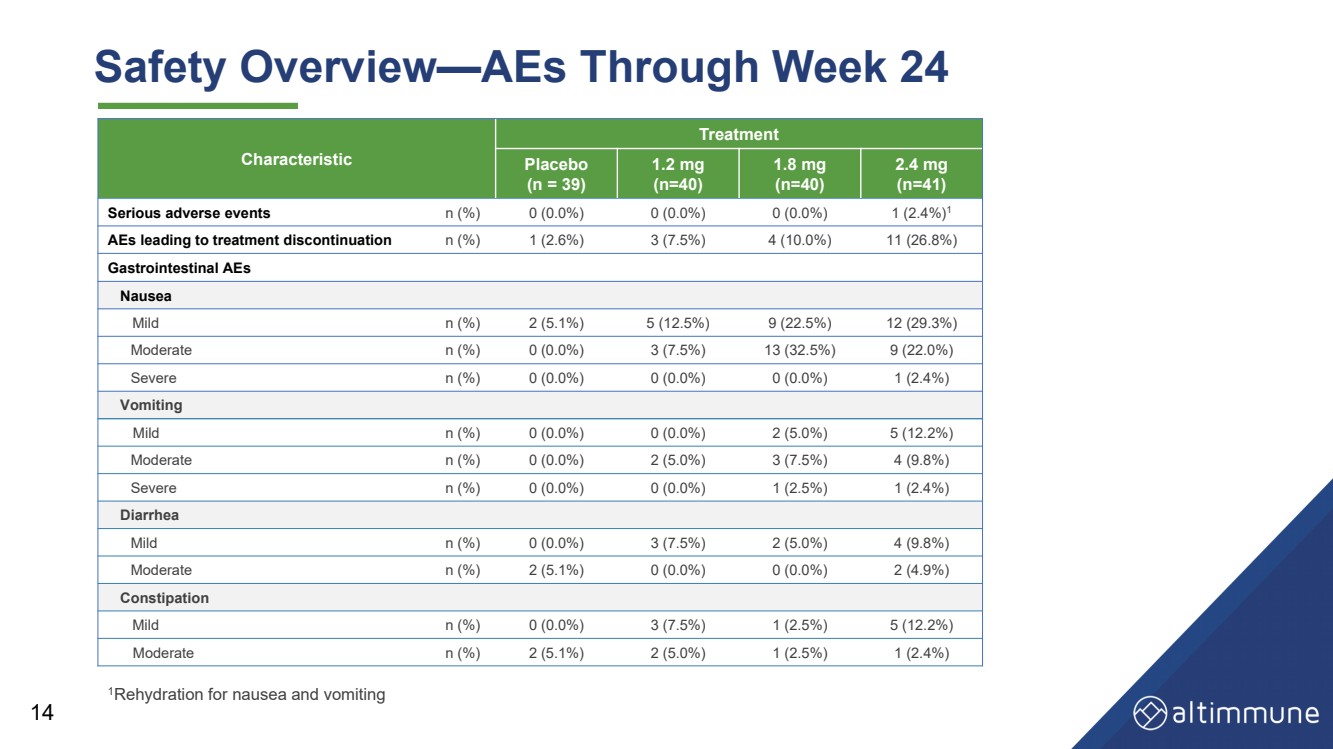
| 14 安全概述——第 24 周的 AES 1補液治療噁心和嘔吐 特徵 治療 安慰劑 (n = 39) 1.2 毫克 (n = 40) 1.8 毫克 (n = 40) 2.4 毫克 (n = 41) 嚴重不良事件 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (2.4%) 1 導致停止治療的不良反應n (%) 1 (2.6%) 3 (7.5%) 4 (10.0%) 11 (26.8%) 胃腸道不良反應 噁心 輕度 n (%) 2 (5.1%) 5 (12.5%) 9 (22.5%) 12 (29.3%) 中等 n (%) 0 (0.0%) 3 (7.5%) 13 (32.5%) 9 (22.0%) 嚴重 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (2.4%) 嘔吐 輕度 n (%) 0 (0.0%) 0 (0.0%) 2 (5.0%) 5 (12.2%) 中等 n (%) 0 (0.0%) 2 (5.0%) 3 (7.5%) 4 (9.8%) 嚴重 n (%) 0 (0.0%) 0 (0.0%) 1 (2.5%) 1 (2.4%) 腹瀉 輕度 n (%) 0 (0.0%) 3 (7.5%) 2 (5.0%) 4 (9.8%) 中等 n (%) 2 (5.1%) 0 (0.0%) 0 (0.0%) 2 (4.9%) 便祕 輕度 n (%) 0 (0.0%) 3 (7.5%) 1 (2.5%) 5 (12.2%) 中等 n (%) 2 (5.1%) 2 (5.0%) 1 (2.5%) 1 (2.4%) |
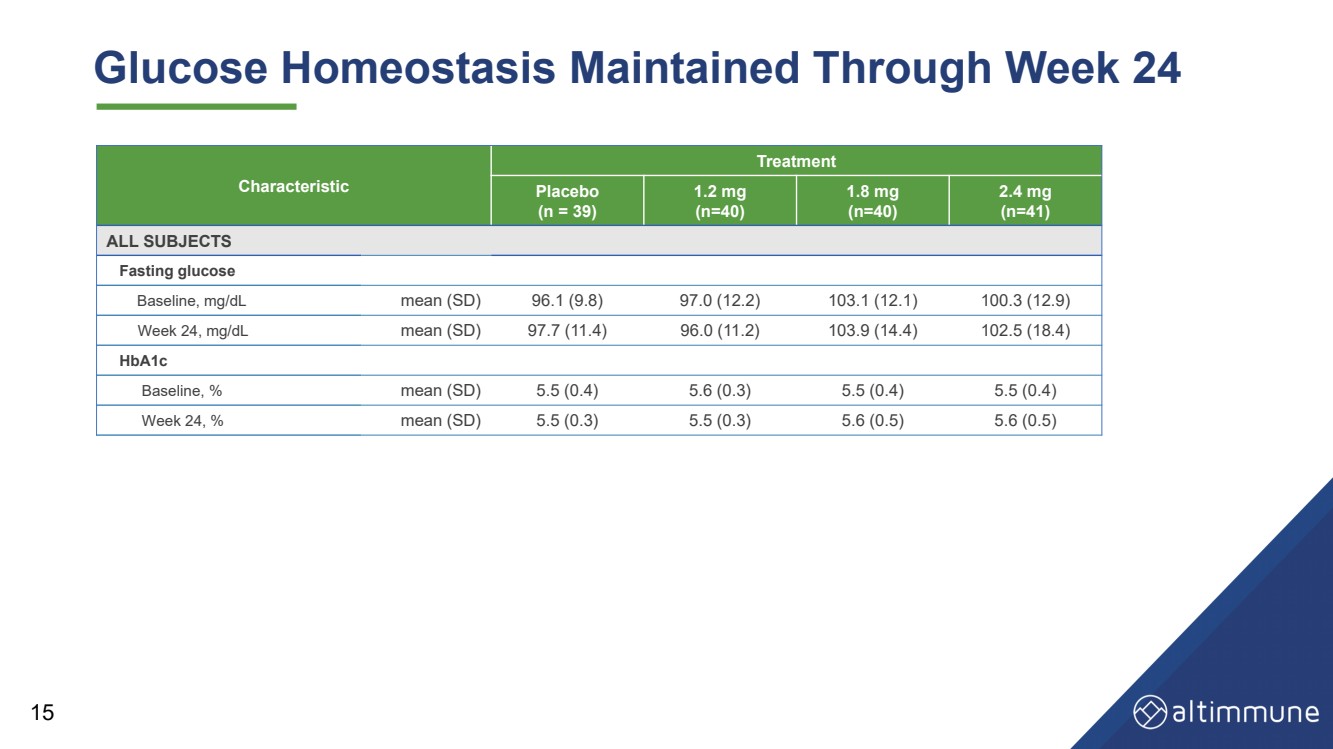
| 葡萄糖動態平衡持續到第 24 周 15 特徵 治療 安慰劑 (n = 39) 1.2 毫克 (n = 40) 1.8 毫克 (n = 40) 2.4 毫克 (n = 41) 所有科目 空腹血糖 基線,mg/dL 平均值 (SD) 96.1 (9.8) 97.0 (12.2) 103.1 (12.1) 100.3 (12.9) 第 24 周,mg/dL 平均值 (SD) 97.7 (11.4) 96.0 (11.2) 103.9 (14.4) 102.5 (18.4) HbA1c 基線,% 平均值 (SD) 5.5 (0.4) 5.6 (0.3) 5.5 (0.4) 5.5 (0.4) 5.5 (0.4) 第 24 周,% 平均值 (SD) 5.5 (0.3) 5.5 (0.3) 5.6 (0.5) 5.6 (0.5) 5.6 (0.5) |
| 摘要和結論 功效 • 截至第 24 周,2.4 mg 和 1.8 mg 的體重減輕了 10.7% 和 9.4%(經安慰劑調整:9.7% 和 8.4%) • 到第 24 周,在 2.4 mg 和 1.8 mg 時,體重減輕了 11.9% 和 10.6%(經安慰劑調整:11.1% 和 9.8%) 在基準體重 ≤ 115 kg 的受試者中 •大約50%的受試者減輕了10%或更多的體重,大約20%的受試者減輕了體重 到第 24 周,體重在 2.4 mg 和 1.8 mg 時,體重達到 15% 或以上 • 大幅減少腰圍、血清脂質和血壓 安全性和耐受性 • 胃腸道 AE 發生率與早期的 pemviduitide 試驗和其他腸促胰島素類藥物相似 • 2.4 mg 劑量下的 AE 停藥率——可能會通過減少劑量來緩解 更多延長劑量滴定 • 心率沒有顯著增加 • 維持葡萄糖動態平衡 16 |
| 為期 12 周的 Pemvidutide 1b 期試驗 肥胖或超重和 2 型受試者 糖尿病 納斯達克:ALT |
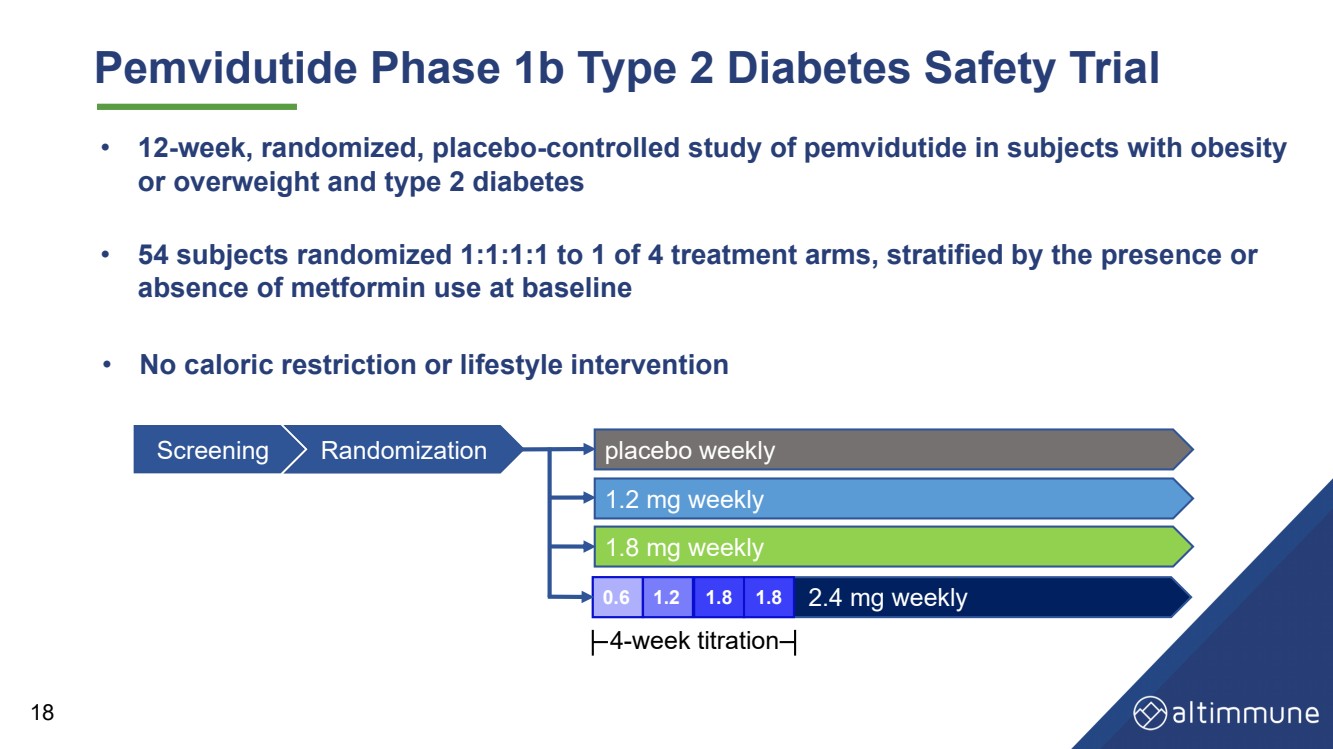
| Pemvidutide 1b 期 2 型糖尿病安全性試驗 • 54 名受試者以 1:1:1 隨機分配到 4 個治療組中的 1 個,按存在或分層 基線時未使用二甲雙胍 • 對肥胖受試者進行為期 12 周的隨機、安慰劑對照研究 或超重和 2 型糖尿病 18 • 沒有卡路里限制或生活方式幹預 每週篩查隨機安慰劑 每週 1.8 毫克 每週 2.4 毫克 每週 1.2 毫克 0.6 1.2 1.8 1.8 4 周滴定 |
| 研究人羣——關鍵資格標準 • 男性和女性,年齡在 18-65 歲之間 • 體重指數 ≥ 28 kg/m2 • 在 2 型糖尿病之前至少服用 3 個月穩定的血糖控制方案 篩選 • 血糖控制方案包括以下至少一項: — 飲食和運動 — 二甲雙胍無胃腸道症狀或出現輕微胃腸道症狀 — SGLT-2 療法 19 |
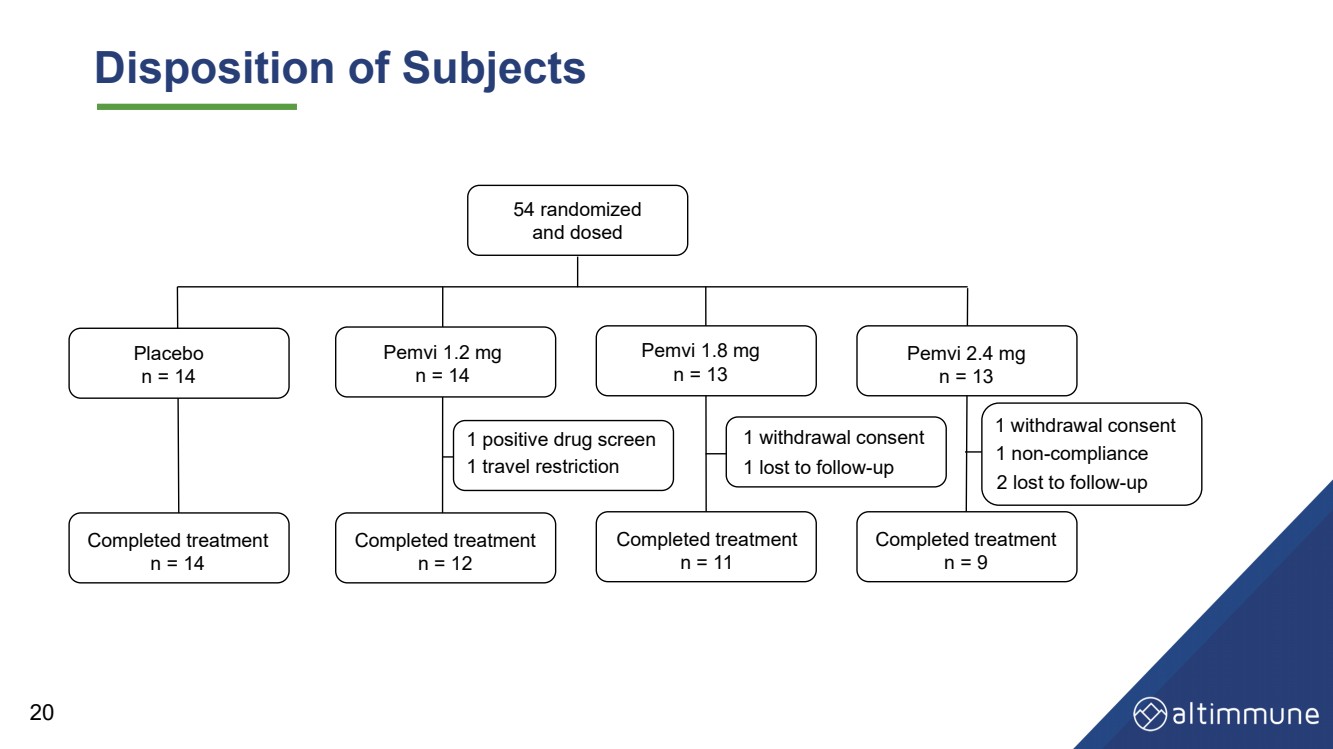
| 受試者的處置 安慰劑 n = 14 Pemvi 1.2 毫克 n = 14 Pemvi 1.8 毫克 n = 13 Pemvi 2.4 毫克 n = 13 治療已完成 n = 14 治療已完成 n = 12 治療已完成 n = 9 1 份撤回同意 治療已完成 n = 11 54 個隨機化 並給藥 1 份撤回同意 1 違規行為 2 人因後續行動而丟失 1 人因後續行動而丟失 1 次藥物篩查陽性 20 1. 旅行限制 |
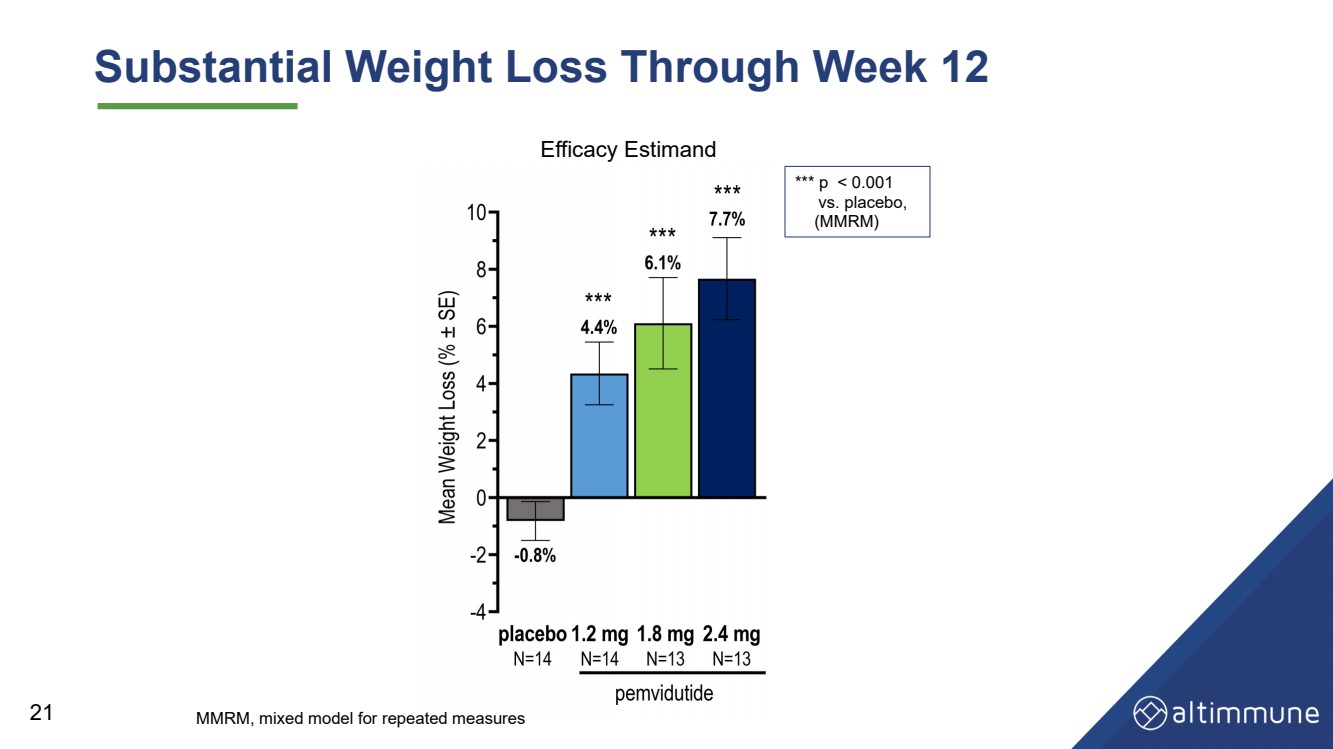
| 第12周體重大幅減輕 21 *** p |
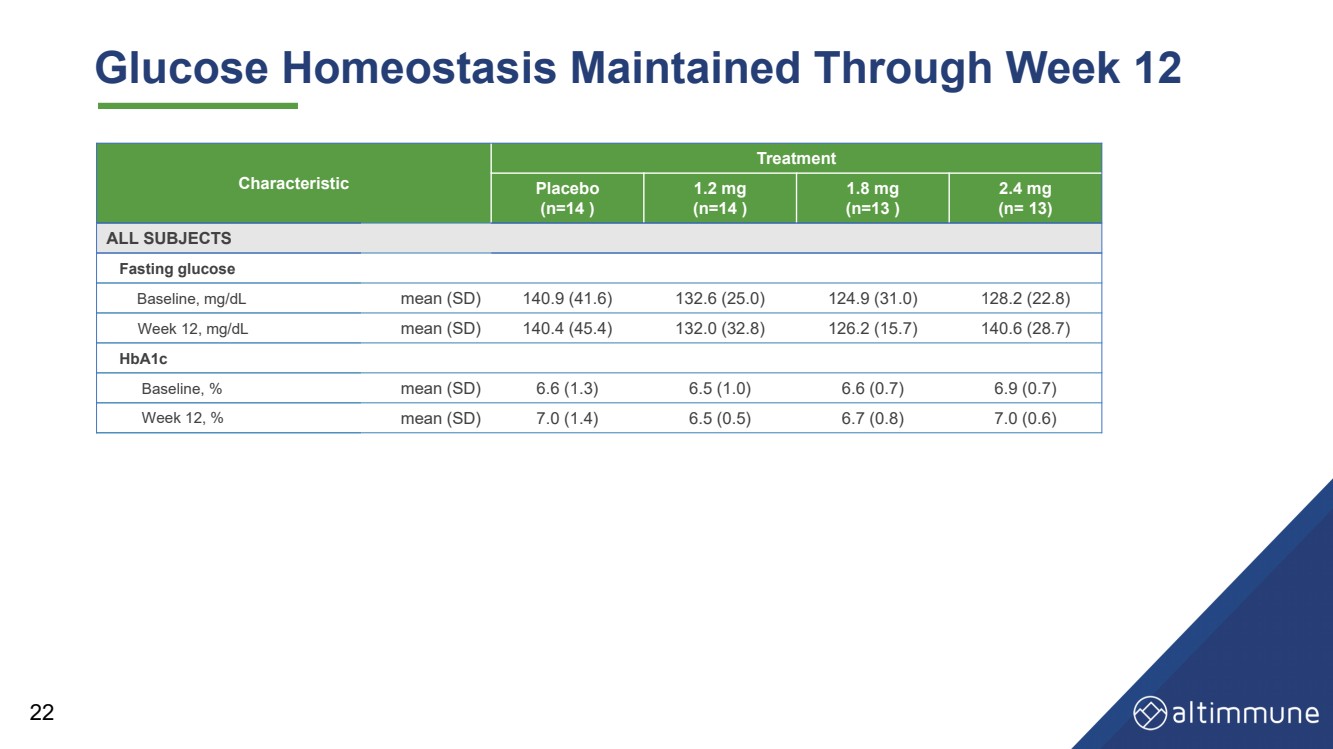
| 22 特徵 治療 安慰劑 (n = 14) 1.2 毫克 (n = 14) 1.8 毫克 (n = 13) 2.4 毫克 (n = 13) 所有科目 空腹血糖 基線,mg/dL 平均值 (SD) 140.9 (41.6) 132.6 (25.0) 124.9 (31.0) 128.2 (22.8) 第 12 周,mg/dL 平均值 (SD) 140.4 (45.4) 132.0 (32.8) 126.2 (15.7) 140.6 (28.7) HbA1c 基線,% 平均值 (SD) 6.6 (1.3) 6.5 (1.0) 6.6 (0.7) 6.9 (0.7) 6.9 (0.7) 第 12 周,% 平均值 (SD) 7.0 (1.4) 6.5 (0.5) 6.7 (0.8) 7.0 (0.6) 血糖動態平衡持續到第 12 周 |
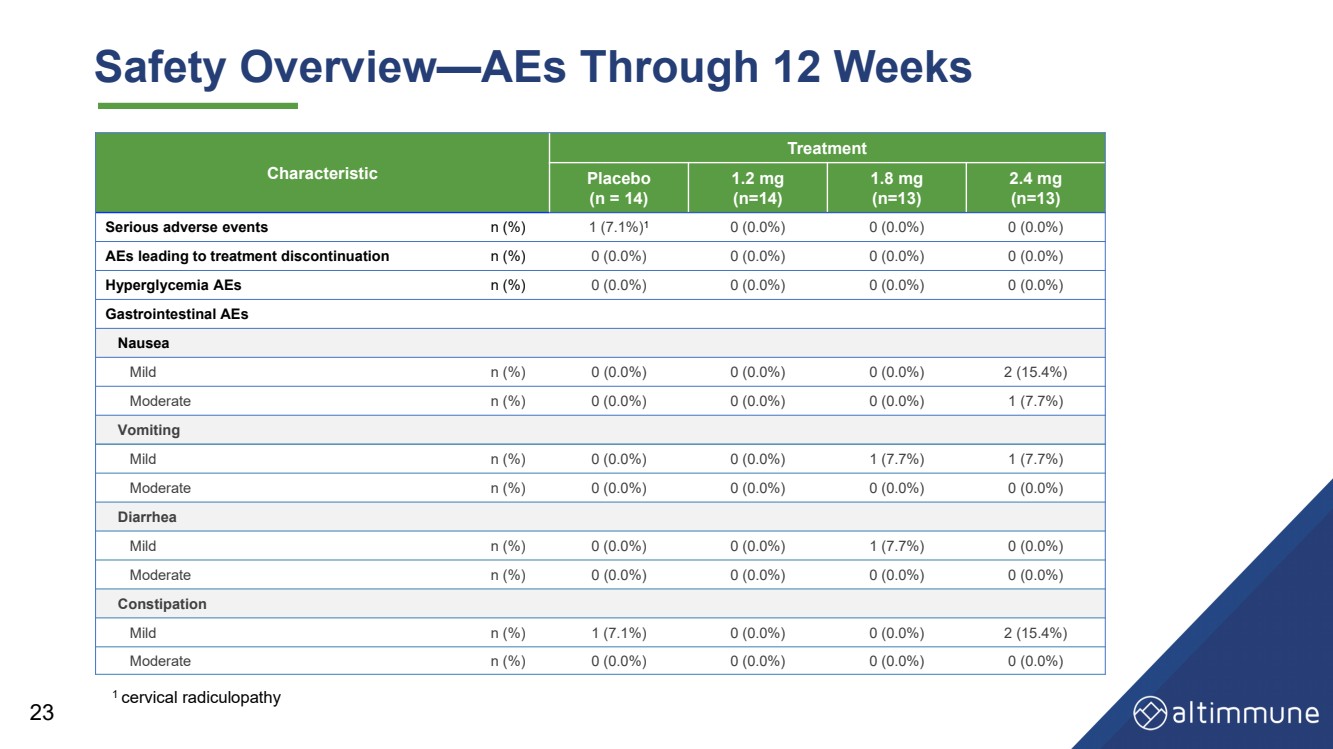
| 23 安全概述——歷時 12 周的 AES 特徵 治療 安慰劑 (n = 14) 1.2 毫克 (n = 14) 1.8 毫克 (n = 13) 2.4 毫克 (n = 13) 嚴重不良事件 n (%) 1 (7.1%) 1 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 導致停止治療的 AE n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 高血糖 aEs n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 胃腸道 AE 噁心 輕度 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 2 (15.4%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 嘔吐 輕度 n (%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 1 (7.7%) 1 (7.7%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 腹瀉 輕度 n (%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 0 (0.0%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 便祕 輕度 n (%) 1 (7.1%) 0 (0.0%) 0 (0.0%) 2 (15.4%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 頸神經根病 |
| 摘要和結論 安全性和耐受性 • 耐受性極佳,GI AE 率低 • 不會因 AE 而停產 24 血糖控制 • 血糖動態平衡得以維持,空腹血糖或 HbA1c 沒有顯著變化 第 12 周 • 無高血糖 aE 減肥 • 到第 12 周,體重減輕 7.7%(安慰劑調整後的 8.5%),體重減輕了 2.4 mg,並有可能保持強效狀態 在以後的時間點減肥 |
| 納斯達克:ALT 與本演示文稿有關的問題: 首席財務官裏奇·艾森斯塔特 reisenstadt@altimmune.com |