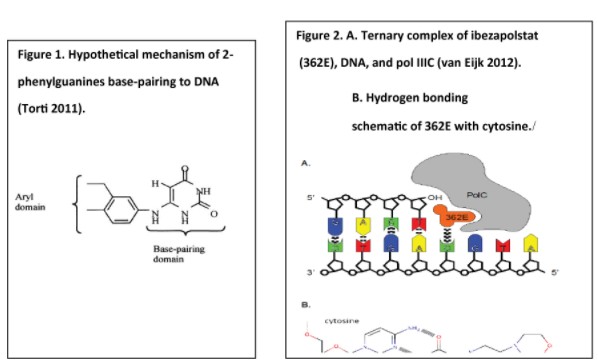
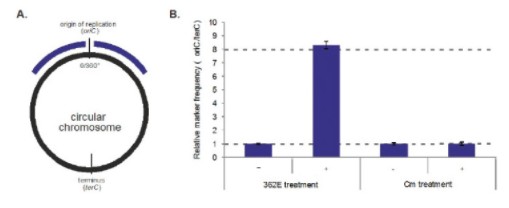
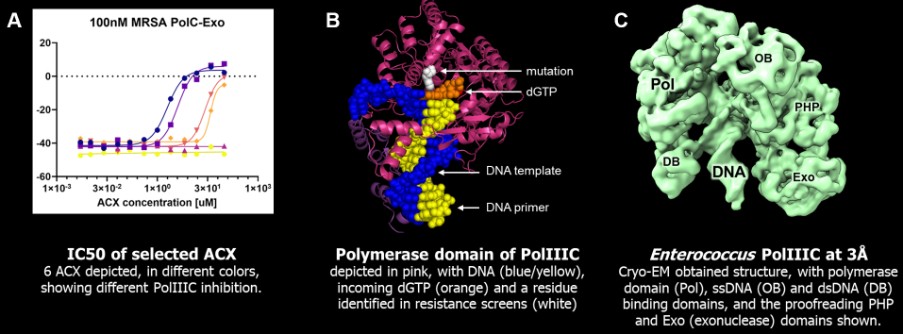
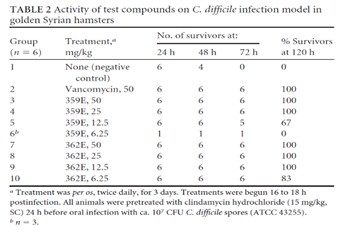
附註4-發行股權
2021年6月23日,Acurx Pharmaceuticals,LLC更名為公司,並更名為Acurx Pharmaceuticals,Inc。公司的註冊證書授權 200,000,000普通股,其中14,468,229是已發佈且截至2023年12月31日尚未償還。
2021年6月29日,本公司完成IPO發行2,875,000普通股,價格為$6.00每股,產生淨現金收益約為$14.8100萬美元,現金髮行成本約為$2.4萬未發行的A類和B類會員權益根據轉換率轉換為普通股股份 一- 兩名會員權益未解決,導致轉換 14,082,318A類和B類會員權益7,041,208普通股股份。購買A類會員權益的憑證同時轉換為購買普通股的憑證 一- 對於兩個轉換比,導致 1,437,577認股權證以加權平均行權價$購買普通股2.88.
與IPO相關,公司發行了 150,000向承銷商發出的認股權證。每份認股權證可行使4.5自2021年12月21日起,行使價為美元7.50每股。該公司採用布萊克-斯科爾斯模型計算權證的價值,估計公允價值為#美元。618,000。計算中使用的投入如下:四還有半年的期限,0.79%無風險利率,授權日股價為$6.26,和一個94利用可比公司的%波動率。這一數額既記錄為額外實收資本的增加,也記錄為發行的非現金髮行成本。
2022年7月25日,公司與公司兩名高管和公司一名董事會成員(統稱為“關聯投資者”)以及一名美國機構投資者(“投資者”)簽訂了證券購買協議(“購買協議”),根據該協議,公司在登記直接發行中發行並出售了總計 1,159,211普通股,面值$0.001每股及預先出資認股權證購買合共130,769普通股。關聯投資者總共購買了59,211普通股,收購價為$3.80每股。投資者購買了總計1,100,000普通股,收購價為$3.25每股,以及總計130,769預融資權證,收購價為$3.2499根據預付資金的授權書。出售給投資者的預融資權證的行使價為$。0.0001,可以立即進行練習。 截至2022年12月31日,所有預籌資金認購權均已行使。 該公司還向聯屬投資者和投資者發行了A系列購買期權 1,289,980購買普通股及B系列認股權證的股份1,289,980普通股,所有這些股票都被認為是權益類的。這些認股權證包括59,211A系列權證和一系列59,211B系列向關聯投資者發行認股權證,行使價為每股$。3.55和一組1,230,769A系列權證和一系列1,230,769B系列認股權證向投資者發行,行權價為每股$3.25. A系列認購證可於2023年1月27日開始行使,投資者將於2029年5月18日到期,關聯公司將於2028年1月27日到期。B系列配股可於2023年1月27日開始行使,投資者將於2029年5月18日到期,關聯公司將於2024年1月27日到期。登記直接發行於2022年7月27日結束。 截至2023年12月31日, 682,769已行使B系列認購權,公司收到約美元2.2這些搜查令的收益為數百萬美元。
本公司從登記直接發售中所得的總收益為$4.2扣除配售代理費及公司應付的其他發售費用後的百萬元及所得款項淨額約為$3.7百萬美元。
於2022年7月25日,本公司與兩名配售代理訂立與登記直接發售有關的配售代理協議(“配售代理協議”),根據該協議,本公司向配售代理支付現金費用$287,874並向各安置代理髮出一份63,018購買普通股的認股權證。認股權證的行使價為$3.60每股(代表 110%登記直接向投資者和關聯投資者出售的普通股總數的加權平均公開發行價),並於2027年7月27日到期。該公司採用布萊克-斯科爾斯模型計算權證的價值,估計公允價值為$171,409。計算中使用的投入如下:五-一年任期,2.82%無風險利率,授權日股價為$3.70以及一個95波動率%