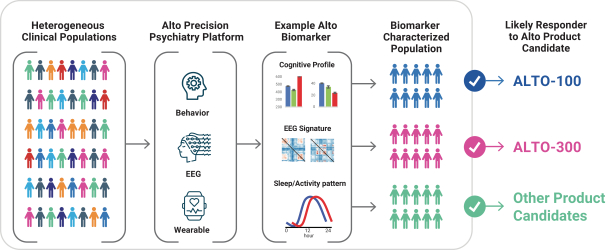
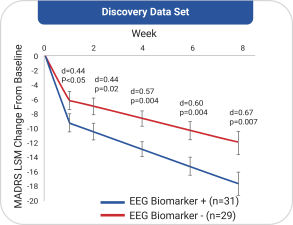
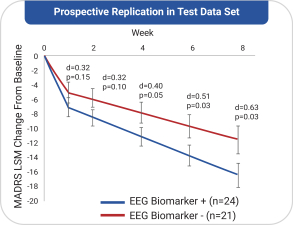
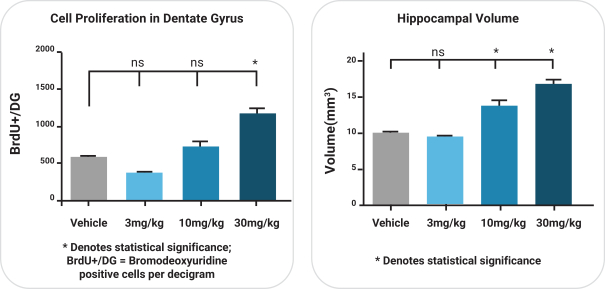
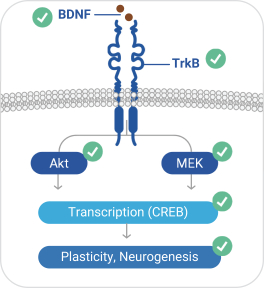
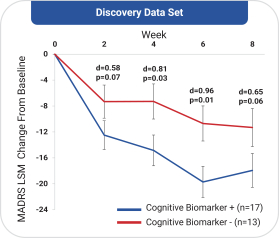
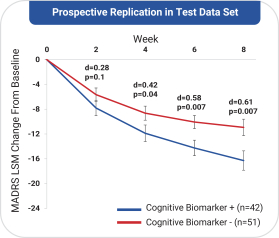
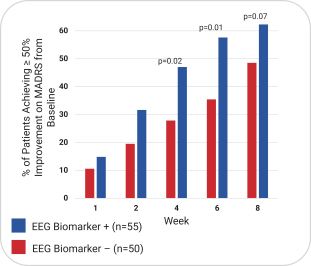
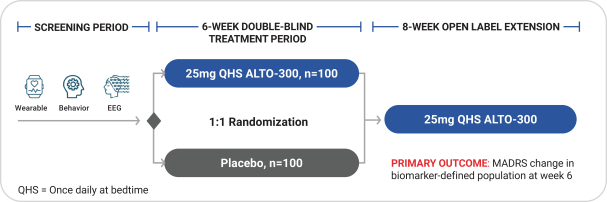
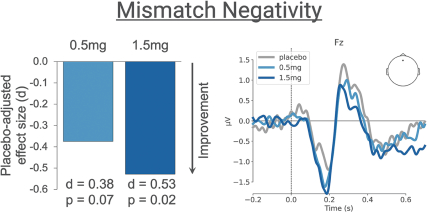
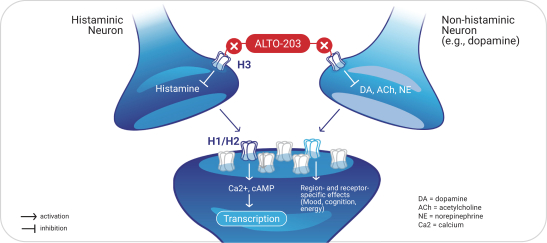
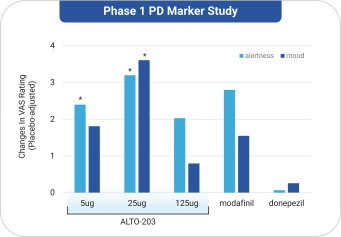
依據第424(B)(4)條提交
註冊號碼333-276495及333-276828
8040,000股

普通股
我們將提供8,040,000股普通股。這是我們的首次公開募股,在此之前,我們的普通股還沒有公開市場。首次公開募股價格為每股16.00美元。我們的普通股已被批准在紐約證券交易所上市,股票代碼為ANRO。
我們是一家新興的成長型公司和一家規模較小的報告公司,根據美國聯邦證券法的定義,因此,我們已選擇遵守本招股説明書的某些減少的報告要求,並可能選擇在本次發行結束後的未來報告中這樣做。見 題為招股説明書摘要和作為一家新興成長型公司和一家較小的報告公司的影響的章節。
投資我們的普通股是有風險的。請參閲本招股説明書第17頁開始的題為風險因素的部分,瞭解您在購買我們普通股股票之前應考慮的因素。
美國證券交易委員會或任何其他監管機構都沒有批准或不批准這些證券,也沒有對本招股説明書的準確性或充分性做出判斷。任何相反的陳述都是刑事犯罪。
| 每股 | 共計 | |||||||
| 首次公開募股價格 |
$ | 16.00 | $ | 128,640,000 | ||||
| 承保折扣及佣金(1) |
$ | 1.12 | $ | 9,004,800 | ||||
| 扣除費用前的收益將捐給Alto神經科學公司。 |
$ | 14.88 | $ | 119,635,200 | ||||
| (1) | 有關承保補償的其他信息,請參閲標題為承保的章節。 |
應我們的要求,承銷商已預留本招股説明書提供的高達5%的股份,以通過定向股票計劃以首次公開募股價格出售給某些個人,包括我們的董事、高級管理人員、員工和管理層確定的其他個人。請參閲標題為承銷定向股票計劃的部分。
普通股預計將於2024年2月6日左右交割。
我們已授予承銷商自本招股説明書之日起為期30天的選擇權,可額外購買最多1,206,000股普通股。如果承銷商全面行使選擇權,我們應支付的承保折扣和佣金總額為10,355,520美元,扣除費用前,我們獲得的總收益將為137,580,480美元。
| 傑富瑞 | TD Cowen | Stifel | 威廉·布萊爾 |
|
貝爾德 | ||||
招股説明書日期:2024年2月1日