| 中期報告 2024 年 1 月 — 3 月 第一季度 |
| Calliditas Therapeutics | 2024 年中期報告:2024 年 1 月 — 3 月 2 日 278 年 50% 810 個關鍵要點,2024 年第一季度展望:2024 年 1 月至 3 月(與 2023 年 1 月至 3 月相比)不變 “在第一季度,我們在需求方面創造了又一個創紀錄的2024年1月至3月季度,註冊人數為705人,新開處方者354人。 我們對這種積極的 趨勢感到非常興奮,我們繼續看到第二季度強勁的 需求。” 1 月 — 2024 年 3 月 31 日 2024 年 3 月 31 日 MSEK TARPEYO 淨銷售額 Renee Aguiar-Lucander /首席執行官 瑞典克朗淨銷售額 瑞典克朗 中期報告 2024 年 1 月 — 3 月 • 淨銷售額為 2.955 億瑞典克朗,其中 TARPEYO 淨銷售額 截至2024年3月31日的三個月, 的銷售額為2.783億瑞典克朗。在截至2023年3月31日的三個 個月中,淨銷售額為1.914億瑞典克朗,其中TARPEYO的淨銷售額為1.857億瑞典克朗。 • 截至2024年3月31日和2023年3月31日的三個月,營業虧損分別為2.038億瑞典克朗和1.801億瑞典克朗。 • Calliditas創下了創紀錄的季度註冊人數為705人, 比第四季度增長了27%。 • 2月,美國專利和商標局(USPTO)頒發了編號為11896719的專利,名為 “新藥物成分”。這是Calliditas在美國獲得的第二項TARPEYO的 專利, 在2043年之前提供產品保護。 • 3月,美國食品藥品管理局授予TARPEYO® 的七年孤兒藥獨家經營權 ,該期限將於 2030 年 12 月 到期,前提是該公司獲得該藥物新適應症的全面批准 。 • 由於 對Change Health的網絡攻擊,TARPEYO本季度淨收入 對約470萬美元的負面影響。由於這個技術問題,我們 未能在第一季度創下的收入 沒有損失,但預計將在接下來的 幾個月內向前延續。預計這不會對年收入產生任何影響 。 • 截至本報告發布之日,TARPEYO第二季度的初步淨銷售額 為2550萬美元。 • Nefecon Open 標籤的 3 期延期試驗顯示為陽性。 • setanaxib 針對 頭頸癌的 2 期試驗結果為陽性。 • 合作伙伴珠穆朗瑪峯 Medicines在中國商業推出Nefecon。 • Calliditas預計收入將持續增長: 截至2024年12月31日的財年,包括里程碑在內的Nevecon特許經營權的總淨銷售額 估計為1.5億至1.8億美元。 報告期之後的關鍵事件 • 截至2024年3月31日和2023年3月31日的三個月,攤薄前後的每股虧損分別為4.59瑞典克朗和3.49瑞典克朗。 • 截至2024年3月31日和2023年3月31日,現金分別為8.103億瑞典克朗和10.136億瑞典克朗。 • 歐盟委員會關於可能全面批准 Calliditas 合作伙伴 STADA 的 Kinpeygo 的決定。 • setanaxib 原發性 膽源性膽管炎二期試驗的完整數據讀取。 • 更新了 KDIGO 指南。 未來 6 個月的關鍵事件 |
| Calliditas Therapeutics | 2024 年中期報告:1 月 — 3 月 3 日 Calliditas — 開創了罕見 疾病的新 療法 我們的價值觀 Calliditas Therapeutics 利用科學專業知識和疾病 具體見解來幫助改善患者的生活。我們是一家 商業階段的生物製藥公司,致力於研究、開發 和商業化新療法,旨在解決罕見疾病治療方面未得到滿足的重大 需求。我們 致力於擴大治療選擇併為罕見病患者建立新的 護理標準,我們針對未滿足的醫療需求的 創新藥物產品線反映了這一點。 我們的主導產品提供了一種治療方案,該方案被證明可以改善IgA腎病(IGaN)(也稱為 伯傑氏病)的疾病。伯傑氏病是一種 的進展性自身免疫性疾病,對許多患者而言,它會導致終末期腎臟疾病 (ESRD),需要透析或器官移植。這種名為Nevecon® 的藥物產品 於2021年獲得美國食品藥品管理局的加速 批准,並於2023年12月獲得全面批准, ,如今以TARPEYO® 品牌在美國上市。 TARPEYO 現在是第一種也是唯一一款獲得完全批准的 iGaN 療法,是根據腎功能的衡量標準獲得批准的。 Nevecon 還獲得了歐盟委員會以Kinpeygo® 品牌在歐洲經濟區(EEA)和英國的有條件上市許可 。 歐盟委員會和MHRA目前正在審查Kinpeygo的全面上市許可。 Nevecon 已在中國、新加坡和澳門獲得有條件批准,並正在接受香港 和韓國的監管機構的審查。Nevecon 由 Everest AGILITY 商業化推出。我們非常靈活,能夠快速調整和適應 不斷變化的形勢和要求。 EXPERTISE 我們利用我們強大的內部經驗和能力,同時根據 的需要通過 知識共享和外部合作來補充我們的優勢。 誠信 我們對自己的行為負責, 遵守最高的道德標準,以我們的道德 原則為指導,做出正確的決定。 PIONEER 我們探索新方法,相互授權 以合規、創新 和務實的方式尋找新的運營方式。 2024 年 5 月中國藥品。Calliditas還建立了 合作伙伴關係,在日本開發和商業化Nefecon。 IgA 腎病是全球最常見的原發性腎小球腎炎 ,因此 Nevecon 的市場潛力巨大, 我們早期的商業成功和潛在付款超過3億美元的許可協議 就證明瞭這一點,包括 預付款、預定義的里程碑以及持續的 特許權使用費。 我們的後期產品線基於同類首創的 NOX 抑制劑平臺。我們的主要化合物setanaxib可抑制炎症和纖維化途徑中涉及 的酶,並且是該類別中第一種進入臨牀階段的藥物。Setanaxib目前正在進行鍼對以炎症 和纖維化為特徵的罕見疾病的 臨牀試驗,包括原發性膽源性膽管炎(PBC)和Alport 綜合徵,還有一項由研究人員主導的特發性肺纖維化(IPF)試驗正在進行中。Calliditas於2024年5月宣讀了 一項使用setanaxib治療頭頸部 癌症的2期概念驗證試驗的陽性數據。 雖然我們的總部位於瑞典斯德哥爾摩,但我們在美國仍保持着龐大的影響力,在紐約 和新澤西州設有辦事處。我們還在法國和瑞士設有辦事處, 是我們的探索團隊的所在地。Calliditas Therapeutics普通股 於2018年在斯德哥爾摩納斯達克上市(CALTX), 隨後,代表我們普通股 的美國存托股票於2020年在美國 的納斯達克全球精選市場(CALT)上市。 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月4日關鍵數據 截至3月31日的三個月 截至年度12月31日止的三個月 千瑞典克朗,每股金額除外 2023 2023 年淨銷售額 295,481 191,352 1,206,888 其中 TARPEYO 產品銷售額 278,276 185,691 1,075,829 營業收入(虧損)(203,826)(180,074) (373,055) 本期所得税前收益(虧損)(247,324)(208,019) (457,017) 攤薄前後的每股收益(虧損)(瑞典克朗)(4.59) (3.49) (8.69) 來自 (用於)經營活動(198,205)(231,940)(434,655) 3 月 31 日(千瑞典克朗,每股金額或另有説明除外)2024 2023 年期末註冊股份總數,包括Calliditas持有的股份,59,580,087 59,580,087 59,580,087 59,580,087 59,580,087 59,580,087 59,580,087 59,580,087 59,580,087 股歸屬於母公司股權持有人的權益期末 120,151 589,403 334,806 期末權益比率 7% 33% 18% 期末現金 810,317 1,013,600 973,733 973,733 最近和預期的驅動因素 NEFECON Setanaxib 實體瘤Ph2試驗(SCCHN)的頭條數據讀出 Ph2 IPF 試驗(ILS)的頂線數據 讀出PBC ph2b試驗的頂線數據讀出 EMA 對合作夥伴 STADA 2024 年下半年的潛在正面評價探索腫瘤學領域的合作 機會 br} 中國和歐洲商業 特許經營權的增長 開放標籤延期 研究數據讀取 更新 KDIGO 指南 商業 在中國上市 經全面批准後 鞏固TARPEYO在美國的市場領導地位 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月5日首席執行官聲明 繼美國食品藥品管理局於2023年12月全面批准TARPEYO之後,我們準備向腎臟科醫生傳達該疾病改變TARPEYO潛力的信息。啟動了新的營銷材料, 對該領域的每個人進行了培訓,以反映新的適應症和標籤 ,並於二月份推出了新計劃。在 2023 年第三季度,我們決定擴大美國野戰部隊, 增加關鍵戰地職能,例如思想領袖聯絡員、醫療 主管和戰地報銷經理,以應對更大的市場潛力。我們的新適應症——減少有疾病進展風險的原發性 IgAn 患者 的腎臟流失——現在使我們能夠 解決所有處於危險中的成人 IgAn 人羣,這對 患者和醫生來説都是一個重要的變化。現在可以在與治療腎臟科醫生的相互作用中討論該藥物能夠延遲透析或移植的臨牀意義的可能性, 因為我們現在可以分享 三期試驗中令人興奮且重要的表皮生長因子數據。對我們來説,重要的是要投資組建一支重點恰當的最好 團隊,以繼續我們為iGaN患者開展重要的 開創性工作。一月份,我們還宣佈 新增一位經驗豐富的高級管理人員 Maria Törnsén 擔任北美總裁,她帶來了 美國罕見病市場十多年的專業知識以及賬户管理、現場資源優化和特許經營權建設方面的豐富經驗。 這是對我們擴大外地業務的關鍵補充,我們 很高興看到她的專業知識帶來的好處。 此次及時的擴張利用了我們在過去兩年 中積累的專業知識,並促成了 個季度的入學人數再創歷史新高。2024年第一季度收到的705名註冊人數比第四季度增長了27%,而第四季度又比第三季度增長了51% 。我們認為 需求的持續強勁增長是我們強勁的數據以及患者和醫生 在現實環境中使用該藥物的積極體驗的結果,這是 2024年預期收入增長的關鍵主要指標。我們對這一積極趨勢感到非常興奮 ,並將繼續看到第二季度強勁的需求 。我們認為,TARPEYO有望成為iGaN的支柱 療法,成為市場上唯一的特定疾病和治療疾病的 藥物,在 治療期間提供表皮生長因子穩定,並且在治療後可以持續使用。對於治療這種漸進性疾病的患者和醫生來説, 在需要進行疾病管理時進行治療的能力很重要 ,特別是如果它有可能使患者在一生中無法接受透析或移植, 。 本季度TARPEYO的總淨收入為2680萬美元(2.78億瑞典克朗)。第一季度的收入受到 兩個重要因素的影響。第一個問題已經在我們的 第四季度演示中傳達了:也就是説,由於保險重新驗證流程的進行,第一季度通常會稍慢一些 季度。 第二個完全出乎意料,即 繼美國 2月份美國聯合健康旗下的Change Health獲得全面批准後, 目標市場 擴張遭到網絡攻擊,該公司是美國三大索賠處理機構之一 。這一重大事件對整個行業產生了深遠影響,也對我們的中心 在系統關閉期間驗證保險承保範圍的能力產生了深遠影響, 因為我們的專業藥房僅使用Change Health。這導致 在此期間, 對收入造成了約470萬美元的負面影響。我們在第一季度無法記錄收入,原因是 這一技術問題沒有丟失,但預計將在未來幾個月內向前推進 ,預計這不會對年收入產生 影響,第二季度TARPEYO淨銷售額的強勁開局也證明瞭這一點,該季度迄今為止,該季度已達到約2550萬美元1 本季度還剩 5 周 。我們的中心經理 Biologics by McKesson 隨後實施了例程,以更好地應對未來這類 突發情況。 我們與付款人的互動繼續按計劃進行, 已經與P&T委員會進行了多次互動。我們預計, 更新的規則將在定於6月/7月進行的 下一個更新週期中對許多大型計劃生效。 第一季度, TARPEYO 的產品保護也得到了顯著加強,因為我們獲得了 新適應症的七年孤兒藥地位,到2030年12月下旬結束。此外,我們還通過一項新專利補充了我們現有的TARPEYO專利組合, 將於 2043 年到期。我們將繼續努力擴大專利 產品組合,擴大地域覆蓋範圍。 後期我們也非常高興地報告了 我們的 setanaxib 2 期頭頸癌試驗的頭條數據。在接受setanaxib和pembrolizumab的患者中, 接受setanaxib和pembrolizumab治療的患者中具有高度相關且具有臨牀意義的無進展存活率和 總體存活率的指標具有統計學意義,此外,鑑於統計學意義,我們可以看到setanaxib抗纖維化作用的臨牀 證據研究使用 setanaxib 治療的腫瘤中的 T 細胞活性。這超出了我們最初對該試驗的預期,我們期待 與潛在合作伙伴進行討論,並看到我們罕見病產品線中其他2期試驗的 結果。 我們的現金狀況仍然強勁,截至本季度末, 資產負債表上有8.1億瑞典克朗,根據TARPEYO的預期收入增長,我們認為這足以使 我們實現盈利。我們 重申我們的指導方針,即2024年 Nevecon特許經營權的淨收入為1.5億至1.8億美元。 首席執行官蕾妮·阿吉亞爾-盧坎德 1TARPEYO的淨銷售額是初步的,未經審計,指的是4月1日至5月23日期間。 |
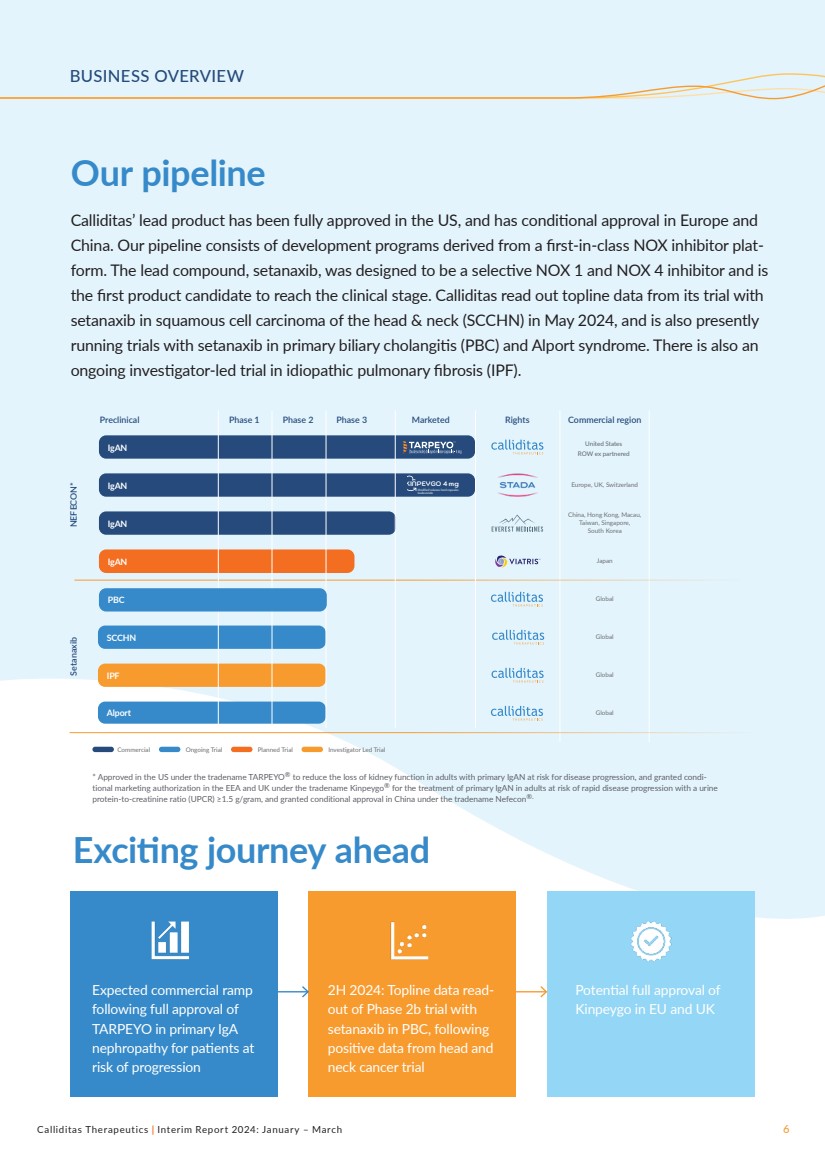
| Calliditas Therapeutics | 2024年中期報告:1月至3月6日業務概覽 我們的產品線 令人興奮的前進之旅 Calliditas的主要產品已在美國獲得全面批准,並在歐洲和 中國獲得了有條件的批准。我們的產品線包括源自同類首創的氮氧化物抑制劑平臺的開發計劃。主要化合物setanaxib被設計為選擇性氮氧化物1和氮氧化物4抑制劑,是 第一個進入臨牀階段的候選產品。Calliditas於2024年5月宣讀了其在頭頸部鱗狀細胞癌(SCCHN)中使用 setanaxib的試驗的主要數據,目前 也在進行setanaxib治療原發性膽源性膽管炎(PBC)和Alport綜合徵的試驗。還有一項由研究者主導的 正在進行的特發性肺纖維化(IPF)試驗。 2024 年下半年有 進展風險患者的原發性 IgA 腎病完全獲準後 TARPEYO 獲得全面批准 預計商業化增長 在 PBC 中使用 setanaxib 進行的 2b 期試驗,其中 頭部和 頸部癌試驗呈陽性數據 歐盟和英國的 peygo NEFECON* Setanaxib 臨牀前 1 期 2 期 3 期上市權商業區 * 在美國獲得批准,商品名為 TARPEYO®,用於減少有患病風險的原發性 IgAn 的成年人的腎功能喪失進展,並以Kinpeygo® 的商品名在歐洲經濟區和英國獲得了有條件的上市許可,用於在尿液 蛋白肌酐比例(UPCR)≥1.5 g/g的情況下治療有快速疾病進展風險的成人的原發性IgAn,並在中國以商品名Nefecon® 獲得了有條件的批准。 正在進行的商業試驗研究者主導的試驗 iGaN 日本 iGaN 美國 ROW ex 合作伙伴 中國、香港、澳門、 臺灣、新加坡、 韓國 iGaN KINPEYGO 4 mg 緩釋硬膠囊 布地奈德 歐洲、英國、瑞士 全球 SCCHN Global IPF Global Alport Global PBC |
| Calliditas Therapeutics | 2024年中期報告:1月至3月7日業務概覽 我們的商用產品 2023年12月20日,Calliditas的主要 產品TARPEYO成為美國 食品藥品監督管理局針對受IgA腎病(IGaN)影響的患者 獲得美國食品藥品監督管理局全面批准的第一種藥物。它是 唯一專為 靶向 IgAn 起源並能改善疾病而設計的治療方法。 iGaN 是一種嚴重的進行性疾病,多達 50% 的 患者在十到二十年內最終面臨患上終末期腎臟疾病 (ESRD) 的風險。該產品以 Nefecon® 的名義開發 ,在美國獲準以 品牌名稱 TARPEYO®。它還於2022年7月獲得歐盟委員會以 品牌名稱Kinpeygo® 的有條件批准,並於2023年2月獲得英國國土資源管理局對 英國的有條件批准。Nefecon 於 2023 年 11 月在中國 獲得了中國國家藥品監督管理局的有條件批准。 疾病背景 儘管 IgAn 在腎臟中表現出來,但有證據表明 它是一種始於腸道遠端的疾病, 特別是在迴腸。Peyer's 貼片集中在迴腸的腸道相關淋巴組織中, 已被確定為粘膜型 IgA 抗體的主要來源。IgA 腎病患者粘膜型 IgA 的 水平升高,與血液中的大多數 IgA 相比,粘膜型 IgA 主要是二聚體或聚合物, 缺乏半乳糖。在IgAn患者中, 遺傳易感性以及環境、細菌和飲食 因素的結合被認為會導致這些 缺乏 半乳糖的IgA抗體的產量增加。 產量的增加可能與腸道通透性的增加相結合, 會導致這些分泌性抗體出現在血液中。 成功的三期試驗讀出 nefiGard 是第一項針對 IgA 腎病的 3 期試驗,該試驗顯示出 具有統計學意義且與臨牀相關的腎臟保護 作用,以 eGFR 衡量。Calliditas對Nefecon 獲得美國食品藥品管理局的全面批准是基於該試驗的強大表皮生長因子數據。 該試驗證實,使用 非慢性方法瞄準疾病起源會對 腎功能產生重大的長期影響。 完整的3期NefiGard試驗共包括364名患者,其中包括來自中期分析的200名患者, 在此基礎上,Calliditas成功向美國食品藥品管理局申請了加速批准 ,並向歐洲 委員會、英國MHRA和中國國家藥監局申請了有條件的批准。完整試驗包括 9 個月的治療和所有研究參與者的 15 個月治療後觀察期,以確認長期 的腎臟保護。完整的3期試驗的終點評估了接受治療的患者和安慰劑 患者在每位患者開始給藥後的兩年內腎功能的差異(以表皮生長因子計)。數據讀取於 2023 年 3 月,並於 2023 年 8 月發表在《柳葉刀》上。 3期試驗的主要終點是兩年內在每個時間點觀察到的表皮生長因子的時間加權平均值。 成功滿足了主要終點,具有高度統計學意義的 p 值為 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月8日IgA腎病 -一個重要的市場機會 我們的商業夥伴關係 • 雖然iGaN是一種罕見疾病,但它是最常見的原發性腎小球腎炎。據估計,美國的患病率介於 13萬至15萬名患者之間,歐洲約為20萬名患者,中國高達500萬名患者。 • 在美國,我們估計大約有 12,000 名腎臟科醫生,其中多達三分之二治療 iGaN 患者。大約 4,000 到 5,000 名專科醫生為大多數患者看病。大約 40% 的患者在學術環境中接受 治療,其餘患者則在社區環境中接受治療。1 業務概覽 歐洲 Nevecon® 於 2022 年 7 月獲得 歐盟委員會授予有條件的 上市許可 (CMA), 隨後於 2 月獲得英國藥品和 醫療保健產品監管局 (MHRA) 的有條件許可 } 2023,品牌名稱為 Kinpeygo® ,用於在 尿蛋白與肌酐比率 (UPCR) >1.5 g/ 的情況下,有快速疾病進展風險的成年人治療 IgAngram,成為歐盟首款獲批准的 iGaN 治療藥物。Kinpeygo 將在歐洲經濟 區(EEA)、英國和瑞士銷售,如果 在該司法管轄區獲得批准,則由 STADA Arzneimittel AG 獨家 出售, Calliditas於2021年7月與該公司簽訂了許可協議 在歐洲註冊和商業化 Kinpeygo。STADA 於 2022 年 9 月在德國推出了 Kinpeygo, 緊隨其後的是其他歐洲國家。 在 完整的NetiGard試驗中讀出陽性數據並向美國食品藥品管理局提交了 sndA 之後,Calliditas正在與STADA進行合作評級,以尋求歐盟委員會對 Kinpeygo的全面批准,並在整個研究人羣中尋求MHRA的全面批准。預計 將在 2024 年上半年出現 CHMP 的 意見。 大中華區 2019年,Calliditas與珠峯藥業(香港交易所 1952.HK)簽訂了許可 協議,讓珠穆朗瑪峯在大中華區和新加坡為iGaN開發Nevecon,並且 將其商業化。2022年3月,這個 協議擴大到包括韓國 。 珠穆朗瑪峯於 2023 年 4 月在中國 海南博鰲試驗區首次推出 Nefecon,作為 IgA 腎病的首例病態療法。該計劃允許在其他地區獲批 的海外創新藥物和醫療器械在國家藥品監督管理局的監管批准 之前在海南省 出售 並在現實臨牀環境中使用。數百名患者 註冊了這個搶先體驗計劃, 使其成為中國啟動的最成功的EAP 項目之一。 2023 年 11 月,中國國家 藥品監督管理局 (NMPA) 在 iGaN 中授予了 的有條件 批准。珠穆朗瑪峯於 2024 年 5 月在中國大陸推出了 Nevecon 。 除了在中國大陸獲得批准和 商業上市外, Nevecon® 還在 澳門、香港和新加坡獲得批准, 已成功商業上市 ,並於 年底在澳門首次開處方 • KDIGO 指南定義的面臨疾病進展風險的 iGaN 患者羣體 估計在 45,000 人之間還有美國有 60,000 名患者。2 • 如今,這些患者中的大多數主要接受 支持性治療,例如用於控制 血液的仿製ACE和/或抗逆轉錄病毒藥物壓力,輔以其他廣泛適用的 有氧和腎臟保護藥物。 • 隨着經批准的特別是 所示和批准用於 IgAn 的藥物的可用性和熟悉度的增加,以及醫生 考慮採取更積極的幹預措施來保持腎臟功能,我們估計全球 IgAn 市場將增長到 50億至80億美元。 2023。 Nevecon® 的新藥申請(NDA)也於 2023 年底成功獲臺灣和韓國接受 的審查。 中國是世界上原發性 腎小球疾病患病率最高的國家, 估計有500萬IgAn患者。在 2023年美國腎臟病學會(ASN) 腎臟週上公佈的中國亞羣分析 的結果 提供了證據 表明 Nevecon 對中國隊列的治療效果大於 腎臟功能、蛋白尿和微血尿的全球數據集 。 在中國隊列中,24個月時表皮生長因子與基線相比的平均絕對 變化 顯示,使用 Nevecon,這種衡量腎功能的 損失減少了大約 66%,而全球數據集中的 表皮生長因子損失減少了 50%。 日本 2022年底,Calliditas與 Viatris Inc.(納斯達克股票代碼:VTRS)的子公司 日本維亞特利製藥公司建立了合作伙伴關係,在 日本實現Nevecon的商業化。 Viatris 是一家全球醫療保健公司, 總部設在美國, 業務遍及超過 165 個國家。 1Veeva OpenData 2023 年,包括所有以腎臟病學為主要專業的活躍醫療機構 2Spherix RealWorld Dynamix |
| Calliditas Therapeutics | 2024 年中期報告:1 月 — 3 月 9 日 TARPEYO:從 支持性護理轉向治療 IgAn 業務概述 靶向 B 細胞 免疫調節劑 旨在局部靶向 疾病起源 與 優化的 RasI 療法相結合;可選擇間歇治療,而不是 慢性治療 IgAn 具有持久的 eGFR 益處 和持續的促天尿病改造作用 特徵明確的 活性成分和 安全概況 作用機制患者關注療效安全性 TARPEYO 和Kinpeygo分別是美國食品藥品管理局和 歐盟委員會批准的第一種用於iGaN的藥物,也是唯一專門針對 iGaN起源並具有改善疾病效果的治療方法。TARPEYO是唯一獲得美國食品藥品管理局完全批准的 iGaN療法,也是唯一一種基於保護腎功能而獲批的治療方法。 • 需要遺傳易感 但還不夠;大多數患者 在20多歲和30多歲時被診斷出來 • 50% 以上有 在10-20年內患上ESRD的風險,導致腎移植 • 治療目標是保持 eGFR — 腎功能 • 最近發佈的縱向 數據表明疾病進展是比 先前想象的更快、前景更差1 iGaN 患者: 1 Pitcher D、Braddon F、Hendry B 等IgA 腎病的長期療效。clin J Am Soc Nephrol。2023;18 (6): 727-738。doi: 10.2215/cjn.0000000000013 Kwon CS、Daniele P、Forsythe A、Ngai C. 關於免疫球蛋白 A 腎病流行病學、與健康相關的生活質量影響和經濟負擔的系統文獻綜述。J Health Econ 結果報告 2021 年 9 月 1 日;8 (2): 36-45. doi:10.36469/001c.26129。PMID:34692885;PMCID: PMC8410133。 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月10日第一季度對TARPEYO的強勁需求業務概覽 在第一季度,Calliditas美國團隊專注於利用TARPEYO的全面FDA 批准和新標籤,向腎臟病醫療保健專業人員、付款人和 患者社區提供有關最新臨牀數據的信息和參與。 在2024年第一季度,TARPEYO又創下了新的季度紀錄,新增了705名患者,這是繼 第四季度51%的季度增長之後,同比大幅增長27%。新開處方者增加了354人,也創下了季度紀錄,這是市場接受度和 對TARPEYO需求的又一個明確指標。在新標籤和適應症的支持下, 這一積極勢頭預計將持續到2024年,這將進一步鞏固TARPEYO作為iGaN中支柱 治療選擇的地位。 新標籤促銷發佈 首款也是唯一一款經美國食品藥品管理局批准的 產品,可減少腎功能喪失。 與 iGaN 基金會和 TARPEYO 患者大使共同舉辦的患者教育網絡研討會。 4 在 WCN 上的演講,其中包含來自 NeflGard 3 期試驗和 QoL 數據的分析 。 季度亮點第一季度註冊的新患者第一季度環比增長 27% LTD 新處方者:1,993 年 17% TARPEYO 2024 年第一季度淨銷售額增長 2024 年第一季度關鍵指標 705 354 268 萬美元 激動人心的未來之旅 第一季度收入受到兩個因素的影響:開放的季節性 效應在美國的註冊期,許多患者的保險 發生了變化,而我們在美國的專屬專業藥房的保險索賠處理機構 的IT網絡 遭到網絡攻擊,Change Healthcare。據估計,這種意外中斷對第一季度收入的負面影響約為470萬美元, 我們預計將在未來幾個月內記錄在案。 重要的是,這不會影響我們2024年的收入指導。 我們也對第二季度TARPEYO淨銷售額的良好開局感到非常鼓舞,截至本報告發布之日,淨銷售額 已達到約2550萬美元,本季度還剩5周 。 繼續在美國的宣傳 努力,推動TARPEYO 作為一種疾病 的定位,修改 iGaN 中的基礎 療法。 在 大型科學大會 和項目(例如 ERA、 NKF、ASN)上推動科學交流 和數據傳播。 利用 KDIGO 指南 預計將於 2024 年發佈。 教育和告知美國 付款人有關全面批准 的信息,以確保 TARPEYO 付款人 政策反映新的 標籤。 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月11日業務概覽 Calliditas的產品線包括基於同類首創的氮氧化物抑制劑平臺的開發 項目。Calliditas目前正在對頭頸部 鱗狀細胞癌 (SCCHN)以及原發性膽汁 膽管炎(PBC)和阿爾波特綜合徵進行前列數據 的正面數據 的臨牀試驗。 氮氧化物酶抑制劑 氮氧化物酶,也稱為煙酰胺腺嘌呤二核苷酸 磷酸鹽 (NADPH) 氧化酶,是唯一專門用於產生活性氧 (ROS) 的已知酶 。在適當的濃度下,活性氧有助於調節細胞 的增殖、分化和遷移,並調節 先天免疫反應、炎症和纖維化。 氧化還原動態平衡的中斷與 多種疾病通路有關,過量 ROS 引起的氧化應激可能是許多疾病的潛在機制, 包括心血管疾病、神經退行性疾病、 和癌症。因此,氮氧化物酶抑制劑成為 在新治療類別中有希望的新型實驗藥物。 Setanaxib 是第一種進入臨牀 階段的氮氧化物抑制劑,它抑制 NOX1 和 NOX4,這些酶與 纖維化和炎症途徑有關,是高潛在的治療靶標。 Alport 綜合徵 Alport 綜合徵是一種遺傳性疾病,由編碼 IV 型膠原蛋白的基因突變引起。IV 型 膠原蛋白 α鏈主要位於腎臟、眼睛、 和耳蝸,因此該病以腎臟 疾病、聽力喪失和眼睛異常為特徵。最終, 患者出現蛋白尿、高血壓、腎功能進行性喪失 (GFR 逐漸下降)和 ESRD。 據估計,美國 州約有67,000人患有這種疾病,它是慢性 腎臟疾病(CKD)的重要原因,導致青少年和年輕 成年人的ESRD,佔歐盟和美國接受腎臟 替代療法兒童的 1.5% 至 3.0%。 管道:氮氧化物抑制劑平臺 基於支持性的臨牀前研究,Calliditas啟動了 一項針對Alport 綜合徵的隨機、安慰劑對照的2期研究,包括約20名患者。該研究將評估整體安全性以及對蛋白尿的影響。這項研究 於2023年11月啟動,根據數據 讀數,我們將決定Alport的全面監管計劃。 Calliditas於2023年9月被美國食品藥品管理局授予使用setanaxib治療 阿爾波特綜合徵的孤兒藥稱號, 於2023年9月被美國食品藥品管理局(EMA)授予孤兒藥稱號。 原發性膽源性膽管炎 PBC 是 肝臟的一種進行性慢性自身免疫性疾病,會對膽道上皮細胞造成免疫損傷,導致 膽汁淤積和纖維化。它是一種孤兒病,根據 其已知的患病率,我們估計美國大約有14萬名患者,每年 發病率為每10萬例0.3至5.8例。2021 年 8 月,Calliditas 在 PBC 中獲得了 FDA 的 setanaxib 快速通道稱號。 熊去氧膽酸,一種仿製藥也被稱為熊二醇或 UDCA,以及被稱為奧卡利瓦的奧貝膽酸,是唯一獲得美國食品藥品管理局批准的PBC治療藥物。但是,儘管有這些 治療選擇, PBC 患者的醫療需求仍未得到滿足,特別是在重要的 生活結果質量方面。 在111名PBC 患者中使用setanaxib進行的一項試驗的2期數據表明,對於 估計肝纖維化階段為F3或更高的患者,setanaxib對 肝纖維化和ALP降低(鹼性磷酸酶,PBC中公認的 預後獨立預測指標)具有更明顯的作用。 肝硬度升高的患者疾病進展的風險更大。 Calliditas正在對肝硬度升高的PBC患者進行一項隨機、安慰劑對照的雙盲2b期試驗 我們預計將在2024年第三季度讀出大約75名患者的數據。 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月12日業務概覽 未觀察到腫瘤大小與基線相比最佳 百分比變化的主要終點有顯著差異。 腫瘤活檢樣本的轉錄組學分析顯示,接受setanaxib治療的患者的腫瘤組織 中的CD8+ T細胞在統計學上顯著增加,表明 腫瘤免疫活性的增加與setanaxib 的作用機制一致。setanaxib與 pembrolizumab一起使用時的耐受性總體良好,沒有發現新的安全信號 。 Setanaxib 用於頭部 和頸部鱗狀細胞癌 2024年5月,Calliditas宣讀了其概念驗證2期試驗的主要數據,該試驗評估了setanaxib與pembrolizumab聯合治療複發性或轉移性 頭頸部鱗狀細胞癌(SCCHN)患者。 試驗是一項隨機、安慰劑對照、雙盲的2期研究,研究了setanaxib 800mg 與 pembrolizumab 200mg 靜脈注射的作用,每 3 周給藥一次,(SCCHN 的標準治療方案), 的完整數據集反映了所有有機會 完成至少15周治療的患者。 分析的基礎包括55名複發性或 轉移性SCCHN和中度或高CAF密度腫瘤的入組患者。 腫瘤活檢是在隨機分組之前進行的,然後在治療至少 9 周後再進行一次 。 管道:氮氧化物抑制劑平臺 第 2 階段數據讀取 治療組之間平衡良好,在基線時觀察到的各組之間沒有臨牀 相關差異。 接受pembrolizumab和setanaxib治療的患者在無進展存活率(PFS中位數為5個月 對比2.9個月;危險比= 0.58)和總存活率(OS 在6個月時為92%對68%;9個月時操作系統為88%對58%;危害 比率=0.0%;危害 比率= 0.0%), 的關鍵次要 終點顯示出 的統計學顯著改善 45) 與使用 pembrolizumab 和安慰劑治療的患者相比。 接受seta-naxib治療的患者的疾病控制率也有所改善,70%的setanaxib組在至少穩定的疾病中表現出 最佳反應,而 安慰劑組的這一比例為52%。 擴大專利保護 2024年4月,Calliditas收到了 美國專利商標局(USPTO)對第16/760,910號專利 申請的許可通知,該專利申請名為 “使用氮氧化物抑制劑治療癌症”。預計 管理程序完成後, 本許可通知將導致美國專利的簽發。允許的索賠涵蓋一種方法 通過將setanaxib與PD-1抑制劑 聯合給藥來治療對PD-1抑制劑 免疫療法表現出耐藥性的實體瘤。該專利一旦頒發,預計到期日將是2038年。 “在這項相對較小的研究中看到 重要臨牀結果具有統計學意義,這非常令人鼓舞, 這為在這一難以治療的人羣中推進setanaxib 提供了良好的基礎。” 凱文·哈靈頓, 倫敦癌症研究所(ICR)生物癌症療法教授,倫敦皇家馬斯登NHS基金會臨牀顧問 腫瘤學家, 該試驗研究員。 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月13日採訪瑪麗亞·託爾森 Calliditas北美總裁瑪麗亞·託爾森 你加入卡利迪塔斯時在 製藥行業擁有超過20年的經驗。你能談談你的職業生涯以及你迄今為止在該行業的 經歷嗎? 我的職業生涯始於瑞典北部的銷售代表。 回顧過去,我想説這有點運氣好,因為我 正在攻讀碩士學位時,我在隆德大學的職業生涯中遇到了來自瑞典禮來公司的代表。我幾乎不知道這次 初次會面會給我帶來過去 22 年的職業生涯,其中大部分時間都在我的祖國瑞典以外的地方度過。 從在瑞典的禮來公司和默沙東雪蘭諾 從事銷售和營銷的初期開始,我在 2008 年移居國外,當時我有機會在瑞士默沙東雪蘭諾擔任全球職務。自 2011 年以來,我 的職業生涯幾乎完全是在夏爾、賽諾菲健贊和薩雷普塔等組織 從事罕見疾病領域的全球、歐洲和美國 工作。我有機會在沒有 療法可用的疾病領域工作,有幾種已獲批准的療法的領域工作, 項目處於開發和商業化的各個階段。 在你接任 Calliditas 北美 總裁後,你認為 之前的哪些經歷最有價值? 雖然所有罕見病都是獨一無二的,但我通過研究 十五種不同的罕見病了解到有許多相似之處, 我已經能夠將這些相似之處從一個組織帶到另一個組織。 首先,罕見疾病患者通常面臨漫長的診斷之旅,有時包括誤診和看多名 專科醫生。這就是為什麼瞭解患者旅程至關重要, 可以確保我們在正確的時間為正確的 利益相關者提供正確的教育方式,以縮短診斷時間並提高 治療的緊迫性。 其次,一旦患者得到診斷,在大多數 病例中就沒有可用的治療方法,或者很難獲得治療。目前超過 95% 的 罕見疾病尚無治療方法,因此醫療保健 提供者可能僅限於提供支持性護理。在Calliditas,我們 可以為一種罕見疾病提供治療,即 IgA 腎病(iGaN)的TARPEYO,我們還擁有一支經驗豐富的准入團隊 ,可以幫助確保符合條件的患者獲得TARPEYO的治療機會。 最後,我還要強調社區支持的方面,以及 這對患有罕見疾病的人來説是多麼重要。由於大多數人對罕見 疾病知之甚少,被診斷患有 罕見疾病的人可能會面臨挑戰,要找到準確的信息 並獲得所需的支持。這就是患者組織 對罕見病患者發揮如此關鍵作用的原因,我感到自豪的是 Calliditas 正在與多個患者組織合作,支持 IGaN 和其他腎臟疾病患者。 領導 Calliditas 在美國的商業活動的前景讓你興奮不已? 2023 年 12 月,我們獲得 TARPEYO 的全面批准,用於 iGaN 的 治療。對於 Calliditas 來説,這是一個關鍵時刻,但對於 iGaN 社區來説,最重要的是 。這是 產品首次被證明可以減少 iGaN 中的腎功能喪失,這是 社區長期以來一直在等待的東西。 我很高興有機會與醫療保健提供者、 患者組織和付款人接觸,就TARPEYO的新適應症 進行教育,並確保適當的患者能夠獲得我們的 療法。 我同樣對我們的臨牀 項目和我們的氮氧化物酶抑制劑平臺感到興奮。在接下來的十二個月中,我們將對未滿足 需求較高的疾病地區進行多次數據讀取。這可能使我們有機會 在 將來可能幫助其他患者。 在護理標準 的背景下,你認為 的全面批准 和擴展的標籤對 TARPEYO 意味着什麼? 多年來,iGaN社區 一直沒有一種經批准的療法,該療法已被證明可以減少 腎功能喪失。自從 TARPEYO 獲得全面批准以來,他們 現在有了這個。我們不能低估這項 全面批准的重要性,因為它使醫療保健提供者有機會不僅可以管理蛋白尿,還可以告訴患者這可以幫助保持 他們的腎臟功能。它還將促進與付款人的討論, 改善患者的可及性。這對於 IgAn 患者來説是一個好處,因為許多人在 40 歲之前就被診斷出來了 ,並且將與這種疾病共存數十年。 你認為來年有哪些關鍵事件和里程碑 可能會推動 TARPEYO 的銷量和知名度? 2023 年 12 月的全面批准是 Calliditas 最重要的 里程碑。這項全面批准為更廣泛的 iGaN 人羣提供了准入。在2024年上半年,我們的重點是 對付款人和醫療保健提供者進行有關新標籤的教育,以確保 更廣泛地獲得TARPEYO。 我們的開放標籤延期(OLE)研究的數據對於幫助我們更好地瞭解提供 第二次 9 個月的 TARPEYO 治療的潛在益處也很重要。 我們預計今年另一個重要的里程碑是 KDIGO 指南的 更新。這些指南最後一次更新 是在2021年,也就是TARPEYO全面批准之前。我們知道,許多 腎臟科醫生在決定如何 使用 IGaN 治療患者時都會使用這些指南。我們預計,更新後的 指南將包括TARPEYO,並且它們還可能擴大 對應接受治療的 “高危人羣” 的定義。 關於今年第一季度在新標籤上與付款人 互動相關的進展,你能分享什麼? 我們在第一季度的重點是教育付款人瞭解 TARPEYO 的新標籤。我們對外地團隊進行了投資,既有 國家客户經理(主要是商業和政府付款人)和現場報銷經理,他們專注於 對腎臟科辦公室進行事先授權流程 的培訓,為患者就診提供便利。 自獲得全面批准以來,我們的國民賬户團隊以及我們的現場醫療團隊 一直在與付款人接觸。 這包括關於新標籤的多份科學演講, 向付款人概述了與先前 標籤相比的差異,並回答了他們的問題。 掌握了這些信息,我們預計主要付款人將在未來六個月內 更新其政策,這將為獲得TARPEYO提供便利。 |
| Calliditas Therapeutics | 2024 年中期報告:1 月 — 3 月 14 日繼續關注 CSRD 的實施 Calliditas Therapeutics | 2024 年中期報告:1 月至 3 月 在第一季度,Calliditas 採取了進一步措施,通過制定項目路線圖 並制定了幾項關鍵業績 指標,實施即將出台的法律要求 CSRD, 確保其 可持續發展工作取得進展。 在第一季度,Calliditas繼續努力 發展其可持續發展工作,重點是 根據雙重重要性評估將指導 未來戰略可持續發展工作和報告的問題。 根據當前的可持續發展報告,進行了 分析,以清楚地瞭解可用的信息和數據,以及為遵守CSRD及其 相關標準需要添加的內容。 為了確保在長期 可持續發展工作中設定正確的優先事項,在第一個 季度制定了路線圖。它定義了Calliditas需要做什麼,以便 推動其可持續發展工作向前發展,以及 工作的完成方式、時間表以及誰負責,或者由哪個 職能部門負責。 可持續性 持續跟蹤的關鍵數據 為了加快可持續發展工作 和數據收集的步伐,第一季度制定了幾項精選的關鍵績效指標 ,以持續監測 Calliditas一些物質可持續發展事項的進展。 該選擇是根據許多ESRS中包含的指標和目標 做出的,Calliditas將從2025財年開始報告這些指標和目標 。概述: 環境 • 從可再生能源購買的所有電力的份額 社會 • 與工傷、健康狀況不佳 病例和死亡有關的事故數量 • 因工作相關的健康狀況不佳而損失的天數 • 離開 Calliditas 的員工人數/員工流失率 治理 • 接受過 Calliditas 守則培訓的員工百分比} 行為 • 已簽署 Calliditas 行為準則的商業夥伴的百分比 繼續努力推動過渡 對於 Calliditas 來説,長期工作是制定政策、流程、 目標,並繼續開展活動。此外,Calliditas將逐步增加關鍵績效指標,以加快 可持續發展工作和CSRD實施的進展。 14 環境問題 • 緩解和適應氣候變化 • 循環經濟和浪費 社會問題 • 員工健康和安全 • 產品獲取 • 最終用户的健康和安全 治理事項 • 反腐敗和反賄賂 • 動物保護 Calliditas的物質可持續發展領域 最重要的可持續性問題 供Calliditas合作、監控和報告 的七個主要區域分為 ,分為 : |
| Calliditas Therapeutics | 2024年中期報告:2024年1月至3月15日1月15日—3月3日財務概覽 收入 截至2024年3月31日和2023年3月31日的三個月,淨銷售額分別為2.955億瑞典克朗和1.914億瑞典克朗, 。淨銷售額主要來自美國 TARPEYO® 的淨銷售額,截至2024年3月31日和2023年3月31日的三個月,淨銷售額分別為2.783億瑞典克朗和 1.857億瑞典克朗。在截至2024年3月31日和2023年3月31日的三個 個月中,我們的合作伙伴關係 的特許權使用費收入分別為1,300萬瑞典克朗和440萬瑞典克朗。 有關其他信息,請參閲註釋 4。 銷售成本 截至2024年3月31日和2023年3月31日的三個月, 的銷售成本分別為1,400萬瑞典克朗和900萬瑞典克朗。 總運營費用 截至2024年3月31日和 2023年3月31日的三個月,總運營支出分別為4.853億瑞典克朗和3.624億瑞典克朗。 研發費用 截至2024年3月31日和2023年3月31日的三個月,研發費用分別為1.506億瑞典克朗和1.267億瑞典克朗。該期間增加了2,390萬瑞典克朗 主要是由於 氮氧化物平臺的臨牀活動增加,包括正在進行的setanaxib試驗。 營銷和銷售費用 截至2024年3月31日和2023年3月31日的三個月,營銷和銷售費用分別為2.401億瑞典克朗 和1.672億瑞典克朗。7,290萬瑞典克朗的增長主要與TARPEYO 的營銷活動加強有關,以及由於TARPEYO在美國 獲得全面批准,美國銷售隊伍的增加。 管理費用 截至2024年3月31日的三個月, 管理費用 分別為1.02億瑞典克朗和7,250萬瑞典克朗 7,250萬瑞典克朗。 期間增加的2950萬瑞典克朗主要與大型組織 的成本增加和監管要求的增加有關。 截至2024年3月31日和2023年3月31日的三個月, 其他營業收入/支出淨額 其他營業收入(支出)淨額分別為750萬瑞典克朗和400萬瑞典克朗。這種改善主要歸因於與經營 應收賬款和負債相關的匯率變動。 淨財務收入和支出 截至2024年3月31日和2023年3月31日的三個月,淨財務收入(支出)分別為(4,350萬瑞典克朗) 和(2790萬瑞典克朗)。 (1,550萬瑞典克朗)淨額的變化主要來自利息支出 和主要與折算效應相關的貨幣影響。 税 截至2024年3月31日和2023年3月31日的三個月,所得税(支出)總額分別為120萬瑞典克朗和2,050萬瑞典克朗。所得税的變化主要是由美國 子公司在2023年第一季度確認的結轉虧損來解釋的。集團結轉的税收損失 未被確認為遞延所得税資產, 除非此類税收損失可用於抵消 臨時差額。 期間的業績 截至2024年3月31日和2023年3月31日的三個月,該期間的虧損 為2.462億瑞典克朗和1.875億瑞典克朗, 稀釋前後的相應每股虧損分別為4.59瑞典克朗和3.49瑞典克朗。 現金流和現金狀況 截至2024年3月31日和2023年3月31日的三個月,用於經營活動的現金流分別為1.982億瑞典克朗和2.319億瑞典克朗。減少的主要原因是當期應收賬款的變化。 截至2024年3月31日和2023年3月31日的三個月,用於投資活動的現金流分別為390萬瑞典克朗和290萬瑞典克朗。 的變化主要是由購置設備來解釋的。 截至2024年3月31日和2023年3月31日的三個月,用於融資活動的現金流分別為550萬瑞典克朗和300萬瑞典克朗。 截至2024年3月31日和2023年3月31日的三個月,現金淨減少分別為2.075億瑞典克朗和2.378億瑞典克朗。截至2024年3月31日和2023年3月31日,現金分別為8.103億瑞典克朗和10.136億瑞典克朗, 。 人員 截至2024年3月31日和2023年3月31日的 三個月,平均員工人數分別為219和170人。 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月16日財務概覽 截至2024年3月31日和2023年3月31日 ,股東權益和 股份數量 的股東權益變動 分別為1.202億瑞典克朗和5.894億瑞典克朗。截至2024年3月31日和2023年3月31日 ,註冊股票的數量分別為59,580,087股和59,580,087股。 庫存股 截至2024年3月31日,Calliditas有5,908,018股普通股 由母公司作為庫存股持有。在2023年年度 股東大會上,授權Calliditas 可以轉讓(出售)這些普通股,其目的是 為收購業務籌集資金,為 項目開發融資,償還貸款或將Calliditas的產品商業化。截至2024年3月31日,尚未轉讓(出售)庫存股 。有關 的更多信息,請參閲註釋 7 和 8。 激勵計劃 在截至2024年3月31日的三個月中,已為2023年ESOP計劃分配了55.5萬份期權。 有關激勵計劃的更多信息,請參閲註釋 9。 母公司 截至2024年3月31日和2023年3月31日的三個月,母公司Calliditas Therapeutics AB 的淨銷售額分別為1.382億瑞典克朗和1.684億瑞典克朗。 下降主要歸因於 產品銷售價格組合與去年相比的變化。 截至2024年3月31日和2023年3月31日的三個月, 的營業虧損分別為1.740億瑞典克朗和4,660萬瑞典克朗。1.274億瑞典克朗的減少主要是 與加強營銷活動、 監管要求增加以及組織規模擴大相關的成本增加有關。 執行管理層 Calliditas Therapeutics AB的執行管理層包括:首席執行官蕾妮·阿吉亞爾-盧坎德、首席財務官弗雷德裏克 約翰遜、首席營銷官理查德·菲利普森、集團總法律顧問 布萊恩·戈爾曼、北美總裁瑪麗亞·託爾森、監管事務副總裁弗蘭克·布林斯特魯普、技術 運營主管拉斯·斯塔伯伯斯兼人力資源主管 桑德拉·弗裏西奧夫。 提名委員會 2024 年股東周年大會提名委員會包括: 帕特里克·索博基(由 Stiftelsen Industrifonden 任命)、卡爾 Tobieson(由 Linc AB 任命)和 Spike Loy(由 BVF 任命)組成。 2024 年年度股東大會 2024 年年度股東大會將於歐洲中部時間 6 月 17 日下午 14:00 在瑞典斯德哥爾摩的 Klarabergsviadukten 90 舉行。所有文件都將在公司的網站上發佈。 2024年展望不變Calliditas預計2024年的收入將持續增長:截至2024年12月31日的財年,包括里程碑在內的 特許經營權的總淨銷售額 估計為1.5億至1.8億美元。 股份 截至2024年3月31日,股票數量為 59,580,087股普通股,其中5,908,018股由母公司作為 庫存股持有。截至2024年3月28日, Calliditas Therapeutics股票CALTX的收盤價為 113.4瑞典克朗。截至2024年3月31日, 的股東總數約為18,000人。 股東結構 截至2024年3月的十大股東% BVF Partners LP 10,51 Linc AB 10,01 Stiftelsen Industrifonden 5,28 Polar Capital 3,94 Unionen 3,60 Avanza Ponder 3,24 Handelsbanken Fonder 2,94 Fonder 2,94 Fonder 2,23 小計,10 大股東 47,06 股 9,92 其他股東 43,02 總計 100.00 Calliditas 研發日 5月30日,Calliditas將於歐洲中部時間下午15點在斯德哥爾摩Västra Trädgårdsgatan 19的Inderes 活動工作室舉行研發日活動。該活動可在線觀看,也可以 現場直播。要參加、直播或在線參加,請通過以下網址註冊: https://financialhearings.com/event/49948/register/live_event Auditor’s 評論 本中期報告未經過 公司審計師的審查。 斯德哥爾摩 2024 年 5 月 23 日 Renee Aguiar-Lucander 首席執行官 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月17日重大事件 財務評論 2024年1月1日至3月31日期間的重大事件 • 1月7日,Calliditas宣佈任命瑪麗亞·託爾森 擔任北美總裁。 Törnsén 女士負責所有在美國的業務, 向首席執行官報告。 • 2月13日,Calliditas宣佈美國 專利商標局(USPTO)頒發了專利號 11896719,標題為 “新藥物成分”,於 2024 年 1 月 24 日生效,有效期為 2024 年 2 月 13 日。這是 Calliditas 在 TARPEYO 在美國獲得的第二項 專利,並在 2043 年 2 月 13 日之前提供 產品保護。 • 3月6日,Calliditas宣佈,美國食品藥品管理局根據該藥物 產品獲得全面批准並擴大適應症的時間,授予TARPEYO® 的 孤兒藥獨家經營期為七年, 將於2030年12月到期。 期限結束後的重大事件 • 4月8日,Calliditas宣佈,公司收到美國專利商標局(USPTO)發出的題為 “使用氮氧化物抑制劑治療癌症” 的第16/760,910號專利申請許可通知。一旦管理程序完成,這份 許可通知預計將導致美國 專利的簽發。 • 4月24日,Calliditas宣佈,對NefiGard三期研究的全球開放標籤 延期(OLE)研究顯示, 所有IgAn患者(包括之前患有尿蛋白與肌酐比例)終點(UPCR)和 估計的腎小球濾過率(eGFR)為9個月, 的治療反應與Nefigard的研究一致在 NetiGard 的研究中獲得了 Nevecon。 • 5月6日,Calliditas公佈了概念驗證2期試驗的主要數據,該試驗評估了其主要氮氧化物酶 抑制劑setanaxib與pembrolizumab聯合治療頭頸部鱗狀細胞癌(SCCHN)患者。 分析顯示,無進展存活率(PFS)和總存活率(OS)具有統計學上的顯著改善, 腫瘤生物學的統計學顯著變化與 setanaxib的作用機制一致。 • 5月14日,Calliditas宣佈其合作伙伴珠穆朗瑪峯 藥業在中國推出了Nevecon®,據估計 有多達500萬患者患有進行性 自身免疫性疾病。 • 截至本報告發布之日,TARPEYO第二季度的初步淨銷售額增長 為2550萬美元。 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月18日向投資者、 分析師和媒體發佈會 欲瞭解更多信息 請聯繫 即將舉行的活動 • Calliditas邀請投資者、分析師和媒體於歐洲中部時間2024年5月23日下午 14:30 參加 2024年第一季度報告的發佈會。該報告於 於歐洲中部時間5月23日上午 7:00 發佈。 • Calliditas首席執行官蕾妮·阿吉亞爾-盧坎德將與首席財務官弗雷德裏克·約翰遜、首席營銷官理查德·菲利普森和北美總裁 瑪麗亞·託爾恩森一起提交報告。演講將以英語進行。 • 時間:歐洲中部時間 2024 年 5 月 23 日星期四下午 14:30 • 網絡直播鏈接 https://ir.financialhearings.com/calliditas-therapeutics-q1-report-2024 • 要通過電話會議註冊,請通過此鏈接註冊: https://conference.financialhearings.com/teleconference/?id=50047214 註冊後,您將收到一個電話號碼和一個用於登錄電話會議的會議ID 。通過電話會議,有 機會進行口頭提問。 Calliditas 2024 年研發日 Västra Trädgärdsgatan 19,斯德哥爾摩 5 月 30 日 2024 年年度股東大會 Klarabergsviadukten 90,斯德哥爾摩 6 月 17 日 第二季度中期報告 2024 年 1 月 — 9 月 11 日 Renee Aguiar-Lucander /首席執行官 +46 (0)) 8 411 30 05 renee.lucander@calliditas.com Å sa Hillsten/投資者關係與可持續發展主管 +46 (0) 764 03 35 43 43 asa.hillsten@calliditas.com 補充信息 本中期報告未經公司審計師審查或審計。 報告中的信息是Calliditas根據歐盟 《市場濫用條例》有義務公開的信息。該信息已於歐洲中部時間 2024 年 5 月 23 日上午 7:00 通過上述聯繫人 的代理機構發送出版。 註冊辦事處 Calliditas Therapeutics AB Kungsbron 1 SE 111 22 瑞典斯德哥爾摩 calliditas.com/ ir@calliditas.com 前瞻性陳述 本中期報告包含經修訂的1995年《私人證券訴訟改革法》所指的前瞻性陳述,包括但不限於有關Calliditas戰略、商業計劃、收入和其他財務預測以及重點的聲明。“可能”、 “將”、“可能”、“將”、“應該”、“預期”、“計劃”、“打算”、“相信”、“估計”、“預測”、“項目”、“潛力”、“繼續”、“目標” 和類似的 表述旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別詞。 本中期報告中的任何前瞻性陳述均基於管理層當前的預期和信念,並受許多風險、 不確定性和重要因素的影響,這些因素可能導致實際事件或結果與本中期報告中包含的任何前瞻性 陳述所表達或暗示的內容存在重大差異,包括但不限於與Calliditas的業務、運營、TARPEYO、 Kinpeygo和Nego商業化相關的任何前瞻性陳述 Fecon、臨牀試驗、供應鏈、戰略、目標和預期時間表發展和潛在批准、來自 其他生物製藥公司的競爭、收入和產品銷售預測或預測,包括2024年的總淨銷售指引和現金跑道以及 迄今為止的2024年第二季度的初步淨銷售額,以及Calliditas向 美國證券交易委員會提交的報告中題為 “風險因素” 的部分中確定的其他風險。 Calliditas提醒您不要過分依賴任何前瞻性陳述,這些陳述僅代表其發表之日。Calliditas聲明 沒有義務公開更新或修改任何此類陳述,以反映預期的任何變化或 任何此類陳述所依據的事件、條件或情況的任何變化,或者可能影響實際業績與前瞻性陳述中列出的結果不同的可能性。 本中期報告中包含的任何前瞻性陳述僅代表Calliditas截至本報告發布之日的觀點,不應將其視為 代表其截至隨後任何日期的觀點。 本中期報告以瑞典語原文編寫,並已翻譯成英文。如果兩者之間存在差異,則適用瑞典語 版本。 |
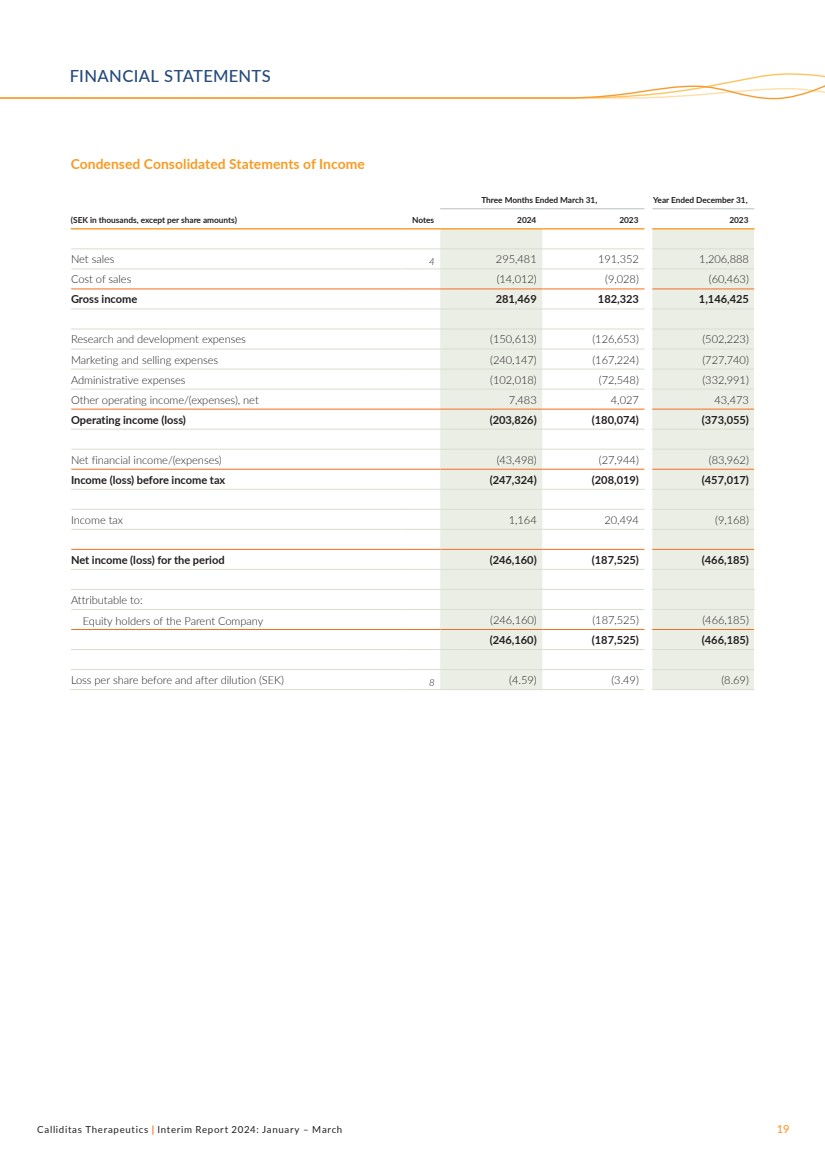
| Calliditas Therapeutics | 2024年中期報告:1月至3月19日簡明合併收益表 截至3月31日的三個月,截至12月31日的財年, (千瑞典克朗,每股金額除外)附註 2024 2023 年淨銷售額 4 295,481 191,352 1,206,888 銷售成本 (14,012) (9,028) (60,463) 總收入 281,469 182,323 1,146,425 研發費用 (150,613) (126,653) (502,223) 營銷和銷售費用 (240,147) (167,224) (727,740) 管理費用 (102,018) (72,548) (332,991) 其他營業收入/ (費用),淨額 7,483 4,027 43,473 營業收入(虧損)(203,826)(180,074)(373,055) 淨財務收入/(支出)(43,498)(27,944)(83,962) 所得税前收入(虧損)(247,324)(208,019)(457,017) 所得税 1,164 20,494 (9,168) 期內淨收益(虧損)(246,160)(187,525)(466,185) 歸屬於: 母公司 (246,160) (187,525) (187,525) (466,185) (246,160) (187,525) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,160) (466,185) 攤薄前後的每股虧損(瑞典克朗)8(4.59)(3.49)(8.69) 財務報表 |
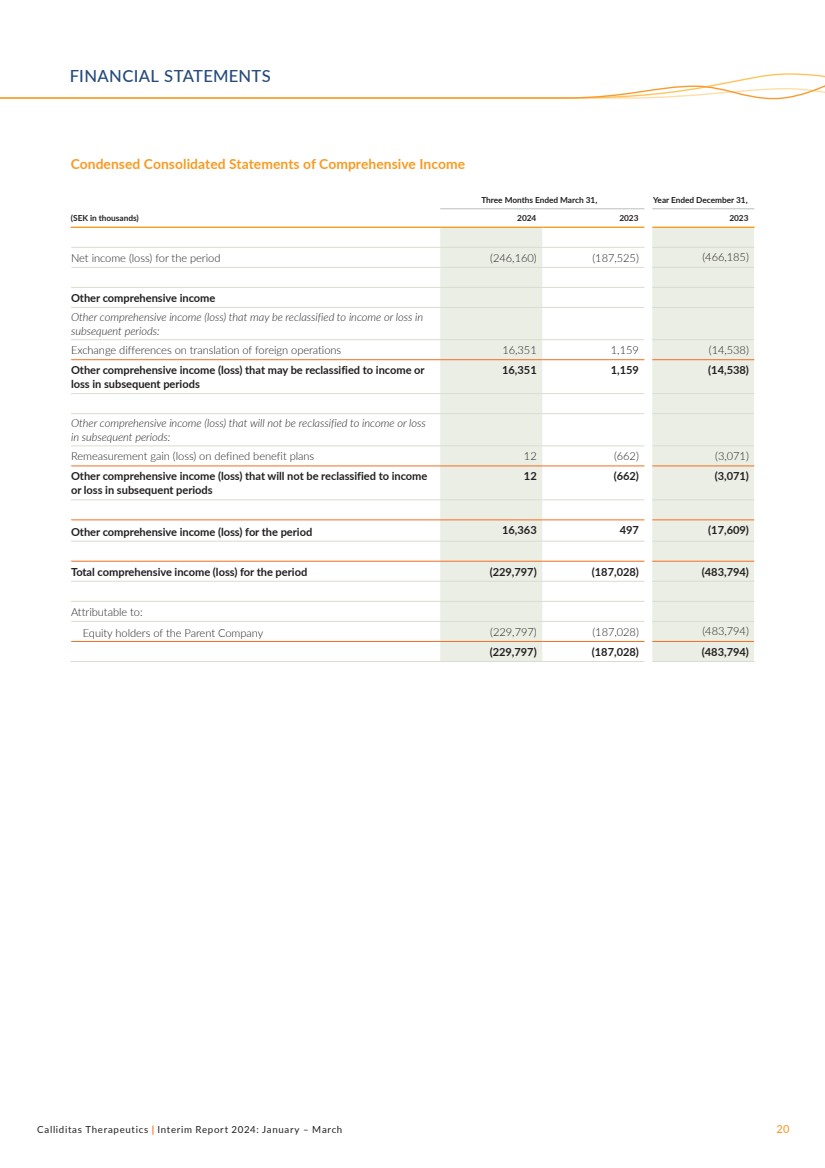
| Calliditas Therapeutics | 2024年中期報告:1月至3月20日簡明綜合收益表 截至3月31日的三個月, (千瑞典克朗)2024 2023 2023 年期間淨收益(虧損)(246,160)(187,525)(466,185) 其他綜合收益 可能重新歸類為收益或的其他綜合收益(虧損) 後續時期的虧損: 國外業務折算的匯兑差額 16,351 1,159 (14,538) 可能重新歸類為收益的其他綜合收益(虧損)或 後續時期的虧損 16,351 1,159 (14,538) 後續時期不會重新歸類為收益或虧損 的其他綜合收益(虧損): 固定福利計劃的重估收益(虧損)12 (662) (3,071) 不會重新歸類為收入 或虧損後續時期 12 (662) (3,071) 該期間的其他綜合收益(虧損)16,363 497(17,609) 該期間(229,797)(187,028)(483,794) 歸屬於: 的股權持有人母公司 (229,797) (187,028) (483,794) (229,797) (187,028) (483,794) 財務報表 |
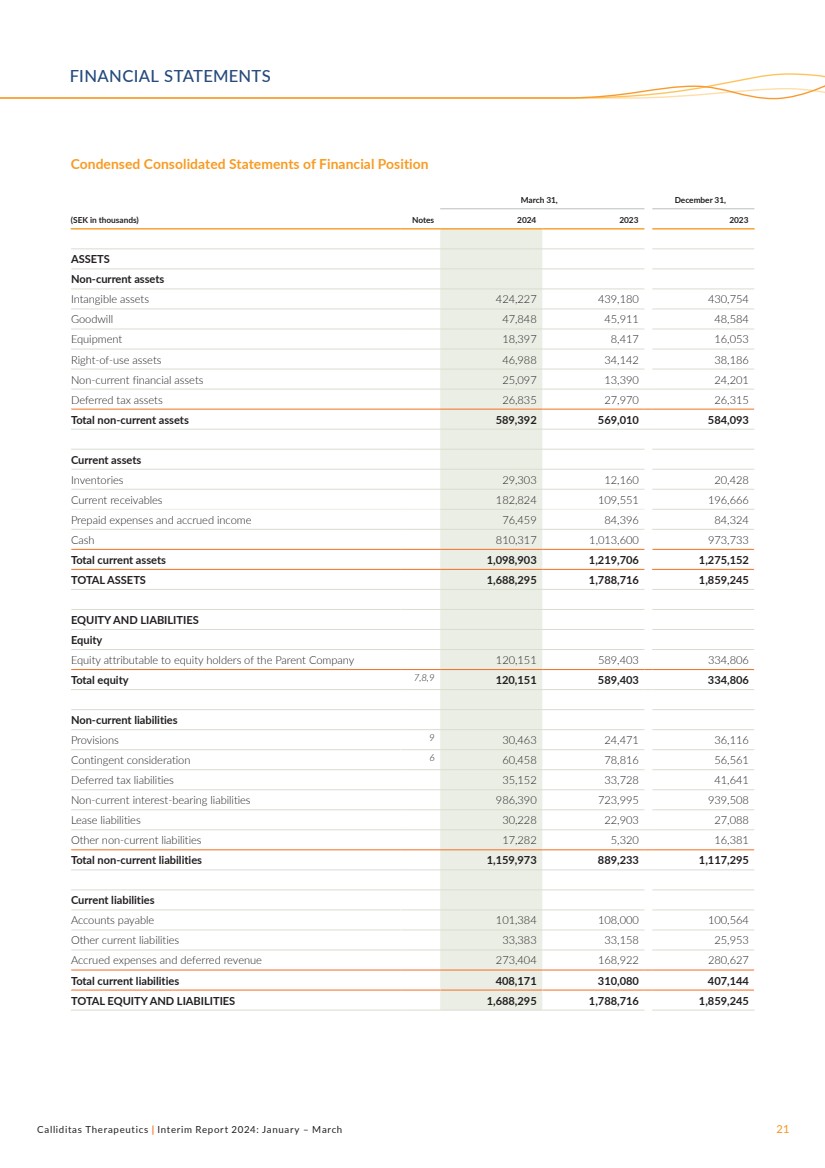
| Calliditas Therapeutics | 2024 年中期報告:1 月 — 3 月 21 日 3 月 31 日,12 月 31 日, (千瑞典克朗)票據 2024 2023 年資產 非流動資產 無形資產 424,227 439,180 430,754 商譽 47,848 45,911 48,584 設備 18,397 8,417 16,053 使用權資產 46,988 34,142 38,186 非流動金融資產 25,097 13,390 24,201 遞延所得税資產 26,835 27,970 26,315 非流動資產總額 589,392 569,010 584,093 流動資產 存貨 29,303 12,160 20,428 流動應收賬款 182,824 109,551 196,666 預付費用和應計費用收入 76,459 84,396 84,324 現金 810,317 1,013,600 973,733 流動資產總額 1,098,903 1,219,706 1,275,152 總資產 1,688,295 1,788,716 1,859,245 1,859,245 權益和負債 股權 歸屬於母公司股東的權益 120,151 589,403 334,806 總權益 7,8,9 120,151 589,403 334,806 非流動負債 準備金 9 30,463 24,471 36,116 或有對價 6 60,458 78,816 561 遞延所得税負債 35,152 33,728 41,641 非流動計息負債 986,390 723,995 939,508 租賃負債 30,228 22,903 27,088 其他非流動負債 17,282 5,320 16,381 非流動負債總額 1,159,973 889,233 1,117,295 流動負債 應付賬款 101,384 108,564 其他流動負債 33,383 33,158 25,953 應計費用和遞延收入 273,404 168,922 280,627 流動負債總額 408,171 310,080 407,144 權益和負債總額 1,688,295 1,788,716 1,859,245 簡明合併財務狀況表 財務報表 |
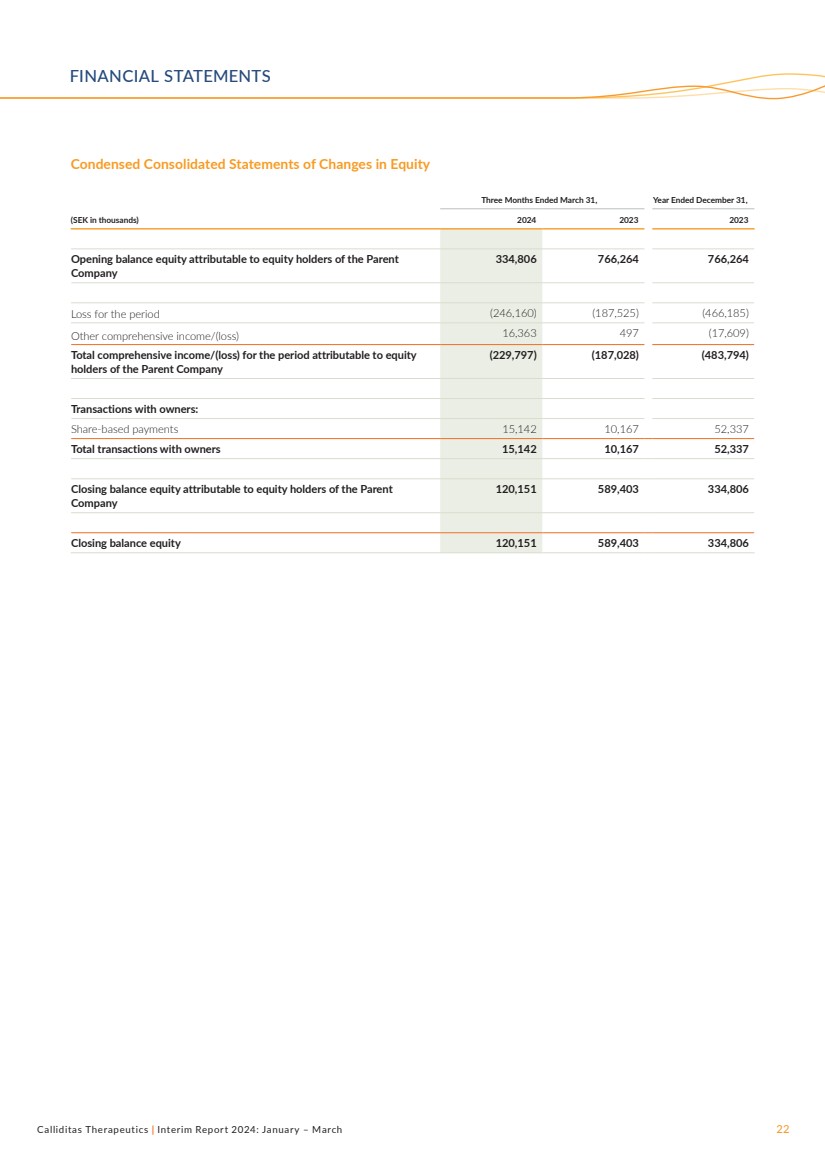
| Calliditas Therapeutics | 2024年中期報告:1月至3月22日截至3月31日的三個月簡明綜合權益變動表 (千瑞典克朗)2024 2023 年歸屬於母公司 公司股權持有人的期初餘額權益 334,806 766,264 766,264 本期虧損 (246,160) (187,525) (46625) (46625) (46625) (46625) (46625) (46625) ,185) 其他綜合收益/(虧損)16,363 497(17,609) 歸屬於母公司權益 持有人的本期綜合收益/(虧損)(229,797)(187,028)(483,794) 與所有者的交易: 基於股份的付款 15,142 10,167 52,337 與所有者的交易總數 15,142 10,167 52,337 歸屬於母公司 股東的期末餘額權益 120,151 589,403 334,806 期末餘額權益 120,151 589,403 334,806 財務報表 |
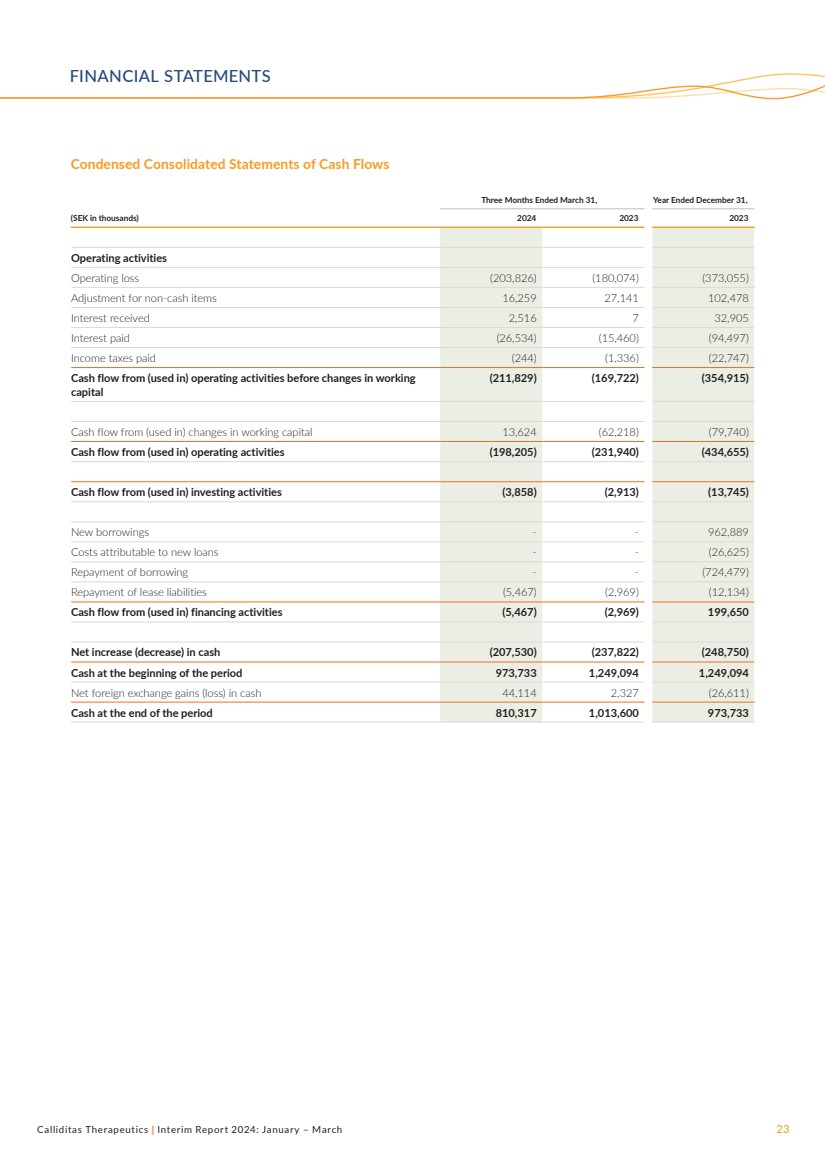
| Calliditas Therapeutics | 2024年中期報告:1月至3月23日截至3月31日的三個月,截至12月31日的年度, (千瑞典克朗)2024 2023 年經營活動 營業虧損 (203,826) (180,074) (373,055) 非現金項目調整 16,259 27,141 102,478 已收利息 2,516 7 32,905 已付利息 (26,905) (15,460) (94,497) 已繳所得税 (244) (1,336) (22,747) 營運資本變動前來自(用於)經營活動的現金流 (211,829) (169,722) (354,915) 來自(用於)工作變動的現金流資本 13,624(62,218)(79,740) 來自(用於)經營活動的現金流(198,205)(231,940)(434,655) 來自(用於)投資活動的現金流(3,858)(2,913)(13,745) 新借款--962,889 歸因於新貸款的成本--(26,625) 償還借款-(724,479) 償還租賃負債 (5,467) (2,969) (12,134) 來自(用於)融資活動的現金流(5,467)(2,969)199,650 現金淨增加(減少)(207,530)(237,822)(248,750) 期初的現金 973,733 1,249,094 1,249,094 淨額現金外匯收益(虧損)44,114 2,327(26,611) 期末現金 810,317 1,013,600 973,733 簡明合併現金流量表 財務報表 |
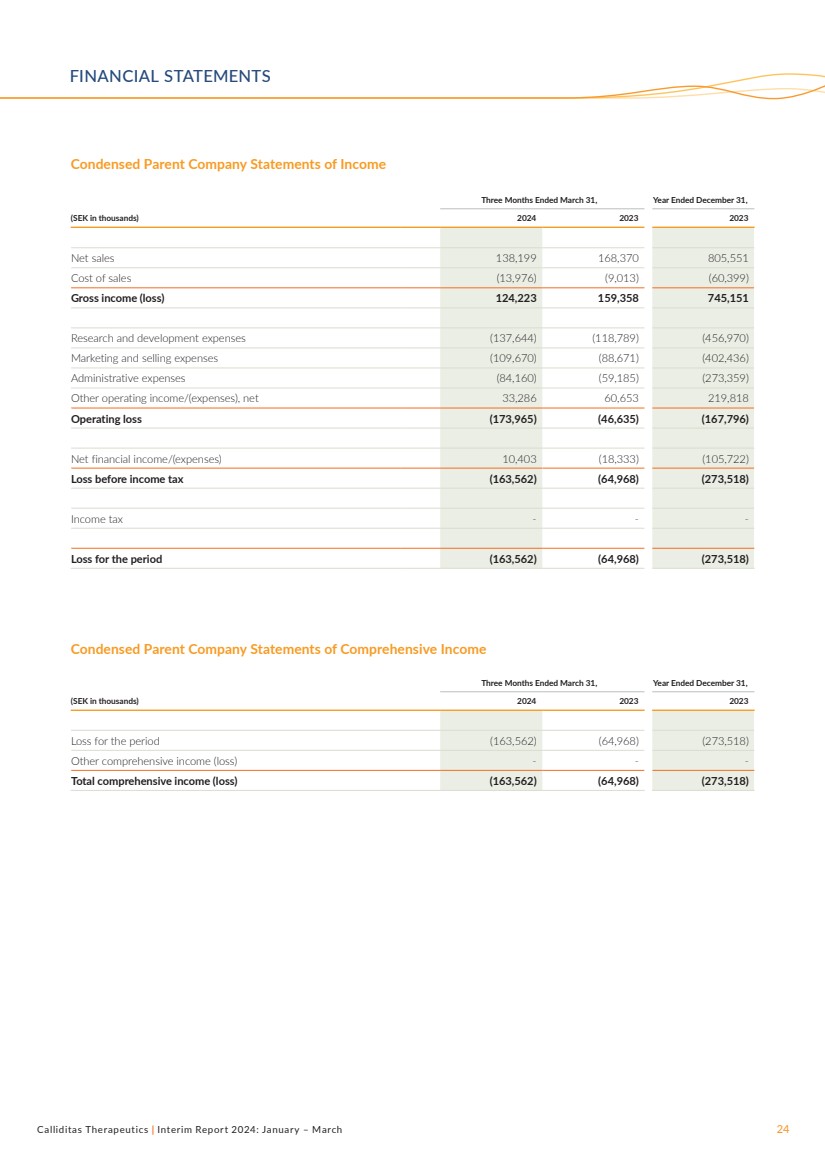
| Calliditas Therapeutics | 2024年中期報告:1月至3月24日簡化母公司收益表 截至3月31日的三個月,截至12月31日的年度, (千瑞典克朗)2024 2023 年淨銷售額 138,199 168,370 805,551 銷售成本(13,976)(9,013)(60,399) 總收益(虧損)124,223 159,358 7458 151 研發費用 (137,644) (118,789) (456,970) 營銷和銷售費用 (109,670) (88,671) (402,436) 管理費用 (84,160) (59,185) (273,359) 其他營業收入/ (費用),淨額 33,286 60,653 219,818 營業虧損 (173,965) (46,635) (167,796) 淨財務收入/ (支出) 10,403 (18,333) (105,722) 所得税前虧損 (163,562) (64,968) (273,518) 所得税-- 期內虧損 (163,562) (63,562) (64,968) 4,968) (273,518) 截至3月31日的三個月,截至12月31日的財年, (千瑞典克朗)2024 2023 2023 年期間虧損 (163,562) (64,968) (273,518) 其他綜合收益(虧損)-- 綜合收益(虧損)(163,562) (64,968) (273,518) (273,518)) 簡明母公司綜合收益表 財務聲明 |
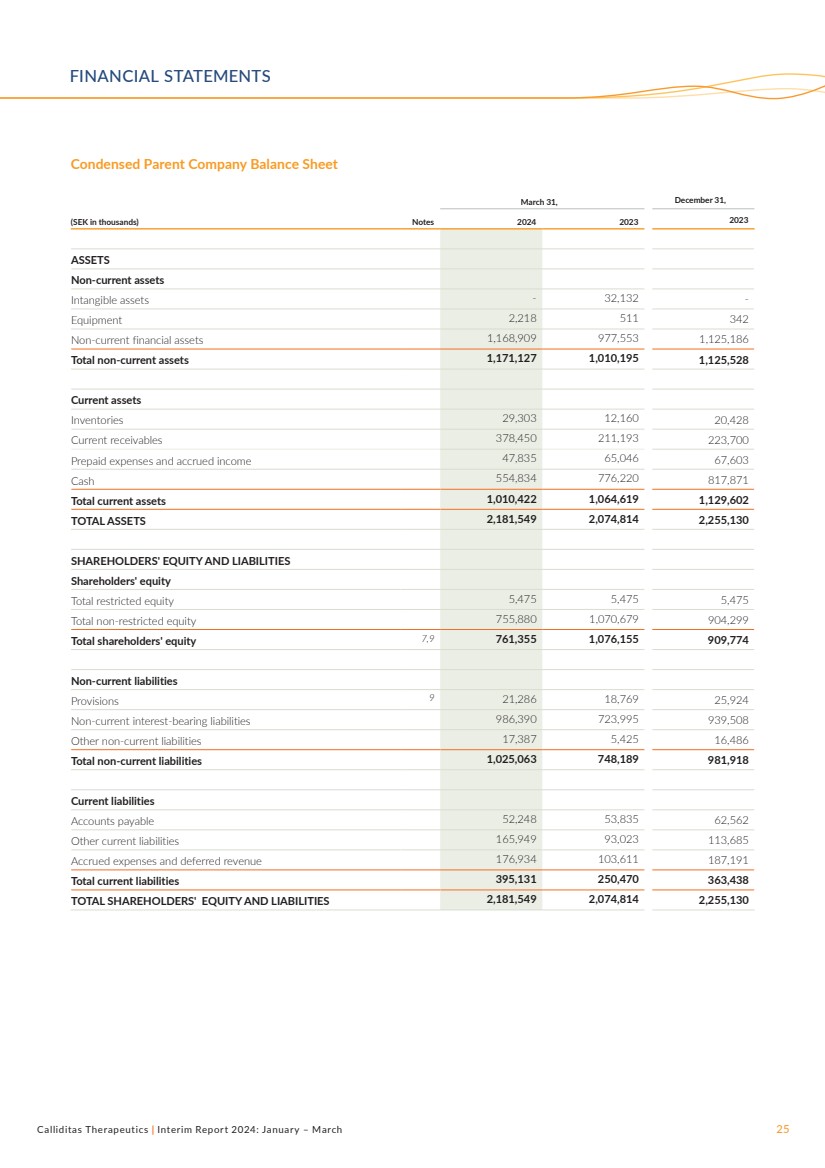
| Calliditas Therapeutics | 2024 年中期報告:1 月 — 3 月 25 日簡化母公司資產負債表 3 月 31 日,12 月 31 日, (千瑞典克朗)票據 2024 2023 年資產 無形資產-32,132- 設備 2,218 511 342 非流動金融資產 1,168,909 977,553 1,125,186 非流動資產總計 1,071,127 10,195 1,125,528 流動資產 存貨 29,303 12,160 20,428 流動應收賬款 378,450 211,193 223,700 預付費用和應計收入 47,835 65,046 67,603 現金 554,834 776,220 817,871 流動總額資產 1,010,422 1,064,619 1,129,602 總資產 2,181,549 2,074,814 2,255,130 股東權益和負債 限制性權益總額 5,475 5,475 5,475 非限制性權益總額 755,880 1,070,679 904,299 股東權益總額 7,9 761,355 1,076,155 909,774 非流動負債 條款 9 21,286 18,769 25,924 非流動計息負債 986,390 723,995 939,508 其他非流動負債 17,387 5,425 16,486 非流動負債總額 1,025,063 748,189 981,918 流動負債 應付賬款52,248 53,835 62,562 其他流動負債 165,949 93,023 113,685 應計費用和遞延收入 176,934 103,611 187,191 流動負債總額 395,131 250,470 363,438 股東權益和負債總額 2,181,549 2,074,814 2,255,130 財務報表 |
| Calliditas Therapeutics | 2024年中期報告:1月至3月26日附註1——業務描述 Calliditas Therapeutics AB(publ)(“Calliditas” 或 “母公司”),公司註冊號為556659-9766,其 子公司(統稱 “集團”)開展藥品商業和開發活動。這些中期簡明 合併財務報表涵蓋了總部設在瑞典斯德哥爾摩的集團及其子公司 截至2024年3月31日和2023年3月31日的三個月。 Calliditas是一家在斯德哥爾摩註冊的瑞典上市有限公司,註冊辦事處設在斯德哥爾摩。 公司總部的註冊地址是瑞典斯德哥爾摩D5的Kungsbron 1。Calliditas在斯德哥爾摩納斯達克的中型股板塊上市,股票代碼為 “CALTX”,並以ADS的形式在美國納斯達克全球精選市場上市,股票代碼為 “CALT”。 這些中期簡明合併財務報表已獲董事會(“董事會”)批准於 2024 年 5 月 23 日發佈。該報告可能包括前瞻性陳述。實際結果可能與所説的有所不同。內部 因素,例如成功管理研究項目和知識產權,可能會影響未來的結果。還有 外部條件(例如經濟環境、政治變化和相互競爭的研究項目)可能會影響集團的業績。 附註2-會計政策 這些中期簡明合併財務報表是根據國際會計準則 第34號(IAS 34)“中期財務報告” 編制的。母公司適用瑞典財務報告委員會建議 RFR2 “法人會計”。在編制中期簡明合併財務 報表時採用的會計政策與編制2023年年度報告時遵循的會計政策一致。2024 年 1 月 1 日生效的新準則或修訂後的標準 和解釋均未對集團的財務報告產生重大影響。重要的 會計政策可以在2023年年度報告中找到,從第45頁起,包括相應附註中的披露。 適用ESMA(歐洲證券和市場管理局)關於替代關鍵績效比率的指導方針,這意味着 對未按照《國際財務報告準則》定義的財務指標進行披露要求。對於國際財務報告準則未定義的關鍵比率, 請參閲第30頁替代績效指標的定義和對賬表。 注3-集團和母公司的風險和不確定性 運營風險 直到批准註冊和上市的研究和藥物開發都面臨相當大的風險,是一個資本密集型的 過程。由於技術風險,例如 未能證明有效性或良好的風險/收益狀況,或者製造問題,所有已啟動的項目中的大多數永遠無法獲得市場註冊。競爭藥品可以佔領市場 份額或更快地進入市場,或者如果競爭的研究項目獲得更好的產品概況,則產品 產品組合的未來價值可能會低於預期。運營也可能受到監管決策的負面影響,例如缺乏批准 和價格變化。 Calliditas的商業化產品已在美國獲得全面批准,品牌名稱為TARPEYO,並在歐盟和英國獲得了 品牌名為Kinpeygo的 有條件的上市許可,在中國以品牌名稱 Nevecon,這取決於有條件的營銷許可的續訂。存在以下風險: 無法按計劃進行商業化,或者處方醫生的吸收率將低於計劃,或者該藥物不會產生足夠的效果, 或出現不良副作用,這可能會對銷售產生負面影響。財務概覽中描述了對財務報表的影響。 金融風險 Calliditas管理金融風險的財務政策由董事會設計,以風險授權和金融活動限額的形式代表 指導方針和規則框架。該集團主要受外匯風險影響 ,因為Nefecon和setanaxib的開發成本主要以美元和歐元支付。此外,集團 持有美元和歐元的應收賬款以及美元和歐元的現金,以支付與 美國TARPEYO商業化和臨牀開發項目有關的 未來預期成本。關於集團和母公司的 財務風險管理,與2023年年度報告中的描述相比,風險基本沒有變化。 有關運營和財務風險的更多信息和全面披露,請參閲2024年4月向美國證券交易委員會提交的2023年年度報告和20-F表年度報告。 簡明合併財務報表附註 附註 |
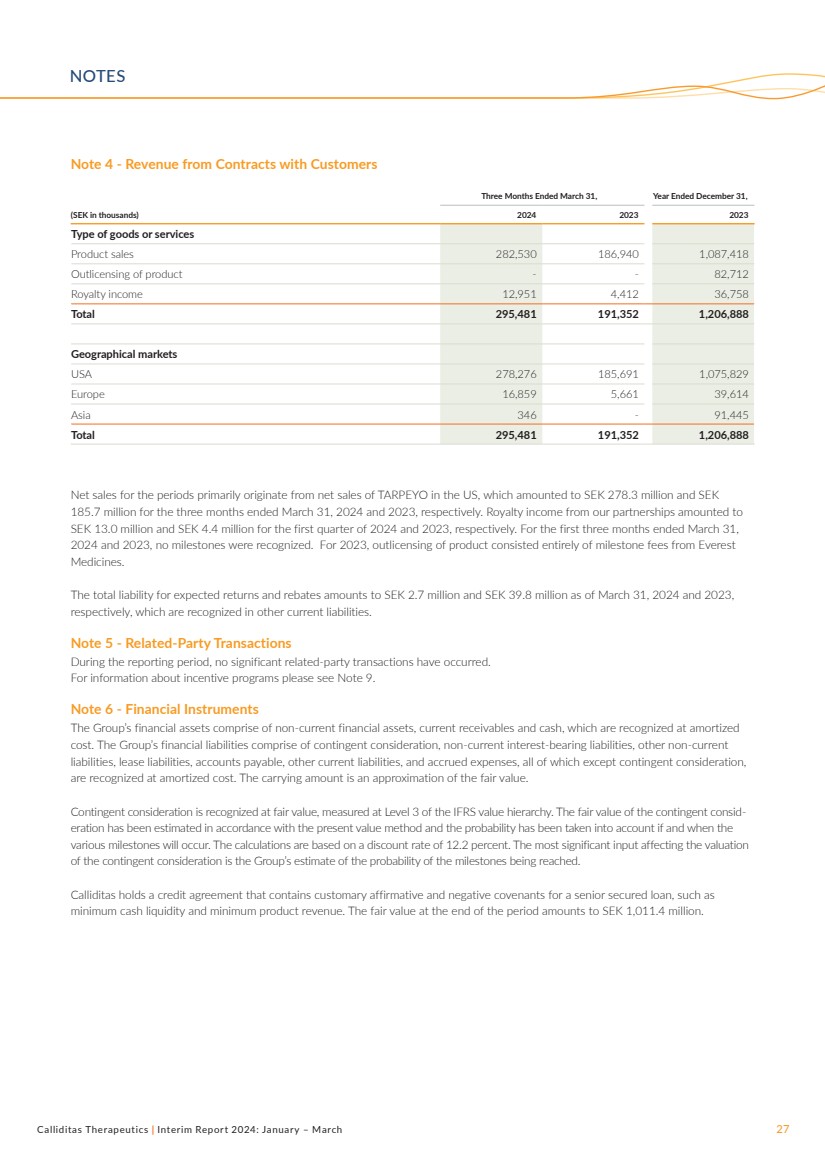
| Calliditas Therapeutics | 2024年中期報告:1月至3月27日附註4——與客户簽訂合同的收入 截至3月31日的三個月, (千瑞典克朗)2024 2023 年 2023 年商品或服務類型 產品銷售額 282,530 186,940 1,087,418 超過產品許可--82,712 特許權使用費收入 12,951 4,412 36,758 總計 295,758 481 191,352 1,206,888 地理市場 美國 278,276 185,691 1,075,829 歐洲 16,859 5,661 39,614 亞洲 346-91,445 總計 295,481 191,352 1,206,888 該期間的淨銷售額主要來自淨銷售額在美國的TARPEYO,截至2024年3月31日和2023年3月31日的三個月,總額分別為2.783億瑞典克朗和1.857億瑞典克朗。2024年和2023年第一季度,我們的合作伙伴關係的特許權使用費收入分別為1,300萬瑞典克朗和440萬瑞典克朗。在截至2024年3月31日和2023年3月31日的前三個月,沒有發現任何里程碑。2023年,產品的許可完全由珠穆朗瑪峯 藥品的里程碑費用組成。 截至2024年3月31日和2023年3月31日,預期回報和回扣的總負債分別為270萬瑞典克朗和3,980萬瑞典克朗, ,這些負債在其他流動負債中確認。 注5-關聯方交易 在本報告所述期間,沒有發生任何重大的關聯方交易。 有關激勵計劃的信息,請參閲註釋 9。 附註6-金融工具 集團的金融資產包括非流動金融資產、流動應收賬款和現金,按攤銷 成本確認。集團的金融負債包括或有對價、非流動計息負債、其他非流動 負債、租賃負債、應付賬款、其他流動負債和應計費用,除或有對價外,所有費用 均按攤銷成本確認。賬面金額是公允價值的近似值。 或有對價按公允價值確認,按國際財務報告準則價值層次結構的第三級衡量。或有對價的公允價值是根據現值法估算的,並考慮了 各種里程碑是否及何時發生的概率。計算基於 12.2% 的折扣率。影響或有對價估值 的最重要因素是集團對達到里程碑概率的估計。 Calliditas持有一份信貸協議,其中包含優先擔保貸款的慣常肯定和否定承諾,例如 最低現金流動性和最低產品收入。期末的公允價值為10.114億瑞典克朗。 注意事項 |
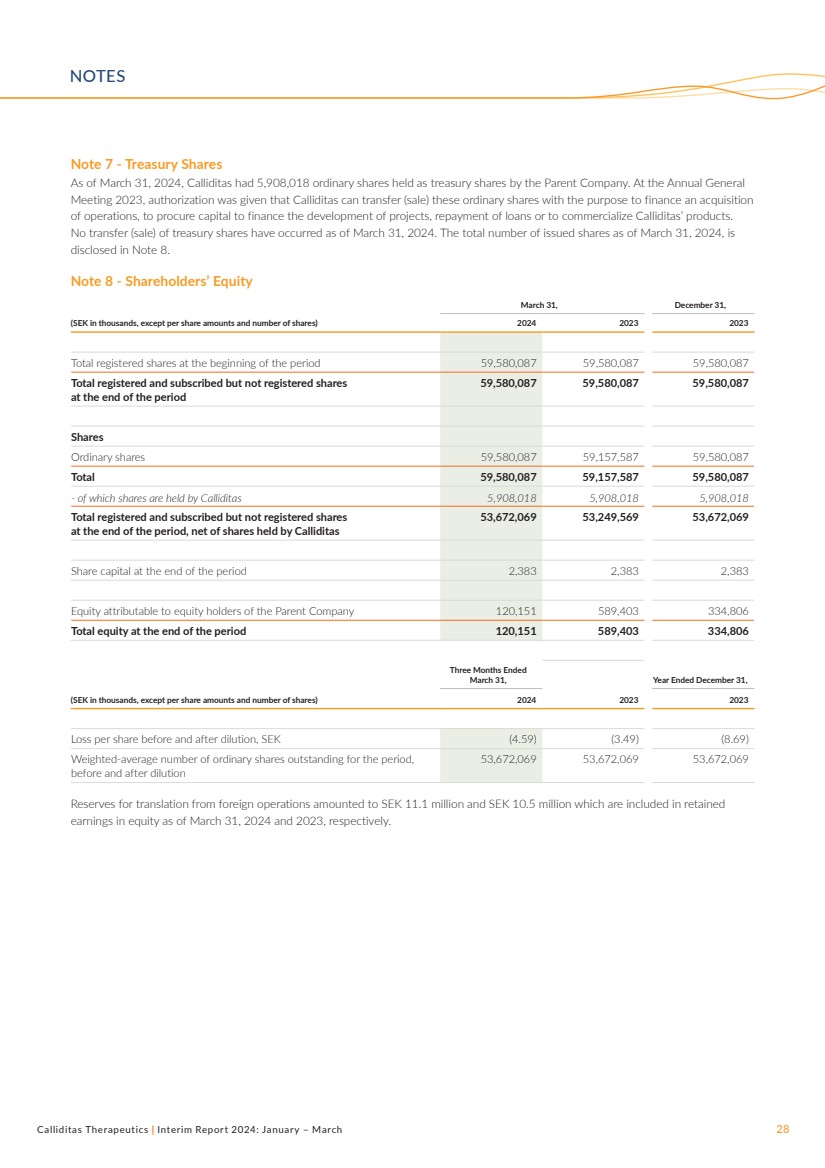
| Calliditas Therapeutics | 2024年中期報告:1月至3月28日附註7——庫存股 截至2024年3月31日,母公司持有5,908,018股普通股作為庫存股。在2023年年度大會 上,授權Calliditas可以轉讓(出售)這些普通股,目的是為收購 業務籌集資金,為項目開發融資,償還貸款或將Calliditas的產品商業化。 截至2024年3月31日,沒有進行過任何庫存股的轉讓(出售)。附註8中披露了截至2024年3月31日的已發行股票總數 。 附註 8-股東權益 3 月 31 日,12 月 31 日, (千瑞典克朗,每股金額和股份數除外)2024 2023 年期初註冊股份總數 59,580,087 59,580,087 59,580,087 期末註冊和認購但未註冊股份總數 59,580,087 7 59,580,087 59,580,087 股 普通股 59,580,087 59,157,587 59,580,087 總計 59,580,087 59,157,587 59,580,087 股——其中由 Calliditas 持有 5,908,018 5,908,018 總註冊和認購但沒有期末註冊股份 ,扣除Calliditas 持有的股份 53,672,069 53,249,569 53,672,069 期末股本 2,383 2,383 2,383 歸屬於母公司股東的權益 120,151 589,403 334,806 期末總權益 120,151 589,403 334,403 806 截至 3 月 31 日的三個月,截至 12 月 31 日的年度, (千瑞典克朗,每股金額和股票數量除外)2024 2023 年 2023 年攤薄前後的每股虧損,瑞典克朗 (4.59) (3.49) (8.69) 加權平均普通股數該期間的已發行股份,攤薄前後 53,672,069 53,672,069 53,672,069 53,672,069 53,672,069萬瑞典克朗的國外業務折算儲備金為1,110萬瑞典克朗和1,050萬瑞典克朗,分別包含在截至2024年3月31日和2023年3月31日的留存股本收益中。 注意事項 |
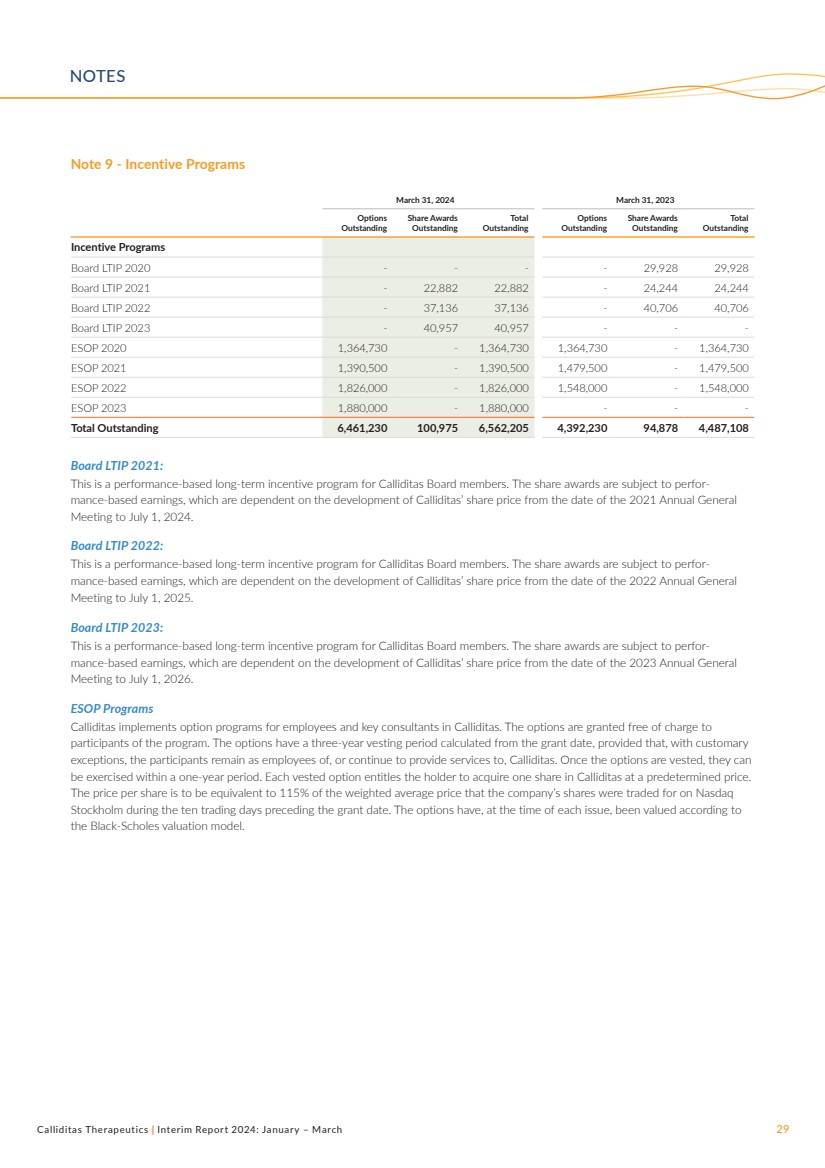
| Calliditas Therapeutics | Interim Report 2024: January – March 29 Note 9 - Incentive Programs Board LTIP 2021: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to perfor-mance-based earnings, which are dependent on the development of Calliditas’ share price from the date of the 2021 Annual General Meeting to July 1, 2024. Board LTIP 2022: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to perfor-mance-based earnings, which are dependent on the development of Calliditas’ share price from the date of the 2022 Annual General Meeting to July 1, 2025. Board LTIP 2023: This is a performance-based long-term incentive program for Calliditas Board members. The share awards are subject to perfor-mance-based earnings, which are dependent on the development of Calliditas’ share price from the date of the 2023 Annual General Meeting to July 1, 2026. ESOP Programs Calliditas implements option programs for employees and key consultants in Calliditas. The options are granted free of charge to participants of the program. The options have a three-year vesting period calculated from the grant date, provided that, with customary exceptions, the participants remain as employees of, or continue to provide services to, Calliditas. Once the options are vested, they can be exercised within a one-year period. Each vested option entitles the holder to acquire one share in Calliditas at a predetermined price. The price per share is to be equivalent to 115% of the weighted average price that the company’s shares were traded for on Nasdaq Stockholm during the ten trading days preceding the grant date. The options have, at the time of each issue, been valued according to the Black-Scholes valuation model. March 31, 2024 March 31, 2023 Options Outstanding Share Awards Outstanding Total Outstanding Options Outstanding Share Awards Outstanding Total Outstanding Incentive Programs Board LTIP 2020 - - - - 29,928 29,928 Board LTIP 2021 - 22,882 22,882 - 24,244 24,244 Board LTIP 2022 - 37,136 37,136 - 40,706 40,706 Board LTIP 2023 - 40,957 40,957 - - - ESOP 2020 1,364,730 - 1,364,730 1,364,730 - 1,364,730 ESOP 2021 1,390,500 - 1,390,500 1,479,500 - 1,479,500 ESOP 2022 1,826,000 - 1,826,000 1,548,000 - 1,548,000 ESOP 2023 1,880,000 - 1,880,000 - - - Total Outstanding 6,461,230 100,975 6,562,205 4,392,230 94,878 4,487,108 NOTES |
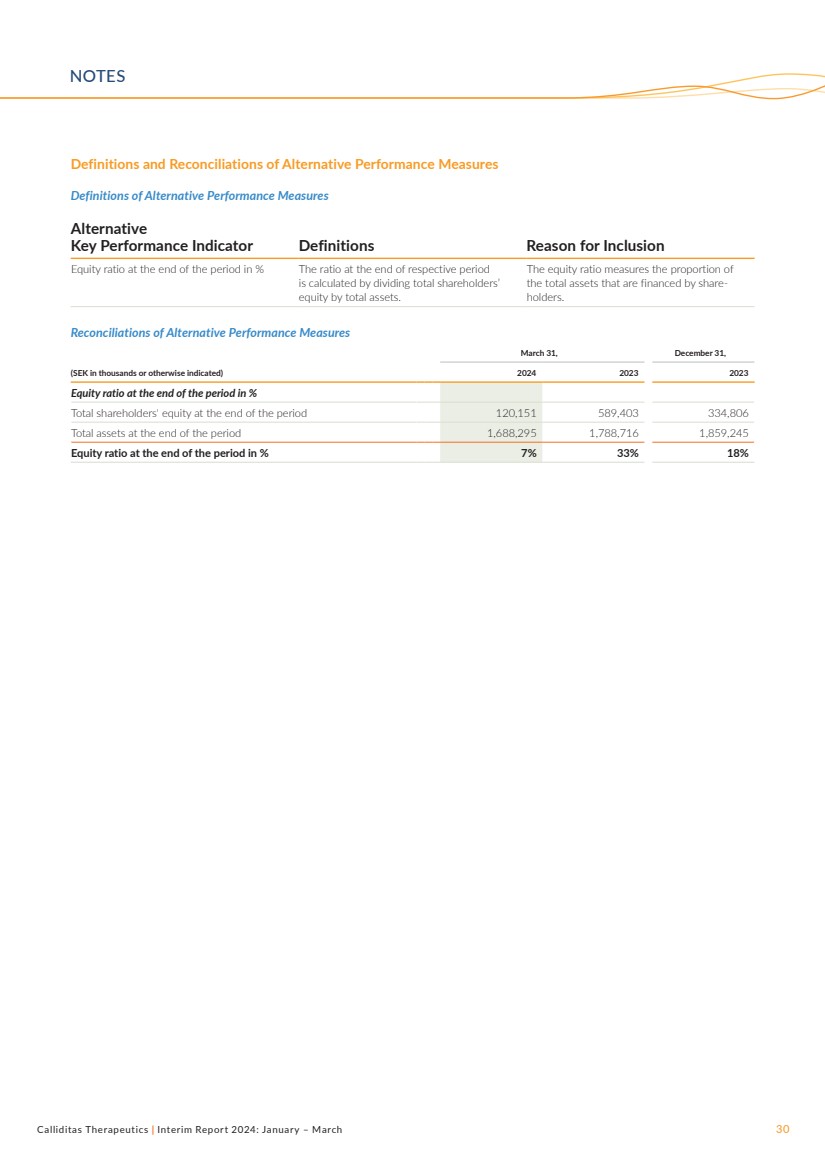
| Calliditas Therapeutics | Interim Report 2024: January – March 30 Definitions and Reconciliations of Alternative Performance Measures Definitions of Alternative Performance Measures Alternative Key Performance Indicator Definitions Reason for Inclusion Equity ratio at the end of the period in % The ratio at the end of respective period is calculated by dividing total shareholders’ equity by total assets. The equity ratio measures the proportion of the total assets that are financed by share-holders. Reconciliations of Alternative Performance Measures March 31, December 31, (SEK in thousands or otherwise indicated) 2024 2023 2023 Equity ratio at the end of the period in % Total shareholders' equity at the end of the period 120,151 589,403 334,806 Total assets at the end of the period 1,688,295 1,788,716 1,859,245 Equity ratio at the end of the period in % 7% 33% 18% NOTES |