藥物通常會造成額外的毒性,因為它們還會在正常細胞中對該靶點造成廣泛的抑制。相比之下,妥塞替尼同時抑制一小套對白血病發生至關重要的由激酶驅動的通路。因此,妥塞替尼在暴露較低的情況下實現臨牀反應,對每個途徑的總體抑制較少,從而避免了競爭對手觀察到的許多毒性。
在2023年6月8日至11日召開歐洲血液學協會(EHA)年會的同時,Aptose於2023年6月10日舉行了臨時臨牀更新網絡直播,介紹了正在進行的tuspetinib臨牀開發的要點。Aptose報告了在77名R/R AML患者中完成了tuspetinib劑量遞增和劑量探索1/2階段試驗,tuspetinib
顯示出良好的安全性,並且tuspetinib在突變多樣和難以治療的R/R AML人羣中提供了四個劑量水平的單一治療反應,沒有劑量限制性毒性,其中包括具有高度不利的
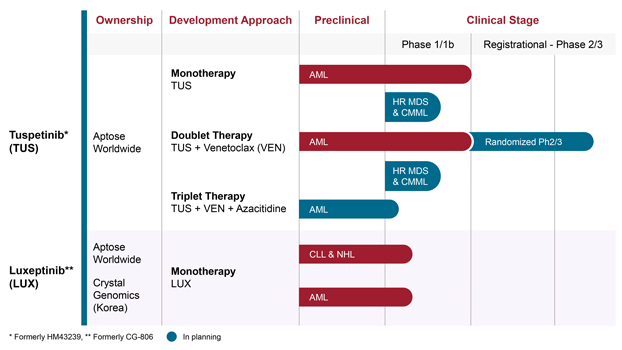
突變的患者,這些患者通常對單一治療或聯合治療無效:tp53突變患者的CR/CRH=20%和RAS突變患者的CR/CRH=22%。Aptose還報告説,與美國FDA成功完成了針對妥斯貝替尼的第一階段結束(EOP1)會議,選擇了每天80毫克的單一療法推薦第二階段劑量(RP2D),所有開發路徑仍保持開放,包括單臂加速路徑。在完成1/2期臨牀計劃的劑量遞增和劑量探索階段後,Aptose將注意力集中在Tuspetinib APTIVATE擴展試驗上。APTIVATE試驗旨在確定可作為對妥塞替尼與萬乃馨(VEN)作為TUS/VEN雙重方案敏感的R/R AML患者的發展途徑的患者羣體,並可作為加速和完全批准的發展途徑。我們報告説,APTIVATE擴大試驗的患者登記情況很好,並且已經報告了接受TUS/VEN雙重治療的患者中初步的CR活性,這些患者以前用ventoclax治療失敗。
2023年10月29日,Aptose在歐洲血液學學院(ESH)第六屆國際會議:急性髓系白血病分子和翻譯:生物學和治療進展(2023年10月29-31日在葡萄牙埃斯托裏爾舉行)上展示了兩張與妥塞替尼的臨牀和臨牀前活動相關的海報。臨牀發現包括1)來自APTO-TUS-HV01臨牀試驗(食品效應研究)的數據,該試驗評估了妥塞替尼在健康人體志願者身上的藥代動力學(PK)特性,在該試驗中,妥塞替尼與OUR空腹服用,以及2)來自美國、韓國、西班牙、澳大利亞和其他地點的R/R AML患者的作為單一藥物(TUS)的
妥塞替尼與萬乃馨(TUS/VEN組合)的國際1/2期研究的數據。來自FED與禁食食品在健康人類志願者中的效果研究的數據表明,妥塞替尼可以在有食物或沒有食物的情況下服用,並且沒有預見到暴露在臨牀上的有意義的差異。這對於患者的方便來説是一個重要的發現,因為靜脈滴注是與食物一起服用的,現在我們可以與靜脈滴注同時聯合服用妥塞替尼,而不需要交錯劑量。1/2期臨牀試驗的結果表明,作為單一藥物(TUS)的妥塞替尼在各種不良基因型的R/R AML患者中耐受性良好且活性高,在每天服用80 mg RP2D的R/R AML患者中,提供42%的CR/CRH交叉評估靜脈滴注(VEN)初治患者。在APTIVATE國際階段對R/R AML患者進行的1/2擴大試驗中,圖斯佩替尼聯合VENTOTCLAX(TUS/VEN)的耐受性良好,在既往VEN失敗(Preor-VEN Failure AML)患者中取得了多重反應,包括之前也未能通過Flt3抑制劑治療的Preor-VEN Failure患者。值得注意的是,妥塞替尼針對的是萬乃馨抵抗機制,該機制可能會使既往VEN失敗患者對萬乃馨重新敏感。
與臨牀研究不同,Aptose在ESH會議期間提交的臨牀前研究(題為:Tuspetinib口服髓樣激酶抑制劑創建合成致命性的VENTOCLAX)調查了Tuspetinib對親本和TUS耐藥AML細胞中磷酸激動組和凋亡蛋白質組關鍵成分的影響。在親本細胞中,tuspetinib抑制了關鍵的致癌信號通路,並使促凋亡和抗凋亡蛋白的平衡有利於細胞凋亡,這表明它可能會產生對ventoclax的易感性。事實上,急性髓系白血病細胞對tuspetinib的獲得性抗性產生了對ventoclax異常高的人工緻死脆弱性。因此,同時給予TUS/VEN可能會阻止治療期間出現對妥塞替尼的耐藥性。與Poster
在ESH Conference上的演講一起,2023年10月30日,Aptose舉辦了AML藥物Tuspetinib的臨牀更新和KOL數據審查,並進行了網絡直播,德克薩斯州休斯敦大學MD安德森癌症中心白血病系董事白血病研究聯盟
計劃教授Naval Daver博士出席了會議。達弗博士是APTOSE和S APTIVATE試驗的首席研究員,並因在包括幾種聯合療法在內的新型急性髓細胞白血病治療方法的開發方面取得的重大成就而被公認。Aptose公佈了49名接受TUS/VEN雙重治療的患者的數據,顯示在所有達到可評估階段的患者中,總有效率(ORR)為48%,在既往VEN失敗的AML患者中,總有效率為44%,其中包括Flt3未突變(野生型)患者(43%ORR)和突變患者(60%ORR),其中一些患者之前也未能通過Flt3抑制劑進行治療。TUS/VEN雙重組件具有良好的耐受性,沒有意外的安全信號。TUS/VEN雙重療法可以服務於之前-VEN失敗的R/R AML患者,這些患者代表着快速增長的人口,對任何有效率在4%-15%範圍內的搶救治療都高度難治。R/R AML患者的TUS/VEN二聯體的令人信服的數據表明,TUS/VEN/HMA三聯體可能滿足一線(1L)初診AML患者的需要。
2023年12月9日,Aptose在第65屆美國血液學學會年會和博覽會上的口頭報告中介紹了妥塞替尼,並宣佈在正在進行的APTIVATE 1/2期研究中,越來越多的臨牀數據表明,Aptose S先導化合物妥塞替尼(TUS)作為單藥並與萬乃馨(VEN)聯合使用,對復發或難治性急性髓細胞白血病(R/RAML)患者具有顯著療效。數據由德克薩斯州休斯敦的德克薩斯大學MD安德森癌症中心白血病系董事白血病研究聯盟項目教授、首席研究員Naval G.Daver醫學博士口頭介紹。
Daver博士報告了來自多個國際臨牀地點的100多名復發/難治患者的數據,這些患者之前的治療失敗,然後接受了作為單藥的妥塞替尼(TUS)或妥塞替尼與萬乃馨(TUS/VEN)的聯合治療。TUS和TUS/VEN在病情嚴重的AML人羣中提供了多次複合完全緩解(CRC),同時在所有接受治療的患者中保持了良好的安全性。數據顯示,妥塞替尼在腫瘤學復發和難治性急性髓細胞白血病中最具挑戰性和異質性的疾病之一中具有活性和良好的耐受性。Tuspetinib顯示出廣泛的活性,包括在Flt3野生型AML患者(佔AML患者總數的70%以上)、Flt3突變AML患者、NPM1突變AML患者以及具有歷史上與靶向治療耐藥性相關的突變的患者中的活性。最值得注意的是,TUS針對VEN耐藥機制,使TUS/VEN能夠獨一無二地治療嚴重患病的先前VEN AML人羣,包括Flt3突變和Flt3野生型疾病。從更廣泛的角度來看,越來越多的抗白血病活性和持續良好的安全性狀況支持圖斯佩替尼在TUS/VEN/HMA三聯體中的進步,用於治療一線新診斷的AML患者。
Daver博士還指出,雖然接受TUS/VEN治療的患者還處於治療週期的早期,但大多數取得反應的患者仍在治療中,隨着劑量的繼續,反應已經開始成熟。達弗·S博士的ASH口頭演講亮點包括:
| |
|
|
在68名可評估的患者中,作為治療劑量為80-160 mg的單一藥物,TUS在VEN-NAYVE患者中更為活躍,總的CRC率為29%(8/28)。這包括Flt3突變患者的42%的CRC率(5/12)和Flt3非突變或野生型AML患者的19%的CRC率(3/16)。持續給藥改善了療效和血細胞計數,許多患者橋接到異基因幹細胞移植(HSCT),在不進行HSCT時觀察到耐受性,並選擇80 mg作為RP2D。總體而言,妥塞替尼表現出良好的安全性,僅有輕微的不良反應(AEs),每天最高可達160毫克,沒有劑量限制毒性(DLTS),也沒有藥物中斷與藥物相關的毒性。 |
| |
|
|
在TUS/VEN雙重研究中,49名患者接受了80毫克圖培替尼和200毫克維奈托克,其中36名患者可評估(13名患者評估為時過早)。患者大量暴露於Prior-VEN和Prior-FLT 3抑制劑治療。TUS/VEN在VEN初治和既往Prior-VEN R/R急性白血病患者中均活躍。TUS表現出令人信服的綜合完全緩解(CRc)率。在所有可評估患者中,TUS/VEN的CRc率為25%(9/36); VEN初治患者為43%(3/7),既往VEN患者為21%(6/29)。在FLT 3野生型患者中,TUS/VEN的總體CRc率為20%(5/25); VEN初治患者為33%(2/6),既往VEN患者為16%(3/19)。在FLT 3突變患者中,TUS/VEN的總體CRc率為36%(4/11); VEN初治患者完全緩解(1/1);既往VEN患者為30%
(3/10);既往接受過FLT 3抑制劑治療的患者為44%(4/9)。 |
盧塞替尼計劃
In許可概述
2018年5月7日,我們行使了一項選擇權,向韓國水晶基因公司(CG)支付了200萬美元現金,購買了在世界所有國家/地區(韓國和中國除外)研究、開發和商業化Luxeptinib的獨家許可證,用於所有領域(統稱為權利)。隨後,在2018年6月14日,我們宣佈與CG簽訂許可協議,以獲得在中國(包括S、Republic of China、香港和澳門人)(中國權利)的權利許可。根據許可協議,我們向CG預付了300萬美元購買中國的轉播權。CG有資格獲得開發、監管和基於商業的里程碑,以及中國產品銷售的個位數特許權使用費。中國轉播權的交易總價值,包括預付款,高達
1.25億美元。Aptose現在擁有全球(不包括韓國)Luxeptinib的權利,a一流的,用於治療急性髓細胞白血病、B細胞惡性腫瘤和其他血液病的高效口服小分子藥物。根據這些協議可能支付的未來可能的特許權使用費將在
逐個國家和逐個產品以淨銷售額為基礎,自該產品在該國家/地區首次商業銷售起至下列時間中較晚者為準:最後一個到期的
涵蓋該產品的在該國家/地區的CG專利的有效主張;以及(Ii)該產品在該國家/地區首次商業銷售後十(10)年。
臨牀前概況
Luxeptinib對具有內部串聯複製的Flt3顯示出微克分子半數最大抑制濃度,對野生型和多種突變形式的Flt3顯示效力,對BTK及其C481S突變體(BTK-C481S)顯示個位數的納摩爾IC50值。此外,Luxeptinib抑制了一小部分其他相關致癌激酶/通路(包括CSF1R、PDGFRα、TRK,以及ERK、MYC、AKT/mTOR/S6K和AURK/H3S10通路),這些通路在急性髓細胞白血病和某些B細胞惡性腫瘤中起作用,但不抑制TEC、表皮生長因子受體(EGFR)和ErbB2/4激酶,而這些通路與其他某些激酶抑制劑的安全性有關。
作為Flt3-ITD的有效抑制劑,Luxeptinib可能成為AML高危患者的有效治療方法。這是因為大約30%的AML患者會發生Flt3-ITD突變,這與預後不良有關。在小鼠人急性髓系白血病異種移植研究(Flt3-ITD)中,口服CG-806導致腫瘤消除(治癒),但沒有可測量的毒性。重要的是,Luxeptinib針對的是其他可能在Flt3-ITD AML中起作用的致癌激酶,從而可能使該藥成為更廣泛的此類患者的重要治療選擇。難治的急性髓系白血病患者羣體。Luxeptinib針對所有形式的Flt3和其他幾種關鍵致癌途徑,從安全性的角度來看,在有效性和正式的良好實驗室操作規範(GLP)毒理學研究中,Luxeptinib耐受性良好,這表明Luxeptinib可能也適用於治療無法耐受其他療法的患者,尤其是65歲以上的患者。
與AML和Flt3的故事不同,Luxeptinib可能是B細胞惡性腫瘤患者的一種治療選擇。BTK酶的過表達可以驅動某些B細胞惡性腫瘤的致癌信號,包括CLL和某些NHL,如套細胞淋巴瘤(MCL)、濾泡性淋巴瘤(FL)、瀰漫性大細胞B細胞淋巴瘤(DLBCL)等。對這些患者使用共價、不可逆的BTK抑制劑,如伊布魯替尼,靶向BTK的活性部位半胱氨酸(Cys)
殘留物,對許多患者可能是有益的。然而,使用共價BTK抑制劑治療可以選擇具有C481S突變的BTK,從而對共價BTK抑制劑產生耐藥性。此外,大約一半的慢性淋巴細胞白血病患者在治療3.4年後停止了伊布魯替尼的治療。根據俄亥俄州立大學進行的一項研究,停用ibrutinib是由於耐藥性的產生(尤其是發生BTK-C481S突變的惡性腫瘤),或者是由於難治性疾病(患者的腫瘤對ibrutinib沒有反應)或不耐受(副作用導致停用ibrutinib)。在5%-10%的患者中觀察到C481S突變,而
46