目錄表
正如2023年12月宣佈的那樣,我們正在為GM1神經節苷脂沉積症(GM1)、克拉貝病和異色性腦白質營養不良(MLD)的臨牀階段兒科項目尋求潛在的外包許可機會。
我們有一條基因治療管道,有可能解決多種神經退行性疾病。我們的發展計劃包括:
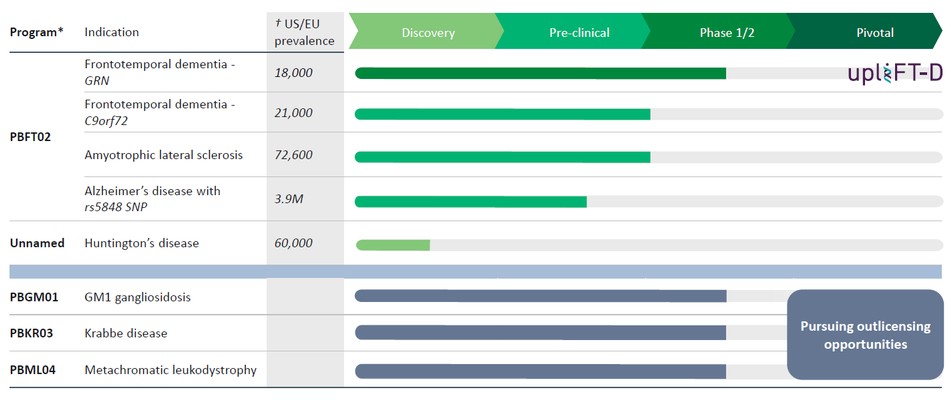
*仍有8個額外的CNS管道許可證選項;之前行使了3個許可證選項,權利隨後歸還給賓夕法尼亞大學。
第三方來源的†美國/歐盟流行率
PBFT02治療FTD-GRN
我們目前正在開發PBFT02,它利用AAV1衣殼來提供GRNPGRN編碼,用於治療FTD-GRN。FTD-GRN是一種可遺傳的FTD形式,由PGRN產量減少引起,原因是GRN吉恩。PGRN是一種複雜的高度保守的蛋白質,在細胞內穩態、神經發育和炎症中具有多種作用。在FTD中-GRN,PGRN缺乏會導致溶酶體功能障礙、神經炎症和神經變性。
目前,還沒有被批准用於治療FTD的疾病修改療法-GRN。根據臨牀前研究的結果,我們認為PBFT02可能提供FTD-GRN預後顯著改善的患者。我們選擇AAV1衣殼和ICM給藥作為PBFT02,是因為這種方法導致了廣泛和強大的媒介在非人類靈長類動物(NHP)的大腦和脊髓中的傳遞,並且由於與其他被測試的血清型相比,AAV1在腦脊液(CSF)中獲得了更高的PGRN水平。與健康受試者的腦脊液水平相比,ICM將AAV1注射到NHP可導致腦脊液中人PGRN水平的升高,並且超過了AAVhu68或AAV5的NHP的水平。我們擁有來自美國食品和藥物管理局(FDA)的積極研究新藥申請(IND),並在多個國家/地區批准了PBFT02的臨牀試驗授權(CTA)。我們正在進行我們的Uplift-D試驗,這是一項針對確診為有症狀的FTD患者的PBFT02的國際、多中心、開放標籤、單臂1/2期臨牀試驗。GRN.
我們報告了2023年12月和2024年5月在我們的Uplit-D試驗的隊列1中的三名患者的初步安全性和生物標誌物數據。在這項試驗中,在接受增強免疫抑制療法的研究參與者中,劑量1的PBFT02治療總體上耐受性良好。PBFT02劑量1導致腦脊液中PGRN濃度持續升高,治療後30天(n=3)和6個月(n=2)的濃度分別為10.7~17.3 ng/m L和21.7~27.3 ng/m L,高於健康成人對照組的3.3~8.2 ng/m L(平均=4.8 ng/m L;n=61)。相比之下,在PBFT02治療後,所有三名患者的血漿PGRN水平沒有改變,在整個可用隨訪期內保持與基線濃度相似,低於健康成人對照組的水平。
25