
® THERAPEUTICS 開創性用於自身免疫的 mRNA 細胞療法 2024 年 5 月 C A R T E S I A N T H E R A P E U T I C S 附錄 99.2

前瞻性陳述披露就本通知而言,以下的 “演示文稿” 是指幷包括隨後的幻燈片、Cartesian Therapeutics, Inc.(“公司”)管理層成員或任何人代表他們對幻燈片的口頭陳述、該口頭陳述之後的任何問答環節、本文檔的硬拷貝以及在該口頭陳述中分發或與之相關的任何材料。前瞻性陳述本演示文稿中關於公司未來預期、計劃和前景的任何陳述,包括但不限於有關公司預期現金資源和現金流的陳述、公司預計手頭現金、公司剩餘A系列無表決權可轉換優先股的轉換、公司的內部製造能力、RNA Armory® 利用多種模式實現對工程細胞進行精確控制和優化的潛力,Descartes-08、Descartes-15、Descartes-33和該公司其他候選產品治療重症肌無力、系統性紅斑狼瘡或任何其他疾病的潛力、正在進行和計劃中的臨牀試驗、研究和數據讀取的預期時間或結果、美國食品藥品管理局對公司監管申報的審查的預期時間或結果、公司進行臨牀的能力試驗和臨牀前研究、任何監管申報的時間或提交、研發選擇的預期時間或結果候選產品、公司完成任何預期協議和許可並實現其預期收益的能力、公司能夠開發的治療模式的新穎性、公司為滿足未滿足的醫療需求而開發的任何療法的潛力、公司建立和維持其戰略合作伙伴關係的能力、參與公司臨牀試驗和其他包含 “預測”、“相信”、“繼續” 字樣的聲明可以”、“估計”、“期望”、“假設”、“打算”,”可能”、“計劃”、“潛力”、“預測”、“項目”、“應該”、“目標”、“將” 和類似表述構成1995年《私人證券訴訟改革法》所指的前瞻性陳述。由於各種重要因素,包括但不限於以下因素,實際結果可能與此類前瞻性陳述所示結果存在重大差異:臨牀試驗(包括概念驗證試驗)的啟動、完成和成本所固有的不確定性,包括不確定的結果;來自正在和未來臨牀試驗的數據的可用性和時機以及此類試驗的結果;特定臨牀試驗的初步結果是否可以預測該試驗的最終結果;以及是否早期臨牀試驗的結果將表明以後的臨牀試驗結果、根據對非人類受試者的研究結果預測對人體進行的研究結果的能力、公司RNA Armory® 技術未經證實的方法、患者入組的潛在延遲、公司候選產品的不良副作用、其依賴第三方進行臨牀試驗、公司無法維持其現有或未來的合作、許可或者合同關係,它的無法保護其專有技術和知識產權,監管部門批准可能延遲,可用資金足以滿足其可預見和不可預見的運營費用和資本支出需求,公司的經常性運營虧損和負現金流,公司普通股價格的大幅波動,與地緣政治衝突和流行病相關的風險以及公司最新年度報告的 “風險因素” 部分中討論的其他重要因素 10-K 表格以及10-Q表格的季度報告以及公司向美國證券交易委員會提交的其他文件中。此外,本演示文稿中包含的任何前瞻性陳述僅代表公司截至其發佈之日的觀點,不應以此作為其後任何日期的觀點。除非法律要求,否則公司明確表示不打算更新本演示文稿中包含的任何前瞻性陳述。2

3 家處於臨牀階段的公司開創了旨在將細胞療法的覆蓋範圍擴大到自身免疫的mRNA細胞療法 • mRNA細胞療法產品線旨在在門診環境中更可靠、更安全地給藥,而不會造成淋巴消耗 • Descartes-08:在針對重症肌無力(MG)患者的2a期研究中,潛在的首創mRNA CAR T細胞(CAR-T)顯示出深刻而持久的臨牀反應 • 全資GL MP 製造旨在實現以迭代方式快速優化流程多種預期的短期催化劑 1.048 億美元截至2024年3月31日;預計將為目前計劃於26年下半年開展的運營提供資金預計將通過第三階段和多個其他臨牀項目為MG中的Descartes-08的持續臨牀開發提供充足的現金資源 • MG的2b期收入數據預計於2024年中期啟動SLE的2期研究 • 預計於2024年下半年啟動其他自身免疫適應症的研究 DESCARTES-08 • 下一代mRNA CAR-T候選藥物 • IND,第一階段的首次人體規劃活動正在進行中 DESCARTES-15 CAR,嵌合抗原受體 SLE,系統性紅斑狼瘡

經驗豐富的管理團隊將領導未來的mRNA細胞療法公司 Matthew Bartholomae 總法律顧問 Metin Kurtoglu,醫學博士,首席技術官米洛斯·米利科維奇,醫學博士首席營銷官布萊恩·戴維斯首席財務官 Chris Jewell,博士管理總裁兼首席執行官 Emily English,博士高級副總裁,製造運營主管 4 名董事會成員 Patrick Zenner 董事尼珊·德席爾瓦總經理,總經理兼總經理蒂莫西·斯普林格博士董事蒂莫西·巴拉貝董事邁克爾·辛格醫學博士、博士主任 Carrie S. Cox 董事長 Murat Kalayoglu,醫學博士,博士主任 Jessica Keliher 首席採購官
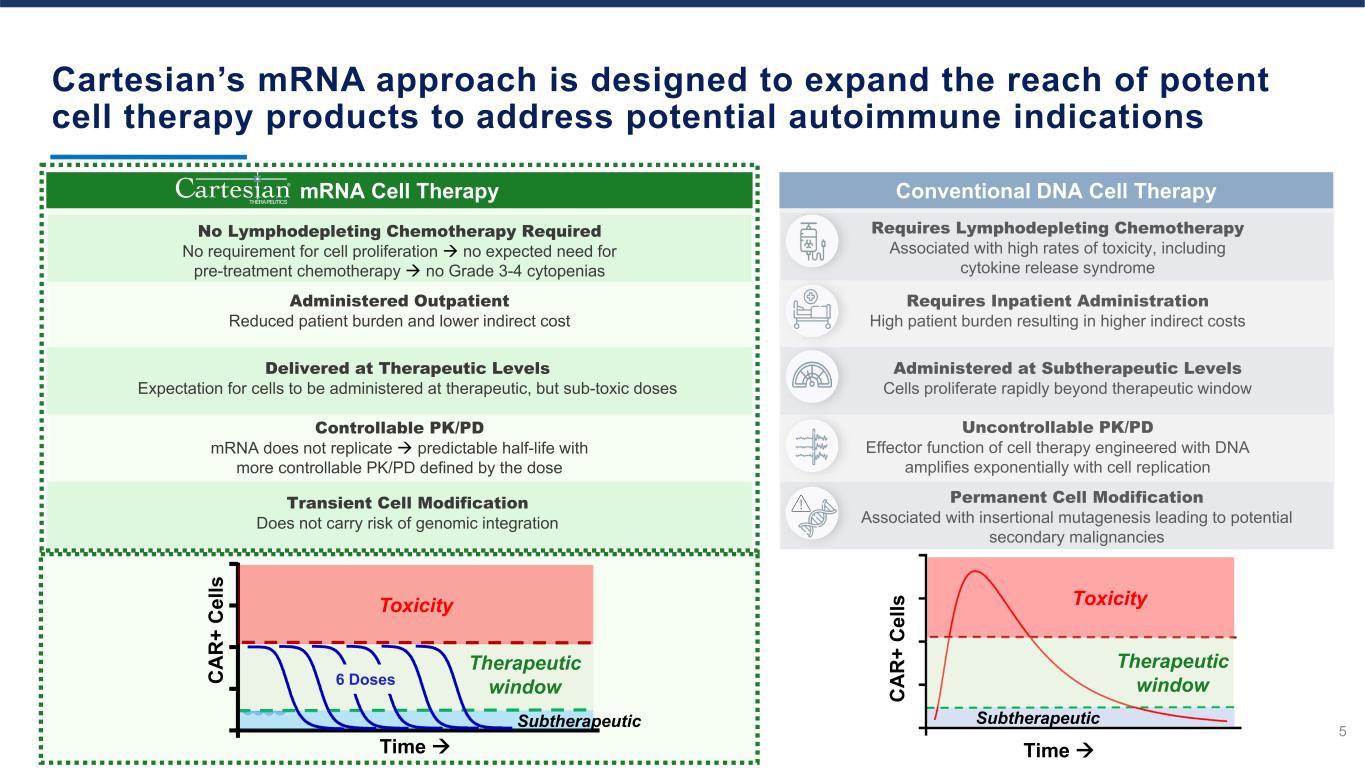
Cartesian的mRNA方法旨在擴大強效細胞療法產品的覆蓋範圍,以應對潛在的自身免疫適應症 5 需要淋巴消耗化療,與高毒性率相關的淋巴消耗化療,包括細胞因子釋放綜合徵傳統的DNA細胞療法永久細胞修飾與插入誘變相關的永久細胞修飾導致潛在的繼發性惡性腫瘤由DNA設計的細胞療法的PK/PD Effector功能隨着亞治療水平的細胞複製而呈指數級放大細胞增殖評分快速超出治療窗口需要住院管理患者負擔過高導致間接費用增加亞治療窗口毒性 C A R + C el ls 時間 mRNA 細胞療法無需淋巴消耗化療不需要細胞增殖預期不需要預治療沒有 3-4 級細胞減少短暫細胞修飾不存在基因組整合風險可控的 PK/PD mRNA 無法複製可預測的半衰期,PK/PD 定義的更可控的 PK/PD 劑量交付於治療水平預期以治療方式給藥但毒性劑量為亞毒劑量給藥門診減輕患者負擔和降低間接成本毒性 C A R + C el ls 6 劑量治療窗口 Subtherapeutics Time® THERAPEUTICS
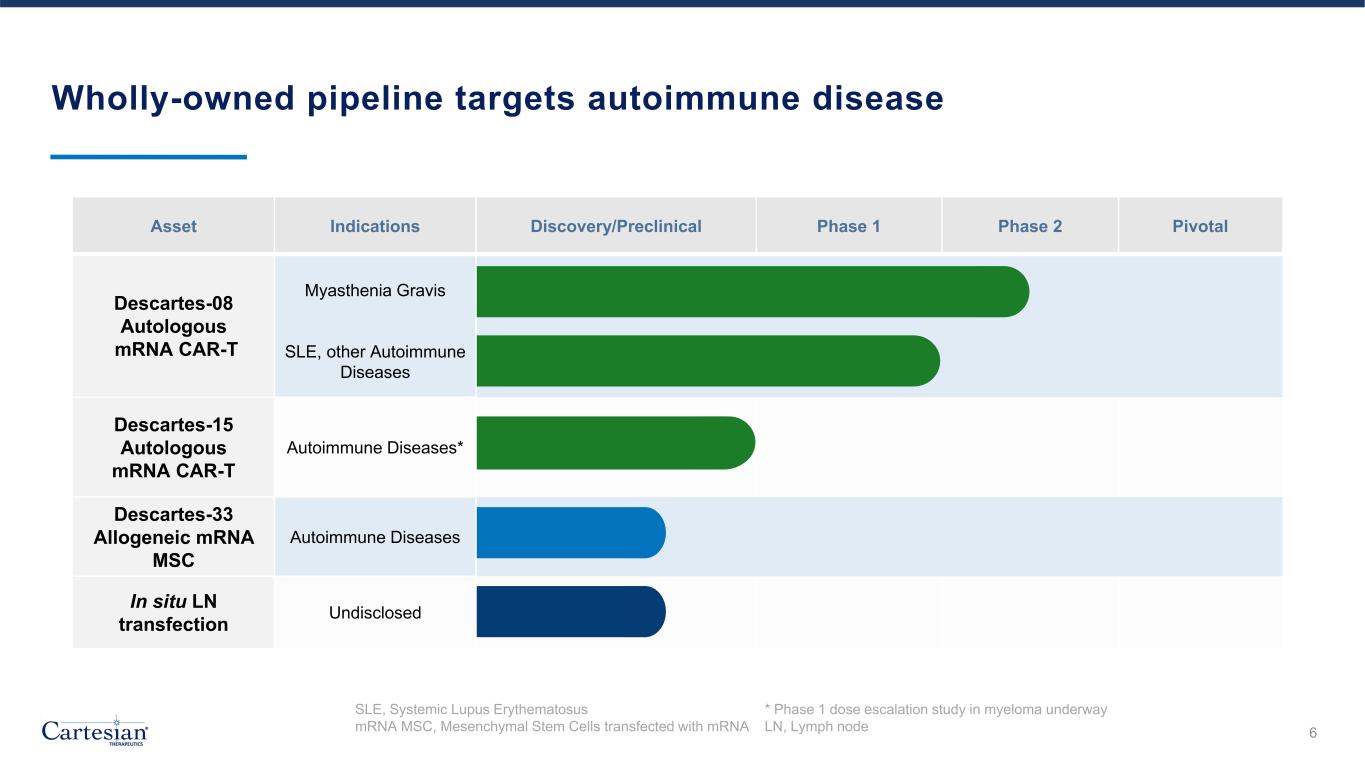
全資管線針對自身免疫性疾病 SLE、系統性紅斑狼瘡 * 正在進行骨髓瘤劑量遞增研究 mRNA MSC、用 mRNA LN 轉染的間充質幹細胞、淋巴結資產適應症發現/臨牀前 1 期 2 期關鍵笛卡爾-08 自體 mRNA CAR-T 重症肌無力 SLE、其他自身免疫性疾病 Descartes-15 Autologos Ous mRNA CAR-T 自身免疫性疾病* Descartes-33 異基因 mRNA MSC 自身免疫性疾病原位 LN 轉染未公開 6

® THERAPEUTICS 7 Descartes-08 被認為是針對自身免疫性疾病臨牀開發的首款mRNA CAR-T,通過轉染具有抗BCMA car編碼的自體CD8+ T細胞而設計的典型批次在大約 3 周內進行輸注,重症肌無力的 2a 期陽性數據凸顯了獲得深度持久反應的潛力美國食品藥品管理局對全身性重症肌無力的孤兒稱號

Descartes-08 專為雙重作用而設計,精確靶向參與一系列自身免疫性疾病的兩個關鍵 BCMA+ 細胞羣 8 多個自身免疫性疾病片段涉及 PCS/等離子體細胞和 PDC 的致病貢獻,包括風濕學、腎臟病學、神經病學和其他選擇性刪除 PCS/血漿細胞和 PDC,如果成功,可能會創建差異化細胞治療平臺 PLASMA CELLS (PCs) 和 PLASM MABLASTS • Descartes-08 靶向的 PC、等離子體細胞和增生 B 細胞只佔一小部分 B 細胞 • 這些細胞完全負責分泌致病性自身抗體 • 在自身免疫期間,自身抗體會攻擊宿主組織並驅動炎症 PLASMACYTOID 樹突狀細胞 (PDC) • Descartes-08 設計靶向的 PDC 是抗原呈遞細胞的罕見子集 • 這些細胞分泌高水平的細胞因子(即 I 型自身激素),在許多人體期間會導致炎症和組織損傷免疫性疾病 • 自身免疫患者(例如系統性紅斑狼瘡)的PDC升高並幹擾最佳治療 • Descartes-08 的設計目的是靶向 BCMA,一種在漿細胞/等離子細胞和漿細胞樣樹突狀細胞上表達的表面抗原 BCMA:B 細胞成熟抗原;SLE:系統性紅斑狼瘡
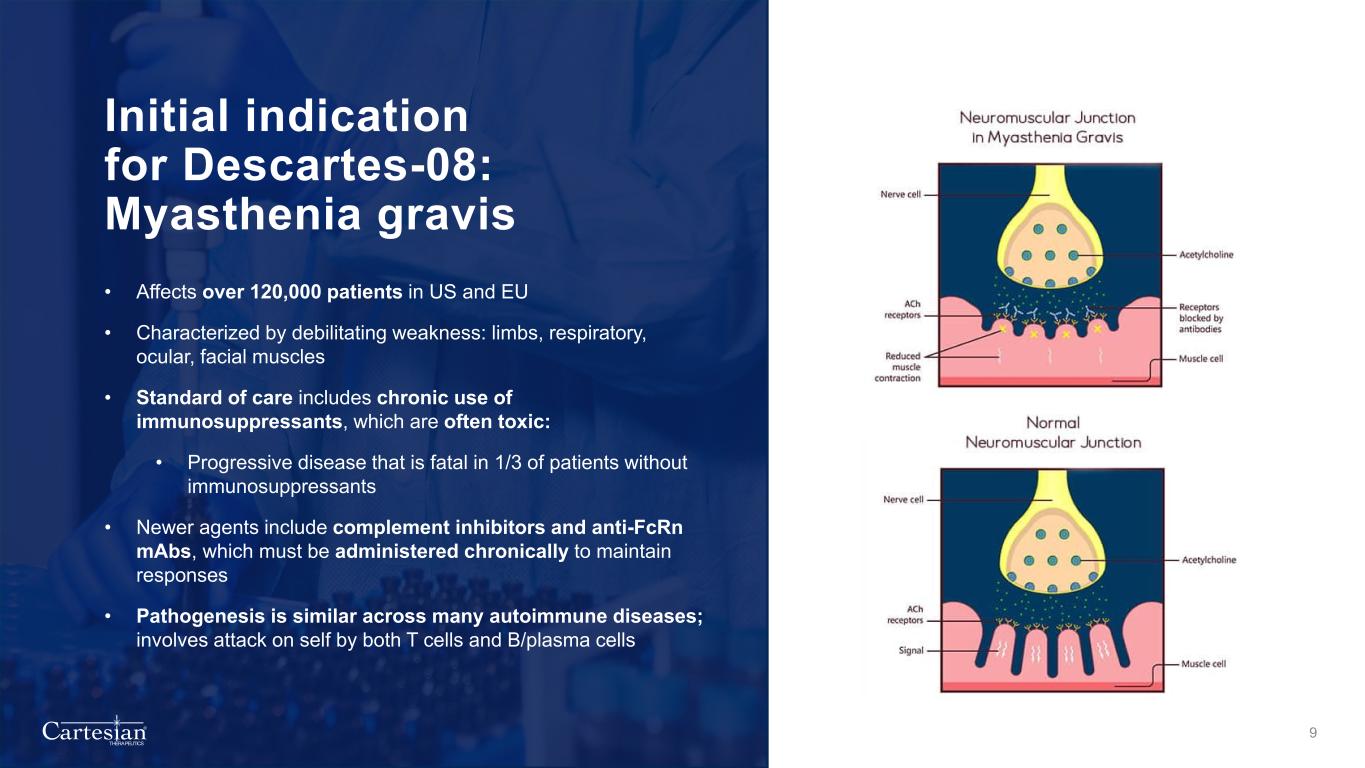
® THERAPEUTICS Descartes-08 的初始適應症:重症肌無力 • 影響美國和歐盟超過 120,000 名患者 • 以虛弱為特徵:四肢、呼吸道、眼部、面部肌肉 • 護理標準包括長期使用免疫抑制劑,通常有毒性:• 進行性疾病,在沒有免疫抑制劑的患者中,有1/3會致命 • 較新的藥物包括補體抑制劑和抗FCRN mCRN mCRN ABS,必須長期給藥以維持反應 • 許多自身免疫性疾病的發病機制相似;涉及發作由 T 細胞和 B/等離子體細胞自身 9

對Descartes-08注射MG(NCT04146051)的2期研究()觀察到所有劑量均安全且耐受性良好 10 患者符合資格 • MG-ADL > 6 • MGFA II-IV 類 • 輸液前 8 周以上的穩定藥物劑量 • 開始使用笛卡爾-08 後不允許進行免疫抑制劑和血漿置換 IvG 和血漿置換,患者預計能夠在治療期間繼續接受治療接收 Descartes-08 細胞製造平臺可耐受大多數標準的免疫抑制療法第 1 部分確定安全劑量 (n = 3) 完成第 2 部分確定最佳給藥時間表(n = 11)Complete1 第 3 部分第 2b 階段比較笛卡爾-08和安慰劑(n = 30)註冊 1 繼續招收服用 musk MG 的患者和原本不符合第 3 部分 MG-ADL、重症肌無力日常生活活動量表 MGFA、美國重症肌無力基金會每週六次輸液導致觀察到深度、持久的反應安慰劑的受試者工程過繼細胞療法的對照試驗
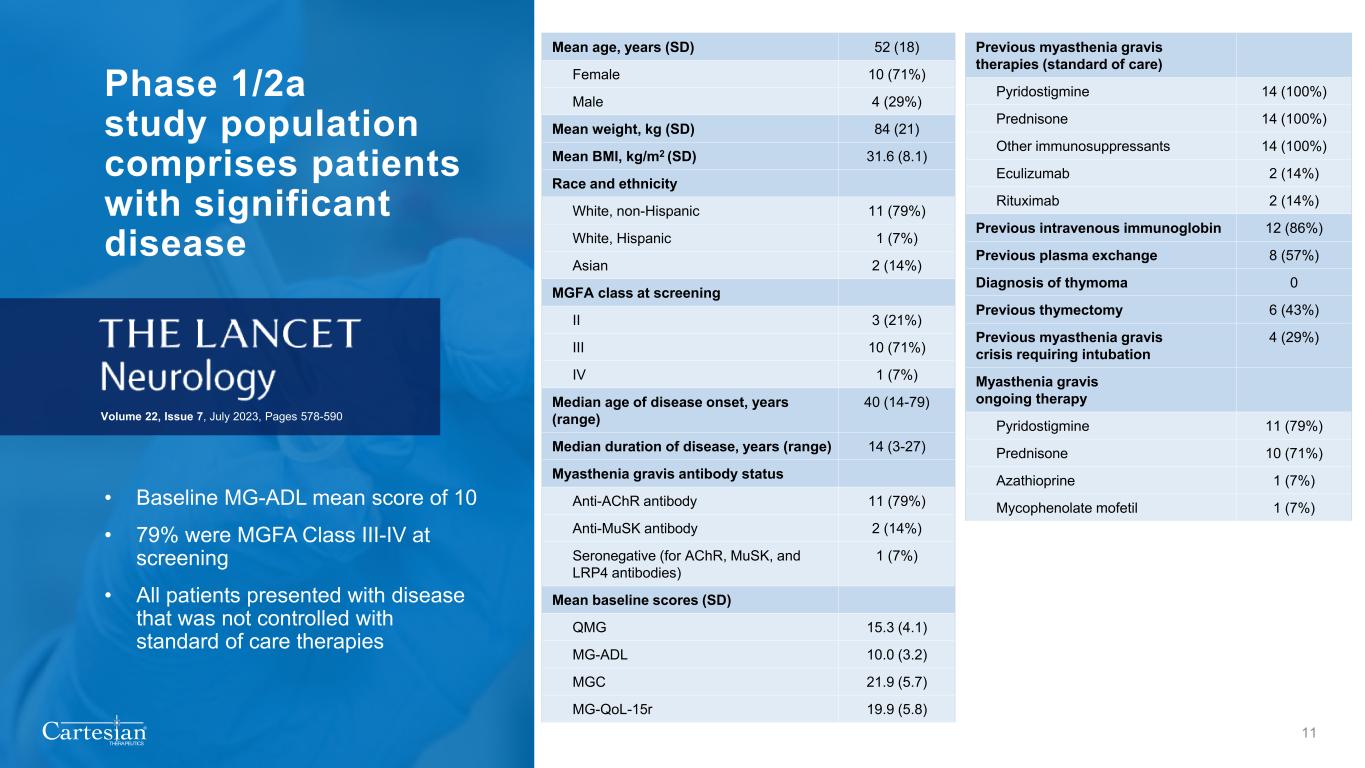
® THERAPEUTICS 1/2a 期研究人羣包括患有重大疾病的患者 • 基線 MG-ADL 平均分為 10 • 篩查時有 79% 的 MGFA III-IV 類 • 所有患有未通過標準護理療法控制的疾病的患者 22 卷,第 7 期,第 578-590 頁 11 頁平均年齡,年齡 (SD) 52 (18) 女性 10 (71%) 男性 4 (29%) 平均體重,kg (SD) 84 (21) 平均體重指數,kg/m2 (SD) 31.6 (8.1) 種族和族裔白人、非西班牙裔 11 (79%) 白人、西班牙裔 1 (7%) 亞裔 2 (14%) 亞裔 2 (14%) MGFA 等級 II 3 (21%) IV 10 (71%) IV 1 (7%)發病年齡中位數,年份(範圍)40(14-79)發病時間中位數,年份(範圍)14(3-27)重症肌無力抗體狀態抗 ACHR 抗體 11 (79%) 抗麝香抗體 2 (14%) 血清陰性(對於 AchR、musK 和 LRP4 抗體)1 (7%) 平均基線評分 (SD) QMG 15.3 (4.1) MG-ADL 10.0 (3.2) MGC 21.9 (5.7) mg-qol-15R 19.9 (5.8) 先前的重症肌無力療法(標準護理)吡哆司汀 14(100%)潑尼鬆 14(100%)其他免疫抑制劑 14(100%)依庫珠單抗 2(14%)利妥昔單抗 2(14%)先前的靜脈注射免疫球蛋白 12 (86%)既往血漿置換 8 (57%) 胸腺瘤的診斷 0 先前的胸腺切除術 6 (43%) 之前需要插管的重症肌無力危象 4 (29%) 重症肌無力持續治療吡啶司汀明 11 (79%) 潑尼鬆 10 (71%) 硫唑嘌呤 1 (7%) Mycophenolate mofetil 1 (7%)
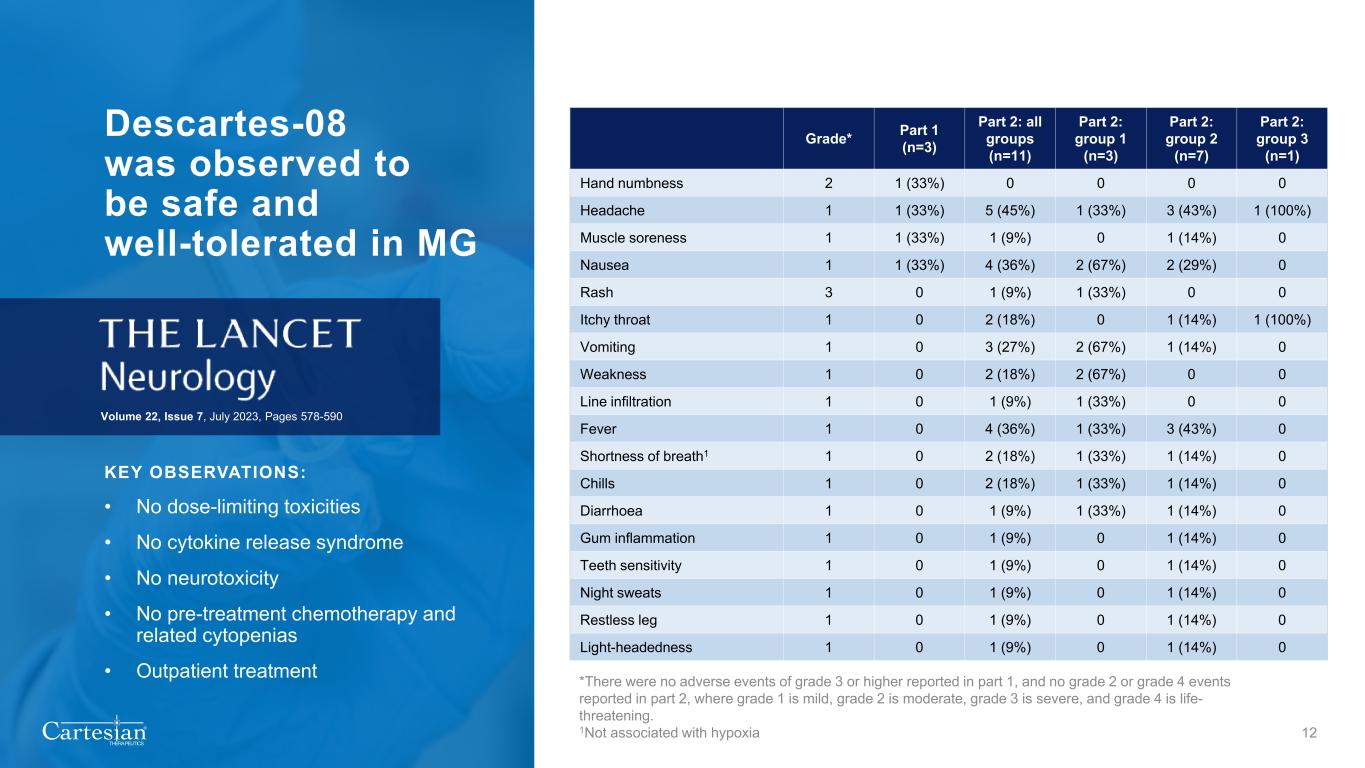
MG 中觀察到® THERAPEUTICS Descartes-08 安全且耐受性良好:• 無劑量限制毒性 • 無細胞因子釋放綜合徵 • 無神經毒性 • 無治療前化療和相關細胞減少症 • 門診治療第 22 卷,第 7 期,2023 年 7 月,第 578-590 頁 12 級* 第 1 部分(n=3)第 2 部分:所有組(n=11)第 2 部分:組 1 (n=3) 第 2 部分:第 2 組 (n=7) 第 2 部分:第 3 組 (n=1) 手部麻木 2 1 (33%) 0 0 0 0 頭痛 1 1 (33%) 5 (45%) 1 (33%) 3 (43%) 1 (100%) 1 (100%) 1 (9%) 0 噁心 1 1 (33%) 4 (36%) 4 (36%)%) 2 (67%) 2 (29%) 0 皮疹 3 0 1 (9%) 1 (33%) 0 0 0 喉嚨發癢 1 0 2 (18%) 0 1 (14%) 1 (100%) 1 (100%) 嘔吐 1 0 3 (27%) 2 (67%) 1 (67%) 1 (67%) 0 發燒 1 (33%) 0 0 4 (36%) 1 (33%) 3 (43%) 0 呼吸急促1 1 0 2 (18%) 1 (33%) 1 (14%) 0 寒戰 1 0 2 (18%) 1 (33%) 1 (14%) 0 腹瀉 1 0 1 (9%) 0 腹瀉 1 0 1 (9%) 1 (9%) 0 腹瀉 1 0 1 (9%) 0 (14%) 0 牙齒敏感度 1 0 1 (9%) 0 1 (14%) 0 盜汗 1 0 1 (9%) 0 1 (14%) 0 腿部不安 1 0 1 (9%) 0 1 (9%) 0 1 (14%) 0 1 (14%) 0 輕度頭暈 1 0 1 (9%) 0 *沒有第 1 部分報告了 3 級或以上的不良事件,第 2 部分未報告 2 級或 4 級事件,其中 1 級為輕度,2 級為中度,3 級為重度,4 級為危及生命。1 與缺氧無關
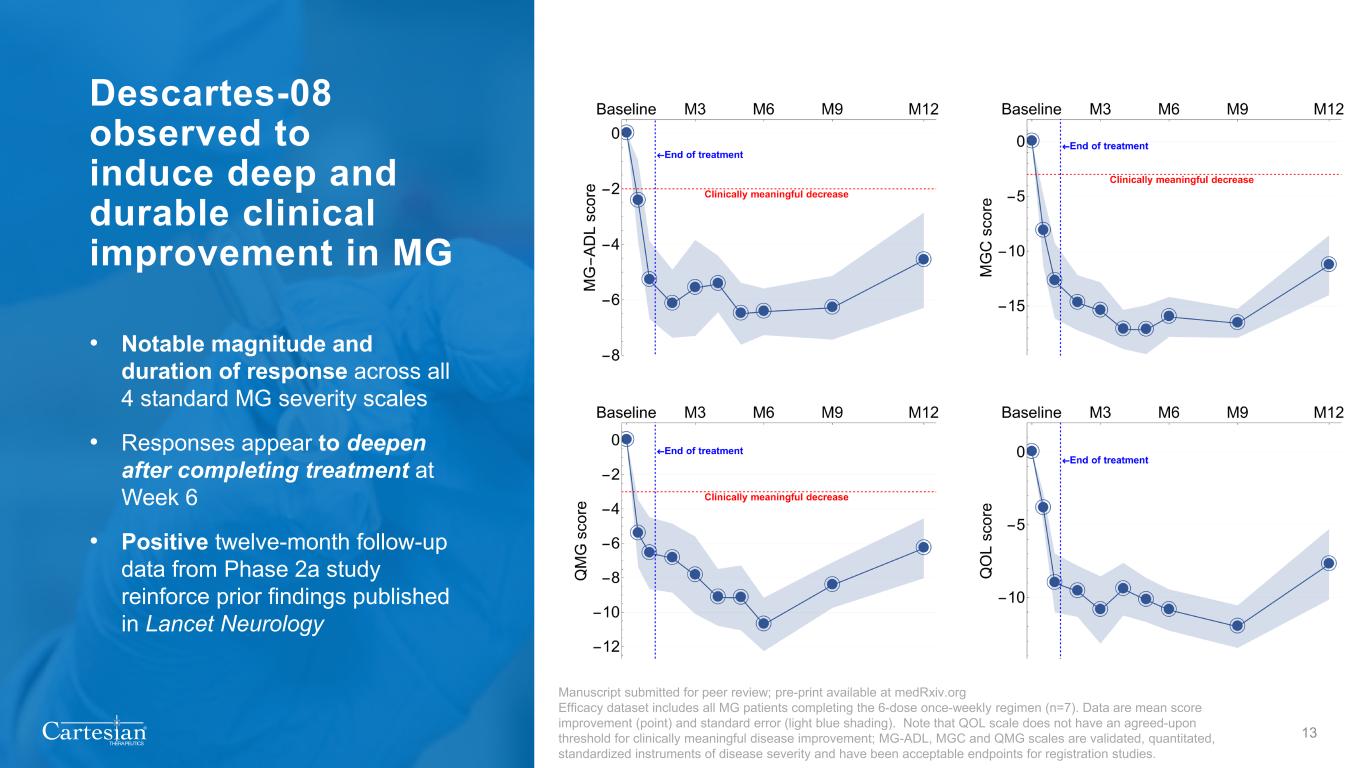
® THERAPEUTICS Descartes-08 觀察到可促進 MG 的深層而持久的臨牀改善 • 在所有 4 個標準 MG 嚴重程度表中均有顯著的緩解幅度和持續時間 • 第 6 周完成治療後,反應似乎有所加深 • 2a 期研究的十二個月積極隨訪數據強化了先前發表在《柳葉刀神經病學 13》手稿中提交同行評審的發現;Medrxiv.org 療效數據集的預印本包括所有每週一次完成 6 劑量療程的 MG 患者 (n=7)。數據是平均分數改善(分數)和標準誤差(淺藍色陰影)。請注意,QOL量表沒有商定的具有臨牀意義的疾病改善閾值;MG-ADL、MGC和QMG量表是經過驗證、定量的標準化疾病嚴重程度儀器,是註冊研究的可接受終點。
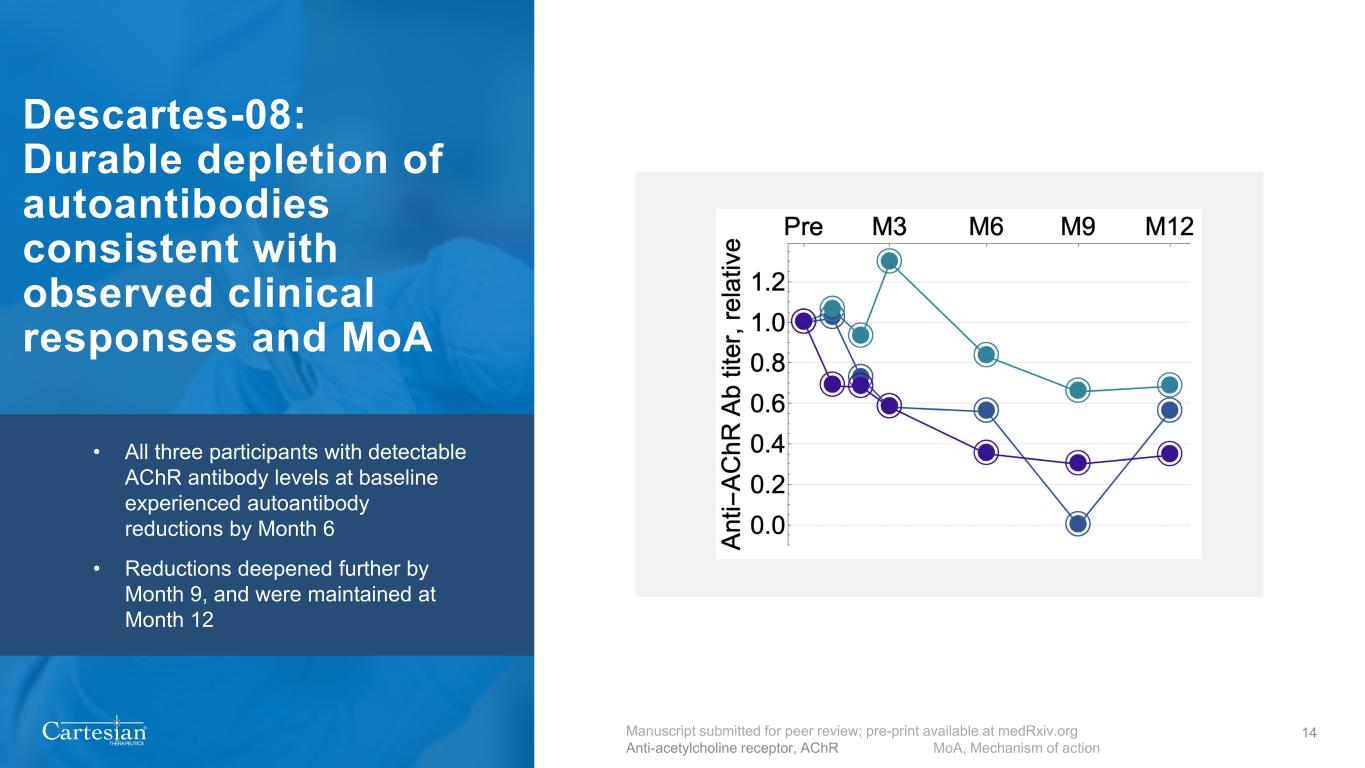
® THERAPEUTICS 14 Descartes-08:與觀察到的臨牀反應和備忘錄相一致的自身抗體持續耗盡 • 在基線時具有可檢測到的 AchR 抗體水平的所有三名參與者在第 6 個月都經歷了自身抗體降低 • 到第 9 個月降幅並維持在第 12 個月提交同行評審的手稿;預印本可在medrxiv.org 抗體受體、AchR MoA、作用機制上獲得
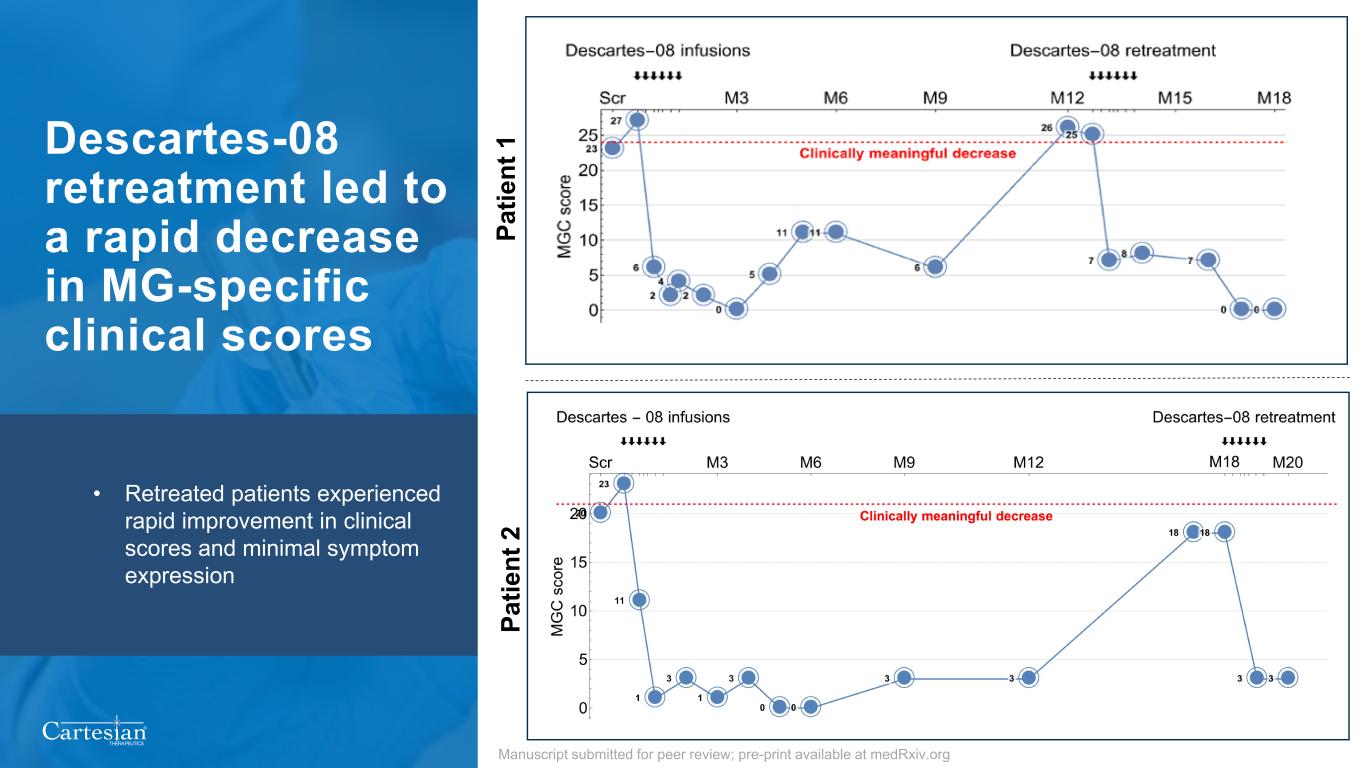
® THERAPEUTICS 15 Descartes-08 再治療導致 MG 特異性臨牀評分迅速下降 • 接受治療的患者臨牀評分迅速改善,症狀表達最少;已提交同行評審稿件;預印本可在 Medrxiv.org 上獲得 Pa tie nt 1 Pa tie nt 2

知情同意/篩查(第 -61 至 -12 天)篩查(第 -60 天至 -11 天)白細胞分離和細胞處理(第 -59 天至 -10 天)笛卡爾-08(第 1、8、15、22、29、36 天)安慰劑(第 1、8、15、22、29、36 天)隨訪第 57 天(± 7 天)第 85*(± 7 天)第 113 天(± 7 天)天) 第 6 個月(± 2 周)第 9 個月(± 2 周)第 12 個月(± 2 周)笛卡爾-08(交叉第 1、8、15、22、29、36 天)隨訪交叉第 57 天(± 7 天)交叉日 85*(± 7 天)交叉日 113(± 7 天)交叉第 6 個月(± 2 周)交叉第 9 個月(± 2 周)交叉第 9 個月(± 2 周)交叉第 9 個月(± 2 周)交叉日第 12 個月 (± 2)周)在MG入組中對Descartes-08進行2b期隨機、安慰劑對照的雙面掩蓋研究正在進行中,預計將在2024年中期取得主要結果計劃治療約30名患者的主要終點 • 在第85天達到次要目標的MG複合應答者的比例(減少至少5個百分點)•安全性和耐受性•量化笛卡爾-08在1年的臨牀效果•QMG,MG QoL 15R,MG ADL,和 MG PIS(從基線更改為第 85 天)• 比較笛卡爾-08與安慰劑對MG量表(從基線變為第85天)對跨界患者的影響Descartes-08 16 隨機分配 MG QMG、定量 MG 分數 MG QOL15R、MG 生活質量 15 次修訂版 MG ADL、MG 日常生活活動 MG PIS、MG 幹預後狀態

探索Descartes-08在系統性紅斑狼瘡(SLE)中的潛力 17 • 對多達30名中度至重度多難治性系統性紅斑狼瘡且未受累中樞神經系統的成年人進行開放標籤研究 • 旨在評估Descartes-08對系統性紅斑狼瘡患者的安全性、耐受性和製造可行性 • 次要目標包括系統性紅斑狼瘡臨牀活動的標準衡量標準:• 系統性紅斑狼瘡疾病活動指數(2000)SLEDAI-2K) • 醫生全球評估 (PGA) • 系統性紅斑狼瘡響應者指數 (SRI) • 不列顛羣島狼瘡評估小組(BILAG) 基於複合狼瘡評估 (BICLA) 篩查(-60 至 -15 天)白細胞置換和細胞處理(第 -59 至 -14 天)2-3 周 Descartes-08(第 1、8、15、22、29、36 天)安全/反應評估(第 50 天)隨訪(第 3、6、9、12 個月)IND 批准的 2024 年上半年第 2 期研究進展順利

探索Descartes-08在自身抗體相關自身免疫性疾病(AAAD)中的其他應用 18 61 歲男性,患有 DPPX 抗體陽性 AIR、結腸炎、潑尼鬆、利妥昔單抗、硼替佐米、iVIG 難治性腦炎;治療前 5/5 種疾病相關自身抗體呈陽性:視力出現臨牀顯著的 2 系改善; 5種自身抗體中有3種無法檢測出在自身免疫性視網膜炎(AIR)患者中觀察到與Descartes-08相關的顯著改善。測試預治療月2 個月 4 個月 6 視力 20/60 20/40 20/40 20/40 20/40 碳酸酐酶 II Ab +--NP* Tubulin Ab +--NP* PKM2 Ab +--NP* 醛縮酶 Ab + + + + NP* *NP — 未執行 • 臨牀數據表明 Descartes-08 可能帶來臨牀益處,同時與疾病相關的消失自身抗體,提示可能存在其他自身免疫適應症 DPPX、二肽酰肽酶樣蛋白 6 iViG、靜脈注射免疫球蛋白
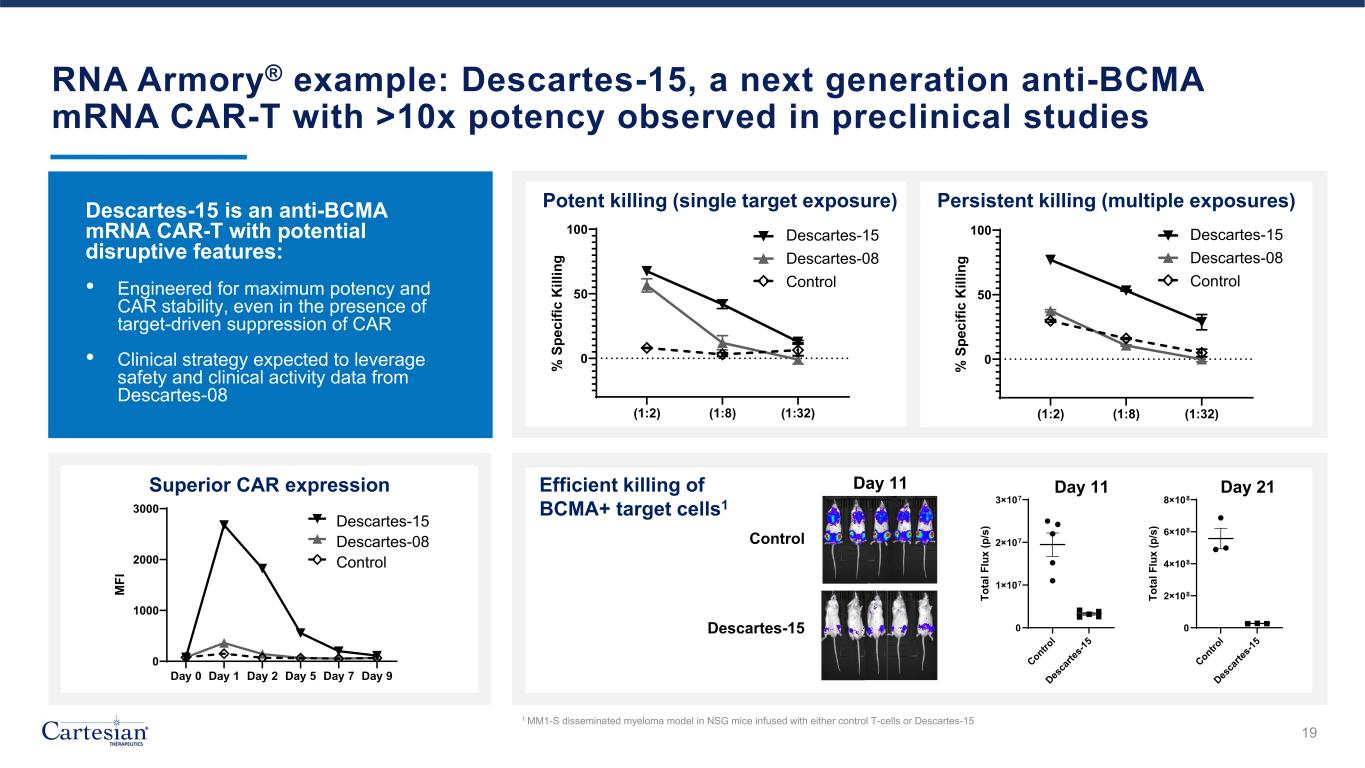
RNA Armory® 示例:Descartes-15,新一代抗 BCMA mRNA CAR-T,在臨牀前研究中觀察到的效力超過 10 倍強效殺死(單靶暴露)持續殺死(1:2)(1:8) (1:32) 0 50 100% S pe ci fic k kill in g DC-15 DC-08 車輛 EP escartes-08 escartes-15 對照 (1:2) (1:8) (1:32) 0 50 100% S pe ci fic k ill in g DC-15 DC-08 車輛 EP escartes-08 escartes-15 Control Descartes-15 是一款具有潛在顛覆性特徵的反 BCMA mRNA CAR-T:• 專為最大效力和汽車穩定性而設計,即使在場也是如此靶向抑制 CAR • 臨牀策略預計將利用來自笛卡爾 08 第 0 天第 1 天第 2 天第 5 天第 7 天 9 天 0 1000 2000 3000 M FI DC-15 DC-08 Vehicle EP escartes-08 escartes-15 Control Superior CAR 表情 Contro l Des ca rte s-1 5 0 2×108 4×108 8×108 第 21 天 To ta l F lu x (/s) Control Descartes-15 Contro l Des ca rte s-1 5 0 1×107 2×107 3×107 第 11 天 To ta l F lu x (p /s) 第 21 天 11 天高效殺死 BCMA+ 靶細胞1 第 11 天 MM1-S 在注入 NSG 小鼠體內的彌散性骨髓瘤模型要麼控制 T 細胞,要麼是 Descartes-15 19
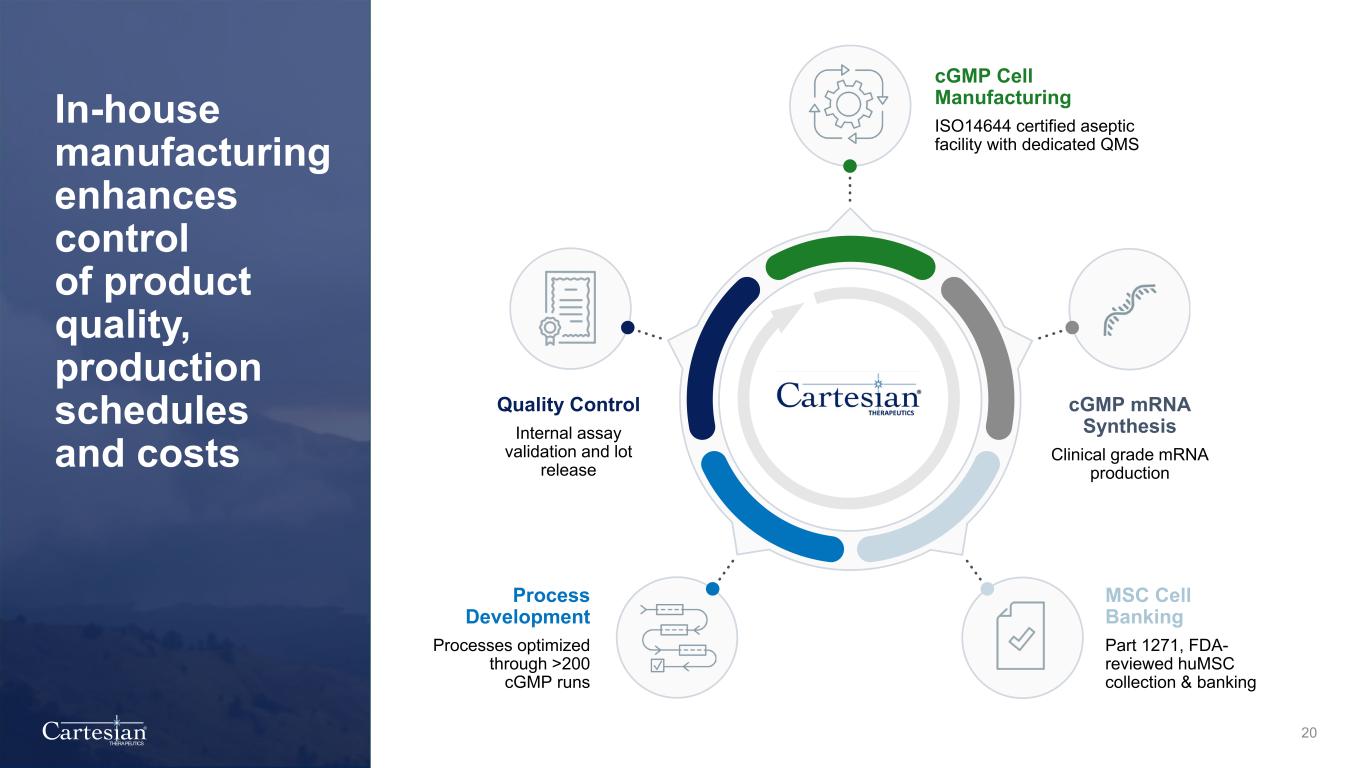
® THERAPEUTICS 20 內部製造增強了對產品質量、生產計劃和成本的控制 cGMP 細胞製造 ISO14644 認證的無菌設施,配備專用 QMS cGMP mRNA 合成臨牀級 mRNA 生產質量控制內部化驗驗證和批次發佈 MSC 細胞庫第 1271 部分,經過 FDA 審查的 HumSC 收集和儲存流程開發流程通過超過 200 次 cGMP 運行進行了優化

全資內部製造:27,000 平方英尺最先進的 cGMP 設施所有權質量控制和生產時間表可靈活地快速適應流程或需求的變化成本效益臨牀和商業製造規模能力支持管道成熟和未來增長 cGMP,目前的良好生產規範工廠位於馬裏蘭州弗雷德裏克
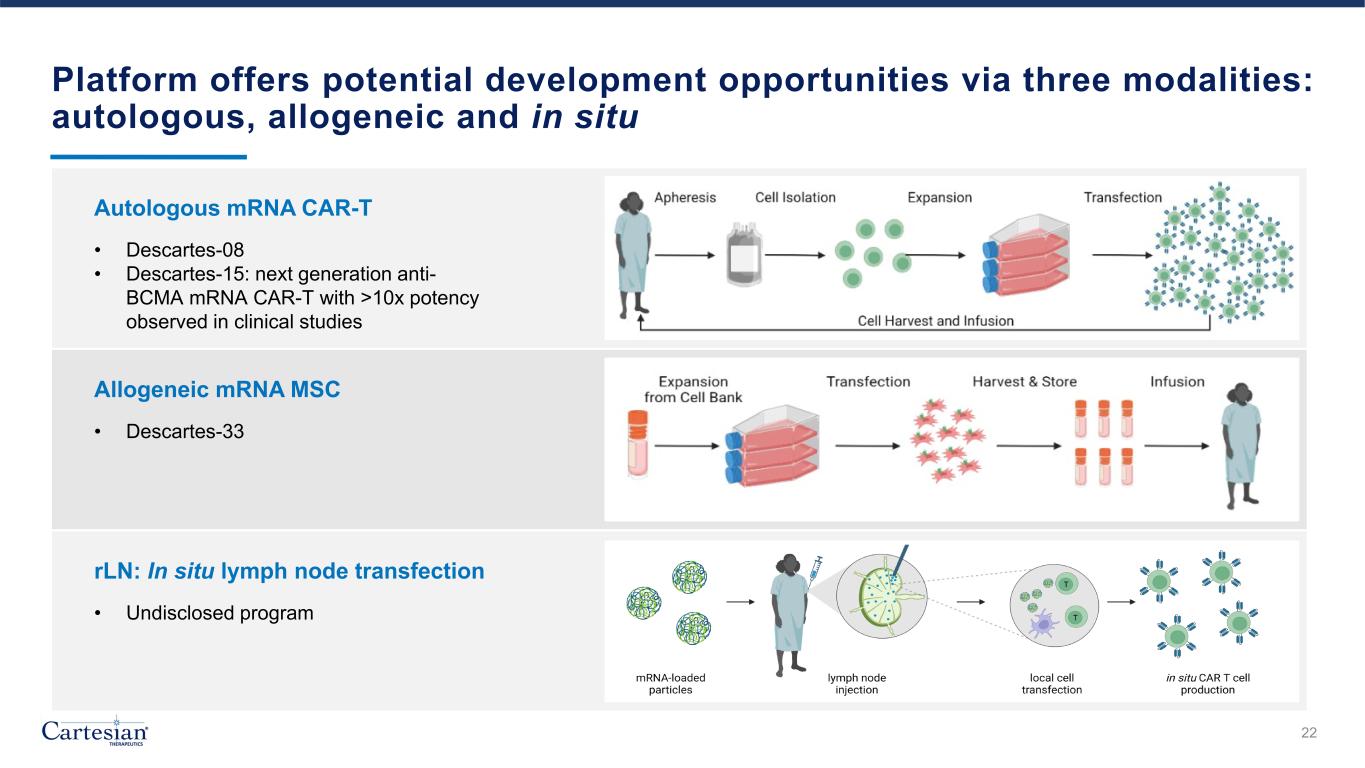
平臺通過三種模式提供潛在的開發機會:自體、異基因和原位 22 自體 mRNA CAR-T • Descartes-08 • Descartes-15:在臨牀研究中觀察到的效力超過 10 倍的下一代抗 BCMA mRNA CAR-T 異基因 mRNA MSC • Descartes-33 rLn:原位淋巴結轉染 • 未公開的計劃
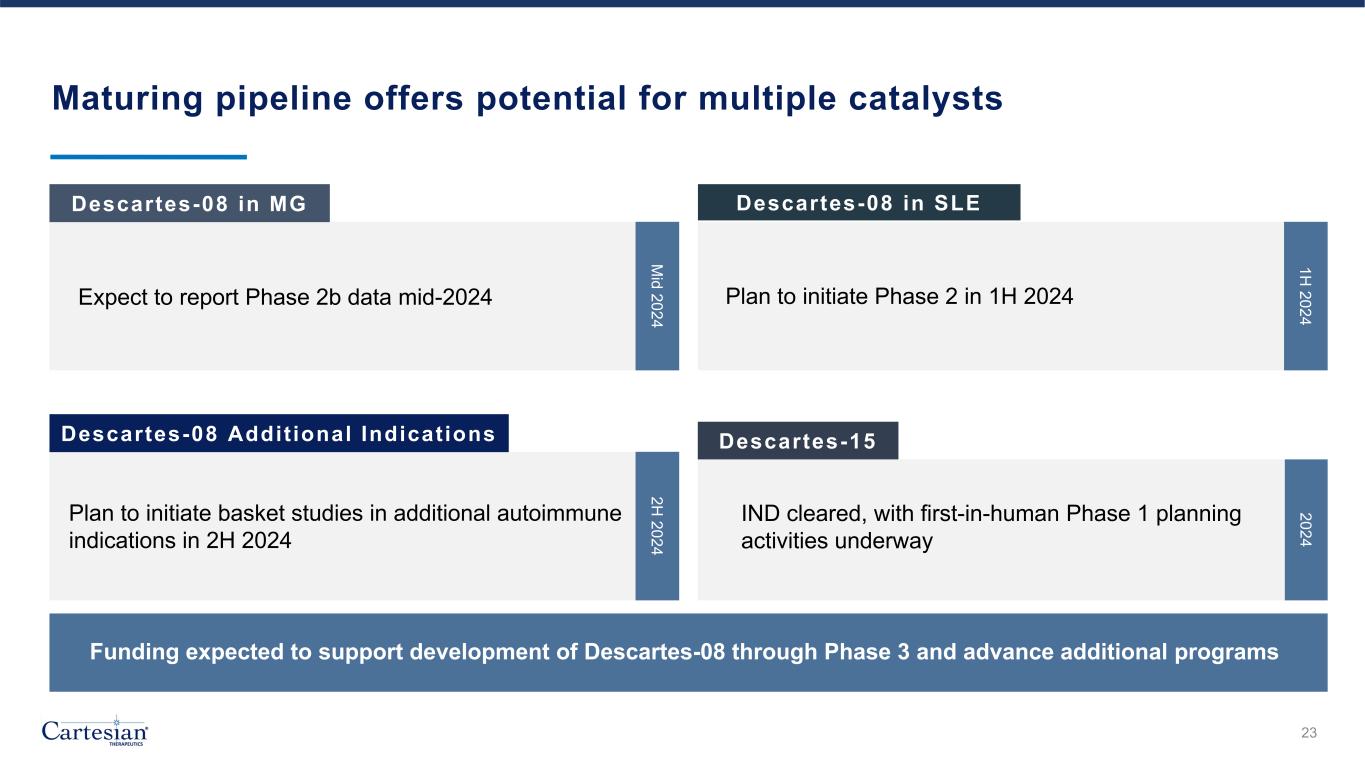
成熟的管道為多種催化劑提供了潛力 23 MG Descartes-08 在 SLE 中間 Descartes-08 其他適應症 Descartes-15 預計將在 2024 年中期公佈第 2b 階段數據計劃在 2024 年上半年啟動第二階段計劃在 2024 年下半年啟動其他自身免疫適應症的籃子研究 IND 已獲批准,2024 年上半年首次人體第一階段規劃活動預計將支持 Descartes-08 開發至第 3 階段,並推進其他項目

® THERAPEUTICS 強勁的財務狀況有望支持管道完成關鍵里程碑

® THERAPEUTICS P I O N E E R I N G M R N A C E L L T H E R A P I E S Pipeline 旨在將細胞療法的覆蓋範圍擴大到自身免疫性 M A T U R I N G P I P E L I N E W I T E X P E C T E D D E D D N E A R-T E R M C A T A T A L Y S 經過驗證的牽頭項目,DescartecarteS-08,預計將在年中提供第 2b 階段的數據 C A S H R E E S O U R C E X P E C T E D T O F U N D O P E R A T I O N S I N T O 2 H 2 0 2 6 預計將在第 3 階段支持 Descartes-08 並推進其他項目 E X P E R I E N C E D L E A D E R S H I P T E A M® THERAPEUTICS 專注於紀律嚴明投資併為股東和患者創造價值

® THERAPEUTICS 開創性自身免疫的 mRNA 細胞療法 C A R T E S I A N T H E R A P E U T I A N T H E R A P E U T I C S

® 治療附錄
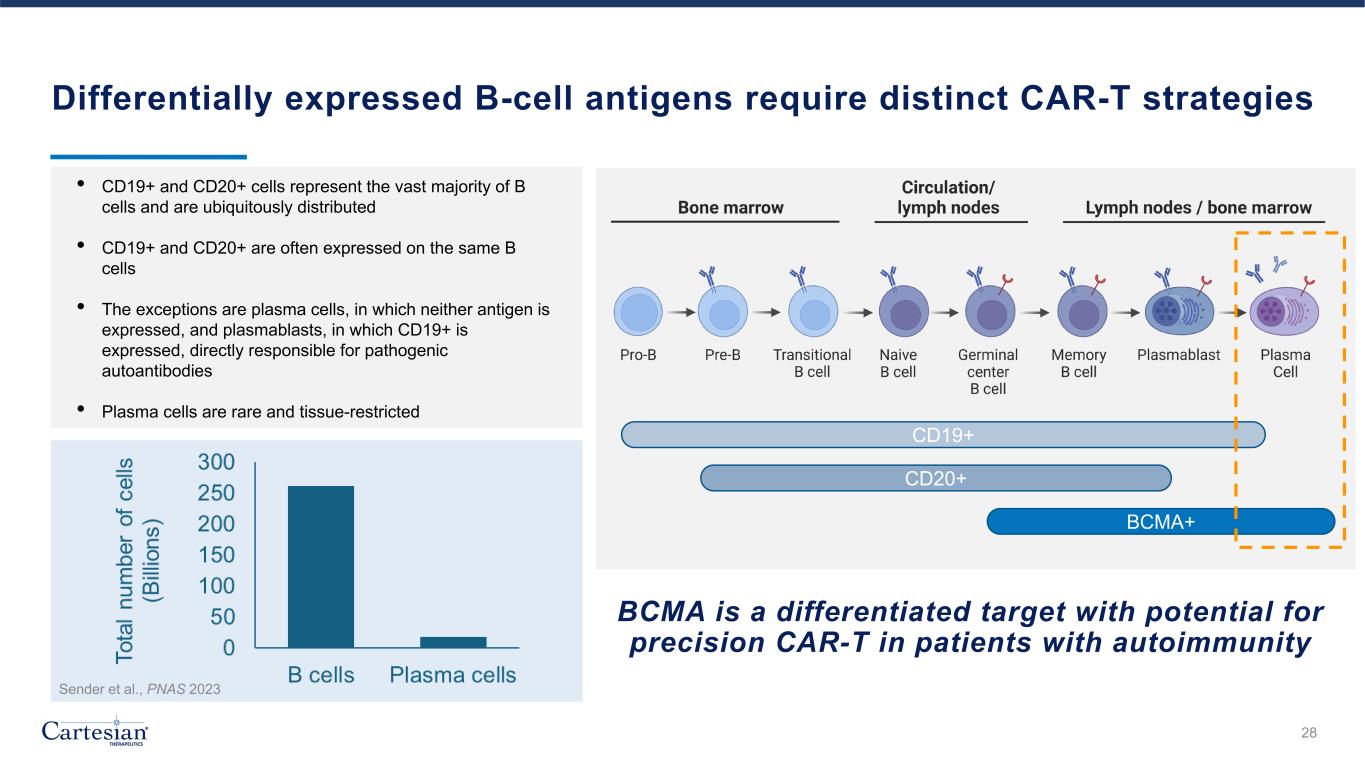
差異表達的 B 細胞抗原需要不同的 CAR-T 策略 • CD19+ 和 CD20+ 細胞佔絕大多數 B 細胞且無處不在 • CD19+ 和 CD20+ 通常在同一 B 細胞上表達 • 例外的是漿細胞,其中均不表達 CD19+,直接導致致病性自身抗體 • 漿細胞稀有且呈組織狀受限 28 Sender 等人,PNAS 2023 BCMA 是一種差異化靶標,有可能對以下患者進行精準 CAR-T自身免疫 CD19+ CD20+ BCMA+
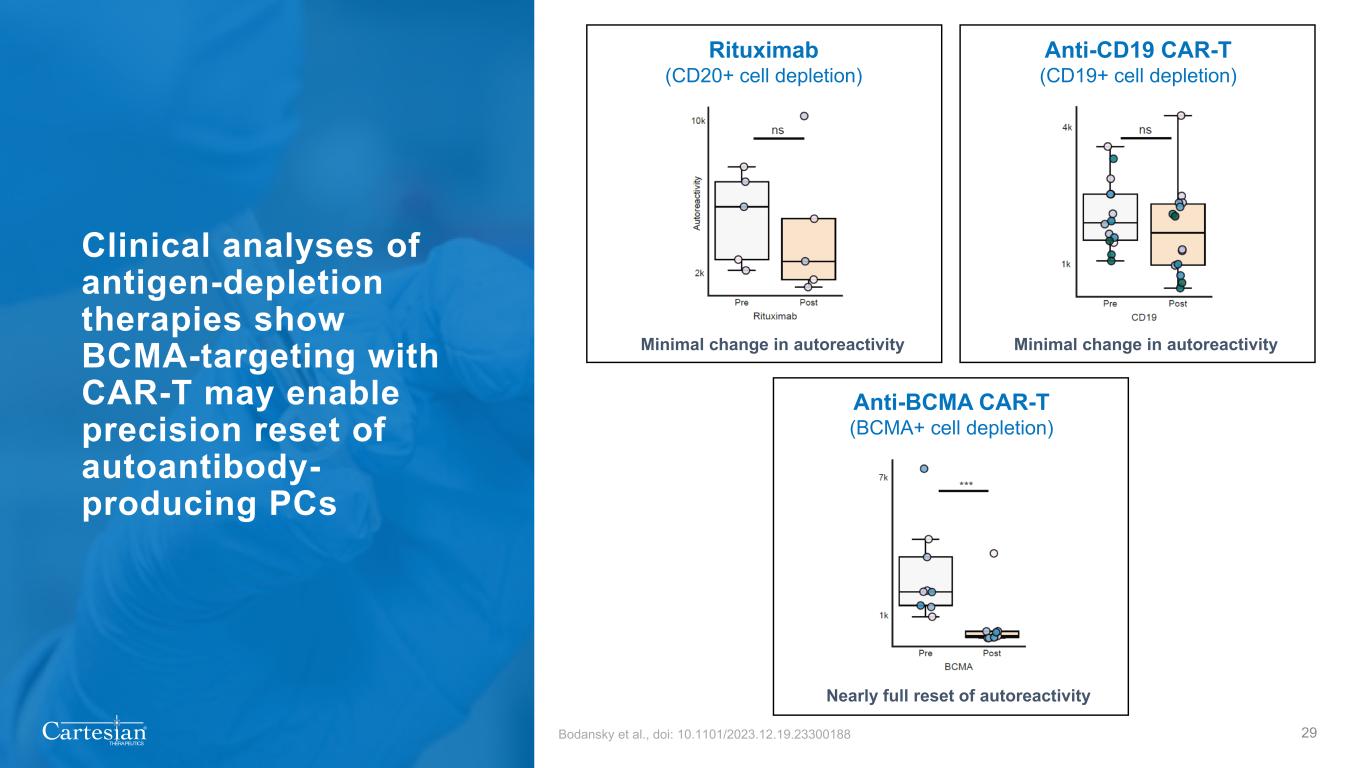
® THERAPEUTICS 抗原消耗療法的臨牀分析顯示,使用 CAR-T 靶向 BCMA 可以精確重置產生自身抗體的 pC 29Bodansky 等人,doi:10.1101/2023.12.19.23300188 利妥昔單抗(CD20+ 細胞耗竭)抗 CD19 CAR-T(BCMA+ 細胞耗竭)抗體微小變化 autoreactivity 自動反應的變化微乎其微的自反應性幾乎完全重置
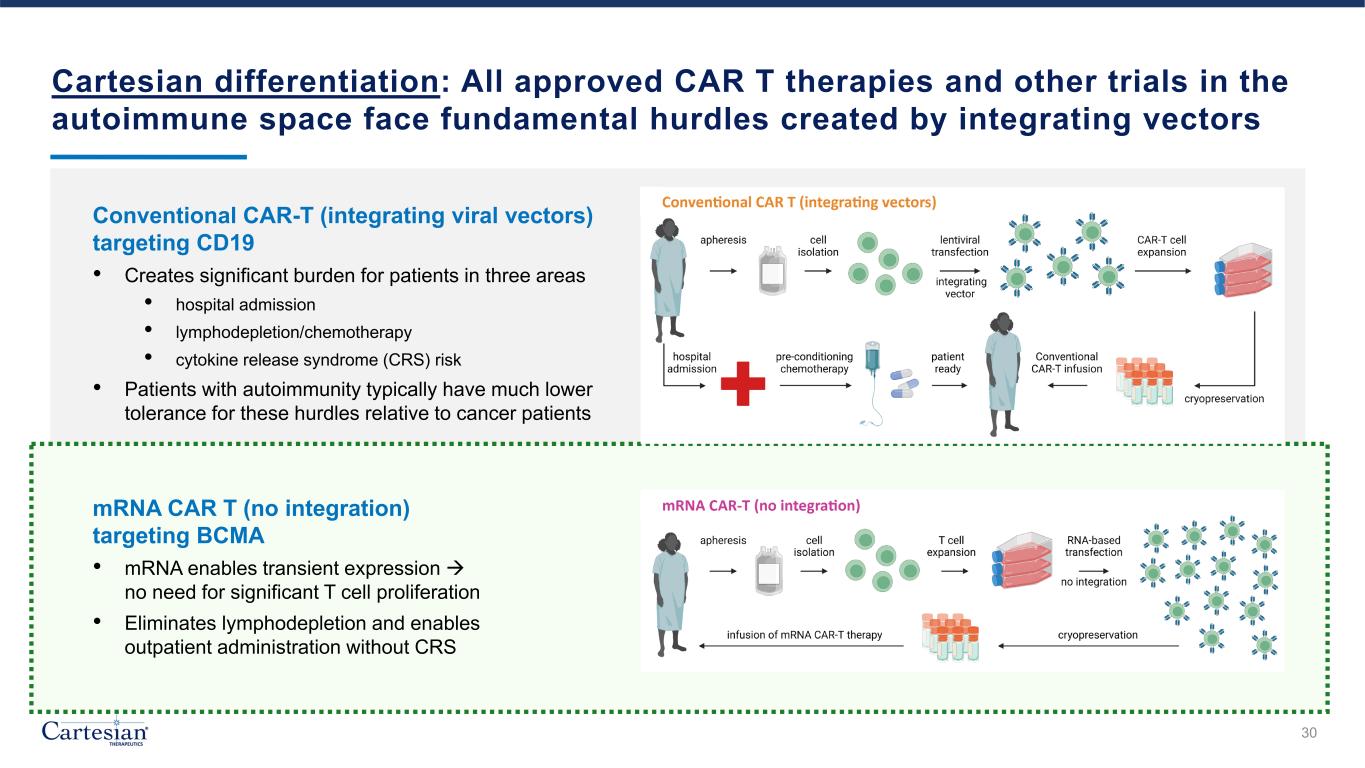
笛卡爾差異化:所有經批准的CAR T療法和自身免疫領域的其他試驗都面臨着整合載體 30 針對CD19的傳統CAR-T(整合病毒載體)所產生的根本障礙 • 在三個方面給患者造成沉重負擔 • 入院 • 淋巴耗盡/化療 • 細胞因子釋放綜合徵 (CRS) 風險 • 與癌症患者相比,自身免疫患者對這些障礙的耐受性通常要低得多 mRNA CAR T(未整合)) 靶向 BCMA • mRNA 可實現瞬時表達,無需顯著的 T 細胞增殖 • 可消除淋巴消耗,無需使用 CRS 即可進行門診治療