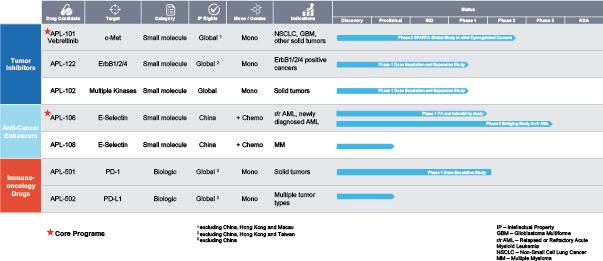
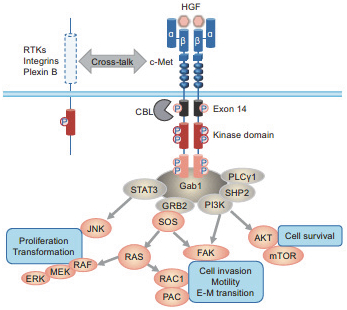
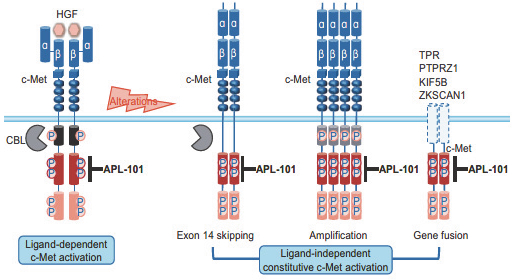
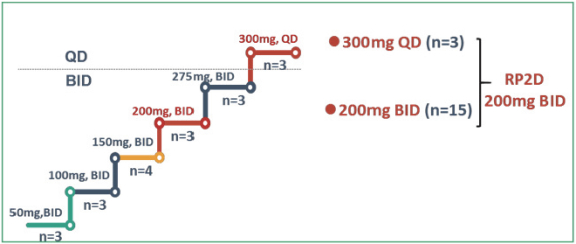
阿波羅經濟學對高管和董事的薪酬
截至2022年12月31日止年度,吾等及吾等附屬公司支付予董事及行政人員的總薪酬及以股份為基礎的薪酬及其他支出為6,044,066美元。
只要我們有資格成為外國私人發行人,我們就不需要遵守適用於美國國內公司的委託書規則,包括適用於新興成長型公司的要求,即披露其首席執行官和其他兩名薪酬最高的高管的薪酬是以個人而不是整體為基礎的。
2016股權激勵計劃
2016年7月,阿波利經濟學董事會通過了CB Treateutics Inc.2016股權激勵計劃,我們的股東也批准了該計劃(“2016計劃”)。2016年計劃自2016年7月通過以來沒有修改過。2016年計劃將不再提供其他獎勵;但是,2016年計劃下的未決獎勵將繼續受其現有條款的制約。
截至2022年12月31日,我們已預留337,225,866股普通股供2016年計劃發行,可根據2016年計劃條款以購股權、股份增值權、限制性股份單位獎勵或其他基於股份的獎勵的形式發行。截至2022年12月31日,我們有135,979,705股普通股的未償還期權,加權平均行使價為0.21美元,其中67,667,737股已歸屬並可行使,以及6,930,235股已發行的未歸屬限制股。受獎勵到期或註銷的未發行股份、我們重新收購的標的股份以及為支付獎勵的收購價或行使價或為滿足預扣税款而扣留的標的股份將根據2016年計劃再次可供發行;然而,它們將不再可根據2023年激勵計劃進行發行。
2023年股權激勵計劃
我們希望利用基於股權的獎勵來促進我們的利益,方法是為我們的高管提供獲得股權的機會,作為他們繼續留在我們服務的激勵,並使他們的利益與我們股權持有人的利益保持一致。關於業務合併,阿波羅經濟學董事會通過了2023年激勵獎勵計劃(經不時修訂),該計劃在本年度報告中被稱為“2023年激勵計劃”,並於結束時生效。2023年激勵計劃允許我們對高級管理人員、員工、非員工董事以及我們的顧問和附屬公司進行股權和基於股權的激勵獎勵。本公司董事會預期,向該等人士提供於本公司的直接權益將確保該等人士的利益與本公司的利益及本公司股東的利益更緊密一致,從而刺激他們代表本公司作出努力,並加強他們繼續留在本公司及其聯屬公司的意願。
行政管理。薪酬委員會負責管理2023年激勵計劃。薪酬委員會一般有權指定參與者,決定授予參與者的獎勵類型,確定證明根據2023年激勵計劃授予的任何獎勵的任何協議的條款和條件,加快獎勵的歸屬或可行使性、獎勵的付款或限制的失效,以及通過、修改和廢除與2023年激勵計劃相關的規則、指導方針和做法。薪酬委員會完全有權管理和解釋2023年獎勵計劃,並作出任何其他決定和/或採取其認為管理2023年獎勵計劃所需或適宜的任何其他行動,而薪酬委員會作出的任何此類決定或採取的任何行動均為最終、決定性的,並對所有個人和實體具有約束力。薪酬委員會可向我們的一名或多名高級職員或任何附屬機構授權,代表薪酬委員會就2023年激勵計劃中薪酬委員會的責任或分配給薪酬委員會的任何事項、權利、義務或選舉採取行動,並可將其作為法律事項如此授權,但向受《交易法》第16條約束的人員授予獎勵的除外。
資格。我們的某些員工、董事、高級管理人員、顧問或顧問或我們的附屬公司有資格參加2023年激勵計劃。63名員工、顧問、顧問和服務提供商以及所有非執行幹事董事都有資格參加2023年激勵計劃。
授權股數。我們最初為2023年激勵計劃下的獎勵發行預留了相當於收盤後所有已發行A類普通股的10%的Apollology A類普通股數量。根據2023年激勵計劃預留供發行的股份數量將於2024年至2033年每年1月1日自動增加,增加的股份數量等於以下兩者中的較小者:(I)Apollonomy A類普通股截至上一年12月31日的流通股總數(四捨五入至最接近的完整股份)的3%,或(Ii)本公司董事會可能決定的數字。儘管2023年激勵計劃有任何相反規定,根據2023年激勵計劃下的激勵股票期權(“ISO”)的行使,可發行不超過根據2023年激勵計劃最初預留的A類普通股數量的Apollology A類普通股。
根據2023年激勵計劃,被沒收、取消、到期、未行使或以現金結算的A類普通股將再次可用於2023年激勵計劃下的新獎勵。如果Apollology的公司資本發生任何變化,委員會可全權酌情對根據2023年激勵計劃預留供發行的Apollology A類普通股數量、根據2023年激勵計劃當時已發行的獎勵涵蓋的Apollology A類普通股數量、2023年激勵計劃下獎勵的限制、未償還期權的行使價格以及其決定的其他公平替代或調整進行替換或調整。
2023年激勵計劃的期限不超過10年,自Apollonomy股東批准之日起計算,在該日期之後,可能不會再根據2023年激勵計劃授予其他獎勵。
可供授予的獎項。薪酬委員會可授予不合格股票期權、獨立董事、股票增值權、限制性股票、限制性股票單位、其他基於股票的獎勵、其他基於現金的獎勵、股息等價物和/或績效補償獎勵或上述獎勵的任意組合。
股票期權與股票增值權。股票期權規定,未來將以授予日設定的行權價購買Apollology A類普通股。與非限制性股票期權不同,如果滿足特定持有期和準則的其他要求,ISO可能會向其持有人提供行使以外的遞延納税和優惠的資本利得税待遇。SARS使其持有人在行使權力後,有權在授予日期至行使日期之間從吾等獲得等同於獎勵股份增值的現金或股份。除與公司交易有關的某些替代獎勵外,股票期權或特別行政區的行使價不得低於相關股份於授出日期的公平市價的100%(如授予某些重要股東,則不低於基礎股份公平市值的110%)。股票期權或特別行政區的期限自授予之日起不得超過10年(如果是授予某些重要股東的股票期權,則不得超過5年)。
限制性股票。限制性股票是對受某些歸屬條件和其他限制限制的不可轉讓Apollology A類普通股的獎勵。
RSU。RSU是未來交付Apollology A類普通股的合同承諾,除非滿足特定條件,否則這些股份也可能繼續被沒收,並可能伴隨着在標的股份交付之前獲得相當於Apollology A類普通股股票支付的等值股息的權利(即股息等價權)。賠償委員會可以規定,如果以RSU為標的的股票的交付將導致違反適用法律,則將被推遲交付。適用於RSU的條款和條件將由薪酬委員會根據2023年激勵計劃中包含的條件和限制確定。
其他基於股票或現金的獎勵。其他基於股票或現金的獎勵包括現金、完全歸屬的Apollology A類普通股,以及通過參考或以其他方式基於Apollology A類普通股進行估值的其他獎勵。其他基於股票或現金的獎勵可以授予參與者,也可以作為結算其他獎勵的付款形式或作為獨立付款。
股息等價物。股息等價物代表有權獲得與Apollology A類普通股支付的股息等值的權利,可以單獨授予,也可以與股票期權或SARS以外的獎勵一起授予。股息等價物於授出獎勵日期至獎勵授予、行使、分配或失效日期之間的股息記錄日期計入,由委員會決定;然而,股息等價物將不會支付,除非及直至相關獎勵成為應付,並將與相關獎勵同等程度地被沒收。
表演獎。根據2023年激勵計劃授予的績效獎勵可以是現金獎金的形式,也可以是以Apollology A類普通股計價的績效股票或績效單位的獎勵的形式,這些獎勵可以現金、財產或發行這些股票的方式結算,但須滿足或達到指定的績效條件。
可轉讓性。每項獎勵只能在參與者有生之年由參與者行使,或在適用法律允許的情況下由參與者的監護人或法定代表人行使,參與者不得以其他方式轉讓、轉讓、質押、扣押、出售、以其他方式轉讓或以其他方式轉讓或擔保,除非依照遺囑或繼承法和分配法,任何這類據稱的轉讓、轉讓、質押、扣押、出售、轉讓或強制執行將是無效的,不能對Apollology或其附屬公司執行。但是,補償委員會可允許將獎勵金(ISO除外)轉讓給家庭成員、為此類家庭成員的利益而設立的信託基金、合夥人或股東為參與者及其家庭成員或經其批准的任何其他人的合夥企業或有限責任公司。
修訂和終止;重新定價。一般而言,本公司董事會可隨時修訂、更改、暫停、終止或終止2023年獎勵計劃。然而,如果適用法律或2023年激勵計劃要求,修改2023年激勵計劃的股東批准可能是必要的。未經任何參與者或接受者的同意,任何修改、更改、暫停、中止或終止都不會對任何參與者或接受者的權利造成實質性的不利損害。任何降低任何股票期權或特別行政區的行使價格的修訂,或取消任何行使價格高於Apollology A類普通股當時的公平市場價值的股票期權或特別行政區,以換取現金、其他獎勵或股票期權或每股行使價格低於原始股票期權或SARS的每股行使價格的SARS,將不需要股東批准。
調整;公司交易。如果發生某些資本化事件或公司交易(如2023年激勵計劃中所述),包括完成我們與另一家公司的合併或合併,薪酬委員會可根據獎勵、獎勵的行使或執行價格或任何適用的業績衡量標準調整Apollology A類普通股或Apollology的其他證券(或其他證券或其他財產的數量和種類)的數量,並可規定以實質上保留此類獎勵條款的方式替代或承擔未完成的獎勵,加快適用於未決裁決的限制的可行使性或失效,以及取消未決裁決,以換取Apollonomy股東就此類交易收到的對價。
190