目錄
第 2 項。管理層對財務狀況和經營業績的討論和分析。
以下討論應與我們在本10-Q表季度報告中包含的未經審計的簡明合併財務報表及其附註以及2023年10-K表中包含的截至2023年12月31日年度的經審計的合併財務報表及其附註一起閲讀。本討論包含前瞻性陳述,反映了我們當前的預期,涉及風險和不確定性。有關與這些陳述相關的不確定性、風險和假設的討論,請參閲 “關於前瞻性陳述的説明”。由於重要因素和風險,包括但不限於下文 “風險因素” 和本文其他地方列出的因素和風險,以及2023年10-K表格第一部分第1A項中確定的因素和風險,我們的實際業績和事件發生時間可能與前瞻性陳述所表達或暗示的結果和發生時間存在重大差異。
概述
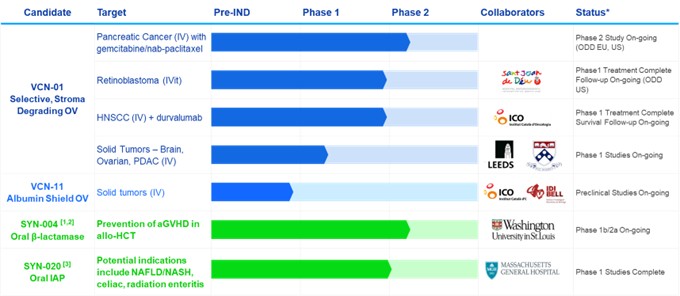
我們是一家處於臨牀階段的多元化公司,正在開發旨在治療未得到滿足的高需求領域的癌症和相關疾病的療法。由於2022年3月收購了Theriva Biologics, S.L.(“VCN”,前身為VCN Biosciences, S.L.),詳情見下文(“收購”),我們通過開發專為靜脈注射和玻璃體內注射觸發而設計的新溶瘤腺病毒平臺,開始將我們的戰略重點轉向腫瘤學,現在是我們的主要重點腫瘤細胞死亡,改善共同給藥的癌症療法獲得腫瘤的機會,並促進患者免疫系統產生強大而持續的抗腫瘤反應。我們的主要候選產品 VCN-01 是一種臨牀階段的溶瘤人類腺病毒,經過修飾後可表達一種酶 PH20 透明質酸酶,目前正在一項治療胰腺癌的 2 期臨牀研究中接受評估,最近在治療視網膜母細胞瘤的 1 期臨牀研究和實體瘤治療的 1 期臨牀研究中用於治療患者。此外,它還已在其他幾種適應症中進行了測試,包括一項治療頭頸部鱗狀細胞癌的1期臨牀研究。
在收購之前,我們的重點是開發旨在治療胃腸道(GI)疾病的療法,其中包括我們的臨牀開發候選藥物:(1)SYN-004(ribaxamase),它旨在降解胃腸道內某些常用的靜脈(IV)β-內酰胺抗生素,以防止微生物組損傷,從而防止病原生物的過度生長和感染,例如 艱難梭菌感染 (CDI) 和耐萬古黴素腸球菌 (VRE),降低異基因造血細胞移植 (HCT) 接受者急性移植物抗宿主病 (AgvHD) 的發病率和嚴重程度,以及 (2) SYN-020,一種在 cGMP 條件下產生的腸道鹼性磷酸酶 (IAP) 酶的重組口服制劑,旨在治療局部胃腸道和全身性胃腸道疾病。作為我們向專注於腫瘤學的公司的戰略轉型的一部分,我們正在探索 SYN-004 和 SYN-020 資產的價值創造選項,包括外包許可或合作。
我們目前的產品管道
23