

DURAVYU 在 NPDRPAVIA 二期臨牀試驗結果中,2024 年 5 月 6 日 ©2024 年 EyePoint Pharmicals, Inc. 版權所有美國食品藥品管理局有條件地接受 DURAVYU 作為 EYP-1901 的專有名稱。DURAVYU是一種研究產品;它尚未獲得美國食品藥品管理局的批准。FDA的批准和潛在批准的時間表尚不確定。展品 99.2

法律免責聲明 ©2024 EyePoint 製藥公司版權所有根據1995年《美國私人證券訴訟改革法》的定義,本演示文稿中的各種陳述均具有前瞻性,並且本質上受風險、不確定性和可能不準確的假設的影響。所有涉及我們打算、預期、計劃或認為將來可能發生的活動、事件或發展的陳述,包括但不限於通過DURAVYU濕性AMD三期臨牀試驗的頭條數據得出的現有現金資源充足的陳述;我們對包括DURAVYU和 EYP-2301 在內的候選產品時機和臨牀開發的預期;DURAVYU作為嚴重眼病的新型持續療法的可能性,包括濕性年齡相關性黃斑變性,非增殖性糖尿病視網膜病變和糖尿病黃斑水腫;以及我們的長期財務和業務目標和預期,均為前瞻性陳述。可能導致實際結果與我們的前瞻性陳述中表達、預期或暗示的預期結果或其他預期存在重大差異的一些因素是我們業務固有的風險和不確定性,包括但不限於:臨牀試驗的有效性和及時性以及數據的有用性;監管部門批准的及時性;我們獲得所需資金的能力;當前和未來的許可協議的終止或違反;我們對合同研究組織的依賴、共同推廣合作伙伴和其他外部供應商和服務提供商;指導方針、建議和研究的影響;保護我們的知識產權和避免知識產權侵權;留住關鍵人員;產品責任;行業整合;遵守環境法;製造風險;國際業務運營的風險和成本;我們股價的波動;可能的稀釋;沒有股息;總體商業和經濟狀況不穩定的影響,包括通貨膨脹和利息的變化利率和勞動力市場;以及我們在向美國證券交易委員會提交的文件中描述的其他因素。我們無法保證任何前瞻性陳述中表達、預期或暗示的結果和其他預期能夠實現。包括這些風險在內的各種因素可能導致我們的實際業績和其他預期與前瞻性陳述中表達、預期或暗示的預期業績或其他預期存在重大差異。如果已知或未知風險出現,或者基本假設被證明不準確,則實際結果可能與過去的業績以及前瞻性陳述中的預期、估計或預測的業績存在重大差異。在考慮任何前瞻性陳述時,應牢記這一點。我們的前瞻性陳述僅代表其發表之日。即使經驗或未來的變化明確表明此類陳述中表達或暗示的任何預期業績都無法實現,我們也沒有義務公開更新或修改我們的前瞻性陳述。

©2024 EyePoint 製藥公司版權所有。使用我們的可生物腐蝕的Durasert E IVT交付技術Duravyu(伏羅拉尼布玻璃體內注射劑)——vorolanib,Durasert E Positive topline濕式2期數據中的選擇性專利TKI AMD濕式AMD的第三階段試驗計劃於2024年下半年在NPDR啟動Topline第二階段數據;預計在第三季度發佈12個月的數據 2024 年 DME 的 Topline 第 2 階段數據預計將於 2025 年第一季度發佈 EYP-2301 — razuprotafib,Durasert E Durasert® 中用於嚴重視網膜疾病的專利 TIE-2 激動劑-久經考驗、安全的體外靜脈注射藥物交付技術 Bioerodible Durasert E 和不可腐蝕配方對四種經美國食品藥品管理局批准的具有不可腐蝕配方的產品安全地注射給成千上萬名患者的眼睛 2023 年 12 月 31 日強勁的資產負債表 3.31 億美元的現金和投資 2026 年 AMD 濕式關鍵試驗頭條數據致力於開發改善嚴重視網膜疾病患者生活的療法 DURAVYU 已獲得 FDA 有條件接受作為 EYP-1901 的專有名稱。DURAVYU是一種研究產品;它尚未獲得美國食品藥品管理局的批准。FDA的批准和潛在批准的時間表尚不確定。IVT,玻璃體內注射
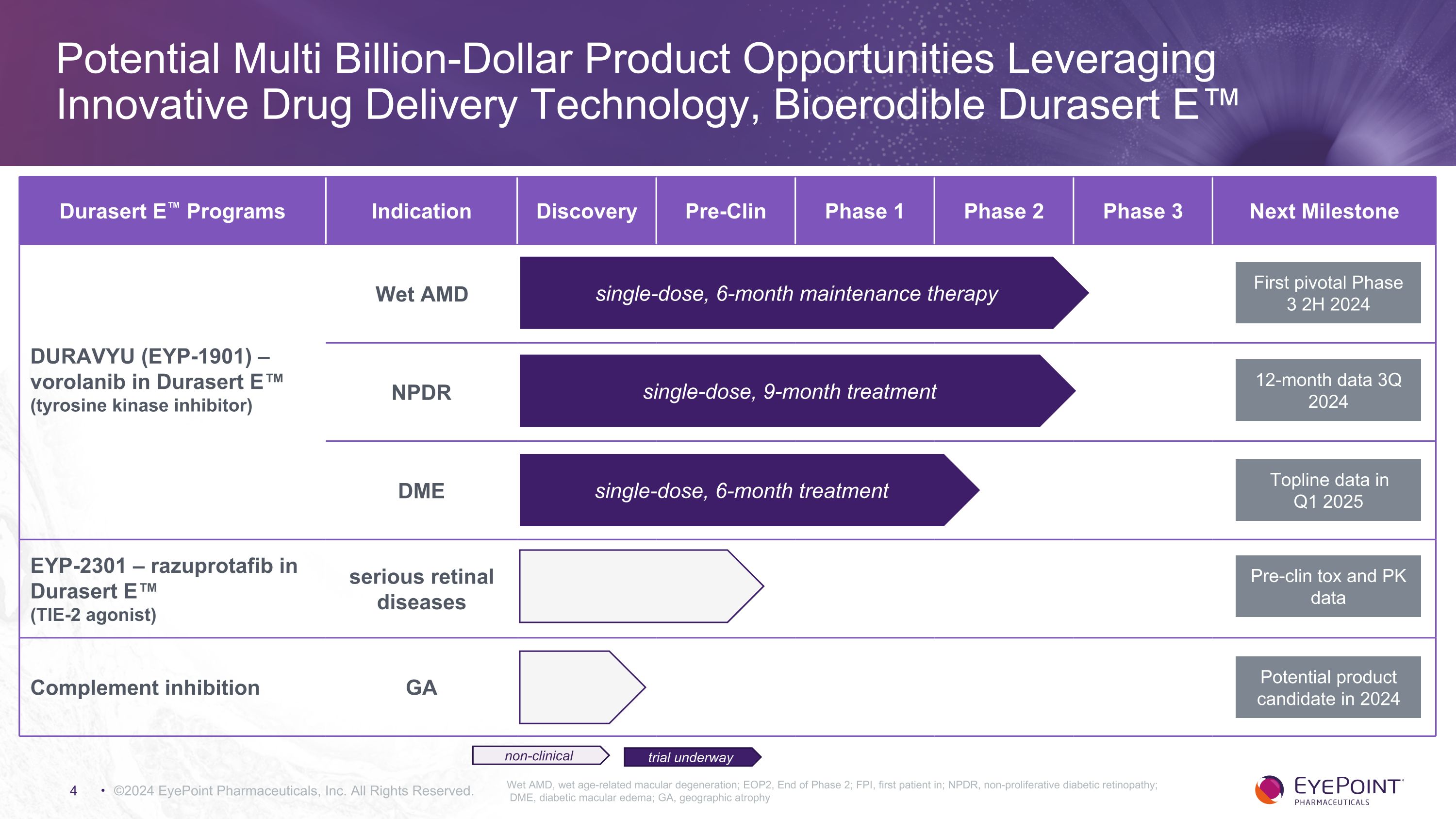
©2024 EyePoint 製藥公司版權所有濕性 AMD,濕性年齡相關性黃斑變性;EOP2,第 2 階段結束;FPI,首位患者;NPDR,非增殖性糖尿病視網膜病變;DME,糖尿病黃斑水腫;GA,地理萎縮 Durasert E 項目適應症發現 Pre-Clin 1 期 2 期 3 期下一個里程碑 DURAVYU (EYP-1901) — durasert E (酪氨酸) 中的伏羅拉尼布激酶抑制劑)濕性 AMD NPDR DME EYP-2301 — razuprotafib 用於 Durasert E(TIE-2 激動劑)嚴重視網膜疾病補體抑制 GA 2024 年下半年 12 個月的第一個關鍵數據 2024 年第三季度關鍵數據 2025 年第一季度前臨牀毒素和PK 數據 2024 年的潛在候選產品試驗正在進行非臨牀單劑量、6 個月維持療法單劑量、9 個月治療單劑量、6 個月治療潛在的數十億美元產品機會利用創新的藥物遞送技術 Bioerodible Durasert E
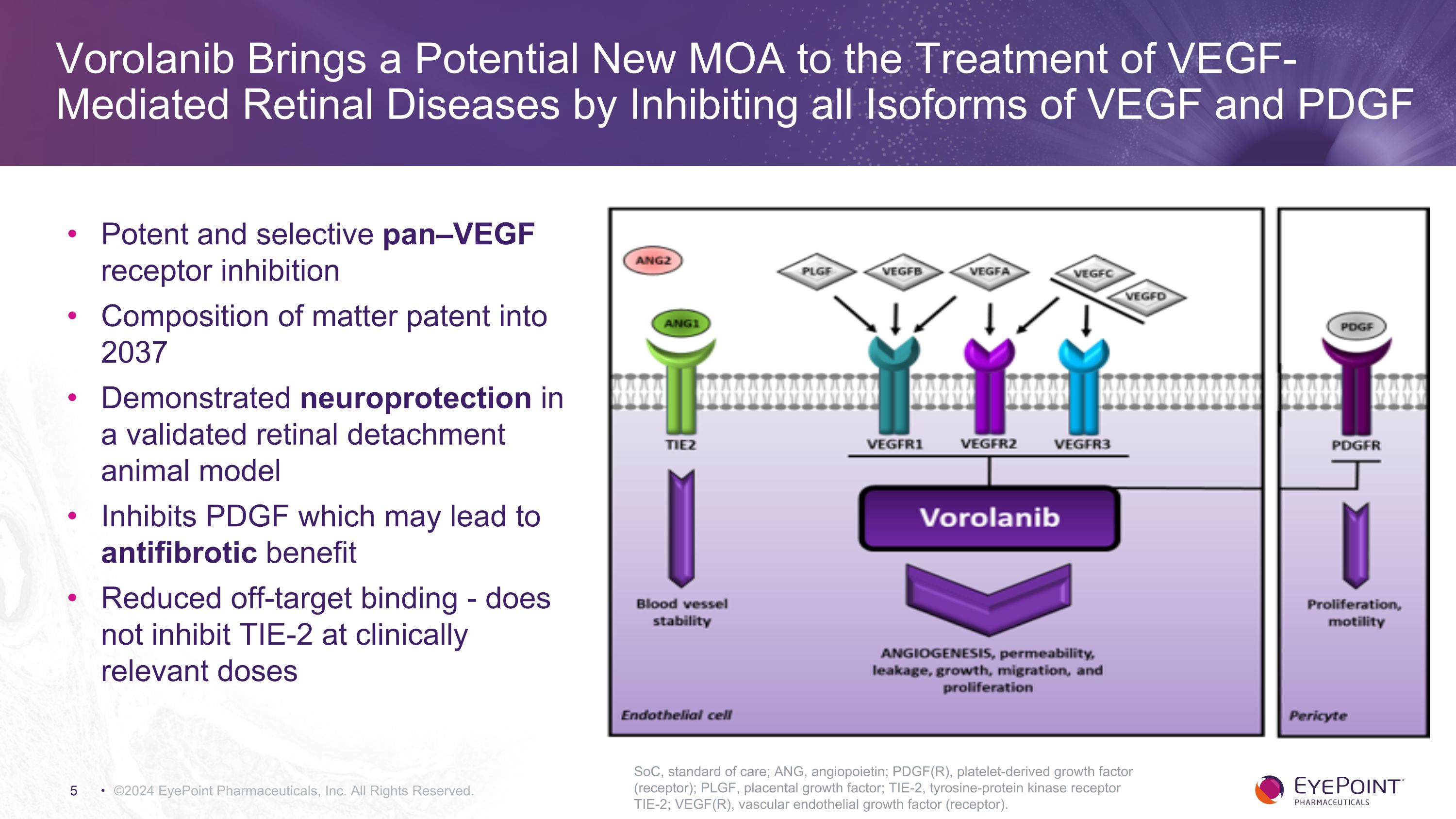
©2024 EyePoint 製藥公司版權所有。SoC,護理標準;ANG,血管生成素;PDGF(R),血小板衍生生長因子(受體);PLGF,胎盤生長因子;TIE-2,酪氨酸蛋白激酶受體 TIE-2;VEGF(R),血管內皮生長因子(受體)。強效和選擇性的 pan—VEGF 受體抑制 2037 年的物質組成專利成分在經過驗證的視網膜脱離動物模型中顯示出神經保護作用抑制 PDGF,從而產生抗纖維化益處減少脱靶結合-在臨牀相關劑量下不會抑制 TIE-2 VOROLANIB 通過抑制 VEGF 和 PDGF 的所有亞型,為血管內皮生長因子介導的視網膜疾病的治療帶來潛在的新 MOA

©2024 EyePoint 製藥公司版權所有插入物約為玻璃體積的1/5000,來自1期DAVIO和2期DAVIO 2臨牀試驗的濕性AMD的陽性療效數據良好的安全性表現良好的安全性在正在進行的2期臨牀試驗中未報告眼部或全身性Duravyu相關SAE立即進行生物利用,首先釋放藥物,然後進行零階動力學釋放,持續約9個月通過常規玻璃體內注射在醫生辦公室交付的樣品在室温下發貨和存放温度 DURAVYU:血管內皮生長因子受體結合 Vorolanib Ion Bioerodible Durasert E VEGF — 血管內皮生長因子:AMD — 與年齡相關的黃斑變性;

©2024 EyePoint 製藥公司版權所有。PAVIA 2 期臨牀試驗主要結果:一項隨機、多中心試驗與虛假對照的對比

©2024 EyePoint 製藥公司版權所有NPDR 中的 PAVIA 臨牀試驗一項評估兩劑DURAVYU對照組的臨牀試驗為期9個月的療法設計:多中心、隨機、雙面罩、單次注射DURAVYU與假對照組對比中重度無活性 CI-DME 的患者主要結局:經獨立評估的第36周(9個月)DRSS改善分數≥2步的患者百分比閲讀中心關鍵次要終點:減少威脅視力的併發症 CI-DME 發生率安全 NPDR,非增生糖尿病視網膜病變;CI-DME,中樞受累的糖尿病黃斑水腫;DRSS,糖尿病視網膜病變嚴重程度量表;DME,糖尿病黃斑水腫
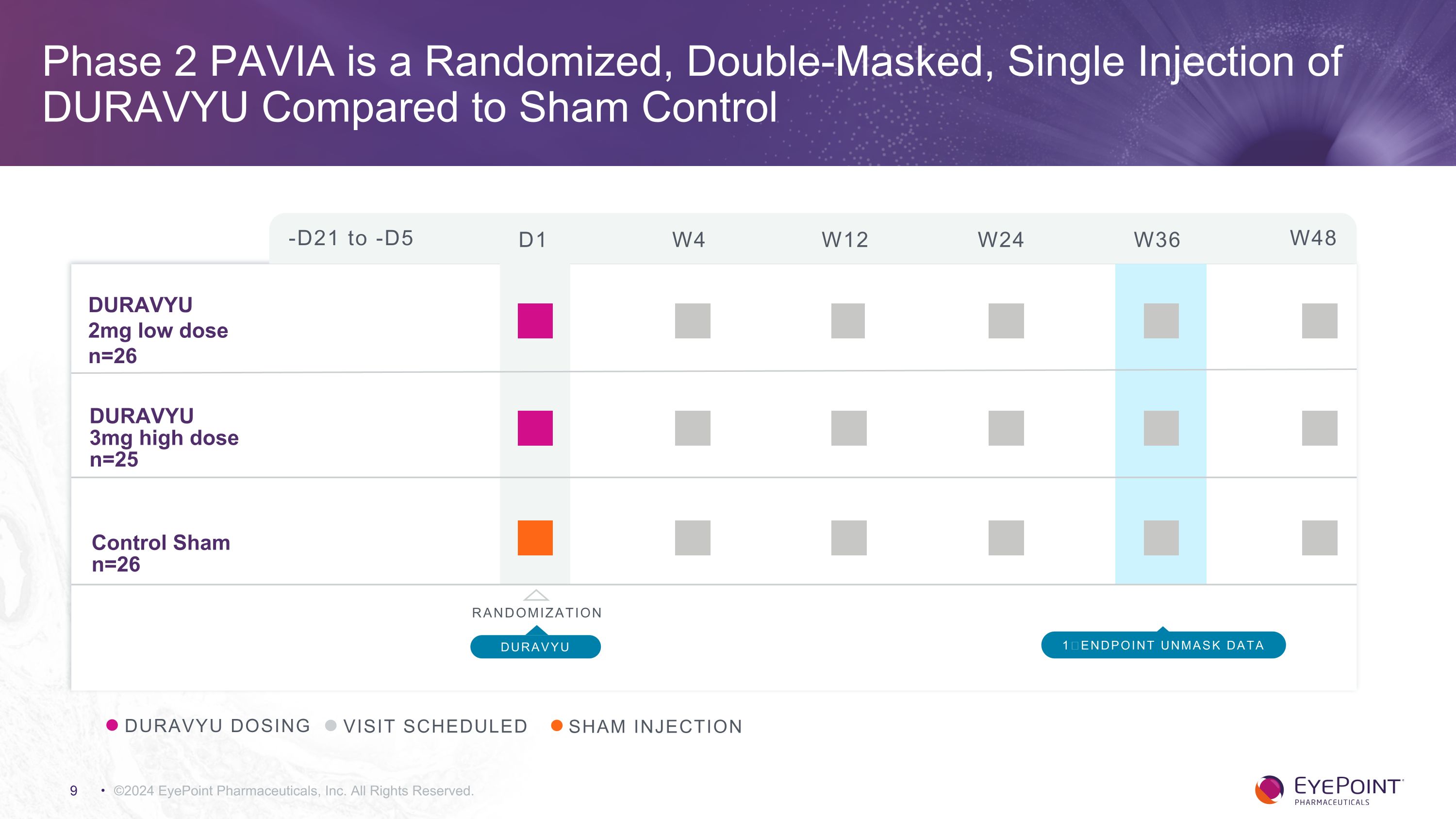
©2024 EyePoint 製藥公司版權所有DURAVYU 給藥就診預定假體注射-D21 至-D5 D1 W4 W12 W24 W36 W48 DURAVYU 2mg 低劑量 n=26 DURAVYU 3mg 高劑量 n=25 對照組 n=26 隨機化 DURAVYU 1終點取消掩碼數據第 2 階段 PAVIA 是 DURAVYU 與假對照組相比,DURAVYU 是隨機、雙面罩、單次注射的 DURAVYU
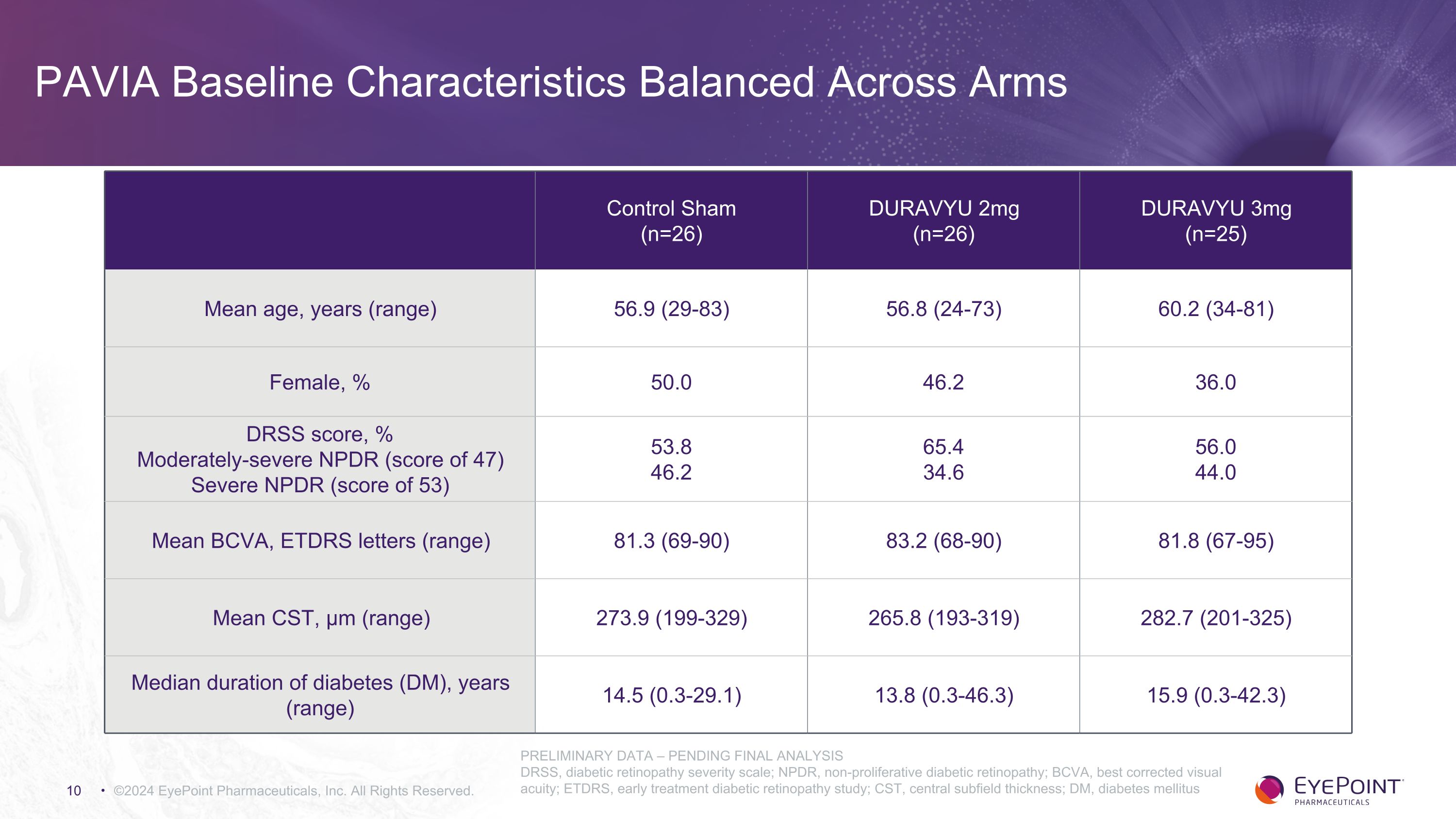
PAVIA 基線特性在兩臂之間保持平衡 ©2024 EyePoint 製藥公司版權所有。Control Sham (n=26) DURAVYU 2mg (n=26) DURAVYU 3mg (n=25) 平均年齡、年齡(範圍)56.9 (29-83) 56.8 (24-73) 60.2 (34-81) 女性,% 50.0 46.2 36.0 DRSS 分數,% 中度重度 NPDR(47 分)嚴重 NPDR(53 分)53.8 46.2 65.4 34.6 56.0 44.0 平均值 BCVA,ETDRS 字母(範圍)81.3(69-90)83.2(68-90)81.8(67-95)平均值 CST,μm(範圍)273.9(199-329)265.8(193-319)282.7(201-325)糖尿病中位持續時間(DM),年(範圍)14.5(0.3-29.1)13.8(0.3-46.3) 15.9 (0.3-42.3) 初步數據 — 待最終分析 DRSS,糖尿病視網膜病變嚴重程度量表;NPDR,非增殖性糖尿病視網膜病變;BCVA,最佳矯正視力;ETDRS,早期治療糖尿病視網膜病變研究;CST,中心亞場厚度;DM,糖尿病
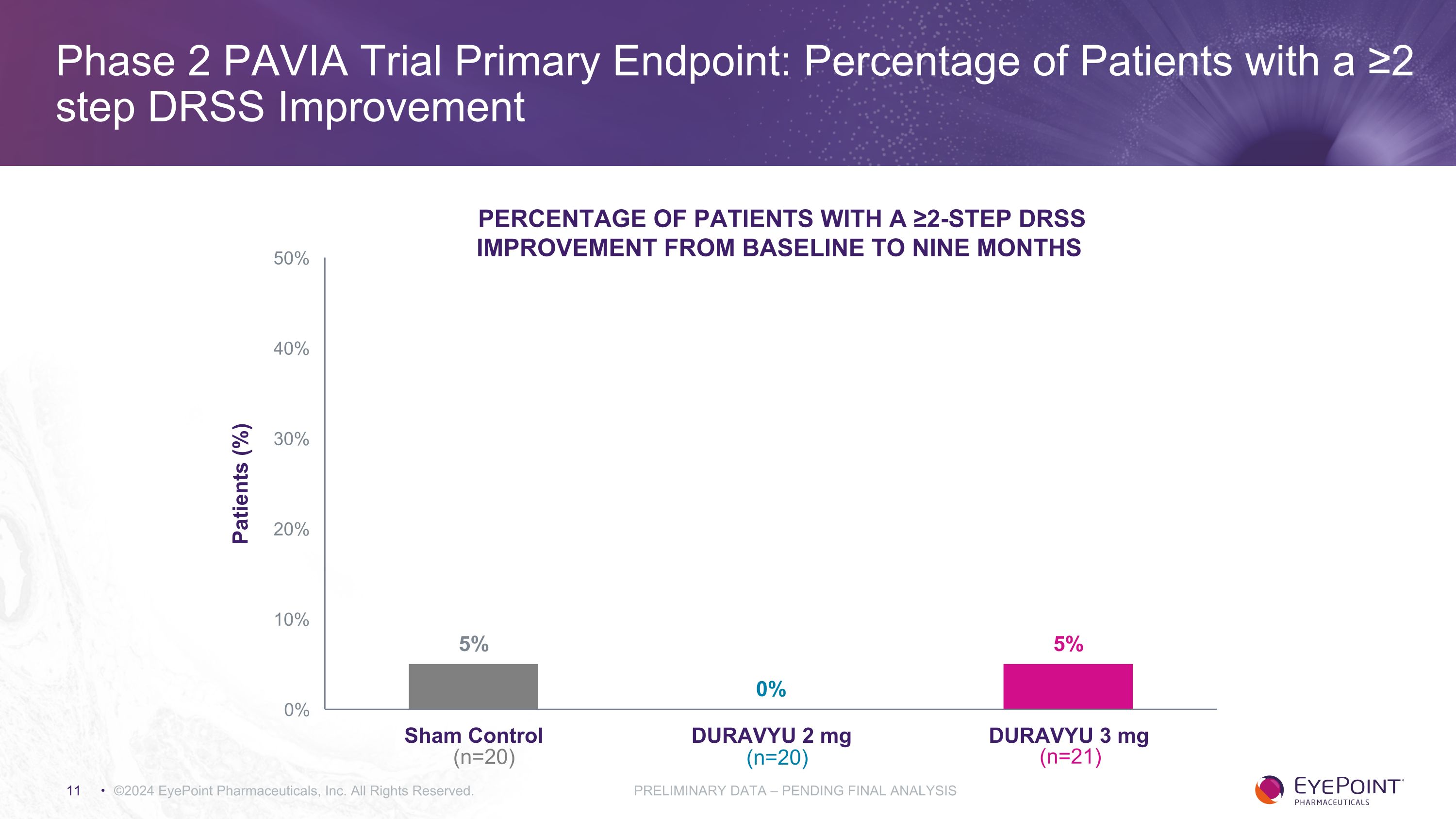
第二階段 PAVIA 試驗主要終點:DRSS 改善 ≥2 步的患者百分比 ©2024 EyePoint Pharmicals, Inc. 版權所有。初步數據 — 待最終分析 DRSS 從基線改善至九個月患者百分比 (%) (n=20) (n=20) (n=20) (n=20) (n=20) (n=21)
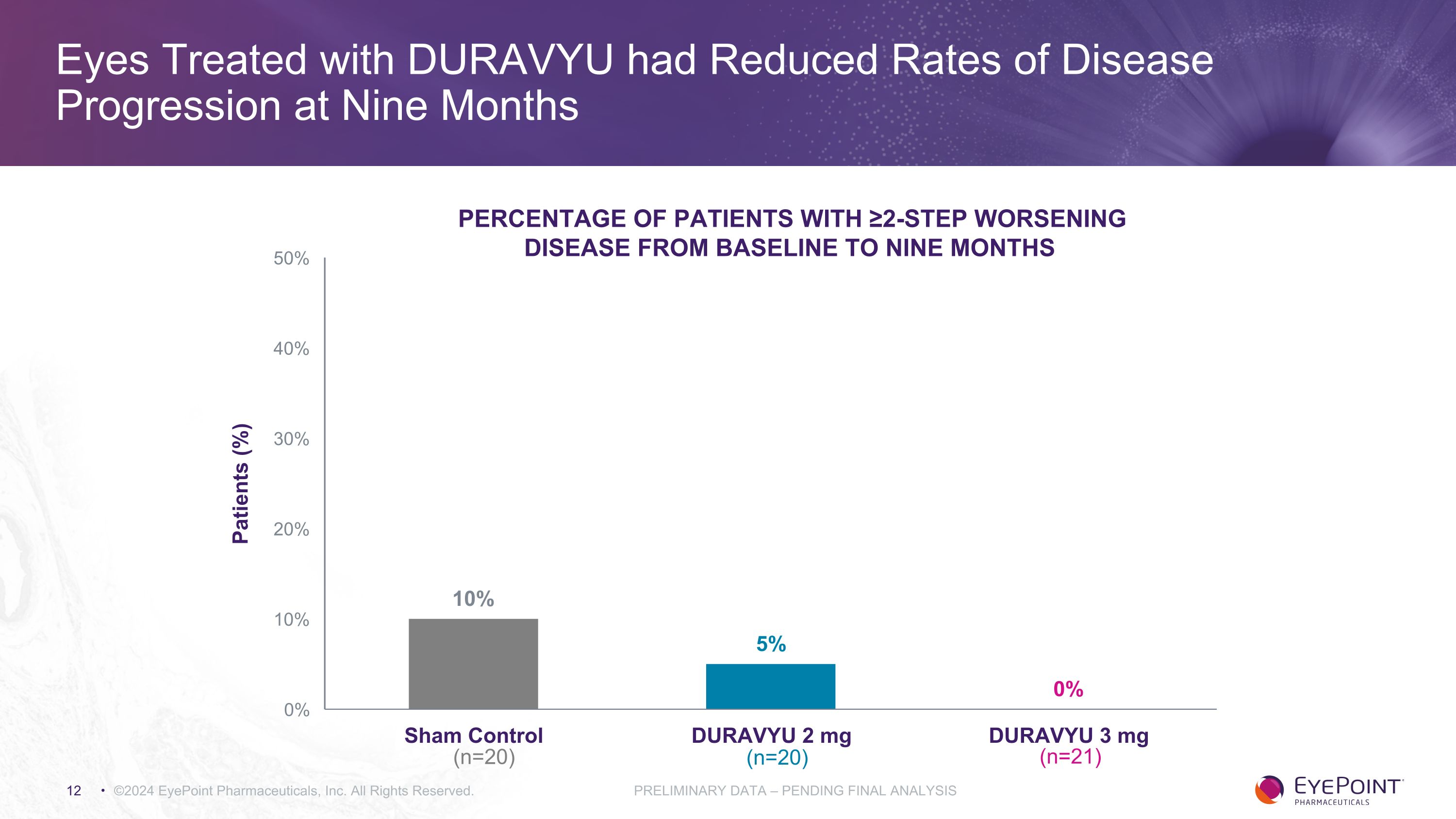
使用DURAVYU治療的眼部在九個月內降低了疾病進展率 ©2024 EyePoint Pharmicals, Inc. 版權所有。初步數據 — 待最終分析患者從基線到九個月的病情惡化患者百分比 (%) (n=20) (n=20) (n=20) (n=20) (n=21)
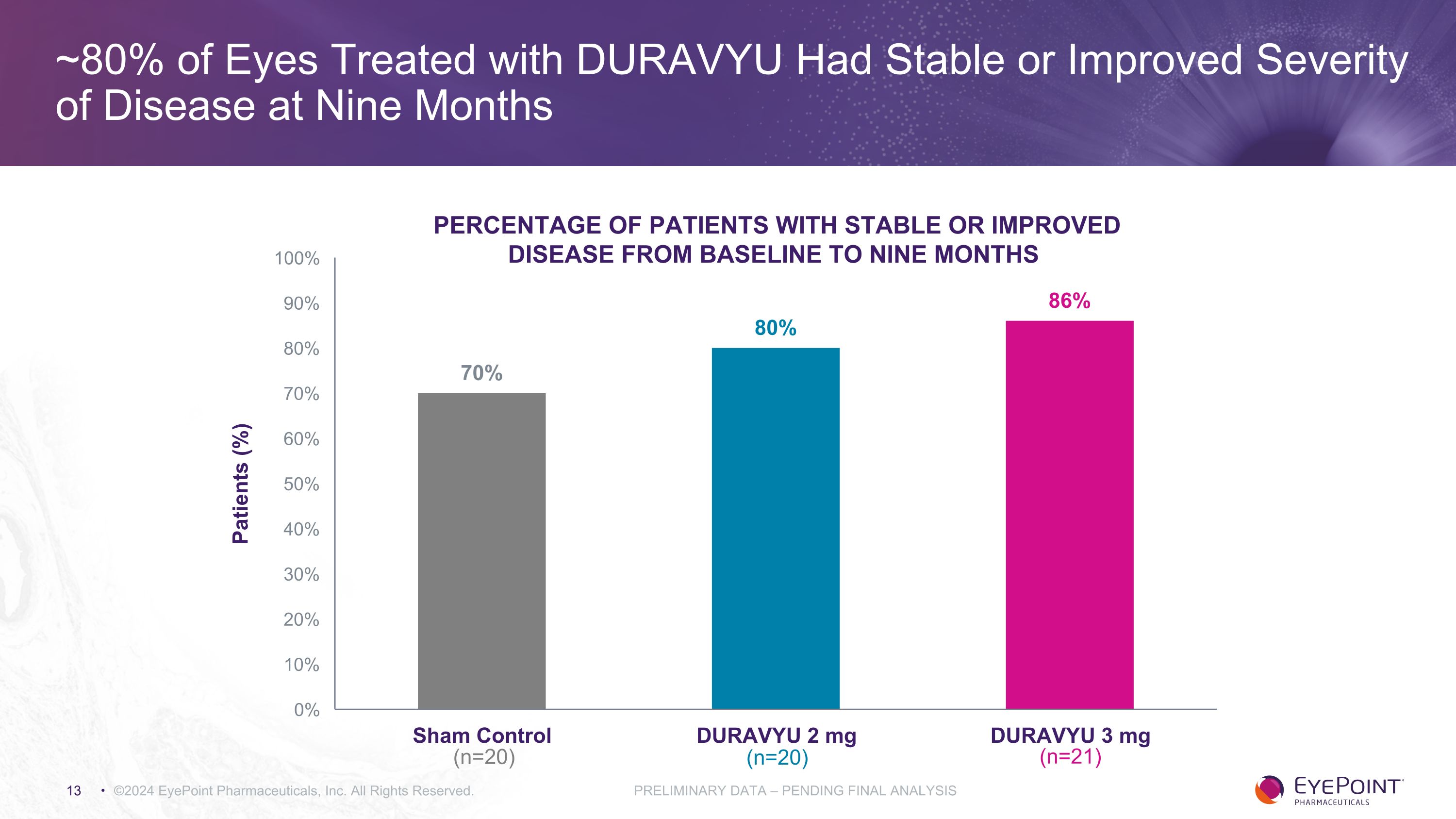
在接受DURAVYU治療的眼睛中,約有80%的眼睛在九個月後病情嚴重程度穩定或有所改善 ©2024 EyePoint Pharmicals, Inc. 版權所有初步數據 — 待最終分析從基線到九個月患者的病情穩定或改善的百分比 (%) (n=20) (n=20) (n=20) (n=21)
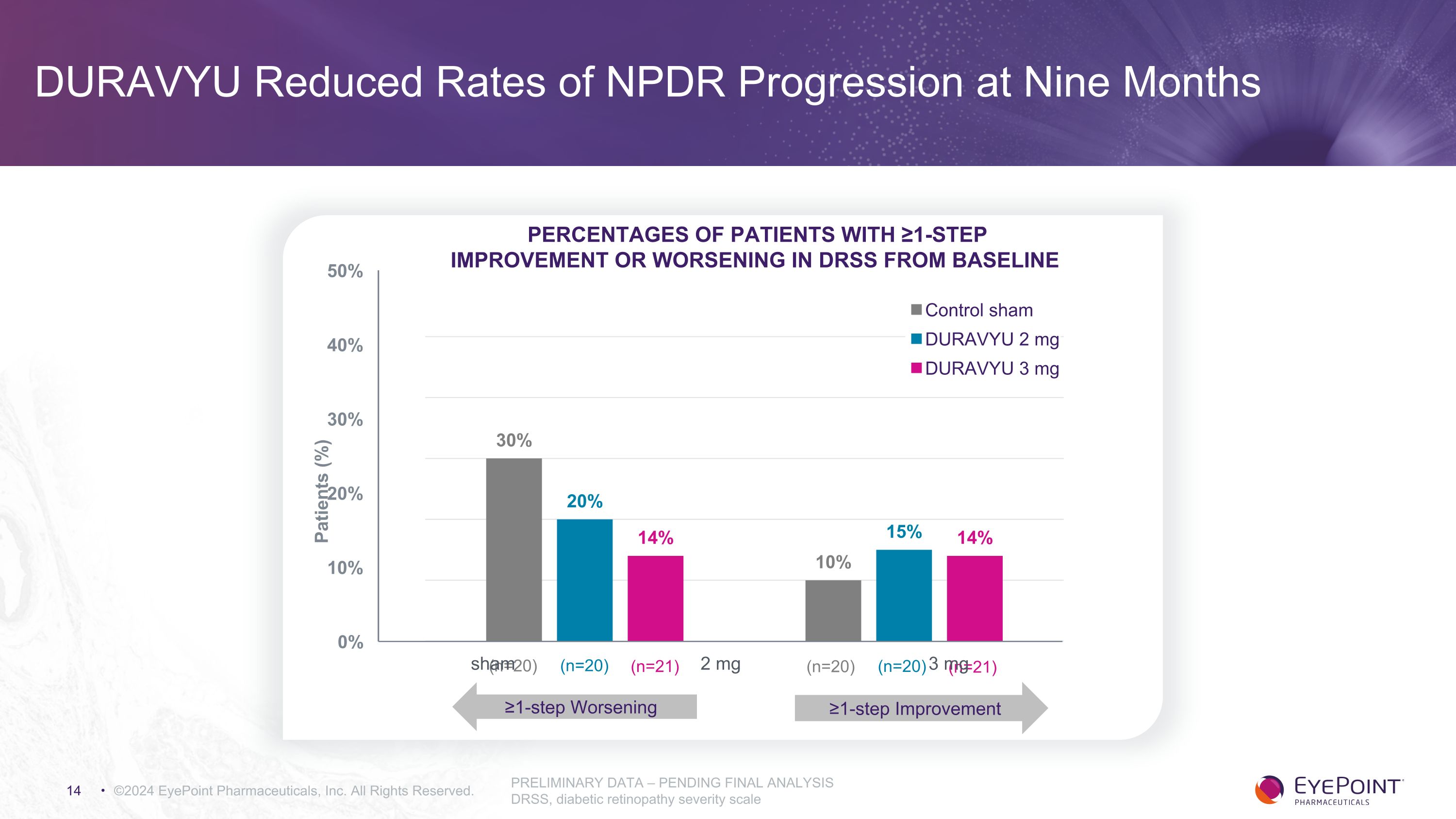
DURAVYU 將 NPDR 進展率降低了九個月 ©2024 EyePoint Pharmicals, Inc. 版權所有。初步數據 — 待最終分析 DRSS,糖尿病視網膜病變嚴重程度表基線患者中 DRSS 改善≥一步或惡化的患者百分比 (%) ≥1 步改善 ≥1 步惡化 (n=20) (n=20) (n=21) (n=20) (n=20) (n=21) (n=21) (n=21)

DURAVYU 在 PAVIA 第 2 期試驗中表現出良好的安全性 ©2024 EyePoint Pharmicals, Inc. 版權所有。截至2024年4月25日的數據 SAE,嚴重不良事件初步數據——待最終分析未報告藥物相關眼部SAE 研究眼中出現兩例眼部SAE,研究人員認為與藥物無關:假對照組中NPDR轉化為PDR在DURAVYU 2mg組給藥八週後出血性玻璃體後脱離(PVD)未報告藥物相關係統性SAE無病例 of:將遷移插入前房眼內炎視網膜血管炎(閉塞性或非閉塞性)患者停藥率低至第 36 周,與 DURAVYU 治療無關

PAVIA的2期臨牀試驗顯示出生物學效應和良好的安全性和耐受性 ©2024 EyePoint Pharmicals, Inc. 版權所有。初步數據 — 待最終分析 SAE,嚴重不良事件;TEAE,治療緊急不良事件療效安全性 DURAVYU 表現出穩定或改善的疾病嚴重程度,9 個月時 NPDR 進展率降低,3mg 組中有 86% 的患者和 2mg 組中 80% 的患者在九個月時表現出穩定或改善,而對照組為 70% 的患者在 3mg 組中,0% 的患者和 2mg 組的 5% 的患者在 2mg 組中出現病情穩定或改善九個月的步數對比對照組為 10% 接受DURAVYU治療的參與者的比例相似以及假注射在九個月內使DRSS評分提高了≥2步持續保持良好的安全性和耐受性,沒有與藥物相關的眼部或全身性SAE。總體而言,DURAVYU和對照組的眼部TEAE的發生率相當。未觀察到眼內炎或視網膜血管炎(閉塞性或非閉塞性)病例。研究人員認為與藥物無關。發病率直至第 36 周,與 DURAVYU 治療無關

DURAVYU 在 NPDRPAVIA 二期臨牀試驗結果中,2024 年 5 月 6 日 ©2024 年 EyePoint Pharmicals, Inc. 版權所有美國食品藥品管理局有條件地接受 DURAVYU 作為 EYP-1901 的專有名稱。DURAVYU是一種研究產品;它尚未獲得美國食品藥品管理局的批准。FDA的批准和潛在批准的時間表尚不確定。