
2024 年 5 月 ZYNLONTA R/R MZL 第二階段 IIT 初始數據展覽 99.2

2 前瞻性陳述本演示文稿及任何隨附的口頭陳述由ADC Therapeutics SA(“ADC Therapeutics”、“我們” 或 “我們”)編寫,僅供參考,不用於任何其他目的。本演示文稿中包含的任何內容都不是,也不應被解釋為主講人或ADC Therapeutics或ADC Therapeutics的任何高管、董事、員工、代理人或顧問的建議、承諾或陳述。本演示文稿並不旨在包羅萬象,也不包含您可能想要的所有信息。本演示和任何隨附的口頭陳述中提供的信息僅適用於截至本文發佈之日。本演示文稿包含1995年《私人證券訴訟改革法》安全港條款所指的前瞻性陳述。在某些情況下,您可以通過諸如 “可能”、“假設”、“將”、“應該”、“將”、“期望”、“打算”、“計劃”、“預期”、“相信”、“估計”、“預測”、“潛在”、“看起來”、“尋找”、“未來”、“繼續” 或 “出現” 等術語來識別前瞻性陳述,儘管如此並非所有前瞻性陳述都包含這些識別詞。前瞻性陳述受某些風險和不確定性的影響,這些風險和不確定性可能導致實際結果與所描述的結果存在重大差異。可能導致這種差異的因素包括但不限於:邁阿密大學研究人員啟動的r/r MZL試驗的未來時間和結果,以及獲得監管部門批准或納入NCCN概要的能力,我們對MZL市場機會的估計,公司更新後的公司戰略的成功;2025年第四季度初的預期現金流,新的商業進入市場戰略的有效性,來自新技術的競爭,該公司在美國增長 ZYNLONTA® 收入的能力各州;瑞典Orphan Biovitrum AB(Sobi®)有能力在歐洲經濟區成功實現ZYNLONTA® 商業化,市場接受度、充足的報銷範圍和未來收入;國家藥監局批准了Overland ADCT BioPharma提交的中國ZYNLONTA® 的BLA以及來自該產品的未來收入,我們的戰略合作伙伴,包括三菱田邊製藥公司,有能力獲得監管部門的批准外國司法管轄區的 ZYNLONTA®,以及未來從這些司法管轄區向我們支付的收入和付款的時間和金額合作伙伴關係;公司或其合作伙伴的研發項目或臨牀試驗的時間和結果,包括LOTIS 5和7、ADCT 601和602以及佛羅裏達州和MZL的IIT,以及對具有不同靶標、連接劑和有效載荷的某些實體瘤的早期研究;公司產品或候選產品的監管申報的時間和結果;美國食品和藥物管理局或外國監管機構的行動;預計收入和支出;公司的進行業務發展或研究合作交易的能力;公司的債務,包括醫療保健特許權使用費管理以及Blue Owl和Oaktree設施,以及此類債務對公司活動施加的限制、遵守各種協議條款和償還此類債務的能力以及償還此類債務所需的大量現金;以及公司為其研究、開發、臨牀和商業活動獲得財務和其他資源的能力。有關這些因素和其他可能導致實際業績與前瞻性陳述中預期存在重大差異的因素的更多信息載於公司10-K表和10-Q表年度報告的 “風險因素” 部分以及公司向美國證券交易委員會提交的其他定期和當前報告和文件中。這些陳述涉及已知和未知的風險、不確定性和其他因素,這些因素可能導致實際業績、業績、成就或前景與此類前瞻性陳述中表達或暗示的任何未來業績、業績、成就或前景存在重大差異。公司提醒投資者不要過分依賴本文件中包含的前瞻性陳述。前瞻性陳述基於我們管理層的信念和假設以及管理層目前可獲得的信息。無法保證將來會取得這樣的結果。本演示文稿中包含的此類前瞻性陳述僅代表截至本次演講之日。除非適用法律要求,否則公司明確表示不承擔任何義務或承諾更新本演示文稿中包含的這些前瞻性陳述以反映我們預期的任何變化或此類陳述所依據的事件、條件或情況的任何變化。對任何此類前瞻性陳述的準確性不作任何陳述或保證(明示或暗示)。本演示文稿中包含的某些信息涉及或基於研究、出版物、調查和其他來自第三方來源的數據以及我們自己的內部估計和研究。儘管我們認為截至本演示文稿之日這些第三方來源是可靠的,但我們尚未獨立核實,對於從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性,我們也沒有做出任何陳述。此外,本演示文稿中包含的所有市場數據都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。最後,儘管我們認為自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。

3 據估計 3 — 4 K 2L+ MZL 患者在 US1 接受藥物治療;儘管患者取得了持久的反應,但
仍有大量未得到滿足的醫療需求

4 MZL 市場概述和 ZYNLONTA 研究來源:1.Clarivate DRG(2022年)、《全球數據》(2017年)、Cerner Enviza CancerMpact(2023);2.NCCN指南;3.MAGNOLIA:ph2,r/r MZL 中的單臂,增強:ph3,在 r/r inHL 中隨機分配 R2 與 R,GADOLIA:ph3 隨機分配 benda vs benda + obin 在 r/r inHL 中,ACE-LY-003:ph2,第 2 部分(r/r MZL 隊列)的第 3 部分 ph1b/2 單獨或聯合用於 B 細胞 NHL; 4.Alderuccio 等人,J Clin Oncol(2018),Alderuccio 等人,Am J Hematol(2019)。MZL 治療和市場概述據估計 3 — 4 K r/r MZL 患者1 每年接受全身性抗癌方案治療 NCCN 的首選藥物除了 2L+2 CR 率的 BTKI 外,還包括所有線路的抗CD20治療方案,對於2L+2 CR 率適中,對於 FDA 批准和 NCCN 首選藥物(即

5 3L+ 當前的 MZL 治療格局 LoT:治療線。資料來源:1.Clarivate DRG(2022年)、《全球數據》(2017年)、Cerner Enviza CancerMpact(2023);2.NCCN 指南。LoT/流行病學1 治療範例2 基於抗 CD20 的方案 BTKI 基於抗 CD20 的方案 BTKI 基於抗 CD20 的方案 T 細胞介導療法 (AXI-cel) 抗CD20 的方案 BTKI 每年接受治療的患者數量 0.8 — 1.3 K 2L 每年接受治療的患者數量 2.2 — 3.2 K 1L 每年接受治療的患者數量 5.5 — 6.5 K 關注領域
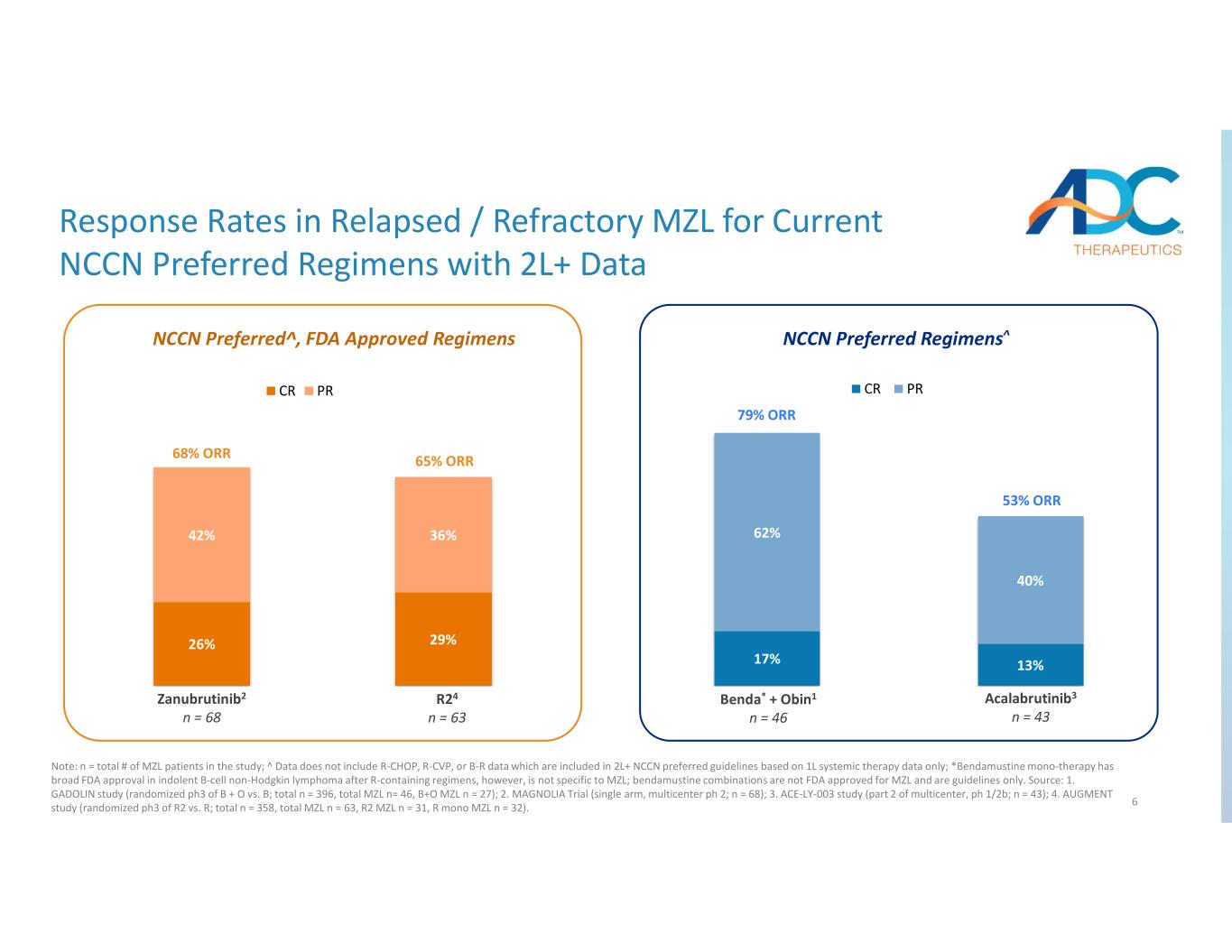
6 17% 13% 62% 40% Benda + Obin1* n=46 Acalabrutinib4 n=43 CR PR 26% 29% 42% 36% Zanubrutinib2 n=68 R25 n=63 CR PR NCCN 優先方案^ 68% ORR 65% ORR 53% ORR Zanu r tinib2 n 68 24 n 63 n be * + Obin1 n 46 Acalabrutinib3 n 43 n 43 當前 NCCN 首選方案 2L+ 的復發/難治性 MZL 的反應率注:n = 研究中 MZL 患者總數;^ 數據不包括僅基於 1L 全身治療數據的 2L+ NCCN 首選指南中包含的 R-CHOP、R-CVP 或 B-R 數據;*苯達莫司汀單一療法在含R的治療方案後的惰性B細胞非霍奇金淋巴瘤中獲得了美國食品藥品管理局的廣泛批准,但它並不特定於MZL;苯達莫司汀組合未獲美國食品藥品管理局批准用於MZL,僅是指導方針。來源:1.GADOLIN 研究(B + O 與 B 的隨機 ph3;總計 n = 396,總計 MZL n= 46,B+O MZL n = 27);2.MAGNOLIA 試驗(單臂,多中心 ph 2;n = 68);3.ACE-LY-003 研究(多中心第 2 部分,ph 1/2b;n = 43);4.AUGMENT 研究(R2 與 R 的隨機 ph3;總計 n = 358,總計 MZL n = 63,R2 MZL n = 31,R mono MZL n = 32)。

7 評估隆卡妥昔單抗在復發/難治MZL中的安全性和有效性的第二階段,開放標籤,研究來源:1。UTX-TGR-205 研究(兩個單臂隊列;總計 n = 710,總計 MZL n = 69)。臨牀設計 R/R MZL 先前使用過 ≥ 1 系全身療法 Loncastuximab 150 μg/kg(第 1 天,+/-3 天)CT/MRI 或 FDG-PET/CT 基於 PET 耐受性 Loncastuximab 75 μg/kg(第 1 天 +/3 q 21 天)CT/MRI 或 FDG-PET/CT 骨髓 CT/MRI 或 FDG-PET/CT 基於篩查週期 1 — 2 週期 3 — 6 30 天的 PET 耐受度的 CT 研究結束/隨訪通過影像學確認 CR 沒有影像學研究概述原假設是 H0: P≤P0,備選假設是 Ha: P≥P1 最佳的 CR 率據報道,umbralisib在研究開始時使用單一藥物復發MZL——在接受治療的69名患者中為16%1。根據這一估計,在原假設下,我們假設CR率(P)為16%(P0)預計CR率將增加15%,導致CR率達到31%或更高。因此,根據替代假設,擬議治療的CR率為31%(P1)一項針對50名在先前進行全身治療(clinicaltrials.gov ID:NCT05296070)後復發/難治MZL患者的多機構研究(clinicaltrials.gov ID:)目前正在註冊2個站點,擴大到5個地點20名患者的徒勞性分析研究理由
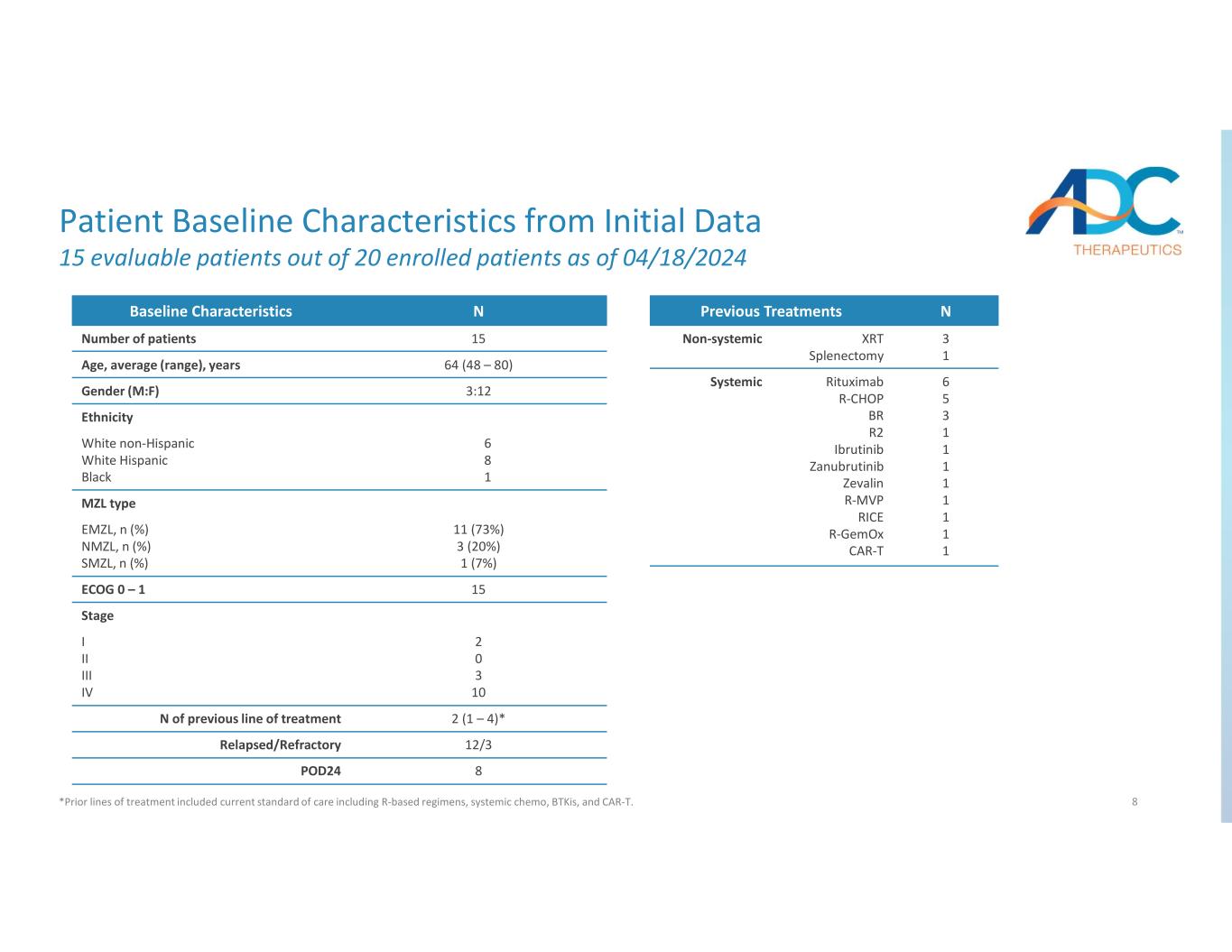
8 個患者基線特徵截至2024年4月18日,在20名入組患者中,有15名可評估的患者 *先前的治療路線包括當前的護理標準,包括基於R的治療方案、全身化療、BTKI和CAR-T。nBaseline 特徵 15 患者人數 64 (48 — 80) 年齡、平均值(範圍)、年齡 3:12 性別(男:F)種族 6 8 1 白人非西班牙裔白人西班牙裔黑人 MZL 11 型 (73%) 3 (20%) 1 (7%) EMZL、n (%) SMZL、n (%) 15ECOG 0 — 1 階段 2 0 3 10 I II II IV 2 (1) (1) — 4) *先前治療路線的 N 12/3復發/難治性 8POD24 n先前的治療 3 1 XRT 脾切除術非全身性 6 5 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 BR R2 依魯替尼 Zabrutinib Zavalin R-MVP RICE r-gemox CAR-T 系統性
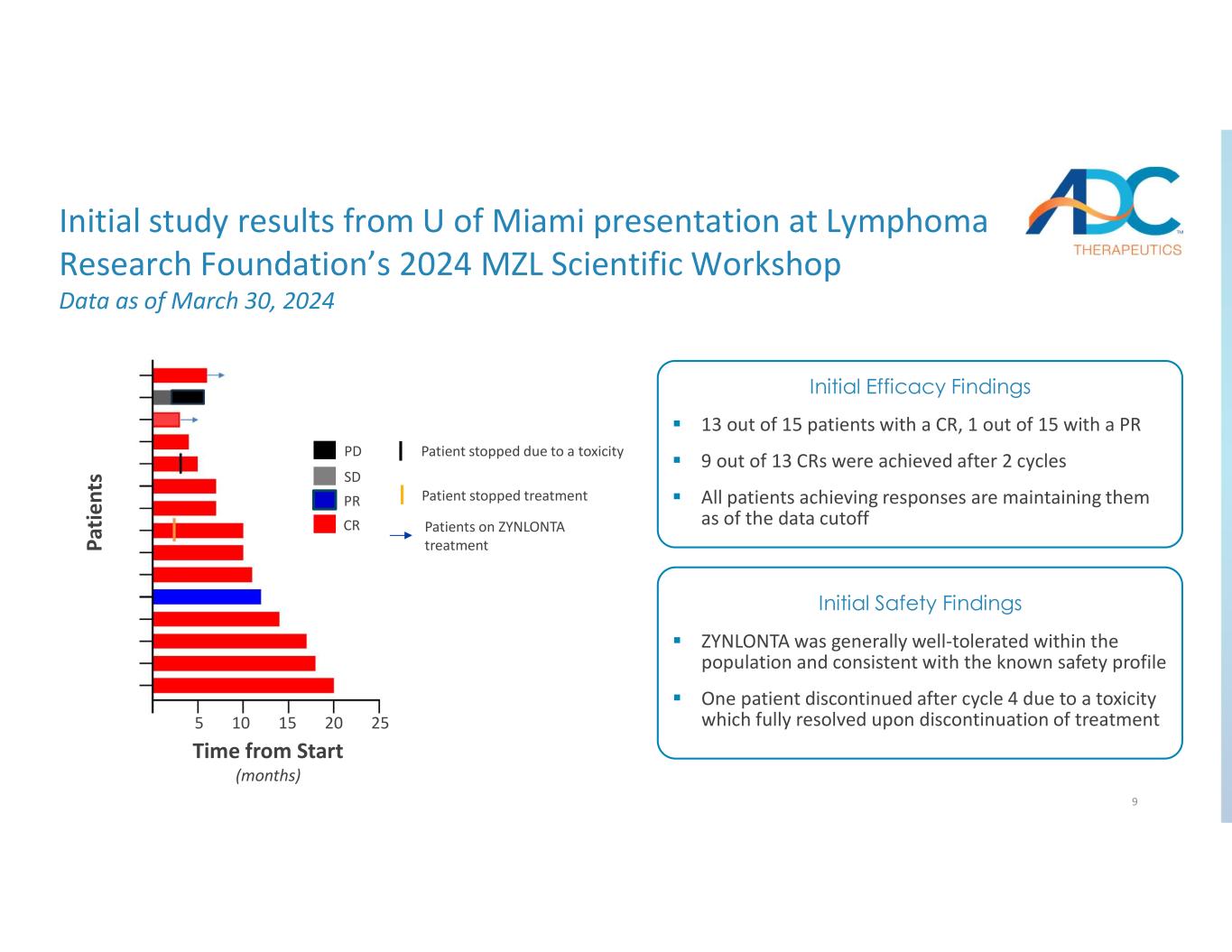
9 個 PR CR PD SD 患者接受了 ZYNLONTA 治療患者停止治療患者因毒性停止治療 15 名患者中有 13 名患有 CR,15 名患者中有 1 名 PR 13 個 CR 中有 9 個是在兩個週期後獲得的。所有獲得反應的患者截至數據截止日期均保持不變。初步療效發現 ZYNLONTA 在人羣中普遍耐受性良好,與已知的安全狀況一致。一名患者在第 4 週期後因毒性而停藥停止治療後完全解決初步安全性調查結果初步邁阿密大學在淋巴瘤研究基金會 2024 年 MZL 科學研討會上發表的研究結果截至 2024 年 3 月 30 日的數據 Pa time nt s 起始時間(月)5 10 15 20 25
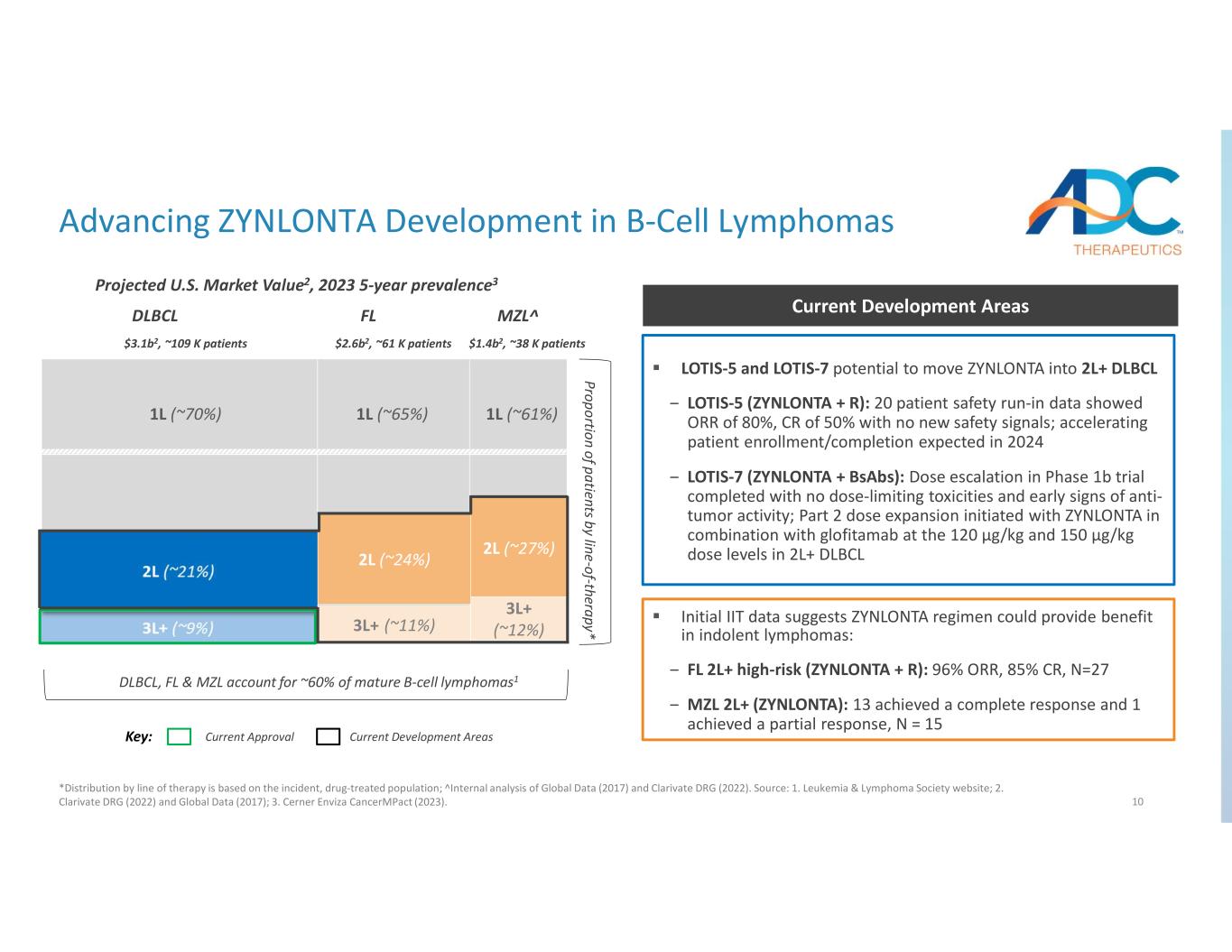
10 按療法劃分的患者比例* DLBCL、FL 和 MZL 佔成熟 B 細胞淋巴瘤的約 60% 1 1L (~ 70%) 1L (~ 65%) 1L (~ 61%) MZL^FLDLBCL 關鍵:當前批准推進ZYNLONTA在B細胞淋巴瘤中的開發領域*按療法分佈,按發病率、藥物治療人羣劃分;全球數據(2017 年)和 Clarivate DRG(2022年)的內部分析。資料來源:1.白血病和淋巴瘤協會網站;2.Clarivate DRG(2022年)和全球數據(2017年);3.Cerner Enviza CancermPact (2023)。2L (~ 24%) 2L (~ 27%) 3L+ (~ 12%) 預計美國市值2,2023 年 5 年流行率3 LOTIS-5 和 LOTIS-7 有可能使 ZYNLONTA 進入 2L+ DLBCL-LOTIS-5 (ZYNLONTA + R):20 名患者安全磨合數據顯示 ORR 為 80%,CR 為 50%,沒有新的安全信號;預計在 2024 年加快患者入組/完成速度 LOTIS-7(ZYNLONTA + BSABs):1b 期試驗的劑量遞增已完成,沒有劑量限制毒性和抗腫瘤活性的早期跡象;第 2 部分劑量擴展由ZYNLONTA啟動在 2L+ DLBCL 當前開發區聯合使用 120 µg/kg 和 150 µg/kg 劑量水平的 glofitamab 初步數據表明,ZYNLONTA 方案可以為惰性淋巴瘤帶來益處:− FL 2L+ 高風險(ZYNLONTA + R):96% ORR,85% CR,N=27 — MZL 2L+(ZYNLONTA):13 取得了完全的緩解和 1 人獲得部分緩解,N = 15 $3.1b2,~10.9 K 名患者 2.6b2,~61 K 名患者 1.4b2,約 38 K 名患者 1.4b2 美元,約 38 K 名患者
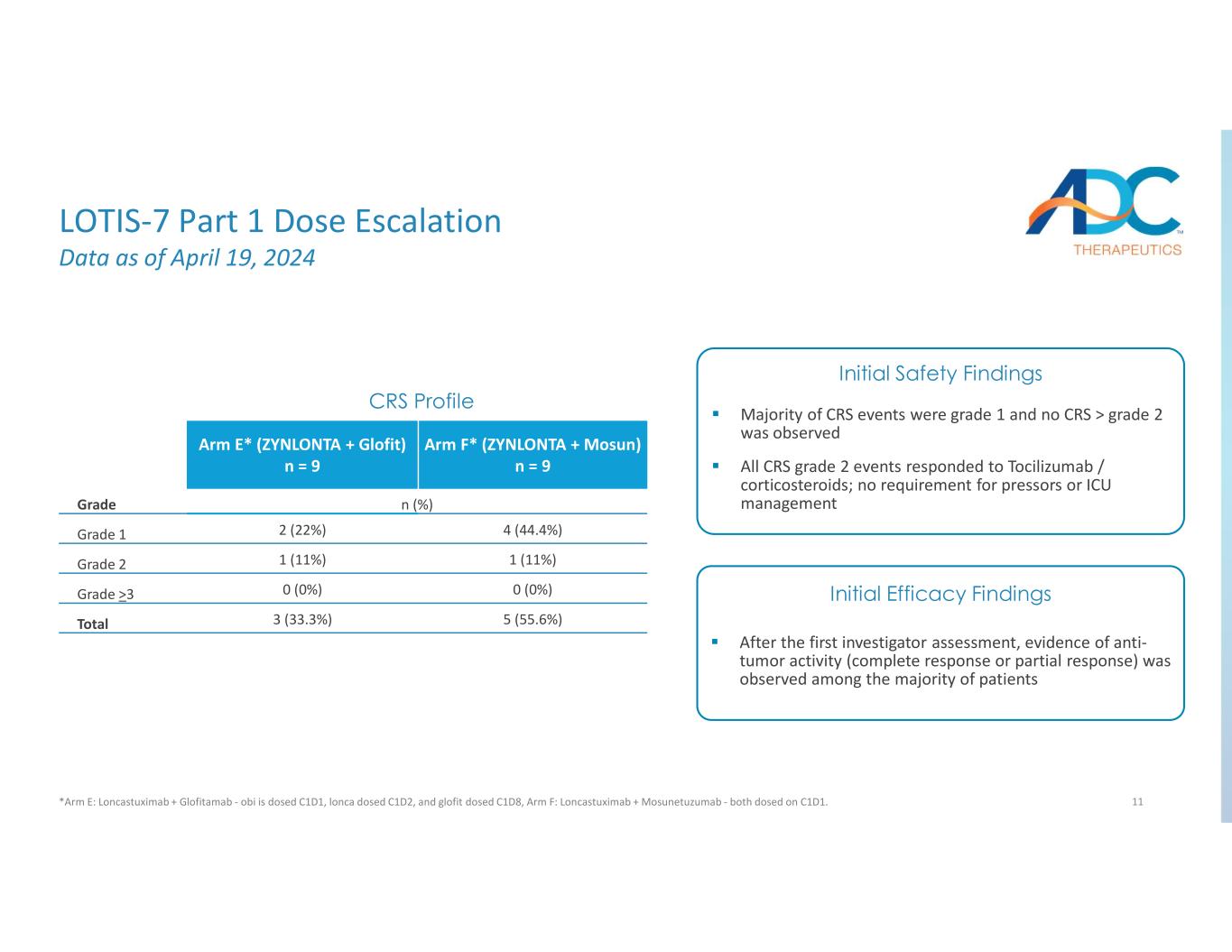
11 Arm F* (ZYNLONTA + Mosun) n = 9 Arm E* (ZYNLONTA + Glofit) n = 9 n (%) 4 級 (44.4%) 2 (22%) 1 (11%) 1 (11%) 2 級 0 (0%) 0%) >3 5 (55.6%) 3 (33.3%) CRS 總體概況首次評估後調查人員證據在大多數患者中觀察到抗腫瘤活性(完全反應或部分反應)大多數CRS事件為1級,未觀察到CRS >2級所有CRS 2級事件均對託珠單抗/皮質類固醇有反應;無需加壓劑或重症監護病房管理初步安全性發現初步療效調查結果 LOTIS-7 第 1 部分劑量遞增數據截至 2024 年 4 月 19 日 *Arm E:Loncastuximab + Glofitamab——obi 的劑量為 C1D1,lonca的劑量為 C1D2,glofit 的劑量為 C1D8,Arm F:Loncastuximab + Mosunetuzumab — 均在 C1D1 上給藥。
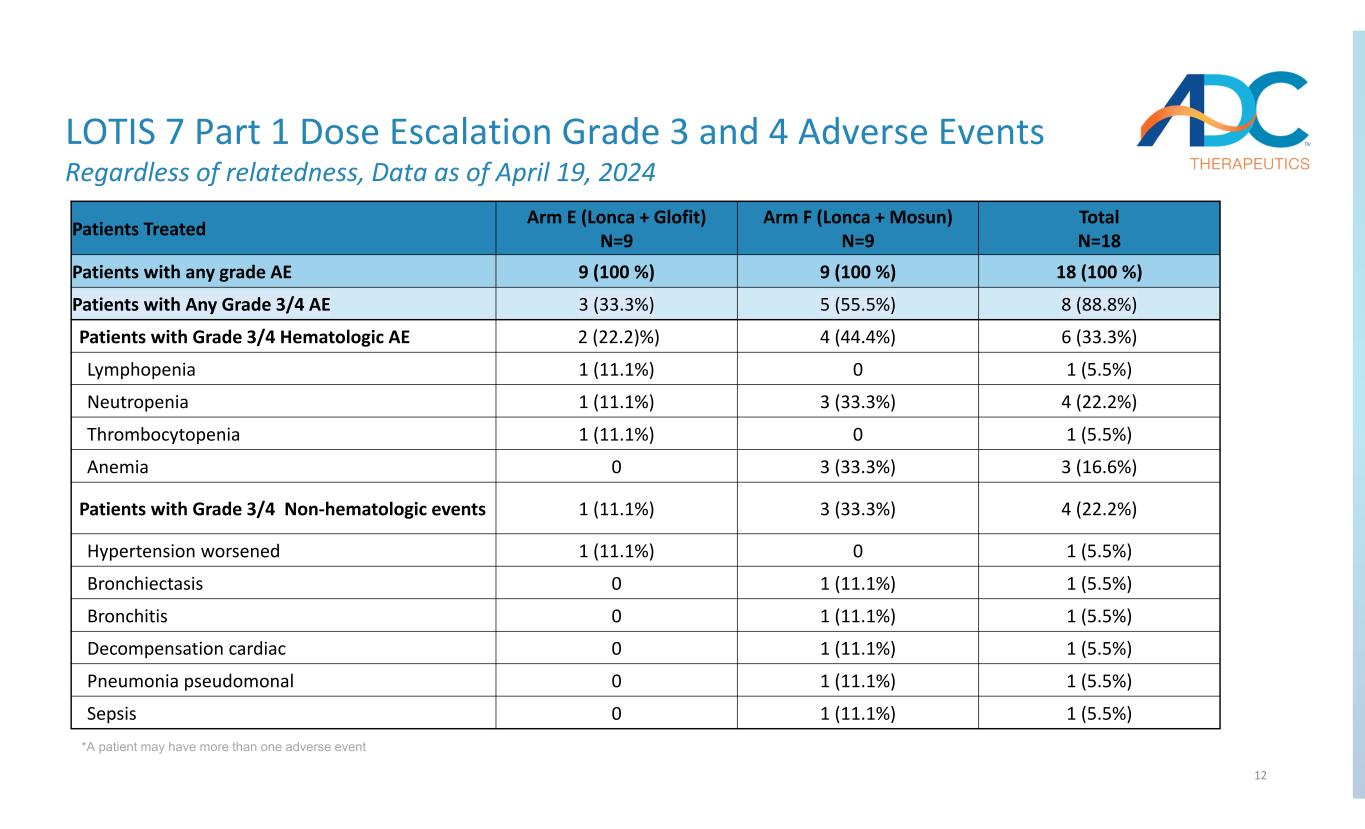
12 LOTIS 7 第 1 部分劑量遞增 3 級和 4 級不良事件無論相關性如何,數據截至 2024 年 4 月 19 日 *患者可能有多個不良事件總計 N=18 Arm F(Lonca + Mosun)N=9 組 E(Lonca + Glofit)N=9 接受治療的患者 18 (100%) 9 (100%) 任何等級 AE 8 (88.8%) 5 (55.5%) 3 (33.3%) 任何等級 3/4 的患者 AE 6 (33.3%) 4 (44.4%) 2 (22.2)%) 3/4 級血液學 AE 1 的患者 (5.5%) 01 (11.1%) 淋巴細胞減少症 4 (22.2%) 3 (33.3%) 1 (11.1%) 1 (11.1%) 中性粒細胞減少症 1 (5.5%) 01 (11.1%) 血小板減少症 3 (16.6%) 3 (33.3%) 0 貧血 4 (22.2%) 3(33.3%) 1 (11.1%) 有 3/4 級非血液學事件的患者 1 (5.5%) 01 (11.1%) 高血壓惡化 1 (5.5%) 1 (11.1%) 0 支氣管擴張 1 (5.5%) 1 (11.1%) 0 支氣管炎 1 (5.5%) 1 (11.1%) 0 肺炎假體 1 (5.5%) 1 (11.1%) 0 肺炎假單元 1 (5.1%) 0 5.5%) 1 (11.1%) 0 敗血癥
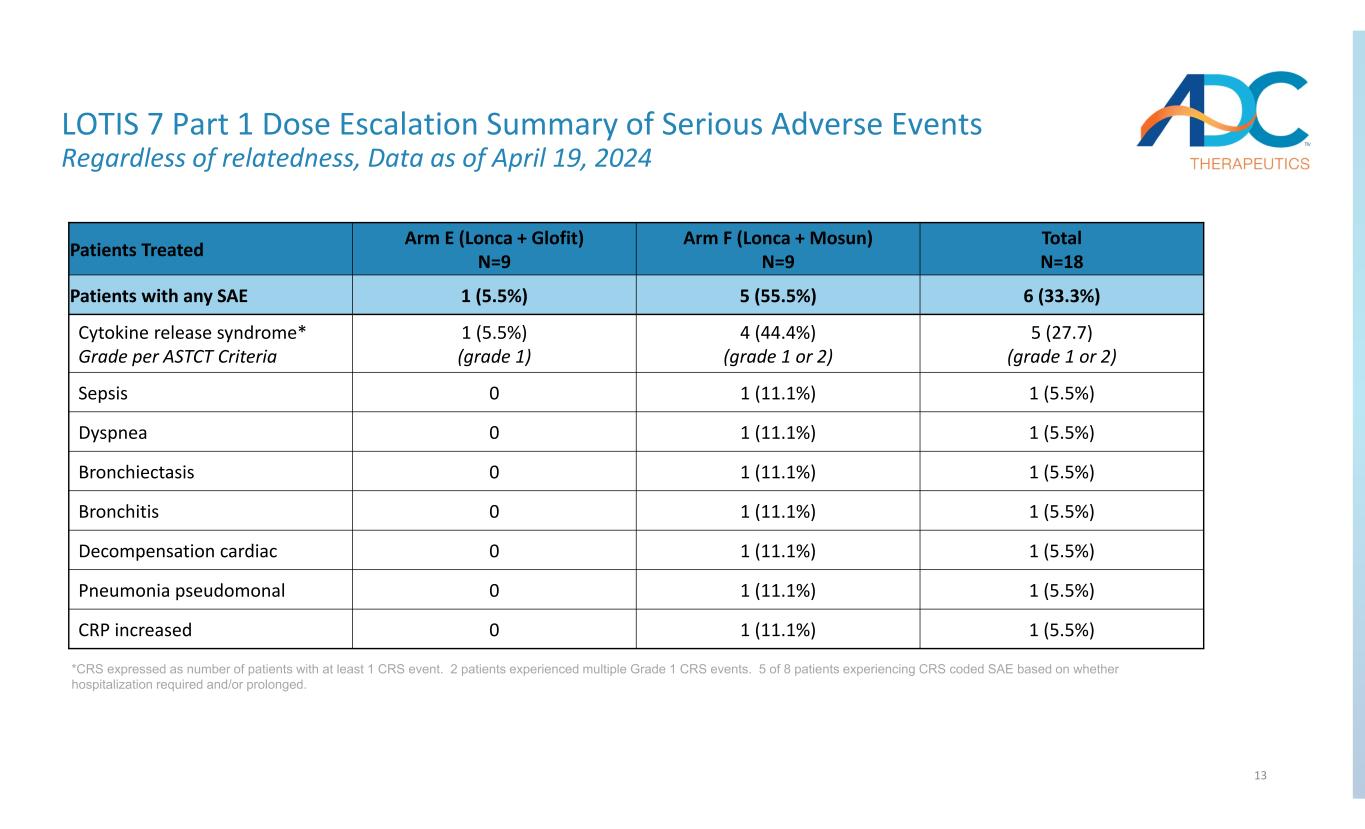
13 LOTIS 7 第 1 部分嚴重不良事件劑量遞增摘要無論相關性如何,截至2024年4月19日的數據 *CRS 表示為至少發生 1 次 CRS 事件的患者人數。2 名患者經歷了多次 1 級 CRS 事件。根據是否需要和/或延長住院,8 名患者中有 5 名出現了 CRS 編碼 SAE 的患者。總數 N=18 組 F (Lonca + Mosun) N=9 組 E (Lonca + Glofit) N=9 接受治療的患者 6 (33.3%) 5 (55.5%) 1 (5.5%) 任何 SAE 5 (27.7)(1 級或 2 級)4(44.4%)(1 級或 2 級)1(5.5%)1(5.5%)細胞因子釋放綜合徵的患者* 按 ASTCT 評級標準 1 (5.5%) 1 (11.1%) 0 敗血癥 1 (5.5%) 1 (11.1%) 0 呼吸困難 1 (5.5%) 1 (11.1%) 0 支氣管擴張 1 (5.5%) 1 (11.1%) 0 支氣管炎 1 (5.5%) 1 (11.5%) 1 (11.5%) 0 肺炎假單胞菌 1 (5.5%) 1 (5.5%) 1 (11.5%) 1 (5.5%) 1 (11.5%) 1 11.1%) 0CRP 增加