
PROGRESS 患者投資者電話會議 2024 年 4 月 29 日附錄 99.1

2 前瞻性陳述本演示文稿包括這些幻燈片的任何印刷或電子副本、演講者的演講、任何演示和問答環節中傳達的信息,以及演示中或與演示文稿相關的任何文件或材料,包含適用證券法(包括經修訂的1995年私人證券訴訟改革法)所指的前瞻性陳述。這些陳述可以用 “可能”、“將”、“可能”、“應該”、“期望”、“計劃”、“預測”、“打算”、“相信”、“估計”、“預測”、“項目”、“潛力”、“繼續”、“目標” 等詞語或其他與X4的預期、戰略、業務、計劃或意圖相關的類似術語或表述來識別。前瞻性陳述包括但不限於暗示或明示的陳述,內容涉及X4對XOLREMDI開始計劃推出、上市和商業化的期望,XOLREMDI已在美國獲準用於12歲及以上的WHIM綜合徵患者;X4計劃在該指標中商業推出XOLREMDI,包括計劃通過PantherX Rare在美國商業上市;X4相信其已做好商業上市準備 XOLREMDI;XOLREMDI 在治療中的潛在益處 [A 或 B];WHIM綜合徵的潛在患者人數和XOLREMDI的潛在市場;完成商用藥品製造的預期時機;以及我們業務的使命和目標。本演示文稿中的任何前瞻性陳述均基於管理層當前的預期和信念。這些前瞻性陳述既不是對未來業績的承諾也不是保證,並且受到各種風險和不確定性的影響,其中許多風險和不確定性是X4無法控制的,這可能導致實際業績與這些前瞻性陳述中設想的結果存在重大差異,包括以下風險:X4在美國的XOLREMDI的推出和商業化努力可能不成功,X4可能無法在我們預期的水平或時機上創造收入在支持我們所需的水平或時機上目標;WHIM綜合徵患者人數、未滿足的額外治療選擇需求以及XOLREMDI的潛在市場可能比我們預期的要小得多;XOLREMDI可能無法達到我們預期的臨牀益處、臨牀用途或市場接受度,或者我們可能會遇到影響我們商業化工作成功的報銷相關或其他與市場相關的問題;我們可能在任何階段遇到XOLREMDI的不良事件,對商業化產生負面影響化;X4 建立和維持有效銷售的能力以及任何批准產品的營銷組織或合適的第三方替代品;作為一個組織,X4缺乏藥品銷售、營銷或分銷方面的經驗;X4的其他候選產品;X4可能探索XOLREMDI的更多機會和適應症;X4正在進行的XOLREMDI臨牀試驗的臨牀數據的預期可用性、內容和時機;臨牀試驗的臨牀試驗設計和註冊以及潛在的治療益處,包括當前的設計一種潛力評估XOLREMDI治療某些慢性中性粒細胞減少性疾病的3期臨牀試驗及其預計將於2024年上半年啟動;患者患病率;市場機會;以及X4的資本使用和其他財務業績,包括其財務狀況。由於許多因素,實際事件或結果可能與本演示文稿中包含的任何前瞻性陳述所表達或暗示的事件或結果存在重大差異,包括但不限於獲得和維持監管部門批准的風險,包括但不限於潛在的監管延遲或拒絕;臨牀前研究、臨牀試驗和臨牀開發的啟動和完成所固有的不確定性;試驗和研究可能延遲且可能無法產生令人滿意結果的風險;臨牀前研究或早期臨牀試驗的結果無法預測以後的臨牀試驗結果;臨牀試驗的初始或中期結果可能無法預測試驗最終結果或未來試驗結果的風險;測試或使用我們的產品和候選產品所產生的潛在不良安全影響;患者患病率、市場或機會估計可能不準確的風險;總體宏觀經濟和地緣政治狀況對X4業務的影響;與 X4 相關的風險籌集額外資金的能力;與對X4持續經營能力的重大懷疑相關的風險;預期或現有競爭的變化;監管環境的變化;如果獲得批准,與X4成功銷售mavorixafor的能力相關的風險;意外訴訟或其他爭議;與合作者結盟的需要可能會阻礙或延遲我們的開發和商業化努力或增加我們的成本;我們的業務可能會受到不利影響,我們的成本可能會受到不利影響如果我們的任何關鍵合作者未能做到這一點,則增加履行其義務或終止合作;我們正在進行和計劃中的活動所需的內部和外部成本以及由此對支出和現金使用的影響可能高於預期,這可能會導致我們比預期的更快地使用現金,或更改或縮減我們的部分計劃,或兩者兼而有之;以及其他風險和不確定性,包括X4向美國證券交易所提交的10-K表年度報告中題為 “風險因素” 的部分中描述的風險和不確定性委員會 (SEC) 於 2024 年 3 月 21 日以及 X4 提交的其他文件中不時與美國證券交易委員會合作。除非法律要求,否則X4沒有義務更新本演示文稿中包含的信息以反映新的事件或情況。本演示文稿中包含的某些信息涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據以及X4自己的內部估計和研究。儘管X4認為截至本演示文稿之日這些第三方來源是可靠的,但它尚未獨立核實,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性做出任何陳述。最後,儘管X4認為自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的驗證或驗證。X4 是各種商標、商品名稱和服務標誌的所有者。本演示文稿中出現的某些其他商標、商品名稱和服務標誌是第三方的財產。僅為方便起見,本演示文稿中提及的商標和商品名稱不帶有® 和 TM 符號,但此類提及不應被解釋為表明其各自所有者不會在適用法律的最大範圍內主張其相關權利。

歡迎和概述 Paula Ragan,博士,總裁兼首席執行官標籤亮點和支持臨牀數據 Christophe Arbet-Engels,醫學博士,首席醫學官商業發佈戰略與執行馬克·鮑德里,首席商務官結論和問答
4 X4:為罕見免疫疾病患者提供創新 2014 X4 成立,旨在推進針對罕見疾病患者的CxCR4靶向療法 2022 X4 宣佈馬沃裏沙福治療WHIM綜合徵的關鍵性全球性3期臨牀試驗取得積極成果 2023 美國食品藥品管理局接受馬沃裏沙福治療WHIM綜合徵的保密協議,批准2024年美國食品藥品管理局批准了XOLREMDITM(mavorixafor),這是第一個,也是唯一的 WHIM 綜合徵患者需要治療 CXCR4 = CXC 趨化因子受體 4;WHIM = 疣、低丙種球蛋白血癥、感染、骨髓病變

現已獲得 FDA 批准!(zôl-rm-dee)

6 終身影響2 慢性先天性疾病通常出現在兒童時期,中位診斷年齡為5.5歲,與普通人羣相比預期壽命較低3,4 由於敗血癥、不可逆器官損傷、複發性肺炎和某些癌症 WHIM 綜合徵是一種原發性免疫缺陷和慢性中性粒細胞減少性疾病1 超罕見人羣5 根據2019年、2020年的X4市場研究,估計美國至少有1,000人。異質表現2 最常見的特徵是:根據包括兒科(65%)和成人(35%)患者在內的66名WHIM綜合徵患者的國際隊列,只有不到四分之一的患者出現WHIM縮寫中的所有四種表現(疣、低丙種球蛋白血癥、感染和骨髓病變)。中性粒細胞減少(98%)反覆感染(92%)低丙種球蛋白血癥(65%)參考文獻:1.Dale DC、Firkin F、Bolyard AA 等人,Blood。2020;136 (26): 2994-3003。2.Geier CB、Ellison M、Cruz R 等人,J Clin Immunol。2022;42 (8): 1748-1765;3.Dotta L、Notarangelo L、Moratto D 等J Allergy Clin Immunol. 2019;7 (5): 1568-1577;4.Beaussant Cohen S、Fenneeau O、Plouvier E 等Orphanet J Rare Dis.2012;7:71;5.存檔的數據。X4 製藥公司,2024 年。疣(40%)
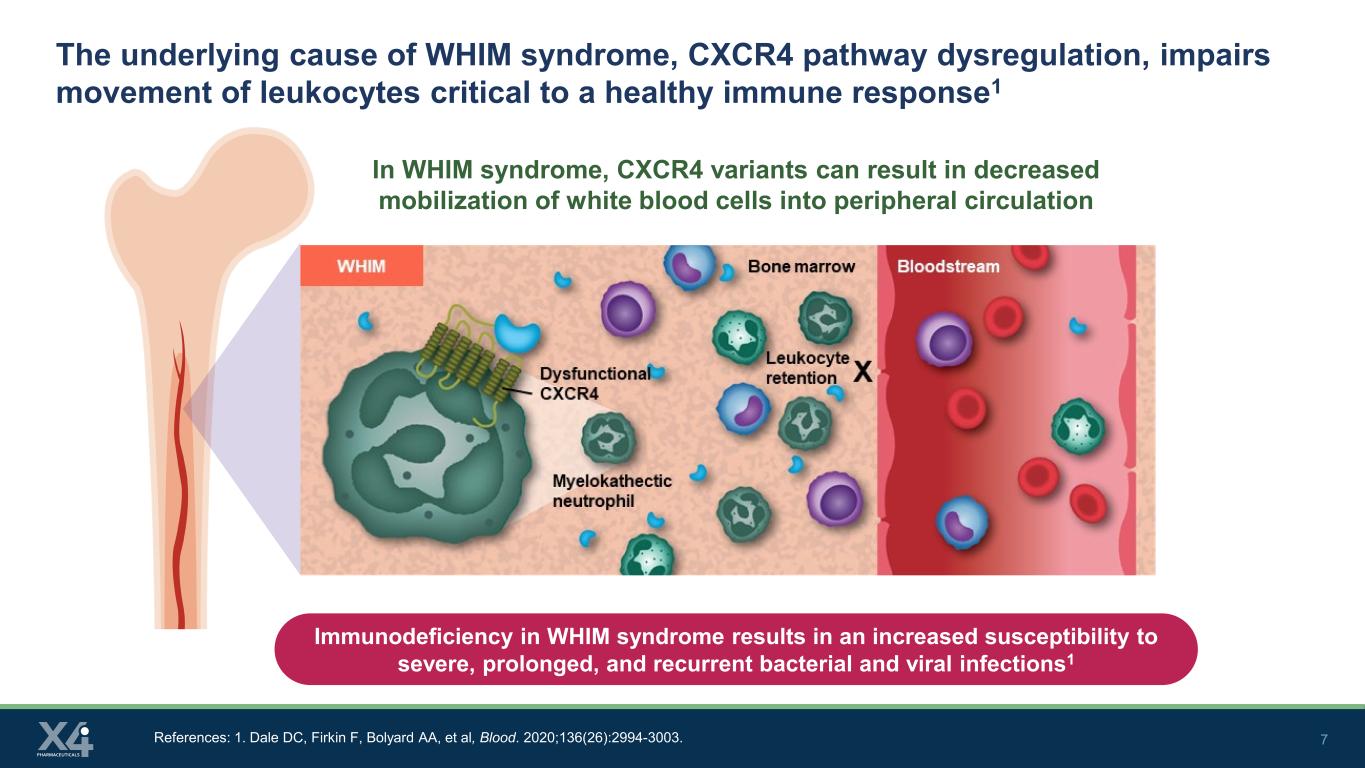
7 WHIM 綜合徵的根本原因,即 CXCR4 通路失調,會損害對健康免疫反應至關重要的白細胞的運動1 淋巴細胞在 WHIM 綜合徵中,CXCR4 變體可能導致白細胞在外周循環中的動員減少。參考文獻:1.Dale DC、Firkin F、Bolyard AA 等人,Blood。2020;136 (26): 2994-3003。WHIM 綜合徵中的免疫缺陷會增加對嚴重、長期和復發的細菌和病毒感染的易感性1
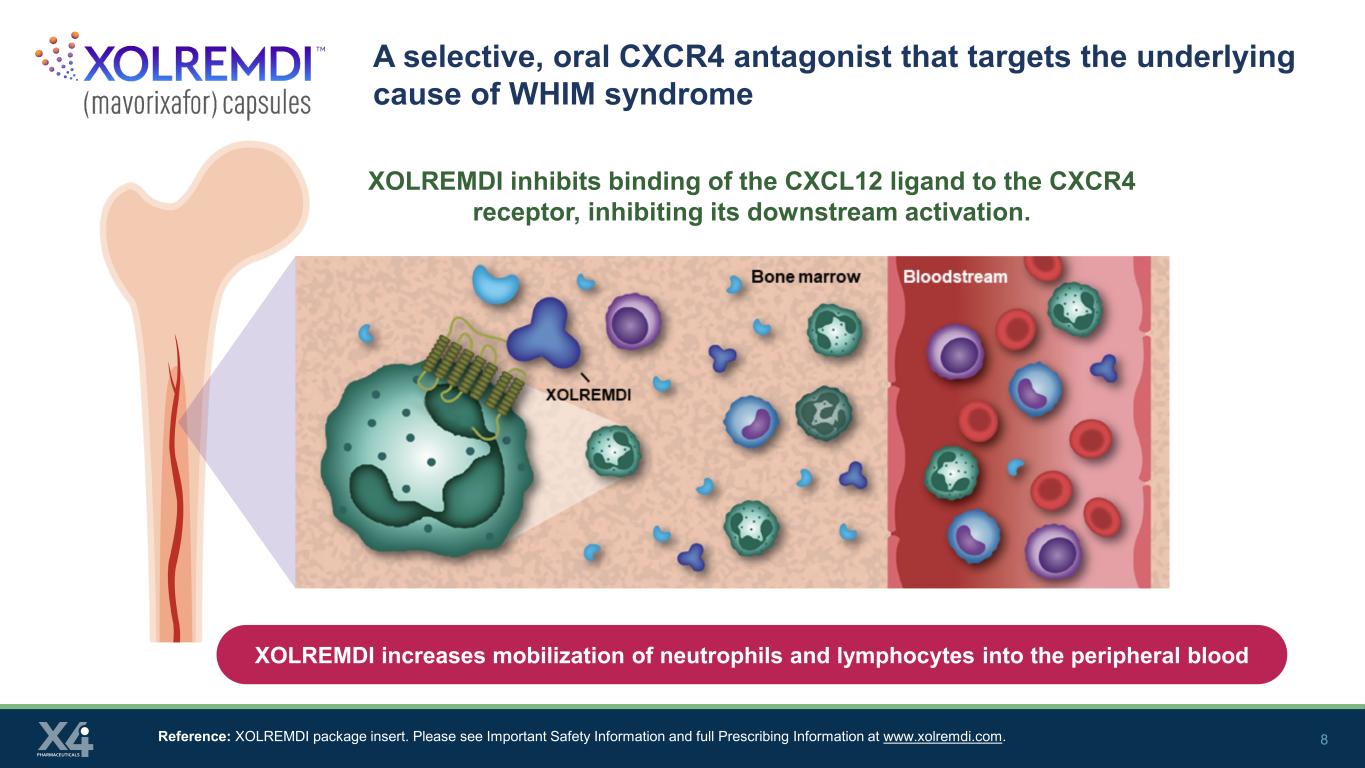
8 一種靶向 WHIM 綜合徵根本原因的選擇性口服 CXCR4 拮抗劑參考文獻:XOLREMDI 包裝説明書。請在www.xolremdi.com上查看重要安全信息和完整的處方信息。XOLREMDI 抑制 CXCL12 配體與 CXCR4 受體的結合,抑制其下游激活。XOLREMDI 可增加中性粒細胞和淋巴細胞在外周血中的動員

標籤亮點和支持臨牀數據 Christophe Arbet-Engels,醫學博士,首席醫學官

10 到目前為止,WHIM 綜合徵的治療方法尚未解決其根本原因參考文獻:1.Dale DC、Firkin F、Bolyard AA 等人,Blood。2020;136 (26): 2994-3003;2.Geier CB、Ellison M、Cruz R 等人,J Clin Immunol。2022;42 (8): 1748-1765;3.Kiss C、Connoley D、Connelly K 等人,抗生素,2022 年 1 月 11 日 (1):62;4.X4 2024 年 3 月研究;74 個 HCP(44 名免疫學家和 30 名 HEM/ONC)。G-CSF:粒細胞集落刺激因子;iViG:靜脈注射免疫球蛋白。抗生素和抗病毒藥物 • 未特別適用於WHIM綜合徵 • 沒有足夠且對照良好的試驗評估WHIM綜合徵患者的安全性和有效性1,2 • G-CSF和IvIG與繁瑣的給藥有關 • 長期使用抗生素與發生抗微生物藥物耐藥性 (AMR) 和累積不良事件風險相關的3 • 73%的受訪HCP(n=74)對WHIM中的抗生素耐藥性感到擔憂 IM 綜合徵患者4 g-CSFIVIG 對症治療

11 XOLREMDITM(mavorixafor)美國標籤亮點適應症聲明 XOLREMDI 獲準用於 12 歲及以上患有 WHIM 綜合徵(疣、低丙種球蛋白血癥、感染和骨髓病變)的患者,以增加循環中的成熟中性粒細胞和淋巴細胞的數量。禁忌症與高度依賴 CYP2D6 的藥物一起使用。盒裝警告無劑量和給藥體重 >50 kg 的患者:400 mg,口服,每日一次,體重 ≤50 kg 的患者:300 mg,口服,每日一次,劑型和強度膠囊:100 mg mavorixafor 參見幻燈片 15 瞭解產品標籤上的不良反應摘要。請在www.xolremdi.com上查看重要安全信息和完整的處方信息。

12 4WHIM 是迄今為止最大的 WHIM 綜合徵的 3 期臨牀試驗 XOLREMDI 是在一項全球隨機、雙盲、安慰劑對照的 3 期試驗中進行的,對 31 名 WHIM 綜合徵患者進行的主要終點 • 絕對中性粒細胞計數 (ANC) 的改善,以次要終點時平均高於 500 個細胞/μL 的 ANC 閾值來衡量 • 絕對淋巴細胞的改善細胞數 (ALC) 以在 13、26、39 和 52 周時平均超過 ALC 閾值 1000 個細胞/μL 來衡量 • 複合終點:分析總感染分數(發生率、嚴重程度)和總疣變化評分基線訪問 XOLREMDI(N = 14)>50 kg:400 mg QD ≤50 kg:200 mg QD 安慰劑(N = 17)主要終點評估了開放標籤擴展(OLE)研究人羣中約 90% 的持續性 • 成人和青少年(12 至
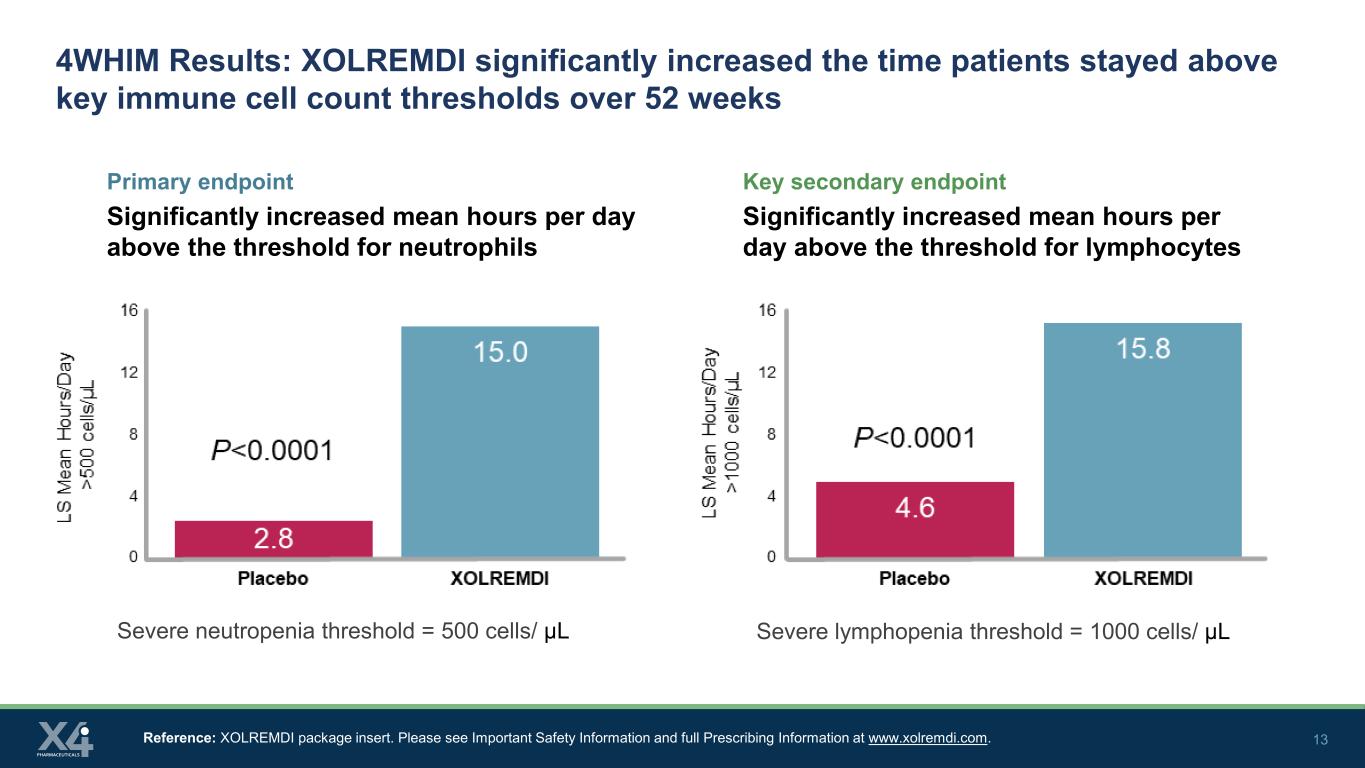
13 4WHIM 結果:XOLREMDI 顯著延長了患者在 52 周內保持在關鍵免疫細胞數量閾值以上的時間主要終點顯著增加每天平均小時數高於中性粒細胞閾值的關鍵次要終點顯著增加淋巴細胞閾值以上的每日平均小時數參考:XOLREMDI 包裝説明書。請在www.xolremdi.com上查看重要安全信息和完整的處方信息。嚴重中性粒細胞減少閾值 = 500 個細胞/μL 嚴重淋巴細胞減少閾值 = 1000 個細胞/μL
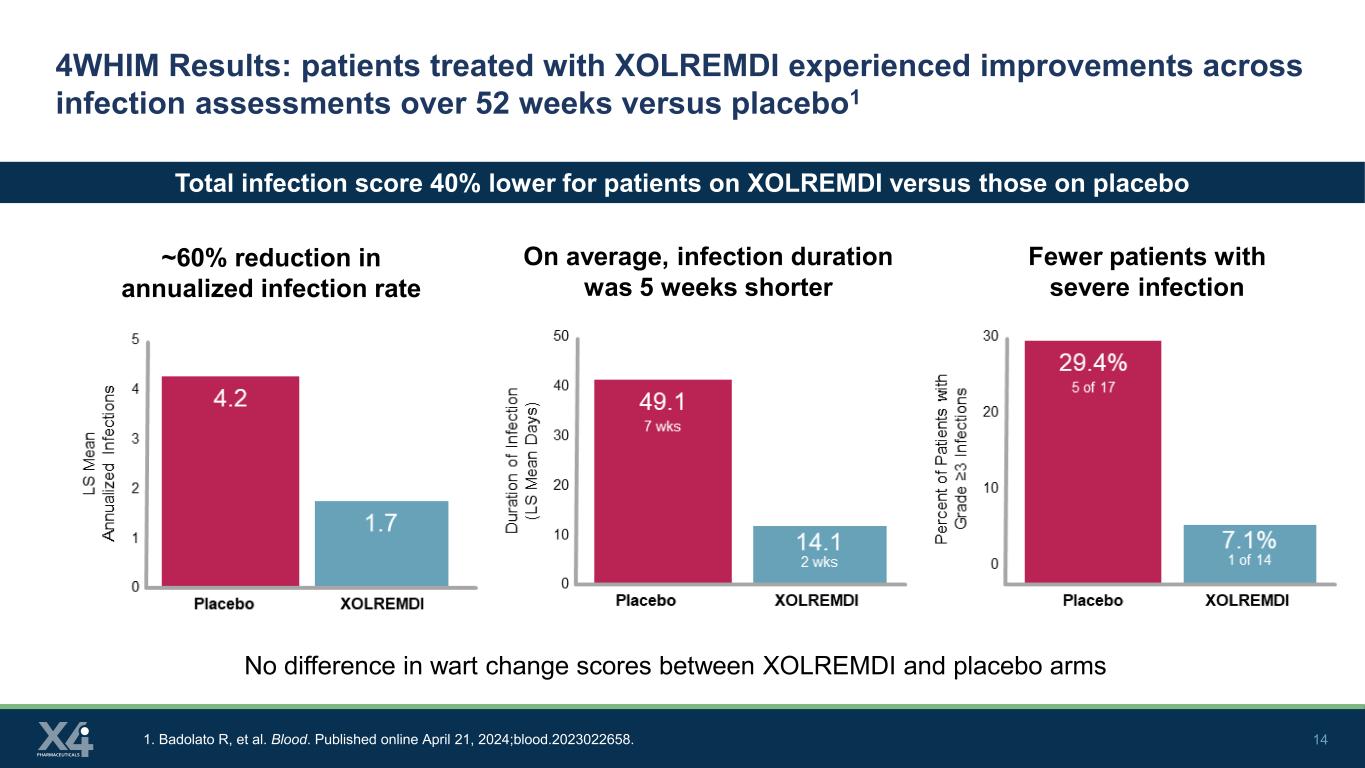
14 4WHIM 結果:與安慰劑相比,接受XOLREMDI治療的患者在感染評估中在52周內得到了改善1,年化感染率降低了約60% 1。Badolato R 等人血。2024 年 4 月 21 日在線發佈;blood.2023022658。嚴重感染患者減少平均而言,感染持續時間縮短了5周,服用XOLREMDI的患者的總感染分數比服用安慰劑的患者低40% XOLREMDI和安慰劑組之間的疣變評分沒有差異
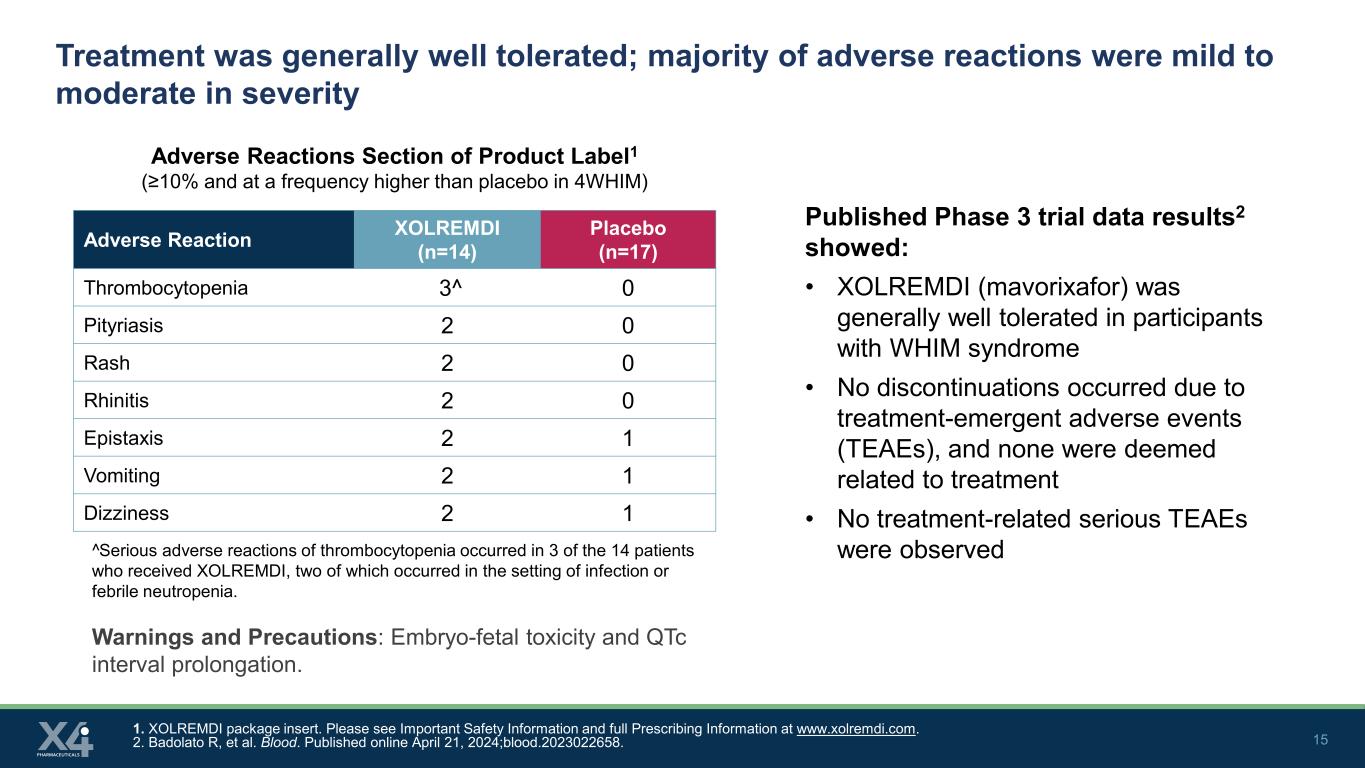
15 治療的耐受性總體良好;大多數不良反應嚴重程度為輕度至中度產品標籤1的不良反應部分(≥ 10%,頻率高於4WHIM中的安慰劑)1。XOLREMDI 包裝説明書。請在 www.xolremdi.com 上查看 “重要安全信息” 和 “完整處方信息”。2.Badolato R 等人血。2024 年 4 月 21 日在線發表;blood.2023022658。不良反應 XOLREMDI (n=14) 安慰劑 (n=17) 血小板減少症 3^ 0 糠疹 2 0 皮疹 2 0 鼻炎 2 0 鼻炎 2 1 嘔吐 2 1 頭暈 2 1 已公佈的 3 期試驗數據結果2顯示:• XOLREMDI(mavorixafor)對WHIM綜合徵參與者的耐受性總體良好 • 沒有停藥由治療緊急不良事件 (TEAE) 引起,無一被認為與治療有關 • 未觀察到與治療相關的嚴重不良反應^在接受XOLREMDI治療的14名患者中,有3例出現了嚴重的血小板減少不良反應,其中兩例發生在感染或發熱性中性粒細胞減少的背景下。警告和注意事項:胚胎毒性和 QtC 間隔延長。

商業發佈戰略與執行首席商務官馬克·巴爾德里

17 商業策略概述:有針對性的教育、參與和准入就WHIM綜合徵進行教育提供診斷支持參與關鍵醫學會議目標血液學家和免疫學家溝通有針對性的MOA和臨牀概況推動相關患者的採用和吸收緩解准入障礙提供全套患者支持服務幫助患者在整個治療過程中支持患者診斷將XOLREMDI確立為WHIM綜合徵的護理標準獲得廣泛准入利用敏捷的商業廣告團隊將執行 X4 的首次產品發佈會

18 推出創新罕見病藥物的合適領域團隊以使命為導向,以患者為中心:為歷史上得不到充分服務的人羣提供新療法團隊專業知識 • 罕見疾病空間/血液學和免疫學 • 支持罕見疾病的診斷 • 瞭解患者旅程 • 向新市場推出療法 • 與醫生、思想領袖和患者權益組織建立社區關係從知名稀有和超罕見組織招募的現場團隊共計250多年的成功經驗在商業發佈中
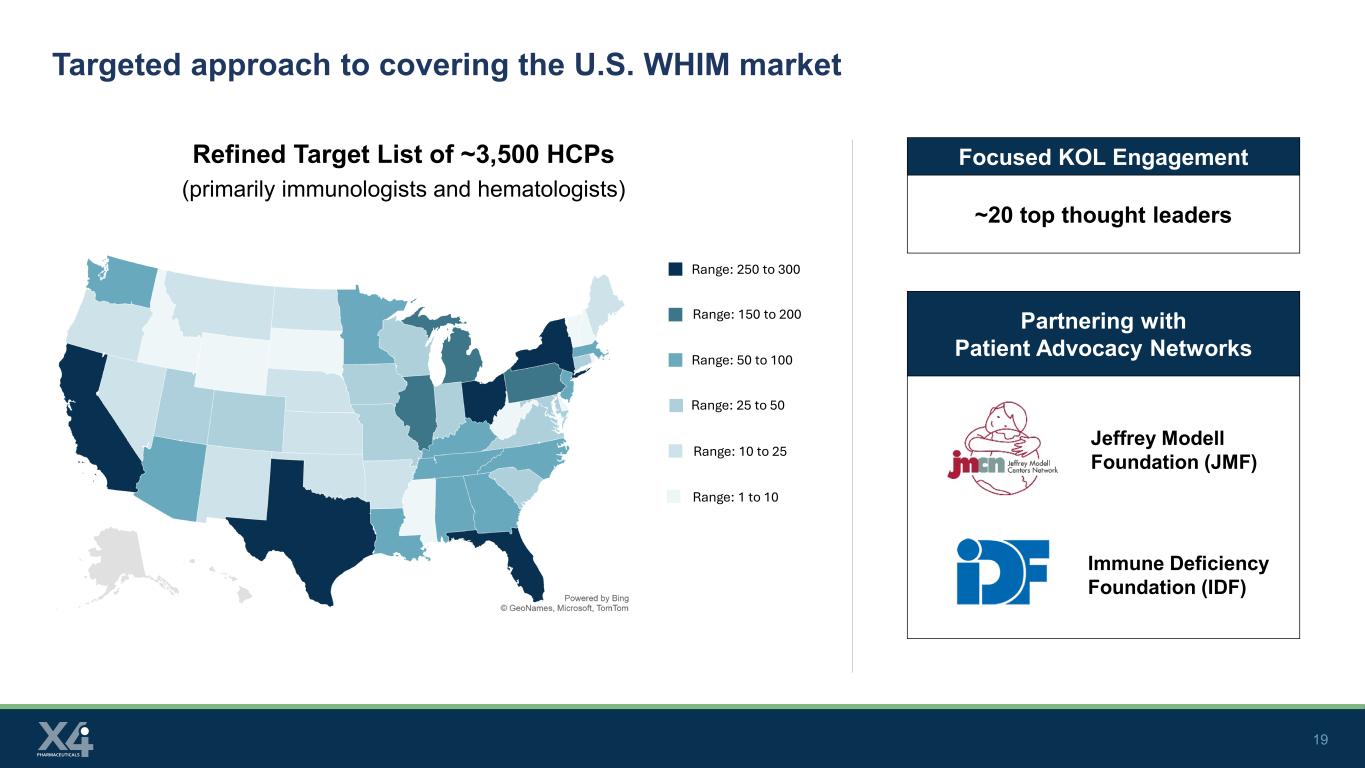
19 與患者權益網絡合作覆蓋美國WHIM市場的有針對性的方法約3500名HCP(主要是免疫學家和血液學家)的精簡目標清單傑弗裏·莫德爾基金會(JMF)免疫缺陷基金會(IDF)範圍:250至300範圍:150至200範圍:50至100範圍:10至25範圍:1至10位重點KOL參與度~20位頂級思想領袖

20 個醫療保健提供者正在尋求針對WHIM綜合徵的靶向療法,這是一種負擔沉重且需求未得到滿足的嚴重疾病 HCPs 上訴/關注的驅動者對以下方面印象特別深刻:• 感染減少 • 治療的靶向性 • HCP的口服配方認為 WHIM 綜合徵是一種嚴重的免疫疾病,可能出現長期併發症 92% HCP 調查認為 WHIM 綜合徵的靶向有效療法的未得到滿足的需求很高 89% 的人對當前的選擇不滿意用於治療 WHIM 綜合徵的症狀 76% 顯示未貼標XOLREMDI 概況,所有關鍵專業的 HCP 對處方的興趣都很高,平均得到 9 分(滿分 10 分)來源:X4 Pharmicals HCP 從 2024 年 2 月(N = 29 個 HCP)和 2024 年 3 月(N = 74 個 HCP)的市場研究和測試

21 項經濟援助計劃 • 經濟援助產品包括針對符合條件的患者的快速啟動、自付援助、過渡計劃和患者援助計劃,患者支持專業藥房流程,並由臨牀藥劑師填寫 XOLREMDI 處方,可用於:• 回答有關治療的問題 • 提供有關潛在副作用的信息 • 確認治療劑量和任何調整 x4ConnectTM 幫助符合條件的患者瞭解保險範圍、事先授權要求和經濟援助計劃,以提供幫助支持訪問 X4Connect 護理協調員 • 調查承保範圍並幫助瀏覽事先的授權、上訴和經濟援助選項 X4 護士教育工作者 • 向患者及其護理人員提供有關 XOLREMDI 和 WHIM 綜合徵的教育和可用資源 X4Connect 專業藥劑師 • 就患者的 XOLREMDI 處方提供諮詢

22 XOLREMDI 通過有針對性的創新解決未滿足的高需求年度價格*反映了價值 • 每日 >50 kg = 400 mg 的患者 = 每年 496,400 美元 • 患者≤50 kg = 每日 300 mg = 每年 372,300 美元可能解決高疾病負擔和增強患者免疫功能的相關方面顯著療效和安全性特徵針對超罕見患者羣體的靶向突破性療法首款也是唯一一款經美國食品藥品管理局批准的針對WHIM綜合徵的療法致力於提供創新解決方案通過 X4 提供支持和教育Connect 和 PantherX Rare 適用於所有符合條件的患者,通過合作、有針對性的教育和對早期診斷的支持,幫助團結 WHIM 綜合徵社區 XOLREMDI 針對 CXCR4 失調,這是 WHIM 綜合徵的根本原因 * 批發收購成本 (WAC);假設完全合規

23 兑現XOLREMDI(mavorixafor)支持患者診斷的承諾將XOLREMDI確立為WHIM綜合徵的護理標準獲得廣泛普及

[設計:請使用新的分隔滑梯]結論 Paula Ragan,博士總裁兼首席執行官
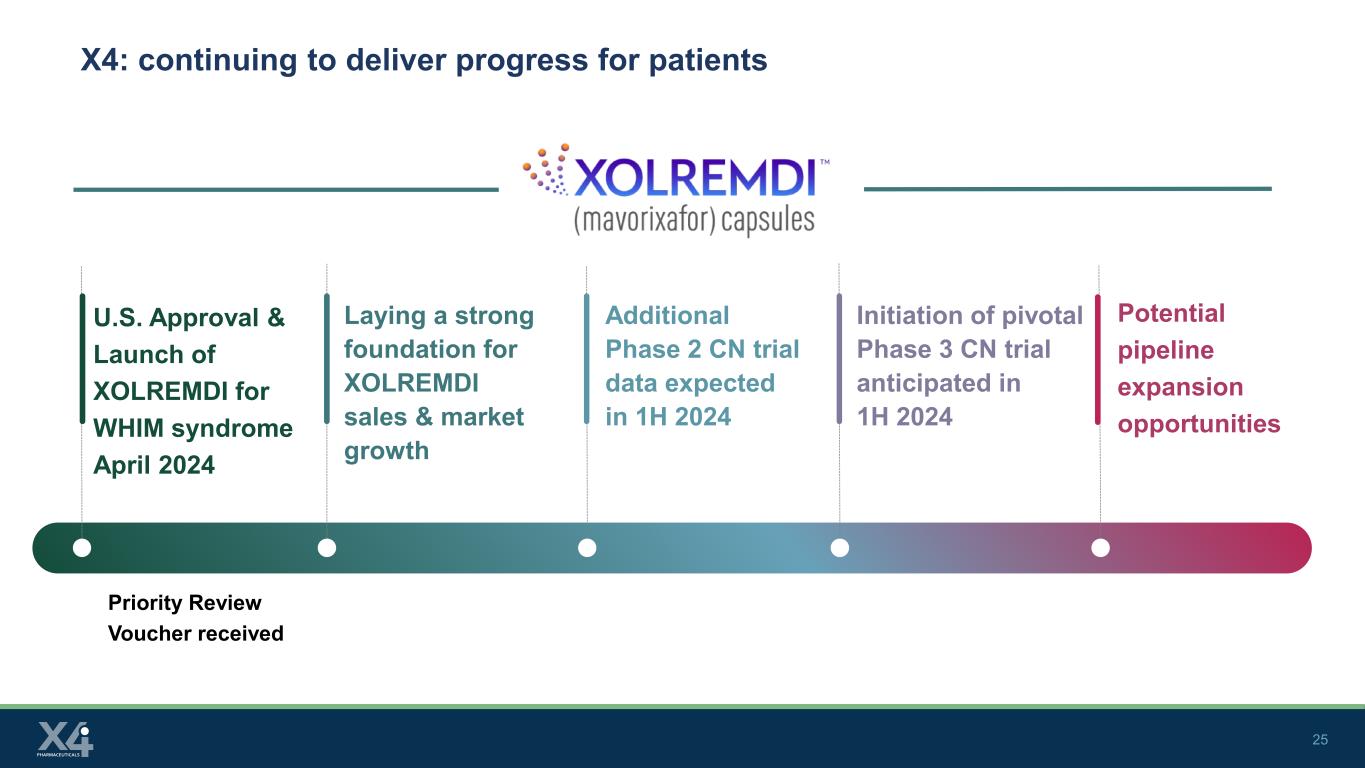
25 X4:繼續為患者帶來進展優先審查憑證獲得美國批准並於2024年4月推出用於WHIM綜合徵的XOLREMDI為XOLREMDI的銷售和市場增長奠定堅實基礎額外的2期CN試驗數據預計將於2024年上半年啟動關鍵的3期CN試驗潛在的管道擴張機會

考特尼,患有 WHIM 綜合症