
| 招股説明書 | 依據第424(B)(4)條提交 |
| 註冊號碼333-275320 |

400,000股普通股
預融資 認股權證最多購買3600,000股普通股
系列 購買最多400萬股普通股的普通權證
B系列普通股認股權證將購買最多400萬股普通股
普通權證相關的800萬股普通股
3600,000股普通股,作為預先出資的認股權證的基礎
我們 在“合理努力”的基礎上發行400,000股普通股,每股票面價值0.0001美元(“普通股”),A系列普通權證購買4,000,000股普通股(“A系列普通股 認股權證”),B系列普通權證購買最多4,000,000股普通股(“B系列普通股 認股權證”),與A系列普通權證一起,以每股1.25美元的合併公開發行 價格發行“普通權證”,並隨附A系列普通權證和B系列普通權證。每股普通股與A系列普通股認股權證和B系列普通股認股權證一起出售,A系列普通股認股權證購買一股普通股,B系列普通股認股權證購買一股普通股。普通權證的行使價為每股1.25美元,並可在發行時行使。A系列普通權證於發行5週年時終止,B系列普通權證於發行18個月後終止。本招股説明書還涉及根據普通權證的行權而發行的普通股的發行。在本次發行期間,每股公開發行價和附帶的普通權證的合併價格將是固定的。
我們 還向投資者提供預融資認股權證,購買最多3,600,000股普通股(以及在行使預融資認股權證後可發行的普通股股票),如果投資者在此次發售中購買我們普通股的股份 將導致該投資者及其關聯公司和某些關聯方實益擁有超過4.99%(或在投資者選擇時,9.99%)的已發行普通股。在本次發售完成後,有機會 購買。代替將導致投資者實益所有權超過4.99%(或在投資者選擇時為9.99%)的普通股,預資金權證將以0.0001美元的行使價購買一股我們的普通股, 我們稱之為預資資權證。每份預先出資的認股權證在發行時即可行使,並將在全部行使時到期 。每份預先出資的認股權證將與購買一股普通股的A系列普通權證和購買一股普通股的B系列普通權證一起出售,該等普通權證的條款將與我們每股普通股一起出售的普通權證的條款相同 。每一份預籌資權證和隨附的普通權證的公開發行價等於本次發行中向公眾出售的普通股和隨附普通權證的每股價格減去0.0001美元。 每份預資資權證和隨附的普通權證的合併公開發行價將在本次發行期間固定。 本招股説明書還涉及在行使預融資權證和向預融資權證的購買者發行普通股時可發行的普通股股票。
普通股和/或預籌資權證及附隨認股權證的股份只能在本次發行中一併購買,但將分開發行 ,並可在發行時立即分開。在您投資我們的證券之前,您應該仔細閲讀這份招股説明書。
我們的普通股在納斯達克全球市場的納斯達克股票市場有限責任公司(“納斯達克”)上市,代碼為“ZVSA”。 2023年12月5日,我們的普通股在納斯達克上最後一次報價出售價格為2.17美元。在此發行的預融資權證或普通權證尚無公開交易市場,我們預計市場不會發展。 如果沒有活躍的交易市場,預融資權證和普通權證的流動性將受到限制。此外,我們 不打算在納斯達克、任何其他國家證券交易所或任何其他交易系統上上市預融資權證或普通權證。
我們 已與AG.P./Alliance Global Partners作為我們的配售代理參與此次發售 。配售代理已同意盡其合理的最大努力安排出售本招股説明書提供的證券。配售代理不購買或出售我們提供的任何證券,並且不要求配售代理安排購買或出售任何特定數量或金額的證券。我們已同意向配售代理支付下表中列出的配售代理費,前提是我們出售了本招股説明書提供的所有證券。 不存在以託管、信託或類似安排獲得資金的安排。沒有最低證券股份數量或最低總收益金額,這是本次發行結束的條件。我們出售的證券可能少於在此提供的所有證券,這可能會顯著減少我們收到的收益,如果我們不出售在此提供的所有證券,此次發行的投資者將不會獲得退款。由於沒有託管帳户,也沒有最低證券數量或收益金額,因此投資者可能已對我們進行了投資,但我們沒有在此次發行中籌集到足夠的收益,不足以滿足本招股説明書中所述收益的預期用途。我們將承擔與此次產品相關的所有費用。我們的某些高級管理人員、董事和員工也可以選擇以與其他購買者相同的條款和條件參與此次發售。請參閲“分銷計劃“從本招股説明書的第142頁開始,瞭解有關這些安排的更多信息。
您 應閲讀本招股説明書,以及標題“在那裏您可以找到更多信息,“在您投資我們的任何證券之前,請仔細考慮。
2023年10月31日,我們的股東批准了我們的普通股流通股的反向拆分,拆分的比例在 10股1股到50股1股的範圍內,按董事會確定的比例和日期生效。我們的 董事會隨後決定,反向股票拆分的比例為35比1。在獲得批准後,我們向特拉華州州務卿提交了第二份修訂和重述的公司註冊證書的 修正案,以 實施反向股票拆分,生效時間為下午4:01。東部時間2023年12月4日。作為反向 股票拆分的結果,我們的普通股中每35股,無論是已發行的還是已發行的,在我們向特拉華州州務卿提交的我們對第二次修訂和重述的公司註冊證書的修訂提交和生效之前,被自動合併並轉換(無需任何進一步行動)為一股已繳足且不可評估的普通股。沒有發行與反向股票拆分相關的零碎股份。如果普通股的股份是直接持有的,則普通股的每一股零碎股份都將 四捨五入為普通股的最接近的完整份額。反向股票拆分 將普通股的流通股總數從反向拆分前的43,515,401股減少到反向拆分後的1,243,297股(受反向股票拆分產生的 股四捨五入的調整)。
本登記聲明中出現的所有財務信息、 股份編號、期權編號、認股權證編號、其他衍生證券編號和行使價,包括Larkspur(如下定義)證券的股份,已進行調整以實施反向 股票拆分。
根據聯邦證券法的定義,我們 是一家“新興成長型公司”,因此,我們可能會選擇遵守某些已降低的上市公司在未來備案時的報告要求。
投資我們的證券涉及高度風險。在購買任何證券之前,您應仔細閲讀標題為“風險因素“從本招股説明書第11頁開始。
每股及隨附普通股 認股權證 | 每份預付資金認股權證和隨附的普通權證 | 總計 | ||||||||||
| 公開發行價 | $ | 1.2500 | $ | 1.2499 | $ | 4,999,640 | ||||||
| 安置代理費(1) | $ | 0.0750 | $ | 0.750 | $ | 299,978 | ||||||
| 給我們的收益(未計費用)(2) | $ | 1.1750 | $ | 1.1749 | $ | 4,699,662 | ||||||
(1) 代表相當於投資者在本次發行中支付的總購買價6.0%的現金費用。我們還同意向 配售代理報銷與其產品相關的某些費用。請參閲“配送計劃從本招股説明書第142頁開始,瞭解配售代理將獲得的補償説明。
(2) 不包括以現金形式行使普通權證的收益(如有)。
證券交易委員會和任何州證券委員會都沒有批准或不批准這些證券,也沒有確定本招股説明書是否真實或完整。任何相反的陳述都是刑事犯罪。
普通股股份、預融資權證和普通權證預計將於2023年12月11日左右交付給購買者。
Sole 安置代理
AGP。
本招股説明書的 日期為2023年12月6日。
目錄表
| 頁面 | |
| 關於這份招股説明書 | 1 |
| 商標 | 2 |
| 選定的定義 | 3 |
| 關於前瞻性陳述的警告性聲明 | 4 |
| 招股説明書摘要 | 6 |
| 供品 | 9 |
| 風險因素 | 11 |
| 收益的使用 | 67 |
| 稀釋 | 68 |
| 我們普通股和股息信息的市場價格 | 70 |
| 生意場 | 71 |
| 管理層對財務狀況和經營成果的討論與分析 | 106 |
| 管理 | 120 |
| 高管薪酬 | 125 |
| 證券的實益所有權 | 140 |
| 配送計劃 | 142 |
| 某些關係和關聯方交易 | 145 |
| 股本説明 | 152 |
| 我們提供的證券説明 | 167 |
| 法律事務 | 171 |
| 專家 | 172 |
| 在那裏您可以找到更多信息 | 173 |
| 財務信息索引 | F-1 |
您 應僅依賴此招股説明書中包含的信息。未授權任何人向您提供與本招股説明書中包含的信息 不同的信息。本招股説明書的日期為本招股説明書封面所列日期。您不應 假設本招股説明書中包含的信息在該日期以外的任何日期都是準確的。
| i |
關於 本招股説明書
我們 未授權任何人提供任何信息或作出任何陳述,但本招股説明書或由我們或代表我們編制的任何免費書面招股説明書或我們已向您推薦的招股説明書中包含的信息或陳述除外。我們 對他人可能向您提供的任何其他信息的可靠性不承擔任何責任,也不能提供任何保證。此 招股説明書僅提供僅出售在此提供的證券的要約,且僅在合法的情況下且在司法管轄區內 。本招股説明書或任何適用的免費書面招股説明書中包含的信息僅在其日期有效,無論其交付時間或我們證券的任何銷售。自該日期以來,我們的業務、財務狀況、運營結果和前景可能已發生變化 。
本招股説明書中提供的信息包含統計數據和估計,包括與我們所參與市場的市場規模和競爭地位有關的數據和估計,這些數據和估計是從我們自己的內部估計和研究,以及從行業和一般出版物以及由第三方進行的研究、調查和研究中獲得的。行業出版物、研究和調查一般都表明,它們是從據信可靠的來源獲得的。雖然我們相信我們公司內部的研究是可靠的,並且我們市場和行業的定義是適當的,但這項研究或這些定義都沒有得到任何獨立的 來源的驗證。
對於美國以外的投資者:我們沒有,配售代理也沒有做任何事情,以允許在美國以外的任何司法管轄區進行此次發行或擁有或分發本招股説明書。 持有本招股説明書的美國境外人員必須告知自己,並遵守與在美國境外發售證券和分發本招股説明書有關的任何限制。
本招股説明書包含本文所述部分文件中包含的某些條款的摘要,但請參考實際文件以獲取完整信息。所有的摘要都被實際文件完整地限定了。本招股説明書所指的部分文件的副本已存檔、將存檔或將通過引用合併為註冊説明書的證物 ,您可以獲得這些文件的副本,如下所述。您 可以在此處找到更多信息。”
除 明確説明或文意另有所指外,本招股説明書中對“公司、“The”註冊人,” “我們,” “我們“和”我們的“指ZyVersa(以及舊ZyVersa的業務,在業務合併生效後, 成為ZyVersa的業務)。
| 1 |
商標
本 文檔包含對屬於其他實體的商標和服務標記的引用。僅為方便起見,本招股説明書中提及的商標和商品名稱可能不帶®或™符號,但此類引用並不以任何方式表明, 適用許可人不會根據適用法律在最大程度上主張其對這些商標和商品名稱的權利。我們無意使用或展示其他公司的商號、商標或服務標誌,以暗示與任何其他公司有關係,或由任何其他公司背書或贊助。
| 2 |
已選擇 個定義
除非 本招股説明書中另有説明或上下文另有要求,否則:
“盡最大努力保證“指我們在本公司於根據我們於2023年1月27日向美國證券交易委員會提交的經修訂的S-1表格註冊聲明(文件編號333-269442),盡力而為。
“盡最大努力 提供“指的是根據我們於2023年1月27日向美國證券交易委員會提交的S-1表格註冊聲明(文件編號333-269442),盡最大努力提供。
“業務組合 “指企業合併,包括《企業合併協議》擬進行的合併和其他交易。
“業務 合併協議“指日期為2022年7月20日的某些業務合併協議,由證券持有人代表ZyVersa、Larkspur和合並子公司簽訂,並經不時修改;
“結業“ 指企業合併的完成;
“截止日期 “指企業合併完成之日,即2022年12月12日;
“普通股 股票“指我們的普通股,面值0.0001美元;
“首次公開募股(IPO)“ 指Larkspur的首次公開募股於2021年12月23日完成。
“誘因 認股權證“指於2023年9月向現有權證持有人發行的新誘導權證,行權價為4.75美元。
“2023年7月提供服務指我們於2023年7月26日完成的公開發售。
“2023年7月的認股權證“指我們在2023年7月發行的認股權證。
“拉克斯普“ 指實施業務合併之前的特拉華州公司Larkspur Health Acquisition Corp.;
“合併“ 指合併Sub與Old ZyVersa並併入Old ZyVersa,Old ZyVersa作為ZyVersa的全資子公司繼續存在;
“合併 子公司“指Larkspur Health Merge Sub,Inc.,該公司是特拉華州的一家公司,也是Larkspur的全資子公司;
“舊的 ZyVersa“指ZyVersa治療公司,佛羅裏達州的一家公司,在業務合併生效後;
“舊的ZyVersa擔保“指因業務合併而向Old ZyVersa權證持有人 註銷及轉換Old ZyVersa的每份已發行認股權證而發行的45,032股本公司普通股可行使的認股權證。
“管道 投資者”指已簽署PIPE認購協議的投資者;
“管道 個共享“指在PIPE投資中出售給PIPE投資者的Larkspur A系列可轉換優先股的股份;
“管道 訂閲協議“指Larkspur與管道投資者之間簽訂的證券購買協議,日期為2022年7月20日,經修訂(並可能根據其條款不時進一步修訂、修改、補充或豁免),據此Larkspur同意以每股1,000美元的收購價向管道投資者發行總計12,500股Larkspur A系列可轉換優先股和認股權證,金額相當於該系列A優先股轉換後可向管道投資者發行的普通股標的股份的100%;
“管道 授權書“指與PIPE股份一起出售給PIPE投資中PIPE投資者的私募權證;
“管道“ 或”管道投資“指PIPE投資者購買總額為8,635,000美元的私募,以換取緊接 PIPE認購協議中規定的條款和條件結束之前的Larkspur A系列優先股和認股權證的股份;
“私募認股權證 “指與首次公開招股有關而發行的非公開認股權證;
“公共 認股權證“指與首次公開招股有關而向投資者發行的公開認股權證;
“證券持有人 代表“指企業合併協議中指定的Old ZyVersa的股東代表;
“系列 A優先股“指35股A系列優先股轉換為500股普通股,轉換價格為每股70.00美元/股,以及715股由獨立持有人持有但尚未轉換的A系列優先股。
“B股系列 “指5,062股Larkspur的B系列可轉換優先股,可轉換為Larkspur的普通股,發行給持有人以清償某些債務和交易成本;
“贊助商“指特拉華州有限責任公司Larkspur Health LLC;以及
“ZyVersa“ 或”公司“指的是ZyVersa治療公司,一家特拉華州的公司,在業務合併生效後。
| 3 |
有關前瞻性陳述的警示性 聲明
本招股説明書包含前瞻性陳述,因此不是歷史事實。這包括但不限於有關財務狀況、業務戰略以及我們未來運營的管理計劃和目標的陳述。這些陳述 構成預測、預測和前瞻性陳述,並不是業績的保證。這樣的陳述可以通過它們與歷史或當前事實沒有嚴格聯繫這一事實來識別。在本招股説明書中使用的詞語,如“預期”、“相信”、“繼續”、“可能”、“估計”、“預期”、“打算”、“可能”、“可能”、“計劃”、“可能”、“可能”、“潛在”、“預測”、“項目”、“ ”應該、“努力”、“將會”以及類似的表達方式可能識別前瞻性陳述,但 沒有這些詞語並不意味着聲明沒有前瞻性。本招股説明書和通過引用併入本招股説明書的任何文件中的前瞻性陳述可能包括,例如,關於:
| ● | 我們 實現業務合併預期收益的能力; | |
| ● | 與我們業務相關的成本; | |
| ● | 我們的 財務和業務表現,包括財務預測和業務指標; | |
| ● | 我們的 在未來實現和保持盈利能力的能力 | |
| ● | 我們的 有效地增長和擴大業務的能力; | |
| ● | 我們目前的計劃和運營受到幹擾的風險; | |
| ● | 商業或經濟中斷的潛在可能性,包括當前和未來的流行病造成的中斷,如新冠肺炎大流行,包括其突變或變體,以及對商業和財務狀況的影響; | |
| ● | 維持我們的證券在納斯達克上上市的能力,以及我們證券的潛在流動性和交易; | |
| ● | 認識到我們業務的預期收益的能力,這可能會受到增長和管理我們的研發和臨牀活動以及留住關鍵員工的能力的影響。 | |
| ● | 適用法律或法規變更的影響; | |
| ● | 我們的 未來的資本需求以及現金來源和使用,包括獲得資本來源或籌集資金的能力 未來; | |
| ● | 我們的網絡強度、我們技術的有效性以及通過我們平臺提供的產品的質量; | |
| ● | 我們業務的預測財務信息、增長率、戰略和市場機會; | |
| ● | 我們的 維持我們現有的許可協議和其他合作安排的能力; | |
| ● | 我們的 能夠獲得和維護我們候選產品的監管批准,以及任何相關限制和限制 未來的產品; | |
| ● | 我們的研發策略和活動的成功、成本和時間; | |
| ● | 我們的 成功推出我們的候選產品並被市場接受的能力; | |
| ● | 與競爭對手競爭的能力、評估和策略; |
| 4 |
| ● | 我們的 吸引和留住人才的能力,以及我們的薪酬策略和領導力的有效性; | |
| ● | 我們的 保持我們的許可證和在嚴格監管的製藥行業運營的能力; | |
| ● | 預防和防範網絡安全攻擊的能力; | |
| ● | 我們的 依賴第三方服務提供商處理支付、Web和移動操作系統、軟件、背景調查, 保險政策; | |
| ● | 我們的 建立和維持有效的財務報告內部控制制度的能力; | |
| ● | 任何已知和未知的訴訟和監管程序的結果,包括任何事件、變更或其他情況的發生, 包括可能對我們提起、可能影響我們業務的任何法律訴訟的結果; | |
| ● | 我們的 維護和保護我們的品牌和知識產權的能力;以及 | |
| ● | 其他 標題為“風險因素.” |
這些 前瞻性陳述基於截至本招股説明書發佈之日可獲得的信息以及當前的預期、預測和假設,涉及大量判斷、風險和不確定性。因此,前瞻性陳述不應被視為代表我們在任何後續日期的觀點,我們不承擔任何義務更新前瞻性陳述 以反映它們作出之日後的事件或情況,無論是由於新信息、未來事件或其他原因, 除非適用的證券法可能要求。
| 5 |
招股説明書 摘要
此 摘要重點介紹了此招股説明書中的精選信息,可能不包含對您作出投資決策 非常重要的所有信息。在投資我們的證券之前,您應仔細閲讀整個招股説明書,包括本招股説明書中包含的財務報表和相關説明,以及本招股説明書中其他部分的“風險因素”、 “業務”和“管理層對財務狀況和經營結果的討論和分析” 標題下列出的信息。另請參閲標題為“在哪裏可以找到更多信息”的小節。除明確説明或文意另有所指外,本招股説明書中的“公司”、“註冊人”、“本公司”、“本公司”及“本公司”均指ZyVersa(及Old ZyVersa的業務,在業務合併生效後成為ZyVersa的業務)。
概述
我們 是一家臨牀階段的生物製藥公司,利用專有技術為患有慢性腎臟疾病或炎症性疾病的患者開發藥物,這些患者的醫療需求尚未得到滿足。我們的使命是開發優化健康結果和提高患者生活質量的藥物。
我們 擁有兩個全球許可的專利藥物開發平臺,每個平臺都是由邁阿密大學米勒醫學院(以下簡稱邁阿密大學)的研究科學家發現的。這些開發平臺 包括:
| ● | 膽固醇外流調節劑TM,VAR200(2-羥丙基-β-環糊精或“2HPβCD”)是一種臨牀上正在開發中的治療腎臟疾病的注射劑。VAR 200於2015年12月15日從L研究有限責任公司獲得許可。L研究公司是由邁阿密大學的研究科學家創立的,他們發現了VAR 200用於腎臟疾病。 | |
| ● | IC 100是一種用於治療炎症性疾病的臨牀前開發中的單抗炎症體ASC抑制劑。IC 100於2019年4月18日從InflamaCore,LLC獲得許可。InflamaCore,LLC是由邁阿密大學的研究科學家創建的,他們發明了IC 100。 |
我們 相信我們的每一種候選產品都有潛力在各自的治療領域治療多種適應症。我們的戰略是專注於適應症擴展,以最大限度地發揮商業潛力。
我們的腎臟管道最初專注於罕見的慢性腎小球疾病。我們對VAR 200的主要指徵是局灶性節段性腎小球硬化(FSGS)。2020年1月21日,我們提交了VAR 200的新藥研究申請(“IND”),美國食品和藥物管理局(“FDA”)已允許我們的開發計劃基於活性成分(2HPβCD)的風險/益處概況,在FSGS患者 中進行2a期試驗。在對患有FSGS的患者啟動2a期試驗之前,我們計劃在2024年第一季度支持一項開放標籤概念驗證試驗,屆時我們預計將獲得8名糖尿病腎病患者的數據。這將能夠在患者進行治療的過程中評估藥物效果,並將為開發我們的2a階段方案提供見解。VAR 200具有代表FSGS、Alport綜合徵和糖尿病腎病的動物模型的藥理學概念驗證數據,其中每一種都可以根據我們的適應症擴展策略進行開發。
我們的炎症體ASC抑制劑計劃IC 100正處於臨牀前開發階段。我們的重點是推動1C 100在2024年第二季度提交當前計劃的 IND,然後啟動第一階段試驗。IC 100具有代表急性呼吸窘迫綜合徵(ARDS)和多發性硬化症(MS)的動物模型的藥理學概念驗證數據。我們計劃在下一波臨牀前發展中進行多達六種適應症的額外動物研究,例如免疫球蛋白A(“IgA”)腎病、帕金森氏病、早期阿爾茨海默病、亨廷頓病和充血性心力衰竭。 我們預計將根據我們臨牀前計劃的數據選擇一個或多個IC 100的主要適應症。
我們的 管道
我們管道的目標是針對具有高度未滿足醫療需求的腎臟和炎症適應症,我們相信可以通過我們的作用機制解決這些問題。我們打算通過為VAR 200和IC 100開發多個適應症 ,以及通過潛在的腎臟和抗炎候選產品的許可,進一步增強和擴大我們的產品組合。
| 6 |
業務 戰略
我們 尋求被公認為領先的生物製藥公司,處於創新前沿,為有高度未滿足醫療需求的患者提供服務。 我們致力於通過開發生物製藥產品來恢復健康並改變患者的生活。我們的策略 是:
| ● | 推進VAR 200的開發. | |
| ● | 推進我們的IC 100臨牀前計劃. | |
| ● | 利用我們的適應症擴展戰略,通過在各自的治療領域開發多個適應症,最大限度地發揮我們每個產品平臺的商業潛力. | |
| ● | 維護我們的候選產品的開發和商業化權利. | |
| ● | 擴展我們的候選產品組合 . | |
| ● | 繼續 加強和擴大我們的知識產權組合. |
上文中反映的 日期和事件僅為估計值,無法保證所包含的事件 將在呈現的預期時間軸上完成,或根本不會完成。此外,無法保證我們將成功開發 我們的任何候選產品,或我們未來可能開發的任何其他產品或候選產品,或我們未來可能開發的任何候選產品 將獲得FDA的任何適應症批准。
市場 和商業機會
我們 認為,我們的主要候選產品具有治療醫療需求顯著未滿足的疾病的潛力,包括(i) 我們的主要候選腎臟產品VAR 200,正在開發用於多種腎臟適應症的潛在治療,如局灶性節段性腎小球硬化症(FSGS)和Alport綜合徵(孤兒適應症)和糖尿病腎病;和(ii)我們的主要抗炎產品 候選產品,IC 100,用於治療多種炎症性疾病,包括,但不限於多發性硬化症和急性呼吸窘迫綜合徵。VAR 200尚未被FDA授予FSGS或Alport綜合徵的孤兒藥指定。
風險因素
我們的業務受到許多風險和不確定性的影響,包括標題為“風險因素“ 緊隨此招股説明書摘要,該摘要闡明瞭我們在成功實施戰略和業務增長方面面臨的挑戰 。以下考慮因素(除其他外)可能會抵消我們的競爭優勢或對我們的業務戰略產生負面影響,這可能會導致我們證券的股價下跌並導致您的全部或部分投資損失 。
| ● | 我們當前或未來的候選產品可能永遠不會獲得批准或獲得商業市場認可; | |
| ● | 我們 是一家處於發展階段的公司,經營歷史有限,沒有收入,有許多因素可能會影響我們的業務前景 ; | |
| ● | 截至 日期,我們沒有數據支持監管部門批准我們的任何藥品,我們沒有任何產品在任何司法管轄區獲準商業銷售,我們也沒有從產品銷售中獲得任何收入; | |
| ● | 我們 將需要額外資金來開發我們的候選產品並將其商業化。如果我們無法籌集足夠的資金,我們 將被迫推遲、減少或取消我們的產品開發計劃; | |
| ● | 我們的業務依賴於我們候選產品的成功開發、監管批准和商業化,特別是VAR 200和IC 100; | |
| ● | 我們的 候選產品如果獲得批准,將面臨激烈的競爭,如果我們不能有效競爭,可能會阻止我們實現顯著的市場滲透; | |
| ● | 我們 可能無法實現我們業務的預期收益,任何收購、戰略關係、合資或投資都可能擾亂我們的業務,損害我們的經營業績和財務狀況; | |
| ● | 如果 我們不能成功地管理我們的增長和擴大我們的業務,我們的聲譽、品牌、業務和運營結果可能會受到損害 ; | |
| ● | 我們 在競爭激烈的人才市場中存在依賴關鍵管理成員和其他關鍵人員以及吸引、留住和培養合格人才的風險; | |
| ● | 我們 可能面臨訴訟風險,並可能因此面臨責任和對我們的專業聲譽的損害; | |
| ● | 我們的業務受到廣泛的國內和國外法規的約束,這可能會使我們面臨巨大的成本和合規要求; | |
| ● | 我們 可能面臨與我們作為1933年《證券法》含義內的新興成長型公司的地位相關的風險,作為 修訂後(“證券法”); | |
| ● | 未能實現並保持對財務報告的有效內部控制可能導致我們無法準確或及時地報告我們的財務狀況或經營結果,這可能對我們的業務和股票價格產生重大不利影響; | |
| ● | 我們 可能無法繼續經營下去。 | |
| ● | 如果我們對關鍵會計政策的估計或判斷被證明是不正確的,我們的經營業績可能會受到不利影響 ; | |
| ● | 作為一家上市公司的要求可能會使我們的資源緊張,導致訴訟,並分散管理層的注意力; | |
| ● | 我們普通股的活躍交易市場可能永遠不會發展或持續; | |
| ● | 我們普通股的價格可能會波動,這可能會給投資者造成重大損失; |
| 7 |
| ● | 我們總流通股的很大一部分被限制立即轉售,但可能在不久的 將來向市場出售,這可能導致我們普通股的市場價格大幅下跌,即使我們的業務表現良好; | |
| ● | 不能保證舊的ZyVersa認股權證、管道認股權證或公共認股權證將在現金中;它們可能到期而毫無價值 因此我們可能無法從行使認股權證中獲得現金收益; | |
| ● | 在行使認股權證和轉換優先股時發行我們的普通股將大大稀釋我們普通股的現有持有者的權益。 | |
| ● | 如果您在此次發行中購買證券,您的投資將立即遭到稀釋; | |
| ● | 我們的 與融資、收購、投資、股票激勵計劃相關的額外股本的潛在發行,作為應付或其他應付賬款的對價,將稀釋所有其他股東的權益; | |
| ● | 我們的 管理層將在使用此次發行的淨收益方面擁有廣泛的自由裁量權,並可能以您不同意的方式和可能不會產生回報的方式投資或使用收益。 | |
| ● | 預籌資權證或特此提供的權證沒有公開市場。 | |
| ● | 預籌資權證或在本次發售中購買的認股權證的持有人 將不享有普通股股東的權利,直到該等持有人 行使其預資資權證或認股權證並收購我們的普通股。 | |
| ● | 本公司於此發行的認股權證屬投機性。 | |
| ● | 此 是盡力而為的產品,不要求出售最低金額的證券,並且我們可能不會籌集我們的業務計劃(包括我們的近期業務計劃)所需的資金。 | |
| ● | 第三方聲稱我們侵犯或濫用他們的專有技術可能會使我們承擔重大責任,並可能迫使 我們重新設計我們的服務和產品或產生重大成本;以及 | |
| ● | 如果我們不能有效地保護我們的知識產權,我們的業務將受到損害。 |
企業信息
於2022年12月12日(“完成日期”),吾等根據該特定業務合併協議的條款,由證券持有人代表Old ZyVersa、Larkspur及合併附屬公司 完成先前公佈的業務合併,並於完成日期(I)Larkspur於截止日期(I)將其名稱更改為“ZyVersa治療公司”,及(Ii)合併 附屬公司合併至Old ZyVersa(“合併”)。隨着Old ZyVersa成為合併中倖存的公司,並在使該合併生效 後,Old ZyVersa成為ZyVersa的全資子公司。
我們的主要執行辦公室位於佛羅裏達州33326,韋斯頓,208室北商業大道2200號,我們的電話號碼是。我們的網站地址是http://www.zyversa.com.本招股説明書不包含本招股説明書中包含的信息或通過我們網站 以其他方式訪問的信息。
最近的發展
反向 股票拆分
2023年10月31日,我們的股東批准了我們的普通股流通股的反向拆分,拆分的比例在 10股1股到50股1股的範圍內,按董事會確定的比例和日期生效。我們的 董事會隨後決定,反向股票拆分的比例為35比1。在獲得批准後,我們向特拉華州州務卿提交了第二份修訂和重述的公司註冊證書的 修正案,以 實施反向股票拆分,生效時間為下午4:01。東部時間2023年12月4日。作為反向 股票拆分的結果,我們的普通股中每35股,無論是已發行的還是已發行的,在我們向特拉華州州務卿提交的我們對第二次修訂和重述的公司註冊證書的修訂提交和生效之前,被自動合併並轉換(無需任何進一步行動)為一股已繳足且不可評估的普通股。沒有發行與反向股票拆分相關的零碎股份。如果普通股的股份是直接持有的,則普通股的每一股零碎股份都將 四捨五入為普通股的最接近的完整份額。反向股票拆分 將普通股的流通股總數從反向拆分前的43,515,401股減少到反向拆分後的總流通股1,243,297股(受反向股票拆分產生的零碎股份 四捨五入的調整)。
本招股説明書中出現的所有財務信息、股份編號、期權編號、認股權證編號、其他衍生證券編號和行權價格,包括Larkspur證券的股票,均已進行調整 以實施反向股票拆分。
納斯達克缺乏症
納斯達克此前曾 通知本公司,其上市證券的買入價在過去30個工作日內每股收盤價低於1.00美元,因此不符合上市規則第5450(A)(1)條(“規則”)。根據上市規則 5810(C)(3)(A),本公司獲給予180個歷日,或直至2023年12月6日,以恢復遵守該規則。
2023年11月14日,納斯達克 向本公司發佈信函稱,截至2023年11月13日,確定本公司證券連續十個交易日的收盤價 為0.1美元或更低。因此,本公司須遵守上市規則 5810(C)(3)(A)(Iii)項下擬訂立的條文。因此,納斯達克決定自2023年11月16日起將公司證券從納斯達克全球市場退市,除非公司及時要求在納斯達克聽證會小組(“小組”)舉行聽證會。因此,納斯達克及時要求並安排在陪審團面前舉行聽證會,因此,在聽證會後陪審團的決定發佈以及陪審團可能批准的任何延期屆滿之前,納斯達克的任何退市行動將被擱置 。在聽證會上,公司將提交其計劃,以證明遵守規則的情況,並要求延長時間 。公司實施了上述反向股票拆分,試圖重新遵守規則 。不能保證將舉行聽證,也不能保證如果舉行聽證,小組將作出有利的決定。
| 8 |
產品
下面的 摘要包含有關此產品的基本信息。摘要並不打算是完整的。您應閲讀本招股説明書中其他部分包含的完整 文本和更具體的詳細信息。
| 提供的普通股 : | 400,000股 | |
| 預先出資的 認股權證: | 我們 還向投資者提供預先出資的認股權證,以購買最多3,600,000股普通股,如果投資者在此次發行中購買我們普通股的股票,將導致該投資者及其關聯公司和某些相關 方實益擁有超過4.99%(或在投資者選擇時,9.99%)的已發行普通股, 在本次發行完成後,有機會購買,代替普通股,否則將導致投資者的實益所有權超過4.99%(或,在購買者的選擇下,超過9.99%),預資金權證將以0.0001美元的行使價購買我們普通股的一股,我們稱之為預資金權證。每份預先出資的權證在發行時即可行使 ,並在全部行使時到期。每一份預先出資的認股權證將與A系列普通權證一起出售,以購買1股我們的普通股,並與B系列普通權證一起出售,以購買1股我們的普通股。每份預籌資權證和附帶普通權證的合併公開發行價格等於本次發行中出售的普通股和附帶普通權證的每股合併公開發行價減去0.0001美元。本招股説明書還涉及在行使預籌資認股權證時可發行的普通股。請參閲“我們提供的證券説明“ 瞭解更多信息。 | |
| 認股權證 提供: | 4,000,000 A系列普通令和4,000,000份B系列普通令。 每股普通股或預先融資的股票將與A系列普通令狀和B系列普通令狀一起提供。 A系列普通股將在發行開始至自該日期起五年結束的期間內行使。 B系列普通股將在發行開始至發行後十八個月結束的期間內行使 約會普通股的行使價為每股1.25美元。本招股説明書還與可發行普通股股份的發行有關 行使普通令狀後見“股本説明“以獲取更多信息。 | |
| 本次發行後發行的普通股: | 1,643,297股,假設本次發行中沒有行使任何預融資權證或普通權證。 |
| 9 |
| 使用收益的 | 我們 估計此次發行的淨收益約為435萬美元, 假設本次發行的所有證券均已售出,扣除配售代理費和我們預計應支付的發售費用後。然而,這是一個合理的最大努力要約,沒有最低證券數量或收益金額作為成交條件 ,我們可能不會出售根據本招股説明書 提供的全部或任何證券;因此,我們在此次發行中獲得的淨收益可能會大幅減少。例如,如果我們僅銷售最高報價的25%、50%或75%, 我們的淨收益將分別約為829,915美元、2,004,831美元或3,179,746美元。 我們只有在行使普通權證 行使價格為1.25美元的情況下,才會從行使與本次發售相關的普通權證 獲得額外收益。請參閲“收益的使用”。
我們 目前打算將此次發行的淨收益用於營運資金和其他一般公司用途,包括 支付應付賬款以及支付某些員工的未付工資和獎金。請參閲“使用收益的 “在這份招股説明書中。 | |
| 股票代碼 符號: | 我們的普通股在納斯達克上掛牌交易,代碼為“ZVSA”。預籌資金的權證或普通權證尚無既定的公開交易市場,我們預計不會發展這樣的市場。我們不打算申請在任何證券交易所或其他國家認可的交易系統上市預融資權證或普通權證。如果沒有活躍的交易市場,預融資權證和普通權證的流動性將受到限制。 | |
| 風險 因素: | 參見 “風險因素“以及本招股説明書中包含的其他信息,以討論您在投資我們的證券之前應考慮的因素。 |
發行後發行的已發行普通股數量以截至2023年12月5日的1,243,297股已發行普通股為基礎,截至該日,不包括以下內容:
| ● | 在行使與Larkspur首次公開募股相關的私募認股權證時可發行6,867股,加權平均行權價為每股402.50美元; | |
| ● | 166,439股於行使認股權證時可發行的股份,加權平均行使價為每股402.50美元; | |
| ● | 行使PIPE認股權證時可發行的139,403股,加權平均行權價為每股70.00美元; | |
| ● | 314,751股可在行使與我們的盡力而為發售相關的盡力而為權證時發行的股票,加權平均行權價為每股31.34美元,其中39,373股盡力而為權證重新定價,行權價 從行權價35.00美元降至5.78美元,作為2023年7月發售的一部分; | |
| ● | 715股作為標的的管材股份; | |
| ● | 20,665股B系列股票; | |
| ● | 45,032股Old ZyVersa認股權證,其中41,627股目前可通過行使公司向Old ZyVersa持有人發行並由本公司承擔的認股權證發行,加權平均行權價為245.72美元,3,405股將在 實現某些里程碑時發行; | |
| ● | 根據我們的2014年股權激勵計劃(“2014年計劃”)發行的股票期權行使時可發行56,999股,加權行權價為378.56美元; | |
| ● | 根據我們的2022年綜合股權激勵計劃(“2022年計劃”)發行的股票期權行使時可發行的41,523股, 加權行權價15.25美元; | |
| ● | 根據2023年獎勵計劃發行的股票期權在行使時可發行3,230股,加權平均行權價為每股74.45美元; | |
| ● | 2023年7月認股權證行使時可發行的160,182股,加權平均行權價為每股5.78美元; | |
| ● | 203,464股於行使誘導權證時可發行的股份,加權平均行使價為4.75美元 |
除非 明確説明或上下文另有要求,否則本招股説明書中的所有信息均假定未行使本招股説明書提供的普通權證或預先出資認股權證。
| 10 |
風險因素
投資我們的證券涉及高度風險。在做出投資決策之前,您應仔細考慮下面介紹的風險。我們的業務、前景、財務狀況或經營業績可能會受到任何這些風險的損害,以及我們目前不知道或我們目前認為無關緊要的其他風險。由於上述任何一種風險,我們證券的交易價格可能會下跌 ,因此,您可能會損失全部或部分投資。“風險因素”中的某些陳述是前瞻性陳述。請參閲“關於前瞻性陳述的告誡聲明”。
與我們的業務、財務狀況和資金需求相關的風險
我們當前和未來的候選產品可能永遠不會獲得批准或獲得商業市場認可。
我們的成功取決於市場的信心,即我們能夠為高度未得到滿足的醫療需求的患者開發候選產品,優化 健康結果並提高患者的生活質量。如果我們當前和未來的候選產品或與我們的協作者共同開發的產品未能按預期開發或執行,可能會嚴重影響我們的業務。我們和我們的合作伙伴可能無法成功 實現我們當前或未來候選產品的商業市場接受度,原因包括:
| ● | 我們在產品創新和商業增長方面的投資的影響; | |
| ● | 我們 向學術機構、生物製藥公司和醫學界展示我們平臺的效用及其相對於現有技術的潛在優勢的能力; | |
| ● | 我們和我們的合作者遵守FDA和其他法規要求的能力;以及 | |
| ● | 我們候選產品的開發速度以及在學術機構、關鍵意見領袖和倡導團體中的聲譽。 |
此外,由於研發計劃的變化、財務限制、監管環境、有關我們候選產品的負面宣傳或競爭產品,這些都是我們無法控制的情況,因此我們的業務可能會受到負面影響。 我們可能無法成功解決這些或其他可能影響市場對我們候選產品和技術接受的因素。 如果我們的候選產品未能開發、獲得批准或獲得市場的商業認可,可能會對我們的業務、財務狀況和運營結果造成嚴重損害。
我們 是一家處於發展階段的公司,運營歷史有限,沒有收入,有許多因素可能會影響我們的 前景。
我們 是一家處於發展階段的製藥公司,經營歷史有限,沒有收入。我們業務計劃的成功可能性必須考慮到在發展和擴大早期業務以及我們所處的監管和競爭環境方面經常遇到的問題、鉅額費用、困難、併發症和延誤。 製藥和生物製藥產品開發是一項投機性很高的工作,涉及很大程度的風險,而且 是一項資本密集型業務。因此,您應根據我們公司等處於發展階段的製藥公司經常遇到的成本、不確定性、延誤和困難來考慮我們的前景,並請注意,我們不能向您保證我們 將能夠成功應對這些風險。
到目前為止,我們的業務主要侷限於我們的組織和融資活動,談判我們的許可協議,以及開展VAR 200和IC 100的開發活動。我們尚未證明我們有能力成功完成大型關鍵臨牀試驗、獲得監管批准、製造商業規模的產品或安排第三方代表我們這樣做,或開展成功實現產品商業化所需的銷售和營銷活動,或管理運營中的上市公司。由於我們的經營歷史有限,我們對可能出現並影響我們業務的趨勢的洞察力有限,在制定應對這些趨勢和我們公司等處於發展階段的製藥公司所面臨的其他挑戰的方法時可能會出錯 。如果不能充分應對這些趨勢和挑戰,可能會導致我們的業務、運營結果和財務狀況受損或失敗。此外,我們有限的經營歷史可能會使我們的股東很難對我們未來成功或生存的可能性做出任何 預測。
| 11 |
可能影響我們前景的與我們的業務相關的因素 可能包括其他因素,例如:
| ● | 我們 有能力獲得額外資金來開發和商業化我們的候選產品; | |
| ● | 在實施我們的發展計劃的監管審查和審批方面出現任何延誤; | |
| ● | 推遲臨牀試驗的開始、登記和時間安排。 | |
| ● | 我們的臨牀前和臨牀試驗在臨牀前和臨牀發展的所有階段都取得了成功; | |
| ● | 在監管部門審查和批准我們的候選產品方面出現任何延誤; | |
| ● | 我們 為我們尋求在美國和外國司法管轄區開發的候選產品獲得並保持監管部門批准的能力; | |
| ● | 潛力 我們候選產品的副作用可能會延遲或阻礙商業化,限制我們候選產品的適應症, 如果獲得批准,則需要制定風險評估和緩解策略("REMS"),導致藥物獲得批准 從市場上撤下或使我們受到罰款和處罰以及第三方索賠; | |
| ● | 市場 接受我們的候選產品(如果批准上市); | |
| ● | 我們的 依賴第三方生產和供應我們的候選產品; | |
| ● | 我們的 依賴臨牀研究組織(“CRO”)進行我們的臨牀試驗; | |
| ● | 我們的 依賴合同製造組織(“CMO”)生產我們的產品用於臨牀目的和商業化; | |
| ● | 我們的 建立或維持合作、許可或其他安排的能力; | |
| ● | 我們的 識別、收購和整合其他業務、產品和/或技術的能力; | |
| ● | 我們的 能夠建立和維護有效的銷售和營銷基礎設施,或者通過創建商業基礎設施 或通過戰略合作; | |
| ● | 競爭 現有產品或可能出現的新產品; | |
| ● | 患者或醫療保健提供者獲得我們候選產品的覆蓋範圍或充分報銷的能力; | |
| ● | 我們的 我們的許可方成功獲取、維護、捍衞和執行知識產權的能力很重要 我們的業務; | |
| ● | 我們的 能夠利用我們合作伙伴的專有技術平臺來發現和開發其他候選產品; | |
| ● | 我們 有能力吸引和留住關鍵人員以有效管理我們的業務; | |
| ● | 我們 管理一家運營中的上市公司並繼續遵守美國證券交易委員會的規則和要求、在此基礎上頒佈的法規以及納斯達克的上市要求的能力; | |
| ● | 我們的 有能力建設我們的金融基礎設施,改善我們的會計制度和控制; | |
| ● | 潛力 產品責任索賠; | |
| ● | 潛力 與危險材料有關的責任;以及 | |
| ● | 我們的 有能力獲得並保持足夠的保險政策。 |
| 12 |
我們 從未盈利過。到目前為止,我們沒有數據支持監管部門批准我們的任何候選藥物產品,我們沒有 在任何司法管轄區獲得商業銷售批准的產品,我們也沒有從產品銷售中獲得任何收入。因此,我們減少虧損和實現盈利的能力未經證實,我們可能永遠無法實現或維持盈利。
我們 從未盈利過,在可預見的未來也不會盈利。截至2023年9月30日,我們在後繼期和前續期的累計淨虧損約為1.52億美元。我們已將大部分財務資源 投入到我們的組織和融資活動中,並就我們的許可協議以及其他戰略合作伙伴關係和合作進行談判。我們沒有通過收到市場批准完成任何候選產品的開發,因此我們沒有從產品銷售中獲得任何收入。由於與製藥 產品開發相關的眾多風險和不確定性,我們無法準確預測增加費用的時間或金額,或者我們何時或是否能夠實現或保持盈利。隨着我們繼續VAR 200的臨牀開發以及IC 100和其他候選產品的臨牀前開發,我們預計會產生更多費用,我們可能會尋求開發這些產品,並可能在美國和其他地方尋求營銷批准。我們還預計,與創建額外基礎設施相關的費用將會增加(包括招聘 額外人員),以開始臨牀試驗,並繼續開發VAR 200和IC 100以及我們可能尋求開發的其他候選產品,並將其商業化。因此,在可預見的未來,我們預計將繼續出現淨虧損和負現金流。這些淨虧損和負現金流已經並將繼續對我們股東的權益和營運資本產生不利影響。
迄今為止,我們已通過出售股本證券為我們的運營提供資金。我們未來淨虧損的數額將部分取決於我們支出的未來增長率和我們創造收入的能力。如果我們無法開發和商業化 VAR 200、IC 100或我們可能尋求開發的任何其他候選產品,無論是單獨還是與合作者合作,或者如果 任何獲得市場營銷批准的候選產品的收入不足,我們可能無法籌集額外資金,也無法 實現盈利。即使我們確實實現了盈利,我們也可能無法維持或提高盈利能力。
我們 可能無法繼續經營下去。
我們 是一家處於發展階段的製藥公司,沒有商業產品。我們的主要候選產品正在 開發過程中,需要大量額外的臨牀前和臨牀開發和投資,才有可能 商業化。因此,自成立以來,我們沒有從運營中產生任何收入,到目前為止,我們發生了大量淨虧損。此外,我們的現金狀況遠遠不足以支持我們的業務計劃,將需要大量額外資金來實施這些計劃,包括研究和開發我們的主要候選產品,為這些候選產品尋求監管 批准,以及在美國和其他市場進行商業化。我們獨立註冊的會計師事務所的報告包含一段解釋性段落,表示懷疑我們是否有能力繼續作為持續經營的企業 。這些情況使人對我們作為一個持續經營的企業繼續下去的能力產生了極大的懷疑。我們尤其相信,我們目前的現金和現金等價物僅足以滿足我們到2023年第四季度的預期現金需求 。如果我們無法繼續經營下去,我們可能不得不清算我們的資產,我們在清算或解散時收到的資產價值 可能顯著低於我們財務報表中反映的價值。此外,我們缺乏現金資源,以及我們可能無法繼續經營下去,可能會對我們的股本價值和我們籌集新資本或與第三方建立關鍵合同關係的能力產生重大不利影響。
| 13 |
我們 發現財務報告的內部控制存在重大缺陷。如果我們不能彌補重大弱點 並以其他方式維持有效的財務報告內部控制系統,我們的財務報告的可靠性、投資者對我們的信心和我們的普通股價值可能會受到不利影響。
作為一家上市公司,我們必須保持對財務報告的內部控制,並報告此類內部控制中的任何重大弱點。薩班斯-奧克斯利法案第404條(“第404條”)要求我們評估和確定財務報告內部控制的有效性,並提供財務報告內部控制的管理報告。重大缺陷是指財務報告的內部控制存在缺陷或缺陷的組合,使得年度或中期財務報表的重大錯報有可能無法得到及時預防或發現和糾正。
在對2022財年的審計中,我們發現財務報告的內部控制存在重大缺陷,因為我們沒有 設計和實施對重大且複雜的非常規交易的會計處理的有效控制。
我們的管理層計劃建立程序,持續監控和評估我們對財務報告的內部控制的有效性,並致力於採取進一步行動和實施必要的增強或改進,包括解決上述重大弱點所需的改進或改進。管理層希望在資源允許的情況下,儘快開始評估其財務報告內部控制的設計和運作有效性,包括制定和實施其補救計劃。但是,在適用的控制措施運行了足夠長的一段時間並且管理層通過測試得出結論認為這些 控制措施正在有效運行之前,不會認為實質性缺陷已得到補救。
如果 我們的措施不足以成功彌補重大弱點並以其他方式建立和維護有效的財務報告內部控制系統 ,我們財務報告的可靠性、投資者對我們的信心以及我們普通股的價值可能會受到重大不利影響。有效的財務報告內部控制對於我們 提供可靠和及時的財務報告是必要的,並與適當的披露控制和程序一起設計,以合理地 發現和防止欺詐。任何未能實施所需的新的或改進的控制措施,或在實施過程中遇到的困難,都可能導致我們無法履行我們的報告義務。只要我們是美國證券法規定的“較小的報告公司”,我們的獨立註冊會計師事務所就不需要證明我們根據第404條對財務報告進行的內部 控制的有效性。對財務報告的內部控制有效性進行獨立評估可以發現我們管理層評估可能無法發現的問題。我們對財務報告的內部控制 中未發現的重大缺陷可能會導致財務報表重述,並要求我們產生補救費用。
此外, 我們並不期望對財務報告的披露控制或內部控制能夠防止所有錯誤和所有欺詐行為。控制 系統,無論設計和操作多麼好,都只能提供合理而非絕對的保證,以保證控制系統的 目標將得到滿足。此外,控制系統的設計必須反映資源限制這一事實,並且必須考慮控制的效益 相對於控制成本。由於所有控制系統的固有侷限性, 控制措施的評估無法提供檢測到所有控制問題和欺詐事件(如果有的話)的絕對保證。我們的 控制系統未能防止錯誤或欺詐,可能會對我們造成重大不利影響。
我們 將需要額外的資金來開發和商業化我們的候選產品。如果我們無法籌集到足夠的資金,我們將被迫推遲、減少或取消我們的產品開發計劃。
開發 醫藥產品,包括進行臨牀前研究和臨牀試驗,費用高昂。我們預計,我們的研發費用 將隨着我們正在進行的活動而增加,特別是當我們開始VAR 200的臨牀試驗和IC 100的臨牀前開發 時。我們沒有承諾或安排任何額外融資,以資助VAR 200、IC 100或我們可能尋求開發的任何其他候選產品的開發和商業化工作。我們將需要籌集大量的額外資金,以開發VAR 200、IC 100以及我們可能尋求開發的任何其他候選產品並將其商業化。由於VAR 200或IC 100的成功開發是不確定的,我們無法估計完成其開發和 商業化所需的實際資金。
在 我們可以從VAR 200、IC 100或我們可能尋求開發的任何其他候選產品中獲得足夠的收入之前,我們預計將通過公開或私募股權發行、債務融資或公司合作和許可安排為未來的現金需求提供資金。 當我們需要額外的資金時,我們可能無法以我們可以接受的條款獲得這些資金,或者根本沒有。如果沒有足夠的資金 ,我們可能會被要求推遲、縮小或縮減我們的業務。就我們通過發行股權證券或可轉換為股權證券的證券籌集額外資金的程度而言,我們當時現有股東的所有權可能會被稀釋,稀釋程度可能會很大,具體取決於我們可能能夠出售證券的價格。此外,如果我們 通過產生債務來籌集額外資本,我們可能會受到限制我們業務活動的額外契約的約束 ,債務工具的持有人可能擁有優先於我們的股權投資者的權利和特權,並且償還此類債務工具下的 利息和本金償還義務可能會轉移原本可用於支持研發、臨牀或商業化活動的資金。因此,我們可能無法參與我們 尋求建立的協作。如果我們通過合作和許可安排籌集額外資金,則可能需要 放棄對我們的技術或候選產品的某些權利,或按可能對我們不利的條款授予許可。只要條件有利,我們 可能會尋求進入公共或私人資本市場,即使我們當時並不迫切需要 額外的資本。此外,已在我們的轉售登記表上註冊的證券(聲明為2023年10月20日生效)可能會限制我們以優惠條款籌集額外資本的能力,因為此類證券具有稀釋效應。此外,如果我們普通股的價格仍然低於在該轉售登記聲明中登記的認股權證的行權價格 ,則持有人不得行使該等認股權證,因此,我們將不會從該行使 中獲得任何收益。
我們的 未來資金需求(無論是近期還是長期)將取決於許多因素,包括但不限於:
| ● | 我們候選產品的臨牀前和臨牀試驗的啟動、進展、時間、成本和結果; | |
| ● | 如果 FDA要求我們對我們尋求開發的候選產品進行額外的研究,以超出我們預期的研究; | |
| ● | 我們可能建立的任何未來合作、許可或其他安排的條款和時間; | |
| ● | 監管批准的結果、時間和成本; | |
| ● | 競爭的技術和市場發展的影響; | |
| ● | 建立商業規模外包製造能力的成本和時間; | |
| ● | 市場 如果我們獲得監管部門的批准,將接受我們的候選產品; | |
| ● | 為候選產品建立銷售、營銷和分銷能力的成本(如果我們獲得監管部門的批准); 和 | |
| ● | 我們收購、授權或投資於業務、產品或技術的程度。 |
| 14 |
我們 受各種美國反腐敗法律以及其他反賄賂和反回扣法律法規的約束。
我們 受美國1977年修訂的《反海外腐敗法》(下稱《反海外腐敗法》)以及我們開展業務所在司法管轄區的其他反腐敗、反賄賂、反洗錢法律的約束。這些法律一般禁止我們和我們的員工 為了獲得或保留業務、將業務導向任何人或獲得任何不正當利益而以不正當方式影響政府官員或商業團體。《反海外腐敗法》和其他適用的反賄賂和反腐敗法律也可能要求我們對代表我們行事的第三方業務合作伙伴、代表和代理人實施的腐敗和賄賂行為承擔責任。我們 和我們的第三方業務合作伙伴、代表和代理可能與政府機構或國有或附屬實體的官員和員工 有直接或間接的互動,我們可能要為這些第三方業務合作伙伴和中介以及員工、代表、承包商和代理的腐敗或其他非法活動負責,即使我們沒有明確 授權此類活動。這些法律還要求我們保存準確的賬簿和記錄,並保持內部控制和合規程序,以防止任何此類行為。雖然我們有政策和程序來解決此類法律的合規性問題,但我們不能 保證我們的員工和代理商不會採取違反我們的政策或適用法律的行為,我們可能最終要為此承擔責任,並且隨着我們在國際業務的擴張以及我們在外國司法管轄區的銷售和 業務的增加,我們違反這些法律的風險增加。任何違反《反海外腐敗法》或其他適用的反賄賂、反腐敗和反洗錢法律的行為都可能導致舉報人投訴、媒體負面報道、調查、徵收鉅額法律費用、喪失出口特權、嚴厲的刑事或民事制裁或暫停或取消美國政府合同的資格、管理層的注意力大幅轉移、股票價格下跌或對我們業務的整體不利影響,所有這些都可能對我們的聲譽、業務、財務狀況和經營業績產生不利影響。
我們的財務狀況和運營結果可能會受到新冠肺炎疫情的不利影響。
疫情或流行病的發生 根據其規模,可能會對我們經營業務和開發候選產品的地區、州和地方經濟造成不同程度的破壞。當前的新冠肺炎疫情已經並可能繼續對我們的業務價值、經營業績和財務狀況產生實質性的不利影響。國際、 聯邦、州和地方公共衞生和政府當局為控制和抗擊新冠肺炎在全球各地區的爆發和傳播而採取的非常行動,包括旅行禁令、隔離、“呆在家裏”命令、暫停利息累算和對某些聯邦支持的學生貸款收取 以及許多個人和企業大幅限制日常活動的類似命令 導致了總體上消費者活動的減少。儘管新冠肺炎疫情造成的經濟放緩和高失業率的程度和持續時間目前仍不確定,特別是在新的病毒株出現並對疫苗接種工作構成潛在挑戰的情況下,但持續的顯著經濟放緩可能會對我們的財務狀況、流動性和運營結果產生重大不利影響。
涉及開發、監管審批和商業化的風險
大流行病、流行病或傳染病爆發(如COVID—19)可能會導致我們候選產品的開發中斷 。
Public health crises such as pandemics or similar outbreaks could adversely impact our business. In December 2019, a novel strain of a virus named SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2), or coronavirus, which causes COVID-19, surfaced in Wuhan, China and has since spread worldwide. The coronavirus pandemic is evolving, and to date has led to the implementation of various responses, including government-imposed quarantines, travel restrictions and other public health safety measures. The extent to which the coronavirus impacts our operations or those of our third-party partners, including our preclinical studies or clinical trial operations, will also depend on future developments, which are highly uncertain and cannot be predicted with confidence, including the duration of the outbreak, new information that will emerge concerning the severity of the coronavirus and the actions to contain the coronavirus or treat its impact, among others. The continued spread of COVID-19 globally could adversely impact our preclinical or clinical trial operations in the U.S. and abroad, including our ability to recruit and retain patients and principal investigators and site staff who, as healthcare providers, may have heightened exposure to COVID-19. For example, similar to other biopharmaceutical companies, we may experience delays in enrolling our current and/or planned clinical trials. COVID-19 may also affect employees of third-party CROs located in affected geographies that we rely upon to carry out our clinical trials. In addition, the patient populations that our lead and other core product candidates target may be particularly susceptible to COVID-19, which may make it more difficult for us to identify patients able to enroll in our future clinical trials and may impact the ability of enrolled patients to complete any such trials. Any negative impact COVID-19 has to patient enrollment or treatment or the execution of our product candidates could cause costly delays to clinical trial activities, which could adversely affect our ability to obtain regulatory approval for and to commercialize our product candidates, increase our operating expenses, and have a material adverse effect on our financial results.
| 15 |
此外, 計劃臨牀試驗的及時入組取決於臨牀試驗中心,這些中心可能受到全球健康問題(如流行病)的不利影響。我們計劃在當前受冠狀病毒影響的地區對候選產品進行臨牀試驗 。冠狀病毒爆發的某些因素會延遲或以其他方式對我們候選產品臨牀試驗的入組以及我們的業務產生不利影響,這些因素包括:
| ● | 醫療保健資源可能從臨牀試驗的實施轉移到關注流行病問題,包括 作為臨牀試驗研究者的醫生、作為臨牀試驗中心的醫院和醫院工作人員的注意 支持開展我們的前瞻性臨牀試驗; |
| ● | 限制 可能中斷關鍵試驗和業務活動(如臨牀試驗中心啟動和監查)的旅行,國內 員工、承包商或患者前往臨牀試驗中心的國際旅行,包括任何政府規定的旅行限制 或可能影響患者、員工或承包商前往參加我們臨牀試驗的能力或意願的臨時措施 網站或安全簽證或入境許可,失去與潛在合作伙伴的面對面會議和其他互動,任何 可能延遲或不利影響我們前瞻性臨牀試驗的進行或進展; |
| ● | 對我們第三方製造商運營的潛在負面影響; |
| ● | 中斷 在全球運輸中,影響我們產品原材料、臨牀試驗材料(如患者樣本)的運輸, 在我們的前瞻性臨牀試驗中使用的研究藥物和調節藥物以及其他供應品;以及 |
| ● | 業務 可能的工作場所、實驗室和辦公室關閉以及對員工在家工作的依賴增加造成的中斷, 正在進行的實驗室實驗和操作中斷或延誤、人員短缺、旅行限制或公共交通 中斷,其中任何一種都可能對我們的業務運營造成不利影響或延遲與當地監管機構的必要互動,道德操守 委員會和其他重要機構和承包商。 |
我們 已採取臨時預防措施,旨在幫助將病毒對我們員工的風險降至最低,包括讓 所有員工遠程工作,暫停員工在全球範圍內的所有非必要旅行,以及阻止員工出席行業活動和麪對面的工作相關會議,這可能會對我們的業務產生負面影響。我們目前無法預測企業和政府機構(如SEC或FDA)計劃和潛在關閉或中斷的範圍 和嚴重程度。
| 16 |
我們的 業務依賴於我們候選產品的成功開發、監管批准和商業化,特別是 VAR 200和IC 100。
我們業務的成功,包括我們為公司提供資金並在未來產生任何收入的能力,將主要取決於 我們候選產品的成功開發、監管批准和商業化或合作。將來,我們 也可能只依賴於我們的一個候選產品,或我們可能獲得許可、收購或開發的任何未來候選產品。 我們候選產品的臨牀前、臨牀和商業成功取決於多個因素,包括:
| ● | 能夠以可接受的條件籌集額外資本,或根本籌集額外資本; |
| ● | 及時的 完成我們的臨牀前和臨牀試驗,這可能比我們目前的預期慢得多或成本更高,並且 將在很大程度上取決於第三方承包商的表現; |
| ● | 如果 FDA或類似的外國監管機構要求我們進行除這些以外的其他臨牀前或臨牀試驗 計劃支持我們的候選產品或任何未來候選產品的批准和商業化; |
| ● | FDA和類似的外國監管機構接受我們的建議適應症和與我們候選產品的建議適應症相關的主要終點評估。 |
| ● | 我們的 能夠證明我們的安全性和有效性,使FDA和類似的外國監管機構滿意 候選產品或任何未來候選產品; |
| ● | 我們的 在藥代動力學研究中可檢測到的製劑中鑑定活性化合物的能力; |
| ● | 與我們的候選產品或未來獲批產品相關的潛在副作用的發生率、持續時間和嚴重程度 產品,如果有的話; |
| ● | 及時收到FDA和類似外國監管機構的必要上市批准; |
| ● | 實現 並維護並(如適用)確保我們的第三方承包商實現並維護我們的合同規定 義務和適用於我們的候選產品或任何未來候選產品或已批准的所有監管要求 產品,如果有的話; |
| ● | 與我們簽訂合同的第三方生產候選產品的臨牀試驗和商業供應品的能力,或 任何未來候選產品,在監管機構中保持良好信譽,並開發、驗證和保持商業可行性 符合當前良好生產規範或cGMP或良好農業和採集的生產工藝 或GACP; |
| ● | a 在臨牀前和臨牀開發期間以及我們的候選產品獲批後,安全性特徵持續可接受 或任何未來的候選產品; |
| ● | 我們的 有能力在美國和國際上成功地將我們的候選產品或任何未來的候選產品商業化, (a)在該等國家和地區批准單獨或與他人合作銷售、銷售和分銷; |
| ● | 驗收 由醫生、患者和支付方對我們候選產品或任何未來候選產品的益處、安全性和有效性進行評估, 如果獲得批准,包括與替代治療和競爭治療有關的; |
| ● | 我們的 能夠遵守多項批准後監管要求; |
| ● | 我們的 以及我們的合作伙伴在候選產品或任何未來產品中建立和實施知識產權的能力 候選產品; |
| ● | 我們的 以及我們的合作伙伴避免第三方專利幹擾或知識產權侵權索賠的能力;以及 |
| ● | 我們的 能夠獲得許可證或獲得我們相信能夠成功開發的其他候選產品或商業階段產品 和商業化。 |
VAR 200可能無法獲得FDA指定為FSGS孤兒藥。FDA於2018年9月 17日收到了我們的孤兒藥認定申請。無法授予孤兒藥認定,原因是(1)用於支持申請的FSGS臨牀前模型反映了 FSGS的預防而非治療,後者是VAR 200的擬定適應症,以及(2)FDA認為根據所用假設和計算,提供的患病率估計值 被低估。我們計劃在VAR 200的臨牀 數據可用時,重新申請孤兒藥認定,並使用其他信息支持FSGS的流行率。
| 17 |
如果我們不能及時或根本實現上述一個或多個因素(其中許多是我們無法控制的),我們可能會遇到重大延誤和成本增加,或者無法獲得監管部門的批准或將我們的候選產品商業化。 即使獲得監管部門的批准,我們也可能永遠無法成功地將我們的任何候選產品商業化。因此, 我們不能向您保證,我們將能夠通過銷售我們的候選產品或任何未來的候選產品來產生足夠的收入以繼續運營。
我們的候選產品IC 100的臨牀前藥物開發非常昂貴、耗時且不確定。我們的臨牀前試驗可能無法 充分展示感興趣的治療領域的藥理活性;在其他身體系統中造成意想不到的短期或長期影響;或產生可能改變或風險益處評估的意外毒性。具有反映IC100作用機制的一類化合物尚未進入臨牀試驗,其藥理類的作用也尚不清楚。這些因素和其他 因素可能會阻礙或推遲進一步的發展。
形成我們開發和開發候選產品的基礎的 科學發現相對較新。支持基於我們的方法開發試劑的可行性的科學證據是初步的,也是有限的。IC 100代表了一種新的治療模式,成功的開發可能需要更多的研究和努力來優化其治療潛力。IC 100可能無法在實驗室或臨牀前研究中向患者展示其治療特性,並可能以不可預見的、無效的甚至有害的方式與人類生物系統相互作用。如果我們不能成功地開發IC 100並將其商業化,我們可能永遠不會盈利,我們的股本價值可能會下降。
IC 100是一種相對新穎的技術,因此很難預測開發時間和成本,以及隨後獲得 監管部門批准的時間和成本。
我們 將我們的研究和開發努力集中在有限數量的初始目標疾病適應症上。不能保證 我們在開發當前或未來的適應症時不會遇到問題或延遲,也不能保證此類問題或延遲不會導致意外成本,也不能保證任何此類開發問題都能得到解決。在IC 100上生成的臨牀前數據以及擬議的臨牀開發計劃需要FDA根據調查性新藥申請進行審查和許可。我們尚未生成支持此類申請的數據,臨牀前研究的結果將需要FDA在啟動臨牀研究之前進行審查,而臨牀研究可能不會獲得批准。
我們 在使用和擴展我們的開發平臺以構建候選產品管道方面可能無法成功。
我們IC 100戰略的一個關鍵要素是使用我們經驗豐富的管理和科學團隊來評估各種人類疾病的IC 100,以建立一個候選產品渠道。儘管到目前為止,我們的研究和開發工作已經產生了潛在的候選產品,但我們可能無法繼續識別和開發其他候選產品。即使我們成功地繼續建立我們的渠道,我們確定的潛在候選產品也可能不適合臨牀開發。 例如,這些潛在候選產品可能會被證明具有有害的副作用或其他特徵,表明它們不太可能獲得上市批准和市場認可。如果我們不能根據我們的方法成功開發候選產品並將其商業化,我們將無法在未來期間獲得產品收入,這可能會對我們的財務狀況造成重大的 損害。不能保證我們將在臨牀前和臨牀開發中取得成功,在任何情況下,獲得監管批准的過程都需要花費大量的時間和財力。
| 18 |
我們候選產品的臨牀 藥物開發非常昂貴、耗時且不確定。我們的臨牀試驗可能無法充分 證明我們候選產品的安全性和有效性,這可能會阻礙或延遲監管部門的批准和商業化。
我們候選產品的臨牀藥物開發非常昂貴、耗時、難以設計和實施,而且其結果本身就不確定。在獲得監管機構對候選產品商業銷售的批准之前,我們必須通過臨牀試驗證明候選產品用於目標適應症既安全又有效,這是不可能預測的。大多數開始臨牀試驗的候選產品從未獲得監管部門的商業化批准。我們的候選產品處於不同的開發階段,在任何測試階段或在 試驗過程中的任何時間,都可能出現多個臨牀試驗失敗的情況。我們預計這些候選產品的臨牀試驗將持續數年,但可能需要比預期更長的時間才能完成。並不是我們所有的候選產品都經過了人體測試,首次在人體上使用可能會產生意想不到的效果。我們還沒有完成所有的臨牀試驗,以獲得我們任何候選產品的批准。
我們 可能會在當前和未來的候選產品臨牀試驗中遇到延誤,並且不知道未來的臨牀試驗(如果有)是否會按時開始、是否需要重新設計、是否按時入組足夠數量的患者或是否會按時完成(如果有的話)。 此外,我們、我們目前或將來可能與之合作的任何合作伙伴、FDA、機構審查委員會(以下簡稱"IRB") 或其他監管機構(包括州和地方機構以及外國的對應機構)可隨時暫停、延遲、 要求修改或終止我們的臨牀試驗,原因包括:
| ● | 發現 安全性或耐受性問題,例如嚴重或意外毒性或副作用或暴露於其他不可接受的環境 研究參與者經歷的健康風險或其他安全性問題; |
| ● | 缺少 臨牀試驗期間任何候選產品的有效性或我們的候選產品未能達到指定終點; |
| ● | 慢 受試者招募率和入組率高於預期,或無法入組足夠數量的臨牀患者 由多種因素導致的試驗,包括其他公司對其候選產品進行的臨牀試驗的普遍性 針對相同適應症,或針對患者不常尋求治療的適應症進行臨牀試驗; |
| ● | 延遲 或由於COVID—19疫情導致的延遲或其他限制,我們的臨牀試驗遇到困難; |
| ● | 難以留住已開始臨牀試驗但可能因治療的不良副作用而隨時退出的受試者, 療效不足、對臨牀試驗過程感到疲勞或任何其他原因; |
| ● | 難度 在獲得IRB批准,以便在每個臨牀試驗中心進行研究; |
| ● | 延遲 生產或獲得,或無法生產或獲得足夠數量的臨牀試驗材料; |
| ● | 不足 我們的生產工藝或產品配方或交付方法的變更; |
| ● | 更改 適用的法律、法規和監管政策; |
| ● | 延遲 或未能就臨牀試驗合同或預期合同研究方案中的可接受條款達成一致 組織(“CRO”)、臨牀試驗中心和其他第三方承包商; |
| ● | 無法 增加足夠數量的臨牀試驗中心; |
| ● | 不確定性 關於正確的配方和劑量; |
| ● | 失敗 由我們、我們的員工、我們的CRO或他們的員工或其他第三方承包商遵守合同和適用的法規 要求或以及時或可接受的方式履行其服務; |
| ● | 失敗 由我們、我們的員工、我們的CRO或他們的員工或我們可能與之合作的任何合作伙伴或他們的員工遵守 與臨牀試驗的實施或處理、儲存、安全和 相關的適用FDA或其他監管要求 藥品和生物製品的記錄保存; |
| ● | 日程安排與參與的臨牀醫生和臨牀機構發生衝突; |
| ● | 未能設計適當的臨牀試驗方案; |
| ● | 數據不足,無法支持監管部門的審批; |
| ● | 醫療研究人員不能或不願意遵循我們的臨牀方案;或 |
| ● | 難度 在治療期間或治療後與受試者保持聯繫,這可能導致數據不完整。 |
我們 或我們可能合作的任何合作伙伴可能會在臨牀試驗中遭受重大挫折,類似於 製藥和生物技術行業的許多其他公司的經歷,即使在早期試驗中獲得了令人鼓舞的結果。如果 我們或我們的潛在合作伙伴放棄或延遲了與我們候選產品相關的臨牀開發工作, 我們可能無法有效執行我們的業務計劃,我們的業務、財務狀況、經營成果和前景將受到損害 。
| 19 |
更改候選產品製造或配方的方法 可能會導致額外成本或延遲。
隨着 候選產品從臨牀前研究到後期臨牀試驗,以獲得潛在的批准和商業化, 開發計劃的各個方面(如生產方法和配方)在此過程中經常發生變化 以優化工藝和結果。這些變更有可能無法實現這些預期目標。任何 這些變更都可能導致我們的候選產品性能不同,並影響計劃的臨牀試驗或 使用變更後的材料進行的其他臨牀試驗的結果。此類變更還可能需要額外的測試、FDA通知或FDA 批准。這可能會延遲臨牀試驗的完成,需要進行橋接臨牀試驗或重複一個或多個臨牀試驗。
根據適用的法規要求,我們 可能無法獲得VAR 200或IC 100的法規批准。 FDA和外國監管機構在批准過程中有很大的自由裁量權,包括延遲、限制或拒絕 候選產品批准的能力。延遲、限制或拒絕任何監管批准將對商業化、 我們的創收潛力、我們的業務和經營成果造成不利影響。
We currently have no products approved for sale, and we may never obtain regulatory approval to commercialize any of our current or future product candidates. The research, testing, manufacturing, safety surveillance, efficacy, quality control, recordkeeping, labeling, packaging, storage, approval, sale, marketing, distribution, import, export and reporting of safety and other post-market information related to our drug products are subject to extensive regulation by the FDA and other regulatory authorities in the United States and in foreign countries, and such regulations differ from country to country. We are not permitted to market any of our current product candidates in the United States until we receive approval of a NDA, BLA or other applicable regulatory filing from the FDA. We are also not permitted to market any of our current product candidates in any foreign countries until we or our partners receive the requisite approval from the applicable regulatory authorities of such countries. To gain approval to market a new drug such as VAR 200 or IC 100, the FDA and/or foreign regulatory authorities must receive, among other things, preclinical and clinical data that adequately demonstrate the safety, purity, potency, efficacy and compliant manufacturing of the drug product for the intended indication applied for in a NDA, BLA or other applicable regulatory filing. The development and approval of new drug products involves a long, expensive and uncertain process, and delay or failure can occur at any stage. A number of companies in the pharmaceutical and biopharmaceutical industry have suffered significant setbacks in nonclinical development, clinical trials, including in Phase 3 clinical development, even after promising results in earlier preclinical studies or clinical trials. These setbacks have been caused by, among other things, findings made while clinical trials were underway and safety or efficacy observations made in clinical trials, including previously unreported adverse events. Success in clinical trials does not ensure that later clinical trials will be successful, or that nonclinical studies will be successful. The results of clinical trials by other parties may not be indicative of the results in trials we or our partners may conduct.
| 20 |
FDA和外國監管機構在藥物開發和批准過程中有很大的自由裁量權,包括 出於多種原因推遲、限制藥物開發或限制或拒絕候選產品的批准。FDA或適用的外國監管機構 可以:
| ● | 不同意 設計或實施一項或多項臨牀試驗; |
| ● | 不是 認為候選產品在其擬定適應症方面是安全有效的,或者認為候選產品的安全性或其他 感知風險超過其臨牀或其他受益; |
| ● | 不是 發現來自臨牀前研究和臨牀試驗的數據足以支持批准,或者臨牀試驗的結果可能 不符合FDA或相關外國監管機構批准所要求的統計學或臨牀意義水平; |
| ● | 不同意 通過我們對臨牀前研究或臨牀試驗數據的解釋,或通過解釋 我們可能與之合作的任何合作伙伴; |
| ● | 確定 從臨牀前或臨牀試驗中收集的數據可能不足以支持IND或NDA或其他 適用的監管備案; |
| ● | 要求 其他臨牀前研究或臨牀試驗; |
| ● | 標識 我們當前或未來候選產品在配方、質量控制、標籤或規格方面的缺陷; |
| ● | 要求在兒科患者中進行臨牀試驗,以確定對藥物更敏感的人羣的藥代動力學或安全性; |
| ● | 批准取決於昂貴的批准後額外臨牀試驗的表現; |
| ● | 批准 我們當前或任何未來的候選產品,使其具有比我們最初要求的更有限的適應症或更窄的患者羣體 或帶有可能影響市場的強烈警告; |
| ● | 不批准我們認為對我們的候選產品成功商業化是必要或可取的標籤; |
| ● | 不是 批准第三方製造商或與我們簽訂合同的測試實驗室的製造工藝、控制或設施; |
| ● | 考慮 我們的產品是一種設備,而不是一種需要不同審批程序和生產需求的藥物; |
| ● | 考慮 我們的一種產品是組合產品,而不是需要額外臨牀試驗或增加數量的單一藥物 每項研究的患者;或 |
| ● | 更改 我們的批准政策或採用新法規,使我們的臨牀數據或監管文件不足以批准。 |
任何 延遲、限制或拒絕我們的任何候選產品的任何適用監管批准將延遲或對我們候選產品的商業化產生不利影響 ,並將損害我們的業務、財務狀況、經營成果和前景。
| 21 |
即使 我們當前的候選產品或任何未來的候選產品獲得了監管部門的批准,它們也可能無法獲得醫生和患者廣泛的應用, 商業成功所需。
我們當前或未來的任何候選產品,如果獲得批准,其商業成功將在很大程度上取決於醫生、患者和支付者對所得產品的廣泛採用和 用於獲批適應症,並且可能無法獲得商業成功。 我們當前或未來候選產品的採用程度和比率(如果獲得批准)將取決於多個因素,包括:
| ● | 產品獲批的臨牀適應症以及患者對治療這些適應症的獲批產品的需求; |
| ● | 與其他可用療法相比,我們產品的有效性; |
| ● | 為我們的任何候選產品提供覆蓋範圍和從管理式護理計劃和其他醫療保健支付方獲得的充分補償 可獲批准; |
| ● | 與替代治療相關的候選產品的治療成本以及產品支付意願(如果獲得批准), 患者的一部分; |
| ● | 驗收 被醫生、診所主要經營者和患者視為安全有效的治療方法; |
| ● | 醫生 以及患者願意採用新療法而不是其他可用療法來治療批准的適應症; |
| ● | 克服 醫生或患者可能對特定治療方法的任何偏見,用於治療獲批適應症; |
| ● | 固有 醫生和醫務人員培訓和管理我們的候選產品; |
| ● | 患者 對我們候選產品的結果和管理以及整體治療經驗的滿意度; |
| ● | 與替代療法相比,我們的候選產品可能為醫生提供的收入和盈利能力; |
| ● | 副作用的發生率和嚴重程度; |
| ● | 限制 或FDA批准的候選產品標籤中包含的警告; |
| ● | 任何 FDA要求進行風險評估和緩解策略,或REMS; |
| ● | 我們的銷售、營銷和分銷工作的有效性; |
| ● | 我們 有能力維持充足的供應量以滿足需求; |
| ● | 對我們候選產品的負面宣傳或對競爭產品的正面宣傳;以及 |
| ● | 潛在的 產品責任索賠。 |
如果我們當前或未來的任何候選產品被批准使用,但未能達到商業成功所需的醫生和患者的廣泛採用 ,我們的運營結果和財務狀況將受到不利影響,這可能會推遲、阻止 或限制我們創造收入和繼續業務的能力。
| 22 |
我們的 候選產品如果獲得批准,將面臨激烈的競爭,如果我們不能有效競爭,可能會阻礙我們實現顯著的市場滲透。
製藥行業的特點是技術快速進步、競爭激烈,並高度重視開發專利療法。許多製藥公司、仿製藥公司、生物技術公司以及學術和研究機構都在從事醫療保健產品的開發、專利申請、製造和營銷,與我們正在開發的產品具有競爭力,包括Travere、輝瑞、Goldfinch Bio、勃林格-英格爾海姆、阿斯特拉-捷利康、賽諾菲、諾華、羅氏和其他公司。 我們的許多競爭對手擁有更強大的財務資源、營銷能力、銷售隊伍、製造能力、研發能力、臨牀試驗專業知識、知識產權組合、獲得專利和監管批准的經驗以及對產品候選和其他資源的批准。一些提供競爭產品的公司還擁有廣泛的其他產品、龐大的直銷隊伍以及與我們的目標醫生的長期客户關係,這可能會阻礙我們的市場滲透努力。此外,如果我們的某些候選產品獲得批准,可能會與一些患者的可自由支配預算份額競爭,並在臨牀實踐中爭取醫生的關注。
我們 預計,如果我們的候選產品獲得監管部門的批准,我們將面臨來自其他批准的 療法的激烈競爭。如果獲得批准,我們的候選產品還可能與不受監管、未經批准、標籤外和非處方藥競爭。 如果獲得批准,我們的某些候選產品將針對已批准的適應症提出新的治療方法,並將 與現有療法競爭,其中一些療法廣為人知,併為醫生和患者所接受。要在這個市場上成功競爭,我們必須證明我們批准的產品的相對成本、安全性和有效性(如果有的話)是現有療法和其他新療法的一個有吸引力的 替代方案。這種競爭可能會導致我們候選產品的市場份額減少,並對我們候選產品的定價造成下行壓力,這可能會損害我們的業務、財務狀況、經營業績和前景 。
我們 預計我們的候選產品將面臨通用或類似類型的產品競爭,這可能會對我們的業務、財務狀況、經營業績和前景產生不利影響。
在 我們的任何候選產品的專利保護到期或喪失時,或者當我們的任何候選產品的專利保護到期或失去時,儘管我們的任何候選產品的仿製藥競爭對手對該仿製藥或其等價物提起了未決的專利侵權訴訟,但該產品已獲批准,且其銷售價格可能顯著低於我們已批准的產品 ,我們可能會在短時間內損失該產品的很大一部分銷售額,這將對我們的業務、財務狀況、運營結果和前景產生不利影響。
我們將商業化的任何候選產品或我們可能與之合作的任何合作伙伴都將接受持續的 和持續的監管審查。
即使在我們或我們的合作伙伴獲得美國監管機構對候選產品的批准(如果有)之後,我們或我們的合作伙伴仍將繼續 接受監管審查和合規義務。例如,對於我們的候選產品,FDA可能會對產品可能上市的批准的指定用途或批准條件施加重大限制 。候選產品的批准 可能包含對可能代價高昂的批准後研究和監測的要求,包括第四階段臨牀試驗或REMS,以監測產品的安全性和有效性。我們還將繼續接受FDA的義務和持續的監管審查,涉及我們的候選產品的製造、加工、標籤、包裝、分銷、不良事件報告、儲存、廣告、促銷和記錄等。這些要求包括提交安全性和其他上市後信息和報告、註冊以及繼續遵守cGMP要求、FDA的良好臨牀實踐、或GCP、或良好農業和採集規範或GACP、要求和良好實驗室規範或GLP要求,這些要求是FDA在臨牀和臨牀前開發中對所有候選產品以及我們在批准後進行的任何臨牀試驗執行的法規和指南。如果候選產品在其他國家/地區獲準銷售,我們 可能會受到這些國家/地區的法律和政府監管機構施加的類似限制和要求。
| 23 |
如果 我們、我們的合作伙伴、候選產品或候選產品的製造設施未能遵守適用的法規 要求,監管機構可以:
| ● | 強加 限制產品的銷售或生產,暫停或撤銷產品批准或撤銷必要的許可證; |
| ● | 要求修改宣傳材料或要求我們向醫療從業者提供正確的信息; |
| ● | 要求 我們或我們的合作伙伴簽署同意令,其中可能包括施加各種罰款,報銷檢查費用, 規定的具體行動和不遵守規定的處罰期限; |
| ● | 問題 警告信、説明原因通知書或描述涉嫌違規行為的無標題信件,這些信件可能公開; |
| ● | 開始 刑事調查和起訴; |
| ● | 強加 禁止、暫停或取消必要的批准或其他許可證; |
| ● | 強加 其他民事或刑事處罰; |
| ● | 暫停 任何正在進行的臨牀試驗; |
| ● | 推遲或拒絕批准我們或我們的潛在合作伙伴提交的未決申請或已批准申請的補充申請; |
| ● | 拒絕允許藥品或易製毒化學品進出口到美國或從美國出口; |
| ● | 暫停運營或對運營施加限制,包括成本高昂的新制造要求;或 |
| ● | 扣押或扣留產品,或要求我們或我們的合作伙伴啟動產品召回。 |
FDA和其他適用政府機構的法規、政策或指導意見可能會發生變化,可能會頒佈新的或附加的法規或政府 法規,以阻止或推遲監管部門對我們候選產品的審批,或者進一步限制或規範審批後的活動。我們無法預測美國或國外未來的立法或行政行動可能產生的不利政府監管的可能性、性質或程度。如果我們不能實現並保持法規遵從性, 我們可能不被允許營銷我們的候選產品,這將對我們創造收入和實現或 保持盈利的能力產生不利影響。
我們 未來可能會在美國和FDA以外的地方為我們的候選產品進行臨牀試驗,適用的外國監管機構可能不接受此類試驗的數據。
我們 未來可能會選擇在美國以外進行一項或多項臨牀試驗,包括在加拿大、歐洲和南美洲。儘管FDA或適用的外國監管機構可以接受來自在美國或適用司法管轄區以外進行的臨牀試驗的數據,但FDA或適用的外國監管機構接受此類研究數據可能受某些條件的限制。如果外國臨牀試驗的數據打算用作美國上市審批的基礎,FDA將不會僅根據外國數據批准申請,除非這些數據適用於美國人口和美國醫療實踐;研究由公認能力的臨牀研究人員進行;並且數據被認為 有效,無需FDA進行現場檢查,或者如果FDA認為有必要進行此類檢查,FDA能夠 通過現場檢查或其他適當方式驗證數據。許多外國監管機構都有類似的要求。 此外,此類外國研究將受到進行研究的外國司法管轄區適用的當地法律的約束。 不能保證FDA或適用的外國監管機構會接受在美國或適用司法管轄區以外進行的試驗數據。如果FDA或適用的外國監管機構不接受此類數據,可能會 導致需要額外的試驗,這將是昂貴和耗時的,並會延誤我們業務計劃的各個方面。
| 24 |
我們的 候選產品可能會導致不良副作用或具有其他意想不到的特性,可能會延遲或阻止其監管 審批、限制已批准標籤的商業形象或導致審批後的監管行動。
我們的任何候選產品都可能在臨牀開發期間或(如果批准)在批准的產品上市後出現不可預見的副作用 。候選產品引起的不良副作用可能會導致我們、我們可能與之合作的任何合作伙伴或監管機構中斷、修改、延遲或暫停臨牀試驗,並可能導致更嚴格的標籤或FDA或類似外國機構的監管批准延遲 。臨牀試驗的結果可能揭示出嚴重且不可接受的副作用的嚴重性和流行率。在這種情況下,試驗可能暫停或終止,FDA或類似的外國監管機構可以命令我們或我們的潛在合作伙伴停止任何或所有目標適應症的候選產品 的進一步開發或拒絕批准。與藥物相關的副作用可能會影響患者招募或入選患者完成試驗的能力或導致產品責任索賠。任何此類事件都可能損害我們的業務、財務狀況、經營業績和前景。
此外, 如果我們或其他人發現我們的候選產品在獲得美國或外國監管機構批准或其他含有相同或相關活性成分的產品後導致的不良副作用或其他以前未知的問題,可能會導致一些潛在的負面後果 ,包括:
| ● | 監管部門可能會撤回對該產品的批准; |
| ● | 監管部門可能要求召回產品,或者我們或我們的潛在合作伙伴可能會自願召回產品; |
| ● | 監管當局可以要求在產品標籤中增加警告或禁忌症,縮小產品標籤中的適應症範圍,或向醫生和藥店發出現場警報; |
| ● | 我們 可能需要創建一份藥物指南,概述此類副作用的風險,以便分發給患者,或者制定一項REMS; |
| ● | 我們 在如何推廣產品方面可能有限制; |
| ● | 我們 可能被要求改變產品的給藥方式或以其他方式修改產品;FDA或適用的外國監管機構可能要求進行額外的臨牀試驗或昂貴的上市後測試和監測,以監控產品的安全性或有效性; |
| ● | FDA或適用的外國監管機構可能需要額外的臨牀試驗或昂貴的上市後測試和監測 以監測產品的安全性或有效性 |
| ● | 該產品的銷售額 可能大幅下降; |
| ● | 我們 可能會被起訴,並對給患者造成的傷害承擔責任;以及 |
| ● | 我們的 品牌和聲譽可能受到影響。 |
由不良副作用或其他以前未知的問題引起的任何 上述事件可能會阻礙我們或我們的潛在合作伙伴 實現或維持受影響候選產品的市場接受度,並可能大幅增加 我們候選產品的商業化成本。
| 25 |
我們 可能會面臨產品責任風險,如果我們的索賠成功,如果我們的保險 覆蓋範圍不足,我們可能會承擔重大責任。
由於對候選產品進行臨牀測試,我們 面臨產品責任的內在風險,如果我們將任何產品商業化,將面臨更大的 風險。即使產品獲得FDA批准進行商業銷售,並且 在FDA或適用的外國監管機構許可和監管的工廠中生產,也存在此風險。我們的產品和候選產品 旨在影響重要的身體功能和過程。與 我們的候選產品相關的任何副作用、製造缺陷、誤用或濫用都可能導致患者受傷甚至死亡。我們不能保證我們將來不會面臨產品 責任訴訟,也不能保證我們的保險範圍足以覆蓋我們在任何 此類情況下的責任。
此外,即使我們的候選產品只是看起來造成了傷害,我們也可能會對我們提出責任索賠。消費者、醫療保健提供者、製藥公司或其他銷售或以其他方式 與我們候選產品接觸的其他人,可能會對我們提出產品 責任索賠。如果我們不能成功地保護自己免受產品責任索賠 ,我們將承擔重大責任和聲譽損害。此外,無論價值或最終結果如何,產品責任 索賠可能導致:
| ● | 臨牀試驗參與者退出; |
| ● | 終止臨牀試驗地點或整個試驗項目; |
| ● | 無法 獲得監管部門對我們候選產品的批准; |
| ● | 無法將我們的候選產品商業化; |
| ● | 減少了對我們候選產品的 需求; |
| ● | 商譽受損 ; |
| ● | 產品 召回或從市場上撤回,或標籤、營銷或促銷限制; |
| ● | 任何相關訴訟或類似糾紛的鉅額費用; |
| ● | 將管理層的注意力和其他資源從我們的主要業務中分心; |
| ● | 實質性 向患者或其他針對我們的索賠人提供的金錢賠償,但可能不在保險範圍內;或 |
| ● | 收入損失 。 |
我們 目前保留產品責任保險,該保險可能不足以涵蓋我們所有與產品責任相關的費用 或損失,並且可能無法涵蓋我們可能遭受的任何費用或損失。此外,保險範圍正變得越來越昂貴, 而且,在未來,我們可能無法以合理的成本、足夠的金額或適當的條款維持保險範圍 ,以保護我們免受因產品責任而造成的損失。如果我們的任何產品 候選產品獲得監管部門批准,我們將需要增加產品責任保險範圍,這將是很昂貴的,而且我們可能無法以商業上合理的條款或根本無法獲得這種增加的產品責任保險 。一個成功的產品責任索賠或一系列索賠可能導致 我們的股價下跌,如果判決超過我們的保險範圍,可能減少我們的現金,並可能損害我們的業務、財務狀況、經營成果和前景。
| 26 |
如果 我們的任何候選產品獲得上市批准,並且發現我們不當地推廣了標籤外使用,或者如果醫生 濫用我們的產品或標籤外使用我們的產品,我們可能會受到禁止銷售或營銷產品、 產品責任索賠和鉅額罰款、處罰和制裁的約束,我們的品牌和聲譽可能會受到損害。
The FDA and other regulatory agencies strictly regulate the marketing and promotional claims that are made about drug and biologic products. In particular, a product may not be promoted for uses or indications that are not approved by the FDA or such other regulatory agencies as reflected in the product’s approved labeling and comparative safety or efficacy claims cannot be made without direct comparative clinical data. If we are found to have promoted off-label uses of any of our product candidates, we may receive warning or untitled letters and become subject to significant liability, which would materially harm our business. Both federal and state governments have levied large civil and criminal fines against companies for alleged improper promotion and have enjoined several companies from engaging in off-label promotion. If we become the target of such an investigation or prosecution based on our marketing and promotional practices, we could face similar sanctions, which would materially harm our business. In addition, management’s attention could be diverted from our business operations, significant legal expenses could be incurred and our brand and reputation could be damaged. The FDA has also requested that companies enter into consent decrees or permanent injunctions under which specified promotional conduct is changed or curtailed. If we are deemed by the FDA to have engaged in the promotion of our products for off-label use, we could be subject to FDA regulatory or enforcement actions, including the issuance of an untitled letter, a warning letter, injunction, seizure, civil fine or criminal penalties. It is also possible that other federal, state or foreign enforcement authorities might take action if they consider our business activities constitute promotion of an off-label use, which could result in significant penalties, including criminal, civil or administrative penalties, damages, fines, disgorgement, exclusion from participation in government healthcare programs and the curtailment or restructuring of our operations.
但是,當醫生 獨立專業醫學判斷認為合適時,我們 不能阻止醫生在這些適應症之外使用我們的候選產品。醫生還可能濫用我們的候選產品或使用不當的 技術,可能導致不良結果、副作用或傷害,從而可能導致產品責任索賠。如果我們的候選產品 被誤用或使用不當技術,我們可能會受到醫生或患者高昂的訴訟。此外, 將我們的候選產品用於FDA批准的適應症以外的適應症可能無法有效治療此類疾病,這 可能會損害我們在醫生和患者中的聲譽。
我們 可以選擇在開發期間或審批後的任何時間不繼續開發或商業化我們的任何候選產品,這將減少或消除我們對這些候選產品的潛在投資回報。
在 任何時候,我們可能會出於各種原因決定停止任何候選產品的開發或不繼續將一個或多個已獲批准的候選產品商業化,包括出現使我們的產品過時的新技術、來自競爭對手產品的競爭、或更改或未遵守適用的法規要求。如果我們終止我們已投入大量資源的計劃 ,我們將不會從投資中獲得任何回報,並且我們將錯過將這些資源分配到潛在更高效用途的預期機會 。
我們 或我們當前和未來的合作伙伴在未來可能會受到產品召回的影響,這可能會損害我們的品牌和聲譽,並且 可能會對我們的業務產生負面影響。
如果我們的任何候選產品被批准上市、不符合規格或被認為會導致受傷或疾病,或者如果我們被指控違反了 政府法規,包括與製造、標籤、促銷、銷售或分銷相關的法規,我們 或我們當前和潛在的合作伙伴可能會受到產品召回、撤回或扣押的影響。未來的任何召回、撤回或扣押都可能對消費者對我們品牌的信心造成重大負面影響,並導致對我們 批准的產品的需求減少。此外,召回、撤回或扣押我們批准的任何產品將需要管理層的高度關注,可能會導致鉅額和意想不到的支出,並將損害我們的業務、財務狀況和運營 結果。
| 27 |
如果 我們或我們可能合作的任何合作伙伴無法為我們獲得監管批准的任何候選產品或我們可能尋求商業化的任何產品實現並保持覆蓋範圍和足夠的報銷水平,他們的商業成功可能會受到嚴重阻礙。
對於 只能通過處方獲得的任何候選產品,我們或我們可能與之合作的任何合作伙伴的成功銷售取決於第三方付款人是否提供保險和足夠的報銷。為治療病情而開藥的患者通常依靠第三方付款人來報銷與其 處方藥相關的全部或部分費用。政府醫療保健計劃(如Medicare和Medicaid)和私人第三方付款人提供的保險範圍和足夠的報銷對於新產品的接受度至關重要。覆蓋範圍的決定可能取決於臨牀和經濟標準,當已經有更成熟或更低成本的治療替代方案可用或隨後 可用時,這些標準不支持新藥產品。如果我們的任何候選產品沒有顯示出有吸引力的功效配置文件,他們可能沒有資格享受保險和報銷 。即使我們獲得了特定產品的保險,由此產生的報銷付款率也可能不夠高,或者 可能需要患者認為不可接受的高得令人無法接受的共同付款。患者不太可能使用我們的產品,除非提供保險並且 報銷足以支付我們產品的大部分成本。
此外,我們候選產品的市場將在很大程度上取決於第三方付款人的藥物處方或第三方付款人提供承保和報銷的藥物清單。行業競爭將被納入此類 配方,往往會給製藥公司帶來下行定價壓力。此外,當有價格較低的仿製藥或其他 替代品時,第三方付款人可以拒絕在其處方中包括特定的 品牌藥物,或以其他方式限制患者使用品牌藥物。
此外, 第三方付款人,無論是國外的還是國內的,或者政府的還是商業的,都在開發越來越複雜的方法來控制醫療成本。此外,在美國,儘管私人第三方付款人傾向於遵循聯邦醫療保險,但第三方付款人之間沒有統一的藥品保險和報銷政策。因此,藥品 產品的承保範圍和報銷範圍因付款人而異。因此,承保範圍確定過程通常是一個耗時且成本高昂的過程,需要我們為每個付款人分別提供科學和臨牀支持,以使用我們的候選產品,而不能保證獲得承保範圍和足夠的報銷。
此外, 我們認為,未來的保險和報銷可能會在美國和國際市場受到更多限制。我們可能獲得監管批准的任何候選產品的第三方保險和報銷可能無法在美國或國際市場 獲得或得到足夠的補償,這可能會損害我們的業務、財務狀況、運營業績和前景。
最近頒佈和未來的醫療立法或監管改革措施,包括政府對定價和報銷的限制, 可能會增加我們獲得上市批准的難度和成本,並可能對我們的業務和運營結果產生負面影響 。
在 美國和一些外國司法管轄區,已經並將繼續有多項關於醫療保健系統的立法和法規變更以及 擬議的變更,這些變更可能會阻止或推遲候選產品的上市審批,限制或監管審批後活動,並影響我們以盈利方式銷售任何獲得營銷審批的候選產品的能力。
已提出立法和監管建議,以擴大審批後要求,並限制藥品 產品的銷售和促銷活動。我們不知道是否會頒佈更多的法律變更,也不知道FDA的法規、指南或解釋 是否會更改,也不知道這些更改會對我們的候選產品的上市審批產生什麼影響(如果有的話)。此外,美國國會對FDA審批過程的更嚴格審查可能會顯著推遲或阻止上市審批,因為 還會使我們受到更嚴格的產品標籤和上市後測試以及其他要求的影響。
| 28 |
In the United States, under the Medicare Modernization Act, or MMA, Medicare Part D provides coverage to the elderly and disabled for outpatient prescription drugs by approving and subsidizing prescription drug plans offered by private insurers. The MMA also authorizes Medicare Part D prescription drug plans to use formularies where they can limit the number of drugs that will be covered in any therapeutic class. The Part D plans use their formulary leverage to negotiate rebates and other price concessions from drug manufacturers. Also under the MMA, Medicare Part B provides coverage to the elderly and disabled for physician-administered drugs on the basis of the drug’s average sales price, a price that is calculated according to regulatory requirements and that the manufacturer reports to Medicare quarterly. Both Congress and the Centers for Medicare & Medicaid Services (“CMS”), the agency that administers the Medicare program, from time to time consider legislation, regulations, or other initiatives to reduce drug costs under Medicare Parts B and D. For example, under the ACA, drug manufacturers are required to provide a 50% discount on prescriptions for branded drugs filled while the beneficiary is in the Medicare Part D coverage gap, also known as the “donut hole.” There have been legislative proposals to repeal the “non-interference” provision of the MMA to allow CMS to leverage the Medicare market share to negotiate larger Part D rebates. Further cost reduction efforts could decrease the coverage and price that we receive for our drug candidates and could seriously harm our business. Private payors often follow Medicare coverage policy and payment limitations in setting their own reimbursement rates, and any reduction in reimbursement under the Medicare program may result in a similar reduction in payments from private payors.
2010年《患者保護和平價醫療法案》(簡稱"ACA")旨在擴大醫療保險的獲取範圍,減少 或限制醫療支出的增長。此外,《平價醫療法案》對生產 或進口品牌處方藥產品的公司徵收了高額年費。它還增加了藥品製造商必須支付給州醫療補助 計劃的回扣金額,要求醫療補助回扣在管理醫療補助使用時支付,並增加了品牌產品固體口服劑型的"產品線 擴展"(如緩釋製劑)的額外回扣。法律還包含大量 條款,影響欺詐和濫用合規性和透明度,這可能要求我們修改我們與醫療保健從業人員的業務慣例,併產生大量成本以確保合規性。
在美國和其他地方的 決策者和支付者中,對促進醫療保健系統的變革有着濃厚的興趣, 的既定目標是控制醫療保健成本、提高醫療質量和/或擴大醫療保健的可獲得性。在美國,製藥行業一直是這些努力的一個特別重點,並受到重大立法倡議的重大影響。
例如,在美國,ACA極大地改變了政府和私人保險公司為醫療保健提供資金的方式 ,並顯著影響了製藥行業。ACA的許多條款影響生物製藥行業,包括 為了使生物製藥產品獲得聯邦醫療保險B部分和醫療補助計劃項下的補償或直接銷售 給美國政府機構,製造商必須向有資格參加《公共衞生服務法案》("PHS")項下的藥品定價 計劃的實體提供折扣。自其頒佈以來,對ACA的某些方面提出了司法和國會的質疑和修正。《ACA》的實施仍然存在不確定性,包括《ACA》可能會進一步修訂,以及對《ACA》的法律挑戰或廢除《ACA》的努力。
此外,自 ACA頒佈以來,美國已經提出並採納了其他影響製藥行業的立法變更。例如,2022年的《降低通貨膨脹法》包括,除其他事項外,授權CMS 每年為有限數量的高成本單一來源藥物談判一個“最高公平價格”的條款,以及另一項條款 ,要求製藥公司在價格上漲快於通脹時向Medicare支付回扣。此外,各州已經通過 或正在考慮通過法律,要求製藥公司在提價前提供通知,並證明漲價的理由 。我們預計未來將採取額外的醫療改革措施,其中任何一項措施都可能限制 聯邦和州政府為醫療產品和服務支付的金額,進而可能大幅降低某些開發項目的預計價值 並降低我們的盈利能力。
| 29 |
鑑於 處方藥和生物製劑成本的上漲,美國 政府對藥品定價做法也加強了審查。此類審查導致了最近的幾項國會調查,並提出並頒佈了聯邦 和州立法,旨在提高產品定價的透明度,審查定價 和製造商患者計劃之間的關係,以及改革政府計劃產品報銷方法。在聯邦一級,現在離任的特朗普政府提出了許多處方藥成本控制措施。同樣,新的拜登政府 已經將降低處方藥價格作為其優先事項之一。拜登政府尚未提出任何具體計劃,但我們預計這些計劃將在近期內出臺。在州一級,立法機構正在越來越多地通過立法和 實施旨在控制藥品和生物製品定價的法規,包括價格或患者報銷 限制、折扣、對某些產品准入和營銷成本披露的限制以及透明度措施,在某些情況下, 旨在鼓勵從其他國家進口和大宗採購。
其他 擬議變更的示例包括但不限於擴大批准後要求、變更《孤兒藥法》以及 限制藥品銷售和促銷活動。我們無法確定是否會頒佈額外的立法變更,或者是否會變更政府法規、指南或解釋,或者這些變更 會對我們候選藥物或產品(如有)的上市批准、銷售、定價或報銷產生什麼影響。我們預計,這些 和未來可能採取的其他醫療改革措施可能會導致更嚴格的覆蓋標準,並對我們收到的任何獲批藥物的價格造成額外的 下行壓力。醫療保險或其他政府 計劃的任何報銷減少都可能導致私人支付者支付的類似減少。成本控制措施或其他 醫療改革的實施可能會阻礙我們創造收入、實現盈利或將我們的藥物商業化。
此外,FDA可能會以可能嚴重影響我們業務 和產品的方式修訂或重新解釋FDA法規和指南。任何新的法規或指南,或對現有法規或指南的修訂或重新解釋,都可能會增加 我們當前或未來的任何候選產品的成本或延長FDA審查時間。我們無法確定 法規、法規、政策或解釋的變更何時發佈、頒佈或採用,將如何影響我們未來的業務。此類 更改除其他外,可能需要:
| ● | 在獲得批准之前要進行額外的 臨牀試驗; |
| ● | 更改制造方法 ; |
| ● | 召回、更換或停產我們的一個或多個產品;以及 |
| ● | 其他 記錄保存。 |
此類 更改可能需要大量時間並帶來巨大成本,或者可能會降低我們候選產品的潛在商業價值 。此外,延遲收到或未能獲得任何其他產品的監管許可或審批將損害我們的業務、財務狀況和運營結果。
我們 還可能受到醫療法律、法規和執法的約束,如果我們不遵守這些法律,可能會對我們的業務、運營和財務狀況產生不利影響。
與欺詐和濫用以及患者權利有關的某些聯邦和州醫療保健法律法規現在和將來都適用於我們的業務。我們受到聯邦政府和我們或我們的合作伙伴開展業務所在州的監管。 可能影響我們運營能力的法律和法規包括:
| ● | 聯邦《反回扣條例》,除其他事項外,禁止任何個人或實體在知情的情況下故意提供、索要、收受或提供任何報酬(包括任何回扣、賄賂或回扣),直接或間接、公開或隱蔽地以現金或實物形式誘使個人推薦或購買、租賃或訂購任何商品、設施或服務, 可全部或部分支付。在聯邦醫療保健計劃下,如聯邦醫療保險和醫療補助計劃 ; |
| ● | 聯邦民事和刑事虛假報銷法和民事金錢懲罰法,包括,例如,聯邦民事虛假報銷法, 對個人或實體施加刑事和民事處罰,包括民事舉報人或準訴訟, 除其他事項外,故意向聯邦政府提交或導致向聯邦政府提交虛假或欺詐性的付款申請,或進行虛假陳述以避免、減少或隱瞞向聯邦政府付款的義務 ; |
| ● | 1996年《聯邦健康保險攜帶和責任法案》(HIPAA),制定了新的聯邦刑法,禁止明知和故意執行或試圖執行詐騙任何醫療福利計劃的計劃,或 通過虛假或欺詐性的藉口、陳述或承諾,獲得任何醫療福利計劃擁有的或在其監管或控制下的任何金錢或財產,而無論付款人(例如,公共或私人),明知和故意挪用或竊取醫療福利計劃,故意阻礙對醫療保健犯罪的刑事調查 ,明知或故意以任何伎倆或手段偽造、隱瞞或掩蓋與醫療保健有關的醫療福利、項目或服務的交付或支付的重大事實,或作出任何重大虛假陳述 ; |
| ● | HIPAA,經《經濟和臨牀健康信息技術法案》及其實施條例修訂的《HIPAA》,在保護個人可識別健康信息的隱私、安全和傳輸方面,對包括醫療保健提供者、健康計劃和醫療信息交換所在內的受覆蓋實體及其各自的商業夥伴施加了保護隱私、安全和傳輸個人可識別健康信息的義務; |
| ● | 《平價醫療法案》下的聯邦醫生陽光要求,該法案要求藥品、設備、生物製品和醫療用品的製造商每年向醫療保險和醫療補助服務中心報告與向醫生和教學醫院提供的付款和其他價值轉移有關的信息,以及醫生及其直系親屬持有的所有權和投資權益;以及 |
| ● | 州法律等同於上述每一項聯邦法律,例如反回扣和虛假索賠法律,可能適用於由任何第三方付款人(包括商業保險公司)報銷的物品或服務;州法律要求製藥公司遵守 製藥行業自願合規指南和聯邦政府頒佈的適用合規指南,或以其他方式限制可能向醫療保健提供者和其他潛在轉介來源提供的付款;州法律,要求藥品製造商報告與向醫療保健提供者支付或以其他方式轉移價值或營銷支出有關的信息;州法律,在某些情況下管理健康信息的隱私和安全,其中許多法律在很大程度上彼此不同,可能不會產生相同的效果,從而使合規工作複雜化。 |
| 30 |
由於這些法律的廣度,以及法定例外和可用安全港的狹窄,我們的一些商業活動可能會受到一項或多項此類法律的挑戰。此外,最近的醫療改革立法加強了這些法律。例如,《平價醫療法案》等修訂了聯邦《反回扣法規》和某些醫療欺詐刑事法規的意圖要求。個人或實體不再需要實際瞭解法規或違反法規的具體意圖。此外,《平價醫療法案》規定,根據聯邦民事虛假申報法的規定,政府可以斷言,包括因違反聯邦《反回扣條例》而產生的物品或服務的索賠構成虛假或欺詐性索賠。
實現並持續遵守這些法律可能被證明是代價高昂的。此外,任何針對我們違反這些法律的行為,即使我們 成功防禦,也可能導致我們產生鉅額法律費用,並將我們管理層的注意力從我們業務的 運營上轉移。如果我們的業務被發現違反了上述任何法律或適用於我們的任何其他政府法律或法規,我們可能會受到懲罰,包括行政、民事和刑事處罰、損害賠償、罰款、交還、被排除在聯邦和州醫療保健計劃之外、個人監禁或削減或重組我們的業務,任何這些都可能對我們的業務運營能力和我們的財務業績產生不利影響。
我們的業務涉及使用危險材料,我們和我們的第三方供應商和製造商必須遵守環境 法律和法規,這些法律法規可能成本高昂,並限制我們的業務方式。
我們的第三方供應商和製造商的製造活動涉及我們擁有的危險材料的受控儲存、使用和處置,包括我們候選產品的組件和其他危險化合物。我們和我們的製造商以及 供應商受有關這些危險材料的使用、製造、儲存、處理和處置的法律法規的約束。 在某些情況下,這些危險材料和使用過程中產生的各種廢物儲存在我們供應商或製造商的 設施中,等待使用和處置。我們和我們的供應商和製造商不能完全消除污染風險,這可能會導致我們的商業化努力、研發努力和業務運營中斷,對我們的服務提供商和其他人造成傷害,並造成環境破壞,導致昂貴的清理工作,並根據管理這些材料和指定廢物的使用、存儲、處理和處置的適用法律和法規承擔責任 。儘管我們相信我們的第三方供應商和製造商用於處理和處置這些材料的安全 程序通常符合這些法律法規規定的標準,但我們不能保證確實如此,也不能消除這些材料的意外污染或傷害風險。在這種情況下,我們可能要對由此產生的任何損害承擔責任,而這種責任可能會超出我們的資源範圍。我們目前不承保生物或危險廢物保險。
我們的 員工、獨立承包商、主要調查人員、顧問、供應商、CRO和我們可能合作的任何合作伙伴 可能從事不當行為或其他不當活動,包括不遵守監管標準和要求。
我們 面臨我們的員工、獨立承包商、主要調查人員、顧問、供應商、CRO和我們可能合作的任何合作伙伴 可能從事欺詐或其他非法活動的風險。這些人員的不當行為可能包括故意、 魯莽或疏忽的行為或違反下列法律或法規的未經授權的活動:法律或法規,包括要求向FDA或外國監管機構報告 真實、完整和準確信息的法律;製造標準;聯邦、州和 外國醫療欺詐和濫用法律及數據隱私;或要求真實、完整和準確報告財務信息或數據的法律。特別是,醫療保健行業的銷售、營銷和其他業務安排受旨在防止欺詐、回扣、自我交易和其他濫用行為的廣泛法律的約束。這些法律可能限制或禁止廣泛的商業活動,包括研究、製造、分銷、定價、折扣、營銷和促銷、銷售佣金、客户激勵計劃和其他商業安排。受這些法律約束的活動還涉及不當使用在臨牀試驗過程中獲得的信息,或非法挪用藥品,這可能會導致監管制裁或 因未能遵守此類法律或法規而引發的其他行動或訴訟,並嚴重損害我們的聲譽。 此外,聯邦採購法對與政府合同相關的不當行為進行了實質性處罰,並要求 某些承包商保持商業道德和行為準則。如果對我們提起任何此類訴訟,而我們未能成功地為自己辯護或維護我們的權利,這些訴訟可能會對我們的業務產生重大影響,包括 施加民事、刑事和行政處罰、損害賠償、罰款、可能被排除在聯邦醫療保險、醫療補助和其他聯邦醫療保健計劃、合同損害、聲譽損害、利潤和未來收益減少以及業務削減 ,任何這些都可能對我們的業務運營能力和我們的經營業績產生不利影響。
| 31 |
實際 或被指控不遵守適用的僱傭法律和法規可能需要進行運營變革,破壞我們的競爭地位,或對我們的業務產生其他重大不利影響。
我們的 業務受各種就業法律和法規的約束,將來可能會受到其他此類要求的約束。 雖然我們認為我們在很大程度上遵守了適用的僱傭法律和法規,但如果要求發生變化, 我們可能需要修改我們的運營或利用資源來保持遵守此類法律和法規。此外, 我們可能會面臨各種與僱傭有關的索賠,包括個人訴訟、集體訴訟和政府執法行動 ,這些訴訟涉及涉嫌僱傭歧視、員工分類和相關扣留、工資小時爭議、勞工標準或 醫療保健和福利問題。此類索賠,無論有效性如何,都可能對我們的業務、財務狀況、現金流或其他經營成果產生重大不利影響。
我們未來的增長在一定程度上取決於我們打入海外市場的能力,在那裏我們將受到額外的監管負擔和其他風險和不確定性的影響。
我們 未來的盈利能力將部分取決於我們在海外市場上將候選產品商業化的能力,我們打算 依靠與第三方的合作。如果我們在國外市場上將VAR 200或IC 100或其他候選產品商業化, 我們將面臨額外的風險和不確定性,包括:
| ● | 我們的 客户能夠在國外市場為我們的候選產品獲得市場準入和適當的報銷; |
| ● | 我們無法直接控制商業活動,因為我們依賴第三方; |
| ● | 遵守複雜多變的外國監管、税務、會計和法律要求的負擔; |
| ● | 不同 影響市場接受的外國醫療習慣和習俗 |
| ● | 進口或出口許可要求; |
| ● | 應收賬款收款時間較長 ; |
| ● | 發貨的交貨期更長; |
| ● | 語言障礙 技術培訓; |
| ● | 減少國外一些國家對知識產權的保護; |
| ● | 外國貨幣匯率波動;以及 |
| ● | 在發生合同糾紛時,受外國法律管轄的合同條款的解釋。 |
我們候選產品的海外銷售也可能受到政府管制、政治和經濟不穩定、貿易限制和關税變化的不利影響,其中任何一項都可能對我們的運營結果產生不利影響。
由於 與特殊目的收購公司的業務合併,監管義務可能會對我們產生不同於 其他上市公司的影響。
我們 通過完成與特殊目的收購公司Larkspur的業務合併而成為一家上市公司。 由於業務合併以及由此考慮的交易,我們的監管義務已經並可能繼續對我們產生與其他上市公司不同的影響。例如,美國證券交易委員會和其他監管機構可能會發布額外的指導意見,或者對像我們這樣已經完成與SPAC業務合併的公司進行進一步的監管審查。管理這種已經並可能繼續發展的監管環境可能會分散管理層對我們業務運營的注意力, 會對我們在需要時籌集額外資本的能力產生負面影響,或者對我們的普通股價格產生不利影響。
| 32 |
我們 面臨自然災害和人為災難、流行病以及惡意和恐怖行為的風險,這些風險可能會對我們的業務、財務狀況和運營結果產生重大不利影響。
自然和人為災難、流行病以及惡意和恐怖行為帶來的風險可能會對我們的行動結果產生實質性的不利影響 。雖然我們已採取措施識別和緩解這些風險,但此類風險無法預測,也無法完全防範 。此外,此類事件可能導致整體宏觀經濟波動,特別是大範圍地理區域的經濟活動減少或停止,對我們在這些地理區域內的業務營銷或運營或總體經濟環境產生不利影響,進而可能對我們的業務、運營和財務狀況產生不利影響。
特別是,已被世界衞生組織宣佈為全球大流行的新冠肺炎疫情對美國和全球的金融市場和經濟狀況產生了重大負面影響。因此,我們的運營受到了, ,並可能進一步受到負面影響。因此,我們的業務、財務狀況和運營結果已經受到影響,並可能受到進一步的重大不利影響。
全球經濟和供應鏈的中斷 可能會對我們的業務、財務狀況和運營結果產生實質性的不利影響。
2020年和2021年對全球經濟的幹擾阻礙了全球供應鏈,導致交付期延長,還增加了關鍵組件成本和運費。我們已經或可能必須採取措施,通過與我們賴以開展業務的第三方密切合作,在交付期內將這些中斷的影響降至最低,並增加成本。儘管我們已採取或可能必須採取行動將中斷對全球經濟的影響降至最低,但不能保證全球供應鏈中不可預見的未來事件不會對我們的業務、財務狀況和運營結果產生重大不利影響。
此外,通貨膨脹會增加臨牀試驗成本、我們候選產品的研發成本以及開展業務的管理和其他成本,從而對我們產生不利影響。我們可能會遇到勞動力價格和其他開展業務的成本上漲的情況。在通貨膨脹的環境下,成本增長可能會超出我們的預期,導致我們使用現金和其他流動資產的速度比預期更快。如果發生這種情況,我們可能需要籌集額外資本來為我們的運營提供資金,而這些資金可能無法獲得足夠的金額或合理的條款,如果有的話,可能會比預期更早。
不利的全球環境,包括經濟不確定性,可能會對我們的財務業績產生負面影響。
全球情況、金融市場的混亂、税制改革對美國造成的任何負面財務影響或對現有貿易協定或税務慣例的 更改,都可能對我們的業務產生不利影響。
此外,全球宏觀經濟環境可能受到以下因素的負面影響:新冠肺炎或其他流行病或流行病、全球經濟市場的不穩定、美國增加的貿易關税和與其他國家的貿易爭端、全球信貸市場的不穩定、供應鏈薄弱、英國退出歐盟導致的地緣政治環境的不穩定、俄羅斯入侵烏克蘭和其他政治緊張局勢以及對外國政府債務的擔憂。這些挑戰已經並可能繼續在當地經濟和全球金融市場造成不確定和不穩定。
| 33 |
與我們依賴第三方相關的風險
我們 過去一直依賴並希望繼續依賴第三方CRO和其他第三方來執行和監督我們的臨牀 試驗和產品開發的其他方面。如果這些第三方不符合我們的要求或以其他方式按要求執行試驗 ,我們可能無法履行合同義務,或在預期或根本無法獲得監管部門批准,或無法將候選產品 商業化。
We have in the past relied and expect to continue to rely on third-party CROs to conduct and oversee our clinical trials and other aspects of product development. We also rely upon various medical institutions, clinical investigators and contract laboratories to conduct our trials in accordance with our clinical protocols and all applicable regulatory requirements, including the FDA’s regulations and GCPs, which are an international standard meant to protect the rights and health of patients and to define the roles of clinical trial sponsors, administrators and monitors, and state regulations governing the handling, storage, security and recordkeeping for drug and biologic products. These CROs and other third parties play a significant role in the conduct of these trials and the subsequent collection and analysis of data from the clinical trials. We rely heavily on these parties for the execution of our clinical trials and preclinical studies, and control only certain aspects of their activities. We and our CROs and other third-party contractors are required to comply with GCP, GLP, and GACP requirements, which are regulations and guidelines enforced by the FDA and comparable foreign regulatory authorities for products in clinical development. Regulatory authorities enforce these GCP, GLP and GACP requirements through periodic inspections of trial sponsors, principal investigators and trial sites. If we or any of these third parties fail to comply with applicable GCP, GLP and GACP requirements, the clinical data generated in our clinical trials may be deemed unreliable and the FDA or other regulatory authority may require us to perform additional clinical trials before approving our or our partners’ marketing applications. We cannot assure you that upon inspection by a given regulatory authority, such regulatory authority will determine that any of our clinical or preclinical trials complies with applicable GCP and GLP requirements. In addition, our clinical trials must generally be conducted with product produced under cGMP regulations. Our failure to comply with these regulations and policies may require us to repeat clinical trials, which would delay the regulatory approval process.
我們的 CRO不是我們的員工,我們無法控制他們是否為我們的臨牀試驗投入了足夠的時間和資源。我們的 CRO還可能與其他商業實體(包括我們的競爭對手)有關係,他們也可能為他們進行臨牀 試驗或其他藥物開發活動,這可能會損害我們的競爭地位。我們面臨潛在的未經授權披露 或CRO盜用我們的知識產權的風險,這可能會降低我們的商業祕密保護,並允許我們的潛在競爭對手 訪問和利用我們的專有技術。如果我們的CRO未能成功履行其合同職責或義務, 未能在預期期限內完成,或者如果他們獲得的臨牀數據的質量或準確性由於 未能遵守我們的臨牀方案或監管要求或任何其他原因而受到影響,我們的臨牀試驗可能會被延長、延遲或 終止,我們可能無法獲得監管部門的批准,或成功地將我們開發的任何候選產品商業化。 因此,我們的財務業績和我們開發的任何候選產品的商業前景都會受到損害,我們的成本可能會增加 ,我們的創收能力可能會被推遲。
如果 我們的任何CRO或臨牀試驗中心出於任何原因終止參與我們的某項臨牀試驗,我們可能無法 與替代CRO或臨牀試驗中心達成協議,或以商業上合理的條款達成協議。此外,如果 我們與臨牀試驗中心的關係終止,我們可能會失去參加 我們正在進行的臨牀試驗的患者的隨訪信息,除非我們能夠將這些患者的護理轉移到另一家合格的臨牀試驗中心。此外, 我們臨牀試驗的主要研究者可能不時擔任我們的科學顧問或顧問,並可能獲得與此類服務相關的 現金或股權補償。如果這些關係和任何相關補償導致了感知的 或實際的利益衝突,FDA可能會質疑在適用的臨牀試驗中心生成的數據的完整性。
| 34 |
我們 完全依賴第三方承包商為我們的候選產品(包括 某些獨家供應商和製造商)供應、生產和分銷臨牀藥物供應,如果我們的任何候選產品獲得監管部門批准,我們打算依靠第三方進行商業供應、生產和分銷 ,我們希望依靠第三方進行臨牀前產品的供應、生產和分銷 ,任何未來候選產品的臨牀和商業供應。
我們 目前沒有,也不計劃獲得供應、生產或分銷臨牀前、 臨牀或商業數量的原料藥或產品的基礎設施或能力。我們開發候選產品的能力取決於,我們商業化供應產品的能力 部分取決於,我們能否從第三方成功獲得原材料和原料藥以及其他 候選產品中使用的物質和材料,以及能否由第三方生產成品 符合法規要求,並以足夠的數量用於臨牀前和臨牀試驗和商業化。如果 我們未能與這些第三方建立和維持供應關係,我們可能無法繼續開發或商業化 我們的候選產品。
我們 依賴並將繼續依賴某些第三方作為其供應材料或其 製造的成品的唯一來源。我們現有的供應商或製造商可能:
| ● | 失敗 因設施意外損壞或破壞,及時或按要求數量向我們提供產品,或 設備或其他; |
| ● | 失敗 提高生產能力,及時以更高的產量生產大量藥品和組分 或成本效益的方式,或完全,以充分滿足我們的商業需求; |
| ● | 是 由於依賴獨家供應商和製造商的問題,無法滿足我們的生產需求; |
| ● | 供應 我們的產品不符合監管要求; |
| ● | 成為 因業務中斷或破產而無法獲得; |
| ● | 失去 作為批准來源的監管地位; |
| ● | 是 無法或不願在現有供應協議及時到期時、以可接受的條款或根本到期時續簽; 或 |
| ● | 停止 生產或製造必要的藥物或產品。 |
在發生上述任何情況時,如果我們沒有替代供應商或製造商,我們將需要花費大量管理時間和費用來識別、鑑定流程並將其轉移給替代供應商或製造商。將技術轉移到其他站點可能需要額外的流程、技術和驗證研究,這些過程、技術和驗證研究成本高昂,可能需要相當長的時間,可能不會成功,並且在大多數情況下需要FDA的審查和批准。任何尋找和鑑定新供應商或製造商的需求都可能顯著延遲我們候選產品的生產,對我們營銷候選產品的能力產生不利影響 ,並對我們的業務產生不利影響。我們可能無法及時、按可接受的條款或根本無法獲得更換。此外, 我們和我們的製造商目前沒有大量的藥品和其他材料庫存。 藥物或其他材料的供應或我們的候選產品生產的任何中斷都可能對我們的業務、財務狀況、經營業績和前景產生重大不利影響。
我們 無法直接控制我們的合同供應商和製造商是否有能力保持足夠的產能和能力來滿足我們的需求,包括質量控制、質量保證和合格人員。雖然我們最終負責確保遵守cGMP和GACP等法規要求,但我們依賴我們的合同供應商和製造商 日常遵守cGMP或GACP來生產原材料、原料藥和成品。我們的合同供應商和製造商用於生產原料藥和其他物質和材料或成品用於商業銷售的設施必須通過 檢查,並獲得FDA和其他相關監管機構的批准。我們的合同供應商和製造商必須遵守FDA通過其設施檢查計劃和審查提交的技術信息執行的cGMP和GACP要求。 如果任何產品或產品候選或組件的安全因未能遵守適用法律或其他 原因而受到損害,我們可能無法成功將受影響的產品或候選產品商業化或獲得監管部門的批准, 我們可能需要對由此造成的傷害承擔責任。這些因素中的任何一個都可能導致我們候選產品的臨牀前研究、臨牀試驗或監管提交或批准的延遲或終止,並可能導致更高的成本或導致我們無法及時有效地將我們批准的產品商業化,或者根本無法實現。
| 35 |
此外,這些合同製造商還與其他公司合作,為此類公司供應和製造材料或產品,這也使我們的供應商和製造商面臨生產此類材料和產品的監管風險。因此, 無法滿足生產這些材料和產品的監管要求也可能影響合同供應商或製造商設施的監管審批。如果FDA或類似的外國監管機構不批准 這些設施用於供應或製造我們的候選產品,或者如果它在未來撤回批准,我們可能需要 尋找替代供應或製造設施,這將對我們開發、獲得監管機構批准或營銷我們的候選產品的能力產生負面影響。
我們對合同製造商和供應商的依賴進一步暴露了他們或有權訪問其設施的第三方可能會訪問並挪用我們的商業祕密或其他專有信息的可能性。
如果 我們無法建立和維護協作,我們可能不得不更改我們的開發和商業化計劃。
我們候選產品的開發和潛在商業化將需要大量額外現金來支付費用。為了 進一步開發我們的候選產品,我們可能會與製藥和生物技術公司合作開發這些候選產品,並可能將其商業化。我們在尋找合適的合作伙伴方面面臨着激烈的競爭。我們是否就合作達成最終協議將取決於我們對合作夥伴資源和經驗的評估 、擬議合作的條款和條件以及擬議合作伙伴對一系列因素的評估。 這些因素可能包括臨牀試驗的設計或結果;FDA或其他監管機構批准的可能性;主題候選產品的潛在市場;製造和向患者交付此類候選產品的成本和複雜性 ;競爭產品的潛力;與我們的知識產權所有權有關的任何不確定性;以及行業和市場狀況。合作伙伴還可以為類似的候選產品或技術考慮可供協作的替代產品或技術 ,以及此類協作是否會比我們的候選產品更具吸引力 。根據未來的許可協議,我們還可能受到限制,不能與潛在合作伙伴就某些條款達成協議。 協作非常複雜,談判和記錄都很耗時。此外,大型製藥公司之間最近發生了大量的商業合併,導致未來潛在合作伙伴的數量減少。
我們未來可能進行的 合作可能涉及以下風險:
| ● | 合作者 在決定將用於這些合作的努力和資源方面可能有很大的酌處權; |
| ● | 協作者 可能未按預期履行義務; |
| ● | 更改 合作者的戰略重點或可用資金,或外部因素(如收購)可能會轉移資源 或創造競爭性的優先事項; |
| ● | 合作者 可能會延遲發現和臨牀前開發,為我們選定的靶點的產品開發提供足夠的資金, 停止或放棄候選產品的發現和臨牀前開發,重複或進行新的發現和臨牀前開發 對於候選產品; |
| 36 |
| ● | 合作者 可以獨立開發或與第三方開發直接或間接與我們的產品或產品競爭的產品 如果合作者認為有競爭力的產品比我們的產品更有可能成功開發; |
| ● | 產品 與我們合作發現的候選產品可能會被我們的合作者視為與他們自己的候選產品有競爭力 或產品,這可能導致合作者停止投入資源開發我們的候選產品; |
| ● | 分歧 與合作者之間的分歧,包括對所有權、合同解釋或首選開發路線的分歧, 可能導致候選產品的發現、臨牀前開發或商業化延遲或終止,可能導致 我們在候選產品方面的額外責任,或可能導致訴訟或仲裁,其中任何一種 既耗時又昂貴; |
| ● | 合作者 可能無法正確維護或捍衞我們的知識產權或授權給我們的知識產權,或者可能使用我們的 專有信息,導致訴訟可能危及我們的知識產權或專有權或無效 信息或使我們面臨潛在訴訟; |
| ● | 合作者 可能侵犯第三方的知識產權,這可能使我們面臨訴訟和潛在責任;以及 |
| ● | 為了協作者的方便,可能會終止合作 ,如果終止,我們可能需要籌集額外資金以 進一步開發適用的候選產品或將其商業化。 |
協作 通常會對各方施加詳細的義務。如果我們違反了我們的義務,我們可能會面臨重大後果,包括 可能終止合作,並且我們對合作夥伴候選產品的權利將失去,我們已經投入了大量 時間和金錢。
我們 可能無法及時、以可接受的條款或根本無法就合作進行談判。如果我們無法做到這一點,我們可能不得不 減少候選產品的開發、減少或推遲我們的開發計劃或我們的一個或多個其他開發計劃、 推遲我們潛在的商業化或增加我們的支出並自費進行開發或商業化活動 。如果我們選擇增加支出來資助自己的開發或商業化活動,我們可能需要獲得 額外的資本,而我們可能無法以可接受的條款或根本無法獲得這些資本。如果我們沒有足夠的資金,我們可能無法 進一步開發我們的候選產品或將其推向市場併產生產品收入。
與管理我們的增長、員工和運營有關的風險
我們 未來將需要進一步增加我們組織的規模和複雜性,我們在執行增長戰略和管理任何增長方面可能會遇到困難。
我們的 管理層、人員、系統和設施目前不足以支持我們的業務計劃和近期的未來增長。 我們將需要進一步擴大我們的化學和生產團隊、臨牀團隊、管理、運營、財務和其他資源 ,以支持我們計劃中的研究、開發和商業化活動。
要 有效管理我們的運營、增長和各種項目,我們需要:
| ● | 繼續 改進我們的業務、財務、管理和監管合規控制以及報告系統和程序; |
| ● | 吸引和留住足夠數量的優秀員工; |
| ● | 發展市場營銷、銷售和分銷能力; |
| 37 |
| ● | 有效且經濟高效地管理我們的候選產品的商業化活動; |
| ● | 與開發和商業化合作夥伴建立和維護關係; |
| ● | 有效管理我們的臨牀前和臨牀試驗; |
| ● | 以經濟高效的方式管理我們的第三方供應和製造運營,同時將我們當前候選產品的生產能力 提高到商業水平;以及 |
| ● | 有效管理我們的開發工作,同時履行對合作夥伴和其他第三方的合同義務。 |
此外,從歷史上看,我們一直並將繼續利用兼職外部顧問為我們執行多項任務,包括與臨牀前和臨牀試驗相關的任務。我們的增長戰略還可能需要擴大我們對顧問的使用 以實施這些任務和未來的其他任務。我們的某些業務職能依賴顧問,需要對這些顧問進行有效的 管理,以確保他們成功履行合同義務並在預期期限內完成任務。 不能保證我們能夠根據需要以經濟合理的條款管理我們現有的顧問或找到其他稱職的外部顧問,或者根本不能。如果我們不能通過招聘新員工和擴大顧問的使用來有效管理我們的增長和擴大我們的組織,我們可能無法成功執行有效執行我們計劃的研發和商業化活動所需的任務,因此可能無法實現我們的研發和 商業化目標。
如果 我們無法吸引和留住管理層和其他關鍵人員,我們可能無法繼續成功開發或商業化我們的候選產品,或以其他方式實施我們的業務計劃。
我們在競爭激烈的製藥行業中的競爭能力取決於我們能否吸引和留住高素質的管理、科學、醫療、銷售和營銷人員以及其他人員。我們高度依賴我們的管理層,包括斯蒂芬·C·格洛弗、彼得·沃爾夫、巴勃羅·A·古茲曼、醫學博士和凱倫·A·卡什米爾。失去這些個人的服務可能會阻礙、 推遲或阻止我們產品管道的成功開發、完成我們計劃的臨牀試驗、將我們的候選產品商業化、或獲得許可或獲得新資產,並可能對我們成功實施業務計劃的能力產生負面影響。如果我們失去了這些人員中的任何一個人的服務,我們可能無法及時 找到合適的替代人員,或者根本無法找到合適的替代人員,因此我們的業務可能會受到損害。我們不為這些個人的生命或我們任何其他員工的生命 維護“關鍵人物”保險單。為了留住我們公司有價值的員工,除了 工資和現金獎勵外,我們還提供隨時間授予的股票期權。隨着時間的推移,授予員工的股票期權的價值將受到我們無法控制的股票價格變動的重大影響,並且隨時可能不足以抵消其他公司的報價 。
我們 未來可能無法吸引或留住合格的管理層和其他關鍵人員,因為生物技術、製藥和其他企業之間對合格人才的競爭非常激烈,尤其是在我們總部所在的佛羅裏達州韋斯頓地區。 我們可能難以吸引有經驗的人員到我們的公司,並可能需要花費大量財務資源 來招聘和留住員工。與我們競爭合格人才的許多其他製藥公司 比我們擁有更多的財務和其他資源、不同的風險狀況和更長的行業歷史。它們還可以提供更多樣化的機會和更好的職業晉升機會。如果我們無法吸引和留住實現業務目標所需的人員 ,我們可能會遇到限制,這將損害我們實施業務戰略和實現業務目標的能力。
此外,我們還擁有科學和臨牀顧問,幫助我們制定開發和臨牀策略。這些顧問 不是我們的員工,可能與其他實體簽訂了承諾、諮詢或諮詢合同,這可能會限制他們對我們的可用性 。此外,我們的顧問可能會與其他公司達成協議,協助這些公司開發可能與我們競爭的產品或技術。
| 38 |
競爭激烈的就業市場在我們發展壯大並努力吸引和留住高技能勞動力的同時,也帶來了挑戰和潛在風險。
我們員工的競爭非常激烈,包括高技能的技術和產品專業人員,這反映了勞動力市場的緊張。 這可能會帶來風險,因為我們正在競爭有經驗的候選人,特別是如果競爭能夠提供更有吸引力的財務 僱傭條款。這一風險延伸到我們目前的員工羣體。此外,我們已經受到並可能進一步受到持續的新冠肺炎疫情的影響,這可能會導致有才華的員工跳槽,並可能使吸引和留住熟練專業人員的工作更具挑戰性。隨着我們業務的發展,我們還可能投入大量的時間和費用來吸引和發展我們的員工,這也會增加他們對其他可能尋求招聘他們的公司的價值。人員更替可能會導致巨大的更換成本和工作效率損失。此外,美國的移民政策可能會使符合條件的外國公民更難獲得或保持H-1B類別的工作簽證。這些H-1B簽證限制可能會使我們更難和/或更昂貴地聘請我們執行增長戰略所需的熟練專業人員,並可能對我們的業務產生不利影響。
我們 目前營銷能力有限,沒有銷售組織。如果我們不能靠自己或通過第三方建立銷售和營銷能力 ,我們將無法成功地將我們的候選產品商業化(如果獲得批准),或產生 產品收入。
我們 目前營銷能力有限,沒有銷售組織。如果我們的候選產品獲得批准,要在美國、加拿大、歐盟和我們尋求進入的其他司法管轄區實現商業化,我們必須建立我們的營銷、銷售、分銷、管理和其他非技術能力,或者與第三方安排執行這些服務,而我們可能無法 成功做到這一點。雖然我們的管理團隊在醫藥產品的營銷、銷售和分銷方面有經驗 之前在其他公司工作過,但作為一家公司,我們在醫藥產品的營銷、銷售和分銷方面沒有經驗 ,建立和管理銷售組織涉及重大風險,包括我們招聘、留住 和激勵合格人員的能力,產生足夠的銷售線索,為銷售和營銷人員提供充分的培訓,以及 有效管理分散在各地的銷售和營銷團隊的能力。如果我們的內部銷售、營銷和分銷能力發展出現任何失敗或延遲,都將對這些產品的商業化產生不利影響。我們可以選擇與擁有直銷隊伍和已建立的分銷系統的其他第三方合作,以擴充我們自己的銷售隊伍和分銷系統,或者代替我們自己的銷售隊伍和分銷系統。如果我們不能以可接受的條款或根本不能達成這樣的安排,我們可能無法成功地將我們的候選產品商業化。如果我們不能成功地將我們的候選產品 單獨或通過與一個或多個第三方合作實現商業化,我們的業務、財務狀況、經營業績和前景都將受到影響。
我們的 未能成功授權、收購、開發和營銷其他候選產品或已獲批准的產品將削弱我們發展業務的能力 。
我們 打算授權、收購、開發和營銷其他產品和候選產品,我們可能會授權或收購商業階段的產品或從事其他戰略交易。由於我們的內部研發能力有限,我們可能會 依賴製藥公司、學術科學家和其他研究人員向我們銷售或許可產品或技術。這一戰略的成功在一定程度上取決於我們識別和挑選有前景的候選藥品和產品的能力, 與現有所有者談判許可或收購協議的能力,以及為這些安排提供資金的能力。
提議、談判和實施許可證或獲取候選產品或經批准的產品的流程既漫長又複雜。其他公司,包括那些擁有大量財務、營銷、銷售和其他資源的公司,可能會與我們競爭候選產品和已批准產品的許可或收購。我們的資源有限,無法識別和執行第三方產品、業務和技術的收購或授權,並將其集成到我們當前的基礎設施中。 此外,我們可能會將資源投入到從未完成的潛在收購或許可機會上,或者我們可能無法實現此類努力的預期好處。我們可能無法按照我們 認為可接受的條款或根本無法獲得其他候選產品的權利。
| 39 |
此外, 我們獲得的任何候選產品在商業銷售之前可能需要額外的開發工作,包括臨牀前或臨牀 測試和FDA和適用的外國監管機構的批准。所有候選產品都容易出現藥品開發中常見的失敗風險,包括候選產品可能不會被證明足夠安全且 有效,無法獲得監管機構的批准。此外,我們不能保證我們收購的任何經批准的產品將以有利可圖的方式生產或銷售或獲得市場認可。
我們可能考慮的其他 潛在交易包括各種不同的業務安排,包括剝離、戰略合作伙伴關係、合資企業、重組、資產剝離、業務合併和投資。任何此類交易可能需要我們產生非經常性費用或其他費用,可能會增加我們的短期和長期支出,並可能帶來重大的整合挑戰或中斷我們的管理 或業務,這可能會對我們的運營和財務業績產生不利影響。例如,這些交易涉及許多潛在的運營和財務風險,包括:
| ● | 暴露於未知債務的風險; |
| ● | 中斷我們的業務,轉移我們管理層的時間和注意力,以開發收購的產品、候選產品或技術。 |
| ● | 發生大量債務或股權證券的稀釋發行,以支付收購費用; |
| ● | 龐大的收購和整合成本; |
| ● | 資產或減值費用的減記 ; |
| ● | 增加了 攤銷費用; |
| ● | 將任何被收購企業的運營和人員與我們的運營和人員合併的難度和成本; |
| ● | 由於管理層和所有權的變化,與任何被收購企業的主要供應商、合作伙伴或客户的關係減值 ; 和 |
| ● | 無法 留住我們的關鍵員工或任何被收購企業的員工。 |
因此,不能保證我們將進行或成功完成上述性質的任何交易,並且我們完成的任何交易 都可能損害我們的業務、財務狀況、經營業績和前景。
| 40 |
製造和供應我們的候選產品中使用的原料藥和其他物質和材料是一項複雜且具有技術挑戰性的工作, 製造、測試、質量保證和分銷供應鏈中的許多環節都可能出現故障, 產品製造和分銷後可能存在潛在缺陷。
原料藥、其他物質和材料以及藥品成品的製造和供應在技術上具有挑戰性。超出我們直接控制範圍的變化可能會影響我們候選產品的質量、數量、價格和成功交付,並可能阻礙、推遲、限制或阻止我們候選產品的成功開發和商業化 。錯誤和處理不當並不少見,可能會影響成功的生產和供應。其中一些風險包括:
| ● | 我們的製造商沒有遵守cGMP或GACP要求,或者在生產或準備運輸過程中對產品處理不當; |
| ● | 我們的合同供應商和製造商無法有效且經濟高效地提高和保持高產量和批次質量, 一致性和穩定性; |
| ● | 我們 無法開發FDA批准的生物檢測來發布任何未來的產品; |
| ● | 難以確定最佳的藥物輸送物質和技術、生產和儲存方法以及包裝和運輸流程; |
| ● | 運輸 和進出口風險,特別是考慮到我們供應鏈的全球性; |
| ● | 延遲 分析結果或我們賴以進行質量控制和未來產品發佈的分析技術失敗; |
| ● | 自然災害、流行病、勞資糾紛、財務困難、缺乏原材料供應、設施和設備問題或其他 形式對我們合同製造商和供應商業務運營的幹擾;以及 |
| ● | 潛在的 產品發佈後可能變得明顯的缺陷,可能導致產品召回和銷燬。 |
這些因素中的任何一個都可能導致與我們的臨牀試驗、監管提交、所需審批或候選產品商業化相關的延遲或更高成本,這可能會損害我們的業務、財務狀況、運營結果和前景。
我們的 經營業績可能波動很大,這使得我們未來的經營業績難以預測,並可能導致我們的經營 業績低於預期。
到目前為止,我們的業務主要限於研究和開發我們的候選產品,並對我們的候選產品進行臨牀前研究和臨牀試驗。我們的任何候選產品都尚未獲得監管部門的批准。因此,您對我們未來成功或生存能力的任何預測可能都不會像我們擁有更長的運營歷史或市場上獲得批准的產品那樣準確。 此外,我們的經營業績可能會因各種其他因素而波動,其中許多因素是我們無法控制的,可能很難預測,包括以下因素:
| ● | 推遲我們的候選產品的開始、註冊和臨牀測試的時間; |
| ● | 我們的候選產品或競爭候選產品的臨牀試驗的時機和成功或失敗,或行業競爭格局中的任何其他變化,包括我們的競爭對手或合作伙伴之間的整合; |
| ● | 臨牀開發中對候選產品的監管審查和批准方面的任何延誤; |
| ● | 與我們的候選產品相關的研究和開發活動的時間、成本和投資水平,可能會 不時發生變化; |
| ● | 製造我們的候選產品的成本,可能會根據FDA的指導方針和要求以及生產數量而有所不同; |
| ● | 我們 有能力獲得額外資金來開發我們的候選產品; |
| ● | 我們將獲得或可能產生的用於獲取或開發其他候選產品和技術的支出 ; |
| ● | 如果我們的候選產品獲得批准,對它們的需求水平可能會有很大差異; |
| ● | 我們的候選產品的潛在副作用,可能會推遲或阻止商業化,或導致批准的藥物退出市場 ; |
| ● | 如果獲得批准,患者或醫療保健提供者獲得我們的候選產品的覆蓋範圍或足夠的補償的能力; |
| ● | 我們對第三方製造商供應或製造我們的候選產品的依賴; |
| 41 |
| ● | 我們的 能夠及時建立有效的銷售、營銷和分銷基礎設施; |
| ● | 市場接受我們的候選產品(如果獲得批准),以及我們預測這些候選產品的需求的能力; |
| ● | 我們 在美國以外獲得批准並將我們的候選產品商業化的能力; |
| ● | 我們建立和維護協作、許可或其他安排的能力; |
| ● | 我們保護知識產權的能力和第三方的能力; |
| ● | 與潛在訴訟或其他糾紛有關的費用和結果; |
| ● | 我們有能力充分支持未來的增長; |
| ● | 我們 有能力吸引和留住關鍵人員以有效管理我們的業務; |
| ● | 與危險材料相關的潛在責任; |
| ● | 我們 有能力維持足夠的保險單;以及 |
| ● | 未來 我們的會計政策中的會計聲明或變更。 |
我們的經營業績和流動性需求可能會受到市場波動和經濟低迷的負面影響。
我們的 經營業績和流動性可能會受到美國和世界其他地方的普遍經濟狀況的負面影響 。自由選擇的醫療產品和程序市場可能特別容易受到不利的經濟條件 。某些患者可能認為我們的某些候選產品是可自行決定的,如果無法全額報銷此類產品 ,則對這些產品的需求可能與我們目標患者人羣的可自行決定的支出水平有關。基於 國內和國際經濟狀況和擔憂,國內 和國際股票和債券市場已經經歷並可能繼續經歷加劇的波動和動盪。如果這些經濟狀況和擔憂持續或惡化,且 市場繼續動盪,我們的經營業績和流動性可能在許多方面受到這些因素的不利影響, 包括對我們某些產品的需求減弱,以及在必要時使我們更難籌集資金,以及我們的股價 可能下跌。此外,雖然我們計劃主要在美國銷售我們的產品,但我們將來可能擁有擁有廣泛全球業務的合作伙伴,從而間接地使我們面臨風險。
如果我們的內部計算機系統出現故障,我們的業務和運營將受到影響。
儘管 實施了安全措施,但我們的計算機系統以及我們當前和未來的合作伙伴、承包商和顧問的計算機系統 很容易受到計算機病毒、未經授權的訪問、自然災害、恐怖主義、戰爭、電信和電氣故障 的損害。雖然迄今為止,我們尚未經歷任何此類重大系統故障、事故或安全漏洞,但如果此類事件 發生並導致我們的運營中斷,則可能導致我們的製造活動、開發 計劃和業務運營發生重大中斷。例如,已完成或將來的臨牀試驗中的生產記錄或臨牀試驗數據丟失,可能導致我們的監管審批工作延遲,並顯著增加我們恢復或複製數據的成本 。如果任何中斷或安全漏洞會導致我們的數據或應用程序丟失或損壞,或 機密或專有信息的不當披露,我們可能會承擔責任,並且我們的產品和候選產品的進一步商業化和開發 可能會被延遲。
| 42 |
我們 越來越依賴信息技術,我們的系統和基礎設施面臨一定的風險,包括網絡安全 和數據泄露風險。
我們的信息技術系統發生重大中斷或信息安全遭到破壞,可能會對我們的業務產生不利影響。在正常的業務過程中,我們收集、存儲和傳輸大量機密信息,因此我們必須以安全的方式 確保此類機密信息的機密性和完整性。我們的信息技術 系統以及與我們簽訂合同的第三方供應商的系統的規模和複雜性使得此類系統可能容易受到服務中斷和安全破壞的影響,原因包括我們的員工、合作伙伴或供應商的疏忽或故意行為、惡意第三方的攻擊,或者我們或第三方維護的系統基礎設施的故意或意外物理損壞。對這些機密、專有或商業祕密信息進行保密對於我們的競爭業務地位非常重要。雖然我們 已採取措施保護此類信息並投資於信息技術,但不能保證我們的努力將 防止系統中的服務中斷或安全漏洞,或可能對我們的業務運營產生不利影響或導致關鍵或敏感信息丟失、傳播或誤用的機密信息的未經授權或無意中的錯誤使用或泄露。違反我們的安全措施或意外丟失、無意披露、未經批准的傳播、挪用或濫用商業祕密、專有信息或其他機密信息,無論是由於盜竊、黑客攻擊、欺詐、 欺騙或其他形式的欺騙或任何其他原因,都可能使其他人生產競爭產品、使用我們的專有技術或信息,或對我們的業務或財務狀況產生不利影響。此外,任何此類中斷、安全漏洞、機密信息的丟失或泄露都可能對我們造成財務、法律、業務和聲譽損害,並可能對我們的業務、財務狀況、運營結果或現金流造成重大不利影響。
由於 我們主要是遠程工作人員,我們可能會面臨更高的業務連續性和網絡風險,這可能會嚴重損害我們的業務 和運營。
COVID—19大流行使我們改變了我們的業務做法,遷移到主要是遠程工作場所,我們的員工通過家庭或其他網絡遠程訪問我們的服務器以履行他們的工作職責。雖然我們的大部分操作都可以 遠程執行,並且目前正在有效地運行,但無法保證這種情況會持續下去,也無法保證我們在遠程工作時 將繼續保持同樣有效,因為我們的團隊分散,許多員工可能有其他個人需求需要處理 ,(例如照顧因學校關閉或家庭成員生病而導致的兒童),僱員本身可能會生病 而無法工作。隨着條件的改善和限制的取消,返回工作崗位過程中也存在類似的不確定性 。此外,雖然我們採取了額外的保護措施來保護數據安全和隱私,但遠程工作人員會給我們的用户基礎架構和第三方帶來額外的 壓力,這些壓力很難緩解。這些風險包括影響 工作連續性和效率的家庭互聯網可用性,以及對第三方通信工具(如即時消息和在線 會議平臺)的額外依賴性。
與我們知識產權相關的風險
未能充分保護我們的知識產權可能會對我們的業務、財務狀況和經營成果造成不利影響。
我們的業務依賴於我們的知識產權和專有技術,而知識產權和專有技術的保護對我們業務的成功至關重要。 我們依靠商標、版權和商業祕密法律、許可協議、知識產權轉讓協議、 和保密程序來保護我們的知識產權。此外,我們依靠專有信息(如行業 祕密、技術訣竅和機密信息)來保護可能無法申請專利的知識產權,或者我們認為通過不需要公開披露的方式保護最好的知識產權。我們通常試圖通過要求代表我們開發知識產權的員工和顧問簽訂保密協議和發明轉讓協議,以及與我們共享信息的第三方簽訂保密協議來保護我們的知識產權、技術和機密信息。這些協議 可能無法有效防止未經授權使用或披露我們的機密信息、知識產權或技術,並且在未經授權使用或披露我們的機密信息或技術或侵犯我們的知識產權的情況下, 可能無法提供足夠的補救措施。例如,我們可能無法達成必要的協議,即使簽訂了這些協議,這些協議 也可能被故意違反或以其他方式無法阻止披露、第三方侵犯或挪用我們的專有 信息,其期限可能受到限制,並且可能無法在未經授權披露或使用 專有信息的情況下提供足夠的補救措施。此外,我們的專有信息可能會被我們的競爭對手 或其他第三方知道或獨立開發。如果我們的員工、顧問、承包商和其他第三方在為我們工作時使用他人擁有的知識產權,則可能會就相關或由此產生的專有技術和發明的權利產生爭議。執行和確定我們的知識產權和其他專有權利的範圍可能需要昂貴且耗時的訴訟,如果不能獲得或維護對我們專有信息的保護,可能會對我們的競爭業務 地位產生不利影響。
| 43 |
儘管 我們努力保護我們的所有權,但其他方可能無意或故意披露、獲取或使用我們的技術 或系統,這可能使未經授權的方複製我們平臺或其他軟件、技術和功能的某些方面,或 獲取和使用我們認為專有的信息。此外,未經授權的方還可能試圖或成功嘗試通過各種方法獲得我們的知識產權、機密信息和商業祕密,包括通過從我們的網站或移動應用程序中抓取 公共數據或其他內容、網絡安全攻擊以及保護 這些數據的法律或其他方法可能不充分。監視未經授權使用和披露我們的知識產權、專有技術或機密信息 可能是困難和昂貴的,我們無法確定我們採取的步驟將防止濫用或侵犯我們的知識產權或專有權利 。
我們 為我們在業務中使用的網站註冊了域名,例如 www.zyversa.com和其他變種。本招股説明書中包含的網站地址不包括或通過引用將本公司網站上的信息併入本招股説明書。
競爭對手 已經並可能繼續採用與我們類似的服務名稱,從而損害我們建立品牌標識的能力,並可能導致 用户困惑。此外,與我們的商標相似的其他商標的所有者可能會提起商號或商標侵權索賠 。此外,未來可能需要向美國專利商標局或美國及海外的其他政府機構和行政機構提起訴訟或訴訟,以強制執行我們的知識產權,並確定他人專有權利的有效性和範圍。我們發起的任何有關第三方侵犯我們知識產權的訴訟都可能代價高昂且耗時,並可能導致我們的知識產權無效或無法強制執行,否則可能會給我們帶來負面後果。即使我們就此類侵權行為起訴其他方 ,此類訴訟也可能對我們的業務產生不利後果。此外,我們可能無法及時或成功地申請專利或註冊我們的商標或以其他方式保護我們的知識產權,這可能會對我們的市場份額、財務狀況和運營結果造成負面影響。我們為保護、維護或執行我們的專有權所做的努力在未來可能不會受到尊重,或者可能會被無效、規避或挑戰,並可能導致鉅額成本和資源轉移 ,這可能會對我們的業務、財務狀況和經營業績產生不利影響。
我們 可能無法繼續使用我們在業務中使用的域名,或阻止第三方獲取和使用侵犯、類似或以其他方式降低我們品牌、商標或服務標記價值的域名。
我們 已註冊在我們的業務中使用或與我們的業務相關的域名。如果我們失去使用域名的能力,無論是由於商標主張、未能續訂適用註冊或任何其他原因,我們可能被迫使用新域名銷售我們的產品,這可能會對我們造成重大損害,或者為了購買相關域名的權利而產生鉅額費用 。由於各種原因,我們可能無法在美國以外獲得首選域名,包括因為 這些域名已被其他人持有。此外,我們的競爭對手和其他公司可以嘗試通過使用與我們的域名類似的域名來利用我們的品牌認知度。我們可能無法阻止第三方獲取和使用侵犯、類似或以其他方式降低我們的品牌或商標或服務標記的價值的域名。保護、維護和執行我們在域名中的權利可能需要訴訟,這可能會導致鉅額成本和資源轉移,這可能會對我們的業務、財務狀況和運營業績產生不利影響。
| 44 |
最近的 專利改革立法可能會增加圍繞我們專利申請的起訴以及我們未來專利的執行 或辯護的不確定性和成本。
我們 獲得專利的能力是高度不確定的,因為迄今為止,一些法律原則仍未得到解決,在美國專利中允許的權利要求的廣度或解釋方面,還沒有一致的 政策,並且支持和解釋專利權利要求所必需的專利和專利申請的具體內容,由於 相關法律、科學、和事實問題。美國 和其他國家的專利法或專利法解釋的變更可能會降低我們知識產權的價值或縮小我們的專利保護範圍。
For example, on September 16, 2011, the Leahy-Smith America Invents Act, or the Leahy-Smith Act, was signed into law. The Leahy-Smith Act includes a number of significant changes to United States patent law. These include provisions that affect the way patent applications will be prosecuted and may also affect patent litigation. The United States Patent and Trademark Office (the “USPTO”) has developed new and untested regulations and procedures to govern the full implementation of the Leahy-Smith Act, and many of the substantive changes to patent law associated with the Leahy-Smith Act, and in particular, the first to file provisions, became effective in March 2013. The Leahy-Smith Act has also introduced procedures making it easier for third parties to challenge issued patents, as well as to intervene in the prosecution of patent applications. Finally, the Leahy-Smith Act contains new statutory provisions that require the USPTO to issue new regulations for their implementation, and it may take the courts years to interpret the provisions of the new statute. It is too early to tell what, if any, impact the Leahy-Smith Act will have on the operation of our business and the protection and enforcement of our intellectual property. However, the Leahy-Smith Act and its implementation could increase the uncertainties and costs surrounding the prosecution of our patent applications and the enforcement or defense of our future patents. Further, the U.S. Supreme Court has ruled on several patent cases in recent years, either narrowing the scope of patent protection available in certain circumstances or weakening the rights of patent owners in certain situations. In addition to increasing uncertainty with regard to our ability to obtain patents in the future, this combination of events has created uncertainty with respect to the value of patents, once obtained. Depending on actions by the U.S. Congress, the federal courts and the USPTO, the laws and regulations governing patents could change in unpredictable ways that would weaken our ability to obtain new patents or to enforce patents that we have owned or licensed or that we might obtain in the future. An inability to obtain, enforce, and defend patents covering our proprietary technologies would materially and adversely affect our business prospects and financial condition.
Similarly, changes in patent laws and regulations in other countries or jurisdictions or changes in the governmental bodies that enforce them or changes in how the relevant governmental authority enforces patent laws or regulations may weaken our ability to obtain new patents or to enforce patents that we may obtain in the future. Further, the laws of some foreign countries do not protect proprietary rights to the same extent or in the same manner as the laws of the United States. As a result, we may encounter significant problems in protecting and defending our intellectual property both in the United States and abroad. For example, if the issuance to us, in a given country, of a patent covering an invention is not followed by the issuance, in other countries, of patents covering the same invention, or if any judicial interpretation of the validity, enforceability, or scope of the claims, or the written description or enablement, in a patent issued in one country is not similar to the interpretation given to the corresponding patent issued in another country, our ability to protect our intellectual property in those countries may be limited. Changes in either patent laws or in interpretations of patent laws in the United States and other countries may materially diminish the value of our intellectual property or narrow the scope of our patent protection.
| 45 |
我們 可能無法在全球範圍內保護我們的知識產權。
在世界各地所有國家對我們的候選產品進行專利申請、起訴和保護將是非常昂貴的。 在某些國家,特別是發展中國家,對專利性的要求可能有所不同。此外,某些外國 的法律對知識產權的保護程度不像美國的法律那樣。因此,我們可能無法 阻止第三方在美國以外的所有國家實踐我們的發明。競爭對手可能會在我們尚未獲得專利保護的司法管轄區使用我們的技術 來開發自己的產品,此外,可能會向我們有專利保護的地區出口侵權 產品,但對侵權活動的執法力度不夠。這些產品可能會與我們的產品競爭 ,我們的專利或其他知識產權可能不有效或不足以阻止它們競爭。
Many companies have encountered significant problems in protecting and defending intellectual property rights in foreign jurisdictions. The legal systems of certain countries, particularly certain developing countries, do not favor the enforcement of patents and other intellectual property protection, particularly those relating to pharmaceuticals, which could make it difficult for us to stop the infringement of our patents or marketing of competing products in violation of our proprietary rights generally. Proceedings to enforce our patent rights in foreign jurisdictions could result in substantial costs and divert our efforts and attention from other aspects of our business, could put our patents at risk of being invalidated or interpreted narrowly and our patent applications at risk of not issuing, and could provoke third parties to assert claims against us. We may not prevail in any lawsuits that we initiate and the damages or other remedies awarded, if any, may not be commercially meaningful. In addition, certain countries in Europe and certain developing countries have compulsory licensing laws under which a patent owner may be compelled to grant licenses to third parties. In those countries, we may have limited remedies if our patents are infringed or if we are compelled to grant a license to our patents to a third party, which could materially diminish the value of those patents. This could limit our potential revenue opportunities. Accordingly, our efforts to enforce our intellectual property rights around the world may be inadequate to obtain a significant commercial advantage from the intellectual property that we own or license. Finally, our ability to protect and enforce our intellectual property rights may be adversely affected by unforeseen changes in foreign intellectual property laws.
獲得和維護我們的專利保護取決於遵守政府專利機構提出的各種程序、文件提交、費用支付和其他要求 ,如果不符合這些要求,我們的專利保護可能會減少或取消。
任何已發佈專利的定期 維護費和年金費應在 專利有效期內分幾個階段向USPTO和外國專利代理機構支付。美國專利商標局和各種外國政府專利機構要求在專利申請過程中遵守一些程序、文件、費用支付和其他類似規定。雖然在許多情況下,意外失效可以根據適用規則通過支付逾期費或通過其他方式予以補救,但在某些情況下,不遵守 可能導致專利或專利申請的放棄或失效,從而導致 相關司法管轄區專利權的部分或全部喪失。可能導致專利或專利申請放棄或失效的違規事件包括 未能在規定時限內迴應官方行動、未支付費用以及未能適當合法化和提交正式 文件。如果我們或我們的許可方未能保留涵蓋我們候選產品的專利和專利申請,我們的競爭對手 可能會進入市場,這將對我們的業務產生不利影響。
如果 我們未能遵守我們在知識產權許可協議下的義務,我們可能會失去對我們業務非常重要的許可權 。
我們 是某些許可協議的一方,這些協議對我們施加了各種盡職調查、里程碑、版税、保險和其他義務。如果 我們未能遵守這些義務,相應的許可方可能有權終止許可,在這種情況下,我們可能 無法開發或銷售受影響的候選產品。失去這些權利可能會對我們的業務、 財務狀況、經營成果和前景造成重大不利影響。有關這些許可證安排的詳細信息,請參閲業務- 戰略聯盟和安排.”
| 46 |
如果 我們因侵犯第三方知識產權而被起訴,費用高昂且耗時,而且不利的結果 可能會對我們的業務產生重大不利影響。
我們的 商業成功取決於我們開發、製造、營銷和銷售候選產品的能力,以及在不侵犯第三方所有權的情況下使用我們的專有技術 。我們不能保證營銷和銷售此類候選產品以及使用 此類技術不會侵犯現有或未來的專利。在與我們的候選產品相關的領域中,存在着大量由第三方擁有的美國和外國頒發的專利和未決專利申請 。隨着生物技術和製藥行業的擴張 以及更多專利的頒發,其他人可能會聲稱我們的候選產品、技術或交付方法 或使用侵犯其專利權的風險增加。此外,包括我們在內的行業參與者並不總是清楚哪些專利涵蓋各種 藥物、生物製劑、藥物輸送系統或其使用方法,以及哪些專利可能有效和可執行。因此,由於 在我們的領域中已頒發大量專利和提交了大量專利申請,可能存在第三方聲稱 他們擁有涵蓋我們候選產品、技術或方法的專利權的風險。
此外,第三方的專利可能被我們的候選產品或專有技術侵犯或被指控侵犯。由於美國的某些專利申請可能在專利頒發之前保密, 由於美國和許多外國司法管轄區的專利申請通常在提交後18個月才公佈,而且科學文獻中的出版物通常落後於實際發現,因此我們不能確定其他人 沒有就我們自己和授權內已頒發的專利或我們正在處理的申請所涵蓋的技術提交專利申請。我們的競爭對手 可能已經提交了專利申請,並可能在未來提交,涵蓋我們的候選產品或與我們類似的技術。任何此類專利申請可能優先於我們自己的和授權內的專利申請或專利,這可能進一步要求我們獲得涵蓋此類技術的已頒發專利的 權利。如果另一方提交了類似於我們擁有或授權給我們的發明的美國專利申請,則我們或在許可技術的情況下,許可人可能必須在美國參與幹擾程序,以確定發明的優先權。
我們 可能面臨或受到擁有專利或其他知識產權的第三方的未來訴訟的威脅,這些第三方聲稱我們的候選產品或專有技術侵犯了這些第三方的知識產權,包括根據《哈奇-瓦克斯曼法》第四款提起的訴訟。這些訴訟可能聲稱存在此類藥物的現有專利權,此類訴訟可能代價高昂,並可能對我們的運營結果產生不利影響,並轉移管理人員和技術人員的注意力,即使我們沒有侵犯此類專利或針對我們的專利最終被認定為無效。 法院可能會裁定我們侵犯了第三方的專利,並將命令我們停止專利涵蓋的活動 。此外,法院可能會命令我們為侵犯對方專利而向對方支付損害賠償金。
由於專利侵權索賠,或為了避免潛在索賠,我們可能會選擇或被要求向第三方尋求許可。 這些許可可能不按商業上可接受的條款提供,或者根本不適用。即使我們能夠獲得許可證,許可證 也可能要求我們支付許可費和/或版税,而授予我們的權利可能是非排他性的,這可能會導致我們的競爭對手獲得相同的知識產權,或者此類權利可能是限制性的,並限制我們現在和未來的活動 。最終,如果由於實際或威脅的專利侵權索賠,我們或被許可人無法以可接受的條款獲得許可,我們或被許可人可能會被阻止將產品商業化,或被迫停止我們業務的某些方面 。
除了可能對我們提出的侵權索賠外,我們還可能成為其他專利訴訟和其他訴訟的一方,包括 美國專利商標局宣佈或批准的幹擾、派生、重新審查或其他授權後訴訟,以及 外國關於我們當前或其他產品知識產權的類似訴訟。
在生物技術和製藥行業中,一般都有大量涉及專利和其他知識產權的訴訟。到目前為止,還沒有人對我們提起過侵權訴訟。如果第三方聲稱我們侵犯了其知識產權,我們可能會面臨許多問題,包括:
| ● | 侵權 和其他知識產權索賠,無論案情如何,提起訴訟都可能既昂貴又耗時,並可能轉移我們管理層對核心業務的注意力。 |
| ● | 大量的侵權損害賠償,如果法院判定爭議產品或技術侵犯或侵犯第三方的權利,我們可能需要支付 ,如果法院認定侵權是故意的,我們可能被勒令支付三倍損害賠償金 和專利權人的律師費; |
| 47 |
| ● | a 法院禁止我們銷售或授權產品或使用技術,除非第三方授權其知識產權 我們的財產權,這是不需要做的; |
| ● | 如果 如果許可證可從第三方獲得,我們可能需要支付大量的版税或前期費用,或向知識產權授予交叉許可證 我們的產品或技術的產權;以及 |
| ● | 重新設計我們的產品或流程,使其不會侵權,這可能是不可能的,也可能需要大量的金錢支出和 時間。 |
我們的一些競爭對手 可能比我們更有效地承擔複雜專利訴訟的費用,因為他們擁有大量 的資源。此外,任何訴訟的發起和持續產生的任何不確定性都可能損害我們籌集額外資金的能力,或以其他方式對我們的業務、財務狀況、經營業績和前景造成不利影響。
由於 我們依賴某些第三方許可人和合作夥伴,並且在未來將繼續這樣做,如果我們的許可人或合作伙伴 因侵犯第三方的知識產權而被起訴,我們的業務、財務狀況、經營成果和前景 可能會以與我們被直接起訴相同的方式受到影響。除了面臨訴訟風險外,我們還同意賠償某些 第三方許可人和合作夥伴,使其免受因我們的專有技術引起的侵權索賠,我們已經或可能 與我們的一些許可方和合作夥伴簽訂了費用分攤協議,這些協議可能要求我們支付專利訴訟的部分費用 對這些第三方提起訴訟,無論指稱的侵權行為是否由我們的專有技術引起。在某些情況下, 這些費用分攤協議還可能要求我們承擔比僅基於我們的技術承擔的更大的侵權損害賠償責任。
發生上述任何情況都可能對我們的業務、財務狀況或經營業績產生不利影響。
我們 可能會捲入訴訟,以保護或執行我們的專利或其他知識產權或我們的許可方的專利, 這可能是昂貴和耗時的。
競爭對手 可能會侵犯我們的知識產權,包括我們的專利或我們許可方的專利。因此,我們可能需要提交 侵權索賠以阻止第三方侵權或未經授權的使用。這可能既昂貴又耗時,尤其是對於我們這樣規模的公司。此外,在侵權訴訟中,法院可以裁定我們的專利無效或不可強制執行, 或者可以以我們的專利主張不包括我們的技術 或未滿足對侵權者授予禁令所需的因素為理由,拒絕阻止另一方使用所涉技術。對任何訴訟或其他訴訟的不利裁決可能會使我們的一項或多項專利面臨被無效、狹義解釋或修改的風險,從而使它們 不涵蓋我們的候選產品。此外,這種不利的裁決可能會使我們的專利申請面臨無法發佈的風險, 或者發佈的範圍有限且可能不足以涵蓋我們的候選產品或阻止其他公司銷售類似的產品 。
對於 我們或我們的許可人或潛在合作伙伴的專利申請,可能需要向USPTO提起干涉、 衍生或其他訴訟來確定發明的優先權或專利性。我們提起的訴訟或USPTO程序可能會失敗,或者 可能會被第三方援引來對我們不利。即使我們取得了成功,國內或國外的訴訟或美國專利商標局或外國專利局 的訴訟程序也可能導致大量成本和分散我們的管理。我們可能無法單獨或與我們的許可人或潛在的 合作伙伴一起防止盜用我們的所有權,特別是在法律可能不像美國那樣充分保護此類權利的國家 。
此外, 由於知識產權訴訟或其他訴訟程序需要大量的發現,因此在此類訴訟或其他訴訟程序中,我們的一些機密信息可能會因披露而泄露。 此外,在此類訴訟或訴訟程序的過程中,可能會公開宣佈聽證結果、 動議或其他臨時程序或事態發展,或公開訪問相關文件。如果投資者認為這些結果是負面的,我們普通股或認股權證的市場價格可能會受到嚴重損害。
| 48 |
我們 對第三方的依賴要求我們分享我們的商業祕密,這增加了我們的商業祕密被盜用 或泄露的可能性,而且與員工和第三方簽訂的保密協議可能無法充分防止商業祕密的泄露 和保護其他專有信息。
我們 認為專有的商業祕密或機密技術和非專利技術對我們的業務非常重要。我們可能依賴商業祕密 或機密技術來保護我們的技術,特別是當我們認為專利保護價值有限時。
為保護此類信息不被競爭對手披露或竊取,我們的政策是要求我們的員工、顧問、合作者、承包商和顧問在開始研究或披露專有信息之前與我們簽訂保密協議以及材料轉讓協議、諮詢 協議或其他類似協議。這些協議通常 限制第三方使用或披露我們的機密信息的權利,包括我們的商業祕密。但是,現任或前任員工、顧問、合作者、承包商和顧問可能會無意或故意向競爭對手泄露我們的機密信息,保密協議可能無法在未經授權泄露機密信息的情況下提供足夠的補救措施。共享商業祕密和其他機密信息的需要增加了此類商業祕密 被我們的競爭對手知曉、被無意中納入其他人的技術中、或在違反這些協議的情況下被披露或使用的風險。鑑於我們的專有地位在一定程度上基於我們的技術訣竅和商業祕密,競爭對手發現我們的商業祕密或其他未經授權的使用或披露將損害我們的競爭地位,並可能對我們的業務和運營結果產生不利影響。強制要求第三方非法獲取並使用商業祕密或機密專有技術是昂貴、耗時且不可預測的。保密協議的可執行性因司法管轄區而異。
此外,這些協議通常會限制我們的員工、顧問、合作者、承包商和顧問發佈可能與我們的商業祕密有關的數據的能力,儘管我們的協議可能包含某些有限的發佈權。儘管我們努力保護我們的商業祕密,但我們的競爭對手可能會通過違反我們與第三方的協議、通過我們的任何第三方合作者獨立開發或發佈信息來發現我們的商業祕密。競爭對手發現我們的商業機密將損害我們的競爭地位,並對我們的業務產生不利影響。
我們 可能會受到以下指控的影響:我們的員工、顧問或獨立承包商錯誤地使用或向我們披露了他們的前僱主或他們的以前或現在的客户的所謂商業機密。
由於 在生物技術和製藥行業很常見,我們的某些員工以前受僱於其他生物技術 或製藥公司,包括我們的競爭對手或潛在競爭對手。此外,我們聘請顧問幫助我們開發我們的產品和候選產品,其中許多人以前受僱於或可能以前受僱於或正在為其他生物技術或製藥公司提供諮詢服務,包括我們的競爭對手或潛在的 競爭對手。我們可能會受到指控,稱這些員工和顧問或我們無意中或以其他方式使用或泄露了他們的前僱主或他們的前或現在客户的商業祕密或其他專有信息。雖然我們目前還不知道有任何此類索賠被指控,但如果發生此類索賠,可能需要提起訴訟來對抗任何此類索賠。 即使我們成功地抗辯了任何此類索賠,任何此類訴訟都可能曠日持久、代價高昂,分散我們管理團隊的注意力,投資者和其他第三方並不看好我們,並可能導致不利的結果。
如果我們的專利期在我們的產品獲得批准之前或之後不久到期,或者如果仿製藥或生物相似藥物製造商成功挑戰我們的專利,我們的業務可能會受到實質性損害。
專利 的有效期有限。在美國,如果及時支付所有維護費,專利的自然失效時間通常為自其在美國最早的非臨時申請日期起計的二十(20)年。可能有各種延期,但專利的有效期及其提供的保護是有限的。即使獲得了涵蓋我們候選產品、其製造或用途的專利,但一旦專利有效期過期,我們可能會面臨來自競爭性藥物的競爭,包括仿製藥或生物相似藥物。
| 49 |
根據我們候選產品的FDA上市批准的時間、期限和條件,我們的一項或多項美國專利 可能有資格根據1984年的《藥品價格競爭和專利期限恢復法》(簡稱《哈奇-瓦克斯曼法》)和歐盟的類似立法獲得有限的專利期延長。《哈奇-瓦克斯曼法案》允許涵蓋經批准產品的專利的專利期延長最多 至五年,以補償在產品開發和FDA監管審查過程中失去的有效專利期。專利期限的延長不能超過自產品批准之日起的14年 ,並且只能延長一項適用於經批准的藥物的專利。但是,如果我們未能在適用的截止日期內提出申請、未能在相關專利到期前提出申請或未能 滿足適用的要求,我們可能得不到延期。此外,延期的長度可能比我們要求的要短。如果我們無法獲得專利 延期,或者任何此類延期的期限比我們要求的要短,我們可以對該產品執行專利權的期限將縮短,我們的競爭對手可能會比我們預期的更早獲得批准,將競爭產品推向市場。此外,我們在任何專利期延展期內排除的權利的範圍可能是有限的,也可能不包括競爭對手的產品或 產品的使用。因此,我們來自適用產品的收入可能會減少,可能會大幅減少。
考慮到新藥候選藥物的開發、測試和監管審查所需的時間,保護此類候選藥物的專利可能會在這些候選藥物商業化之前或之後不久到期。因此,我們的專利和專利申請可能無法 為我們提供足夠的權利來排除其他人將與我們相似或相同的產品商業化。上述任何一項 都可能對我們的競爭地位、業務、財務狀況、經營結果和前景產生重大不利影響。
仿製藥或生物類似藥的製造商 可能會在法庭或專利局對我們專利的範圍、有效性或可轉讓性提出質疑, 我們可能無法成功執行或捍衞這些知識產權,因此可能無法開發 或專門銷售相關產品,這將對該產品的任何潛在銷售產生重大不利影響。當我們已頒發的專利或可能由我們待決專利申請頒發的專利到期時,我們將無法向潛在競爭對手主張此類專利權,我們的業務和經營成果可能會受到不利影響。
如果我們的商標和商號得不到充分保護,我們可能無法在我們感興趣的市場建立知名度 ,我們的業務可能會受到不利影響。
我們的 未註冊商標或商品名稱可能會受到質疑、侵權、規避或宣佈為通用商標或被確定為侵犯 其他商標。我們可能無法保護我們對這些商標和商號的權利,而我們需要在我們感興趣的市場中建立起潛在合作者或客户的名稱認知 。有時,競爭對手可能採用與我們相似的商品名稱或商標,從而阻礙我們建立品牌標識的能力,並可能導致市場混亂。此外,其他註冊商標或包含我們未註冊商標或商號變體 的商標所有者可能會提出 商號或商標侵權索賠。從長遠來看,如果我們無法成功註冊我們的商標和商號並根據我們的商標和商號建立名稱識別,那麼我們可能無法有效競爭,我們的 業務可能會受到不利影響。我們執行或保護我們與商標、商業祕密、域名 、版權或其他知識產權相關的所有權的努力可能無效,並可能導致鉅額成本和資源轉移 ,並可能對我們的財務狀況或運營結果造成不利影響。
我們的 專有信息可能會丟失,或者我們可能會遭受安全漏洞。
在 日常業務過程中,我們在數據 中心和網絡中收集和存儲敏感數據,包括知識產權、臨牀試驗數據、專有 業務信息、臨牀試驗受試者和員工的個人數據和個人身份信息。安全處理、維護和傳輸這些信息對我們的運營至關重要。儘管 我們採取了安全措施,但我們的信息技術和基礎設施仍可能容易受到黑客攻擊,或因員工 錯誤、瀆職或其他中斷而遭到破壞。儘管據我們所知,迄今為止,我們還沒有遇到任何此類重大安全漏洞, 任何此類漏洞都可能危及我們的網絡,並且存儲在網絡中的信息可能會被訪問、公開披露、丟失或被盜。 任何此類訪問、披露或其他信息丟失都可能導致法律索賠或訴訟、 保護個人信息隱私的法律責任、重大監管處罰、擾亂我們的運營、損害我們的聲譽並導致 對我們和我們開展臨牀試驗的能力失去信心,這可能會對我們的聲譽造成不利影響,並延遲我們候選產品的臨牀開發 。
| 50 |
與上市公司相關的風險
我們的 管理團隊管理上市公司的經驗有限,可能無法成功管理我們向上市公司地位的過渡。
我們管理團隊的大多數 成員在管理上市公司、與上市公司投資者互動以及遵守與上市公司相關的日益複雜的法律方面的經驗有限。我們的管理團隊可能無法成功或有效地 管理向上市公司的過渡,而上市公司將受到 聯邦證券法規定的重大監管監督和報告義務,並受到證券分析師和投資者的持續審查。這些新的義務和組成部分 需要我們的高級管理層高度關注,可能會分散他們對 業務的日常管理的注意力,這可能會損害我們的業務、經營成果和財務狀況。
作為一家上市公司,我們 產生了顯著增加的費用和行政負擔,這可能會對我們的業務、財務狀況和經營業績產生不利影響。
作為一家上市公司,我們面臨着更多的法律、會計、行政和其他成本和費用,這是我們作為私營公司沒有發生的 ,在我們不再是一家“新興成長型公司”後,這些費用可能會增加得更多。薩班斯-奧克斯利法案,包括第404節的要求,以及後來由美國證券交易委員會實施的規則和條例,2010年的多德-弗蘭克華爾街改革和消費者保護法及其頒佈和即將頒佈的規則和條例,美國上市公司會計準則委員會和證券交易所以及納斯達克的上市標準,要求上市公司承擔額外的報告和其他義務。
遵守上市公司的要求會增加成本,並使某些活動更加耗時。其中許多要求 將要求我們執行以前未執行的活動。例如,我們成立了新的董事會委員會,簽訂了新的保險單,並採用了新的內部控制和披露控制程序。此外,還將產生與 美國證券交易委員會報告要求相關的費用。此外,如果在遵守這些要求方面發現任何問題(例如, 如果管理層或我們的獨立註冊會計師事務所發現財務報告的內部控制存在重大弱點),我們可能會產生糾正這些問題的額外成本,這些問題的存在可能會對我們的聲譽 或投資者對我們的看法產生不利影響,並且獲得董事和高級管理人員責任保險的成本可能會更高。與我們上市公司身份相關的風險可能會使我們更難吸引和留住合格的人員加入我們的董事會或擔任高管 。此外,作為一家上市公司,我們可能會受到股東激進主義的影響,這可能會導致鉅額成本,分散管理層的注意力,並以我們目前沒有預料到的方式影響我們運營業務的方式。由於在本招股説明書和上市公司要求的備案文件中披露信息,我們的業務和財務狀況將變得更加可見,這可能會導致威脅或實際的訴訟,包括競爭對手和其他第三方的訴訟。如果此類索賠成功, 我們的業務和運營結果可能會受到實質性的不利影響,即使索賠不會導致訴訟或得到對我們有利的解決方案,這些索賠以及解決這些索賠所需的時間和資源可能會分散我們管理層的資源 ,並對我們的業務和運營結果產生不利影響。這些規則和法規規定的額外報告和其他義務將增加法律和財務合規成本以及相關法律、會計和行政活動的成本。 這些增加的成本將要求我們轉移大量原本可以用於擴大業務和實現戰略目標的資金。股東和第三方的倡導努力還可能促使治理和報告要求發生更多變化,這可能會進一步增加成本。
| 51 |
上市公司的 要求可能會使我們的資源緊張,分散管理層的注意力,並影響我們吸引和留住合格董事會成員的能力。
我們 須遵守經修訂的1934年《證券交易法》(以下簡稱《交易法》)、《薩班斯-奧克斯利法案》及其下頒佈的任何規則以及納斯達克的報告要求。這些規則和法規的要求增加了我們的法律和財務合規成本,使某些活動更加困難、耗時或成本高昂,並增加了對我們的系統和資源的需求 。《薩班斯-奧克斯利法案》(Sarbanes-Oxley Act)要求我們保持有效的披露控制和程序以及財務報告的內部控制。為了維持並在必要時改進我們的信息披露控制和程序以及財務報告的內部控制以達到這一標準,將需要大量資源和管理監督,因此,管理層的注意力可能會從其他業務事項上轉移。這些規章制度還會使我們更難吸引和留住合格的獨立董事會成員。此外,這些規章制度 使我們獲得董事和高級管理人員責任保險變得更加困難和昂貴。我們可能被要求接受降低的 承保範圍或產生更高的費用才能獲得承保。遵守上市公司報告要求的成本增加 ,以及我們可能無法滿足這些要求,可能會對我們的運營、業務、財務狀況 或運營結果產生重大不利影響。
為了履行作為上市公司的義務,我們需要聘請具有適當上市公司經驗的合格會計和財務人員。
作為一家新成立的上市公司,我們將需要改進和保持有效的信息披露和財務控制,並在我們的公司治理實踐中做出改變。我們可能需要招聘更多具有適當上市公司經驗和技術會計知識的會計和財務人員,招聘和留住這些人員可能會有困難。即使我們能夠僱用合適的人員,我們現有的運營費用和運營也將受到僱用他們的直接成本以及與從研發工作中轉移管理資源相關的間接後果的影響。
我們 是一家新興成長型公司,任何決定只遵守適用於新興成長型公司的某些減少的報告和披露要求 都可能會降低我們的普通股對投資者的吸引力。
根據《就業法案》的定義,我們 是一家新興成長型公司。只要我們繼續是一家新興成長型公司,我們就可以選擇利用適用於其他上市公司但不適用於“新興成長型公司”的各種報告要求的豁免,包括:
| ● | 不要求獨立註冊會計師事務所根據薩班斯-奧克斯利法案第404節對我們的財務報告進行內部控制; |
| ● | 簡化 在我們的定期報告和10—K表格的年度報告中披露有關高管薪酬的義務;以及 |
| ● | 豁免 就高管薪酬和股東批准任何黃金降落傘舉行非約束性諮詢投票的要求 以前未批准的款項。 |
因此, 股東可能無法訪問他們認為重要的某些信息。我們作為新興增長型公司的地位將在發生以下任何一種情況時終止:
| ● | 每年收入最少為10.7億元的財政年度的最後一天; |
| ● | 我們有資格成為“大型加速申報人”的日期,其中至少有7億美元的股權證券由非關聯公司持有; |
| ● | 我們在任何三年期內發行超過10億美元的不可轉換債務證券的日期;或 |
| ● | 在Larkspur IPO五週年後結束的財年最後一天。 |
| 52 |
根據《就業法案》,新興成長型公司還可以推遲採用新的或修訂的會計準則,直到這些準則 適用於私營公司。我們可能會選擇利用這一延長的過渡期,因此,我們的財務報表可能無法與類似情況的上市公司進行比較。
如果我們選擇依賴新興成長型公司提供的任何豁免,我們 無法預測投資者是否會發現我們的普通股吸引力降低。如果一些投資者因為我們依賴任何這些豁免而發現我們的普通股吸引力下降,我們的普通股可能會出現 不那麼活躍的交易市場,我們普通股的市場價格可能會更加波動,可能會下降。
如果我們未能對財務報告保持有效的披露控制和內部控制系統,我們編制及時準確的財務報表或遵守適用法規的能力可能會受損,這可能會對投資者 對我們的信心產生不利影響,從而影響我們普通股的市場價格。
作為一家上市公司,我們將被要求遵守《薩班斯—奧克斯利法案》的要求,其中包括我們 維持有效的披露控制和程序以及對財務報告的內部控制。我們將繼續制定和完善 我們的披露控制措施和其他程序,以確保我們在提交給SEC的報告中披露的信息 在SEC規則和表格中規定的時間段內得到記錄、處理、彙總和報告,並確保根據《交易法》要求在報告中披露的信息得到累積並傳達給我們的管理層,包括我們的首席執行官和財務官。
我們 必須繼續改進財務報告的內部控制。我們將被要求對我們的財務報告內部控制的有效性進行正式評估,一旦我們不再是一家新興成長型公司,我們可能會被要求 包括由我們的獨立註冊會計師事務所出具的關於財務報告內部控制的證明報告。為了在規定的時間內實現這些要求的合規,我們將參與一個流程 來記錄和評估我們對財務報告的內部控制,這既昂貴又具有挑戰性。在這方面,我們 將需要繼續投入內部資源,可能聘請外部顧問,並採用詳細的工作計劃,以評估和記錄我們對財務報告的內部控制的充分性,通過測試驗證控制 是否如文件所述發揮作用,並實施持續的報告和改進財務報告的內部控制流程 。存在這樣的風險,即我們無法在規定的時間內或根本無法得出結論,即我們對財務報告的內部控制是有效的,符合薩班斯-奧克斯利法案第404條的要求。此外,我們的測試,或我們的獨立註冊會計師事務所隨後進行的測試,可能會揭示我們在財務報告方面的內部控制 存在其他被認為是重大弱點的缺陷。
任何 未能實施和保持有效的披露控制和程序以及財務報告的內部控制,包括確定一個或多個重大弱點,都可能導致投資者對我們 財務報表和報告的準確性和完整性失去信心,這可能會對我們普通股的市場價格產生不利影響。此外,我們可能 受到我們普通股上市的證券交易所、美國證券交易委員會和其他監管機構的制裁或調查。
在這方面,在2022財年的審計期間,我們發現財務報告的內部控制存在重大弱點 ,因為我們沒有設計和實施對重大和複雜的非常規交易的會計進行有效控制。 見“風險因素--我們發現財務報告的內部控制存在重大缺陷。如果我們不能 彌補重大弱點並以其他方式維持有效的財務報告內部控制系統,我們財務報告的可靠性、投資者對我們的信心和我們普通股的價值可能會受到不利影響.”
我們 可能會受到證券訴訟的影響,這是昂貴的,可能會轉移管理層的注意力。
我們普通股的每股價格可能會波動,在過去,經歷過股票市場價格波動的公司會受到證券訴訟,包括集體訴訟。此類訴訟可能導致 鉅額費用和轉移管理層的注意力和資源,這可能對我們的業務、財務狀況和運營結果產生實質性的不利影響。訴訟中任何不利的裁決也可能使我們承擔重大責任。
由於 我們是通過傳統的承銷首次公開發行以外的方式成為上市公司的,我們的股東可能面臨 額外的風險和不確定性。
由於我們通過完善業務合併而不是通過傳統的承銷首次公開募股的方式成為一家上市公司,因此沒有獨立的第三方承銷商出售我們普通股的股票,因此,我們的 股東將無法受益於通常由獨立承銷商在公開證券發行中執行的獨立審查和調查類型。盡職調查審查通常包括對公司、任何顧問及其各自附屬公司的背景進行獨立調查,審查發售文件,並對業務計劃和任何潛在的財務假設進行獨立分析。
雖然 我們對Old ZyVersa進行了與業務合併有關的盡職調查和調查,但缺乏獨立的 盡職調查和調查增加了投資我們證券的風險,因為我們的盡職調查和調查 可能沒有發現對潛在投資者很重要的事實。
此外,由於我們沒有通過傳統的承銷首次公開募股方式成為上市公司,證券 或行業分析師可能不會提供或不太可能提供我們的保險。投資銀行也可能不太可能同意 代表我們承銷二次發行,而如果我們通過傳統的 承銷首次公開募股成為一家上市公司,他們可能會不太瞭解我們,因為分析師和 媒體的報道更加有限。未能獲得我們普通股市場的研究覆蓋或支持,可能會對我們開發普通股流動性市場的能力產生不利影響。
| 53 |
與本次發行和我們證券所有權相關的風險
我們普通股的 活躍交易市場可能永遠不會發展或維持下去。
雖然 我們的普通股在納斯達克上市,但我們股票的市場表現出不同水平的交易活動。如果一個活躍的交易 市場沒有發展,或發展了但沒有維持,由於有限的 公眾持股量,您可能難以出售我們的任何普通股。我們無法預測我們普通股的交易價格。在未來的一個或多個時期,我們的 運營結果和產品管道的進展可能無法滿足公眾市場分析師和投資者的期望, 並且,由於這些和其他因素,我們的普通股價格可能會下跌。因此,我們不能向您保證您有能力 在需要時或以等於或高於您購買股份的價格出售您的普通股股份,或根本不出售。
我們普通股的市場價格可能會波動,這可能會給投資者帶來重大損失。
我們普通股的 交易價格一直且可能繼續高度波動,並可能會因各種因素(其中一些因素超出了我們的控制範圍)而發生大幅度波動。
我們普通股的市場價格可能會因各種因素而波動,包括:
| ● | 開發和批准我們的候選產品; | |
| ● | 我們候選產品的發佈和商業化時間(如果獲得批准),以及此類發佈和 商業化符合證券分析師和投資者的期望; | |
| ● | 實際 或我們經營業績的預期波動,包括季度和年度業績的波動; | |
| ● | 操作 費用超出預期; | |
| ● | 我們的任何產品開發和研究計劃失敗或中斷; |
| 54 |
| ● | 更改 學術和研究實驗室和機構的研究結構或資金,包括會影響 購買我們的儀器或消耗品的能力; | |
| ● | 現有或新的競爭性業務或技術的成功; | |
| ● | 公告 關於我們競爭對手的新研究項目或產品; | |
| ● | 發展 專利申請、授權專利或者其他知識產權的爭議; | |
| ● | 關鍵人員的招聘或離職; | |
| ● | 訴訟 以及涉及我們、我們行業或兩者的政府調查; | |
| ● | 法規 或美國和其他國家的法律發展; | |
| ● | 波動性 以及一般生命科學技術部門,或蛋白質組學或基因組學部門的市場條件的變化; | |
| ● | 投資者 對我們或我們行業的看法; | |
| ● | 與我們的任何研發項目或產品相關的費用水平; | |
| ● | 實際 或預期我們的財務業績或開發時間表的估計發生變化,財務業績的變化 或那些被認為與我們相似的公司的公司,或證券分析師的估計或建議發生變化,如果 任何,涵蓋我們的普通股或被認為與我們相似的公司; | |
| ● | 如果 我們的財務業績符合證券分析師或投資者的期望; | |
| ● | 宣佈或預期額外的融資努力; | |
| ● | 銷售 我們或我們的內部人士或其他股東持有我們的普通股; | |
| ● | 市場僵局或禁售協議到期; | |
| ● | 一般 經濟、工業和市場狀況;以及 | |
| ● | 流行病, 例如COVID-19大流行、自然災害或重大災難性事件。 |
無論我們的經營業績如何,這些 市場和行業因素可能會大幅降低我們普通股的市場價格。
最近, 一般的股票市場,特別是生命科學技術公司的市場,經歷了重大的價格和 交易量波動,這些波動通常與其股票正在經歷這些價格和交易量波動的公司的經營業績變化無關或不成比例。廣泛的市場和行業因素可能會嚴重影響 我們普通股的市場價格,而不管我們的實際經營業績如何。這些波動在我們的普通股和權證的交易市場上可能更加明顯 。在公司證券市場價格出現這種波動的時期之後,證券 集體訴訟往往會針對該公司提起。
由於 我們普通股價格的潛在波動,我們將來可能會成為證券訴訟的目標。證券 訴訟可能導致大量成本,並分散管理層對我們業務的注意力和資源。
| 55 |
無法保證我們能夠遵守納斯達克的持續上市標準。
如果 納斯達克因未能達到納斯達克的上市標準而使我們的普通股在其交易所退市,我們和我們的股東可能面臨重大的不利後果,包括:
| ● | 我們證券的市場報價有限; | |
| ● | 降低了我們證券的流動性; | |
| ● | a 確定我們的普通股是一種"廉價股",這將要求交易我們普通股的經紀商遵守 更嚴格的規則,並可能導致我們證券在二級交易市場的交易活動減少; | |
| ● | a 有限的新的和分析員覆蓋範圍;以及 | |
| ● | A 未來發行額外證券或獲得額外融資的能力下降。 |
我們 未能遵守納斯達克的持續上市要求,可能導致我們的普通股退市。
我們的 普通股目前在納斯達克全球市場上市交易。我們必須滿足 納斯達克的持續上市要求,以維持我們的普通股在納斯達克全球市場的上市。
2023年6月9日,公司收到納斯達克的一封信函,表明根據公司普通股過去連續30個工作日的收盤出價,公司目前不符合維持每股1.00美元的最低出價的要求,以在納斯達克全球市場繼續上市,根據納斯達克上市規則5550(a)(2)(“通知”)的規定。
根據納斯達克上市規則第5810(C)(3)(A)條,我們 獲得了180個歷日的合規期,自通知之日起或至2023年12月6日,以重新遵守最低成交報價要求。
2023年11月14日,納斯達克 向本公司發佈信函稱,截至2023年11月13日,確定本公司證券連續十個交易日的收盤價 為0.1美元或更低。因此,本公司須遵守上市規則 5810(C)(3)(A)(Iii)項下擬訂立的條文。因此,納斯達克決定於2023年11月16日將本公司的證券從納斯達克全球市場退市,除非本公司及時要求在納斯達克聽證會小組(下稱“小組”)舉行聽證會。因此,公司 及時要求並安排了小組聽證會,納斯達克的任何退市行動將被擱置,等待小組在聽證會後發佈決定以及小組可能批准的任何延長期屆滿。 在聽證會上,公司將提交其計劃,以證明其遵守規則的情況,並請求延長 這樣做的時間。2023年10月31日,在公司股東周年大會上,公司股東批准了對公司第二份修訂後的公司註冊證書的修正案 ,對公司已發行的普通股進行反向股票拆分,比例不低於10股1股,不大於1股50股,具體比例 由公司董事會自行決定。該公司以35股1股的比例實施了這種 反向股票拆分,試圖重新遵守規則。
不能保證將舉行聽證,也不能保證如果舉行聽證,專家組將作出有利的決定。
如果我們沒有從評審團獲得有利的決定,我們將被摘牌。
此外, 2023年9月1日,本公司收到納斯達克的一封信,稱在過去的連續30個營業日,本公司 不符合繼續在納斯達克全球市場上市的公開持有股票(“MVPHS”)最低市值為5,000,000美元的要求,如納斯達克上市規則5450(b)(1)(C)所述。
| 56 |
根據納斯達克上市規則第5810(C)(3)(D)條,本公司有180個歷日,或至2024年2月28日,以恢復 遵守MVPHS的最低要求。要重新獲得合規,公司普通股的最低MVPHS必須 在180個日曆日合規期內至少連續十個工作日達到或超過5,000,000美元。
如果公司未能在2024年2月28日之前重新遵守MVPHS的最低要求,納斯達克將向公司發出書面通知,通知其證券將被摘牌。或者,本公司也可以考慮申請將本公司的證券轉讓給納斯達克資本市場。
公司打算從現在起至2024年2月28日監控其普通股的MVPHS,如果其普通股的交易水平不是很可能重新合規,公司將考慮可供公司使用的各種選擇。
如果我們未來無法繼續滿足所有適用的納斯達克全球市場要求,而納斯達克決定將我們的普通股退市 ,退市可能會大幅減少我們普通股的交易量;由於失去與納斯達克相關的市場效率和失去州證券法的聯邦優先購買權,我們的普通股的市場流動性受到不利影響 ;對我們以可接受的條款獲得融資的能力產生不利影響(如果有的話);並可能導致投資者、供應商、客户和員工潛在失去信心 ,減少業務發展機會。此外,我們普通股的市場價格可能會進一步下跌,股東可能會損失部分或全部投資。
除非 我們的普通股繼續在國家證券交易所上市,否則它將受到所謂的 “便士股票” 限制銷售行為的規則。
如果我們無法維持我們的普通股在納斯達克或其他國家證券交易所的上市,如果我們的普通股的市值低於每股5.00美元,我們的普通股 可能會受到所謂的“細價股”規則的約束。 美國證券交易委員會通過的規定將細價股定義為包括任何市值低於每股5.00美元的股票, 受某些例外情況的限制,包括在國家證券交易所交易的股票例外。《美國證券交易委員會條例》對經紀自營商銷售低價股的行為施加了 限制性銷售要求,這些經紀自營商將低價股出售給美國證券交易委員會相關規則所定義的已建立客户和經認可的 投資者以外的人。這些額外的要求可能會阻礙經紀自營商對被歸類為細價股的證券進行交易,這可能會嚴重限制此類證券的市場價格和流動性,以及購買者在二級市場出售此類證券的能力。這意味着,如果我們無法維持我們的普通股在國家證券交易所上市,股東在二級市場出售普通股的能力可能會受到不利影響 。
如果涉及細價股的交易不受美國證券交易委員會規則的約束,經紀自營商必須在交易前向每位投資者提交一份與細價股市場相關的披露明細表。經紀-交易商還必須披露支付給經紀-交易商及其註冊代表的佣金、細價股票的當前報價,如果經紀-交易商是唯一的做市商,則經紀-交易商必須披露這一事實以及經紀-交易商對市場的假定控制。最後,必須發送每月對帳單 ,披露客户帳户中持有的細價股的最新價格信息,以及有關細價股的有限市場的信息。
我們 可能需要減記或註銷、重組和減值或其他可能對我們的財務狀況和普通股股價產生重大負面影響的費用 ,這可能會導致您的部分或全部投資損失。
我們 可能被迫在以後減記或註銷資產、重組業務或產生減值或其他費用,從而導致 報告損失。可能會出現意想不到的風險,已知的風險可能會以以前沒有預料到的方式出現。儘管這些 費用可能是非現金項目,不會對我們的流動性產生立竿見影的影響,但我們報告這種性質的費用的事實可能會導致市場對我們或我們的證券的負面看法。此外,這種性質的指控可能會導致我們違反槓桿或我們可能受到的其他契約。因此,我們的股東可能會因為任何此類減記或減記而遭受其 股票價值的縮水。
| 57 |
編制備考財務信息時使用的 假設可能不準確,其他因素可能會影響我們未來的財務狀況 或經營成果。我們的財務狀況或經營業績的任何潛在下降都可能導致 我們的股價發生重大變化。
我們於2023年1月27日提交了對我們於2023年12月16日提交的當前8-K/A表格(“原始8-K/A”)的修正案(“修正案”);該修正案純粹是為了完全取代原始8-K/A表格中包含的未經審計的形式簡明的綜合財務信息,該信息包括在我們的S-4表格中與業務組合有關的註冊聲明中。未經審核的備考簡明綜合財務資料先前反映管理層根據業務合併完成時可得的資料所作的估計,並會隨着獲得額外資料及進行分析而有所變動 。我們在分析完成後更新了未經審計的備考簡明合併財務信息 ,以反映業務合併為ZyVersa治療公司(“Old ZyVersa”)的遠期合併,因為已確定Old ZyVersa為可變權益實體。未經審核的備考簡明綜合財務資料及其相關附註 反映對本公司收購的Old ZyVersa的資產淨值作出的公允價值調整,該等淨資產主要包括進行中的研究 及開發中的無形資產,該等無形資產為無限期的。由於未經審計的備考簡明合併財務信息的變化,我們可能面臨潛在的訴訟或其他糾紛,其中可能包括涉及我們股東的訴訟、援引聯邦和州證券法的索賠、合同索賠或因此類變更而產生的其他索賠。截至本招股説明書發佈之日,我們不知道有任何此類索賠、訴訟或糾紛。但是,我們不能保證此類索賠、訴訟或 糾紛不會在未來發生。任何此類索賠、訴訟或糾紛,無論勝訴與否,都可能對我們的業務、運營結果和財務狀況產生重大不利影響。
我們 受到可能影響普通股市場價格的業務不確定性的影響。
關於我們業務或運營的不確定性 可能會影響我們與各自供應商、用户、分銷商、許可人、 和被許可人之間的關係。任何此類影響都可能對我們和我們普通股的市場價格產生不利影響。這些不確定性可能導致 與我們打交道的各方尋求改變與他們的現有業務關係,並推遲或推遲有關我們的決策。 現有業務關係的變更(包括終止或修改)可能會對我們的收入、收益 和現金流以及我們普通股的市價產生負面影響。
此外, 事務可能需要投入時間和資源,否則這些時間和資源本可以用於其他可能對我們有利的機會。此外,業務合併可能會產生潛在的責任,包括由於與業務合併相關的未決和未來的股東訴訟。這些事項中的任何一項都可能對我們的業務、財務狀況或運營結果產生不利影響。
| 58 |
第三方 可以終止或更改與我們的現有合同或關係。
與分銷商、關聯公司、房東、許可人和其他業務合作伙伴和我們目前有關係的第三方簽訂的合同 可能會終止、縮小關係範圍或以其他方式對他們與我們的關係造成重大不利影響。追求此類權利 可能會導致我們遭受潛在未來收入損失,或因違反此類協議而產生責任,並失去對我們業務至關重要的權利。任何此類中斷都可能限制我們實現業務預期收益的能力。此類中斷的不利影響也可能影響我們的業務和運營或 我們普通股的市場價格。
我們 在完成業務合併和整合Larkspur和Old ZyVersa的業務時, 產生了大量交易費用和成本。
我們 就業務合併及完成業務合併協議及相關交易協議擬進行的交易 產生重大非經常性費用。雖然我們假設業務合併將 產生一定水平的費用,但有許多超出我們控制範圍的因素已經影響並可能繼續 影響我們合併後業務的該等費用的總額或時間。業務合併後,在開展業務過程中可能會繼續產生額外的意外成本 。
如果我們受到任何證券訴訟或股東維權活動的影響,我們的業務和運營可能會受到負面影響, 這可能會導致我們產生鉅額費用,阻礙我們業務和增長戰略的執行,並影響我們的股價。
在過去,隨着一家公司證券市場價格的波動,經常會對該公司提起證券集體訴訟。股東激進主義可以採取多種形式,也可以在各種情況下出現,最近一直在增加。我們普通股股價的波動或其他原因可能會導致我們在未來成為證券訴訟或股東維權的目標。證券訴訟和股東激進主義,包括潛在的代理權競爭, 可能會導致鉅額成本,並將管理層和董事會的注意力和資源從我們的業務中轉移出去。 此外,此類證券訴訟和股東激進主義可能會給我們的未來帶來明顯的不確定性,對我們與服務提供商的關係產生不利影響,並使吸引和留住合格人員變得更加困難。我們還可能被要求支付與任何證券訴訟和維權股東事宜相關的鉅額法律費用和其他費用。此外,我們的股票價格可能會受到重大波動或受到任何證券訴訟和股東行動的事件、風險和不確定性的不利影響 。
向某些持有人授予註冊權,包括根據PIPE認購協議,以及未來此類 權利的行使可能會對我們普通股的市場價格產生不利影響。
業務合併完成後,經修訂及重訂的註冊權協議由吾等及若干其他訂約方 訂立,取代Larkspur先前的註冊權協議。根據經修訂及重訂的登記權利協議,受其約束的可登記證券持有人及其獲準受讓人及受讓人將享有有關其普通股股份的慣常登記權利(包括索取權、擱置權及搭載權,但須受合作及削減條款規限)。根據就完成PIPE投資訂立的登記權協議, 我們在業務合併後向美國證券交易委員會提交了一份登記聲明,就PIPE投資而言,我們將以PIPE證券為基礎的普通股進行二次發行。此外,根據該等登記權協議,吾等同意我們將盡商業上合理的最大努力(I)使該登記聲明在其後即時宣佈生效 及(Ii)維持該登記聲明的效力,直至不再有任何須登記證券 未清償為止。此外,PIPE認購協議規定,這些持有者將擁有某些“搭載”註冊權利,將其證券包括在我們提交的其他註冊聲明中。我們還同意向B系列股票的 持有人授予登記權,據此這些持有人將獲得與B系列股票相關的普通股股票的習慣登記權(包括索取權、擱置權和搭載權,受合作和削減條款的限制)。
| 59 |
如果 證券或行業分析師沒有發表關於我們的研究,或者發表關於我們、我們的業務 或我們的市場的不準確或不利的研究,或者如果他們對我們普通股的建議產生不利影響,我們的 普通股的交易價格或交易量可能會下降。
我們普通股的交易市場將在一定程度上受到證券或行業分析師可能發佈有關我們、我們的業務、我們的市場或我們的競爭對手的研究和報告的影響。如果一位或多位證券分析師以不利評級啟動研究,或下調我們的普通股評級,對我們的競爭對手提供更有利的推薦,或發佈關於我們業務的不準確或不利的研究 ,我們的普通股價格可能會下跌。如果很少有證券分析師開始報道我們,或者如果其中一個或多個分析師停止報道我們,或未能定期發佈有關我們的報告,我們可能會在金融市場失去可見性 ,對我們證券的需求可能會減少,這可能會導致我們普通股的價格和交易量下降。
我們總流通股的很大一部分可能會在不久的將來向市場出售,這可能會導致我們普通股的市場價格大幅下跌,即使我們的業務表現良好。
我們普通股的市場價格可能會因為在市場上大量出售我們普通股的股票,或者 認為這些出售可能發生的感覺而下降。截至2023年12月5日,我們共有1,243,297股已發行普通股(根據反向股票拆分產生的零碎股份的四捨五入進行調整)。在受某些股份約束的鎖定期滿 之後的任何時間,某些股東將有權根據我們修訂和重訂的《登記權利協議》享有有關根據證券法登記該等股份的要約和出售的某些權利,包括要求我們提交登記聲明以登記其股份的要約和出售。
作為2023年7月發行的一部分,B系列股票的轉換價格 降至每股普通股245.00美元的底價,管道認股權證的行權價 降至每股普通股70美元的底價,39,373份盡力而為 認股權證的行權價從行權價35美元降至5.78美元。只要我們普通股的市場價格在重新設定管道權證和盡力而為權證的行權價格後高於底價,該證券的持有者就可以行使此類證券並出售普通股的標的 股票,從中獲利。如果我們普通股的市場價格低於持有人認股權證的行使價,則持有人不太可能行使其認股權證。因此,在這種調整之後,此類證券的持有者可能更有可能行使或將證券轉換為我們的普通股並出售該普通股,從而對我們的普通股的市場價格造成額外的負面 壓力和其他稀釋效應。
保薦人股份登記於2023年10月20日完成,使500多萬股我們的普通股 可在短期內向市場出售。保薦人股票的成本基礎低於我們因Larkspur IPO和業務合併而發行的普通股,因此保薦人 股票持有人可能願意以低於我們普通股其他持有人的價格出售此類證券。保薦人股份及根據本公司於2023年10月20日生效的S-1表格登記聲明所登記的其他證券的供應,可能會對本公司普通股的市價產生負面影響。
此外,我們還提交了一份登記聲明,登記根據我們的股權補償計劃為未來發行預留的股票。 在該登記聲明生效後,在滿足適用的歸屬限制以及上述市場僵持協議和鎖定協議到期或豁免的情況下,根據此類計劃授予的未償還股票期權、限制性股票單位獎勵和認股權證或授予其他股權獎勵而發行的股票將可立即在公開市場上轉售。
隨着限制終止或根據註冊權出售我們的普通股 可能會使我們在未來以我們認為合適的價格出售股權證券 變得更加困難。這些出售還可能導致我們普通股的交易價格 下跌,使您更難以您認為合適的時間和價格出售我們普通股的股票。
| 60 |
我們 在可預見的未來不打算支付現金股息。
我們 目前打算保留我們的未來收益(如有),以資助我們的業務的進一步發展和擴展,並且不打算 在可預見的將來支付現金股息。任何未來支付股息的決定將由我們的 董事會酌情決定,並將取決於我們的財務狀況、經營業績、資本要求、未來協議中包含的限制 和融資工具、業務前景以及我們的董事會認為相關的其他因素。
我們的 股東未來可能會遭遇稀釋。
由於收購的股權發行、資本市場交易或其他原因,包括但不限於我們可能授予我們的董事、高級管理人員和員工的股權獎勵、行使我們的認股權證,當前股東持有的我們普通股的 百分比在未來可能被稀釋。
此外, 本次發行中註冊的股票數量可能會對我們以我們可以接受的價格發行額外股票的能力產生負面影響 ,發行金額足以讓我們執行我們的業務戰略。在公開市場上出售我們的大量普通股。這些出售,或市場上認為持有大量普通股的人打算出售股票的看法,可能會降低我們普通股的市場價格。此外,在公開市場上轉售或預期轉售或可能轉售大量普通股,可能會對普通股的市場價格 產生不利影響,並使我們的股東更難在他們認為 合適的時間和價格出售所持股份。由於保薦人股份與Larkspur首次公開招股及業務合併相關發行的股份相比成本基準較低,保薦人股份持有人可決定以低於其他投資者的價格出售該等股份。因此,根據本註冊聲明進行發行所產生的不利市場和價格壓力可能會持續很長一段時間。
經當時未發行的認股權證中至少50%的持股權證持有人批准,我們 可以修改認股權證的條款,修改方式可能對公開認股權證持有人不利。因此,可以提高認股權證的行使價格,縮短行使權證的期限,並減少在行使認股權證時可購買的普通股數量,所有這些都不會影響每份認股權證的 批准。
我們購買普通股作為Larkspur首次公開募股的一部分的認股權證是根據作為認股權證代理的大陸股票轉讓和信託公司與我們之間的權證 協議以註冊形式發行的。認股權證協議規定,這些認股權證的條款 可在未經任何持有人同意的情況下修改,以糾正任何含糊之處或更正任何有缺陷的條款,但須 至少50%當時尚未發行的公共認股權證持有人批准,才能作出任何對公共認股權證註冊持有人的利益造成不利影響的更改 。因此,如果當時未發行的公共認股權證中至少50%的持有人同意修改,我們可以不利於持有人的方式修改公共認股權證的條款。雖然我們在獲得當時至少50%的已發行公開認股權證同意的情況下,修訂公開認股權證的條款的能力是無限的,但此類修訂的例子 可以包括提高認股權證的行使價、將認股權證轉換為現金、縮短行使期或減少在行使認股權證時可購買的普通股數量。
我們 可以在對認股權證持有人不利的時間贖回未到期的認股權證,從而使該等認股權證變得一文不值。
我們 有能力在某些已發行的公共認股權證可行使後和到期前的任何時間,以每股認股權證0.35美元的價格贖回 ,前提是我們的普通股或普通股(視情況而定)在我們向認股權證持有人發送贖回通知的日期前30個交易日內的任何20個交易日內的最後售價等於或超過每股630.00美元(經股票拆分、股份資本化、重組、資本重組和類似調整後)。我們不會贖回此等認股權證,除非根據證券法 就可於行使此等認股權證時發行的普通股發行作出的有效登記聲明生效,且有關該等普通股的現行招股説明書 在整個30天的贖回期間內可供查閲,但如認股權證可在無現金基礎上行使,且該等無現金行使可獲豁免根據證券法登記,則本公司將不會贖回此等認股權證。如果且當認股權證變為可贖回時,如果在行使認股權證時發行的股票不能根據適用的州藍天法律獲得註冊或資格豁免,或者我們無法根據所有適用的州證券法註冊標的證券或使其符合出售資格,則我們可能無法行使贖回權。贖回未贖回認股權證可能迫使其持有人(I)行使 權證,並在可能對其不利的情況下支付其行使價,(Ii)在持有人原本可能希望持有認股權證的情況下,以當時的市場價格出售認股權證,或(Iii)接受名義贖回價格,而在要求贖回未償還認股權證時,名義贖回價格很可能大幅低於該等認股權證的市值。
| 61 |
我們的認股權證可能會對我們普通股的市場價格產生不利影響。
購買166,439股普通股的認股權證,作為Larkspur首次公開發售的單位的一部分,同時,Larkspur首次公開募股結束, 以私募方式發行了總計9,156個單位(每份包括一股普通股和可按每股402.50美元購買一股普通股的可贖回認股權證的四分之三)。認股權證使持有人 有權購買Larkspur普通股的股份,這些股份在業務合併完成後轉換為我們的普通股。我們 還發行了認股權證,購買PIPE Investment中最多141,868股普通股,可在盡力而為要約每股70.00美元(其中包括139,403股普通股)後按調整後的行權價格行使。此外,我們還發行了盡力而為認股權證,以購買最大努力發售的314,751股普通股,行使價為每股35.00美元,其中39,373股盡力而為認股權證重新定價,行權價從行權價35.00美元降至5.78美元。作為2023年7月發售的一部分,Old ZyVersa認股權證最多購買45,032股我們的普通股,誘導權證最多購買203,464股,行權價為每股4.75美元,以及2023年7月的認股權證,其中160,182股仍可發行,行權價為每股5.78美元。此類認股權證在行使時,將增加已發行和已發行普通股的數量,並降低普通股的價值。
不能保證舊的ZyVersa認股權證、管道權證、私募認股權證、公開認股權證、2023年7月的認股權證、誘導權證或盡力而為的認股權證將在現金中;它們可能到期一文不值,因此我們可能無法從行使認股權證獲得現金收益。
截至本協議日期,我們擁有(I)公開認股權證購買166,439股普通股,可按每股402.50美元的行使價行使,其於2027年12月12日到期或贖回,(Ii)Old ZyVersa認股權證購買最多45,032股我們的普通股,(Iii)私募認股權證購買6,867股我們的普通股,可按每股402.50美元的行使價行使,(Iv)管道認股權證,購買最多139,403股我們的普通股,可按每股70.00美元的行使價 行使,2027年12月12日到期;以及(V)盡力權證購買314,751股我們的普通股,可按加權平均行權價每股31.34美元行使,其中39,373股盡力權證重新定價,行權價從行權價35.00美元降至5.78美元,作為公司2023年7月發售的一部分, 本公司出售總計93,031股普通股,以及購買270,607股普通股代替普通股的預資金權證,以及購買最多363,646股普通股的普通權證。合併公開發行價為每股5.78美元及附帶普通權證,或每份預籌資權證及附帶普通權證5.77美元。自2023年7月發行以來,所有購買270,607股普通股的預先出資的權證均已行使,購買最多203,464股普通股的權證已重新定價 至行使價4.75美元,而2023年7月的認股權證目前仍保留160,182份,行使價為每股5.78美元行使Old ZyVersa認股權證、管道權證、私募認股權證、公共認股權證、盡力權證、2023年7月認股權證和誘導權證,以及我們可能從其行使中獲得的任何收益在很大程度上取決於我們普通股的價格以及行權時認股權證的行權價格與普通股價格之間的價差。 例如,如果我們的普通股價格超過每股402.50美元,我們的私募認股權證和公開認股權證的持有者更有可能行使他們的認股權證。如果我們普通股的價格低於每股402.50美元, 這些持有者不太可能行使他們的認股權證。截至2023年12月5日,我們普通股的收盤價為每股2.17美元。不能保證我們所有的認股權證在到期前都會在現金中。我們的公共認股權證和私募認股權證在某些條件下(如認股權證協議中所述)可由我們按每份認股權證0.35美元的價格贖回。我們的管狀認股權證不可贖回,並可在無現金的基礎上行使。因此,我們可能永遠不會從行使認股權證中獲得任何現金收益。此外,作為舊ZyVersa認股權證、公開認股權證、私募認股權證、誘導權證和管道認股權證的普通股股份已在本公司提交的轉售登記聲明中登記 ,因此不再承擔轉售義務。
在行使認股權證和轉換優先股時發行我們的普通股將大大稀釋我們普通股的現有持有者。
截至本協議日期,我們擁有(I)公開認股權證購買166,439股普通股,可按每股402.50美元的行使價行使,其於2027年12月12日到期或贖回,(Ii)Old ZyVersa認股權證購買最多45,032股我們的普通股,(Iii)私募認股權證購買6,867股我們的普通股,可按每股402.50美元的行使價行使,(Iv)管道認股權證,購買最多139,403股我們的普通股,可按每股70.00美元的行使價 行使,2027年12月12日到期;以及(V)盡力權證購買314,751股我們的普通股,可按加權平均行權價每股31.34美元行使,其中39,373股盡力權證重新定價,行權價從行權價35.00美元降至5.78美元,作為公司2023年7月發售的一部分, 公司出售總計93,031股普通股,以及購買270,607股普通股代替普通股的預資金權證,以及購買最多363,646股普通股的普通權證。合併公開發行價為每股5.78美元及附帶普通權證,或每份預籌資權證及附帶普通權證5.77美元。自2023年7月發行以來,購買270,607股普通股的所有預籌認股權證均已行使,購買最多203,464股普通股的認股權證已重新定價 至行權價4.75美元,目前從2023年7月發行起仍保留160,182股認股權證,行權價為每股5.78美元。截至2023年12月5日,我們普通股的收盤價為2.17美元。如果我們的普通股高於舊ZyVersa認股權證、公開認股權證、私募認股權證、誘導權證的行使價,以及管道認股權證和此等認股權證的持有人行使併發行普通股,我們現有普通股持有人的普通股將被大幅稀釋。 此外,與舊ZyVersa認股權證、公開認股權證、私人配售認股權證、誘因認股權證和管道認股權證相關的普通股股份已在本公司提交的轉售登記聲明中登記,因此不再承擔轉售義務。
此外,保薦人股份、A系列優先股和B系列股票已在本公司 備案的回售登記書中登記,並於2023年10月20日被美國證券交易委員會宣佈生效(檔號333-268934)。在公開市場上出售大量此類普通股 或可能行使此類認股權證的事實可能會對我們普通股的市場價格產生不利影響。
| 62 |
我們 使用了我們盡最大努力提供的淨收益的很大一部分贖回了幾乎所有的PIPE股票,這可能會 對我們的業務和股東產生不利影響。
完成我們盡力而為的發售所得淨收益的很大一部分用於贖回幾乎所有的 管道股票。根據A系列指定證書,我們以發行價的120%贖回了管道股份。因此,我們盡最大努力完成發售所得的淨收益按發行價的120%用於贖回PIPE股份, 這比持有人購買該等PIPE股份的金額高出約20%的利潤。只有吾等在有關發售中收取的款項淨額(扣除吾等應付的有關發售費用後)才會用作營運資金及其他一般公司用途,而該等發售所得款項超過贖回基本上所有 PIPE股份所需的金額。我們通過出售2022年12月12日完成的與我們的業務合併相關的管道股票收到的總收益約為1,100萬美元,我們向投資者支付的贖回此類證券的價格約為1,050萬美元。儘管我們打算將此類發行的剩餘收益用於營運資金和其他一般公司用途,但贖回PIPE股票將影響我們 可用於其他用途和執行我們的業務戰略的現金。我們預計將在後續發行中通過發行股權或與股權掛鈎的證券來籌集額外資本。如果我們無法通過以對我們有利的條款發行股權或股權掛鈎證券來籌集額外資本,我們可能沒有足夠的流動性來執行我們的業務戰略,這可能會對我們的業務、我們普通股的價值和我們的股東產生不利影響。有關更多信息,請參閲標題為“管理層對財務狀況和經營結果的討論和分析-流動性和資本資源-業務後合併 資本需求、“和其他風險因素。”風險因素.”
我們的 章程規定,除有限的例外情況外,高等法院將是某些 股東訴訟事項的唯一和專屬法院,這可能會限制我們的股東在與我們或我們的董事、 管理人員、員工或股東之間的糾紛中獲得選定的司法法院的能力。
我們的 第二次修訂和重述的公司註冊證書(“章程”)要求,在法律允許的最大範圍內, 以我們的名義提起的衍生訴訟,針對董事、高級管理人員和員工違反受託責任的訴訟以及其他類似的 訴訟,可以向大法官法院提起,或者,如果該法院缺乏主題管轄權,位於特拉華州的另一個聯邦或州法院。購買或以其他方式獲得本公司股本股份的任何權益的任何個人或實體應被視為 已通知並同意本公司章程中的法院條款。此外,我們的章程和修訂和重申的細則 將規定,美國聯邦地區法院應是解決根據證券法和交易法提出訴訟理由的任何投訴的唯一論壇。雖然專屬法院條款並不限制 股東根據《證券法》提出索賠的能力,但它可能限制股東在司法法院提出索賠的能力 ,他們認為有利的,並可能增加股東的某些訴訟費用,這可能會阻礙根據 《證券法》對我們、我們的董事和管理人員提出索賠。
2020年3月,特拉華州最高法院發佈了一項判決, Salzburg等人。V.Sciabacucchi該法院認定,根據特拉華州法律,一項專門的法院條款規定,根據《證券法》,索賠應提交聯邦法院,在表面上是有效的。目前還不清楚 是否會對這一決定提出上訴,或者本案的最終結果會是什麼。我們打算執行這一規定,但我們不知道其他司法管轄區的法院是否會同意或執行這一決定。
本 法院選擇條款可能限制股東在其認為有利於與我們或我們任何董事、高級管理人員、其他員工或股東發生糾紛的司法法院提出索賠的能力,這可能會阻礙就此類索賠提起訴訟。 或者,如果法院認定《憲章》中包含的法院選擇條款在 訴訟中不適用或無法執行,我們可能會在其他司法管轄區因解決此類訴訟而產生額外費用,這可能會損害我們的業務、 經營成果和財務狀況。
此外, 不確定法院條款的選擇是否具有強制性。《證券法》第22條為聯邦和州法院 對所有為執行《證券法》或其下的規則和條例所規定的任何義務或責任而提起的訴訟 確立了共同管轄權。鑑於這種不確定性,提出索賠的投資者可能面臨某些額外風險,包括成本增加和 訴訟結果的不確定性。
我們組織文件中的反收購條款可能會延遲或阻止控制權的變更。
本公司章程和章程的某些 條款可能具有反收購效力,並可能延遲、推遲或阻止股東可能認為符合其最佳利益的合併、收購、要約收購、 收購嘗試或其他控制權變更交易,包括那些可能導致本公司股東所持股份溢價高於市價的嘗試 。
| 63 |
除其他事項外,這些 規定:
| ● | 我們董事會發行一個或多個系列優先股的能力; | |
| ● | 一個分類版塊; | |
| ● | 提前 通知股東提名董事和股東將在我們的年度會議上審議的事項; | |
| ● | 召開特別股東大會的某些限制; | |
| ● | 限制可以召開股東特別會議的人員; | |
| ● | 限制股東通過書面同意採取行動的能力;以及 | |
| ● | 我們的董事會有明確的權力制定、更改或廢除我們的章程。 |
這些 反收購條款可能會使收購變得更加困難或受挫,或者阻止第三方收購我們,即使第三方的要約可能被我們的許多股東認為是有益的。此外,這些規定可能會使股東更難更換負責任命管理層成員的董事會成員,從而挫敗或阻止 我們的股東試圖更換或罷免我們目前的管理層。因此,我們的股東獲得股票溢價的能力可能會受到限制。這些規定還可能阻止代理權競爭,並使您 和其他股東更難選舉您選擇的董事,並導致我們採取您希望的其他公司行動。請參閲“我們的股本説明 。”
由我們的董事和高級管理人員索賠 可能會減少我們的可用資金,以滿足針對我們的成功的第三方索賠 ,並可能減少我們的可用資金。
我們的組織文件規定,我們將在特拉華州 法律允許的最大程度上對我們的董事和高級管理人員進行賠償。
此外,在特拉華州公司法第145條允許的情況下,我們的附則和與我們的董事和高級管理人員簽訂的賠償協議規定:
| ● | 我們 將賠償我們的董事和高級管理人員以這些身份為我們服務或應我們的要求為其他商業企業服務, 在特拉華州法律允許的最大範圍內。特拉華州法律規定,如果該人 誠信行事,且該人合理認為符合或不違背註冊人的最大利益 而就任何刑事法律程序而言,無合理因由相信該人的行為屬違法; | |
| ● | 在適用法律允許的情況下,我們 可以酌情對員工和代理人進行賠償; | |
| ● | 我們 將被要求向我們的董事和高級管理人員墊付與訴訟辯護相關的費用,但如果最終確定該人沒有資格獲得賠償,則該等董事或高級管理人員應承諾償還預付款; | |
| ● | 根據我們的章程,我們 不會就某人對我們或我們的其他受賠人提起的訴訟 承擔賠償義務,除非是我們董事會授權的訴訟或為強制執行索賠權利而提起的訴訟; | |
| ● | 章程賦予的權利並非排他性的,我們有權與我們的董事、高級職員、僱員和代理人訂立賠償協議,併購買保險以賠償此等人士;以及 | |
| ● | 我們 不能追溯修改我們的章程條款,以減少我們對董事、高級管理人員、員工和 代理人的賠償義務。 |
| 64 |
如果您在此次發行中購買證券,您的投資將立即受到稀釋。
您的 將因此次發售而立即遭受重大稀釋。普通股及附屬普通權證的每股合併公開發售價格及每股預籌資權證及附屬普通權證的合併公開發售價格將大幅高於本次發售後普通股的預計調整每股有形賬面淨值 。因此,如果您在此次發行中購買證券,您將支付您所收購的普通股的每股有效價格 ,大大超過我們在此次發行後的預計每股有形賬面淨值。根據普通股及隨附的普通權證每股1.25美元的發行價,並假設本次發售中不出售任何預籌資助權證, 本次發售中不會行使普通權證,且該等普通權證不會產生任何價值,且該等認股權證分類及入賬為權益,則閣下將立即攤薄每股2.54美元,相當於本次發售生效後我們的備考金額與調整後每股有形賬面淨值之間的差額。
我們的 與融資、收購、投資、股票激勵計劃相關的額外股本的潛在發行, 作為應付或其他應付賬款的對價,將稀釋所有其他股東的權益。
我們的 與融資、收購、投資、股票激勵計劃相關的額外股本的潛在發行, 作為應付或其他應付賬款的對價,將稀釋我們的股東。我們預計未來將發行額外的股本,這將導致對所有其他股東的攤薄。我們預計將根據我們的股票激勵計劃向員工、董事和顧問授予股權獎勵。我們未來還可能通過股權融資籌集資金,並可能以股本形式支付某些應付賬款。作為我們業務戰略的一部分,我們可能會收購或投資於互補的公司、產品或技術,併發行股權證券來支付任何此類收購或投資。任何此類額外股本的發行都可能導致股東的所有權權益顯著稀釋,我們普通股的每股價值也會下降。
此外,由於最近完成了盡力而為的發售,我們產生了額外的攤薄,原因是此類發售的價格以及B系列股票的轉換價和管道權證的行使價被重置為適用的底價。此外,由於最近完成的2023年7月發售,由於此類發售的價格和部分盡力而為認股權證的行使價被重置為降價,我們產生了額外的攤薄。行使PIPE認股權證時可發行普通股的股數也調整為等於轉換PIPE股份時可發行普通股的100%。在盡力而為的發售中發行證券,以及在行使或轉換B股和PIPE認股權證(視情況而定)後可能發行額外的普通股 可能會導致股東經歷重大的 稀釋。
此外, 只要我們普通股的市場價格高於管道權證和盡力而為權證行權價格重置後的底價,該等證券的持有人就可以行使該等證券並出售普通股的標的股份以賺取利潤。如果我們普通股的市場價格低於持有人認股權證的行權價格,則持有人不太可能 行使其認股權證。因此,在這種調整之後,此類證券的持有者可能更有可能將這些證券轉換為我們普通股的股票並出售該股票,從而對我們普通股的市場價格造成額外的負面壓力 以及其他稀釋效應。
此外, 本次發行中註冊的股票數量可能會對我們以我們可以接受的價格發行額外股票的能力產生負面影響 ,發行金額足以讓我們執行我們的業務戰略。我們預計將在後續發行中通過發行股權或股權掛鈎證券來籌集額外資本。盡力而為發售(2023年7月發售)的完成,以及未來的任何 發售,或在行使或轉換B系列股票、 管道認股權證、盡力而為認股權證和誘導權證(視情況而定)後可能增發普通股,可能會對我們按對我們有利或不會對現有股東造成重大稀釋的條款籌集額外資本的能力產生不利影響。如果我們無法通過以對我們有利的條款發行股權或股權掛鈎證券來籌集額外資本,我們可能沒有足夠的流動性來執行我們的業務 戰略。此外,盡力而為發售、2023年7月發售或任何未來發售的完成,或可能在行使或轉換B系列股份、管道認股權證、盡力認股權證及誘導權證(視情況而定)時發行額外普通股 ,可能會對我們普通股的市場價格產生不利影響,因為在盡力而為發售、2023年7月發售或任何未來發售中出售的額外股份,或在行使或轉換B系列股份、管道認股權證及最佳努力認股權證(視情況而定)時發行的額外股份,代表我們普通股的很大一部分已發行和流通股 ,在未來的任何發行中出售的普通股的價格可能低於我們普通股的當前市場價格,或在適用的情況下行使或轉換B系列股票、管道認股權證和最大努力認股權證後發行的普通股, 最佳努力認股權證可能會顯著稀釋我們普通股的現有持有者。
| 65 |
我們的 管理層將在使用此次發行的淨收益方面擁有廣泛的自由裁量權,並可能以您不同意的方式和可能不會產生回報的方式投資或使用收益。
我們的 管理層將擁有廣泛的自由裁量權來運用此次發行的淨收益,包括用於標題為“收益的使用,“作為投資決策的一部分,您將沒有機會評估淨收益是否得到了適當的使用。由於將決定我們使用此次發行的淨收益的因素的數量和可變性,它們的最終用途可能與其當前的預期用途不同。如果我們的管理層 未能有效地使用這些資金,可能會損害我們的業務。在使用之前,我們可能會將此次發行的淨收益投資於投資級計息證券。這些投資可能不會給我們的證券持有人帶來有利的回報。
在此發行的預融資權證或普通權證沒有公開市場。
在此發售的預融資權證或普通權證尚無既定的公開交易市場,我們預計 不會發展這樣的市場。此外,我們不打算申請在任何國家證券交易所或其他國家認可的交易系統上市預融資權證或普通權證。如果沒有活躍的市場,預先出資的權證和普通權證的流動性將受到限制。
在本次發行中購買的預資金權證或普通權證的持有人 在 該等持有人行使其預資資權證或認股權證並收購我們的普通股之前,將不享有作為普通股股東的權利。
在預融資權證或普通權證的持有者在行使時獲得本公司普通股股份之前,該等持有人 將不享有與預融資權證或普通權證相關的普通股股份的權利。 在行使預融資權證或普通權證時,持有人僅有權就記錄日期在行使日期之後的事項行使普通股股東的權利。
本公司發行的普通認股權證屬投機性性質。
本公司發行的普通股認股權證並不賦予其持有人任何普通股所有權權利,例如投票權或收取股息的權利,而只是代表在有限時間內以固定價格取得普通股股份的權利。此外,本次發售後,普通權證的市值(如有)將不確定,且無法 保證認股權證的市值將等於或超過其推定發行價。普通權證將不會在任何市場或交易所上市或報價交易。不能保證我們普通股的市場價格將 永遠等於或超過普通權證的行使價,因此普通權證可能到期時毫無價值。
此 是盡力而為的產品,不要求出售最低金額的證券,我們可能不會籌集我們認為業務計劃(包括我們的近期業務計劃)所需的資本額。
配售代理已同意盡其合理的最大努力征求購買本次發行中的證券的要約。配售代理沒有義務從我們手中購買任何證券,也沒有義務安排購買或出售任何特定數量或金額的證券。完成本次發售沒有必須出售證券的最低數量的要求。 由於本次發售的完成沒有最低發售金額的要求,因此我們的實際發售金額、配售代理費和收益目前無法確定,可能會大大低於上述最高金額。 我們可能會少於在此發售的所有證券,這可能會顯著減少我們收到的收益金額,如果我們出售的證券數量不足以支持我們的 持續運營(包括我們近期的持續運營),則此次發行的投資者將不會獲得退款。因此,我們可能不會在短期內籌集我們認為的運營所需的資本額 ,並且可能需要籌集額外的資金,這些資金可能無法獲得或無法以我們可以接受的條款獲得 。
我們的反向股票拆分可能會減少我們普通股的流動性 。
我們於2023年12月4日實施了35股1股的反向股票拆分。我們普通股的流動性可能會受到反向股票拆分的不利影響 因為反向股票拆分後流通股數量減少。此外,反向股票 拆分增加了持有我們普通股的零頭(不到100股)的股東數量,這可能會使這些 股東經歷出售其股票的成本增加和實現此類出售的更大困難。
股票反向拆分後,我們普通股的市場價格可能無法吸引包括機構投資者在內的新投資者,也可能無法滿足這些投資者的投資要求。因此,我們普通股的交易流動性可能不會改善。
儘管我們相信更高的普通股市場價格可能有助於激發更大或更廣泛的投資者興趣,但不能保證反向股票拆分,包括我們在2023年12月4日實施的35股1股反向拆分,將導致股價 吸引新的投資者,包括機構投資者。此外,不能保證我們普通股的市場價格將滿足這些投資者的投資要求。因此,我們普通股的交易流動性可能不一定會改善。我們在2023年12月4日實施35股1股的反向股票拆分的主要目的是,由於普通股已發行和已發行股票數量的減少,我們的普通股價格在反向股票拆分後立即出現 預期的上漲,將有助於我們滿足納斯達克上市規則規定的最低投標價格要求 。不能保證反向股票拆分,包括我們在2023年12月4日實施的35股反向股票拆分,將導致我們普通股市場價格的任何持續比例上升,這 取決於許多因素,包括我們的業務和財務業績、一般市場狀況以及未來的成功前景 ,這些與我們已發行普通股的數量無關。在股票反向拆分後的一段時間內,公司普通股的市場價格下跌並不少見。
| 66 |
使用收益的
我們 估計,在扣除配售代理費和估計應支付的發售費用後,假設不行使普通權證,並假設在此發售的所有證券 在本次發售中出售我們的普通股股份、預籌資權證和普通權證的淨收益將約為435萬美元。但是, 這是合理的盡力而為發售,沒有最低證券數量或收益金額作為成交條件,而且我們可能不會出售根據本招股説明書發售的全部或任何證券;因此,我們在此次發售中獲得的淨收益可能會大幅減少 。例如,如果我們只銷售最高報價的25%、50%或75%,我們的淨收益將分別約為829,915美元、2,004,831美元或3,179,746美元。如果以現金為基礎的普通權證全部行使,我們將獲得大約1000萬美元的額外收益。
我們 目前打算將此次發行的淨收益用於營運資金和其他一般公司用途,包括支付 應付未付賬款以及支付某些員工的未付工資和獎金。
我們實際支出的金額和時間將取決於許多因素,包括我們的臨牀開發努力、我們的運營成本和本招股説明書中“風險因素”項下描述的其他因素。因此,我們的管理層將可以靈活運用此次發售的淨收益 。投資者將沒有機會評估我們根據如何使用收益做出決定所依據的經濟、金融或其他信息。
| 67 |
稀釋
如果您投資於我們的證券,您的所有權權益將被稀釋,稀釋程度為我們普通股和附帶普通權證的合併公開發行 每股價格與本次發售生效後立即調整的普通股每股有形賬面淨值之間的差額。
截至2023年9月30日,我們的有形淨賬面赤字約為1,110萬美元,或每股普通股約8.93美元。每股有形賬面淨虧損等於我們的總有形資產減去總負債除以普通股流通股數量。
在 本次發行中假設以每股1.25美元的公開發行價出售400,000股普通股和隨附的普通權證以及隨附的普通權證和預融資權證,以每股預籌資助權證和隨附的普通權證1.2499美元的公開發行價購買最多3,600,000股普通股後,在扣除配售代理費和估計應支付的發售費用後,並假設本次發售中的預資金權證以現金方式全面行使,而不行使本次發售中的普通權證,由於此類普通權證沒有任何價值,而此類普通權證被歸類為股權並計入股權,我們截至2023年9月30日的調整後有形 賬面價值約為670萬美元,或每股普通股約1.29美元。這一數額意味着我們現有股東的調整後有形賬面淨值立即增加每股7.64美元,對參與此次發行的投資者立即稀釋每股2.54美元。我們通過從參與此次發行的投資者支付的每股綜合公開發行價和附帶的普通權證中減去我們的調整後每股有形賬面淨值來確定對參與此次發行的投資者的每股攤薄 。
下表以每股為單位説明瞭對新投資者的攤薄:
| 每股公開發行價格和附帶的普通認股權證 | $ | 1.25 | ||||||
| 截至2023年9月30日的有形賬面淨赤字 | $ | (8.93 | ) | |||||
| 可歸因於此次發行的每股有形賬面淨值的增加 | $ | 7.64 | ||||||
| 本次發售生效後調整後的每股有形賬面淨值 | $ | (1.29 | ) | |||||
| 在此次發行中向新投資者稀釋每股收益 | $ | (2.54 | ) |
| 68 |
以上討論和表格基於截至2023年9月30日的已發行普通股1,243,297股,不包括 以下內容:
| ● | 在行使與Larkspur首次公開募股相關的私募認股權證時可發行6,867股,加權平均行權價為每股402.50美元; | |
| ● | 166,439股於行使認股權證時可發行的股份,加權平均行使價為每股402.50美元; | |
| ● | 行使PIPE認股權證時可發行的139,403股,加權平均行權價為每股70.00美元; | |
| ● | 314,751股可在行使我們的Best Effort發行的盡力而為認股權證時發行的股票,加權平均行權價為每股31.34美元,其中39,373股盡力而為權證重新定價,作為2023年7月發售的一部分,行權價從行權價35.00美元降至5.78美元; | |
| ● | 715股作為標的的管材股份; | |
| ● | 20,665股B系列股票; | |
| ● | 45,032股Old ZyVersa認股權證,其中41,627股目前可在公司向Old ZyVersa 持有人發行並由公司承擔的權證行使時發行,加權平均行權價為245.72美元,3,405股將在 實現某些里程碑時發行; | |
| ● | 根據我們的2014年計劃發行的股票期權行使時可發行的56,999股,加權行權價為378.56美元; | |
| ● | 根據我們的2022年綜合股權激勵計劃發行的股票期權行使時可發行41,523股,加權行權價為15.25美元; | |
| ● | 根據2023年獎勵計劃發行的股票期權在行使時可發行3,230股,加權平均行權價為每股74.45美元; | |
| ● | 2023年7月認股權證行使時可發行的160,182股,加權平均行權價為每股5.78美元;以及 | |
| ● | 203,464股於行使誘導權證時可發行的股份,加權平均行使價為4.75美元。 |
除非明確説明或上下文另有要求,否則本招股説明書中的所有信息 均假定未行使本招股説明書提供的普通權證。
| 69 |
我們普通股和股利信息的市場價格
市場 我們普通股的價格
我們的普通股目前在納斯達克全球市場納斯達克股票市場有限責任公司(“納斯達克”)上市,代碼為“ZVSA”。 在業務合併完成之前,拉克斯珀的單位、普通股和公募權證分別以“LSPRU”、“LSPR”和“LSPRW”的代碼在納斯達克資本市場上市。拉克斯珀的單位和公募認股權證不再在納斯達克資本市場上市。
2023年12月5日,我們普通股的收盤價為每股2.17美元。
截至2023年12月5日,我們普通股的記錄持有人約有500人。這些數字不包括受益的 所有者通過被指定人的名字持有我們的證券。
分紅政策
我們 從未就我們的股本宣佈或支付任何現金股息,目前我們也不打算在可預見的未來支付任何現金股息。我們希望保留未來的收益,如果有的話,為我們業務的發展和增長提供資金。未來是否決定向我們的普通股支付股息將由我們的董事會酌情決定,並將取決於我們的財務狀況、經營業績、當前和預期的現金需求、擴張計劃以及董事會認為相關的其他因素。
| 70 |
生意場
除 明確説明或文意另有所指外,本招股説明書中提及的“公司”、“註冊人”、“我們”、“我們”及“我們”均指ZyVersa(以及舊ZyVersa的業務,在業務合併生效後成為ZyVersa的業務 )。
概述
我們 是一家臨牀階段的生物製藥公司,利用專有技術為患有慢性腎臟疾病或炎症性疾病的患者開發藥物,這些患者的醫療需求尚未得到滿足。我們的使命是開發優化健康結果和提高患者生活質量的藥物。
我們 擁有兩個全球許可的專利藥物開發平臺,每個平臺都是由邁阿密大學米勒醫學院(以下簡稱邁阿密大學)的研究科學家發現的。這些開發平臺 包括:
| ● | 膽固醇外流調節劑TM,VAR200(2-羥丙基-β-環糊精或“2HPβCD”)是一種臨牀開發中的治療腎臟疾病的注射用藥物。VAR 200於2015年12月15日從L研究有限責任公司獲得許可。L研究公司是由邁阿密大學的研究科學家創立的,他們發現了VAR 200用於腎臟疾病。 | |
| ● | IC 100是一種用於治療炎症性疾病的臨牀前開發中的單抗炎症體ASC抑制劑。IC 100於2019年4月18日從InflamaCore,LLC獲得許可。InflamaCore,LLC是由邁阿密大學的研究科學家創建的,他們發明了IC 100。 |
我們 相信我們的每一種候選產品都有潛力在各自的治療領域治療多種適應症。我們的戰略是專注於適應症擴展,以最大限度地發揮商業潛力。
我們的腎臟管道最初專注於罕見的慢性腎小球疾病。我們對VAR 200的主要指徵是局灶性節段性腎小球硬化(FSGS)。2020年1月21日,我們提交了VAR 200的新藥研究申請(“IND”),美國食品和藥物管理局(“FDA”)已允許我們的開發計劃基於活性成分(2HPβCD)的風險/益處概況,在FSGS患者 中進行2a期試驗。在啟動對FSGS患者的2a期試驗之前,我們計劃在2024年第一季度支持一項開放標籤概念驗證試驗,我們預計將在那裏獲得8名糖尿病腎病患者的數據。這將能夠在患者進行治療時評估藥物效果 ,並將為開發我們的2a階段方案提供見解。VAR 200具有代表FSGS、Alport綜合徵和糖尿病腎病的動物模型的藥理學概念驗證數據,其中每一種都可以根據我們的適應症擴展策略進行開發。
我們的炎症體ASC抑制劑計劃IC 100正處於臨牀前開發階段。我們的重點是推動1C 100在2024年第二季度提交當前計劃的 IND,然後啟動第一階段試驗。IC 100具有代表急性呼吸窘迫綜合徵(ARDS)和多發性硬化症(MS)的動物模型的藥理學概念驗證數據。我們計劃在下一波臨牀前開發中進行多達六種適應症的額外動物研究,例如免疫球蛋白A(“IgA”)腎病、帕金森氏病、亨廷頓病、充血性心力衰竭和早期阿爾茨海默病。 我們預計將根據我們臨牀前計劃的數據選擇IC 100的一個或多個主要適應症。
關於慢性腎臟病(CKD)
慢性腎臟疾病(“CKD”)是一個日益嚴重的公共衞生問題,全世界有7500萬人受到影響,美國約有3700萬人受到影響。國家腎臟基金會估計,美國約有8000萬成年人面臨患腎臟疾病的風險。由於商業上沒有改善疾病的藥物療法,相當大比例的腎臟患者進展為終末期腎病(“ESRD”),需要透析或移植才能存活。根據疾病控制和預防中心的數據,2018年,美國約有131,600人開始接受ESRD治療,目前美國有近786,000人患有ESRD(在這786,000人中,約71% 接受透析,29%接受腎臟移植)。此外,與慢性腎臟疾病相關的經濟負擔可能是巨大的 ,因為根據國家腎臟基金會的數據,2018年聯邦醫療保險按服務收費的支出為1300億美元。 我們認為CKD造成的高發病率和沉重的金錢負擔創造了對有效的疾病修飾藥物 療法的需求。
| 71 |
慢性腎臟病 與預後不良有關,根據國家生命統計報告,2017年,慢性腎臟病是美國第九大死因。為了解決這一重大的健康問題,2019年7月10日,白宮和衞生與公眾服務部啟動了推進美國腎臟健康(AAKH)倡議,以推進美國的腎臟疾病預防和護理,該倡議有三個目標:(1)通過更好的診斷、治療和預防性護理來減少患腎衰竭的患者數量;(2)最大限度地提供家庭透析護理;以及(3)擴大可供移植的腎臟池。我們相信,通過調節導致腎臟損傷和功能障礙的多餘腎細胞內膽固醇的清除,VAR 200有可能幫助實現AAKH計劃的第一個目標,即減少發生腎功能衰竭的患者數量。
我們的主要腎臟適應症是FSGS,這是一種進行性腎臟疾病,沒有批准的藥物療法。大約40%-60%的FSGS患者在10-20年內發展為終末期腎病,需要透析並最終進行腎臟移植才能存活。FSGS是一種孤兒疾病,在美國大約有40,000人受到影響。它的特點是腎濾過系統或“腎小球足細胞”受損,導致局部(即,僅影響某些腎小球)和節段性(即,僅影響部分腎小球)瘢痕形成。在FSGS患者的活檢組織和具有代表性的FSGS動物模型中,已看到膽固醇和脂質在腎小球的積聚, 與結構損害和腎功能受損有關。腎小球受損會導致蛋白質泄漏到尿液中,這種情況被稱為蛋白尿。隨着尿中蛋白質水平的增加,患者會出現一系列特殊的症狀,稱為腎病綜合徵。蛋白尿與腎臟疾病的進展密切相關,腎病綜合徵通常預示着不良的預後。大約70%的FSGS患者在確診時出現腎病綜合徵。通過調節從腎小球中清除多餘的膽固醇,我們相信VAR 200具有保存腎臟結構和功能的潛力,從而減少導致FSGS進展的蛋白尿。
關於 炎症疾病
慢性 炎性疾病已被公認為當今世界最重要的死亡原因之一,全球所有 死亡病例中超過50%歸因於炎症相關疾病,例如缺血性心臟病、中風、癌症、糖尿病、慢性 腎病、非酒精性脂肪肝("NAFLD")以及自身免疫性和神經變性疾病。炎症體的過度和持續激活與這些類型的慢性疾病的病理生理學有關。
炎症體由3種蛋白質組成:(I)幾種類型的感受器分子中的一種,(Ii)含有caspase招募結構域(“asc”)的凋亡相關斑點樣蛋白,以及(Iii)促炎症caspase-1(“促caspase-1”)。它們是根據它們相關的傳感器分子來命名的,如NLRP1、NLRP2、NLRP3、NLRC4、AIM2和PYRIN。許多炎症性疾病往往與多種類型的炎症體的激活有關。例如,多發性硬化症與AIM2、NLRP1、NLRP3和NLRC4的激活有關。炎性小體的ASC成分 是一個很有前途的藥物靶點,因為它是上面提到的六種最常見類型的炎性小體的成分。我們認為,這比針對特定的傳感器蛋白更有利,後者是一種炎症體的一種成分,是幾個潛在競爭對手的焦點。除了在啟動炎症反應所需的炎性小體的形成和激活方面發揮關鍵作用外,ASC還在與ASC斑點的細胞外釋放相關的炎症的永久化中發揮作用。通過針對ASC,我們相信IC 100具有有效控制多種炎症性疾病炎症的潛力。
我們的 管道
我們管道的目標是針對具有高度未滿足醫療需求的腎臟和炎症適應症,我們相信可以通過我們的作用機制解決這些問題。我們打算通過為VAR 200和IC 100開發多個適應症 ,以及通過潛在的腎臟和抗炎候選產品的許可,進一步增強和擴大我們的產品組合。
| 72 |
我們的 當前的管道包括以下內容:
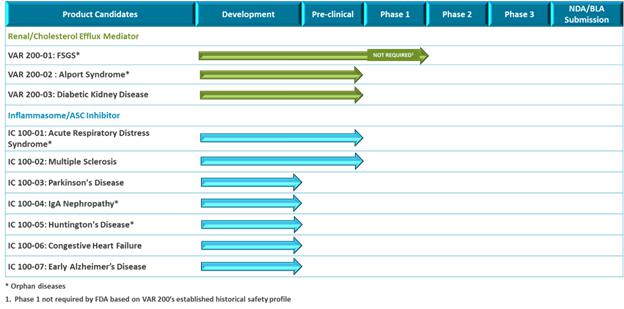
| 1. | 開發 階段:開發藥物製劑以確保滿足適當的藥物遞送參數的階段。 | |
| 2. | 臨牀前 階段:進行體外(實驗室)和體內(動物)研究以收集證據證明臨牀試驗合理性的階段 在人類身上。 | |
| 3. | FDA 根據VAR 200的既定歷史安全性特徵,同意VAR 200不需要進行I期試驗。 |
對於VAR 200,我們的主要腎臟指徵是FSGS(VAR 200-01)。對於IC 100,我們將在計劃於2024年第二季度提交IND之前選擇一個或多個銷售線索指示。這將基於現有和未來臨牀前研究的數據。
由於慢性炎症導致了無數不同的疾病和狀況,我們相信IC 100具有治療多種炎症性疾病的潛力。以下是IC 100‘S電流管道的市場 摘要。
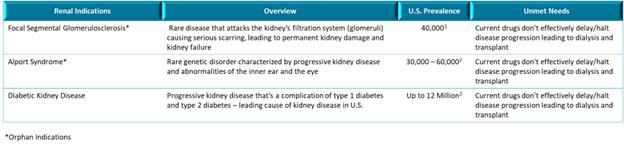
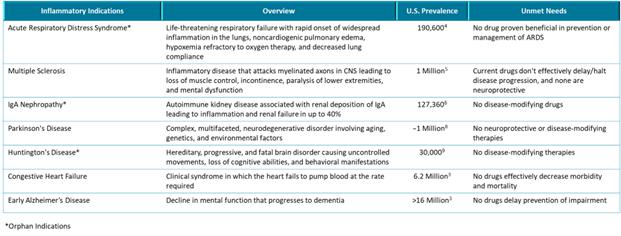
| 1. | 金塔尼利亞 E,et al. Front Genet. 2021年12月 | |
| 2. | 國家 多發性硬化症協會 | |
| 3. | IgA 腎病市場DelveInsight報告,2021年10月 |
| 4. | 國家 癌症研究所 | |
| 5. | 帕金森病 基礎 | |
| 6. | 亨廷頓疾病市場。DelveInsight報告,2021年10月 | |
| 7. | 疾病控制和預防中心 |
| 73 |
業務 戰略
我們 尋求被公認為領先的生物製藥公司,處於創新前沿,為有高度未滿足醫療需求的患者提供服務。 我們致力於通過開發生物製藥產品來恢復健康並改變患者的生活。我們的策略 是:
| ● | 推進VAR 200的開發。我們打算通過支持在2024年第一季度對8名糖尿病腎病患者進行概念驗證研究來推進VAR 200的開發,隨後啟動2a期臨牀試驗。這項概念驗證試驗將能夠在患者進行試驗的同時評估他們的藥物效果。關鍵 所學知識將用於2a階段試驗的設計。 | |
| ● | 推進我們的IC 100臨牀前計劃。我們計劃推進IC 100臨牀前計劃,以便在2024年第二季度提交IND。 我們目前有小鼠和非人類靈長類動物(NHP)的非GLP毒理學數據表明,高達300 mg/kg的劑量沒有不良反應,以及代表急性呼吸窘迫綜合徵和多發性硬化症的動物模型中IC 100的藥理學概念驗證數據。我們計劃在小鼠和NHP上進行GLP毒理學研究,並在多達6個其他適應症(如IgA腎病、帕金森氏病、早期阿爾茨海默病、亨廷頓病和充血性心力衰竭)中進行額外的動物研究。這將使最佳選擇一個或多個鉛適應症將 帶入臨牀。 | |
| ● | 充分利用我們的適應症擴展戰略,通過在各自的治療領域開發多個適應症,最大限度地發揮我們每個產品平臺的商業潛力。我們目前的生產線包括三種膽固醇的潛在適應症 外排介質TMVAR 200、VAR 200(包括FSGS、Alport綜合徵和糖尿病腎病)和IC 100炎症體ASC抑制物平臺的八個潛在適應症(包括ARDS、多發性硬化症、IgA腎病、帕金森氏症、亨廷頓病、充血性心力衰竭和早期阿爾茨海默病)。我們打算利用我們從兩個產品平臺的臨牀前和臨牀計劃中獲得的知識,以確定擴大適應症的其他機會。 | |
| ● | 維護 開發和商業化我們候選產品的權利。我們打算保留開發和商業化的權利 我們在美國的候選產品,同時尋求與其他製藥公司的戰略聯盟和合作 加速發展,分擔風險,補充資源,最大限度地發揮美國以外的潛力。 | |
| ● | 擴展 我們的候選產品組合。我們計劃通過利用我們在開發和商業化方面的專業知識來擴展我們的產品組合 以識別和批准具有重大臨牀和商業潛力的其他候選藥物。除了適應症 我們的VAR 200和IC 100平臺的擴展,我們的業務戰略包括確定和抓住機會獲取開發 以及與腎臟和炎症疾病治療有關的技術的商業化權利。 | |
| ● | 繼續 以加強和擴大我們的知識產權組合。VAR 200的知識產權由一個投資組合組成 在美國和其他國家的已發佈和正在申請的專利。我們有2個涵蓋腎小球疾病的專利家族, 糖尿病腎病同樣,我們計劃為FSGS和Alport綜合徵尋求孤兒藥指定,這將 如果這些司法管轄區獲得批准,則在美國提供7年獨家經營權,在歐盟提供10年獨家經營權。知識分子 IC 100的財產包括在美國和其他國家的已發佈和正在申請的專利組合。we have 5 專利系列涵蓋物質組成,生物標誌物和使用方法。此外,我們計劃尋求孤兒專屬權 我們為IC 100開發的任何罕見疾病適應症對於這兩個產品平臺,我們的專有地位通過其他 技術訣竅和商業祕密。我們計劃在適當情況下積極尋求獲得最廣泛的知識產權保護 申請專利或其他適用知識產權保護,涵蓋新產品或增強產品 專利技術和開發中的新制劑、給藥方案和給藥途徑。 |
上文中反映的 日期和事件僅為估計值,無法保證所包含的事件 將在呈現的預期時間軸上完成,或根本不會完成。此外,無法保證我們將成功開發 我們的任何候選產品,或我們未來可能開發的任何其他產品或候選產品,或我們未來可能開發的任何候選產品 將獲得FDA的任何適應症批准。
| 74 |
我們的 候選產品
膽固醇 外排調節劑 TM,Var 200(2-羥丙基-β-環糊精,2HPβCD)
膽固醇外流調節劑VAR 200是一種臨牀開發中的可注射藥物,用於治療慢性腎小球疾病,最初專注於FSGS。根據我們的適應症擴展戰略,可能會尋求Alport綜合徵和糖尿病腎臟疾病的適應症。
開發VAR 200的目的是保護腎臟結構和功能,並通過中介清除損害腎小球的多餘膽固醇來減少導致腎小球疾病進展的蛋白尿 。在啟動對FSGS患者的2a期試驗之前, 我們計劃在2024年第一季度支持一項開放標籤的概念驗證試驗,我們預計將在那裏獲得8名糖尿病腎病患者的數據。這將能夠在患者進行治療時評估藥物效果 ,並將為開發我們的2a階段方案提供見解。VAR 200具有代表FSGS、Alport綜合徵和糖尿病腎病的動物模型的藥理學概念驗證數據,其中每一種都可以根據我們的適應症擴展策略進行開發。
膽固醇和脂質蓄積在腎小球疾病(包括FSGS、Alport綜合徵和糖尿病腎病)中的作用
在 慢性腎小球疾病中,膽固醇在腎小球足細胞中積聚,部分原因是細胞外轉運受損, 膽固醇轉運蛋白ABCA 1和ABCG 1表達降低導致"外排"。腎小球脂質蓄積的證明是 , 體外培養足細胞研究、人體活檢數據和各種腎臟疾病的動物模型,包括FSGS、Alport綜合徵和糖尿病腎病。如下圖所示,脂質積聚導致足細胞結構扭曲、足細胞足突受損, 和足細胞脱落和丟失,從而損害腎臟濾過,導致蛋白尿和疾病進展。我們假設, 脂質穩態和足細胞完整性的恢復有可能減緩正在進行的腎損傷進展至腎衰竭, 並延遲透析和最終移植的需要。
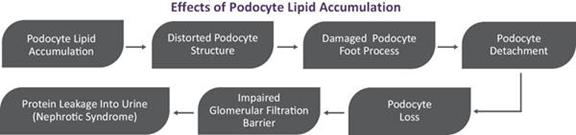
| 75 |
VAR 200作用機制
VAR 200的活性成分2H β CD由7個糖分子組成,形成一個3—D環,具有疏水核心 和親水外部。VAR 200通過與腎小球膜的親水組分相互作用,被動和主動介導膽固醇流出 。
被動 膽固醇流出
被動 膽固醇流出伴隨着2HP β CD二聚體的形成而發生,該二聚體與細胞膜表面結合,並將膽固醇以包合物的形式摻入 其疏水核心。2HP β CD/膽固醇包合物從細胞膜表面釋放 將膽固醇帶入溶液,轉移至膽固醇受體,如高密度脂蛋白("HDL")。
活動 膽固醇流出
主動 膽固醇流出通過介導遊離膽固醇代謝為氧固醇而發生。氧化固醇激活肝臟X受體 ("LXR")—轉錄因子,導致誘導細胞膽固醇流出途徑,包括上調膽固醇流出轉運蛋白ABCA 1和ABCG 1,它們將細胞外的遊離膽固醇轉運至膽固醇受體,如HDL。
臨牀前支持Cholestol Efflux MediatorTMVAR 200
我們 相信VAR 200具有既定的受益/風險概況,得到我們的支持 體內此外,我們相信,來自代表FSGS、Alport綜合徵和糖尿病腎臟疾病的動物模型的數據表明,VAR 200可促進足細胞中膽固醇的清除,保護腎臟的過濾系統免受損害,並減少蛋白 溢出到尿液或“蛋白尿”中。這些類型的結果被認為是延緩或防止腎臟疾病進展的關鍵。
VAR 200和FSGS
在兩種FSGS小鼠模型中評價VAR 200,一種是實驗性活化T細胞核因子("NFAT")FSGS模型和一種 阿黴素("ADR")誘導的FSGS模型,其特徵在於比 NFAT模型更温和、進展更少的腎病形式。
活化T細胞核因子(NFAT)模型
在 一項旨在檢查改變的足細胞膽固醇穩態在NFAT介導的足細胞損傷中的作用以及VAR 200治療效果 的研究中,研究人員以4,000 mg/kg的劑量對6周齡的NFATc 1皮下注射VAR 200NUC在用多西環素誘導前24小時給小鼠注射,然後每隔一天持續4天。單個轉基因("ST")小鼠用作對照。
| 76 |
與 未處理的雙轉基因小鼠(下圖中以"DT"表示)相比,VAR 200(下圖中以"CD"表示)顯著降低了FSGS小鼠腎皮質中的膽固醇。這與蛋白尿(白蛋白/肌酸比)顯著降低 相關,如下所示。
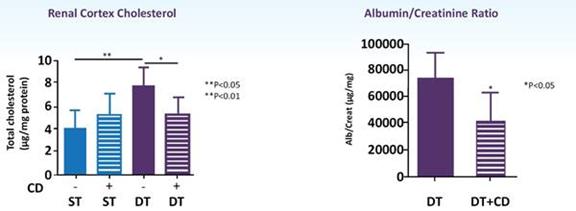
阿黴素 (ADR)誘導模型
在 第二個FSGS模型中,研究人員向5周齡的BALB/c小鼠注射了一劑11 mg/kg的阿黴素。隨後, 在24小時後通過皮下滲透泵以40 mg/kg的劑量給予VAR 200,持續10周。未誘導小鼠作為對照。
與未處理ADR誘導小鼠相比,VAR 200(下圖中以"CD"表示)顯著減少系膜擴張,系膜擴張通常與 脂質沉積相關,如下所示。這與VAR 200處理的ADR誘導小鼠中蛋白尿 (白蛋白/肌酸)和血尿素氮("BUN")的顯著降低相關,如下所示。
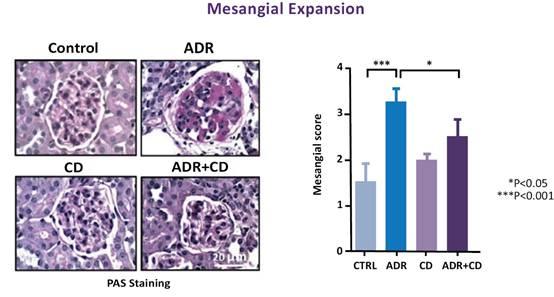
| 77 |
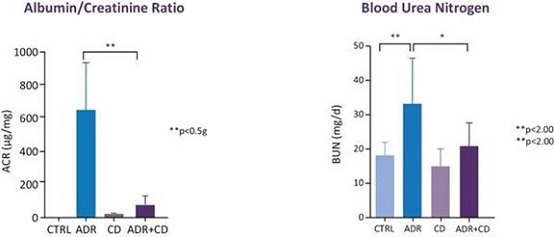
VAR 200和Alport綜合徵
在另一項研究中,為了評估VAR 200對Alport綜合徵是否有保護作用,研究人員以4000 mg/kg每週皮下注射VAR 200給四周大的雌性Col4a3基因敲除小鼠(Col4a3 −/−),持續4周。野生型Col4a3("Col43 +/+") 小鼠用作對照。
與未處理Alport綜合徵小鼠相比,VAR 200(在下圖中以"CD"表示)顯著降低Alport綜合徵小鼠腎臟中性脂質、膽固醇酯和膽固醇 晶體的累積,如下所示。
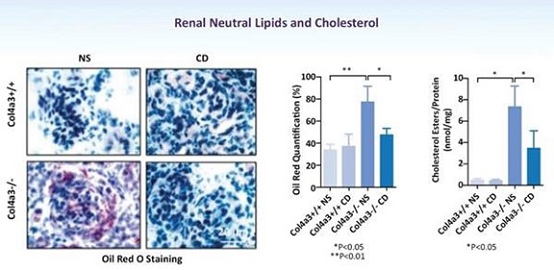
| 78 |
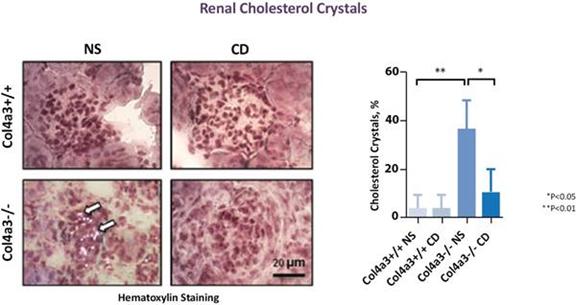
與未經治療的Alport綜合徵小鼠相比,經VAR 200治療的Alport綜合徵小鼠的細胞內脂肪水平降低與腎臟損害 (減少系膜擴張、纖維化和足突消失)顯著減少相關,並且腎功能得以維持,與未經治療的Alport綜合徵小鼠相比,蛋白尿(白蛋白/肌酐)、血尿素氮和血清肌酐均降低,這一點如下所示。
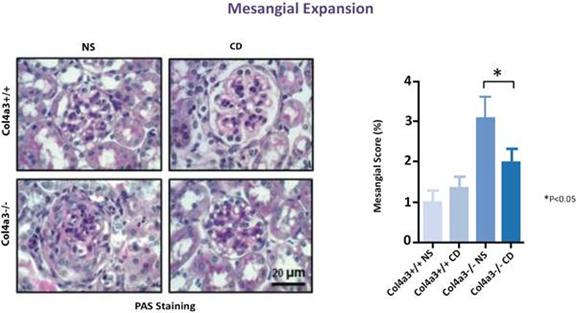
| 79 |
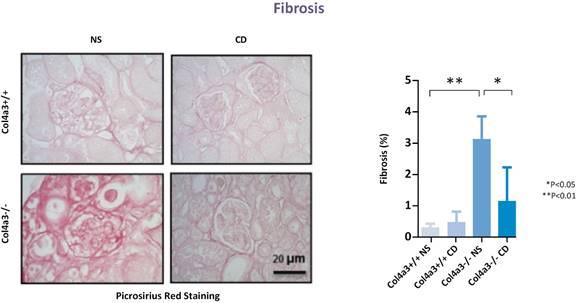
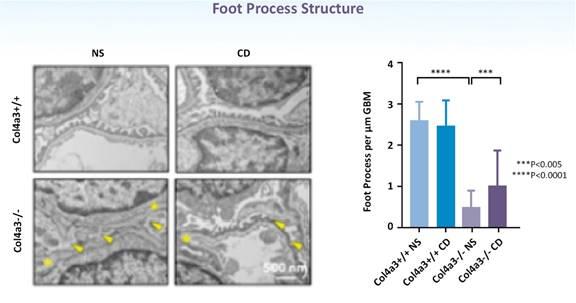
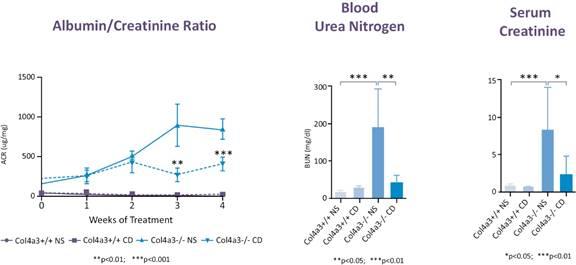
VAR 200與糖尿病腎病
在 另一項旨在確定VAR 200是否可以隔離細胞內膽固醇並保護足細胞免受糖尿病腎病中膽固醇依賴性損傷 的研究中,研究人員對4周齡BTBR ob/ob純合子小鼠(一種進行性腎病的糖尿病模型)進行治療, 每週3次皮下注射VAR 200,劑量為4,000 mg/kg,持續5個月。雜合子小鼠作為對照。
與未處理的 糖尿病小鼠相比,VAR 200(下圖中以"CD"表示)顯著降低了腎皮質中的總膽固醇。這與治療後2個月開始的未治療糖尿病小鼠腎損傷(系膜擴張)顯著減少和蛋白尿(白蛋白/肌酐)減少 相關,從3個月 至研究結束,水平顯著降低,如下所示。
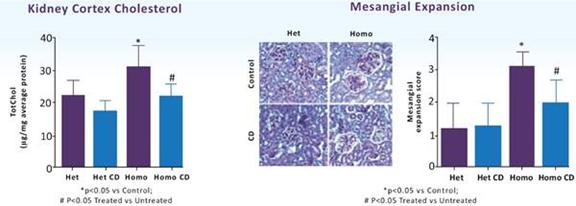
| 80 |
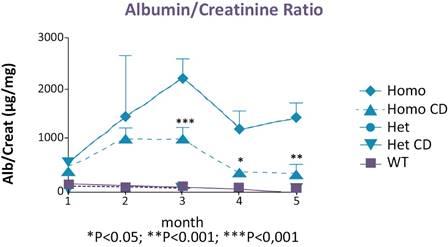
基於 以上總結的3種不同腎臟疾病動物模型的結果,我們認為VAR 200有可能誘導和維持腎病綜合徵腎病患者的蛋白尿部分或完全緩解,從而降低腎臟疾病進展的速率。
炎症體ASC抑制劑IC 100
IC 100是一種用於治療多種炎症性疾病的臨牀前開發中的單抗抗炎症體ASC抑制劑。IC 100的開發目的是通過阻斷先天炎症反應的啟動和持續,以阻止疾病進展和提高生活質量,從而介導在多種炎症性疾病中致病的慢性異常炎症。
對於IC 100,尚未確定 線索指示。我們的重點是推動IC 100在2024年第二季度按計劃提交IND申請 ,之後我們打算啟動第一階段試驗。IC 100擁有代表ARDS和MS的動物模型的藥理學概念驗證數據 我們計劃在小鼠和NHP中進行GLP毒理學研究,並在下一波臨牀前開發中對多達6種額外的適應症進行額外的動物研究,如IgA腎病、帕金森病、早期阿爾茨海默病、亨廷頓病和充血性心力衰竭。將根據我們臨牀前計劃的數據為IC 100選擇一個或多個鉛適應症。
炎症體在炎症疾病中的作用
炎症體的過度 和持續激活與炎症性疾病的病理生理學有關。炎性體是多蛋白複合物,可啟動對病原體或內部危險信號的免疫反應。它們由三種鹼性蛋白質組成:(i)幾種類型的傳感器分子中的一種(例如,NLRP1、NLRP2、NLRP3、NLRC4、AIM 2和Pyrin),(ii)銜接蛋白,ASC,和(iii)半胱天冬酶原 1。每個傳感器分子響應不同的病原體或內部危險信號。
如下圖所示,在有害病原體或細胞損傷存在的情況下,細胞內的感應器分子(如NLRP3)被觸發,刺激適配器ASC的招募,而ASC又招募 前caspase-1以形成炎症體。炎性小體是組織中心,招募額外的ASC,並以Pron樣的 結構聚合,形成一個巨大的絲狀信號平臺,稱為ASC SPECK。ASC SPOKS為前caspase-1募集提供了支架, 它觸發了前caspase-1到活性caspase-1的轉換,進而將細胞因子Pro-IL-1?轉化為其活性形式,從而啟動炎症反應。激活的caspase-1還驅動Gasdermin D的裂解,從而觸發下垂, 一種程序性細胞死亡形式,釋放活躍的細胞因子和ASC斑點進入細胞外空間,並持續激活 前IL-1ü,增強和維持鄰近細胞和組織的炎症反應。儘管炎性小體觸發先天免疫反應對於抵禦病原體是必不可少的,但炎性小體持續的過度激活可能會導致許多炎症條件和疾病的基礎的慢性炎症。許多炎症性疾病與多種類型的炎症體的激活有關。例如,多發性硬化症與AIM2、NLRP1、NLRP3和NLRC4的激活有關。
| 81 |
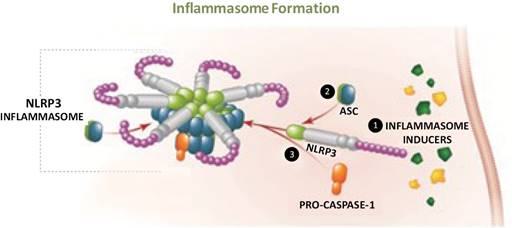
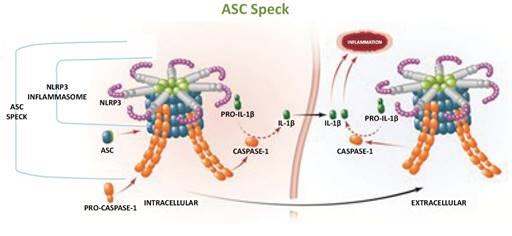
IC 100行動機制
IC 100被設計為結合銜接蛋白ASC中的關鍵氨基酸,所述關鍵氨基酸控制ASC募集到炎性體複合物和ASC Speck形成:
| ● | 通過抑制ASC重新聚集到炎症體複合體中,抑制炎症體的形成,從而阻斷炎性物質下跌的啟動; | |
| ● | 通過破壞ASC細胞內和細胞外斑點的形成,破壞性的炎症持續被阻止。 |
| 82 |
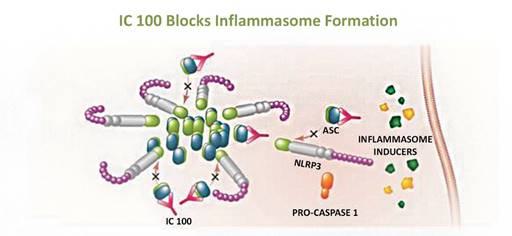
炎症體 一種情況下的激活可能影響另一種情況
最近發表在《翻譯研究》上的一篇論文表明,由一種獨特的炎症條件觸發的炎症體活動和信號蛋白可以影響並潛在地與另一種炎症條件相互作用。作者提供了大量證據表明,創傷性腦損傷(TBI)和阿爾茨海默病(AD)是通過多種類型的炎症體(NLRP3、NLRP1和AIM2)的激活而聯繫在一起的。在每種情況下,炎症體的激活都會導致細胞死亡,並向鄰近細胞釋放活性細胞因子和ASC斑點,從而使一種情況可能加劇另一種情況。例如,有中度腦外傷病史的人患AD的風險是前者的2.3倍。同樣,顱腦損傷患者的炎症體激活通過IL-18以及病理性ASC SPECK與澱粉樣β蛋白和磷酸化tau的相互作用可能加劇AD的病理,這些都是AD的特徵。作者報道,由於ASC在增強和維持鄰近細胞的炎症方面的獨特作用,以及它與澱粉樣β蛋白和磷酸化tau的病理相互作用,因此ASC是治療腦外傷和AD的有前途的治療靶點。在隨後的一項研究中,研究人員評估了通過使用IC 100抑制ASC來阻斷炎症體活性是否可以減少腦損傷後AD小鼠升高的炎症反應。數據表明,100導致損傷後1周AD小鼠受損皮質中炎症體介導的細胞因子IL-1β減少。這與使用IC 100進行的臨牀前研究是一致的,這些研究顯示創傷性腦損傷和與年齡相關的腦炎症(與阿爾茨海默病等疾病相關)模型中炎症活動減少,組織學和/或功能結果改善,將在下面的 下一節中重點介紹。
臨牀前 IC 100支持
在小鼠和非人類靈長類動物中進行的非GLP毒理學研究表明,IC 100具有良好的安全性。在這兩個物種中,劑量在300毫克/千克以下的患者均未發生與藥物相關的不良反應。同樣,表觀遺傳篩選顯示出比許多生物製品更低的免疫原性潛力。根據我們在代表MS的動物模型中進行的臨牀前研究,炎症在沒有免疫抑制的情況下被減輕。 除了上面提到的創傷性腦損傷和年齡相關炎症(早期認知障礙)的研究外, IC 100還擁有代表ARDS和MS的動物模型的藥理學概念驗證數據,以及代表脊髓損傷的動物模型的機械概念驗證數據 。
IC 100和MS
在 一項確定IC 100是否能防止MS進展的研究中,研究人員通過用髓鞘少突膠質細胞糖蛋白肽35—55("MOG35—55")免疫,在C57 BL/6小鼠中誘導了活動性實驗性自身免疫性腦脊髓炎 ("EAE")。在臨牀症狀出現前,第8天通過腹膜內("IP")注射10、30或45 mg/kg的IC 100 ,隨後每4天給藥一次,持續32天。車輛作為對照。
IC 100穿透脊髓並減少脊髓激活的小膠質細胞CD 4+、CD 8+和髓細胞的數量。這與 基於MS臨牀評分,延遲發作和功能顯著改善相關,如下所示。
| 83 |
IC 100和ARDS
在 另一項旨在確定IC 100是否可以改善ARDS的組織病理學結局的研究中,研究人員通過從創傷性腦損傷小鼠體內遞送細胞外囊泡("EV"),隨後在EV遞送1小時後IV 給予IC 100功能原型5 mg/kg,在未處理小鼠中誘導急性肺損傷和隨後的 ARDS;24小時後處死動物。將數據 與未處理組、假手術組(生理鹽水)組、未處理組或依諾肝素3 mg/kg實驗組進行比較。
IC 100抑制肺中的炎性體和細胞因子活化,與未處理的陽性對照動物相比, 100通過Caspase—1、ASC、IL—1 β、AIM 2、HMGB1的降低證明。這與組織學結局改善和急性肺損傷 評分降低相關,表明肺損傷嚴重程度降低。
| 84 |
| 85 |
IC 100機械概念驗證數據
脊髓損傷
為了 確定ASC中和在脊髓損傷中的作用,研究人員在中度頸脊髓損傷("SCI")的Fischer大鼠損傷後20分鐘給予50 mcg抗ASC工具抗體IV和IP 。抗ASC中和 抗體降低半胱天冬酶—1活化和細胞因子水平,改善組織病理學結果和減少脊髓損傷體積, 並改善功能結果(例如,運動技能)與控制相比。
基於 在各種炎性疾病動物模型中的有希望的結果,我們認為IC 100有潛力介導與炎性疾病相關的持續 破壞性炎症並改善結局。
創傷性腦損傷
在兩種不同的動物模型上評價了ASC中和在創傷性腦損傷中的作用,即穿透性彈道樣腦損傷模型和液體衝擊傷模型。
在穿透彈道樣腦損傷模型中,研究人員在接受穿透彈道樣腦損傷的SD大鼠中,在損傷後4小時以5 mg/kg的速度靜脈注射IC 100的功能原型。與賦形劑對照組相比,IC100可降低炎性小體的激活,表現為caspase-1活性降低,小膠質細胞和浸潤性白細胞出現鬆弛。
在流體衝擊損傷模型中,研究人員在接受流體衝擊損傷的SD大鼠中,在損傷後15微克立即靜脈注射抗ASC工具抗體。免疫球蛋白G(“Ig G”)作為對照。ASC的中和幹擾了NLRP1炎症體信號轉導,導致caspase-1較Ig G顯著降低。這與挫傷體積的顯著減少有關。
年齡相關性炎症(早期認知障礙)
為確定IC-100對老年小鼠(即18月齡)的炎症反應的影響,以10 mg/kg的劑量給老齡小鼠(即18月齡)的老年小鼠注射IC-100。接受生理鹽水對照組的老齡小鼠和未治療的幼年小鼠(即3個月大的小鼠)作為對照。IC100減少炎症體蛋白水平(即NLRP1、Asc、Capase-1)和與IL-1β減少相關的Asc斑點,表明IC100減少了老齡小鼠皮質中的炎症體激活。
ASC 作為生物標誌物
生物標誌物 是預測、診斷和監測疾病進展的寶貴工具。它們還可用於針對可能 對特定治療有反應的患者,並監測這些治療隨時間推移的持續療效。
邁阿密大學的研究人員 評估了血清炎性體蛋白作為炎性疾病的潛在生物標誌物,並將ASC 確定為潛在候選物。與健康人相比,各種炎症性疾病患者的血清ASC水平升高。 此外,與作為多發性硬化患者生物標誌物的半胱天冬酶—1相比,ASC對半胱天冬酶—1的敏感性相似, 但特異性顯著高於半胱天冬酶—1。
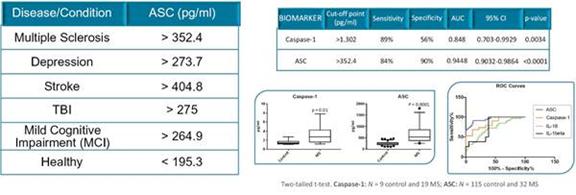
已證明ASC 水平與疾病結局和疾病嚴重程度相關,例如:
| ● | 在腦損傷患者中,損傷後前5天內的ASC蛋白水平可預測創傷後5個月的預後。 | |
| ● | 在將MS患者劃分為輕度或中度疾病的患者中,中度患者的血清ASC水平高於輕度患者。 |
| 86 |
市場 和商業機會
我們 認為,我們的主要候選產品具有治療醫療需求顯著未滿足的疾病的潛力,包括(i) 我們的主要候選腎臟產品VAR 200,正在開發用於多種腎臟適應症的潛在治療,如局灶性節段性腎小球硬化症(FSGS)和Alport綜合徵(孤兒適應症)和糖尿病腎病;和(ii)我們的主要抗炎產品 候選產品,IC 100,用於治療多種炎症性疾病,包括,但不限於多發性硬化症和急性呼吸窘迫綜合徵。VAR 200尚未被FDA授予FSGS或Alport綜合徵的孤兒藥指定。
膽固醇 外排調節劑TMVar 200個商機
FSGS 市場
尚未確定針對FSGS的疾病特定藥物療法的總目標市場,因為沒有批准的針對該疾病的藥物療法 (請參閲下一節,討論當前的治療限制)。根據NephCure Kidney International的數據,FSGS是一種孤兒症狀,據估計在美國約有40,000人受到影響,每年有超過5,400例新診斷病例。FSGS最常見於45歲及以上的成年人,在美國黑人中的發病率是高加索美國人的四倍。
當前 FSGS治療方法和侷限性
目前,還沒有針對FSGS的針對疾病的商業治療方法,也沒有已知的治療方法。目前的治療方法 側重於保持足夠的營養,控制血壓和血脂,最大限度地減少尿蛋白損失, 防止浮腫併發症,從而穩定腎功能。最常見的藥物治療包括治療浮腫的利尿劑、減少蛋白尿的血管緊張素轉換酶抑制劑和血管緊張素轉換酶抑制劑、其他降壓藥和降脂藥物。類固醇和鈣調神經磷酸酶抑制劑也可用於誘導蛋白尿的部分緩解。
我們 認為,對於有效的FSGS特異性治療存在顯著未滿足的需求,這些治療可延緩疾病進展、預防終末期腎病 、改善患者生活質量並降低衞生經濟負擔。
Alport 綜合徵(AS)
作為孤兒,腎臟疾病是一種進行性遺傳性疾病,通常與聽力損失和眼睛異常有關。它是由編碼IV型膠原家族成員的基因突變引起的,最終導致腎臟基底膜或“腎小球”、內耳或“耳蝸”、 和眼睛的脂肪堆積和疤痕形成。強直性脊柱炎的一個關鍵的早期特徵是尿液中的血液,或“血尿”,腎臟功能進行性下降,最終導致腎功能衰竭。影響雙耳的聽力損失發生在兒童晚期或青春期早期,通常是在腎衰竭發作之前。患者也可能有晶狀體畸形(晶狀體前圓錐)和視網膜顏色異常,但這些異常很少會導致視力喪失。AS患者預後較差。
AS 市場
由於沒有FDA批准的針對AS疾病的 藥物療法(請參閲下一節討論當前的治療限制),因此尚未建立針對AS的疾病特定藥物療法的總目標市場。AS代表 所有地理和種族羣體。儘管普通人羣的總體發病率尚不清楚,但美國的數據顯示,3%的兒童和0.2%的成人患有終末期腎臟疾病。根據美國國家罕見病組織的數據,美國AS的基因頻率估計為1:5,000到1:10,000人,這表明大約有30,000到60,000人受到影響。
當前 AS治療方法和侷限性
目前還沒有針對AS的針對疾病的商業治療方法。目前的治療方法側重於最大限度地減少尿中蛋白質的損失,並防止浮腫併發症,以幫助穩定腎功能。對於有明顯蛋白尿的AS患者,推薦使用血管緊張素轉換酶(“ACE”)抑制劑或血管緊張素受體阻滯劑(“ARB”)治療。我們認為,對於能夠延緩疾病進展、防止終末期腎臟疾病和聽力損失,並提高患者生活質量的有效的AS特異性治療,仍有大量未得到滿足的需求。
| 87 |
糖尿病 腎病
自20世紀50年代以來,腎臟 疾病或"腎病"已被認為是糖尿病的常見併發症。目前,糖尿病腎病 是美國和其他西方社會慢性腎病的主要原因。就個體糖尿病患者的發病率和死亡率而言,這也是最重要的 長期併發症之一。在美國,糖尿病佔所有終末期腎病(“ESRD”)病例的30%至40%。蛋白尿是發病率和死亡率的預測因子。 蛋白尿患者的相對死亡率高出40倍。微量白蛋白尿(尿液中少量白蛋白) 獨立預測心血管疾病,蛋白質、白蛋白溢出到尿液中(或"微量白蛋白尿和 大量白蛋白尿")會增加糖尿病患者因任何原因造成的死亡率。
糖尿病 腎病市場
尚未建立糖尿病腎病的疾病特異性藥物治療的 總可尋址市場,因為沒有批准的 特定於該疾病的藥物治療(請參見下一節討論當前治療侷限性)。患有糖尿病超過20年的患者中,高達50%的患者患有糖尿病腎病。據疾病控制和預防中心估計,美國有多達1200萬人。
當前 糖尿病腎病治療方法和侷限性
高血糖或“高血糖”已被證明是糖尿病腎病進展的主要決定因素,因此良好的血糖控制是管理這種情況的關鍵。與其他腎臟疾病一樣,目前還沒有針對腎臟的藥物療法。使用血管緊張素轉換酶抑制劑和ARB控制血壓是護理的標準。新的治療指南建議對2型糖尿病、糖尿病腎病患者使用鈉-葡萄糖共轉運體2(“SGLT2”)抑制劑,在當前任何血糖控制水平下,估計每1.73m2的腎小球濾過率(“≥”)為30毫升/分鐘。SGLT2抑制劑已被證實可改善這一人羣的腎臟和心血管結局。
我們 認為,對於能夠延緩疾病進展、預防終末期腎臟疾病並提高患者生活質量的有效的糖尿病腎病特效治療,存在着巨大的未得到滿足的需求。
IC 100機會
抗炎 生物製品市場
全球抗炎生物製劑市場在2019年的價值為648.4億美元,預計到2027年將達到1498億美元。
多發性硬化症(MS)
多發性硬化症(MS)是一種潛在的大腦和脊髓致殘性疾病,其發生是由於免疫系統攻擊覆蓋神經纖維的保護性髓鞘,導致大腦和身體其他部分之間的溝通問題。最終, 疾病會導致神經的永久性損傷或惡化。
MS的體徵 和症狀差異很大,取決於神經損傷的程度和受影響的特定神經。常見症狀包括 一個或多個肢體麻木或無力、某些頸部運動時的電擊感、震顫、缺乏協調或不穩 步態。有些重度MS患者可能會失去獨立行走的能力或根本喪失行走的能力,而另一些患者可能會經歷長時間的緩解 而沒有任何新症狀。視力問題在MS患者中也很常見,包括部分或完全視力喪失(通常 一次一隻眼睛)、延長複視或視力模糊。其他症狀可能包括言語不清、疲勞、頭暈和刺痛 或身體部位疼痛。大約30%的患者在20至25年內發生嚴重殘疾。
| 88 |
MS 市場
2019年,根據Cowan and Company的一份2020年報告,美國MS疾病修飾藥物實現了144億美元的銷售額。根據當前 估計,根據美國多發性硬化症協會的數據,MS影響了美國100萬人,全球280萬人。根據國家多發性硬化症協會的數據,大約85%的MS患者患有復發緩解型MS,並經歷了幾天或幾周內出現的新症狀或復發,通常部分或完全改善。這些 復發之後是疾病緩解的平靜期,可以持續數月甚至數年。大約60%至70%的復發緩解型MS患者最終出現症狀穩定進展,有或沒有緩解期,稱為繼發性進展型MS。一些 患有MS的患者經歷了逐漸發作和體徵和症狀穩定進展而沒有任何復發。這被稱為初級漸進式 MS。
當前 MS治療方法和侷限性
當前MS的 治療包括免疫調節療法("IMT")以解決潛在免疫疾病,以及緩解 或改善症狀的療法。IMT的目標是減少復發頻率和減緩疾病進展。雖然市場上有許多 疾病改善藥物,但大多數藥物僅被批准用於復發型MS。只有一種 IMT被FDA批准用於治療原發性進展型MS。我們認為,對於有效治療進展型MS的藥物有着巨大的需求,我們認為IC 100有可能解決這一未滿足的需求。
急性呼吸系統疾病綜合徵(ARDS)
ARDS 是一種危及生命的呼吸衰竭形式,其特徵為肺部廣泛炎症迅速發作、非心源性 肺水腫、氧療難治的低氧血癥、胸部X線片上瀰漫性異常和肺順應性降低。患者 需要延長ICU住院時間和住院時間,消耗大量醫療資源。預後差,併發症多,死亡率高;倖存者在康復後的數年內有明顯的功能障礙。急性呼吸窘迫綜合徵最常見的原因是 COVID—19、肺炎、胃內容物吸入和敗血癥。
ARDS 市場
由於目前未使用藥物治療進行治療(請 參見下一節討論當前治療侷限性),目前尚未建立起針對ARDS的藥物治療總體市場。根據Quintanilla等人(2021年出版物),在美國,每年大約有90,600名患者感染ARDS,死亡率高達45%。在全球範圍內,ARDS佔重症監護病房住院人數的10%,每年有超過300萬名ARDS患者。雖然急性呼吸窘迫綜合徵的發病率並不因性別而異,但隨着年齡的增長而增加。
當前 ARDS治療方法和侷限性
目前沒有市售的治療ARDS的藥物。目前對ARDS的治療主要集中在基礎疾病、支持性護理、使用低潮量的無創或機械通氣以及保守的液體管理。我們相信IC 200有潛力 治療急性呼吸窘迫綜合徵中廣泛存在的炎症.
其他 發展候選人
我們 將繼續尋求識別並獲得與腎臟和炎症疾病相關的其他技術的商業化權利。
| 89 |
戰略聯盟和安排
L & F Research LLC許可協議
吾等 與L研究有限公司(“L研究”)訂立經修訂後於2015年12月15日生效的許可協議(“L研究許可協議”),據此,L研究根據VAR 200的專利及知識產權及專有技術授予吾等一項獨家、享有版税、全球可再許可的許可,用於治療、抑制或預防人類腎臟疾病及其症狀,包括FSGS。L&F研究公司是由邁阿密大學米勒醫學院的VAR200發明家和研究人員 創立的,他們從邁阿密大學獲得了知識產權。根據L許可協議,吾等(I)於簽署時向L研究支付預付許可費 200,000美元;(Ii)同意在實現某些開發里程碑時向L研究支付額外款項 ,總額最高可達2,150萬美元;及(Iii)同意在實現某些淨銷售里程碑時,就任何由此產生的 產品的淨銷售額向L研究支付特許權使用費,根據某些年度淨銷售門檻從5%至10%不等。此外,於簽署L及F許可協議後,吾等向L研究發行四(4)份認股權證(“L F認股權證”),可按L F許可協議及L F認股權證所載的若干條款及條件,合共行使25,113股我們的普通股。
2022年12月23日,我們與L研究 有限責任公司(“L研究”)簽訂了“放棄許可協議下某些權利的第二修正案”(“第二修正案”),修訂了之前披露的、日期為2022年3月2日的ZyVersa治療公司、佛羅裏達州一家公司(“Old ZyVersa”)和L&F Research之間的許可協議下某些權利的放棄(“放棄協議”)。第二修正案進一步延長至2023年3月31日,即L研究放棄終止許可協議的權利並根據許可協議行使任何其他補救措施的期間,涉及根據L許可協議應向L研究支付的1,500,000美元的里程碑 付款(“里程碑付款”)。於2023年2月28日, 我們與L研究簽訂了修訂及重述協議(“重述”),修訂並重申經修訂的放棄協議。重述規定,對於里程碑付款,L研究放棄其終止L&F許可協議並根據協議行使任何其他補救措施的權利,直至(A)2023年3月31日,關於該等里程碑付款的1,000,000美元(“放棄A”),和(B)2024年1月31日,關於該等里程碑付款的500,000美元(“放棄”)。豁免A取決於(I)本公司就L研究公司(借款方)與Old ZyVersa研究公司(貸款方)之間日期為2020年12月13日的承付票(日期為2020年12月13日)的未償還本金總額351,579美元的寬免(“票據”),及(Ii)本公司將於2023年3月31日或之前向L研究公司支付648,421美元的現金付款。豁免B取決於本公司向L研究公司支付500,000美元現金,於(X)2024年1月31日或之前及(Y)本公司從發行新股本收到至少30,000,000美元淨收益之日起十個工作日內完成。L許可協議的所有其他條款仍然有效 。
L & F許可協議將在L & F 許可協議項下所有特許權使用費支付義務最後到期時終止,我們有權在提前60天通知後終止L & F許可協議。
如果另一方嚴重違反協議,且未在通知後60天內糾正違約情況,則任何一方均可終止 L & F許可證。如果我們未能根據協議支付款項,L & F Research可在10天 通知後終止協議。此外,如果我們 直接或通過給予第三方的協助,啟動任何干擾或反對程序,質疑 的有效性或可執行性,或反對任何延長或授予補充保護證書,L & F Research有權在書面通知我們後立即終止L & F許可協議, 任何許可方專利權(如協議中的定義)。
如果 我們未在投產里程碑完成日期(根據協議中的定義)完成投產里程碑, L & F Research可在90天書面通知我們後選擇(a)終止整個協議;或(b)終止 協議的排他性條款並將許可證轉換為非排他性。但是,在L & F Research終止 協議或終止排他性之前,如果由於不可抗力事件或 重大變更(如協議中所定義),我們未能在指定時間內實現特定的交付里程碑,則雙方將真誠協商,商定相關交付里程碑的修訂日期。如果我們不能就不可抗力事件或 重大變更達成一致意見,即在未能滿足原始生產里程碑完成日期之日或我們通知發生不可抗力事件或重大變更後15天 (以較遲者為準),L & F Research可行使其終止權。
InflamaCORE, LLC許可協議
我們 與InflamaCORE,LLC(“InflamaCORE”)簽訂了一份於2019年4月18日生效的許可協議(“InflamaCORE許可協議”),根據該協議,InflamCORE向我們授予了一項獨家的、全球性的、可再許可的專利、知識產權、技術和技術許可,用於IC 100的開發和商業化,用於所有疾病和疾病的治療和診斷用途。InflamaCORE是由邁阿密米勒醫學院IC 100發明者和研究人員創建的,他們從邁阿密大學和瑞士細胞系開發公司Selexis SA獲得了知識產權許可。根據InflamaCORE許可協議,我們(I)在簽署時向InflamaCORE支付了346,321.08美元的預付許可費;(Ii)同意在實現某些開發里程碑時向InflamaCORE支付額外款項,總額最高可達2250萬美元;(Iii)同意在實現某些淨銷售里程碑時向InflamaCORE支付版税,根據淨銷售額的水平從5%到10%不等;(Iv)同意在實現某些淨銷售額里程碑(從淨銷售額的3%到6%不等)後,向邁阿密大學支付某些最終產品的淨銷售額的特許權使用費;以及(V)獲得包括Selexis細胞系技術在內的所有第三方技術的再許可,並同意向InflamaCORE支付其Selexis許可的義務。根據Selexis許可證,我們向Selexis支付了50,000瑞士法郎的預付許可費。我們還有義務向Selexis支付(通過償還InflamaCORE) (I)每年10,000瑞士法郎的維護費,(Ii)在實現某些開發里程碑時支付的款項,最高總額約為110萬瑞士法郎,以及(Iii)按淨銷售額支付相當於較低個位數的特許權使用費。此外,於簽署InflamaCORE許可協議後,並根據InflamaCORE許可協議,吾等(I)向邁阿密大學 發行5,714股普通股,(Ii)並向InflamaCORE發行四(4)份認股權證(“InflamaCORE認股權證”),可根據InflamaCORE許可協議及InflamaCORE認股權證所載若干條款及條件,合共行使5,675股本公司普通股。
| 90 |
InflamaCORE許可協議將在InflamaCORE 許可協議項下的所有版税支付義務最後到期時終止,我們有權在發出60天通知後終止InflamaCORE許可協議。如果另一方嚴重違反本協議,且未在 通知後60天內糾正違約行為,則任何一方均可 終止許可證。如果我們未能根據協議支付款項,InflamaCORE可提前10天通知終止協議。此外, 協議可由一方在另一方破產或無力償債時終止。
InflamaCORE許可協議終止後,授予我們的許可將自動終止並恢復到InflamaCORE。
製造業
我們 目前沒有擁有或運營任何設施來配製、製造、測試、儲存、包裝或分銷VAR 200、IC 100和我們正在開發或可能尋求開發的任何其他候選產品,並且目前沒有能力進行此類活動。 我們目前依靠第三方來製造、儲存和測試VAR 200、IC 100以及我們可能尋求 開發的任何其他候選產品。我們將依賴第三方供應商和生產組織來提供我們所有所需的原材料和原料藥 ,以及配製、生產、測試、儲存、包裝和分銷臨牀試驗數量的VAR 200、IC 100和我們可能尋求開發的任何其他候選產品 。我們計劃繼續發展我們的第三方供應商和製造組織網絡, 但將來,如果有技術需求或 戰略或財務利益,我們可能會決定考慮投資於我們自己的製造和供應能力。
我們 有內部人員,並利用具有豐富技術、製造、分析和質量經驗的顧問來監督 我們的合同製造和測試活動。製造業受到廣泛的法規的約束,這些法規規定了程序和文件 要求,包括但不限於記錄保存、製造過程和控制、人員、質量控制和質量 保證。我們的系統、程序和承包商必須遵守這些法規,並通過定期 監控和正式審計進行評估。
研究和開發
我們 在2020年的研發活動上花費了大約650萬美元,在截至2021年12月31日的一年中花費了210萬美元,從2022年1月1日到2022年12月12日的前一段時間花費了540萬美元,從2022年12月13日到2022年12月31日的後繼期花費了40萬美元,在截至2023年9月30日的九個月裏花費了300萬美元。
銷售 和市場營銷
我們 目前沒有市場營銷、銷售或分銷能力。要將任何獲準商業銷售的產品商業化,我們 必須開發自己的銷售、營銷和分銷基礎設施,或與擁有此類商業 基礎設施和相關營銷和銷售經驗的第三方合作。我們希望能夠在 任何預期的產品發佈之前,隨着時間的推移建立我們的商業基礎設施,我們可能依賴與戰略合作伙伴的許可、聯合銷售和聯合推廣協議 來實現我們的產品的商業化。如果我們建立商業基礎設施來支持VAR 200、 IC 100和我們可能尋求開發的任何其他候選產品的潛在市場營銷,則預期此類商業基礎設施將包括由銷售管理、內部銷售支持、內部營銷團隊和分銷支持支持的有針對性的 銷售隊伍。為了 建立適當的商業基礎設施,在批准VAR 200、IC 100和我們可能尋求開發的任何其他候選產品之前,我們需要投入大量的財務和管理資源。
競爭
製藥和生物技術行業競爭激烈。這些競爭對手包括許多公共和私營公司、大學、 政府機構和其他積極參與產品研發的研究組織,這些產品可能與我們尋求開發或解決類似適應症的候選產品相似。許多競爭對手擁有比我們擁有的更多的財政、技術和人力資源,並且可能更有能力開發、製造和銷售他們的產品。我們還預計 尋求開發與我們產品類似的產品和療法的公司數量可能會隨着時間的推移而增加。製藥和生物技術行業的競爭因素 包括產品功效、安全性、易用性、價格、證明的成本效益、 營銷效果、服務、聲譽和獲取技術信息。我們開發和尋求商業化的任何產品 可能無法在一個或多個這些考慮因素方面與我們競爭對手的產品競爭。
| 91 |
例如, 目前還有幾家其他公司在臨牀開發針對FSGS的藥物,靶向炎症、纖維化、 和血管收縮。在我們的競爭對手中,有一些產品處於不同的開發階段,包括處於開發階段2和 階段3的化合物。然而,我們認為VAR 200可能是目前正在開發的唯一一種解決腎小球脂質積聚的藥物 。目前腎臟疾病的治療算法包括多種藥物治療,以解決導致腎臟疾病的各種途徑 。我們認為VAR 200可能與其他治療方式聯合使用,解決 其他致病途徑。
此外, 還有許多其他公司開發靶向炎性體途徑的藥物,其中一些公司正在進行多個適應症的臨牀試驗 。在這些競爭對手中,我們瞭解到許多處於不同開發階段的產品,包括正在進行或已完成II期臨牀試驗的產品,包括痛風、施尼茨勒綜合徵、COVID—19呼吸系統症狀、症狀性膝關節骨關節炎、家族性感冒自身炎症綜合徵、角膜上皮缺損、幹/濕黃斑變性、糖尿病視網膜疾病和黑色素瘤等適應症。此外,還有許多I期臨牀試驗正在進行,包括CAPS、輕度COVID—19、收縮性心力衰竭和實體瘤等適應症 以及健康受試者。我們認為IC 100可能是 唯一靶向炎性體ASC組分的單克隆抗體,其可潛在地抑制多種類型的炎性體 以防止炎症的發生和持續。
知識產權
我們 尋求通過專利、監管排他性和專有技術的組合來保護我們的產品和技術。我們的 目標是為我們的產品、配方、工藝、方法和其他專有 技術獲得、維護和實施專利保護,保護我們的商業祕密,並在不侵犯其他方(無論是在美國還是在其他國家)的所有權的情況下運營。我們的政策是在適當的情況下,通過合同安排和專利(如適用)的組合,積極尋求 在美國和國外 為我們當前的組合物和方法以及任何未來開發中的組合物和方法、專有信息、 和專有技術獲得儘可能廣泛的知識產權保護。然而,即使是專利保護,也不一定總是能夠完全保護那些試圖規避我們的 專利的競爭對手。關於其他情況,見題為"一節。風險因素—與我們的知識產權有關的風險。
根據L&F許可協議,我們擁有與2-hydroxypropyl-beta-cyclodextrin (“2HPβCD”)用於治療人類腎臟疾病(包括FGS)相關的發明的獨家、可再許可的全球許可,如某些使用方法專利和根據專利合作條約(“專利合作條約”)的規定在美國和部分外國(加拿大、中國、歐洲、日本和墨西哥)提交的未決申請中所述。目前,有3項美國專利和7項外國授權或允許的申請。這些專利以及從 待決申請中頒發的任何專利的有效期預計至少為2033年,不會有任何專利期調整或延長。
根據InflamaCORE許可協議,我們擁有與識別、診斷和治療炎症小體及其組件所介導的炎症反應和炎症相關的發明的獨家、可分許可的全球許可,包括但不限於IC 100,這是一種人源化的IgG4抗體,針對細胞凋亡相關斑點樣蛋白(ASC)的派林域的特定氨基酸序列。IC 100的專利組合包括5個專利系列,涵蓋物質組成、生物標記物和使用方法專利及其在美國和選定國家/地區(澳大利亞、巴西、加拿大、智利、中國、哥倫比亞、歐洲、印度、印度尼西亞、以色列、日本、馬來西亞、墨西哥、菲律賓、新加坡、南非、韓國、泰國、越南)的相關國家申報文件。目前,已頒發的美國專利有5項,國外已批准或允許的申請有3項,待批申請有56項。這些專利以及從待決申請中頒發的任何專利的有效期預計至少為2028年, 沒有任何專利期調整或延長。
| 92 |
目前,ZyVersa沒有與L & F或InflamaCORE許可協議相關的專利或專利申請。
即使 我們已經授權了已發佈的專利,但如果受到第三方的質疑 ,也不能保證專利的有效性得到維護。我們無法保證我們的任何知識產權將為我們提供任何免受競爭的保護。
2023年2月24日,我們提交了兩項商標申請:(1)Cholesterol Exfflux Mediator™和(2)Lipid Exfflux Mediator™ ,用於治療腎臟疾病和疾病的藥物製劑。尚未就開發中的產品或技術的任何名稱或徽標提交其他商標保護申請 。我們計劃在適當的情況下在美國境內和境外尋求商標保護。我們打算將這些註冊標記用於 我們的藥物研究和開發(包括專有技術)以及我們的候選產品。
監管事項
在美國,FDA根據聯邦食品、藥物和化粧品法案(FDCA)、公共衞生服務法(PHSA)和其他聯邦法律和法規對藥品、生物製品和醫療器械進行監管。這些受FDA監管的產品也受州和地方法規以及外國適用的法律或法規的約束。 FDA和州、地方、地方司法管轄區和外國的類似監管機構對受FDA監管的產品的研究、開發、測試、製造、質量控制、標籤、包裝、儲存、分銷、記錄保存、批准、 批准後監測、廣告、促銷、營銷、抽樣和進出口提出了實質性要求。
政府 法規
我們未來可能尋求開發或收購的與VAR 200、IC 100和任何其他候選產品相關的任何產品開發活動都將受到多個政府機構的廣泛監管,包括FDA和其他聯邦、州和 地方法規以及其他國家/地區的類似監管機構,它們規範製藥 產品和設備的設計、研究、臨牀 和非臨牀開發、測試、製造、儲存、分銷、進口、出口、標籤、廣告和營銷。通常,在銷售一種新藥之前,必須獲得大量證明其質量、安全性和有效性的數據,組織成每個監管機構特定的格式,提交給監管機構進行審查並獲得監管機構的批准。 這些數據通常是在兩個不同的開發階段產生的:臨牀前和臨牀。VAR 200、IC 100和我們未來可能尋求開發或收購的任何其他候選產品,必須獲得FDA通過新藥申請(“NDA”)、生物許可申請(“BLA”)或其他適用的審批程序的批准,才能在美國合法上市 。
臨牀開發階段通常可以分為三個可能重疊的連續階段:第一階段、第二階段和第三階段臨牀試驗 。在第一階段,通常,少量健康志願者暴露於單次遞增劑量,然後再暴露於候選產品的多次遞增劑量 。這些研究的主要目的是評估藥物的新陳代謝、藥理作用、副作用耐受性和安全性。第二階段試驗通常涉及對受疾病影響的患者進行研究,以確定產生預期益處所需的劑量。同時,還收集了安全性和進一步的藥代動力學和藥效學信息。在某些情況下,FDA可能不認為有必要或不要求進行正式的第一階段和第二階段試驗。當FDA認為原料藥的安全性和有效性很好時,通常就是這種情況。在第三階段的研究中,藥物或治療會被提供給大羣人,以確認其有效性、監測副作用、將其與常用的治療方法進行比較,並收集信息以使 藥物或治療得以安全使用。在既定的監管路徑下,原料藥與FDA已知的原料藥相同或相似的藥品通常比該機構全新的化合物進入更精簡的開發計劃。
批准後 研究,有時稱為4期臨牀試驗,可在初步上市批准後進行。這些研究可用於從預期治療條件下的患者的治療中獲得更多經驗,或獲得藥物的其他適應症 。在某些情況下,FDA可能會強制執行第4階段研究。
| 93 |
美國藥品和生物製品的發展
在美國,獲得監管批准以及隨後遵守適當的聯邦、州、地方和外國法律法規的過程需要花費大量的時間和財力。在產品開發過程、審批過程或批准後的任何時間未能遵守適用的美國要求,可能會 申請人受到行政或司法制裁。這些制裁可能包括FDA拒絕批准待決申請、 撤回批准、臨牀封存、警告信、產品召回或從市場上撤回、產品扣押、完全或部分暫停生產或分銷、禁令、罰款、拒絕政府合同、恢復原狀、退還或 民事或刑事處罰。
在美國開始對新藥或生物製品進行人體臨牀研究之前,臨牀前實驗室和動物試驗通常是根據FDA的《良好實驗室規範》進行的。贊助商必須將臨牀前試驗的結果與生產信息、分析數據、任何可用的臨牀數據和文獻以及擬議的臨牀方案 一起作為研究新藥(IND)申請的一部分提交給FDA。其他國家也要求提交類似的文件。 IND中必須提供的數據量取決於研究的階段。第一階段研究通常比較大的第三階段研究需要更少的數據。在開始臨牀試驗之前,必須向FDA提交臨牀計劃。如果FDA對臨牀計劃或擬議研究的安全性有顧慮,他們可以隨時暫停或終止該研究。研究必須按照良好的臨牀實踐進行,並定期報告研究進展和任何不良經歷。研究也受到獨立機構審查委員會的審查,這些委員會負責監督特定研究人員地點的研究 並保護人類研究對象。獨立機構評審委員會也可在啟動後暫停或終止研究。 因此,提交IND不能保證FDA批准臨牀試驗開始,或一旦開始,不會出現可能導致試驗暫停或終止的問題。
美國藥品和生物製品的審查和批准
完成第三階段試驗後,將對試驗數據進行分析,以確定安全性和有效性。然後,將完整的開發數據以保密協議或BLA的形式提交給FDA,同時提交產品的建議標籤以及將用於確保產品質量的製造和測試流程和設施的信息。NDA和BLA申請是藥品 贊助商正式建議FDA批准在美國銷售和營銷的新藥品的工具。NDA或BLA 必須包含安全性、純度、效力和有效性的證明,這需要廣泛的臨牀前和臨牀測試。在IND的動物研究和人類臨牀試驗期間收集的數據將成為NDA或BLA的一部分。
FDA對NDA或BLA的審查和評估可能需要幾年時間才能完成。FDA可以對新產品的生產設施進行審批前檢查,以確定它們是否符合cGMP要求,並可能審計 臨牀和臨牀前試驗的數據。
FDA可以在批准時附加條件,包括要求風險評估和緩解策略(“REMS”)以確保該製劑的安全使用。如果FDA得出結論認為需要REMS,則申請的贊助者必須提交建議的REMS,其中可能包括用藥指南、醫生溝通計劃或確保安全使用的要素,如受限分發方法、患者登記和其他風險最小化工具。
IND與藥物和生物製品的臨牀試驗
在開始藥物或生物製品的人體臨牀試驗之前,必須向FDA提交一份IND,其中包含臨牀前研究的結果以及其他信息,如有關產品化學、製造和控制的信息以及建議的方案。IND是FDA授權給人類服用研究藥物或生物製品的請求。 IND在FDA收到後30天自動生效,除非FDA在30天內對臨牀試驗的進行提出擔憂或問題。在這種情況下,IND贊助商必須在臨牀試驗開始之前解決FDA的任何懸而未決的問題。在藥物開發期間進行的每個後續臨牀試驗都必須單獨提交給現有的IND。
| 94 |
建議進行臨牀試驗的每個研究中心的獨立機構審查委員會(“IRS”)必須在該研究中心開始試驗之前審查並 批准試驗的研究計劃。必須獲得每位 試驗受試者的知情書面同意。
人類 藥物和生物製品的臨牀試驗通常按順序進行,這些階段可能會重疊:
| ● | 階段 I:研究藥物/生物最初給健康的人類受試者或有目標疾病或狀況的患者 ,以確定藥物在人體內的新陳代謝和藥理作用,副作用,如果可能,獲得關於有效性的早期證據 。在第一階段臨牀試驗期間,可以獲得關於研究藥物/生物的藥代動力學和藥理作用的足夠信息,以允許設計控制良好和科學有效的第二階段臨牀試驗。 | |
| ● | 階段 第二階段:進行臨牀試驗是為了評估藥物/生物製劑對特定適應症或目標人羣中有限數量患者的有效性,以確定可能的不良反應和安全風險,確定藥物/生物製劑對特定目標疾病的療效,並確定劑量耐受性和最佳劑量。贊助商可在開始規模更大、成本更高的第三階段臨牀試驗之前進行多個第二階段臨牀試驗 以獲取信息。 | |
| ● | 第三階段:當第二階段臨牀試驗證明藥物/生物製劑的劑量範圍似乎有效且具有可接受的安全性,併為第三階段臨牀試驗的設計提供足夠的信息時,第三階段臨牀試驗可以在多個臨牀地點擴大的 患者羣體中開始。它們旨在進一步評估劑量、有效性和安全性, 建立研究藥物/生物的總體效益-風險關係,併為產品標籤 和FDA批准提供充分的基礎。在大多數情況下,FDA需要兩個充分且受控良好的III期臨牀試驗,以證明該藥物在多個臨牀試驗地點擴大的患者羣體中的療效。 |
所有 臨牀試驗必須按照FDA法規進行,包括藥物臨牀試驗質量管理規範("GCP")要求, 這些法規旨在保護試驗參與者的權利、安全和福祉,定義臨牀試驗申辦者、管理人員 和監查員的角色,並確保臨牀試驗數據的完整性。監管機構(包括FDA、IRB、數據安全監測委員會 或申辦者)可隨時基於各種原因暫停或終止臨牀試驗,包括髮現受試者 暴露於不可接受的健康風險或臨牀試驗未按照FDA要求進行。
在 新藥或生物製劑的開發過程中,申辦者有機會在某些時候與FDA會面。這些時間點可以 在提交IND之前、II期臨牀試驗結束時以及提交NDA或BLA之前。可請求在其他時間舉行會議 。這些會議可為申辦方提供機會,共享迄今為止收集的數據信息, FDA提供建議,申辦方和FDA就下一階段的開發達成協議。申辦者通常會利用 II期臨牀試驗結束會議討論其II期臨牀試驗結果,並提出他們認為將支持新藥/生物製劑批准的關鍵III期註冊試驗的計劃。
試驗用藥物產品是同一劑型中兩種不同藥物的組合,必須符合另一項規則 ,該規則要求每種組分對製劑聲稱的作用有貢獻。這通常需要進行更大規模的研究 ,對藥物的每一種成分進行測試。
臨牀試驗信息披露
FDA監管產品(包括藥物、生物製品和器械)臨牀試驗的申辦者 需要註冊和披露某些 臨牀試驗信息。與產品、患者人羣、研究階段、研究中心和研究者以及臨牀試驗的其他方面相關的信息,作為註冊的一部分予以公開。申辦者還有義務在完成臨牀試驗後討論其結果 。臨牀試驗結果的披露可以推遲到正在研究的新產品或新適應症 獲得批准。競爭對手可以使用這些公開可用的信息來獲取有關 開發計劃進展的知識。
| 95 |
新藥申請(NDA)和生物製品許可證申請(BLA)審批流程
我們的 藥物或生物製品必須分別通過NDA和BLA批准程序獲得FDA的批准,然後才能 在美國合法上市。FDA要求在美國上市的藥物或生物製品的這些程序通常涉及 :
| ● | 完成非臨牀實驗室測試,如果是NDA,則完成根據良好實驗室實踐或其他適用法規進行的動物研究和配方研究; | |
| ● | 提交IND申請 ; | |
| ● | 根據GCP進行的人體臨牀試驗,以確定擬用於其預期用途的藥物或生物製品的安全性和有效性。 | |
| ● | 在所有關鍵臨牀試驗完成後,向FDA提交NDA或BLA(視情況適用); | |
| ● | FDA對生產設施的審批前檢查和對臨牀試驗地點的審計;以及 | |
| ● | FDA 批准保密協議或BLA(如果適用)。 |
為了獲得在美國上市的藥物或生物製品的批准,必須向FDA提交一份上市申請,其中 提供數據,證明試驗藥物在擬定適應症中的安全性和有效性,並使FDA滿意。準備和提交NDA或BLA的費用是巨大的。每份NDA或BLA提交都需要支付用户費用 (2019財年超過250萬美元),除非適用豁免或豁免。經批准的BLA的製造商或贊助商 還需繳納年度設立費。該申請包括從相關非臨牀研究、 或臨牀前研究和臨牀試驗中獲得的所有相關數據,包括陰性或不明確的結果以及陽性結果,以及與產品化學、生產、控制和擬定標籤相關的詳細 信息,以及其他信息。數據可以 來自公司申辦的旨在測試產品使用的安全性和有效性的臨牀試驗,或來自許多 替代來源,包括由符合GCP要求的研究者發起的研究。
公司 還必須開發有關藥物或生物製品特性的其他信息,並最終確定NDA 或BLA申辦者按照現行藥品生產質量管理規範("cGMP")要求生產產品的工藝。 生產工藝必須能夠始終如一地生產候選產品的質量批次,並且生產商必須 開發檢測成品藥物或生物製品的方法。此外,必須選擇和測試適當的包裝, 必須進行穩定性研究,以證明候選產品在 有效期內不會發生不可接受的變質。
藥物或生物製品開發、非臨牀研究和臨牀試驗的結果,以及生產過程 、對藥物或生物製品進行的試驗、擬定標籤和其他相關信息的描述,作為申請產品上市的NDA或BLA的一部分, 提交給FDA 。
FDA審查提交的所有NDA或BLA,以確保它們在接受其 備案之前足夠完整,可進行實質性審查。FDA可以要求提供更多信息,而不是接受NDA或BLA進行備案。在這種情況下,必須重新提交NDA或BLA 以及附加信息。重新提交的申請在FDA接受申請之前也要接受審查。FDA 在收到NDA或BLA後有60天的時間進行初步審查,以根據FDA的閾值確定,即申請是否被接受提交 ,即申請足夠完整,允許進行實質性審查。
一旦 NDA或BLA提交被接受備案,FDA將開始對NDA或BLA進行深入審查,以確定 申報產品是否安全有效地用於其預期用途,以及產品是否按照cGMP生產,以確保產品的特性、強度、質量和純度。FDA已同意 NDAs和BLA審查的具體績效目標,並尋求在提交相應申請後12個月內審查標準NDAs或BLA,並在8個月內審查生物製品 。FDA可能會將審查過程延長三個月,以考慮 某些遲交的信息或旨在澄清提交文件中已經提供的信息的信息。
| 96 |
FDA評估NDA或BLA後,將發佈批准函或完整的回覆函。批准函授權 藥物或生物製品的商業銷售,並附有針對特定適應症的特定處方信息。完整的回覆 函表明申請尚未準備好審批。完整的回覆函可能需要額外的臨牀數據和/或 額外的關鍵臨牀試驗,和/或與臨牀試驗、 臨牀前研究或生產相關的其他重要、昂貴且耗時的要求。即使提交了此類附加信息,FDA也可能最終決定NDA或 BLA不符合批准標準。FDA還可以將新藥物或生物製品或出現安全性或有效性難題的藥物或 生物製品的申請提交給諮詢委員會,通常是一個由 臨牀醫生和其他專家組成的小組,以供審查、評估和建議是否批准申請,如果批准, 在什麼條件下批准。FDA不受諮詢委員會建議的約束,但會仔細考慮此類建議 ,並在做出決定時通常遵循此類建議。
在 批准NDA或BLA之前,FDA通常會檢查產品生產的工廠。FDA將不會批准 產品,除非FDA確定生產工藝和設施符合cGMP要求,並足以 確保產品在要求的質量標準範圍內一致生產。FDA在評估NDA或BLA和生產設施後,發佈批准函或完整的回覆函。如果FDA確定申請、生產過程或生產設施不可接受,其完整的回覆函通常會概述缺陷,並且通常 會要求提供額外的測試或信息,其中可能包括額外的大規模臨牀測試或信息,以便 FDA重新考慮申請。這可能會大大推遲對申請的進一步審查。
如果 FDA發現某個臨牀試驗機構未按照GCP法規進行臨牀試驗,FDA可以決定將該臨牀試驗機構生成的數據 排除在NDA或BLA中提供的主要療效分析之外。此外,儘管 提交了任何要求的額外信息,FDA最終可能會決定申請不符合批准的監管標準。
If, or when, those deficiencies have been addressed to the FDA’s satisfaction in a resubmission of the NDA or BLA, the FDA will issue the approval letter. The FDA has committed to reviewing such resubmissions in 2 or 6 months depending on the type of information included. An approval letter authorizes commercial marketing and distribution of the product with specific prescribing information for specific indications. As a condition of approval, the FDA may require substantial post-approval testing and surveillance to monitor the product’s safety or efficacy after a product is approved, including additional clinical trials and may impose other conditions, including labeling restrictions, which can materially affect the product’s potential market and profitability. These so-called Phase IV or post-approval clinical trials may be a condition for continuing drug approval. The results of Phase IV clinical trials can confirm the effectiveness of a product candidate and can provide important safety information. In addition, the FDA now has express statutory authority to require sponsors to conduct post-marketing trials to specifically address safety issues identified by the agency. Once granted, product approvals may be withdrawn if compliance with regulatory standards is not maintained or problems or safety issues are identified following initial marketing.
FDA還有權要求REMS確保藥物或生物製品的益處大於其風險。贊助商也可以自願提出REMS作為NDA提交的一部分。作為NDA或BLA審查的一部分,確定是否需要REMS。REMS的要素可能包括“親愛的醫生函”、用藥指南、更詳細的有針對性的教育計劃,以及在某些情況下確保安全使用的要素(“ETASU”),這是限制最嚴格的REMS。ETASU可包括但不限於針對處方或配藥的特殊培訓或認證、僅在某些情況下的配藥、特殊監測和患者登記簿的使用。這些要素是作為保密協議或BLA批准的一部分進行協商的,在某些情況下,批准日期可能會推遲。一旦實施,REMS將接受定期評估和 修改。
對已批准申請中確立的某些條件進行更改 ,包括適應症、標籤、設備組件或製造流程或設施的更改 ,可能需要提交和FDA批准新的NDA或BLA,或NDA或BLA補充物,才能實施更改 。新適應症的NDA或BLA補充劑通常需要與原始申請中類似的臨牀數據,並且FDA在審查NDA或BLA補充劑時使用與審查NDA或BLA相同的程序和行動。
| 97 |
即使候選產品獲得監管部門的批准,批准也可能僅限於特定的疾病狀態、患者羣體和劑量,或者可能以警告、預防或禁忌症的形式,或以繁瑣的風險管理計劃、分銷限制或上市後試驗要求的形式,包含對使用的重大限制。此外,即使在獲得監管部門批准 之後,發現以前未知的產品問題可能會導致該產品受到限制,甚至完全從市場上撤出。此外,可能會建立新的政府要求,包括由 新立法產生的要求,或者FDA的政策可能會改變,這可能會推遲或阻止監管部門批准我們正在開發的產品。此外,我們無法預測未來美國或外國政府的行動可能會產生哪些不利的政府法規 。
《哈奇-瓦克斯曼法案》
根據修訂後的1984年《藥品價格競爭和專利期限恢復法》(俗稱《哈奇-瓦克斯曼法案》),在臨牀開發和FDA監管審查期間丟失的產品美國專利期的一部分可以恢復。Hatch-Waxman修正案還提供了一個程序,用於在FDA批准的藥物產品中列出與已批准產品有關的專利,並帶有治療等效性評估(通常稱為橙色手冊),以及尋求批准 引用已列出專利的產品的申請的競爭對手,以進行與此類專利有關的認證。此外,《哈奇-瓦克斯曼修正案》 規定了針對FDA接受或批准某些競爭對手申請的法定保護,稱為非專利排他性。
專利期限恢復
專利期限恢復可以通過為涵蓋新產品或其用途的專利返還最多五年的專利壽命來補償藥物開發和監管審查過程中損失的時間。這段時間通常是IND的生效日期(在專利頒發之後)和保密協議提交日期之間的時間的一半,加上保密協議提交日期和申請獲得批准之間的時間 ,前提是發起人盡職調查。然而,專利期限恢復不能將專利的剩餘期限延長 自產品批准之日起總共14年,並且只能延長適用於經批准的 藥物的一項專利,並且必須在專利到期之前申請延長。美國專利商標局與FDA協商後,審查和批准任何專利期延長或恢復的申請。
橙色 圖書清單
在通過保密協議尋求藥物批准的過程中,申請人被要求向FDA列出其權利要求涵蓋申請人的產品的每一項專利。一旦藥物獲得批准,NDA持有者在藥物申請或其他方面列出的每一項專利都會在FDA的橙皮書中公佈。橙色手冊中列出的藥物反過來可以被潛在的仿製藥競爭對手引用,以支持 批准簡化新藥申請(“ANDA”)。ANDA允許銷售含有與上市藥物相同強度和劑型的有效成分(S),並已通過生物等效性測試 證明在治療上與上市藥物相同的藥物產品。除了生物等效性測試的要求外,ANDA申請者不需要 進行臨牀前研究或臨牀試驗的結果,以證明其藥物產品的安全性或有效性。 根據ANDA批准的藥物通常被稱為上市藥物的“仿製藥”,並且通常可以由藥劑師在為原始上市藥物開出的處方下替代。任何申請人提交ANDA申請以尋求批准橙皮書中所列藥物的仿製藥或涉及橙冊中所列藥物的505(B)(2)NDA時,必須向FDA證明:(I)作為申請標的的藥物產品的專利信息尚未提交給FDA;(Ii) 此類專利已到期;(Iii)此類專利到期的日期;或(Iv)該專利無效或不會因製造、使用或銷售申請所申請的藥品而受到侵犯。最後一項認證稱為第(Br)段IV認證。必須向作為認證標的的專利的每個所有者以及ANDA或505(B)(2)申請所指的經批准的保密協議的持有人提供第四款認證的通知。申請人還可以選擇 提交“第八節”聲明,證明其建議的標籤不包含(或刻出)與專利使用方法有關的任何語言,而不是證明列出的使用方法專利。如果參考NDA持有者和專利所有人在收到第四款認證通知後45天內對橙書所列專利之一提出專利挑戰,則FDA不得批准申請,直到收到第四款認證通知後30個月,即專利到期時,即與申請人有關的侵權案件做出有利於申請人的裁決時,或法院可能下令的較短或較長期限。這一禁令通常被稱為30個月的緩期。 ANDA或505(B)(2)申請也將在橙色手冊中列出的品牌參考藥物的任何適用非專利排他性到期之前不會獲得批准。因此,ANDA或505(B)(2)NDA的批准可能會被推遲很長一段時間,這取決於申請人所做的專利認證和參考藥品贊助商發起專利訴訟的決定。
| 98 |
市場排他性
市場 FDCA下的排他性條款還可能推遲某些藥物申請的提交或批准。《哈奇-瓦克斯曼法》(Hatch-Waxman Act) 為某些經批准的藥物產品設立了監管排他期,在此期間,FDA不能批准(或在某些情況下 接受)依賴品牌參考藥物的ANDA或505(B)(2)申請。例如,FDCA為第一個獲得新化學實體(“NCE”)NDA批准的申請人提供了五年的美國境內非專利營銷排他性 。 如果FDA以前沒有批准過任何其他含有相同活性部分的新藥,則該藥物是NCE,該活性部分是負責該藥物物質作用的分子或離子。在排他期內,FDA可能不接受由另一家公司為該藥物的另一版本提交的ANDA或505(B)(2) NDA進行審查,但申請人不擁有或擁有對批准所需的所有數據的法定參照權。然而,如果申請包含第四段認證,則可以在四年後提交申請。 《哈奇-瓦克斯曼法案》還規定,如果FDA認為申請人進行或贊助的一項或多項新的 臨牀研究(生物利用度或生物等效性研究除外)對批准申請至關重要,則針對特定批准條件的NDA(包括505(B)(2)NDA)或上市產品的變更,如先前批准的產品的新配方,《哈奇-瓦克斯曼法》還規定了三年的市場排他性。現有藥物的劑量或強度。 這三年排他期防止FDA批准ANDA和505(B)(2)NDA,適用於包括需要新臨牀數據的創新的藥物,但不禁止FDA批准包含原始有效成分的ANDA。 五年和三年排他期不會推遲完整NDA的提交或批准;但是,提交完整的保密協議的申請者必須進行或獲得證明安全性和有效性所必需的所有非臨牀研究和充分且控制良好的臨牀試驗的參照權。
生物仿製藥 排他性
2009年《生物製品價格競爭和創新法案》(簡稱"BPCIA")根據《公共衞生服務法案》(簡稱"PHSA")第351(k)節為生物仿製藥產品創建了一個簡化的審批途徑。生物仿製藥產品或"生物仿製藥"是指與現有FDA許可的參比產品高度相似且無臨牀意義差異的生物 產品。生物相似性 必須通過分析研究、動物研究和至少一項臨牀研究來證明,除非豁免。如果生物仿製藥產品為生物仿製藥,且符合BPCIA的其他要求,包括 預期其產生與參比產品相同的臨牀結果,且多次給藥的產品, 生物製劑和參比生物製劑在先前給藥後可互換,而不會增加安全風險,或 相對於僅使用參比生物製劑,療效降低的風險。可以用可互換產品替代 參比產品,而無需處方者參與。
Under the BPCIA, no section 351(k) application for a biosimilar may be submitted for four (4) years from the date of licensure of the reference product. Additionally, a reference biologic is granted twelve (12) years of exclusivity from the time of first licensure of the reference product, During this twelve (12)-year exclusivity period, another company may still market a competing version of the reference product if the FDA approves a full BLA for the competing product submitted under section 351(a) of the PHSA containing the competing sponsor’s own pre-clinical data and data from adequate and well-controlled clinical trials to demonstrate the safety, purity, and potency of the other company’s product. The first biologic product submitted under the abbreviated approval pathway that is determined to be interchangeable with the reference product may obtain exclusivity against a finding of interchangeability for other biologics for the same condition of use for the lesser of (i) one (1) year after first commercial marketing of the first interchangeable biosimilar; (ii) eighteen (18) months after the first interchangeable biosimilar is approved if there is no patent challenge; (iii) eighteen (18) months after resolution of a lawsuit over the patents of the reference biologic in favor of the first interchangeable biosimilar applicant; or (iv) forty-two (42) months after the first interchangeable biosimilar’s application has been approved if a patent lawsuit is ongoing within the forty-two (42)-month period.
| 99 |
加快開發和審查計劃
快速 路徑指定
Fast track designation may be granted for a product that is intended to treat a serious or life-threatening disease or condition for which preclinical or clinical data demonstrate the potential to address unmet medical needs for the condition. The sponsor of an investigational drug product may request that the FDA designate the drug candidate for a specific indication as a fast track drug concurrent with, or after, the submission of the IND for the drug candidate. The FDA must determine if the drug candidate qualifies for fast track designation within 60 days of receipt of the sponsor’s request. For fast track products, sponsors may have greater interactions with the FDA and the FDA may initiate review of sections of a fast track product’s NDA before the application is complete. This rolling review is available if the FDA determines, after preliminary evaluation of clinical data submitted by the sponsor, that a fast track product may be effective. The sponsor must also provide, and the FDA must approve, a schedule for the submission of the remaining information and the sponsor must pay applicable user fees. At the time of NDA filing, the FDA will determine whether to grant priority review designation. Additionally, fast track designation may be withdrawn if the FDA believes that the designation is no longer supported by data emerging in the clinical trial process.
突破性的 治療指定
The FDA may also accelerate the approval of a designated Breakthrough Therapy, which is a drug that is intended, alone or in combination with one or more other drugs, to treat a serious or life-threatening disease or condition and preliminary clinical evidence indicates that the drug may demonstrate substantial improvement over existing therapies on one or more clinically significant endpoints, such as substantial treatment effects observed early in clinical development. The sponsor of a Breakthrough Therapy may request the FDA to designate the drug as a Breakthrough Therapy at the time of, or any time after, the submission of a IND for the drug. If the FDA designates a drug as a Breakthrough Therapy, it must take actions appropriate to expedite the development and review of the application, which may include (i) holding meetings with the sponsor and the review team throughout the development of the drug; (ii) providing timely advice to, and interactive communication with, the sponsor regarding the development of the drug to ensure that the development program to gather the nonclinical and clinical data necessary for approval is as efficient as practicable; (iii) involving senior managers and experienced review staff, as appropriate, in a collaborative, cross-disciplinary review; (iv) assigning a cross-disciplinary project lead for the FDA review team to facilitate an efficient review of the development program and to serve as a scientific liaison between the review team and the sponsor; and (v) taking steps to ensure that the design of the clinical trials is as efficient as practicable, when scientifically appropriate, such as by minimizing the number of patients exposed to a potentially less efficacious treatment.
加速了 審批
Accelerated approval may be granted for a product that is intended to treat a serious or life-threatening condition and that generally provides a meaningful therapeutic advantage to patients over existing treatments. A product eligible for accelerated approval may be approved on the basis of either a surrogate endpoint that is reasonably likely to predict clinical benefit, or on a clinical endpoint that can be measured earlier than irreversible morbidity or mortality, that is reasonably likely to predict an effect on irreversible morbidity or mortality or other clinical benefit, taking into account the severity, rarity or prevalence of the condition and the availability or lack of alternative treatments. The accelerated approval pathway is most often used in settings in which the course of a disease is long, and an extended period of time is required to measure the intended clinical benefit of a product, even if the effect on the surrogate or intermediate clinical endpoint occurs rapidly. The accelerated approval pathway is contingent on a sponsor’s agreement to conduct additional post-approval confirmatory studies to verify and describe the product’s clinical benefit. These confirmatory trials must be completed with due diligence and, in some cases, the FDA may require that the trial be designed, initiated, and/or fully enrolled prior to approval. Failure to conduct required post-approval studies, or to confirm a clinical benefit during post-marketing studies, would allow the FDA to withdraw the product from the market on an expedited basis. All promotional materials for product candidates approved under accelerated regulations are subject to prior review by the FDA.
| 100 |
孤兒藥物
根據 孤兒藥法案,FDA可以授予孤兒藥指定給旨在治療罕見疾病或病症的藥物,這通常是 在美國影響不到20萬人或超過200人的疾病或病症,美國000人 但沒有合理預期開發和製造此類疾病產品的成本,或 在美國銷售的產品將恢復。
在提交NDA之前,必須申請孤兒藥指定。在FDA授予孤兒藥指定後,FDA公開披露該藥物的身份和 其潛在的孤兒用途。孤兒藥指定不會在監管審查和批准過程中帶來任何好處或縮短 持續時間。
第一個獲得FDA批准的特定活性部分用於治療罕見疾病的NDA申請人 有權在美國針對該適應症獲得7年獨家上市期。在七年的排他性 期內,FDA不得批准任何其他針對同一疾病的相同藥物上市申請,除非在有限的情況下, 例如通過更高的有效性、更高的安全性、 或為患者護理提供重大貢獻,或在藥物供應問題的情況下,表現出優於具有孤兒藥排他性的產品的臨牀優越性。孤兒藥的排他性並不妨礙 FDA批准不同的藥物治療相同的疾病或病症,或相同的藥物治療不同的疾病或病症。孤兒藥指定的其他好處 包括某些研究的税收抵免和豁免NDA用户費。
兒科信息
根據 《兒科研究公平法案》或PREA,NDA或NDA補充劑必須包含用於評估 藥物在所有相關兒科亞羣中聲明適應症的安全性和有效性的數據,並支持該藥物安全有效的每個兒科亞羣的劑量和給藥。FDA可以批准全部或部分豁免,或推遲提交數據。 除非法規另有要求,否則PREA不適用於已授予孤兒指定的任何適應症藥物, 某些例外情況除外。
如果滿足某些條件,《兒童最佳藥品法案》(BPCA)為NDA持有者提供六個月的藥物獨佔權(專利或非專利)延期。排他性的條件包括FDA確定 與兒科人羣使用新藥相關的信息可能會為該人羣帶來健康益處、FDA 提出兒科研究書面請求,以及申請人同意在法定時間範圍內進行並報告所要求的研究 。BPCA下的申請被視為優先申請,享有指定賦予的所有好處。
上市後 FDA法規
在 新產品獲得批准後,製藥公司和獲批產品將受到FDA和其他 聯邦和州監管機構的持續監管,其中包括監測和記錄保存活動,向適用 監管機構報告產品的不良反應,向監管機構提供最新的安全性和有效性 信息,產品抽樣和分銷要求,以及遵守促銷和廣告要求,其中包括 直接面向消費者的廣告標準,限制在藥物批准標籤中未描述的用途或患者人羣中推廣藥物 (稱為"標籤外使用"),對行業贊助的科學和教育活動的限制,以及對涉及互聯網的促銷活動的要求。雖然醫生可以處方合法可用的藥物 用於標籤外用途,但製造商不得銷售或推廣此類標籤外用途。產品或標籤的修改或增強 或生產地點的變更通常需要FDA和其他監管機構的批准,這些批准可能會收到,也可能不會收到 ,或者可能會導致漫長的審查過程。
| 101 |
FDA、州和外國監管機構擁有廣泛的執法權力。不遵守適用的監管要求 可能導致FDA、州或外國監管機構採取執法行動,其中可能包括以下內容:
| ● | 無標題 信件或警告信; | |
| ● | 罰款、 交出、歸還或民事處罰; | |
| ● | 禁令 (例如,全部或部分暫停生產)或同意令; | |
| ● | 產品 召回、行政拘留或扣押; | |
| ● | 客户 通知或維修、更換或退款; | |
| ● | 操作 限制或部分暫停或完全關閉生產; | |
| ● | 延遲或拒絕批准未來產品批准或外國監管機構對新產品、新預期用途或 對現有產品的修改的請求; | |
| ● | 撤回 或暫停FDA產品營銷批准或外國監管機構批准,導致產品銷售被禁止; | |
| ● | 臨牀 暫停臨牀試驗; | |
| ● | FDA 拒絕向外國政府頒發出口產品在其他國家銷售的證書;以及 | |
| ● | 刑事 起訴。 |
任何 這些制裁措施都可能導致高於預期的成本或低於預期的銷售額,並對 我們的聲譽、業務、財務狀況和經營業績產生重大不利影響。政府機構的此類行動也可能要求我們 花費大量資源來應對這些行動。任何機構或司法執法行動都可能對我們的業務產生重大不利影響 。
處方藥 廣告受聯邦、州和外國法規的約束。在美國,FDA監管處方藥促銷, 包括直接面向消費者的廣告。處方藥促銷材料必須在其 首次使用時一併提交給FDA。處方藥產品和藥物樣品的任何分銷必須符合美國處方藥營銷法(“PDMA”),這是FDCA的一部分。產品一旦獲得批准,其製造將受到FDA全面和持續的 法規的約束。FDA法規要求產品在特定批准的工廠中生產,並符合 cGMP,NDA或BLA持有者必須列出其產品並向FDA註冊其生產機構。這些法規 還對製造和質量保證活動提出了某些組織、程序和文件要求。 藥品製造商和其他參與生產和分銷獲批藥品的實體需接受FDA和某些州機構的定期突擊檢查 ,以確保其符合cGMP和其他法律。
使用合同製造商、實驗室或包裝商的NDA 或BLA持有人負責選擇和監控合格的 公司。這些公司隨時接受FDA的檢查,發現違規行為可能導致執行行動 ,從而中斷任何此類設施的運營或分銷這些設施製造、加工或測試的產品的能力。 新發現或開發的安全性或有效性數據可能需要更改產品的批准標籤,包括添加 新警告和禁忌症,還可能需要實施其他風險管理措施。
| 102 |
醫療保健 和報銷條例
If VAR 200, IC 100 and any other product candidate that we seek to develop, are approved by the FDA, government coverage and reimbursement policies will both directly and indirectly affect our ability to successfully commercialize the product, and such coverage and reimbursement policies will be affected by future healthcare reform measures. Government health administration authorities, private health insurers and other organizations generally decide which drugs they will pay for and establish reimbursement levels for healthcare. In particular, in the United States, private health insurers and other third-party payors often provide reimbursement for products based on the level at which the government (through the Medicare or Medicaid programs) provides reimbursement for such treatments. Patients who are prescribed treatments for their conditions and providers performing the prescribed services generally rely on third-party payors to reimburse all or part of the associated healthcare costs. Many patients are unlikely to use our products unless coverage is provided and reimbursement is adequate to cover a significant portion of the cost of our products. Sales of our products will therefore depend substantially, both domestically and abroad, to the extent they are reimbursed by government health administration authorities, such as Medicare and Medicaid, private health coverage insurers and other third-party payors. The market for our products will depend significantly on access to third-party payors’ formularies, or lists of products or treatments for which third-party payors provide coverage and reimbursement. Also, third-party payors are developing increasingly sophisticated methods of controlling healthcare costs. Coverage and reimbursements for therapeutic products can differ significantly from payor to payor. A third-party payors’ decision to provide coverage for a medical product or service does not imply that an adequate reimbursement rate will be approved. One third-party payor’s decision to cover a particular medical product or service does not assure that other payors will also provide coverage for the medical product or services, or to provide coverage at an adequate reimbursement rate. As a result, the coverage determination process will require us to provide scientific and clinical support for the use of or products to each payor separately, with no assurance that adequate coverage and reimbursement will be obtained.
在 美國和其他潛在重要市場,VAR 200、IC 100和我們尋求開發的任何其他候選產品, 政府當局和其他第三方支付方正在開發越來越複雜的控制醫療成本的方法。 例如,第三方支付方正試圖限制或規範醫療產品的價格,特別是新的和創新的 產品和療法的價格,這導致了平均銷售價格的下降。此外, 美國越來越重視管理式醫療保健,這將給產品定價、報銷和使用帶來額外壓力。這些壓力可能來自管理式醫療團體的規則和 實踐、司法決定以及與醫療保險、醫療補助和醫療保健改革有關的政府法律法規、藥品報銷政策和一般定價。
美國和一些外國司法管轄區已經頒佈或正在考慮多項立法和監管提案 ,旨在改變醫療保健體系,從而影響我們以盈利方式銷售產品的能力。在美國和其他地方的決策者和 支付者中,有很大的興趣促進醫療保健系統的變革,其目標是控制醫療保健成本、提高醫療質量和/或擴大醫療保健的可獲得性。在美國,製藥行業一直是這些努力的一個特別重點,並受到重大立法舉措的重大影響,包括2010年3月頒佈的《患者保護》 和《平價醫療法案》(ACA)。今後,可能會有其他與 美國醫療保健系統改革有關的提案,其中一些提案可能會進一步限制我們對產品的收費價格,或 產品的報銷金額。如果向 總務管理局聯邦供應計劃的授權用户提供藥品,則適用其他法律和要求。所有這些活動還可能受到 聯邦和州消費者保護和不正當競爭法的約束。
此外, 如果藥品由Medicare、Medicaid或其他聯邦或州醫療保健計劃報銷,我們和我們的業務活動, 包括但不限於我們的銷售、營銷和科學/教育補助計劃,必須遵守經 修訂的《虛假索賠法案》、經修訂的聯邦反回扣法令》、其他醫療保健欺詐和濫用法律以及類似的州法律。此外,如果 門診處方藥產品由Medicare或Medicaid報銷,定價和回扣計劃必須符合(如適用) 1990年綜合預算協調法案(經修訂)和2003年Medicare處方藥改進和現代化法案的Medicaid回扣要求。
其他 監管事項和合規要求
Manufacturing, sales, promotion and other activities following product approval are also subject to regulation by numerous regulatory authorities in addition to the FDA, including, in the United States, the Centers for Medicare & Medicaid Services (“CMS”), other divisions of the Department of Health and Human Services, the Drug Enforcement Administration, the Consumer Product Safety Commission, the Federal Trade Commission, the Occupational Safety & Health Administration, the Environmental Protection Agency, and state and local governments. Sales, marketing and scientific/educational programs must also comply with federal and state fraud and abuse laws. Pricing and rebate programs must comply with the Medicaid rebate requirements of the U.S. Omnibus Budget Reconciliation Act of 1990. If products are made available to authorized users of the Federal Supply Schedule of the General Services Administration, additional laws and requirements apply. The handling of any controlled substances must comply with the U.S. Controlled Substances Act and Controlled Substances Import and Export Act. Products must meet applicable child-resistant packaging requirements under the U.S. Poison Prevention Packaging Act. Manufacturing, sales, promotion and other activities are also potentially subject to federal and state consumer protection and unfair completion laws.
| 103 |
藥品分銷受到其他要求和法規的約束,包括廣泛的記錄保存、許可、存儲和安全要求,旨在防止未經授權銷售藥品。
ACA中的 聯邦醫師支付陽光法案及其實施條例要求某些藥物、 設備、生物和醫療用品製造商,如果根據醫療保險、醫療補助或兒童健康保險 計劃支付費用,(除某些例外情況外)報告與支付或分配給醫生和教學醫院的某些付款或其他價值轉移有關的信息,或應醫生和教學醫院的要求或代表醫生和教學醫院指定的實體或個人,並每年報告醫生及其直系親屬持有的某些所有權和投資權益。
此外,我們可能受到聯邦政府和我們開展業務所在州的數據隱私和安全法規的約束。 經《健康信息技術促進經濟和臨牀健康法》(“HITECH”)及其實施條例修訂的《1996年健康保險可攜帶性和責任法案》(“HIPAA”)對個人可識別健康信息的隱私、安全和傳輸提出了某些要求。除其他事項外,HITECH使 HIPAA的隱私和安全標準直接適用於“業務夥伴”--代表承保實體接收或獲取受保護健康信息以提供服務的獨立承包商或代理。HITECH還創建了四個新的民事罰款等級,修訂了HIPAA,使民事和刑事處罰 直接適用於商業夥伴和可能的其他人,並賦予州總檢察長新的權力,可以向聯邦法院提起民事訴訟,要求損害賠償或禁令,以執行聯邦HIPAA法律,並尋求與提起聯邦民事訴訟相關的律師費和費用。此外,州法律在某些情況下管理健康信息的隱私和安全, 其中許多法律在很大程度上彼此不同,可能不會產生相同的效果,從而使合規工作複雜化。例如,加利福尼亞州最近頒佈了《加州消費者隱私法》(California Consumer Privacy Act,簡稱CCPA),並於2020年1月1日生效。 CCPA除其他事項外,還為承保公司制定了新的數據隱私義務,併為加州居民提供了新的隱私權,包括選擇不披露其信息的權利。CCPA還創建了針對某些數據泄露的法定損害賠償的私人訴權 ,從而潛在地增加了與數據泄露相關的風險。
腐敗 法律
美國《反海外腐敗法》和類似的外國反腐敗法一般禁止公司及其中間人 為獲得 或保留業務或獲取不公平優勢而進行不正當付款或提供任何有價值的東西以不正當地影響外國政府官員。近年來,反腐敗法的全球執行量大幅增加 。我們預期的非美國業務和我們預期的擴展到美國以外的其他國家,包括髮展中國家,可能會增加此類違規行為的風險。違反這些法律可能導致嚴重的 刑事或民事制裁,可能擾亂我們的業務,並可能對我們的聲譽、業務和運營結果 或財務狀況造成不利影響。
國際藥物管制
我們在美國以外的任何司法管轄區銷售VAR 200、IC 100和我們尋求開發的任何其他候選產品之前, 我們必須在該司法管轄區獲得必要的上市許可。許多此類司法管轄區需要大量的安全性和有效性數據 ,類似於FDA在授予上市許可前要求的數據。我們可能無法成功獲得我們在美國境外尋求的營銷 授權。如果我們在一個司法管轄區(包括美國)成功獲得上市許可,則該授權並不確保我們將在任何其他司法管轄區獲得上市許可。 銷售藥品所需的授權因管轄區而異。如果我們在美國以外的任何司法管轄區獲得 上市批准,我們將遵守該司法管轄區的現行法規, 與我們在美國將遵守的現行法規一致。
| 104 |
國際 數據隱私和安全法
Certain non-U.S. laws, such as the GDPR govern the privacy and security of health information in certain circumstances, some of which are more stringent than HIPAA and many of which differ from each other in significant ways and may not have the same effect, thus complicating compliance efforts. Failure to comply with these laws, where applicable, can result in the imposition of significant civil and/or criminal penalties and private litigation. For example, in Europe, the GDPR went into effect in May 2018 and introduces strict requirements for processing the personal data of individuals within the EEA. The GDPR also increases the scrutiny of transfers of personal data from clinical trial sites located in the EEA to the United States and other jurisdictions that the European Commission does not recognize as having “adequate” data protection laws. Further, recent legal developments in Europe have created complexity and compliance uncertainty regarding certain transfers of information from the EEA to the United States. For example, on June 16, 2020, the Court of Justice of the European Union, or the CJEU, declared the EU-U.S. Privacy Shield framework, or the Privacy Shield, to be invalid. As a result, Privacy Shield is no longer a valid mechanism for transferring personal data from the EEA to the United States. Moreover, it is uncertain whether the standard contractual clauses will also be invalidated by the European courts or legislature, which seems possible given the rationale behind the CJEU’s concerns about U.S. law and practice on government surveillance. Companies that must comply with the GDPR face increased compliance obligations and risk, including more robust regulatory enforcement of data protection requirements and potential fines for noncompliance of up to €20 million or 4% of the annual global revenues of the noncompliant company, whichever is greater. Additionally, following the United Kingdom’s withdrawal from the European Union and the EEA, companies have to comply with the GDPR and the GDPR as incorporated into United Kingdom national law, the latter regime having the ability to separately fine up to the greater of £17.5 million or 4% of global turnover. The relationship between the United Kingdom and the European Union in relation to certain aspects of data protection law remains unclear, for example around how data can lawfully be transferred between each jurisdiction, which exposes us to further compliance risk. In Canada, PIPEDA and similar provincial laws impose obligations on companies with respect to processing personal information, including health-related information, and provides individuals certain rights with respect to such information, including the right to access and challenge the accuracy of their personal information held by an organization. Failure to comply with PIPEDA could result in significant fines and penalties.
屬性
於2019年1月18日,本公司就位於北商業園道2200 North Commerce Parkway,Suite 208,Weston 33326,簽訂約3,502平方尺寫字樓 訂立租賃協議(“租賃”)。租期為60個月,自2019年1月起至2024年1月止。我們相信,我們現有的設施足以滿足我們目前的需求,但可能需要額外的辦公空間 ,以滿足我們預期的員工擴展。
員工
截至2022年12月31日,我們擁有七(7)名全職員工 。我們的所有員工都從事行政、財務、研發、臨牀、監管和業務發展職能。我們相信我們與員工的關係很好。此外,我們利用並將繼續利用顧問、臨牀研究組織和第三方來執行我們的臨牀前研究、臨牀研究、製造和監管職能。
法律訴訟
我們 目前沒有參與任何重大法律訴訟,也沒有意識到會受到任何重大法律訴訟的影響。然而,我們可能不時成為我們日常業務過程中產生的各種法律訴訟的一方,這可能對我們的業務、 財務狀況或經營業績造成重大不利影響。無論結果如何,訴訟都可能因辯護和和解費用 、管理資源的轉移和其他因素而影響我們的業務。
企業信息
我們 是以“Larkspur Health Acquisition Corp.”的名稱註冊成立的。2021年3月17日,根據特拉華州法律,進行涉及一個或多個其他企業的合併、資本股票交換、資產收購、股票購買、重組或類似的企業合併。2022年12月12日,我們更名為 “ZyVersa治療公司”。與企業合併有關。
我們的主要執行辦公室位於北商業公園路2200North Commerce Parkway,Suit208,Weston,佛羅裏達州33326。我們的電話號碼是(754) 231-1688,我們的網址是https://www.zyversa.com.
| 105 |
管理層對財務狀況和結果的討論和分析
運營
除非 上下文另有規定,否則本節中所有提及的“我們”、“我們”或“我們”指的是業務合併前佛羅裏達州ZyVersa治療公司與特拉華州ZyVersa治療公司及其合併子公司在業務合併生效前的合併業務。
下面的討論和分析提供了管理層認為與評估和了解我們的 綜合運營結果和財務狀況相關的信息。您應將此討論和分析與本招股説明書中其他部分包含的合併財務報表和附註一起閲讀。 由於四捨五入,某些金額可能不足額。本討論和分析包含前瞻性陳述,涉及許多風險和不確定因素,包括但不限於“風險因素”和“關於前瞻性陳述的告誡陳述”中描述的風險和不確定性。我們沒有義務更新這些前瞻性陳述中的任何一項。實際的 結果可能與任何前瞻性陳述中包含的結果大不相同。
業務 概述
我們是一家臨牀階段的專業生物製藥公司,利用先進的專利技術為腎臟 或炎症性疾病患者開發一流的藥物,這些患者的醫療需求尚未得到滿足。
我們的主要腎臟藥物 ,我們稱之為膽固醇外流調節劑TMVAR200(2-羥丙基-β-環糊精或“2HPβCD”)具有治療多種腎臟疾病的潛力。我們的主要抗炎藥候選藥物,我們將其稱為Inflammasome ASC抑制劑IC 100,是一種人源化的單抗IgG4抗體炎症體ASC抑制劑,靶向ASC,具有治療多種炎症性疾病的潛力。
業務合併
於2022年12月12日(“截止日期”),吾等根據該業務合併協議(“業務合併協議”)的條款完成先前公佈的業務合併,由ZyVersa治療公司、佛羅裏達州的ZyVersa治療公司(“Old ZyVersa”)、其中指定的Old ZyVersa股東代表(“證券持有人代表”)、特拉華州的Larkspur Health Acquisition Corp.(“Larkspur”)及Larkspur的全資附屬公司Larkspur Merge Sub,Inc.(“合併子公司”)完成先前公佈的業務合併。根據業務合併協議的條款(以及在業務合併協議的所有其他條件得到滿足或放棄時),於業務合併及擬進行的交易(“業務合併”)的截止日期,(I)Larkspur更名為“ZyVersa Treateutics, Inc.”,特拉華州的一家公司(“該公司”)及(Ii)與Old ZyVersa合併並併入Old ZyVersa(“合併”)的合併子公司, 與Old ZyVersa合併為合併中的倖存公司,並在實施該合併後,Old ZyVersa成為本公司的全資附屬公司(統稱為“繼承人”)。
在業務合併完成之前,Larkspur於2021年3月17日在特拉華州註冊成立,ZyVersa Treateutics,Inc.(前身) 於2014年3月11日作為Variant PharmPharmticals,Inc.在佛羅裏達州註冊成立。Merge Sub於2022年7月13日在特拉華州註冊。提及“公司”或ZyVersa時,指的是截至2023年9月30日的三個月和九個月的繼任者,指的是截至2022年9月30日的三個月和九個月的前任。
| 106 |
財務 運營概述
我們 到目前為止沒有產生任何收入,並出現了嚴重的運營虧損。我們在2023年1月1日至2023年9月30日(後繼期)期間的淨虧損為8,500萬美元,從2022年1月1日至2022年9月30日(前繼期)的淨虧損為940萬美元。截至2023年9月30日,我們的累計赤字約為8990萬美元,現金為160萬美元。我們預計在可預見的未來將繼續產生鉅額費用和運營虧損 。我們預計我們與持續活動相關的費用將增加,因為我們:
| ● | VAR 200和IC 100的開發進展; | |
| ● | 準備 並提交監管提交; | |
| ● | 生產我們用於臨牀試驗的候選產品; | |
| ● | 聘請額外的研發、財務、一般和行政人員; | |
| ● | 保護 保護我們的知識產權;以及 | |
| ● | 滿足 成為上市公司的要求。 |
我們 需要額外的資金來支持我們的持續運營。我們正在尋求通過公共或私募股權或債務融資或其他來源為我們的運營提供資金,其中可能包括政府撥款和與第三方的合作。我們可能無法以可接受的條款獲得足夠的額外融資 ,或者根本無法獲得。我們未能在需要時籌集資金,將對我們的財務狀況、執行業務戰略的能力和持續經營的能力產生負面影響 。我們將需要籌集大量資金以繼續我們的研發目標並創造收入以實現盈利,但我們可能永遠不會這樣做 。
經營成果的組成部分
收入
自 成立以來,我們沒有產生任何收入,預計在不久的將來也不會從產品銷售中產生任何收入。如果我們針對候選產品的開發工作取得成功並獲得監管部門的批准,或者如果我們與第三方簽訂了 協作或許可協議,我們未來可能會從產品銷售 或協作或許可協議付款的組合中獲得收入。
運營費用
研究和開發費用
研究和開發費用包括髮現和開發我們的候選產品所產生的成本,主要包括:
| ● | 根據與合同研究組織(“CRO”)和研究地點簽訂的第三方協議而發生的費用,進行或將進行我們的臨牀試驗和部分臨牀前活動的費用; | |
| ● | 原材料成本,以及我們用於臨牀試驗和其他開發測試的材料的製造成本; | |
| ● | 費用,包括從事研究和開發活動的僱員的工資、股票薪酬和福利; | |
| ● | 設備成本、折舊和其他分攤費用;以及 | |
| ● | 為合同監管服務支付的費用 以及支付給包括美國食品和藥物管理局在內的監管機構的費用 以審查和批准我們的候選產品。 |
| 107 |
我們 將研發費用按發生時支付。外部開發活動的成本根據 使用供應商提供給我們的信息對完成特定任務的進度進行的評估確認。這些活動的付款 基於個別協議的條款,可能與發生的成本模式不同,並在我們的財務報表中 反映為預付費用或應計費用。
研究 和開發活動是我們商業模式的核心。我們預計,在可預見的將來,我們的研發費用將繼續增加 ,因為我們將繼續為候選產品進行臨牀開發。隨着產品進入臨牀開發的後期階段 ,它們的開發成本通常高於臨牀開發早期階段的產品,這主要是由於 後期臨牀試驗的規模和持續時間的增加。從歷史上看,我們的研發成本主要與VAR 200和IC 100的開發有關。隨着我們推進VAR 200和IC 100,以及確定任何其他潛在候選產品, 我們將繼續將我們的直接外部研發成本分配給產品。我們希望從我們的當前現金和現金等價物以及任何未來股權或債務融資或其他資本來源(包括與其他公司的潛在合作或其他戰略交易)中為我們的研發費用提供資金。
我們候選產品的成功開發具有很大的不確定性。目前,我們無法合理估計或瞭解完成剩餘開發所需的工作的性質、 時間和成本,或者何時(如果有的話),我們的候選產品可能會開始實質性的 現金淨流入。這種不確定性是由於與 臨牀試驗的持續時間和成本相關的許多風險和不確定性,這些風險和不確定性在項目的整個生命週期中因許多因素而顯著不同,包括:
| ● | 納入臨牀試驗的臨牀地點數量; | |
| ● | 招收合適的患者所需的時間長度; | |
| ● | 參與臨牀試驗的患者羣體大小; | |
| ● | 患者接受的劑量數; | |
| ● | 患者隨訪的持續時間; | |
| ● | 候選產品的開發狀況;以及 | |
| ● | 候選產品的有效性和安全性。 |
我們的 支出還受到其他不確定因素的影響,包括監管批准的條款和時間,以及提交、起訴、辯護和執行任何專利主張或其他知識產權的費用。我們可能永遠無法成功獲得監管部門 對我們的候選產品的批准。我們可能會從臨牀試驗中獲得意想不到的結果。我們可以選擇停止、延遲或 修改候選產品的臨牀試驗。與 候選產品開發相關的這些變量的結果發生變化,可能意味着與該候選產品開發相關的成本和時間發生重大變化。 例如,如果FDA或其他監管機構要求我們進行超出我們當前 預期的臨牀試驗,或者如果我們在任何臨牀試驗中出現了嚴重的入組延遲,我們可能需要花費大量 額外的財政資源和時間來完成臨牀開發。產品商業化將需要數年時間 ,開發成本可能高達數百萬美元。
一般費用 和管理費用
一般 和管理費用主要包括行政、 和財務職能部門員工的工資、基於股票的薪酬和相關成本。一般和管理費用還包括法律、會計、審計、税務 和諮詢服務、保險、人力資源、信息技術、辦公室和差旅費用的專業費用。
我們 預計,隨着我們增加一般和行政人員數量,我們的一般和行政費用將在未來增加 ,以支持我們的持續研發和候選產品的潛在商業化。我們還預計將產生 與上市公司相關的費用增加,包括會計、審計、法律、監管和税務合規 服務、董事和高級管理人員保險以及投資者和公共關係成本。
其他 (收入)支出
利息 支出包括與無擔保可轉換本票相關的債務利息和債務折價的增加,該票據的年利率為6%。
衍生負債的公允價值變動 代表我們的衍生負債定期按市價計價。本公司記錄於發行時按公允價值計量的衍生負債,涉及若干應付可轉換票據的贖回特徵及認沽期權 。
| 108 |
運營結果
截至2023年9月30日(後繼期)的三個月與截至2022年9月30日(前續期)的三個月的比較
下表彙總了我們在截至2023年9月30日的三個月的後續業務和截至2022年9月30日的三個月的業務業績。
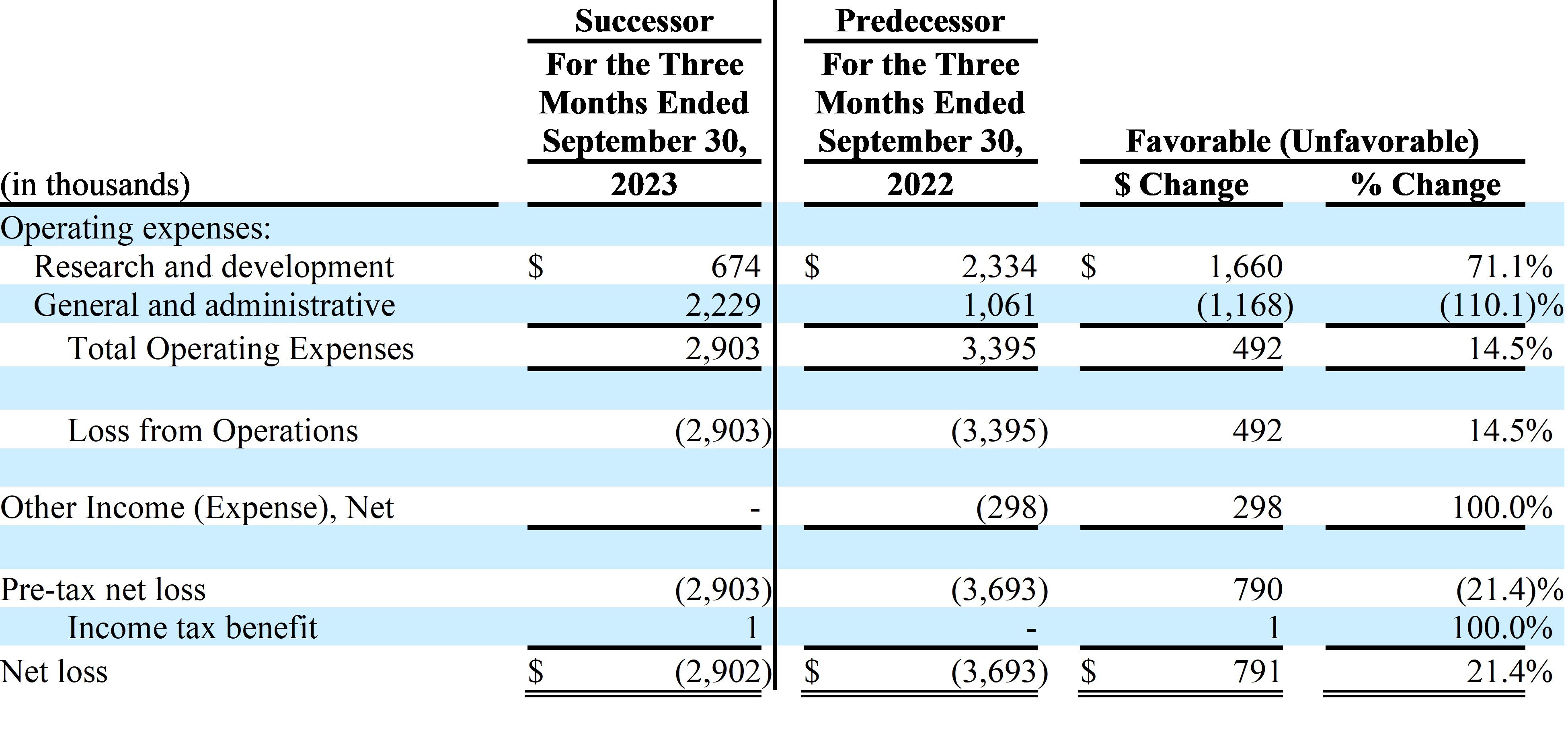
研究和開發費用
截至2023年9月30日的三個月,研究和開發費用為70萬美元,比截至2022年9月30日的三個月減少170萬美元,降幅為71.1%。這主要是由於截至2022年9月30日的三個月,IC 100材料的製造成本減少了170萬美元。
一般費用 和管理費用
截至2023年9月30日的三個月,一般和行政費用為220萬美元,比截至2022年9月30日的三個月增加了120萬美元或110.1%。這一增長主要歸因於與上市公司相關的專業費用增加了40萬美元 ,董事和高管保險增加了30萬美元,獎金 應計項目增加了20萬美元,以及投資者和公關營銷成本增加了10萬美元。
其他收入(費用)
截至2023年9月30日的三個月,淨其他收入(支出)總額為零,比截至2022年9月30日的三個月減少了30萬美元,降幅為100.0%。這一變動主要是由於利息減少以及由於可轉換債務轉換為股權而導致的衍生負債支出公允價值變動總額約為30萬美元所致。
截至2023年9月30日(後繼期)的9個月與截至2022年9月30日(前繼期)的9個月的比較
下表彙總了截至2023年9月30日的9個月的後續業務和截至2022年9月30日的9個月的業務結果。
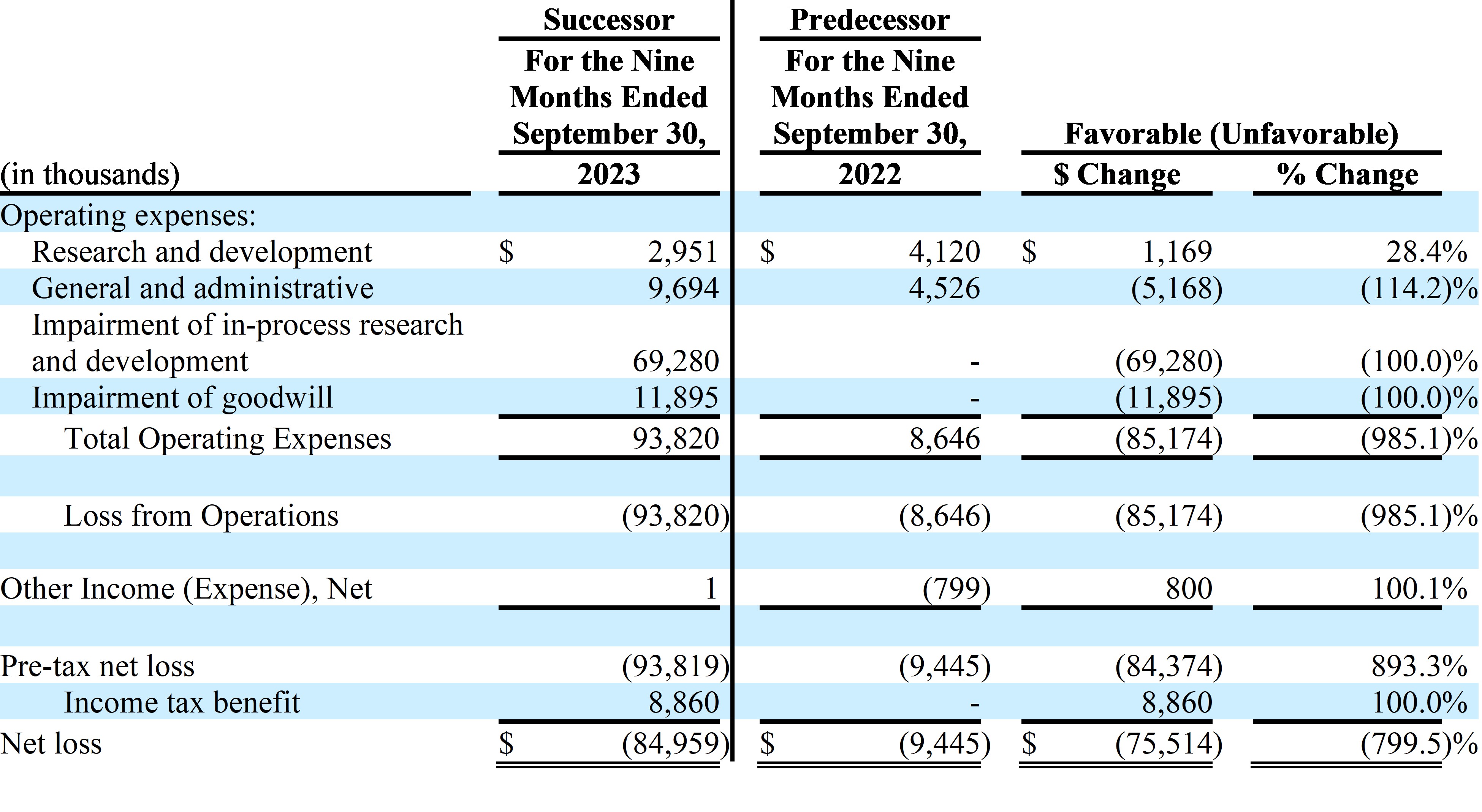
研究和開發費用
截至2023年9月30日的9個月,研發費用為300萬美元,比截至2022年9月30日的9個月減少了120萬美元,降幅為28.4%。這一減少主要是由於IC 100的製造材料成本減少了約200萬美元。藥品製造、配方和臨牀前操作成本增加了約80萬美元,部分抵消了這一增長。
一般和行政費用
截至2023年9月30日的9個月,一般和行政費用為970萬美元,比截至2022年9月30日的9個月增加了520萬美元或114.2%。這一增長主要是由於與上市公司相關的專業費用增加了250萬美元,投資者和公關營銷成本增加了110萬美元,董事和高管保險增加了100萬美元,以及2023年因與PIPE股份相關的效力失效而支付的款項增加了40萬美元。
正在進行的研發和商譽減值
正在進行中的研發減值和商譽減值分別為6930萬美元和1190萬美元,而截至2022年9月30日的9個月為零。減值是由於我們的股票價格下跌以及由此導致的公司在2023年6月30日的市值 。
其他(收入)支出
截至2023年9月30日的九個月,淨其他收入(支出)為1,000美元,與截至2022年9月30日的九個月相比,支出減少了80萬美元,降幅為100.1%。這一變化是由於利息支出減少了約40萬美元,以及衍生債務公允價值變化導致的虧損減少了40萬美元,兩者都是由於可轉換債務轉換為股權造成的。
| 109 |
現金流
下表彙總了截至2023年9月30日的9個月的後繼者和截至2022年9月30日的9個月的前繼者的運營和融資活動的現金流:

經營活動的現金流
截至2023年9月30日和2022年9月30日的9個月,經營活動中使用的現金淨額分別為590萬美元和110萬美元。 截至2023年9月30日和2022年9月30日的9個月,經營活動中使用的現金淨額主要歸因於分別約8,500萬美元和940萬美元的淨虧損,分別被7500萬美元和360萬美元的非現金支出淨額和約400萬美元和480萬美元的淨虧損所抵消。經營資產和負債水平所產生的現金。
淨額 融資活動提供的現金
截至2023年9月30日和2022年9月30日的9個月,融資活動提供的現金淨額分別為160萬美元和140萬美元。 截至2023年9月30日的9個月,融資活動提供的現金主要包括通過公開發行普通股獲得的1,310萬美元現金收益和通過認股權證激勵要約獲得的100萬美元行使收益。這被與普通股發行相關的180萬美元註冊和發行成本以及贖回A系列優先股所支付的1070萬美元現金所抵消。在截至2022年9月30日的9個月中,融資活動提供的現金是通過非公開配售發行優先股獲得的140萬美元。
流動性 與資本資源
下表彙總了我們在2023年9月30日和2022年12月31日的流動資產、流動負債和營運資本缺口總額:

自2014年成立至2023年9月30日,我們沒有產生任何收入,並且出現了嚴重的運營虧損和運營現金流為負的情況。根據我們目前的運營計劃,我們已經限制了我們的研發支出,我們預計截至2023年9月30日的160萬美元現金僅足以支付我們的運營費用和資本支出 按月計算的需求。然而,在獲得FDA批准之前,很難預測我們在候選產品上的支出。此外,不斷變化的情況可能會導致我們花費現金的速度遠遠快於我們目前的預期,而且由於我們無法控制的情況,我們 可能需要花費比當前預期更多的現金。
正在進行 關注
自2014年成立至2023年9月30日,我們沒有產生任何收入,並且出現了嚴重的運營虧損和運營現金流為負的情況。根據我們目前的運營計劃,我們已經限制了我們的研發支出,我們預計截至2023年9月30日的160萬美元現金僅足以支付我們的運營費用和資本支出 按月計算的需求。然而,在獲得FDA批准之前,很難預測我們在候選產品上的支出。此外,不斷變化的情況可能會導致我們花費現金的速度遠遠快於我們目前的預期,而且由於我們無法控制的情況,我們 可能需要花費比當前預期更多的現金。
合同義務
以下 彙總了我們截至2023年9月30日的合同義務,這些義務將影響我們未來的流動性。根據我們目前的運營計劃,我們計劃從目前的現金餘額和未來的融資中履行以下確定的義務。
現金 截至2023年9月30日,我們的流動負債所需現金包括約1,170萬美元的應付帳款、應計費用、 和我們的經營租賃負債。
未來資本需求
我們 打算在短期內籌集更多資金,以履行我們目前的債務,併為我們的日常運營和當前的 債務提供資金。
我們 預計在後續發行中通過發行股權或與股權掛鈎的證券來籌集額外資本。如果我們無法通過以對我們有利的條款發行股權或股權掛鈎證券來籌集額外資本,我們可能沒有足夠的流動性來執行我們的業務 戰略。我們有各種可為我們的普通股行使的未清償認股權證,其中許多必須行使,以換取該等認股權證持有人向我們支付的現金。如果我們普通股的市場價格低於持有者認股權證的行權價格,持股人不太可能行使認股權證。因此,根據我們普通股的當前市場價格和該等認股權證的行使價,我們預計近期內不會因行使我們的大部分認股權證而獲得重大收益。
我們的 政策是將任何超出我們當前需求的現金投資於旨在保持本金餘額和提供流動性的投資,同時產生適度的投資回報。因此,我們的現金等價物將主要投資於貨幣市場基金,在當前的利率環境下,這些基金目前只提供最低迴報。
我們 預計至少在未來幾年內,隨着我們繼續開發我們的候選產品並尋求市場批准,並在獲得批准後最終將我們的產品 商業化,我們將繼續招致大量的額外運營虧損。如果我們的候選產品獲得市場批准,我們將產生大量的銷售、營銷和外包製造費用 。此外,我們預計會產生額外費用來增加運營、財務和信息系統以及人員,包括支持我們計劃的產品商業化努力的人員。我們還預計在遵守適用於我們作為上市公司的公司治理、內部控制和類似要求方面會產生鉅額成本。
| 110 |
經營成果
截至2022年12月31日的年度與2021年12月31日的年度比較
下表彙總了我們在2022年12月13日至2022年12月31日期間的後續業務、在2022年1月1日至2022年12月12日期間以及截至2021年12月31日的前一年的運營結果:
| 繼任者 | 前身 | |||||||||||
| 對於 期間 | 對於 期間 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| (單位:千) | 2022 | 2022 | 2021 | |||||||||
| 運營費用 : | ||||||||||||
| 研發 | $ | 400 | $ | 5,408 | $ | 2,124 | ||||||
| 常規 和管理 | 420 | 7,605 | 5,580 | |||||||||
| 總計 運營費用 | 820 | 13,013 | 7,704 | |||||||||
| 總計 經營虧損 | (820 | ) | (13,013 | ) | (7,704 | ) | ||||||
| 其他 收入(),淨 | - | 1,035 | 380 | |||||||||
| 淨 除所得税前虧損 | (820 | ) | (14,048 | ) | (8,084 | ) | ||||||
| 收入 税收優惠 | 745 | - | - | |||||||||
| 淨虧損 | $ | (75 | ) | $ | (14,048 | ) | $ | (8,084 | ) | |||
| 111 |
研發費用
下表總結了 我們在2022年12月13日至2022年12月31日期間為繼任者以及在2022年1月1日至2022年12月12日期間為前任者 以及截至2021年12月31日的年度的研發費用:
| 繼任者 | 前身 | |||||||||||
| 對於 期間 | 對於 期間 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| (單位:千) | 2022 | 2022 | 2021 | |||||||||
| 研發 | ||||||||||||
| 人事費用 | $ | 31 | $ | 1,045 | $ | 1,306 | ||||||
| 臨牀 手術 | ||||||||||||
| VAR200 | - | (100 | ) | 259 | ||||||||
| 臨牀前操作 | ||||||||||||
| IC100 | - | 60 | 161 | |||||||||
| 藥品 生產和配方 | ||||||||||||
| VAR200 | 1 | 27 | 25 | |||||||||
| IC100 | 322 | 3,934 | 144 | |||||||||
| 其他 成本 | ||||||||||||
| VAR200 | 36 | 314 | 215 | |||||||||
| IC100 | 10 | 128 | 14 | |||||||||
| 研發總額 | $ | 400 | $ | 5,408 | $ | 2,124 | ||||||
從2022年12月13日至2022年12月31日的後續期間的研發費用為40萬美元,從2022年1月1日至2022年12月12日的前一段時間的研發費用為540萬美元。截至2022年12月31日的合併年度的研發費用為580萬美元,比截至2021年12月31日的前一年的210萬美元增加370萬美元或173.4%。 研發費用的增加是由於批量製造分析服務和製造材料供應的支出總體增加。
從2022年12月13日至2022年12月31日的後續期間的人事費用為31 000美元,從2022年1月1日至2022年12月12日的前一期間的人事費用為100萬美元。截至2022年12月31日的合併年度的人事支出為110萬美元,較截至2021年12月31日的前一年的130萬美元減少20萬美元或17.6%。人事費用減少的主要原因是,前一年授予立即歸屬的諮詢人的期權的股票薪酬減少。
| 112 |
從2022年12月13日至2022年12月31日的後續期間的臨牀手術費用為0美元,從2022年1月1日至2022年12月12日的前一期間的臨牀手術費用為(10萬美元)。截至2022年12月31日的合併年度的臨牀手術為(10萬美元) ,比截至2021年12月31日的前一年的30萬美元減少了40萬美元或138.6%。臨牀業務減少的主要原因是一家供應商對因新冠肺炎疫情而未完成的工作獲得了信用。
從2022年12月13日至2022年12月31日的後續期間的臨牀前 操作為0美元,從2022年1月1日至2022年12月12日的前一期間的臨牀前 操作為60,000美元。截至2022年12月31日的合併年度的臨牀前手術為6萬美元,比截至2021年12月31日的前一年的16.1萬美元減少了10.6萬美元或62.7%。 減少是由於截至2022年12月31日的年度內藥品支出微乎其微所致。
從2022年12月13日至2022年12月31日的後續期間的藥物製造和配方費用為40萬美元,從2022年1月1日至2022年12月12日的前一期間的費用為400萬美元。截至2022年12月31日的合併年度的藥品製造和配方為430萬美元,比截至2021年12月31日的前一年的20萬美元增加了410萬美元或2436.1%。這一增長是由於為預期的批量製造購買了260萬美元的材料,併為批量製造和分析服務購買了150萬美元。
從2022年12月13日到2022年12月31日的後續期間的其他研發成本為46,000美元,從2022年1月1日到2022年12月31日的前一期間的其他研發成本為442,000美元。截至2022年12月31日的合併年度的其他研發成本為48.8萬美元,比截至2021年12月31日的前一年的22.9萬美元增加了25.9萬美元或113.1%。增長是由諮詢服務推動的。
一般費用和管理費用
下表彙總了2022年12月13日至2022年12月31日期間繼任者以及2022年1月1日至2022年12月12日期間以及截至2021年12月31日的前一年的一般和行政費用:
| 繼任者 | 前身 | |||||||||||
| 在該期間內 | 在該期間內 | 這一年的 | ||||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||||
| 十二月三十一日, | 12月12日, | 十二月三十一日, | ||||||||||
| (單位:千) | 2022 | 2022 | 2021 | |||||||||
| 一般和行政部門: | ||||||||||||
| 人員費用 | $ | 138 | $ | 4,150 | $ | 4,474 | ||||||
| 交易成本 | 63 | 2,088 | - | |||||||||
| 律師費和律師費 | 100 | 887 | 639 | |||||||||
| 房租費用 | 8 | 149 | 148 | |||||||||
| 其他 | 111 | 331 | 319 | |||||||||
| 一般和行政合計 | $ | 420 | $ | 7,605 | $ | 5,580 | ||||||
從2022年12月13日到2022年12月31日的後續期間的一般和行政費用為40萬美元,而從2022年1月1日到2022年12月12日的前一期間的一般和行政費用為760萬美元。截至2022年12月31日的合併年度的一般和行政費用為800萬美元,比截至2021年12月31日的前一年的560萬美元增加了240萬美元或43.8%。
從2022年12月13日至2022年12月31日的後續期間的人事費用為 10萬美元,從2022年1月1日至2022年12月12日的前一期間的人事費用為420萬美元。截至2022年12月31日的合併年度的人事支出為430萬美元,比截至2021年12月31日的前一年的450萬美元減少了20萬美元或4.1%。人事費用減少的主要原因是,由於2022年授予的期權減少,股票薪酬減少。
從2022年12月13日至2022年12月31日的後續期間的交易成本為100萬美元,而從2022年1月1日至2022年12月12日的前一期間的交易成本為210萬美元。截至2022年12月31日的合併年度的交易成本為220萬美元,而截至2021年12月31日的前一年的交易成本為零。交易成本的增加與業務合併的準備工作直接相關。
從2022年12月13日到2022年12月31日的後續期間的法律和專業費用 為10萬美元,從2022年1月1日到2022年12月12日的前一段時間的法律和專業費用為90萬美元。截至2022年12月31日的合併年度的法律和專業費用為100萬美元,較截至2021年12月31日的前一年的60萬美元增加40萬美元或54.4%。 法律和專業費用的增加是由於與交易沒有直接關係的業務合併費用。
| 113 |
從2022年12月13日至2022年12月31日的後續期間的租金費用為8 000美元 ,從2022年1月1日至2022年12月12日的前一期間的租金費用為149 000美元。截至2022年12月31日的合併年度的租金支出為15.7萬美元,比截至2021年12月31日的前一年的14.8萬美元增加了9000美元或6.1%。這一增長是由公共區域收費的增長 推動的。
從2022年12月13日至2022年12月31日的後續期間的其他一般和行政費用為10萬美元,從2022年1月1日至2022年12月12日的前一期間的其他一般和行政費用為30萬美元。截至2022年12月31日的合併年度的其他一般和行政費用為40萬美元,比截至2021年12月31日的前一年的30萬美元增加了10萬美元或38.5%。其他費用的增加主要是因為董事和官員保險增加了5萬美元 ,投資者和公關費用增加了大約5萬美元。
其他 (收入)費用
下表彙總了2022年12月13日至2022年12月31日期間繼任者的其他(收入)支出,以及2022年1月1日至2022年12月12日期間以及截至2021年12月31日的年度的前繼者的其他(收入)支出:
| 繼任者 | 前身 | |||||||||||
| 在該期間內 | 在該期間內 | 這一年的 | ||||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||||
| 十二月三十一日, | 12月12日, | 十二月三十一日, | ||||||||||
| (單位:千) | 2022 | 2022 | 2021 | |||||||||
| 其他費用 | ||||||||||||
| 利息支出 | $ | - | $ | 428 | $ | 821 | ||||||
| 衍生負債的公允價值變動 | - | 607 | (228 | ) | ||||||||
| 獲得PPP貸款的寬免權 | - | - | (213 | ) | ||||||||
| 其他費用合計(淨額) | $ | - | $ | 1,035 | $ | 380 | ||||||
從2022年12月13日至2022年12月31日的後續期間的總其他費用淨額為0美元,而從2022年1月1日至2022年12月12日的前一期間淨額為100萬美元。截至2022年12月31日的合併年度的其他支出淨額為100萬美元,較截至2021年12月31日的前一年的40萬美元增加60萬美元或172.4%。這一變動是 由於可轉換債務轉換導致利息支出減少約40萬美元所致,但被衍生債務公允價值變化增加的虧損40萬美元和2021年購買力平價貸款豁免收益約(20萬美元)所抵消。
現金流
下表彙總了2022年12月13日至2022年12月31日期間、2022年1月1日至2022年12月12日期間以及截至2021年12月31日的前一年的運營和融資活動的現金流:
| 繼任者 | 前身 | |||||||||||
| 對於 期間 | 對於 期間 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| (單位:千) | 2022 | 2022 | 2021 | |||||||||
| 淨額 提供的現金(用於) | ||||||||||||
| 操作 活動 | $ | (3,394 | ) | $ | (1,495 | ) | $ | (5,076 | ) | |||
| 為 活動提供資金 | - | 1,865 | 5,230 | |||||||||
經營活動的現金流
2022年12月13日至2022年12月31日的後續期間經營活動中使用的現金淨額為340萬美元,2022年1月1日至2022年12月12日期間的前一期間為150萬美元。 截至2022年12月31日的合併年度的經營活動中使用的現金淨額為490萬美元,較截至2021年12月31日的前一年的510萬美元減少20萬美元或 3.7%。在截至2022年12月31日的合併年度和截至2021年12月31日的年度,用於經營活動的現金淨額主要是由於分別淨虧損約1,410萬美元和810萬美元,分別被360萬美元和400萬美元的非現金淨支出抵消,以及分別由運營資產和負債水平產生的現金約560萬美元和(用於) 的現金約100萬美元。
| 114 |
淨額 融資活動提供的現金
從2022年12月13日到2022年12月31日,融資活動提供的淨現金為0美元,從2022年1月1日到2022年12月12日,融資活動提供的現金淨額為190萬美元。 截至2022年12月31日的合併年度,融資活動提供的現金淨額為190萬美元,比截至2021年12月31日的前一年的520萬美元減少330萬美元 或64.3%。在截至2022年12月31日的年度內,融資活動提供的現金為發行優先股的收益。在截至2021年12月31日的年度內,我們從發行可轉換債券中獲得520萬美元。
流動性 與資本資源
下表彙總了我們在2022年12月31日和2021年12月31日的流動資產、負債和營運資本缺口總額。 :
| 繼任者 | 前身 | |||||||
| 12月31日, | 12月31日, | |||||||
| (單位:千) | 2022 | 2021 | ||||||
| 當前資產 | $ | 6,363 | $ | 812 | ||||
| 流動負債 | $ | 8,188 | $ | 13,626 | ||||
| 營運資金不足 | $ | (1,825 | ) | $ | (12,814 | ) | ||
自2014年成立至2022年12月31日,我們沒有產生任何收入,並且發生了嚴重的運營虧損和運營現金流為負。根據我們目前的運營計劃,我們預計截至2022年12月31日我們的現金為590萬美元,僅夠支付我們按月計算的運營費用和資本支出要求。 然而,在獲得FDA批准之前,很難預測我們在候選產品上的支出。此外,不斷變化的環境 可能會導致我們花費現金的速度遠遠快於我們目前的預期,而且由於我們無法控制的情況,我們可能需要花費比當前預期更多的現金 。
正在進行 關注
自 成立以來,我們一直從事組織活動,包括籌集資金和研發活動。我們 尚未產生收入,尚未實現盈利運營,也從未從運營中產生正現金流。 不能保證盈利運營即使實現,也能持續下去。我們面臨着與任何臨牀前階段的製藥公司相關的風險,這些公司在研發方面投入了大量資金。 不能保證我們的研發項目會成功,不能保證開發的產品會獲得必要的監管批准,也不能保證任何批准的產品在商業上是可行的。此外,我們在技術快速變化的環境中運營,並在很大程度上依賴於員工和顧問的服務。此外,我們未來的運營取決於公司籌集額外資本的努力是否成功。這些不確定性使人對我們是否有能力在財務報表發佈日期後繼續作為一家持續經營的企業持續12個月提出了極大的懷疑。所附財務報表 是以持續經營為基礎編制的。財務報表不包括任何調整,以反映因公司可能無法繼續經營而可能對資產的可回收性和分類或負債的金額和分類造成的未來可能影響 公司計劃在正常業務過程中繼續經營、變現資產和清算負債。截至2022年12月31日的財年,我們共虧損1,410萬美元,截至2021年12月31日的財年淨虧損810萬美元,截至2022年12月31日,我們的累計赤字為490萬美元。我們預計會遭受更多損失,直到我們可以從目前正在開發的候選產品中獲得可觀的收入為止。我們的主要資金來源 一直是發行債務和股權證券。我們認為,目前的現金僅足以按月為運營和資本需求提供資金。我們將需要額外的資金來為我們的運營提供資金,完成 的開發,並將我們的候選產品進行商業開發。不能保證在需要時或按可接受的條款提供此類融資。
| 115 |
合同義務
以下 彙總了我們截至2022年12月31日的合同義務,這些義務將影響我們未來的流動性。根據我們目前的運營計劃,我們計劃從目前的現金餘額和未來的融資中履行以下確定的義務。
截至2022年12月31日,我們當前負債的現金需求包括約820萬美元的應付帳款和應計費用。 截至2022年12月31日,長期負債沒有現金需求。
企業合併後的資本需求
我們打算在未來籌集更多資金,為我們的運營和VAR200和IC100的持續開發提供資金。
我們預計在後續發行中通過發行股權或與股權掛鈎的證券來籌集額外資本。如果我們無法通過以對我們有利的條款發行股權或股權掛鈎證券來籌集額外資本,我們可能沒有足夠的流動性來執行我們的業務戰略。我們 有各種可為我們的普通股行使的未清償認股權證,其中許多必須行使,以換取該等認股權證持有人向我們支付的現金。如果我們普通股的市場價格低於持有人認股權證的行權價格,則持有人不太可能行使其認股權證。因此,根據我們普通股的當前市場價格和該等認股權證的行使價格,我們預計短期內不會從行使我們的大部分認股權證中獲得重大收益 。
我們的政策是將任何超出我們當前需求的現金投資於旨在保持本金餘額和提供流動性的投資,同時產生適度的投資回報。因此,我們的現金等價物將主要投資於貨幣市場基金,鑑於目前的利率環境,這些基金目前只提供最低迴報。
我們 預計至少在未來幾年內,隨着我們繼續開發我們的候選產品並尋求市場批准,並在獲得批准後最終將我們的產品 商業化,我們將繼續招致大量的額外運營虧損。如果我們的候選產品獲得市場批准,我們將產生大量的銷售、營銷和外包製造費用 。此外,我們預計會產生額外費用來增加運營、財務和信息系統以及人員,包括支持我們計劃的產品商業化努力的人員。我們還預計在遵守適用於我們作為上市公司的公司治理、內部控制和類似要求方面會產生鉅額成本。
我們 未來運營現金和資本需求的使用將取決於許多前瞻性因素,包括:
| ● | 我們候選產品的臨牀試驗的啟動、進度、時間、成本和結果; | |
| ● | 我們為每個候選產品制定的臨牀開發計劃; | |
| ● | 我們開發或可能獲得許可的候選產品的數量和特徵; | |
| ● | 我們可能選擇執行的任何協作協議的條款; | |
| ● | 滿足FDA或其他類似外國監管機構制定的監管要求的結果、時間和成本; | |
| ● | 提交、起訴、辯護和執行我們的專利主張和其他知識產權的費用; | |
| ● | 為知識產權糾紛辯護的費用,包括第三方對我們提起的專利侵權訴訟; | |
| ● | 實施商業規模製造活動的成本和時間;以及 | |
| ● | 在我們選擇自己將產品商業化的地區,為我們可能獲得監管批准的任何候選產品建立或外包銷售、營銷和分銷能力的成本 。 |
| 116 |
To continue to grow our business over the longer term, we plan to commit substantial resources to research and development, clinical trials of our product candidates, and other operations and potential product acquisitions and in-licensing. We have evaluated and expect to continue to evaluate a wide array of strategic transactions as part of our plan to acquire or in-license and develop additional products and product candidates to augment our internal development pipeline. Strategic transaction opportunities that we may pursue could materially affect our liquidity and capital resources and may require us to incur additional indebtedness, seek equity capital or both. In addition, we may pursue development, acquisition or in-licensing of approved or development products in new or existing therapeutic areas or continue the expansion of our existing operations. Accordingly, we expect to continue to opportunistically seek access to additional capital to license or acquire additional products, product candidates or companies to expand our operations, or for general corporate purposes. Strategic transactions may require us to raise additional capital through one or more public or private debt or equity financings or could be structured as a collaboration or partnering arrangement. We have no arrangements, agreements, or understandings in place at the present time to enter into any acquisition, in-licensing or similar strategic business transaction. In addition, we continue to evaluate commercial collaborations and strategic relationships with established pharmaceutical companies, which would provide us with more immediate access to marketing, sales, market access and distribution infrastructure.
如果我們通過發行股權證券籌集額外資金,我們的股東將受到稀釋。債務融資如果可行, 將導致固定支付義務增加,並可能涉及一些協議,其中包括限制或限制我們採取特定行動的能力的契約,例如招致額外債務、進行資本支出或宣佈股息。我們籌集的任何債務融資或額外的 股權可能包含對我們或我們的現有股東不利的條款,如清算和其他優惠。 如果我們通過與第三方的合作和許可安排籌集額外資金,可能需要放棄對我們的技術、未來收入流或候選產品的寶貴 權利,或者以可能對我們不利的條款授予許可證 。
職位 會計選舉法案
ZyVersa是一家“新興成長型公司”,根據2012年的JumpStart Our Business Startups Act或JOBS Act的定義。JOBS法案允許具有新興成長型公司地位的公司 利用延長的過渡期遵守新的或修訂的會計準則, 推遲採用這些會計準則,直到它們適用於私營公司。ZyVersa希望利用這一延長的過渡期,使其能夠遵守新的或修訂的會計準則,這些會計準則對上市公司和私營公司具有不同的生效日期,直到公司(1)不再是新興成長型公司或(2)明確且 不可撤銷地選擇退出《就業法案》規定的延長過渡期。因此,截至上市公司生效日期,我們的財務報表可能無法與符合新的或修訂的會計準則的公司進行比較。
此外,公司打算依靠《就業法》規定的其他豁免和降低的報告要求。
表外安排
本公司與任何對財務狀況、財務狀況、收入或開支、經營業績、流動資金、資本支出或資本資源具有或合理地可能對當前或未來有重大影響的其他實體之間並無任何表外安排 對股東而言至關重要。
關鍵會計政策和估算
財務報表和相關披露的編制必須符合美國公認會計準則。這些會計原則要求我們作出估計和判斷,這些估計和判斷可能會影響截至財務報表日期報告的資產和負債額以及列報期間報告的收入和費用。我們相信,我們所依賴的估計和判斷是基於我們在作出這些估計和判斷時獲得的信息而做出的。如果這些估計與實際結果之間存在重大差異,我們的財務結果將受到影響。下面介紹反映我們更重要的估計和判斷的會計政策,以及我們認為有助於全面瞭解和評估我們報告的財務業績的最關鍵的會計政策。
以下內容並不是我們所有會計政策或估算的綜合清單。我們的會計政策在本招股説明書末尾的財務報表中的附註3-重要會計政策摘要中有更全面的描述。
預算的使用
根據美國公認會計原則編制財務報表要求管理層作出估計、判斷和假設,這些估計、判斷和假設會影響財務報表中報告的金額和財務報表相關附註中披露的金額。本公司的估計和判斷基於歷史經驗和其認為在當時情況下合理的各種其他假設。本公司資產負債表中報告的資產和負債額以及列報的每個期間的支出金額受估計和假設的影響,這些估計和假設用於但不限於股權證券、負債、基於股份的薪酬和收購的無形資產的公允價值計算,以及為遞延税 資產建立估值扣除。公司的某些估計可能會受到外部條件的影響,包括公司獨有的情況和一般經濟狀況。實際結果有可能與這些估計值不同,這是合理的。
| 117 |
業務合併
在對企業合併應用收購 會計方法時,分配給所收購可識別資產和負債的金額基於收購日期的估計 公允價值,其餘部分記錄為善意。無形資產最初採用適合無形資產類型的公認估值方法按公允價值進行估值。在業務合併中收購的在製品研發(IPR & D) 在獲得監管機構批准之前被資本化為無限壽命的無形資產,此時 將其作為無限壽命的資產核算,並在其估計使用壽命或終止期間攤銷,此時 無形資產將被註銷。
長期資產和商譽
公司按照ASC 360-10-35的規定對長期資產進行會計處理。不動產、廠房和設備、減值 或長期資產的處置.本會計準則要求,當事件 或情況變化顯示賬面值可能無法收回時,應對長期資產進行減值審查。將持有及使用資產的可收回性 乃通過比較資產的賬面值與該資產預期產生的未來未貼現現金流量淨額來計量。 如果資產的賬面值超過其估計未來現金流量,則按資產賬面值超過資產公允價值的金額確認減值費用。
公司根據ASC 350會計準則對商譽和無形資產進行會計處理。無形資產-商譽和其他。商譽 代表實體的購買價格超出所收購資產和承擔的負債的估計公允價值。 ASC 350要求商譽和其他具有無限壽命的無形資產每年進行減值測試,或在 事件或情況表明資產的公允價值已降至低於其賬面價值的情況下進行臨時減值測試。
在確定是否需要進行量化評估時,本公司將對相關事件或情況進行評估,以確定報告單位的公允價值是否更有可能低於其賬面價值。如果在進行定性評估後,某實體得出結論認為報告單位的公允價值極有可能低於其賬面價值,則該實體將執行ASC 350中所述的量化減值測試。然而,如果在應用定性評估後,該實體得出結論認為公允價值不太可能少於賬面價值,則不需要進行量化減值測試。該公司基於其歷史數據和經驗、行業預測、微觀和宏觀經濟狀況預測以及預期做出這些假設。
可轉換本票
本公司評估其 可轉換工具,以確定該等合約或該等合約的嵌入部分是否符合衍生金融工具的資格,並須根據財務會計準則委員會(“FASB”)會計準則編纂(“ASC”)的第815題“衍生工具及對衝”(“ASC 815”)單獨入賬。衍生金融工具的會計處理要求本公司按協議開始之日的公允價值和隨後的每個資產負債表日期的公允價值記錄任何有分歧的嵌入特徵。公允價值的任何變動均作為營業外、非現金收入或支出計入每個期間的收益 。本公司於每個資產負債表日重新評估其衍生工具的分類。如果分類因期間內發生的事件而更改,則合同自導致重新分類的 事件發生之日起重新分類。分叉的嵌入功能按其初始公允價值記錄,這為託管工具創造了額外的 債務折扣。
在2021年1月1日採用會計準則更新(ASU)2020-06年度之前,如果嵌入的轉換選項不需要區分,則公司隨後通過比較截至承諾日的公司標的股票的公允價值和工具的有效轉換價格(內在價值)來評估是否存在有益的轉換功能。託管票據按攤餘成本計量,賬面價值按實際利息法計提合約到期日本金金額,並計入相應的利息支出。在2021年1月1日採用ASU 2020-06之後,公司不再需要 評估是否存在有益的轉換功能。
金融工具的公允價值
本公司根據ASC 820“公允價值計量和披露”(“ASC 820”)計量金融資產和負債的公允價值, 定義公允價值,建立公允價值計量框架,並擴大關於公允價值計量的披露。
ASC 820將公允價值 定義為在計量日市場參與者之間有序交易中為資產或負債在本金或最有利的 市場上轉移負債而收取的交換價格(退出價格)。ASC 820還建立了公允價值等級,要求實體在計量公允價值時最大限度地使用可觀察到的投入,最大限度地減少使用不可觀察到的投入 。ASC 820描述了可用於計量公允價值的三個級別的投入:
第1級--相同資產或負債在活躍市場的報價 ;
第2級--對活躍市場或可觀察到的投入中類似資產和負債的報價;以及
級別3-無法觀察到的輸入(例如,基於假設的現金流建模輸入)。
由於這些工具的短期性質,公司的金融工具,如現金、應付賬款和投資者存款的賬面價值接近公允價值。
有關評估第3級投入所用的估值技術和假設的其他詳情,請參閲附註8-衍生負債 。
| 118 |
所得税
對於財務報表或納税申報表中已計入或未計入的項目的預期未來税務後果,本公司確認遞延的 納税資產和負債。遞延税項資產及負債乃根據資產及負債的課税基準與其各自按現行税率計算的財務報告金額(“暫時性差異”)之間的差額(“暫時性差異”)而釐定。遞延税項資產減值至管理層認為資產更有可能無法變現的範圍。税率變動對遞延税項資產和負債的影響 在包括頒佈日期在內的期間的經營報表中確認。
本公司利用確認門檻和計量程序確認財務報表,並對納税申報表中已採取或預期採取的納税狀況進行計量 。
研究和開發費用
研發成本 按已發生費用計入,包括與我們的候選產品開發相關的所有直接和間接成本。這些費用 包括支付給第三方的研發和製造服務、人員成本和製造設備的折舊 。在報告期結束時,我們將向第三方服務提供商支付的款項與在完成研究或開發目標方面的估計進度進行比較。隨着獲得更多信息,此類估計可能會發生變化。 根據向服務提供商付款的時間和我們估計所提供的服務取得的進展,我們可能會記錄與這些成本相關的預付或應計費用淨額。
基於股票的薪酬
本公司根據授予權益工具的公允價值計量獲得服務的成本 。獎勵的公允價值 在授予日計量。然後在需要提供服務以換取獎勵的期間(通常是授權期)確認公允價值金額。
股票期權和認股權證的公允價值
該公司使用Black-Scholes期權定價模型計算了授予的股票期權和認股權證的公允價值。期權沒收在發生時計入 。後續普通股將採用市場法,使用普通股在納斯達克全球市場的交易價格進行估值。於2022年期間,前身普通股的公允價值是根據業務合併協議在每個估值日期與收購方進行的公平討論的狀況,以及該協議最終於2022年7月20日簽訂,前身估值為8,500萬美元,採用市場法確定的。2021年,管理層在第三方估值專家的協助下,採用收益法確定了前身普通股的公允價值。期權使用的預期 術語是授予的期權預計未償還的預計時間段。 認股權證使用的預期期限為合同期限。本公司利用“簡化”方法對“普通”期權授予的預期期限進行估算。本公司在2022年12月13日之前沒有普通股的公開交易歷史,以支持其 歷史波動率計算。因此,本公司使用的預期波動率數字是基於對六家可比實體在相當於被估值工具的預期壽命的一段時間內的歷史波動率進行回顧的 。無風險利率是根據美國國債零息債券的隱含收益率確定的,剩餘期限與被估值工具的預期期限一致。
最近採用的 會計聲明
2019年12月,FASB 發佈了ASU 2019-12《所得税(740主題):簡化所得税會計處理》,旨在簡化與所得税會計處理相關的各個方面。ASU 2019-12刪除了主題740中一般原則的某些例外情況,並澄清和修改了現有指南,以改進一致性應用。ASU 2019-12財年在2021年12月15日之後從 開始的財年有效。該標準於2022年1月1日採用,並未對公司的財務報表產生實質性影響。
2021年5月,FASB發佈了ASU 2021-04、每股收益(主題260)、債務修改和清償(主題470-50)、補償-股票補償(主題718)以及實體自身股權的衍生品和對衝合同(主題815-40):發行人 對獨立股權分類書面看漲期權的某些修改或交換進行了會計處理。這項新標準提供了 澄清,並減少了發行人對修改或交換獨立股權分類 書面看漲期權(如權證)的會計處理的多樣性,這些期權在修改或交換後仍保持股權分類。本標準在2021年12月15日之後的 財年有效,包括該財年內的過渡期。公司應將新標準 應用於新標準生效日期之後發生的修改或交換。本準則於2022年1月1日採用,並未對公司財務報表產生實質性影響。
2020年8月,財務會計準則委員會發布了ASU 2020-06,債務轉換和其他期權(分主題470-20)和衍生工具和套期保值-實體自有股權合同(分主題815-40):實體自己股權中可轉換工具和合同的會計處理 ,以明確某些具有負債和股權特徵的金融工具的會計處理。本次更新中的修訂 通過刪除現金轉換模式和受益轉換特徵模式,減少了可轉換債務工具和可轉換優先股的會計模式數量 。限制會計模型將導致從主機合同中單獨識別的嵌入式轉換功能減少 個。繼續受分離模式約束的可轉換工具是:(1)具有與宿主合同不明確和密切相關的嵌入轉換特徵的可轉換工具,符合衍生工具的定義,不符合衍生工具會計範圍例外的可轉換債務工具,以及(2) 發行的溢價可觀的可轉換債務工具,其溢價記錄為實收資本。此外,這一ASU改進了對可轉換工具和每股收益指引的披露要求。ASU還修訂了衍生產品 範圍例外指南,以減少由遠程或有事件驅動的基於形式而不是實質的會計結論。此更新中的修訂 適用於2023年12月15日之後的財政年度以及該財政年度內的過渡期 。將允許提前採用,但不能早於2020年12月15日之後的財年。本公司提前採用了ASU 2020-06,自2021年1月1日起生效,無需評估是否需要在發行新的可轉換票據時確認有益的轉換功能。
2016年2月,美國財務會計準則委員會發布了2016-02年度會計準則更新(“ASU”)“租賃(主題842)”。ASU 2016-02要求承租人確認經營性租賃產生的資產和負債。承租人應在財務狀況表 中確認支付租賃款項的負債(租賃負債)和代表其在租賃期內的標的資產使用權的使用權資產。對於租期為12個月或以下的租賃,承租人可按標的資產類別選擇不確認租賃資產和租賃負債的會計政策。在過渡期間,承租人和出租人需要 在採用修正的回溯法提出的最早期間開始時確認和計量租約。這項修訂 將在2021年12月15日之後的財年對非上市公司和新興成長型公司生效,並在2022年12月15日之後的財年內的過渡期 內生效。FASB於2018年7月發佈了ASU第2018-10號《對主題 842租賃的編纂改進》和ASU第2018-11號《租賃(主題842)有針對性的改進》,並於2018年12月發佈了ASU第2018-20號《租賃 (主題842)--出租人範圍狹窄的改進》。ASU 2018-10和ASU 2018-20提供了影響ASU 2016-02發佈的指南的狹義方面的某些修訂。ASU 2018-11允許所有采用ASU 2016-02的實體 選擇另一種(且可選的)過渡採用方法,根據該方法,實體最初在採用日期適用新的租賃標準,並確認採用期間留存收益期初餘額的累計效果調整。 本公司於2022年12月31日採用ASU 2016-02,自1月1日起生效。2022年和採用該ASU導致本公司經營租賃的使用權資產和租賃負債入賬約182,732美元和199,642美元,並取消確認遞延租金約16,910美元。
關於市場風險的定量和定性披露
不適用 。
| 119 |
管理
執行官員和董事
下表列出了截至2023年12月5日有關我們的高管和董事的某些信息:
| 名字 | 年齡 | 職位 | ||
| Stephen C.格洛弗 | 64 | 主管 執行官、總裁兼主席 | ||
| Karen a.羊絨 | 71 | 首席商務官 | ||
| 彼得 沃爾夫 | 56 | 主管 財務幹事和祕書 | ||
| 巴勃羅·A·古茲曼醫學博士 | 74 | 首席醫療官、醫務處高級副總裁 | ||
| Robert G. finizio | 52 | 董事 | ||
| 最小值 Chul Park博士 | 42 | 董事 | ||
| 詹姆斯·薩皮爾斯坦 | 62 | 董事 | ||
| 格雷戈裏·弗賴塔格 | 61 | 董事 |
執行官員
斯蒂芬·C·格洛弗。格洛弗先生是我們的聯合創始人之一,自2022年12月以來一直擔任我們的首席執行官總裁和董事長 。格洛弗先生於2014年3月至2022年12月擔任Old ZyVersa首席執行官兼總裁, 於2014年3月至2021年9月擔任董事會成員,並於2021年9月至2022年12月擔任董事長。格洛弗先生以前是Coherus Biosciences的聯合創始人,在那裏他專注於商業戰略、合作伙伴關係、產品開發努力和公司資本。在加入Coherus之前,他是Insmed治療蛋白公司的總裁(2007年至2010年),以及Insmed Inc.的首席商務官(2007年至2010年)。在Insmed,格洛弗先生負責創建生物相似業務部門,並將業務剝離給默克公司。作為首席商務官,他領導了Insmed的戰略審查流程,導致了Insmed和Transave的合併。在加入Insmed之前,格洛弗先生曾在Andrx實驗室(2004年至2005年)和Andrx治療公司(2005年至2006年)擔任高級副總裁兼總經理一職,這兩個部門都是Andrx Corporation 。在Andrx,格洛弗先生負責Andrx實驗室(開發和營銷代謝性疾病和男性健康產品)和Andrx Treeutics(專注於開發新的受控釋放產品和合同製造)的戰略和運營。早些時候,他曾在霍夫曼·拉羅什(1984年至1995年)、安進(1995年至1998年)和IMS Health(1998年至2001年)擔任過多個銷售、營銷和運營職務。格洛弗先生獲得了伊利諾伊州州立大學的市場營銷學士學位。格洛弗先生在財富100強、初創企業和創業環境中擁有多方面的經驗,他還在PDS Biotech、庫爾特基金會(邁阿密大學)和Asclepius Lifesciences的董事會任職。基於格洛弗先生在治療學行業的豐富經驗、對ZyVersa的深厚知識以及他作為其他生命科學公司董事會成員的持續經驗,格洛弗先生被選為我們的董事會成員。GLOVER先生根據企業合併協議由ZyVersa 任命為我們的董事會成員。
Karen A.山羊絨。卡什米爾女士自2022年12月以來一直擔任我們的首席商務官。羊絨女士於2019年1月至2022年12月在Old ZyVersa擔任同樣的職務,並於2014年8月至2019年1月擔任代理副總裁總裁,負責開發和市場營銷。卡什米爾女士在生物製藥和醫療器械公司的業務規劃和執行方面擁有超過25年的經驗,這些公司的規模從初創公司到財富100強公司。她曾在Mako Surgical Corporation(一家新興的機器人整形外科公司)負責市場營銷 溝通職能,在那裏她負責為每個定價超過100萬美元的機械臂系統及其用於部分膝關節和全髖關節置換的相關植入物 樹立知名度並推動銷售。卡什米爾女士還曾擔任Auxilium PharmPharmticals新產品營銷高級副總裁總裁,Auxilium PharmPharmticals是一家專注於男性健康和孤兒適應症的新興製藥公司。職責包括創建新產品營銷業務部門、戰略機會評估、管道優先順序、臨牀開發的商業監督,以及策劃新的產品商業化戰略。卡什米爾女士領導了Auxilium的戰略合作伙伴關係審查程序,導致將具有多個指標的關鍵資產xiaflex的歐洲權利授予輝瑞公司。在加入Auxilium之前,卡什米爾女士在安德烈斯實驗室擔任董事高級市場部 ,負責一個新成立的業務部,專注於男士健康流水線產品的商業化 。早些時候,她在Noven、Serono和Abbott擔任戰略營銷職位。
| 120 |
彼得·沃爾夫。沃爾夫先生自2022年12月以來一直擔任我們的首席財務官兼祕書。沃爾夫先生於2019年至2022年12月擔任Old ZyVersa財務與行政部 高級副總裁,在此之前於2015年10月至2019年10月擔任財務副總裁。Wolfe先生在金融服務、專業金融和製藥/醫療保健行業擔任過各種財務職務。最近,Wolfe先生在各種醫療保健實體中培養了 個初創企業組織,經常與複雜的商業模式打交道,以開發一個財務框架,使其中許多此類第一類企業獲得成功。沃爾夫先生在其職業生涯的最後24年裏一直在醫療保健行業 ,其中四分之一的時間是在Kos PharmPharmticals度過的,Kos PharmPharmticals是一家上市的、完全整合的專業製藥公司。沃爾夫先生擁有邁阿密大學的工商管理學士學位和匹茲堡大學的MBA學位。
巴勃羅·A·古茲曼,醫學博士古茲曼博士自2023年1月以來一直擔任我們的首席醫療官和醫務事務高級副總裁 。在此之前,他是我們的顧問,從2015年1月開始。自2017年以來,古茲曼博士一直在治療解決方案國際公司的科學諮詢委員會任職,這是一家專注於免疫調節的公司。他於1971年在澤西城聖彼得大學獲得生物學學士學位,1975年在波多黎各大學醫學院獲得醫學學位,1980年在巴爾的摩約翰·霍普金斯醫院獲得介入心臟病學獎學金。他擁有內科(1978)和心血管疾病(1981)方面的董事會認證。他於1980年加入約翰霍普金斯大學的工作人員,他的職責包括照顧病人,教學,以及狗實驗室的臨牀和基礎科學研究。他在同行評議的期刊上發表了30多篇文章和許多摘要,其中一些在包括美國心臟協會和美國心臟病學會在內的國家會議上發表。在霍普金斯大學期間,他成為美國心臟協會臨牀心臟病學委員會的會員、北美起搏和電生理學學會的會員、美國心臟病學會的會員,並擔任過巴爾的摩市醫院(現為弗朗西斯·斯科特關鍵醫院)心臟插管實驗室的董事助理、永久起搏器實驗室的聯合董事和心臟導管實驗室的聯合董事。古茲曼博士在南佛羅裏達州從事醫學/介入心臟病學執業35年 ,1987年,古茲曼博士設計併成為博卡拉頓社區醫院(現為博卡拉頓地區醫院)心臟插管實驗室的董事研究員,併成為心臟血管造影和幹預學會的會員。然後,他成為北嶺醫學中心心導管實驗室的董事助理。他是大勞德代爾卡杜塞學會的昔日總裁,曾任北嶺醫學中心心血管和肺部疾病科主任。古茲曼博士是勞德代爾堡心臟病協會的管理合夥人,曾是布羅沃德縣醫學會的成員,並是聖十字健康公司董事會的成員,自2015年以來一直是三一健康公司的成員。他是Campbell神經科學公司和國際治療解決方案公司的科學顧問委員會成員。
非僱員董事
羅伯特·G·菲尼齊奧。菲尼齊奧先生自2022年12月以來一直擔任我們的董事會成員。Finizio先生於2018年9月至2022年12月在Old ZyVersa擔任同樣的職務。菲尼齊奧先生目前是藥品開發公司PleoPharma的執行董事,該公司專注於尋找FDA批准的安全有效的治療藥物使用障礙的方法 。Finizio先生是TreateuticsMD Inc.的聯合創始人,這是一家創新的女性健康製藥公司,並在2008年至2021年11月期間擔任該公司的首席執行官和董事。Finizio先生擁有20多年的醫療保健經驗,在內窺鏡專家公司(ESI)開始了他的職業生涯,該公司是腹腔鏡設備外包和術中技術支持方面的領先者。在ESI任職期間,Finizio先生晉升到區域管理職位,最終離開 加入製藥自動化領域的領先者OmNicell Technologies。在宏盟時,菲尼齊奧擔任董事的銷售員,最終於2001年離開公司,與人共同創立了CareFusion。CareFusion是醫院患者用藥、血液和護理點標本驗證安全系統的先驅。Finizio先生於2008年聯合創立了TreateuticsMD,結合了他在女性醫療保健、製藥技術、臨牀軟件和患者安全方面的背景。菲尼齊奧先生是兩個非營利性組織--生物佛羅裏達和博卡拉頓警察基金會--的董事會成員。Finizio先生畢業於邁阿密大學,獲得了醫學預科和心理學專業的文學學士學位,在從事醫療保健工作之前,他曾在日本大阪教授英語。Finizio先生因其在醫療保健行業早期公司發展方面的豐富經驗而被選為我們董事會的成員。Finizio先生 根據業務合併協議被ZyVersa任命為我們的董事會成員。
分鐘 Chul朴智星博士。Park博士自2022年12月以來一直擔任我們的董事會成員。從2021年5月到2022年12月,朴槿惠在Old ZyVersa擔任同樣的職務。Park博士是英傑大學藥學院的助理教授。Park博士曾擔任韓國首爾生物製藥公司CureBioTreateutics的首席執行官和董事首席執行官,從2020年10月至2022年4月,該公司開發治療癌症、脱髮和傷口護理的多肽藥物。Park博士還在2017年8月至2022年3月期間擔任庫裏比奧首席技術官總裁和董事 執行副總裁。Park博士於2019年3月至2022年2月在韓國大學藥劑系擔任ADJUST教授。Park博士在製藥行業擁有10年的工作經驗,曾在藥物靶標發現、分析開發和候選藥物優化領域工作。他在基礎和應用分子和細胞生物學方面擁有專業知識。在他之前在Curebio治療公司擔任的職務期間,Park博士領導了融資和業務開發交易,包括與三家制藥公司 的共同開發協議,以及一項許可協議。此外,他還開發了化粧品多肽,並共同開發了抗體、基於循環腫瘤細胞的診斷方法和癌症幹細胞分析系統。此外,Park博士是TME治療公司的聯合創始人,目前是其科學顧問委員會的成員。
| 121 |
在2017年之前,Park博士一直擔任韓國首爾新生物技術公司的首席執行官和董事,在那裏他幫助擴大了合同實驗和生物材料業務, 他領導了將新經濟學與Curebio和BumYoung Bio,Ltd.合併為CureBio.的努力。Park博士開發了化粧品多肽,以及一種皮膚病多肽藥物候選藥物,他獲得了許可。Park博士的職業生涯始於首爾國立大學醫學生物融合研究中心的高級研究助理 ,在那裏他開發並領導了一種外顯體分離設備的外部許可交易,他 負責了兩項抗腫瘤致癌多肽的外部許可交易。Park博士在首爾國立大學藥劑係獲得了藥物生物科學博士學位。Park博士因其對製藥行業和藥物開發技術的深入瞭解而被選為我們的董事會成員。Park博士根據企業合併協議由ZyVersa 任命為我們的董事會成員。
詹姆斯·薩皮爾斯坦。詹姆斯·薩皮爾斯坦自2023年1月以來一直擔任我們的董事會成員。薩皮爾斯坦先生目前是第一波生物製藥(納斯達克:FWBI)的董事長、首席執行官兼總裁。薩皮爾斯坦先生的職業生涯始於較小的生物技術公司,他後來加入吉利德科學公司,領導全球營銷團隊推出ViRead(替諾福韋)。 2002年,他接受了Serono實驗室代謝和內分泌學執行副總裁總裁的職位。後來,在2006年,他成為當時一傢俬營公司Tobira Treeutics的創始首席執行官。Tobira治療公司於2016年被Allergan 收購。2012年,Sapirstein先生成為Aliqua,Inc.的首席執行官。此後,他在2014年3月至2018年10月期間擔任Contravir PharmPharmticals的首席執行官。這些都是上市公司。薩皮爾斯坦先生在他擔任首席執行官的各種活動中,通過風險投資和公共資本市場籌集了超過3億美元的資金。 他入圍了2015年和2016年安永年度企業家獎的決賽。除了擔任First Wave Bio Pharma的董事會成員外,Sapirstein先生目前還在以諾基亞生物科學公司(Enochian Biosciences)(納斯達克股票代碼:ENOB)和藍色生物疫苗公司(Blue Water Vaccines)(納斯達克股票代碼:BWV)擔任董事職務。2017年2月至2019年2月,他擔任新澤西州生物製藥行業協會BioNJ董事會主席。此外,他還是BIO(生物技術創新組織)的董事會成員,BIO是推動醫療保健領域公共政策和網絡的領先生物技術貿易組織,他是新興公司 部門管理委員會的成員。Sapirstein先生之所以被選為董事會成員,是因為他在生物技術和製藥行業擔任高管以及在這些行業的多家上市公司擔任董事的豐富經驗。
格雷戈裏 弗雷塔格。格雷戈裏·弗雷塔格自2023年1月以來一直擔任我們的董事會成員。Freitag先生目前是PDS生物技術公司(納斯達克代碼:PDSB)的董事會成員,該公司是一家臨牀階段免疫治療公司,基於其專有的Veramune和Infectimune T細胞激活平臺,開發不斷增長的靶向癌症和傳染病免疫治療流水線。他還是致力於周圍神經修復的領先再生醫藥公司Axogen,Inc.(納斯達克代碼:AXGN)的董事會成員。Freitag先生於2020年6月至2021年3月擔任Axogen的特別法律顧問,於2011年9月至2020年6月擔任總法律顧問,於2011年9月至2014年5月和 2015年8月至2016年3月擔任首席財務官,並於2014年5月至2018年10月擔任高級副總裁業務發展部部長。Freitag先生是LecTec Corporation的首席執行官、首席財務官和董事會成員,LecTec Corporation是一家知識產權許可和控股公司,於2011年9月與Axogen Inc.合併,從2010年6月到2011年9月。從2009年5月到現在,Freitag先生一直是FreiMc,LLC的負責人,這是一家他創建的醫療保健和生命科學諮詢和諮詢公司 ,提供戰略指導和業務發展諮詢服務。在創建FreiMc,LLC之前,Freitag先生是輝瑞健康解決方案公司業務開發部的董事主管,從2006年1月到2009年5月,他是輝瑞公司的前子公司。 從2005年7月到2006年1月,Freitag先生在Guidant Corporation的業務開發部工作。在加入Guidant公司之前,Freitag先生從2000年3月至2005年初擔任生物技術工具初創公司HTS BioSystems的首席執行官。從1995年12月到2000年3月,Freitag先生擔任公共醫療診斷公司Quantech的首席運營官、首席財務官和總法律顧問。在此之前,Freitag先生在明尼蘇達州明尼阿波利斯從事公司法工作。Freitag先生擁有芝加哥大學的法學博士學位和明尼蘇達州Macalester學院的經濟學、商業和法律與社會專業的學士學位。Freitag先生之所以被選為董事會成員和公司審計委員會主席,是因為他作為一名高級管理人員具有成熟的領導力和經驗,他 對上市公司的特殊知識,包括與之相關的報告、合規和金融市場,他的財務 管理和法律專業知識,他曾擔任過的上市公司首席財務官,以及在生命科學領域 的30多年經驗。
| 122 |
董事會委員會
我們董事會的常務委員會由審計委員會、薪酬委員會和提名和公司治理委員會組成。我們的董事會可能會不時成立其他委員會。本公司首席執行官和其他高管定期向非執行董事彙報工作以及審計、薪酬和提名及公司治理委員會,以確保對我們的活動進行有效和高效的監督,並協助進行適當的風險管理和持續的管理控制評估。我們相信,我們董事會的領導結構為公司的活動提供了適當的風險監督。
審計委員會
審計委員會由擔任主席的格雷戈裏·弗雷塔格、羅伯特·G·菲尼齊奧和詹姆斯·薩皮爾斯坦組成。我們的董事會已確定,根據董事上市規則 和交易所法案規則10A-3的獨立性要求,審計委員會的每一名成員都有資格成為獨立的納斯達克。至少有一名審計委員會成員有資格成為S-K條例第407(D)(5)項所界定的“審計委員會財務專家”。審計委員會的目的是 準備美國證券交易委員會要求的審計委員會報告,該報告應包括在公司根據美國證券交易委員會規則和條例要求提交的任何委託書或招股説明書中,並協助我們的董事會監督和監督(1)財務報表的質量和完整性;(2)遵守法律和監管要求;(3)公司獨立的註冊會計師事務所的資格和獨立性;(4)公司內部審計職能的履行情況(如果有);(五)本公司獨立註冊會計師事務所的經營情況。我們的董事會已經通過了審計委員會的書面章程,該章程可以在我們的公司網站(www.zyversa.com).
薪酬委員會
薪酬委員會由羅伯特·G·菲尼齊奧(Robert G.Finizio)擔任主席,樸敏哲(Min Chul Park)博士和詹姆斯·薩皮爾斯坦(James Sapirstein)組成。我們的董事會已經通過了薪酬委員會的書面章程,該章程可以在我們的公司網站(www.zyversa.com)。 薪酬委員會的目的是協助我們的董事會履行以下職責:(1) 制定公司的薪酬計劃及其高管和董事的薪酬;(2)監督公司的激勵性和基於股權的薪酬計劃;以及(3)準備薪酬委員會報告,該報告必須包括在公司根據美國證券交易委員會的規則和規定必須提交的任何委託書或招股説明書中。
提名和公司治理委員會
提名和公司治理委員會由格雷戈裏·弗雷塔格、敏哲·帕克博士和詹姆斯·薩皮爾斯坦組成,擔任主席。我們的董事會已經為提名和公司治理委員會通過了一份書面章程,可以在我們的 公司網站(www.zyversa.com)。提名和公司治理委員會的目的是幫助我們的董事會 直接履行以下職責:(1)根據董事會批准的標準確定、審查董事會推薦的提名人選進入董事會,(2)遴選或推薦董事會挑選下一屆年度股東大會的董事提名人選,(3)監督董事會和管理層的年度評估,以及(4)向董事會推薦董事會各委員會的董事提名人選。
| 123 |
商業行為準則
公司通過了適用於我們所有董事、高級管理人員和員工的新商業行為準則,包括首席執行官、首席財務官和首席會計官,該準則可在公司網站上查閲。 公司的商業行為準則是S-K條例第406(B)項中定義的“道德準則”。請注意 公司的互聯網網站地址僅作為非活動文本參考提供。本公司將在其公司網站上對其道德守則條款的修訂或豁免進行任何法律 規定的披露。
薪酬 委員會聯鎖和內部人士參與
在2022財年期間或在任何其他時間,我們的薪酬委員會沒有 成員是我們的高管或員工。 我們的高管都沒有擔任過董事或任何實體的薪酬委員會(或具有同等 職能的其他委員會)的成員,其中一名高管曾擔任過我們董事會的董事或薪酬 委員會的成員。
董事會獨立性
納斯達克規則一般要求獨立董事必須在上市公司董事會中佔多數。根據各推薦董事要求及提供的有關其背景、工作及從屬關係(包括家庭關係)的資料, 我們已確定,羅伯特·G·菲尼齊奧、樸敏哲博士、詹姆斯·薩皮爾斯坦和格雷戈裏·弗雷塔格代表美國證券交易委員會五(5)名董事中的四(4)名,該詞是根據美國證券交易委員會適用的規則和法規以及 納斯達克的上市要求和規則定義的。
責任和賠償的限制 事項
《第二次修訂和重新簽署的公司註冊證書》(以下簡稱《憲章》)包含的條款限制了本公司董事因違反其受託責任而承擔的金錢損害賠償責任,但根據DGCL不能免除的責任除外。 特拉華州法律規定,公司董事對違反其受託責任的個人責任不承擔個人責任,但對下列任何一項的責任除外:
| ● | 違反其對公司或其股東的忠誠義務; |
| ● | 非善意的行為或不作為,或者涉及故意的不當行為或者明知是違法的; |
| ● | 非法支付股息或非法股票回購或 DGCL第174條規定的贖回;或 |
| ● | 董事從中獲取不當個人信息的任何交易 效益 |
此 責任限制不適用於根據聯邦證券法產生的責任,且不影響 等公平救濟措施的可用性,例如禁令救濟或撤銷。
《章程》和《第二次修訂和重述的章程》(以下簡稱《章程》)還規定,我們應在法律允許的最大範圍內賠償董事和執行人員,並可賠償我們的其他高級管理人員和僱員以及其他代理人。我們認為, 《章程》規定的賠償至少包括違約方的過失和重大過失。本章程 還允許我們代表任何高級管理人員、董事、僱員或其他代理人為他或 的行為引起的任何責任投保,無論本章程是否允許賠償。
除了我們的章程文件中規定的賠償 外,我們 還與董事和執行官簽訂了單獨的賠償協議。這些協議,除其他事項外,規定我們的董事和執行官 賠償此人在因此人作為董事或執行官的服務而引起的任何訴訟或程序中或應我們的要求而發生的費用、判決、罰款和和解金額。我們認為,這些條款和協議對於吸引 和留住合格的人員擔任董事和執行官是必要的。
| 124 |
高管薪酬
摘要 截至2022年12月31日的年度薪酬表
以下薪酬摘要表列出了有關我們的指定高管 (“NEO”)在2022年和2021年因在2022年和2021年期間以各種身份向我們及其子公司提供的服務而支付、授予或賺取的薪酬的信息。
| 名稱和主要職位 | 年 | 薪金(元) | 期權獎勵(1)($) | 總補償(美元) | ||||||||||||
| 史蒂芬·C·格洛弗 | 2022 | 450,500 | 1,027,948 | 1,478,448 | ||||||||||||
| 聯合創始人、首席執行官、總裁兼董事長 | 2021 | 450,500 | 1,803,896 | 2,254,396 | ||||||||||||
| 尼古拉斯·A小拉貝拉(2) | 2022 | 325,000 | 385,394 | 710,394 | ||||||||||||
| 首席科學官兼高級副總裁 的研發 | 2021 | 325,000 | 425,902 | 750,903 | ||||||||||||
| 卡倫·A·卡什米爾 | 2022 | 300,000 | 282,622 | 582,622 | ||||||||||||
| 首席商務官 | 2021 | 300,000 | 312,328 | 612,328 | ||||||||||||
| 彼得·沃爾夫 | 2022 | 275,000 | 282,622 | 557,622 | ||||||||||||
| 首席財務官兼祕書 | 2021 | 275,000 | 312,328 | 587,328 | ||||||||||||
| 巴勃羅·古茲曼,醫學博士(3) | 2022 | - | - | - | ||||||||||||
| 首席醫療官與醫務處高級副總裁 | 2021 | - | - | - | ||||||||||||
| (1) | 報告的 金額代表根據FASB ASC主題718計算的截至2022年12月31日和2021年12月31日的年度內,根據我們的2014年股權激勵計劃授予董事的股票期權的授予日期公允價值合計。有關計算授予日期公允價值時使用的假設,請參閲我們的 財務報表附註11。 |
| (2) | 小尼古拉斯·拉貝拉,M.S.,我們的前首席科學官和研發高級副總裁總裁於2023年8月18日退休。 |
| (3) | 古茲曼博士於2023年1月26日開始擔任我們的首席醫療官和醫務事務高級副總裁 。 |
高管 薪酬安排
執行 僱傭協議
斯蒂芬·C·格洛弗
於2019年1月1日,吾等與Stephen C.Glover訂立僱傭協議(“GLOVER僱傭協議”)。 根據GLOVER僱傭協議的條款,他擔任首席執行官一職,每年領取45萬美元的基本工資,該基本工資金額可能會由董事會或薪酬委員會定期調整。此外,格洛弗先生有資格獲得年度獎金,目標金額相當於格洛弗先生基本工資的50%(50%)。 每筆年度獎金的實際金額將基於我們公司目標的實現程度和格洛弗先生的個人目標,在每種情況下,都是由我們和格洛弗先生為與年度獎金相關的日曆年度確定的 。公司目標的實現程度和格洛弗先生一年的個人業績目標應由我們根據合理的酌情權作出決定。此外,根據格洛弗僱傭協議的條款,格洛弗先生有資格根據我們現有的股權激勵計劃或我們未來可能採用的任何其他股權激勵計劃不時獲得股權獎勵,獎勵的條款和條件(如果有)將由我們的董事會或 薪酬委員會酌情決定。格洛弗先生還有資格參加我們採用的任何高管福利計劃或計劃。
根據 《Glover僱傭協議》,我們可以在提前60天書面通知Glover先生的情況下,在沒有理由的情況下隨時終止Glover先生的僱傭關係(該期限見Glover僱傭協議 中的定義)。Glover先生可在90天書面通知我們後(根據Glover先生僱傭協議中的定義)終止其僱傭關係,收到通知後,我們有 30天的時間來糾正Glover先生認為符合良好理由的條件,但須遵守Glover僱傭協議 中規定的某些條件。
如果 Glover先生的僱傭被無故終止,或有正當理由而非控制變更後期間(定義見Glover僱傭協議 ),Glover先生將有權獲得(i)應計債務(定義見格洛弗僱傭協議),㈡相當於格洛弗先生15個月基薪的遣散費(在格洛弗先生被解僱後60天內的下一個正常 發薪日一次性支付),以及(iii)如果選擇,公司將向Glover先生償還15個月的COBRA健康福利。
儘管如此,如果格洛弗先生在控制權變更後12個月內被無故終止僱傭或有正當理由辭職(如格洛弗僱傭協議所定義),格洛弗先生將獲得(I)應計債務,(Ii)相當於格洛弗先生基本工資36個月的遣散費 (從格洛弗先生被解僱後60天內的下一個正常發薪日開始分兩個月支付),(Iii)應付給格洛弗先生的任何遞延賠償金,(Iv)如果當選,本公司將償還格洛弗先生為期24個月的某些眼鏡蛇健康福利,(V)相當於格洛弗先生在終止發生的日曆年的目標年度紅利金額的付款,(Vi)代替因行使授予格洛弗先生的未償還期權而發行的普通股,格洛弗先生將獲得相當於(A)納斯達克上報告的普通股收盤價 的超額乘積的現金。按終止日期或最接近終止日期之最低出價及最高出價之平均值(br}終止日期或最近終止日期)計算,除以格洛弗先生所持每項購股權之每股行使價(不論當時是否可全數行使)加上任何適用現金增值權金額,乘以(B)每項該等購股權所涵蓋之普通股股份數目,及(Vii)相當於格洛弗先生因該等終止而招致之任何及所有法律費用金額之付款。
| 125 |
根據 《Glover僱傭協議》,我們可以在書面通知Glover先生後隨時無故終止Glover先生的僱傭關係。 Glover先生可在沒有充分理由的情況下隨時自願終止其僱傭關係,但須提前九十(90)天書面通知 公司;但是,我們保留在書面通知格洛弗先生後接受格洛弗先生的辭職通知的權利 ,並加速該通知並使格洛弗先生的辭職立即生效,或在格洛弗先生 計劃的最後一天工作之前,我們認為合適的其他日期。如果Glover先生的僱傭被無故終止或無正當理由,他 有權獲得(i)其在僱傭最後一天已賺取但未支付的基本工資,(ii)其累積但未使用的假期, (iii)根據僱傭協議在僱傭最後一天或之前產生的可報銷的費用,及(iv)Glover先生根據我們的任何股權補償計劃有權獲得的任何金額 或利益。
根據 《Glover僱傭協議》,我們可以在書面通知Glover先生後隨時無故終止Glover先生的僱傭關係。 Glover先生可在沒有充分理由的情況下隨時主動終止其僱傭關係,但須提前兩週書面通知我們。
於2022年7月20日,吾等與Stephen C.Glover訂立新的行政人員聘用協議(“新Glover協議”) ,該協議於業務合併完成後生效,據此吾等同意在業務合併完成後繼續保留GLOVER先生為我們的行政總裁,但須受新GLOVER協議的條款及條件所規限。新的格洛弗協議已經取代了格洛弗就業協議。根據新格洛弗協議,格洛弗先生的僱用條件包括,除其他事項外,他同意並簽署專有信息和限制性 契約協議。
根據新格洛弗協議的條款,格洛弗先生將繼續擔任首席執行官一職,並根據我們的標準薪資慣例領取每年550,000美元的基本工資。格洛弗先生的基本工資和未來的薪酬增長 將由董事會定期審查和批准。此外,格洛弗先生有資格獲得基於績效的年度現金獎金,目標金額相當於格洛弗先生基本工資的55%(55%),董事會將根據格洛弗先生實現某些業績目標的情況進行審查和調整。格洛弗先生是否獲得年度獎金還取決於格洛弗先生在支付獎金時是否繼續受僱於我們,否則年度獎金將被沒收。此外,根據新格洛弗協議的條款,格洛弗先生可能有資格獲得我們普通股的某些股權獎勵,但須受授予獎勵的我們的股權計劃的歸屬和其他條款和條件以及我們將提供並與格洛弗先生簽訂的協議的限制。格洛弗先生還有資格在與處境相似的員工相同的 基礎上參加我們的福利計劃,該計劃在他受僱期間不時生效。
根據新格洛弗協議 ,我們可在書面通知格洛弗先生後,隨時終止對格洛弗先生的僱用(該術語在新格洛弗協議中定義)。如果我們之前沒有通知格洛弗先生我們打算終止他的僱傭關係, 格洛弗先生可以在60天內向我們發出書面通知,在符合新格洛弗協議中規定的條件的情況下,基於正當理由(該術語在新格洛弗協議中定義),我們有30天的時間解決格洛弗先生認為有充分理由的條件。如果格洛弗先生因正當理由辭職,且該解僱 構成離職(如新格洛弗協議中所定義),則在格洛弗先生履行其在新格洛弗協議下的義務的前提下,格洛弗先生有資格獲得離職福利(該條款在新格洛弗協議中定義為 ),其條款和條件與我們在無故終止其僱傭關係時有權獲得的條款和條件相同。
如果我們在任何時間無故終止聘用格洛弗先生,或如果格洛弗先生因正當理由辭職,且這種終止構成了離職,則格洛弗先生有權獲得應計債務(該條款在新格洛弗協議中定義),並且,在格洛弗先生履行其在新格洛弗協議下的義務的情況下,格洛弗先生還應有權獲得以下福利:(I)相當於格洛弗先生當時24個月基本工資的金額, 在發佈生效日期(該術語在 新格洛弗協議中定義)之後的定期工資單日期以等額分期付款的方式支付;(2)在格洛弗先生被解僱後60天內一次性一次性支付的數額,相當於在格洛弗先生被解僱前一年所賺取的任何未付獎金。(3)數額等於以下兩項中較大的一項:(A)在格洛弗先生被終止之前的業績年度支付的獎金,和(B)格洛弗先生在發生此種終止的業績年度本應獲得的獎金,兩者按格洛弗先生受僱期間至其被解僱之日按比例計算,在格洛弗先生被解僱後60天內一次性支付;(IV) 截至格洛弗先生離職之日尚未授予格洛弗先生的任何股權獎勵將成為100%既得 ,任何未行使的股票期權將繼續可行使,直至(A)格洛弗先生離職後18個月、 或(B)適用獎勵協議規定的此類既得期權的原始到期日;以及(Iv)如果當選,我們將根據新的《格洛弗協議》的條款和條件以及適用的法律法規,向格洛弗先生報銷長達18個月的某些COBRA健康福利。
儘管有上述規定, 如果吾等(或任何尚存或收購公司)在控制權變更生效日期(定義見《格洛弗僱傭協議》)生效日期前90天內及生效日期後24個月內,無故終止格洛弗先生的僱傭,或格洛弗先生有正當理由辭職,則格洛弗先生將有權獲得應計債務,並在格洛弗先生履行其在新格洛弗協議下的義務的情況下 ;格洛弗先生有資格領取福利,條件與我們無故終止僱用他的條件相同;然而,如果格洛弗先生在其被終止的年度獲得相當於格洛弗先生基本工資55%(55%)的獎金;而且,如果控制權的變更 是公司所有權的變更、公司實際控制權的變更或公司資產的相當大部分的所有權變更,則此類終止的應付(或剩餘應付)遣散費的累計金額應在控制權變更後30天或之後30天內一次性支付。
根據新格洛弗協議,我們可以書面通知格洛弗先生,隨時終止對格洛弗先生的僱用。如果格洛弗先生的僱傭關係在任何時候因任何原因被終止,格洛弗先生將不會獲得遣散費或任何其他遣散費或福利,但根據我們的標準工資政策,我們將向格洛弗先生支付應計債務。格洛弗先生可在不少於30天前書面通知我們辭去他在我們公司的工作。如果格洛弗先生因任何原因(正當理由辭職除外)辭去我們的工作,格洛弗先生將不會獲得遣散費福利或任何其他遣散費或福利,但我們將支付並提供應計債務。
格洛弗先生有權獲得某些遣散費福利的條件之一是,他有義務簽署並交付有效的豁免 (該術語在新格洛弗協議中定義),其格式為我們可以接受的60這是終止後的第二天或新聞稿中規定的較早日期。
| 126 |
彼得·沃爾夫
於2022年7月20日,吾等與Peter Wolfe訂立高管聘用協議(“Wolfe聘用協議”),該協議於完成業務合併後生效,據此吾等同意在業務合併完成後,根據Wolfe聘用協議的條款及條件,繼續留任Wolfe先生擔任我們的首席財務官。根據Wolfe僱用協議,Wolfe先生的僱用條件包括,除其他事項外,他同意並簽署專有信息和限制性契約協議。
根據沃爾夫僱傭協議的條款,沃爾夫先生將擔任首席財務官一職,根據我們的標準工資慣例,他每年的基本工資為395,000美元。沃爾夫先生的基本工資和未來的薪酬增長將由董事會定期審查和批准。此外,沃爾夫先生有資格獲得基於績效的年度現金獎金,目標金額相當於沃爾夫先生基本工資的40%(40%),董事會將根據沃爾夫先生實現某些業績目標的情況進行審查和調整。沃爾夫先生是否獲得年度獎金也取決於沃爾夫先生在支付獎金時是否繼續受僱於我們,否則年度獎金 將被沒收。此外,根據沃爾夫僱傭協議的條款,Wolfe先生可能有資格獲得我們普通股的某些股權授予 獎勵,受授予獎勵的我們的股權計劃的歸屬和其他條款和條件以及我們將提供並與Wolfe先生簽訂的協議的限制。沃爾夫先生還有資格在與 處境相似的員工相同的基礎上參加我們的福利計劃,該計劃在他任職期間不時生效。
根據Wolfe僱傭協議,吾等可在書面通知Wolfe先生後,隨時無故終止Wolfe先生的僱傭(該術語在Wolfe僱傭協議中定義) 。如果我們之前沒有通知Wolfe先生我們打算終止他的僱傭關係,則Wolfe先生可以在30天內 書面通知我們,根據Wolfe僱傭協議中規定的條件,基於充分的理由(該術語在Wolfe僱傭協議中定義)辭去他在我們的僱傭關係。如果Wolfe先生因正當理由辭職,且該解僱構成離職(如Wolfe僱傭協議中所定義),則在Wolfe先生履行其在Wolfe僱傭協議下的義務的情況下,Wolfe先生有資格按與我們無故終止其僱傭關係 的相同條款和條件領取Serverance福利(該條款在Wolfe僱傭協議中定義)。
如果我們在任何時間無故終止對Wolfe先生的僱用,或者Wolfe先生出於正當理由辭職,且這種終止構成了與服務的分離,則Wolfe先生有權獲得應計債務(該條款在Wolfe僱傭協議中定義),並且,在Wolfe先生履行其在Wolfe僱傭協議下的義務的情況下,Wolfe先生還應有權獲得以下福利:(I)相當於Wolfe先生當時12個月的基本工資的金額。在發佈生效日期(如《沃爾夫僱傭協議》中定義的那樣)之後,在我們定期安排的薪資發放日以等額分期付款的方式支付;(Ii)在Wolfe先生被解僱後60天內一次性一次性支付的金額,相當於Wolfe先生被解僱時前一年所賺取的任何未付獎金;及(Iv)如果當選,我們 將向Wolfe先生償還長達12個月的某些COBRA健康福利,在每種情況下都要遵守Wolfe僱傭協議和適用法律法規的條款和條件。
儘管有上述規定, 如果我們(或任何尚存或收購的公司)無故終止對Wolfe先生的僱用,或Wolfe先生在控制權變更(定義見Wolfe僱傭協議)生效日期前90天內及生效日期後24個月內因正當理由辭職,則Wolfe先生將有權獲得應計債務,且受Wolfe先生履行Wolfe僱傭協議項下義務的限制。沃爾夫先生有資格獲得福利,條件與他有權因我們無故終止其僱傭關係和下列各項的條件相同,但如果控制權變更 是公司所有權的變更、公司實際控制權的變更或公司資產大部分所有權的變更,應在控制權變更後30天內或在控制權變更後30天內一次性支付終止合同的遣散費的累計金額 :(I)沃爾夫先生將在其終止合同發生的 年度獲得相當於沃爾夫先生基本工資的40%(40%)的獎金,並在沃爾夫終止合同後60天內一次性支付;及(Ii)倘若吾等向Wolfe先生發出的任何股權獎勵於控制權變更結束時仍未完成 由尚存實體在該控制權變更中承擔或繼續(根據其條款),則該等股權獎勵的未歸屬部分將於Wolfe先生終止時100%歸屬。
根據沃爾夫僱傭協議,我們可以書面通知沃爾夫先生,隨時終止對沃爾夫先生的僱用。如果沃爾夫先生的僱傭關係在任何時候因任何原因被終止,沃爾夫先生將不會獲得遣散費或任何其他遣散費補償或福利,但根據我們的標準工資政策,我們將向沃爾夫先生支付應計債務。沃爾夫先生可在不少於30天前書面通知我們辭去他在我們公司的工作。如果沃爾夫先生因任何原因(有充分理由辭職除外)辭去我們的工作,沃爾夫先生將不會獲得離職金或任何其他遣散費或福利,但我們將支付和提供應計債務。
沃爾夫先生有權獲得某些離職福利的條件之一是,他有義務簽署並交付一份有效的免責聲明(如沃爾夫僱傭協議中定義的那樣),其格式為我們可以接受的60這是終止後的第二天或新聞稿中規定的較早日期。
| 127 |
凱倫 山羊絨
於2022年7月20日,吾等與凱倫羊絨訂立高管聘用協議(“羊絨聘用協議”) ,該協議於業務合併完成後生效,據此吾等同意於業務合併完成後,根據 羊絨聘用協議的條款及條件,繼續留任卡什米爾女士為我們的首席商務官。根據《羊絨就業協議》,除其他事項外,卡什米爾女士的就業條件包括她的協議和簽署專有信息和限制性契約協議。
根據《羊絨僱傭協議》的條款,凱什米爾女士將擔任首席商務官一職,並根據我們的標準薪資慣例獲得32萬美元的基本年薪。卡什米爾女士的基本工資和未來的薪酬增長 將由董事會定期審查和批准。此外,卡什米爾女士有資格獲得基於績效的年度現金獎金,目標金額相當於卡什米爾女士基本工資的30%(30%),董事會將根據卡什米爾女士實現某些業績目標的情況進行審查和調整。卡什米爾女士是否收到年終獎也取決於卡什米爾女士在發放年終獎時是否繼續受僱於我們,否則 年終獎被沒收。此外,根據羊絨僱傭協議的條款,根據授予獎勵的本公司股權計劃的歸屬及其他條款和條件,凱什米爾女士可能有資格 獲得我們普通股的某些股權獎勵 ,以及我們將提供並與羊絨女士簽訂的協議。卡什米爾女士也有資格 在與處境相似的員工相同的基礎上參加我們的福利計劃,該計劃在她受僱期間不時生效。
根據《羊絨就業協議》,我們可在書面通知卡什米爾女士後,隨時無故終止對卡什米爾女士的聘用(該術語在《羊絨就業協議》中有定義)。如果我們之前沒有通知卡什米爾女士我們打算終止她的僱傭關係 ,卡什米爾女士可以有充分的理由(該術語在羊絨僱傭協議中定義)在30天內書面通知我們,我們有30天的時間來解決卡什米爾女士認為 是正當理由的條件,但要遵守羊絨僱傭協議中規定的某些條件。如果卡什米爾女士出於好的 理由辭職,並且只要該解僱構成離職(如《羊絨僱傭協議》中所定義),則在卡什米爾女士履行其在《羊絨僱傭協議》項下的義務的情況下,卡什米爾 女士將有資格按與我們有權無故終止其僱傭關係的條款和條件 領取離職福利。
如果我們在任何時間無故終止僱用克什米爾女士,或如果克什米爾女士出於正當理由辭職,且這種終止構成離職,則克什米爾女士有權獲得應計債務(該術語在《羊絨僱傭協議》中有定義),並且,在克什米爾女士履行《羊絨僱傭協議》規定的義務的前提下,克什米爾女士還有權獲得以下福利:(I)相當於克什米爾女士當時12個月基本工資的金額,在發放生效日期(該術語在《羊絨就業協議》中定義)之後,在我們定期安排的工資發放日以等額分期付款的方式支付;(Ii)在羊絨女士離職後60天內一次性一次性支付相當於上一年(br}羊絨女士被解僱時)賺取的任何未付獎金的金額;及(Iv)如果當選,我們將根據羊絨僱傭協議的條款和條件以及適用的法律和法規,向羊絨女士償還長達12個月的某些眼鏡蛇健康福利。
儘管有上述規定, 如果我們(或任何尚存或收購的公司)在控制權變更生效日期(定義見《羊絨僱傭協議》)生效前90天內和生效後24個月內,無故終止凱什米爾女士的僱傭關係,或凱什米爾女士有正當理由辭職,則凱什米爾女士將有權獲得應計債務,並受凱什米爾女士遵守《羊絨僱傭協議》規定的義務的制約。卡什米爾女士有資格在與我們無故終止僱傭關係及下列各項相同的 條件下領取離職金,但如果控制權變更是公司所有權的變更、公司實際控制權的變更或公司大部分資產所有權的變更,終止合同應支付的遣散費(或剩餘款項)的累計金額應在控制權變更後30天內一次性支付:(I)凱什米爾女士在終止合同的當年將獲得相當於凱什米爾基本工資的30%(30%)的獎金,在凱什米爾女士被解僱後60天內一次性支付;及(Ii)倘若吾等向羊絨女士發出的任何股權獎勵 於控制權變更結束時仍未清償,而控制權變更中尚存的實體(根據其條款)接管或繼續(根據其條款),則該等股權獎勵的未歸屬部分將於羊絨女士終止時成為 歸屬。
根據《羊絨僱傭協議》,我們可以書面通知凱什米爾女士,隨時終止對凱什米爾女士的僱傭。如果卡什米爾女士的僱傭關係在任何時間因任何原因被終止,卡什米爾女士將不會獲得離職金或任何其他遣散費 補償或福利,但根據我們的標準工資政策,我們將向卡什米爾女士支付應計債務。 卡什米爾女士可以在不少於30天的提前書面通知我們辭職後的任何時間辭去她在我們公司的工作。如果卡什米爾女士因任何原因(正當理由辭職除外)辭去我們的工作,卡什米爾女士將不會獲得離職金或任何其他遣散費補償或福利,但我們將支付並提供 應計債務。
克什米爾女士有權獲得某些遣散費福利的條件之一是,她有義務簽署並交付一份有效的免責聲明(如《羊絨僱傭協議》中所定義的),其形式為我們可以接受的60這是終止後的第二天或新聞稿中規定的較早日期。
| 128 |
尼古拉斯·拉貝拉,Jr.
2018年12月28日,我們與小Nicholas A.LaBella,Jr.簽訂了僱傭協議。根據LaBella僱傭協議的條款,他擔任首席科學官和研發部門的高級副總裁 ,每年基本工資為325,000美元,該基本工資金額會受到董事會或薪酬委員會的定期調整 。
此外,根據拉貝拉僱傭協議,拉貝拉先生有資格獲得年度獎金,目標金額相當於拉貝拉先生基本工資的35%。每筆年度獎金的實際金額將基於我們和格洛弗先生就年度獎金所涉及的日曆年度所確立的公司目標的實現程度。 此外,根據其僱傭協議的條款,拉貝拉先生有資格根據我們現有的股權激勵計劃或我們未來可能採取的任何其他股權激勵計劃不時獲得股權獎勵 ,而此類獎勵的條款和條件(如果有)將由我們的董事會或薪酬委員會酌情決定。
如果 在生效日期之後的任何時間,而不是在控制權變更期間(如LaBella僱傭協議所定義),我們無故終止LaBella先生的僱傭(如LaBella僱傭協議所定義),則受LaBella先生在終止僱傭後六十(60)天內執行且未撤銷對公司的全面索賠的約束,Labella先生將有權獲得:(I)繼續領取其基本工資的六個月,包括按比例計算的年度獎金,減去適用的聯邦和州扣繳税款,按照公司正常的工資發放方式支付工資; (2)相當於(A)COBRA規定的每月醫療和牙科保險保費與(B)6的乘積的款項,將於 60支付這是(I)於有關僱傭關係終止後第二日;(Iii)歸屬受LaBella先生於緊接有關僱傭關係終止後六個月內將會歸屬的任何購股權及股權獎勵的股份數目;及(Iv)於僱傭關係終止後三個月行使既有股份,但須受其受僱期間授出的購股權所規限。
如果, 在控制權變更開始的12個月期間(如拉貝拉僱傭協議所定義),我們無故終止了拉貝拉先生的僱傭(如拉貝拉僱傭協議所界定的),或他有正當理由辭職(如拉貝拉僱傭協議所界定),則受其執行且不撤銷在該僱傭終止後60天內以本公司可接受的形式對本公司提出的索賠、以及上述遣散費和福利的限制。LaBella先生終止時持有的受任何股票期權和股權獎勵約束的100%未歸屬股份將加速並完全歸屬,他將有權在終止僱傭後的六個月內行使既有股份,但須遵守LaBella先生受僱期間授予的期權。
2022年7月20日,我們與小Nicholas A.LaBella,Jr.簽訂了一份新的高管聘用協議。(“新拉貝拉協議”) 於完成業務合併後生效,據此,吾等同意在業務合併完成後,根據新拉貝拉協議的條款及條件,繼續留任拉貝拉先生為我們的首席科學官及研發總監高級副總裁。新拉貝拉協議取代了拉貝拉僱傭協議。 根據新拉貝拉協議,拉貝拉先生的僱用條件包括,他同意並簽署專有信息和限制性契約協議。
根據新拉貝拉協議的條款,拉貝拉先生將繼續擔任首席科學官和研發部門高級副總裁總裁,並根據我們的標準工資慣例,每年獲得40萬美元的基本工資。 拉貝拉先生的基本工資和未來的薪酬增長將由董事會定期審查和批准。 此外,拉貝拉先生還有資格獲得年度績效現金獎金,目標金額相當於拉貝拉先生基本工資的35%。須由董事會根據拉貝拉先生實現某些業績目標的情況進行審查和調整。LaBella先生是否獲得年度獎金還取決於LaBella先生在支付獎金時是否繼續受僱於我們,否則年度獎金將被沒收。此外,根據新的拉貝拉協議的條款,拉貝拉先生可能有資格獲得我們普通股的某些股權獎勵,但須受歸屬和我們授予獎勵的股權計劃的其他條款和條件以及我們將提供並與拉貝拉先生簽訂的協議的限制。LaBella先生也有資格在與類似職位的員工相同的基礎上參加我們的福利計劃,在他任職期間 生效。
根據新拉貝拉協議,吾等可在書面通知拉貝拉先生後,隨時無故終止聘用拉貝拉先生(該詞在新拉貝拉協議中定義)。如果我們之前沒有通知LaBella先生我們打算終止他的僱傭關係,LaBella先生可以有充分的理由(該術語在新LaBella 協議中定義)在30天內書面通知我們,我們有30天的時間來解決LaBella先生認為是好的理由的條件,但受新LaBella協議中規定的某些條件的限制。如果LaBella先生因正當理由辭職, 並且該終止構成離職(該術語在新LaBella協議中定義),則 在LaBella先生履行其在新LaBella協議下的義務的情況下,LaBella先生有資格獲得 離職福利(該條款在新LaBella協議中定義),條款和條件與他有權因我們無故終止其僱傭關係而享有的條款和條件相同。
如果我們在任何時間無故終止拉貝拉先生的僱用,或者拉貝拉先生出於正當理由辭職,但這種終止構成離職,則拉貝拉先生有權獲得應計債務(如新拉貝拉協議中所定義的),並且,在拉貝拉先生履行其在新拉貝拉協議下的義務的情況下,拉貝拉先生還應有權獲得以下福利:(I)相當於拉貝拉先生當時12個月基本工資的金額,在發佈生效日期(該術語在新拉貝拉協議中定義)之後,在我們定期安排的工資單日期以等額分期付款方式支付;(Ii)在LaBella先生被解僱後60天內一次性一次性支付相當於LaBella先生被解僱前一年所賺取的任何未付獎金的金額; 及(Iv)如果當選,我們將向LaBella先生償還長達12個月的某些眼鏡蛇健康福利,每一種情況下都要遵守新LaBella協議的條款和條件以及適用的法律和法規。
| 129 |
儘管有上述規定,如果我們(或任何尚存或收購的公司)無故終止拉貝拉先生的僱傭,或拉貝拉先生在控制權變更生效日期(定義見拉貝拉僱傭協議)前90天內及生效日期後24個月內因正當理由辭職,則拉貝拉先生將有權獲得應計債務,並在拉貝拉先生遵守他在新拉貝拉協議下的義務的情況下,拉貝拉先生有資格在與我們無故終止其僱傭關係和下列各項相同的條件下獲得離職福利,但條件是,如果控制權變更是公司所有權的變更、公司實際控制權的變更或公司大部分資產所有權的變更,應在控制權變更後30天內或在控制權變更後30天內一次性支付終止合同的遣散費的累計金額 :(I)拉貝拉先生將在其終止合同的當年獲得相當於拉貝拉先生基本工資的35%(35%)的獎金,在拉貝拉先生終止合同後60天內一次性支付;及(Ii)倘若吾等向LaBella先生發出的任何股權獎勵於控制權變更結束時仍未完成,而控制權變更中尚存的實體(根據其條款) 接管或繼續 ,則該等股權獎勵的未歸屬部分將於LaBella先生終止時100%歸屬。
根據新拉貝拉協議,吾等可在書面通知拉貝拉先生後,隨時以任何理由終止聘用拉貝拉先生。 如拉貝拉先生因任何原因而被終止聘用,拉貝拉先生將不會獲得遣散費福利或任何 其他遣散費或福利,但根據我們的標準薪酬政策,我們將向拉貝拉先生支付應計的 債務。LaBella先生可以在不少於30天的提前書面通知我們的情況下,隨時辭去他在我們公司的工作。如果LaBella先生因任何原因(好的原因辭職除外)辭去我們的工作,LaBella先生將不會獲得離職金或任何其他遣散費或福利,但我們將支付並 提供應計債務。
拉貝拉先生有權獲得某些遣散費福利的條件之一是,他有義務簽署並 以我們可以接受的形式提交有效的解除(如新拉貝拉協議中定義的那樣)這是終止後的第 天或新聞稿中規定的較早日期。
小尼古拉斯·A·拉貝拉於2023年8月18日退休。
巴勃羅·A·古茲曼,醫學博士
2023年1月26日,我們與巴勃羅·古茲曼博士簽訂了一項高管聘用協議(“古茲曼聘用協議”),該協議在完成業務合併後生效,據此,吾等同意終止與古茲曼博士之間的任何未完成的諮詢協議,並保留古茲曼博士為我們的首席醫療官和醫療事務部的高級副總裁,但須遵守古茲曼聘用協議的條款和條件。根據《古茲曼就業協議》,除其他事項外,古茲曼博士的就業條件包括他同意並簽署專有信息和限制性公約協議。
根據古茲曼僱傭協議的條款,古茲曼博士將擔任首席醫療官和醫療事務部的高級副總裁,並根據我們的標準工資慣例獲得每年350,000美元的基本工資。古茲曼博士的基本工資和未來的薪酬增長將由董事會定期審查和批准。此外,古茲曼博士有資格獲得基於績效的年度現金獎金,目標金額相當於古茲曼博士基本工資的30%(30%),董事會將根據古茲曼博士實現某些業績目標的情況進行審查和調整。古茲曼博士是否獲得年度獎金還取決於古茲曼博士在支付獎金時是否繼續受僱於我們,否則年度獎金將被沒收。此外,根據古茲曼僱傭協議的條款,古茲曼博士可能有資格獲得我們普通股的某些股權獎勵,條件是授予獎勵的我們的股權計劃的歸屬和其他條款和條件,以及我們將提供並與古茲曼博士簽訂的協議。古茲曼博士也有資格在與處境相似的員工相同的基礎上參加我們的福利計劃,該計劃在他受僱期間不時生效。
| 130 |
根據古茲曼僱傭協議,我們可在書面通知古茲曼博士後,隨時無故終止對古茲曼博士的僱用(該術語在古茲曼僱傭協議中有定義)。如果我們之前沒有通知古茲曼博士我們打算終止他的僱傭關係,古茲曼博士可以在30天內向我們發出書面通知後,以正當理由(該術語在古茲曼僱傭協議中定義)辭去他在我們的工作,並在30天內治癒古茲曼博士認為是正當理由的條件,但要遵守古茲曼僱傭協議中規定的某些條件。如果古茲曼博士因良好的 理由辭職,並且該解僱構成離職(如古茲曼僱傭協議中的定義),則在古茲曼博士履行其在古茲曼僱傭協議下的義務的情況下,古茲曼博士有資格 按他有權在我們無故終止其僱傭關係的相同條款和條件下獲得離職福利(該條款在古茲曼僱傭協議中定義)。
如果我們在任何時間無故終止對古茲曼博士的僱用,或古茲曼博士出於正當理由辭職,且該終止構成離職,則古茲曼博士有權獲得應計債務(如古茲曼僱傭協議中所定義),並且,在古茲曼博士履行其在古茲曼僱傭協議下的義務的情況下,古茲曼博士還應有權獲得以下福利:(I)相當於古茲曼博士當前12個月基本工資的金額,在發放生效日期(古茲曼僱傭協議中對該術語的定義)之後,在我們定期安排的工資單日期以等額分期付款方式支付;(Ii)在古茲曼博士離職後60天內一次性一次性支付相當於古茲曼博士離職前一年所賺取的任何未付獎金的金額; 和(Iv)如果當選,我們將向古茲曼博士償還長達12個月的某些眼鏡蛇醫療福利,在每種情況下都要遵守古茲曼僱傭協議的條款和條件以及適用的法律和法規。
儘管有上述規定,如果我們(或任何尚存或收購的公司)無故終止對古茲曼博士的僱用,或古茲曼博士在控制權變更生效日期(如《古茲曼僱傭協議》所定義)生效日期前90天內和生效日期後24個月內有充分理由辭職,則古茲曼博士將有權獲得應計債務,並在古茲曼博士履行其在《古茲曼僱傭協議》下的義務的前提下,古茲曼博士有資格獲得離職福利,條件與他有權在我們無故解僱他的情況下領取福利的條件相同,但條件是,如果控制權變更是公司所有權的變更、公司實際控制權的變更或公司大部分資產所有權的變更,終止合同的應付(或剩餘應付)遣散費的累計金額 應在控制權變更後30天內一次性支付:(I)古茲曼博士終止合同的當年將獲得相當於古茲曼博士基本工資30%(30%)的獎金,並在古茲曼博士終止合同後60天內一次性支付;及(Ii)倘若吾等向古茲曼博士發出的任何股權獎勵於控制權變更結束時仍未清償,而該控制權變更中的倖存實體(根據其條款)接管或繼續(根據其條款),則該等股權獎勵的未歸屬部分將於古茲曼博士終止時100%歸屬。
根據《古茲曼僱傭協議》,在書面通知古茲曼博士後,我們可以隨時終止對古茲曼博士的僱用。 如果古茲曼博士的僱傭因任何原因而在任何時間被終止,古茲曼博士將不會獲得離職金或任何其他遣散費補償或福利,但根據我們的標準工資政策,我們將向古茲曼博士支付應計的 義務。古茲曼博士可在不少於30天前向我們發出辭職書面通知,隨時辭去在我們的工作。如果古茲曼博士因任何原因(正當理由辭職除外)辭去我們的工作,古茲曼博士將不會獲得離職福利或任何其他遣散費補償或福利,但我們將支付並提供應計債務。
古茲曼博士有權獲得某些遣散費福利的條件之一是,他有義務以我們可以接受的形式簽署並交付有效的解除合同(如古茲曼僱傭協議中定義的那樣)。Th 在此之前的一天,或在此之前的一天,或在此之前。
2023年1月26日,我們董事會的薪酬委員會批准授予古茲曼博士可行使的2,858股我們普通股的期權,行權價為73.85美元。
年度現金獎金
根據他們的僱傭協議或聘書(視情況而定),每個NEO都有資格獲得基於公司和個人實現董事會酌情確定的業績目標的現金獎勵獎金。2021年,近地天體未參加 年度現金獎勵獎金計劃,但可能有資格參加2022年1月1日生效的年度現金獎勵獎金計劃。在2022財年,我們的每個近地天體都有資格獲得一個目標獎金金額,該金額反映了其年度基本工資的一個百分比。董事會還有權根據具體情況向我們的近地天體發放額外的酌情獎金 。在截至2022年12月31日的財政年度內,授予近地天體的任何可自由支配的獎金均列於上文標題為“-《高管聘用協議》
員工 福利計劃
除了每個指定高管的僱傭協議(如上所述)中規定的任何個人福利外,根據適用法律,提名的 高管通常有資格在與公司其他員工相同的基礎上參與我們的高管和員工健康及其他員工福利計劃。
我們的 員工福利計劃包括我們的醫療、牙科、視力、團體人壽和意外死亡和肢解保險計劃,在每個 案例中,其基礎與我們所有其他員工相同。
| 131 |
獎勵 安排
2014股權激勵計劃
我們 有權根據2018年10月9日、2019年2月2日和2021年2月2日修訂的2014年股權激勵計劃(“2014計劃”)頒發獎勵。根據2014年計劃,自2021年12月31日起,授權發行285,714股我們的普通股 。2014計劃下可供發行的普通股數量應在2014計劃期限內自2019年開始的每個日曆年1月份的第一個交易日自動增加,增加的金額相當於前一日曆年12月份最後一個交易日已發行普通股總數的5% (5%),但在任何情況下,此類年度增加不得超過2,857股普通股。2014年計劃規定向我們及其附屬公司的員工、董事和顧問發放激勵性股票期權、非法定股票期權、普通股購買權、股票增值權、限制性股票 和限制性股票單位。2014計劃要求股票期權的行權價格 不低於授予之日我們普通股的公允價值。截至2021年12月31日,根據2014年計劃,可供未來發行的股票為30,519股。
2014年計劃修正案
2022年12月12日,為完成業務合併,本公司批准了對2014年計劃的修訂 (《2014計劃修訂》)。2014年計劃修正案規定,完成業務合併後,2014年計劃下保留和可供發行的普通股股份不得進一步增加 ,2014年計劃下不再授予新的獎勵。2014年計劃修正案的上述摘要由2014年計劃修正案全文限定 作為本招股説明書的附件,並以引用的方式併入本文
2022年綜合股權激勵計劃
以下是對《2022年綜合股權激勵計劃》(以下簡稱《2022年計劃》)主要條款的説明,是對《2022年計劃》全文的總結。
管理。 總體而言,2022計劃將由董事會薪酬委員會管理。薪酬委員會將確定哪些人可以購買普通股、股票增值權(或SARS)、限制性股票單位、受限或非限制性普通股、績效股票、績效單位、激勵獎金、 其他股票獎勵和其他現金獎勵。薪酬委員會還可制定規則和條例 ,以管理2022年計劃以及修訂或修改未決賠償金。薪酬委員會可根據適用法律和《2022年計劃》, 授權首席執行官和其他高管向員工(他們本人除外)授予期權和其他獎勵。在2022年計劃生效日期即2032年(或到期日)後10年或之後,不得根據2022年計劃作出任何期權、股票購買權或獎勵,但2022年計劃此後將繼續 ,而之前授予的期權、SARS或其他獎勵仍未完成。
| 132 |
資格。 根據2022年計劃,有資格獲得期權、SARS或其他獎勵的人士是薪酬委員會認為能夠為我們的成功做出貢獻的本公司及其子公司的員工、高級管理人員、董事、顧問、顧問和其他個人服務提供商,或薪酬委員會認為是公司或任何子公司的未來員工、高管、 高管、董事、顧問、顧問或其他個人服務提供商的任何人士。截至2022年10月31日,公司及其子公司共有七名員工,其中包括四名高管和兩名非僱員董事。由於2022計劃下的 獎勵是薪酬委員會的自由裁量權,我們無法確定上述每個類別中有多少人將獲得獎勵。
受2022年計劃約束的股票 。根據2022年計劃的調整條款和下文所述的自動增持規定,根據2022年計劃可能發行的普通股的最大總數為41,517股。
根據2022年計劃可供發行的普通股數量將於1月1日自動增加ST每年的 ,從2023年1月1日開始,此後每年1月1日至到期日,金額相當於我們在12月31日發行的普通股總數的4%ST除非董事會在此之前採取行動,規定該年度的股份儲備不會增加,或該年度的股份儲備增加的普通股數量將少於其他情況下增加的普通股數量。
根據《2022年計劃》,可根據《2022年計劃》授予最多71,429股根據《2022年計劃》授權發行的普通股,這些股票期權或ISO旨在滿足修訂後的《1986年國內收入法》第422節的要求 。根據前款規定可供發行的普通股增發股份不得受國際標準化組織的約束。
如果 根據2022年計劃授予的任何期權或SAR在尚未全部行使或任何獎勵被沒收的情況下終止,或普通股股票 被扣繳以支付期權或其他獎勵的預扣税款,或用於支付期權的行使價或獎勵的購買價 ,則被沒收的被扣留或支付的普通股數量將可用於2022計劃下的未來授予。以現金結算的獎勵將不計入根據2022年計劃可供發行的 股票數量。
在任何日曆年度,非僱員董事不得獲得會計價值超過250,000美元的獎勵(包括非僱員董事在該年度獲得的任何現金獎勵,但不是根據2022年計劃);但如果是新的非僱員董事,則在非僱員董事任期的最初一年,這一金額將增加到500,000美元。
根據2022年計劃授權發行的股份數量和前述股份限制受股票拆分、股票分紅、類似交易或影響我們普通股的任何其他變化的慣常調整 。
期權條款 和條件。根據2022年計劃授予的期權可能是不符合守則第422節要求的ISO或“非法定股票期權” 。薪酬委員會將確定根據2022年計劃授予的期權的行權價格。股票期權的行權價格不得低於授予之日我們普通股的每股公允市值(如果是授予10%股東的ISO,則不得低於公允市值的110%)。
如果普通股在授予日在證券交易所上市或在納斯達克股票市場自動報價系統中報價,則公允市場價值通常為授予日(或授予日 日未發生交易)前最後一個交易日的收盤價。如果沒有這樣的價格,公平市場價值將由賠償委員會基於合理應用合理的估值方法 真誠地確定。
| 133 |
自授予之日起, 期權不得超過十年(如果ISO授予10%的股東,則為五年)。根據2022年計劃授予的期權將在薪酬委員會在授予時規定的一個或多個時間內行使。任何員工在任何日曆年首次可行使的ISO金額不得超過100,000美元。
薪酬委員會可酌情允許期權持有人在期權以其他方式行使之前行使該期權, 在這種情況下,我們發行給接受者的普通股股票將繼續遵守 行使前適用於該期權的歸屬要求。
通常,期權價格可以現金支付,也可以通過保兑支票、銀行匯票或匯票支付。賠償委員會可允許其他付款方式 ,包括(A)通過交付公平市值等於購買價格的普通股股票, (B)通過具有賠償委員會允許的條款的有全額追索權的計息本票,或(C)這些方法的組合,如授標協議中規定的或賠償委員會以其他方式決定的。薪酬委員會 被授權建立無現金行權計劃,並允許履行行權價格(或預扣税款義務) ,方法是從行權時可發行的股票中減去一些公平市值等於行權價格的股票。
除遺囑或繼承和分配法外,不得轉讓任何選擇權,在接受者有生之年,選擇權只能由接受者行使。但是,補償委員會可允許期權、特別行政區或其他獎勵的持有人將期權、權利或其他獎勵轉讓給直系親屬、用於遺產規劃的家庭信託或將禮物轉讓給慈善機構。薪酬委員會將決定股票期權持有人在終止與我們的服務後可在多大程度上行使該期權。
股票 增值權利。補償委員會可能會根據2022年計劃批准SARS。賠償委員會將決定適用於SARS的其他條款。香港特別行政區的每股行使價格將不低於授予日我們普通股的公平市值的100% ,由補償委員會決定。根據《2022年規劃》授予的任何特區的最長期限為自授予之日起十年。一般而言,每個特區均會在運動時給予參加者一筆相等於以下金額的款項:
| ● | 行使日一股我們普通股的公允市值超過行權價的 乘以 | |
| ● | 香港特別行政區涵蓋的普通股股數。 |
支付 可以是我們普通股的股票,也可以是現金,或者部分是普通股,部分是現金,所有這些都由薪酬委員會決定。
受限股票和受限股票單位。薪酬委員會可根據2022年計劃授予限制性普通股和/或限制性股票 個單位。限制性股票獎勵包括轉讓給參與者的股票,但受限制 ,如果不滿足指定條件,這些限制可能會導致沒收。限制性股票單位授予在薪酬委員會指定的特定條件達到或之後的未來日期接受我們普通股、現金或股票和現金組合的權利 。適用於每次授予限制性股票或限制性股票 單位的限制和條件可能包括基於業績的條件。與限制性股票有關的股息或分配可在向股東支付股息時或在限制性股票歸屬時支付給股份持有人,由補償委員會確定。如果任何股息或分配是在限制性股票歸屬之前以股票支付的,則它們將受到相同的限制。 受限股票單位可在向股東支付現金股息時支付股息等值金額,或在單位歸屬時支付 股息等值金額。除非薪酬委員會另有決定,否則限制性股票的持有者將有權投票表決股票。
| 134 |
績效 股票和績效單位。薪酬委員會可根據2022年計劃授予績效股和/或績效單位。績效股票和績效單位是以股票或美元計價的獎勵,在特定的 績效期間根據達到薪酬委員會制定的績效標準而賺取。薪酬 委員會將確定適用於每個績效股票和績效單位獎勵的限制和條件。
獎勵 獎金。薪酬委員會可根據2022年計劃不定期發放激勵性獎金。獎勵 獎金的條款將在獎勵協議中規定。每份獎勵協議將有薪酬委員會確定的條款和條件,包括績效目標和根據這些目標的實現情況支付的金額。獎勵獎金以現金和/或普通股形式 支付。
其他 基於股票和現金的獎勵。薪酬委員會可根據《2022年計劃》授予其他類型的股權或現金獎勵,包括授予或出售沒有歸屬要求的普通股股票,以及在滿足薪酬委員會可能施加的條件的情況下獲得一筆或多筆現金付款的權利。
某些公司交易的影響 。補償委員會可在授予裁決時規定控制權變更(如《2022年計劃》所界定)對任何裁決的影響,包括(1)加快或延長行使、歸屬於任何裁決或從任何裁決中實現收益的期限,(2)取消或修改裁決的業績或其他條件,或(3)按補償委員會所確定的等值現金價值現金結算裁決。賠償委員會可酌情采取下列一項或多項行動,視控制權的變動而定:(A)使任何或所有未清償期權和SARS立即全部或部分可行使;(B)使任何其他賠償全部或部分不可沒收;(C)取消任何期權或特別行政區以換取替代期權;(D)取消對限制性股票、限制性股票單位、履約股份或績效單位的獎勵,以換取任何繼承人的股本的類似獎勵;。(E)贖回任何限制性股票以換取現金和/或其他替代對價;。(F)取消或終止任何現金和/或其他替代對價的獎勵,以換取相當於參與者在控制權變更發生之日行使此類獎勵或實現權利時應獲得的金額(如果有)的現金和/或財產,但如果關於任何期權或特別行政區的控制權對價的改變 不超過其行使價格,則可以取消該期權或特別行政區,而無需支付任何對價; 或(G)對賠償委員會認為必要或 適當的其他未支付賠償金進行修改、調整或修改。
修改, 終止。董事會可隨時修訂2022年計劃,以滿足守則或其他適用法律或法規的要求或任何其他法律目的,但未經股東同意,董事會不得(A)增加2022年計劃下的普通股數量,(B)改變有資格獲得期權、SARS和/或其他獎勵的個人羣體,或(C)延長2022年計劃的期限。
其他 信息
沒有提供美國證券交易委員會委託書規則中描述的 “新計劃福利”表,因為2022計劃下的期權和 其他獎勵的授予是可自由支配的,我們現在無法確定未來將向任何特定個人或羣體授予 期權或獎勵的具體數量或類型。
美國 聯邦所得税後果
以下是2022年計劃下OPTION和其他贈款的美國聯邦所得税後果摘要。建議根據2022年計劃授予的其他權利和獎勵的受購人和接受者在行使期權或 特別行政區或處置因行使期權或特別行政區或在授予和支付任何獎勵後收到的任何股票之前諮詢其個人税務顧問。 此外,以下摘要基於對現行法律、現行法律、司法裁決、行政裁決、法規和擬議法規的分析,所有這些都可能發生變化,不涉及州、地方、外國或其他 税法。
| 135 |
選項的處理
《準則》區別對待激勵性股票期權和非法定股票期權。然而,對於這兩類期權,在授予2022年計劃下的期權時,不會向期權受讓人確認任何收入,本公司屆時也不會有權享受減税 。
一般而言,在行使非法定股票期權(包括擬作為激勵性股票期權但在行使時並未繼續符合此資格的期權)時,期權受讓人將就行使日股票的公平市值超過期權價格確認普通所得税。本公司將有權獲得減税,減税金額等於受購人在包括受購人的納税年度結束在內的會計年度中確認的普通收入。我們將被要求 滿足適用的預扣要求,才有權享受税收減免。一般來説,如果期權接受者在行使非法定股票期權時,以部分或全部支付期權價格的方式投標我們普通股的股份,投標將不會確認任何收益或損失 。然而,如果投標的股份是在行使激勵性股票期權時獲得的 ,而投標是在授予之日起兩年內或激勵性股票期權行使之日後一年內進行的,則投標 將是對行使激勵性股票期權時獲得的股份的喪失資格的處置。
對於 激勵性股票期權,期權持有人在行使時不存在應税收入。然而,在決定“替代最低税額”是否適用於行權年度時,將考慮股票在行權日期的公平市價 超過行權價格的情況。如果行權時收購的股份持有至授予之日起至少兩年,行權之日起一年以上,則出售該等股份所產生的任何損益,如作為資本資產持有,則為長期資本收益或虧損(以股票售價與行權價格之間的差額衡量)。根據當前的聯邦所得税法,長期資本利得的税率將低於普通收入的最高税率。如果不符合兩年和一年持有期的要求(“取消資格處置”),期權受讓人將在處置年度確認普通收入,其數額等於(I)股票在行使日的公允市值減去行使價或(Ii)處置變現金額減去行使價中的較小者。 收益的剩餘部分將被視為長期資本收益,具體取決於該股票是否已持有一年以上。如果期權接受者 作出取消資格的處置,本公司將有權獲得相當於期權接受者確認的普通收入的減税。
在一般情況下,如果期權接受者在行使激勵性股票期權時,以部分或全部支付期權價格的方式投標普通股股份,投標時不會確認任何收益或損失。然而,如果投標股份是在行使另一項激勵性股票期權時獲得的,而投標是在授予日起兩年內或另一項期權行使日期 後一年內進行的,則投標將是對行使另一項期權所獲得的股份的喪失資格的處置。
如上文 所述,行使激勵性股票期權可使期權接受者繳納替代性最低税額。對任何特定期權持有人適用替代性最低税額取決於行使年度內與期權持有人有關的特定事實和情況。然而,作為一般規則,普通股在期權行使之日的公允市值超過期權行權價格的金額將構成一項“調整”項目,以確定可對其徵收替代税的替代最低應納税所得額。因此,此項目將進入計算替代最低税的計税基礎,因此可能導致替代最低税在任何給定年度都適用 。
股票增值權的處理
一般情況下,特區的接受者不會在授予特區時確認任何收入,屆時我公司也將無權扣除。 在行使特區時,持有人將確認普通收入,我公司一般將有權獲得相應的扣除, 相當於當時我們普通股的公允市值超過行使價的部分。
| 136 |
股票獎勵的處理
通常情況下, 如果沒有根據《守則》第83(B)條當前要徵税的選擇(或第83(B)條),則在授予限制性股票獎勵或績效股票獎勵時,不會對接受者或本公司產生聯邦收入 税收後果。在限制期屆滿及適用於受限制股份的任何其他限制獲得滿足後,收受人將確認普通收入,本公司一般將有權獲得相當於當時普通股公平市價的相應扣除 。如果在授予限制性股票獎勵之日起30天內作出第83(B)條的選擇,接受者將在收到限制性股票時確認一筆普通收入,本公司 一般將有權獲得相應的扣除,相當於當時股票的公平市值(在不考慮適用限制的情況下確定) 減去接受者為股票支付的任何金額。如果作出第83(B)條的選擇,則在股份限制失效時(以及在出售該等股份之前),接受者不會確認額外的 收入,但如果股份隨後被沒收,接受者不得扣除在收到股份時根據第83(B)條確認的收入 。
非限制性股票獎(包括業績單位獎)的 獲獎者將確認普通收入,我們公司通常將有權獲得相應的扣除,相當於獎項頒發時作為獎勵對象的普通股的公平市值 。
限制性股票單位的接受者一般會在單位歸屬和結算時確認普通收入。收益的金額將等於我們當時發行的普通股的公允市值,我們公司將有權 獲得相應的扣除。限制性股票單位的接受者將不被允許就該裁決作出第83(B)條的選擇 。
激勵性獎金和其他股票或現金獎勵的處理
通常情況下,獎勵獎金或其他基於股票或現金的獎勵的獲得者在獎勵授予時不會確認任何收入,同時本公司屆時也無權獲得扣減。在支付此類獎勵時,獲獎者將確認普通 收入,我們公司通常將有權獲得相應的扣減,相當於支付的現金金額和/或我們當時發行的普通股的公平市場價值。
公司扣除額的潛在限制
《守則》第(Br)162(M)節一般不允許公共控股公司在一個課税年度向其首席執行官和某些其他“受保僱員”支付超過100萬美元的補償的減税。我們的董事會和薪酬委員會 打算考慮第162(M)條對根據2022年計劃發放的贈款的潛在影響,但保留批准超過第162(M)條扣減限額的高管期權和其他獎勵的贈款 的權利。
預繳税款
根據《2022年計劃》,我們有權在適當的時候要求購買普通股的每一位受購人和獲得普通股獎勵的每一位受讓人繳納法律規定須預扣的任何聯邦、州或地方税。
| 137 |
未償還的 2022財年年底的股權獎勵
下表彙總了截至2022年12月31日,我們每位被任命的高管所持有的普通股標的已發行股票期權的股票數量:
| 選項 獎項(1) | ||||||||||||||||
| 名字 | 授予日期 | 證券 可行使的基礎未行使期權(#) | 證券 基礎未行使期權不可行使(#) | 期權 行權價(美元) | 選項 到期日期 | |||||||||||
| 史蒂芬·C·格洛弗 | ||||||||||||||||
| 聯合創始人兼首席執行官, | 4/11/2014 | 3,971 | (2) | - | 176.05 | 04/11/2024 | ||||||||||
| 和主席 | 10/28/2016 | 4,822 | (6) | - | 176.05 | 10/28/2026 | ||||||||||
| 4/2/2019 | 7,567 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 2/8/2021 | 1,201 | (10) | 2,403 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 2/3/2022 | - | 2,270 | (12) | 572.60 | 02/03/2032 | |||||||||||
| 小尼古拉斯·A·拉貝拉 | ||||||||||||||||
| 首席科學官兼 | 4/11/2014 | 568 | (2) | - | 176.05 | 04/11/2024 | ||||||||||
| 總裁副主任 | 6/9/2015 | 1,135 | (4) | - | 176.05 | 06/09/2025 | ||||||||||
| 研究與開發 | 10/30/2017 | 1,702 | (7) | - | 176.05 | 10/30/2027 | ||||||||||
| 4/2/2019 | 1,135 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 2/8/2021 | 284 | (10) | 567 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 1/28/2022 | - | 851 | (11) | 572.60 | 01/28/2032 | |||||||||||
| 卡倫·A·卡什米爾 | ||||||||||||||||
| 首席商務官 | 9/10/2014 | 284 | (3) | - | 176.05 | 09/10/2024 | ||||||||||
| 10/30/2017 | 568 | (7) | - | 176.05 | 10/30/2027 | |||||||||||
| 4/2/2019 | 851 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 2/8/2021 | 208 | (10) | 416 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 1/28/2022 | - | 624 | (11) | 572.60 | 01/28/2032 | |||||||||||
| 彼得·沃爾夫 | ||||||||||||||||
| 首席財務官 | 10/21/2015 | 284 | (5) | - | 175.05 | 10/20/2025 | ||||||||||
| 和局長 | 10/30/2017 | 284 | (8) | - | 176.05 | 10/30/2027 | ||||||||||
| 04/02/2019 | 1,135 | (9) | - | 405.30 | 04/02/2029 | |||||||||||
| 02/08/2021 | 208 | (10) | 416 | (10) | 572.60 | 02/08/2031 | ||||||||||
| 01/28/2022 | - | 624 | (11) | 572.60 | 01/28/2032 | |||||||||||
| (1) | 本表所述的所有 未償還股票期權獎勵(“ZyVersa期權”) 均根據ZyVersa 2014股票計劃(“2014計劃”)授予,可對ZyVersa普通股股票行使 。某些選項會在發生 特定事件時加速。為使業務合併生效,期權相關股份數量和行使價已進行調整 。 |
| (2) | 2014年4月11日,我們授予了為期10年的股票期權,購買了總計4,539股普通股,這些普通股在三年內按年等額分期付款, 行權價為每股176.05美元,它代表我們的普通股在授予日的市場價格。 |
| (3) | 2014年9月10日,我們授予了為期10年的股票期權,購買了總計284股普通股,這些普通股在三年內按年等額分期付款, 行權價為每股176.05美元,代表授予日我們普通股的市場價格。 |
| (4) | 2015年6月9日,我們授予了購買1,135股普通股的10年期股票期權,這些股票在三年內按年等額分期付款,行權價 為每股176.05美元。它代表我們普通股在授予日期 的市場價格。 |
| (5) | 2015年10月21日,我們授予了購買284股普通股的10年期股票期權,普通股在三年內按年等額分期付款,行權價 為每股176.05美元。它代表我們普通股在授予日期 的市場價格。 |
| (6) | 2016年10月26日,我們授予了購買4,822股普通股的10年期股票期權,這些股票立即歸屬,行權價為每股176.05美元, 代表授予日我們普通股的市場價格。 |
| (7) | 2017年10月30日,我們授予了10年期股票期權,購買了總計2270股普通股,其中三分之一立即歸屬,其餘歸屬於兩年內等額的年度分期付款,行使價為每股 176.05美元,代表我們普通股在授予日的市場價格。 |
| (8) | 2017年10月30日,我們授予了為期10年的股票期權,購買了總計284股普通股,其中25%立即歸屬,剩餘部分在三年內按年等額分期付款,行權價為每股176.05美元。其中 代表我們普通股在授予日的市場價格。 |
| (9) | 2019年4月2日,我們授予了10年期股票期權,購買了總計10,688股普通股,這些普通股在三年內按年等額分期付款, 行權價為每股405.30美元,它代表我們的普通股在授予日的市場價格。 |
| (10) | 2021年2月8日,我們授予了為期10年的股票期權,購買了總計5,703股普通股,這些普通股在三年內按年等額分期付款, 行權價為每股572.60美元,代表授予日我們普通股的市場價格。 |
| (11) | 2022年1月28日,公司授予了為期十年的股票期權,購買了總計2,099股普通股,這些普通股在三年內按年等額分期付款,行權價為每股572.60美元。它代表我們普通股在授予日的市場價格。 |
| (12) | 2022年2月3日,公司授予為期十年的股票期權,購買總計2,270股普通股,這些普通股在三年內按年等額分期付款 ,行權價為每股572.60美元,它代表我們普通股在授予日的市場價格。 |
| 138 |
董事 薪酬
下表列出了有關在2022年內擔任本公司董事會非僱員成員的每位員工所賺取或支付的薪酬信息。2022年,除下文另有描述外,我們沒有向董事會任何其他非僱員成員支付任何費用、進行任何股權獎勵或 支付任何其他薪酬。我們向董事會成員報銷因出席董事會會議而產生的合理差旅費用。
賺取的費用或 以現金支付 ($) | 庫存 獎項(1) ($) | 選擇權 獎項(1) ($) | 總計 ($) | |||||||||||||
| David·S·布里奧內斯(2) | - | - | - | - | ||||||||||||
| Raj Mehra博士,J.D.(2) | - | - | - | - | ||||||||||||
| 格雷戈裏·斯卡利奇(2) | - | - | - | - | ||||||||||||
| 克里斯托弗·特威蒂博士(2) | - | - | - | - | ||||||||||||
| Daniel·奧康納(3) | - | - | - | - | ||||||||||||
| 羅伯特·菲尼齊奧(4) | 37,000 | - | 128,465 | 165,465 | ||||||||||||
| 民哲公園(4) | 30,000 | - | 128,465 | 158,465 | ||||||||||||
| (1) | 報告的金額代表根據FASB ASC主題718計算的截至2022年12月31日的年度,根據我們的2014年股權激勵計劃授予董事的股票期權的授予日期公允價值合計。有關計算授出日期公允價值時使用的假設,請參閲我們的財務報表附註11。 |
| (2) | 業務合併完成後,個人 於2022年12月12日辭去公司董事會職務。 |
| (3) | Daniel 奧康納自成立以來一直是拉克斯珀的董事公司,並在業務合併完成後仍是公司的董事公司。 |
| (4) | 業務合併完成後,個人 於2022年12月12日被任命為公司董事會成員 。 |
授予本公司非僱員董事的購股權於三年內授予,其中33 1/3%的購股權於授出日期一週年時歸屬及可行使,33 1/3%歸屬及於購股權授出日期兩年週年日及33 1/3%歸屬時行使,並於購股權授出日期三年週年日行使,惟非僱員董事 須於適用歸屬日期前繼續留在本公司董事會。
董事會設置非僱員董事薪酬, 旨在提供必要的具有競爭力的薪酬,以吸引和留住高質量的非僱員董事,並鼓勵 持有我們的普通股,以進一步使他們的利益與我們股東的利益保持一致。2022年,公司每位非員工董事 有資格獲得30,000美元的年費。財務委員會的一名成員因擔任這一職務而額外獲得7,000美元。根據2014年計劃,公司還向非僱員董事授予股票期權。
Finizio先生每年將獲得40,000美元的現金預聘費(按本年度比例計算),以及作為薪酬委員會主席和審計委員會成員的額外現金預聘費15,000美元和8,000美元。根據本公司先前披露的2022年綜合股權激勵計劃(“2022年計劃”),Finizio先生還將獲得初始和年度期權授予。
樸博士每年將獲得40,000美元的現金預約費(按比例計算為本年度),並因其作為薪酬委員會成員的服務而額外獲得7,500美元的現金預付金。
O‘Connor先生每年將獲得40,000美元的現金預約費(按本年度的比例計算),以及作為審計委員會成員的額外保留現金8,000美元。根據2022年計劃,奧康納先生還將獲得初始和年度期權授予。
薩皮爾斯坦先生將獲得每年40,000美元的現金預聘費(按本年度比例計算),以及作為薪酬委員會和提名與公司治理委員會成員的額外現金預付金7,500美元和4,000美元。 薩皮爾斯坦先生還將根據2022年計劃獲得初始和年度期權授予。
弗雷塔格先生將獲得每年40,000美元的現金預聘費(按本年度比例計算),以及作為審計委員會主席和公司治理委員會成員服務的18,500美元的額外現金預聘費。根據2022年計劃,Freitag先生還將獲得初始和年度期權獎勵。
魯帕拉博士每年將獲得40,000美元的現金預聘費(按本年度比例計算),並因擔任董事會提名和公司治理委員會主席而額外獲得8,000美元的現金預付金。Rupalla博士還將根據2022年計劃獲得初始 和年度期權贈款。
| 139 |
證券的實益所有權
下表 列出了截至2023年12月5日公司普通股的實益所有權:
| ● | 每個 已知為公司5%以上已發行普通股實益擁有人的人; | |
| ● | 公司的每一位高管和董事;以及 | |
| ● | 所有 公司現任高管和董事作為一個團體。 |
受益所有權是根據美國證券交易委員會的規則確定的,該規則一般規定,如果一個人對該證券擁有單獨或共享的投票權或投資權,則該人對該證券擁有實益所有權。根據這些規則,受益所有權包括個人或實體有權在2023年12月5日起60天內通過行使認股權證或股票期權或授予受限股票單位等方式獲得的證券。受2023年12月5日起60天內可行使或可行使的認股權證或期權約束的股票,或受2023年12月4日起60天內歸屬的受限股票單位約束的股票,在計算該人的持有量百分比時,被視為已發行股票,並由持有該等認股權證、期權或受限制股票單位的人實益持有,但在計算任何其他人士的持有量百分比時,則不視為已發行股份 。
本公司普通股的某些受益股東擁有購買本公司普通股股份的認股權證,而該認股權證含有阻止持有人行使其認股權證的阻止劑,條件是持有人將因行使該等權利而實益擁有超過4.99%或9.99%(視情況而定)的本公司普通股。在準備下表時,我們在適用的情況下考慮了這些阻滯劑。根據向本公司提供的信息,除腳註所註明的情況外,在符合社區財產法的情況下,下表所列個人和實體對其實益擁有的所有股份擁有唯一投票權和投資權。 除非另有説明,下表所列各實益所有人的營業地址為c/o ZyVersa Treateutics,Inc., 2200 N.Commerce Parkway,Suite208,Weston,佛羅裏達州33326。
我們普通股的實益所有權 基於2023年12月5日發行和發行的1,243,297股普通股。
| 實益擁有的股份數目 | 實益擁有的股份百分比 | |||||||||||
| 實益擁有人姓名或名稱及地址 | 在提供產品之前 | 在提供服務之前* | 在提供後* | |||||||||
| 董事及行政人員 | ||||||||||||
| 史蒂芬·C·格洛弗(1) | 40,779 | 3.22 | % | 2.45 | % | |||||||
| 樸敏哲博士(2) | 1,040 | * | * | |||||||||
| 羅伯特·G·菲尼齊奧(3) | 1,418 | * | * | |||||||||
| 彼得·沃爾夫(4) | 4,326 | * | * | |||||||||
| 卡倫·卡什米爾(5) | 2,535 | * | * | |||||||||
| 巴勃羅·A·古茲曼醫學博士(6) | 4,041 | * | * | |||||||||
| 詹姆斯·薩皮爾斯坦 | - | - | - | |||||||||
| 格雷戈裏·弗賴塔格 | - | - | - | |||||||||
| 所有董事和高級管理人員為一組(8人) | 54,139 | 4.24 | % | 3.23 | % | |||||||
| 其他5%實益擁有人 | ||||||||||||
| Ion Ventures LLC(7) | 87,625 | 6.76 | % | 5.17 | % | |||||||
| Wleye Opportunities大師基金(8) | 179,515 | 9.99 | % | 9.99 | % | |||||||
| L1 Capital Global Opportunities Master Fund(9) | 81,424 | 6.42 | % | 4.88 | % | |||||||
| * | 表示 受益所有權低於1%。 |
| 140 |
| (1) | 包括史蒂芬·C·格洛弗及其關聯公司持有的18,190股普通股,其中包括(1)斯蒂芬·C·格洛弗登記持有的13,076股普通股;(2)MedicaRx Inc.登記持有的1,253股普通股;(3)Asclepius生命科學基金有限責任公司登記持有的2,442股普通股;以及(4)Asclepius Master Fund,Ltd.登記持有的1,419股普通股。該金額還包括可在2023年12月5日或之後60天內分別針對20,275股和2,314股普通股行使的期權和認股權證。格洛弗先生 是MedicaRx Inc.的董事管理董事、Asclepius Master Fund,Ltd.的管理董事以及Asclepius生命科學基金LP的管理成員。 |
| (2) | 表示可在2023年12月5日或之後60天內對1,040股普通股行使的期權。 |
| (3) | 表示在2023年12月5日或之後60天內可對1,418股普通股行使的期權。 |
| (4) | 代表:(I)1,275股普通股;及(Ii)可於2023年12月5日或之後60天內分別行使2,535股及516股普通股的期權及認股權證 。 |
| (5) | 表示在2023年12月5日或之後60天內可對2,535股普通股行使的期權。 |
| (6) | 代表:(I)744股普通股;及(Ii)可於2023年12月5日或之後60天內分別就3,039股及258股普通股行使的期權及認股權證 。 |
| (7) | 包括(I)35,598股普通股和(Ii)購買52,027股普通股的認股權證,如2023年5月3日提交的附表13G所披露。根據該等 備案文件,已披露的由報告人持有的認股權證可予行使,但須受該等認股權證所載的9.99%實益擁有權的限制限制,但鑑於自該等申報以來本公司已發行股份的增加,所持有的所有認股權證 均於此披露。這些證券由Ionic Ventures LLC持有。布倫丹·奧尼爾和基思·庫爾斯頓都是Ionic Ventures LLC的經理,對Ionic Ventures LLC實益擁有的股票擁有共同的投票權和投資者控制權。 Ionic Ventures,LLC的業務地址是3053Fillmore St,Suit256,San Francisco,CA 94123。 |
| (8) | 代表(I)25,864股普通股及(Ii)購買153,651股普通股的認股權證,但不包括購買244,698股普通股的認股權證,該等認股權證因該等認股權證所載9.99%的實益擁有權限制而目前不可行使。這些證券由Walleye Opportunities Master Fund創紀錄地持有 。Walleye Opportunities Master Fund Ltd成員的首席投資官William England對Walleye Opportunities Master Fund Ltd持有的證券擁有唯一投票權和處置權。Walleye Opportunities Master Fund的業務地址為:開曼羣島喬治城埃爾金大道190號,開曼羣島KY-9008。 |
| (9) | 代表總計81,424股實益擁有的普通股,包括:(I)60,207股普通股,以各種私募方式向保薦人和某些其他投資者發行,與Larkspur的成立、Larkspur IPO的完成有關,幷包括與Larkspur IPO完成相關的權證;(Ii)11,359股普通股,可在行使2023年4月股票發行時發行的認股權證 時發行;及(Iii)於管道股份轉換後60天內可發行的普通股9,858股,每股管道股份的金額等於管道股份的收購價除以轉換價格 $70.00(底價)。這些證券由L1 Capital Global Opportunities Master Fund登記持有。David先生及Joel Arber為L1 Capital Global Opportunities Master Fund Ltd董事。因此,L1 Capital Global Opportunities Master基金有限公司、Feldman先生及Arber先生可被視為實益擁有上述證券(該詞的定義見1934年證券交易法第13d-3條)。在費爾德曼先生和阿爾伯先生被視為實益擁有該等 股份的範圍內,費爾德曼先生和阿爾伯先生不為所有其他目的而實益擁有這些證券。L1 Capital Global Opportunities Master Fund的業務地址為開曼羣島大開曼羣島KY1-10085信箱10085炮庭1號施登路161A。 |
| 141 |
分銷計劃
AG.P./Alliance 我們在此稱為配售代理的全球合作伙伴已同意根據2023年12月6日的配售代理協議的條款和條件,擔任本次發行的配售代理。配售代理不購買或出售本招股説明書提供的任何證券,也不需要安排購買或出售任何特定數量或金額的證券,但其已同意 盡其合理努力安排出售本招股説明書提供的所有證券。我們將與買方就本次發售直接簽訂證券購買協議,不得根據本招股説明書 出售全部發售的證券。
本次 發售將不遲於本次發售開始後兩個工作日完成,該等證券的交割將在收到本公司收到的投資者資金後進行。
我們 將根據機構投資者的選擇,直接與機構投資者簽訂證券購買協議,機構投資者將在此次發行中購買我們的證券。未簽訂證券購買協議的投資者應僅依據本招股説明書 購買本次發行的我們的證券。
我們 將在收到投資者資金後向投資者交付正在發行的證券,以購買根據本招股説明書 提供的證券。我們預計將在2023年12月11日左右交付根據本招股説明書發行的證券。 本次發行沒有任何最低證券數量或收益金額作為結束髮行的條件。
我們 已同意賠償配售代理和指定其他人的特定責任,包括《證券法》下的責任,並分擔配售代理可能被要求就此支付的款項。
費用 和費用
本次 發售是以“合理的最大努力”為基礎進行的,配售代理沒有義務從我們手中購買任何證券,也沒有義務安排購買或出售任何特定數量或金額的證券。我們已同意 支付下表所列的配售代理費(假設購買了我們提供的所有證券)。
根據 分享和陪伴共同 認股權證 | 按預先資助的金額 令狀和隨附普通令狀 | 總計 | ||||||||||
| 公開發行價 | $ | 1.2500 | $ | 1.2499 | $ | 4,999,640 | ||||||
| 安置代理費 | $ | 0.0750 | $ | 0.750 | $ | 299,978 | ||||||
| 給我們的收益(未計費用)(1) | $ | 1.1750 | $ | 1.1749 | $ | 4,699,662 | ||||||
| (1) | 不包括行使普通權證的收益(如果有的話)。 |
我們 已同意向配售代理支付相當於本次發行所籌總收益6.0%的現金費用。由於本次發售沒有最低發售金額要求作為完成發售的條件,因此實際現金配售費用(如果有)目前無法確定,可能會大大低於上文規定的最高金額。
我們 估計本次發行應支付的總費用約為345,000美元,其中包括:(I)支付給配售代理的非實報實銷的 費用津貼20,000美元;(Ii)與我們支付的配售代理的法律費用有關的實報實銷費用 80,000美元(均未預付);以及(Iii)其他估計的 費用約245,000美元,其中包括我們的法律、會計和印刷成本以及與我們的證券註冊和上市相關的各種費用。
| 142 |
配售代理可被視為證券法第2(A)(Ii)條所指的承銷商,其收取的任何佣金和在作為委託人轉售其出售的證券時實現的任何利潤,可能被視為根據證券法承銷 折扣或佣金。作為承銷商,配售代理將被要求遵守證券法和交易法的要求,包括但不限於證券法下的規則415(A)(4)和交易法下的規則10b-5和規則M。這些規則和條例可能會限制作為委託人的配售代理購買和出售證券的時間。根據這些規則和規定,安置代理:
| ● | 不得從事與我們的證券相關的任何穩定活動;以及 | |
| ● | 不得 競購或購買我們的任何證券,或試圖誘使任何人購買我們的任何證券,除非交易法允許 ,直到它完成參與分銷。 |
鎖定協議
我們的 董事和高級管理人員已簽訂鎖定協議。根據這些協議,除 指定的例外情況外,這些個人同意,在本招股説明書日期後90天結束的期間內,除非事先獲得配售代理的書面同意,否則不得出售或轉讓任何普通股或可轉換為、可交換或可行使普通股的證券。具體地説,這些人在一定程度上同意不:
| ● | 要約、質押、出售、合同出售或以其他方式處置我們的證券或任何可轉換為或可行使或可交換的普通股股票 ; | |
| ● | 將 輸入到任何交換或其他轉移到其他安排中。全部或部分擁有我們證券的任何經濟後果,無論任何此類交易是以現金或其他方式交割我們的證券; | |
| ● | 對我們的任何證券的登記提出任何要求或行使任何權利;以及 | |
| ● | 公開 披露打算對我們的任何證券進行任何要約、出售、質押或處置,或進行任何交易、互換、對衝或其他 安排。 |
儘管有這些限制,我們的證券可以在有限的情況下轉讓,包括但不限於贈送。遺囑或無遺囑繼承。
我們 已與配售代理達成協議,根據本招股説明書,自發售結束之日起45天內為禁售期。這意味着,在適用的禁售期內,除某些有限的例外情況外,未經配售代理事先書面同意,吾等不得:(I)發行、訂立任何協議以發行或宣佈發行或擬發行任何普通股或普通股等價物,或(Ii)提交任何登記聲明或其修訂或補充 ,但與本次發售有關的初步招股説明書或招股説明書或S-8表格中與任何員工福利計劃有關的登記聲明除外。
發行價的確定
我們發售的證券的公開發行價由吾等與投資者協商,並根據發售前我們普通股的交易情況與配售代理進行磋商,以及其他事項。在確定我們正在發行的證券的公開發行價時考慮的其他因素包括我們的歷史和前景、我們經營的行業、我們過去和現在的經營業績、我們業務的發展階段、我們對未來的業務計劃以及這些計劃的實施程度、我們高管以前的經驗、發行時證券市場的總體狀況以及其他被認為相關的因素。
| 143 |
上市
我們的普通股在納斯達克全球市場的納斯達克股票市場有限責任公司上市,代碼是“納斯達克”。普通權證還沒有建立公開交易市場,我們預計不會發展這樣的市場。我們不打算申請在任何證券交易所或其他國家認可的交易系統上上市普通權證。如果沒有活躍的交易市場,普通權證的流動性將受到限制。
可自由支配的 帳户
配售代理不打算確認向其擁有自由裁量權的任何賬户出售在此發售的證券。
其他 活動和關係
配售代理及其某些附屬公司是從事各種活動的全方位服務金融機構,這些活動可能包括證券交易、商業和投資銀行、財務諮詢、投資管理、投資研究、本金投資、對衝、融資和經紀活動。配售代理及其某些附屬公司已經並可能在未來為我們及其附屬公司提供各種商業和投資銀行及金融諮詢服務, 他們已收到或將收到常規費用和開支。
AG.P. 於2021年5月購買了12,767股Old Larkspur B類普通股,該等股份因完成業務合併而轉換為我們的普通股 。AGP此前還擔任Old Larkspur IPO的承銷商和管道的配售代理。關於此次IPO,Old Larkspur向A.G.P.支付了500,000美元的承銷費,並同意 聘請A.G.P.擔任業務合併的顧問,以協助其與股東舉行會議,討論潛在的業務合併和目標業務的屬性,將其介紹給有興趣購買其與業務合併相關的證券的潛在投資者,幫助其獲得股東對業務合併的批准 ,並協助其發佈新聞稿和提交與業務合併相關的公開文件。Old Larkspur同意在業務合併完成後向AGP支付相當於首次公開募股總收益的4.5%的現金諮詢費(“諮詢費”)。關於管道,我們同意支付管道總收益的6.0%的AGP配售代理費(“管道代理費”)。關於完成業務合併,我們與AGP達成協議,通過發行面值為每股0.0001美元的B系列可轉換優先股(“B系列股票”),履行我們欠AGP的諮詢費和管道代理費方面的義務。在企業合併結束時,A.G.P.獲得了4,026股B系列股票,總購買價為4,026,000美元,其中包括(1)3,495,000美元的諮詢費,(2)506,000美元的管道代理費,以及(3)相當於25,000美元的非可交代費用。 有關更多信息,請參閲“某些關係和關聯人交易。
AG.P.持有的3,495股B系列股票受一項鎖定協議的約束,根據該協議,根據FINRA規則 51101,除其中另有規定外,該等B系列股票和轉換後可發行的普通股股票 不會被出售、轉讓、轉讓、質押或質押,也不會成為任何對衝、賣空、衍生品、看跌或看漲交易的標的,從而導致任何人在緊接我們的盡力而為的要約結束後的900日內有效經濟處置該等股票。AGP亦訂立登記權協議 ,據此,吾等根據證券法以S-1表格形式向美國證券交易委員會提交一份登記聲明,涵蓋於B系列股份轉換後可發行的所有普通股的回售。不存在對此類股票的需求權。 此外,AGP在招股説明書發佈之日起七年內擁有一定的“搭便式”註冊權。 該招股説明書涵蓋了我們的最大努力產品。我們將承擔與提交任何此類註冊聲明相關的費用。
此外,配售代理及其若干關聯公司在其各項業務活動的正常過程中,可進行或 持有多種投資,並積極交易債務和股權證券(或相關衍生證券)和金融工具 (包括銀行貸款)用於其自身賬户和其客户的·賬户,該等投資和證券活動 可能涉及本公司及其關聯公司發行的證券和/或工具。如果配售代理或其關聯公司與我們建立借貸關係 ,他們將根據其慣常的風險管理政策對衝其對我們的信用風險敞口。 配售代理及其關聯公司可以通過進行交易來對衝此類風險敞口,交易包括購買信用違約互換或在我們的證券或我們關聯公司的證券中建立空頭頭寸,可能包括據此發行的普通股。任何此類空頭頭寸都可能對特此發售的普通股未來的交易價格產生不利影響。配售代理及其某些附屬公司亦可傳達獨立的投資建議、市場顏色或交易理念及/或 就該等證券或工具發表或表達獨立研究意見,並可隨時持有或向 客户推薦他們持有該等證券及工具的多頭及/或空頭頭寸。
此電子格式的招股説明書可以在配售代理維護的網站上獲得,並且配售代理可以電子方式分發 本招股説明書。
上述 並不是配售代理協議或證券購買協議的條款和條件的完整聲明,其副本附在本招股説明書所屬的註冊説明書上。請參閲“在哪裏可以找到更多信息.”
| 144 |
某些 關係和關聯方交易
除了與董事和高級管理人員的薪酬安排外,“高管薪酬 “和”管理“以及本招股説明書其他地方描述的註冊權,以下 是自2020年12月12日以來每筆交易以及當前擬議交易的描述,其中:
| ● | 我們 曾經或即將成為參與者; | |
| ● | 涉及金額超過或將超過120,000美元;和 | |
| ● | 任何 我們的董事、執行人員或5%以上股本的受益持有人,或任何直系親屬, 或與其中任何一個人(租户或員工除外)共享家庭的人,已經或將擁有直接或間接的 物質利益。 |
業務合併後 關聯方交易
私人配售
2023年6月5日,我們向保薦人的某些成員發行了總計86,978股普通股,以換取延長該等成員擁有的本公司所有證券的鎖定期。
婚約 信(S)
於2023年1月19日,我們與AG.P/Alliance Global Partners(“AG.P.”)簽訂聘書,同意向AG.P.支付現金費用,相當於預期發售中出售證券的每位購買者支付的總購買價的6.0%,並向AG.P.償還與此類發售相關的某些費用,總額最高可達100,000美元。AGP還曾擔任我們IPO的承銷商 和管道的配售代理,如下文所述:前業務合併關聯方交易: 拉克斯普.”
諮詢 協議
2015年1月22日,我們與我們的首席醫療官巴勃羅·古茲曼博士和醫療事務高級副總裁總裁簽訂了經修訂的諮詢協議,以我們代理首席醫療官的身份為我們提供服務。根據諮詢安排,自2020年12月12日以來,我們(I)向古茲曼博士支付了總額相當於207,984美元的現金;以及(Ii)向古茲曼博士授予了以每股396.55美元至572.60美元的行使價購買834股我們普通股的期權。與古茲曼博士的諮詢安排於2023年1月26日終止,自他受僱於本公司起生效。
管道 交易和相關協議
管道 訂閲協議
關於業務合併,吾等與PIPE投資者(包括本公司的若干聯屬公司)訂立經修訂的PIPE認購協議,據此,吾等以私募方式向PIPE投資者出售合共8,636股A系列可轉換優先股 ,每股面值0.0001美元(“PIPE股份”),總購買價為8,635,000美元,可轉換為普通股 ,轉換價格最初等於每股350.00美元(須向下調整至不低於 我們普通股股票的底價每股70美元,這是根據本登記聲明生效日期後90天 和該證券登記生效日期後150天計算的),可在 根據A系列指定證書的條款轉換管道股票時發行,但需進行某些調整; 及(Ii)普通股認購權證(各為“PIPE認股權證”),可購買最多相當於PIPE股份轉換後已發行及可發行的普通股 至100%的普通股,行使價最初為每股402.50美元,但須作出若干 調整。PIPE認股權證的行權價將受若干調整影響,包括(I)股票 派息及分拆、(Ii)後續供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自願 調整及(Vi)根據PIPE認股權證的條款以當時有效價格發行其他證券所產生的調整。A系列指定證書包括髮行人按當時已發行管道股票發行價的120%贖回此類股票的權利。此外,PIPE訂閲協議還包含慣例陳述和擔保,以及某些轉讓限制。完成出售PIPE股份及PIPE認股權證的條件包括(其中包括)慣常完成交易的條件及完成業務合併協議所擬進行的交易。 根據PIPE認購協議發行的證券基本上與完成業務合併的完成同時完成。
管道 保修協議
關於PIPE認購協議,吾等與其他PIPE投資者訂立認股權證協議,據此,吾等發行普通股認購權證(每份為“PIPE認股權證”),以購買最多數目相當於PIPE股份轉換後可發行普通股的最多數目的普通股 至100%的普通股,行使價初步等於每股402.50美元,並可作出若干調整。PIPE認股權證的行權價將受若干調整影響,包括(I)股票股息及分拆、(Ii)後續供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自願調整及(Vi)按行使價或低於行使價發行其他證券所產生的調整 ,在每種情況下,根據PIP權證的條款。
| 145 |
管道 註冊權協議
關於業務合併的完成,吾等與PIPE投資者訂立了登記權協議 (“PIPE登記權協議”),據此,吾等同意於業務合併完成日期後5個工作日內向美國證券交易委員會編制及提交本登記聲明,該登記聲明以1933年證券法 下經修訂的表格S-1為準,涵蓋因PIPE股份的轉換或行使而可發行的所有普通股股份的回售 以及根據PIPE認購協議及PIP權證發行的PIP權證。我們還需盡最大努力使此類初始註冊聲明(以及根據PIPE註冊權利協議需要提交的其他註冊聲明)在提交後在切實可行的範圍內儘快由美國證券交易委員會宣佈生效,但在任何情況下不得遲於提交後20個歷日 (如果美國證券交易委員會進行“全面審查”,則不得遲於45個歷日)。此外,根據管道登記權協議的條款 ,在符合某些要求和習慣條件的情況下,包括可能行使的某些 請求權,管道投資者還應擁有某些“搭便式”登記權利,但須受某些要求和習慣條件的約束。我們將承擔與提交任何此類註冊聲明相關的費用 。
股東 支持協議
關於業務合併協議,Larkspur、Old ZyVersa和主要ZyVersa股東簽訂了股東支持協議(“股東支持協議”),其中規定主要ZyVersa股東(其所有權權益共同代表已發行的ZyVersa普通股和ZyVersa A系列優先股(按轉換後的基準投票)足以代表Old ZyVersa批准業務合併),支持批准和採納業務合併協議和擬進行的交易,並簽署和交付了書面同意,股東支持協議將於(A)企業合併結束、(B) 企業合併協議根據其條款終止、(C)Larkspur及Old ZyVersa採納對企業合併協議的任何重大修訂,及(D)Larkspur、Old ZyVersa及ZyVersa股東終止股東支持協議的書面協議(“終止時間”)中以最早者為準終止。ZyVersa的主要股東還同意, 在到期之前,遵守某些轉讓限制(不包括轉換)。
鎖定 協議
關於股東支持協議,我們與Key ZyVersa股東簽訂了鎖定協議,我們將其稱為“鎖定協議”。根據禁售期協議,向ZyVersa發行的與業務合併有關的已發行及未償還證券總額的約75%須受以下所述的限制,自交易結束 起至適用禁售期終止為止。
我們 和ZyVersa主要股東已同意,在未經本公司董事會審計委員會事先書面同意的情況下,除某些例外情況外,不會在適用的禁售期內:
| ● | 直接或間接出售、要約出售、簽訂合同或同意出售、質押、質押、授予購買或以其他方式轉讓、處置或同意轉讓或處置的任何期權、權利或權證, 或設立或增加看跌期權等值頭寸,或平倉或減少交易所法案及據此頒佈的美國證券交易委員會規則和條例所指的看漲期權等值頭寸,在緊接收購合併生效時間後由其持有的任何合併實體的普通股,或因業務合併而向其發行或可向其發行的任何股份(包括作為管道投資的一部分收購或為交換而發行的公司普通股),或 轉換或行使作為管道投資的一部分發行的任何證券),在緊接收購合併生效時間後,可在行使購買其持有的公司普通股股份的期權時發行的任何公司普通股,或在緊接合並生效時間後可轉換為或可行使或可交換的任何證券 公司持有的普通股(“禁售股”); | |
| ● | 訂立全部或部分轉讓任何禁售股的任何經濟後果的任何掉期或其他安排,不論任何此類交易 將以現金或其他方式交付此類證券結算;或 | |
| ● | 公開 宣佈任何意向達成上述條款規定的任何交易。 |
| 146 |
根據禁售協議,吾等及ZyVersa主要股東於截止日期起至(X)截止日期(X)及(Y)本公司完成清算、合併、股本交換、重組或導致本公司所有 股東有權將其股份兑換為現金、證券或其他財產的日期(以較早者為準)的期間內,同意上述轉讓限制。
修訂了 並重新簽署了註冊權協議
關於業務合併,由Larkspur 與持有Larkspur證券的某些個人和實體之間於2021年12月10日簽訂的特定註冊權協議(“IPO註冊權協議”)已修訂並重述,本公司、保薦人、在交易結束前持有Larkspur證券的某些個人和實體(連同保薦人、“Larkspur持有人”)以及在交易結束前持有Old ZyVersa證券的某些個人和實體(“ZyVersa持有人”,以及Larkspur持有人,註冊權持有人“)簽訂了日期為2022年12月12日的修訂和重新簽署的註冊權協議。根據經修訂及重訂的登記權利協議,本公司同意,(I)登記權利持有人將獲準於業務合併完成後六個月 要求取得某些登記權利,(Ii)本公司將盡其商業上合理的努力,向美國證券交易委員會提交一份登記轉售由 持有或可向登記權利持有人發行的若干證券的登記聲明(“轉售登記聲明”)。及(Iii)本公司將盡其商業上合理的努力,在轉售登記聲明提交後,在合理可行的情況下儘快宣佈該聲明生效。在某些情況下,註冊權持有人可以要求最多兩次包銷發行,這些持有人 將有權獲得習慣上的搭便式註冊權。經修訂及重訂的註冊權協議並無就本公司未能履行經修訂及重訂的權利協議項下的任何責任而支付任何現金罰款作出規定 。
B系列採購協議
關於業務合併,我們同意以私募方式向向我們提供服務的某些買家發行總計5,062股B系列可轉換優先股(“B系列購買協議”),每股面值0.0001美元(“B系列股票”),總購買價為5,062,000美元。可轉換為我們普通股的股票,轉換價格最初等於每股350.00美元(受 向下調整至不低於每股245.00美元的底價,這是基於我們普通股的股票的公開交易價格 在本註冊聲明生效日期後150日計算),可根據B系列指定證書的條款轉換為B系列股票時發行, 需進行某些調整。B系列指定證書包括髮行人以當時已發行B系列股票發行價的120% 贖回此類股票的權利。此外,B系列購買協議還包含慣例陳述和擔保,以及某些轉讓限制。完成出售B系列股份的條件包括(其中包括)慣常的成交條件及完成業務合併協議所擬進行的交易。證券的發行 基本上與業務合併的結束同時完成。
系列 B註冊權協議
關於B系列購買協議,吾等及其他買方訂立了登記權協議(“B系列登記權協議”),據此,吾等根據1933年證券法(經修訂)以S-1表格格式(或 其他適用登記聲明)格式向美國證券交易委員會提交本初步登記聲明,當中涵蓋根據B系列購買協議發行的B系列股份轉換或行使時可發行的所有普通股的全部股份的轉售。我們 還被要求盡最大努力促使該初始註冊聲明(以及根據註冊權協議需要提交的額外註冊聲明 )在提交後在切實可行的範圍內儘快由美國證券交易委員會宣佈生效。此外, 根據B系列註冊權協議的條款,在符合某些要求和習慣條件的情況下,包括關於可能行使的某些要求權利,購買者還應具有某些“搭載”登記權利 ,受某些要求和習慣條件的限制。我們將承擔與提交 任何此類註冊聲明相關的費用。
| 147 |
過橋融資
從2022年3月至2022年12月,Old ZyVersa進行了A系列可轉換優先股的股票和認股權證(“過橋認股權證”)的私募發行,以購買Old ZyVersa的普通股(“過橋融資”)。 A系列可轉換優先股的股票在緊接業務合併完成之前自動轉換為Old ZyVersa普通股。該等舊ZyVersa普通股於完成業務合併後(按兑換比率)交換為36,363股本公司普通股(其中9,635股與過橋融資有關,其餘股份來自將2021年本票融資轉換為過橋融資的轉換)。此外,在業務合併完成後,已發行的過橋認股權證被假定並(根據合併交換比率)轉換為認股權證,以購買我們普通股的股份。替代認股權證可行使36,363股普通股(其中9,365股認股權證來自橋融資,其餘認股權證來自2021年承諾票 票據融資轉換為橋融資),初始行使價相當於每股241.50美元(經 調整以實施業務合併),須作出若干調整。本公司的某些關聯公司作為投資者參與了Bridge融資。
相關的 方交易政策
我們的 董事會已採納書面關聯人交易政策,其中規定了 關聯人交易審查、批准或批准的以下政策和程序。
"關聯人交易"是指公司或其任何子公司 過去、現在或將來參與的交易、安排或關係,涉及的金額超過120,000美元,並且任何關聯人在其中已經、已經或將要擁有 直接或間接重大利益。
“關係人”是指:
| ● | 任何 是或在適用期間內任何時候曾是公司的 公司的高級管理人員或董事之一; |
| ● | 公司所知的擁有超過5% (5%)有表決權股票的實益所有人; |
| ● | 任何 上述任何人的直系親屬,指任何子女,繼子, 父母、繼父母、配偶、兄弟姐妹、婆婆、岳父、兒媳、姐夫 董事、高級管理人員或超過百分之五(5%)的實益擁有人的嫂子 其有表決權的股份,以及任何人(租客或僱員除外)與家庭共享 該董事、高級管理人員或受益所有人的投票權超過百分之五(5%) 存貨;及 |
| ● | 任何商號、公司或其他實體,其中任何上述人士為合夥人或負責人或處於類似職位,或擁有10%(10%)或更大的實益 所有權權益。 |
公司制定了政策和程序,旨在儘量減少因與 關聯公司的任何交易而產生的潛在利益衝突,並提供適當的程序,以披露 不時可能存在的任何實際或潛在利益衝突。具體而言,根據其章程,審計委員會有責任審查關聯方交易。
本節中描述的所有 交易都是在採用本政策之前進行的。上述披露的某些內容 是我們關聯方協議的某些條款的摘要,其全部內容均參考此類協議的所有條款 進行限定。由於這些描述僅是適用協議的摘要,因此它們不一定包含您可能會發現有用的所有信息。某些協議(或協議形式)的副本已作為本招股説明書的一部分作為登記説明書的附件提交,並可在美國證券交易委員會網站上以電子方式獲得,網址為:Www.sec.gov.
執行 高管和董事薪酬安排
參見 “高管薪酬"有關與公司執行人員和董事 的薪酬安排的信息,其中包括(除其他外)僱傭、終止僱傭和控制權變更安排、股票獎勵 和某些其他福利。
董事 和軍官賠償
本公司第二次修訂及重訂的公司註冊證書(“章程”)及第二次修訂及重訂的附例(“附例”) 為本公司的董事及高級職員提供最大限度的保障。我們已經與我們的每一位董事和高管簽訂了賠償協議。有關更多信息,請參閲中包含的賠償討論 “管理。”
| 148 |
開業前 舊ZyVersa合併關聯方交易
2021年本票融資
在2021年2月至3月期間,Old ZyVersa發行了本金總額為523萬美元的可轉換本票(“2021年票據”)。Old ZyVersa超過5%的股東Inon有限公司購買了本金總額為250萬美元的2021年債券,Old ZyVersa首席執行官斯蒂芬·格洛弗購買了本金總額為30萬美元的2021年債券。 2021年債券的利息年利率為6%,按日複利,2021年12月31日到期。如果ZyVersa在2021年2月15日之後開始債務融資(“合格債務融資”),2021年票據將自動轉換為 與合格債務融資中發行的相同形式、相同條款和條件的本票,本金 金額等於2021年票據項下的當時未償還本金和應計未付利息(“票據義務”)。 當公司在2021年2月15日之後完成最低50萬美元的股權融資(“合格股權融資”)時, 2021年票據將自動轉換為以該等合資格股權融資的任何投資者所收到的相同價格及相同條款及條件於一項合資格股權融資(“後續一輪證券”)出售的股權證券。 於該等轉換後將發行的後續一輪證券的數目,應等於(I)除以(I)該等有限制股權融資結束時未償還的票據責任的金額除以該等後續一輪證券在該合資格股權融資中出售的最低每份證券價格(“換股價格”)所得的商數。如果在合格股權融資之前的任何時間,控制權發生變更,則相當於該控制權變更結束時未償還票據債務的金額應在控制權變更結束時自動轉換,價格為每股3.25美元。2022年7月8日,由於A系列優先股融資(導致合格股權融資,累計毛收入超過500,000美元),2021年票據由5,230,000美元本金和428,888美元應計利息組成, 自動轉換為1,802,193股A系列優先股,實際轉換價格為A系列優先股每股3.14美元。此外,購買2,035,571股普通股的A系列認股權證是在A系列優先股自動轉換時向前2021年票據持有人發行的。A系列優先股在業務合併結束時發生。 這些證券最終轉換為橋樑融資中發行的證券,並按相同的條款轉換。
庫存 與INCON,Ltd.的採購協議。
在2018年11月15日的融資交易中,Old ZyVersa向INCON,Ltd.發行了4,347,826股Old ZyVersa普通股 ,總代價為1,000萬美元(“2018 INCON投資”)。關於2018年的INCON投資,INCON任命了一名代表加入Old ZyVersa的董事會,INCON可能會要求Old ZyVersa的首席執行官Stephen Glover加入並擔任INCON董事會的成員。
註冊 權利協議
於2016年11月,就非公開配售Old ZyVersa的普通股(“2016 Old ZyVersa融資”), Old ZyVersa與參與2016年融資的每名投資者訂立註冊權協議(“2016註冊權協議”)。根據二零一六年登記權協議,參與二零一六年融資的每名投資者均獲授予搭載登記權,據此,倘若Old ZyVersa建議根據證券法登記任何供Old ZyVersa出售的股本股份,而登記形式將容許登記投資者的普通股股份,則參與二零一六年融資的每名投資者將有權將其持有的Old ZyVersa普通股股份納入該登記聲明內。2016註冊 權利協議在業務合併結束時自動終止。
在2016年Old ZyVersa的發行中,Old ZyVersa首席執行官斯蒂芬·格洛弗和與格洛弗先生有關的實體購買了總計55萬美元的普通股,與Old ZyVersa 5%股東肖恩·泰特科姆有關的實體購買了價值20萬美元的普通股。
2014年舊ZyVersa股東協議
2014年4月11日,Old ZyVersa與三名5%股東Shawn Titcomb、Nico Pronk和Nathan Cali以及Old ZyVersa首席執行官Stephen Glover簽訂了股東協議(“2014年ZyVersa舊股東協議”)、據此,每個 股東同意以確保(i)董事人數 的方式對其各自的所有投票證券進行投票Old ZyVersa始終擔任三名董事,並且(ii)Shawn Titcomb、Nico Pronk和Stephen Glover當選並繼續擔任Old ZyVersa董事。
| 149 |
《2014舊ZyVersa股東協議》還包含對股東方所擁有證券的某些轉讓限制 ,但某些慣例例外情況除外。根據2014年Old ZyVersa股東協議,如果任何其他股東方收到第三方出售其證券的真誠要約,則股東各方均有優先購買權。 2016年10月28日,諾貝爾國際投資公司,Old ZyVersa普通股超過5%的股東和與Pronk先生有關聯的實體 簽署了一項聯合協議,並根據與其他各方相同的條款被定為2014 Old ZyVersa股東協議的訂約方。2014年舊ZyVersa股東協議在業務合併結束時自動終止 。
開業前 Larkspur合併關聯方交易
於2021年4月4日,Larkspur與Brio Financial Group(“Brio Financial”) 訂立協議(“Brio協議”),據此Brio Financial向Larkspur提供若干財務及會計服務,包括但不限於協助Larkspur制定及記錄每月及季度會計結算流程、編制財務報表、維護Larkspur會計系統及其內部債務及權益分類賬、編制季度及年度報告的MD&A部分,以及評估其財務報告的內部控制。根據Brio協議,Larkspur同意向Brio Financial支付固定價格15,000美元的初始服務和固定的每月1,750美元的經常性服務,從2021年6月開始。Larkspur 還同意報銷Brio Financial的旅費和其他自付費用。《Brio協議》的有效期自2021年4月4日起生效,有效期至2022年12月31日。Larkspur或Brio Financial可在書面通知另一方後10天內,以任何理由隨時終止Brio協議。David·S·布里奧內斯,Larkspur的首席財務官、財務主管、祕書兼董事,是Brio Financial的管理成員,擁有Brio Financial的100%股權。布里奧協議的價值約為48,250美元,David·S·布里奧內斯在布里奧協議中的權益的大約價值為48,250美元。
在完成業務合併方面,Larkspur與A.G.P. 簽訂了B系列購買協議,包括向A.G.P.發行4,026股B系列股票,考慮到A.G.P.代表我們開展的活動, 包括確定潛在目標業務和對合適的業務合併進行盡職調查,購買總價約為4,026,000美元,其中包括:(I)與管道有關的配售代理費6.0%,金額約為506,000美元,(Ii)與本公司首次公開招股有關的遞延承銷折扣4.5%,金額相當於3,495,000美元;及(Iii)不可申報的 開支,金額相當於25,000美元。
在Larkspur首次公開募股結束之前,Larkspur Health LLC的投資者同意向Larkspur提供總計75萬美元的貸款,用於此次發行的部分費用。這些貸款是無息、無抵押的,應於2021年12月31日之前或Larkspur首次公開募股結束時(以較早的日期為準)到期 用於支付相關發售費用(承銷佣金除外)的估計1,176,000美元發售所得款項。
在Larkspur最初的業務合併之後,其管理團隊中繼續留在合併後公司的成員可能會從合併後的公司獲得諮詢費、管理費或其他費用,並在投標要約或委託書徵集材料(視情況而定)中向股東充分披露任何和所有金額。此類薪酬的金額 不太可能在分發此類投標要約材料時或在為考慮我們最初的業務合併而召開的股東大會 上得知,因為將由合併後業務的董事 來確定高管和董事的薪酬。
Larkspur 與我們的高級管理人員和董事簽訂了慣例協議,在其修訂和重新修訂的公司註冊證書中規定的賠償之外,提供合同賠償。Larkspur的章程還將允許他們代表任何高管、董事或員工為其行為引起的任何責任投保,而無論特拉華州法律 是否允許此類賠償。Larkspur將購買董事和高級管理人員責任保險,為其高級管理人員和董事在某些情況下支付辯護、和解或支付判決的費用提供保險,併為其賠償其高級管理人員和董事的義務提供保險。
| 150 |
於2021年5月7日,保薦人根據一份書面協議向Larkspur 購買合共9,151個私募單位,購買價為每份認股權證350.00美元,與首次公開發售結束及承銷商行使超額配售選擇權同時進行。每個定向增發單位由一股A類普通股和四分之三的可贖回定向增發認股權證組成。每份私募認股權證使持有人有權以每股402.50美元的價格購買一股A類普通股,價格可能會有所調整。普通股和私募認股權證的標的股份(包括行使認股權證時可發行的普通股股份),除某些有限的 例外情況外,持有人不得轉讓、轉讓或出售,直至初始業務合併完成後30天。
於2021年5月7日,Larkspur向保薦人的投資者發行無擔保本票(“本票”),並於2021年10月7日修訂及重列,據此Larkspur可借入本金總額高達750,000美元。 本票為無息票據,於(I)2021年12月31日及(Ii)Larkspur完成首次公開發售時(以較早者為準)支付。
對於在完成初始業務合併之前或與初始業務合併相關的服務,不會向保薦人、高級管理人員和董事或他們各自的關聯公司支付任何形式的補償,包括髮起人和諮詢費。然而, 這些個人將獲得與Larkspur代表活動相關的任何自付費用的報銷 ,例如確定潛在的目標業務和對合適的業務組合進行盡職調查。Larkspur的審計委員會按季度審查Larkspur向贊助商、高級管理人員、董事或其附屬公司支付的所有款項,並確定哪些費用和費用金額將得到報銷。此類人員因代表Larkspur開展活動而發生的自付費用沒有上限或上限。
此外,為了支付與計劃的初始業務合併相關的交易成本,保薦人或保薦人的附屬公司或Larkspur的某些高級管理人員和董事可以(但沒有義務)按需要借給Larkspur資金 (“營運資金貸款”)。這種週轉資金貸款將由期票證明。票據可在業務合併完成時償還,不計利息。這些單位將與私人配售單位相同。如果企業合併沒有結束,公司可以使用信託賬户以外的收益的一部分來償還營運資金貸款,但信託賬户中的收益不會用於償還營運資金貸款。截至2022年9月30日,營運資金貸款項下沒有未償還金額。Larkspur預計不會從贊助商、其附屬公司或其管理團隊以外的其他方尋求貸款,因為它不相信第三方會願意借出此類資金,並免除 尋求使用信託賬户中資金的任何和所有權利。
賠償協議
公司已與每位董事和指定的高管簽訂了賠償協議。這些協議要求公司在特拉華州法律允許的範圍內,最大限度地賠償這些個人因其服務於公司而可能產生的責任,並預支因對他們提起訴訟而產生的費用,因為他們可能會受到賠償。該公司還打算與其未來的董事和高管簽訂賠償協議。對於 ,有關賠償協議的更詳細描述,請參閲《高管薪酬.”
關聯方交易的政策和程序
我們的董事會已經通過了一項政策,我們的高管、董事、被選舉為董事的被提名人、任何類別普通股的實益擁有人 、任何上述人士的直系親屬以及上述任何人受僱於其中、是合夥人或主事人或處於類似職位或擁有5%或更大實益所有權權益的任何公司、公司或其他實體(統稱為“關聯方”),未經本公司董事會通過審核委員會行事或在某些情況下經審核委員會主席事先同意,不得 與本公司進行交易。任何要求本公司與關聯方進行交易的請求,如涉及金額超過100,000美元,且該關聯方將擁有直接或間接利益,則必須首先提交審計委員會,或在某些情況下提交審計委員會主席進行審查、審議和批准。在批准或拒絕任何此類建議時,審計委員會或審計委員會主席應考慮交易的重大事實,包括但不限於,交易條款是否不低於在相同或相似情況下非關聯第三方通常可獲得的條款、對我們的好處程度、可比產品或服務的其他來源 ,以及關聯方在交易中的利益程度。
董事 獨立
我們的董事會對其組成、委員會的組成以及每個董事的獨立性進行了審查。根據每個董事要求並提供的有關其背景、就業和從屬關係的信息,包括家庭關係,我們的董事會決定,代表董事七(7)名董事中的六(6)名的羅伯特·G·菲尼齊奧、樸敏哲、Daniel·J·奧康納、詹姆斯·薩皮爾斯坦、格雷戈裏·弗雷塔格和卡特琳·魯帕拉博士不存在會干擾獨立判斷履行董事職責的關係。該等 名董事均為“獨立”董事,該詞由美國證券交易委員會的適用規則及規則及納斯達克的上市 要求及規則界定。
| 151 |
股本説明
以下是對ZyVersa治療公司(“我們”、“我們”、“我們”或“公司”)的證券的説明,這些證券載於我們第二次修訂和重新簽署的公司註冊證書(“憲章”)和我們第二次修訂和重新修訂的章程(“章程”)的某些條款、A系列指定證書、B系列指定證書和適用的認股權證。每一份之前已向美國證券交易委員會(“美國證券交易委員會”)提交,並通過引用併入作為本招股説明書組成部分的本登記聲明的證物。本摘要並不聲稱是完整的 ,全文包括憲章全文、章程、A系列指定證書、B系列指定證書、適用的授權書格式以及《特拉華州公司法》(以下簡稱《DGCL》)的適用條款。 我們鼓勵您仔細閲讀我們的《憲章》、章程、A系列指定證書、B系列指定證書、適用的授權書格式和DGCL的適用部分。
授權的 資本化
公司授權股本總額包括:
| ● | 250,000,000股普通股,每股面值0.0001美元(“普通股”),以及 | |
| ● | 1,000,000股優先股,每股面值0.0001美元(“優先股”)。 |
截至2023年12月5日,我們的已發行和已發行股本包括1,243,297股普通股、50股A系列優先股和5,062股B系列優先股。我們的普通股在納斯達克全球市場上市,代碼為 “ZVSA”。
普通股 股票
投票權 權利
每名普通股持有人有權就股東一般有權投票的所有事項,就其登記在案的每股普通股股份投一票。
分紅 權利
在 可能適用於任何已發行優先股的優先權的前提下,普通股股份持有人將有權 從合法可用的資金中獲得 按比例收取具有股息權的普通股的股息(如有)。
清算時的權利
如果 公司事務發生任何自願或非自願清算、解散或清盤,普通股持有人將有權按比例分享公司債務和其他債務償還後剩餘的所有資產, 平價通行證以及優先股或任何類別或系列的優先股優先於普通股 的優先股的優先分配權,當時尚未發行,如果有的話。
其他 權利
普通股的 持有者將不享有優先認購權或轉換權或其他認購權。不會有適用於普通股的贖回或償債撥備 。普通股持有人的權利、優先權和特權將受制於公司未來可能發行的任何優先股的持有人的權利、優先權和特權。
| 152 |
優先股 股票
我們 有50股A系列優先股和5,062股B系列優先股已發行和流通。 憲章規定,優先股可以不時以一個或多個系列發行。董事會被授權確定適用於每一系列優先股股票的投票權、指定、權力和優惠、相對、參與、選擇或其他特殊權利及其任何資格、限制和限制。董事會可以在沒有股東批准的情況下發行具有投票權和其他權利的優先股,這些權利可能會對普通股持有人的投票權和其他權利產生不利影響,並可能產生反收購效果。董事會在未經股東批准的情況下發行優先股的能力可能會延遲、推遲或阻止 公司控制權的變更或現有管理層的撤換。
系列 A可轉換優先股
關於業務合併,吾等與PIPE投資者(包括本公司的某些關聯公司)訂立經修訂的PIPE認購協議,據此,吾等以私募方式向PIPE投資者出售合共8,636股A系列可轉換優先股,每股面值0.0001美元,總收購價為8,635,000美元。可轉換為普通股,轉換價格最初等於每股350.00美元(根據我們普通股的股票公開交易價格,根據與此類證券的登記相關的註冊聲明生效日期後90天和150天計算,向下調整至不低於每股70美元的底價),可在根據A系列指定證書的條款轉換管道股票時發行,但需進行某些調整;和(Ii)PIPE認股權證購買最多 數量的普通股,初始數量相當於PIPE根據A系列指定證書和認股權證的條款轉換後已發行和可發行的普通股 ,行使價最初等於 至每股402.50美元,可進行某些調整。PIPE認股權證的行使價將受若干調整影響 ,包括因(I)股票股息及拆分、(Ii)後續供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自願調整及(Vi)按行使價或低於行使價發行其他證券而產生的調整 ,在每種情況下,根據PIPE認股權證的條款生效。A系列指定證書包括髮行人有權以當時已發行管道股票發行價的120%贖回此類股票。此外,PIPE訂閲協議 包含慣例陳述和保證,以及某些轉讓限制。完成出售管道股份及管道認股權證的條件包括(其中包括)慣常的完成條件及完成業務合併協議預期的交易 。根據PIPE認購協議發行證券的工作基本上與業務合併的完成同時完成。截至2023年12月5日,(I)只有50股管道股票已發行,(Ii)已發行的管道權證為139,403股,均可按每股70.00美元行使。
B系列可轉換優先股
緊接業務合併完成前,吾等根據認購 協議(統稱為“B系列認購協議”),向本公司若干服務供應商發行合共5,062股本公司B系列可轉換優先股(“B系列股份”),收購價為每股1,000美元 ,以代替向該等服務供應商支付的若干費用的現金支付,總額為5,062,000美元。每一股B系列股票可轉換為若干普通股 ,等於購買價格除以轉換價格。根據B系列指定證書的條款,轉換價格等於每股245.00美元 ,可能會進行某些調整。指定的B系列證書包括髮行人有權按當時發行的B系列股票發行價的120%贖回此類股票。 此外,B系列購買協議還包含慣例陳述和擔保,以及某些轉讓限制。完成出售B系列股份的條件包括(其中包括)慣常的成交條件及完成業務合併協議擬進行的交易。證券的發行基本上在業務合併結束的同時完成 。
| 153 |
未償還的認股權證
公共 認股權證
每份完整認股權證使登記持有人有權在自Larkspur首次公開招股結束起一年後至業務合併完成 後30天開始的任何時間,按每股402.50美元的價格購買一股普通股,但下一段討論的調整除外。根據認股權證協議,認股權證持有人只能就整數股普通股行使其認股權證。
這 意味着權證持有人在給定時間內只能行使整個權證。拆分單位後,不會發行零碎認股權證,只會買賣整份認股權證。該等認股權證將於業務合併完成後五年、美國東部時間下午5:00或贖回或清盤時更早到期。
我們 將沒有義務根據認股權證的行使交付任何普通股,也沒有義務就此類認股權證的行使進行結算 ,除非根據證券法就認股權證相關的普通股股份的登記聲明生效,且招股説明書是最新的,前提是我們履行了下文所述的登記義務 ,或者有有效的登記豁免。認股權證將不會被行使,我們將不會有義務在認股權證行使時發行普通股,除非認股權證行使時可發行的普通股股份已根據認股權證登記持有人居住國家的證券法登記、符合資格或被視為豁免。如果前兩句中的條件不符合認股權證的條件,則該認股權證的持有人將無權行使該認股權證,而該認股權證可能沒有價值且到期時一文不值。 在任何情況下,我們均不會被要求以現金淨額結算任何認股權證。如果登記聲明對已行使的認股權證無效,則包含該認股權證的單位的購買者將僅為該單位的普通股股份支付該單位的全部購買價。
我們 已同意,我們將盡我們商業上合理的努力,儘快向美國證券交易委員會提交一份登記聲明 ,以便根據證券法登記在行使認股權證時可發行的普通股,我們將 盡我們商業上合理的努力,使其在我們最初的 業務合併結束後60個工作日內生效,並保持該登記聲明和與該等普通股有關的當前招股説明書的有效性,直到認股權證協議中規定的認股權證到期或贖回為止;如果我們的普通股股票 在行使未在國家證券交易所上市的公共認股權證時符合證券法第18(B)(1)條規定的“擔保證券”的定義,我們可以根據證券法第3(A)(9)條的規定,要求行使其認股權證的公共認股權證持有人在“無現金基礎上”行使,如果我們這樣選擇,我們將不會被要求為根據證券法登記在行使認股權證時可發行的普通股股份的 提交或維護登記聲明,但我們將 盡我們商業上合理的努力根據適用的藍天法律登記或符合出售資格 不能獲得豁免 。如果認股權證行使時可發行普通股的登記聲明在60年前未生效這是在初始業務合併結束後第二天,權證持有人可根據證券法第3(A)(9)條或其他豁免以“無現金基礎”方式行使認股權證,但我們將盡我們商業上合理的努力,根據適用的藍天法律登記股票或使其符合豁免條件,直至 有有效的註冊聲明及未能維持有效的註冊聲明的任何期間為止。在這種情況下,每位持股人將交出普通股的認股權證,以支付行使價,認股權證的數目等於(A)認股權證的普通股股數乘以(X)認股權證相關的普通股股數乘以(X)認股權證的行使價格所得的“公平市價”(定義見下文)乘以(Y)公平市價和(B)每份認股權證的0.361。本款所稱“公允市價”,是指權證代理人收到行權通知之日前十個交易日內普通股股票成交量加權平均價。
贖回權證
一旦 認股權證變為可行使,我們可以贖回尚未行使的認股權證(除本文中關於私募認股權證的説明外):
| ● | 全部而不是部分; |
| ● | 以每份認股權證0.35美元的價格; |
| ● | 向每名權證持有人發出至少30天的提前贖回書面通知;以及 |
| ● | 如果, 且僅當普通股的收盤價等於或超過每股630.00美元(經行使時可發行的股份數量調整後調整)或權證的行權價,如標題“-未償還的 可贖回權證-公開認股權證-反稀釋調整“) 在我們向認股權證持有人發出贖回通知之日前三十(30)個交易日內任何二十(20)個交易日內的任何二十(20)個交易日。 |
| 154 |
我們 將不會贖回上述認股權證,除非證券法下有關在行使認股權證時可發行的普通股 股份的註冊聲明生效,以及有關該等普通股 股份的最新招股説明書在整個30天的贖回期內可供查閲。如果認股權證可由我們贖回,我們可以 行使贖回權,即使我們無法根據所有適用的州證券法登記標的證券或使其符合出售資格 。
如果 我們如上所述要求贖回權證,我們的管理層將有權要求所有希望行使 權證的持有者在“無現金的基礎上”這樣做。在決定是否要求所有持有人在“無現金 基礎上”行使其認股權證時,除其他因素外,我們的管理層將考慮我們的現金狀況、尚未發行的認股權證的數量,以及在行使我們的認股權證後發行最多數量的普通股對我們股東的稀釋影響。在這種情況下,每位持股人將通過交出普通股 股票的認股權證來支付行使價,該數量等於(A)認股權證相關普通股數量乘以(X)普通股股份數量乘以(Y)認股權證行使價格除以(Y)公平市場價值所得的普通股“公平市價”的差額,兩者中的較小者。
我們 已經建立了上述最後一個贖回標準,以防止贖回贖回,除非在贖回時存在對認股權證行使價的顯著溢價。如果滿足上述條件併發出認股權證贖回通知,每個認股權證持有人將有權在預定的贖回日期之前行使其認股權證。任何此類行使將不會在“無現金”的基礎上進行,並將要求行使權證持有人為行使的每份認股權證支付行使 價格。然而,普通股的價格可能會低於630.00美元的贖回觸發價格 (根據行使時可發行的股份數量或權證的行使價格的調整進行調整,如標題“-未償還可贖回權證-公有權證-反稀釋調整“) 以及贖回通知發出後的402.50美元(整股)認股權證行權價。
行權時不會發行任何普通股的零碎股份。如果在行使時,持有人將有權獲得一股股份的零頭 權益,我們將向下舍入到將向 持有人發行的普通股數量的最接近整數。如果在贖回時,根據認股權證協議,認股權證可行使普通股股份以外的證券(例如,如果我們不是我們最初業務合併中尚存的公司),則可就該等證券行使認股權證。當認股權證可供普通股股份以外的證券行使時,本公司(或尚存公司)將根據證券法作出商業上合理的努力,登記可於行使認股權證時發行的證券。
贖回程序
如果認股權證持有人選擇受制於一項要求,即該持有人將無權行使該認股權證,則該認股權證持有人可以書面通知吾等,但條件是在行使該等權利後,該人(連同該人的 聯屬公司),據認股權證代理人實際所知,將實益擁有超過9.8%(或持有人 指定的其他金額)的已發行及已發行普通股股份。
認股權證 收益
在本公司進行要約收購或以其他方式贖回、終止或註銷所假設的Larkspur認股權證的情況下,(X)Larkspur創始股東及(Y)本公司管理層的若干成員將有權因行使與該等贖回有關的任何 該等假設的Larkspur認股權證而獲得本公司實際收到的任何現金收益的百分之五(5%)。
反稀釋調整
如果普通股的流通股數量因普通股的資本化或應付股息而增加,或普通股的分拆或其他類似事件增加,則在該 資本化或股份分紅、分拆或類似事件的生效日期,每份認股權證可發行的普通股數量將按普通股流通股的此類增加比例增加。向所有或幾乎所有普通股持有者配股 有權以低於“歷史公允市價”(定義見下文)的價格購買普通股,將 視為相當於以下乘積的普通股股息:(I)在配股中實際出售的普通股數量(或在配股中出售的可轉換為普通股或可行使普通股的任何其他股權證券下可發行的)和(Ii)1減去(X)在此類配股中支付的普通股每股價格和(Y)歷史公允市值的商數。為此目的,(I)如果配股是可轉換為普通股或可為普通股行使的證券,在確定普通股的應付價格時,將考慮為該等權利收到的任何對價,以及在行使或轉換時應支付的任何額外金額,以及(Ii)“歷史公允市價”是指普通股在適用交易所或適用市場正常交易的第一個交易日之前的10個交易日內報告的普通股成交量加權平均價格,但無權獲得該權利。
| 155 |
此外,如果我們在認股權證未到期及未到期期間的任何時間,以現金、證券或其他資產向所有或幾乎所有普通股持有人支付普通股(或認股權證可轉換為的其他證券)的股息或現金分配,但(A)如上所述,(B)任何現金股息或現金分配 ,如果以每股為基礎與在宣佈該等股息或分配之日止的365天期間就普通股股份支付的所有其他現金股利和現金分配合並,則不超過17.50美元(經調整後適當反映任何其他調整,不包括導致 行使價或在行使每份認股權證時可發行的普通股股數調整的現金股利或現金分配),但僅涉及等於或低於每股17.50美元的現金股息或現金分配總額。(C)滿足普通股持有人與擬議的初始業務合併相關的贖回權,(D)滿足普通股持有人的贖回權利 股東投票修改我們的章程(A)修改我們的章程的實質或時間 我們有義務向普通股持有人提供贖回其股票的權利,以與我們最初的業務合併相關 如果我們沒有在首次公開募股結束後12個月內完成我們的初始業務合併(除非該日期按照現有的組織文件延長)或{br)(B)與本公司普通股持有人的權利有關的任何其他條文,或(E)因未能完成初步業務合併而贖回本公司的公眾股份,則認股權證行權價將於該事件生效日期後立即減去現金金額及/或就該事件支付的任何證券或普通股每股資產的公平市價。
如果普通股的流通股數量因普通股合併、合併、股份反向拆分或重新分類或其他類似事件而減少,則在該合併、合併、股份反向拆分或類似事件的生效日期,每份認股權證可發行的普通股數量將根據普通股流通股的此類減少按比例減少。
如上文所述,每當 行使認股權證時可購買的普通股股份數目被調整時,認股權證的行使價將會作出調整,方法是將緊接該項調整前的認股權證行使價格乘以一個分數(X),其中 分子將為緊接該項調整前 行使認股權證時可購買的普通股股份數目,及(Y)其分母將為緊接該項調整後可購買的普通股股份數目。
普通股流通股的任何重新分類或重組(上文所述的或僅影響該等普通股面值的 除外),或我們與 或其他公司的任何合併或合併(合併或合併除外,其中我們是持續公司,且不會導致我們的普通股流通股進行任何重新分類或重組),或將吾等的全部或實質上與吾等解散有關的資產或其他財產出售或轉讓給另一公司或實體的情況下,認股權證持有人此後將有權在 的基礎上,根據認股權證中指定的條款和條件,立即購買和接收普通股,以取代在行使其所代表的權利時到目前為止可購買和應收的普通股 股票或其他證券或財產(包括現金)的種類和金額合併或合併,或在任何該等出售或轉讓後解散時,權證持有人如在緊接該等事件發生前已行使其認股權證,該等認股權證持有人將會收到該等認股權證。然而,如果該等持有人有權就該等合併或合併後應收證券、現金或其他資產的種類或金額行使選擇權,則每份認股權證可行使的證券、現金或其他資產的種類及金額,將被視為該等持有人在該等合併或合併中所收取的種類及每股金額的加權平均值,且如已向該等持有人(投標除外)提出投標、交換或贖回要約,並已接受該等要約。公司就本章程規定的公司股東所持有的贖回權作出的交換或贖回要約,或由於公司贖回普通股股份的結果(如果擬議的初始業務 合併提交給公司股東以供批准),在這種情況下,投標或交換要約完成後,其發起人連同該發起人所屬的任何團體的成員(在規則13d-5(B)(1)的範圍內),並連同該莊家的任何聯營公司或聯營公司(根據《交易法》規則12b-2的含義),以及任何此類聯營公司或聯營公司是其中一部分的任何此類集團的任何成員,實益擁有 (根據《交易法》規則13d-3的含義)超過50%的已發行和已發行普通股, 認股權證持有人將有權獲得最高金額的現金,如果該認股權證持有人在該等收購要約或交換要約屆滿前已行使認股權證,並接受該要約,而該持有人所持有的所有普通股股份已根據該收購要約或交換要約購買,則該持有人 實際有權作為股東享有的證券或其他財產,須經調整(在該收購要約或交換要約完成時及之後) ,與認股權證協議所規定的調整儘可能相等。如果普通股持有者在此類交易中的應收對價不足70%應以普通股的形式在 在全國證券交易所上市交易或在已建立的場外交易市場報價的繼承實體支付,或將在此類事件發生後立即如此上市交易或報價,且如果權證的註冊持有人在此類交易公開披露後30天內正確行使認股權證,權證行權價格將根據權證協議中的布萊克-斯科爾斯價值(在權證協議中的定義),按照權證協議中的規定進行下調。此等行權價格下調的目的,是在權證行權期內發生 權證持有人未能獲得權證全部潛在價值的特別交易時,為權證持有人提供額外價值。
| 156 |
認股權證是根據作為認股權證代理的大陸股票轉讓信託公司與我們之間的認股權證協議以註冊形式發行的。認股權證協議規定,認股權證的條款可在未經任何持有人同意的情況下進行修改,以(I)糾正任何含糊之處或糾正任何錯誤,包括使認股權證協議的規定符合本招股説明書所載認股權證條款及認股權證協議的説明。(Ii)根據認股權證協議修訂與普通股派發現金股息有關的條文 ,或就認股權證協議各方認為必要或適宜,並認為不會對認股權證登記持有人的權利造成不利影響的事項或問題,加入 或更改任何有關認股權證協議項下的事宜或問題的條文, 但須經當時已發行的至少50%的公開認股權證持有人批准,方可作出任何對登記持有人利益造成不利影響的改動。認股權證協議副本是作為首次公開招股登記聲明的證物而提交的,其中載有適用於認股權證的條款和條件的完整説明。
權證持有人在行使認股權證並獲得普通股股份之前,不享有普通股持有人的權利或特權及任何投票權。於認股權證行使後發行普通股後,每名股東將有權就股東就所有事項所持有的每一股登記股份投一票。
拆分單位後,不會發行任何零碎認股權證,只會買賣整份認股權證。如於認股權證行使時,持有人將有權獲得一股股份的零碎權益,吾等將於行使認股權證時將普通股股份數目向下舍入至最接近的整數。
我方 已同意,根據適用法律,因 認股權證協議而引起或以任何方式與之有關的任何訴訟、訴訟或索賠將在紐約州法院或美國紐約南部 地區法院提起並執行,我方無可爭議地服從該司法管轄權,該司法管轄權將是任何此類訴訟的專屬法院, 訴訟或索賠。本規定適用於《證券法》下的索賠,但不適用於《交易法》下的索賠或 美利堅合眾國聯邦地區法院是唯一和專屬法院的任何索賠。
私募認股權證
除以下所述的 外,私募認股權證的條款及條款與作為Larkspur首次公開招股的 部分單位出售的認股權證相同。私募認股權證(包括在行使私募認股權證時可發行的普通股)在我們的初始業務合併完成後30天內不得轉讓、轉讓或出售(除我們的高級職員和董事以及與私募認股權證初始購買者有關聯的其他個人或實體的有限例外情況外),只要它們由保薦人或其獲準受讓人持有,吾等將不能贖回。保薦人或其獲準受讓人有權在無現金的基礎上行使私募認股權證。如果私募認股權證由保薦人或其獲準受讓人以外的持有人持有,則私募認股權證將可由我們在所有贖回情況下贖回,並可由持有人按與Larkspur首次公開募股所出售單位所包括的認股權證相同的基準行使。對私募認股權證條款的任何修訂或認股權證協議中有關私募認股權證的任何條款,都需要持有當時尚未發行的私募認股權證數量的至少50%的 持有人投票表決。
如果 私募認股權證持有人選擇在無現金基礎上行使認股權證,他們將支付行使價,支付行使價,支付行使價 他/她或其認股權證的認股權證數量等於(X)認股權證相關普通股數量的乘積乘以“保薦人公平市價”(定義見下文) 除以認股權證的行使價除以(Y)保薦人公平市價所得的商數。就此等目的而言,“保薦人公平市價” 指認股權證行使通知送交認股權證代理人的日期前,截至 第三個交易日止的10個交易日內普通股的平均收市價。Larkspur同意這些認股權證可在無現金基礎上行使,只要它們由保薦人及其許可受讓人持有,是因為在Larkspur首次公開募股時, 並不知道它們是否會在業務合併後與我們建立聯繫。如果他們仍然與我們保持聯繫,他們在公開市場上出售我們的證券的能力將受到極大限制。我們制定了政策,限制 內部人士出售我們的證券,但在特定時間段除外。即使在允許內部人士出售我們證券的這段時間內,如果內部人士掌握重要的非公開信息,他或她也不能交易我們的證券。因此,與公眾股東可以行使認股權證並在公開市場上自由出售行使認股權證後獲得的普通股以收回行使權證的成本不同,內部人士可能會受到很大限制,不能出售此類證券。 因此,我們認為允許持有人以無現金基礎行使認股權證是適當的。
為了彌補營運資金不足或支付與Larkspur計劃的初始業務合併相關的交易成本,發起人或發起人的關聯公司或Larkspur的某些高級管理人員和董事可以(但沒有義務)根據需要借給我們資金。最多1,500,000美元的此類貸款可根據貸款人的選擇,按每份認股權證35美元的價格轉換為公司的認股權證。這類認股權證將與私募認股權證相同。
| 157 |
管道 授權書
為配合PIPE認購協議,吾等根據A系列指定證書及PIP權證的條款,發行普通股認購權證(每份為“PIPE認股權證”),以購買最多相當於PIPE股份轉換後可發行普通股股份的最多數目的普通股 ,行使價最初相當於每股402.50美元,可作出若干調整。在我們的盡力而為發售後,PIPE認股權證的行使價重置為70.00美元,行使PIPE認股權證後可發行的普通股金額增加至141,868股。管道 認股權證的行使期為五年。PIPE認股權證的行權價將受若干調整影響,包括(I)股票股息及分拆、(Ii)後續供股、(Iii)按比例分配、(Iv)基本交易、(V)若干自願調整及(Vi)按行使價或低於行使價發行其他證券所產生的調整 ,在每種情況下,根據PIP權證的條款。
管道認股權證不包括任何兑換功能。管道認股權證可在無現金基礎上行使:(I)在沒有關於管道認股權證相關普通股的有效登記聲明的情況下,以及(Ii)在管道認股權證的行權期屆滿時。PIP權證持有人在行使認股權證並收取普通股股份之前,並不享有普通股持有人的權利或特權及任何投票權。普通股發行後 認股權證行使後,每位股東將有權就將由 股東表決的所有事項持有的每股股份享有一票投票權。截至2023年12月5日,未償還的管道權證有139,403份,所有這些權證都可以每股70.00美元的價格行使。
盡最大努力是必要的
根據我們於2023年1月27日向美國證券交易委員會提交的經修訂的S-1表格登記聲明(文件第333-269442號)(“盡力而為發售”),我們按行使價每股35美元(或每股合併公開發行價及隨附認股權證的100%),發行認股權證以購買314,751股普通股(“盡力而為認股權證”)。其中39,373份盡力而為權證重新定價 ,作為2023年7月發行的一部分,行權價從行權價35.00美元下調至5.78美元。以下 是盡力而為認股權證的某些條款和條款的摘要,並不完整,受認股權證條款的約束,並受認股權證條款的約束,其形式作為招股説明書的一部分作為註冊説明書的證物提交。我們鼓勵您仔細審閲認股權證表格的條款和規定,以獲得對認股權證條款和條件的完整描述。
存續期與行權價格
每份 認股權證的行使價相當於每股35.00美元(或每股合併公開發行價和附帶的 認股權證的100%)。認股權證將可立即行使,並可在發行之日起計五年內行使。行權時可發行的普通股的行權價格和數量在發生股票分紅、股票拆分、重組或影響我們的普通股和行權價格的類似事件時,將進行適當調整。認股權證將分別與普通股或預籌資權證分開 發行,並可在此後立即單獨轉讓。認股權證將 僅以認證形式簽發。
可運動性
根據每位持有人的選擇,認股權證將可全部或部分行使,方法是向吾等遞交正式簽署的行權通知 ,並就行權時所購買的普通股股數支付全數款項(以下討論的無現金行權除外)。持有人(及其聯屬公司)不得行使該等持有人認股權證的任何部分至 持有人在行使後立即擁有超過4.99%的已發行普通股,但如持有人於 向吾等發出至少61天的事先通知,持有人可在行使該等認股權證後增加已發行普通股的持有量,最多可於行使後增加至本公司已發行普通股數目的9.99%,該百分比所有權乃根據認股權證條款釐定。終止日,權證 將通過無現金行使方式自動行使。
無現金鍛鍊
如果, 在持有人行使認股權證時,登記發行或轉售認股權證相關普通股的登記聲明 當時並不有效或不適用於發行該等股份,則 持有人可選擇在行使認股權證時收取(全部或部分)根據認股權證所載公式釐定的普通股股份淨額,而不是支付原本預期在行使認股權證時向吾等支付的現金款項。
| 158 |
基本面交易
在 認股權證所述的任何基本交易(一般包括與另一實體的任何合併或合併)、出售我們的全部或幾乎所有資產、要約收購或交換要約、或我們普通股的重新分類的情況下,在任何 隨後行使認股權證時,持有人將有權就緊接該等基本交易發生前行使該等權利而可發行的普通股的每股股份,收取繼任者或收購公司或本公司普通股的股份數目,作為替代對價。如果是尚存的公司,以及持有者在緊接該事件之前可行使認股權證的普通股數量的交易中或因該交易而應收的任何額外 代價。儘管有上述規定,如發生基本交易,認股權證持有人有權要求吾等或後續實體於基本交易完成後30天內或同時贖回認股權證未行使部分的Black-Scholes 價值(定義見每份認股權證)的權證,以換取現金。
然而, 如果發生不在我們控制範圍內的基本交易,包括未經我們董事會批准的基本交易,權證持有人將有權從我們或我們的後續實體獲得與基本交易相關的相同類型或形式(且按相同比例)的對價,無論該對價是以現金形式向我們普通股持有人提供和支付的。股票或現金和股票的任何組合,或者我們普通股的持有者是否可以選擇獲得與基本交易相關的其他形式的對價。
可轉讓性
在符合適用法律的情況下,權證持有人在將權證連同適當的轉讓文書交回本行時,可自行選擇轉讓權證。
零碎股份
認股權證行使時,不會發行普通股的零碎股份。相反,根據我們的選擇,將發行的普通股數量將向上舍入到下一個完整的股份,或者我們將就該最後的 部分支付現金調整,金額等於該部分乘以行使價。
交易市場
目前認股權證尚無成熟的交易市場,我們預計不會出現活躍的交易市場。我們不打算申請 在任何證券交易所或其他交易市場上市權證。如果沒有交易市場,權證的流動性將極其有限。
作為股東的權利
除非 認股權證另有規定或憑藉持有人對本公司普通股股份的所有權,否則該認股權證持有人 不享有本公司普通股持有人的權利或特權,包括任何投票權,直至該持有人行使該等 持有人認股權證。認股權證將規定,認股權證持有人有權參與我們普通股的分派或股息。
豁免及修訂
經我方和持有人書面同意,可修改或修改本授權書,或放棄本授權書的規定。
| 159 |
2023年7月的認股權證
以下是2023年7月認股權證的某些條款和條款的摘要,並不完整,受2023年7月認股權證的條款制約,並受其限制。截至2023年12月5日,有2023年7月的認股權證可購買最多160,182股普通股,行使價為每股普通股5.78股。
持續期 和行權價
2023年7月發行的每份認股權證的行使價相當於每股5.78美元。2023年7月的S認股權證可立即行使 ,有效期至發行之日起計五年。在股票分紅、股票拆分、重組或類似事件影響我們的普通股和行權價格的情況下,行權時可發行的普通股的行權價格和股份數量將進行適當調整。
可運動性
2023年7月的認股權證可由每名持有人選擇全部或部分行使,方法是向吾等遞交正式籤立的行使權通知 ,並就行使權證時所購買的普通股股數支付全數款項(以下討論的無現金行使除外)。持有人(及其關聯公司)不得行使該持有人2023年7月認股權證的任何部分 ,條件是持有人在行使後立即擁有超過4.99%的已發行普通股,但在持有人向吾等發出至少61天的事先通知後,持有人可在 行使持有人的2023年7月認股權證後,將已發行普通股的持有量增加至緊隨行使後已發行普通股數量的9.99%,因為該百分比所有權是根據認股權證的條款確定的。在終止日期 ,認股權證將通過無現金行使自動行使。
無現金鍛鍊
如果在持有人根據證券法行使其2023年7月認股權證時,登記發行或轉售認股權證相關普通股的登記聲明當時並未生效或不適用於發行該等股份,則 持有人可選擇根據2023年7月認股權證所載公式收取(全部或部分)行使認股權證時所決定的普通股股份淨額,以代替預期於行使認股權證時向吾等支付的現金付款。
| 160 |
基本交易
如果發生如2023年7月認股權證所述的任何基本交易,一般包括與另一實體的任何合併、出售我們的全部或幾乎所有資產、要約收購或交換要約、或我們普通股的重新分類,則在隨後的任何認股權證行使時,持有者將有權就緊接該基本交易發生前行使認股權證後可發行的普通股的每股股份收取替代對價, 繼任者或收購公司或本公司的普通股股份數目,如果是尚存的公司, 以及持有者在緊接該事件發生前可行使認股權證的普通股數量的交易中或因該交易而應收的任何額外代價。儘管如上所述,如果發生基本交易,2023年7月權證的持有人有權要求我們或後續實體在基本交易完成後30天內,同時贖回或贖回權證未行使部分的布萊克-斯科爾斯價值(定義見每份權證),以換取現金 。
然而, 如果發生不在我們控制範圍內的基本交易,包括未經我們董事會批准的基本交易,2023年7月認股權證的持有人將有權從我們或我們的後續實體獲得自該基本交易完成之日起的相同類型或形式(以及相同比例)的對價,其價值為向我們普通股持有人提供並支付與該基本交易相關的權證的未行使部分的黑斯科爾斯 價值,無論該對價是現金形式,股票或現金和股票的任何組合,或者我們普通股的持有者是否可以選擇獲得與基本交易相關的其他形式的對價 。
可轉讓性
在符合適用法律的情況下,2023年7月認股權證在持有人將2023年7月認股權證連同適當的轉讓文書交回吾等後,可由持有人自行選擇轉讓。
零碎的 股
於2023年7月認股權證行使時,不會發行普通股的零碎股份。相反,根據我們的選擇,將發行的普通股數量將向上舍入到下一整股,或者我們將就該最終部分支付現金調整,金額等於該部分乘以行使價。
交易 市場
2023年7月的權證沒有成熟的交易市場,我們預計不會出現活躍的交易市場。我們不打算 申請將認股權證在任何證券交易所或其他交易市場上市。如果沒有交易市場,權證的流動性將極其有限。
權利 作為股東
除認股權證另有規定或持有人對本公司普通股股份的所有權另有規定外,持有本公司2023年7月認股權證的持有人在該持有人 行使該持有人的2023年7月認股權證之前,並不享有本公司普通股持有人的權利或特權,包括任何投票權。2023年7月的認股權證將規定,認股權證持有人有權 參與我們普通股的分派或派息。
豁免和修正案
經我方和持有人書面同意,可修改或修訂認股權證,或放棄2023年7月認股權證的條款。
| 161 |
獎勵令
於2023年9月,根據有限時間誘因要約,以4.75美元的減價行使本公司普通股股份的203,464份現有認股權證。因此,公司發行了203,464股普通股,加上203,464股新的誘導權證,行使價為4.75美元,獲得約966,000美元的總收益。 新的誘導權證於發行六個月週年日起可行使,並可在此後五年內行使 。
期限和行權價格 價格
每個 誘導權證的行權價格將等於其適用的減價行權價格。誘導權證將於發行之日起六個月內行使,並可自該日起行使五年。在發生股票分紅、股票拆分、重組或類似事件影響我們的普通股和行權價格時,行權價格和行權時可發行的普通股數量將進行適當調整。
可運動性
激勵認股權證將可由每名持有人選擇全部或部分行使,方法是向吾等遞交正式籤立的行權通知,並就行權時購買的普通股股數支付全數款項(以下討論的無現金行權的情況除外)。持有人(及其聯營公司)不得行使該持有人的 誘導權證的任何部分,條件是持有人在行使權證後立即擁有超過9.99%的已發行普通股,但在持有人向吾等發出至少61天的事先通知後,持有人可增加該百分比的擁有權。
無現金鍛鍊
如在持有人行使誘導權證時,登記根據1933年證券法(經修訂)(“證券法”)發行誘導權證股份 的登記聲明當時並不有效或不適用於發行 該等股份,則持有人可選擇在行使誘導權證時收取(全部或部分)根據誘導權證所載公式釐定的普通股股份淨額,以代替在行使誘導權證時預期向吾等支付的現金付款。
基本面交易
如果發生任何基礎交易,如誘導權證中所述,一般包括與另一實體的任何合併、出售我們的全部或幾乎所有資產、要約收購或交換要約、或我們普通股的重新分類, 則在隨後行使誘導權證時,持有人將有權以 在緊接該基礎交易發生之前行使該權證後可發行的普通股作為替代對價,收取繼任者或收購公司或本公司普通股的股數。如果是尚存的 公司,以及持有在緊接該事件之前可行使激勵認股權證的普通股數量的 普通股的持有人在該交易中或因該交易而應收的任何額外代價。儘管有上述規定,如發生基本交易,誘導權證持有人有權要求吾等或後繼實體 在基本交易完成後30天內或同時贖回誘導權證中未行使部分的布萊克-斯科爾斯價值(定義見各誘導權證)的現金誘導權證。
然而, 如果發生不在我們控制範圍內的基本交易,包括一項未經我們董事會批准的基本交易,誘導權證持有人將有權從我們或我們的後續實體獲得與基本交易相關的相同類型或形式(且按相同比例)的對價,無論該對價是以現金的形式提供並支付給我們普通股持有人的。股票或現金和股票的任何組合,或者我們普通股的持有者是否可以選擇獲得與基本交易有關的其他形式的對價 。
可轉讓性
在符合適用法律的情況下,在將誘因認股權證連同適當的轉讓文書交回吾等時,持有人可選擇轉讓誘因認股權證。
零碎股份
於激勵認股權證行使時,不會發行普通股的零碎股份。相反,根據我們的選擇,將發行的普通股數量將向上舍入到下一個完整的股份,或者我們將就該最終部分支付現金調整 ,金額等於該部分乘以行使價。
交易市場
目前還沒有成熟的誘導權證交易市場,我們預計不會出現活躍的交易市場。我們不打算申請在任何證券交易所或其他交易市場上市 誘導權證。如果沒有交易市場,誘導權證的流動性將極其有限。
| 162 |
作為股東的權利
除非 誘導權證另有規定或憑藉持有人對本公司普通股股份的所有權,該等 誘導權證持有人並不享有本公司普通股持有人的權利或特權,包括任何投票權,直至該持有人行使該持有人的誘導權證。誘導權證將規定,誘導權證的持有人有權參與我們普通股的分派或派息。
豁免及修訂
經我方和持有人書面同意,可修改或修改誘因認股權證,或放棄誘因認股權證的規定。
替換 認股權證
從2022年3月至2022年12月,佛羅裏達州的ZyVersa治療公司(“Old ZyVersa”)進行了一次私募 發售其A系列可轉換優先股和認股權證(“橋樑認股權證”),以購買 Old ZyVersa的普通股(“橋樑融資”)。本公司的某些關聯公司作為投資者參與了橋樑融資 。A系列可轉換優先股的股票在緊接業務合併完成之前自動轉換為舊ZyVersa普通股。該等舊ZyVersa普通股於完成業務組合後(按交換比率)交換為36,363股本公司普通股(其中9,365股與過橋融資有關,其餘 為2021年本票融資轉換為過橋融資的轉換所得)。此外,在完成業務合併後,已發行的過橋認股權證被假定並(根據合併交換比率)轉換為認股權證,以購買我們普通股的股份。2022年12月12日,在業務合併完成的同時,本公司發行了置換認股權證(“置換認股權證”),以換取橋式認股權證,如下所述。
可對36,363股普通股行使 認股權證(其中9,365股認股權證來自橋融資,其餘認股權證來自2021年本票融資轉換為橋融資) ,初始行使價相當於每股241.50美元(經調整以使業務合併生效),須受 某些調整。替代認股權證的行使期為五年。替換認股權證的行使價將受到某些調整的影響,包括因派發股息、重新分類和拆分而產生的調整。更換認股權證 不包括任何兑換功能。替代認股權證可在無現金基礎上行使。置換認股權證持有人 在行使認股權證並獲得普通股股份之前,不享有普通股持有人的權利或特權及任何投票權。於行使替代認股權證而發行普通股後,每名持有人將有權就所有將由股東表決的事項,以每一股已登記在案的普通股股份投一票。
可轉換債券輪權證
2018年11月30日,Old ZyVersa發行了可轉換債券輪權證(“可轉換債券輪權證”),如下所述。未發行的可轉換債券輪認股權證由本公司在完成業務合併後承擔。
可轉換債券輪認股權證可行使3,771股普通股,初始行權價等於每股405.30美元,但須作出某些調整。可轉換債券輪的行使期限為五年。 可轉換債券輪的行使價格將受到某些調整,包括因股票股息、重新分類和拆分而產生的調整。可轉換債券輪認股權證不包括任何贖回功能。可轉換債券 輪權證可在無現金基礎上行使。可轉換債權證持有人在行使認股權證並收取普通股股份前,並不享有普通股持有人的權利或特權及任何投票權。在可轉換債券輪認股權證行使後發行普通股後,每位持有人將有權就其股東就所有事項所登記持有的每股普通股股份投一票 。
經紀人 認股權證
2018年11月30日,Old ZyVersa發行了經紀認股權證(以下簡稱經紀認股權證)。尚未發行的經紀 權證於業務合併完成後由本公司承擔。經紀權證於2023年11月1日到期。
| 163 |
戰略性 認股權證
2019年4月16日,Old ZyVersa發佈了戰略認股權證(“戰略認股權證”),詳情如下。未償還的 戰略認股權證由本公司於業務合併完成後承擔。
戰略認股權證總數為8,669份,其中3,268份目前可行使普通股股份,初步行使價格為每股275.10美元,須作出若干調整。剩餘的5,401個將在取得里程碑式成就時定價。戰略認股權證的行使期為五年。戰略認股權證的行使價將受若干調整影響,包括因派發股息、重新分類及拆分而產生的調整。戰略認股權證 不包括任何贖回功能。戰略認股權證可在無現金基礎上行使。戰略認股權證持有人在行使認股權證並收取普通股股份前,並不享有普通股持有人的權利或特權及任何投票權。於戰略認股權證行使後發行普通股後,每名股東將有權就其股東就所有事項所登記持有的每股普通股股份投一票。
《憲章》和《附例》的反收購
《憲章》和《章程》包含可能延遲、推遲或阻止另一方獲得對本公司控制權的條款。 公司希望下面概述的這些規定將阻止強制收購行為或不充分的收購出價。這些規定還旨在鼓勵尋求獲得該公司控制權的人首先與董事會,公司認為這可能會導致任何此類收購的條款得到改善,有利於公司的 股東。然而,它們也賦予董事會阻止一些股東可能贊成的合併的權力。
董事會 組成和填補空缺
章程規定,只有在有理由的情況下,並且只有在擁有至少多數 當時有權在董事選舉中投票的所有有表決權股票的持有人投票的情況下,才可罷免董事。 董事會因死亡、辭職、取消資格、退休、免職或其他原因而產生的任何空缺,以及 因董事人數增加而產生的任何新設董事職位,應完全由現任董事的過半數贊成票填補,即使不足法定人數,或由唯一剩餘董事(由一個或多個已發行優先股系列單獨投票選出的任何董事除外),且不得由股東填補。根據上一句任命的任何 董事應任職至 該董事應被任命的類別的任期屆滿或其提前死亡、辭職、退休、取消資格或免職。
股東特別會議
《憲章》規定:(A)股東大會主席可召集股東特別會議。董事會、(B)董事會或(C)本公司首席執行官或總裁 ,但該特別會議可由董事會或召集會議的其他人士延期、重新安排或取消。該章程將年度或特別股東大會上可能進行的事務限制在適當提交會議的事項上。
經書面同意採取的行動
章程規定,要求或允許股東採取的任何行動必須在股東年度或特別會議上 ,不得以書面同意代替會議採取。
提前 通知要求
章程規定了與提名候選人蔘選 或提交股東會議的新業務有關的股東提案的事先通知程序。這些程序規定,股東提案通知 必須在擬採取行動的會議之前以書面形式及時向公司的公司祕書發出。一般而言,為及時,通知必須在上一年的年度大會第一週年日前90天 或120天前,或(如較晚)10天前,在公司主要行政辦公室收到這是 首次公開披露(定義見第2.4節)該特別會議日期的次日。 章程規定了所有股東通知的形式和內容的要求。這些要求可能阻止股東 在年度或特別會議上向股東提出事項。
| 164 |
章程和章程修正案
董事會明確授權採用、修改或廢除章程。公司的股東也有 通過、修改或廢除章程的權力;條件是,除了適用法律或本章程要求的公司任何類別或系列股票的持有人的任何投票權外,(包括一個或多個優先股系列 的任何指定證書)或公司章程,採納,公司股東對章程的修訂或廢除 應要求擁有至少 當時有權在董事選舉中普遍投票的所有有表決權的公司當時流通股的投票權的持有人投贊成票, 作為一個類別共同投票 。
特拉華州 反收購法規
DGCL和我們的章程的條款 可能會使通過要約收購、委託書競爭或其他方式收購本公司變得更加困難, 或罷免現任高級管理人員和董事。這些條款概述如下,旨在阻止強制收購行為和不充分的收購要約,並鼓勵尋求獲得公司控制權的人首先與 董事會談判。我們認為,這些條款的好處大於阻止某些收購或收購提議的壞處,因為談判這些提議可能會改善條款,並增強我們董事會實現股東價值最大化的能力 。然而,這些條款可能會延遲、阻止或阻止股東可能認為符合其最佳利益的對我們的合併或收購,包括那些可能導致溢價高於普通股現行市場價格的嘗試。
此外,我們的憲章還規定了可能具有反收購效力的某些其他條款:
| ● | 沒有關於董事選舉的 累計投票; | |
| ● | 董事會有權選舉一名董事,以填補因 董事會擴大或在某些情況下董事辭職、去世或罷免而產生的空缺; | |
| ● | 董事 只有在有理由的情況下才能從董事會中免職; | |
| ● | 董事會將分為三類董事,因此,一個人可以通過在兩個或兩個以上的年度 會議上成功地進行代理競爭來獲得對我們董事會的控制權; | |
| ● | 禁止股東在書面同意下采取行動,迫使股東在股東年度會議或特別會議上採取行動; | |
| ● | 禁止股東召開特別會議,並要求只有我們的董事會成員才能召開股東會議,這可能會推遲我們的股東強制考慮提案或採取行動的能力,包括罷免董事 ;和 | |
| ● | 我們的 授權但未發行的普通股和優先股可用於未來的發行,無需股東批准,並且可以 可用於各種公司目的,包括未來用於籌集額外資本、收購和員工福利計劃的產品。本公司董事會有權在無需股東進一步批准的情況下指定一個或多個優先股系列以及該系列優先股的相關投票權、優先股和特權。已授權但未發行的 和未保留的普通股和優先股的存在可能會使獲得控制權的嘗試變得更加困難或受阻我們 通過代理競爭,要約收購、合併或其他方式。 |
| 165 |
論壇 選擇條款
我們的 憲章包括論壇選擇條款。我們的《憲章》規定,除有限的例外情況外,特拉華州衡平法院和特拉華州內的聯邦法院將是下列任何人的專屬論壇:
| ● | 衍生 代表公司提起的訴訟或訴訟; |
| ● | 主張董事、本公司高管或股東違反本公司或本公司股東的受託責任或其他不當行為的訴訟; |
| ● | 針對本公司或本公司的任何高級職員、股東、僱員或代理人根據本公司章程或附例的任何規定或本公司授權特拉華州衡平法院行使管轄權的訴訟; | |
| ● | 解釋、適用、強制執行或確定本公司章程或章程的有效性的行動 ;或 | |
| ● | 針對公司或受內部事務原則管轄的公司任何現任或前任董事、高管、 或股東主張索賠的其他 行動。 |
此 選擇的法院條款不適用於為執行《交易法》或聯邦法院擁有專屬管轄權的任何其他索賠而提起的義務或責任的訴訟。此外,根據我們的章程,除非公司書面同意選擇替代法院,否則美國聯邦地區法院將在 法律允許的最大範圍內成為解決根據證券法提出的任何訴因的獨家法院。公司 打算將本條款適用於根據《證券法》提出訴因的任何投訴,儘管《證券法》第 22節規定,聯邦法院和州法院可同時管轄為執行《證券法》或其下頒佈的規則和條例所規定的任何義務或責任而提起的所有訴訟。
高級職員和董事的責任和賠償限制
《憲章》包含將公司現任和前任董事對金錢損害的責任限制在特拉華州法律允許的最大限度內的條款。特拉華州法律規定,公司董事不對任何違反董事受託責任的行為承擔個人賠償責任,但以下責任除外:
| ● | 任何 違反了他對我們或我們的股東忠誠的義務; | |
| ● | 非善意的行為或者不作為,或者涉及故意的不當行為或者明知是違法的 ; | |
| ● | 非法支付股息或非法回購或贖回股票;以及 | |
| ● | 董事牟取不正當個人利益的交易。 |
對於違反美國聯邦證券法的行為,這些規定可能被裁定為不可執行。
轉接 代理
普通股轉讓代理和登記機構以及公開認股權證和私募認股權證的認股權證代理為大陸股票轉讓信託公司。我們已同意賠償大陸證券轉讓信託公司作為轉讓代理人和認股權證代理人、其代理人及其股東、董事、高級職員和員工的所有責任,包括因其以該身份進行的活動或遺漏的行為而可能產生的判決、費用和合理的律師費,但因受賠人或實體的任何嚴重疏忽、故意不當行為或失信行為而產生的責任除外。
| 166 |
我們提供的證券説明
我們將發行400,000股普通股,A系列普通權證購買最多4,000,000股普通股 系列普通股認股權證,以每股1.25美元的公開發行價購買最多4,000,000股普通股,以及附帶的A系列普通權證和B系列普通權證。我們還向那些在本次發售中購買我們普通股股份將 導致買方及其關聯方和某些關聯方在本次發售完成後實益擁有超過4.99%(或經買方選擇,9.99%)我們的普通股流通股的購買者提供預資權證,以購買最多3,600,000股普通股,而不是將導致該超額所有權的普通股股份 。普通股和預先出資的認股權證的每股股票將與A系列普通股認股權證和B系列普通股認股權證一起出售。 普通股認股權證的行使價為每股1.25美元,發行時可行使。A系列普通權證將於發行五週年時終止,而B系列普通權證將於發行十八個月後終止 。我們還登記在行使預先出資的認股權證和在此提供的普通權證時可不時發行的普通股股份。
普通股 股票
本公司普通股的主要條款和規定在“股本説明”的標題下説明。
本次發行中提供預融資的 認股權證
持續期 和行權價
在此發售的每一份預付資金認股權證的初始行權價將相當於每股普通股0.0001美元。預付資金權證將可立即行使,並可隨時行使,直至預付資金認股權證全部行使為止。行權價格和行權時可發行的股票數量在發生股票分紅、股票拆分、重組或影響我們普通股和行權價格的類似事件時,將進行適當的比例調整。
可運動性
預籌資認股權證將根據每個持有人的選擇,全部或部分通過向我們交付正式籤立的行使權證通知和(I)兩個交易日和(Ii)構成普通股標準結算期的交易日(以較早者為準)在此後交付行使權證通知之日有效的方式行使。全額支付在行使時購買的普通股股數(以下討論的無現金行使除外)。 持有人不得行使預籌資權證的任何部分,條件是持有者及其關聯公司和任何其他 人以及任何此類人士將擁有超過4.99%(或經購買者選擇,9.99%)的 行使後立即發行的普通股股數(“受益所有權限制”); 只要實益所有權限額為4.99%的持有人在接到通知後61天內通知我們,只要實益所有權限額在任何情況下都不超過行權後已發行普通股數量的9.99%,該持有人就可以提高實益所有權限額。
| 167 |
無現金鍛鍊
持有者可以通過無現金行使的方式行使其預付的認股權證(全部或部分),而不是進行預期的現金支付 以支付行權總價,在此期間,持有人只能通過無現金行權的方式行使其預付資助權證(全部或部分),持有者有權在行使時獲得根據預付資權證中規定的公式確定的普通股淨股數。其規定的股票數量一般等於(A)(1)行權通知前一個交易日的成交量加權平均價格,如果行權通知是在非交易日或在行權通知的交易日“常規交易時間”開盤前的一天籤立和交付,或(Y)行權通知的交易日,如果行權通知是在該交易日的“正常交易時間”結束之後籤立和交付的,或(2)行權通知當日的買入價,如果行權通知是在交易日的“正常交易時間”內執行並在此後兩小時內交付的,則減去(B)行權價格乘以(C)可行使預融資認股權證的普通股數量,再除以 該乘積除以根據本句(A)款確定的數量。
零碎的 股
在行使預先出資的認股權證時,不會發行普通股的零碎股份。相反,我們將在我們的選擇中, ,代替發行該零碎股份,(I)支付金額等於該零碎股份乘以行權價格的現金,或(Ii)四捨五入到在行使預融資認股權證後可發行的下一個完整股份。
可轉讓性
在符合適用法律的情況下,預付資助權證可在持有人將預備資金權證交還給我們時根據持有人的選擇進行轉讓 連同適當的轉讓文書和足以支付此類轉讓時應繳納的任何轉讓税款的資金。
交易 市場
在任何證券交易所或國家認可的交易系統上,都沒有預融資權證的交易市場。我們 不打算在任何證券交易所或國家認可的交易系統上上市預融資權證。行使預融資權證後可發行的普通股目前在納斯達克掛牌上市,代碼為“ZVSA”。
作為股東的權利
除 預資金權證另有規定或憑藉該持有人對普通股股份的所有權外,預資資權證持有人在行使其預資資權證之前,並不享有本公司普通股持有人的權利或特權,包括任何投票權。
基本交易
如果發生如預籌資權證所述的基本交易,一般包括我們普通股的任何重組、資本重組或重新分類,出售、轉讓或以其他方式處置我們的全部或幾乎所有財產 或資產,我們與另一人的合併或合併,收購公司普通股股權的50%以上的投票權,預資資權證的持有人將有權在行使預資資權證時獲得 種類和金額的證券,如果持有人在緊接這類基本交易之前行使預籌資權證,他們將獲得的現金或其他財產。
| 168 |
本次發行中提供普通 認股權證
稀釋 和行使價
在此發售的每份普通權證的初始行使價為每股1.25美元。普通權證將立即可行使。A系列普通權證將於發行五週年時終止,而B系列普通權證將於發行十八個月後終止 。如果發生股息、股份拆分、重組或類似事件影響我們的普通股和行權價格,行使時可發行的普通股的行使價和股份數量將受到適當的比例調整 。
可運動性
普通權證將根據每個持有人的選擇,通過向我們交付正式簽署的行使通知和(I)兩個交易日和(Ii)構成普通股的標準結算期的交易日(以較早者為準)在此後交付行使通知之日有效的方式,全部或部分行使普通股。全額支付在行使時購買的普通股股數(以下討論的無現金行使除外)。 持有者不得行使普通股認股權證的任何部分,條件是持有者及其附屬公司和任何其他作為一個集團的人以及任何此類人將擁有超過4.99%(或在購買者選擇時,9.99%)的普通股在行使權證後立即發行的股數(“受益所有權限制”); 只要實益所有權限額為4.99%的持有人在通知吾等並在該通知送達吾等後六十一(61)天內生效 ,只要實益所有權限額在任何情況下均不超過行權後已發行普通股數量的9.99% ,該持有人即可提高實益所有權限額。
無現金鍛鍊
如果, 在持有人行使普通權證時,根據證券法登記普通股股票發行的登記聲明 不再有效或不適用於該等股票的發行,則 持有人只能行使其普通權證(全部或部分),而不是在行使時向我們支付現金,以支付總的行權價,在這種情況下,通過無現金行使,持有人有權在行使時獲得根據普通權證中提出的公式確定的普通股淨數量,該公式通常規定普通股的數量等於(A)(1)行使通知前一個交易日的 成交量加權平均價格,如果行權通知是在非交易日或在交易日的“正常交易時間”開盤前或(Y)行權通知的交易日 之前籤立和交付的,如果行權通知是在該交易日的“正常交易時間”收盤之後籤立和交付的,或者(2)行權通知當天的買入價,如果行權通知是在交易日的“正常交易時間”內執行並在此後兩小時內交付的,則減去(B)行權價格,乘以(C)可行使普通股認股權證的普通股股數,乘以該乘積除以本句第(A)款規定的數字。
零碎的 股
在普通權證行使時,不會發行普通股的零碎股份。相反,我們將在我們的選擇中,並 代替發行該零碎股份,(I)支付金額等於該零碎股份乘以行權價格的現金,或(Ii)向上舍入至在行使普通權證時可發行的下一個完整股份。
可轉讓性
在符合適用法律的情況下,普通權證在將普通權證交還給吾等後,持有人可選擇將其連同適當的轉讓文書和足以支付轉讓時應付的任何轉讓税款的資金一起轉讓。
交易 市場
任何證券交易所或國家認可的交易系統上的普通權證都沒有交易市場。我們不打算在任何證券交易所或國家認可的交易系統上上市普通權證。行使普通權證後可發行普通股 目前在納斯達克掛牌上市,代碼為“ZVSA”。
| 169 |
作為股東的權利
除 普通權證另有規定或憑藉該持有人對普通股股份的所有權外,普通權證持有人 在 行使其普通股認股權證前,並不享有本公司普通股持有人的權利或特權,包括任何投票權。
基本交易
如果發生普通權證中所述的基本交易,一般包括普通股的任何重組、資本重組或重新分類,出售、轉讓或以其他方式處置我們所有或幾乎所有的財產或資產, 我們與他人合併或合併,收購公司普通股超過50%的投票權,普通權證持有人將有權在行使普通權證時獲得 證券的種類和金額,如果持有人在緊接此類基本交易之前行使普通權證,他們將獲得現金或其他財產。此外,在發生基本交易的情況下,我們或任何後續實體將根據普通權證持有人的選擇權,在基本交易完成 的同時或在基本交易完成後三十(30)天內(或,如果晚於其公佈日期)從持有人手中購買普通權證,向持有人支付相當於基於Black-Scholes期權定價模型的基本交易完成日期 該普通權證剩餘未行使部分的價值的對價。根據共同認股權證中規定的公式 確定。支付給持有人的對價將與與基本交易相關的向普通股持有人提出和支付的對價的類型或形式相同;如果沒有提出或支付此類對價,普通股持有人將被視為在該基本交易中收到了後續實體的普通股 ,就本普通權證的規定而言。
| 170 |
法律事務
在此提供的證券的有效性將由紐約Thompson Hine LLP為我們傳遞。配售代理 由加利福尼亞州科斯塔梅薩的馬納特,菲爾普斯和菲利普斯律師事務所代表,與此次發行有關。
| 171 |
專家
ZyVersa Treateutics,Inc.於2022年12月31日(前身)和2021年12月31日(前身)、2022年12月13日至2022年12月31日(前身)、2022年1月1日至2022年12月12日(前身)和截至2021年12月31日的合併財務報表已由獨立註冊會計師事務所安永會計師事務所審計。如其報告所載(該報告載有一段解釋,描述財務報表附註 2所述令人對本公司持續經營能力產生重大懷疑的情況),並根據該等公司作為會計及審計專家的授權而列入。
| 172 |
此處 您可以找到詳細信息
我們 向美國證券交易委員會提交年度、季度和當前報告、委託書和其他信息。我們還根據證券法就本招股説明書提供的證券提交了S-1表格的登記聲明 ,包括證物。本招股説明書 是註冊説明書的一部分,但並不包含註冊説明書或證物中包含的所有信息。 我們的美國證券交易委員會備案文件可在互聯網上由美國證券交易委員會維護的網站http://www.sec.gov.上向公眾提供這些文件 也可在我們的網站上的“財務和文件”標題下向公眾提供或通過http://www.zyversa.com. The訪問,但我們網站上包含的信息或通過我們網站以其他方式訪問的信息不是、也不應被視為本招股説明書的一部分。
| 173 |
財務報表索引
| 獨立註冊會計師事務所報告(PCAOB ID:42) | F-2 | |
| 截至2022年12月31日(繼任者)和2021年12月31日(前身)的資產負債表 | F-3 | |
| 2022年12月13日至2022年12月31日(繼任)、2022年1月1日至2022年12月12日(前身)和2021年12月31日終了年度(前身)的業務説明 | F-4 | |
| 2022年12月13日至2022年12月31日繼承期股東權益變動表 | F-5 | |
| 2021年12月31日至2022年12月12日前一期間股東虧損額變動報表 | F-6 | |
| 2022年12月13日至2022年12月31日(繼任)、2022年1月1日至2022年12月12日(前身)和2021年12月31日終了年度(前身)的現金流量表 | F-7 | |
| 合併財務報表附註 | F-8 |
| 截至2023年9月30日(未經審計)和2022年12月31日(後續)的簡明綜合資產負債表 | F-33 | |
| 截至2023年9月30日(後繼)和2022年9月30日(前身)的三個月和九個月未經審計的合併業務簡表 | F-34 | |
| 截至2023年9月30日(繼任)和2022年9月30日(前身)的三個月和九個月未經審計的簡明股東權益變動表(虧損表) | F-35 | |
| 截至2023年9月30日(後繼)和2022年9月30日(前身)的9個月未經審計的簡明現金流量表 | F-36 | |
| 未經審計的簡明合併財務報表附註 | F-37 |
| F-1 |
獨立註冊會計師事務所報告{br
致ZyVersa治療公司的股東和董事會。
對財務報表的意見
我們 審計了ZyVersa治療公司(本公司)截至2022年12月31日(後繼者) 和2021年(前身)的合併資產負債表、2022年12月13日至2022年12月31日(後繼者)期間的相關綜合經營報表、股東權益和現金流量的變化、2022年1月1日至2022年12月12日(前身)和截至2021年12月31日的年度的相關綜合經營報表、股東短缺和現金流量變化以及相關附註 (統稱為“合併財務報表”)。我們認為,綜合財務報表在所有重要方面都公平地反映了公司於2022年12月31日、2022年12月31日和2021年12月31日的財務狀況,以及2022年12月13日至2022年12月31日(後繼者)、2022年1月1日至2022年12月12日(前身)以及截至2021年12月31日的年度的經營成果和現金流,符合美國公認會計原則。
公司作為持續經營企業的能力
隨附綜合財務報表的編制假設本公司將持續經營。如財務報表附註2中所述 ,該公司遭受了經常性的經營損失,存在營運資金不足,且 已表示對該公司持續經營的能力存在重大疑問。管理層對事件和條件的評估以及管理層關於這些事項的計劃也在附註2中描述。合併財務報表 不包括可能因此不確定性結果而導致的任何調整。
徵求意見的依據
這些 財務報表由公司管理層負責。我們的責任是根據我們的審計對公司的財務報表發表意見。我們是一家在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券 法律以及美國證券交易委員會和PCAOB的適用規則和法規,我們必須與公司保持獨立。
我們 按照PCAOB的標準進行審計。這些標準要求我們計劃和執行審計,以獲得關於財務報表是否沒有重大錯報的合理保證,無論是由於錯誤還是舞弊。公司 不需要對其財務報告的內部控制進行審計,也沒有聘請我們進行審計。作為我們審計的一部分,我們需要了解財務報告的內部控制,但不是為了對公司財務報告內部控制的有效性發表意見。因此,我們不表達這樣的意見。
我們的 審計包括執行程序,以評估財務報表重大錯報的風險,無論是由於錯誤 還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查與財務報表中的金額和披露有關的證據。我們的審計還包括評估管理層使用的會計原則和作出的重大估計,以及評估財務報表的整體列報。我們相信,我們的審計 為我們的觀點提供了合理的基礎。
/s/ 安永律師事務所
我們 自2019年以來一直擔任本公司的審計師。
佛羅裏達州奧蘭多
2023年3月31日,除合併財務報表附註14中討論的反向股票拆分的影響外,日期為2023年12月4日
| F-2 |
ZYVERSA THERAPEUTICS,INC.
合併資產負債表
| 繼任者 | 前身 | |||||||
| 十二月三十一日, | 十二月三十一日, | |||||||
| 2022 | 2021 | |||||||
| 資產 | ||||||||
| 流動資產: | ||||||||
| 現金 | $ | 5,902,199 | $ | 328,581 | ||||
| 預付費用和其他流動資產 | 225,347 | 106,929 | ||||||
| 供應商保證金 | 235,000 | 376,272 | ||||||
| 流動資產總額 | 6,362,546 | 811,782 | ||||||
| 設備,網絡 | 17,333 | 27,733 | ||||||
| 正在進行的研究和開發 | 100,086,329 | - | ||||||
| 商譽 | 11,895,033 | - | ||||||
| 保證金 | 46,659 | 46,659 | ||||||
| 經營性租賃使用權資產 | 98,371 | - | ||||||
| 供應商保證金 | - | 240,000 | ||||||
| 總資產 | $ | 118,506,271 | $ | 1,126,174 | ||||
| 負債、臨時權益和股東權益(虧損) | ||||||||
| 流動負債: | ||||||||
| 應付帳款 | $ | 6,025,645 | $ | 2,000,100 | ||||
| 應計費用和其他流動負債 | 2,053,559 | 1,914,101 | ||||||
| 經營租賃負債 | 108,756 | - | ||||||
| 衍生負債 | - | 560,600 | ||||||
| 應付可轉換票據(截至2022年12月31日和2021年12月31日,分別扣除0美元和39,942美元的債務折價) | - | 5,976,508 | ||||||
| 可轉換應付票據關聯方 | - | 3,175,000 | ||||||
| 流動負債總額 | 8,187,960 | 13,626,309 | ||||||
| 遞延税項負債 | 10,323,983 | - | ||||||
| 總負債 | 18,511,943 | 13,626,309 | ||||||
| 承付款和或有事項(附註10) | - | - | ||||||
| 繼任者 可贖回普通股,可能贖回截至2022年12月31日已發行的1,880股 | 331,331 | - | ||||||
| 前身可贖回普通股,可能需要贖回,截至2021年12月31日已發行的331,331股 | - | 331,331 | ||||||
| 股東權益(不足): | ||||||||
| 優先股,面值0.0001美元,授權股份1,000,000股: | ||||||||
| 截至2022年12月31日,A系列繼任者優先股,指定股份8,635股,已發行和已發行股票8,635股 | 1 | - | ||||||
| 繼任者B系列優先股,指定5,062股,截至2022年12月31日已發行和已發行5,062股 | 1 | |||||||
| 繼承人 普通股,面值0.0001美元,授權股份1.1億股;截至2022年12月31日已發行和已發行股票257,604股 | 26 | - | ||||||
| 前身普通股,面值0.00001美元,授權股份75,000,000股;截至2021年12月31日已發行和已發行24,167,257股 | - | 242 | ||||||
| 追加實收資本 | 104,584,147 | 40,065,109 | ||||||
| 累計赤字 | (4,921,178 | ) | (52,896,817 | ) | ||||
| 股東權益總額(虧損) | 99,662,997 | (12,831,466 | ) | |||||
| 負債總額、臨時權益和股東權益(虧損) | $ | 118,506,271 | $ | 1,126,174 | ||||
附註是這些合併財務報表的組成部分。
| F-3 |
ZYVERSA THERAPEUTICS,INC.
綜合 運營説明書
| 繼任者 | 前身 | |||||||||||
| 對於 期間 | 對於 期間 | 本年度的 | ||||||||||
| 12月 13至 | 1月1日至 | 告一段落 | ||||||||||
| 12月31日, | 12月 12, | 12月31日, | ||||||||||
| 2022 | 2022 | 2021 | ||||||||||
| 運營費用 : | ||||||||||||
| 研發 | $ | 399,894 | $ | 5,407,859 | $ | 2,124,277 | ||||||
| 常規 和管理 | 420,174 | 7,605,205 | 5,580,099 | |||||||||
| 運營費用總額 | 820,068 | 13,013,064 | 7,704,376 | |||||||||
| 運營虧損 | (820,068 | ) | (13,013,064 | ) | (7,704,376 | ) | ||||||
| 其他 (收入): | ||||||||||||
| 利息 費用 | - | 427,542 | 821,366 | |||||||||
| 衍生負債公允價值變動 | - | 607,001 | (228,100 | ) | ||||||||
| 收益 關於免除PPP貸款 | - | - | (213,481 | ) | ||||||||
| 税前 淨虧損 | (820,068 | ) | (14,047,607 | ) | (8,084,161 | ) | ||||||
| 收入 税收優惠 | 745,050 | - | - | |||||||||
| 淨虧損 | (75,018 | ) | (14,047,607 | ) | (8,084,161 | ) | ||||||
| 被視為 優先股股東股息 | - | (10,015,837 | ) | - | ||||||||
| 淨 歸因於普通股股東的損失 | $ | (75,018 | ) | $ | (24,063,444 | ) | $ | (8,084,161 | ) | |||
| 每股淨虧損 | ||||||||||||
| - 基本及攤薄 | $ | (0.29 | ) | $ | (0.99 | ) | $ | (0.33 | ) | |||
| 加權 已發行普通股平均數量 | ||||||||||||
| - 基本及攤薄 | 257,604 | 24,194,270 | 24,167,257 | |||||||||
附註是這些合併財務報表的組成部分。
| F-4 |
ZYVERSA THERAPEUTICS,INC.
合併 股東權益變動表
| 2022年12月13日至2022年12月31日期間 | ||||||||||||||||||||||||||||||||||||
| A系列 | B系列 | 其他內容 | 總計 | |||||||||||||||||||||||||||||||||
| 優先股 | 優先股 | 普通股 | 已繳費 | 累計 | 股東的 | |||||||||||||||||||||||||||||||
| 股票 | 金額 | 股票 | 金額 | 股票 | 金額 | 資本 | 赤字 | 權益 | ||||||||||||||||||||||||||||
| 繼任者 | ||||||||||||||||||||||||||||||||||||
| 餘額-2022年12月13日 | 0 | 8,635 | $ | 1 | 5,062 | $ | 1 | 257,604 | $ | 26 | $ | 104,527,814 | $ | (4,846,160 | ) | $ | 99,681,682 | |||||||||||||||||||
| 基於股票的薪酬 | - | - | - | - | - | - | - | 56,333 | - | 56,333 | ||||||||||||||||||||||||||
| 淨虧損 | - | - | - | - | - | - | - | - | (75,018 | ) | (75,018 | ) | ||||||||||||||||||||||||
| 餘額-2022年12月31日 | - | 8,635 | $ | 1 | 5,062 | $ | 1 | 257,604 | $ | 26 | $ | 104,584,147 | $ | (4,921,178 | ) | $ | 99,662,997 | |||||||||||||||||||
附註是這些合併財務報表的組成部分。
| F-5 |
ZYVERSA THERAPEUTICS,INC.
合併 股東不足變動表
| 2020年12月31日至2022年12月12日期間 | ||||||||||||||||||||||||||||
| 其他內容 | 總計 | |||||||||||||||||||||||||||
| 優先股 | 普通股 | 已繳費 | 累計 | 股東的 | ||||||||||||||||||||||||
| 前身 | 股票 | 金額 | 股票 | 金額 | 資本 | 赤字 | 缺憾 | |||||||||||||||||||||
| 餘額-2020年12月31日 | - | - | $ | - | - | 24,167,257 | $ | 242 | $ | 35,923,373 | $ | (44,812,656 | ) | $ | (8,889,041 | ) | ||||||||||||
| 基於股票的薪酬 | - | - | - | - | - | - | 4,141,736 | - | 4,141,736 | |||||||||||||||||||
| 淨虧損 | - | - | - | - | - | - | - | (8,084,161 | ) | (8,084,161 | ) | |||||||||||||||||
| 餘額-2021年12月31日 | - | - | - | - | 24,167,257 | 242 | 40,065,109 | (52,896,817 | ) | (12,831,466 | ) | |||||||||||||||||
| 以私募方式發行優先股[1] | - | 625,639 | 6 | - | - | - | 1,865,378 | - | 1,865,384 | |||||||||||||||||||
| 將應付可轉換票據轉換為優先股[2] | - | 1,802,193 | 18 | - | - | - | 5,658,870 | - | 5,658,888 | |||||||||||||||||||
| 將優先股轉換為普通股 | - | (2,427,832 | ) | (24 | ) | - | 6,406,210 | 64 | (40 | ) | - | - | ||||||||||||||||
| 將應付可轉換票據轉換為普通股[3] | - | - | - | - | 2,940,537 | 29 | 5,838,180 | - | 5,838,209 | |||||||||||||||||||
| 基於股票的薪酬 | - | - | - | - | - | - | 3,524,801 | - | 3,524,801 | |||||||||||||||||||
| 淨虧損 | - | - | - | - | - | - | - | (14,047,607 | ) | (14,047,607 | ) | |||||||||||||||||
| - | ||||||||||||||||||||||||||||
| 餘額-2022年12月12日 | 1 | - | $ | 0 | 1 | 33,514,004 | $ | 335 | $ | 56,952,298 | $ | (66,944,424 | ) | $ | (9,991,791 | ) | ||||||||||||
附註是這些財務報表的組成部分。
| [1] | 包括1,964,524美元的總收益減去99,140美元的發行成本 |
| [2] | 包括本金 5,230,000美元和應計利息428,888美元 |
| [3] | 包括本金 3,961,000美元、應計利息709,608美元和衍生負債1,167,601美元 |
| F-6 |
ZYVERSA THERAPEUTICS,INC.
合併 現金流量表
| 繼任者 | 前身 | |||||||||||
| 在該期間內 | 在該期間內 | 這一年的 | ||||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||||
| 十二月三十一日, | 12月12日, | 十二月三十一日, | ||||||||||
| 2022 | 2022 | 2021 | ||||||||||
| 經營活動的現金流: | ||||||||||||
| 淨虧損 | $ | (75,018 | ) | $ | (14,047,607 | ) | $ | (8,084,161 | ) | |||
| 對淨虧損與經營活動中使用的現金淨額進行的調整: | ||||||||||||
| 股票補償選項 | 56,333 | 3,524,801 | 4,141,736 | |||||||||
| 債務貼現攤銷 | - | 39,492 | 317,833 | |||||||||
| 獲得PPP貸款的寬免權 | - | - | (213,481 | ) | ||||||||
| 衍生負債的公允價值變動 | - | 607,001 | (228,100 | ) | ||||||||
| 固定資產折舊 | 532 | 9,868 | 10,400 | |||||||||
| 非現金租金費用 | 4,443 | 79,918 | - | |||||||||
| 遞延税項負債 | (745,050 | ) | - | - | ||||||||
| 經營性資產和負債變動情況: | ||||||||||||
| 預付費用和其他流動資產 | 36,606 | 73,675 | (318,761 | ) | ||||||||
| 保證金 | - | - | 11,665 | |||||||||
| 供應商保證金 | 125,645 | 255,627 | 10,000 | |||||||||
| 應付帳款 | (2,076,863 | ) | 6,617,064 | (311,862 | ) | |||||||
| 經營租賃負債 | (4,786 | ) | (86,100 | ) | - | |||||||
| 應計費用和其他流動負債 | (715,730 | ) | 1,431,620 | (411,358 | ) | |||||||
| 經營活動中使用的現金淨額 | (3,393,888 | ) | (1,494,641 | ) | (5,076,089 | ) | ||||||
| 融資活動的現金流: | ||||||||||||
| 私募發行優先股所得 | - | 1,964,524 | - | |||||||||
| 與優先股發行相關的發行成本 | - | (99,140 | ) | - | ||||||||
| 發行可轉換應付票據所得款項 | - | - | 5,230,000 | |||||||||
| 融資活動提供的現金淨額 | - | 1,865,384 | 5,230,000 | |||||||||
| 現金和限制性現金淨(減)增 | (3,393,888 | ) | 370,743 | 153,911 | ||||||||
| 現金--期初 | 9,296,087 | 328,581 | 174,670 | |||||||||
| 現金--期末 | $ | 5,902,199 | $ | 699,324 | $ | 328,581 | ||||||
| 現金流量信息的補充披露: | ||||||||||||
| 非現金投資和融資活動: | ||||||||||||
| 獲得PPP貸款的寬免權 | $ | - | $ | - | $ | 231,481 | ||||||
| 將可轉換票據和應計利息轉換為優先股 | $ | - | $ | 5,658,888 | $ | - | ||||||
| 將可轉換票據和應計利息轉換為普通股 | $ | - | $ | 5,838,209 | $ | - | ||||||
| 採用ASC 842後ROU資產和租賃負債的確認 | $ | - | $ | 182,732 | $ | - | ||||||
| 延期發售費用的應付帳款 | $ | 240,691 | $ | 667,224 | $ | 25,000 | ||||||
附註是這些簡明財務報表的組成部分。
| F-7 |
ZYVERSA THERAPEUTICS,INC.
財務報表附註
注 1-企業組織、運營性質及風險和不確定性
業務 組織、運營性質和陳述依據
組織 和運營
Larkspur(“Larkspur”)是一家空白支票特殊用途收購公司,於2021年3月17日在特拉華州註冊成立。2022年12月12日,Larkspur完成了與ZyVersa Treateutics,Inc.(前身)的業務合併(詳情見注4-業務合併),ZyVersa Treateutics,Inc.(前身)於2014年3月11日作為Variant PharmPharmticals,Inc.在佛羅裏達州註冊成立。在業務合併完成之日,Larkspur(“新母公司”)更名為ZyVersa Treateutics,Inc.,前身在與新母公司的子公司合併後更名為ZyVersa Treateutics Operating,Inc.(“運營中的 公司”)這導致它在特拉華州註冊成立,併成為新母公司的全資子公司(統稱為“繼承人”)。 凡提及“公司”或“ZyVersa”時,指的是從2022年12月13日至2022年12月31日的繼承人,以及指從2021年1月1日至2022年12月12日的前身。
ZyVersa 是一家臨牀階段的生物製藥公司,利用專有技術為慢性腎臟疾病或炎症性疾病患者開發藥物,這些患者具有高度未得到滿足的醫療需求。我們的使命是開發優化健康結果和提高患者生活質量的藥物。
風險 和不確定性
2020年初,引起冠狀病毒病的一種新的冠狀病毒株--SARS-CoV-2(新冠肺炎)在全球暴發。一開始,該公司的業務在許多方面都受到了重大的負面影響。這些影響包括 VAR 200 2a期試驗推遲啟動,因為潛在的患者參與者不願冒險進入設施進行試驗 。此外,私人融資市場不穩定,使公司失去了為業務融資所需的流動資金。因此,管理層實施了大量降低成本的措施,以持續到經濟狀況改善。新冠肺炎S未來對公司運營和財務狀況的全面影響仍不確定。持續的新冠肺炎疫情可能會對該公司的運營業績、財務狀況和流動性產生重大不利影響,包括該公司推進其臨牀開發計劃的時間和能力。財務報表不包括 這種不確定性可能導致的任何調整。
2023年3月10日,硅谷銀行(SVB)被加州金融保護和創新部關閉,聯邦存款保險公司(FDIC)被任命為接管人。同樣,2023年3月12日,Signature銀行和Silvergate Capital Corp.分別被捲入破產管理程序。財政部、美聯儲和聯邦存款保險公司的一份聲明稱,SVB的所有儲户在關閉僅一個工作日後就可以取用他們的所有資金,包括未投保存款賬户中的資金。對於每個帳户所有權類別,每個投保銀行的每個儲户的標準存款保險金額最高為250,000美元。雖然我們在上述銀行沒有任何存款,但我們與其他金融機構的現金餘額經常超過FDIC保險限額。如果存款機構未能退還存款,可能會影響我們獲得現金或現金等價物,並可能對我們的經營流動性和財務業績產生不利影響。
注 2-持續經營和管理層的計劃
自成立以來,公司每年都出現虧損,截至2022年12月31日,公司淨營運資金不足。根據財務報表發佈之日的手頭現金,本公司預計,自財務報表發佈之日起12個月內,公司目前的可用現金將不足以支持其運營。因此,公司 將被要求通過股權或債務融資籌集額外資金,並且不能保證它將成功獲得額外資本 。這些條件令人對公司是否有能力在這些財務報表發佈之日起至少一年內繼續經營下去產生很大的懷疑。
公司尚未實現盈利,預計將繼續從運營中產生現金流出。預計其研究和開發以及一般和管理費用將繼續增加,因此,公司最終將需要 產生可觀的產品收入以實現盈利。
| F-8 |
公司的現金流需求包括運營其業務的計劃成本,包括為研發提供資金所需的金額、 營運資金和資本支出。公司未來的資本需求和可用資金的充足性 將取決於許多因素,包括公司成功將其產品和服務商業化的能力、競爭性的技術 和市場發展,以及與其他公司合作或收購其他公司或技術以 增強或補充我們的產品和服務產品的需要。我們打算在未來籌集額外資金,為運營提供資金。如果 公司無法獲得額外的資本,則可能會要求其縮減研發計劃,並採取額外的 措施來降低成本,以節省現金。
隨附的財務報表是根據美國公認的會計原則 ("美國公認會計原則")編制的,該原則考慮了公司作為持續經營企業的持續經營以及在正常業務過程中實現資產 和清償負債。財務報表不包括任何必要的調整,如果公司無法繼續作為一個持續經營。
注 3 -重要會計政策摘要
列報依據和合並原則
隨附的合併財務報表源自本公司及其合併子公司的會計記錄。 由於業務合併,出於會計目的,Larkspur Health Acquisition Corp.是收購方,ZyVersa Therapeutics, Inc.是收購方。是被收購者和會計的前身。因此,財務報表列報包括 前任公司在2022年12月13日之前的財務報表和繼承公司在2022年12月13日及之後的財務報表,包括 ZyVersa Therapeutics Operating,Inc.的合併。所有重大公司間結餘均已在合併 財務報表中抵銷。綜合財務報表是根據美國公認會計準則(“美國公認會計準則”)和美國證券交易委員會(“SEC”)的會計規則和條例編制的。
使用預估的
根據美國公認會計原則編制財務報表要求管理層 作出估計、判斷和假設,這些估計、判斷和假設會影響財務報表中報告的金額和財務報表相關附註中披露的金額。本公司的估計和判斷基於歷史經驗和其認為在當時情況下合理的各種其他 假設。本公司資產負債表中列報的資產負債額和列報各期間的支出金額受估計和假設的影響,這些估計和假設用於但不限於股權證券、衍生負債、基於股份的薪酬和收購的無形資產的公允價值計算,以及遞延税項資產的估值扣除。公司的某些估計 可能會受到外部條件的影響,包括公司獨有的情況和一般經濟狀況。實際結果有可能與這些估計值不同,這是合理的。
現金 和現金等價物
公司在財務報表中將所有原始到期日在三個月或以下的高流動性投資視為現金等價物。截至2022年12月31日和2021年12月31日,公司沒有現金等價物。
公司有現金存款,有時可能超過聯邦存款保險公司("FDIC")的保險限額。 本公司未在此類賬户中出現虧損,並定期評估其金融機構的信譽。 請參見注釋1—風險和不確定性。
| F-9 |
業務合併
在應用業務合併會計的收購方法時,分配給收購的可識別資產和負債的金額是基於收購日期的估計公允價值, 其餘部分記錄為商譽。無形資產最初按公允價值估值,採用適用於該類型無形資產的公認估值方法 。在企業合併中取得的正在進行的研究與開發(IPR&D)在獲得監管部門批准之前,將作為無限期無形資產進行資本化 ,在獲得監管部門批准之前,將其計入定期無形資產,並在其預計使用壽命內攤銷,或停止使用,此時將註銷該無形資產。
長期資產和商譽
本公司 根據ASC 360-10-35的規定對長期資產進行會計處理。財產、廠房和設備、減值或處置長期資產。本會計準則要求,只要發生事件或情況變化表明賬面金額可能無法收回,就應對長期資產進行減值審查。將持有和使用的資產的可回收性是通過將資產的賬面價值與資產預期產生的未來未貼現淨現金流量進行比較來衡量的。 如果資產的賬面價值超過其估計的未來現金流量,則按資產賬面價值超過資產公允價值的金額確認減值費用。本公司擬於每年10月1日起進行年度減值測試。
本公司 根據ASC 350會計準則對商譽和無形資產進行會計處理。無形資產-商譽和其他。商譽是指一個實體的購買價格超出所收購資產和承擔的負債的估計公允價值的部分。ASC 350要求 具有無限壽命的商譽和其他無形資產每年進行減值測試,或在事件或情況表明資產的公允價值已降至低於其賬面價值的情況下臨時進行減值測試。
在確定是否需要進行量化評估時,本公司將對相關事件或情況進行評估,以確定報告單位的公允價值低於其賬面價值的可能性是否更大。如果在進行定性評估後, 某實體得出結論認為報告單位的公允價值很可能少於其賬面價值,則該實體 將執行ASC 350中所述的量化減值測試。然而,如果在應用定性評估後,實體 得出結論認為公允價值不太可能小於賬面價值,則不需要 進行量化減值測試。該公司基於其歷史數據和經驗、行業預測、微觀和宏觀總體經濟狀況預測以及預期做出這些假設。
設備, 淨
設備 按成本扣除累計折舊後的淨額列報,從啟用之日起採用直線 法,按足以在預計使用年限(即5年)內將應折舊資產的成本計入運營的比率進行記錄。截至2022年和2021年12月31日,設備包括2019年9月1日投入使用的價值52,000美元的醫療設備,減去截至2022年和2021年12月31日分別為34,667美元和24,267美元的累計折舊。在2022年12月13日至2022年12月31日期間,繼任者 確認折舊費用為532美元。 在截至2022年12月12日和2021年12月31日期間,前任 確認折舊費用為$每個期間9 869美元,列入業務報表中的一般費用和行政費用。
融資 成本
債務 發行成本主要包括與債務融資有關的直接、遞增專業費用, 作為應付票據面值的直接扣除進行報告,並使用實際利率法在相關應付票據的合同期限內攤銷 。
可轉換本票 本票
本公司評估其可轉換工具,以確定該等合約或該等合約的嵌入部分是否符合根據財務會計準則委員會(“FASB”)會計準則編纂 (“ASC”)第815題“衍生工具及對衝”(“ASC 815”)單獨入賬的衍生金融工具的資格。對衍生金融工具的會計處理要求本公司按協議開始之日的公允價值和隨後的每個資產負債表日期的公允價值記錄任何分支的嵌入特徵 。公允價值的任何變動在每一期間的收益中作為非營業、非現金收入或費用入賬。本公司於每個資產負債表日重新評估其衍生工具的分類。如果分類因期間內的 事件而發生更改,則合同自導致重新分類的事件發生之日起重新分類。分叉的 嵌入功能按其初始公允價值記錄,這為託管工具創造了額外的債務折扣。
在2021年1月1日採用會計準則更新(ASU)2020-06年1月1日之前,如果嵌入的轉換選項不需要 分支,公司然後通過比較 公司截至承諾日期的標的股票的公允價值和工具的有效轉換價格(內在價值)來評估是否存在有益的轉換功能。 主機工具按攤餘成本計量,賬面價值計入規定的合同到期日本金 使用有效利息法,並相應計入利息費用。在2021年1月1日採用ASU 2020-06之後,公司不再需要評估是否存在有益的轉換功能。
金融工具的公允價值
公司根據ASC 820 "公允價值計量和披露" (以下簡稱"ASC 820")計量金融資產和負債的公允價值,該標準定義了公允價值,建立了公允價值計量框架,並擴大了公允價值計量的披露 。
| F-10 |
ASC 820將公允價值定義為在計量日期 市場參與者之間有序交易的資產或負債的本金或最有利市場中為轉移負債而收取的或支付的交換價格(退出價格)。ASC 820還建立了公允價值等級,這要求一個實體在計量公允價值時最大限度地使用可觀察到的投入,並最大限度地減少使用不可觀察到的投入。ASC 820描述了可用於計量公允價值的三個級別的投入:
1級—相同資產或負債在活躍市場的報價;
2級—活躍市場或可觀察輸入數據中類似資產和負債的報價;以及
第3級—不可觀察的輸入(例如,基於假設的現金流建模輸入)。
由於該等金融工具的短期性質,該等金融工具的賬面價值,例如現金、應付帳款及投資者存款,接近公允價值。
有關評估第3級投入時使用的估值技術和假設的更多詳情,請參閲 附註8-衍生負債。
所得税 税
對於財務報表或納税申報表中已計入或未計入的項目的預期未來税務後果,公司確認遞延税項資產和負債。遞延税項資產及負債乃根據資產及負債的課税基準與其各自的財務報告金額(“暫時性差異”)之間的差額(“暫時性差異”)而釐定,該等差額按預期暫時性差額可望撥回的年度的現行税率 計算。遞延税項資產在管理層得出結論認為資產不會變現的可能性比 更大的範圍內減值。税率變動對遞延税項資產和負債的影響在包括頒佈日期在內的期間的經營報表中確認。
公司使用確認閾值和計量流程,用於財務報表確認和計量已採取或預期將在納税申報表中採取的税務狀況 。
租契
有關採用ASC 842的更多詳細信息,請參見 附註3—重要會計政策摘要—最近採用的會計聲明。
研究和開發
研究 和開發費用在發生時計入運營。
基於股票的薪酬
公司根據獎勵的公允價值計量為換取權益工具獎勵而獲得的服務成本。 獎勵的公允價值於授予日期計量。然後,公允價值金額在需要提供服務以換取獎勵的期間(通常為歸屬期)內確認。
股票期權和認股權證的公允價值
公司使用Black-Scholes期權定價模型計算了授予的股票期權和認股權證的公允價值。期權沒收 在發生時計入。後續普通股將採用市場法,使用普通股在納斯達克全球市場的交易價格 進行估值。在2022年期間,前身普通股的公允價值是根據在每個估值日期與收購方進行的業務合併協議公平討論的狀況 採用市場法確定的,該協議最終於2022年7月20日簽訂,前置估值為8,500萬美元。2021年,管理層在第三方估值專家的協助下,採用 收益法確定了前身普通股的公允價值。期權使用的預期術語是授予的期權預計未償還的預計時間段。 認股權證使用的預期術語是合同期限。本公司利用“簡化”方法對“普通”期權授予的預期期限進行估算。本公司在2022年12月13日之前沒有普通股的公開交易歷史,以支持其歷史波動率計算。因此,本公司採用預期波動率 數字,該數字是基於對六家可比實體在相當於被估值工具預期壽命的一段時間內的歷史波動率的回顧得出的。無風險利率是根據美國國債零息債券的隱含收益率確定的,其剩餘期限與被估值工具的預期期限一致。
| F-11 |
每股普通股淨虧損
基本 每股普通股淨虧損的計算方法為淨虧損除以期間已發行的既有普通股的加權平均數。每股普通股攤薄淨收入的計算方法是淨收入除以每個期間已發行的普通股和稀釋性普通股的加權平均數。
下表列出了未行使的潛在攤薄證券,這些證券已被排除在計算每股攤薄淨虧損 之外,因為這樣做會產生反攤薄效應:
附表 反稀釋證券不計入稀釋後每股淨虧損。
| 繼任者 | 前身 | |||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 前身授權令 [1] | - | 8,560,561 | 2,154,351 | |||||||||
| 繼任權證[1][5] | 246,534 | - | - | |||||||||
| 前置任務選項 | - | 10,039,348 | 8,755,179 | |||||||||
| 繼任者選項 | 56,950 | - | - | |||||||||
| 前身A系列可轉換優先股 | - | 6,406,210 | - | |||||||||
| 後續A系列可轉換優先股 | 24,671 | (3) | - | - | ||||||||
| 後續B系列可轉換優先股 | 14,465 | (4) | - | - | ||||||||
| 應付前身可轉換票據 [2] | - | - | 3,400,187 | |||||||||
| 潛在稀釋股份總數 | 342,620 | 25,006,119 | 14,309,717 | |||||||||
| [1] | 作為InflamaCORE,LLC許可協議的一部分,購買600,000股前身普通股或3,404股後繼普通股的認股權證將在滿足某些里程碑後發行 ,因此不包括在目前報告的金額中。 |
| [2] | 公司的可轉換應付票據內含轉換選項,可在某些符合條件的交易完成後自動發行普通股 。轉換價格是與符合條件的交易相關聯的隱含普通股價格的函數。為了披露上表中的潛在稀釋證券,我們使用了符合條件的交易發生且隱含普通股價格等於截至2021年12月31日每股3.25美元的普通股公允價值的情況下可發行的普通股數量。 |
| [3] | 如果後續A系列可轉換優先股轉換價格重置為其下限價格,則 不包括額外的98,686股票。 |
| [4] | 如果後續B系列可轉換優先股轉換價格重置為其下限價格,則 不包括額外的6,199股票。 |
| [5] | 如果後續的A系列認股權證行權價重置為底價,則 不包括額外的98,686股。 |
細分市場報告
本公司作為一個可報告的運營部門和運營部門來經營和管理其業務。所有資產和業務都在美國。公司首席執行官是首席運營決策者,他在彙總的基礎上審查財務信息,以分配資源和評估財務業績。
最近 採用了會計公告
2019年12月,FASB發佈了ASU 2019—12“所得税(主題740):簡化所得税會計”,旨在簡化與所得税會計相關的各個方面。ASU 2019—12刪除了主題740中一般 原則的某些例外,並澄清和修訂了現有指南,以改善一致性應用。ASU 2019—12在2021年12月15日之後開始的 財政年度內有效。該準則於2022年1月1日採納,對 公司的財務報表沒有重大影響。
2021年5月,FASB發佈ASU 2021—04,每股收益(專題260)、債務修改和消除(子主題470—50), 補償—股票補償(主題718),以及實體自有權益中的衍生品和套期保值合同(副主題 815—40):發行人對獨立股權分類書面看漲期權的某些修改或交換的會計處理。此 新準則澄清並減少發行人對修改或交換後仍為權益分類的獨立 股權分類書面認購期權(如認股權證)的修改或交換會計處理的多樣性。本準則 於2021年12月15日之後開始的財政年度生效,包括該財政年度內的中期期間。公司應 對新準則生效日期後發生的修改或交換預期應用新準則。該準則 於2022年1月1日採納,對公司的財務報表並無重大影響。
| F-12 |
2020年8月,財務會計準則委員會發布了ASU 2020-06,債務轉換和其他期權(分主題470-20)和衍生工具和套期保值-實體自有股權合同(分主題815-40):實體自己股權中可轉換工具和合同的會計處理 ,以明確某些具有負債和股權特徵的金融工具的會計處理。此次更新中的修訂刪除了現金轉換模型和受益轉換功能模型,從而減少了可轉換債務工具和可轉換優先股的會計模型數量。限制會計模型將導致從主機合同中單獨識別的嵌入式轉換 功能更少。繼續受分離模式約束的可轉換工具包括:(1)具有與宿主合同不明確和密切相關、符合衍生工具定義 且不符合衍生工具會計例外範圍的嵌入轉換特徵的可轉換債務工具;及(2)已發行且溢價可觀的可轉換債務工具 ,其溢價記錄為實收資本。此外,該ASU還改進了對可轉換工具和每股收益指引的披露要求。ASU還修訂了衍生工具範圍例外指南,以減少由遠程或有事件驅動的基於形式而不是實質的會計結論。此更新中的修訂適用於我們從2023年12月15日之後的 開始的財政年度以及這些財政年度內的過渡期。將允許提前採用,但不得早於2020年12月15日之後的 財年。公司提前採用了ASU 2020-06,自2021年1月1日起生效,無需在發行新的可轉換票據時評估是否需要確認有益的轉換功能。
2016年2月,美國財務會計準則委員會發布了2016-02年度會計準則更新(“ASU”)“租賃(主題842)”。ASU 2016-02要求承租人確認經營性租賃產生的資產和負債。承租人應在財務狀況表中確認支付租賃款項的負債(租賃負債)和代表其在租賃期內使用標的資產的權利的使用權資產。對於租期為12個月或以下的租賃,承租人被允許按標的資產類別作出會計政策選擇,不確認租賃資產和租賃負債。在過渡階段, 承租人和出租人必須確認和計量採用改進的回溯法提出的最早期間開始時的租約。這項修訂將在2021年12月15日之後的財年 以及2022年12月15日之後的財年內的過渡期內對非上市公司和新興成長型公司生效。FASB於2018年7月發佈了ASU 第2018-10號《對主題842租賃的編纂改進》和ASU第2018-11號《租賃(主題842)針對性改進》,並於2018年12月發佈了ASU第2018-20號《租賃(主題842)--出租人範圍狹窄的改進》。ASU 2018-10和ASU 2018-20提供了某些修正案,這些修正案會影響ASU 2016-02發佈的指南的狹義方面。ASU 2018-11允許採用ASU 2016-02的所有實體選擇另一種(和可選的)採用過渡方法,根據該方法,實體最初在採用日期應用新租賃標準,並確認採用期間留存收益期初餘額的累計影響調整 。本公司於2022年12月31日採用ASU 2016-02,自2022年1月1日起生效,採用此ASU後,本公司經營租賃的使用權資產和租賃負債入賬,金額約為182,732美元和199,642美元,取消確認遞延租金約為16,910美元。
重新分類
某些 上一年度餘額已重新分類,以符合本年度的列報方式。這些重新分類對 之前報告的經營業績或每股虧損沒有影響。
注: 4-業務合併
業務 組合、善意和在製品研發
2022年7月20日,運營公司與Larkspur,Larkspur Merger Sub Inc.簽署了一份業務合併協議(以下簡稱“業務合併協議”)。(“合併子公司”是Larkspur的全資子公司)和Stephen Glover(作為運營公司股東代表的身份)。Larkspur是一家空白支票特殊目的收購公司(“SPAC”) ,於2021年12月23日完成首次公開募股後成為一家上市公司,其成立的目的是 與一傢俬人公司業務進行合併,該業務可以通過獲得可以籌集的資本而受益,因為 其股票在納斯達克公開交易。
| F-13 |
2022年12月12日,在2022年12月8日召開特別股東會議後,業務合併完成,Larkspur的股東審議並批准了一項通過業務合併協議的提案等事項。有關業務合併的更多 信息載於(i)表格S-4上註冊聲明中包含的委託聲明/招股説明書 (文件編號333-266838),經修訂和補充,最初於2022年8月12日提交給SEC,並於2022年11月14日由SEC宣佈生效。和(ii)2022年7月22日向SEC提交的8-K表格當前報告。
業務合併包括以下交易:
| ● | 運營公司合併到合併子公司,因此運營公司成為存續實體,並在 特拉華 | |
| ● | 運營公司普通股股東以33,845,335股前身普通股(包括33,514,004股永久股權和331,331股臨時股權)換取前身普通股191,992股,換股比例為176.28。 該前身普通股被註銷,新母公司僅擁有運營公司一股。因此,營運公司成為新母公司的全資附屬公司。 | |
| ● | 10,039,348個未償還的前置期權換成了56,950個未償還的後繼期權。向前置期權持有人發行的後續期權數量 是在實施176.28的交換比例後確定的。 相應期權的行權價也根據交換比例進行了調整。 | |
| ● | 8,560,561份未償還的先行權證換成了48,561份未償還的後繼權證。向先行權證持有人發行的後繼權證數量 是在176.28的交換比例生效後確定的。 每份相應權證的行使價也根據交換比例進行調整。 |
公司將業務合併作為經營公司的遠期收購入賬,因為已確定經營 公司於業務合併日期為可變權益實體。新母公司是主要受益人,因為其所有權 提供了指導運營公司活動的權力,並有義務承擔運營公司的損失和/或收益 。
業務合併採用收購會計方法入賬,初始收購價格分配基於我們對收購對價的公允價值和經營公司於收購日收購的有形和無形資產及承擔的負債的公允價值的初步評估。由於收購日期接近日曆年末,採購價格分配未完成,將在允許的12個月測算期內進行細化。
收購對價的收購日期公允價值的初步估計是採用市場法估計的,對於繼任者普通股的公允價值,採用1級投入(可觀察投入),對於繼繼權證和期權的公允價值,採用3級投入(不可觀察投入) 。根據業務合併協議,收購方有責任取代營運公司的現有認股權證及期權。因此,有必要在購買對價(合併前服務的公允價值)和合並後服務補償之間分配替代認股權證和期權的公允價值。可歸因於合併後服務的替代權證和期權的公允價值分別為584,260美元和1,731,237美元。
| F-14 |
購買對價的收購日期公允價值的初步估計如下:
購買對價公允價值附表
| 繼承人普通股 | $ | 67,197,300 | ||
| 繼承權證 | 12,190,015 | |||
| 繼任者選項 | 11,864,556 | |||
| 購買代價的公允價值總額 | $ | 91,251,871 |
收購資產的初步收購日期公允價值由管理層估計,但最終將得到改進,特別是對於正在進行的研究和開發,將包括使用收益法進行的估計。收購價格超出所收購可確認淨資產的估計公允價值的部分計入商譽。
收購的可識別淨資產估計公允價值附表 記為商譽
| 流動資產,包括現金699 324美元 | $ | 1,093,223 | ||
| 正在進行的研究和開發 | 100,086,329 | |||
| 商譽 | 11,895,033 | |||
| 其他非流動資產 | 64,523 | |||
| 收購的總資產 | 113,139,108 | |||
| 流動負債 | 10,818,204 | |||
| 遞延税項負債 | 11,069,033 | |||
| 承擔的負債總額 | 21,887,237 | |||
| 取得的淨資產 | $ | 91,251,871 |
為賬面目的而記錄的正在進行的研究和開發被視為無限期的無形資產,直到研究和開發工作完成或放棄為止。由於收購是以股票出售的形式進行的,因此正在進行的研發和商譽預計不會有任何税基,也不會因為税收目的而扣除。
在截至2022年12月12日的前身期間,前身產生了約210萬美元的交易成本,其中 計入營業報表的一般和行政費用。
考慮到 Larkspur作為SPAC的活動的非經常性性質,合併Larkspur和運營公司業務合併前結果 的備考財務數據將沒有意義,因此未呈列。
繼任者在成功完成業務合併的同時,以8,635,000美元的淨收益出售了A系列優先股 。有關更多信息,請參見附註11-股東永久和臨時股權-後續A系列優先股融資 。
| F-15 |
附註 5-應收票據
於二零二零年十二月十三日,本公司與L訂立本票協議(“L本票協議”),據此,本公司同意接受L本金額為351,579美元的應收票據(“L本票”)。L票據的利息年利率為1.17釐,每年派息一次,到期日期為(A)本公司在發生違約事件後要求支付L票據項下所有未償還款項的日期及(B)2025年12月15日,兩者中以較早者為準。L公司被要求立即預付L和L公司票據的所有應計和未付利息,並支付以下款項:(A)ZyVersa根據許可協議的條款向L公司支付的第二筆500,000美元里程碑式付款的100% (見附註10-承諾和或有事項),(B)L&F根據認沽期權的條款向ZyVersa出售普通股所得的100%(見附註11-股東永久和臨時股權),(C)L律師事務所向ZyVersa以外的任何一方出售ZyVersa普通股超過每股1.00美元的總收益 ,以及(D)因協議定義的某些清算事件而收到的收益 。自2021年12月13日起至2025年12月13日止,只要L票據本金 未償還,本公司將每年向L支付相當於6,000美元的管理費。於二零二二年十二月三十一日,由於本公司尚未收到L及F支付的應付款項,亦未就附註10-承擔及或有事項中所述的許可協議向L&F支付任何所需款項,因此,該筆款項被記錄為抵銷負債,以抵銷應支付予L及F的與許可協議有關的里程碑式付款 ,有關款項已計入應計開支及其他流動負債內。在將應收L&F票據計入抵銷責任時,本公司考慮了商業實質、雙方的意圖以及ZyVersa與L研究之間的整體合同協議,該協議賦予雙方法定權利將本公司欠L研究的里程碑式的債務與本公司應收的L&F票據進行抵銷。本公司確定該等金額可於資產負債表內抵銷,原因如下:i)本公司所欠及欠本公司的金額可予釐定,ii)本公司有法定的 權利以欠L研究公司的L票據金額抵銷欠本公司的里程碑負債,iii)本公司 擬將L應收票據抵銷里程碑負債,以及iv)抵銷權利可依法強制執行。有關L&F票據的其他詳細信息,請參閲 附註13-後續活動。
附註 6--應計費用和其他流動負債
截至2022年12月31日和2021年12月31日,應計費用和其他流動負債包括:
應計費用和其他流動負債明細表
| 在過去幾年裏 | ||||||||
| 十二月三十一日, | ||||||||
| 2022 | 2021 | |||||||
| L & F里程碑付款責任 | $ | 1,500,000 | $ | 1,500,000 | ||||
| L&F注 | (351,579 | ) | (351,579 | ) | ||||
| L & F,淨額 | 1,148,421 | 1,148,421 | ||||||
| 應計薪金 | 584,226 | - | ||||||
| 其他應計費用 | 214,229 | - | ||||||
| 應付聯邦所得税 | 106,683 | - | ||||||
| 應計利息 | - | 748,767 | ||||||
| 遞延租金 | - | 16,913 | ||||||
| 應計費用和其他流動負債總額 | $ | 2,053,559 | $ | 1,914,101 | ||||
附註 7-可轉換應付票據
無擔保 可轉換本票
於2019年10月至2020年7月期間,本公司向投資者及經紀商發行了24個月期無抵押可轉換本票(“票據”),本金總額為3,961,000美元。其中,25,000美元的票據已發行給關聯方(公司管理團隊的成員 )。債券的利息相當於年息6釐,到期日期為(I)初始成交後二十四個月 個月;(Ii)失責事件發生之時、當日或之後;或(Iii)本公司控制權任何變更發生時(br}較早者)。在公司結束合格發行的情況下,定義為;(I)首次公開募股,總收益至少2000萬美元,或成為普通股在合格交易所上市的實體,(Ii)與上市公司反向合併,(Iii)公司股權證券的法規A發行,總收益至少2000萬美元,或(Iv)公司股權證券的發行,總收益不低於2000萬美元,債券項下到期的本金及應計利息應按投資者在該等合資格發售中收到的相同 條款及條件自動轉換。自動轉換價格應等於(A) 每股3.25美元或(B)每股價格的80%,(I)如果是首次公開發行(IPO)或REG A發行, 合格發行證券的最低每股價格,(Ii)如果是反向合併,則是應付給公司股東的普通股每股毛價,或(Iii)如果是私募,轉換股份的每股價格(“贖回功能轉換價格”)。本公司分析了票據的嵌入特徵,並確定票據包含(I)按固定價格每股3.25美元的合資格發售時的自動轉換,(br}不包含有益的轉換功能,(Ii)違約時的贖回功能,不需要分拆,(Iii)按贖回功能轉換價格的合資格發行時的贖回 功能,總公允價值為373,000美元,該功能是從債務宿主分出的,並記錄了貸方到衍生負債和借方到債務的折扣,及(Iv)於控制權變更時觸發認沽期權,公平值為64,342美元,由債務承擔者分拆,並記入衍生負債的貸方及借方與債務的折讓。債務折價按實際利率法於票據期限內攤銷,衍生負債於每個報告日期按市價計價。有關更多詳情,請參閲附註8-衍生負債。
| F-16 |
於2021年2月至3月期間,公司發行了新的無抵押可轉換本票(“2021年票據”),本金總額為5,230,000美元,其中3,150,000美元已發行給公司關聯方(包括公司管理層成員、一名創始人和一名重要股東)。2021年發行的債券年利率為6%,按日複利,到期日期為2021年12月31日。如果本公司在2021年2月15日之後開始債務融資(“有條件債務融資”),則2021年票據應自動轉換為本票,其形式和條款與在有條件債務融資中發行的票據相同,本金金額等於2021年票據項下的當時未償還本金和應計未付利息(“票據義務”)。在本公司於2021年2月15日後完成最少500,000美元的股權融資(“合資格股權融資”)後,2021年債券將自動轉換為以合資格股權融資(“下一輪證券”)出售的股權證券,其價格和條款與任何投資者在該等合資格股權融資中收到的相同。在該等轉換時將發行的後續輪證券的數目 應等於以下所得的商數:(I)等同於該等合格股權融資完成時的未償還票據債務的金額除以隨後的每輪證券在合格股權融資中出售的最低價格 (“轉換價格”)。如果在合格股權融資之前的任何時間發生控制權變更,相當於該控制權變更結束時未償還票據債務的金額應在控制權變更結束時同時自動轉換,價格為每股3.25美元。本公司分析了2021年債券的嵌入特點,並確定2021年債券包含(I)在符合資格的債務融資時自動轉換而不需要分拆,(Ii)在符合資格的股權融資時自動轉換 每股3.25美元的固定價格而不需要分拆,(Iii)在控制權變更時以每股3.25美元的固定價格自動轉換而不需要分拆,及(Iv)違約時的贖回 功能不需要分拆。
於2022年1月,本公司及其可換股票據持有人同意將票據及2021年票據的到期日延長至2022年12月31日。這些擴展被限定為修改,因為這些術語並沒有本質上的不同。因此,擴展説明 被視為原始説明和2021年説明的延續。
公司須支付相當於總收益8%的現金費用,金額為配售代理首先確定的範圍 並將債券融資的任何投資者帶給公司。關於票據融資,前身產生了總計228,236美元的配售代理和法律費用,這些費用被記錄為債務折扣,並將按實際利息法在票據期限內攤銷 。
在2022年12月13日至2022年12月31日期間,繼承人記錄了與票據相關的債務折價攤銷0美元。 請參閲下面的自動轉換。
在截至2022年12月12日和2021年12月31日的期間內,前身分別在與票據有關的營業報表中將債務貼現攤銷記為利息支出 709,608美元和317,833美元。
| F-17 |
自動 轉換
2022年7月8日,由於額外的前身A系列優先股融資(這導致了合格股權融資 ,累計毛收入超過500,000美元),2021年票據由5,230,000美元本金和428,888美元應計利息組成,自動轉換為前身A系列優先股1,802,193股,有效轉換價格為每股前身A系列優先股3.14美元。更多細節見附註11--股東永久和臨時股權--前身A系列優先股融資。由於按照原始條款轉換的2021年債券和2021年債券不包括股份結算贖回功能,因此自動轉換通過轉換會計進行核算,其中2021年債券的本金和應計利息的賬面價值被取消確認,這些總額 分配為普通股(面值)和額外的實收資本。
2022年12月12日,本公司完成了符合與上市公司反向合併的法律定義的業務合併(見附註4-業務合併)(儘管出於會計目的,這是一項正向合併)。因此,該業務組合符合合格發售的定義,因此,3,961,000美元的票據本金、709,608美元的相關應計利息和1,167,601美元的衍生負債自動 轉換為2,940,537股前身普通股,再 換取16,681股後繼普通股 。自動換股乃根據票據原始條款所包括的股份結算贖回功能而進行,換股價格為1.58835美元(按業務合併交換比率5.037釐定的前身普通股每股公允價值1.98542美元的八成)。根據股份結算贖回功能自動轉換可轉換票據 計入清償,但這項自動轉換並未導致 確認清償虧損,因為贖回功能(衍生負債)於業務合併日期(詳見附註8-衍生負債)在終止確認票據本金、應計利息及衍生負債的賬面價值 前按市場計價(見附註8-衍生負債),而該等總額分配為普通股(面值)及額外實收資本。
附註 8--衍生負債
截至2021年1月1日,本公司擁有3級衍生負債,按發行時的公允價值計量,與債券的贖回功能和認沽期權有關。有關更多細節,請參閲附註7-可轉換應付票據。贖回功能是使用貼現現金流和Black-Scholes估值技術相結合進行估值的。
於2022年12月12日,於業務合併完成時(見附註4-業務合併),票據自動將 轉換為2,940,537股前身普通股,轉換價格為1.58835美元(業務合併時應支付給本公司股東的普通股每股1.98542美元公允價值的80%),公允價值對價為5,838,209美元。 通過將贖回功能調整為其在業務合併日期的公允價值,自動 轉換的損益表影響是確認衍生負債的公允價值變動186,401美元,沒有清償收益或損失。
下表列出了按公允價值計量的第3級衍生負債的公允價值變化摘要 :
第三級衍生品負債公允價值變動表
| 截至2021年1月1日的期初餘額 | $ | 788,700 | ||
| 衍生負債的公允價值變動 | (228,100 | ) | ||
| 截至2021年12月31日的期末餘額 | $ | 560,600 | ||
| 衍生負債的公允價值變動 | 607,001 | |||
| 票據轉換後重新分類為權益 | (1,167,601 | ) | ||
| 2022年12月12日期末餘額 | $ | - |
| F-18 |
截至2022年12月31日,沒有衍生負債。對於衍生品負債估值,截至2021年12月31日,貼現現金流中使用的重要 不可觀察輸入為25%的貼現率、發生合格發行的可能性為 85%和發生控制權變更的可能性為0%。對於截至2021年12月31日的估值,Black-Scholes假設 如下:
衍生品負債表公允價值假設
| 2021年12月31日 | ||||
| 發行日普通股公允價值 | $ | 3.25 | ||
| 無風險利率 | 0.06% - 0.19 | % | ||
| 預期期限(年) | 0.00 - 0.50 | |||
| 預期波動率 | 75 | % | ||
| 預期股息 | 0.00 | % | ||
附註 9--所得税
公司須繳納美國聯邦和州所得税。
所得税準備金包括以下(福利)準備金:
所得税撥備附表
| 繼任者 | 前身 | |||||||||||
| 在該期間內 | 在該期間內 | |||||||||||
| 12月13日至 | 一月一日 至 | 這一年的 已結束 | ||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 遞延税項優惠: | ||||||||||||
| 聯邦制 | $ | (151,625 | ) | $ | (2,191,344 | ) | $ | (1,480,472 | ) | |||
| 狀態 | (34,844 | ) | (482,283 | ) | (763,612 | ) | ||||||
| 遞延税項優惠 | (186,469 | ) | (2,673,627 | ) | (2,244,084 | ) | ||||||
| 更改估值免税額 | (558,581 | ) | 2,673,627 | 2,244,084 | ||||||||
| 所得税撥備 | $ | (745,050 | ) | $ | - | $ | - | |||||
所得税規定與聯邦法定税率不同,具體如下:
所得税準備金表與聯邦法定税率不同
| 繼任者 | 前身 | |||||||||||
| 在該期間內 | 在該期間內 | |||||||||||
12月 13 穿過 | 一月 1 穿過 | 本年度的 告一段落 | ||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 聯邦法定利率 | 21.0 | % | 21.0 | % | 21.0 | % | ||||||
| 扣除聯邦福利後的州税率 | 3.6 | % | 3.6 | % | 3.7 | % | ||||||
| 永久性物品 | (1.9 | %) | (5.4 | %) | (0.9 | %) | ||||||
| 不可扣除的基差 | 0.0 | % | 0.0 | % | 0.1 | % | ||||||
| 國家利率變化的影響 | 0.0 | % | (0.1 | %) | 3.9 | % | ||||||
| 上期調整數和其他 | 0.0 | % | (0.1 | %) | 0.0 | % | ||||||
| 更改估值免税額 | 68.1 | % | (19.0 | %) | (27.8 | %) | ||||||
| 有效所得税率 | 90.8 | % | (0.0 | %) | 0.0 | % | ||||||
| F-19 |
遞延 納税資產和負債包括:
遞延税項資產負債表
| 繼任者 | 前身 | |||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 淨營業虧損結轉 | $ | 6,671,907 | $ | 6,639,882 | $ | 4,930,055 | ||||||
| 基於股票的薪酬費用 | 2,936,945 | 4,084,595 | 3,220,799 | |||||||||
| 資本化的研發成本 | 2,421,390 | 2,362,939 | 2,199,126 | |||||||||
| 資本化啟動成本 | 1,121,802 | 565,530 | 620,016 | |||||||||
| 資本化許可證費用 | 687,926 | 689,820 | 735,485 | |||||||||
| 衍生負債 | - | - | 6,388 | |||||||||
| 資本化專利 | 288,123 | 273,682 | 235,065 | |||||||||
| 認股權證 | 133,203 | 238,768 | 239,307 | |||||||||
| 應計工資總額 | 71,830 | - | - | |||||||||
| 結轉捐款 | 2,833 | 2,833 | 2,840 | |||||||||
| 租賃負債 | 26,794 | - | - | |||||||||
| 遞延租金 | - | - | 4,176 | |||||||||
| 遞延税項資產 | 14,362,753 | 14,858,049 | 12,193,257 | |||||||||
| 估值免税額 | - | (14,853,648 | ) | (12,180,021 | ) | |||||||
| 遞延税項資產 | 14,362,753 | 4,401 | 13,236 | |||||||||
| 遞延債務貼現 | - | - | (6,388 | ) | ||||||||
| 使用權資產 | (24,236 | ) | - | - | ||||||||
| 正在進行的研究和開發 | (24,658,231 | ) | - | - | ||||||||
| 固定資產 | (4,270 | ) | (4,401 | ) | (6,848 | ) | ||||||
| 遞延税項負債 | (24,686,737 | ) | (4,401 | ) | (13,236 | ) | ||||||
| 遞延税項資產,淨額 | $ | (10,323,984 | ) | $ | - | $ | - | |||||
在2022年12月31日,繼任者結轉的聯邦淨營業虧損約為27,515,427美元,州淨營業虧損約為20,567,703美元;在2022年12月12日和2021年12月31日,繼任者的聯邦淨營業虧損結轉約為27,385,445美元和20,446,200美元,州淨營業虧損結轉約為20,458,902美元和14,644,000美元,可用於 抵消未來聯邦和州應納税收入。這樣的NOL結轉不會過期。然而,由於所有權變更,它們用於抵銷未來應納税所得額 可能會受到《國税法》第382條和類似州法規的限制。
公司已評估了遞延税項資產變現的可能性,並考慮了所有可用的正面和負面證據,包括遞延税項負債的預定沖銷、預計未來應納税所得額和税務籌劃策略。當“很有可能”全部或部分遞延税項資產不會變現時,便會計提估值撥備。 在截至2022年12月12日及2021年12月31日進行審核後,管理層認為前述遞延税項資產的未來變現存在不確定性,因此已於該等日期設立全額估值撥備。因此,前任在2022年1月1日至2022年12月12日期間和2021年12月31日終了年度與税務準備金有關的估值免税額分別增加2 673 627美元和2 244 084美元。
由於2022年12月12日的業務合併和新的遞延税項負債的出現(A)作為收購會計的一部分,前身 公佈了其14,853,648美元的估值準備。在後續期間,新母公司發放了558,581美元的估值免税額,作為一項所得税優惠,與業務合併分開。
| F-20 |
管理層已評估並得出結論,截至2022年12月31日和2021年12月31日,公司財務 報表中沒有需要確認的重大不確定税務狀況。本公司預計其未確認的税務優惠在報告日期起計的12個月內不會有任何重大變化。
截至2022年12月31日及2021年12月31日止年度內,並無開始或正在進行税務審核,且該等年度內並無產生任何與税務有關的利息或罰款 。本公司自截至2019年12月31日止年度開始的報税表仍有待審核。
附註 10--承付款和或有事項
訴訟、索賠和評估
在 正常業務過程中,本公司可能會涉及在正常業務過程中產生的法律訴訟、索賠和評估 。當損失被評估為可能發生且 損失金額可以合理估計時,公司記錄因此類索賠而產生的或有負債(如有)。
許可證 協議
L & F Research LLC
2015年12月15日,本公司與L律師事務所訂立許可協議,根據協議所載條款及條件,L授予ZyVersa若干技術的獨家許可 。許可協議的期限應從生效日期開始 ,除非按照協議條款提前終止,否則將一直持續到被許可人的所有使用費支付義務的最後一個到期為止。
許可協議包括預付現金200,000美元(2015年支付並確認為研發費用),里程碑現金付款總額2,150萬美元(公司將在有可能實現里程碑時確認與里程碑現金付款相關的支出;2020年確認的1,500,000美元支出(其中500,000美元最初應於 到期,並於2021年支付)與美國食品和藥物管理局(FDA)接受研究新藥申請以及開始2a期臨牀試驗有關;2,500,000美元的下一個里程碑是在與FDA的第二階段會議積極結束時賺取的(br}),當產品進入市場時,版税從產品銷售的5%-10%不等(如果銷售發生,公司將確認版税費用 ;至今仍未確認)及前置認股權證,可購買合共878,947股前置認股權證,行使價為每股1.00美元,授予日公允價值為766,384美元,自實現指定里程碑之日起五年內可予行使(前置認股權證購買351,579股前置普通股的權證於2015年發行時可予行使,因此,本公司於2015年內確認其授出日期公允價值306,411美元為研發開支,並與額外實收資本相對應;當有可能達到相關的履約條件時,本公司將 確認與剩餘認股權證相關的費用; 根據FDA的定義,在FDA接受化合物或產品的研究新藥申請後,可於2020年1月行使購買175,789股前任普通股的前任認股權證,當時公司確認的費用等於授權日公允價值153,324美元;截至2022年12月31日,尚未行使購買351,578股前任普通股的前任認股權證 ,因為尚未實現里程碑)。對於上述尚未支出或支付的對價,本公司將在相關項目有可能實現且價值可評估時確認相關支出。
2020年1月9日,對許可協議進行了修訂,其中規定了以下修訂:(I)部分延長了與成功完成第一階段臨牀試驗相關的1,000,000美元里程碑現金付款的支付時間(在2a階段臨牀試驗開始時支付500,000美元(“1/2里程碑”)和在 1/2階段里程碑開始一週年(“一週年里程碑”)時支付500,000美元);及(Ii)在L律師事務所於1/2期里程碑完成後行使其認股權證的條件下,351,579美元的行權價將從應付L 1/2期里程碑的現金中扣減。有關L基金行使認股權證時訂立的本票協議及附註11-股東權益-認沽期權有關本公司與L就L票據協議訂立的認沽期權協議的進一步詳情,請參閲附註4-應收票據。
| F-21 |
2022年3月7日,本公司與L公司簽署了一份放棄協議,放棄L公司在2022年8月31日之前因未支付150萬美元里程碑式付款而終止許可協議或任何其他補救措施的權利。許可協議的所有其他條款仍然有效。
2022年8月26日,本公司與L律師事務所簽署了一份放棄協議,放棄L律師事務所在2023年1月3日之前因未支付150萬美元里程碑付款而終止許可協議或任何其他補救措施的權利。許可協議的所有其他條款仍然有效。
2022年12月23日,本公司與L律師事務所簽署了一份放棄協議,放棄L律師事務所在2023年3月31日之前因未支付150萬美元里程碑付款而終止許可協議或任何其他補救措施的權利。許可協議的所有其他條款仍然有效。
有關L&F許可協議的更多詳細信息,請參閲 附註13-後續活動。
InflamaCORE
於2019年4月18日,本公司與InflamaCORE,LLC(“InflamaCORE”)訂立許可協議,據此,InflamaCORE同意向其前身授予InflamaCORE計劃技術的獨家許可。許可協議的期限應從生效日期開始 ,除非按照協議條款提前終止,否則將一直持續到被許可人的所有使用費支付義務的最後一個到期為止。在本許可協議的同時,InflamaCORE與邁阿密大學簽訂了一項協議,將InflamaCORE科學家開發的所有知識產權和技術整合到InflamaCORE旗下,這些科學家都是邁阿密大學的員工。本協議的有效期自生效之日起生效,直至(A)專利權範圍內所有已頒發的專利和提交的專利申請均已失效或被放棄且無使用費到期之日,或(B)二十(20)年,除非根據協議條款提前終止,否則一直有效。簽署這兩項協議的諒解是,ZyVersa將根據許可協議進一步開發知識產權和技術。
作為許可證的對價,前任同意向InflamaCORE支付346,321美元的預付款,以支付向邁阿密大學償還專利的費用。InflamaCORE還有權獲得六筆里程碑式的付款,總計22,500,000美元(第一筆200,000美元的里程碑式付款是由提交治療許可產品的第一個適應症的研究新藥申請引發的)。ZyVersa需要向InflamaCORE支付5%至10%的銷售特許權使用費,該特許權使用費將在協議中定義的(A)最後一個到期的專利或(B)法規排他性到期的最新 到期時到期。ZyVersa 需要向邁阿密大學支付3%至6%的銷售版税。最後,InflamaCORE將獲得總計1,000,000股前置普通股的五年前置權證,其中,前置認股權證購買400,000股前置普通股,發行日期公允價值為815,822美元,記為研發費用, 在協議執行時以每股2.30美元的行使價發行,其餘前置認股權證購買 60萬股前置普通股,將在滿足某些里程碑後,以相當於發行時前置普通股公允價值的每股價格發行。除非本公司完成首次公開招股(“IPO”),否則將發行所有認股權證 ,其定義為前身普通股或其他股本證券的首次公開招股。如果公司在緊接到期日之前的三年內完成首次公開募股,到期日將自動延長至公司首次公開募股生效日期的三週年。該公司認定該業務合併不符合首次公開募股的定義。根據協議,邁阿密大學還收到了200,000股前身 普通股,授予日期公允價值為460,000美元,記為研發費用。 截至2022年12月31日,繼任者沒有支付或欠任何特許權使用費,與現金支付和發行繼承者認股權證相關的業績里程碑沒有實現,公司沒有產生任何付款,也沒有發行與許可協議相關的剩餘繼承者權證 。
| F-22 |
運營 租約
於2019年1月18日,前任簽訂了一份位於佛羅裏達州韋斯頓的約3,500平方英尺辦公空間的租賃協議 ,租期為五年。根據租賃協議,第一年的年度基本租金(不包括前任應承擔的税項和運營成本)約為89,000美元,此後每年上漲約3%,總基本租金約為497,000美元。
繼任者確認2022年12月13日至2022年12月31日期間的租金支出為7,795美元,繼任者確認截至2022年12月12日和2021年12月31日期間的租金支出分別為148,881美元和148,125美元。
有關 公司採用新租賃會計準則以及確認使用權資產和經營租賃 負債的相關信息,請參見 附註3—主要會計政策概要—最近採用的會計聲明。
本公司的使用權資產和負債摘要如下:
使用權資產及負債一覽表
| 財務 指定、前身和繼承人 [固定列表] | 繼任者 | 前身 | ||||||
| 2022年12月31日 | 十二月 2022年12月12日 | |||||||
| 為計量租賃負債所包括的金額支付的現金: | ||||||||
| 運營 經營業務所用之現金流量 | $ | 4,786 | $ | 86,100 | ||||
| 使用權 為換取租賃義務而獲得的資產 | ||||||||
| 運營 租約 | $ | - | $ | - | ||||
| 加權 平均剩餘租期 | ||||||||
| 運營 租約 | 1.08 年 | 1.08 年 | ||||||
| 加權 平均折價率 | ||||||||
| 運營 租約 | 6.5 | % | 6.5 | % | ||||
根據這些經營租賃協議,未來 最低付款額如下:
租賃項下未來最低付款計劃
| 金額 | ||||
| 未來最低還款額 | $ | 112,916 | ||
| 減去:代表推定利息的金額 | (4,160 | ) | ||
| 總計 | $ | 108,756 | ||
注 11 -股東永久和臨時股權
授權資本
前身獲授權發行75,000,000股前身普通股,每股面值0.00001美元,以及5,000,000股前身優先股,每股面值0.00001美元。前任普通股的持有者有權 每股一票。
繼承人被授權發行110,000,000股繼承人普通股,每股面值0.0001美元,以及1,000,000股繼承人優先股,每股面值0.0001美元。繼承人普通股的持有者有權每股 股投一票。
| F-23 |
股權激勵計劃
前身 2014年股權激勵計劃
前身獲授權根據其2014年股權激勵計劃(“2014計劃”)頒發獎勵,該計劃於2018年10月9日、2019年2月2日和2021年2月2日修訂。根據2014年計劃,自2021年12月31日起,授權發行本公司10,000,000股前身普通股 。2014年計劃下可供發行的普通股數量應在2014計劃期限內自2019年開始的每個日曆年1月份的第一個交易日自動增加,增加的金額相當於上一日曆年12月份最後一個交易日已發行普通股總數的5%(5%),但在任何情況下,此類年度增加不得超過10萬股普通股 。2014年計劃規定向本公司及其關聯公司的員工、董事和顧問發行激勵性股票期權、非法定股票期權、普通股購買權、股票增值權、限制性股票和限制性股票單位。2014年計劃要求股票期權的行權價格不低於授予日公司普通股的公允價值。截至2022年12月31日,根據2014年計劃,可供未來發行的前身股票有45,652股。
2022年12月12日,鑑於業務合併的完善,前身批准了2014年計劃修正案(“2014年計劃修正案”)。除其他事項外,《2014年計劃修正案》規定,在業務合併完成後, 根據2014年計劃保留和可供發行的普通股股份不得進一步增加, 根據2014年計劃不得作出新的獎勵。
繼任者 2022年綜合股權激勵計劃
繼任者有權根據《2022年綜合股權激勵計劃》(《2022年計劃》)頒發獎勵。根據2022年計劃,自2022年12月12日起,授權發行繼任者的31,138股繼任者普通股 。2022年計劃下可供發行的普通股數量應在2022年計劃期限內的每個日曆年1月份的第一個交易日(從2023年日曆年開始)自動增加,增加的金額相當於上一個日曆年12月份最後一個交易日已發行普通股總數的4%(4%)。2022年計劃規定向本公司及其關聯公司的員工、董事和顧問發行激勵性股票期權、非法定股票期權、普通股購買權、股票增值權、限制性股票和限制性股票單位 。2022年計劃要求股票期權的行權價格不低於授予之日公司普通股的公允價值。截至2022年12月31日,根據2022年計劃,可供未來發行的後繼股為31,138股 。
可贖回普通股
於2020年12月13日(“生效日期”),關於L票據協議(詳見附註5-應收票據 ),前身與L訂立協議,向L提供認沽期權,使本公司可按每股1.00美元的價格購買最多331,331股前身普通股(“認沽期權”)。 認沽期權將於(A)L票據悉數償還之日屆滿;或(B)生效日期五(5)週年。雙方同意,如L公司行使權力,本公司將根據L公司票據協議減少L公司當時欠本公司的應收款項,以代替向L公司支付認沽股份。認沽期權 以331美元的總代價售予L基金,並記入額外實收資本內。
2022年12月12日,本公司結束了業務合併(見附註4-業務合併),據此,受認沽期權約束的331,331股前身普通股交換為1,880股後繼普通股,價格為 每股176.28美元。看跌期權具有使普通股標的股票可贖回的實際效果。因此,在繼任者和前任資產負債表上,它們都被歸類為臨時股本。
| F-24 |
有關L債券和看跌期權的更多詳細信息,請參閲 附註13-後續事件。
前身 A系列優先股
前身 系列A優先股融資s
2022年3月31日,前身以每股3.14美元的價格向投資者出售了133,541股A系列優先股,淨收益為392,301美元,其中10萬美元來自關聯方。
先前A系列優先股可根據持有人的選擇隨時以一對一的方式轉換為先前普通股股票 ,但須進行標準反稀釋調整。此外,如果本公司 以低於有效轉換價的價格進行任何非豁免發行,則應按加權 平均值降低先前A系列優先股轉換價。在(i)公開交易結束或(ii)先前A系列優先股多數當時流通股持有人的書面同意或協議指定日期的同時,每股先前A系列優先股的每股股份應自動轉換為先前普通股 。公開 交易指(a)承銷公開發行的堅定承諾;或(b)與納斯達克股票市場上市的特殊 收購公司("SPAC")的交易完成,在該交易中,公司將成為SPAC的全資子公司 。
先前A系列優先股股東應與先前普通股股東在轉換後的基礎上共同投票, 股息僅在支付給先前普通股股東時,才會在轉換後的基礎上支付。在任何清算、 解散或清盤的情況下,或在被視為清算事件的情況下,在支付給先前普通股 之前,先前A系列優先股股東將有權從先前可供分配的資產中獲得原購買價的兩倍,加上先前A系列優先股每股已宣佈且未支付的股息 ,或先前A系列優先股持有人在轉換後將收到的金額(如金額更大)。任何收益的餘額 應按比例分配給先前普通股股東。視為清算事件包括(a)前公司或其子公司為組成方的合併 或合併導致控制權變更("合併 事件");或(b)前公司全部或絕大部分資產的出售、租賃、轉讓、獨家許可或其他處置("處置事件")。
前身A系列優先股不可強制贖回,因此不應歸類為負債。 前身確定被視為清算事件在前身控制範圍內,因此前身A系列優先股應歸類為永久股權。具體地説,根據州法律,合併事件和處置事件需要得到董事會的批准,而前任優先股東無法控制董事會的投票 。前人確定,嵌入的轉換期權與優先股宿主明確而密切相關,因此,嵌入的轉換期權不需要被分成兩部分。但是,如果在隨後的證券發行中重新設定轉換價格,則前任將需要評估價格重新設定的會計處理。由於前身在2021年1月1日採用了ASU 2020-06,因此沒有必要評估嵌入式轉換選項以實現有益的轉換 功能。
2022年7月8日,前身以每股3.14美元的價格向投資者出售了94,393股前身A系列優先股,產生了296,400美元的毛收入。21,200美元的配售代理費被記錄為額外實收資本的減少。
2022年9月16日,前身以每股3.14美元的價格向投資者額外出售了222,929股前身A系列優先股,產生了700,000美元的毛收入。配售代理費16,000美元被記錄為額外實收資本的減少。
2022年12月6日,前身以每股3.14美元的價格向投資者出售了174,776股前身A系列優先股,產生了548,805美元的毛收入。2,000美元的配售代理費被記錄為額外實收資本的減少。
| F-25 |
修改前身系列A優先股名稱
2022年5月10日,前身獲得了必要的批准,以(A)修改前身公司註冊證書中的前身A系列優先股名稱,將前身A系列優先股的有效轉換價格 從每股前身普通股3.14美元降至每股前身普通股2.78美元;以及(B)並增加了100%的認股權證覆蓋面, 這樣,轉換時發行的每一股前身普通股,持有人也將獲得前身認股權證,以購買 一股前身普通股。這些前置認股權證可按每股3.20美元的初始行權價行使(如果被視為發行價低於當前行權價格,則可在公開交易完成時減持),並在五年後到期(“前置A系列認股權證”),或在不符合公開交易定義的較早控制權變更時 。前身確定(A)前身A系列權證 在發行時有資格被歸類為股權,而不需要隨後的重新計量,以及(B)前身A系列權證的或有發行性質不會改變前身的結論,即嵌入的轉換選項與優先股宿主明確而密切地 相關,因此,嵌入的轉換選項不需要被分開。前身公司還認定,降低前身A系列優先股轉換價格,再加上轉換時增加100%的權證覆蓋率, 代表前身A系列優先股條款需要應用清償會計的重大變化。因此,在計算每股虧損時,有必要將經修訂前身A系列優先股及新前身A系列認股權證的331,200美元增量公允價值(與A系列優先股的賬面價值相比)記錄為視為股息以計算每股虧損 。
對先前系列A優先股名稱的第二次修訂
2022年8月31日,前身向佛羅裏達州國務院提交了對前身公司註冊證書中前身A系列優先股名稱的第二次修訂,將前身A系列優先股的轉換價格從每股前身普通股和前身A系列認股權證降至每股1.19美元。此外,前身還將轉換時可發行的前身A系列權證的行權價從每股3.20美元下調至每股1.37美元。
前身確定下調前身A系列優先股轉換價格,再加上與可於轉換時發行的前身A系列認股權證(統稱為“第二修訂證券”)相關的修訂條款 , 代表需要應用清償會計的重大變化。因此,為計算每股虧損,有必要將經修訂前身A系列優先股及經修訂前身A系列認股權證的9,684,637美元增量公允價值(與A系列優先股的賬面價值及前身A系列認股權證第二次修訂前的公允價值比較)記錄為視為股息,以計算每股虧損。
撲滅前身A系列優先股
本公司認為,降低A系列優先股轉換價格,加上或有發行A系列認股權證或更改A系列優先股(統稱為“經修訂證券”),是一項需要應用清償會計的重大變化。因此,為計算每股虧損,有必要將經修訂證券的331,200美元增量價值(與原來A系列優先股的價值相比)記錄為視為股息 。
| F-26 |
自動 先前A系列優先股轉換
於2022年12月12日,與業務合併有關,所有已發行的2,427,832股前身A系列優先股 自動轉換為6,406,210股前置普通股和5年期前置A認股權證,以購買6,406,210股前置普通股, 然後 換成36,340股後繼普通股和5年期 認股權證,以每股241.50美元的行使價 購買36,340股後繼普通股。按照優先股的原始條款轉換的權益類優先股將導致優先股賬面價值的終止確認,並將該金額分配給普通股(面值)和額外的實收資本,而不確認損益。
繼任者 優先股
繼任者 A系列優先股融資
在業務合併方面,繼承人出售了8,635股A系列優先股和五年權證,可按行使價每股402.50美元(“管道認股權證”),購買24,671股後續普通股(“管道認股權證”), 以每股1,000美元的價格向某些買家出售淨收益8,635,000美元(“管道”融資)。
根據持有人的選擇,後續系列A優先股可在任何時間轉換為一定數量的後續普通股,等於面值除以當時生效的轉換價格(最初為350.00美元)。此外,在後續A系列優先股發行後的五年內,轉換價格將自動調整為(A) $70.00美元和(B)低於轉換價格的任何後續證券發行的最低價格中的較大者。
在後續A系列優先股(每個均為“生效日期”)註冊生效後, 轉換價格也將分別重置為90天和150天,以(A)70.00美元和(B)自每個生效日期(包括)開始幷包括在內的連續十個每日成交量加權平均價格中最低價格的85%為較大值。截至申請日,後續系列 A優先股尚未註冊,也未進行換股價格重置。
| F-27 |
繼任A系列優先股股東沒有投票權,只有在向繼任普通股股東支付股息時,股息才會按折算後的基礎支付。如果繼承人發生清算、解散或清盤,每一位A系列優先股繼承人有權從合法可供分配的公司資產、其所持股份的聲明價值以及任何應計和未支付的股息中獲得 支付。任何收益的餘額應按折算後的基礎分配給後續的A系列優先股股東Pari 通行證有繼任者的普通股股東。
繼任者A系列優先股在持有人選擇時不可贖回 ,因此被歸類為永久股權。然而,在持有人有權選擇 進行轉換的情況下,公司有權隨時以面值的120%贖回後續的A系列優先股。後繼者 確定嵌入的轉換選項與優先股主機明顯且密切相關,因此,嵌入的 轉換選項不需要被分成兩部分。然而,如果轉換價格因隨後的證券發行而重置,則本公司將需要評估價格重置的會計處理。由於繼任者於2021年1月1日採用ASU 2020-06,因此無需評估嵌入式轉換選項以實現有益的轉換功能。
後繼者 首選系列B發行
在業務合併方面,繼承人以每股1,000美元的價格向向本公司提供服務的某些供應商發行了5,062股B系列優先股,以換取5,062,000美元的公司債務。
根據 持有者的選擇,後續B系列優先股可在任何時間轉換為若干後續普通股,等於面值除以當時的轉換價格(最初為350.00美元)。 此外,在後續B系列優先股發行後的五年內,轉換價格將自動調整為(A)245.00美元; 和(B)任何後續證券發行的最低價,價格低於轉換價格。
在後續B系列優先股註冊生效後的150日內,轉換價格也將重置為(A)245.00美元、 和(B)連續五個每日成交量加權平均價格中的最低者,自開始日期(包括開始日期)起計。截至申請日,後續系列 B優先股尚未註冊,也未進行轉換價格重置。
繼任者B系列優先股股東沒有投票權,只有在向繼任者普通股股東支付股息時,股息才會按折算後的基礎支付。如果繼承人發生任何清算、解散或清盤,則每個繼承人B系列優先股股東有權從公司合法可供分配的資產、其所持股份的規定價值以及任何應計和未支付的股息中獲得支付。 任何收益的餘額應按折算後的基礎分配給繼承人B系列優先股股東。平價通行證 與繼任者普通股股東。
繼任者B系列優先股不可贖回 ,因此被歸類為永久股權。繼任者確定嵌入的轉換選項與優先股宿主明確而密切地相關,因此,嵌入的轉換選項不需要被分成兩部分。但是,如果在隨後的證券發行中重置了轉換價格 ,則繼任者將需要評估重置價格的會計處理。由於繼任者於2021年1月1日採用了ASU 2020-06,因此沒有必要評估嵌入式轉換 選項以獲得有利的轉換功能。
| F-28 |
基於股票的薪酬
在2022年12月13日至2022年12月31日期間,繼任者記錄的股票薪酬支出為56,333美元(其中,7,808美元包括在研發中,48,525美元包括在一般和行政費用中),與向員工和顧問發放的期權 相關。在截至2022年12月12日的期間,前任記錄的基於股票的薪酬支出為3,524,802美元(其中673,160美元包括在研發中,2,851,642美元包括在一般和行政費用中),與向員工和顧問發放的期權有關。截至2022年12月31日,有2,957,047美元的未確認股票薪酬 費用,公司預計將在1.6年的加權平均期間內確認。
在截至2021年12月31日的年度,公司記錄了4,245,463美元的股票薪酬支出(其中944,525美元包括在研發中,3,300,938美元包括在一般和行政費用中),與向員工和顧問發放的期權有關。
股票 期權
2022年12月12日,本公司結束了業務合併(見附註4-業務合併),據此,10,039,348個未償還前置期權 交換了56,999個未償還後繼期權 。向前置期權持有人發行的後繼期權數量 是通過可發行前置普通股的股數除以176.28的兑換比率來確定的。 每個前置期權的行權價格也乘以兑換比率。
在將布萊克-斯科爾斯期權定價模型應用於已授予的前身股票期權時,該公司使用了以下假設:
已授予的股票期權日程表
| 繼任者 | 前身 | |||||||||
| 在該期間內 | 在該期間內 | 這一年的 | ||||||||
| 12月13日至 | 1月1日至 | 告一段落 | ||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||
| 授予日期普通股的公允價值 | 不適用 | $2.27 - $3.00 | $ | 3.25 | ||||||
| 無風險利率 | 不適用 | 1.68% - 3.01 | % | 0.66% - 1.26 | % | |||||
| 預期期限(年) | 不適用 | 3.53 - 6.00 | 5.00 - 6.00 | |||||||
| 預期波動率 | 不適用 | 111% - 119 | % | 118% - 125 | % | |||||
| 預期股息 | 不適用 | 0.00 | % | 0.00 | % | |||||
截至2022年12月12日止期間,前身公司普通股的公允價值是根據 在每個估值日與收購方進行的公平討論的業務合併協議的狀態,使用市場法確定的,該協議最終於2022年7月20日簽訂,公司估值為8500萬美元。截至2022年12月12日期間 授予的期權的合同期限為七至十年,必要的服務期限為零至三年。
在截至2021年12月31日的年度內,管理層在第三方估值專家的協助下使用收益法確定了前身普通股的公允價值。截至2021年12月31日止年度授予的期權的合同期限為十年,必要的服務期為零至三年。
| F-29 |
繼承人2022年12月13日至2022年12月31日期間以及繼承人截至2022年12月12日期間的期權活動 如下:
股票期權活動時間表
| 繼任者 | 數量 選項 | 加權 平均值 鍛鍊 價格 | 加權 平均值 剩餘 生命 以年為單位 | 集料 固有的 價值 | ||||||||||||
| 傑出,2022年12月13日 | 56,999 | $ | 366.29 | |||||||||||||
| 授與 | - | - | ||||||||||||||
| 已鍛鍊 | - | - | ||||||||||||||
| 被沒收 | - | - | ||||||||||||||
| 未清償,2022年12月31日 | 56,999 | $ | 366.29 | 5.8 | $ | - | ||||||||||
| 可行使,2022年12月31日 | 47,030 | $ | 337.43 | 5.3 | $ | - | ||||||||||
| 前身 | 數量 選項 | 加權 平均值 鍛鍊 價格 | 加權 平均值 剩餘 生命 以年為單位 | 集料 固有的 價值 | ||||||||||||
| 未償還,2022年1月1日 | 8,755,179 | $ | 2.00 | |||||||||||||
| 授與 | 1,284,169 | 3.17 | ||||||||||||||
| 已鍛鍊 | - | - | ||||||||||||||
| 被沒收 | - | - | ||||||||||||||
| 傑出,2022年12月12日 | 10,039,348 | $ | 2.15 | 5.9 | $ | 3,271,992 | ||||||||||
| 可撤銷,2022年12月12日 | 8,258,023 | $ | 1.91 | 5.3 | $ | 3,271,992 | ||||||||||
下表列出了截至2022年12月31日與股票期權相關的信息:
與股票期權相關的信息一覽表
| 繼任者 | ||||||||||||||
| 未完成的期權 | 可行使的期權 | |||||||||||||
| 傑出的 | 加權平均 | 可操練 | ||||||||||||
| 鍛鍊 | 數量 | 餘生 | 數量 | |||||||||||
| 價格 | 選項 | 以年為單位 | 選項 | |||||||||||
| $ | 176.05 | 18,952 | 3.1 | 18,952 | ||||||||||
| $ | 396.55 | 351 | 9.5 | 351 | ||||||||||
| $ | 405.30 | 20,819 | 6.3 | 20,819 | ||||||||||
| $ | 572.60 | 16,877 | 8.3 | 6,908 | ||||||||||
| 56,999 | 5.3 | 47,030 | ||||||||||||
| F-30 |
股票 認股權證
繼承人2022年12月13日至2022年12月31日期間以及繼承人截至2022年12月12日期間的授權活動 如下:
權證活動摘要
| 加權 | ||||||||||||||||
| 加權 | 平均值 | |||||||||||||||
| 平均值 | 剩餘 | 集料 | ||||||||||||||
| 數量 | 鍛鍊 | 生命 | 固有的 | |||||||||||||
| 繼任者 | 認股權證 | 價格 | 以年為單位 | 價值 | ||||||||||||
| 傑出,2022年12月13日 | 246,594 | $ | 376.11 | |||||||||||||
| 已發佈 | - | - | ||||||||||||||
| 未清償,2022年12月31日 | 246,594 | $ | 376.11 | 4.8 | $ | - | ||||||||||
| 可行使,2022年12月31日 | 244,598 | $ | 376.11 | 4.8 | $ | - | ||||||||||
| 加權 | ||||||||||||||||
| 加權 | 平均值 | |||||||||||||||
| 平均值 | 剩餘 | 集料 | ||||||||||||||
| 數量 | 鍛鍊 | 生命 | 固有的 | |||||||||||||
| 前身 | 認股權證 | 價格 | 以年為單位 | 價值 | ||||||||||||
| 未償還,2022年1月1日 | 2,154,352 | $ | 1.98 | |||||||||||||
| 已發佈 | 6,406,210 | 1.37 | ||||||||||||||
| 已鍛鍊 | - | - | ||||||||||||||
| 傑出,2022年12月12日 | 8,560,562 | $ | 1.52 | 1.8 | $ | 59,681 | ||||||||||
| 可撤銷,2022年12月12日 | 8,560,562 | $ | 1.55 | 3.9 | $ | 34,203 | ||||||||||
下表顯示了截至2022年12月31日繼任者的認股權證相關信息:
認股權證相關資料附表
| 繼任者 | ||||||||||||||
| 未清償認股權證 | 可行使的認股權證 | |||||||||||||
| 鍛鍊 | 傑出的 | 加權平均 | 可行使的數目 | |||||||||||
| 價格 | 數量 | 餘生 | 認股權證 | |||||||||||
| $ | 176.05 | 2,994 | 2.0 | 998 | ||||||||||
| $ | 241.50 | 36,363 | 4.9 | 36,363 | ||||||||||
| $ | 402.50 | 197,985 | 4.9 | 197,985 | ||||||||||
| $ | 405.30 | 9,252 | 1.0 | 9,252 | ||||||||||
| 246,594 | 4.8 | 244,598 | ||||||||||||
截至2022年12月31日的後續認股權證包括以下內容:
| (a) | 可行使的 認股權證購買173,302股後續 普通股,這些普通股最初是由Larkspur向Larkspur的企業前合併首次公開募股和私募的參與者發行的(“Larkspur 認股權證”)。根據它們的條款,Larkspur認股權證(I)的行使價為每股後續普通股402.50美元;(Ii)由於業務合併的結束,其到期日延長至2027年12月12日;及(Iii)在本公司向認股權證持有人發出贖回通知前30個交易日結束的任何20個交易日內,繼任普通股的收市價等於或超過每股630.00美元的情況下,本公司可按每份Larkspur認股權證0.35美元的價格,在至少30天的書面贖回通知下贖回。 |
| F-31 |
| (b) | 可行使的 認股權證購買24,671股後續普通股,由Larkspur的PIPE融資參與者 發行,該融資與業務合併同時結束,並以此為條件(見 附註11-股東永久和臨時股權-後續A系列優先股融資)。根據其條款,管道認股權證(I)的行使價為每股後續普通股402.50美元; 和(Ii)的到期日為2027年12月12日。 | |
| (c) | 認股權證 購買48,561股後繼普通股(“替代認股權證”) 於本公司於2022年12月12日本公司結束業務合併(見附註4-業務合併)時, 取代已發行的前置認股權證,購買8,560,561股前置普通股。根據後續權證可發行的股票數量是通過將根據每個前置權證發行的股份除以交易所 比率176.28來確定的。 後續權證的行權價格是通過將每個前置權證的行權價格乘以176.28的交換比率來確定的。 | |
| 替換認股權證包括:(A)購買36,340股後續普通股的可行使權證,行使價為每股241.50美元,到期日為2027年12月12日,取代A系列優先股持有人的前身在其前身A系列優先股 自動轉換為前身普通股和前身A系列權證後發行的權證(見注11- 股東永久和臨時股權-前身A系列優先股的自動轉換);(B) 購買2,992股後續普通股,行使價為每股176.05美元,取代前身向戰略合作伙伴發行的權證 (見附註10-承諾和或有-許可協議 -L&F Research LLC),其中購買997股的權證可行使至2025年1月6日左右到期,其餘部分在實現某些里程碑時授予,並在實現該等里程碑後五年內到期;和(C)購買9,229股後續普通股的可行使權證,行使價為每股405.30美元,截止日期為2024年4月17日,取代前身 在簽訂許可協議時向某些可轉換票據購買者、某些經紀商和戰略合作伙伴發行的認股權證 (見附註10-承諾和或有-許可協議-InflamaCORE)。 |
附註 12-關聯方交易
在2022年12月13日至2022年12月31日期間,繼任者沒有任何關聯方交易。
在截至2022年12月12日和2021年12月31日的期間內,前任分別向作為公司部分所有者的投資銀行家支付了0美元和50,000美元的經紀費。
在截至2022年12月12日和2021年12月12日的期間內,公司分別從公司管理團隊成員、創始人和主要股東那裏獲得了0美元和3,150,000美元,用於購買2021年債券。有關2021年票據的進一步討論,請參閲附註7--可轉換應付票據 。
附註 13-後續事件
自財務報表發佈之日起,公司已對後續事件進行了評估。根據評估,本公司並無發現任何已確認或未確認的後續事項需要在財務報表中作出調整或披露,但下述情況除外。
許可證 協議
於2023年2月28日,本公司與L律師事務所簽署修訂及重述協議,放棄L因未能支付1,500,000美元里程碑付款而終止許可協議或任何其他補救措施的權利,直至(A)2023年3月31日為止(B)就該等里程碑付款中的1,000,000美元(“豁免A”)及(B)2024年1月31日就500,000美元的里程碑付款(“放棄(Br)B”)。豁免A視乎(I)本公司寬免本金總額351,579美元,以及(Ii)本公司於2023年3月31日或之前向L律師事務所支付648,421美元現金。豁免B視情況而定 本公司於2024年1月31日或之前向L律師事務所支付500,000美元現金,及(Y)自本公司收到發行新股本所得款項淨額至少30,000,000美元之日起計十個營業日。許可協議的所有其他 條款仍然有效。
2023年3月29日,本公司向L基金支付了648,421美元現金,從而滿足了豁免A的條件,同時也具有取消應收票據和看跌期權的效果。
股票 期權授予
於2023年1月27日,本公司根據納斯達克上市規則第5635(C)(4)條,向新任命的首席醫療官及醫務部高級副總裁授予為期十年的購股權,以購買2,857股繼任 普通股,作為進入本公司工作的誘因。這些股票期權在三年內每年授予一次,行權價為每股73.85美元。
2023年3月10日,公司根據2022年計劃向公司員工授予了購買372股後續普通股的為期10年的股票期權。這些股票期權在三年內每年授予一次,行權價為每股79.10美元。在372股中,有143股是向公司一名高管的兒子發行的。
有效性失效
於2023年2月20日左右,本公司未能讓美國證券交易委員會在PIPE證券購買協議(“PIPE證券購買協議”)規定的 期限內申報涵蓋PIPE應登記證券的登記聲明 生效(“生效失敗”)。SPA使PIPE投資者有權在有效性失敗之日收到相當於每位投資者購買價格1.5%的註冊延遲付款,並在有效性失敗持續後每隔30 天獲得一次延遲付款。未能及時支付註冊延遲付款將導致 按每月2.0%的利率計息。截至提交日期,公司預計必須支付兩個月的註冊延遲付款(總計約260,000美元),然後才能解決有效性故障。
附註 14-反向股票-普通股授權股份的拆分和增加
2023年12月4日,公司按35股1股的比例對普通股進行了反向拆分(“反向拆分”)。在反向拆分生效後,每35股已發行普通股重新分類併合併為一股普通股。此外,因行使本公司的股權獎勵、可轉換證券及認股權證而可發行的普通股股份按比例減少,而相應的行使價格則按比例增加。由於反向拆分,沒有發行零碎股份。因此,此等財務報表及其附註所呈列所有期間的所有股份及每股 金額已追溯調整至後續期間(如適用),以反映各項未償還股權獎勵、可換股證券及認股權證的行使價的反向拆分及調整,猶如交易於呈列的最早期間開始時發生一樣。
自2023年11月30日起,公司修改了公司註冊證書,將公司股本的法定股數從111,000,000股增加到251,000,000股,普通股的法定股數從110,000,000股增加到250,000,000股。
| F-32 |
ZYVERSA THERAPEUTICS,INC.
精簡的 合併資產負債表
| 繼任者 | ||||||||
| 9月30日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| (未經審計) | ||||||||
| 資產 | ||||||||
| 流動資產: | ||||||||
| 現金 | $ | 1,578,721 | $ | 5,902,199 | ||||
| 預付費用和其他流動資產 | 426,519 | 225,347 | ||||||
| 供應商保證金 | - | 235,000 | ||||||
| 流動資產總額 | 2,005,240 | 6,362,546 | ||||||
| 設備,網絡 | 9,533 | 17,333 | ||||||
| 正在進行的研究和開發 | 30,806,158 | 100,086,329 | ||||||
| 商譽 | - | 11,895,033 | ||||||
| 保證金 | - | 46,659 | ||||||
| 經營性租賃使用權資產 | 31,078 | 98,371 | ||||||
| 總資產 | $ | 32,852,009 | $ | 118,506,271 | ||||
| 負債、臨時權益和股東權益 | ||||||||
| 流動負債: | ||||||||
| 應付帳款 | $ | 8,897,534 | $ | 6,025,645 | ||||
| 應計費用和其他流動負債 | 2,775,485 | 2,053,559 | ||||||
| 經營租賃負債 | 34,349 | 108,756 | ||||||
| 流動負債總額 | 11,707,368 | 8,187,960 | ||||||
| 遞延税項負債 | 1,440,982 | 10,323,983 | ||||||
| 總負債 | 13,148,350 | 18,511,943 | ||||||
| 承付款和或有事項(附註8) | - | - | ||||||
| 繼任者 可贖回普通股,可能贖回,0 和1,880股已發行股票 分別截至2023年9月30日和2022年12月31日 | - | 331,331 | ||||||
| 股東權益: | ||||||||
| 後續優先股,面值0.0001美元,授權1,000,000股: A系列優先股,指定股8,635股,截至2023年9月30日和12月已發行和流通股50股和8,635股 分別為2022年31日 | - | 1 | ||||||
| B系列優先股,指定5,062股,發行5,062股和 截至2023年9月30日和2022年12月31日未償還 | 1 | 1 | ||||||
| 後續普通股,0.0001美元 面值,110,000,000股 授權; 1,243,359和257,604 分別於2023年9月30日和2022年12月31日發行的股票和1,243,297 和257,604股已發行股票 分別截至2023年9月30日和2022年12月31日 | 123 | 26 | ||||||
| 追加實收資本 | 109,591,327 | 104,584,147 | ||||||
| 累計赤字 | (89,880,624 | ) | (4,921,178 | ) | ||||
| 國庫券,按成本計算,62 9月且0股 分別於2023年30日和2022年12月31日 | (7,168 | ) | - | |||||
| 股東權益總額 | 19,703,659 | 99,662,997 | ||||||
| 負債、臨時權益和股東權益合計 | $ | 32,852,009 | $ | 118,506,271 | ||||
附註是這些簡明綜合財務報表的組成部分。
| F-33 |
ZYVERSA THERAPEUTICS,INC.
精簡的 合併業務報表
(未經審計)
| 繼任者 | 前身 | 繼任者 | 前身 | |||||||||||||
| 截至2023年9月30日的三個月內 | 截至以下三個月 2022年9月30日 | 在截至的9個月中 2023年9月30日 | 在截至的9個月中 2022年9月30日 | |||||||||||||
| 運營費用: | ||||||||||||||||
| 研發 | $ | 673,943 | $ | 2,334,120 | $ | 2,950,462 | $ | 4,120,477 | ||||||||
| 一般和行政 | 2,228,735 | 1,061,046 | 9,694,097 | 4,526,428 | ||||||||||||
| 正在進行的研究和開發的損害 | - | - | 69,280,171 | - | ||||||||||||
| 商譽減值 | - | - | 11,895,033 | - | ||||||||||||
| 總運營費用 | 2,902,678 | 3,395,166 | 93,819,763 | 8,646,905 | ||||||||||||
| 運營虧損 | (2,902,678 | ) | (3,395,166 | ) | (93,819,763 | ) | (8,646,905 | ) | ||||||||
| 其他(收入)支出: | ||||||||||||||||
| 利息(收入)支出 | 210 | 69,352 | (555 | ) | 377,820 | |||||||||||
| 衍生負債的公允價值變動 | - | 228,100 | - | 420,600 | ||||||||||||
| 税前淨虧損 | (2,902,888 | ) | (3,692,618 | ) | (93,819,208 | ) | (9,445,325 | ) | ||||||||
| 所得税優惠 | 485 | - | 8,859,762 | - | ||||||||||||
| 淨虧損 | (2,902,403 | ) | (3,692,618 | ) | (84,959,446 | ) | (9,445,325 | ) | ||||||||
| 優先股股東視為股息 | (32,373 | ) | (9,684,637 | ) | (7,948,209 | ) | (10,015,837 | ) | ||||||||
| 普通股股東應佔淨虧損 | $ | (2,934,776 | ) | $ | (13,377,255 | ) | $ | (92,907,655 | ) | $ | (19,461,162 | ) | ||||
| 每股淨虧損 | ||||||||||||||||
| -基本版和稀釋版 | $ | (3.32 | ) | $ | (0.55 | ) | $ | (167.59 | ) | $ | (0.81 | ) | ||||
| 已發行普通股加權平均數 | ||||||||||||||||
| -基本版和稀釋版 | 885,101 | 24,167,257 | 554,372 | 24,167,257 | ||||||||||||
附註是這些簡明綜合財務報表的組成部分。
| F-34 |
ZYVERSA THERAPEUTICS,INC.
集中 股東權益變動綜合報表(不足)
| 截至2023年9月30日的三個月和九個月 | ||||||||||||||||||||||||||||||||||||||||||||
| A系列 | B系列 | 其他內容 | 總計 | |||||||||||||||||||||||||||||||||||||||||
| 優先股 | 優先股 | 普通股 | 庫存股 | 已繳費 | 累計 | 股東的 | ||||||||||||||||||||||||||||||||||||||
| 股票 | 金額 | 股票 | 金額 | 股票 | 金額 | 股票 | 金額 | 資本 | 赤字 | 權益 | ||||||||||||||||||||||||||||||||||
| 繼任者 | ||||||||||||||||||||||||||||||||||||||||||||
| 餘額-2023年1月1日 | 8,635 | $ | 1 | 5,062 | $ | 1 | 257,604 | $ | 26 | - | $ | - | $ | 104,584,147 | $ | (4,921,178 | ) | $ | 99,662,997 | |||||||||||||||||||||||||
| 重新分類以前可贖回的普通股 | - | - | - | - | 1,880 | - | - | - | 331,331 | - | 331,331 | |||||||||||||||||||||||||||||||||
| 根據供應商協議發行普通股 | - | - | - | - | 3,714 | - | - | - | 395,200 | - | 395,200 | |||||||||||||||||||||||||||||||||
| 與發行優先股相關的註冊成本 | - | - | - | - | - | - | - | - | (34,674 | ) | - | (34,674 | ) | |||||||||||||||||||||||||||||||
| 基於股票的薪酬 | - | - | - | - | - | - | - | - | 287,461 | - | 287,461 | |||||||||||||||||||||||||||||||||
| 淨虧損 | - | - | - | - | - | - | - | - | - | (3,543,950 | ) | (3,543,950 | ) | |||||||||||||||||||||||||||||||
| 餘額-2023年3月31日 | 8,635 | 1 | 5,062 | 1 | 263,198 | 26 | - | - | 105,563,465 | (8,465,128 | ) | 97,098,365 | ||||||||||||||||||||||||||||||||
| 登記發行普通股[1] | - | - | - | - | 314,729 | 31 | - | - | 9,830,988 | - | 9,831,019 | |||||||||||||||||||||||||||||||||
| 贖回A系列優先股 | (8,400 | ) | (1 | ) | - | - | - | - | - | - | (10,080,000 | ) | - | (10,080,001 | ) | |||||||||||||||||||||||||||||
| 將A系列優先股轉換為普通股 | (35 | ) | - | - | - | 500 | - | - | - | - | - | - | ||||||||||||||||||||||||||||||||
| 作為延長禁售期代價而發行的股份 | - | - | - | - | 86,976 | 9 | - | - | 1,156,769 | - | 1,156,778 | |||||||||||||||||||||||||||||||||
| 根據供應商協議發行普通股 | - | - | - | - | 10,857 | 1 | - | - | 209,999 | - | 210,000 | |||||||||||||||||||||||||||||||||
| 基於股票的薪酬 | - | - | - | - | - | - | - | - | 365,742 | - | 365,742 | |||||||||||||||||||||||||||||||||
| 按成本價購入庫存股 | - | - | - | - | - | - | (62 | ) | (7,168 | ) | - | - | (7,168 | ) | ||||||||||||||||||||||||||||||
| 淨虧損 | - | - | - | - | - | - | - | - | - | (78,513,093 | ) | (78,513,093 | ) | |||||||||||||||||||||||||||||||
| 餘額-2023年6月30日 | 200 | - | 5,062 | 1 | 676,260 | 67 | (62 | ) | (7,168 | ) | 107,046,963 | (86,978,221 | ) | 20,061,642 | ||||||||||||||||||||||||||||||
| 登記發行普通股[2] | - | - | - | - | 93,030 | 9 | - | - | 1,575,929 | - | 1,575,938 | |||||||||||||||||||||||||||||||||
| 授權證修改 | - | - | - | - | - | - | - | - | 181,891 | - | 181,891 | |||||||||||||||||||||||||||||||||
| 贖回A系列優先股 | (150 | ) | - | - | - | - | - | - | - | (215,048 | ) | - | (215,048 | ) | ||||||||||||||||||||||||||||||
| 行使預先出資的認股權證 | - | - | - | - | 270,606 | 27 | - | - | 920 | - | 947 | |||||||||||||||||||||||||||||||||
| 認股權證誘導要約—行使收益 [3] | - | - | - | - | 203,463 | 20 | - | - | 757,627 | - | 757,647 | |||||||||||||||||||||||||||||||||
| 基於股票的薪酬 | - | - | - | - | - | - | - | - | 243,045 | - | 243,045 | |||||||||||||||||||||||||||||||||
| 淨虧損 | - | - | - | - | - | - | - | - | - | (2,902,403 | ) | (2,902,403 | ) | |||||||||||||||||||||||||||||||
| 餘額-2023年9月30日 | 50 | $ | - | 5,062 | $ | 1 | 1,243,359 | $ | 123 | (62 | ) | $ | (7,168 | ) | $ | 109,591,327 | $ | (89,880,624 | ) | $ | 19,703,659 | |||||||||||||||||||||||
| 截至2022年9月30日的三個月和九個月 | ||||||||||||||||||||||||||||
| A系列 | 其他內容 | 總計 | ||||||||||||||||||||||||||
| 優先股 | 普通股 | 已繳費 | 累計 | 股東的 | ||||||||||||||||||||||||
| 股票 | 金額 | 股票 | 金額 | 資本 | 赤字 | 缺憾 | ||||||||||||||||||||||
| 前身 | ||||||||||||||||||||||||||||
| 餘額-2022年1月1日 | - | $ | - | 24,167,257 | $ | 242 | $ | 40,065,109 | $ | (52,896,817 | ) | $ | (12,831,466 | ) | ||||||||||||||
| 以私募方式發行優先股[4] | 133,541 | 1 | - | - | 393,300 | - | 393,301 | |||||||||||||||||||||
| 基於股票的薪酬 | - | - | - | - | 1,941,746 | - | 1,941,746 | |||||||||||||||||||||
| 淨虧損 | - | - | - | - | - | (3,748,495 | ) | (3,748,495 | ) | |||||||||||||||||||
| 餘額-2022年3月31日 | 133,541 | 1 | 24,167,257 | 242 | 42,400,155 | (56,645,312 | ) | (14,244,914 | ) | |||||||||||||||||||
| 基於股票的薪酬 | - | - | - | - | 695,940 | - | 695,940 | |||||||||||||||||||||
| 淨虧損 | - | - | - | - | - | (2,004,212 | ) | (2,004,212 | ) | |||||||||||||||||||
| 餘額-2022年6月30日 | 133,541 | 1 | 24,167,257 | 242 | 43,096,095 | (58,649,524 | ) | (15,553,186 | ) | |||||||||||||||||||
| 以私募方式發行優先股[5] | 317,322 | 4 | - | - | 959,196 | - | 959,200 | |||||||||||||||||||||
| 將應付可轉換票據和應計利息轉換為優先 股票 | 1,802,193 | 18 | - | - | 5,658,870 | - | 5,658,888 | |||||||||||||||||||||
| 基於股票的薪酬: | - | - | - | - | 494,022 | - | 494,022 | |||||||||||||||||||||
| 淨虧損 | - | - | - | - | - | (3,692,618 | ) | (3,692,618 | ) | |||||||||||||||||||
| 餘額-2022年9月30日 | 2,253,056 | $ | 23 | 24,167,257 | $ | 242 | $ | 50,208,183 | $ | (62,342,142 | ) | $ | (12,133,694 | ) | ||||||||||||||
| [1] | 包括收益總額11,015,500美元減去發行成本1,184,482美元 |
| [2] | 包括總收益2,099,053美元,減去發行成本523,115美元 |
| [3] | 包括收益總額966,349美元,減去發行成本208,702美元 |
| [4] | 包括收益總額419,320美元,減去發行成本26,019美元 |
| [5] | 包括收益總額996,400美元,減去發行成本37,200美元 |
附註是這些簡明綜合財務報表的組成部分。
| F-35 |
ZYVERSA THERAPEUTICS,INC.
簡明 合併現金流量表
| 繼任者 | 前身 | |||||||
| 為九人而戰 | 為九人而戰 | |||||||
| 截至的月份 | 截至的月份 | |||||||
| 9月30日, | 9月30日, | |||||||
| 2023 | 2022 | |||||||
| 經營活動的現金流: | ||||||||
| 淨虧損 | $ | (84,959,446 | ) | $ | (9,445,325 | ) | ||
| 對淨虧損與經營活動中使用的現金淨額進行的調整: | ||||||||
| 正在進行的研究和開發的損害 | 69,280,171 | - | ||||||
| 商譽減值 | 11,895,033 | - | ||||||
| 基於股票的薪酬 | 896,248 | 3,131,708 | ||||||
| 根據供應商協議發行普通股 | 605,200 | - | ||||||
| 作為延長禁售期代價而發行的股份 | 1,156,778 | - | ||||||
| 債務貼現攤銷 | - | 39,492 | ||||||
| 衍生負債的公允價值變動 | - | 420,600 | ||||||
| 固定資產折舊 | 7,800 | 7,800 | ||||||
| 非現金租金費用 | 67,293 | - | ||||||
| 遞延税項優惠 | (8,883,001 | ) | - | |||||
| 經營性資產和負債變動情況: | ||||||||
| 預付費用和其他流動資產 | (201,172 | ) | (57,366 | ) | ||||
| 保證金 | 46,659 | (1 | ) | |||||
| 供應商保證金 | 235,000 | 160,000 | ||||||
| 應付帳款 | 2,871,889 | 3,448,439 | ||||||
| 經營租賃負債 | (74,407 | ) | - | |||||
| 應計費用和其他流動負債 | 1,122,488 | 1,216,322 | ||||||
| 經營活動中使用的現金淨額 | (5,933,467 | ) | (1,078,331 | ) | ||||
| 融資活動的現金流: | ||||||||
| 公開發行普通股所得款項 | 13,114,555 | - | ||||||
| 與普通股發行有關的登記和發行費用 | (1,763,584 | ) | - | |||||
| 贖回A系列優先股 | (10,695,610 | ) | - | |||||
| 私募發行優先股所得 | - | 1,415,720 | ||||||
| 購買庫存股 | (7,168 | ) | - | |||||
| 行使預先出資的認股權證 | 947 | - | ||||||
| 認股權證誘導要約—行使收益 | 966,349 | - | ||||||
| 與優先股發行相關的註冊和發行費用 | (5,500 | ) | (63,219 | ) | ||||
| 融資活動提供的現金淨額 | 1,609,989 | 1,352,501 | ||||||
| 現金淨(減)增 | (4,323,478 | ) | 274,170 | |||||
| 現金--期初 | 5,902,199 | 328,581 | ||||||
| 現金--期末 | $ | 1,578,721 | $ | 602,751 | ||||
| 現金流量信息的補充披露: | ||||||||
| 將可轉換應付票據和應計利息轉換為優先股 | $ | - | $ | 5,658,888 | ||||
| 重新分類以前可贖回的普通股 | $ | 331,331 | $ | - | ||||
| 採用ASC 842後ROU資產和租賃負債的確認 | $ | - | $ | 182,732 | ||||
| 延期發售費用的應付帳款 | $ | 44,892 | $ | 1,506,211 | ||||
| 權證修改-增量價值 | $ | 181,891 | $ | - | ||||
| 認股權證誘因要約-增值 | $ | 134,591 | $ | - | ||||
附註是這些簡明綜合財務報表的組成部分。
| F-36 |
ZYVERSA治療公司 Inc.
簡明合併財務報表附註
附註 1--業務組織、業務性質和列報依據
組織 和運營
Larkspur(“Larkspur”)是一家空白支票特殊用途收購公司,於2021年3月17日在特拉華州註冊成立。2022年12月12日,Larkspur完成了與ZyVersa Treateutics,Inc.(前身)的業務合併(定義如下),該業務合併於2014年3月11日作為Variant PharmPharmticals,Inc.在佛羅裏達州註冊成立。根據業務合併協議(“業務合併協議”)的條款(以及在滿足或放棄業務合併協議的所有其他條件的情況下),在完成業務合併和由此預期的交易(“業務合併”)的日期(“截止日期”),Larkspur(“新母公司”) 更名為ZyVersa Treateutics,Inc.,前身在與新母公司的一家子公司合併後更名為ZyVersa Treating,Inc.(“運營公司”),運營公司是尚存的實體,這導致它在特拉華州註冊成立,併成為新母公司的全資子公司(統稱為“繼承人”)。 提及“公司”或“ZyVersa”是指截至2023年9月30日的三個月和九個月的繼任者。以及截至2022年9月30日的三個月和九個月的前任。
ZyVersa 是一家臨牀階段生物製藥公司,利用專有技術為慢性腎臟或炎症性疾病患者開發一流的藥物,這些患者具有高度未得到滿足的醫療需求。該公司的使命是開發優化健康結果和提高患者生活質量的藥物。
列報依據和合並原則
隨附的未經審核簡明綜合財務報表乃根據美國中期財務資料公認會計準則(“美國公認會計原則”)編制。因此,它們不包括 美利堅合眾國公認的年度財務報表所要求的所有信息和披露。管理層認為,該等報表包括為公平列報本公司截至2023年9月30日及截至2023年9月30日及截至2022年9月30日及截至2022年9月30日的9個月的未經審核簡明綜合財務報表所需的所有調整(只包括正常經常性項目) 。截至2023年9月30日的九個月的經營業績並不一定代表全年的經營業績。建議將這些未經審計的簡明合併財務報表與公司於2023年3月31日提交給美國證券交易委員會(“美國證券交易委員會”)的截至2022年12月31日的10-K表格年度報告中包含的綜合財務報表及其附註一併閲讀。
隨附的未經審核簡明綜合財務報表 來源於本公司及其合併子公司的會計記錄。作為業務合併的結果,出於會計目的,Larkspur是收購方,前身是ZyVersa治療公司,Inc.是被收購方和會計前身。因此,財務報表列報包括前身在2022年12月13日之前的財務報表和後繼者在2022年12月13日及之後期間的財務報表,包括運營公司的合併。所有重大的公司間結餘已在未經審計的簡明綜合財務報表中沖銷。未經審計的簡明綜合財務報表是根據美國公認會計準則和美國證券交易委員會的會計規則和規定編制的。
2023年12月4日,公司 以1股普通股與35股已發行普通股的比例進行反向股票拆分。因此,此等財務報表及其附註所呈列的所有後續期間的所有股份及每股金額已追溯調整 ,以反映各項未償還股權獎勵、可換股證券及認股權證的行使價的反向拆分及調整,猶如交易已於呈列的最早期間開始時發生。
注 2-持續經營和管理層的計劃
隨附的簡明綜合財務報表以持續經營為基礎編制,考慮正常業務過程中的資產變現和負債清償。簡明綜合財務報表並不包括與資產金額的可收回及分類或負債分類有關的任何調整,而如本公司無法繼續經營下去,則該等調整可能需要 。
截至2023年9月30日,公司的現金約為160萬美元,營運資金赤字約為970萬美元。 在截至2023年9月30日的9個月中,公司淨虧損約8500萬美元,運營中使用的現金約為590萬美元。截至2023年9月30日,該公司的累計赤字約為8990萬美元。
| F-37 |
公司尚未實現盈利,預計將繼續從運營中產生現金外流。該公司將需要大量現金來完成其專有技術的開發,目前正在管理成本以維持現金。 預計其研發以及一般和管理費用將繼續增加,因此,公司最終將需要產生大量產品收入來實現盈利。
因此,公司將被要求通過股權或債務融資籌集額外資金。管理層相信本公司可獲得資本資源,並繼續評估額外的融資機會;然而,不能保證本公司將 成功獲得額外資本,或本公司將能夠以商業上可接受的條款獲得資金。 也不能保證本公司可能籌集的資金數額將使本公司消除營運資金 赤字、完成其發展計劃或實現盈利運營。上述情況令人對公司是否有能力在這些財務報表發佈之日起至少一年內繼續經營下去產生極大的懷疑。
注 3 -重要會計政策摘要
自公司在截至2022年12月31日的2022年年報10-K表格中發佈2022年12月31日財務報表以來,公司的重大會計政策沒有發生重大變化。
使用預估的
根據美國公認會計原則編制財務報表要求管理層作出估計、判斷和假設,以影響財務報表中報告的金額和財務報表相關附註中披露的金額。本公司的估計和判斷基於歷史經驗和其認為在 情況下合理的各種其他假設。本公司資產負債表中列報的資產和負債額以及列報各期間的支出金額受估計和假設的影響,這些估計和假設用於但不限於股權證券、衍生負債、基於股份的薪酬和收購的無形資產的公允價值計算,以及確定遞延税項資產的估值 準備。公司的某些估計可能會受到外部條件的影響,包括公司獨有的情況和一般經濟狀況。實際結果有可能與這些估計值不同,這是合理的。
每股普通股淨虧損
基本 每股普通股淨虧損的計算方法為淨虧損除以期間已發行的既有普通股的加權平均數。每股普通股攤薄淨收入的計算方法是淨收入除以每個期間已發行的普通股和稀釋性普通股的加權平均數。
下表列出了未行使的潛在攤薄證券,這些證券已被排除在計算每股攤薄淨虧損 之外,因為這樣做會產生反攤薄效應:
反攤薄證券附表 不計入每股攤薄淨虧損
| 繼任者 | 前身 | |||||||
| 9月30日, | 9月30日, | |||||||
| 2023 | 2022 | |||||||
| 前身授權令 [1] | - | 8,699,397 | ||||||
| 繼任權證[1] | 1,039,295 | - | ||||||
| 前置任務選項 | - | 10,039,348 | ||||||
| 繼任者選項 | 101,695 | - | ||||||
| 繼任者系列A可轉換優先股 | 714 | - | ||||||
| 繼任者B系列可轉換優先股 | 20,664 | - | ||||||
| 前身A系列可轉換優先股 | - | 5,945,045 | ||||||
| 前身可轉換應付票據[2] | - | 2,977,528 | ||||||
| 潛在稀釋股份總數 | 1,162,368 | 27,661,318 | ||||||
| [1] | 作為InflamaCORE,LLC許可協議的一部分,購買600,000股前置普通股或3,404股後繼普通股的認股權證將在滿足某些里程碑後發行 ,因此不包括在當前報告的金額中。 有關詳細信息,請參閲注8-承諾和或有-許可協議。 |
| [2] | 公司的可轉換應付票據內含轉換選項,可在某些符合條件的交易完成後自動發行普通股 。轉換價格是與符合條件的交易相關聯的隱含普通股價格的函數。為了披露上表中的潛在稀釋證券,我們使用了符合條件的交易發生且隱含普通股價格等於截至2022年9月30日的普通股公允價值每股67.90美元的情況下可發行的普通股數量。 |
| F-38 |
分部 報告
公司將其業務作為一個可報告和經營分部進行經營和管理。所有資產和運營均在美國。公司的 首席執行官(即首席運營決策者)以彙總的方式審查財務信息,以 分配資源和評估財務業績。
注 4-業務合併、商譽和正在進行的研究與開發
2022年12月12日,Larkspur完成了與ZyVersa Treateutics,Inc.的業務合併(見注1-業務組織, 運營性質和陳述基礎)。本公司將業務合併作為經營公司的遠期收購入賬,因為已確定經營公司於業務合併日期為可變權益實體。新母公司被確定為主要受益人,因為它的所有權賦予了指導運營公司活動的權力和承擔運營公司的損失和/或接受運營公司利益的義務。
考慮到 Larkspur作為SPAC的活動的非經常性性質,合併Larkspur和運營公司業務合併前結果 的備考財務數據將沒有意義,因此未呈列。
採購 價格分配
業務合併採用收購會計方法入賬,初始收購價格分配基於 公司對收購對價的公允價值的初步評估,以及經營公司於收購日收購的有形和無形資產及承擔的負債的公允價值。截至2022年12月31日,由於收購日期臨近日曆年末,採購價格分配 尚未完成。
截至2023年6月30日,收購對價的收購日期公允價值的初步估計和收購價格分配的初步估計已得到確認,不需要測算期調整,並被視為最終估計。收購日期 購買對價要素的公允價值是採用市場法估計的,對於繼任者普通股的公允價值,採用1級投入(可觀察投入) ,對於歸屬於繼任權證和期權的公允價值,採用3級投入(不可觀察投入)。根據業務合併協議,收購方有責任取代營運公司現有的 認股權證及期權。因此,有必要在購買對價(合併前服務的公允價值)和合並後服務的補償之間分配 替代權證和期權的公允價值。可歸因於合併後服務的替代認股權證和期權的公允價值分別為584 260美元和1 731 237美元。
收購代價於收購日期公允價值的最終估計如下:
購買對價公允價值附表
| 繼承人普通股 | $ | 67,197,300 | ||
| 繼承權證 | 12,190,015 | |||
| 繼任者選項 | 11,864,556 | |||
| 購買代價的公允價值總額 | $ | 91,251,871 |
| F-39 |
收購資產和假設負債的最終收購日期公允價值(見下表)由管理層在專門負責正在進行的研究和開發(“IPR&D”)的第三方估值專家的協助下確定。 IPR&D資產的估計公允價值是使用“收益法”確定的,這是一種估值技術 ,根據市場參與者對資產在其剩餘使用壽命內使用第三級投入將產生的現金流的預期,提供對資產公允價值的估計。估值中使用的一些更重要的假設包括:每項資產每年的估計淨現金流、衡量未來現金流固有風險所需的適當貼現率、每項資產的生命週期、潛在的監管和商業成功風險、淨銷售額的特許權使用費,以及其他 因素。存在與這些因素相關的固有不確定性以及管理層在應用這些因素以得出估計公允價值時的判斷。收購價格超出收購的可識別淨資產估計公允價值的部分記為商譽,管理層認為這是由於集合的勞動力和其他不符合單獨確認資格的無形資產所致。
收購的可識別淨資產估計公允價值附表 記為商譽
| 流動資產,包括現金699 324美元 | $ | 1,093,223 | ||
| 正在進行的研究和開發 | 100,086,329 | |||
| 商譽 | 11,895,033 | |||
| 其他非流動資產 | 64,523 | |||
| 收購的總資產 | 113,139,108 | |||
| 流動負債 | 10,818,204 | |||
| 遞延税項負債 | 11,069,033 | |||
| 承擔的負債總額 | 21,887,237 | |||
| 取得的淨資產 | $ | 91,251,871 |
在完成或放棄研究和開發工作之前,為賬面目的記錄的知識產權和開發 被視為一種無限期無形資產。由於該收購是以股票銷售為結構,因此知識產權和開發和商譽沒有任何税基 ,因此不能就税務目的進行扣減。
減損
雖然管理層沒有發現與其知識產權研發資產相關的任何不利發展,但管理層確實確定,由於公司市值大幅持續下降,公司單一報告單位的公允價值更有可能低於其賬面價值。因此,有必要從2023年6月30日起進行中期減值測試。
本公司的公允價值乃採用收益法釐定。收益法是以未來現金流量的現值為基礎的,這些現金流量是根據財務預測得出的,需要作出重大假設和判斷,包括每項資產每年的估計淨現金流量、衡量未來現金流量固有風險所需的適當貼現率、每項資產的生命週期、潛在的監管和商業成功風險、淨銷售額的特許權使用費以及其他因素。由此產生的估計公允價值與本公司的市值進行了核對。
對賬包括2023年6月30日估計的隱含控制權溢價,該溢價比公司市值高出約100%。
| F-40 |
本公司的商譽和知識產權研發公允價值合計(由本公司的貼現現金流量計算所示) 與本公司的綜合公允價值(如本公司的市值所示)進行比較,以評估本公司計算的合理性。本公司確定投資者將為控制頭寸支付的合理控制溢價包括以下幾個因素:
| ● | 市場 控制溢價。識別可比同行收購交易的近期公開市場信息。可比同行收購交易的選擇受到判斷和不確定性的影響。 | |
| ● | 影響 低公眾持股量和有限的市值交易活動:公司普通股的很大一部分 由集中的投資者擁有。公司普通股的公眾持股量,按百分比計算 由公眾投資者自由交易的普通股除以公司的流通股總數,顯著低於 比公司上市的同行根據公司對第三方市場數據的評估,我們認為 由於公眾持股量較低,交易量有限,存在影響公司股價的內在折扣,因此 影響公司的市值。 |
根據該公司的分析,2023年6月30日,該公司對其1,190萬美元的聲譽進行了全額減損,並記錄了 對其其他無限壽命無形資產(即IPR & D)的6,930萬美元的減損費用。
公司確定,截至2023年9月30日,不存在任何新事件或情況表明IPR & D的公允價值已降至低於其公允價值的情況,並打算自2023年10月1日起進行年度減損測試。
注 5 -應計費用和其他流動負債
截至2023年9月30日和2022年12月31日,應計 費用和其他流動負債包括以下內容:
應計費用和其他流動負債明細表
| 9月30日, | 十二月三十一日, | |||||||
| 2023 | 2022 | |||||||
| L & F里程碑付款責任 | $ | 500,000 | $ | 1,500,000 | ||||
| L & F票據 [1] | - | (351,579 | ) | |||||
| L & F,淨額 | 500,000 | 1,148,421 | ||||||
| 應計薪金 | 894,416 | 584,226 | ||||||
| 其他應計費用 | 31,969 | 214,229 | ||||||
| 應付聯邦所得税 | 129,922 | 106,683 | ||||||
| 獎金應計 | 1,212,359 | - | ||||||
| 註冊延誤責任 [2] | 6,819 | - | ||||||
| 應計費用和其他流動負債總額 | $ | 2,775,485 | $ | 2,053,559 | ||||
| [1] | 請參閲 注8 -“承諾和意外情況”瞭解L & F註釋豁免的詳細信息。 |
| [2] | 請參閲 注9 -“股東永久和臨時權益”,瞭解登記延遲責任的詳細信息。 |
注 6 -衍生品負債
截至2022年1月1日,本公司擁有按發行時公允價值計量的3級衍生債務,與某些可轉換票據的贖回 特徵和認沽期權有關。贖回功能使用貼現現金流和布萊克-斯科爾斯估值技術相結合的方式進行估值。截至2023年9月30日或2022年12月31日,沒有衍生品負債。
在截至2022年9月30日的三個月和九個月內,前身分別記錄了衍生工具負債的公允價值變動虧損228,100美元和420,000美元。
| F-41 |
附註 7--所得税
截至2023年、2023年及2022年9月30日止九個月的税項撥備乃根據適用於各應課税司法管轄區的估計實際税率計算。本公司的税率將根據需要接受管理層的季度審查和修訂。截至2023年9月30日及2022年9月30日止九個月,本公司的實際税率分別為9.44%及0%。 季度税率上升主要是由於其估值津貼的變動所致。截至2022年9月30日,由於歷史和預計虧損,公司 記錄了全額估值備抵。截至2022年12月31日,本公司記錄了一項重大的遞延税項負債,該負債是於2022年12月12日與業務合併相關設立的,這是實現其遞延税項淨資產的未來應納税所得額的來源。於截至2023年9月30日止九個月內,本公司錄得與遞延税項負債相關的資產減值,以減少遞延税項負債。因此,截至2023年9月30日的9個月的有效税率為9.44%,主要是由於對遞延納税淨負債的調整。
附註 8--承付款和或有事項
訴訟、索賠和評估
在正常業務過程中,公司可能會參與法律訴訟、索賠和評估。當評估為可能發生損失且損失金額可合理估計時,公司記錄因此類索賠而產生的或有負債(如果有的話)。
許可證 協議
L & F Research LLC
公司與L研究有限責任公司(“L研究”)訂立經修訂 許可協議(下稱“L許可協議”),自2015年12月15日起生效。根據該協議,L於2023年2月28日授予吾等一項於VAR 200的專利及知識產權及專有技術許可,以治療、抑制或預防人類的腎臟疾病及其症狀,包括局灶性節段性腎小球硬化。本公司與L律師事務所簽訂了《修訂及重述協議》,放棄L律師事務所因未能支付第一筆里程碑付款而終止L許可證協議或任何其他補救措施的權利,直至:(A)2023年3月31日就該等里程碑付款中的1,000,000美元(“放棄A”)及(B)2024年1月31日就500,000美元的里程碑付款(“放棄B”)。 放棄A取決於(I)本公司對某一可轉換票據項下未償還的本金總額351,579美元的寬免。及(Ii)本公司於2023年3月31日或之前向L基金支付648,421美元現金。豁免B視情況而定 本公司於2024年1月31日或之前向L律師事務所支付500,000美元現金,及(Y)自本公司收到發行新股本所得款項淨額至少30,000,000美元之日起計十個營業日。L&F許可證的所有 其他條款仍然有效。
於2023年3月29日,本公司免除了某票據的本金總額351,579美元,並向L基金支付了648,421美元現金,從而滿足了豁免A的條件 L的認沽期權在滿足豁免A的條件後到期,從而將1,880股普通股和331,331美元的臨時股權重新分類為永久股權。
運營 租約
於2019年1月18日,前任簽訂了一份位於佛羅裏達州韋斯頓的約3,500平方英尺辦公空間的租賃協議 ,租期為五年。根據租賃協議,第一年的年度基本租金(不包括前任應承擔的税項和運營成本)約為89,000美元,此後每年上漲約3%,總基本租金約為497,000美元。
繼任者分別就截至2023年9月30日止三個月及九個月的經營租賃確認了38,885美元及116,083美元的使用權資產攤銷,而前身則分別就截至2022年9月30日止三個月及九個月的經營租賃確認租金支出42,225美元及118,519美元。
| F-42 |
本公司的使用權資產和負債摘要如下:
使用權資產及負債一覽表
| 財務名稱、前身和繼任者[固定列表] | 繼任者 | 前身 | ||||||
| 為九人而戰 | 為九人而戰 | |||||||
| 截至的月份 | 截至的月份 | |||||||
| 9月30日, | 9月30日, | |||||||
| 2023 | 2022 | |||||||
| 為計量租賃負債所包括的金額支付的現金: | ||||||||
| 經營活動中使用的經營現金流量 | $ | 74,405 | $ | 67,567 | ||||
| 以租賃義務換取的使用權資產 | ||||||||
| 經營租約 | $ | - | $ | - | ||||
| 加權平均剩餘租期 | ||||||||
| 經營租約 | 0.34年 | 1.34年 | ||||||
| 加權平均貼現率 | ||||||||
| 經營租約 | 6.5 | % | 6.5 | % | ||||
根據這些經營租賃協議,未來 最低付款額如下:
租賃項下未來最低付款計劃
| 金額 | ||||
| 2023年10月1日至2023年12月31日 | $ | 34,822 | ||
| 減去:代表推定利息的金額 | (472 | ) | ||
| 總計 | $ | 34,349 | ||
附註 9--股東的永久和臨時股權
普通股 股票
2023年6月5日,本公司以私募方式向某些投資者(包括本公司保薦人的某些成員)發行了86,976股普通股,價值120萬美元,以換取該等投資者持有的總計56,507股普通股作為該等投資者所持本公司所有證券的鎖定期延長至2023年7月31日。已發行普通股的公允價值1,156,778美元在截至2023年9月30日的9個月的營業報表中記錄在一般和行政費用中。
在截至2023年9月30日的9個月內,本公司與兩家供應商簽訂了投資者營銷協議,其中本公司 發行了總計14,571股普通股和現金以換取營銷服務 。普通股的公允價值605,200美元被確定為預付費用,公司正在根據合同條款確認這筆費用。
| F-43 |
股權 產品
於2023年4月28日,本公司完成發售314,729股普通股及認股權證,以1,100萬美元的總收益 購買314,729股普通股(“登記發售”)。 每股普通股連同一份五年期認股權證一併出售,認股權證可於發行時按每股35.00美元的行使價購買一股普通股。 本公司決定認股權證應按股權分類,主要是因為該認股權證與本公司本身的股票掛鈎,並符合股權分類的要求。因此,由於普通股和權證都是按股權分類的, 沒有必要將收益或發行成本分配給各自的證券。總髮行成本為1,184,482美元,包括配售費用440,620美元,法律費用455,332美元,與此次發行相關的會計和專業服務成本259,774美元,以及其他成本28,756美元。
於2023年7月26日,本公司完成公開發售93,030股普通股、預資金權證(“預資金權證”),以購買270,606股普通股及普通權證(“2023年7月認股權證”),以每股5.78美元的合併公開發行價購買363,636股普通股,總收益210萬美元(“2023年7月發售”)。 預資金權證可即時行使,可隨時行使,直至所有預資資權證全部行使為止。 ,行權價為每股0.0035美元。2023年7月的認股權證可立即行使,行使期為五年 ,行使價為每股5.78美元。本公司決定這兩份認股權證應按股權分類,主要是因為它們與本公司本身的股票掛鈎,並且符合股權分類的要求 。因此,由於普通股和兩種權證都是按股權分類的,因此沒有必要將收益或發行成本分配給各自的證券。總髮行成本為523,115美元,包括125,943美元的配售費用、236,091美元的法律費用、87,037美元的會計和專業服務成本 、26,744美元的其他成本以及與原始認股權證相比的47,300美元的增額認股權證公允價值(見下文認股權證)。
贖回A系列優先股
在2023年4月28日左右,註冊發行的現金收益1,050萬美元用於贖回8,400股A系列優先股。優先股清償損失的會計處理方式與對優先股支付股息的處理方式類似。清償損失按(A)轉讓給A系列優先股持有人的1,050萬美元現金的公允價值(這也解決了公司支付溢價和有效性失敗付款的義務)與(B)A系列優先股的380萬美元賬面淨額之間的差額計算。因此,贖回導致在計算公司每股普通股虧損時確認670萬美元的視為股息 。由於公司有累計虧損,與股息相關的借方和貸方都是額外的實收資本,因此不存在資產負債表效應。
於2023年8月3日,本公司與一名投資者訂立贖回協議併發放股份,導致本公司於2023年8月4日贖回A系列剩餘200股可轉換優先股及認股權證中的150股,按行使價每股70.00美元購買2,464股普通股,現金支付230,000美元。 本公司於截至2023年9月30日的三個月內確認了84,315美元的股息,這是與贖回相關的會計清償所致。
觸發下一輪撥備
作為登記發行的結果,(A)A系列認股權證的行權價以每股402.50美元的行權價購買24,671股普通股, 在原始管道融資中向參與者發行的行權證的行權價重置為每股70美元的底價,同時可以行使141,861股普通股(這導致 確認了140萬美元的視為股息);(B)A系列優先股其餘235股的原始轉換價格重置為每股普通股350.00美元的下限 轉換價格為每股普通股70.00美元(這導致 確認了37,000美元的股息);以及(C)與企業合併有關而發行的5,062股B系列優先股的原始轉換價格重置為每股普通股245.00美元的底價(這導致 確認了100,000美元的視為股息)。
| F-44 |
轉換A系列優先股
在觸發下一輪條款後,A系列優先股35股的持有者以每股70.00美元的新轉換價格將 轉換為500股普通股。
臨時股權
關於2023年3月29日臨時股本轉為永久股本的討論,見 附註8--“承付款和或有事項”。
基於股票的薪酬
在截至2023年9月30日的三個月中,繼任者記錄了243,045美元的基於股票的薪酬支出(其中,(38,224美元)包括在研發中,281,269美元包括在一般和行政費用中),與向員工和顧問發放的期權有關。在截至2022年9月30日的三個月裏,前身記錄的基於股票的薪酬支出為494,022美元(其中67,608美元包括在研發中,426,414美元包括在一般和行政費用中),與向員工和顧問發放的期權有關。
在截至2023年9月30日的9個月中,繼任者記錄的股票薪酬支出為896,249美元(其中117,320美元包括在研發中,778,929美元包括在一般和行政費用中),與向員工和顧問發放的期權有關。在截至2022年9月30日的9個月中,前身記錄的基於股票的薪酬支出為3,131,708美元(其中619,363美元包括在研發中,2,512,345美元包括在一般和行政費用中),與向員工和顧問發放的期權有關。截至2023年9月30日,有1,324,176美元未確認的基於股票的薪酬 費用,公司預計將在1.7年的加權平均期間確認這筆費用。
股票 期權
2023年1月27日,本公司根據納斯達克上市規則 2022年綜合股權激勵計劃(“2022計劃”)第5635(C)(4)條,向新任命的首席醫療官 和醫務部高級副總裁授予為期十年的 購股權,購買2,858股後續普通股,授予日合計價值184,426美元,作為進入本公司工作的激勵。股票期權在三年內每年授予,行權價為每股73.85美元。
2023年3月10日,公司根據2022年計劃,授予公司員工購買372股後續普通股的為期10年的股票期權 。這些股票期權的授予日總價值為23,770美元,在三年內每年授予,行權價為每股79.10美元。在372股中,有143股是向公司一名高管的兒子發行的。
2023年5月24日,公司根據2022年計劃向公司員工和董事授予了為期十年的股票期權,購買了41,523股後續普通股。股票期權的授予日總價值為555,004美元,其中499,660美元在三年內每年授予,55,344美元立即授予,行使價 為每股15.40美元。
在截至2023年9月30日和2022年9月30日的三個月和九個月期間授予的股票期權的授予日期公允價值是使用布萊克·斯科爾斯方法確定的,並使用了以下假設:
已授予的股票期權日程表
| 繼任者 | 前身 | 繼任者 | 前身 | |||||||||||||
| 對於三個人來説 | 對於三個人來説 | 為九人而戰 | 為九人而戰 | |||||||||||||
| 截至的月份 | 截至的月份 | 截至的月份 | 截至的月份 | |||||||||||||
| 9月30日, | 9月30日, | 9月30日, | 9月30日, | |||||||||||||
| 2023 | 2022 | 2023 | 2022 | |||||||||||||
| 授予日期普通股的公允價值 | 不適用 | 不適用 | $ | 15.26 - $78.05 | $ | 2.27 - $3.00 | ||||||||||
| 無風險利率 | 不適用 | 不適用 | 3.53% - 4.27 | % | 1.68% - 3.01 | % | ||||||||||
| 預期期限(年) | 不適用 | 不適用 | 6.00 | 3.53 - 6.00 | ||||||||||||
| 預期波動率 | 不適用 | 不適用 | 120% - 123 | % | 111% - 119 | % | ||||||||||
| 預期股息 | 不適用 | 不適用 | 0.00 | % | 0.00 | % | ||||||||||
| F-45 |
截至2023年9月30日止九個月的期權活動摘要如下:
股票期權活動時間表
| 加權 | |||||||||||||||
| 加權 | 平均值 | ||||||||||||||
| 平均值 | 剩餘 | 集料 | |||||||||||||
| 數量 | 鍛鍊 | 生命 | 固有的 | ||||||||||||
| 選項 | 價格 | 以年為單位 | 價值 | ||||||||||||
| 未償還,2023年1月1日 | 56,999 | $ | 366.29 | ||||||||||||
| 授與 | 44,753 | 19.52 | |||||||||||||
| 已鍛鍊 | - | - | |||||||||||||
| 被沒收 | - | - | |||||||||||||
| 未完成,2023年9月30日 | 101,752 | $ | 220.65 | 6.6 | $ | - | |||||||||
| 可行使,2023年9月30日 | 56,284 | $ | 333.65 | 5.2 | $ | - | |||||||||
下表列出了截至2023年9月30日與股票期權相關的信息:
與股票期權相關的信息一覽表
| 未完成的期權 | 可行使的期權 | |||||||||||||
| 加權 | ||||||||||||||
| 傑出的 | 平均值 | 可操練 | ||||||||||||
| 鍛鍊 | 數量 | 餘生 | 數量 | |||||||||||
| 價格 | 選項 | 以年為單位 | 選項 | |||||||||||
| $ | 15.25 | 41,523 | 10 | 4,286 | ||||||||||
| $ | 73.85 | 2,858 | - | - | ||||||||||
| $ | 79.10 | 372 | - | - | ||||||||||
| $ | 176.05 | 18,952 | 2.3 | 18,952 | ||||||||||
| $ | 396.55 | 351 | 8.8 | 351 | ||||||||||
| $ | 405.30 | 20,819 | 5.5 | 20,819 | ||||||||||
| $ | 572.60 | 16,877 | 7.7 | 11,876 | ||||||||||
| 101,752 | 5.2 | 56,284 | ||||||||||||
| F-46 |
股票 認股權證
2023年7月26日,關於2023年7月的發行(見上文股權發行),本公司將向三名投資者購買39,373股普通股的若干 認股權證的行使價從每股35.00美元修訂為5.78美元,到期日從2028年4月28日修訂為2028年7月28日。與原始認股權證相比,經修改的權證的公允價值增加47,300美元,確認為2023年7月發行的額外發行成本。
2023年8月2日、8月8日和9月8日,2023年8月2日、8月8日和9月8日,一名發行股票的投資者行使了預融資權證,以每股0.0035美元的行使價購買了270,607股普通股,總收益為947美元。
在2023年9月13日至2023年9月18日期間,本公司啟動了一項有限時間計劃,在權證持有人的選擇下, 將允許他們以每股4.75美元的降價行使2023年7月的權證,他們還將獲得 新的5.5年權證,以每股4.75美元的行權價購買同等數量的 普通股。新認股權證在前六個月內不可行使 。根據該計劃,2023年9月14日,以966,400美元的總收益減去208,702美元的總髮行成本,行使了總計203,464股普通股的認股權證。 發行成本包括配售代理費57,980美元, 法律費用16,131美元, 和權證修改成本134,591美元。 由於修改是短期激勵,因此只對根據該計劃實際執行的權證進行修改會計處理。本公司確認經修訂的權證及增發的權證較原來的權證於修改日期增加134,591美元,作為行使認股權證的發行成本。
在截至2023年9月30日和2022年9月30日的三個月和九個月期間發行的認股權證的發行日期公允價值是使用布萊克·斯科爾斯方法確定的,並使用了以下假設:
已授出認股權證公允價值附表{br
| 繼任者 | 前身 | 繼任者 | 前身 | |||||||||||||
| 對於三個人來説 | 對於三個人來説 | 為九人而戰 | 為九人而戰 | |||||||||||||
| 截至的月份 | 截至的月份 | 截至 | 截至 | |||||||||||||
| 2023年9月30日 | 2022年9月30日 | 2023年9月30日 | 2022年9月30日 | |||||||||||||
| 授予日期普通股的公允價值 | $ | 4.90 - $5.95 | 不適用 | $4.90 - $35.00 | 不適用 | |||||||||||
| 無風險利率 | 4.09% - 4.42 | % | 不適用 | 3.51% - 4.42 | % | 不適用 | ||||||||||
| 預期期限(年) | 4.9-5.5年 | 不適用 | 5年 | 不適用 | ||||||||||||
| 預期波動率 | 121 % - 123 | % | 不適用 | 121% - 123 | % | 不適用 | ||||||||||
| 預期股息 | 不適用 | 不適用 | 不適用 | 不適用 |
| F-47 |
截至2023年9月30日止九個月的認購證活動摘要如下:
權證活動摘要
| 加權 | ||||||||||||||||
| 加權 | 平均值 | |||||||||||||||
| 平均值 | 剩餘 | 集料 | ||||||||||||||
| 數量 | 鍛鍊 | 生命 | 固有的 | |||||||||||||
| 認股權證 | 價格 | 以年為單位 | 價值 | |||||||||||||
| 未償還,2023年1月1日 | 246,594 | $ | 376.11 | |||||||||||||
| 已發佈 | 1,152,467 | 13.58 | ||||||||||||||
| 已鍛鍊 | (474,071 | ) | 5.33 | |||||||||||||
| 被沒收 | (2,796 | ) | 109.69 | |||||||||||||
| 重新定價—舊 [1] | (24,672 | ) | 402.50 | |||||||||||||
| 重新定價—新 [1] | 141,868 | 70.00 | ||||||||||||||
| 重新定價—舊 [2] | (39,372 | ) | 35.00 | |||||||||||||
| 重新定價—新 [2] | 39,372 | 5.78 | ||||||||||||||
| 重新定價—舊 [3] | (203,464 | ) | 5.78 | |||||||||||||
| 重新定價—新 [3] | 203,464 | 4.75 | ||||||||||||||
| 未完成,2023年9月30日 | 1,039,384 | $ | 100.25 | 4.6 | $ | - | ||||||||||
| 可行使,2023年9月30日 | 832,690 | $ | 123.37 | 4.4 | $ | - | ||||||||||
| [1] | 逮捕令 代表將購買24,671股普通股的PIPE令的行使價重置至底價 每股70.00美元。 |
| [2] | 權證 代表將2023年4月28日發行的認股權證購買39,371股普通股的行使價重新設定為每股5.79美元的價格。 |
| [3] | 權證 代表將2023年7月26日發行的某些認股權證購買203,463股普通股的行使價重新設定為每股4.75美元。 |
| F-48 |
下表顯示了截至2023年9月30日的認股權證相關信息:
認股權證相關資料附表
| 未清償認股權證 | 可行使的認股權證 | |||||||||||||
| 傑出的 | 加權平均 | 可操練 | ||||||||||||
| 鍛鍊 | 數量 | 餘生 | 數量 | |||||||||||
| 價格 | 認股權證 | 以年為單位 | 認股權證 | |||||||||||
| $ | 4.75 | 203,464 | 不適用 | - | ||||||||||
| $ | 5.78 | 199,555 | 4.8 | 199,555 | ||||||||||
| $ | 35.00 | 275,378 | 4.6 | 275,378 | ||||||||||
| $ | 70.00 | 139,403 | 4.2 | 139,403 | ||||||||||
| $ | 176.05 | 2,994 | 1.3 | 998 | ||||||||||
| $ | 241.50 | 36,363 | 4.2 | 36,363 | ||||||||||
| $ | 402.50 | 173,306 | 4.2 | 173,306 | ||||||||||
| $ | 405.30 | 8,921 | 0.2 | 8,921 | ||||||||||
| 1,039,384 | 4.4 | 833,924 | ||||||||||||
有效性 失敗
在業務合併方面,根據日期為2022年7月20日的認購協議(統稱為“管道認購協議”),本公司根據日期為2022年7月20日的認購協議,發行了8,635股A系列可換股優先股 (“管道股份”)及普通股認股權證(每股為“管道認購權證”),按每股35,000美元的收購價及認股權證購買24,671股普通股,總認購價為8,635,000美元(“管道投資”)。於2023年2月20日左右,本公司未能讓美國證券交易委員會在PIPE證券購買協議(“PIPE證券購買協議”)規定的時間內宣佈涵蓋 私募股權投資(“PIPE”)應註冊證券的註冊聲明生效(“生效失敗”)。SPA使PIPE投資者有權在有效性失敗之日收到相當於每個投資者購買價格1.5% 的註冊延遲付款(“註冊延遲付款”),並在有效性 失敗持續後每隔30天獲得一次註冊延遲付款。未能及時支付註冊延遲付款將導致每月按 2.0% 的利率計息。2023年4月28日,登記發行所得資金用於贖回幾乎所有的PIPE股票。(請參閲上文 贖回A系列優先股。)截至本文件的提交日期,公司預計在2023年9月30日之後、在修復生效失敗之前,必須額外支付總計約6819美元的註冊延遲付款
注 10-後續事件
2023年9月8日,公司董事會批准了經股東於2023年10月31日批准的2022年綜合股權激勵計劃(“A&R計劃”)。重述的計劃將公司預留供發行的普通股數量增加114,286股,達到155,803股。
2023年12月4日,本公司按35股1股的比例對其普通股進行了 股反向拆分(“反向拆分”)。在反向拆分生效後,每35股已發行普通股重新分類併合併為一股普通股。此外,因行使本公司的股權獎勵、可轉換證券及認股權證而可發行的普通股股份按比例減少,而相應的行使價格按比例增加。沒有因反向拆分而發行任何零碎股份。因此,此等財務報表及其附註所呈列的所有後繼期的所有股份及每股金額已追溯調整(如適用),以反映各項未償還股權獎勵、可轉換證券及認股權證的反向拆分及 行使價調整,猶如交易已於呈列的最早期間開始時發生。
自2023年11月30日起,公司修訂了公司註冊證書,將公司股本的法定股數從111,000,000股增加到251,000,000股,普通股的法定股數從110,000,000股增加到250,000,000股。
| F-49 |
400,000股普通股
購買最多3600,000股普通股的預融資認股權證
A系列普通股認股權證最多購買400萬股普通股
B系列普通股認股權證將購買最多400萬股普通股
800萬股普通股作為普通權證的基礎
3,600,000股普通股 預籌資金認股權證

招股説明書
Sole 安置代理
AGP。
2023年12月6日