

踏上消滅癌症的旅程 Erasca 2024 年 1 月企業演示附錄 99.1

我們提醒您,本演示文稿包含前瞻性陳述。除本演示文稿中包含的歷史事實陳述以外的所有陳述,包括有關我們未來的經營業績和財務狀況、業務戰略、研發計劃、預期時間(包括啟動時間和數據讀出時間)、成本、我們正在進行和計劃中的候選產品的臨牀前研究和臨牀試驗的設計和實施、我們當前或未來與第三方的安排的潛在收益、我們成功的時機和可能性的陳述計劃和目標、取消某些計劃優先順序的影響以及預期產品開發工作的未來結果均為前瞻性陳述。在某些情況下,您可以通過諸如 “可能”、“將”、“應該”、“預期”、“計劃”、“預期”、“可能”、“打算”、“目標”、“項目”、“考慮”、“相信”、“估計”、“預測”、“潛在” 或 “繼續” 等術語來識別前瞻性陳述,或者這些術語或其他類似表述的否定值。我們不應將納入前瞻性陳述視為我們對任何計劃將實現的陳述。由於我們業務固有的風險和不確定性,實際結果可能與本演示文稿中列出的結果有所不同,包括但不限於:我們發現和開發候選產品的方法以關閉RAS/MAPK途徑為唯一重點,這是一種新穎且未經證實的方法;我們只有四個候選產品處於臨牀開發階段,所有其他開發工作都處於臨牀前或開發階段;對合並階段1和階段的分析 2 naporafenib + trametinib 數據涵蓋兩項臨牀具有不同設計和納入標準的試驗,無法直接比較,因此可能不是療效數據的可靠指標;臨牀試驗的初步結果不一定代表最終結果,在對數據進行更全面的審查和更多的患者數據之後,隨着患者入組的繼續,一項或多項臨牀結果可能會發生重大變化,包括後續評估後UpR治療可能最終無法導致CPR治療的風險;我們尚未完成納波拉非尼的任何臨牀試驗都依賴於諾華在先前開展的臨牀試驗中生成的數據;我們計劃的SEACRAFT試驗可能不支持納波拉非尼的註冊;我們對哪些項目可能更有可能成功的假設可能不準確,我們可能會花費有限的資源來尋找特定的候選產品和/或適應症,而無法利用具有更大開發或商業潛力的候選產品或適應症;開學、入學可能出現延遲完成臨牀試驗和臨牀前研究;我們在製造、研究、臨牀前和臨牀測試方面依賴第三方;我們的候選產品出現意想不到的不良副作用或療效不足,可能會限制其開發、監管批准和/或商業化,或可能導致召回或產品責任索賠;臨牀前研究或臨牀試驗的不利結果;臨牀前研究或早期臨牀試驗的結果不一定能預測未來的結果;無法從我們當前的許可、收購或合作、任何未來的許可、收購或合作中獲得任何好處,也無法履行此類安排下的義務的能力;我們對哪些項目可能更有可能成功的假設可能不準確,我們可能會花費有限的資源來尋找特定的候選產品和/或適應症,而無法利用具有更大發展或商業潛力的候選產品或適應症;美國的監管發展各州和國外;美國食品和藥物管理局或歐洲衞生當局的後續進展可能與迄今為止收到的有關我們的開發計劃和試驗設計的反饋不一致;快速通道指定或孤兒藥指定可能不會加快開發或監管審查或批准程序,也不會增加我們的候選產品獲得上市批准的可能性;我們可能無法實現與孤兒藥指定相關的好處;我們用當前的現金、現金為運營計劃提供資金的能力等價物和2026年上半年的有價證券;以及我們先前向美國證券交易委員會(SEC)提交的文件中描述的其他風險,包括我們在截至2022年12月31日止年度的10-K表年度報告中標題為 “風險因素” 的風險,以及隨後向美國證券交易委員會提交的任何文件。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本文發佈之日,我們沒有義務更新此類陳述以反映在本聲明發布之日之後發生的事件或存在的情況。本警示聲明是根據1995年《私人證券訴訟改革法》的安全港條款作出的,對所有前瞻性陳述進行了全面的限定。本演示文稿還包含獨立方和我們提供的與市場規模和增長相關的估計和其他統計數據,以及有關我們行業的其他數據。這些數據涉及許多假設,提醒您不要過分重視此類估計。此外,對我們未來表現的預測、假設和估計以及我們經營的市場的未來表現必然受到高度的不確定性和風險的影響。這些因素和其他因素可能導致結果與獨立各方和我們在估計中表達的結果存在重大差異。免責聲明:前瞻性陳述和市場數據
我們的名字就是我們的使命:消除癌症中樞神經系統 = 中樞神經系統 1 開始使用 Erasca 療程 2 年後存活且無癌症或沒有癌症進展的患者人數,衡量標準是無病存活率(輔助設置)和無進展存活率(轉移性設置)2 未經審計,截至2023年9月30日,作為一家經驗豐富的全球領先腫瘤公司,願景是有朝一日消滅至少 100,000 名患者的癌症1 領導團隊和擁有連環成功記錄的 SAB 由總經理 Jonathan Lim 和大約 Kevan Shokat 博士創立以RAS為目標的顛覆性想法由RAS/MAPK途徑的領先先驅者組成的團隊在有效規劃和執行全球臨牀試驗方面擁有豐富經驗的行業領先產品組合專注於關閉具有同類首創(FIC)潛力的RAS/MAPK途徑Naporafenib pan-RAFI,以及RAS Q61X實體瘤中nRASM黑色素瘤和FIC潛力的快速通道稱號 ERAS-007 ERKI 具有一流潛力 BraFM CRC ERAS-801,滲透到中樞神經系統的 eGFRI 具有 FIC 潛力 EGFR 驅動的 rgBM 財務狀況良好高質量的投資者基礎和行業知名度3.44億美元的現金、現金等價物和有價證券2;2026年上半年的現金流——Fierce Biotech 2021年 “Fierce 15” 最有前途的生物技術公司之一

SAB包括RAS/MAPK途徑領域的世界領先專家埃拉斯卡聯合創始人。RAS領域的世界專家,率先開發了抑制KRAS G12C(RAS-GDP)和RAS(RAS-GTP)活性狀態的方法的世界ERK專家,研究了幾乎所有已經開發或正在開發的ERK抑制劑,以及針對KRAS、BRAF和MEK突變的靶向療法,全球靶向腫瘤學療法專家,率先開發了幫助推出精準腫瘤學的Gleevec® 革命世界結構藥物設計專家;前Agouron研究主管和基因泰克研究與前負責人早期開發(GreD)全球專家 RAS/MAPK 通路信號傳導和確定可將其關閉的新型聯合療法凱倫·西卓斯基博士,喬治·德米特里,醫學博士邁克爾·瓦尼博士,斯蒂芬·布萊克洛博士,SHP2 的世界專家,他幫助諾華開創了第一種 SHP2 抑制劑,醫學博士 RAS/MAPK 途徑的世界專家,專注於 SHOC2 磷酸酶複合物癌症和 RasPathies 等疾病背景下有效激活通路所需的獨特調節節點 Pablo Rodriguez-Viciana,博士 Kevan肖卡特博士
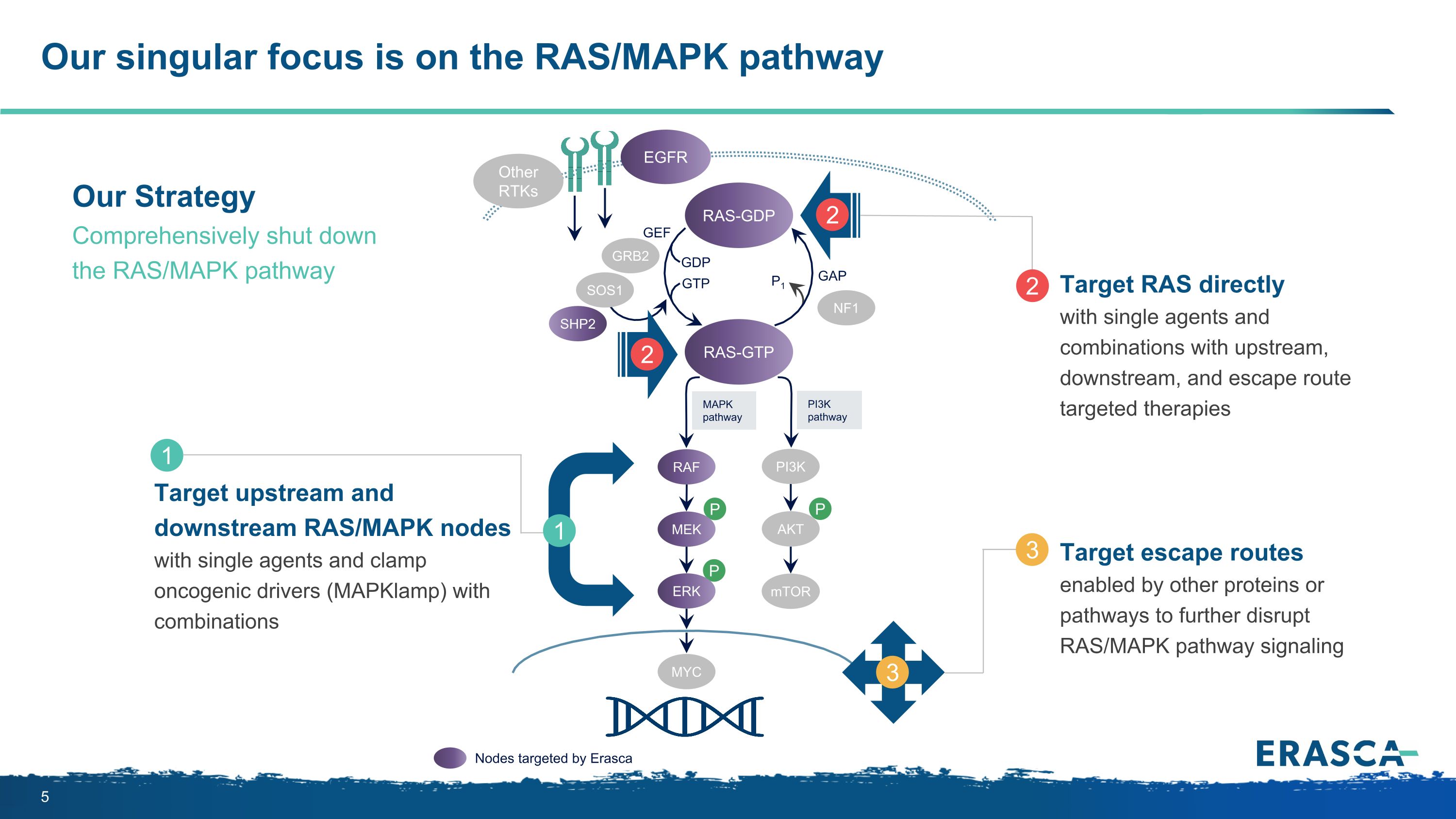
我們的唯一重點是 RAS/MAPK 途徑 P P P MapkPathay pi3KPathay RAS-GTP GRB2 SHP2 GAP GDP GTP GTP P1 NF1 SOS1 RAF MEK PI3K AKT mTOR ERK RAS-GDP EGFR 其他 RAS/MAPK 節點目標上游和下游 RAS/MAPK 節點使用單一藥物和抑制致癌驅動因素 (mapkLamp) 組合 1 1 使用單一藥物直接靶向RAS,與上游、下游和逃脱途徑聯合靶向療法 2 2 2 由其他蛋白質或途徑啟用的靶向逃逸路線,進一步破壞 RAS/MAPK 通路信號 3 3 我們的策略全面關閉 RAS/MAPK 路徑
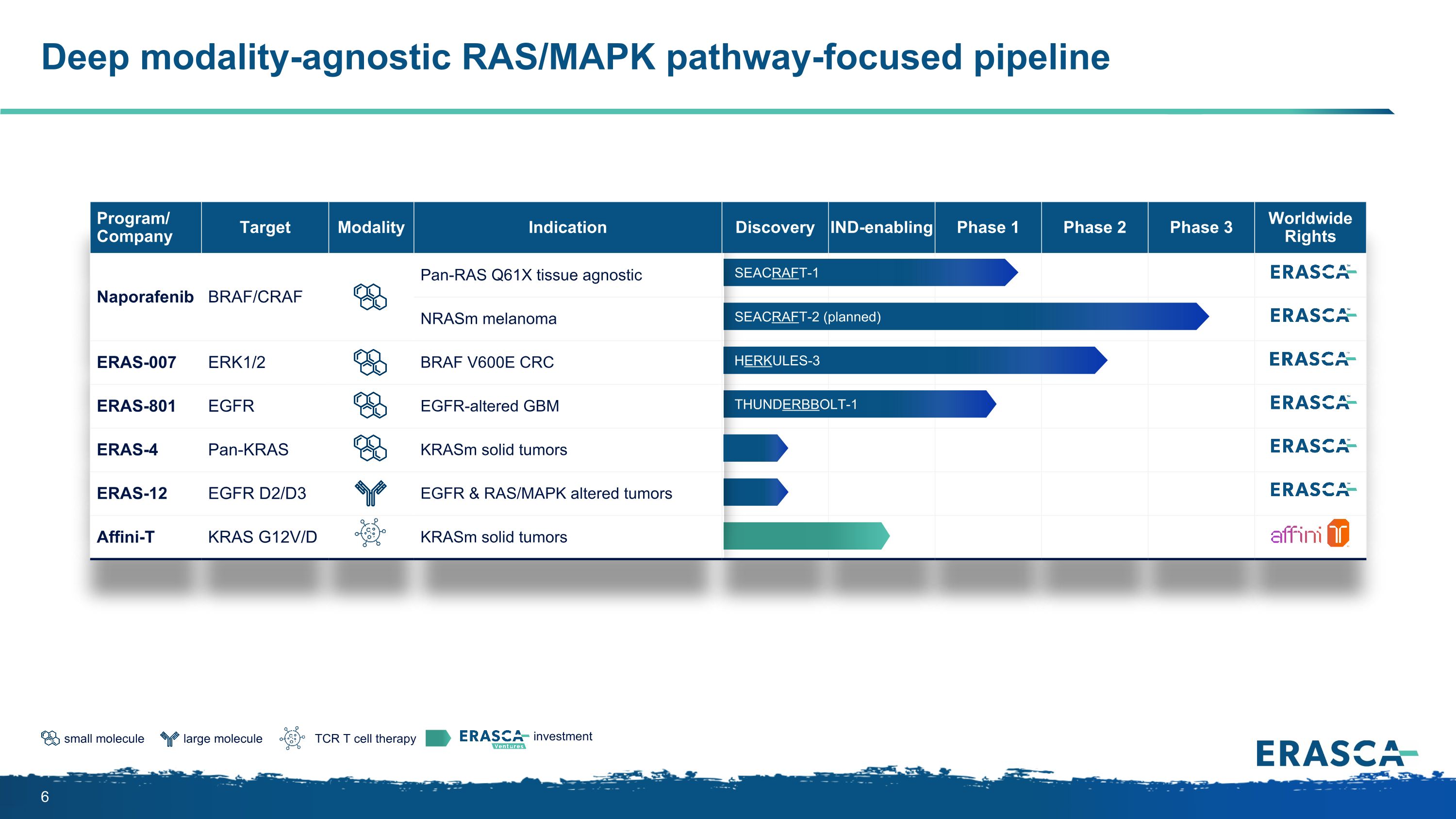
大分子小分子 TCR T 細胞療法投資深度模式無關的 RAS/MAPK 以路徑為重點的管道項目/公司目標模式適應症發現支持 IND 的 1 期第 2 期第 3 期全球版權 Naporafenib BRAF/CRAF pan-RAS Q61X 組織無關型 nRasm 黑色素瘤 ERAS-007 ERK1/2 BRAF V600E CRC ERAS-801 EGFR 表皮生長因子改變的 GBM ERAS-4 pan-KRAS KRASM ERAS-12 實體瘤表皮生長因子 D2/D3 表皮生長因子和 RAS/MAPK 改變的腫瘤 Affini-T KRAS G12V/D KRasm 實體瘤 SEACRAFT-2(計劃中)HERKULES-3 SEACRAFT-1 THUNDERBBOLT-1
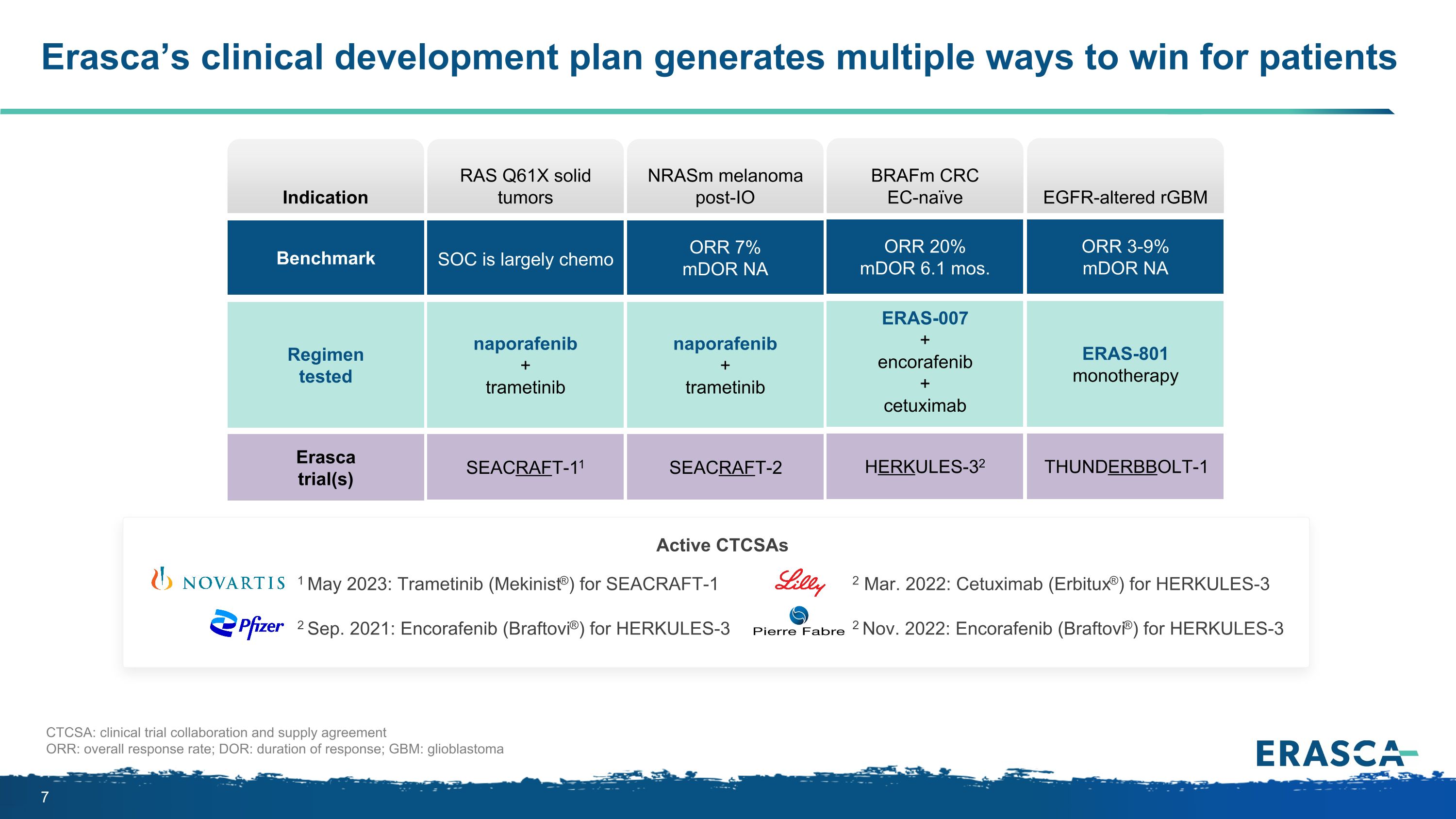
埃拉斯卡的臨牀開發計劃為患者提供了多種獲勝途徑適應症基準方案測試的埃拉斯卡試驗 CTCSA:臨牀試驗合作和供應協議 ORR:總體緩解率;DOR:反應持續時間;GBM:膠質母細胞瘤 HERKULES-32 braFM CRC EC-naive ERAS-007 + encorafenib + 西妥昔單抗 ORR 20% mdOR 6.1 個月。braFM CRC EC-naieve THUNDERBBOLT-1 表皮生長因子改變的 rgBM ERAS-801 單一療法 ORR 3-9% mdor NA 表皮生長因子改變的 rgBM SEACRAFT-11 納波拉非尼 + 曲美替尼 SOC 主要是化療 RAS Q61X 實體瘤 SEACRAFT-2 納波拉非尼 + 曲美替尼 ORR 7% mdor NA nRasm 黑色素瘤 2023 年 5 月 1 日:用於 SEACRAFT-1 Sep2 的曲美替尼(Mekinist®). 2021 年:適用於 HERKULES-3 的安可非尼 (Braftovi®) 於 2022 年 3 月 2 日:適用於 HERKULES-3 的 Cetuximab (Erbitux®):適用於 HERKULES-3 Active ctcSAs 的 Encorafenib (Braftovi®)
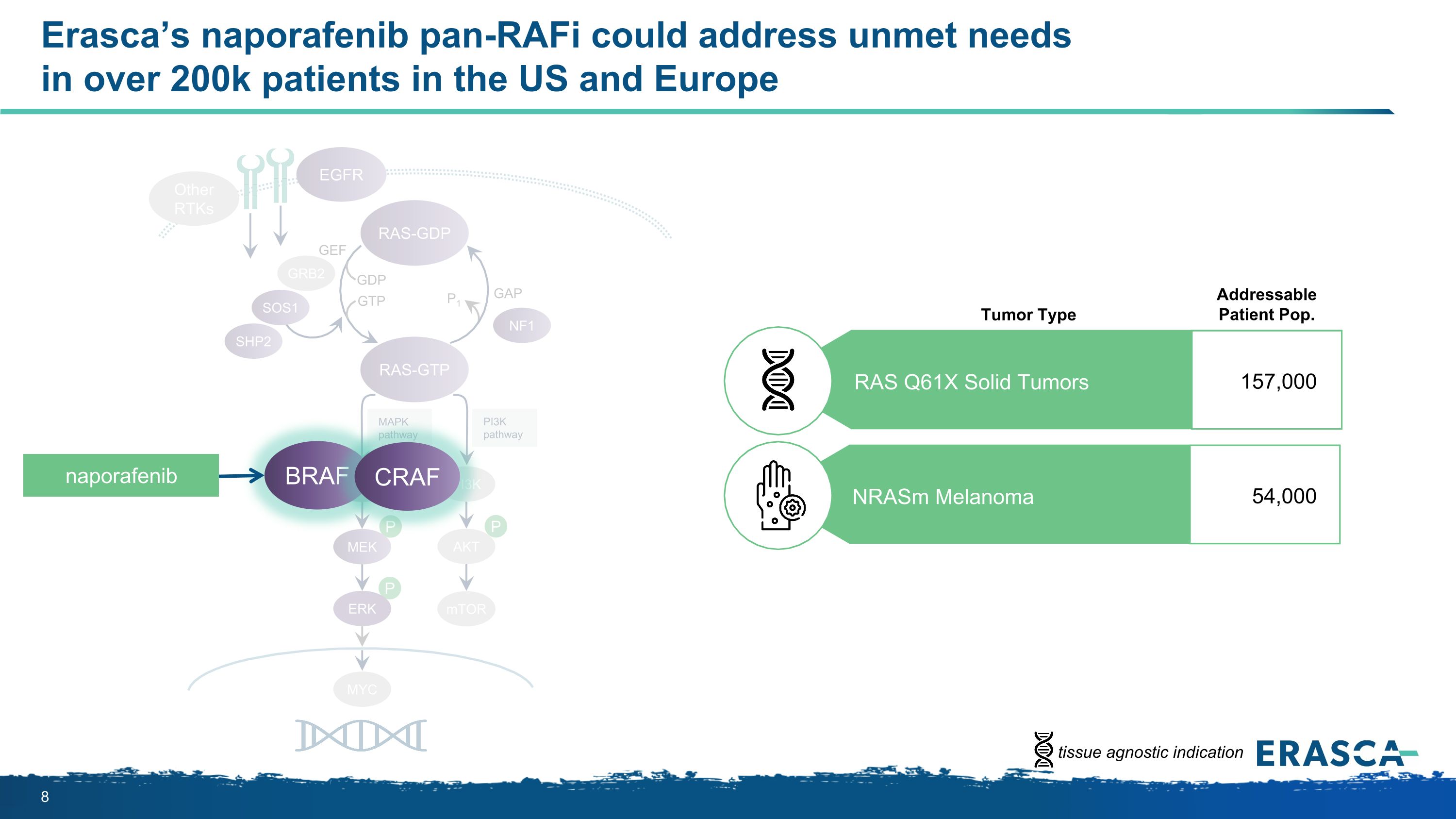
P P P MapkPathway PI3KPathway RAS-GTP GRB2 SHP2 GAP GTP P1 NF1 SOS1 RAF MEK PI3K AKT mTOR RAS-GDP EGFR 其他 RTKs MYC GEF 埃拉斯卡的納波拉非尼泛-RAFI可以解決美國和歐洲超過20萬名患者未滿足的需求 ERK BRAF CRAF naporafenib 可尋址患者 Pop腫瘤類型 RAS Q61X 實體瘤 157,000 nRasm 黑色素瘤 54,000 個組織無關適應症

Naporafenib 是一種有效的選擇性的 BRAF 和 CRAF 抑制劑,具有亞納摩爾 IC50 效力和最先進的 pan-RAFI 在開發中的測定值 (nM) 生化 CRAF IC50 (IC50) 0.1 生化 BRAF IC50 (IC50) 0.2 生化 ARAF 抑制劑 (IC50) 6.4 納波拉非尼對RAF激酶家族生化活性的生化活性 456 種激酶中的納波拉非尼(KinomeScan)來源:摩納哥 K-A、Delach S 等LXH254,一種有效的、選擇性的 BRAF 和 CRAF 節制 ARAF 抑制劑,用於治療 MAPK 驅動的腫瘤。2021PMID:33355204;Ramurthy S、Taft BR 等N-(3-(2-(2-羥乙氧基)-6-嗎啉吡啶-4-基)-4-甲基苯基)-2-(三氟甲基)異煙酰胺的設計和發現,這是一種針對RAS突變癌症的選擇性、有效且耐受性良好的RAF抑制劑:臨牀之路。2020年。PMID:31059256
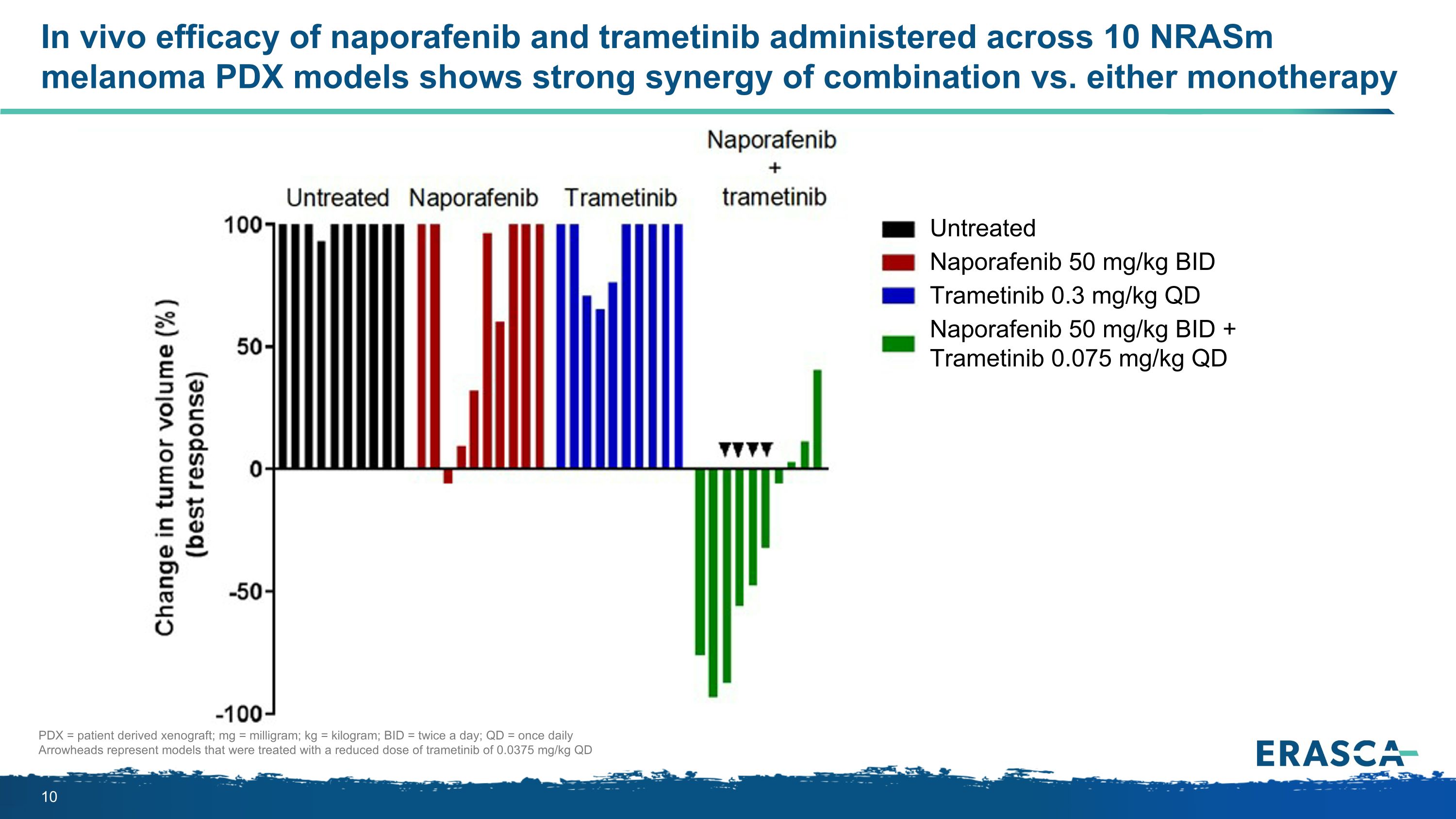
納波非尼和曲美替尼在 10 個 nrASM 黑色素瘤 PDX 模型中給藥的體內療效顯示出聯合療法與任何一種單一療法的強大協同作用未經治療的納波拉非尼 50 mg/kg BID 曲美替尼 0.3 mg/kg QD Naporafenib 50 mg/kg QD PDX = 患者源性異種移植;mg = 毫克;kg = 千克;BID = 每天兩次;QD = 每天一次 Arrowheads 代表使用減量 0.0375 mg/kg QD 的曲美替尼治療的模型
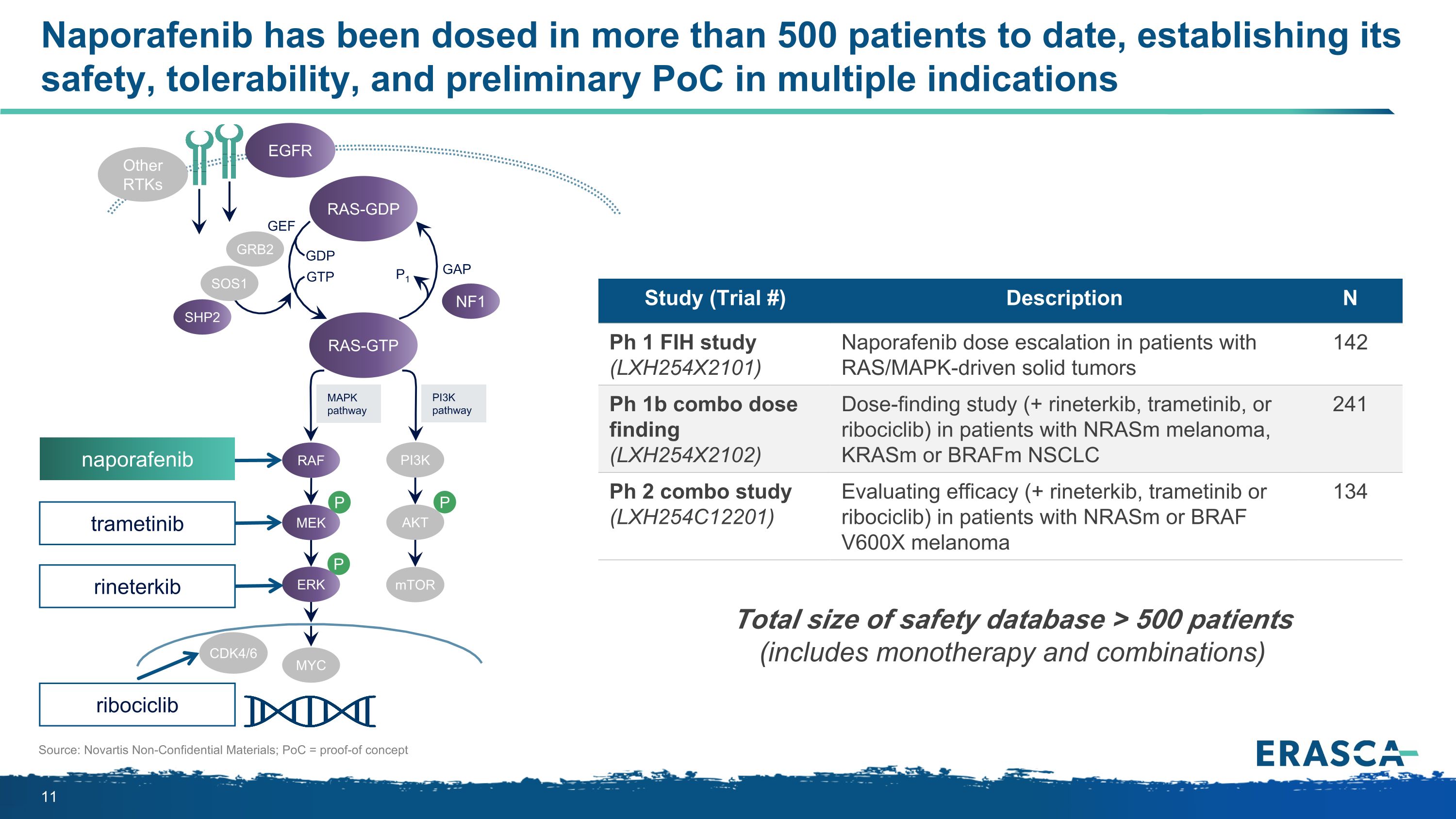
迄今為止,Naporafenib已在500多名患者中服藥,確立了其安全性、耐受性和多種適應症的初步PoC來源:諾華非機密材料;PoC = 概念驗證 P P P MapkPathway PI3KPathway RAS-GTP GRB2 SHP2 GAP GTP GTP P1 NF1 SOS1 RAF MEK PI3K AKT mTOR ERK RAS-GTP GTP GTP GTP P1 NF1 SOS1 RAF MEK PI3K AKT mTOR ERK RAS-GTP GTP GTP GTP P1 NF1 SOS1 RAF MEK KS MYC GEF CDK4/6 研究(試驗 #)描述 N Ph 1 FIH 研究 (LXH254X2101) Ras/MAPK 驅動的實體瘤患者的納波拉非尼劑量增加 142 Ph 1b 組合劑量發現 (LXH254X2102) 劑量發現研究 (+ rineterkib、曲美替尼) 劑量發現研究 (+ rineterkib、trametinib),或 ribociclib)用於 nRasm 黑色素瘤患者,Krasm 或 braFM NSCLC 241 Ph 2 組合研究(LXH254C12201)評估 nrasm 或 BRAF V600X 黑色素瘤患者的療效(+ rineterkib、trametinib 或 ribociclib)134 安全數據庫總規模 > 500 名患者(包括單一療法和組合)曲美替尼納波拉非尼 rineterkib ribociclib

Naporafenib:有可能快速進入市場,並有多種途徑使美國和歐盟每年診斷出的 RAS/MAPK 驅動的腫瘤患者受益 157,000 名在美國和歐盟每年診斷的患者 54,000 名 nrasm 黑色素瘤 RAS Q61X 實體瘤基於高未滿足的需求和監管路徑的一致性獲得全面批准的引人注目的 Ph 1 和 2 POC 數據生成 SEACRAFT-2 納波拉非尼+曲美替尼的第 3 期計劃實施 2024 年上半年啟動基於高度未滿足的需求和組織不可知的方法,有可能獲得快速批准 SEACRAFT-1 第 1b 階段納波拉非尼+曲美替尼計劃在 Q2-Q4 2024 年發佈的數據 POC = 基於SEER數據庫(美國)、ECIS數據庫(ECIS)和AACR GENIE的概念驗證發生率
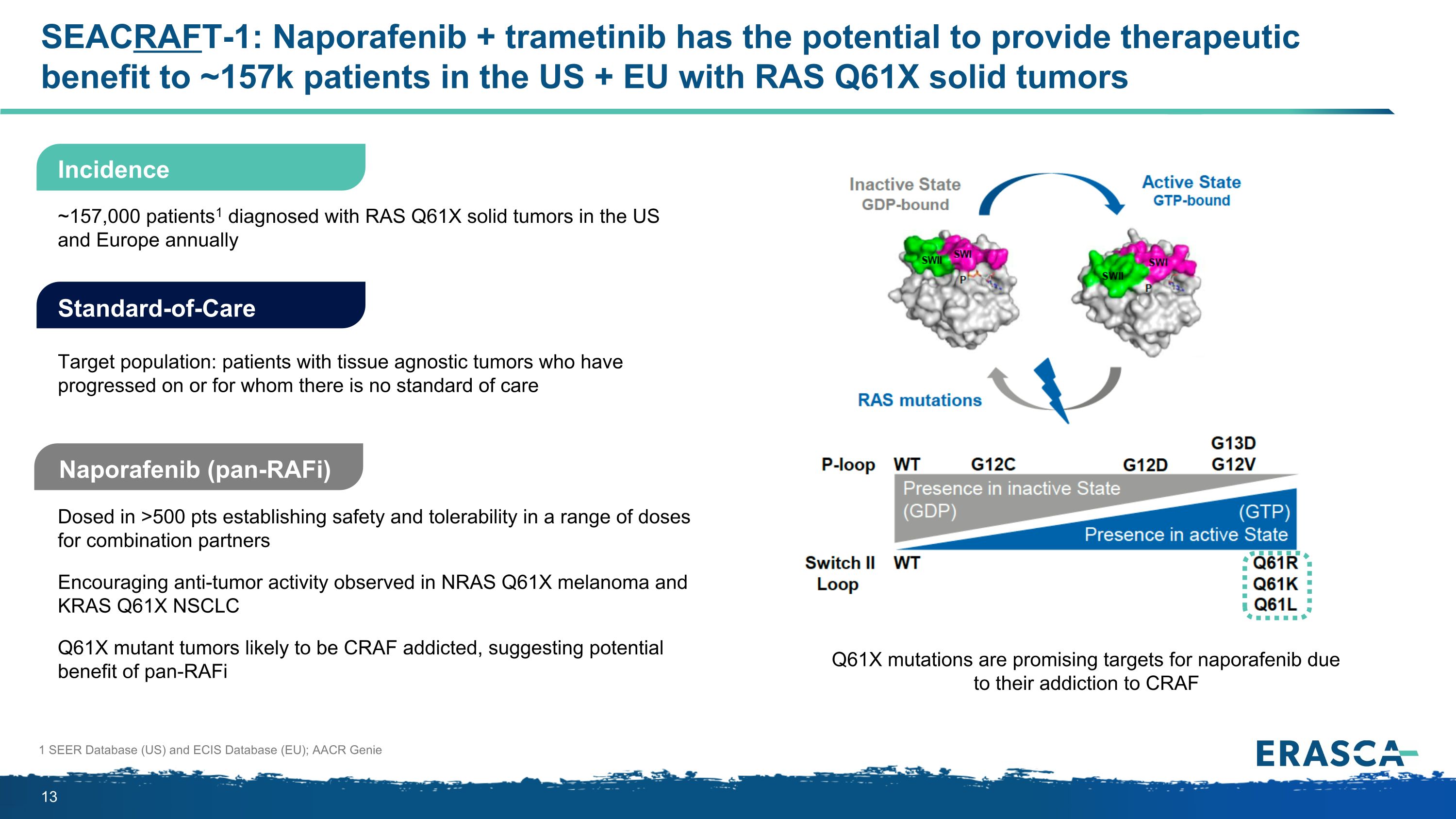
SEACRAFT-1:Naporafenib + trametinib有可能為美國和歐盟的約15.7萬名RAS Q61X實體瘤患者提供治療益處納波拉非尼(pan-RAFI)劑量>500 pts,為組合夥伴建立一系列劑量的安全性和耐受性鼓勵在NRAS Q61X黑色素瘤和KRAS Q61X NSCLC Q61X突變體腫瘤中觀察到抗腫瘤活性可能對CRAF上癮,這表明Pan-RAFI標準護理目標人羣具有潛在益處:已進展或沒有標準的組織不可知性腫瘤患者在美國和歐洲,每年約有15.7萬名患者1被診斷出患有RAS Q61X實體瘤 1 SEER數據庫(美國)和ECIS數據庫(歐盟);AACR精靈發生率Q61X突變因對CRAF成癮而成為納波拉非尼的有希望的靶標
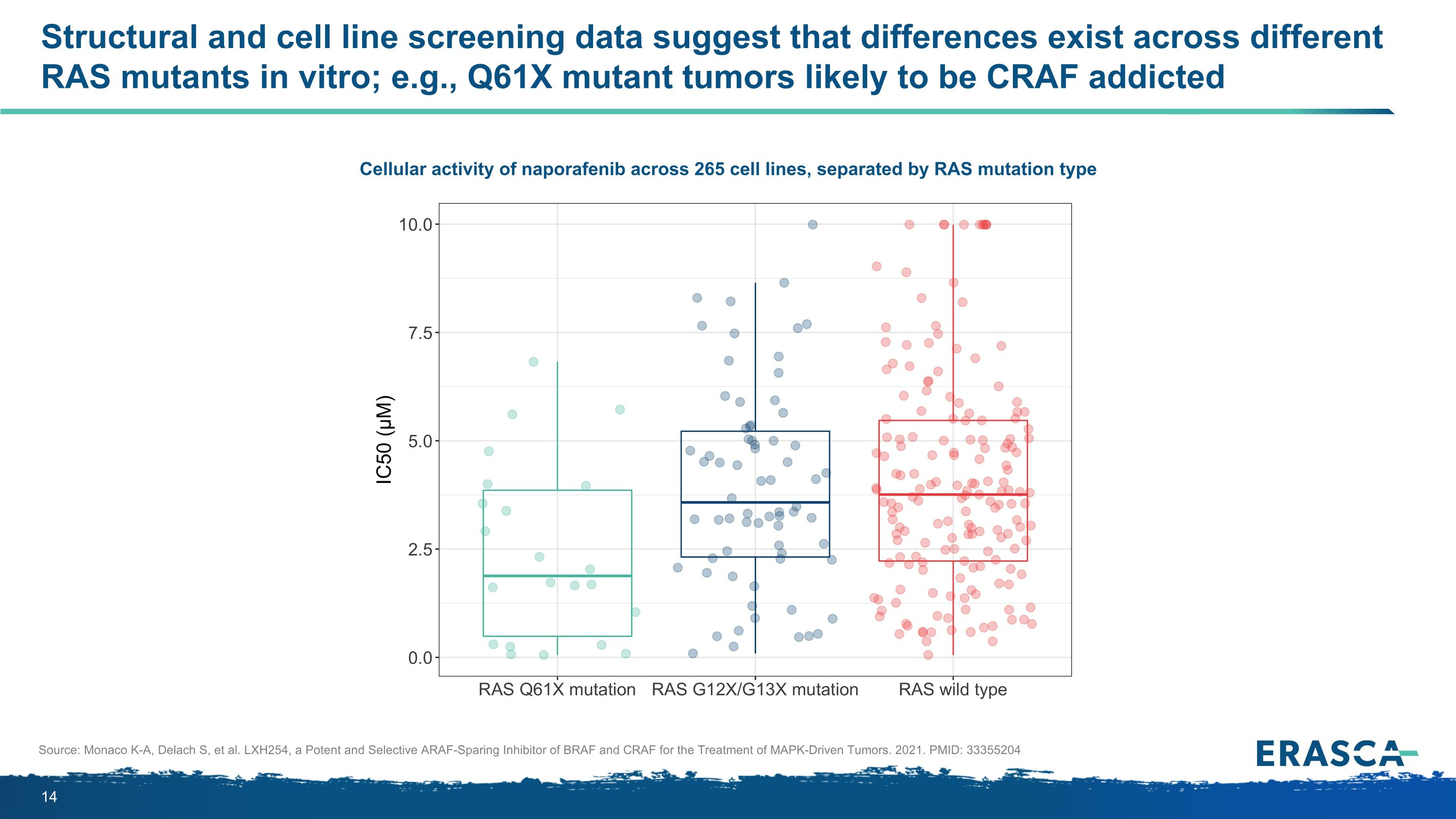
結構和細胞系篩選數據表明,不同的RAS突變體在體外存在差異;例如,Q61X突變體腫瘤可能對CRAF上癮,納波拉非尼在265個細胞系中的細胞活性,按RAS突變類型分開來源:摩納哥K-A、Delach S等LXH254,一種有效的、選擇性的 BRAF 和 CRAF 節制 ARAF 抑制劑,用於治療 MAPK 驅動的腫瘤。2021PMID:33355204
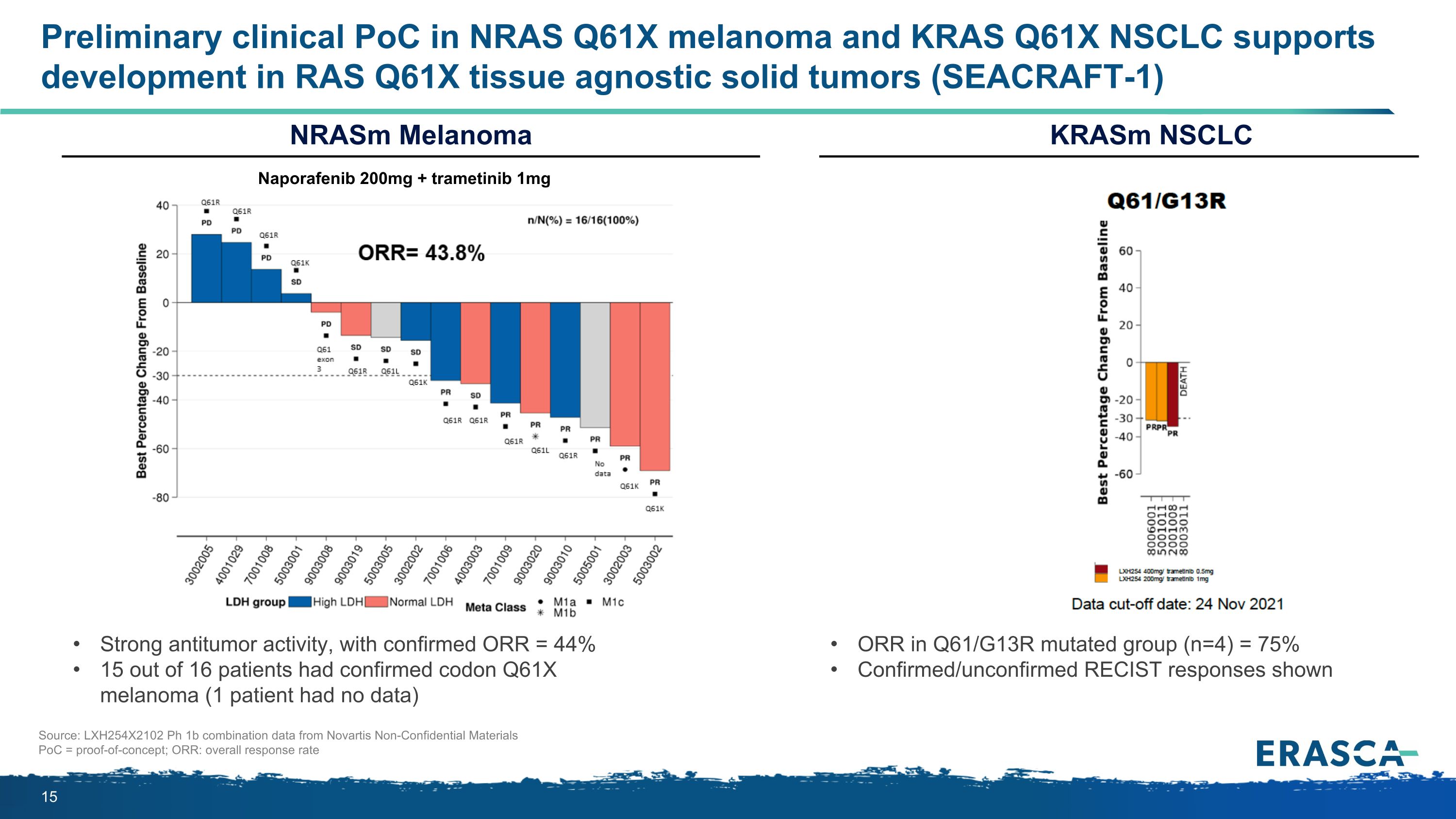
NRAS Q61X 黑色素瘤和 KRAS Q61X NSCLC 的初步臨牀 PoC 支持 RAS Q61X 組織無關實體瘤 (SEACRAFT-1) 的開發具有很強的抗腫瘤活性,經證實的 ORR = 44% 16 名患者中有 15 名已確診密碼子 Q61X 黑色素瘤(1 名患者沒有數據)來源:LXH254X2102 Ph 1b 組合數據來自諾華非機密材料 PoC = 概念驗證;ORR:Q61/G13R 突變組(n=4)中的 krasm NSCLC nrasm 黑色素瘤 ORR 的總體緩解率 = 75% 已確認/未經證實的 RECIST 反應顯示納波拉非尼 200 毫克 + 曲美替尼 1mg
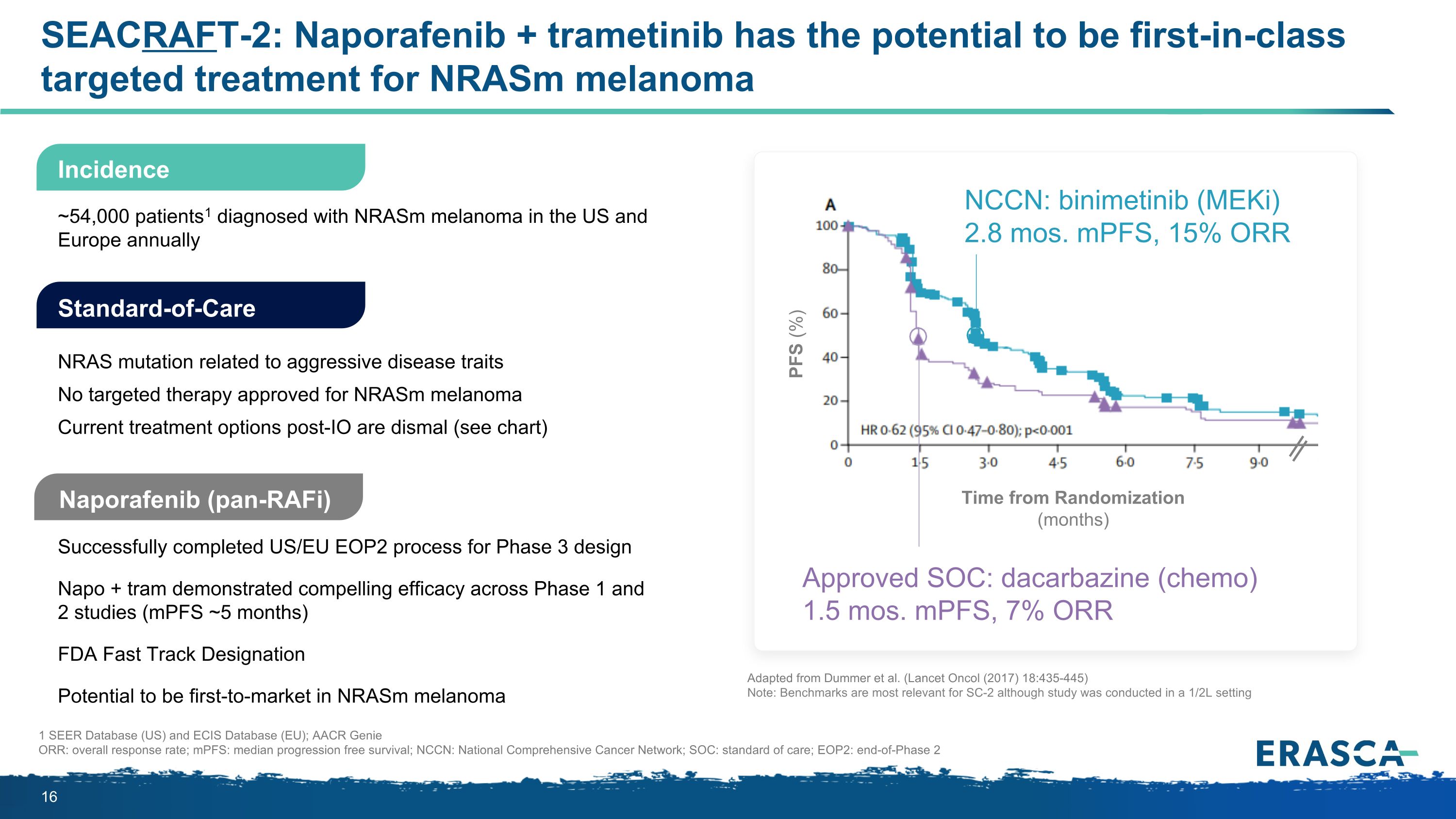
SEACRAFT-2:Naporafenib + trametinib有可能成為nRASM黑色素瘤的首創靶向治療Naporafenib(pan-RAFI)成功完成了美國/歐盟 EOP2 的第 3 期設計流程 Napo + tram 在 1 期和 2 期研究(MPF 約 5 個月)中表現出令人信服的療效 FDA 快速通道認證有可能率先進入市場 nrasm 黑色素瘤護理標準 NRAS 突變相關產品致侵襲性疾病特徵未獲批准用於nRASM黑色素瘤的靶向療法目前的治療方案令人沮喪(見圖表)約有54,000名患者1被確診每年在美國和歐洲出現nRasm黑色素瘤 1 SEER數據庫(美國)和ECIS數據庫(歐盟);AACR Genie ORR:總體緩解率;MPF:無進展存活率中位數;NCCN:全國綜合癌症網絡;SOC:護理標準;EOP2:隨機化療後2階段結束髮病時間(月)PFS(%)批准的SOC:達卡巴嗪(化療)1.5 個月。fS,7% ORR NCCN:比尼美替尼(meKi)2.8 個最大 MPF,15% ORR 改編自 Dummer 等人。(Lancet Oncol(2017)18:435-445)注意:儘管研究是在1/2L的環境中進行的,但基準與SC-2最相關
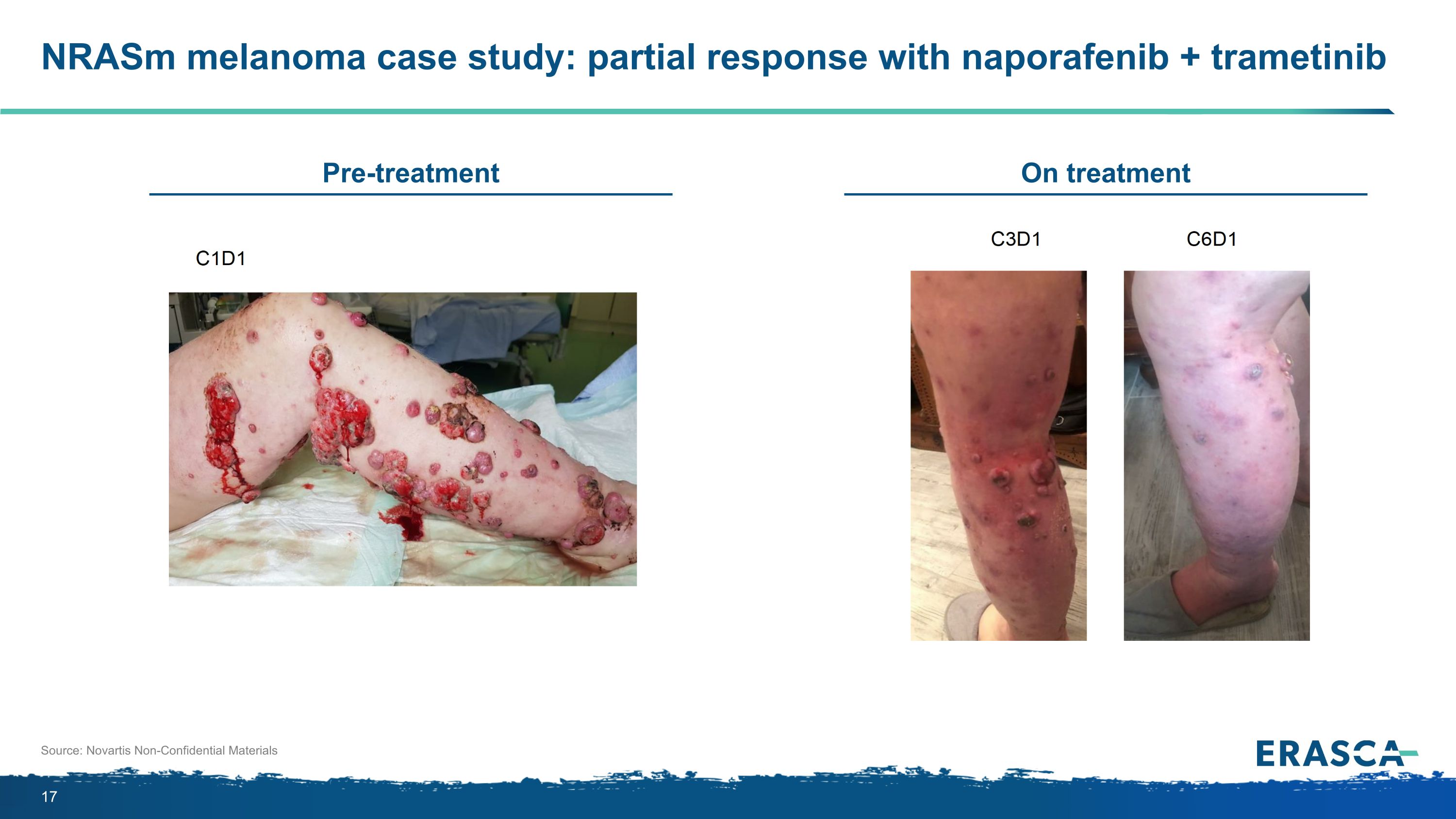
nrASM 黑色素瘤案例研究:使用納泊非尼+曲美替尼的部分緩解來源:諾華非機密材料關於治療預處理
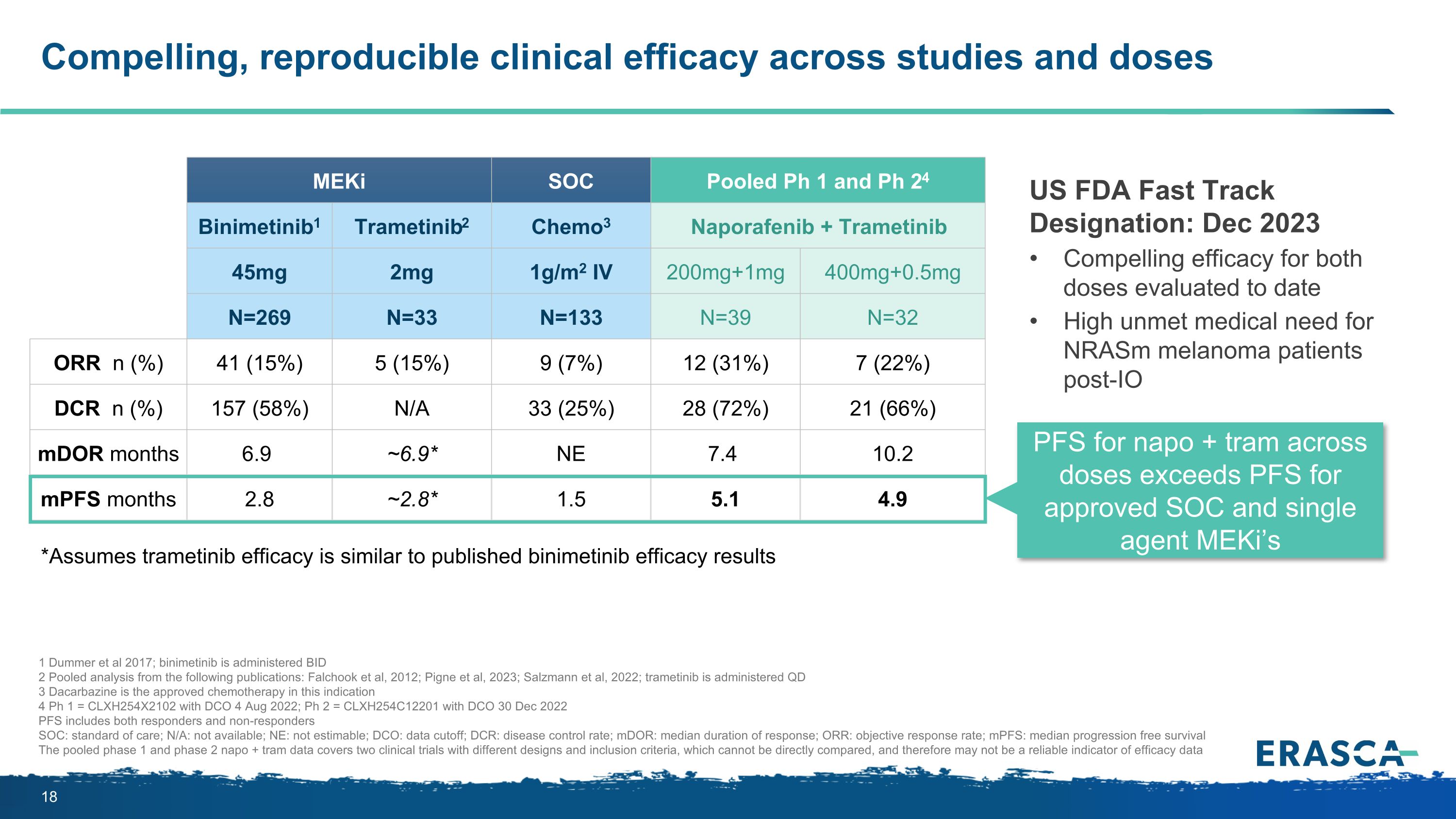
各種研究和劑量均具有令人信服的、可重複的臨牀療效 meKi 發表的文獻 SOC Pooled Ph 1 和 Ph 24 Binimetinib1 曲美替尼2 Chemo3 Naporafenib + 曲美替尼 45mg 2mg 1g/m2 IV 200mg+1mg 400mg+0.5mg N=269 N=33 N=32 ORR n (%) 41 (15%) 5 (15%) 9 (7%) 9 (7%)) 12 (31%) 7 (22%) DCR n (%) 157 (58%) N/A 33 (25%) 28 (72%) 21 (66%) mdOR 月 6.9 ~6.9* NE 7.4 10.2 mpfs 月 2.8 ~2.8* 1.5 5.1 4.9 *假設曲美替尼的療效與公佈的比尼美替尼療效結果相似美國食品藥品管理局快速通道稱號:2023 年 12 月兩種劑量的顯著療效迄今為止評估的napo + tram IO後nram 黑色素瘤患者未得到滿足的醫療需求高於經批准的 SOC 和單一藥物的 PFS MeKi's 1 Dummer 等人 2017 年;binimetinib 使用了 BID 2 來自以下出版物的彙總分析:Falchook 等人,2023 年;Salzmann 等人,2022年;曲美替尼在QD 3 Dacmer給藥阿巴嗪是該適應症中批准的化療 4 Ph 1 = CLXH254X2102,DCO,2022年8月4日;Ph 2 = CLXH254C12201,DCO,2022年12月30日 Pfs 包括反應者和非反應者 SOC:標準護理;N/A:不可用;NE:無法估計;DCO:數據截止率;DCR:疾病控制率;mdOR:中位緩解持續時間;ORR:客觀緩解率;MPF:無進展存活率中位數 1 期和 2 期 napo + tram 數據涵蓋了兩項具有不同設計和納入標準的臨牀試驗,因此可能不是療效數據的可靠指標
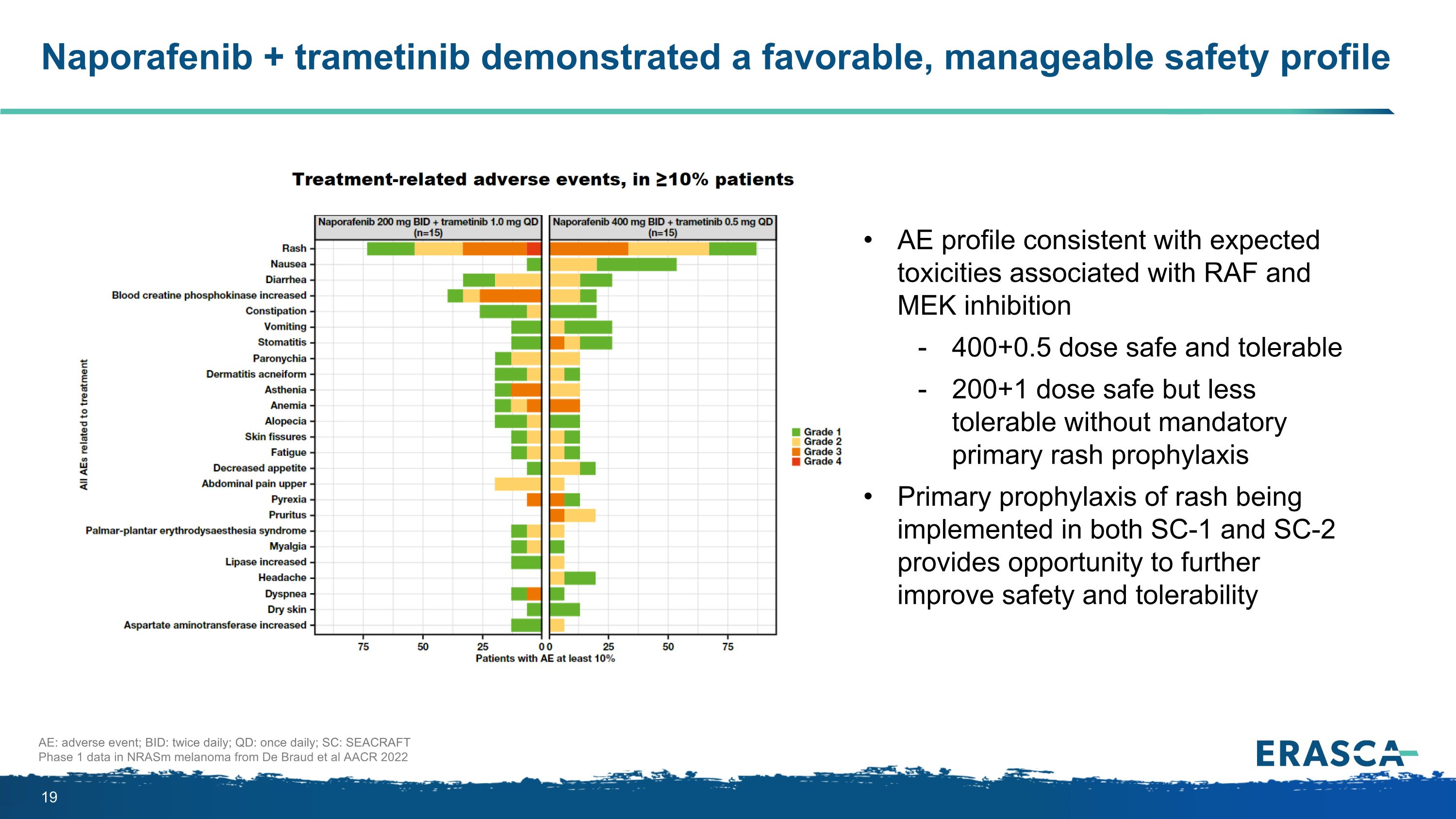
Naporafenib + 曲美替尼顯示出良好的可控安全性 AE:不良事件;BID:每日兩次;QD:每日一次;SC:來自 De Braud 等人 AACR 2022 AE 概況的 seacraft nrasm 黑色素瘤第 1 期數據與RAF和MEK抑制相關的預期毒性一致 400+1 劑量安全耐受 200+1 劑量安全但不具備強制性原發性皮疹預防的耐受性較差 phylaxis 在 SC-1 和 SC-2 中實施的皮疹初級預防為進一步提高安全性和耐受性提供了機會
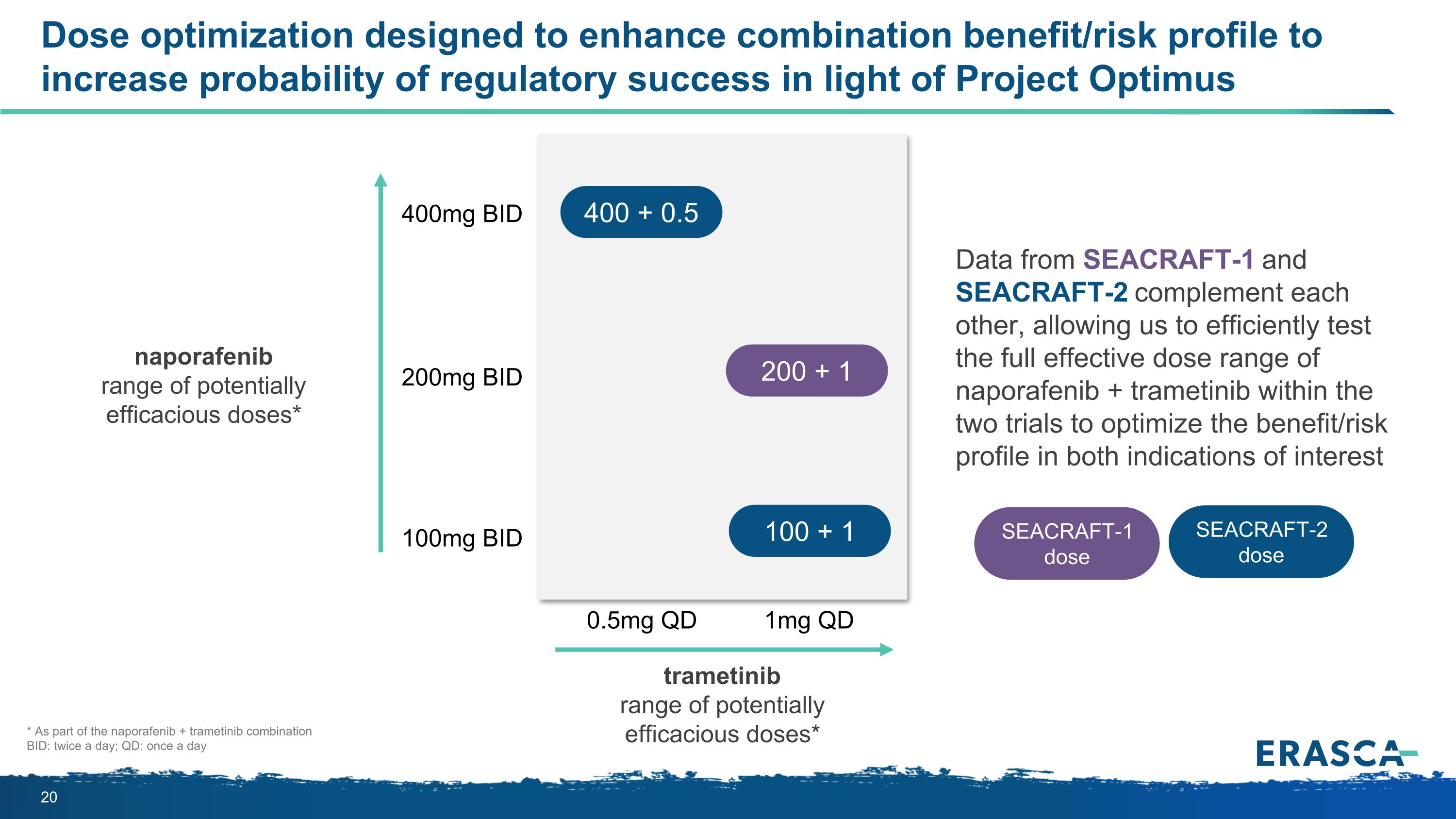
劑量優化旨在增強組合效益/風險狀況,以提高監管成功的概率,這是根據擎天柱計劃納波拉非尼的一系列潛在有效劑量* 400mg BID 100mg BID 200mg BID 0.5mg QD 1mg QD QD QD QD QD QD QD QD QD QD QD QD QD QD 數據相輔相成,使我們能夠在兩項試驗中高效測試納波拉非尼+曲美替尼的全部有效劑量範圍,以優化益處/風險狀況在兩種感興趣的跡象中 * 作為納波非尼+曲美替尼組合的一部分 BID:每天兩次;QD:每天一次 SEACRAFT-1 SEACRAFT-2曲美替尼潛在有效劑量範圍* 400 + 0.5 100 + 1 SEACRAFT-2 劑量 SEACRAFT-1 劑量 200 + 1
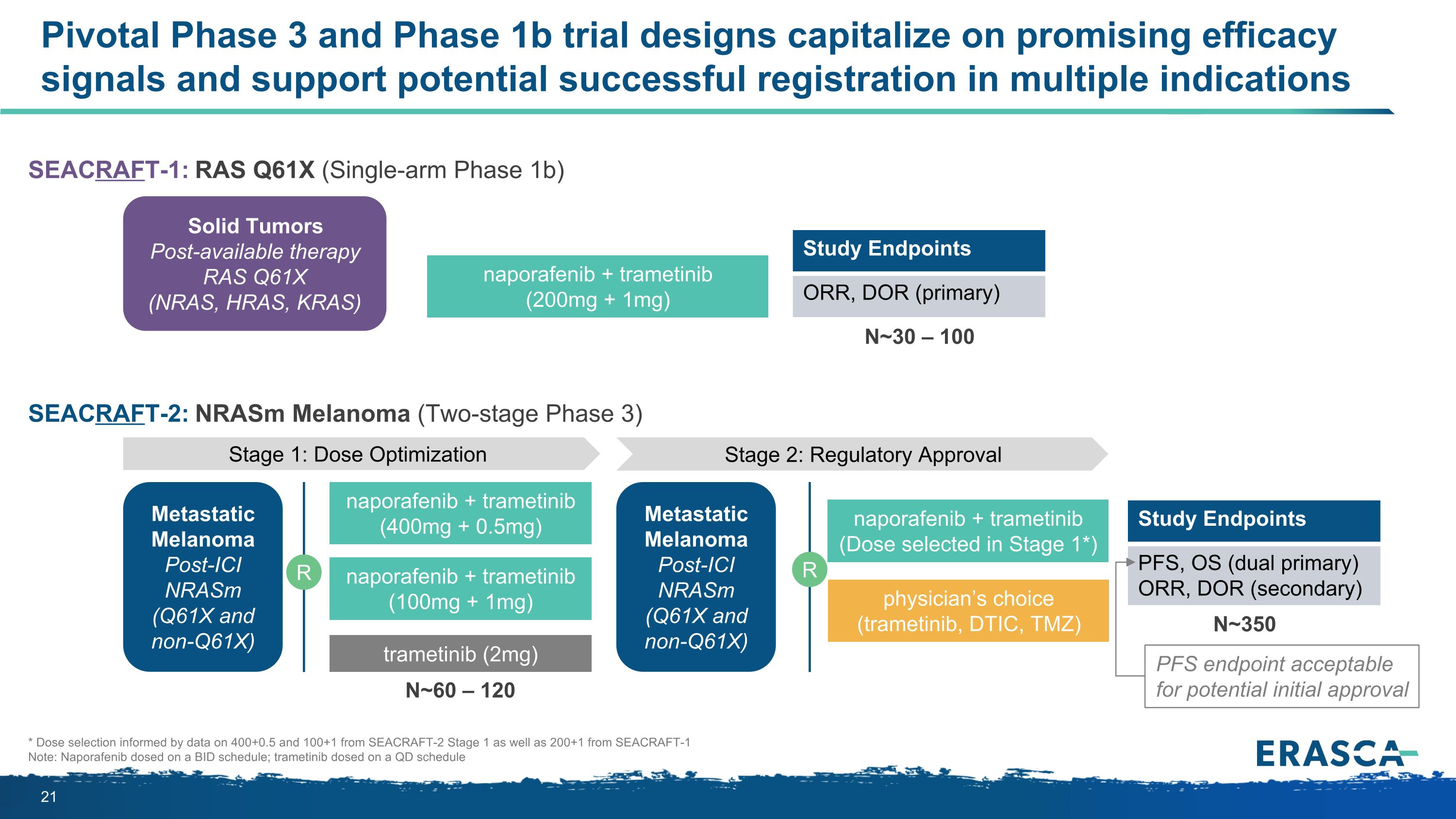
SEACRAFT-2:nRasm 黑色素瘤(兩階段 3 期)關鍵的 3 期和 1b 期試驗設計利用了有希望的療效信號,支持實體瘤上市後可能成功註冊的多適應症 RAS Q61X(NRAS、HRAS、KRAS)naporafenib + trametinib(200mg + 1mg)第 1 階段:劑量優化第 2 階段:監管批准 ICI 後轉移性黑色素瘤(Q61X)和非 Q61x)納波拉非尼 + 曲美替尼(400 毫克 + 0.5 毫克)R 曲美替尼(2 毫克)納波拉非尼 + 曲美替尼(100 毫克 + 1mg)研究終點 ORR、DOR(原發性)轉移性黑色素瘤ICI 後 nrasm(Q61X 和非 Q61x)R naporafenib + trametinib(在第 1 階段選擇的劑量*)醫生選擇(曲美替尼、DTIC、TMZ)研究終點 PFS、OS(雙主要)ORR、DOR(二級)SEACRAFT-1:RAS Q61X(單臂期 1b)N~350 N~60 — 120 N~30 — 100 * 劑量選擇由來自 SEACRAFT-2 第 1 階段的 400+0.5 和 100+1 的數據以及來自 SEACRAFT-1 的 200+1 的數據注意:納波拉非尼按投標計劃給藥;曲美替尼按量定量給藥 PFS 終點可接受潛在的初步批准
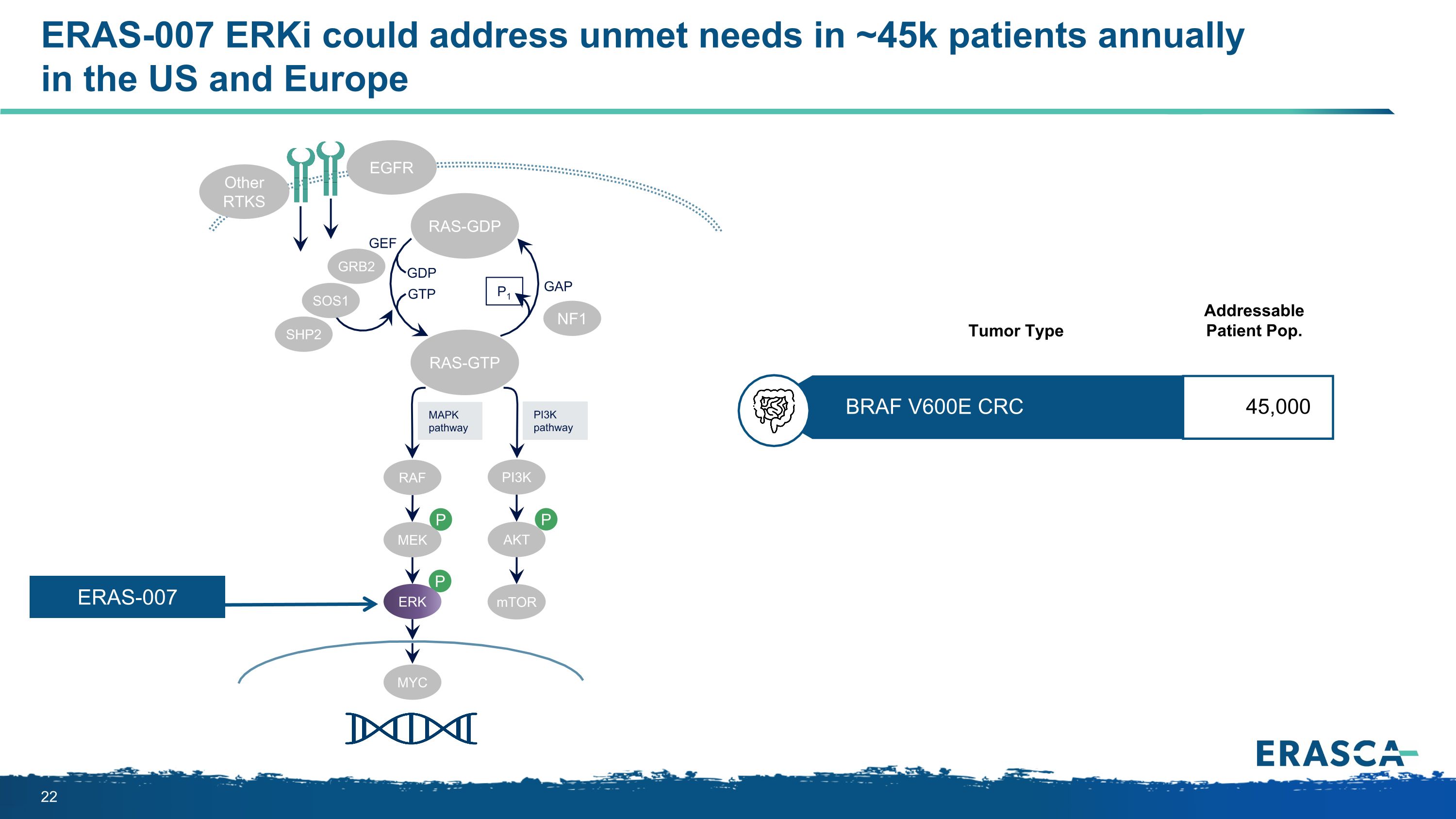
ERAS-007 ERKi 可以解決美國和歐洲每年約 4.5 萬名患者未得到滿足的需求 P P P MapkPathay PI3KPathay RAS-GTP GRB2 SHP2 GAP GTP GTP GTP P1 NF1 SOS1 RAF MEK PI3K AKT mTOR ERK RAS-GDP EGFR 其他 RTKS GEF ERAS-007 BRAF V600E CRC 45,000 可尋址患者 Pop。腫瘤類型

我們認為 ERAS-007 是開發中最有效的 ERK 抑制劑,其靶標停留時間獨特地更長分析類型測定 ERAS-007 IC50 (nM) 生化 ERK1 2 ERK2 2 2 基於細胞的機制 (HT-29) prSK 7 ERAS-007 被設計成一種強效、選擇性、可逆的口服抑制劑 koff (s-1) 停留時間 (min) ERAS-007 0.30 x 10-4 550 Ulixertinix 與其他eRki相比,10.1 x 10-4 16 Ravoxertinib 13.9 x 10-4 12 ERAS-007 的目標停留時間更長,這可能使患者服藥間隔更長
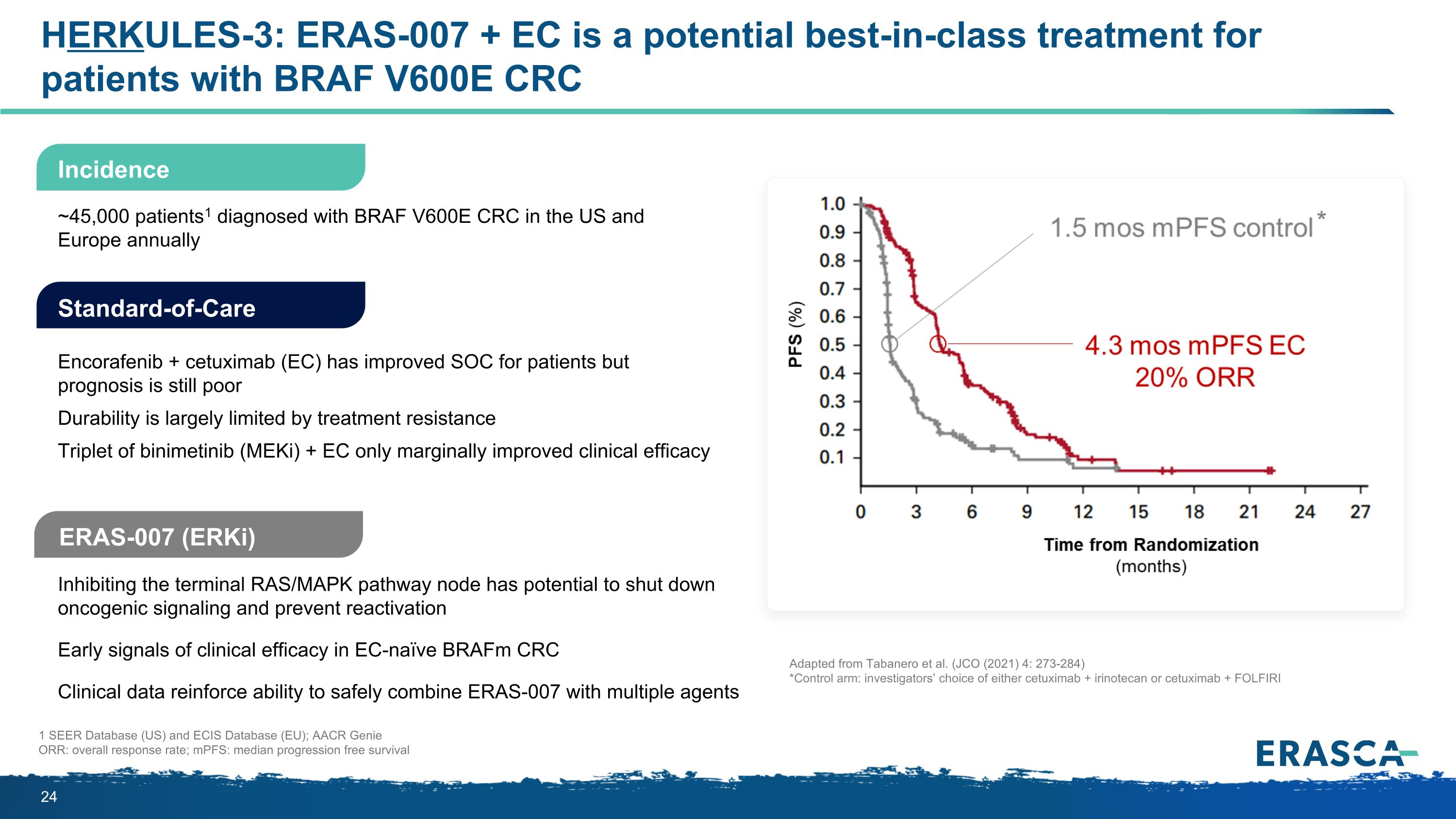
HERKULES-3:對於 BRAF V600E CRC 患者,ERAS-007 + EC 可能是同類最佳療法。抑制末端 RAS/MAPK 通路節點有可能阻斷致癌信號傳導並防止再激活 EC-naive brafm CRC 臨牀療效的早期信號。臨牀數據增強了 ERAS-007 與多種藥物安全聯合應用的能力。標準護理 Encorafenib + cetuximab (EC) SOC 已得到改善適用於患者但預後仍不佳耐久性在很大程度上受耐藥性的限制 binimetinib (meKi) + EC 三聯體僅限於比尼美替尼 (MeKi) + EC ERAS-007臨牀療效略有改善,每年在美國和歐洲被診斷出患有 BRAF V600E CRC 的患者1 1 1 SEER數據庫(美國)和ECIS數據庫(歐盟);AACR Genie ORR:總體緩解率;MPF:無進展存活率中位數改編自塔巴內羅等人(JCO(2021)4:273-284)*對照組:研究人員選擇西妥昔單抗 + 伊立替康或西妥昔單抗 + FOLFIRI * 發病率
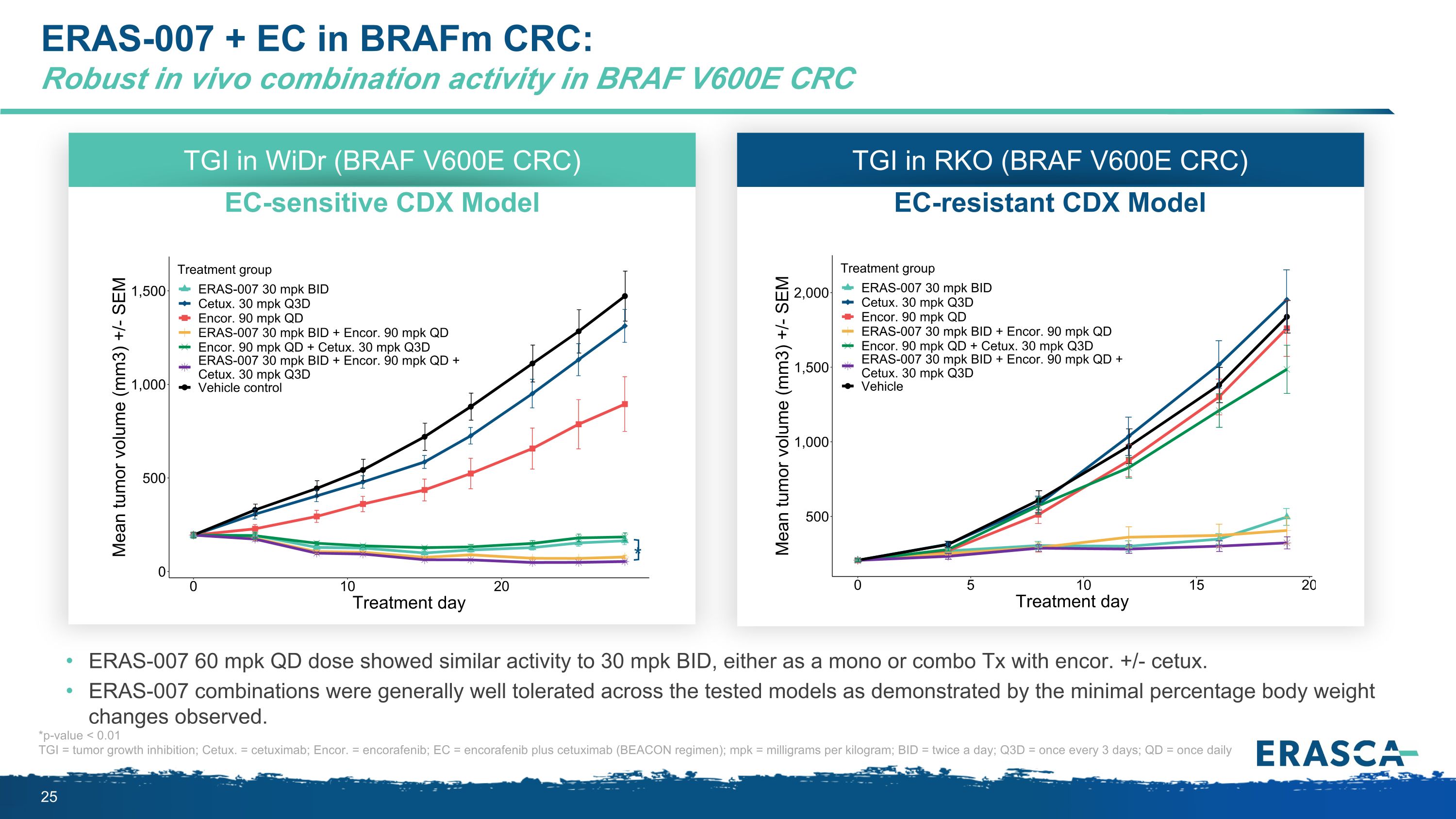
brafM CRC 中的 ERAS-007 + EC:BRAF V600E CRC ERAS-007 60 mpk QD 劑量中表現出強勁的體內組合活性,無論是單劑量還是與 encor 的組合 Tx,均顯示出與 30 mpk BID 相似的活性。+/-cetux。正如觀察到的最小體重變化百分比所證明的那樣,在所有測試模型中,ERAS-007 組合的耐受性普遍良好。WidR (BRAF V600E CRC) EC 敏感 CDX 模型中的 TGI * RKO (BRAF V600E CRC) 抗電性 CDX 模型中的 TGI *p 值
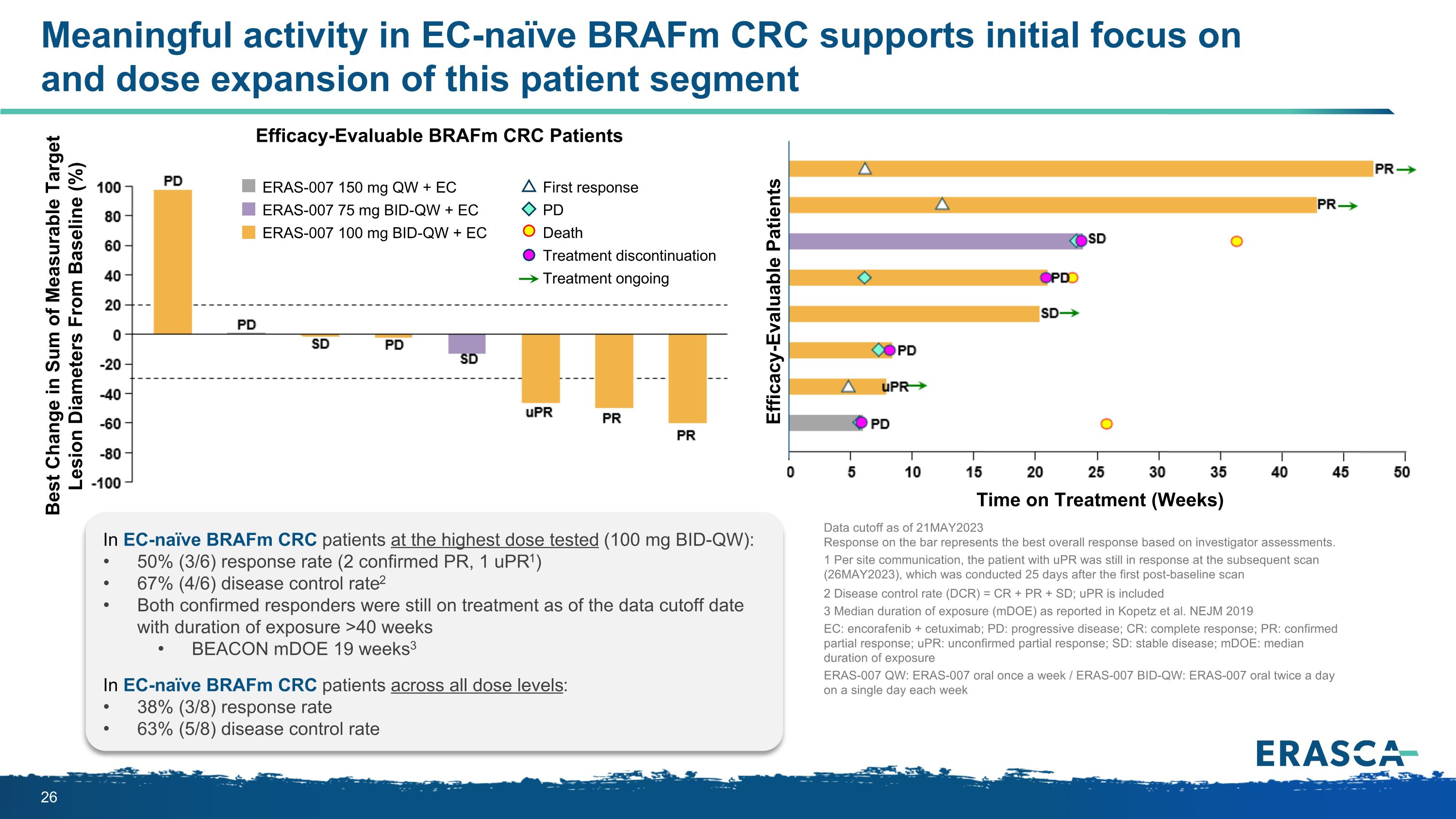
EC-naíve braFM CRC 中的有意義活性支持該患者羣體的初始關注和劑量擴大療效可評估 braFM CRC 患者的治療時間(周)ERAS-007 150 mg QW + EC ERAS-007 75 mg BID-QW + EC ERAS-007 100 mg BID-QW + EC 100 mg BID-QW + EC 第一反應 PD 死亡治療中止治療與基線相比最佳變化(%)療效可評估患者接受最高測試劑量(100 mg BID-QW)的天真 BraFM CRC 患者:50%(3/6)的緩解率(2 例確認 PR,1 例 upr1)67%(4/6)疾病控制率2 截至數據截止日,兩名確診的應答者仍在接受治療,暴露時間超過 40 周 BEACON mDoE 19 周3 在所有劑量水平的 EC-naíve BrafM CRC 患者中:38% (3/8) 疾病控制率 63% (5/8) 疾病控制率截止於 21MAY2023 的數據截止值根據研究者的評估,欄上的反應代表最佳的總體反應。1 每次現場通信,使用 UP 的患者在隨後的掃描(26MAY2023)中 R 仍有反應,該掃描是在基線後首次掃描 25 天后進行的 2 疾病控制率(DCR) = CR + PR + SD;uPR 包括 3 中位暴露持續時間 (mDoE),如 Kopetz 等人報告的。NEJM 2019 EC:encorafenib + cetuximab;PD:進行性疾病;CR:完全緩解;PR:已確認的部分反應;uPR:未經證實的部分反應;SD:穩定疾病;mDoE:中位暴露時間 ERAS-007 QW:ERAS-007 口服每週一次/ERAS-007 BID-QW:ERAS-007 每週單日口服兩次
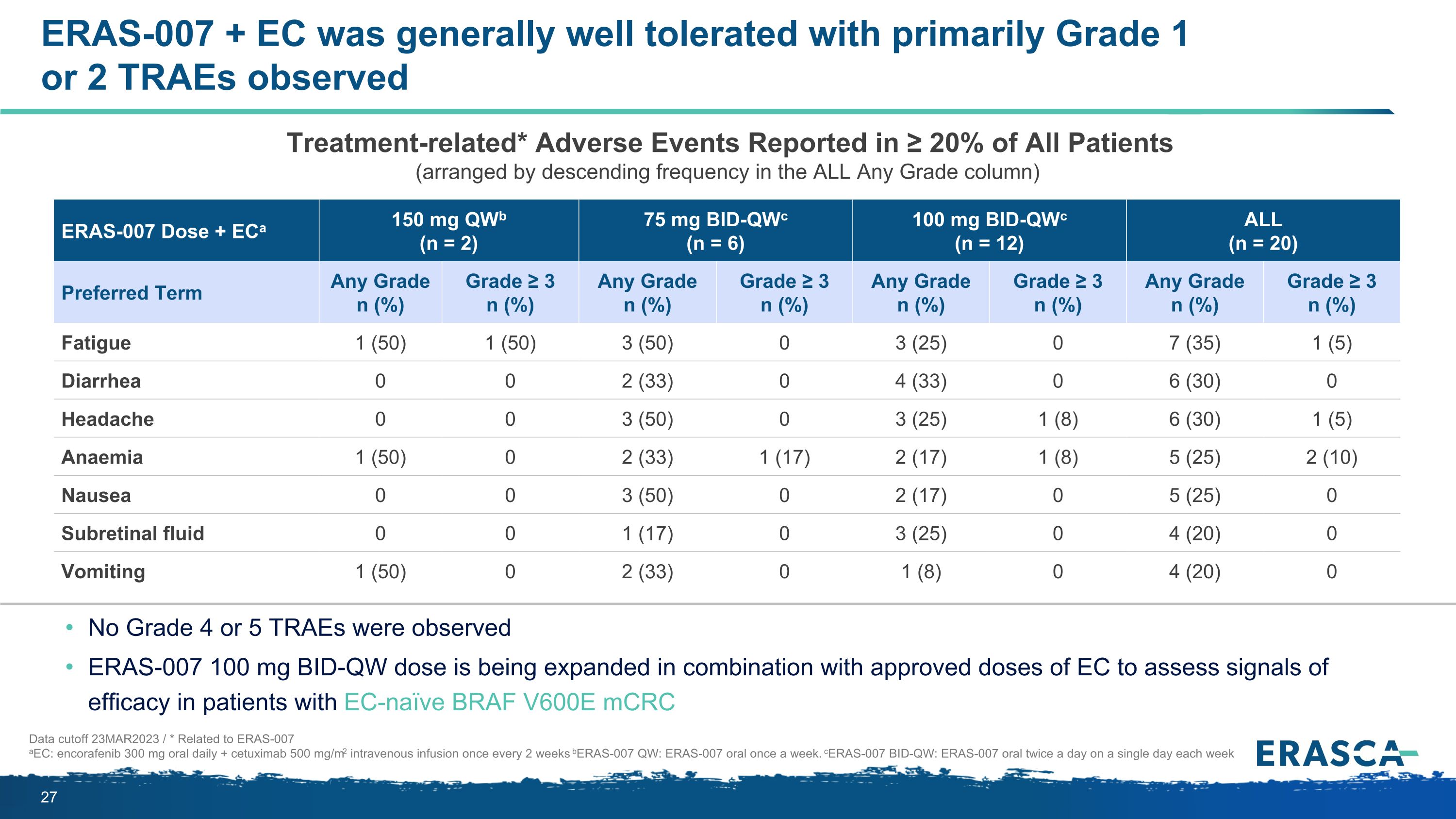
ERAS-007 + EC 的耐受性總體良好,主要觀察到 1 級或 2 級 traE 數據截止值 23MAR2023/* 與 ERAS-007 aEC 有關:encorafenib 300 mg 每日口服 + cetuximab 500 mg/m2 每 2 周靜脈注射一次 beras-007 QW:ERAS-007 每週口服一次。觀察到 ERAS-007 100 mg BID-QW 劑量與批准劑量的 EC 聯合使用,正在擴大 BID-QW 劑量,以評估 EC-naíve BRAF V600E mCRC ERAS-007 劑量 + eCA 150 mg qwB (n = ERAS-0072) 75 mg bid-qwC (n = 6) 100 mg bid-QWC (n = 12) 全部 (n = 20) 首選期限任何等級 n (%) 等級 ≥ 3 n (%) 任何等級 n (%) 等級 ≥ 3 n (%) 任何等級 ≥ 3 n (%) 疲勞 1 (50) 1 (50) 3 (%) 50) 0 3 (25) 0 7 (35) 1 (5) 腹瀉 0 0 2 (33) 0 4 (33) 0 6 (30) 0 0 頭痛 0 0 3 (50) 0 3 (25) 1 (8) 6 (30) 1 (5) 貧血 1 (50) 0 2 (33) 1 (17) 1 (8) 5 (25) 2 (10) 噁心 0 3 (50) 0 (50)) 0 2 (17) 0 5 (25) 0 視網膜下積液 0 0 1 (17) 0 3 (25) 0 4 (20) 0 嘔吐 1 (50) 0 2 (33) 0 1 (8) 0 4 (20) 0 與治療相關的* 不良事件在 ≥ 20% 的所有患者中進行了報告(在 “所有任意等級” 列中按降序頻率排列)
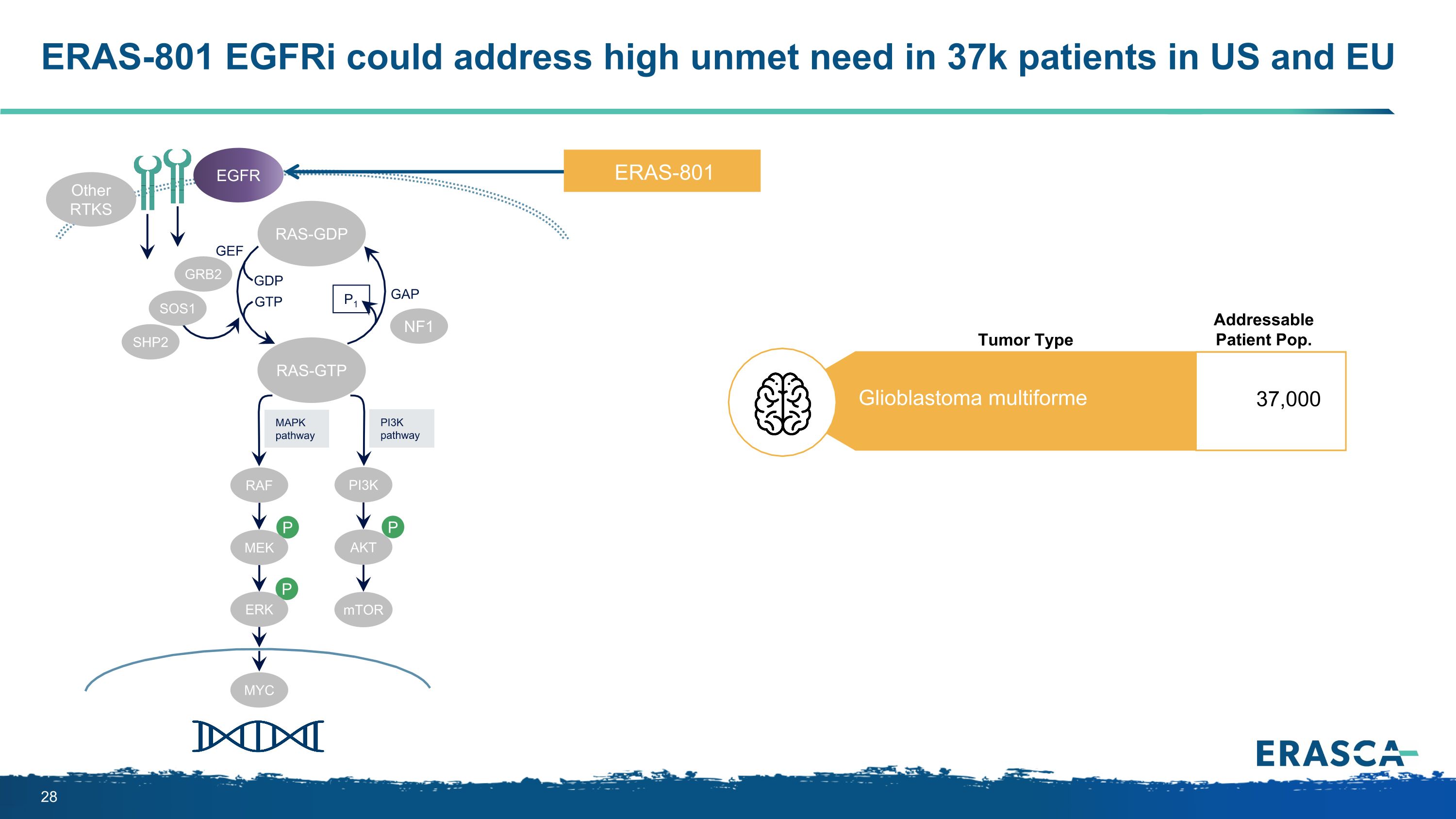
ERAS-801 eGFRI 可以解決美國和歐盟 3.7 萬名患者未得到滿足的高需求 P P P MapkPathay pi3kPathway RAS-GTP GRB2 SHP2 GAP GTP GTP P1 NF1 SOS1 RAF MEK PI3K AKT mTOR ERK RAS-GDP 其他 RTKS GEF ERAS-801 多形膠質母細胞瘤 37,000 名可尋址患者 Pop。腫瘤類型
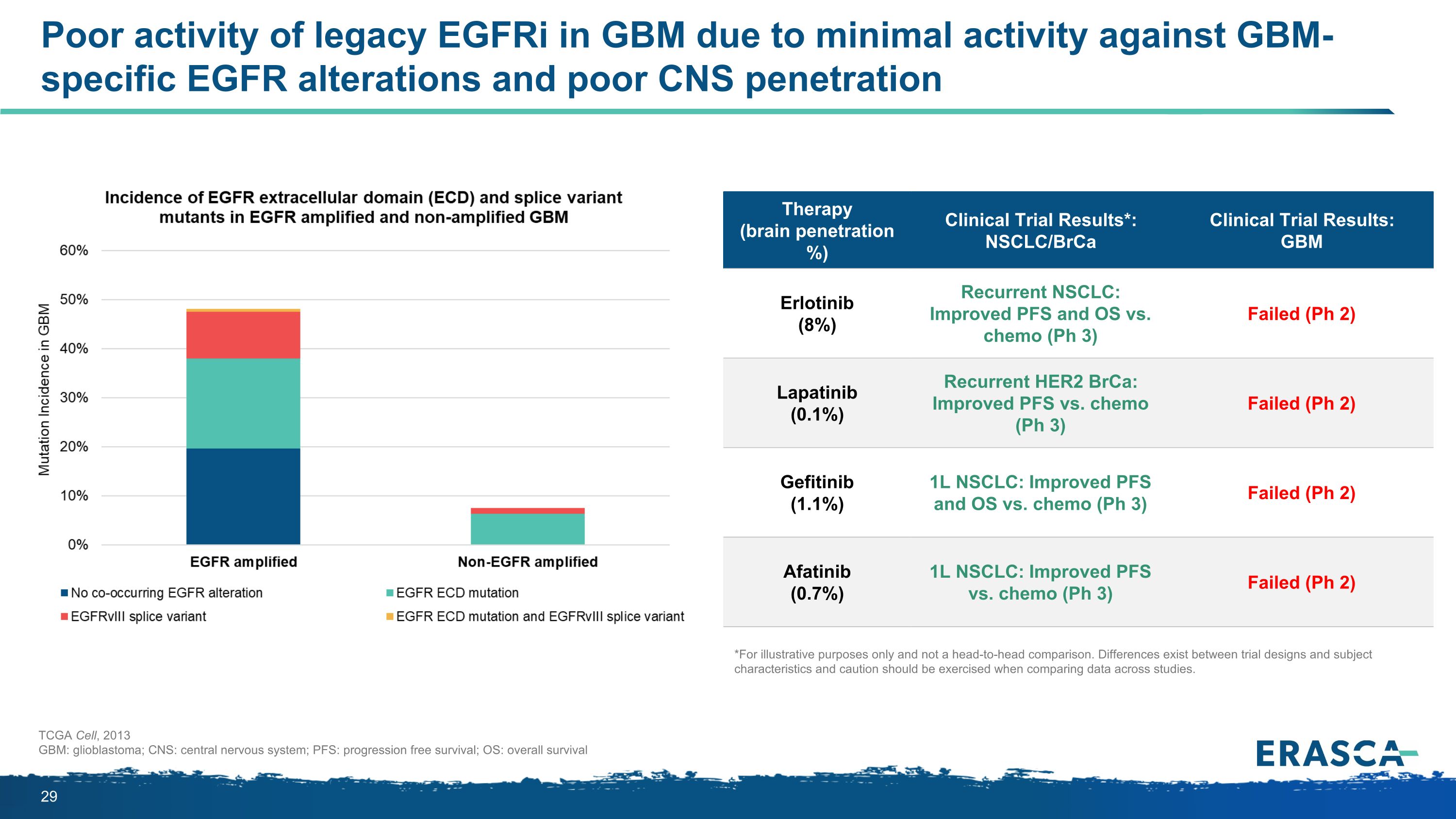
由於對基因組特異性表皮生長因子改變的活性微小和中樞神經系統穿透力差,傳統表皮生長因子在 GBM 中的活性不佳,2013 年 GBM:膠質母細胞瘤;中樞神經系統;PFS:無進展存活率;操作系統:總體存活療法(大腦穿透率)臨牀試驗結果*:GBM Erlotinib(8%)複發性非小細胞肺癌:改善 FS 和操作系統與化療(Ph 3)失敗(Ph 2)Lapatinib(0.1%)復發 HER2 brCA:Pfs 與化療(Ph 3)的改善(Ph 3)失敗(Ph 2)吉非替尼(1.1%)1L NSCLC:與化療(Ph 3)相比,Pfs 和操作系統改善(Ph 2)阿法替尼(0.7%)1L NSCLC:與化療(Ph 3)相比,Pfs 的改善(Ph 3)失敗(Ph 2)*僅用於説明目的,不進行正面比較。試驗設計和受試者特徵之間存在差異,在比較不同研究的數據時應謹慎行事。
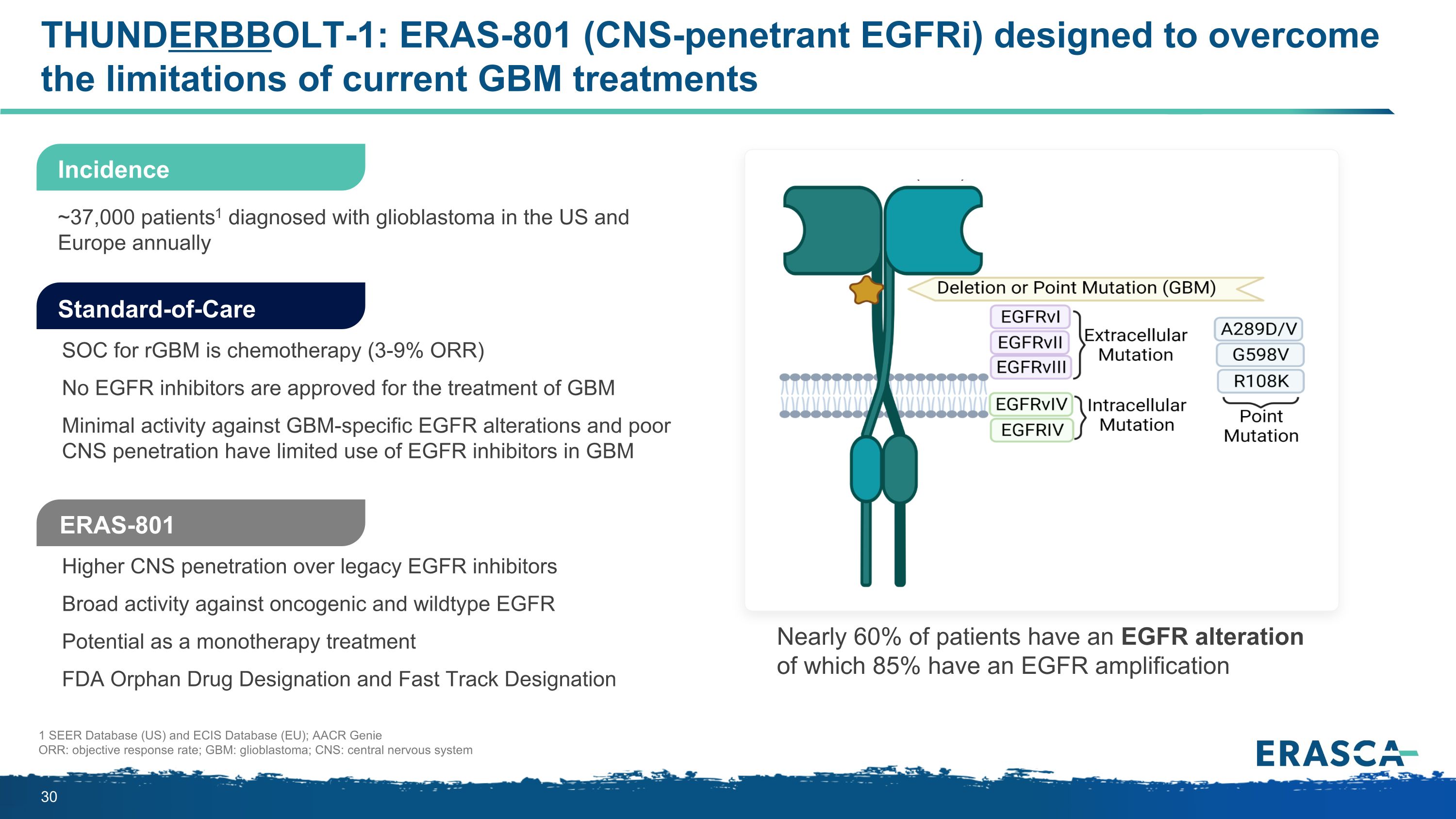
THUNDERBBOLT-1:ERAS-801(CNS-perentrant eGFRI)旨在克服當前 GBM 治療的侷限性與傳統表皮生長因子抑制劑相比更高的中樞神經系統滲透率對致癌和野生型表皮生長因子的廣泛活性作為單一療法的潛在美國食品藥品管理局孤兒藥認定和快速通道認定 scfr 是化療(3-9% ORR)未批准用於治療 GBM 特異性表皮生長因子變異的活性最小中樞神經系統滲透率低導致表皮生長因子抑制劑在GBM 1 SEER數據庫(美國)和ECIS數據庫(歐盟)中的使用有限;AACR Genie ORR:客觀緩解率;GBM:膠質母細胞瘤;中樞神經系統:中樞神經系統發病率每年在美國和歐洲被診斷出患有膠質母細胞瘤的患者1。標準護理 ERAS-801 近 60% 的患者有表皮生長因子改變,其中 85% 的患者有表皮生長因子放大
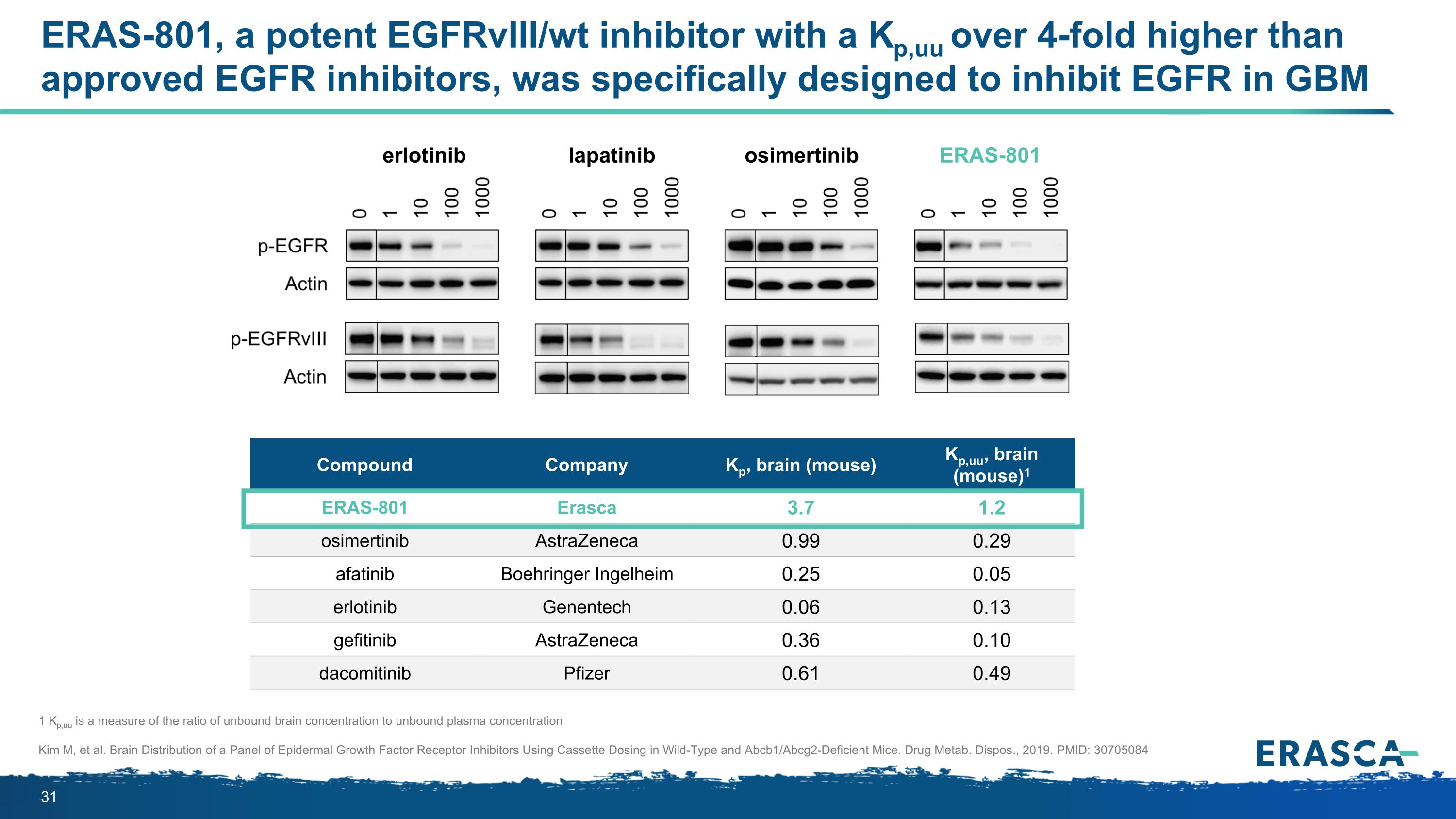
ERAS-801 是一種強效的 EGFRVIII/WT 抑制劑,其Kp,uu 比批准的表皮生長因子抑制劑高 4 倍以上,專為抑制 GBM 1 Kp 中的表皮生長因子而設計,uu 是衡量未結合大腦濃度與未結合血漿濃度之比的指標 Kim M 等人。在野生型和Abcb1/Abcg2缺陷小鼠中使用盒式劑量對錶皮生長因子受體抑制劑組的大腦分佈。Drug Metab。Dispos.,2019 年。PMID:30705084 化合物公司 Kp,大腦(小鼠)Kp,uu,大腦(小鼠)1 ERAS-801 Erasca 3.7 1.2 奧西美替尼阿斯利康 0.99 0.29 阿法替尼勃林格英格爾海姆 0.25 0.05 厄洛替尼基因泰克 0.06 0.13 吉非替尼阿斯利康 0.36 0.10 達科米替尼輝瑞 0.61 49 厄洛替尼拉帕替尼奧美替尼 ERAS-801
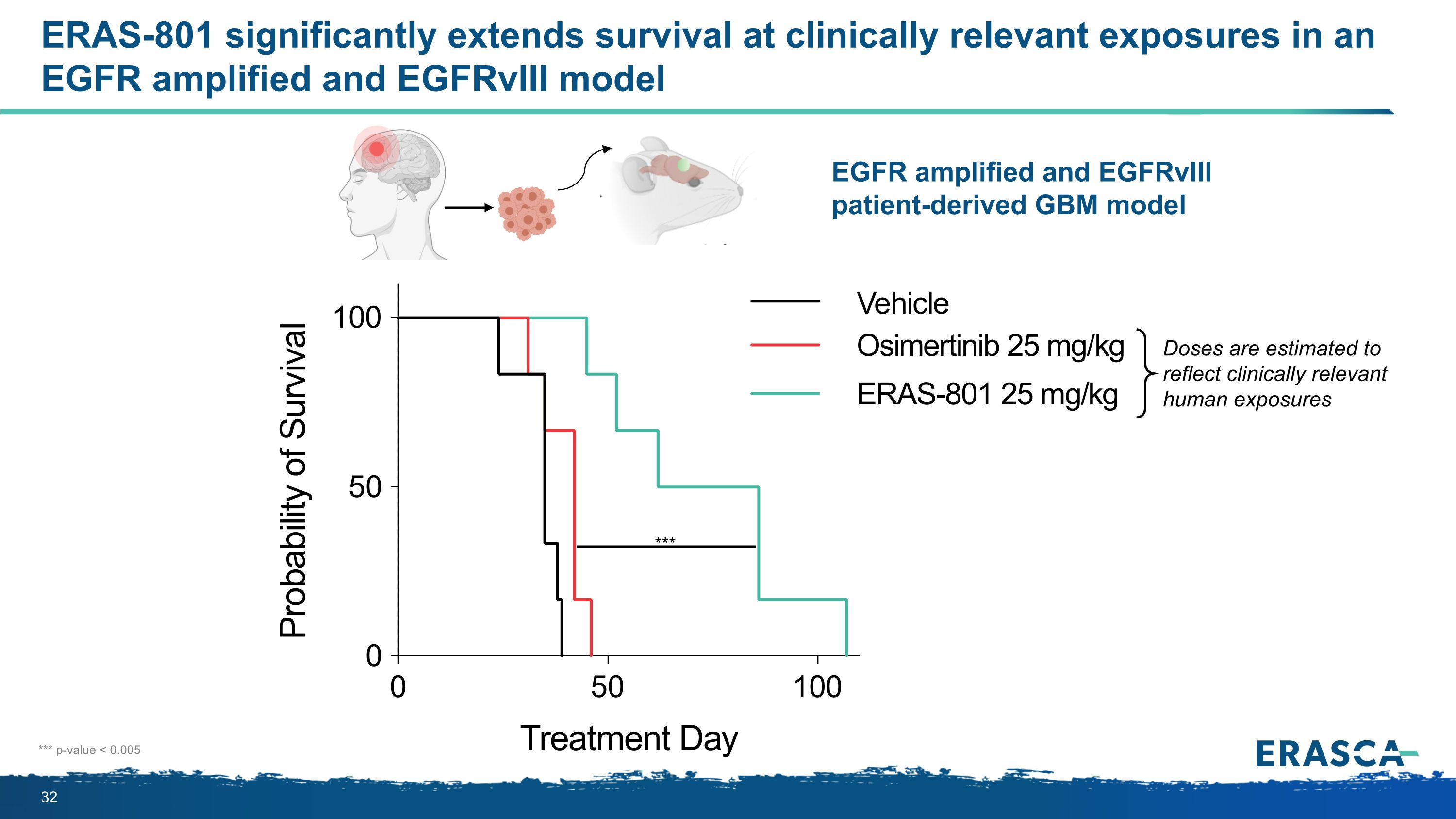
在 aneGFR 擴增和 egfrVIII 模型 EGFR 擴增和 egfrVIII 患者衍生的 GBM 模型中,ERAS-801 顯著延長了臨牀相關暴露下的存活期 *** p 值
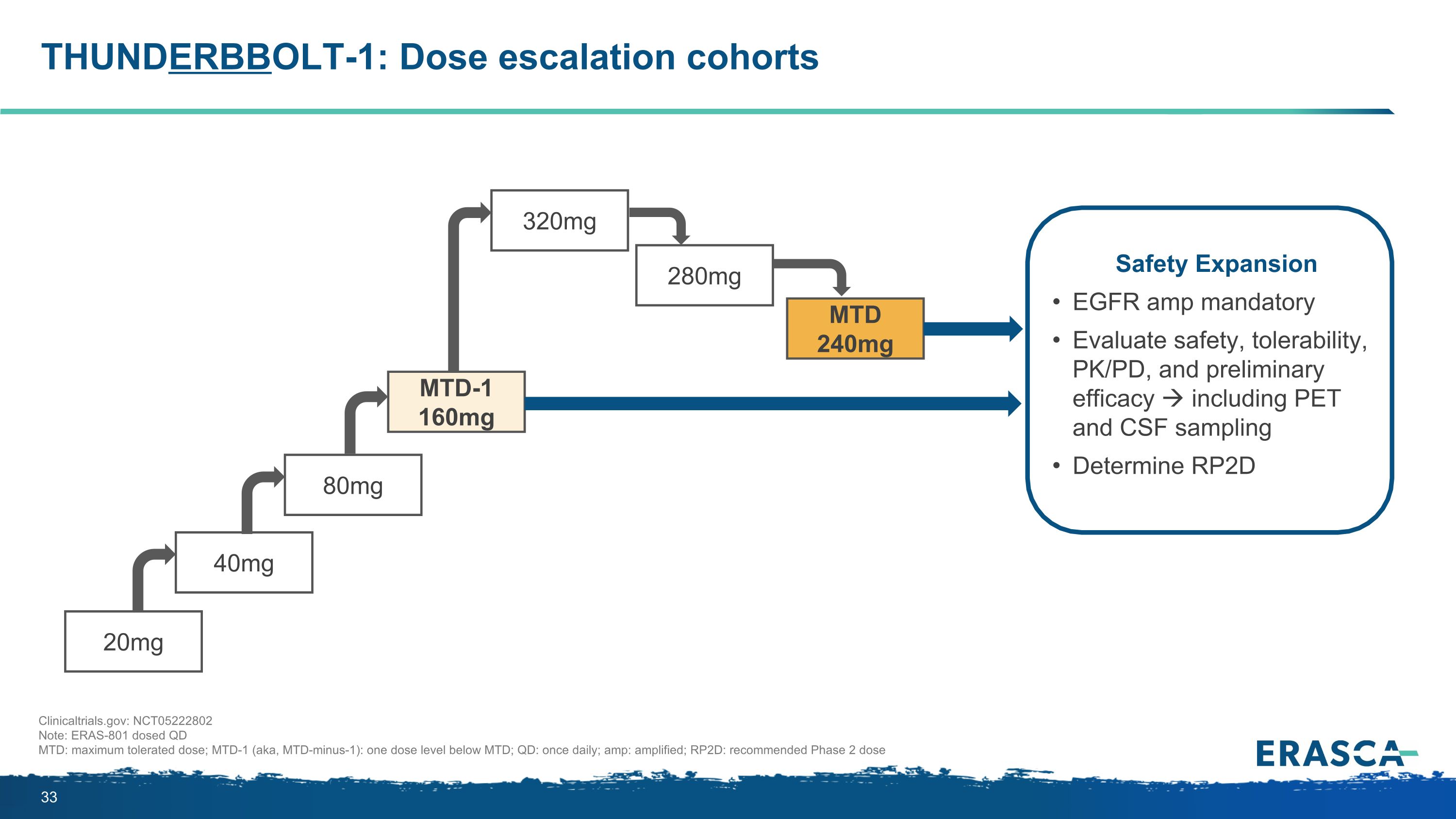
THUNDERBBOLT-1:劑量遞增隊列 20mg 280mg 320mg MTD 240mg 40mg 80mg MTD-1 160mg 安全擴展 EGFR 和強制性評估安全性、耐受性、PK/PD 和初步療效,包括 PET 和 CSF 採樣確定 RP2D ClinicalTrials.gov:NCT05222802 注意:ERAS-801 劑量 QD MTD:最大耐受劑量;MTD-1(又名 mtd-minus-1):低於 MTD 一劑量水平; QD:每日一次;和:擴增;RP2D:推薦的 2 期劑量

預期的關鍵里程碑和臨牀試驗讀數 1 數據包括相關人羣中相關劑量的安全性、藥代動力學 (PK) 和療效計劃機制試驗名稱指示(組合合作伙伴,如果適用)預期里程碑 Naporafenibpan-RAF 抑制劑 SEACRAFT-1 RAS Q61X 實體瘤(+ 曲美替尼)2024 年第二季度至 2024 年第四季度:Ph 1b 組合數據1 Seacraft-2NRNB ASM 黑色素瘤(+ 曲美替尼)2024 年上半年:Ph 3 關鍵試驗啟動 2025 年:Ph 3 階段 1 隨機劑量優化數據1 ERAS-007 ERK1/2 抑制劑 HERKULES-3 EC-naive brafMCRC(+ encorafenib 和 cetuximab)H1 2024:Ph 1b 組合數據1 ERAS-801 CNS滲透表皮生長因子抑制劑 THUNDERBBOLT-1 膠質母細胞瘤 2024:Ph 1 單一療法數據1

引人入勝的投資論文經驗豐富的團隊有連續成功的記錄經驗豐富的藥物開發人員推動了從發現到臨牀試驗再到全球批准的多個項目世界一流的科學顧問委員會包括以下領域的領先先驅:KRAS(Shokat,UCSF)、SHP2(Blacklow,HMS)、ERK(Corcoran,MGH)、RAS/MAPK途徑(倫敦大學學院羅德里格斯-維西亞納;Cichowski,HMS)、精準腫瘤學(Demetri、DFCI)和生物製藥(Varney、Genentech)消滅癌症的廣泛產品組合我們已經建立了業內最深的管道之一,以全面關閉RAS/MAPK 途徑,有可能滿足全球超過 500 萬名患者未得到滿足的需求三種臨牀階段化合物差異化特徵包括納波非尼(一種針對 nRASM 黑色素瘤和 Q61X 組織不可知實體瘤的 3 期就緒泛RAF抑制劑)、ERAS-007 ERK 抑制劑,以及 ERAS-801(一種針對 GBM 的中樞神經系統表皮生長因子抑制劑)多種潛在的短期和長期價值驅動因素重點臨牀開發計劃 2024 年及以後的多個臨牀數據,以及推動同類首創或同類最佳化合物的強大研究引擎進入診所

謝謝!
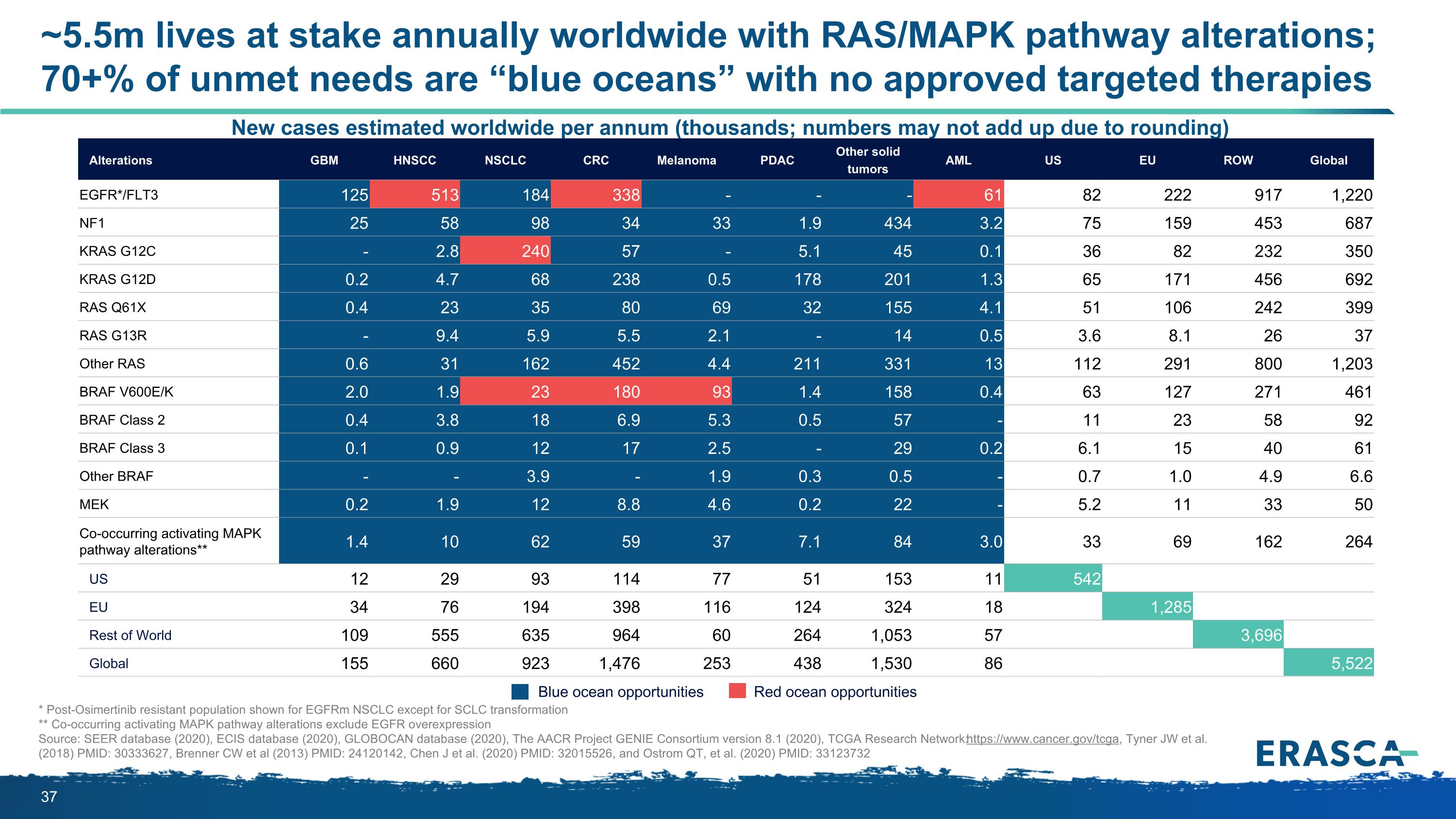
* 除小細胞肺癌轉化外 eGFRM NSCLC 出現耐藥後奧美替尼人羣 ** 同時發生的激活 MAPK 途徑改變不包括 EGFR 過度表達來源:SEER 數據庫(2020 年)、ECIS 數據庫(2020 年)、GLOBOCAN 數據庫(2020 年)、AACR 項目精靈聯盟版本 8.1(2020)、TGA 研究網絡:https://www.cancer.gov/tcga,Tyner JW 等人(2018)PMID:30333627,Brenner CW 等人(2013)PMID:24120142,Chen J 等人(2020)PMID:32015526,以及 Ostrom QT 等人(2020)PMID:33123732 估計全球每年新增病例(數千例)由於四捨五入,數字可能不相加)藍海機會紅海機會改變 GBM HNSCC NSCLC CRC 黑色素瘤 PDAC 其他實體瘤 AML 美國歐盟 ROW 全球 EGFR*/FLT3 125 513 184 338--61 82 222 917 1,220 NF1 25 58 98 34 33 1.9 434 3.2 75 159 687 KRAS G12C-2.8 240 57-5.1 45 0.1 36 82 232 350 KRAS G12D 0.2 4.7 68 238 0.5 178 201 1.3 65 171 456 692 RAS Q61X 0.4 23 35 80 69 32 155 4.1 51 106 242 399 RAS G13R-9.4 5.9 5.9 5.5 2.1-14 0.5 3.6 8.1 26 37 其他 RAS 0.6 31 162 452 4.1 112 291 800 1,203 BRAF V600E/K 2.0 1.9 23 180 931.4 158 0.4 63 127 271 461 BRAF 2 類 0.4 3.8 18 6.9 5.3 0.5 57-11 23 58 92 BRAF 3 0.1 0.9 12 2.5-29 0.2 6.1 15 40 61 其他 BRAF--3.9-1.9 0.3 0.7 1.0 4.9 6.6 MEK 0.2 12 8.8 4.6 0.2 0.2-5.2 11 33 50 同時發生的激活 MAPK 途徑改變** 1.4 10 62 59 37 74 3.0 69 264 162 US 12 29 93 114 77 51 153 11 542 歐盟 34 76 194 398 116 124 324 18 1,285 世界其他地區 109 555 635 964 60 264 1,053 57 3,696 全球 155 660 923 1,476 253 438 1,530 86 5,522 ~550 萬人由於RAS/MAPK路徑的改變而面臨生命危險;70+%未滿足的需求是 “藍海”,沒有批准的靶向療法
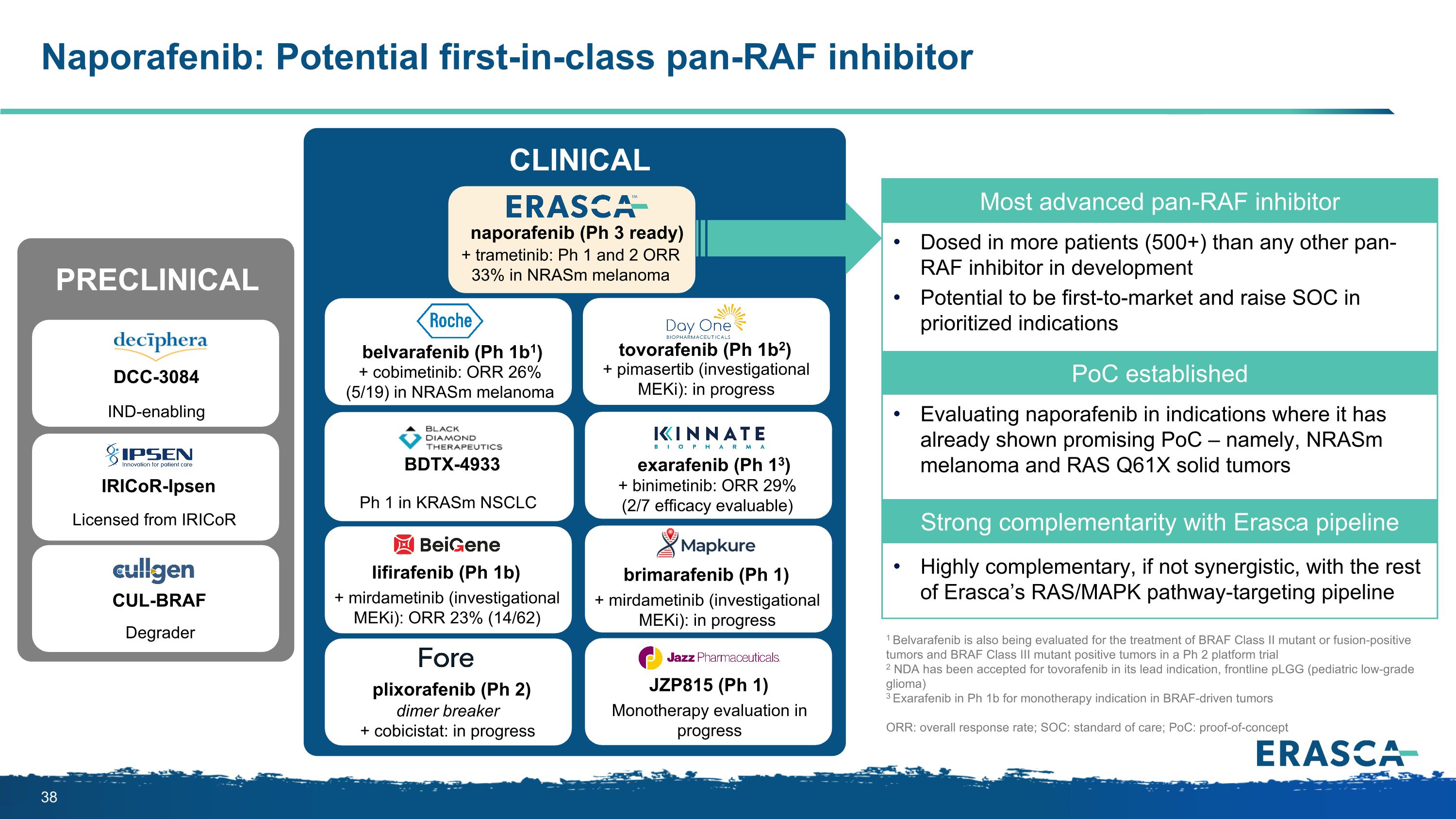
Naporafenib:潛在的同類首創 pan-RAF 抑制劑 DCC-3084 IRICOR-IPSEN CUL-BRAF 降解劑 IND 啟用 IRICOR 臨牀前最先進的 pan-RAF 抑制劑的劑量比任何其他在研的 pan-RAF 抑制劑都要多(500 人以上)。有望率先進入市場並在優先適應症中提高 SOC 成立 PoC 評估納波拉非尼在已顯示出前景的適應症中 — 即 nRasm 黑色素瘤和 RAS Q61X 實體瘤與 Erasca 管線的強互補性與其他產品高度互補,甚至具有協同作用在 Erasca 的 RAS/MAPK 路徑靶向管道中,naporafenib(Ph 3 已就緒)+ 曲美替尼:nRasm 黑色素瘤的 ph 1 和 2 ORR 33% belvarafenib(Ph 1b1)+ cobimetinib:nRasm 黑色素瘤託沃拉非尼(Ph 1b2)+ pimasertib(研究中 meKi)中的 ORR 26%(5/19): 進行中 exarafenib(Ph 13)+ binimetinib:ORR 29%(2/7 療效可評估)1 Belvarafenib 也在評估用於治療 BRAF II 類突變體或融合陽性腫瘤以及 Ph 2 平臺試驗 2 中的 BRAF III 類突變體陽性腫瘤和 BRAF III 類突變體陽性腫瘤。前線 pLGG(小兒低度神經膠質瘤)3 埃沙拉非尼在 Ph 1b 中用於 BRAF 驅動腫瘤的單一療法 ORR:總體緩解率;SOC:護理標準;PoC:概念驗證利非尼(Ph 1b)+ 米達美替尼(研究中 meKi):ORR 23%(14/62)普利索拉非尼(Ph 2)JZP815(Ph 1)二聚體 breaker + cobicistat:正在進行單一療法評估正在進行臨牀brimarafenib(Ph 1)+ mirdametinib(研究中 meKi):正在進行 Krasm NSCLC 的 BDTX-4933 Ph 1
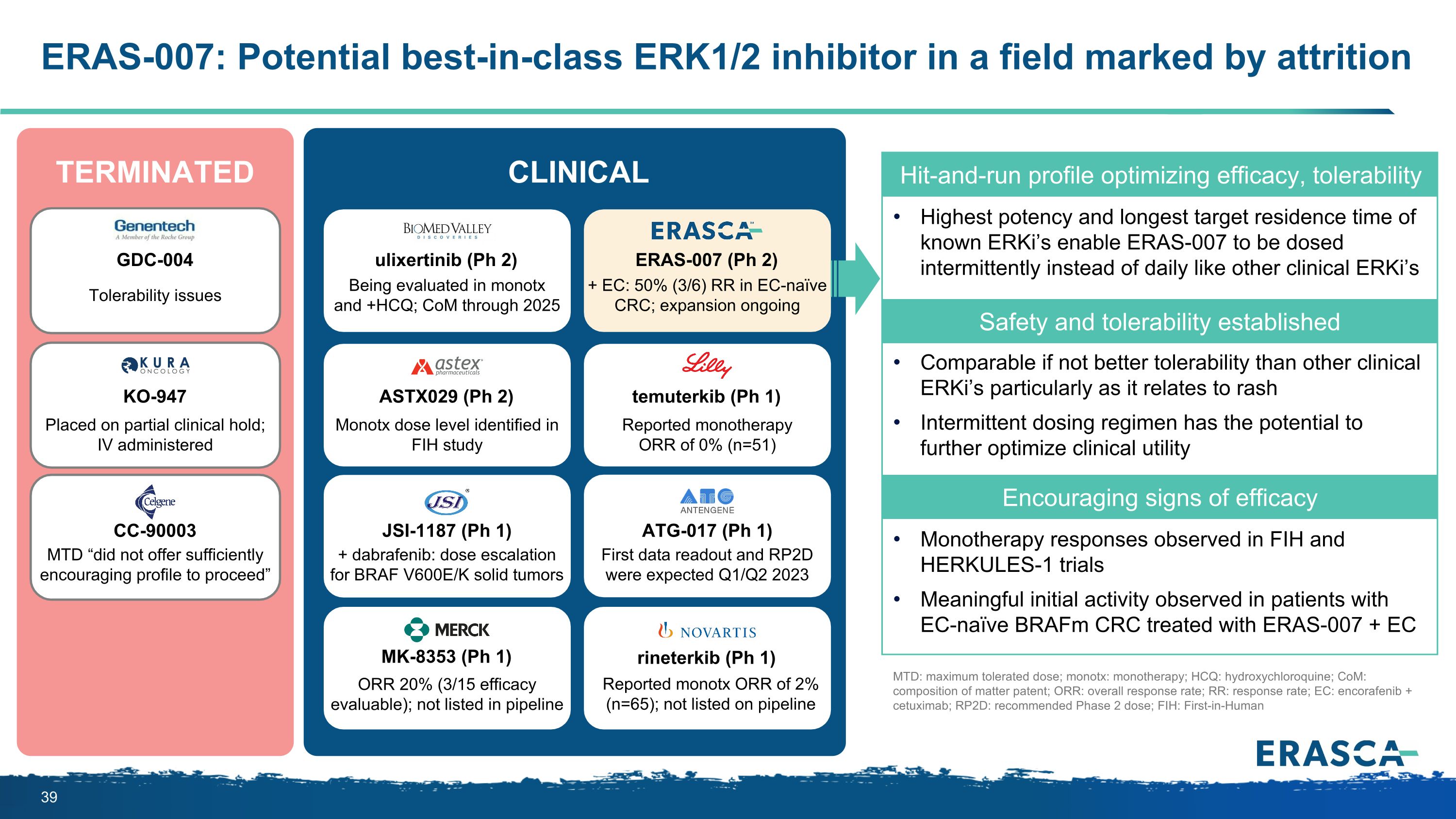
ERAS-007:在以流失為標誌的領域,潛在的同類最佳ERK1/2抑制劑可優化療效、耐受性已知 ERKi 的最大效力和最長的靶標停留時間使 ERAS-007 可以間歇性給藥,而不是像其他臨牀試驗一樣每天給藥 ERKi 的安全性和耐受性與其他臨牀 ERKI 相當,甚至更好,尤其是與皮疹相關的間歇性給藥方案具有進一步優化的潛力臨牀用途令人鼓舞的療效跡象單一療法的反應在 FIH 和 HERKULES-1 試驗中觀察到,在使用 ERAS-007 + EC ERAS-007 (Ph 2) + EC 治療的 EC-naíve braFM CRC 患者中觀察到有意義的初始活性:在 EC-naive CRC 中觀察到 50% (3/6) RR;正在進行擴展 ASTX029 (Ph 2) 在 FIH 研究中確定單劑量水平 ulixertinib (Ph 2) 正在進行單效和 +HCQ 評估;CoM 至 2025 年 temuterkiterkitkib b(Ph 1)報告的單一療法 ORR 為 0%(n=51)JSI-1187(Ph 1)ATG-017(Ph 1)+ dabrafenib:BRAF V600E/K 實體瘤的劑量遞增預計在 2023 年第一季度/第二季度首次讀出數據和 RP2D MK-8353ORR 20%(3/15 療效可評估);未列入管道報告的單一抗體ORR為 2%(n=65);未列入管道中 GDC-004 KO-947 CC-90003 耐受性問題已部分臨牀擱置;靜脈注射 MTD “沒有提供足夠令人鼓舞的進展情況” 終止臨牀藥物:最大耐受劑量;單一療法;HCQ:羥氯喹成分;CoM:物質成分專利;ORR:總體反應率;RR:反應率;EC:encorafenib + cetuximab;RP2D:推薦的 2 期劑量;FIH:首次在人體中使用
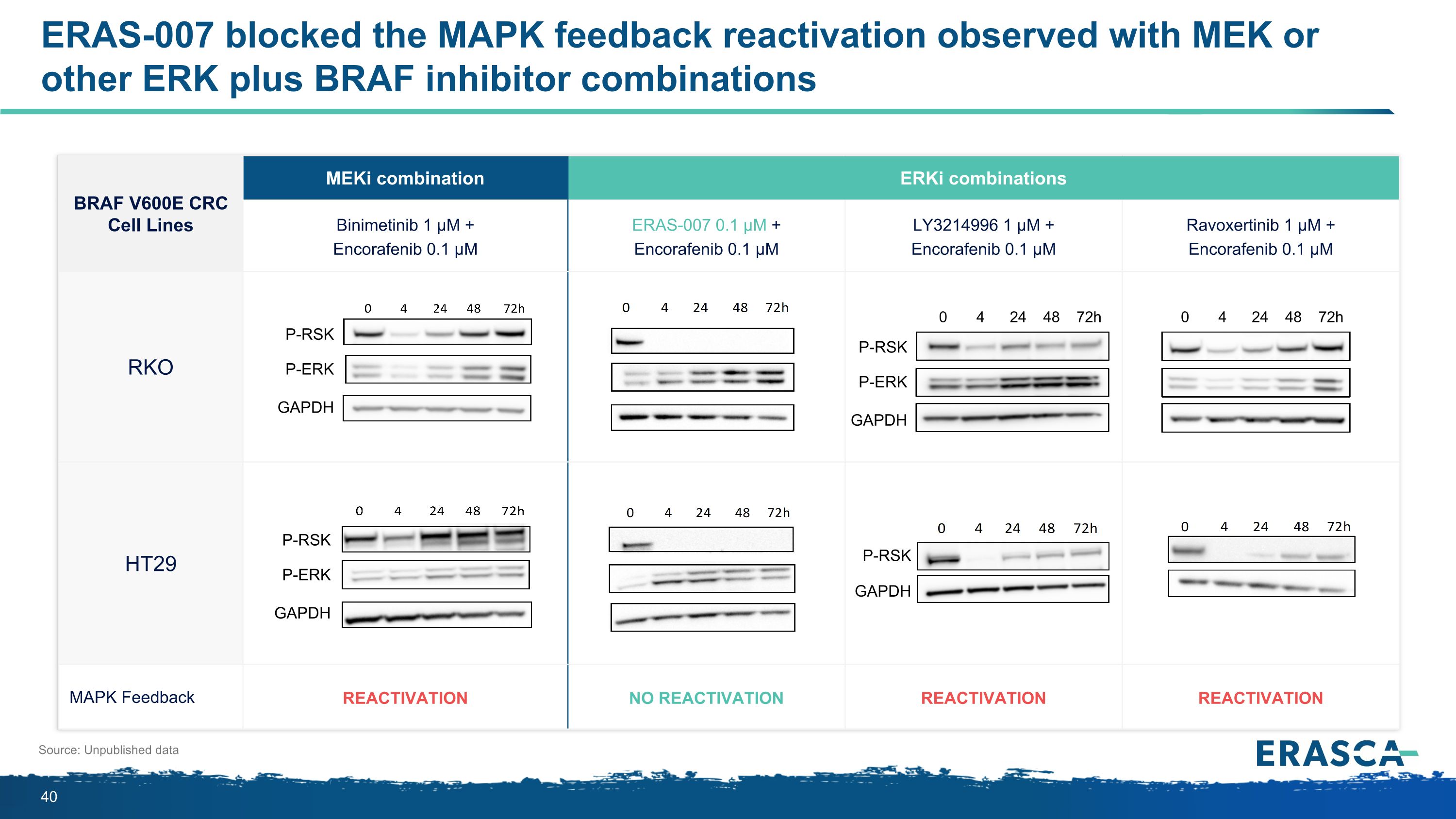
BRAF V600E CRC 細胞系 meKi 組合 ERKI 組合比尼美替尼 1 µM + Encorafenib 0.1 µM ERAS-007 0.1 µM + Encorafenib 0.1 µM LY3214996 1 µM + Encorafenib 0.1 µM Rovoxertinib 1 µM + Encorafenib 1 µM + Encorafenib 0.1 µM RKO HT29 MAPK 反饋重新激活無重新激活來源:未公佈的數據 P-RSK P-ERK GAPDH P-RSK P-ERK GAPDH P-RSK GAPDH P-RSK P-ERK GAPDH 0 4 24 48 72h 0 4 24 48 72h ERAS-007 阻斷了在 MEK 或其他 ERK 加 BRAF 抑制劑組合中觀察到的 MAPK 反饋重新激活
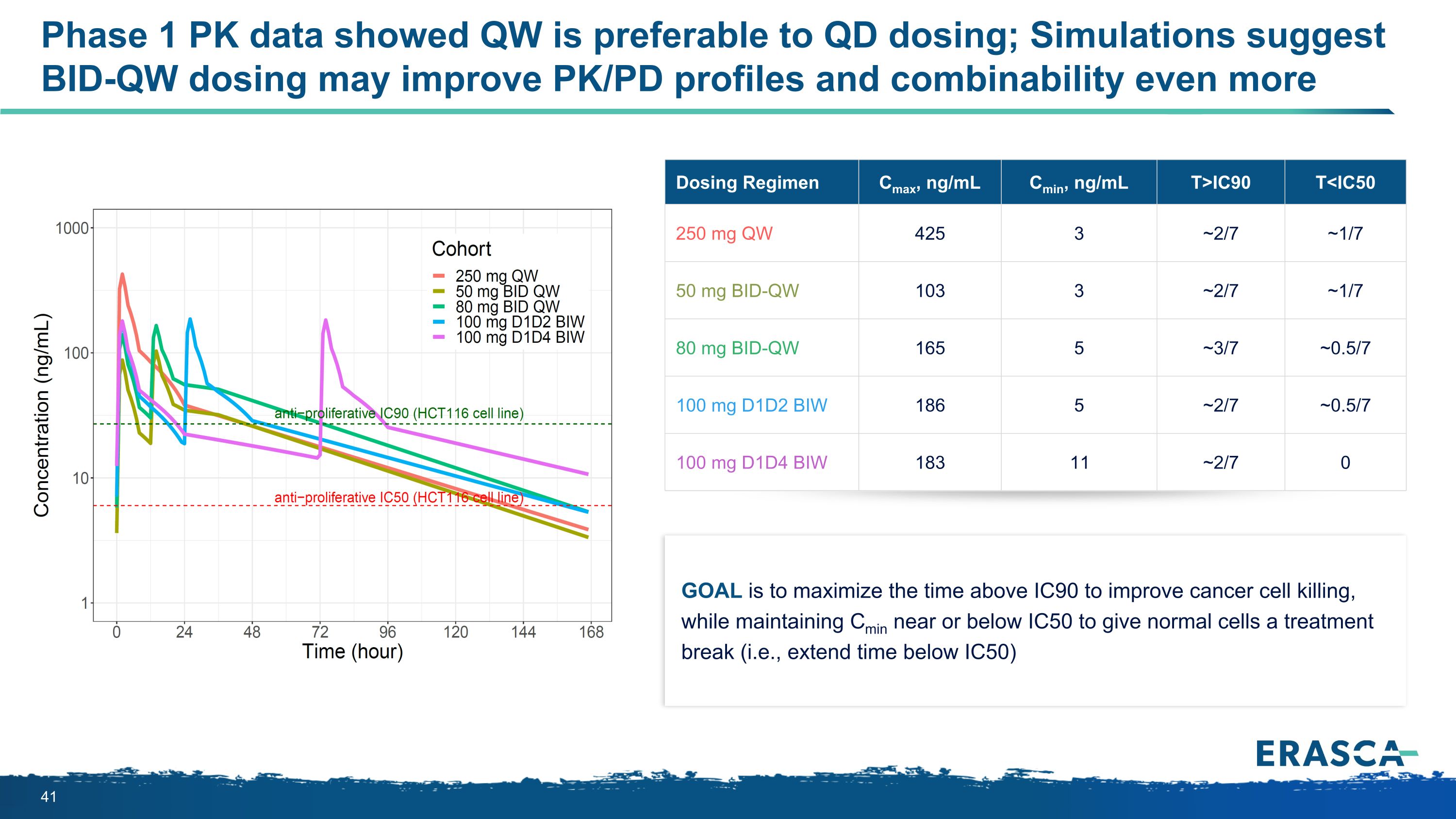
目標是最大限度地延長IC90以上的時間以改善癌細胞的殺傷效果,同時保持Cmin接近或低於IC50,讓正常細胞獲得治療間隔(即延長至低於IC50的時間)給藥方案 Cmax、ng/mL Cmin、ng/mL T>IC90 T