

Repotrectinib Topline TRIDENT-1 第 1/2 階段數據顯示在 ROS1+ NSCLC 投資者電話會議和網絡直播中,2022 年 4 月 13 日附錄 99.1

本演示文稿中非歷史事實陳述的陳述均為前瞻性陳述。此類前瞻性陳述包括但不限於有關我們的研究和臨牀開發活動、計劃和預計時間表、業務戰略和計劃、監管事宜、未來運營管理目標、市場規模和機會、我們完成某些里程碑的能力,以及我們對候選藥物相對於競爭療法相對優勢的期望的陳述。諸如 “相信”、“可以”、“繼續”、“預期”、“可能”、“估計”、“計劃”、“預測”、“期望”、“打算”、“將”、“可能”、“目標”、“即將到來”、“短期”、“里程碑”、“潛力”、“目標” 或這些術語或類似表述的否定詞旨在識別前瞻性陳述,儘管並非都是前瞻性陳述語句必須包含這些識別詞。由於此類陳述受風險和不確定性的影響,因此實際結果可能與此類前瞻性陳述所表達或暗示的結果存在重大差異。導致前瞻性陳述不確定性的風險包括但不限於:我們的臨牀前研究和臨牀試驗可能不成功;包括美國食品藥品監督管理局(FDA)在內的監管機構可能不同意我們對候選藥物臨牀試驗數據的解釋;我們可能會決定,監管機構可能會要求我們進行額外的臨牀試驗或修改正在進行的臨牀試驗;我們可能會延遲開始、註冊、完成或完成的分析我們的候選藥物的臨牀測試,或者我們的臨牀試驗設計的充分性或臨牀試驗的執行可能會出現重大問題,這可能會導致成本增加和延遲,或限制我們獲得監管部門批准的能力;我們的候選藥物可能無法獲得監管部門的批准或成功商業化;我們的候選藥物意外的不良副作用或治療療效不足可能會延遲或阻礙監管機構的批准或商業化;COVID-19 疫情可能會擾亂我們的業務,我們所依賴的第三方,包括推遲或以其他方式幹擾我們的研發活動;我們可能無法獲得額外的融資。不應將這些前瞻性陳述視為預測或承諾,也不應將其視為暗示任何保證或保證此類前瞻性陳述所依據的假設是正確或詳盡無遺的。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本演示文稿發佈之日。我們向美國證券交易委員會提交的文件中更全面地描述了影響我們的其他風險和不確定性。我們沒有義務更新此類聲明以反映在聲明發表之日之後發生的事件或存在的情況。本演示文稿討論了正在進行臨牀研究且尚未獲得美國食品藥品監督管理局批准上市的候選藥物。沒有説明這些候選藥物在研究這些候選藥物時的安全性或有效性。前瞻性陳述

今天的議程簡介 Athena Countouriotis,醫學博士,總裁兼首席執行官 Repotrectinib Topline TRIDENT-1 第 1/2 期數據 ROS1+ NSCLC Mohammad Hirmand,醫學博士,首席醫學官問答小組 Athena Countouriotis,醫學博士,總裁兼首席執行官穆罕默德·赫爾曼德醫學博士,首席醫學官亞歷山大·德里隆,紀念館早期藥物開發服務主任斯隆·凱特琳癌症中心
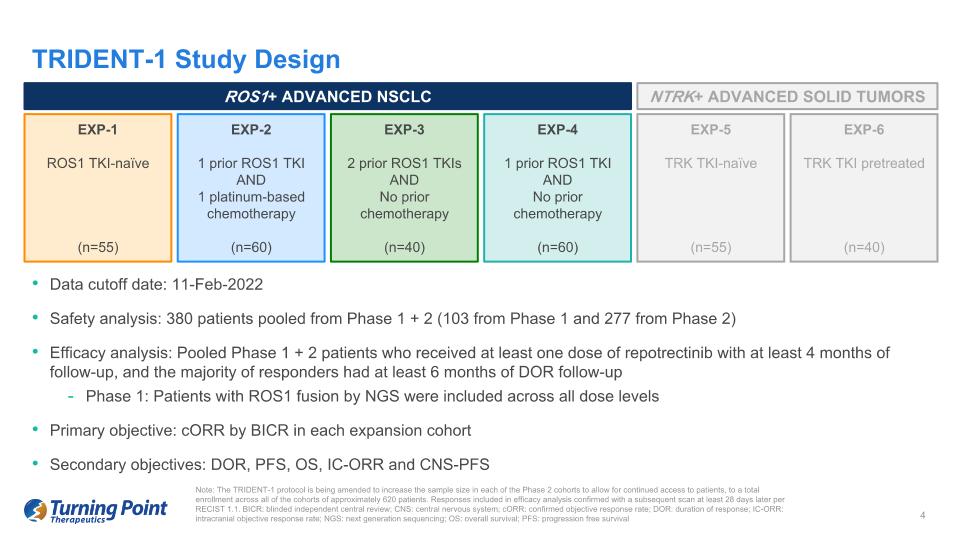
數據截止日期:2022年2月11日安全性分析:1期+2期共有380名患者(1期103例,2期277例)療效分析:合併1期+2期患者,至少接受一劑瑞波替尼且隨訪時間至少為4個月,大多數受訪者接受了至少6個月的DOR隨訪第1階段:所有劑量均包括NGS的ROS1融合患者等級主要目標:每個擴展隊列中按 BICR 劃分的 CorR 次要目標:DOR、PFS、OS、IC-ORR 和 CNS-PFS 注意:TRIDENT-1 協議正在修訂為增加每個2期羣組的樣本量,以允許持續接觸患者,使所有隊列的總入學人數達到約620名患者。根據RECIST 1.1,療效分析中包含的答覆經至少28天后的後續掃描得到證實。BICR:盲人獨立中樞審查;中樞神經系統:中樞神經系統;CorR:確診的客觀緩解率;DOR:反應持續時間;IC-ORR:顱內客觀反應率;NGS:下一代測序;操作系統:無進展生存 TRIDENT-1 研究設計 ROS1+ 高級非小細胞肺癌 NTRK+ 晚期實體瘤 EXP-1 ROS1 TKI-Naieve(n=55)EXP-2 1 之前的 ROS1 TKI 和 1 次鉑類化療 (n=60) EXP-3 2 次之前的 ROS1 TKI 且之前沒有接受過化療 (n=40) EXP-4 1 之前沒有接受過 ROS1 TKI 且之前沒有化療 (n=60) EXP-5 TRK TKI-naieve (n=55) EXP-6 TRK TKI 預處理 (n=40)
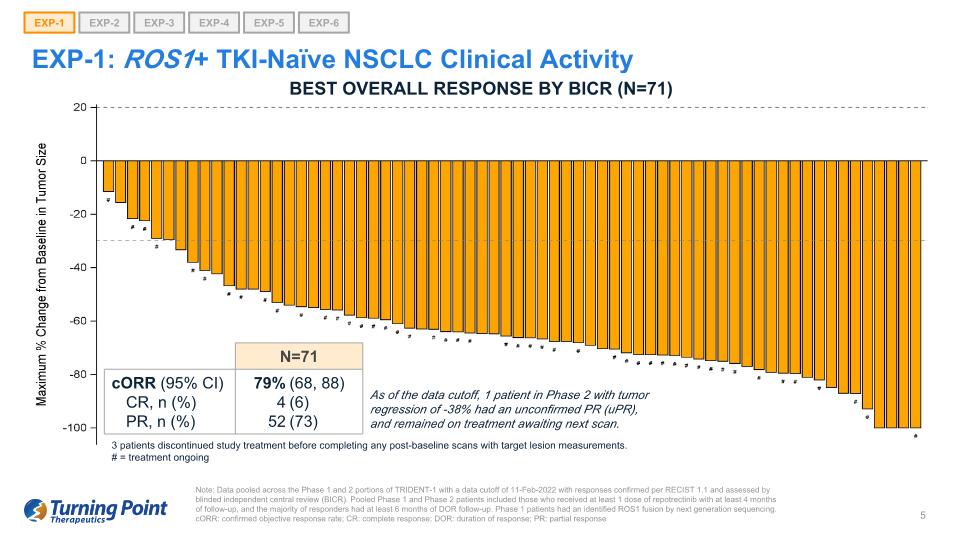
EXP-1:ROS1+ TKI-naíve NSCLC 臨牀活動説明:彙總了 TRIDENT-1 第 1 期和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,根據RECIST 1.1 確認了答覆,並由盲目獨立中心審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀反應率;CR:完全反應;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-2 EXP-3 EXP-4 EXP-5 EXP-6 N=71 CorR (95% CI) CR、n (%) PR、n (%) 79% 4 52 (68、88) (6) (73) 截至數據截止時,1 名患者患有腫瘤 -38% 的迴歸是未經證實的 PR(uPR),並且仍在接受治療等待下一次掃描。BICR 的最佳總體反應(N=71)3 名患者在完成任何基線後掃描並進行目標病變測量之前停止了研究治療。# = 治療正在進行中
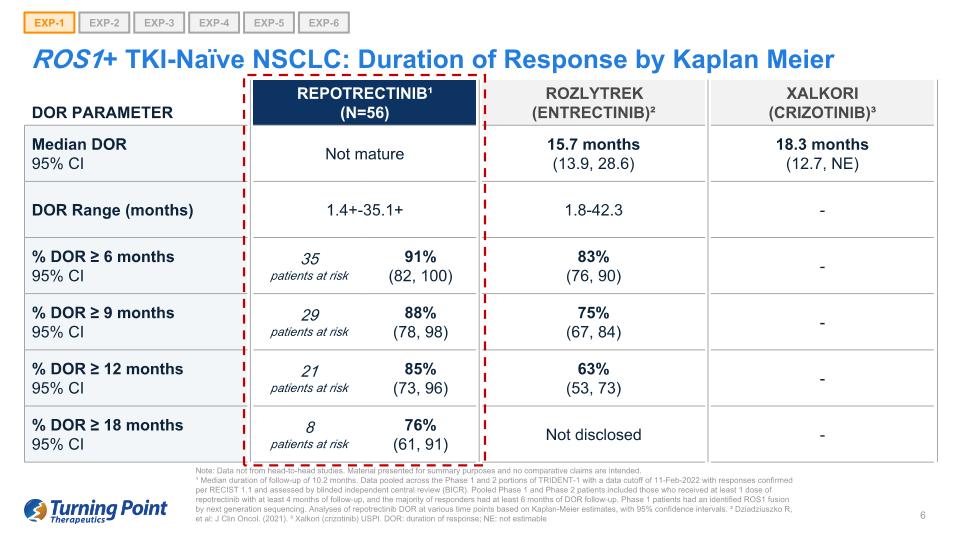
ROS1+ TKI-naieve NSCLC:Kaplan Meier EXP-1 EXP-2 EXP-3 EXP-4 EXP-5 EXP-6 DOR 參數 Repotrectinib¹(N=56)Rozlytrek(恩曲替尼)² Xalkori(crizotinib)³ 中位數 95% 置信區間未成熟 15.7 個月(13.9,28.6)18.3 個月(12.7,NE)DOR 範圍(月)1.1 4+-35.1+ 1.8-42.3-% DOR ≥ 6 個月 95% 置信區間 35 名高危患者 91% (82, 100) 83% (76, 90)-% DOR ≥ 9 個月 95% 置信區間 29 名高危患者 88% (78, 98) 75% (67, 84)-% DOR ≥ 12 個月 95% 置信區間 21 名風險患者 85% (73, 96) 63% (53, 73)-% DOR ≥ 18 個月置信區間 95% 8 名患者處於危險之中 76% (61、91)) 未披露——注意:數據不是來自正面交鋒的研究。提供的材料僅供彙總之用,無意進行比較索賠。¹ 隨訪時間中位數為10.2個月。彙總了 TRIDENT-1 第 1 階段和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 進行了確認,並由盲目獨立中央審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。通過下一代測序,1期患者已確定了ROS1融合。根據卡普蘭-邁爾的估計,對不同時間點的瑞波替尼DOR進行分析,置信區間為95%。² Dziadziuszko R等人:J Clin Oncol。(2021年)。³ Xalkori(crizotinib)USPI。DOR:響應時間;NE:不可估計
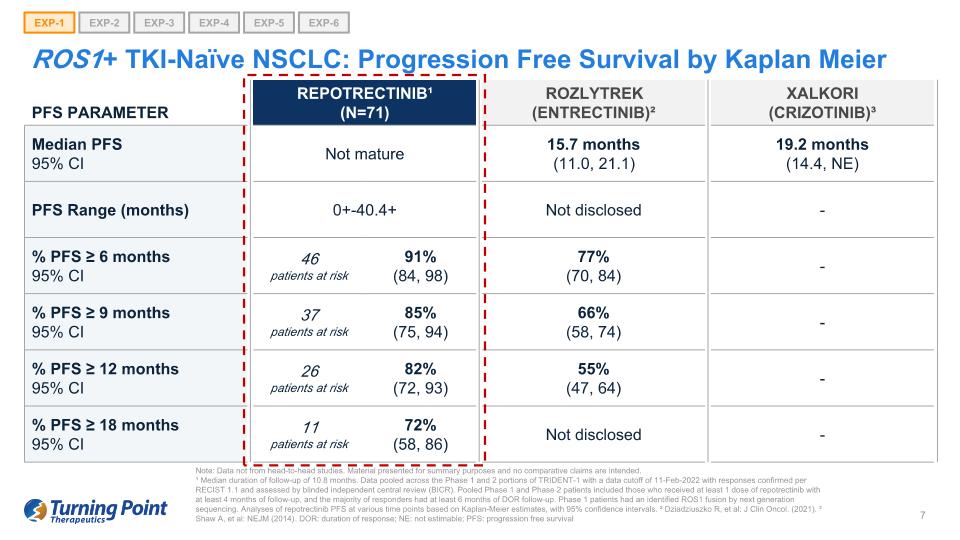
ROS1+ TKI-naieve NSCLC:無進展生存作者 Kaplan Meier EXP-1 EXP-2 EXP-3 EXP-4 EXP-5 EXP-6 PFS 參數 Repotrectinib¹(N=71)Rozlytrek(恩曲替尼)² Xalkori(crizotinib)³ PFS 中位數 95% 置信區間未成熟 15.7 個月(11.0、21.1)19.2 個月(14.4,NE)PFS 範圍(月) 0+-40.4+ 未披露-% PFS ≥ 6 個月 95% 置信區間 46 位風險患者 91% (84, 98) 77% (70, 84)-% PFS ≥ 9 個月 95% 置信區間 37 位風險患者 85% (75, 94) 66% (58, 74)-% PFS ≥ 12 個月 95% 置信區間 26 位風險患者 82% (72, 93) 55% (47, 64)-% PFS ≥ 12 個月 18 個月 95% 置信區間 11 名患者處於危險之中 72%(58、86) 未披露——注意:數據並非來自正面交鋒研究。提供的材料僅供彙總之用,無意進行比較索賠。¹ 隨訪時間中位數為10.8個月。彙總了 TRIDENT-1 第 1 階段和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 進行了確認,並由盲目獨立中央審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪時間至少為4個月的患者,大多數應答者接受了至少6個月的DOR隨訪。通過下一代測序,1期患者已確定了ROS1融合。根據卡普蘭-邁爾的估計,對瑞波替尼PFS在不同時間點的分析,置信區間為95%。² Dziadziuszko R,等人:J Clin Oncol。(2021)。³ Shaw A,等人:NEJM(2014)。DOR:反應持續時間;NE:不可估計;PFS:無進展生存

注意:TRIDENT-1 第 1 階段和第 2 階段的數據彙總,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 得到確認,並由盲目獨立中央審查 (BICR) 評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀緩解率;CR:完全反應;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-3 EXP-4 EXP-5 EXP-6 EXP-2 EXP-2:1 個先前 TKI 和 1 個鉑基化療ROS1+ TKI預治療的非小細胞肺癌臨牀活性 N=26 CorR (95% CI) CR,n (%) PR,n (%) 42% 1 10 (23, 63) (4) (38) DOR N 11 範圍(月)3.6-18.3+ BICR 的最佳總體反應(N=26)1 名患者在完成任何目標病變的基線後掃描之前停止了研究治療測量。# = 治療正在進行中

注意:TRIDENT-1 第 1 階段和第 2 階段的數據彙總,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 得到確認,並由盲目獨立中央審查 (BICR) 評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀緩解率;CR:完全緩解;DOR:緩解持續時間;PR:部分反應 EXP-1 EXP-4 EXP-5 EXP-6 EXP-2 EXP-3 EXP-3:2 個先前沒有化療的 TKI+ TKI預治療的非小細胞肺癌臨牀活性最佳總體反應 BICR (N=18) N=18 CorR (95% CI) CR,n (%) PR, n (%) 28% 1 4 (10, 54) (6) (22) DOR N 5 範圍(月)1.9+-20.3+ 3 名患者在完成任何標靶病變測量的基線後掃描之前停止了研究治療。# =治療正在進行中
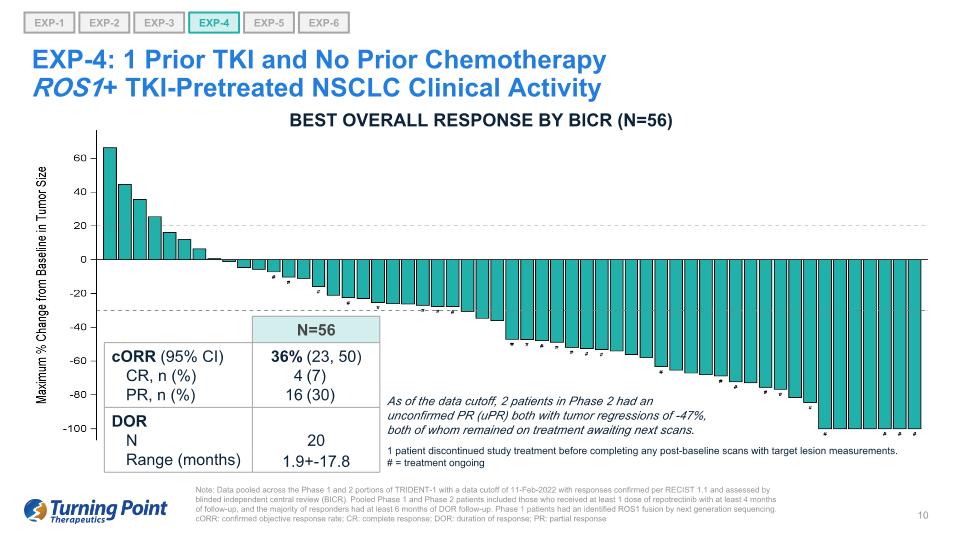
注意:TRIDENT-1 第 1 階段和第 2 階段的數據彙總,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 得到確認,並由盲目獨立中央審查 (BICR) 進行評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀緩解率;CR:完全緩解;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-3 EXP-5 EXP-6 EXP-2 EXP-4 EXP-4:1 先前 TKI 和未進行過化療ROS1+ TKI預治療的 NSCLC 臨牀活動截至數據截止時,2 名處於未經證實的 PR (uPR) 均伴有腫瘤迴歸 -47%,兩人仍在接受治療等待下一次掃描。BICR 的最佳總體反應 (N=56) 1 名患者在完成任何基線後掃描並進行目標病變測量之前停止了研究治療。# = 治療進行中 N=56 corR (95% CI) CR、n (%) PR、n (%) 36% 4 16 (23、50) (7) (30) DOR N 20 範圍(月)1.9+-17.8

注意:在 TKI 預治療的患者中,有 10 名患者沒有基線可評估信息來確定是否存在 ROS1 G2032R 溶劑前端突變。彙總了 TRIDENT-1 第 1 階段和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 進行了確認,並由盲目獨立中央審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪時間至少為4個月的患者,大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀反應率;CR:完全反應;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-5 EXP-6 ROS1+ TKI 預處理的 NSCLC 臨牀活動基線患者 ROS1 G2032R 溶劑前突變患者 EXP-2 EXP-3 EXP-4 最佳總體反應 BICR(N = 17)2 名患者在完成任何基線後掃描和靶損測量之前停止了研究治療. # = 正在進行的治療 N=17 corR (95% 置信區間) CR、n (%) PR、n (%) 59% 1 9 (33、82) (6) (53)DOR N 10 區間(月)1.9+-20.3+
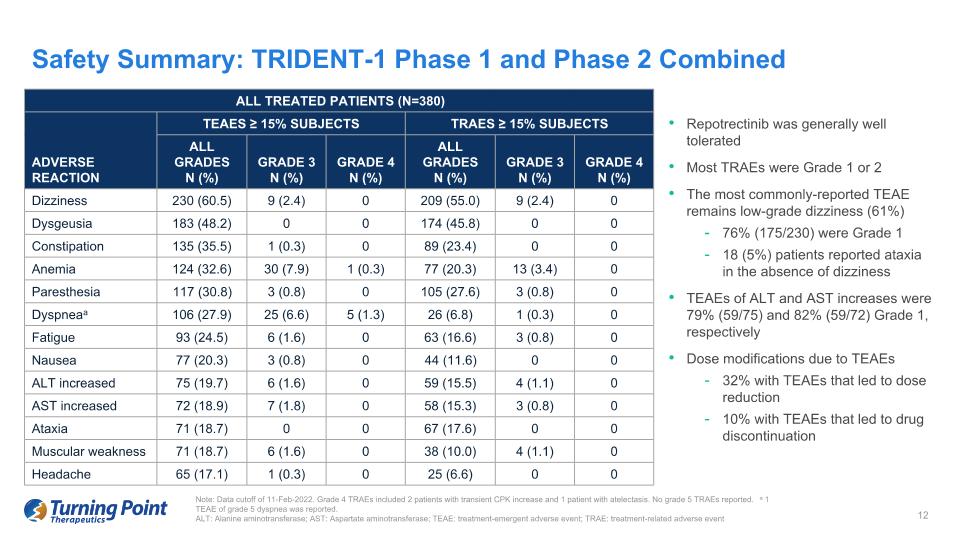
所有接受治療的患者 (N=380) 不良反應 TEAES ≥ 15% 受試者 TRAES ≥ 15% 受試者所有等級 3N (%) 4N 級 (%) 所有等級 N (%) 3N 級 (%) 4N 級 (%) 4N 級 (%) 頭暈 230 (60.5) 9 (2.4) 9 (2.4) 0 Dysgeusia 183 (48.2) 0 174 (0) 45.8) 0 便祕 135 (35.5) 1 (0.3) 0 89 (23.4) 0 0 貧血 124 (32.6) 30 (7.9) 1 (0.3) 77 (20.3) 13 (3.4) 0 感覺異常 117 (30.8) 3 (0.8) 0 105 (27.6) 3 (0.8) 0 呼吸困難 106 (27.9) 25 (6.6) 5 (1.3) 26 (6.8) 1 (0.3) 0 疲勞 93 (24.5) 6 (1.6) 0 63 (16.6) 3 (0.8) 0 噁心 77 (20.3) 3 (0.8) 0 44 (11.6) 0 0 ALT增加 75 (19.7) 6 (1.6) 0 59 (15.5) 4 (1.1) 0 AST 增加 72 (18.9) 7 (1.8) 0 58 (15.3) 3 (0.8) 0 共濟失調 71 (18.7) 0 0 0 67 (17.6) 0 0 肌肉無力 71 (18.7) 6 (1.6) 0 38 (10.0) 4 (1.1) 0 頭痛 65 (17.1) 1 (0.3) 0 25 (6.6) 0 0 安全摘要:TRIDENT-1 第 1 階段和第 2 階段合併注意:數據截止日期為 2022 年 2 月 11 日。4級TRAE包括2名短暫性CPK升高的患者和1名肺不張患者。未報告 5 級 TRAE。報告了 1 個 TEAE 為 5 級呼吸困難。ALT:丙氨酸氨基轉移酶;AST:天冬氨酸氨基轉移酶;TEAE:治療緊急不良事件;TRAE:治療相關不良事件 Repotrectinib 的耐受性總體良好。最常報告的 TEAE 仍然是低度頭暈(61%)76%(175/230)是 1 級 18(5%)患者在沒有頭暈的情況下報告了共濟失調 ALT 和 AST 增加的 TEAE 分別為 79%(59/75)和 82%(59/72)1 級,TEAE 導致的劑量調整為 32%這導致了TEAE的劑量減少了10%,從而導致藥物停產

ROS1+ TKI-naieve NSCLC 隊列的 TRIDENT-1 頭條數據與 79%(95% 置信區間:68、88)的潛在同類最佳概況 CorR 一致,不包括 1 名等待確認性掃描 12 個月的 DOR 里程碑為 85% 和 PFS 里程碑為 82% 的患者,早期鼓舞人心的 18 個月的 DOR 和 PFS 里程碑分別為 76% 和 72%,ROS1中位數不成熟令人鼓舞的數據 + 經TKI預處理的非小細胞肺癌,沒有批准的靶向療法 n=380 名患者普遍耐受性良好,安全性和耐受性與先前報告的一致調查結果預計將在2022年第二季度與美國食品藥品管理局舉行保密協議之前討論所有四個 ROS1+ 非小細胞肺癌隊列的數據計劃在即將於2022年下半年舉行的醫學會議上介紹來自 TRIDENT-1 ROS1+ NSCLC 隊列的詳細研究結果:摘要和後續步驟

問答小組 Athena Countouriotis,醫學博士總裁兼首席執行官穆罕默德·赫爾曼德,醫學博士首席醫學官亞歷山大·德里隆,紀念斯隆·凱特琳癌症中心早期藥物開發服務醫學博士主任

Repotrectinib Topline TRIDENT-1 第 1/2 階段數據顯示在 ROS1+ NSCLC 投資者電話會議和網絡直播中,2022年4月13日