

下一代精準腫瘤醫學公司概述 2022年5月附錄 99.2

本演示文稿中非歷史事實陳述的陳述均為前瞻性陳述。此類前瞻性陳述包括但不限於有關我們的研究和臨牀開發活動、計劃和預計時間表、業務戰略和計劃、監管事宜、未來運營管理目標、市場規模和機會、我們完成某些里程碑的能力,以及我們對候選藥物相對於競爭療法相對優勢的期望的陳述。諸如 “相信”、“可以”、“繼續”、“預期”、“可能”、“估計”、“計劃”、“預測”、“期望”、“打算”、“將”、“可能”、“目標”、“即將到來”、“短期”、“里程碑”、“潛力”、“目標” 或這些術語或類似表述的否定詞旨在識別前瞻性陳述,儘管並非都是前瞻性陳述語句必須包含這些識別詞。由於此類陳述受風險和不確定性的影響,因此實際結果可能與此類前瞻性陳述所表達或暗示的結果存在重大差異。導致前瞻性陳述不確定性的風險包括但不限於:我們的臨牀前研究和臨牀試驗可能不成功;包括美國食品藥品監督管理局(FDA)在內的監管機構可能不同意我們對候選藥物臨牀試驗數據的解釋;我們可能會決定,監管機構可能會要求我們進行額外的臨牀試驗或修改正在進行的臨牀試驗;我們可能會延遲開始、註冊、完成或完成的分析我們的候選藥物的臨牀測試,或者我們的臨牀試驗設計的充分性或臨牀試驗的執行可能會出現重大問題,這可能會導致成本增加和延遲,或限制我們獲得監管部門批准的能力;我們的候選藥物可能無法獲得監管部門的批准或成功商業化;我們的候選藥物意外的不良副作用或治療療效不足可能會延遲或阻礙監管機構的批准或商業化;COVID-19 疫情可能會擾亂我們的業務,我們所依賴的第三方,包括推遲或以其他方式幹擾我們的研發活動;我們可能無法獲得額外的融資。不應將這些前瞻性陳述視為預測或承諾,也不應將其視為暗示任何保證或保證此類前瞻性陳述所依據的假設是正確或詳盡無遺的。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本演示文稿發佈之日。我們向美國證券交易委員會提交的文件中更全面地描述了影響我們的其他風險和不確定性。我們沒有義務更新此類聲明以反映在聲明發表之日之後發生的事件或存在的情況。本演示文稿討論了正在進行臨牀研究且尚未獲得美國食品藥品監督管理局批准上市的候選藥物。沒有説明這些候選藥物在研究這些候選藥物時的安全性或有效性。前瞻性陳述
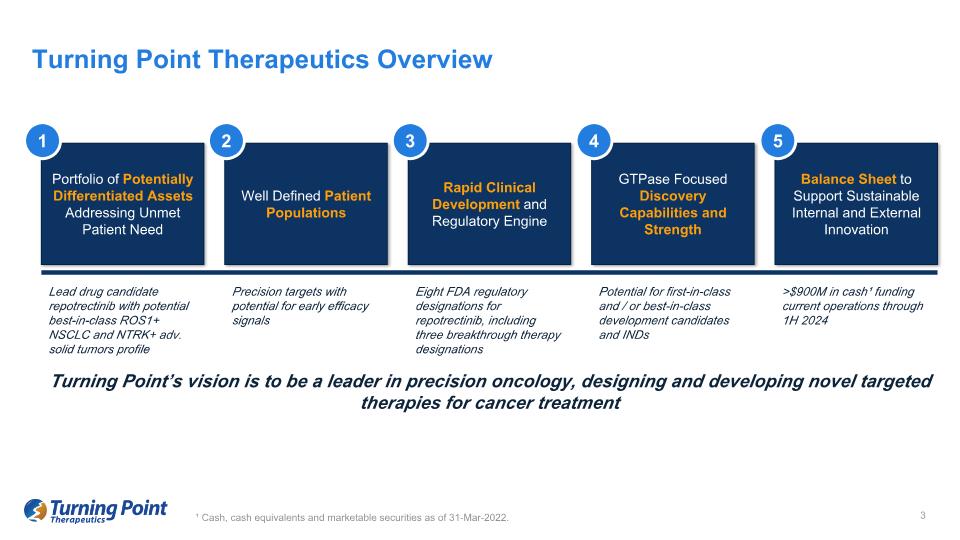
¹ 截至2022年3月31日的現金、現金等價物和有價證券。Turning Point Therapeutics概述Turning Point的願景是成為精準腫瘤學領域的領導者,為癌症治療設計和開發新的靶向療法產品組合,以滿足未滿足的患者需求 1 明確的患者羣體 2 快速臨牀開發和監管引擎 3 以GTPase為重點的發現能力和優勢 4 支持可持續內部和外部創新的資產負債表 5 具有潛在同類最佳ROS1+ NSCLC和NTRK+ adv的主要候選藥物repotrectinib. 實體瘤概況瑞波替尼的八項美國食品藥品管理局監管稱號,包括三種突破性療法名稱:有潛力推出同類首創和/或同類最佳的研發候選藥物和超過9億美元的現金¹,為2024年上半年之前的當前運營提供資金的精準靶標,有可能產生早期療效信號
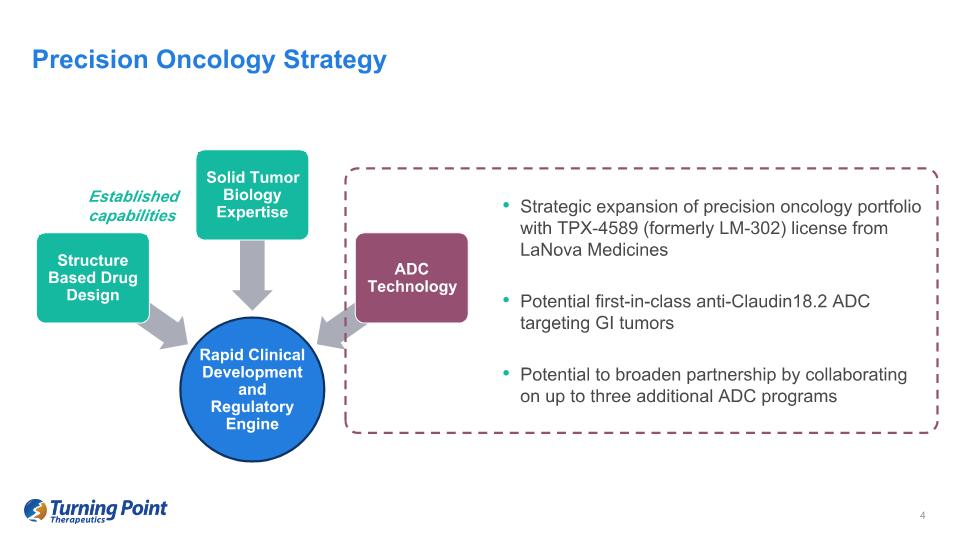
利用 LaNova Medicines 的 TPX-4589(前身為 LM-302)許可對精準腫瘤學產品組合進行戰略擴張潛在的針對胃腸道腫瘤的同類首創抗 Claudin18.2 ADC 通過合作可能擴大合作伙伴關係精準腫瘤策略快速臨牀開發和基於監管引擎結構的藥物設計實體瘤生物學專業知識 ADC 技術既有能力
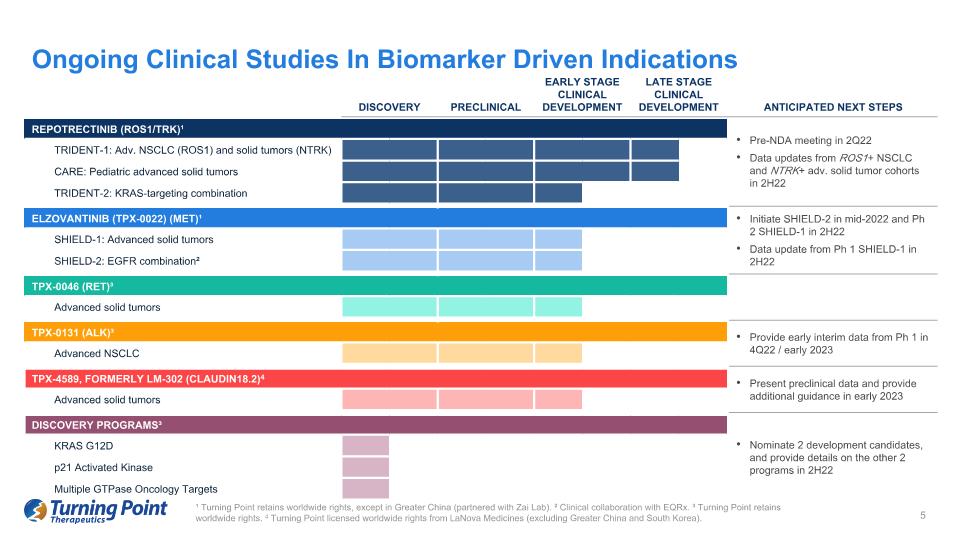
正在進行的生物標記物驅動適應症的臨牀研究 DISCOVERY 臨牀前早期臨牀開發預期的下一步行動 REPOTRECTINIB (ROS1/TRK) ¹ 在 22 年第 2 季度舉行保密協議前會議 TRIDENT-1 下半年 ROS1+ NSCLC 和 NTRK+ adv.實體瘤隊列數據更新:高級非小細胞肺癌 (ROS1) 和實體瘤 (NTRK) CARE:兒科晚期實體瘤 TRIDENT-2: KRAS 靶向組合 ELZOVANTINIB (TPX-0022) (MET) ¹ 將於 2022 年中期啟動 SHIELD-2,Ph 2 SHIELD-1 於 22 年下半年啟動 Ph 1 SHIELD-1 的數據更新 SHIELD-1:高級固體腫瘤 SHIELD-2:表皮生長因子組合² TPX-0046(RET)³ 晚期實體瘤 TPX-0131 (ALK) ³ 提供 22 年第 4 季度/2023 年初來自 Ph 1 的早期中期數據 Alvanced NSCLC TPX-4589,前身為 LM-302 (CLAUDIN18.2) 4 在 2023 年初提供臨牀前數據並提供更多指導晚期實體瘤探索計劃 ³ 提名 2 個候選開發項目,並提供 2H22 KRAS G12D p21 Activated Kinas 中其他 2 個項目的詳細信息多重GTPase腫瘤學靶點 ¹ Turning Point 保留全球版權,大中華區(與 Zai Lab 合作)除外。² 臨牀與 eqRx 合作。³ Turning Point 保留全球版權。4 Turning Point 已獲得 LaNova Medicines 的全球版權(不包括大中華區和韓國)。
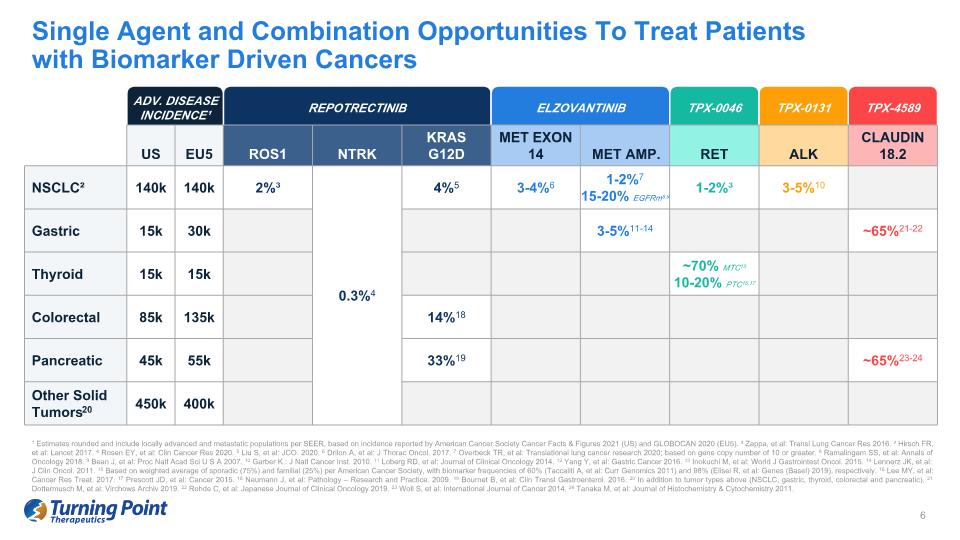
¹ 根據美國癌症協會2021年癌症事實與數據(美國)和GLOBOCAN 2020(EU5)報告的發病率,四捨五入估計值,包括每個SEER的局部晚期和轉移人羣。² Zappa等人:Transl Luncer Res 2016。³ Hirsch FR 等人:Lisch FR,2017。4 Rosen EY,等人:2020 年臨牀癌症研究報告。5 Liu S 等人:JCO. 2020。6 Drs Ilon A 等人:J Thorac Oncol。2017。7 Overbeck TR 等人:2020 年轉化肺癌研究;基於 10 或以上的基因拷貝數。8 Ramalingam SS 等人:2018 年腫瘤學年鑑。9 Bean J 等人:Proc NatlAcad Sci U S A 2007. 10 Garber K.: J Natl Cancer Inst. 2010。11 Loberg RD,等人:2014 年臨牀腫瘤學雜誌。12 Yang Y 等人:2016 年胃癌。13 Inokuchi M,等人:World J Gastrointest Oncol。2015。14 Lennerz JK,等人:J Clin Oncol。2011。15 基於散發的加權平均值(75%)和家族(25%),根據美國癌症協會,生物標誌物頻率分別為 60%(Taccaliti A 等人:Curr Genomics 2011)和 98%(Elisei R 等人:基因(巴塞爾)2019)。16 Lee MY 等人:Cancer Res Treat。2017。17 Prescott JD,等人:Cancer 2015。18Neumann J 等人:病理學——研究與實踐。2009。19 Bournet B,等人:Clin Transl Gastroenterol。2016。20 除了上述腫瘤類型(非小細胞肺癌、胃、甲狀腺、結直腸和胰腺)外。21 Dottermusch M,等人:2019 年 Virchows Archiv。22 Rohde C 等人:2019 年日本臨牀腫瘤學雜誌。23 Wolde L S 等人:《2014年國際癌症雜誌》。24 Tanaka M,等人:《2011年組織化學與細胞化學雜誌》。治療生物標誌物驅動型癌症患者的單一藥物和組合機會 REPOTRECTINIB ELZOVANTINIB TPX-4589 TPX-0046 ADV。疾病發病率¹ TPX-0131 美國 EU5 ROS1 NTRK KRAS G12D MET Exon 14 MET EXON 14 MET Amp.RET ALK Claudin18.2 NSCLC² 140k 140k 2% ³ 0.3% 4 4% 5 3-4% 6 1-2% 7 15-20% egfrm8,9 1-2% ³ 3-5% 10 胃部 15k 30k 3-5% 11-14 ~ 65% 21-22 甲狀腺 15k 15k ~ 70% MTC15 10-20% PTC16,17 結直腸 85k 135k 14% 18 胰腺 45k 55k 33% 19 ~ 65% 23-24 其他實體腫瘤20 450k 400k

Repotrectinib 一種高選擇性 ROS1/TRK 抑制劑
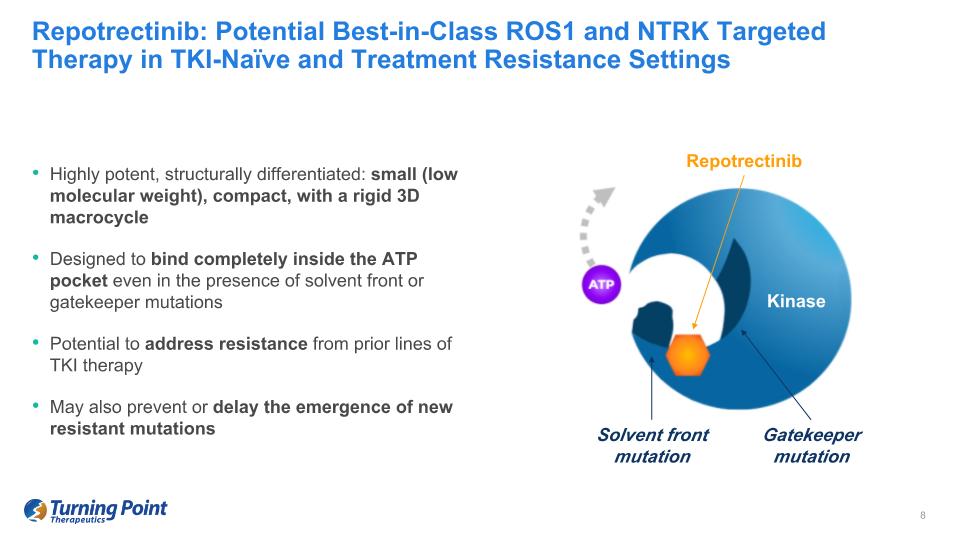
Repotrectinib:潛在的同類最佳ROS1和NTRK靶向療法在TKI-naíve和治療耐藥性環境中具有高效、結構差異化:小(低分子量)、緊湊、採用剛性三維宏循環設計即使存在溶劑前端突變或看門人突變也可能在ATP口袋內完全結合解決先前TKI療法的耐藥性可能還可以預防或延緩新的耐藥突變的出現 Repotrectinib 激酶溶劑正面突變 Gatekeeper 突變
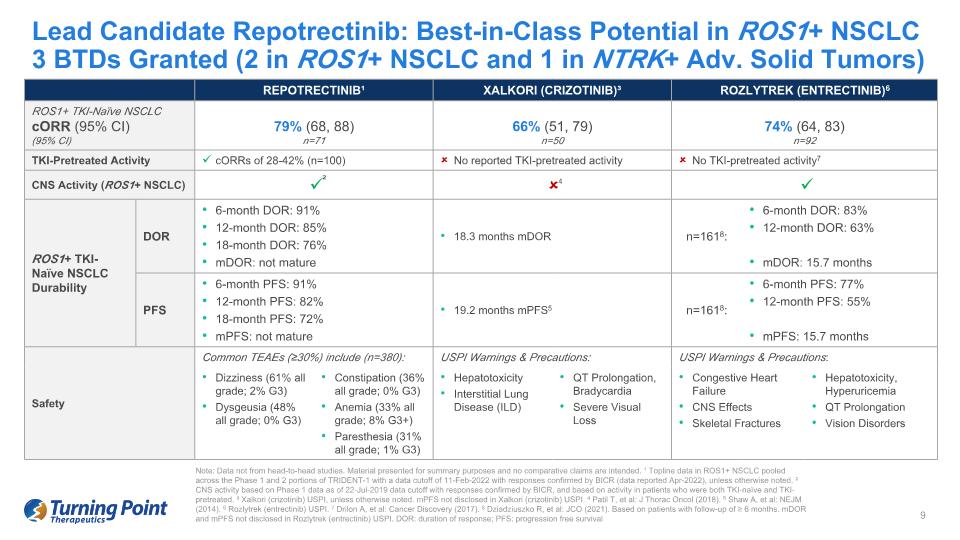
Repotrectinib 主要候選藥物:ROS1+ NSCLC3 BTD 中具有最佳潛力(2 個在 ROS1+ 非小細胞肺癌中,1 個在 NTRK+ 高級實體瘤中)REPOTRECTINIB¹ XALKORI(CIZOTINIB)³ ROZLYTREK(ENTRECTINIB)6 ROZLYTREK(ENTRECTINIB)6 ROS1+ TKI-naive NSCLC CoRR(95% 置信區間)(95% 置信區間)7% 9% (68, 88) n=71 66% (51, 79) n=50 74% (64, 83) n=92 TKI 預處理活性 CORR 為 28-42% (n=100) 未報告 TKI 預處理活性無 TKI 預處理活性7 中樞神經系統活性 (ROS1+ NSCLC) ROS1+ TKI-naieve NSCLC 6 個月耐久性:91% 12 個月 DOR:85% 18 個月 DOR:76% mDor:未到期 18.3 個月 mdOR n=1618:6個月期權率:83% 12個月期權率:63% mDor:15.7個月PFS 6個月PFS:91% 12個月PFS:82%18個月PFS:72%MPF:未到期19.2個月mpfs5 n=1618:6個月PFS:77% 12個月PFS:55%MPF:15.7個月安全常見TEAE(≥ 30%)包括(n=380):USPI 警告和注意事項:USPI 警告和注意事項:安全性頭暈(所有等級 61%;G3 2%)消化不良(所有等級 48%;G3 0%)便祕(所有等級 36%;0% G3)貧血(所有等級 33%;8% G3+)感覺異常(所有等級 31%;1% G3)肝毒性間質肺病 (ILD) QT 延長,心動過速嚴重視力喪失充血性心力衰竭中樞神經系統影響骨折肝毒性、高尿酸血癥、QT 延期視力障礙 4 ² 注意:數據不是來自正面交鋒研究。提供的材料僅供彙總之用,不提供比較索賠。¹ ROS1+ NSCLC 的主要數據彙集在 TRIDENT-1 的第 1 階段和第 2 階段,數據截止日期為 2022 年 2 月 11 日,BICR 確認了答覆(2022年4月報告的數據),除非另有説明。² 中樞神經系統活動基於截至 2019 年 7 月 22 日的第 1 階段數據和 BICR 確認的答覆,並基於中的活動既是 TKI-naieve 又預先接受了 TKI 治療的患者。³ Xalkori(crizotinib)USPI,除非另有説明。Xalkori(crizotinib)USPI 中未披露MPF。4 PatilT 等人:J Thorac Oncol(2018)。5 Shaw A,等人:NEJM(2014)。6 Rozlytrek(恩特雷替尼)USPI。7 Drilon A 等人:癌症發現(2017)。8 Dziadziuszko R 等人:JCO(2021)。基於隨訪時間≥6個月的患者。Rozlytrek(恩瑞替尼)USPI中未披露mDor和MPF。DOR:反應持續時間;PFS:無進展生存

在 ROS1+ NSCLC 和 NTRK+ 晚期實體瘤中可能處於同類最佳狀態,其耐受性總體上良好的安全性在 TKI-naieve 和 TKI 預治療的患者中均具有臨牀意義的療效,包括 G2032R 溶劑前端突變的患者靶向約 2% 的非小細胞肺癌和約 0.3% 的實體瘤作為單一藥物的聯合療法,有可能治療 KRAS-突變實體瘤患者註冊有可能改變ROS1+的護理標準 NSCLC 強大的臨牀概況可滿足龐大的醫療需求註冊人數強勁,多個隊列達到目標註冊¹ 共有 8 個 FDA 監管機構指定,3 個突破性療法名稱,包括 ROS1+ TKI-naíve NSCLC 預保密協議會議,FDA 預計於 2022 年第二季度舉行的 NTRK+ 高級實體瘤保密協議前會議,FDA 預計於 2023 年第一季度在潛在註冊方面繼續取得進展 ¹ EXP-1、EXP-4 和 EXP-6。

TRIDENT-1 一項正在進行的 Repotrectinib 治療包含 ROS1、NTRK1-3 重排的晚期實體瘤患者的1/2期研究
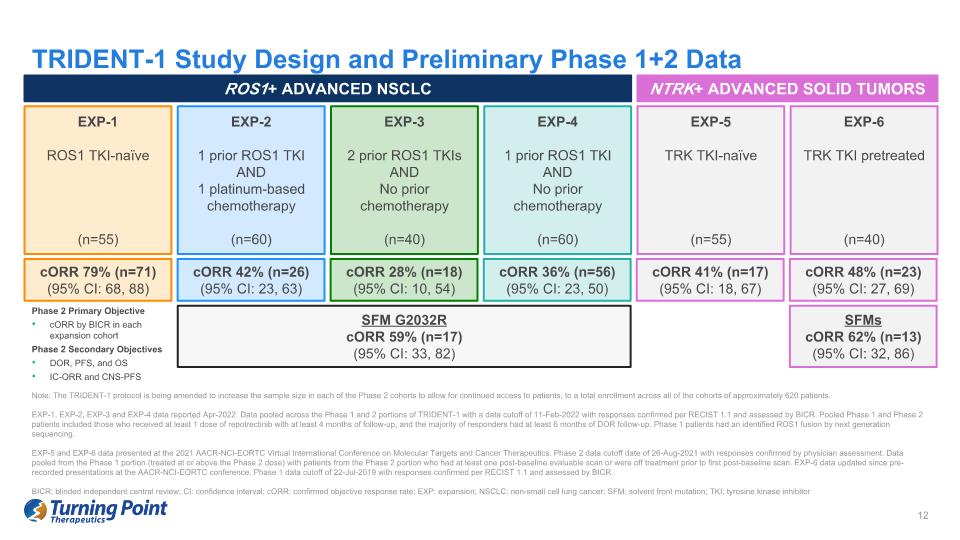
TRIDENT-1 研究設計和初步 1+2 期數據 ROS1+ ADVANCED NSCLC NTRK+ 晚期實體瘤 EXP-1 ROS1 TKI-naieve (n=55) EXP-2 1 個先前的 ROS1 TKI 和 1 個鉑基化療 (n=60) EXP-3 2 個之前的 ROS1 TKI 且之前沒有化療 (n=60) EXP-5 TRK TKI-KI-VE naieve(n=55)EXP-6 TRK TKI 預處理(n=40)CorR 42%(n=26)(95% 置信區間:23、63)CoRR 28%(n=18)(95% 置信區間:10、54)CorR 36%(n=56)(95% 置信區間:68、88)CorR 36%(n=56)(95% 置信區間:68、88)CorR 41%(n=58)CorR 41%(n=58)17) (95% 置信區間:18, 67) CorR 48% (n=23) (95% 置信區間:27, 69) 可持續森林管理 G2032R EXP-4CorR 59%(n=17)(95% 置信區間:33、82)SFM CorR 62%(n=13)(95% 置信區間:32、86)第 2 階段主要目標 BICR 在每個擴展隊列中 CorR 的第 2 階段主要目標 DOR、PFS 和 OS IC-ORR 和 CNS-PFS 注意:正在修訂 TRIDENT-1 協議,以增加每個第 2 階段隊列的樣本量以允許持續訪問對於患者,所有隊列中約有620名患者的總入學人數。EXP-1、EXP-2、EXP-3 和 EXP-4 數據於2022年4月公佈。TRIDENT-1 第 1 階段和第 2 階段的數據彙總在一起,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 予以確認,並由 BICR 評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪時間至少為4個月的患者,大多數應答者接受了至少6個月的DOR隨訪。通過下一代測序,1期患者已確定了ROS1融合。EXP-5 和 EXP-6 數據在 2021 年 AACR-NCI-EORTC 分子靶標和癌症治療虛擬國際會議上公佈。第 2 階段數據截止日期為 2021 年 8 月 26 日,經醫生評估確認了答覆。從 1 期部分(治療等於或高於 2 期劑量)中彙總的數據,涉及至少接受過一次基線後可評估掃描或在首次基線後掃描之前已停止治療的 2 期患者。自從 AACR-NCI-EORTC 會議上預先錄製演講以來,EXP-6 數據已更新。第一階段數據截止日期為2019年7月22日,根據RECIST 1.1確認了答覆,並由BICR進行了評估。BICR:盲目獨立中心審查;CI:置信區間;CorR:確認的客觀反應率;EXP:擴展;NSCLC:非小細胞肺癌;SFM:溶劑前端突變;TKI:酪氨酸激酶抑制劑
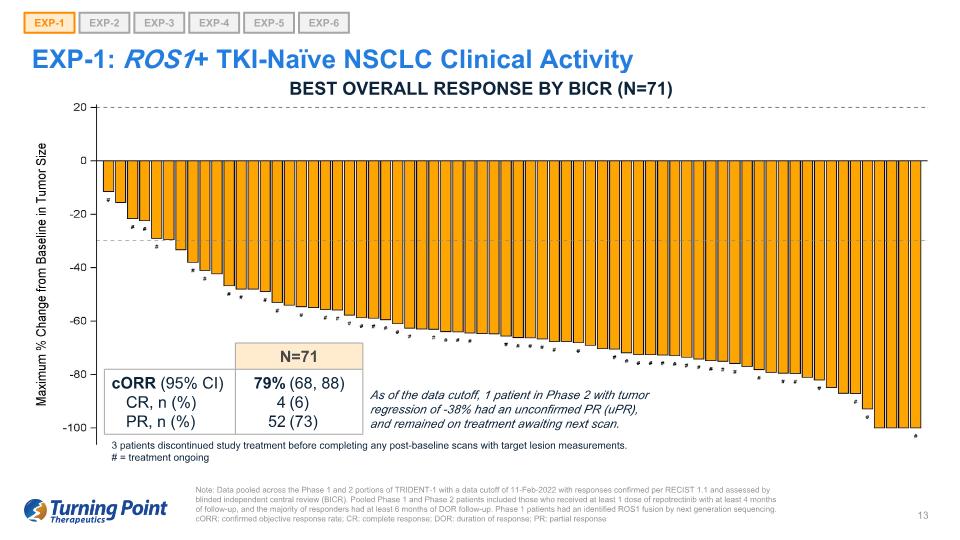
EXP-1:ROS1+ TKI-naíve NSCLC 臨牀活動説明:彙總了 TRIDENT-1 第 1 期和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,根據RECIST 1.1 確認了答覆,並由盲目獨立中心審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀反應率;CR:完全反應;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-2 EXP-3 EXP-4 EXP-5 EXP-6 N=71 CorR (95% CI) CR、n (%) PR、n (%) 79% 4 52 (68、88) (6) (73) 截至數據截止時,1 名患者患有腫瘤 -38% 的迴歸是未經證實的 PR(uPR),並且仍在接受治療等待下一次掃描。BICR 的最佳總體反應(N=71)3 名患者在完成任何基線後掃描並進行目標病變測量之前停止了研究治療。# = 治療正在進行中
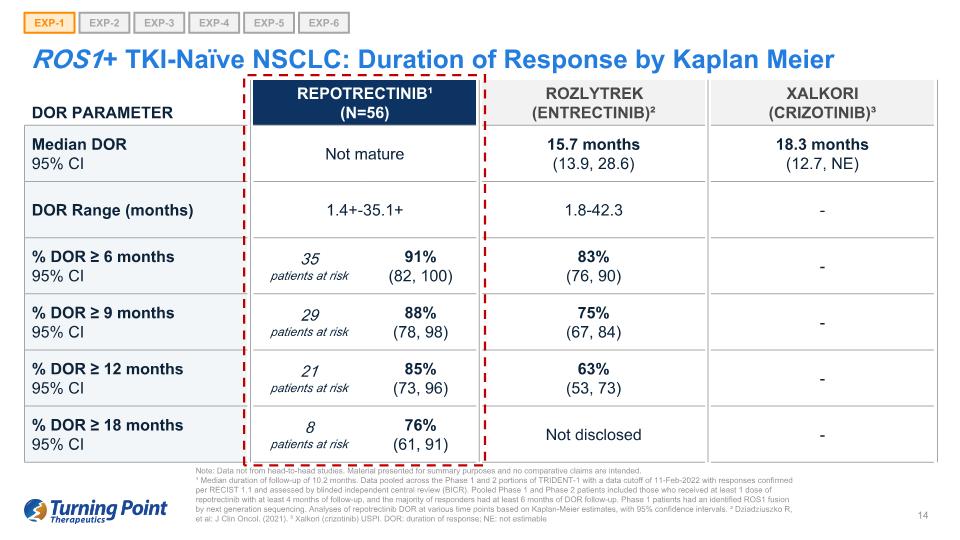
ROS1+ TKI-naieve NSCLC:Kaplan Meier EXP-1 EXP-2 EXP-3 EXP-4 EXP-5 EXP-6 DOR 參數 Repotrectinib¹(N=56)Rozlytrek(恩曲替尼)² Xalkori(crizotinib)³ 中位數 95% 置信區間未成熟 15.7 個月(13.9,28.6)18.3 個月(12.7,NE)DOR 範圍(月)1.1 4+-35.1+ 1.8-42.3-% DOR ≥ 6 個月 95% 置信區間 35 名高危患者 91% (82, 100) 83% (76, 90)-% DOR ≥ 9 個月 95% 置信區間 29 名高危患者 88% (78, 98) 75% (67, 84)-% DOR ≥ 12 個月 95% 置信區間 21 名風險患者 85% (73, 96) 63% (53, 73)-% DOR ≥ 18 個月置信區間 95% 8 名患者處於危險之中 76% (61、91)) 未披露——注意:數據不是來自正面交鋒的研究。提供的材料僅供彙總之用,無意進行比較索賠。¹ 隨訪時間中位數為10.2個月。彙總了 TRIDENT-1 第 1 階段和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 進行了確認,並由盲目獨立中央審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。通過下一代測序,1期患者已確定了ROS1融合。根據卡普蘭-邁爾的估計,對不同時間點的瑞波替尼DOR進行分析,置信區間為95%。² Dziadziuszko R等人:J Clin Oncol。(2021年)。³ Xalkori(crizotinib)USPI。DOR:響應時間;NE:不可估計

ROS1+ TKI-naieve NSCLC:無進展生存作者 Kaplan Meier EXP-1 EXP-2 EXP-3 EXP-4 EXP-5 EXP-6 PFS 參數 Repotrectinib¹(N=71)Rozlytrek(恩曲替尼)² Xalkori(crizotinib)³ PFS 中位數 95% 置信區間未成熟 15.7 個月(11.0、21.1)19.2 個月(14.4,NE)PFS 範圍(月) 0+-40.4+ 未披露-% PFS ≥ 6 個月 95% 置信區間 46 位風險患者 91% (84, 98) 77% (70, 84)-% PFS ≥ 9 個月 95% 置信區間 37 位風險患者 85% (75, 94) 66% (58, 74)-% PFS ≥ 12 個月 95% 置信區間 26 位風險患者 82% (72, 93) 55% (47, 64)-% PFS ≥ 12 個月 18 個月 95% 置信區間 11 名患者處於危險之中 72%(58、86) 未披露——注意:數據並非來自正面交鋒研究。提供的材料僅供彙總之用,無意進行比較索賠。¹ 隨訪時間中位數為10.8個月。彙總了 TRIDENT-1 第 1 階段和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 進行了確認,並由盲目獨立中央審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪時間至少為4個月的患者,大多數應答者接受了至少6個月的DOR隨訪。通過下一代測序,1期患者已確定了ROS1融合。根據卡普蘭-邁爾的估計,對瑞波替尼PFS在不同時間點的分析,置信區間為95%。² Dziadziuszko R,等人:J Clin Oncol。(2021)。³ Shaw A,等人:NEJM(2014)。DOR:反應持續時間;NE:不可估計;PFS:無進展生存
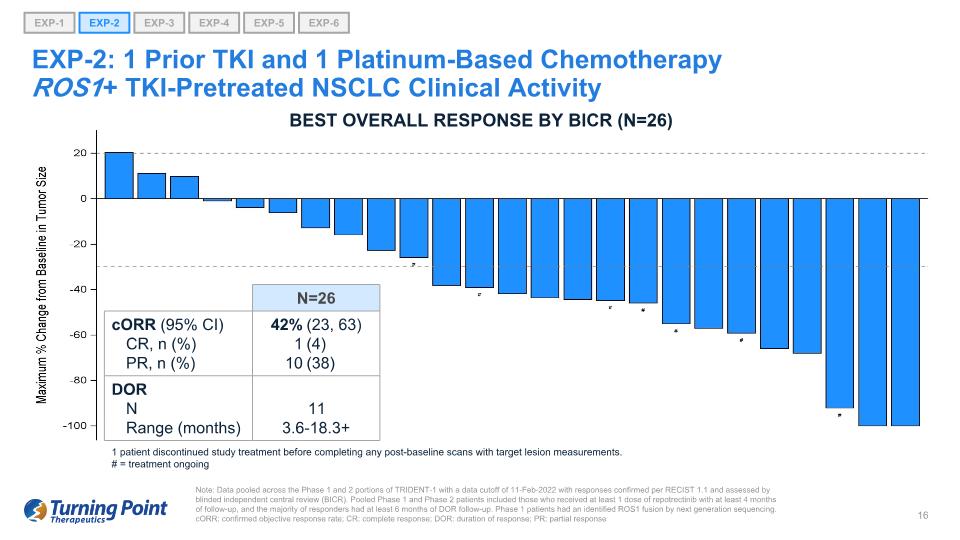
注意:TRIDENT-1 第 1 階段和第 2 階段的數據彙總,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 得到確認,並由盲目獨立中央審查 (BICR) 評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀緩解率;CR:完全反應;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-3 EXP-4 EXP-5 EXP-6 EXP-2 EXP-2:1 個先前 TKI 和 1 個鉑基化療ROS1+ TKI預治療的非小細胞肺癌臨牀活性 N=26 CorR (95% CI) CR,n (%) PR,n (%) 42% 1 10 (23, 63) (4) (38) DOR N 11 範圍(月)3.6-18.3+ BICR 的最佳總體反應(N=26)1 名患者在完成任何目標病變的基線後掃描之前停止了研究治療測量。# = 治療正在進行中
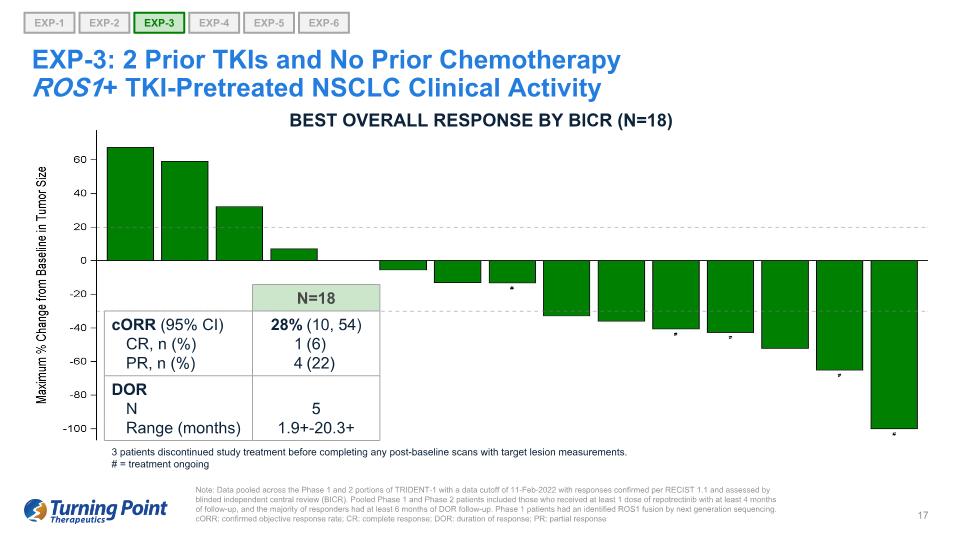
注意:TRIDENT-1 第 1 階段和第 2 階段的數據彙總,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 得到確認,並由盲目獨立中央審查 (BICR) 評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀緩解率;CR:完全緩解;DOR:緩解持續時間;PR:部分反應 EXP-1 EXP-4 EXP-5 EXP-6 EXP-2 EXP-3 EXP-3:2 個先前沒有化療的 TKI+ TKI預治療的非小細胞肺癌臨牀活性最佳總體反應 BICR (N=18) N=18 CorR (95% CI) CR,n (%) PR, n (%) 28% 1 4 (10, 54) (6) (22) DOR N 5 範圍(月)1.9+-20.3+ 3 名患者在完成任何標靶病變測量的基線後掃描之前停止了研究治療。# =治療正在進行中
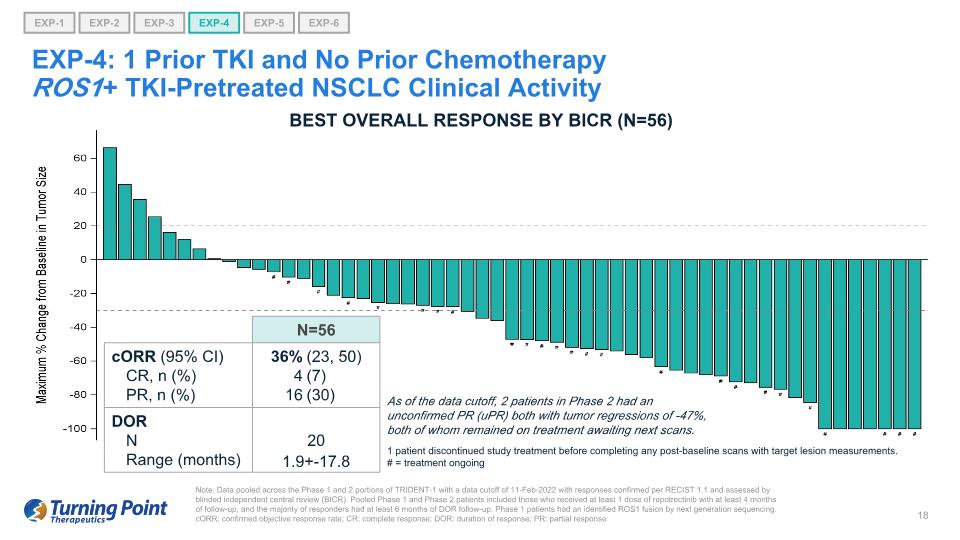
注意:TRIDENT-1 第 1 階段和第 2 階段的數據彙總,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 得到確認,並由盲目獨立中央審查 (BICR) 進行評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪至少4個月的患者,並且大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀緩解率;CR:完全緩解;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-3 EXP-5 EXP-6 EXP-2 EXP-4 EXP-4:1 先前 TKI 和未進行過化療ROS1+ TKI預治療的 NSCLC 臨牀活動截至數據截止時,2 名處於未經證實的 PR (uPR) 均伴有腫瘤迴歸 -47%,兩人仍在接受治療等待下一次掃描。BICR 的最佳總體反應 (N=56) 1 名患者在完成任何基線後掃描並進行目標病變測量之前停止了研究治療。# = 治療進行中 N=56 corR (95% CI) CR、n (%) PR、n (%) 36% 4 16 (23、50) (7) (30) DOR N 20 範圍(月)1.9+-17.8
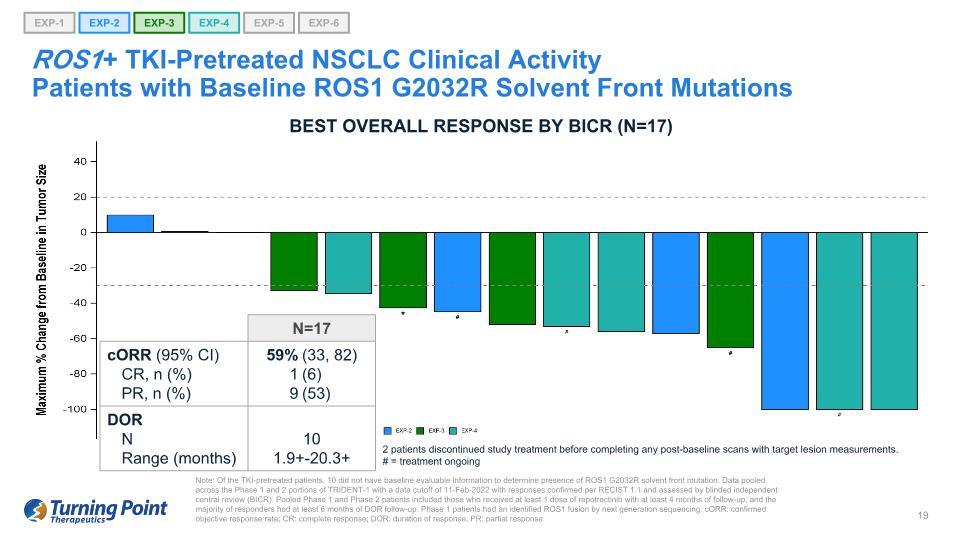
注意:在 TKI 預治療的患者中,有 10 名患者沒有基線可評估信息來確定是否存在 ROS1 G2032R 溶劑前端突變。彙總了 TRIDENT-1 第 1 階段和第 2 階段的數據,數據截止日期為 2022 年 2 月 11 日,答覆根據 RECIST 1.1 進行了確認,並由盲目獨立中央審查 (BICR) 進行了評估。合併後的1期和2期患者包括接受至少1劑repotrectinib且隨訪時間至少為4個月的患者,大多數應答者接受了至少6個月的DOR隨訪。1 期患者通過下一代測序確定了 ROS1 融合。corR:確診的客觀反應率;CR:完全反應;DOR:反應持續時間;PR:部分反應 EXP-1 EXP-5 EXP-6 ROS1+ TKI 預處理的 NSCLC 臨牀活動基線患者 ROS1 G2032R 溶劑前突變患者 EXP-2 EXP-3 EXP-4 最佳總體反應 BICR(N = 17)2 名患者在完成任何基線後掃描和靶損測量之前停止了研究治療. # = 正在進行的治療 N=17 corR (95% 置信區間) CR、n (%) PR、n (%) 59% 1 9 (33、82) (6) (53)DOR N 10 區間(月)1.9+-20.3+
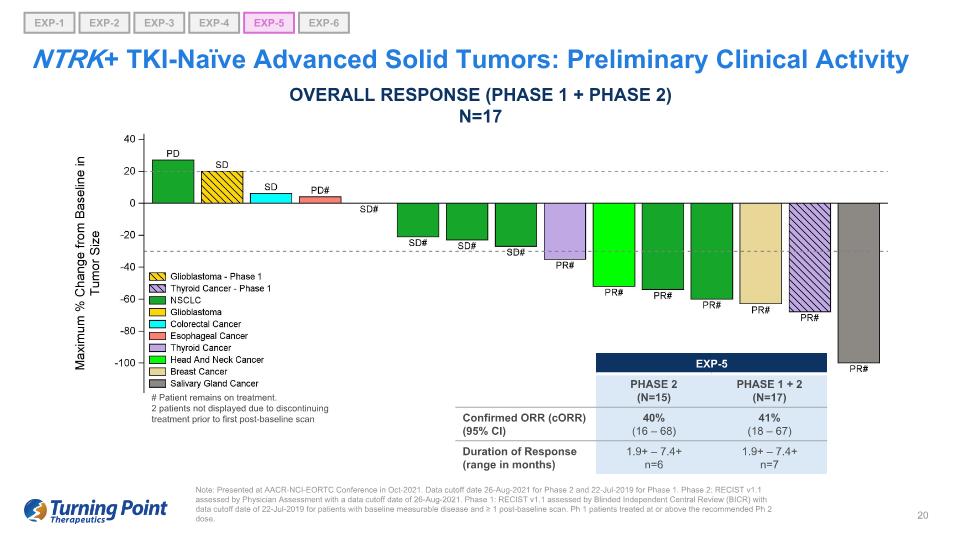
注意:在 2021 年 10 月的 AACR-NCI-EORTC 會議上發表。第 2 階段的數據截止日期為 2021 年 8 月 26 日,第 1 階段的數據截止日期為 2019 年 7 月 22 日。第 2 階段:RECIST v1.1 由醫生評估評估,數據截止日期為 2021 年 8 月 26 日。第一階段:RECIST v1.1由盲人獨立中央審查(BICR)評估,基線可測量疾病患者的數據截止日期為2019年7月22日,基線後掃描≥1次。Ph 1 患者治療的劑量等於或高於推薦的 Ph 2 劑量。NTRK+ TKI-naieve 晚期實體瘤:初步臨牀活動總體反應(第 1 階段 + 第 2 階段)N=17 # 患者仍在接受治療。2 名患者因在首次基線掃描前停止治療而未出現治療 EXP-5 第 2 階段 (N=15) 1 + 2 (N=17) 確診的 ORR (CoRR) (95% 置信區間) 40% (16 — 68) 41% (18 — 67) 反應持續時間(範圍月) 1.9+ — 7.4+ n=6 1.9+ — 7.4+ n=7 EXP-1 EXP-5 EXP-6 EXP-2 EXP-3 EXP-4
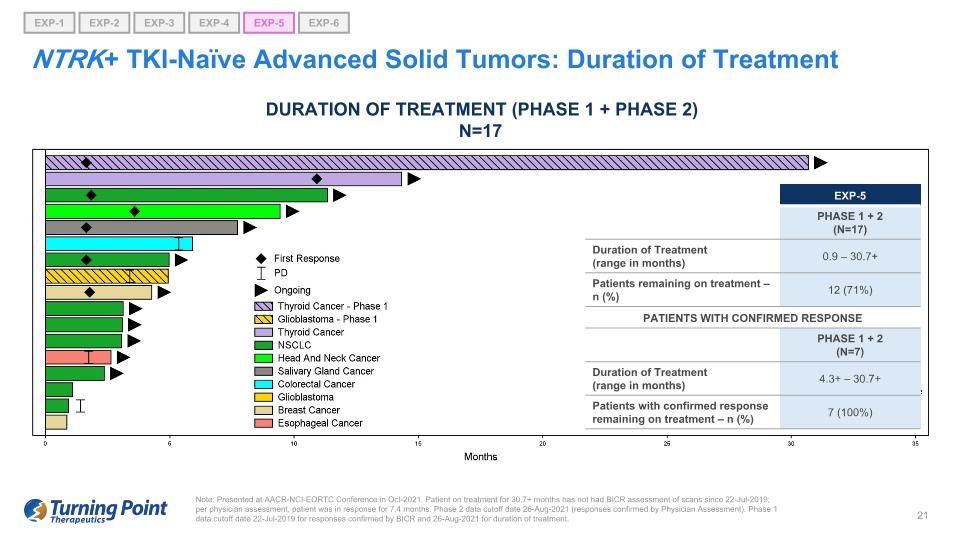
注意:在 2021 年 10 月的 AACR-NCI-EORTC 會議上發表。自2019年7月22日以來,接受治療30.7個月以上的患者沒有接受過BICR掃描評估;根據醫生的評估,患者有7.4個月的緩解期。第 2 階段數據截止日期 2021 年 8 月 26 日(經醫生評估確認的答覆)。對於經BICR確認的答覆,第一階段的數據截止日期為2019年7月22日,治療期間的數據截止日期為2021年8月26日。NTRK+ TKI-naieve 晚期實體瘤:治療持續時間(第 1 階段 + 第 2 階段)N=17 EXP-5 第 1 階段 + 2(N = 17)治療持續時間(以月為單位)0.9 — 30.7+ 仍在接受治療的患者 — n (%) 12 (71%) 確診反應的患者 1 + 2 (n=7) 治療時間(以月為單位)4.3+ — 30.7% + 仍在接受治療的確診患者 — n (%) 7 (100%) EXP-1 EXP-5 EXP-6 EXP-2 EXP-3 EXP-4
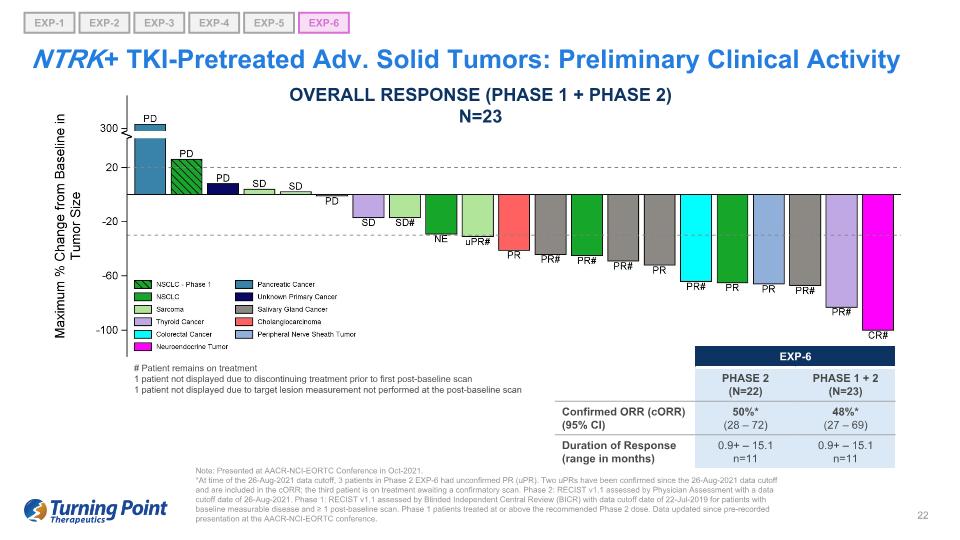
注意:在 2021 年 10 月的 AACR-NCI-EORTC 會議上發表。*在 2021 年 8 月 26 日截止數據時,3 名 2 期 EXP-6 患者出現未經證實的 PR (uPR)。自2021年8月26日數據截止以來,已經確認了兩例UPR,幷包含在CorR中;第三名患者正在接受治療,等待確認性掃描。第 2 階段:RECIST v1.1 由醫生評估評估,數據截止日期為 2021 年 8 月 26 日。第一階段:RECIST v1.1由盲人獨立中央審查(BICR)評估,基線可測量疾病患者的數據截止日期為2019年7月22日,基線後掃描≥1次。1 期患者接受的治療等於或高於推薦的 2 期劑量。自從在AACR-NCI-EORTC會議上預先錄製演示文稿以來,數據已更新。NTRK+ TKI預處理的進階實體瘤:初步臨牀活動總體反應(第 1 階段 + 階段 2)N=23 # 患者仍在接受治療 1 名患者因在首次基線後掃描前停止治療而未顯示 1 名患者由於未在基線後掃描中進行靶損測量而未顯示 EXP-6 第 2 階段(N=22)第 1 期 + 2(N = 23)確診的 ORR (CoRR) (95% 置信區間) 50% * (28 — 72) 48% * (27 — 69) 響應持續時間(以月為單位)0.9+ — 15.1 n=11 0.9+ — 15.1 n=11 EXP-1 EXP-5 EXP-6 EXP-2 EXP-3 EXP-4
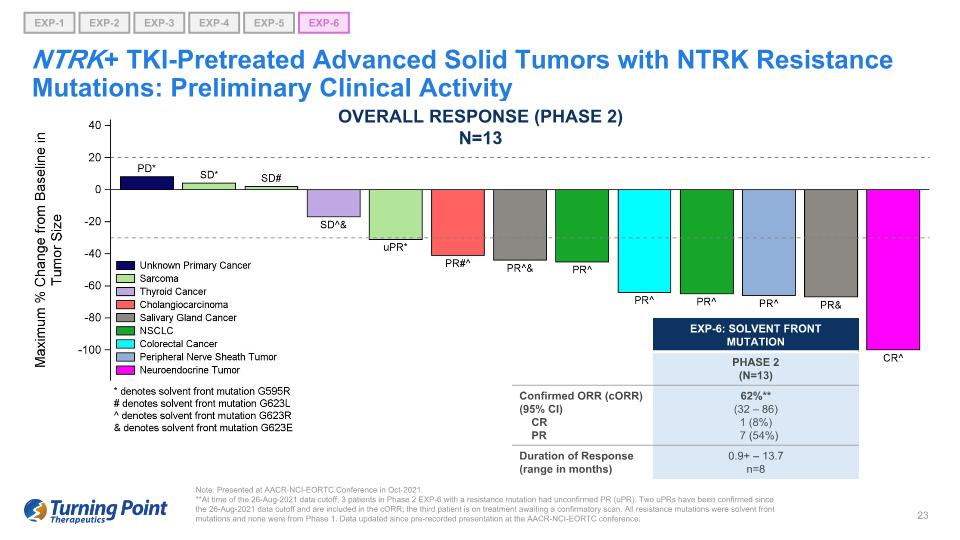
NTRK+ TKI預先治療的具有NTRK耐藥突變的晚期實體瘤:初步臨牀活動説明:在2021年10月的AACR-NCI-EORTC會議上發表。**在 2021 年 8 月 26 日截止數據時,3 名具有耐藥突變的 2 期 EXP-6 患者的病情未經證實 (uPR)。自2021年8月26日數據截止以來,已經確認了兩例UPR,幷包含在CorR中;第三名患者正在接受治療,等待確認性掃描。所有耐藥突變均為溶劑前端突變,沒有一個來自第一階段。自從在AACR-NCI-EORTC會議上預先錄製演示文稿以來,數據已更新。總體反應(第 2 階段)N=13 EXP-6:溶劑前端突變第 2 階段(N=13)已確認 ORR (CoRR) (95% CI) CR PR 62% ** (32 — 86) 1 (8%) 7 (54%) 反應持續時間(以月為單位)0.9+ — 13.7 n=8 EXP-1 EXP-5 EXP-6 EXP-2 EXP-3 EXP-4
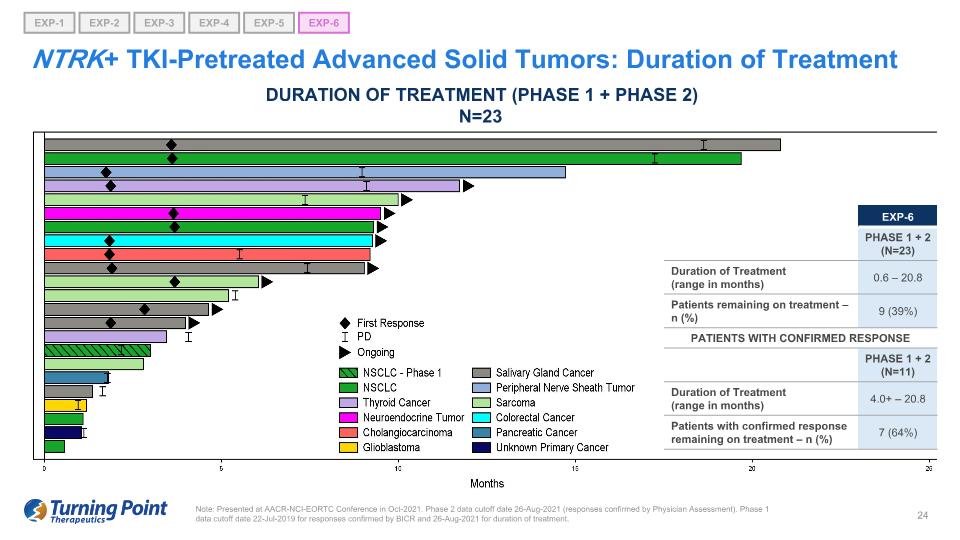
注意:在 2021 年 10 月的 AACR-NCI-EORTC 會議上發表。第 2 階段數據截止日期 2021 年 8 月 26 日(經醫生評估確認的答覆)。對於經BICR確認的答覆,第一階段的數據截止日期為2019年7月22日,治療期間的數據截止日期為2021年8月26日。NTRK+ TKI 預治療的晚期實體瘤:治療持續時間(第 1 階段 + 第 2 階段)N=23 EXP-6 第 1 階段 + 2(N = 23)治療時間(以月為單位)0.6 — 20.8 仍在接受治療的患者 — n(%)9(39%)確診反應的患者 1 期 + 2(n = 11)治療時間(以月為單位)4.0+ — 20.8 確診緩解的患者仍在接受治療 — n (%) 7 (64%) EXP-1 EXP-5 EXP-6 EXP-2 EXP-3 EXP-4
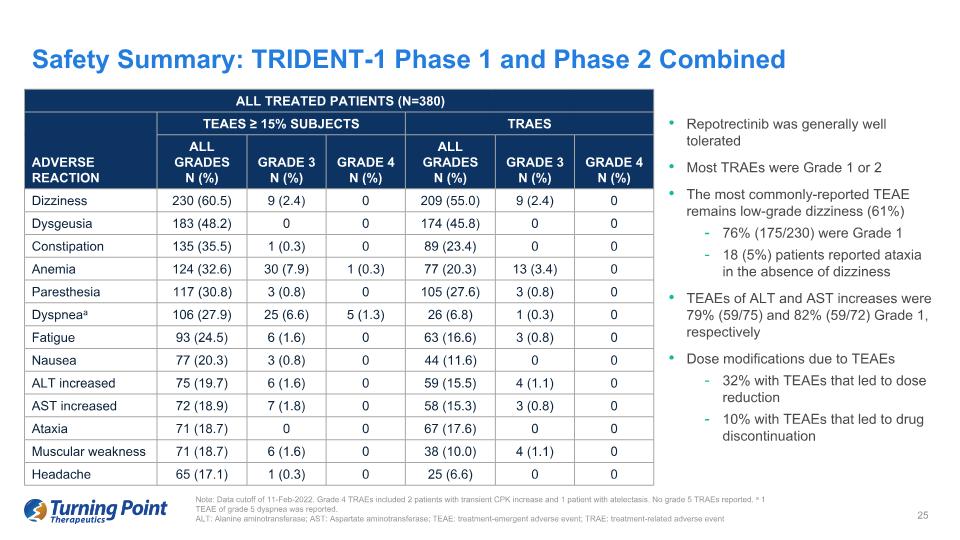
所有接受治療的患者 (N=380) 不良反應 TEAES ≥ 15% 受試者 TRAES 所有等級 N (%) 3N (%) 4N 級 (%) 所有等級 N (%) 3N 級 (%) 4N 級 (%) 頭暈 230 (60.5) 9 (2.4) 9 (2.4) 0 消化不良 183 (48.2) 0 174 (45.8) 0 0 便祕 135 (35.5) 1 (0.3) 0 89 (23.4) 0 0 貧血 124 (32.6) 30 (7.9) 1 (0.3) 77 (20.3) 13 (3.4) 0 感覺異常 117 (30.8) 3 (0.8) 0 105 (27.6) 3 (0.8) 0 呼吸困難 106 (27.9) 25 (6.6) 5 (1.3) 26 (6.8) 1 (0.3) 1 (0.8) 1 () 0 疲勞 93 (24.5) 6 (1.6) 0 63 (16.6) 3 (0.8) 0 噁心 77 (20.3) 3 (0.8) 0 44 (11.6) 0 0 ALT 增加 75 (19.7) 6 (1.6) 0 59 (15.5) 4 (1.1) 0 AST 增加 72 (18.9) 7 (1.8) 0 58 (15.3) 3 (0.8) 0 共濟失調 71 (18.7) 0 0 0 67 (17.6) 0 0 肌肉無力 71 (18.7) 6 (1.6) 0 38 (10.0) 4 (1.1) 0 頭痛 65 (17.1) 1 (0.3) 0 25 (6.6) 0 0 安全摘要:TRIDENT-1 第 1 階段和第 2 階段合併注意:數據截止日期為 2022 年 2 月 11 日。4級TRAE包括2名短暫性CPK升高的患者和1名肺不張患者。未報告 5 級 TRAE。報告了 1 個 TEAE 為 5 級呼吸困難。ALT:丙氨酸氨基轉移酶;AST:天冬氨酸氨基轉移酶;TEAE:治療緊急不良事件;TRAE:治療相關不良事件 Repotrectinib 的耐受性總體良好。最常報告的 TEAE 仍然是低度頭暈(61%)76%(175/230)是 1 級 18(5%)患者在沒有頭暈的情況下報告了共濟失調 ALT 和 AST 增加的 TEAE 分別為 79%(59/75)和 82%(59/72)1 級,TEAE 導致的劑量調整為 32%這導致了TEAE的劑量減少了10%,從而導致藥物停產

Repotrectinib 聯合用於 KRAS 驅動的腫瘤
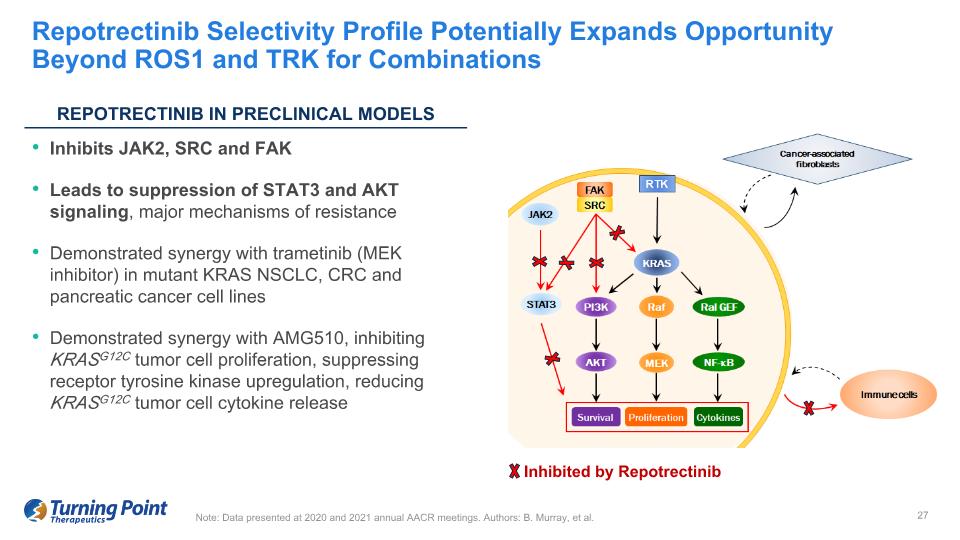
抑制 JAK2、SRC 和 FAK 可抑制 STAT3 和 AKT 信號,主要的耐藥機制在突變體 KRAS NSCLC、CRC 和胰腺癌細胞系中顯示出與曲美替尼(MEK 抑制劑)的協同作用,抑制 KRASG12C 腫瘤細胞增殖,抑制受體酪氨酸激酶上調,減少 KRASG12C 腫瘤細胞因子的釋放 Repotrectinib 選擇性概況有可能擴大除ROS1和TRK之外的合併機會注:數據在2020年和2021年AACR年度會議上公佈。AMG510作者:B. Murray 等人瑞波替尼抑制了臨牀前模型中的 REPOTRECTINIB
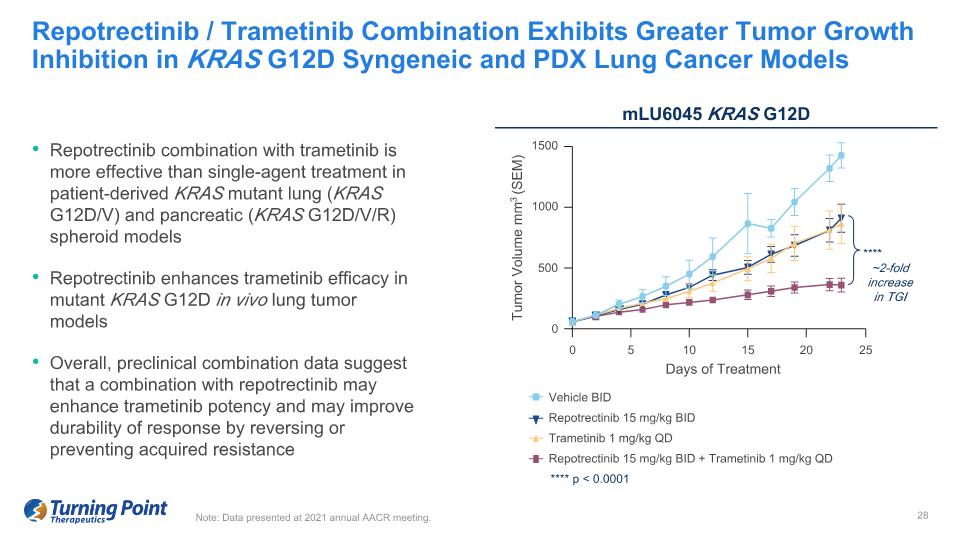
Repotrectinib 聯合曲美替尼在患者衍生的 KRAS 突變肺部 (KRAS G12D/V) 和胰腺 (KRAS G12D/V/R) 球體模型中比單藥治療更有效 Repotrectinib 在突變體 KRAS G12D 體內肺腫瘤模型中增強了曲美替尼的療效。總體而言,臨牀前組合數據表明,與瑞波替尼聯合使用可增強曲美替尼在突變體 KRAS G12D 中的療效可增強曲美替尼效力,並可通過逆轉或預防獲得性耐藥性來提高反應的耐久性 Repotrectinib/Trametinib 組合在 KRAS G12D 中表現出更大的腫瘤生長抑制作用同基因和 PDX 肺癌模型注:在 2021 年 AACR 年會上公佈的數據。mlu6045 KRAS G12D 1500 1000 500 0 腫瘤體積 mm3 (SEM) 0 5 10 15 20 25 天治療車輛 BID Repotrectinib 15 mg/kg BID 曲美替尼 1 mg/kg QD Repotrectinib 15 mg/kg QD 增加約 2 倍在 TGI **** p
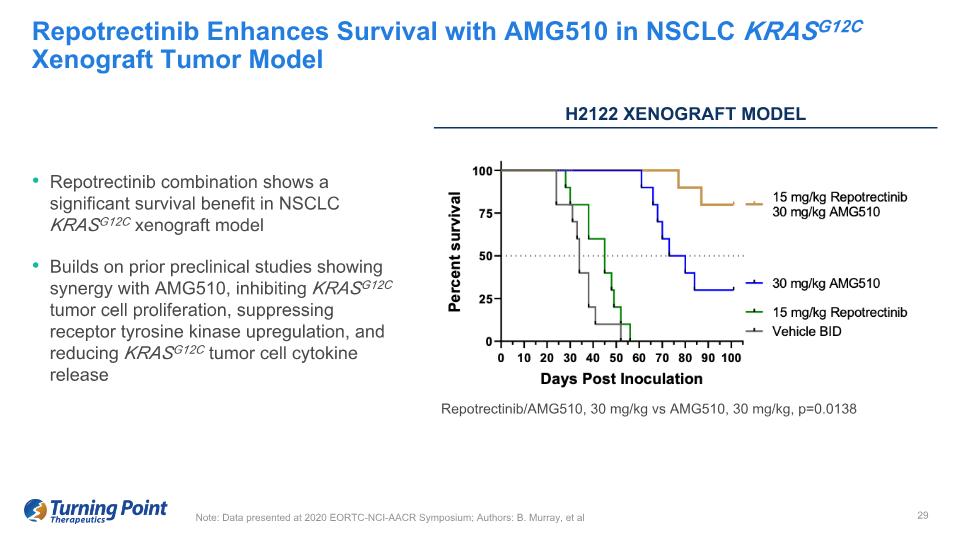
Repotrectinib 組合在 NSCLC KRASG12C 異種移植模型中顯示出顯著的存活益處 Repotrectinib 建立在先前的臨牀前研究基礎上,這些研究顯示與 AMG510 協同作用,抑制 KRASG12C 腫瘤細胞增殖,抑制受體酪氨酸激酶上調,降低 KRASG12C 腫瘤細胞因子釋放 Repotrectinib 在 NSCLC KRASG12C 異種移植腫瘤模型中使用 AMG510 提高存活率注:2020 年 EORTC-NCL 上公佈的數據 CI-AACR 研討會;作者:B. Murray 等人 H2122 Xenograft 模型 repotrectinib/AMG510,30 mg/kg vs AMG510,30 mg/kg vs,30 mg/kg,p=0.0138
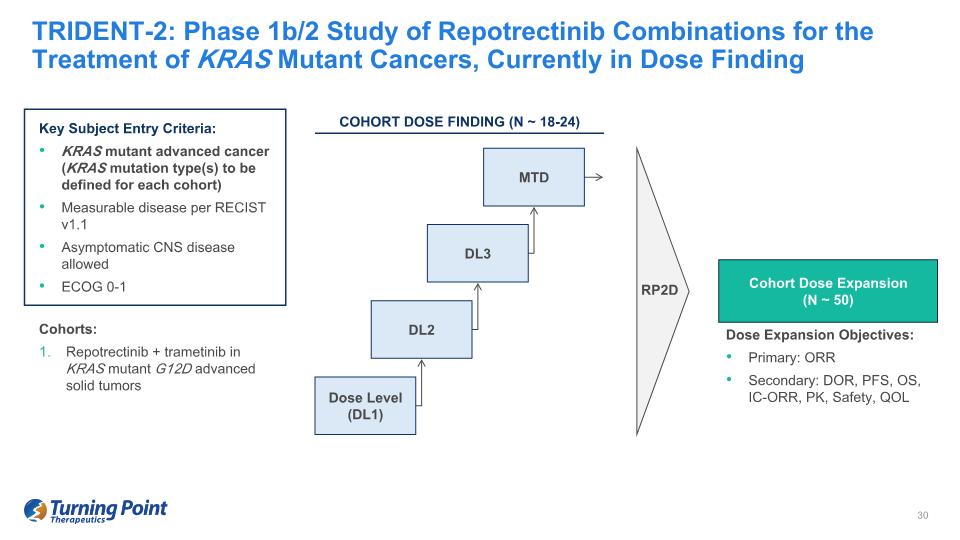
TRIDENT-2:用於治療 KRAS 突變癌症的 Repotrectinib 組合的 1b/2 期研究,目前處於劑量查找關鍵受試者進入標準:KRAS 突變晚期癌症(KRAS 突變類型將為每個隊列定義)根據 RECIST v1.1 允許無症狀中樞神經系統疾病 ECOG 0-1 RP2D 隊列劑量擴展(N ~ 50)劑量水平(DL1)DL2 DL3 MTD 隊列:KRAS 突變體 G12D 晚期實體瘤中的 Repotrectinib + trametinib 劑量擴展目標:主要:ORR 次要:DOR、PFS、OS、IC-ORR、PK、安全性、QOL 隊列劑量調查(N ~18-24)

SHIELD-1 一項正在進行的艾佐萬替尼(TPX-0022)治療有遺傳變異的晚期實體瘤患者的1期研究
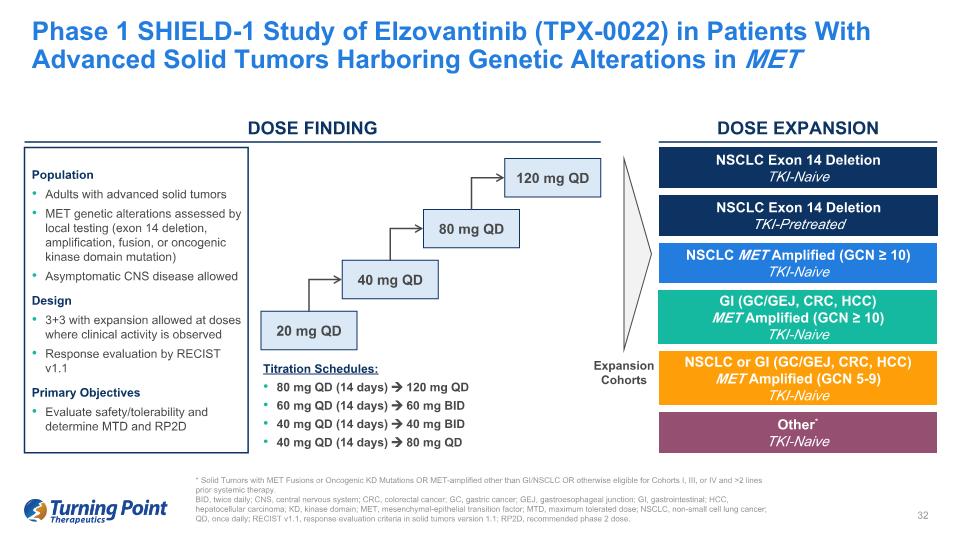
劑量擴增劑量發現 * 具有 MET 融合或致癌性 KD 突變或 MET 擴增的 GI/NSCLC 以外的 MET 擴增的實體瘤,或者符合第 I、III 或 IV 組以及在全身治療之前大於 2 系的實體瘤。BID,每日兩次;中樞神經系統;CRC,結直腸癌;GC,胃癌;GEJ,胃食管交界處;胃腸道;HCC,肝細胞癌;KD,激酶結構域;MET,間充質上皮轉化因子;MTD,最大耐受劑量;NSCLC,非小細胞肺癌;QD,每日一次;RECIST v1.1,實體瘤的反應評估標準 1.1 版;RP2D,推薦的 2 期劑量。Elzovantinib (TPX-0022) 在 MET 人羣中存在遺傳變異的晚期實體瘤患者的 1 期 SHIELD-1 研究通過局部檢測(外顯子 14 缺失、擴增、融合或致癌激酶結構域突變)評估 MET 遺傳變異允許無症狀中樞神經系統疾病的設計 3+3,允許在觀察到臨牀活性的劑量下擴展 RECIST v1.1 的反應評估主要目標評估安全性/耐受性可行性並確定 MTD 和 RP2D 擴展隊列 NSCLC 外顯子 14 刪除 TKI-Naive GI(GC/GEJ、CRC、HCC)MET 擴增(GCN ≥ 10)TKI-naive NSCLC 外顯子 14 刪除 TKI 預處理 NSCLC MET 擴增(GCN ≥ 10)TKI-naive NASCLC MET 擴增(GCN 5-9)TKI-naive 40 mg QD 80 mg QD 120 mg QD 20 mg QD 滴定時間表:80 mg QD(14 天)120 mg QD 60 mg QD(14 天)60 mg BID 40 mg QD(14 天)60 mg BID 40 mg QD(14 天)40 mg BID 40 mg QD(14 天)80 mg QD
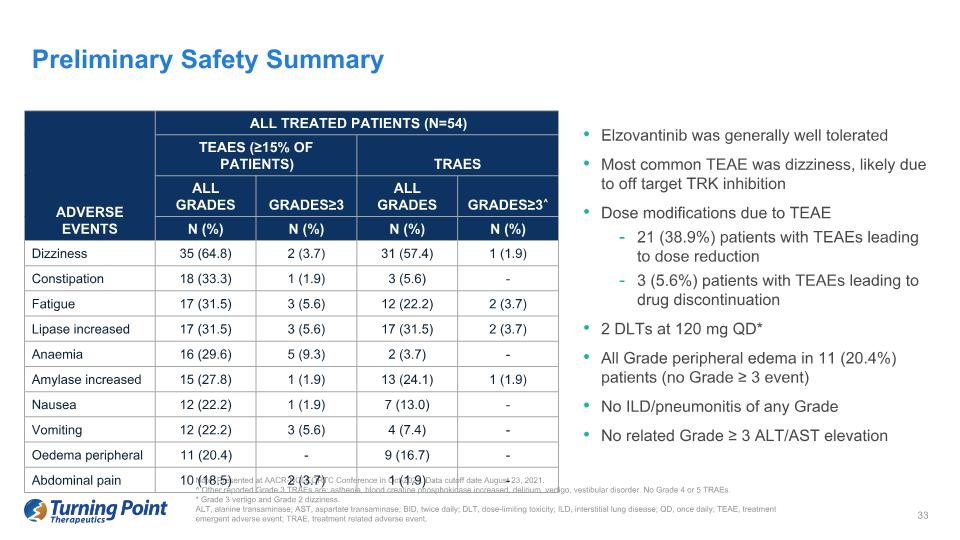
Elzovantinib 的耐受性總體良好。最常見的 TEAE 是頭暈,可能是由於脱靶的 TRK 抑制作用導致 TEAE 21 (38.9%) TEAE 患者劑量調整導致劑量減少 3 (5.6%) 的 TEAE 患者停藥 120 mg QD* 所有級別的外周水腫(無 ≥ 3 級事件)無 ILD/任何級別的肺炎無相關等級 ≥ 3 ALT/AST 升高初步安全摘要説明:在 2021 年 10 月的 AACR-NCI-EORTC 會議上發表。數據截止日期為 2021 年 8 月 23 日。^ 其他報告的 3 級 TRAE 有:虛弱、血肌酸磷酸激酶升高、神志失常、眩暈、前庭障礙。沒有 4 級或 5 級 TRAE。* 3 級眩暈和 2 級頭暈。ALT,丙氨酸轉氨酶;AST,天冬氨酸轉氨酶;BID,每日兩次;DLT,劑量限制毒性;ILD,間質性肺病;QD,每日一次;TEAE,治療緊急不良事件;TRAE,治療相關不良事件。所有接受治療的患者(N=54)TEAE(≥ 15% 的患者)traES 不良事件所有等級≥3 所有年級≥3^ n (%) n (%) n (%) n (%) 頭暈 35 (64.8) 2 (3.7) 31 (57.4) 1 (1.9) 1 (1.9) 1 (1.9) 1 (1.9) 3 (5.6)-疲勞 17 (31.5) 3 (5.6)-疲勞 17 (31.5) 3 (5.6)-疲勞 17 (31.5) 3 (5.6)) 12 (22.2) 2 (3.7) 脂肪酶升高 17 (31.5) 3 (5.6) 17 (31.5) 2 (3.7) 貧血 16 (29.6) 5 (9.3) 2 (3.7)-澱粉酶增加 15 (27.8) 1 (1.9) 13 (24.1) 1 (1.9) 1 (1.9) 1 (1.9) 7 (13.0)-嘔吐 12 (22.2) 3 (5.6)) 4 (7.4)-外周水腫 11 (20.4)-9 (16.7)-腹痛 10 (18.5) 2 (3.7) 1 (1.9)-
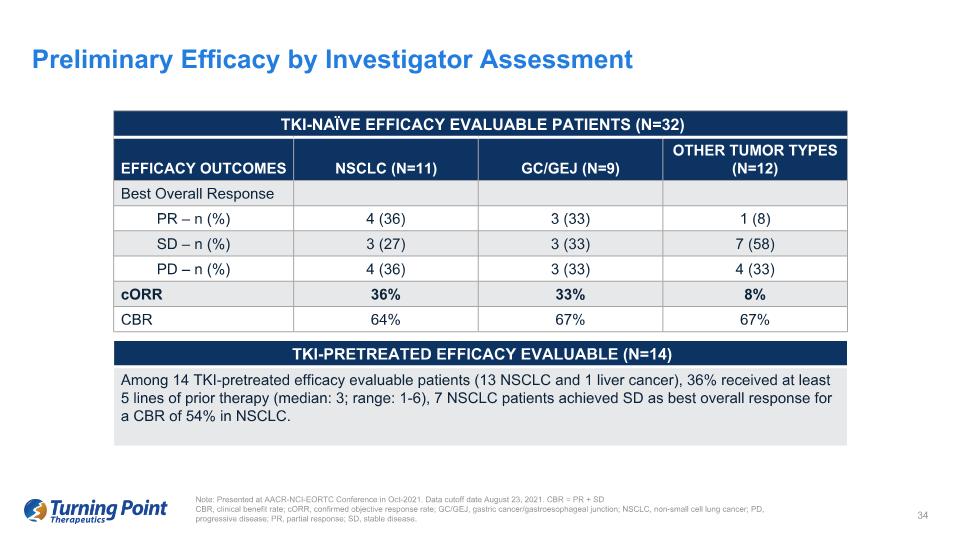
注意:在 2021 年 10 月的 AACR-NCI-EORTC 會議上發表。數據截止日期為 2021 年 8 月 23 日。CBR = PR + SD CBR,臨牀獲益率;CorR,確診的客觀緩解率;GC/GEJ,胃癌/胃食管交界處;NSCLC,非小細胞肺癌;PD,進行性疾病;PR,部分反應;SD,穩定疾病。研究者評估初步療效 TKI-naíve 療效可評估患者 (N=32) TKI-naieve 療效可評估患者 (N=32) 療效結果 NSCLC (N=11) GC/GEJ (N=9) 其他腫瘤類型 (N=12) 最佳總體反應 PR — n (%) 4 (36) 3 (33) 1 (8) SD — n (%) 3 (27) 3 (33) 7 (58) PD — n (%) 4 (36) 3 (33) 4 (33) CorR 36% 33% 8% CBR 64% 67% 67% TKI 預處理療效可評估 (N=14) 在 14 名 TKI 預治療療效可評估患者(13 名非小細胞肺癌和 1 例肝癌)中,36% 接受過至少 5 行先前治療(中位數:3;範圍:1-6),7 名非小細胞肺癌病人在非小細胞肺癌中,CBR 為 54% 的最佳總體應答率。
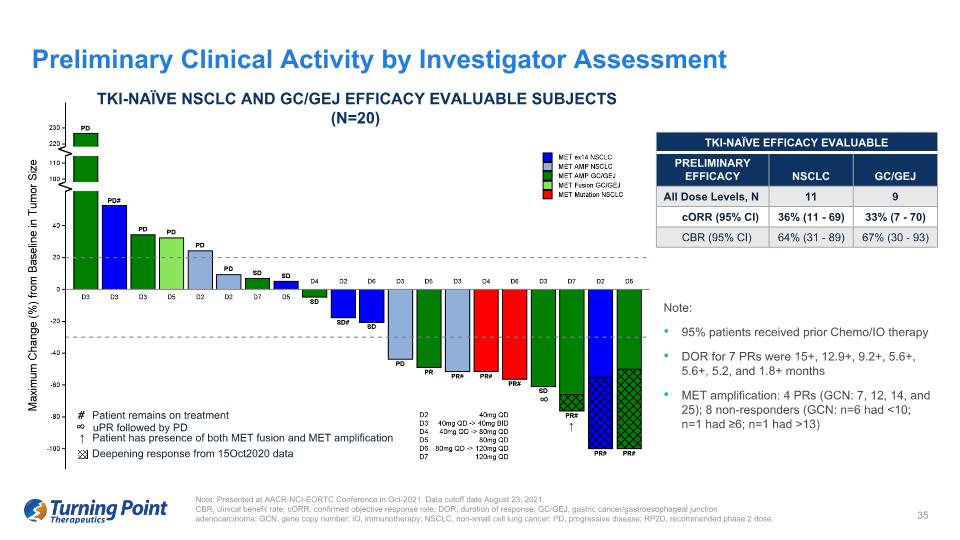
注意:95% 的患者先前接受化療/IO 治療 7 個 PR 的 DOR 為 15+、12.9+、9.2+、5.6+、5.6+、5.2 和 1.8 個月以上 MET 擴增:4 個 PR(GCN:7、12、14 和 25);8 名無反應者(GCN:n=6 有 13 個)研究者的初步臨牀活動評估説明:在 AACR-NCI-EORTC 會議上發表在 2021 年 10 月。數據截止日期為 2021 年 8 月 23 日。CBR,臨牀獲益率;CorR,確診的客觀緩解率;DOR,緩解持續時間;GC/GEJ,胃癌/胃食管交界處腺癌;GCN,基因拷貝數;IO,免疫療法;NSCLC,非小細胞肺癌;PD,進行性疾病;RP2D,推薦的2期劑量。TKI-naíve NSCLC 和 GC/GEJ 療效可評估的受試者(n=20)↑ Ÿ # 患者仍在接受治療 ↑ 患者同時存在 MET 融合和 MET 擴增 │ uPR 其次是 PD 深化反應來自於 2020 年 10 月 15 日的數據 TKI-naieve 療效可評估 TKI-naive 療效可評估患者(N=32)初步療效 NSCLC GC/GEJ 所有劑量水平,N 11 9 CorR (95% 置信區間) 36% (11-69) 33% (7-70) CBR (95% 置信區間) 64% (31-89) 67% (30-93) 67% (30-93)
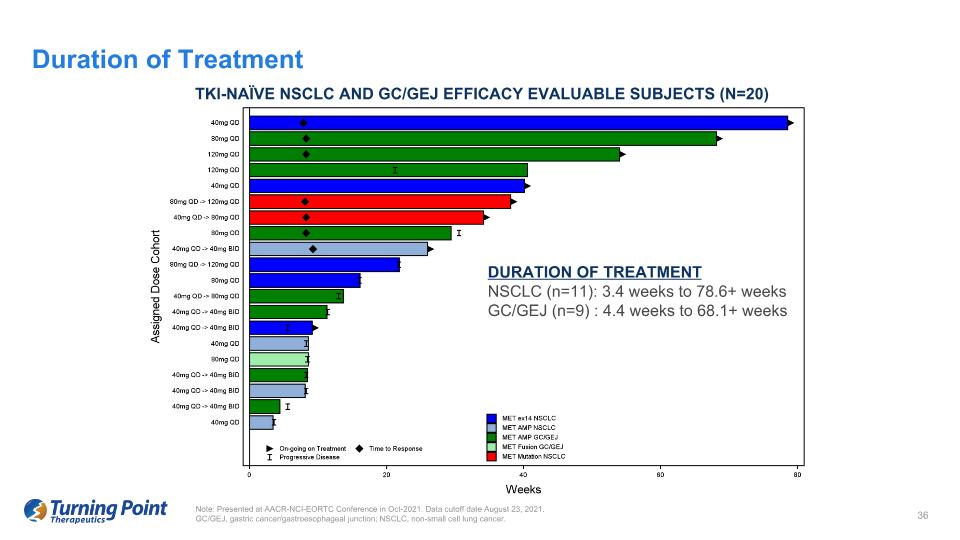
TKI-naíve NSCLC 和 GC/GEJ 療效可評估受試者(n=20)治療時間 NSCLC(n = 11):3.4 周至 78.6 周以上 GC/GEJ(n=9):4.4 周至 68.1 周以上注意:在 2021 年 10 月的 AACR-NCI-EORTC 會議上發表。數據截止日期為 2021 年 8 月 23 日。GC/GEJ,胃癌/胃食管交界處;NSCLC,非小細胞肺癌。治療持續時間

SHIELD-2 Elzovantinib 與 Aumolertinib 聯合治療表皮生長因子突變體 MET 擴增的晚期非小細胞肺癌的 1b/2 期研究
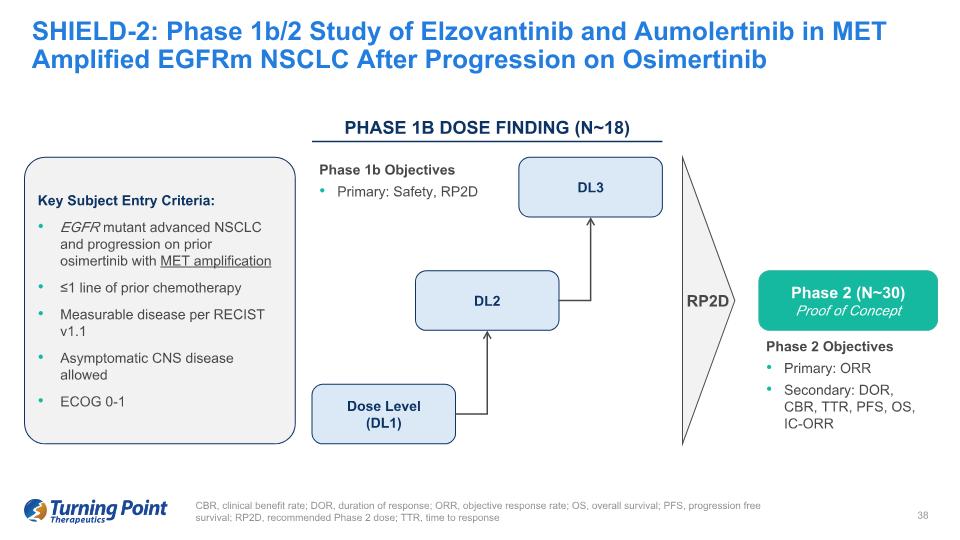
CBR,臨牀獲益率;DOR,緩解持續時間;ORR,客觀緩解率;OS,總存活率;PFS,無進展存活率;RP2D,推薦的 2 期劑量;TTR,緩解時間 SHIELD-2:奧美替尼進展後 MET 放大 eGFRM NSCLC 中的 1b/2 期研究主要目標:ORR 二級:DOR、CMLC BR、TTR、PFS、OS、IC-ORR 關鍵受試者進入標準:表皮生長因子突變體晚期 NSCLC 和先前使用 MET 擴增的奧西替尼的進展 ≤1 系先前化療可測量的疾病,符合 RECIST v1.1允許出現無症狀的中樞神經系統疾病 ECOG 0-1 RP2D 第 2 階段(N~30)概念驗證劑量水平(DL1)DL2 DL3 第 1B 期劑量發現(N~18)1b 階段目標初級:安全性,RP2D

一項針對包含 RET 融合或突變的晚期實體瘤患者的 TPX-0046 正在進行的 1 期研究 SWORD-1
結合界面小的緊湊型大環可有效抑制細胞分析中的野生型 RET 和多個 RET 突變,表明異種移植模型中的腫瘤迴歸 VEGF 可節省,有可能比批准的藥物提供更高的安全性,在選擇性 RET TKI 和 Gavreto 接受選擇性 RET TKI 治療的患者中,沒有獲得批准的靶向療法 Retevmo 和 Gavreto 的潛在機會 TPX-0046 是一種有效的下一代 RET 酪氨酸激酶抑制劑
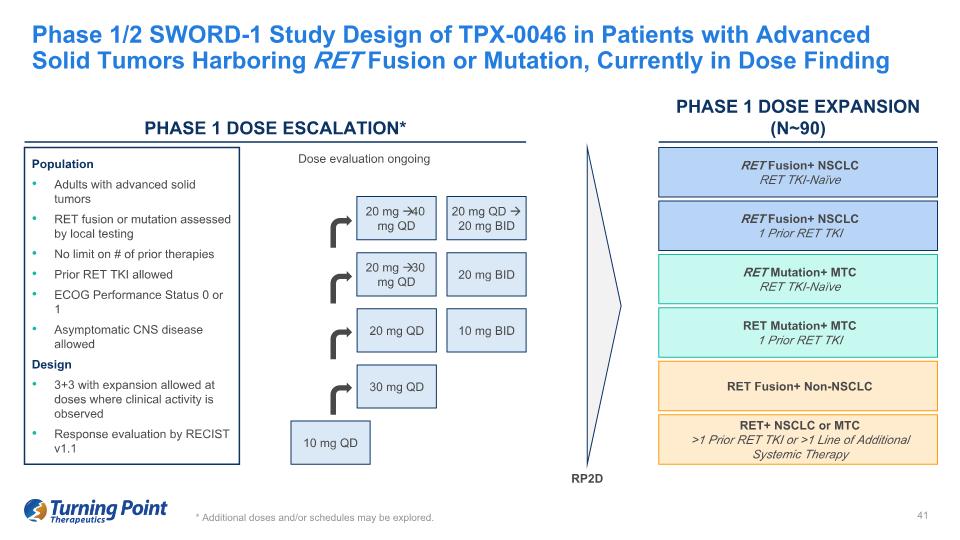
*可以探討其他劑量和/或時間表。1/2 期 SWORD-1 研究針對包含 RET 融合或突變的晚期實體瘤患者 TPX-0046 的設計,目前處於劑量查找人羣中通過局部測試評估的晚期實體瘤 RET 融合或突變成人 RET 融合或突變不限制先前的療法數量 ECOG 表現狀態 0 或 1 允許無症狀中樞神經系統疾病在觀察到臨牀活性的劑量下擴展 RECIST v1.1 的反應評估正在進行 10 mg QD 20 mg QD D 10 mg BID 30 mg QD 20 mg 30 mg QD 20 mg BID 20 mg 40 mgQD RET Fusion+ NSCLC RET TKI-naieve RET Fusion+ NSCLC1 之前的 RET TKI RET 突變+ MTC RET TKI-naieve RET 突變+ MTC 1 先前 RET TKI RET 融合+ 非 NSCLC RET+ NSCLC 或 MTC >1 先前 RET TKI 或 >1 種其他全身療法 RP2D 20 mg BID 第 1 階段劑量擴展 (n~90) 第 1 階段劑量升級*
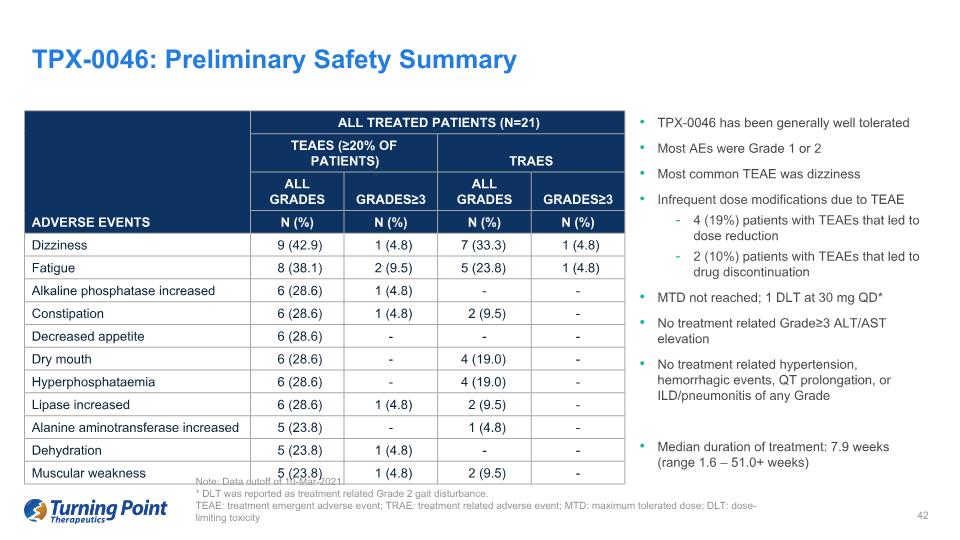
TPX-0046 的耐受性總體良好。大多數 AE 為 1 或 2 級最常見的 TEAE 是頭暈 TEAE 4 (19%) 患者的 TEAE 導致劑量減少 2 (10%) TEAE 患者未達到 MTD;30 mg QD時為 1 DLT * 無治療相關等級 ALT/AST 升高無治療相關高血壓、出血事件,QT 延長,或任何等級的 ILD/肺炎中位治療時間:7.9 周(範圍 1.6 — 51.0 周以上)TPX-0046:初步安全摘要説明:數據截止時間2021 年 3 月 10 日。* 據報道,DLT 是與治療相關的 2 級步態障礙。TEAE:治療緊急不良事件;TRAE:治療相關不良事件;MTD:最大耐受劑量;DLT:劑量限制毒性所有接受治療的患者(N = 21)TEAE(≥ 20% 的患者)traES 所有等級≥3 所有等級≥3 所有等級不良事件 n (%) n (%) n (%) 頭暈 9 (42.9) 1 (4.8) 7 (33) 3.3) 1 (4.8) 疲勞 8 (38.1) 2 (9.5) 5 (23.8) 1 (4.8) 鹼性磷酸酶升高 6 (28.6) 1 (4.8)--便祕 6 (28.6) 1 (4.8) 2 (9.5)-食慾下降 6 (28.6)--口乾 6 (28.6)-4 (19.0)-4 (19.0) 0)-脂肪酶6 (28.6) 1 (4.8) 2 (9.5)-丙氨酸氨基轉移酶增加 5 (23.8)-1 (4.8)-脱水 5 (23.8) 1 (4.8)--肌肉無力 5 (23.8) 1 (4.8)--肌肉無力 5 (23.8) 1 (4.8) 2 (9.5)-
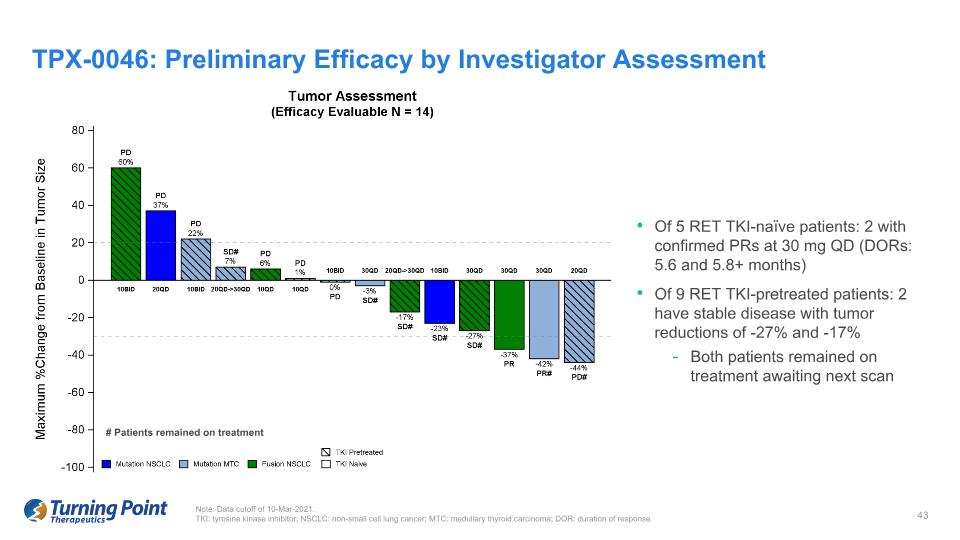
在 5 名 RET TKI-naíve 患者中:2 名確診的 PR 為 30 mg QD(DOR:5.6 和 5.8 個月)在 9 名 RET TKI 預治療患者中:2 名患病穩定,腫瘤減少幅度分別為 -27% 和 -17% 兩名患者仍在接受治療等待下一次掃描 TPX-0046:研究者的初步療效評估説明:數據截止日期為 2021 年 3 月 10 日。TKI:酪氨酸激酶抑制劑;NSCLC:非小細胞肺癌;MTC:甲狀腺髓樣癌;DOR:反應持續時間 # 患者仍在接受治療

下一代 ALK 抑制劑 TPX-0131
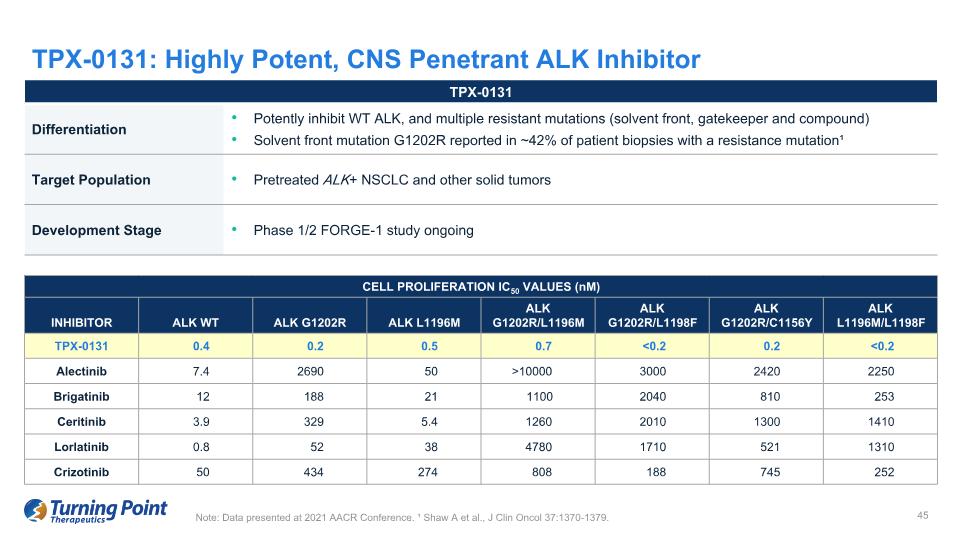
TPX-0131 分化可有效抑制 WT ALK 和多種耐藥突變(溶劑前線、看門人和化合物)溶劑前突變 G1202R 在大約 42% 的具有耐藥性突變的患者活檢中報告了¹ 目標人羣預處理的 ALK+ NSCLC 和其他實體瘤發育階段 1/2 期 FORGE-1 研究正在進行注意:在 2021 年 AACR 會議上公佈的數據。¹ Shaw A 等人,J Clin Oncol 37:1370-1379。TPX-0131:高效、中樞神經系統滲透 ALK 抑制劑細胞增殖 IC50 值 (nM) 抑制劑 ALK WT G1202R ALK L1196M ALK G1202R/L1196M ALK ALK G1202R/L1198F ALK G1202R/C1156Y ALK L1196M/L11986Y ALK L1196M/L1198F TPX-0131 0.4 0.2 0.5 0.7 10000 3000 2420 2250 Brigatinib 12 188 21 1100 2040 810 253 Ceritinib 3.9 329 5.4 1260 2010 1300 1410 洛拉替尼 0.8 52 38 4780 1710 521 1310 1310 1310 Crizotinib 50 434 274 808 188 745 252
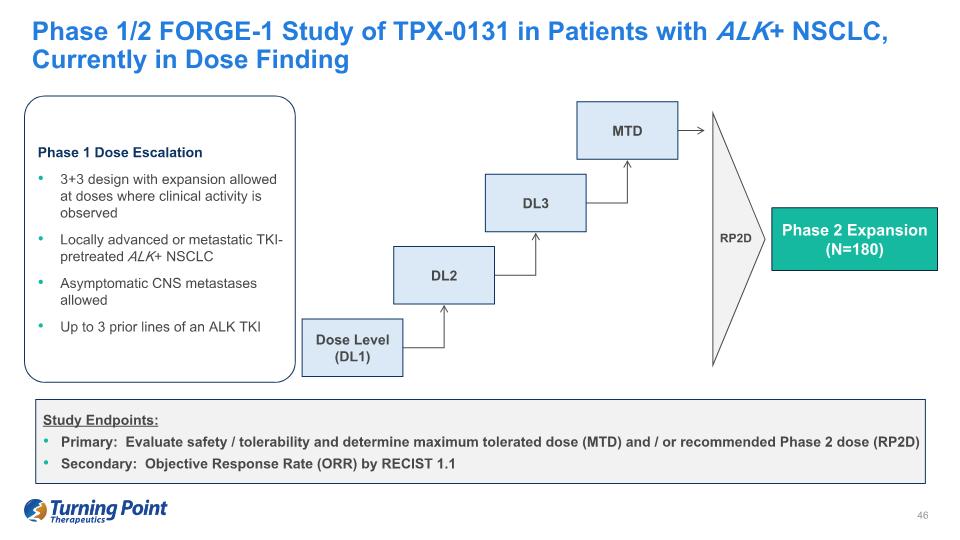
研究終點:主要:評估安全性/耐受性並確定最大耐受劑量 (MTD) 和/或推薦的 2 期劑量 (RP2D) 次要:RECIST 1.1 對 TPX-0131 的 1/2 期 FORGE-1 研究,目前處於劑量查找階段 1 劑量遞增 3+3 設計,在觀察到臨牀活性的劑量局部晚期或轉移性 TKI 預處理 ALK+ NSCLC 時允許擴展 C 允許無症狀中樞神經系統轉移 ALK TKI RP2D 劑量水平 (DL1) DL2 DL3 MTD 第 2 期擴展 (N) 的先前多達 3 行=180)

可能是同類首創的 Claudin18.2 ADC TPX-4589(前身為 LM-302)
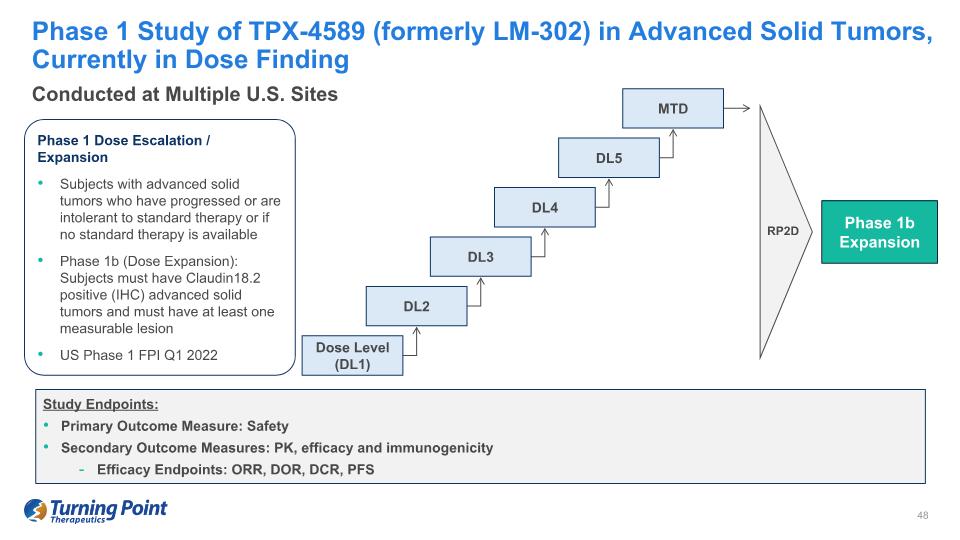
TPX-4589(前身為 LM-302)在晚期實體瘤中的1期研究,目前處於劑量查找研究終點:主要結果衡量標準:安全性次要結果衡量標準:PK、療效和免疫原性療效終點:ORR、DOR、DCR、PFS 1期劑量遞增/擴展受試者、已進展或對標準療法不耐受的受試者 1b 期(劑量擴大):受試者必須有 Claudin18.2 陽性(IHC) 晚期實體瘤且必須至少有一個可測量的病變美國第一階段 FPI Q12022 RP2D 劑量等級 (DL1) DL2 DL3 MTD 第 1b 階段擴展 DL4 DL5 在美國多個地點進行

探索計劃
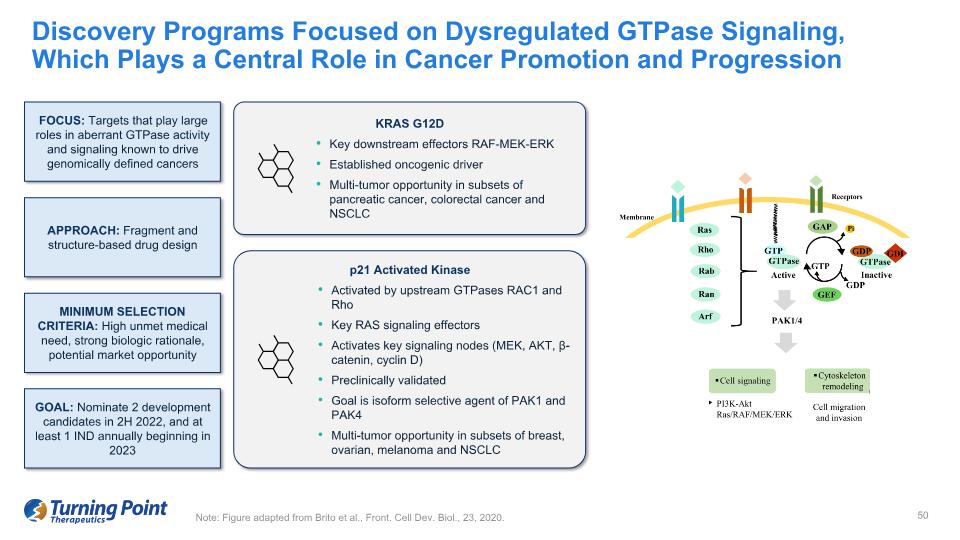
注:該圖改編自 Brito 等人,正面。細胞開發。Biol.,2020 年 23 日。專注於失調的GTPase信號傳導的發現項目,其在癌症的促進和進展中起着核心作用 PAK1/4 KRAS G12D 關鍵下游效應物 RAF-MEK-ERK 在胰腺癌、結直腸癌和非小細胞肺癌亞羣中確立了致癌驅動因素多腫瘤機會。重點:在異常的GTPase活性和信號傳導中起重要作用的靶標已知會推動基因組定義的癌症方法:片段和結構基於藥物設計的最低選擇標準:未滿足的高度醫療需求、強大的生物學依據、潛在的市場機會目標:在2022年下半年提名2種開發候選藥物,從2023年開始每年至少提名1種由上游GTPases RAC1和Rho Key RAS信號效應器激活關鍵信號轉導節點(MEK、AKT、β-連環素、細胞週期素D)臨牀前驗證目標是乳房、卵巢亞羣中PAK1和PAK4多腫瘤機會的亞型選擇劑黑色素瘤和非小細胞肺癌

2022年預期里程碑

Repotrectinib 在 2022 年第 2 季度保密協議前會議上與美國食品藥品管理局討論 ROS1+ NSCLC BICR 數據介紹來自 TRIDENT-1 2H 2022 年 ROS1+ NSCLC 隊列的詳細研究結果提供來自 TRIDENT-1 下半年 NTRK+ 晚期實體瘤隊列的臨牀數據更新 Elzovantinib 啟動艾佐萬替尼的 1b/2 SHIELD-2 期研究 2022年中期與aumolertinib聯合使用啟動 SHIELD-1 研究的第二階段部分,等待美國食品藥品管理局對2022年下半年中間劑量水平數據的反饋提供1期SHIELD-1 研究的臨牀數據更新2022年下半年 TPX-0131 提供在 FORGE-1 研究劑量發現部分接受治療的初始患者的早期中期數據 2022年下半年/2023年初 Tpx-4589 提供臨牀前數據並提供更多發展計劃指導 2023 年初發現提名 2 名開發候選人 2022 年下半年提供其他 2 個 GTPase 信號發現項目的詳細信息 2022-2023 年預期里程碑

下一代精準腫瘤醫學公司概述 2022年5月