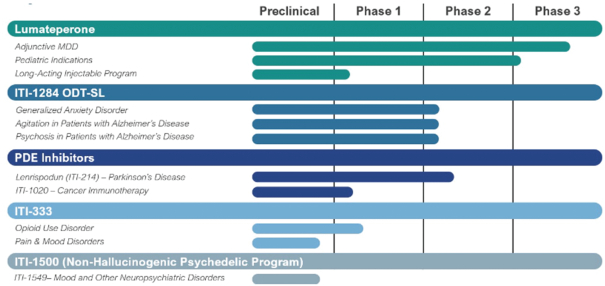
可能進行額外的註冊試驗,以支持補充新藥申請(snDa),以批准盧馬佩龍作為抗抑鬱藥的輔助療法,用於治療
MDD(如果需要)。我們預計將在2024年第二季度末公佈第502號研究的主要結果,根據這些結果,我們預計將在2024年下半年向美國食品藥品管理局提交sndA,批准lumateperone作為抗抑鬱藥的輔助療法,用於
治療MDD。
2020年第一季度,作為lumateperone雙相抑鬱症臨牀項目的一部分,我們
啟動了第三項單一療法的3期研究,即403號研究,評估了盧馬匹龍作為單一療法治療與躁鬱症I或雙相情感障礙相關的重度抑鬱發作中的單一療法。繼我們的輔助研究
(這是我們的雙相抑鬱症臨牀項目402號研究的一部分)取得積極結果之後,我們對403號研究進行了修訂,以評估I型或雙相情感障礙患者中具有混合特徵的重度抑鬱發作以及MDD
患者的混合特徵。2023 年 3 月,我們宣佈了 403 項研究的積極結果,即每天給予一次的 42 mg lumateperone 達到了該研究的主要終點,這表明在混合特徵的 MDD 和混合特徵的雙相抑鬱綜合患者羣體中,第 6 周的 MADRS
總分與安慰劑相比有統計學意義且具有臨牀意義的降低(與安慰劑相比降低 5.7 分;p
我們還有一項正在進行的研究,即304號研究,該研究評估了盧馬佩隆預防精神分裂症患者復發的作用。該研究
分五個階段進行,包括篩查階段;為期6周的開放標籤磨合階段,所有患者每天將接受42毫克的盧馬佩龍;為期12周的開放標籤穩定階段,在此期間,所有患者每天將接受42毫克的盧馬佩龍;雙盲治療階段,持續26周,在此期間,患者每天接受42毫克的
lumateperone 或安慰劑(比例為 1:1);以及為期2周的安全隨訪階段。這項研究是根據我們在批准後向美國食品藥品管理局做出的上市承諾
進行的,該承諾涉及批准CAPLYTA用於治療精神分裂症,就像抗精神病藥物一樣。
在lumateperone
產品組合中,我們已經或正在對患有與自閉症譜系障礙相關的精神分裂症、雙相情感障礙和易怒的兒科患者進行研究。此外,我們正在開發一種長效注射劑(
或 LAI),為精神疾病患者提供更多治療選擇。我們已經使用LAI配方進行了1期單一遞增劑量研究。該研究評估了
lumateperone LAI 在精神分裂症症狀穩定且總體上安全且耐受性良好的患者中的藥代動力學、安全性和耐受性。我們正在評估其他幾種治療持續時間為一個月或更長時間的lumateperone LAI配方。我們已經完成了所有非臨牀研究,以支持啟動另外四種LAI製劑的1期研究。我們預計將在2024年上半年開始這項研究的臨牀研究。鑑於迄今為止口服盧馬佩龍具有令人鼓舞的療效和良好的安全性,我們認為,特別是LAI選項可能成為某些患者的重要配方選擇。
我們正在開發 ITI-1284-ODT-SL用於
治療廣泛性焦慮症、治療痴呆患者的躁動和痴呆相關精神病的治療。
ITI-1284-ODT-SL是 lumateperone 的一種氘化形式,這是一種新的分子實體,配方為口服崩解片,用於
舌下給藥。 ITI-1284-ODT-SL採用口服固體劑型配製,放置在舌下
時幾乎會立即溶解,便於老年人使用,可能特別有益於
2