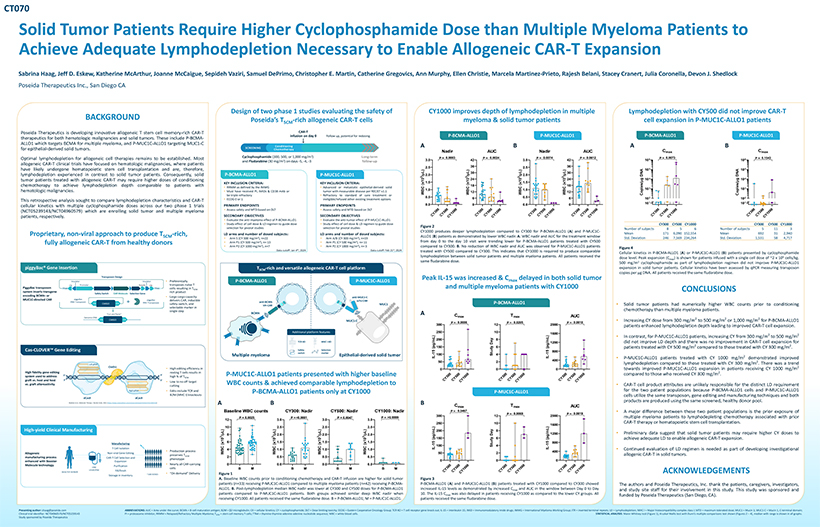
CT070 實體瘤患者需要比多發性骨髓瘤患者更高的環磷酰胺劑量才能達到實現異基因治療所必需的充足 淋巴消耗 CAR-T Expansion Sabrina Haag、Jeff D. Eskew、Katherine McArthur、Joanne McCaigue、Sepideh Vaziri、塞繆爾·德普利莫、克里斯托弗 E. Martinez Martinez-Prietics、Ann 墨菲、艾倫·克里斯蒂、馬塞拉·馬丁內斯-普列託、拉傑什·貝拉尼、史黛西·克拉內拉、德文·謝德洛克 Poseida Therapeutics Inc.、加利福尼亞州聖地亞哥設計在兩項評估 CY1000 安全性的 1 期研究中,CY500 改善了多次淋巴消耗中 淋巴消耗的深度,並未改善 CAR-T 背景 Poseidas 富含 T 的異體 CAR-T 細胞骨髓瘤和實體瘤 患者細胞P-MUC1C-ALLO1 患者人數的擴大 SCM Poseida Therapeutics 正在開發創新的異體 T 幹細胞記憶豐富 CAR-T CAR-T 輸液,有可能在第 0 天隨訪中重用 P-BCMA-ALLO1 P-MUC1C-ALLO1 P-BCMA-ALLO1 P-MUC1C-ALLO1 療法,治療血液系統惡性腫瘤和實體瘤。其中包括針對多發性骨髓瘤的 靶向 BCMA 的 P-BCMA-ALLO1,以及針對上皮源性實體瘤的 MUC1-C 調節 A B A B 篩查隨訪的 P-MUC1C-ALLO1。化療 Nadir AUC Nadir AUC Cmax Cmax Cmax 環磷酰胺(300、500 或 1,000 mg/m2)異基因細胞療法的長期最佳淋巴消耗仍有待確定。大多數 P = 0.0003 P = 0.0024 P = 0.0074 P = 0.0612 P = 0.1543 P = 0.1543 3.0 42 106 106 和氟達拉濱(30 mg/m2)在第 -5、-4、3 天隨訪異體 CAR-T 臨牀試驗側重於血液系統惡性腫瘤,其中 2.5 36 2.5 36 5 5 可能接受了造血幹細胞移植,因此,L) 10 10 30 30 與實體瘤患者形成鮮明對比的淋巴消耗 。因此,固體的 P-BCMA-ALLO1 P-MUC1C-ALLO1/µ2。0 /µL/µL) 2.0/µL) DNA DNA 3 3 3 3 腫瘤 接受異基因 CAR-T 治療的患者可能需要更高劑量的調理 10 24 24 104 104 x 1.5 x10 x 1 1.5 x 1 1.5 x 1 關鍵納入標準:關鍵納入標準:化療以達到 淋巴消耗深度與 (18 ((18 ies/µg ies/µg ies/µg RRMM 的患者相當作者:IMWG Advanced 或轉移性上皮衍生的固體 C p 103 p 103 血液系統惡性腫瘤。公元前 1.0 年 1.0 BC 必須 接受過 PI、IMID 和 CD38 mAb 或根據 RECIST v1.1 WB 12 12 WBC W W Co 接受過可測量疾病的腫瘤Co 是三重難治性難治性不符合標準護理治療或 0.5 6 0.5 6 102 102 本回顧性分析旨在比較淋巴消耗特徵和 CAR-T ECOG 0 或 1 不符合資格/拒絕其他現有治療方案 101 101 在我們的兩項 1 期試驗中使用多個環磷酰胺劑量的細胞動力學主要終點主要終點 0.0 0 0 0 評估安全性和 MTD 基於 DLT 評估安全性和 MTD T 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 (NCT05239143/NCT04960579) 正在註冊實體瘤和多個 骨髓瘤 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3 5 0 3 5 0 3 5 0 3 5 0 3 5 0 3 5 0 Y Y 1 Y 1 Y Y 1 Y 1 Y 1 Y Y 1 Y 1 Y Y 1 Y Y 1 Y Y 1 Y Y 1 Y Y 1 Y Y 1 患者。次要目標次要目標 C C Y C Y C Y C Y C Y C Y C Y C Y C Y C C C C C C C C C C C C 評估 P-MUC1C-ALLO1 的抗骨髓瘤作用評估的抗腫瘤作用細胞劑量和 LD 方案指導劑量的研究效果 細胞劑量和 LD 方案對指導劑量的研究效果 CY300 CY1000 CY300 CY500 CY1000 圖 2 關鍵研究選擇關鍵研究選擇受試者數量 8 5 6 受試者人數 5 11 3 CY1000 與 CY300 相比,會產生更深的 淋巴枯竭——專利 P-BCMA-ALLO1 CY500 P-BCMA-ALLO1 P-MUC1C,採用非病毒方法生產富含 T 的 LD 組 和給藥受試者數量:LD 組和給藥受試者數量:ALLO1(B)患者,白細胞最低點下限即為所示。答:治療窗口的 WBC 最低點和 AUC 平均值 171 6,090 152,554 平均值 692 31 2,940 SCM 2 2 2 Std.偏差 246 7,569 234,264 英尺偏差 1,531 58 4,717 Arm S(CY 300 mg/m),n=22 Arm A/B(CY 300 mg/m),n=19 來自健康捐贈者的完全異體 CAR-T Arm P1(CY 500 mg/m2),n= 13 Arm P1(CY 500 mg/m2),從第 0 天到第 10 天就診的 n= 11,在接受 CY500 Arm P2(CY 1000 mg/m2)治療的 P-BCMA-ALLO1 患者中呈下降趨勢,n=7 Arm P2(CY 1000 mg/m2),與 CY300 相比 n= 3。B. P-MUC1C-ALLO1 患者未觀察到白細胞最低點和 AUC 減少 圖 4 數據截止日期:2024 年 1 月 4 日數據截止日期:2024 年 2 月 21 日數據截止日期:2024 年 2 月 21 日使用 CY500 與 CY300 進行治療。 這表明,對於實體瘤 患者和多發性骨髓瘤患者之間的環磷酰胺淋巴消耗所表現的 P-BCMA-ALLO1 (A) 或 P-MUC1C-ALLO1 (B) 患者, 需要使用 CY1000 來產生類似的細胞動力學。所有患者都接受了6劑量水平。注射單細胞劑量約為 2 x 10 個細胞/千克的患者的峯值擴展(Cmax)。氟達拉濱劑量相同。作為 淋巴消耗方案的一部分,2 500 mg/m 環磷酰胺並未改善實體瘤 患者富含 T 的多功能異體 CAR-T 細胞平臺擴展。P-MUC1C-ALLO1通過qPCR對細胞動力學進行了評估,測量了每微克DNA的轉座子SCM拷貝。所有患者都接受了相同劑量的氟達拉濱。Transposon Design Peak IL-15 在兩個實體瘤絕緣體中均出現延遲 C 延遲,優先 P-BCMA-ALLO1 P-MUC1C-ALLO1 max ITR 啟動子 Poly (A) ITR 轉置天真 T 和多個 骨髓瘤患者 CY1000 piggyBac 轉座子 TTAA TTAA 細胞導致 T 系統插入轉基因 SCM 結論豐富的產品編碼 BCMA 或安全開關 CAR 分子基因選擇大型貨物容量抗 muc1-C 導向 muc1C 的 CAR piggyBac piggyBac 提供 CAR、可誘導的 scfv-Car DNA 轉座子 RNA 轉座子 RNA 轉座酶抗體 B P-BCMA-ALLO1 ITR CARGO ITR安全開關,在單步 化療中調節 VH 可選標誌物之前,MUC1 實體瘤患者的白細胞計數比多發骨髓瘤患者高。剪切並粘貼 BCMA A Cmax Tmax Tmax AUC 基因組 DNA 2 2 2 ITR CARGO ITR MUC1-C 將 P-BCMA-ALLO1 的 CY 劑量從 300 mg/m 增加到 500 mg/m 或 1,000 mg/m P = 0.0086 P = 0.00105 P = 0.0010 300 12 2000 名患者淋巴消耗深度增強,從而改善 CAR-T 細胞的擴張。其他平臺的特點是 250 10 1600 2) L 相比之下,對於 P-MUC1C-ALLO1 患者,將 CY 從 300 mg/m 增加到 500 mg/m 200 y 8 m TCR KO MHC I-KO /mL) Da/1200 並未改善 LD 深度 ,與 CY 500 mg/m 治療的患者相比,g 2 (p 150 y 6) 的 CAR-T 細胞擴張也沒有改善 CY 500 mg/m。cas-clover 基因編輯安全選擇 800 切換標記 15 15 多發性骨髓瘤上皮衍生實體瘤 100 Stud 4IL P-MUC1C-ALLO1 患者與使用 CY 300 mg/m2 治療的患者相比,經過 CY 1000 mg/m2 治療的患者表現出改善 400 2 50 2 淋巴消耗。Left gRNA Clo051 2 0 0 的高編輯效率有改善 接受 CY 1000 mg/m 的患者的 P-MUC1C-ALLO1 擴張的趨勢。與接受 CY 300 mg/m的患者相比,高保真度基因編輯靜息 T 細胞的結果為 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0,用於治療 5 3 名 P-MUC1C-ALLO1 患者 出現較高的 TSCM 3 5 5 0 3 5 0 Y Y Y 1 Y 1 Y 1 Y Y 1 移植物與宿主和宿主 3 5 C Y C C Y C Y C Y C Y C Y C Y 與移植物同種反應性 WBC 計數低至無偏離目標 WBC 計數且達到了 可比的淋巴消耗對於 C C C 削減 CAR-T 細胞產品屬性不太可能導致 LD 的不同要求。對於 CY1000 P-MUC1C-ALLO1 的兩個患者羣體,gRNA 編輯僅包括 TCR 和 P-BCMA-ALLO1 患者,因為 P-BCMA-ALLO1 細胞和 P-MUC1C-ALLO1 B2M(MHC I)敲除細胞使用相同的轉座、基因編輯和製造技術,以及 dcas9 dCas9 Madison 等人,《分子療法核酸》,2022年。 (https://www.sciencedirect.com/science/article/pii/S216225312200155X) A B B 產品是使用相同的經過篩選的健康捐贈者庫生產的。Cmax Tmax AUC 基線 WBC 計數 CY300:最低點 CY500:最低點 CY1000:最低點 P = 0.0467 0.0069 0.0019 這兩個患者羣體之間的主要區別是 P = P = 300 12 2000 多發性骨髓瘤患者先前接觸過與先前 P = 0.0025 P =0.9999 12 3.0 3.0 250 10 CAR-T 療法或造血幹細胞轉化相關的淋巴消耗化療種植。1600 10 2.5 2.5 2.5 L)) 高產量臨牀製造) 200 y 8 µL /m 1200 初步數據表明,實體瘤患者 可能需要更高的 CY 劑量至/8 /µL) 2.0 /µL) 2.0 /µL) 2.0 gDa 3 3 3 3 p 0 0 0 150 y 6 (pg/mL 達到足夠的 LD 以實現異體 CAR-T 擴展。10 (d 6 x1 1.5 x1 1.5 x1 1.5 x1 1.5 x1 1.5 u 800 Manufacturing (x ((15 t 15 C 100 S 4T Cell IL IL) 作為研究性 4 1.0 1.0 1.0 生產工藝的一部分,需要繼續評估 LD 方案 400 異基因非病毒基因編輯 WB WBC WBC WBC WBC 50 2 實體瘤中的異體 CAR-T。保留了 TSCM 製造工藝 CAR-T Cell Selection 和 2 0.5 0.5 0.5 膨脹表型 0 0 0 使用 Booster Molecule 技術增強幾乎所有載有汽車 0 0.0 0.0 0.0 0.0 淨化 0 0 0 0 0 0 0 0 0 0 0 0 0 0 B M B M M B M M 3 5 0 3 5 0 LEUKOPAK 填充/完成 Y Y Y 1 Y Y 1 Y Y 1 Y Y 1 健康捐贈者 C C Y C Y 按需交付致謝圖 1 C C C 庫存中存儲 ~100 劑量 A. 基準白細胞計數與接受 P-BCMA-P-BCMA-ALLO1 (A) 和 P-MUC1C-ALLO1 (B) 患者接受 CY 治療的多發性骨髓瘤患者 (n=42) 相比,接受 P-MUC1C-ALLO1 的實體瘤患者 (n=33) 在進行調理化療和 CAR-T 輸注之前更高1000 與 CY300 相比,作者和 Poseida Therapeutics, Inc. 對 ALLO1 的患者、護理人員、研究人員表示感謝。B. 淋巴消耗後白細胞消耗後的最低點在 CY300 和 CY500 劑量下降低,P-BCMA-ALLO1 的 IL-15 水平升高,如第 0 天至最大值之間的 C 和 AUC 升高以及研究現場工作人員參與本研究的研究現場工作人員所示。這項研究得到了贊助,患者與 P-MUC1C-ALLO1 患者進行了比較。兩組在10歲時都達到了相似的深度白血球最低點。與較低的 CY 組相比,接受 CY1000 的患者的 IL-15 C 也有所延遲。所有 上限均由波塞達治療公司(加利福尼亞州聖地亞哥)資助。正在接受 CY1000。所有患者接受相同劑量的氟達拉濱。B = P-BCMA-ALLO1;M = P-MUC1C-ALLO1。患者 接受了相同劑量的氟達拉濱。主講作者:shaag@poseida.com 縮寫:AUC = 曲線下方區域;BCMA = B 細胞成熟抗原;B2M = 2 微球蛋白;CK = 細胞動力學;CY = 環磷酰胺;DLT = 劑量限制毒性;ECOG = 東方合作腫瘤小組;TCR KO = T 細胞受體基因敲除;IL-15 = 白介素 15;IMid = 免疫調節酰亞胺類藥物;IMWG = 國際骨髓瘤工作組;ITR = 末端反向重複;LD = 淋巴消耗;MHC I = 主要組織相容性複合體 I 類;MTD = 最大耐受劑量;MUC1 = 粘蛋白 1;MUC1-C =粘蛋白 1,C 末端結構域;臨牀試驗標識符:NCT04960579/NCT05239143 PI = 蛋白酶體抑制劑;RRMM = 復發/難治性多發性骨髓瘤;TSCM = 幹細胞記憶 T 細胞;TTAA = 胸腺嘧啶腺嘌呤 核苷酸序列;WBC = 白細胞。統計分析:曼恩-惠特尼檢驗(圖 1),顯示了 Kruskal-Wallis 檢驗和 Dunns 的多重比較測試(圖 2 4),所有圖表中都顯示了帶區間的中位數。由 Poseida Therapeutics 贊助的研究
附錄 99.3