目錄
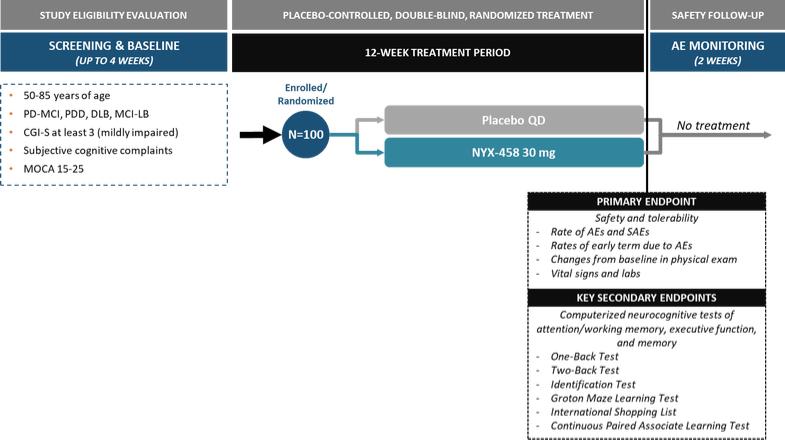
| NYX-458的第二階段研究目前正在進行中,這將為NYX-458的未來發展提供信息。基於相關的、可翻譯的、非人類靈長類動物模型中令人信服的數據,我們相信NYX-458如果獲得批准,可能會對與路易體痴呆相關的認知障礙的現有治療方法提供實質性的改進。 |
| ● | 通過利用我們的NMDAR調製器發現平臺,在NMDAR生物學領域建立和擴大我們的領先地位,繼續擴大我們的渠道。我們打算利用我們的發現平臺,開發一系列大腦和神經系統疾病的廣泛管道和產品組合。我們的研發流程由我們的1,000多種獨特的、合成的小分子NMDAR調節劑庫提供支持,這些調節劑來自我們廣泛的原創性研究,並發現了一種新的結合結構域,我們相信這種結合結構域可以安全有效地增強突觸的可塑性。所有這些化合物的設計都符合良好的中樞神經系統(CNS)、安全性和藥代動力學(PK)標準。我們還計劃繼續尋找依賴NMDAR的生物標誌物,這可能有助於我們未來候選產品的開發。 |
| ● | 優化我們候選產品的開發和商業潛力。在我們選定的適應症中,我們擁有NYX-2925、NYX-783和NYX-458的全球商業權。我們的主要戰略是獨立追求我們候選產品的開發和商業化。我們組建了一支經驗豐富的管理團隊,能夠沿着藥物開發和商業化的整個價值鏈執行。隨着我們繼續建立和發展我們的產品組合,我們可能會機會主義地尋求戰略合作伙伴關係,使我們的管道價值最大化。 |
來自我們的Discovery平臺的候選產品
下表彙總了我們從Discovery平臺生成的全資候選產品管道的當前開發狀況:

雖然我們所有的候選產品和我們發現平臺中的其他分子都調節NMDAR,但它們是不同的化學實體,具有不同的藥理特性。我們的每個分子都在結合域內唯一地結合,導致不同的活性、效力和NMDAR亞型選擇性特徵。我們通過在大腦和神經系統疾病的不同臨牀前模型中詢問我們的分子來評估這些變異的治療意義。我們從這些臨牀前研究中收集的數據表明,哪些分子更適合不同的適應症,並相應地為我們的開發決策提供信息。
7