招股説明書
依據第424(B)(4)條提交
註冊説明書第333-276500號
註冊説明書第333-271416號
ABVc BioPharma公司
11,714,683股普通股
本招股説明書涉及本招股説明書中在“出售股東”標題下確定的出售股東不時轉售內華達州ABVC BioPharma公司(下稱“本公司”)最多11,714,683股普通股,面值0.001美元(“普通股”)。這些股份包括:(I)3,527,778股普通股,作為根據該公司與Lind Global Fund II,LP於2023年2月23日訂立的某項有擔保可轉換票據的證券購買協議(“Lind交易”);
(Ii)5,291,667股普通股根據Lind交易認購普通股;(Iii)211,667股普通股
根據Lind交易配售代理普通股認購權證(“PA認股權證”);
(Iv)342,857股本公司普通股,根據本公司與Lind Global Fund II,LP(“2”)於2023年11月17日簽署的某項證券購買協議,發行有擔保的可轉換票據。發送Lind Transaction“);
(V)1,000,000股作為普通股認購權證基礎的普通股發送Lind交易;(Vi)30,000股普通股,作為配售代理普通股認購權證的基礎,根據2發送鏈接交易
(“2發送PA Warrant”);(vii)根據本公司與Lind於2024年1月17日簽訂的若干證券購買協議,285,714股本公司普通股(“3研發
(八)根據第三條規定,100萬股普通股相關普通股認股權證;研發
林德交易;及(ix)25,000股普通股相關配售代理普通股購買權證根據
3研發Lind事務(“3研發PA Warrant”)。
有關出售股東的詳細信息,請參閲《出售股東》。
出售股票的股東可以不時地在我們的普通股以現行市場價格交易的主要市場上出售這些股票,也可以通過談判交易或通過“分銷計劃”一節中所述的任何其他方式來出售。出售股票的股東可被視為其發行的普通股的承銷商,這符合修訂後的《1933年證券法》的含義。我們將支付註冊這些股票的費用。
我們不會從出售股票的股東出售本招股説明書所涵蓋的股份中獲得收益。
股票登記是為了允許出售股票的股東或其各自的質權人、受讓人、受讓人或其他利益繼承人在公開市場上不時地出售股票。我們不知道出售股票的股東何時或以多少金額可以出售這些證券。出售
股東可以出售本招股説明書提供的部分、全部或全部證券。
我們的
普通股在納斯達克資本市場以ABVC的代碼報價。2024年4月4日,我們普通股的收盤價為每股1.28美元。
出售股東可在
中出售本招股説明書中描述的普通股股份 多種不同的方式,以現行市場價格或私下協商的價格,
出售股東的發行沒有終止日期。
在您投資我們的任何證券之前,您應仔細閲讀本招股説明書以及
在“通過引用合併某些信息”和“在哪裏可以找到更多信息”標題下描述的其他信息。
投資我們的證券涉及高風險。請參閲本招股説明書第8頁開始的“風險因素”。
美國證券交易委員會和任何州證券委員會都沒有批准或不批准這些證券,也沒有確定本招股説明書是否真實或完整。
任何相反的陳述都是刑事犯罪。
本招股説明書日期為2024年4月5日
目錄
| 前景
公約 |
II |
| 行業和市場數據 |
三、 |
| 招股説明書
摘要 |
1 |
|
產品 |
7 |
| 風險因素
|
8 |
| 有關前瞻性陳述的特別説明 |
27 |
| 使用收益的
|
28 |
| 管理層對財務狀況和經營結果的討論和分析 |
29 |
| 生意場 |
54 |
| 管理 |
70 |
| 高管薪酬
|
75 |
| 安全
某些受益所有者和管理層的所有權 |
79 |
| 相關
合併公司董事及執行人員的交易 |
80 |
| 證券説明
|
83 |
| 出售
個股東 |
85 |
| 分銷計劃
|
86 |
| 法律事務
|
88 |
| 專家 |
88 |
| 此處
您可以找到詳細信息 |
88 |
您應僅依賴本招股説明書或我們可能特別授權交付或提供給您的任何免費編寫的招股説明書中包含的信息。我們
和我們的承銷商沒有授權任何人向您提供除本招股説明書或我們授權交付或提供給您的任何免費書面招股説明書中包含的任何信息以外的任何信息。對於其他人可能向您提供的任何其他信息的可靠性,我們不承擔任何責任,也不能提供任何保證。本招股説明書僅適用於合法提供和出售我們的證券的情況。本招股説明書中的信息僅在本招股説明書的日期是準確的,與本招股説明書的交付時間或我們證券的任何出售無關。自該日期以來,我們的業務、財務狀況、運營結果和前景可能已發生變化
。我們不會在任何不允許要約的司法管轄區對這些證券進行要約。
除文意另有所指外,本招股説明書中的術語“ABVC”、“我們”、“我們”和“我們”均指ABVC BioPharma,Inc.,而“本次發售”指的是本招股説明書中預期的發售。
招股章程慣例
除上下文另有所指外,
僅就本招股章程而言:
“American BriVision Corporation”
是指特拉華州的一家公司,是ABVC的全資子公司;
“APR”或“年利率”是指向借款人收取的年利率,包括固定利率和交易手續費利率,以單個百分比數字表示,表示貸款有效期內的實際年借款成本;
“BioKey”指BioKey,Inc.指的是美國加州的一家公司和ABVC的全資子公司;
“BioLite”指BioLite Holding,
Inc.是指內華達州的一家公司和ABVC的全資子公司;
“董事會”是指本公司的董事會;
“中國”和“中華人民共和國”
是指人民Republic of China,包括香港特別行政區和澳門特別行政區,除指中華人民共和國通過的具體法律、法規和其他僅適用於內地的法律或税務事項外,
本招股説明書不包括臺灣;
“普通股”是ABVC Biophma,Inc.的普通股,每股票面價值0.001美元;
“合併協議”指截至2018年1月31日的協議和合並計劃,根據該協議,本公司、BioLite、BioKey、“BioLite收購公司”
一家內華達州公司和BioKey收購公司。一家加州公司於2019年2月8日完成了業務合併,ABVC通過向BioLite和BioKey的股東增發普通股收購了BioLite和BioKey;
“Lind”指Lind Global Fund
II,LP;
“A系列可轉換優先股”
是ABVC Biophma,Inc.的A系列可轉換優先股,每股票面價值0.001美元;
除非上下文另有規定,術語“我們”、“公司”、“我們的公司”或“ABVC”是指ABVC Biophma,Inc.、內華達州的一家公司和這裏定義的所有子公司;
"****"或"臺灣"
指****臺灣;
“子公司”或“子公司”是指美國BriVision公司,有時也稱為“BriVision”,BioLite Holding,Inc.或BioLite and BioKey,
Inc.或BioKey;
凡提及“新臺幣”及“新臺幣”,均指R.O.C.的法定貨幣;
所有提到的“美元”、
“美元”和“$”都是指美國法定貨幣。
本招股説明書詳細説明瞭某些新臺幣的金額
,括號內為按本招股説明書發佈之日的匯率計算的大致美元金額。NTD和美元的轉換率可能會發生變化,因此,我們不能保證本招股説明書中指定的美元金額不會發生變化。
為澄清起見,本招股説明書遵循英文
名後隨姓的命名慣例,無論個人姓名是中文還是英文。
行業和市場數據
本招股説明書包括有關
市場和行業狀況以及來自第三方來源的市場份額的信息,或基於使用此類來源(如果有)的估計。
我們沒有直接或間接贊助或參與任何此類材料的發佈。我們認為這些信息和估計是合理和可靠的。我們還假設從第三方來源的出版物中提取的信息已被準確複製。我們理解,如果本招股説明書中包含的信息的任何部分在很大程度上是不正確、誤導性或不準確的,本公司將承擔責任。
招股説明書摘要
本摘要重點介紹了本招股説明書中其他地方包含的信息,並不包含您在做出投資決策時應考慮的所有信息。
在投資我們的證券之前,您應仔細閲讀本招股説明書全文,包括我們的財務報表和相關的
註釋,以及本招股説明書中其他地方的“風險因素”和“管理層對財務狀況和經營結果的討論和分析”標題下列出的信息。
公司概述
我們的使命
我們
致力於打造一家成熟的生物技術公司,併成為生物製藥行業的先驅。我們的首席執行官Uttam Patil博士和公司創始人兼大股東蔣宗山博士,瞭解生物技術行業的挑戰和機遇,並打算為尚未滿足的重大醫療需求提供治療解決方案,並通過開發治療中樞神經系統(CNS)的創新植物藥物來改善人類的健康和生活質量腫瘤學/血液學
疾病。
業務概述
截至本文發佈之日,該公司的最低收入來自通過BioKey銷售CDMO服務。然而,該公司的重點是通過仔細跟蹤亞太地區研究機構的新醫學發現或醫療器械技術來開發產品流水線
。臨牀前,疾病動物模型和I期安全性研究由公司的科學家和公司已知的其他專家仔細檢查,以根據公司的內部資質確定其認為有效和安全的藥物或醫療器械。一旦一種藥物或醫療器械被證明是進一步開發和最終商業化的良好候選藥物或醫療器械,ABVC將從原始研究人員那裏獲得該藥物或醫療器械的許可,並向美國、澳大利亞和臺灣備受尊敬的主要研究人員介紹藥物或醫療器械臨牀試驗計劃
。ABVC發現,在幾乎所有情況下,這些國家的研究機構都渴望與該公司合作,推進第二階段臨牀試驗。
已經或正在與ABVC合作進行第二階段臨牀試驗的機構包括:
| ● | 藥物:ABV-1504,嚴重抑鬱障礙(MDD),第二階段完成。NCE藥物首席研究員:Charles DeBattista醫學博士和Alan F.Schatzberg醫學博士,斯坦福大學醫學中心,Li醫學博士,醫學博士-臺北退伍軍人總醫院 |
| ● | Drug:
ABV-1505, Adult Attention-Deficit Hyperactivity Disorder (ADHD), Phase II Part 1 completed.
Principal Investigators: Keith McBurnett, Ph.D. and Linda Pfiffner, Ph.D., University of
California San Francisco (UCSF), School of Medicine. Phase II, Part 2 clinical study sites
include UCSF and 5 locations in Taiwan. The Principal Investigators are Keith McBurnett,
Ph.D. and Linda Pfiffner, Ph.D., University of California San Francisco (UCSF), School of
Medicine; Susan Shur-Fen Gau, M.D., National Taiwan University Hospital; Xinzhang Ni, M.D.
Linkou Chang Gung Memorial Hospital; Wenjun Xhou, M.D.; Kaohsiung Chang Gung Memorial Hospital;
Ton-Ping Su, M.D., Cheng Hsin General Hospital; Cheng-Ta Li, M.D., Taipei Veterans General
Hospital. Phase II, Part 2 began in the 1st quarter of 2022 at the 5 Taiwan sites. The UCSF
site joined the study in the 2nd quarter of 2023. The subjects enrolled in the study has
reached the number for interim analysis in 2023 December, and the interim analysis of the
study is in progress. |
| ● | 藥物:ABV-1601,癌症患者的主要抑鬱,I/II期,NCE藥物首席研究員:斯科特·歐文,醫學,博士-雪松西奈醫學中心(CSMC)。第一階段臨牀研究將於2024年第一季度啟動。
|
| ● | 醫療
器械:ABV—1701,Vitargus ®在玻璃體切除手術中的II期研究已經啟動
在澳大利亞和泰國,主要研究者:Duangnate Rojanaporn,醫學博士,拉瑪提博迪 醫院;Thuss Sanguansak,醫學博士,兩個泰國研究中心的Srinagarind醫院和教授/博士。
Matthew Simunovic,悉尼眼科醫院;Elvis Ojaimi博士,東墨爾本眼科集團&
東墨爾本視網膜。第二階段研究於2023年第二季度開始,公司
正在通過新一批試驗產品改進Vitargus產品
產品 |
以下審判預計將於2024年第三季度開始:
| ● | 藥物:
ABV-1519,非小細胞肺癌治療,臺灣I/II期研究,首席研究員:
羅永鴻醫生,醫學博士,臺北退伍軍人總醫院(TVGH) |
| ● | 藥物:ABV-1703,晚期無法手術或轉移性胰腺癌,II期,首席研究員:安德魯·E·亨迪法爾,醫學-雪松西奈醫學中心(CSMC) |
成功完成第二階段試驗後,ABVC將尋找合作伙伴(通常是大型製藥公司)完成第三階段研究,並在獲得美國FDA、臺灣TFDA和其他國家/地區監管機構的批准後將藥物或醫療器械商業化。
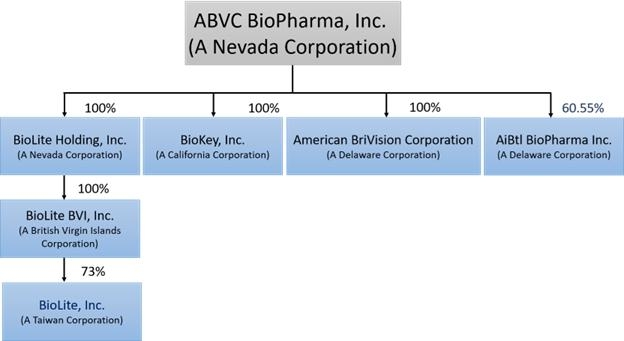
公司結構
ABVc於2002年2月6日根據內華達州法律註冊成立,擁有三家全資子公司:BriVision、BioLite Holding,Inc.和BioKey,Inc.BriVision於2015年7月在特拉華州註冊成立,目前在北美從事醫藥產品開發業務。
BioLite Holding於2016年7月27日根據內華達州法律註冊成立,授權持有5億股,面值0.0001美元。其主要子公司包括於2016年9月13日在英屬維爾京羣島註冊成立的BioLite BVI,Inc.(“BioLite BVI”)和成立於2006年2月的臺灣公司BioLite Inc.(“BioLite
臺灣”)。BioLite臺灣公司從事新藥研發已有超過12年的歷史。根據股份購買/交換協議(“股份購買/交換協議”),BioLite臺灣的若干股東以BioLite臺灣約73%的股權證券
交換BioLite Holding的普通股。因此,BioLite Holding通過BioLite BVI擁有BioLite臺灣約73%的股份。未加入本股份購買/交換協議的其他股東保留其在BioLite臺灣的股權。
BioKey於2000年11月20日在加利福尼亞州成立,該公司最初選擇專注於開發仿製藥,以抓住蓬勃發展的行業的機遇。
合併於2019年2月8日完成後,BioLite和BioKey成為ABVC的兩家全資子公司。
以下圖表説明了ABVC的公司結構:
自2022年3月5日起,公司董事會批准修訂公司章程,刪除允許董事累計投票的第2.8條
,因為我們的公司章程明確禁止累計投票。由於我們的《公司章程》第
條未另有規定,董事應根據內華達州修訂後的《章程》的規定,在選舉中以多數票選出。
自2024年3月14日起,公司董事會批准修訂公司章程第2.8節,以修改在股東大會上確定法定人數所需的股份數量。修正案將法定人數要求從有權對某一事項投出的多數票改為33-1/3%
。現將修訂後的現行章程全文作為附件3.2附於本文件。
最新發展動態
納斯達克上市
2021年8月5日,我們完成了1,100,000股的公開發行(“發售”),每個單位包括一股我們的普通股
(“普通股”),一股A系列認股權證(“A系列認股權證”),以每股6.30美元的行使價購買一股普通股,可行使至發行日期五週年,以及一份B系列認股權證(
“B系列認股權證”),以及A系列認股權證,“公開認股權證”)以每股10.00美元的行使價購買一股普通股,可行使至發行日五週年;認股權證的行權價格須受其中所述的若干調整及無現金行權條款所規限。本公司根據最初於2021年4月8日提交給美國證券交易委員會(以下簡稱“美國證券交易委員會”)的S-1表格註冊聲明(第333-255112號文件)(經修訂後的“原始註冊聲明”)、美國證券交易委員會宣佈於2021年8月2日生效的S-1表格註冊聲明(第333-258404號文件)及於2021年8月4日自動生效的S-1表格註冊聲明(“S-1MEF”)及原始註冊聲明完成發售。註冊聲明)。
單位定價為每單位6.25美元,扣除承銷折扣和發售費用前,總收益為6,875,000美元。
此次發售基於堅定的承諾進行。該普通股獲準在納斯達克資本市場上市,並於2021年8月3日開始
交易,股票代碼為“ABVC”。
2022年8月19日,我們收到納斯達克股票市場有限責任公司(“納斯達克”)的納斯達克上市資格部(“員工”)發來的短函
通知我們,根據納斯達克上市規則5550(A)(2)(“規則5550(A)(2)”),我們普通股的收盤價連續30個工作日低於在納斯達克資本市場繼續上市所需的最低每股1.00美元。
根據納斯達克上市規則5810(C)(3)(A),我們最初被要求在2月14日之前2023重新遵守規則
5550(A)(2)。由於我們在此日期之前沒有重新獲得合規,因此我們請求並收到了額外的180天,直到2023年8月14日
來遵守規則5550(A)(2)。
| 1 | 癌症研究與臨牀(2009)135:1215-1221 |
2023年5月24日,本公司收到納斯達克證券市場有限責任公司(“納斯達克”)上市資格審核部(“員工”)發來的短函
,通知本公司不符合最低股東權益要求,或不符合上市證券市值或持續經營所得淨收入替代方案,無法繼續在納斯達克資本市場上市。納斯達克上市規則
第5550(B)(1)條要求上市公司保持至少2500,000美元的股東權益,截至2023年3月31日,公司的股東權益為1,734,507美元。根據納斯達克規則,本公司有45個日曆日,即在2023年7月10日之前提交計劃,以重新獲得合規。作為對提交的計劃的迴應,納斯達克批准我們將合規證明延期至2023年8月31日。在我們隨後於2023年9月6日完成幾筆交易後,納斯達克通知我們,他們確定我們
符合納斯達克上市規則5550(B)(1)。
戰略
我們業務戰略的關鍵要素包括:
| |
● |
前進到
ABV—1701 Vitargus ®用於治療視網膜脱離或玻璃體出血的關鍵試驗階段,這是我們預期的
在未來創造收入。 |
| |
● |
專注於
在成功完成II期臨牀試驗後,批准ABV—1504用於治療重度抑鬱症(MDD)
審判 |
| |
● |
正在完成
ABV—1505治療注意缺陷多動障礙(ADHD)的II期,第2部分臨牀試驗。 |
| |
● |
將候選藥物和候選醫療器械授權給主要製藥公司進行第三階段和關鍵臨牀試驗(如果適用),如果獲得FDA批准,還可以進行進一步的營銷。 |
我們計劃通過對中樞神經系統、血液/腫瘤學和眼科領域的研究新藥和醫療器械進行第一階段和第二階段臨牀試驗,來增強我們的核心研發能力和資產。
我們的管理團隊在廣泛的新藥和醫療器械開發方面
擁有豐富的經驗,我們擁有來自美國和臺灣的大型研究機構和大學的授權新藥和醫療器械候選人。通過自信的產品開發方法,我們預計我們
將建立一個強大的腫瘤學/血液學、中樞神經系統和眼科產品組合。我們主要專注於新藥候選的第一階段和第二階段研究
,並將第二階段後的產品授權給製藥公司;我們預計不會投入大量的
努力和資源來建立針對疾病的分銷渠道。
物質風險和挑戰
我們面臨着來自許多老牌和新興製藥和生物技術公司的激烈競爭,這些公司開發、分銷或銷售治療藥物,以治療我們的候選藥物設計用於治療的相同適應症
。我們目前和潛在的競爭對手包括大型製藥和生物技術公司,以及專業製藥和仿製藥公司。我們當前和潛在的許多競爭對手擁有比我們多得多的財力、技術和人力資源,並且在產品的營銷、商業化、發現、開發和監管審批方面擁有更多的經驗,這可能會使我們處於顯著的競爭劣勢,或者剝奪我們的營銷
獨家權利。通常,我們的競爭對手很可能比我們擁有更多的資本資源來支持他們的產品。此外,在投資我們之前,您應仔細考慮從第8頁開始的“風險因素”部分中描述的風險。
其中一些風險包括:
| ○ | 我們
從未產生過收入,在可預見的未來將繼續無利可圖。 |
| ○ | 我們的業務、運營、計劃和時間表可能會受到衞生流行病的影響,包括最近的新冠肺炎疫情。 |
| ○ | 我們的
臨牀試驗可能會延遲或不成功,並且我們可能無法按預期獲得監管部門對任何候選藥物的批准,或者根本無法獲得批准。 |
| ○ | 我們
可能會在臨牀試驗中遇到延遲,這可能會對我們的業務和
運營產生不利影響。 |
| ○ | 我們
依賴第三方進行臨牀前研究和臨牀試驗,如果此類
第三方不能在截止日期前完成或以其他方式按要求進行研究,我們
可能會延遲進展,或者最終可能無法進展,我們的候選藥物
進入臨牀試驗。 |
| ○ | 我們
可能無法確保和維持研究機構來進行我們未來的試驗。 |
| ○ | 我們
可能無法確保聯合開發人員或合作伙伴進一步進行二期臨牀試驗
並最終將我們的候選藥物商業化。 |
| |
○ |
我們可能需要優先
開發我們最有前途的候選產品,而不是開發其他產品。 |
| ○ | 醫生、患者、第三方付款人或醫學界其他人可能不接受我們的產品,我們未來可能不會通過銷售或許可我們的產品獲得任何收入。 |
| ○ | 我們
可能無法成功獲得或維護專利或其他必要的相關權利
以開發我們正在開發的候選藥物; |
| ○ | 由於缺乏維護,作為我們獨家許可權基礎的知識產權可能會過期或終止
; |
| ○ | 我們面臨着來自已經或正在為我們的目標疾病適應症開發產品的實體的競爭,包括開發與我們類似的新療法和技術的公司;以及 |
| ○ | 我們
主要依賴我們的三種候選藥物的關鍵提取物的獨家供應商,如果供應商未能按照我們的訂單交付提取物,如果我們不能迅速找到該
供應商的替代品,則可能會產生巨大的成本和延誤。 |
| ○ | 如果
我們沒有獲得必要的政府批准,我們將無法將我們的藥品再授權或
商業化;以及 |
| ○ | 即使
如果我們獲得了候選藥物的監管批准,我們的產品也可能仍然受到監管機構的審查。 |
| ○ | 普通股的市場價格和交易量可能會波動,可能會受到我們無法控制的經濟狀況的影響;以及, |
| ○ | 我們的普通股只有一個有限的交易市場,這樣的市場可能永遠不會發展。 |
本招股説明書中描述的這些風險和其他風險可能對我們的業務、財務狀況、經營業績和現金流產生重大不利影響,這可能會導致我們普通股的交易價格下跌,並可能導致您的投資損失。
彙總風險因素
以下是
我們業務的主要風險以及與此產品相關的風險摘要。這只是一個總結。您應閲讀下文
和本招股説明書其他地方對風險的更詳細討論,以更完整地討論下列風險和其他風險。
| ○ | 我們當前和潛在的許多競爭對手擁有比我們多得多的財務、技術和人力資源,這可能會使我們處於顯著的競爭劣勢
或剝奪我們的市場獨家經營權。 |
| ○ | 我們當前和潛在的許多競爭對手在產品的營銷、商業化、發現、開發和監管審批方面擁有更多的經驗,這可能會使我們處於顯著的競爭劣勢或剝奪我們的市場獨家經營權 |
| ○ | 我們
從未產生過收入,在可預見的未來將繼續無利可圖。 |
| ○ | 我們的業務、運營、計劃和時間表可能會受到衞生流行病的影響,包括最近的新冠肺炎疫情。 |
| ○ | 我們的
臨牀試驗可能會延遲或不成功,並且我們可能無法按預期獲得監管部門對任何候選藥物的批准,或者根本無法獲得批准。 |
| ○ | 我們
可能會在臨牀試驗中遇到延遲,這可能會對我們的業務和
運營產生不利影響。 |
| ○ | 我們
依賴第三方進行臨牀前研究和臨牀試驗,如果此類
第三方不能在截止日期前完成或以其他方式按要求進行研究,我們
可能會延遲進展,或者最終可能無法進展,我們的候選藥物
進入臨牀試驗。 |
| |
○ |
我們可能無法確保
並維持研究機構來進行我們未來的試驗。 |
| |
○ |
我們可能無法確保
合作開發者或合作伙伴進一步II期後臨牀試驗,並最終將我們的候選藥物商業化。 |
| ○ | 我們
可能需要優先開發最有前途的候選產品,而不是
其他產品的開發。 |
| |
○ |
醫生、患者、第三方付款人或醫學界其他人可能不接受我們的產品,我們未來可能不會從銷售或許可我們的產品中獲得任何收入。 |
| |
○ |
我們可能無法
成功地獲得或維護專利或其他相關權利,這對於我們正在研發的候選藥物來説是必要的。 |
| |
○ |
我們獨家許可權背後的知識產權可能會因缺乏維護而到期或終止; |
| |
○ |
我們面臨競爭
來自已開發或正在開發針對我們目標疾病適應症的產品的實體,包括開發新型產品的公司
與我們類似的處理方法和技術;以及 |
| |
○ |
我們主要依賴於我們的三種候選藥物的關鍵提取物的獨家供應商,如果供應商未能按照我們的訂單交付提取物,如果我們無法
迅速找到該供應商的替代品,則可能會產生巨大的成本和延誤。 |
| |
○ |
如果我們沒有獲得必要的政府批准,我們將無法對我們的藥品進行再許可或商業化;以及 |
| |
○ |
即使我們
獲得了候選藥物的監管批准,我們的產品也可能仍然受到監管審查。 |
| |
○ |
普通股的市場價格和交易量可能會波動,並可能受到我們無法控制的經濟狀況的影響;以及, |
| |
○ |
我們的普通股只有一個有限的交易市場,這樣的市場可能永遠不會發展。 |
本招股説明書中描述的這些風險和其他風險可能對我們的業務、財務狀況、經營業績和現金流產生重大不利影響,這可能會導致我們普通股的交易價格下跌,並可能導致您的投資損失。此外,您應仔細考慮從第8頁開始的“風險因素”中描述的風險
。
企業信息
ABVC於2002年2月6日根據內華達州的法律註冊成立。BriVision於2015年7月21日在特拉華州註冊成立。BioLite於2016年7月27日在內華達州註冊成立。BioKey於2000年11月20日在加利福尼亞州註冊成立。BriVision、BioLite和BioKey是本公司全資擁有的三家運營子公司。
本公司股東於2020年股東周年大會(“股東周年大會”)上批准修訂公司章程,將公司名稱由American BriVision(Holding)
Corporation更改為ABVC BioPharma,Inc.,並批准並通過修訂證書以使其生效。公司公司章程的名稱更改修正案已向內華達州州務卿提交,並於2021年3月8日生效,FINRA批准了我們於2021年5月3日更改名稱的申請
。
該普通股獲準在
納斯達克資本市場上市,並於2021年8月3日開始交易,股票代碼為ABVC。該公司的CUSIP
編號為0091F106。
我們的主要執行辦公室位於加利福尼亞州弗裏蒙特老温泉大道44370號,郵編:94538。我們主要執行辦公室的電話號碼是(510)-668-0881。我們BriVision的公司網站是http://www.abvcpharma.com.我們公司網站上的信息不是本招股説明書的一部分,也不會通過引用將其納入本招股説明書。
供品
| 出售股東發行的普通股
|
最多
11,714,683股普通股,包括:(I)最多3,527,778股普通股,
本金為3,704,167美元的Lind票據全部轉換後可發行的普通股,(Ii)
最多5,291,667股作為Lind認股權證的基礎普通股,(Iii)最多211,667股作為PA認股權證基礎的普通股
,(Iv)最多342,857股普通股,可在第二期票據完全轉換時發行,本金為1,200,000美元,(V)最多
1,000,000股普通股發送Lind認股權證;(Vi)30,000股普通股,作為配售代理普通股認購權證的標的
根據發送林德交易;(vii)285,714股普通股,可發行
在完全轉換3研發Lind票據,本金金額為1,000,000美元;
(Viii)1,000,000股普通股,根據第三次Lind交易
作為普通股認購權證的基礎;及(Ix)25,000股普通股,根據第三次Lind交易
代理普通股認購權證。
出售普通股的股東可以按現行市價或私下商定的價格出售所持普通股。我們不會
從出售股東的銷售中獲得任何收益。 |
| |
|
| 使用收益的
|
我們
不會收到任何出售股東出售股份的收益。 |
| |
|
| 交易
符號 |
ABVc |
| |
|
| 風險因素
|
本招股説明書提供的證券是投機性的,涉及高風險,購買證券的投資者應
不要購買證券,除非他們能夠承擔全部投資的損失。你應該閲讀"風險因素",
從第8頁開始,討論在決定投資我們的證券之前需要考慮的因素。 |
| |
|
| 轉接
代理 |
VStock
轉讓,有限責任公司 |
風險因素
投資我們的證券包括高風險
。在決定投資我們的證券之前,您應該仔細考慮下面討論的具體因素,以及本招股説明書中包含的所有其他信息。如果實際發生以下任何風險,我們的業務、財務狀況、經營結果和未來前景都可能受到實質性的不利影響。這可能會導致我們普通股的市場價格下跌,並可能導致您的全部或部分投資損失。
與公司業務相關的風險
不利的全球經濟狀況,包括健康和安全方面的擔憂,可能會對我們的業務、財務狀況或運營結果產生不利影響。
我們的運營結果可能會受到全球經濟一般狀況的不利
影響,包括我們無法控制的狀況,例如健康影響
以及當前爆發的新冠肺炎冠狀病毒(“新冠肺炎”)帶來的安全擔憂。新冠肺炎於2020年3月被世界衞生組織宣佈為大流行。此次疫情的蔓延已導致不同國家和城市強制實施宵禁,包括“就地避難”和關閉大多數非必要企業,以及其他緩解病毒傳播的措施。
新冠肺炎對我們業務的負面影響正在持續
,其程度仍不確定,可能會廣泛傳播,包括:
| ● | 我們在這些不確定時期成功執行長期增長戰略的能力; |
| |
● |
我們有能力招募必要數量的患者來完成未來的臨牀試驗; |
| |
|
|
| |
● |
ABV-1504、ABV-1505和ABV-1601項目的供應鏈中斷
,原因是勞動力減少、原材料短缺以及對受感染地區生產的貨物進行審查或禁運。 |
| |
● |
我們有能力與我們在美國、大陸中國和日本的潛在合作伙伴/合作伙伴一起對ABV-1505(MDD第二階段完成的新藥候選)和ABV-1701(Vitargus FIH完成的醫療設備)項目進行
現場盡職調查; |
| |
● |
我們獲得資本的能力
來源,以及我們的主要客户、供應商和供應商在履行其自身義務方面的能力;以及 |
| |
● |
將管理層和員工的注意力和資源轉移到新冠肺炎應對工作之外的關鍵業務活動和風險管理上,包括
維護內部控制。 |
新冠肺炎大流行的波動性仍然很高
並且每天都在繼續演變,因此,儘管我們努力抗擊該病毒並取得了進展,
不能保證這些措施將被證明是成功的。新冠肺炎將在多大程度上繼續影響公司的業務、銷售和運營業績,這將取決於未來的發展,而未來的發展具有很高的不確定性,無法預測。
本公司是一家處於發展階段的生物製藥公司,因此面臨與該行業新業務相關的風險。
公司獲得了來自BioLite的六種用於治療目的化合物的開發和商業化的獨家許可權,以及與BioFirst共同開發一種醫療設備(統稱為“ABVC管道產品”)的權利。因此,該公司是一家臨牀階段的生物製藥公司,其業務產生的收入並不多。公司正在建立和實施許多經營業務所必需的重要職能,包括ABVC管道產品的臨牀研究和開發,進一步建立公司的管理和行政結構、會計制度和內部財務控制
BioLite和BioKey預計將繼續
收入有限,在無限期內保持不盈利。
因此,您應該根據一家經營歷史和收入有限的製藥公司所面臨的風險和不確定性來考慮公司的前景。具體而言,潛在投資者應考慮到公司將無法:
| ● | 在資本市場或其他方面籌集足夠的資金,以實現其業務計劃; |
| ● | 在與商業合作伙伴(如許可方和供應商)的合同中輸入
。 |
如果發生上述任何風險,公司的業務可能會失敗,在這種情況下,您可能會損失您在公司的全部投資。本公司不能保證其在業務運營方面的任何努力都將取得成功,或導致新產品的及時開發,或最終產生任何
實質性收入和利潤。
作為一家盈利前的生物製藥公司,
公司需要從一個以研發為重點的公司轉型為一個有能力支持商業活動的公司。
公司可能無法達到這樣的過渡點或進行這樣的轉型,這將影響我們的業務、財務狀況、運營結果和前景。
如果該公司無法籌集額外的資本,其實施其業務模式和戰略的能力可能會受到影響。
該公司的資本資源和業務有限。BioKey提供的CDMO服務產生的收入有限,只能部分支持公司的運營
。到目前為止,該公司的部分運營資金來自其
股東的融資或貸款收益。我們可能會不時尋求額外融資,以提供擴大研發計劃和/或營運資金所需的資金,並在營運現金流不足時償還未償還貸款
。我們無法確切地預測任何此類資本金要求的時間或金額。
如果公司沒有籌集到足夠的資本來支持其持續的開發活動,很可能無法執行其業務計劃,包括研發開發
和擴大生產設施。目前,由於缺乏資金,該公司不得不擱置了幾個項目。即使公司為近期運營和產品開發獲得融資,也可能需要超出近期的額外資金。此外,可能無法以足夠的金額或合理的條款獲得額外資本(如果有的話),並且我們籌集額外資本的能力可能會受到潛在的全球經濟狀況惡化以及最近美國和全球信貸和金融市場因持續的新冠肺炎疫情而中斷和波動的不利影響。
如果公司無法在需要時籌集資金,其業務、財務狀況和運營結果將受到重大影響
,它可能被迫減少或停止我們的業務。
該公司沒有為任何新藥候選藥物獲得監管批准或將其商業化的歷史。
由於運營歷史有限,該公司
從未獲得過任何新藥候選藥物的監管批准或商業化。FDA可能拒絕接受我們針對六種藥品中的任何一種產品的計劃新藥申請(或“NDA”)進行實質性審查,或者可能在審查我們的數據後得出結論:我們的申請不足以獲得監管部門對候選新藥或醫療器械的批准。儘管我們的CDMO戰略業務部門在獲得簡化新藥申請(或ANDA)審批方面有經驗,但獲得NDA審批和ANDA審批的流程和時間表可能會有很大差異。如果FDA不接受或不批准我們計劃的候選產品保密協議,可能需要我們進行額外的臨牀、臨牀前或製造
驗證研究,這可能成本高昂。根據FDA要求的研究,我們提交的任何保密協議或申請的批准可能會顯著推遲,可能會推遲幾年,或者可能需要我們花費比我們現有的資源更多的資源。任何延遲獲得或無法獲得任何候選藥物的監管批准都將阻止我們對此類產品進行再許可。如果進行並完成其他研究,FDA也可能認為這些研究不夠充分。如果出現上述任何結果,我們可能會被迫放棄針對該候選藥物的計劃保密協議,這將對我們的業務產生重大不利影響,並可能導致我們停止運營。我們在外國司法管轄區也面臨類似的監管風險。
我們的增長取決於我們成功開發、收購或許可新藥的能力。
我們的增長得益於在時間、資源和資本方面的持續投資,以識別和開發新產品或新配方,以滿足市場和市場滲透的需要。如果我們
既不能自己開發新產品,也不能從其他方獲得新產品的許可證,我們的收入增長能力和市場份額將受到不利影響。此外,我們可能無法收回在新藥和醫療器械開發方面的投資,因為項目可能中斷、不成功、不像最初設想的那樣有利可圖,或者我們可能無法獲得此類開發所需的資金。同樣,也不能保證我們能在經濟上可行的基礎上成功地從第三方那裏獲得此類權利。
我們目前的產品有一定的副作用。如果在營銷和銷售之前未發現與我們當前或未來產品相關的副作用,我們
可能會被要求將此類產品從市場上召回、進行宂長的額外臨牀試驗或更改我們產品的標籤,
任何這些都可能對我們的增長產生不利影響。
公司研發了以下七個藥品和一個醫療器械:ABV-1501、ABV-1504、ABV-1505、ABV-1519、ABV-1702、ABV-1601和ABV-1703。這七種產品中的每一種都可能對用户造成嚴重的不良影響。例如,ABV-1501、ABV-1702、ABV-1703的接口為Maitake蘑菇提取液。與Maitake蘑菇提取物相關的副作用或不良事件包括血液膽紅素升高、淋巴細胞計數下降、中性粒細胞計數下降、血小板計數下降、白細胞下降、頭痛和高血糖。與該化合物相關的嚴重不良事件(統稱為“SAE”)包括白細胞增多、血小板減少、眼部疾病、腹痛、胃腸道疾病、失音、肺部感染、右側肌肉無力、神志不清、腦水腫、中風、呼吸困難、喘息和瘙癢。
ABV-1504和ABV-1505的原料藥相同,稱為遠志或PDC-1421膠囊(遠志)。與ABV-1504和ABV-1505相關的副作用,或與ABV-1504和ABV-1505相關的不良事件,來自試驗藥物或檢查程序,如抽血程序(暈厥、疼痛和/或瘀傷),可能會導致胃腸道疾病(腹脹和便祕)、神經系統疾病(嗜睡、嗜睡和口腔潰瘍)。此外,長期使用可能會導致流產。
這項研究的安全性和初步療效發現,與ABV-1701的獨特特性相結合,為進一步研究其在玻璃體切除手術後用於需要玻璃體置換的患者提供了支持。然而,隨着臨牀試驗的繼續,可能會發現ABV-1701新的嚴重副作用。
這些不良事件的發生
將損害我們未來這些藥物的銷售,並大幅增加這些藥物的營銷成本和費用,而這又可能導致我們的收入和淨收入下降。此外,由於發現了嚴重的副作用,我們未來藥品的聲譽和銷售可能會受到不利影響。
我們未來可能受到產品責任索賠的影響,這可能會轉移我們的資源,導致我們承擔大量責任,並限制我們可能開發的任何產品的商業化
。
如果我們的產品的使用被指控造成了不良副作用,我們將面臨固有的商業風險,即暴露於產品責任索賠。與我們的任何產品有關的副作用
或營銷或製造問題可能會導致產品責任索賠或負面宣傳。
這些風險將存在於那些處於臨牀開發階段的產品以及那些獲得監管部門批准用於商業銷售的產品
。此外,儘管我們在歷史上沒有遇到與產品用户索賠相關的任何問題,但我們目前不維護產品責任保險,也不能保證我們能夠以商業上可行的條款獲得產品責任保險。
我們面臨產品責任的固有風險
由於對我們的產品進行臨牀測試,並可能以商業方式銷售我們可能開發的任何產品,因此我們面臨索賠的固有風險。例如,如果我們開發的任何產品據稱在臨牀測試、製造、營銷或銷售過程中造成傷害或被發現不適合,我們可能會被起訴。任何此類產品責任索賠可能包括對製造缺陷、設計缺陷、未能警告產品固有危險、疏忽、嚴格責任或違反保修的指控。索賠也可以根據州消費者保護法
提出。如果我們不能成功地針對產品責任索賠為自己辯護,我們可能會承擔鉅額責任或被要求限制我們候選產品的商業化。無論是非曲直或最終結果如何,責任索賠都可能導致:
| |
● |
對我們的候選產品或可能開發的產品的需求減少
; |
| |
|
|
| |
● |
損害我們的聲譽和重大負面媒體
注意; |
| |
● |
為由此產生的訴訟辯護的鉅額費用; |
| |
|
|
| |
● |
向試驗參與者或患者提供鉅額金錢獎勵; |
| |
|
|
| |
● |
收入損失; |
| |
|
|
| |
● |
減少了管理層用於開展業務的資源
戰略;以及 |
| |
|
|
| |
● |
我們無法將任何產品商業化
可以發展。 |
我們目前有保單承保臨牀試驗中的責任,但不維持一般責任保險;即使我們將來有一般責任保險
,該保險也可能不能完全涵蓋我們可能產生的潛在責任。任何產品責任訴訟或其他訴訟的費用,即使解決了對我們有利的問題,也可能是巨大的。如果我們開始銷售任何獲得營銷批准的候選產品,我們將需要增加我們的保險覆蓋範圍。此外,保險範圍正變得越來越昂貴。
如果我們無法以可接受的成本獲得或維持足夠的保險範圍,或無法以其他方式針對潛在的產品責任索賠提供保護,則可能會阻止或抑制我們候選產品的開發和商業生產和銷售,這可能會對我們的業務、財務狀況、運營結果和前景產生不利影響。
我們已經並可能在美國以外的地點對我們的某些候選產品進行臨牀試驗,FDA可能不接受在這些地點進行的試驗數據。
我們已經並可能在未來選擇在美國以外進行一項或多項臨牀試驗。儘管FDA可能會接受在美國境外進行的臨牀試驗的數據,但這些數據的接受取決於FDA施加的某些條件。例如,臨牀試驗
必須由合格的研究人員按照道德原則進行和實施。試驗人羣
還必須充分代表美國人口,並且數據必須適用於美國人口和美國醫療實踐
,且FDA認為有臨牀意義的方式。此外,雖然這些臨牀試驗受制於適用的當地法律,但FDA是否接受數據將取決於其確定試驗是否也符合所有適用的美國法律和法規。
不能保證FDA會接受在美國境外進行的試驗的數據。如果FDA不接受我們決定在美國境外進行的任何臨牀試驗的數據,很可能會導致需要
額外的試驗,這將是昂貴和耗時的,並推遲或永久停止我們對候選產品的開發。
此外,在美國以外進行臨牀試驗可能會對我們產生重大影響。進行國際臨牀試驗所固有的風險包括:
| |
● |
外國監管要求可能限制
或限制我們進行臨牀試驗的能力; |
| |
|
|
| |
● |
在多個外國監管模式下進行臨牀試驗的行政負擔
; |
| |
|
|
| |
● |
外匯波動;以及 |
| |
|
|
| |
● |
在某些情況下,知識產權保護有所減弱
國家 |
如果我們候選產品的臨牀試驗
未能證明令FDA和類似的非美國監管機構滿意的安全性和有效性,我們可能會產生額外成本
或延遲完成,或最終無法完成我們候選產品的開發和商業化。
未經FDA批准,我們不得在美國商業化、營銷、促銷或銷售任何候選產品。類似的非美國監管機構也實施了類似的限制。我們可能永遠不會得到這樣的批准。我們必須完成廣泛的臨牀前開發和臨牀試驗,以證明我們的候選產品在人體上的安全性和有效性,然後我們才能獲得這些批准。
臨牀測試費用昂貴,難以設計和實施,可能需要數年時間才能完成,而且結果本身也不確定。任何無法成功完成臨牀前
和臨牀開發的情況都可能導致我們的額外成本,並削弱我們從產品銷售、監管
和商業化里程碑和版税中獲得收入的能力。此外,如果(1)我們被要求在我們預期的試驗和測試之外對我們的候選產品進行額外的臨牀試驗或其他測試,(2)我們無法成功完成對我們的候選產品的臨牀試驗或其他測試,(3)這些試驗或測試的結果是不利的、不確定的或僅是適度有利的,
或(4)與我們的候選產品相關的不可接受的安全問題,我們除了招致額外的成本外,還可能:
| |
● |
獲得適應症批准
或患者人羣不像我們預期或期望的那樣廣泛; |
| |
● |
獲得標籤批准
包括重大的使用或分銷限制或重大的安全警告,包括盒裝警告; |
即使我們的任何候選產品獲得了
上市批准,它也可能無法達到醫生、患者、第三方付款人和
醫療界其他人的市場接受程度,而候選產品的市場機會可能比我們估計的要小。
從第一階段到FDA審批和商業化,我們從未完成過新藥或新醫療器械的FDA申請流程。即使我們的產品獲得相應監管機構的批准用於市場營銷和銷售,它們也可能無法獲得醫生、患者、第三方付款人和醫學界其他人的足夠市場接受度。例如,即使新的、可能更有效或更方便的治療方法進入市場,醫生通常也不願將他們的患者從現有的治療方法中切換出來。此外,患者通常習慣於他們目前正在接受的治療,並且不想更換,除非他們的醫生建議更換產品,或者他們因現有治療缺乏報銷而被要求更換治療。
我們產品的潛在市場機會很難準確估計。我們對潛在市場機會的估計基於許多假設,包括行業知識和出版物、第三方研究報告和其他調查。雖然我們相信我們的內部假設是合理的,但這些假設涉及我們管理層的重大判斷,本質上是不確定的,
這些假設的合理性尚未由獨立消息來源進行評估。如果任何假設被證明是不準確的,
我們產品的實際市場可能小於我們對潛在市場機會的估計。
我們可能會尋求與第三方合作,以開發我們的候選產品並將其商業化。如果我們未能達成此類合作,
或此類合作不成功,我們可能無法利用我們候選產品的市場潛力。
我們可能會尋求第三方合作伙伴來開發我們的產品並將其商業化。我們在任何營銷、分銷、開發、許可或更廣泛的協作安排方面可能的合作伙伴包括大中型製藥公司、地區性和全國性製藥公司、非營利組織、政府機構和生物技術公司。我們從這些安排中創造收入的能力將取決於我們的合作者
成功履行這些安排中分配給他們的職能的能力。
涉及我們產品的協作將給我們帶來
以下風險:
| ● | 協作者
在確定他們將應用於這些協作的工作和資源方面可能有很大的自由裁量權
; |
| ● | 合作者
不得對我們的候選產品進行開發和商業化,或者可以根據臨牀前或臨牀試驗結果、合作者戰略重點的變化或可用的資金,選擇不繼續或續訂開發或商業化計劃。
或外部因素,如轉移資源或創造相互競爭的優先事項的收購; |
| ● | 合作者
可以推遲臨牀試驗,為臨牀試驗計劃提供資金不足,停止臨牀試驗或放棄候選產品,重複或進行新的臨牀試驗,或者
要求臨牀試驗候選產品的新配方; |
| ● | 合作者
可以獨立開發,也可以與第三方開發,直接或間接與我們的候選產品競爭的產品,如果合作者認為有競爭力的產品
更有可能被成功開發或能夠以比我們的產品更具經濟吸引力的條款進行商業化; |
| ● | 擁有一個或多個產品的營銷和分銷權限的協作者
不能投入足夠的
資源用於此類產品的營銷和分銷; |
| ● | 合作者
可能無法正確維護或捍衞我們的知識產權,或可能以某種方式使用我們的專有
信息,從而招致可能危害或使我們的知識產權或專有信息無效或使我們面臨潛在訴訟的訴訟; |
| ● | 合作者
可能會侵犯第三方的知識產權,這可能會使我們面臨訴訟
和潛在的責任; |
| ● | 合作者和我們之間可能發生糾紛,導致我們候選產品的研究、開發或商業化的延遲或終止,或導致成本高昂的訴訟或仲裁,分散管理層的注意力和資源;以及 |
| ● | 協作
可能會終止,如果終止,可能需要額外的資金來進一步開發適用的候選產品或將其商業化。 |
協作協議可能不會以最有效的方式或根本不會導致我們的候選產品的開發或商業化。如果我們的合作伙伴參與
業務合併,我們對產品開發或商業化計劃的持續追求和重視可能會被推遲、減少或終止。
ABVc通過BioLite可能無法
收到BioLite,Inc.和BioHopeKing之間的合作協議下的全部可用金額,這可能會增加其尋求額外資本為業務運營提供資金的負擔。
2015年2月和12月,BioLite的子公司BioLite,Inc.與BioHopeKing簽訂了三項合作協議,在大多數亞洲國家(不包括日本)共同開發用於TNBC的ABV-1501(或BioLite內部使用的BLI-1401-2)和用於MDD的ABV-1504(或BioLite內部使用的BLI-1005)和BLI-1006,後者後來在亞洲(日本除外)被BLI-1008取代。根據BriVision和BioLite臺灣公司簽訂的合作協議及其附錄,ABVc和BioLite正在共同開發用於TNBC的ABV-1501和用於MDD的ABV-1504
其中ABVC和BriVision負責這兩種候選新藥的臨牀試驗。根據《關於ABV-1501或BLI-1401-2的BioHopeKing合作協議》及其附錄的條款,BioLite將根據BioLite在某些里程碑中取得的成就和藥品淨銷售額的12%(12%),在不同階段收到總計1,000萬美元的現金和BioHopeKing股權或其擁有的股權證券的付款
。如果BioLite未能及時達到任何里程碑,它可能無法收到BioHopeKing支付的其餘
款項。由於BioLite可能無法根據與BioHopeKing的合作協議獲得全額付款,ABVC可能不得不尋求其他資金來源來為其運營活動提供資金。
ABVC
及其子公司可能無法成功建立和維護額外的戰略合作伙伴關係,這可能會對ABVC的產品開發和商業化能力產生不利影響,從而對其經營業績產生負面影響。
除了ABVC目前與BioHopeKing在選定的亞洲市場的合作外,其戰略的一部分是評估並在被認為合適的情況下,在未來與主要的生物技術或製藥公司建立更多的合作伙伴關係。ABVC的
產品可能很難按計劃進行有效的許可。各種監管、商業和製造因素可能會
影響ABVC尋求合作開發商的能力,或者通過授權正在籌備中的七種產品中的任何一種來增加收入,這些產品
都沒有完全獲得許可。具體而言,ABVC可能會因以下原因而遇到困難:
| |
● |
它無法有效地確定並與美國的商業合作伙伴合作開發ABV-1504用於治療抑鬱症,ABV-1505用於治療注意力缺陷多動疾病,ABV-1501用於治療三陰性乳腺癌,ABV-1519用於治療非小細胞肺癌,ABV-1703用於治療胰腺癌,ABV-1601用於治療癌症患者的抑鬱症,ABV-1702用於治療骨髓增生異常綜合徵和ABV-1701用於治療視網膜脱離或玻璃體出血; |
| |
● |
無法獲得適當的合同研究機構(“CRO”)進行數據分析、實驗室研究和FDA的溝通;以及 |
| |
● |
它
無法有效地繼續我們所有正在研究的新藥的臨牀研究並確保其積極研究結果
以吸引美國以外的更多商業合作伙伴。 |
ABVc
在為其候選治療藥物尋找合適的合作伙伴方面面臨着激烈的競爭,談判過程既耗時又複雜。為了讓ABVC成功地與其自身免疫、中樞神經系統和血液學候選藥物以及其醫療設備Vitargus合作,潛在合作伙伴必須考慮到ABVC正在尋求的條款,並將其與其他公司許可的其他可用產品進行比較,認為這些候選藥物在他們認為具有吸引力的市場上具有經濟價值。即使
如果ABVC成功地建立了新的戰略合作伙伴關係,ABVC同意的條款可能並不有利,
如果自身免疫療法的開發或批准被推遲,或者批准的產品銷售令人失望,它可能無法維持這種戰略合作伙伴關係。與ABVC的任何候選治療藥物相關的任何新的戰略合作伙伴協議的任何延遲都可能推遲此類候選藥物的開發和商業化,並降低其競爭力
即使它進入市場。
如果ABVC未能與尚未獲得完全許可的候選治療藥物建立和維護額外的戰略合作伙伴關係或協作,它將承擔與任何此類候選藥物開發相關的所有風險和成本,並且可能需要
尋求額外資金、僱用更多員工或以其他方式發展其預算之外的專業知識。這可能會對任何不完全合作的候選新藥的開發產生負面影響。
ABVC的許可方可以選擇終止與ABVC的任何許可協議。因此,ABVC對含有潛在原料藥的新候選藥物的研究和開發可能會突然終止。
如果ABVC的子公司BioLite嚴重違反其與Yukiguni Maitake Co.(“Yukiguni”)、
醫藥工業技術與發展中心(“MPITDC”)或工業技術研究所(“ITRI”)的任何許可協議,或任何此類許可協議意外終止,BioLite可能無法繼續研究和開發包含已終止許可的基礎原料藥的候選新藥。根據Yukiguni許可協議
,如果BioLite未能滿足里程碑銷售要求或未能按照協議規定的時間表向適當的衞生當局提交某些申請,Yukiguni將有權終止Yukiguni許可協議。如果Yukiguni許可協議非自願終止,BioLite將被迫停止ABV-1703、ABV-1502和ABV-1501的新藥開發,並終止與這三種新藥候選藥物有關的合作協議。終止底層接口的使用權將對ABVC的運營造成實質性的影響。根據BioLite臺灣與工研院之間的許可協議,如果BioLite臺灣
無理由或因工研院未滿足的原因而未能按照其中所列時間表完成研究提交里程碑,工研院有權終止與BioLite臺灣的許可協議,而不向BioLite臺灣退還費用。BioLite
臺灣和BioLite已經提交了PDC-1421的IND,並根據BioLite臺灣和MPITDC之間的許可協議中列出的時間表,對從PDC-1421開發的兩種候選藥物進行了第二階段臨牀試驗。
ABVc的子公司BioLite依賴一家供應商提供ABV-1703、ABV-1519、ABV-1502和ABV-1501的原料藥,如果該供應商
未能提供足夠數量的符合其質量標準的原料藥,可能會對其對這四種候選藥物的研究產生實質性的不利影響。
目前,BioLite主要依賴日本供應商Yukiguni提供Yukiguni Maitake Extract 404,即ABV-1703、ABV-1519、ABV-1502和ABV-1501中包含的原料藥,這是BioLite腫瘤學/血液學產品組合中七種候選藥物中的四種。除其他事項外,它還簽訂了Yukiguni許可協議,交付Yukiguni Maitake Extra 404。BioLite同意滿足其對Yukiguni Maitake萃取物404的需求,首先從Yukiguni購買治療產品,Yukiguni表示
它將提供足夠數量的符合cGMP標準的此類原料藥。如果Yukiguni Maitake提取物404的供應因任何原因中斷
,BioLite對這四種候選藥物的研發活動可能會推遲。這些延遲可能是廣泛和昂貴的,特別是在沒有現成替代產品的情況下。
BioLite
目前正在與位於加拿大的另一家Yukiguni Maitake Extract 404供應商進行談判。但是,不能保證
談判是否成功。如未能及時獲得足夠的優質御前草萃取物404供應,可能會對ABVC及BioLite的ABV-1703、ABV-1519、ABV-1502及ABV-1501的研發活動造成影響,對本公司的業務、財務狀況及經營業績造成重大不利影響。
ABVC
可能在其業務中使用危險化學品和生物材料。任何與不當處理、儲存或處置這些材料有關的索賠都可能既耗時又昂貴。
ABVC的研究和開發可能涉及危險材料的受控使用,包括化學品和生物材料。ABVC不能
消除意外污染或排放以及這些材料造成的任何傷害的風險。ABVC可能會因其使用或第三方使用這些材料而造成的任何傷害或污染而被起訴,其責任可能超過任何保險
承保範圍及其總資產。聯邦、州和地方法律法規管理這些危險材料和指定廢物產品的使用、製造、儲存、搬運和處置,以及向環境和人類健康排放污染物以及安全問題。儘管ABVC會盡最大努力遵守環境法律法規,儘管會帶來高昂的成本和不便,但ABVC不能保證將來不會錯誤處理任何危險材料。如果未能遵守這些要求或發生任何對危險材料的不當處理,可能會招致鉅額成本,包括民事或刑事罰款和處罰、清理費用或控制設備的資本支出,或實現和保持合規所需的運營變更。此外,ABVC無法預測新的或修訂的環境法律或法規
或現有和未來法律法規的解釋和執行方式的任何變化對其業務的影響。
生產候選藥物樣品的設施需要按照良好的製造
實踐標準進行維護和監控,如果此類維護失敗,可能會污染我們的臨牀試驗結果,並對我們的運營產生不利影響。
ABVc的子公司BioKey運營的實驗室設施是經過認證的良好生產實踐設施(“cGMP”),其一些合同臨牀試驗服務提供商使用cGMP設施進行臨牀研究。ABVC不能確定ABVC或其當前或未來的合同製造商或供應商是否能夠遵守cGMP法規和FDA的其他法規要求。
如果不遵守這些要求,可能會導致生產活動全部或部分暫停,FDA未能批准上市,以及撤回、暫停或吊銷上市審批。
有關知識產權的風險
製藥
專利和專利申請涉及高度複雜的法律和事實問題,如果確定這些問題對公司不利,可能會
對各自許可人的專利地位產生負面影響,並中斷其研究活動。
製藥公司和研究機構的專利地位可能高度不確定,涉及複雜的法律和事實問題
。涉及藥物組合物的一些專利中所允許的權利要求的解釋和廣度可能是不確定和難以確定的,並且經常受到與專利組合物和相關專利權利要求有關的事實和情況的重大影響。美國專利商標局或USPTO的標準有時是不確定的,未來可能會發生變化
。因此,不能確切地預測專利的發放和範圍。專利一旦頒發,可能會受到質疑、宣佈無效或被規避。美國專利和專利申請也可能受到幹擾程序的影響,美國專利可能
受到USPTO的重新審查程序、授權後審查和/或各方之間的審查。外國專利可能在相應的外國專利局受到反對或類似的訴訟,這可能導致專利損失或專利申請被駁回,或者專利或專利申請的一項或多項權利要求的範圍喪失或縮小。
此外,這種幹擾、重新審查、授權後審查、各方之間的審查和反對程序可能代價高昂。因此,
任何已發佈專利下的權利可能無法為公司提供足夠的保護,使其免受競爭產品或工藝的影響。
此外,美國和外國專利法的更改或不同解釋可能允許其他人使用公司的發現或將其候選新藥開發和商業化而不提供任何補償,或者可能限制公司可以獲得的專利或權利要求的數量。某些國家/地區的法律保護知識產權的程度不如美國法律,這些國家/地區可能缺乏足夠的規則和程序來保護
公司的知識產權。
如果公司不能獲得並保持其各自產品的專利保護和商業祕密保護,公司可能會
失去其競爭優勢,面臨的競爭將增加,從而減少任何潛在收入,並對其實現或保持盈利的能力造成不利影響。
專利法的發展
可能會對本公司許可人的專利地位和本公司的業務產生負面影響。
美國最高法院、其他聯邦法院、美國國會或美國專利商標局可能會不時更改可專利性標準
,任何此類更改都可能對公司業務產生負面影響。
此外,2011年簽署成為法律的《萊希-史密斯美國發明法》或《美國發明法》對美國專利法進行了多項重大修改。這些變化包括從“先發明”制度過渡到“先申請”制度,改變對已發佈專利的質疑方式,以及改變審查過程中對專利申請的爭議方式。
這些變化可能有利於規模更大、更成熟的公司,這些公司有更多的資源用於專利申請的提交和起訴。美國專利商標局制定了管理《美國發明法》全面實施的法規和程序,與《美國發明法》相關的專利法的許多實質性修改,尤其是首次提交申請的條款,已於2013年3月16日生效。與美國發明法相關的專利法的實質性變化可能會影響公司、BioLite和BioKey獲得專利以及在獲得專利後強制執行或保護這些專利的能力。因此,尚不清楚《美國發明法》最終將對起訴公司專利申請的成本、公司根據其發現獲得專利的能力以及強制執行或保護其專利的能力產生什麼影響(如果有的話)。
如果公司無法保護其商業祕密的機密性,其業務和競爭地位將分別受到損害。
除了專利保護外,由於該公司經營的是發現和開發療法的高科技領域,因此它在一定程度上依賴商業祕密保護,以保護其專有技術和工藝。然而,商業祕密很難保護。本公司已與其員工、顧問、外部科學和商業合作者、贊助研究人員和其他顧問簽訂保密和保密協議。這些協議通常要求其他
方保密,不得向第三方披露在與其建立關係期間由該方開發或由本公司知曉的任何機密信息
。這些協議還一般規定,當事人在向本公司提供服務的過程中構思的發明將是ABVC的專有財產。但是,這些協議
可能不會得到遵守,也可能不會有效地將知識產權轉讓給公司。
除合同措施外,公司還嘗試使用物理和技術安全措施來保護其專有信息的機密性。例如,在員工或擁有授權訪問權限的第三方盜用商業祕密的情況下,此類措施可能不會為公司提供足夠的保護。公司的安全措施可能無法阻止
員工或顧問盜用其商業祕密並將其提供給競爭對手,並且公司對此類不當行為採取的追索權可能無法提供充分的補救措施來充分保護公司的利益。強制執行一方非法披露或挪用商業祕密的索賠可能是困難、昂貴和耗時的,結果是不可預測的。此外,美國以外的法院可能不太願意保護商業祕密。商業祕密可能由其他人以阻止公司進行法律追索的方式獨立開發
。如果公司的機密或專有信息(如商業祕密)被泄露或挪用,或者任何此類信息由競爭對手獨立開發,其競爭地位可能會受到損害。
第三方可以聲稱公司的員工或顧問錯誤地使用或泄露機密信息或挪用商業祕密。
公司可能會僱傭以前受僱於大學或其他生物製藥公司的人員,包括其競爭對手
或潛在競爭對手。儘管公司通過與其高級管理人員和員工簽訂的某些保密契約和僱傭協議,
確保其員工和顧問不會在公司的工作中使用他人的專有信息或專有技術
,但公司可能會受到索賠,稱其或其員工、顧問或獨立承包商無意中
或以其他方式使用或披露了前僱主或其他第三方的知識產權,包括商業祕密或其他專有信息。可能有必要提起訴訟來抗辯這些指控。如果公司未能為任何此類索賠辯護,
除了支付金錢損害賠償外,公司還可能失去寶貴的知識產權或人員。即使公司
成功抗辯此類索賠,訴訟也可能導致鉅額成本,並分散公司
管理層和其他員工的注意力。
如果ABVC沒有充分保護其專有權利或受到他人知識產權的限制,其競爭能力可能會下降
。
ABVC的商業成功取決於獲得和維護其候選藥物的專有權,以及成功地捍衞這些
權利免受第三方挑戰。ABVC獲得了使用和研究某些專有信息以進一步開發候選藥物的權利
主要來自三個機構,MPITDC、ITRI和Yukiguni(統稱為“許可方”)。這三家機構擁有已授權給我們的產品的知識產權,並可能起訴在各自許可協議下的許可使用範圍內發明或發現的
候選藥物的新專利。ABVC只有在其有效和可強制執行的專利或有效保護的商業祕密和專有技術涵蓋這些專利的範圍內,才能保護其候選新藥免受第三方的未經授權的使用。
ABVC為其候選新藥獲得新專利保護的能力不確定,原因有很多,包括:
| |
● |
ABVC
可能不是第一個使待審專利申請或已頒發專利涵蓋的發明; |
| |
● |
ABVC
可能不是第一個為其候選新藥提交專利申請的公司; |
| |
● |
其他
可以獨立開發相同、相似或替代的產品或組合物及其用途; |
| |
● |
ABVC在專利申請中的披露可能不足以滿足可專利性的法定要求; |
| |
● |
ABVC的任何或所有未決專利申請可能不會產生已頒發的專利; |
| |
● |
ABVC
可能不會在可能最終提供重大商機的國家尋求或獲得專利保護; |
| |
● |
向ABVC頒發的任何專利可能不會為商業上可行的產品提供基礎,可能不會提供任何競爭優勢,或者可能會受到第三方的成功挑戰; |
| |
● |
ABVC的許可人可能會成功地質疑ABVC的新專利申請超出了產品的許可使用範圍;或者 |
| |
● |
其他人
可能會圍繞ABVC的專利聲明進行設計,以生產超出其專利範圍的有競爭力的產品。 |
即使ABVC擁有或獲得了涵蓋其候選新藥的新專利,ABVC仍可能被禁止製造、使用和銷售這些專利,因為
侵犯了其他人的專利權。其他公司可能已經提交,將來也可能提交專利申請,涵蓋與ABVC相似或相同的產品。有許多已頒發的美國和外國專利與治療產品有關,其中一些與ABVC的
候選新藥有關。這些可能會對ABVC開發其候選藥物的能力產生實質性影響。由於專利申請可能需要
數年時間才能發佈,因此可能存在ABVC目前未知的未決申請,這些申請可能會導致其
候選新藥可能會侵犯已頒發的專利。這些專利申請可能優先於ABVC提交的專利申請。
公司及其各自的許可方可能無法在全球範圍內強制執行其知識產權。
某些國家的法律對知識產權的保護程度不如美國法律。許多公司
在某些外國司法管轄區的知識產權保護和保護方面遇到了嚴重問題。一些國家的法律制度,特別是發展中國家的法律制度,不贊成實施專利和其他知識產權保護,特別是與藥品和醫療器械有關的保護。這可能會使本公司及其各自的許可人難以阻止對許可人的某些專利的侵犯或對其其他知識產權的盜用。
例如,許多外國國家都有強制許可法,根據這些法律,專利所有者必須向第三方授予許可。
此外,許多國家還限制專利對包括政府機構或政府承包商在內的第三方的可執行性。
在這些國家,專利可能提供有限的好處,甚至沒有好處。專利保護最終必須在每個國家的基礎上尋求,這是一個昂貴且耗時的過程,結果不確定。因此,公司及其許可人在過去和將來可能會選擇不在某些國家/地區尋求專利保護,因此公司將不會在這些國家/地區享受專利保護
。此外,該公司未來可能會選擇不在某些國家/地區尋求專利保護,因此不會在這些國家/地區享有專利保護的利益。
在外國司法管轄區強制執行本公司及其許可人的專利權的訴訟
可能會導致鉅額成本,並
將其努力和注意力從業務的其他方面轉移。因此,在這些國家/地區保護公司知識產權的努力可能不夠充分。此外,美國和其他國家/地區的法律和法院判決的變化可能會影響公司為其技術和知識產權獲得充分保護的能力。
與生物製藥業務相關的監管風險
公司受到各種政府法規的約束。
人類治療和診斷產品在美國和其他司法管轄區的製造和銷售受各種
法規和法規的管轄。這些法律要求批准製造設施、受控的產品研究和測試以及政府
審查和批准包含製造、臨牀前和臨牀數據的提交文件,以獲得上市批准,其基礎是確定產品針對所尋求的每個用途的安全性和有效性,包括在生產和儲存過程中遵守當前的PIC/S良好製造指南
,以及控制營銷活動,包括廣告和標籤。
該公司目前正在開發的產品將需要大量開發、臨牀前和臨牀測試,並在商業化之前投入大量資金。獲得所需批准的過程可能既昂貴又耗時,而且不能保證未來的產品將被成功開發並在臨牀試驗中被證明是安全有效的,或者
獲得適用的監管批准。美國以外的市場也有類似的限制。潛在投資者和股東
應該意識到我們可能遇到的風險、問題、延誤、費用和困難,因為我們的業務受到廣泛的監管
環境的控制。
公司不能確定其當前或
未來的任何候選產品是否能夠獲得監管部門的批准或成功商業化。
公司可能無法開發任何當前或未來的候選產品。在開始商業化之前,該公司的候選新藥將需要大量額外的臨牀開發、測試和監管批准。本公司候選藥物的臨牀試驗正在進行中,我們的候選新藥的生產和營銷將受到美國和其他國家/地區眾多政府機構的廣泛
和嚴格的審查和監管,在這些國家/地區,本公司打算
測試並在獲得批准的情況下銷售任何新藥候選藥物。在獲得任何候選產品商業銷售的監管批准之前,該公司必須通過臨牀前測試和臨牀試驗證明該候選產品在每個目標適應症中使用是安全有效的
。這一過程可能需要多年時間,可能包括上市後研究和監督,這將需要投入大量資源。在美國大量正在開發的藥物中,只有一小部分成功地完成了FDA的監管審批流程並實現了商業化。因此,即使該公司能夠獲得必要的
資金以繼續為其開發和臨牀計劃提供資金,它也不能向投資者保證任何候選產品
將被成功開發或商業化。
在獲得美國食品藥品監督管理局或美國食品藥品監督管理局的批准之前,該公司不得在美國銷售治療產品,或在獲得這些國家/地區的必要批准之前,該公司不得在任何外國銷售該產品。獲得保密協議的批准是一個複雜、漫長、昂貴和不確定的過程,FDA可能會出於多種原因推遲、限制或拒絕批准任何候選產品,
其中包括:
| |
● |
不能
證明候選產品是安全有效的,令FDA滿意; |
| |
● |
該公司的臨牀試驗結果可能不符合FDA對上市審批所要求的統計或臨牀意義水平。 |
| |
● |
BioLite或本公司聘請進行臨牀試驗的CRO可能採取不受其控制的行動,對其臨牀試驗產生重大不利影響; |
| |
● |
患者登記延遲
,可用於臨牀試驗的患者數量和類型的變化,以及臨牀試驗中患者的保留率低於預期
; |
| |
● |
FDA可能會發現來自臨牀前研究和臨牀試驗的數據不足以證明候選產品的臨牀和其他益處超過了其安全風險,例如患者或一般公眾濫用藥物的風險; |
| |
● |
FDA可能不同意對該公司臨牀前研究和臨牀試驗數據的解釋; |
| |
● |
FDA可能不接受該公司臨牀試驗現場產生的數據; |
| |
● |
如果提交的保密協議由諮詢委員會審查,FDA可能難以及時安排諮詢委員會的會議,或者諮詢委員會可能建議不批准我們的申請,或者可能建議FDA要求額外的臨牀前研究或臨牀試驗、批准的標籤限制或
分發和使用限制作為批准條件; |
| |
● |
FDA可能要求制定風險評估和緩解策略或REMS,作為批准或批准後的條件;或 |
這些風險同樣適用於適用的外國監管機構,該公司可通過BioLite向這些機構尋求批准我們的任何
候選新藥。
這些因素中的任何
,其中許多都不是該公司所能控制的,都可能危及其獲得監管部門對
的批准併成功營銷任何候選新藥的能力。因此,本公司在爭取初步或額外監管批准的過程中遇到任何此類挫折,都將對其業務和前景產生重大不利影響。
如果該公司未能成功完成臨牀前和I、II期臨牀開發,它將無法根據各自的合作協議收到全額付款
,將無法找到未來的合作者或合作伙伴將候選藥物帶到III期臨牀試驗
。即使該公司成功完成了所有第一階段和第二階段臨牀試驗,這些結果也不一定能預測在向FDA提交第三階段試驗的保密協議之前可能需要的額外試驗結果。儘管美國和其他國家有大量藥物正在開發中,但只有很小一部分藥物實現了商業化,甚至更少的藥物在監管部門批准後獲得了醫生和消費者的廣泛接受。
此外,在產品開發期間,由於新的政府法規、未來的立法或行政行動或FDA政策或解釋的變化,公司可能會遇到延遲或候選藥物被拒絕的情況。如果公司獲得了所需的
監管審批,則以後可能會撤回此類審批。在獲得監管批准方面的延誤或失敗可能會導致:
| |
● |
FDA和類似的外國監管機構對數據和承諾的不同解釋;以及 |
| |
● |
這些候選藥物可能擁有或獲得的任何競爭優勢的喪失。 |
此外,
如果公司在此監管過程中的任何階段未能遵守適用的FDA和其他監管要求,
公司可能會遇到或受到:
| |
● |
FDA或類似的外國監管機構拒絕審查待處理的申請或已批准申請的補充; |
公司面臨着來自擁有比公司多得多的資源和經驗的公司的激烈競爭,這可能會導致其他人在公司之前或比公司更成功地發現、開發、獲得批准或商業化產品。
該公司與研究、開發、製造和營銷中樞神經系統、血液學/腫瘤學和自身免疫領域的現有和新的藥物產品的公司展開競爭。隨着新的
公司帶着新藥和/或技術進入市場,和/或其競爭對手改進其現有產品,該公司預計未來將面臨日益激烈的競爭。他們的一個或多個競爭對手可能會提供優於本公司的新藥,從而使本公司的藥物變得不划算。該公司目前的許多競爭對手以及許多各自的潛在競爭對手都擁有更高的知名度、更豐富的知識產權組合、更長的運營歷史、更多用於投資新藥開發的資源、更豐富的產品營銷和新產品開發經驗、更強的監管專業知識、更廣泛的製造能力
以及向客户交付產品的分銷渠道。如果該公司不能成功競爭,它可能無法產生足夠的收入來實現盈利。該公司的成功競爭能力將在很大程度上取決於其以下能力:
老牌製藥公司投入大量財務資源來發現、開發或許可可能使公司的產品和候選產品過時的新化合物。我們的競爭對手可能會在我們之前獲得專利保護,獲得FDA的批准,並將藥品商業化。其他公司正在或可能參與化合物或植物材料的發現,這些化合物或植物材料可能與該公司正在開發的候選藥物競爭。
在開發中樞神經系統、腫瘤學/血液學和眼科等領域的治療藥物方面,
公司與眾多可能比公司擁有更多資源的知名製藥公司展開競爭。
公司正在開發或商業化的任何與當前批准的產品競爭的候選新藥必須在療效、便利性、耐受性和/或安全性方面表現出令人信服的
優勢,以應對價格競爭並在商業上取得成功。
如果公司無法有效地與當前和未來的競爭對手競爭,其業務將無法增長,其財務狀況和運營將受到影響。
與在美國境外做生意有關的風險
由於ABVC的部分藥品研發是在美國以外進行的,該公司面臨着在國際上開展業務的風險,包括週期性的外國經濟衰退和政治不穩定,這可能會對
公司在臺灣開展業務的收入和成本造成不利影響。
ABVC
與主要營業地在臺灣的合作伙伴合作,Republic of China,公司在臺灣有某些關鍵員工
。國外經濟不景氣可能會影響我們未來的經營業績。此外,與公司業務在美國以外的運營有關的其他事實可能會對公司的業務、財務狀況和經營結果產生重大不利影響,包括:
| |
● |
實施政府管制或改變政府規章,包括税法、規章和條約; |
| |
● |
遵守涉及國際業務的美國和國際法律,包括《反海外腐敗法》和出口管制法律。 |
| |
● |
由於工會的勞工和勞資委員會,在實現裁員方面存在困難
; |
隨着公司繼續在全球範圍內開展業務,其成功將在一定程度上取決於其預測和有效管理這些風險的能力。上述任何一項或多項因素的影響均可能對本公司的業務、財務狀況及經營業績造成重大不利影響。
根據美國《反海外腐敗法》(“FCPA”)和中國反腐敗法,該公司可能承擔責任。
公司受《反海外腐敗法》及其他法律的約束,這些法律禁止法規規定的美國人為獲得或保留業務而向外國政府、外國政府官員和政黨支付或提出不正當的付款或要約。
公司可能與可能在中國大陸和美國銷售中國的第三方達成協議,在此過程中,公司可能會面臨腐敗。在臺灣的活動會造成員工、公司顧問或代理人未經授權付款或提出付款的風險,因為這些當事人並不總是受公司的控制。
儘管公司相信到目前為止,它在所有實質性方面都遵守了《反海外腐敗法》和中國反腐敗法的規定,但
現有的保障措施和未來的任何改進可能被證明是無效的,公司的任何員工、顧問或代理人都可能從事腐敗行為,公司可能要對此承擔責任。違反《反海外腐敗法》或中國反腐敗法可能導致公司和個人受到嚴厲的刑事或民事制裁,從而可能對公司的業務、經營業績和財務狀況產生負面影響。此外,****可能尋求讓公司作為繼承人對公司投資或收購的公司違反《反海外腐敗法》的行為負責。
國際業務使本公司面臨貨幣兑換和匯回風險,本公司無法預測未來匯率波動對其業務和經營業績的影響。
該公司在臺灣有業務運營,在美國和日本有合作活動。收到大量收入,支出以新臺幣和美元計價。因此,該公司面臨貨幣波動的風險。本公司
無法向您保證,貨幣匯率波動的影響不會對其未來的收入和淨收入產生實質性影響。
我們在國際上開展業務,與國際業務相關的商業、法律和政治風險的影響可能會嚴重損害我們的業務。
截至2023年及2022年12月31日止年度,美國以外客户的銷售額分別佔93%及66%。我們的國際銷售和運營受到
範圍廣泛的風險,這些風險可能因國家和地區而異。這些風險包括:
| |
● |
出口和進口關税、進出口條例的變化以及對資金轉移的限制; |
| |
● |
人員配置和管理國際業務方面的困難,包括與欺詐、盜竊和其他非法行為有關的風險; |
| |
● |
遵守法律法規,包括環境法、就業法和税法,這些法律法規因國家和時間的不同而有所不同,增加了遵守成本和不遵守的潛在風險。 |
| |
● |
執行我們的合同和知識產權的困難,特別是在那些沒有像美國和歐洲國家那樣尊重和保護知識產權的外國國家。 |
| |
● |
運營可能受到政治緊張局勢、貿易爭端等類似問題的影響,特別是中國與臺灣或中國與美國之間的緊張關係。 |
| |
● |
美國和對外貿易限制,包括那些可能限制技術或部件進口或從不同國家進口或徵收關税或配額的限制;以及 |
| |
● |
實施外匯管制或徵税,使從外國匯回資金不切實際或代價高昂。 |
我們
無法向您保證,與我們的國際業務相關的風險不會嚴重損害我們的業務。
如果公司直接受到最近涉及在美上市中國公司的審查、批評和負面宣傳,
我們可能不得不花費大量資源來調查和解決問題。調查的任何不利結果都可能
損害我們的業務運營、此次產品和我們的聲譽。
最近,幾乎所有業務都在中國的美國上市公司受到投資者、財經評論員和監管機構(如美國證券交易委員會)的密切關注、批評和
負面宣傳。許多審查、批評和負面宣傳都集中在財務和會計違規行為、對財務會計缺乏有效的內部控制、公司治理不足及其執行不力,以及在許多情況下對欺詐的指控。由於加強了審查、批評和負面宣傳,許多美國上市中國公司的上市股票價值大幅縮水,在某些情況下,幾乎變得一文不值或缺乏流動性。其中許多公司現在面臨股東訴訟和美國證券交易委員會執法行動,並正在對這些指控進行內部和外部調查。目前尚不清楚全行業調查將對公司產生什麼影響。如果本公司成為任何不利指控的對象,無論該等指控被證明屬實或不屬實,本公司將不得不花費大量資源調查該等指控併為本公司辯護。如果這些指控沒有被證明是毫無根據的,本公司將受到嚴重阻礙,本公司股票價格可能大幅下跌。如果這些指控被證明是沒有根據的,調查可能會嚴重分散公司管理層的注意力。
與公司財務狀況相關的風險
我們現有的債務可能會對我們獲得額外資金的能力產生不利影響,並可能增加我們在經濟或業務低迷時的脆弱性
。
我們面臨着許多與債務相關的風險,包括:1)我們必須將一部分運營現金流用於支付償債成本,因此我們可用於運營和其他目的的資金較少;2)通過融資獲得額外資金可能更加困難和昂貴
如果有的話;3)我們更容易受到經濟低迷和利率波動的影響,
承受競爭壓力的能力較差,在應對行業和總體經濟狀況的變化方面靈活性較差;以及4)如果我們在任何現有的信貸安排下違約,或者如果我們的債權人要求償還我們的部分或全部債務,我們
可能沒有足夠的資金來支付此類款項。截至2023年12月31日,我們的未償還流動負債分別約為560萬美元,主要由短期銀行貸款和應計費用組成。於2020年4月5日及20日,吾等分別與若干可轉換本票的美國及非美國持有人訂立若干交換協議,總金額為1,446,780美元;根據交換協議,吾等向持有人發行合共795,735股普通股及
認股權證以購買795,735股普通股。2020年11月9日,我們與某位非美國
持有人簽訂了一項金額為270,272美元的若干可轉換本票持有人的交換協議;根據交換協議,我們將向持有人
發行總計120,121股普通股和認股權證,以購買120,121股普通股。我們還同意向我們的部分員工發行總計545,182份普通股期權,以代替他們的遞延工資,總金額為1,090,360美元。
如果未能糾正內部會計控制中的重大缺陷,可能會導致我們的財務報表出現重大錯報。
我們的管理層在財務報告的內部控制中發現了一個重大弱點
,原因是沒有足夠和熟練的會計人員具備與公司財務報告要求相適應的美國公認會計原則應用方面的技術會計知識和經驗
,並得出結論認為,由於這種重大弱點,我們的披露
控制和程序截至2023年12月31日尚未生效。如果不採取補救措施,或如果我們發現我們的內部控制存在進一步的重大弱點
,我們未能建立和維護有效的披露控制和程序以及對財務報告的內部控制,可能會導致我們的財務報表中出現重大錯報,並無法履行我們的報告和財務義務
,每一項都可能對我們的財務狀況和我們普通股的交易價格產生重大不利影響。
如果
未能保持我們披露控制和程序的有效性,可能會導致重述我們的財務報表,損害我們的
經營業績,使我們受到監管機構的審查和制裁,導致投資者對我們報告的財務信息失去信心
,並對我們普通股的市場價格產生負面影響。
2002年的《薩班斯-奧克斯利法案》和美國證券交易委員會(美國證券交易委員會)有一些我們可能無法滿足或可能不符合的要求,例如2002年《薩班斯-奧克斯利法案》第404條所要求的內部控制審計師認證,我們目前並不需要遵守,因為我們是一家較小的報告公司。如果我們未能達到並保持我們內部控制的充分性
,因為此類標準會不時被修改、補充或修訂,我們可能無法確保
我們能夠持續地得出結論,即我們根據2002年薩班斯-奧克斯利法案第404條對財務報告進行了有效的內部控制。此外,有效的內部控制,特別是與收入確認相關的控制,對於我們編制可靠的財務報告是必要的
,對於幫助防止財務欺詐非常重要。如果我們不能提供可靠的財務報告或防止欺詐,我們的業務和經營業績可能會受到損害,投資者可能會對我們報告的財務
信息失去信心,我們股票的交易價格可能會大幅下跌。
我們的公司章程允許我們的董事會在沒有股東進一步批准的情況下創建新的優先股系列,這
可能會對我們普通股持有人的權利產生不利影響。
我們的
董事會有權確定和確定優先股的相對權利和優先股,而無需股東
批准。因此,我們的董事會可以授權發行一系列優先股,這些優先股將在清算時授予持有人對我們資產的優先權利,在向普通股持有人分配股息之前獲得股息支付的權利,以及在贖回我們的普通股之前贖回股票的權利和溢價。此外,我們的董事會還可以授權發行一系列優先股,這些優先股擁有比我們的普通股更大的投票權,或者可以轉換為我們的普通股。這可能會降低我們普通股的相對投票權,或導致我們現有股東的股權被稀釋。
我們
可以創建任何額外的優先股系列,並在未來發行此類股票,儘管我們目前沒有這樣做的打算
。
我們
可能無法以可接受的條款或任何條款獲得未來運營需求所需的融資。
我們可能會不時尋求額外融資,以提供擴大我們的生產設施、研發計劃和/或營運資金所需的資金,並在運營現金流不足的情況下償還未償還貸款
。我們無法確切地預測任何此類資本金要求的時間或金額。如果不能以令人滿意的條款獲得此類融資,我們可能無法按所需的速度擴大業務或發展新業務。如果我們能夠產生債務,我們可能會受到債務條款施加的某些限制,而償還此類債務可能會限制我們的現金流
和增長。如果我們無法產生債務,我們可能會被迫增發股權,這可能會對我們目前的
股東產生稀釋效應。
我們的內部計算機系統或我們的第三方承包商或顧問的計算機系統可能會出現故障或遭遇安全漏洞,這可能會
導致我們的產品開發計劃受到實質性破壞。
儘管實施了安全措施,但我們的內部計算機系統以及我們的第三方承包商和顧問的計算機系統容易受到計算機病毒、未經授權的訪問、自然災害、恐怖主義、戰爭、電信和電氣故障的破壞。
雖然我們認為到目前為止我們還沒有經歷過任何此類系統故障、事故或安全漏洞,但如果發生此類事件並導致我們的運營中斷,可能會導致我們的新藥候選藥物的臨牀試驗數據丟失,這
可能會導致我們的監管審批工作延遲,並顯著增加我們恢復或複製數據的成本。如果任何中斷或安全漏洞導致我們的數據或應用程序或與我們的技術或新藥候選藥物相關的其他數據或應用程序丟失或損壞,或者不適當地披露機密或專有信息,我們可能會招致
責任,我們候選產品的進一步開發可能會被推遲。
根據內華達州法律,取消針對我們董事和高級管理人員的個人責任,以及我們的董事、高級管理人員和員工所擁有的賠償權利的存在,可能會導致鉅額費用。
公司章程在內華達州法律允許的範圍內,免除了我們的董事和高級職員因違反作為董事或高級職員的受託責任而對我們和我們的股東承擔的個人責任。此外,我們的章程規定,我們有義務在內華達州法律授權的最大程度上賠償我們的每一名董事或高級職員,並在某些條件的限制下,預支任何董事或高級職員在最終處置之前為任何訴訟、訴訟或訴訟辯護而產生的費用。這些賠償義務
可能使我們面臨鉅額支出,以支付我們董事或高級管理人員的和解或損害賠償費用,
我們可能負擔不起。此外,這些條款和由此產生的成本可能會阻止我們或我們的股東因違反受託責任而對我們的任何現任或前任董事或高級管理人員提起訴訟,即使此類行為可能
否則有利於我們的股東。
與公司普通股相關的風險
我們普通股的股價波動很大,可能會受到許多因素的影響,其中一些因素是我們無法控制的。
我們的普通股目前只有一個有限的公開市場,在納斯達克資本市場上市,無法保證
我們的普通股未來會進一步發展或維持交易市場。我們普通股的交易價格可能波動很大,可能會受到各種因素的影響而大幅波動,其中一些因素是我們
無法控制的。除了本“風險因素”一節和本文其他部分討論的因素外,這些因素還包括:
| |
● |
我們尋求的候選產品以及我們獲得開發這些候選產品的權利的能力; |
| |
● |
我們決定啟動臨牀試驗,而不是啟動臨牀試驗或終止現有臨牀試驗; |
| |
● |
我們的臨牀前研究和臨牀試驗中實際的或預期的不良結果或延遲; |
| |
● |
意想不到的
與我們的任何新藥候選藥物的使用和研究活動相關的嚴重安全和環境問題; |
| |
● |
整體
股票市場表現和其他可能與我們的經營業績或競爭對手的經營業績無關的因素,包括類似公司的市場估值變化; |
| |
● |
宣佈我們或我們的競爭對手的重大收購、戰略夥伴關係、合資企業或資本承諾; |
| |
● |
我們或我們的股東未來出售我們的證券,或認為可能發生此類出售; |
| |
● |
我們對財務報告或披露控制和程序的內部控制是否有效? |
| |
● |
美國和我們開展業務的其他國家和地區的一般政治和經濟狀況; |
| |
● |
適用於我們的候選產品的法律或法規的變化,包括但不限於臨牀試驗審批要求; |
| |
● |
與專利和其他所有權以及我們為產品獲得保護的能力有關的爭議或其他事態發展; |
| |
● |
我們對第三方的依賴,包括CRO和科學和醫療顧問; |
| |
● |
未能
達到或超過我們可能向公眾提供的有關發展里程碑的任何財務指導或期望; |
此外,股市,特別是小型醫療保健、生物技術和製藥公司的股票,
經歷了極端的價格和交易量波動,這些波動往往與這些公司的經營業績無關或不成比例
。無論我們的實際經營業績如何,廣泛的市場和行業因素都可能對我們普通股的市場價格產生負面影響。實現上述任何風險或任何廣泛的其他風險,包括
這些“風險因素”中描述的風險,可能會對我們普通股的市場價格產生重大的不利影響。
內部人員
對我們有很大的控制權,他們可以推遲或阻止我們公司控制權的變更,即使我們的其他股東希望
發生這種情況。
我們的執行官、董事和主要股東總共擁有約61.4%的已發行普通股。由於持有股權,這些股東
能夠對需要股東批准的事項(包括選舉董事和批准重大公司交易)行使實質性控制權。這可能會延遲或阻止外部方收購或合併我們,即使我們的其他
股東希望這樣做發生。
我們普通股的市場價格可能會波動和我們的證券市場可能沒有足夠的流動性
以供投資者出售其證券。
我們普通股的市場價格一直很不穩定,而且很可能會繼續波動,整個股票市場也是如此。可能對我們普通股的市場價格產生重大影響的因素
不在我們的控制範圍之內,無論我們的業績如何,這些因素都可能對我們的普通股的市場價格產生重大不利影響。此外,公開股市經歷了極端的價格波動和成交量波動。這些廣泛的市場波動可能會影響我們普通股的市場價格。我們的普通股目前只有一個有限的公開市場,在納斯達克資本市場上市,無法保證
交易市場未來會進一步發展或維持。
股票市場經歷了極端的價格和成交量波動,已經並將繼續影響許多公司的股權證券的市場價格,包括最近與正在進行的新冠肺炎大流行有關的股票價格,這導致許多公司的股價下跌,儘管它們的基本業務模式或前景沒有根本改變。這些波動往往與這些公司的經營業績無關或不成比例。廣泛的市場和行業因素,包括潛在的惡化的經濟條件和與正在進行的新冠肺炎疫情有關的其他不利影響或事態發展,政治、監管和其他市場條件,可能會對我們普通股的市場價格產生負面影響,無論我們的實際經營業績如何
。我們普通股的市場價格可能會下跌,您可能會損失部分或全部投資。
我們
過去沒有分紅,未來也不會分紅,任何投資回報都可能以我們股票的價值為限。
我們
從未對我們的普通股支付過任何現金股息,在可預見的未來也不會支付任何現金股息,並且
任何投資回報可能僅限於我們普通股的價值。我們計劃保留未來的任何收益,為增長提供資金。
根據適用的內華達州法律,在下列情況下,作為內華達州公司,我們一般不能進行分配:i)我們將無法償還在正常業務過程中到期的債務,或者ii)我們的總資產將少於我們的總負債的總和加上
在分配時解散時,為滿足其優先權利高於接受分配的股東的優先權利而需要的金額。
如果證券或行業分析師不發表有關我們業務的研究報告或發表不準確或不利的研究報告,我們的股票價格和任何交易量都可能下降。
我們普通股的任何可能發展的交易市場將在一定程度上取決於證券或行業分析師
發佈的關於我們或我們業務的研究和報告。截至目前,關於我們業務的公開研究報告只有1份。如果證券或
行業分析師提供更多報道,而其中一位或多位分析師下調了我們的股票評級,或發佈了關於我們業務的不準確或不利的
研究報告,我們的股價可能會下跌。如果這些分析師中的一位或多位停止對我們公司的報道,或者
未能定期發佈有關我們的報告,對我們普通股的需求可能會減少,這可能會導致我們的股價和任何交易量
下降。
未來
出售和發行我們的普通股或購買普通股的權利,包括根據我們的股權激勵計劃或其他方式,
可能會導致我們股東的所有權百分比稀釋,並可能導致我們的股價下跌。
我們
預計未來我們將需要大量額外資本來繼續我們計劃的運營。為了籌集資本,我們可以按我們不時確定的價格和方式在一次或多次交易中出售
普通股、可轉換證券或其他股權證券。如果我們在不止一次交易中出售普通股、可轉換證券或其他股權證券,包括根據任何未來的股票激勵計劃向我們的高級管理人員、董事、員工和非員工顧問發行股權證券,以換取他們為我們提供的服務,則先前交易中的投資者可能會因隨後的出售而被嚴重稀釋。此外,任何此類出售都可能
對我們的現有股東造成實質性稀釋,新的投資者可以獲得優先於我們普通股持有者的權利、優惠和特權。此外,我們未來出售我們的普通股或我們現有股東轉售我們的普通股可能會導致我們的普通股的市場價格下跌。未來授予任何可行使或可轉換為我們普通股的期權、認股權證或其他證券,或行使或轉換該等股票,以及在市場上出售該等股票,均可能對我們普通股的市場價格產生不利影響。2021年10月29日,我們提交了2021年11月16日修訂的S-3表格註冊聲明,該聲明於2021年11月29日宣佈生效。於2022年5月11日,吾等同意發行2,000,000股普通股,每股面值0.001美元,按每股2.11美元的價格發行,以及根據日期為2022年5月11日的若干證券購買協議,可按每股2.45美元的價格行使的最多2,000,000股普通股的5年期認股權證,該協議生效於
撤銷公司經修訂的S-3表格的擱置登記聲明。我們還發行了共同配售代理認股權證
,以購買最多160,000股普通股,條款與投資者與交易相關的認股權證相同。我們
未來可能會通過S-3表格發行普通股,這將進一步稀釋您的所有權。
我們的普通股可能會受到美國證券交易委員會的“細價股”規則的約束,這可能會使股東更難出售我們的普通股。
美國證券交易委員會採用了規則15G-9,該規則將與我們相關的目的中的“細價股”定義為市場價格低於每股5美元的任何股權證券,但某些例外情況除外。對於任何涉及細價股的交易,
除非獲得豁免,否則規則要求經紀人或交易商批准某人的細價股交易賬户,經紀人或交易商
從投資者那裏收到交易的書面協議,列出要購買的細價股的身份和數量
。
要批准某人的帳户進行細價股交易,經紀商或交易商必須獲得該人的財務信息和
投資經驗目標,併合理地確定該人的細價股交易是合適的
,並且該人在財務方面具有足夠的知識和經驗,能夠評估
細價股交易的風險。
經紀商或交易商在進行任何細價股交易前,還必須提交美國證券交易委員會規定的有關細價股市場的披露時間表,其中以突出顯示的形式闡明經紀商或交易商作出適宜性確定的依據,以及經紀商或交易商在交易前收到投資者簽署的書面協議。
一般而言,經紀商可能不太願意進行受“細價股”規則約束的證券交易。這可能會使投資者更難在公司普通股符合出售資格的情況下處置該公司的普通股,並可能導致其股票市值下跌。
還必須披露
在公開發行和二級交易中投資細價股的風險,以及支付給經紀自營商和註冊代表的佣金、證券的當前報價以及投資者在細價股交易欺詐情況下可獲得的權利和補救措施。最後,必須發送月結單,披露賬户中持有的細價股的最新價格信息和細價股有限市場的信息。
我們
未能滿足納斯達克資本市場的持續上市要求可能會導致我們的普通股被摘牌.
如果
我們無法滿足納斯達克資本市場持續上市的要求,如公司治理要求或
最低收盤價要求,納斯達克資本市場可能會採取措施,將我們的普通股退市。這樣的退市可能會
對我們普通股的價格產生負面影響,並會削弱您出售或購買我們普通股的能力
您希望這樣做的時候。
於2022年08月19日,我們收到納斯達克股票市場有限公司(“納斯達克”)上市資格審核部(“員工”)的一封短函,通知我們根據“納斯達克上市規則”
5550(A)(2)(“規則5550(A)(2)”),我們普通股的收盤價連續30個工作日低於在納斯達克資本市場繼續上市所需的最低每股1.00美元。根據納斯達克上市規則,我們必須在2023年2月14日之前恢復合規。由於我們在此日期之前未重新獲得合規,因此我們請求並收到額外的180天,直到2023年8月14日,以遵守規則
5550(A)(2)。
2023年5月24日,
公司收到納斯達克股票市場有限責任公司(“納斯達克”)上市資格部(“員工”)發出的短板函,通知公司目前不符合最低股東權益要求,或不符合上市證券市值或持續經營淨收益替代方案,無法繼續在納斯達克資本市場上市
。納斯達克上市規則第5550(B)(1)條要求上市公司保持至少2,500,000美元的股東權益,截至2023年3月31日,公司的股東權益為1,734,507美元。根據納斯達克的規定,
公司有45個日曆日,即在2023年7月10日之前提交計劃,以重新獲得合規。在提交了恢復合規的計劃後,納斯達克於2023年7月10日批准該公司延期至20203年8月30日,以遵守上市規則第5550(B)(1)條。本公司於2023年7月31日以登記直接發售方式發行300,000股普通股及200,000股預融資權證,行使價為每股0.01美元。根據這筆交易,股東權益增加了175萬美元。2023年8月1日,500,000美元的票據以每股3.5美元的價格轉換,持有人獲得了142,857股普通股。由於這次轉換,
股東權益增加了50萬美元。此外,於2023年8月14日,本公司與中滙聯合科技(成都)集團有限公司
訂立合作協議,根據該協議,本公司收購中滙擁有的若干物業的20%所有權
及中滙擁有的一幅土地,以換取合共37萬股普通股。因此,股東權益增加了740萬美元。於2023年2月23日,本公司與Lind訂立證券購買協議,據此,本公司向Lind發行本金為3,704,167美元的有擔保可換股票據(“Lind發售”),購買價格為3,175,000美元(“Lind票據”),該票據可按每股1.05美元的初步換股價轉換為普通股,並可予調整。於2023年8月24日,本公司開始償還林德債券項下到期的每月分期付款;308,000美元已透過發行176,678股普通股(“每月股份”)按贖回
股份價格(定義見林德票據)每股1.698美元償還。根據Lind Note的條款,Lind將下一個月付款金額增加至100萬美元,從而於9月連同每月股份,本公司於2023年9月前共償還Lind
100萬美元。結果,股東權益額外增加了100萬美元。由於上述四項
交易,本公司預計其股東權益將增加約1,065萬美元。
2023年9月6日,納斯達克發佈了一封信,表明本公司遵守了規則5550(B)(1),但指出,如果在本公司下一次定期報告時,本公司沒有證明遵守規則,則可能被退市。
如果我們的普通股從納斯達克退市,我們普通股的交易很可能發生在為未上市證券建立的場外交易市場
,如場外交易市場或場外交易市場集團維護的粉色市場。投資者可能會
發現在場外市場出售我們的普通股或獲得準確的報價不那麼方便,
而且許多投資者可能由於難以進入場外市場而不會買賣我們的普通股。禁止他們交易未在國家交易所上市的證券的政策或其他原因。此外,作為退市的證券,我們的普通股
將受到美國證券交易委員會規則的約束,作為“細價股”,這對經紀自營商施加了額外的信息披露要求。
與細價股有關的法規,再加上由於經紀佣金等因素導致的細價股投資者的每筆交易成本通常較高,
將進一步限制投資者交易我們的普通股的能力。
如果發生退市事件,我們預計我們會採取行動恢復遵守納斯達克資本市場或其他國家交易所的上市要求,但我們不能保證我們採取的任何此類行動將允許我們的普通股
繼續在納斯達克資本市場上市,穩定我們的市場價格,提高我們普通股的流動性,防止我們的
普通股跌破納斯達克資本市場的最低買入價要求,或者防止未來不符合納斯達克資本市場或其他國家交易所的上市要求。
作為一家上市公司,我們
將繼續產生顯著增加的成本,並且由於我們的普通股在納斯達克資本市場上市,我們的管理層將被要求
投入大量時間來滿足新的合規要求。
作為上市公司運營,我們
將繼續招致顯著增加的成本,我們的管理層將被要求
投入大量時間來滿足納斯達克資本市場的新合規要求。作為一家上市公司,我們將繼續產生鉅額的法律、會計和其他費用。我們必須遵守《交易法》的強制性報告要求,其中包括,我們必須繼續向美國證券交易委員會提交有關我們業務和財務狀況的年度、季度和當前報告,我們不需要作為自願報告公司向美國證券交易委員會提交此類報告(儘管我們確實是在自願的基礎上向美國證券交易委員會提交此類報告)。我們已經並將繼續產生與這些美國證券交易委員會報告的準備和歸檔相關的費用。此外,
我們必須遵守強制性的新公司治理和納斯達克資本市場的其他合規要求。此外,《薩班斯-奧克斯利法案》以及隨後由美國證券交易委員會、多德-弗蘭克華爾街改革和消費者保護法、納斯達克資本市場或其他全國性交易所實施的規則也對上市公司提出了各種其他要求。股東激進主義,
當前的政治環境以及當前高度的政府幹預和監管改革可能會導致大量的新法規和披露義務,這可能會導致額外的合規成本和影響(以我們目前無法預見的方式)
我們運營業務的方式。我們的管理層和其他人員將需要投入大量時間來實施這些合規計劃
。此外,這些規則和法規已經並將繼續增加我們的法律和財務合規成本,並將
使一些活動更加耗時和昂貴。
此外,如果我們不再是一家較小的報告公司,並受到薩班斯-奧克斯利法案第404(B)條的約束,我們將被要求
提交一份由我們的獨立註冊會計師事務所出具的財務報告內部控制的認證報告。為了在規定的時間內遵守第404條,我們將繼續參與記錄和評估我們對財務報告的內部控制的過程
,這既成本高昂,又具有挑戰性。在這方面,我們
需要投入更多的內部資源,可能需要聘請外部顧問,並通過詳細的工作計劃來評估和記錄財務報告內部控制的充分性,繼續採取適當的步驟來改進控制流程,通過測試驗證控制是否按照文檔所述發揮作用,並實施持續的報告和改進流程,以實現財務報告的內部控制
。儘管我們做出了努力,但如果需要,我們的獨立註冊會計師事務所
可能無法在規定的時間框架內得出結論,證明我們對財務報告的內部控制是有效的,符合第404條的要求
。這可能會導致金融市場因對我們
財務報表的可靠性失去信心而產生不良反應。
有關前瞻性陳述的特別説明
本招股説明書包含涉及風險和不確定性的前瞻性陳述,包括基於我們目前的預期、
對我們、我們的行業以及我們和我們的生態系統中不可或缺的公司運營的監管環境的預期、估計和預測的陳述。前瞻性陳述主要包含在題為“招股説明書摘要”、“風險因素”、“收益的使用”、“管理層對財務狀況和經營結果的討論與分析”和“業務”的部分。這些陳述涉及已知和未知的風險、不確定因素和其他因素,可能會導致我們的實際結果、業績或成就與前瞻性陳述中明示或暗示的大不相同。在某些情況下,這些前瞻性陳述可以通過諸如“可能”、“將會”、“
”預期“”、“預期”、“目標”、“估計”、“打算”、“計劃”、“
”“相信”、“潛在”、“繼續”、“很可能”或其他類似表述來識別。
本招股説明書中包括的前瞻性陳述涉及以下方面:
| |
● |
與我們的研發活動相關的風險和不確定性,包括我們的臨牀試驗和臨牀前研究; |
| |
● |
我們的候選藥物的監管申請和批准或替代監管途徑的時間或可能性; |
| |
● |
我們對候選藥物的潛在市場規模和患者數量的期望(如果獲得批准用於商業用途),以及我們服務於此類市場的能力; |
| |
● |
估計我們的支出、未來收入、資本需求以及我們對額外融資的需求; |
| |
● |
我們
開發、獲取和推進我們的候選產品併成功完成臨牀試驗和臨牀前研究的能力
並獲得監管部門的批准; |
| |
● |
為我們的業務和候選藥物實施我們的商業模式和戰略計劃; |
| |
● |
未來臨牀前研究和臨牀試驗的啟動、成本、時間、進度和結果,以及我們的研發計劃。 |
| |
● |
未來許可安排的條款,以及我們能否達成此類安排; |
| |
● |
時間安排以及許可和里程碑收入的收付(如果有的話); |
| |
● |
我們能夠為我們的候選藥物建立和維護的知識產權保護範圍,以及我們在不侵犯他人知識產權的情況下開展業務的能力。 |
| |
● |
我們
保持和建立合作關係或獲得額外資金的能力; |
| |
● |
持續的新冠肺炎大流行的影響; |
| |
|
|
| |
● |
我們的財務業績;以及 |
| |
● |
與我們的競爭對手和我們的行業相關的發展情況和預測。 |
我們
提醒您,上述突出顯示的前瞻性表述並不涵蓋本招股説明書或通過引用併入本招股説明書的文件中所作的所有前瞻性表述。
There are important factors that could cause
actual results to vary materially from those described herein as anticipated, estimated or expected, including, but not limited to: the
effects of the COVID-19 outbreak, including on the demand for our products; the duration of the COVID-19 outbreak and severity of
such outbreak in regions where we operate; the pace of recovery following the COVID-19 outbreak; our ability to implement cost
containment and business recovery strategies; the adverse effects of the COVID-19 outbreak on our business or the market price of
our common stock; competition in the industry in which we operate and the impact of such competition on pricing, revenues and margins,
volatility in the securities market due to the general economic downturn; SEC regulations which affect trading in the securities of “penny
stocks,” and other risks and uncertainties described herein and the risk factors set forth in Part I - Item 1A, “Risk Factors”,
in our Annual Report on Form 10-K for the year ended December 31, 2023, as filed with the SEC on March 14, 2024, and elsewhere in the
documents incorporated by reference into this prospectus. Moreover, we operate in a very competitive and challenging environment. New
risks and uncertainties emerge from time to time, and it is not possible for us to predict all risks and uncertainties that could have
an impact on the forward-looking statements contained in this prospectus and in the documents incorporated by reference in this prospectus.
We cannot assure you that the results, events and circumstances reflected in the forward-looking statements will be achieved or occur,
and actual results, events or circumstances could differ materially from those described in the forward-looking statements. Except as
required by law, we assume no obligation to update any forward-looking statements publicly, or to update the reasons actual results could
differ materially from those anticipated in any forward- looking statements, even if new information becomes available in the future.
Depending on the market for our stock and other conditional tests, a specific safe harbor under the Private Securities Litigation Reform
Act of 1995 may be available. Notwithstanding the above, Section 27A of the Securities Act of 1933, as amended (the “Securities
Act”) and Section 21E of the Securities Exchange Act of 1934, as amended (the “Exchange Act”) expressly state that
the safe harbor for forward-looking statements does not apply to companies that issue penny stock. Because we may from time to time be
considered to be an issuer of penny stock, the safe harbor for forward-looking statements may not apply to us at certain times.
本招股説明書和通過引用併入本招股説明書的文件中包含的
前瞻性陳述僅涉及截至陳述發表之日的事件。我們不承擔任何義務公開發布對此類
前瞻性陳述的任何修訂,以反映本招股説明書日期後的事件或情況,或反映意外事件的發生。我們可能無法實際實現我們的前瞻性聲明中披露的計劃、意圖或預期,您不應過度依賴我們的前瞻性聲明。我們的前瞻性陳述不反映我們可能進行的任何未來收購、合併、處置、合資企業、其他戰略交易或投資的潛在影響。
使用收益的
我們
不會從出售股東根據本招股説明書出售普通股股份中獲得任何收益。出售股份所得的所有
將歸出售股票的股東所有。出售股票的股東可以在公開市場或其他地方以出售時的市場價、與當時的市場價相關的價格或以協商價格出售這些股票。
出售股東將支付任何承銷折扣和佣金,以及因經紀或法律服務而產生的費用,或出售股東在處置本招股説明書所列股份時發生的任何其他費用。我們
將承擔完成本招股説明書涵蓋的股票登記所產生的所有其他成本、費用和開支,包括
所有登記和備案費用以及我們的律師和會計師的費用和開支。
發行價的確定
出售股票的股東可以在場外交易市場出售這些股票,也可以以出售時的市價、與當時的市價相關的價格或按協議價格出售這些股票。我們不會從出售股份的股東
出售股份中獲得任何收益。
管理層對財務狀況和經營結果的討論和分析
以下討論和分析應與我們的財務報表以及本招股説明書中其他部分的相關説明一起閲讀。本討論包含反映我們當前預期的前瞻性表述,涉及風險和不確定性。
有關不確定性、風險和與這些表述相關的假設的討論,請參閲“關於前瞻性表述和行業數據的警示説明”。由於許多因素的影響,實際結果和事件發生的時間可能與我們的前瞻性陳述中討論的情況大不相同,包括本招股説明書中“風險因素”和其他部分闡述的因素。
概述
自成立以來,該公司並未從其醫療設備和新藥開發中獲得可觀的收入。在截至2023年12月31日的年度內,該公司創造了152,430美元的收入,主要來自銷售合同開發與製造組織(“CDMO”)服務。
業務
概述
BioPharma Inc.於2002年2月6日根據內華達州的法律註冊成立,是一家臨牀階段的生物製藥公司,專注於開發新藥和醫療器械,所有這些新藥和醫療器械都來自植物。
從植物中提取的藥物具有緩解或預防多種疾病的悠久歷史,並且通常比從動物或化學成分中提取的藥物顯示出更少的副作用。也許最著名的例子是阿司匹林,它是從柳樹樹皮和葉子中發現的一種化合物進化而來的,後來從1899年開始由拜耳公司銷售。阿司匹林幾乎沒有嚴重的副作用,已被證明是醫學史上最成功的藥物之一。大約50年後,科學家在玫瑰長春花中發現了抗癌化合物
,禮來公司隨後生產了這種化合物用於治療白血病和霍奇金斯病。其他廣為人知的成功植物藥物包括從太平洋紅豆杉中分離出來的抗癌紫杉醇。
該公司通過仔細跟蹤亞太地區研究機構的新醫學發現或醫療器械技術來開發其銷售渠道。臨牀前、疾病動物模型和I期安全性研究由公司的科學家和公司已知的其他專家仔細檢查,以根據公司的內部資質確定其認為能夠證明有效性和安全性的藥物。一旦一種藥物被證明是進一步開發和最終商業化的良好候選藥物,BriVision
將從最初的研究人員那裏獲得藥物或醫療設備的許可,並開始向美國、澳大利亞和臺灣備受尊敬的
主要研究人員介紹藥物臨牀計劃。在幾乎所有情況下,我們都發現這些國家/地區的研究機構都渴望與該公司合作,推進第二階段臨牀試驗。
目前,與ABVC合作進行第二階段臨牀試驗的機構包括:
| |
● |
醫療器械:ABV-1701,Vitargus®
在玻璃體切除手術方面,澳大利亞和泰國的第二階段研究,主要研究員:悉尼眼科醫院的馬修·西蒙諾維奇教授/博士;東墨爾本眼科集團和東墨爾本視網膜集團的埃爾維斯·奧賈米博士;桑甘薩克,醫學博士,斯利那加林德醫院。 |
| |
● |
藥物:ABV-1505,成人注意缺陷多動障礙(ADHD),II期,NCE藥物主要研究人員:Keith McBurnett博士和Linda Pfiffner博士,加州大學舊金山分校(UCSF)醫學院 |
| |
● |
藥物:ABV-1601,癌症患者的主要抑鬱
,I/II期,NCE藥物首席研究員:Scott Irwin,醫學博士,博士-雪松西奈醫學中心(CSMC) |
| |
● |
藥物:ABV-1519,一項I/II期開放標籤研究,評估BLEX 404口服液聯合培美曲塞+卡鉑治療晚期不可手術或轉移性EGFR野生型非小細胞肺癌患者的安全性和有效性 |
成功完成第二階段試驗後,該公司將尋找合作伙伴-一家大型製藥公司-完成第三階段研究,提交新藥申請(NDA),
並在FDA和臺灣FDAS批准後將該藥物商業化。
該公司業務的另一部分由全資子公司BioKey進行,該公司從事廣泛的服務,包括原料藥表徵、配方前研究、配方開發、分析方法開發、穩定性研究、IND/NDA/ANDA/510K提交、臨牀試驗材料製造(第一階段至第三階段)和商業製造。
2023年6月21日,董華德博士辭去公司首席執行官一職。公司董事會任命Uttam Patil博士接替Doong博士擔任公司首席執行官。
於2023年8月14日,本公司與中輝聯合科技(成都)集團有限公司訂立合作協議,據此,本公司收購中輝擁有的若干物業及一幅土地(統稱“物業”)20%的所有權,以每股20美元換取合共37萬股普通股(“中輝股份”)。因此,股東權益增加了740萬美元。
該公司和眾輝計劃共同將該物業發展成為ABVC特殊興趣領域的老年生活、長期護理和醫療護理的保健中心。
如眼科、腫瘤和中樞神經系統。計劃是為中國市場和這些利益的全球發展建立一個基地。資產所有權證明正在申請過程中,正在等待中國政府的批准。
2023年第三季度,本公司發行了中輝股份。中輝股份的禁售期為本次交易完成之日起一年。
此外,雙方約定,交易完成後一年後,如已發行股份市值或物業價值增加或減少,雙方將真誠協商作出合理調整;但條件是,中輝的持股比例在任何情況下均不得超過本公司的19.99%。
2023年7月31日,本公司與根據人民Republic of China法註冊成立的X創新治療有限公司簽訂了一份具有約束力的條款説明書。
條款説明書設想,根據最終協議,X創新將獲得開發、製造、銷售和分銷治療抑鬱症的ABV-1504和治療注意力缺陷/多動障礙的ABV-1505的獨家許可。在中國市場,本公司將承擔中國的臨牀試驗和產品註冊費用,本公司將獲得基於XInnovation在中國的預計許可藥物年淨銷售額的初始
許可費和特許權使用費,範圍為5%至12%。此交易仍有待最終文件的協商,因此不能保證此交易
將會發生。
2023年11月,公司及其子公司BioLite,Inc.(“BioLite”)分別與AIBL簽訂了一份為期多年的全球許可協議,授予公司和BioLite的中樞神經系統藥物MDD(嚴重抑鬱障礙)和ADHD(注意力缺陷多動障礙)
(“許可產品”)。潛在許可將涵蓋許可產品的臨牀試驗、註冊、製造、供應和分銷權。ABVC和BioLite擁有MDD和ADHD的授權產品,經第三方評估,這些產品的價值為6.67億美元。雙方決心在授權產品的全球開發方面進行合作。雙方還在努力加強新藥開發和業務合作,包括技術、互操作性和標準開發。根據各自的協議,ABVC和BioLite各自以每股10美元的價格獲得2,300萬股AIBL股票,如果達到某些里程碑,ABVC和BioLite各自可能獲得3,500,000美元和相當於淨銷售額的5%的特許權使用費,最高可達1億美元。股票發行後,AIBL成為ABVC的子公司。
於二零二四年二月六日,本公司與蜀陵江(“蜀陵”)訂立最終協議,據此,蜀陵將其擁有的位於臺灣桃園市的若干土地(“該土地”)的擁有權轉讓予本公司(“該協議”)。舒靈
為本公司旗下董事,與本公司首席戰略官蔣明江結婚,持有本公司約15.4%的已發行及已發行普通股。
作為該土地的代價,本公司將按每股3.50美元的價格向蜀陵支付(I)703,495股本公司普通股的限制性股份(“股份”)及(Ii)可購買最多1,000,000股本公司普通股的五年期認股權證,行使價為每股2.00美元。根據該協議,蜀陵還將把該土地的未償債務(約500,000美元)轉讓給本公司。
因此,雙方對交換的估值約為2,962,232美元。
被徵用土地的使用
ABVC收購上述房地產是出於支持其產品線和降低成本的長期目的。根據FDA的指導方針,植物類藥物的原料必須在良好農業規範(GAP)下的特定區域種植,或在完全受環境控制的植物工廠中種植以保持質量。通過收購土地,ABVC計劃在其控制下種植植物藥原材料;這樣做將有助於
公司保持產品質量,降低原材料成本,進而在植物藥商業化後降低藥材和藥品的成本。
常見的
股票反向拆分
2023年7月25日,該公司提交了公司章程修正案證書,授權對其普通股的已發行和流通股進行10股1股的反向股票拆分。公司股東此前在2023年7月7日召開的公司特別股東大會上批准了反向股票拆分。實施反向股票拆分是為了減少已發行和已發行股票的數量,並增加公司普通股的每股交易額,儘管這一結果並不能得到保證。除非另有説明,否則本10-K表格中的所有
股票和相關財務信息都反映了這種10股1股的反向股票拆分。
納斯達克上市
於2022年8月,吾等收到納斯達克上市資格審核部(“職員”)發出的短函,通知吾等
根據納斯達克上市規則第5550(A)(2)條(“規則5550(A)(2)”(“規則5550(A)(2)”),本公司普通股的收市價連續30個工作日低於納斯達克資本市場繼續上市所需的最低每股1.00美元。根據納斯達克上市規則第5810(C)(3)(A)條,我們最初被要求在2023年2月14日之前恢復遵守第5550(A)(2)條。由於公司在該日期前仍未恢復合規,因此要求並收到額外180天,直至2023年8月14日,以遵守規則5550(A)(2)。
這一不足對公司普通股的上市沒有立竿見影的影響,其普通股目前繼續在納斯達克資本市場交易,交易代碼為ABVC。
如果
在2023年8月14日之前的任何時間,公司普通股的投標價格在至少連續10個工作日內以每股1.00美元或更高的價格收盤,工作人員將提供書面確認,確認公司已達到合規要求,並將結束此事
。
如果公司未能在2023年8月14日之前重新遵守規則5550(A)(2),工作人員將發出書面通知,通知公司的證券將被摘牌,但公司仍有權對此決定提出上訴。本公司打算
積極監測其普通股的收盤價,並將考慮可供選擇的方案來解決不足之處,並重新
遵守規則5550(A)(2)。
2023年8月8日,本公司收到納斯達克的通知函,通知本公司,工作人員已確定,自2023年7月25日至2023年8月7日,本公司普通股的收盤價連續10個工作日至少為每股1.00美元或更高。因此,工作人員認定本公司重新遵守上市規則第5550(A)(2)條
,並表示此事現已結案。
於2023年5月24日,吾等收到納斯達克證券市場有限責任公司(“納斯達克”)上市資格審核部(“職員”)發出的短板函件,通知
本公司目前不符合最低股東權益要求,或不符合上市證券市值或持續經營所得淨收入的替代方案,無法繼續在納斯達克資本市場上市。納斯達克上市規則
第5550(B)(1)條要求上市公司保持至少2500,000美元的股東權益,截至2023年3月31日,公司的股東權益為1,734,507美元。根據納斯達克規則,本公司有45個日曆日,即在2023年7月10日之前提交計劃,以重新獲得合規。在提交了恢復合規的計劃後,納斯達克於2023年7月10日批准該公司
延期至20203年8月30日,以遵守上市規則第5550(B)(1)條。2023年7月31日,該公司以登記直接發售的方式發行了300,000股普通股和200,000份預融資權證,行使價為每股0.01美元。根據這筆交易,股東權益增加了175萬美元。2023年8月1日,500,000美元的票據以每股3.50美元的價格轉換,持有人獲得了142,857股普通股。本次換股後,股東權益增加了50萬美元。
此外,於2023年8月14日,本公司與中滙聯合科技(成都)集團有限公司
簽訂了合作協議,據此,本公司收購了中滙擁有的若干物業的20%所有權和中滙擁有的一塊土地,以換取合計37萬股普通股。因此,股東權益增加了740萬美元。於2023年2月23日,本公司與Lind訂立證券購買協議,據此,本公司發行Lind一張本金為3,704,167美元的有擔保可轉換票據(“Lind發售”),購買價為3,175,000美元(“Lind票據”),可按初步轉換價格每股1.05美元轉換為普通股,並可予調整。於2023年8月24日,本公司開始償還Lind票據項下到期的每月分期付款;308,000美元已透過發行176,678股普通股(“每月股份”)償還,贖回股份價格(定義見Lind Note)為每股1.698美元。
根據Lind Note的條款,Lind將下一次每月付款金額增加至100萬美元,以致截至2023年9月,本公司連同每月股份,償還Lind共1,000,000美元。因此,股東權益額外增加了100萬美元。作為上述四項交易的結果,公司估計其股東權益將增加約1,065萬美元。2023年9月6日,納斯達克發佈了一封信,表示公司遵守了規則
第5550(B)(1)條,但指出,如果在公司下一次定期報告時,公司沒有證據表明遵守了規則,可能會
被摘牌。
最近的
研究結果
Vitargus®第二階段研究已經在澳大利亞和泰國啟動
,首席研究員:Ramathibodi醫院的Duangate Rojanaporn醫學博士、泰國兩個地點的斯利那加林德醫院的Thurs Sanguansak醫學博士和悉尼眼科醫院的Matthew Simunovic教授/博士;澳大利亞兩個地點東墨爾本眼科集團和東墨爾本視網膜的Elvis Ojaimi博士。第二階段研究已在第二階段展開。發送2023年的第四季度。該公司
正在通過新一批研究產品對Vitargus產品進行改進。
最初,該公司將專注於ABV-2002,這是一種在穿透性角膜移植(全厚度角膜移植)或內皮角膜移植(背層角膜移植)之前用來儲存供體角膜的解決方案。根據該公司的產品識別系統命名為ABV-2002的溶液
由一種特殊的多氨基酸組成,可保護眼睛組織免受手術前儲存過程中暴露在外部滲透壓下造成的損害。ABV-2002中的特殊聚合物可以調整滲透壓,以保持330到390 mOsm的範圍,從而允許在儲存期內角膜基質內的水合作用。基質水化可使(A)保持可接受的角膜透明度,(B)防止供體角膜腫脹。ABV-2002還含有一種在植物細胞壁中發現的豐富的酚類植物化學物質,可提供抗氧化劑、抗菌性能和神經保護。
BioFirst公司的早期測試表明,在長期儲存期間,ABV-2002可能比目前可用的其他存儲介質更有效地保護角膜和視網膜,並且可以以更低的成本製造。由於缺乏資金,進一步的臨牀開發任務被擱置。
此外,BioFirst於2006年11月7日成立,專注於創新專利藥品的研發、製造和銷售。BioFirst的技術來自BioFirst與國內研發機構簽訂的全球獨家授權協議。目前,BioFirst的主要研發產品是獲得美國國家衞生研究院許可的玻璃體替代品(Vitargus®)。Vitargus是世界上第一個可生物降解的玻璃體替代品,通過最大限度地減少醫療併發症和減少額外手術需要,它具有許多優於現有玻璃體替代品的優點。
Vitargus已開始在臺灣新竹生物醫學科技園建設GMP工廠,旨在建立一個供應全球市場的生產基地,並推動
臺灣可生物降解玻璃替代品製造中心的建設。該工廠的建成將使ABVC能夠在GMP認證的製藥廠以世界級的技術生產Vitargus。BioFirst的目標是在2025年完成建設。
2022年7月12日,該公司宣佈了該公司ADHD藥物(ABV-1505)第二階段第二部分臨牀研究的登記進展。自2022年5月10日首次接受治療的受試者報告以來,共有69(69)名受試者參加了這項研究,其中包括50名完成56天治療的受試者。
這項隨機、雙盲、安慰劑對照研究--PDC-1421治療患有注意力缺陷多動障礙(ADHD)的成人患者的第二階段耐受性和有效性研究,第二部分,預計最終將涉及大約100名患者。臺灣的五家著名研究醫院和加州大學舊金山分校(UCSF)的研究醫院將參與這項研究,該研究是加州大學舊金山分校成功完成的ABV-1505第二階段第一部分研究的繼續,並於2020年10月獲得美國食品和藥物管理局(FDA)的認可。加州大學舊金山分校醫療中心機構審查委員會已批准
參與第二部分研究,現場啟動訪問於2023年3月進行。
公開發行和融資
2024年融資
於2024年1月17日,本公司與Lind Global Fund II,LP(“Lind”)訂立證券購買協議,據此,本公司發行本金為1,000,000美元的有擔保可轉換票據,本金為1,000,000美元,購買價為833,333美元(“3研發Lind Note“),
可按轉換價格轉換為本公司普通股的股票,該價格應為(I)$3.50(固定價格)和(Ii)最低三個VWAP的平均值的90%(定義見3研發Lind Note)於轉換前20個交易日內(“浮動價格”),可予調整(“票據股份”)。儘管有上述規定,但前提是未發生違約事件(如第3款所定義研發Lind Note)應已發生,在
第3研發Lind Note應在截止日期後的前180天內以固定價格發行。Lind還將獲得為期5年的普通股認購權證(“3研發Lind認股權證“)按每股2.00美元的初始行使價購買最多1,000,000股公司普通股
,經調整(每股為一股認股權證股份,連同
3研發Lind Note、Note Shares和3研發Lind認股權證,“證券”)。雙方後來同意將可變價格的底價定為1.00美元,如果可變價格低於轉換時的底價,本公司將以現金補償Lind。
一旦發生任何違約事件(如
中定義的,研發Lind Note),公司必須向Lind支付相當於當時未償還本金的120%的金額
研發Lind Note,除3項下的任何其他補救措施外研發Lind Note或其他交易單據
(定義如下)。
三人組研發Lind認股權證可通過無現金行使方式行使
如果無法提供有關認股權證股票的登記聲明用於轉售該認股權證
,或在行使3研發與基本交易相關的Lind認股權證(如第3條所定義研發
Lind授權)。
根據證券購買協議的條款,如在發售結束後18個月之前的任何時間,本公司建議在隨後的融資中發售或出售任何額外證券,本公司應首先向Lind提供購買該等新證券最多10%的機會。
與本次發行有關,公司
及其子公司:(i)Biokey,Inc.,一家加利福尼亞公司("BioKey"),(ii)Biolite Holding,Inc.,a Nevada Corporation
("BioLite"),(iii)Biolite BVI,Inc.,英屬維爾京羣島公司("BioLite BVI")和(iv)American
BriVision Corporation,特拉華州公司(“American BriVision”,並與公司、BioKey、BioLite、
和BioLite BVI統稱為“擔保人”)共同和個別擔保公司與發行有關的所有義務。(以下簡稱“擔保”)與相關交易文件(定義見下文)中所述的某些擔保物。出售3研發林德票據和發行條款(包括擔保)在證券購買協議中規定,研發Lind Note,The 3研發林德權證、擔保第二修正案、擔保協議第二修正案、擔保人擔保協議第二修正案(統稱為“交易文件”)。
Allele Capital Partners,LLC(“Allele”)
連同其執行經紀交易商Wilmington Capital Securities,LLC(連同其聯屬公司“Wilmington”),
擔任是次發售的獨家配售代理(“配售代理”)。本公司已同意支付配售代理與是次發售有關的若干費用
,並向他們發出認股權證,購買最多25,000股普通股,條款與研發林德搜查令。
證券購買協議還包括本公司和投資者的慣例陳述和擔保、
公司的賠償義務、終止條款以及各方的其他義務和權利。
以上對交易文檔的描述通過參考交易文檔的形式的全文來限定,所述交易文檔的形式作為證據提交於此,並通過引用結合於此。
2023年融資
2023年11月17日,
公司簽訂了一份證券購買協議(“2發送林德證券購買協議”),根據該協議,本公司向林德發行本金額為1,200,000美元的有擔保可轉換票據(“2發送Lind Offering“),購買價格為1,000,000美元(”2發送Lind附註"),
可按轉換價轉換為公司普通股股份,轉換價應為(i)3.50美元(
"固定價格")和(ii)三個最低VWAP平均值的90%(定義見2發送在轉換前的20個交易日內,可作調整。儘管有上述規定,前提是沒有違約事件(如
中定義的發送Lind Note)應已發生,2項下的轉換發送在截止日期後的前180天內,Lind票據應以固定價格
為準。林德還將獲得一份為期5年的普通股購買權證("2發送
林德認股權證”)購買最多1,000,000股公司普通股,初始行使價為每股2美元,可予調整。雙方後來同意可變價格的最低價為1.00美元,如果轉換時可變價格低於最低價,公司將以現金補償林德。
一旦發生任何違約事件(如
第2發送林德票據),公司必須向林德支付相當於當時未償還本金額的120%的金額
發送Lind Note,除了根據第2條規定的任何其他補救措施外,發送Lind Note或其他交易單據
(定義如下)。
根據第2條的條款發送Lind
證券購買協議,如果是在兩個交易日結束後18個月之前的任何時間發送Lind發售,公司建議在隨後的融資中發售或出售任何額外的證券,公司應首先向Lind提供購買此類新證券最多10%的機會
。
關於2個發送林德提供,
公司及其子公司:(i)Biokey,Inc.,一家加利福尼亞公司("BioKey"),(ii)Biolite Holding,Inc.,a Nevada
Corporation("BioLite"),(iii)Biolite BVI,Inc.,英屬維爾京羣島公司(“BioLite BVI”)和(iv)
美國BriVision公司(一家特拉華州公司)(“American BriVision”,與本公司、BioKey、
BioLite和BioLite BVI統稱為“擔保人”)共同和個別擔保公司與
發送林德提供(“擔保”)某些抵押品,如相關交易文件
(定義見下文)所述。
該票據的出售及該2期票據的條款發送
Lind產品,包括擔保,在2中闡述發送Lind證券購買協議,2ndLind
請注意,2發送Lind擔保、擔保第一修正案、擔保協議第一修正案和擔保人擔保協議第一修正案(統稱為交易文件)。
Allele Capital Partners,LLC(“Allele”)
連同其執行經紀交易商Wilmington Capital Securities,LLC(連同其關聯公司,“Wilmington”),
擔任這2只股票的獨家配售代理(“配售代理”)發送林德供貨。我們已同意支付安置代理與2個項目相關的某些費用發送林德供貨。
2024年2月29日提交了一份修正案,
披露,由於納斯達克的要求,雙方對票據進行了修正,據此,轉換價
的最低價為1.00美元(以下簡稱"修正案")。此外,修訂案要求公司向
林德支付現金,如果與轉換有關,轉換價被視為最低價。
證券購買協議亦載有本公司及投資者的慣常申述及保證、本公司的賠償義務、終止條款及各方的其他義務及權利。
以上對交易文檔的描述通過參考交易文檔的形式的全文來限定,所述交易文檔的形式作為證據提交於此,並通過引用結合於此。
於2023年2月23日,本公司與Lind Global Fund II,LP(“Lind”)訂立證券購買協議(“Lind證券購買協議”),據此,本公司發行Lind一張本金為3,704,167美元的有擔保可換股票據(“Lind發售”),
買入價為3,175,000美元(“Lind票據”),可按初步換股價每股1.05美元轉換為本公司普通股
,但須予調整(“票據股份”)。本公司亦向Lind
發出普通股購買認股權證(“Lind認股權證”),以按每股1.05美元的初步行使價購買最多5,291,667股本公司普通股
(每份為“認股權證股份”,連同附註、
票據股份及認股權證,稱為“Lind證券”)。
Lind Note不附帶任何利息。自Lind票據發行日期起計六個月及其後每一(1)個月週年日起,本公司
須向Lind支付相當於308,650.58美元的款項,直至Lind票據的未償還本金已於
前或於到期日或(如較早)根據Lind票據的條款加速、轉換或贖回為止(“每月付款”)。本公司可酌情決定以(I)現金、(Ii)本公司普通股
股份或(Iii)現金加股份的形式支付每月款項;如以股份支付,股份數目應以(X)以股份支付的本金金額除以(Y)適用付款日期前20個交易日內每日最低5個VWAP的平均數的90%而釐定。Lind Notes列出了在本公司每月以普通股支付任何款項之前必須滿足的某些條件。如果公司每月以現金付款,公司還必須向Lind支付每月付款的5%的現金溢價。
一旦發生任何違約事件(定義見Lind Note),本公司必須向Lind支付相當於Lind Note當時未償還本金的120%的金額
,以及票據或其他交易文件下的任何其他補救措施。
Lind保證書可通過無現金操作
行使。
根據Lind Securities購買協議的條款,如於Lind發售結束後18個月前的任何時間,本公司建議
在隨後的融資中發售或出售任何額外證券,本公司應首先向Lind提供購買該等新證券最多10%的機會。
關於Lind的發行,本公司及其子公司:(I)Biokey,Inc.,加利福尼亞州公司(“BioKey”),(Ii)Biolite Holding,Inc.,內華達州公司(“BioLite”),(Iii)Biite BVI,Inc.,一家英屬維爾京羣島公司(“BioLite BVI”),以及(Iv)American{br>BriVision Corporation,一家特拉華州公司(“American BriVision”,與本公司、BioKey、BioLite和BioLite BVI,“擔保人”),根據相關交易文件(定義見下文
),本公司以若干抵押品共同及個別擔保本公司與Lind發售(“擔保”)有關的所有責任。
Lind Note的出售和Lind發售的條款,包括擔保,載於Lind證券購買協議、票據、認股權證、擔保協議、擔保人擔保、擔保、與Rgene Corporation的商標擔保協議、與BioFirst的商標擔保協議、專利擔保協議、版權擔保協議及股票質押協議(統稱為“交易文件”)。
Allele Capital Partners,LLC(“Allele”)
連同其執行經紀交易商Wilmington Capital Securities,LLC(連同其聯屬公司“Wilmington”),
擔任Lind發售的獨家配售代理(“配售代理”)。作為Lind發售的結果,公司將向配售代理支付(I)出售證券所得總收益的6%的現金費用,以及(Ii)普通股認股權證,以購買根據Lind Note可發行的普通股股數的6%。我們還同意支付配售代理與Lind發售相關的某些
費用。
根據Lind證券購買協議,本公司同意登記所有Lind證券及發行予配售代理的認股權證所涉及的普通股股份。
證券購買協議亦載有本公司及投資者的慣常申述及保證、本公司的賠償義務、終止條款及各方的其他義務及權利。
一旦發生任何違約事件(定義見Lind Note),本公司必須向Lind支付相當於Lind Note當時未償還本金的120%的金額
(“強制性違約金額”),以及票據或其他交易文件下的任何其他補救措施。
本公司與Lind於2023年9月12日訂立函件協議,據此,強制性違約金額減至Lind票據當時未償還本金金額的115%;根據函件協議,Lind亦同意豁免與本公司市值低於1,250萬美元的任何違約
,直至2024年2月23日,但保留轉換其票據的權利。此外,如果本公司無法增加其市值,且不能
獲得對Lind Note的進一步豁免或修訂,則本公司可能會發生Lind Note項下的違約事件,
這可能會對本公司的流動資金、財務狀況和經營業績產生重大不利影響。公司
不能對公司增加市值的可能性、確定性或確切時間作出任何保證,因為這些指標不在公司的直接控制範圍內,取決於公司
控制之外的各種因素。
以上對交易文檔的描述通過參考交易文檔的形式的全文來限定,所述交易文檔的形式作為證據提交於此,並通過引用結合於此。
2022年融資
於2022年5月11日,本公司與若干投資者(“買方”)訂立若干證券購買協議(“五月SPA”)。根據五月份的SPA,本公司同意按每股2.11美元的價格發行2,000,000股普通股和購買最多2,000,000股普通股的5年期認股權證,可按每股2.45美元的價格向購買者行使。
扣除任何估計發售費用前的總收益為4,220,000美元。5月SPA計劃的交易於2022年5月16日完成
。
本公司向配售代理支付相當於所售證券銷售總價8%的總現金費用,並向他們發行認股權證,按與5月份認股權證相同的條款購買最多160,000股普通股。
戰略
我們業務戰略的關鍵要素包括:
| ● | 將
推進到ABV-1701Vitargus®治療視網膜脱離或玻璃體出血的關鍵試驗階段,我們預計這將在未來產生收入。 |
| ● | 在成功
完成其第二階段臨牀試驗後,
將重點放在授權ABV-1504治療嚴重抑鬱障礙MDD上。 |
| ● | 完成ABV-1505治療注意力缺陷多動障礙(ADHD)的第二階段第二部分臨牀試驗。 |
| ● | 將候選藥物和候選醫療器械
授權給主要製藥公司進行第三階段和關鍵臨牀試驗(如果適用),並在FDA批准的情況下進行進一步營銷
。 |
我們計劃通過對中樞神經系統、血液/腫瘤學和眼科領域的研究新藥和醫療器械進行第一階段和第二階段臨牀試驗,來增強我們的核心研發能力和資產。
我們的管理團隊在廣泛的新藥和醫療器械開發方面
擁有豐富的經驗,我們擁有來自美國和臺灣的大型研究機構和大學的授權新藥和醫療器械候選人。通過自信的產品開發方法,我們預計我們
將建立一個強大的腫瘤學/血液學、中樞神經系統和眼科產品組合。我們主要專注於新藥候選的第一階段和第二階段研究
,並將第二階段後的產品授權給製藥公司;我們預計不會投入大量的
努力和資源來建立針對疾病的分銷渠道。
業務目標
該公司的核心業務基於合作活動,可通過研究、開發和/或商業化合資協議產生當前和未來的收入。這些協議的條款通常包括向公司支付與以下一項或多項有關的款項:
除
許可產品淨銷售額的版税收入外,每種類型的支付都會產生收入,這些收入被歸類為版税收入。到目前為止,我們尚未收到任何版税收入。收入在履行履約義務後通過將商品或服務的控制權轉讓給合資夥伴而確認。
作為這些安排的會計處理的一部分,公司應用判斷來確定履約義務是否不同,並在確定協作協議中確定的每項不同履約義務的獨立售價時進行假設。為了確定獨立的銷售價格,公司依據的假設可能包括預測收入、開發時間表、研發人員成本的報銷率、貼現率以及技術和監管成功的概率。
根據合作協議,該公司有多項交付成果,包括與授予技術許可、法規和臨牀開發以及營銷活動有關的交付成果
。評估公司可交付成果的履約期需要
管理層的判斷。管理層在評估估計績效期間時考慮的重要因素包括但不限於公司在進行臨牀開發、監管和製造活動方面的經驗。公司每年根據其合作協議審查其績效期限的估計持續時間,並在預期的基礎上進行任何適當的調整。
根據其合作協議對績效期間的估計未來的變化可能會影響未來收入確認的時間安排。
有關這些差額支付
安排的更多詳細信息,請參見下文的"關鍵會計政策摘要"。公司
最近簽訂的合作協議示例如下:
與關聯方BHK簽訂合作協議
| (i) |
2015年2月和12月,BioLite,Inc.輸入
與BioHopeKing簽署了三項合資協議,共同開發ABV—1501治療三陰性乳腺癌(TNBC),
ABV—1504用於MDD,ABV—1505用於ADHD。這些協議授予BioHopeKing在某些亞洲國家的營銷權,作為回報
一系列里程碑式的付款,總額為1000萬美元的現金和BioHopeKing的股權或BioHopeKing擁有的股權證券。 |
里程碑付款由BioLite開發成果計劃
確定,如下所示:
| 里程碑 | |
付款 | |
| 簽署BHK共同開發協議 | |
$ | 1,000,000 | |
| 研究用新藥(IND)提交 | |
$ | 1,000,000 | |
| 第二階段臨牀試驗完成 | |
$ | 1,000,000 | |
| 啟動第三階段臨牀試驗 | |
$ | 3,000,000 | |
| 新藥申請(NDA)申請 | |
$ | 4,000,000 | |
| 總計 | |
$ | 10,000,000 | |
| (Ii) |
2015年12月,BHK支付了初始現金付款100萬美元
在BHK協議簽署後。公司得出的結論是,某些可交付成果被視為單獨的會計單位
因為交付的物品對客户具有獨立價值,並將此現金付款確認為協作收入
2015年,所有研究、技術和開發數據都交付給BHK。該付款包括對過去研究的補償
BioLite Taiwan在BHK協議簽署之前做出的努力和貢獻,與未來的承諾無關
由BioLite臺灣和BHK在BHK協議中達成。 |
| (Iii) |
2016年8月,公司收到了第二筆里程碑式的付款
100萬美元,並確認了截至2016年12月31日的年度協作收入。截至2022年12月31日,公司已於2019年10月31日完成了ABV-1504 MDD的II期臨牀試驗,但尚未完成ABV-1505 ADHD的II期臨牀試驗。 |
| (Iv) |
除里程碑付款外,BioLite Inc.有權獲得相當於BHK與ABV-1501、ABV-1504和ABV-1505產品相關淨銷售額的12%的特許權使用費。截至2022年12月31日,
本公司尚未根據BHK共同開發協議賺取版税。 |
| (v) |
BHK共同開發協議將有效期為十五年
自產品在亞洲(日本除外)首次商業銷售之日起的年。 |
與BioLite,Inc.的合作協議,
關聯方
本公司於2015年12月29日與BioLite,Inc.簽訂合作協議,然後簽訂經修訂的該協議的兩份附錄(“BioLite
協議”)。BioLite的大股東為本公司的附屬公司之一,本公司董事長蔣先生為本公司的董事成員,而本公司首席戰略官兼董事的姜博士為本公司的主席。
根據BioLite協議,公司
獲得了BioLite開發和商業化六種化合物用於治療目的的獨家許可權。根據
協議的條款,公司應支付BioLite(i)里程碑付款,最高為1億美元的現金和公司股權
或其擁有的股權證券,在不同階段按照BioLite的某些里程碑成就所規定的時間表,
協議中規定的("里程碑付款")和(ii)當ABV—1501獲準在許可地區銷售時,相當於藥品淨銷售額5%的專利費付款
。
如果BioLite未能及時達到任何里程碑
,則可能無法從公司收到其餘款項。根據BioLite協議,II期臨牀
試驗完成後,里程碑付款的15%到期,應分兩個階段支付:(i)不遲於二零二一年十二月三十一日支付5%(“二零二一年十二月付款”)及(ii)不遲於二零二二年十二月三十一日支付10%。
2022年2月12日,公司董事會決定,2021年12月的付款相當於5,000,000美元,將通過註銷BioLite截至2021年12月31日欠公司的某些未償債務
5,000,000美元來支付。
2022年2月22日,雙方簽訂了BioLite協議的修正案,允許公司通過免除BioLite欠公司的等值債務來支付根據協議到期的所有款項。
這是一筆關聯方交易。
與Rgene公司的共同開發協議,
關聯方
於二零一七年五月二十六日,本公司與元基因公司控股受益人股東與本公司共同控制的關聯方Rgene Corporation(“Rgene”)訂立共同開發協議(“Rgene協議”)
(見附註12)。根據Rgene協議,BriVision和Rgene同意共同開發ABV-1507 HER2/neu陽性乳腺癌聯合療法、ABV-1703胰腺癌聯合療法和ABV-1527卵巢癌聯合療法,並將其商業化。根據Rgene協議的條款,Rgene必須在2017年8月15日之前向
公司支付3,000,000美元現金或等值的Rgene股票,作為BriVision過去研究工作的補償
BriVision在Rgene協議簽署之前所做的努力和貢獻。此付款與BriVision實現的任何未來里程碑無關
。除3,000,000美元外,公司有權獲得Rgene未來淨許可收入或淨銷售利潤的50%。所有開發成本將由BriVision和Rgene平分。
2017年6月1日,本公司根據Rgene協議向Rgene交付所有研究、技術數據和開發數據,以換取現金支付450,000美元和1,530,000股價值2,550,000美元的Rgene普通股,這些股票於2018年採用權益法長期投資入賬。於2018年12月31日,本公司根據本公司對減值嚴重程度及持續時間的評估,以及對被投資公司經營表現、市況不利變化、監管或經濟環境、Rgene經營結構變化、額外資金需求及Rgene持續經營能力的定性及定量分析,決定完全撇銷此項投資。所有發起的研究項目將由公司和Rgene平等管理和資助。
本公司與Rgene於2020年11月10日簽署了Rgene協議修正案,據此,雙方同意刪除AB-1507 HER2/neu陽性乳腺癌聯合治療和AB-1527卵巢癌聯合治療,並在將共同開發和商業化的產品中增加ABV-1519 EGFR陽性非小細胞肺癌聯合治療和
ABV-1526結直腸癌聯合治療。Rgene協議的其他條款
仍然完全有效。
與關聯方Rgene Corporation簽訂臨牀開發服務協議
2022年6月10日,該公司擴大了與Rgene的聯合開發合作伙伴關係。該公司的子公司BioKey與Rgene簽訂了一項臨牀開發服務協議(“服務協議”),以指導某些Rgene藥物產品,RGC-1501用於治療非小細胞肺癌(NSCLC),RGC-1502用於治療胰腺癌,RGC-1503用於治療直腸癌患者,通過完成美國FDA IND法規要求的第二階段臨牀
研究(“Rgene研究”)。根據服務協議的條款,BioKey
有資格在3年內獲得總計300萬美元的付款,每筆付款金額將根據協議期間獲得的某些監管里程碑來確定。
通過過去
5年來的一系列交易,本公司與Rgene共同開發了服務協議涵蓋的三種藥物產品,從而使公司擁有Rgene 31.62%的股份。
作為Rgene研究的一部分,本公司同意向Rgene提供100萬美元貸款,為此,Rgene已向本公司提供5%的營運資金可轉換貸款(“票據”)。
如果票據全部轉換,本公司將額外擁有Rgene 6.4%的股份。預計本公司將於2024年上半年前以現金或轉換Rgene股份的方式從關聯方獲得未償還貸款。本公司可隨時按(I)相當於每股1.00美元的固定換股價格或(Ii)當時最新發行的股票價格的20%折****r}(以較低者為準),將票據
轉換為Rgene的普通股;換股價格將按附註
所述作出調整。本附註包括標準違約事件以及交叉違約條款,根據該條款,違反服務
協議的行為如果在提供有關違規行為的5個工作日的書面通知後未得到糾正,將觸發本附註下的違約事件
。一旦發生違約事件,未償還的本金和任何應計和未付的利息應立即到期並支付。
服務協議將一直有效,直至最後一項專利到期,並自動續訂5年以上,除非任何一方提前
六個月書面通知終止。任何一方均可提供30天的書面通知,以此為理由終止服務協議。
Rgene已進一步同意從2022年7月1日起向公司提供在Rgene董事會的席位,直到貸款全部償還為止。本公司已提名首席戰略官兼董事姜博士擔任該職位;姜博士也是本公司的最大股東之一,持有本公司12.8%的股份。
Rgene研究是一項關聯方交易。
與BioFirst公司的合作協議,
關聯方
於二零一七年七月二十四日,本公司與根據臺灣法律註冊成立的公司BioFirst Corporation(“BioFirst”)訂立
合作協議(“BioFirst協議”),據此BioFirst授予本公司使用ABV-1701玻璃體替代玻璃體切割的全球許可權。BioFirst是本公司的關聯方,因為本公司為董事的控股受益人股東(見附註12),故為元基因公司的控股受益人股東。
根據BioFirst協議,公司
和BioFirst將共同開發和商業化BFC—1401。公司將在2018年9月30日前以現金或公司股票形式向BioFirst支付總額為3,000,000美元的款項,作為BioFirst在BioFirst協議簽署前的全部研究工作和BioFirst所作貢獻的全額付款。公司有權獲得與Vitargus ®相關的任何未來淨許可收入或淨利潤的50%。所有開發費用將由BriVision和BioFirst平均分擔。
2017年9月25日,BioFirst向公司交付了所有研究、技術、數據和開發數據。於截至2017年9月30日止年度,本公司決定全額支出3,000,000美元,因相關許可權並無其他未來用途。根據ASC 730-10-25-1,
如果沒有替代未來用途,購買用於研發活動的產品權利必須立即計入
研發費用。因此,3,000,000美元的全部金額在截至2017年9月30日的年度內作為研發費用全額支出。
於2019年6月30日,本公司與BioFirst訂立
購股協議(“購股協議”)。根據購買協議,本公司向BioFirst發行428,571股本公司普通股,以支付本公司就BioFirst協議欠BioFirst的3,000,000美元。
2019年8月5日,本公司與BioFirst訂立了第二次購股協議,據此,本公司向BioFirst發行了414,702股本公司普通股,作為從BioFirst向BriVision提供的2,902,911美元貸款的全額償還。
2020年11月4日,該公司與BioFirst簽署了對BioFirst協議的
修正案,在協議中增加了ABV-2001眼內沖洗溶液和ABV-2002角膜存儲溶液
。ABV-2002用於角膜移植手術,用於替換受損或患病的角膜,而ABV-2001在各種眼科手術中有更廣泛的用途。
最初
該公司將專注於ABV—2002,這是一種用於在
穿透性角膜移植術(全層角膜移植)或內皮性角膜移植術
(back角膜層移植)。ABV—2002是一種由特定聚氨基甲酸酯組成的溶液
保護眼組織免受外部滲透壓暴露導致損傷的酸
手術前的儲藏室ABV—2002中的特定聚合物可調節滲透壓,以維持
在330至390 mOsM的範圍內,從而允許在
儲存期。基質水化導致(a)維持可接受的角膜透明度
和(b)防止供體角膜腫脹。ABV—2002還含有豐富的酚類植物化學物質
發現於植物細胞壁,提供抗氧化抗菌特性和神經保護。
BioFirst公司的早期測試表明,在長期儲存期間,ABV-2002可能比目前可用的其他存儲介質更有效地保護角膜和視網膜,並且可以以更低的成本製造。由於缺乏資金,進一步的臨牀開發被擱置。
此外,BioFirst於2006年11月7日成立,專注於創新專利藥品的研發、製造和銷售。BioFirst的技術來自BioFirst與國內研發機構簽訂的全球獨家授權協議。目前,BioFirst的主要研發產品是獲得美國國家衞生研究院許可的玻璃體替代品(Vitargus®)。Vitargus是世界上第一個可生物降解的玻璃體替代品,通過最大限度地減少醫療併發症和減少額外手術需要,它具有許多優於現有玻璃體替代品的優點。
Vitargus已開始在臺灣新竹生物醫學科技園建設GMP工廠,旨在建立一個供應全球市場的生產基地,並推動
臺灣可生物降解玻璃替代品製造中心的建設。該工廠的建成將使ABVC能夠在GMP認證的製藥廠以世界級的技術生產Vitargus。BioFirst的目標是在2024年完成建設。
與BioLite日本公司的聯合開發協議
K.K.,關聯方
於二零二一年十月六日(“完成日期”),本公司、日本公司LucidaimCo.,Ltd.(“Lucidaim”,連同本公司,“股東”)及日本BioLite Japan K.K.(“Biolite JP”)訂立
合資協議(“該協議”)。BioLite JP是一傢俬人有限公司(日本人Kabushiki Kaisha)
於2018年12月18日註冊成立,於協議日期擁有10,000股授權普通股,其中3,049股普通股
已發行及已發行(“普通股”)。緊接該協議籤立前,Lucidim擁有1,501股普通股,而本公司擁有1,548股普通股。股東加入合資企業,正式表明他們希望作為合資企業來投資和經營比力特。合資企業的業務應為研究和開發藥品、醫療器械和數字媒體、投資、基金運營和諮詢、分銷和營銷補充劑
,由Biolite及其在日本的子公司或任何其他地區或業務(可能不時通過協議修正案
同意)。交易的完成以所有必要的政府批准和接收為條件,
這些批准已經收到。
根據該協議和相關股份轉讓協議,公司將無償向Lucidaim轉讓其54股普通股,因此,在轉讓後,
Lucidaim將擁有1,555股普通股(51%),公司將擁有1,494股普通股(49%)。此外,根據本協議,
Biolite JP應有3名董事,其中1名董事由公司任命,2名董事由Lucidiam任命。公司
應任命公司現任董事長兼首席業務官Eugene Jiang,Lucidaim應任命大西仁;
Biolite JP現任董事Toru Seo(也是BioLite日本另一股東的董事)被視為Lucidaim的第二任董事。
該協議還規定,公司
與Biite應將其之間的研究合作和許可協議轉讓給Biite或準備該協議(“許可
協議”)。上述交易發生在完成日期。
根據協議,股東應監督及管理Biite JP的業務及營運
。董事無權因其作為董事的服務而獲得任何報酬
每個股東可以撤換他/她指定的董事。
如果股東出售或處置其所有普通股,該股東
指定的董事必須提出辭呈。《協議》還規定了必須經所有股東事先批准的某些公司行為(預留事項)。
如果股東無法就任何預留事項作出決定,則任一股東
可以向另一股東提交僵局通知,5天后,必須將此事提交各股東董事長,並以誠意解決爭議。
如果在此後10天內爭議仍未解決,然後任何一個股東都可以提出
以指定的價格現金收購另一個股東的全部普通股;
如果銷售沒有得到肯定的接受,則銷售應按照銷售要約中的規定進行。
各股東均享有優先認購權,以購買額外的
股普通股,使該等股東可在Biite JP發行任何新普通股時,維持其於Biite JP的持股比例。然而,該協議規定,公司
在某些情況下將失去優先購買權。如果另一股東收到購買該股東普通股的要約,股東還享有優先購買權。
該協議還要求Biolite JP獲得金額為30,460,000日元(約272,000美元)的銀行貸款,作為其初始營運資金用途。根據《協議》,各股東同意在銀行要求擔保的情況下為此類銀行融資提供擔保。因此,本公司可能對銀行貸款承擔最高達14,925,400日元(約134,000美元)的責任,相當於最高銀行貸款的49%。
該協議進一步規定,Biite JP應按其利潤的至少1.5%發行年度股息,
如果其有足夠的現金這樣做的話。
根據該協議,本公司與BIOLITE JP同意盡其最大努力於2021年12月底前簽署許可協議。本公司同意,代表Biolite JP就許可協議條款進行的任何談判
應由Lucidaim任命的董事處理。如果
公司與該等Lucidaim董事未能就條款達成協議,Biolite JP可全權酌情決定不簽署許可協議,而不對公司承擔任何責任。
該協議包含在股東或其子公司不再為股東後的兩年內的非要約和非競爭條款,此類限制性契約僅限於眼科領域或中樞神經領域的業務。BIOLITE
JP的活動產生的任何知識產權應屬於BIOLITE JP。
本協議包含標準的賠償條款
,但任何賠償方不得對單個責任承擔任何責任,除非賠償金額超過500,000日元(約4,500美元),且直至所有責任總額超過2,000,000日元(約18,000美元),然後僅在此類責任超過該限額的範圍內。
該公司為組建合資企業支付了15萬美元;意向書簽署後,BioLite日本的另一股東也支付了15萬美元。
本協議有效期為10年,除非
提前終止。該協議還允許一名股東在另一名股東違約時終止協議,如協議所述。
這是一筆關聯方交易。
2021年11月,公司從行使公司2021年8月3日公開發行的證券中發行的認股權證中獲得4,244,452美元的毛收入。投資者
總共以每股6.30美元的價格行使了673,405份A系列權證,以每股10美元的價格行使了200份B系列權證。
BioKey收入
除了合作協議,ABVC還通過其全資擁有的BioKey子公司獲得收入,該子公司提供廣泛的合同開發和製造組織(CDMO)服務,包括原料藥表徵、配方前研究、配方開發、分析方法開發、
穩定性研究、IND/NDA/ANDA/510K提交、臨牀試驗材料製造(從第一階段到第三階段)和藥品的商業製造。
此外,BioKey還提供根據客户需求量身定做的各種監管服務,包括對與配方開發、臨牀試驗、上市產品、仿製藥、營養食品和非處方藥產品相關的提交文件進行校對和監管審查,以及培訓演示。除了支持ABVC的新藥開發外,BioKey還代表ABVC向FDA提交IND、NDA、ANDA和DMF,以符合FDA新的電子提交指南。
新冠肺炎疫情的影響
2020年1月30日,世界衞生組織宣佈冠狀病毒爆發為“國際關注的突發公共衞生事件”,並於2020年3月10日宣佈其為大流行。世界各地為幫助減緩冠狀病毒傳播而採取的行動包括限制旅行、在某些地區實施隔離措施,以及強制關閉某些類型的公共場所和企業。冠狀病毒和為緩解其而採取的行動
已經並預計將繼續對許多國家的經濟和金融市場產生不利影響,包括
公司經營的地理區域。
由於COVID—19疫情,我們
2022財年的收入受到重大影響。於二零二三年,我們的業務開始從COVID—19的影響中復甦。我們一直在努力
新合同,以創造收入和增加現有產品的銷售,並納入新產品銷售。
新冠肺炎大流行,包括變種,已經並預計將繼續對我們CDMO業務部門的要素產生不利影響。新冠肺炎大流行政府施加了限制研究人員進入全球實驗室的限制。這些限制限制了科學發現能力,我們觀察到這些實驗室的需求遠遠低於歷史水平。最近,隨着世界各地對社交距離的限制逐漸取消,實驗室已經能夠增加研究活動。雖然我們認為,由於實驗室操作仍低於正常產能,潛在需求仍未達到新冠肺炎之前的水平,但我們希望,正在進行的疫苗接種計劃與計劃在夏季進行的政策變化相結合,將進一步增加研究活動,並支持全球恢復到新冠肺炎之前的需求水平
。
新冠肺炎的全球流行繼續快速發展,我們將繼續密切關注事態發展,包括其對我們計劃和時間表的潛在影響。
此外,財務報表中作出的估計有可能在短期內受到或將受到重大不利影響,原因包括存貨損失、與商譽和其他長期資產及流動負債有關的減值損失。
關鍵會計政策摘要
陳述的基礎
隨附的綜合財務報表
是根據美國公認會計原則(“美國公認會計原則”)編制的。
所有重大的公司間交易和賬户餘額均已註銷。
此會計基礎涉及應用權責發生制會計,因此,收入和收益在賺取時確認,費用和損失在發生時確認。
公司的財務報表以美元表示。
財政年度
公司更改了從10月1日開始的會計年度ST並於9月30日結束這是至1月1日開始的期間ST
,12月31日結束ST,從2018年1月1日開始。
預算的使用
按照美國公認會計原則編制財務報表要求管理層作出估計和假設,即
會影響合併財務報表日期的資產和負債額、或有資產和負債的披露,以及報告期內的收入和支出。實際結果可能與
這些結果大不相同。
股票反向拆分
2023年7月25日,該公司提交了公司章程修正案證書,授權對其普通股的已發行和流通股進行10股1股的反向股票拆分。公司股東此前在2023年7月7日召開的公司特別股東大會上批准了反向股票拆分。實施反向股票拆分是為了減少已發行和已發行股票的數量,並增加公司普通股的每股交易額,儘管這一結果並不能得到保證。反過來,本公司相信,股票反向拆分將使本公司能夠恢復遵守納斯達克資本市場的某些持續上市標準。本10-K表格中的所有股票和相關財務信息反映了這種10股1股的反向股票拆分。
公允價值計量
FASB ASC 820“公允價值計量”
定義了按公允價值記錄的某些金融和非金融資產和負債的公允價值,建立了公允價值計量框架
,並擴大了關於公允價值計量的披露。它要求實體衡量其金融工具
以退出價格為基礎的公允價值,最大限度地使用可觀察單位,並最大限度地減少使用不可觀察投入來確定退出價格
。它建立了一個層次結構,對用於衡量公允價值的估值技術的投入進行優先排序。這一層次結構通過最大限度地使用可觀察到的投入和最大限度地減少不可觀察到的投入的使用,提高了公允價值計量和相關披露的一致性和可比性。可觀察投入是反映
市場參與者將根據從本公司獨立來源獲得的市場數據為資產或負債定價時使用的假設的投入。不可觀察到的投入是反映公司自己對市場參與者將使用的假設的假設,這些假設是根據當時可獲得的最佳信息制定的資產或負債定價。該層次結構根據輸入的可靠性將輸入劃分為三個大致級別,如下所示:
| ● | 級別
1-投入是指公司在計量日期有能力獲得的相同資產或負債在活躍市場上的報價。這些工具的估值不需要很高的判斷,因為估值是基於活躍市場的報價,而這些報價是現成的、定期可得的。 |
| ● | 第
2級-活躍市場報價以外的直接或間接可觀察到的投入
,例如類似資產或負債的報價;
非活躍市場報價;或其他可觀察到或可由資產或負債整個期間的可觀察市場數據所證實的其他投入。 |
| ● | 第3級-基於不可觀察且未經市場數據證實的投入進行估值。
此類資產和負債的公允價值通常使用定價模型、貼現現金流方法、或包含市場參與者在為資產或負債定價時使用的假設的類似技術。 |
本公司若干資產及負債的賬面價值,例如現金及現金等價物、限制性現金、應收關聯方應收賬款、存貨、預付費用及其他流動資產、應付賬款、應計負債及應付關聯方的賬面價值,因其到期日相對較短而接近公允價值。本公司的短期銀行貸款、應付可轉換票據及應計利息的賬面價值與其公允價值大致相同,因為借款條款與現行市場利率一致,而到期期限亦較短。本公司長期銀行貸款的賬面價值接近公允價值,因為利率接近本公司可以獲得的類似條款和期限的債務的市場利率。
客户集中
截至2023年12月31日,公司最大的客户是膳食補充劑和膳食補充劑行業中專門從事膳食補充劑和治療藥物開發和商業化的客户,佔公司應收賬款總額的87.24%。
截至2022年12月31日,保健品行業專門從事膳食補充劑和治療藥物開發和商業化的主要客户
佔公司應收賬款總額的71.89%
;董事長為生物鑰匙公司董事董事會的第二大客户佔公司應收賬款總額的16.62%。
截至2023年12月31日止年度,在亞太地區分銷營養補充劑是最主要的客户,佔公司總收入的80.04%。截至2022年12月31日的
年度,一個主要客户(即公司股東)在臺灣從事
新藥開發和商業化工作,佔公司總收入的93.22%。
現金和現金等價物
公司認為到期日為三個月或更短的高流動性投資是
現金等價物購買時。截至2023年12月31日和2022年12月31日,公司現金
和現金等價物分別為60 155美元和85 265美元。公司的一些
現金存款存放在臺灣境內的金融機構,目前
關於銀行賬户強制保險的規定。公司認為,這一金融
信用質量高。
受限現金
受限現金主要包括在臺灣的儲備銀行賬户中持有的現金。截至2023年12月31日和2022年12月31日,公司的限制性現金分別為656,625美元和1,306,463美元,
。
庫存
庫存包括原材料、在製品、產成品和商品。存貨按成本或市價中較低者列報,並按移動加權平均成本計價。
市價是根據可變現淨值釐定的。公司定期審查其庫存的使用年限和週轉率,以確定是否有任何庫存已經過時或價值下降,並因已知和預期的過時庫存而產生運營費用
。
信用風險集中度
本公司面臨集中信用風險的金融工具主要包括現金和現金等價物。本公司將現金和臨時
現金投資於優質信貸機構,但這些投資可能超過臺灣中央存款保險公司和美國聯邦存款保險公司的保險限額。本公司並不以對衝、交易或投機為目的而訂立金融工具。
我們對客户進行持續的信用評估
,不需要抵押品。壞賬準備是基於對應收賬款可收回性的審查。
我們通過考察其歷史催收經驗和當前客户信用質量的趨勢以及其內部信貸政策來確定壞賬準備的金額。實際的信貸損失可能與我們的估計不同。
應收賬款和預期準備
信用損失賬户
應收賬款按原始發票金額減去任何潛在壞賬準備後入賬。
本公司根據我們對各種因素的評估,包括歷史經驗、應收賬款餘額的年齡、客户的信用質量、當前經濟狀況、對未來經濟狀況的合理和可支持的預測,以及可能影響我們從客户那裏收回
能力的其他因素,對信用損失準備和未開單應收賬款準備的預期信用
和可收回趨勢進行估計。這筆準備金以應收賬款餘額入賬,並在合併損益表中記錄相應的費用。實際收到的金額可能與管理層對信譽和經濟環境的估計不同。
在管理層確定收回的可能性不大後,拖欠的賬户餘額將與壞賬撥備進行註銷。
截至2023年12月31日和2022年12月31日,預期信貸損失賬户撥備分別為616,505美元和194,957美元。
收入確認
在2018財年,公司採用了會計準則編纂(“ASC”),主題606(ASC 606),與客户的合同收入,對截至2018年1月1日尚未完成的所有合同採用修改的
追溯方法,並將新的收入標準作為對2018年初累計赤字期初餘額的調整
,以產生累積影響。自2018年1月1日及之後開始的本公司
報告期的業績根據ASC 606列報,而上期金額不作調整,
繼續根據上期有效的會計準則進行報告。根據公司對截至2018年1月1日的現有合作協議的審查,公司得出結論,採用新的指導方針對公司在所述所有期間的收入沒有重大的
變化。
根據ASC 606,當客户獲得承諾的商品或服務的控制權時,公司確認收入,收入金額反映了公司預期為交換這些商品或服務而收到的對價。為確定公司確定屬於ASC 606範圍內的安排的收入確認,公司執行以下五個步驟:(i)確定與客户的合同;(ii)確定合同中的履約義務;(iii)確定交易價格;(iv)將交易價格分配給合同中的履約義務;及(v)於本公司履行履約責任時確認收入。本公司僅
在本公司很可能收取本公司有權
換取本公司轉讓給客户的商品或服務的對價時,將五步模型應用於合同。在合同開始時,一旦合同被確定
在ASC 606的範圍內,公司將評估每份合同中承諾的貨物或服務,確定那些屬於
履約義務的貨物或服務,並評估每項承諾的貨物或服務是否是獨特的。本公司隨後將在履行履約義務時分配至相關履約義務的交易價格金額
確認為收入。
以下是公司
根據公司收到的付款類型確認收入的示例。
協作收入—公司確認
通過協作研究、開發和/或商業化協議產生的協作收入。這些
協議的條款通常包括向公司支付與以下一項或多項相關的款項:不可退還的前期許可費、開發
和商業里程碑、部分或全部的研發成本報銷以及許可
產品淨銷售額的使用費。每種類型的付款都能產生協作收入,但許可產品淨銷售額的版税收入除外,
這類收入被歸類為版税收入。迄今為止,公司尚未收到任何版税收入。收入在履行
履約義務時通過將貨物或服務的控制權轉移給協作夥伴而確認。
作為這些安排的會計處理的一部分,公司應用判斷來確定履約義務是否不同,並在確定協作協議中確定的每個不同履約義務的獨立售價時進行假設。為了確定獨立的銷售價格,公司依據的假設可能包括預測收入、開發時間表、研發人員成本的報銷率、貼現率以及技術和監管成功的概率。
根據
合作協議,該公司有多項可交付成果,包括與授予技術許可證、監管和臨牀開發以及
營銷活動有關的可交付成果。對公司可交付成果的績效期的估計需要使用管理層的
判斷。管理層評估估計績效期間時考慮的重要因素包括但不限於
公司在開展臨牀開發、監管和生產活動方面的經驗。本公司每年檢討其合作協議項下的
估計履約期間,並按預期基準作出任何適當調整
。根據其合作協議對業績期間估計的未來變動可能影響未來收入確認的時間。
(I)不可退還的預付款項
如果公司知識產權的許可被確定有別於協議中確定的其他履約義務,公司將根據許可規定的相對獨立銷售價格與安排的總銷售價格相比,確認相關不可退還預付款的收入
。當許可證轉讓給協作合作伙伴,並且協作合作伙伴能夠使用許可證並從中受益時,確認收入。到目前為止,收到的不可退還的預付費用僅用於補償公司在簽訂合作協議之前所做的過去研究工作和貢獻
,與公司與合作伙伴在合作協議中作出的任何未來義務和承諾無關。
(Ii)里程碑付款
根據與協作合作伙伴簽訂的協作協議,公司有資格根據特定開發、監管和商業活動的完成情況獲得里程碑式的
付款。管理層評估了觸發這些或有付款的事件的性質,並得出結論,這些事件
分為兩類:(A)涉及履行公司與合作伙伴合作協議項下義務的事件,以及(B)不涉及履行公司與合作伙伴合作協議項下義務的事件。
前一類里程碑付款包括
由合作協議中規定的地區內的開發和監管活動觸發的付款。管理層
的結論是,這些付款中的每一筆都是實質性的里程碑付款。該結論主要基於以下事實:
(i)每個觸發事件代表一個特定結果,該結果只能通過公司成功履行一個或多個可交付成果來實現,(ii)每個觸發事件的實現受到固有風險和不確定性的影響,並將導致
額外付款到期,(iii)每個里程碑付款不可退還,(iv)完成每個里程碑需要
大量的努力,(v)每個里程碑付款的金額相對於實現里程碑所創造的價值而言是合理的,(vi)預付款和潛在里程碑付款之間預計會經過大量的時間,
以及(vii)里程碑付款僅與過去的業績有關。基於上述情況,本公司在基礎觸發事件發生期間確認這些
里程碑付款的任何收入。
(三)多元素安排
本公司評估多種要素安排,以確定(1)安排中包括的交付成果,以及(2)各個交付成果是否代表獨立的會計單位,或者它們是否必須作為一個合併的會計單位來核算。此評估涉及主觀確定
,並要求管理層對各個交付成果以及此類交付成果是否與合同關係的其他方面分開進行判斷。交付項目被視為獨立的會計單位,條件是:(I)交付項目對客户具有獨立的價值,(Ii)如果安排包括相對於交付項目的一般退貨權,則未交付項目的交付或履行被認為是可能的,且基本上在其控制範圍之內。在評估協作項下的項目是否具有獨立價值時,公司會考慮協作合作伙伴的研究、製造和商業化
能力以及相關專業知識在一般市場的可用性等因素。公司還會考慮其協作合作伙伴是否可以在未收到剩餘
要素的情況下將其他交付成果用於其預期用途、交付成果的價值是否取決於未交付項目,以及是否有其他供應商可以
提供未交付要素。
當ASC 606中的所有收入確認標準滿足特定會計單位時,公司確認分配給每個會計單位的安排對價
。如果可交付物不代表單獨的會計單位,公司將在公司合同期間或預計履約期內確認未交付要素的合併會計單位的收入,這通常是公司研發義務的期限。如果沒有可識別的業績模式
或不存在客觀可衡量的業績衡量標準,則本公司將在預期完成其業績義務的期間內以直線方式確認安排下的收入
。相反,如果可以確定向客户提供服務的績效模式,並且存在客觀可衡量的績效指標,則公司將使用比例績效法在安排下確認
收入。確認的收入限於截至期末日使用直線法或按比例績效法(視情況而定)確定的累計收到的付款金額或累計收入金額中的較小者。
在包括
里程碑付款的安排開始時,公司根據里程碑的或有
性質評估每個里程碑是否具有實質性,是否對雙方都有風險。該評估包括評估:(1)對價是否與公司實現里程碑的
業績相稱,或者是否因實現里程碑的業績而導致交付項目的價值提升;(2)對價僅涉及過去的業績;以及(3)相對於安排內的所有可交付成果和付款條款,對價是合理的。該公司評估為實現特定里程碑而必須克服的科學風險、臨牀風險、監管風險、商業風險和其他風險等因素,以及在進行此評估時為實現特定里程碑所需的工作和投資水平。在確定里程碑是否滿足得出里程碑是實質性的結論所需的所有標準時,需要進行相當多的判斷。假設
所有其他收入確認標準都得到滿足,如果沒有剩餘的履約義務或在剩餘的業績期間,不被視為實質性的里程碑被確認為已賺取的。
(4)特許權使用費和利潤分享付款
根據與合作伙伴的合作協議,本公司有權就產品銷售收取特許權使用費,按淨銷售額的若干百分比收取。公司
根據ASC 606中規定的收入確認標準確認這些事件的收入。根據這些標準,本公司
將這些付款視為或有收入,並在適用的或有事項
得到解決的期間將其確認為收入。
研究與開發活動所得收入
服務—根據合同條款,在執行相關服務
或活動時確認與研究與開發及監管活動有關的收入。公司通常在合同開始時只有一項履約義務,即執行研發服務。公司還可以向客户提供一個選項
,以請求公司在未來提供額外商品或服務,例如活性藥物成分、API或IND/NDA/ANDA/510K
提交。本公司於合約開始時評估該等購股權是否為重大權利。如果本公司確定
某項期權是一項重大權利,本公司將將該期權視為一項單獨的履約義務。
如果公司有權從
其客户處獲得特定研發費用的補償,則公司將其提供的相關服務作為單獨的
履約義務入賬,前提是公司確定這些服務代表重大權利。本公司亦會根據總收入或淨收入列報規定,決定研發費用的償付
是否應入賬列作收入或抵銷研發費用。本公司在履行相關履約義務時確認相應收入或將相應
衝減計入研究開發費用。
然後,本公司通過審查本公司根據合同有資格獲得的對價金額(包括任何可變對價)來確定交易價格。根據未完成合同,對價通常包括固定對價和以潛在里程碑付款形式的可變對價
。在協議開始時,公司的交易價格通常包括支付給公司或由公司支付的款項
基於分配給項目的全職相當研究人員的數量和相關的研發費用。
公司通常不會在初始交易價格中包括公司未來可能收到的任何付款,因為付款的可能性不大。公司將在每個報告期重新評估交易總價,以確定公司
是否應在交易價格中包括額外付款。
公司根據每份合同中設定的開單時間表從客户那裏獲得付款。預付款和費用可在收到客户時或到期時記為預付款,並可能要求將收入確認推遲到未來一段時間,直到公司履行這些
安排下的義務。當公司的對價權利是無條件的時,金額被記錄為應收賬款。如果合同開始時的預期是從客户付款到向客户轉讓承諾的貨物或服務之間的時間
為一年或更短時間,則公司
不評估合同是否有重要的融資部分。
財產和設備
財產和設備按累計折舊後的成本淨額
入賬。修理費和維護費在發生時計入。改善相關
資產功能或延長使用壽命的支出將計入資本化。當財產和設備報廢或以其他方式處置時,相關收益或
虧損計入營業收入。租賃改進按直線法按資產的剩餘租賃期或估計使用年限中較短的一個折舊。折舊按直線法計算,包括資本租賃項下的財產和設備
,一般以下列使用年限為基礎:
| |
|
|
估計數
年生活 |
|
| 建築物和租賃設施的改進 |
|
|
5 ~ 50 |
|
| 機器和設備 |
|
|
5 ~ 10 |
|
| 辦公設備 |
|
|
3 ~ 6 |
|
在建工程
本公司收購的建築物構成其某些固定資產。與固定資產建設有關且在資產達到預定可使用狀態前發生的一切直接和間接成本,均作為在建工程資本化。並無就在建工程計提折舊撥備。
在建工程轉入特定固定資產項目,當這些資產達到預定用途時,開始折舊
。本公司收購了中滙擁有的某項物業和一幅土地的20%所有權,
旨在將該物業共同開發為ABVC
特殊利益領域的老年生活、長期護理和醫療保健保健中心,如眼科、腫瘤和中樞神經系統。該計劃是為中國市場
和這些利益的全球發展建立一個基地。該公司是與中滙相關合作協議的一方,但正在等待中國政府的最終
資產所有權認證。
長期資產減值準備
公司採用了會計準則
編碼子主題360-10,財產、廠房和設備(“ASC 360-10”)。ASC 360-10要求,只要發生事件或情況變化表明資產的賬面價值可能無法收回,本公司持有和使用的長期資產和
某些可識別無形資產必須進行減值審查。本公司每年對其長期資產進行減值評估
或在事件和情況需要時更頻繁地評估減值。與可恢復性有關的事件可能包括業務狀況的重大不利變化、經常性虧損或預計無法在較長時期內實現盈虧平衡經營業績。如顯示價值減值,無形資產的賬面價值將根據對資產的使用和最終處置所產生的未來貼現現金流量的估計進行調整。ASC 360-10還要求以賬面價值或公允價值減去出售成本中的較低者報告資產處置。
長期股權投資
本公司收購股權投資是為了
促進業務和戰略目標。本公司對被投資單位不具有控制權的非流通股權益及其他權益性投資,按下列方法核算:
| ● | 當公司有能力對被投資人施加重大影響,但
無法控制時,進行股權投資。其在收入或虧損中的比例按月確認,並計入股權投資的收益(虧損)。 |
需要作出重大判斷以確定
本公司非流通股投資的估值是否存在減值,因此本公司認為這是一個關鍵的會計估計。其年度分析同時考慮了可能對被投資人的公允價值產生重大影響的定性和定量因素。對其投資的定性分析涉及瞭解被投資方的財務業績和近期前景、被投資方所在行業或地理區域的總體市場狀況變化,以及被投資方的管理和治理結構。使用市場法和收益法對其投資的公允價值進行量化評估。市場方法包括使用私營和上市公司的可比財務指標
以及最近幾輪融資。收益法包括使用貼現現金流模型,這需要對被投資對象的收入、成本和貼現率進行重大估計。公司在確定是否存在減值時對這些因素的評估在未來可能會因新的發展或應用的假設發生變化而發生變化。
非暫時性減值
公司的長期股權投資
須接受定期減值審查。減值對收益的影響如下:
| ● | 可銷售的股權證券包括對一般市場狀況、公允價值低於成本的持續時間和程度的考慮,以及我們持有投資的能力和意圖
,以便在可預見的未來收回價值。
本公司還考慮與被投資方的財務健康狀況和業務前景有關的特定不利條件。這可能包括行業和部門表現、
技術、運營和融資現金流因素的變化,以及被投資方信用評級的變化。本公司在股權投資的損益中計入非暫時性的有價證券減值和有價證券方法投資減值。 |
| ● | Non-marketable
equity investments based on the Company’s assessment of the severity and duration of
the impairment, and qualitative and quantitative analysis of the operating performance of
the investee; adverse changes in market conditions and the regulatory or economic environment;
changes in operating structure or management of the investee; additional funding requirements;
and the investee’s ability to remain in business. A series of operating losses of an
investee or other factors may indicate that a decrease in value of the investment has occurred
that is other than temporary and that shall be recognized even though the decrease in value
is in excess of what would otherwise be recognized by application of the equity method. A
loss in value of an investment that is other than a temporary decline shall be recognized.
Evidence of a loss in value might include, but would not necessarily be limited to, absence
of an ability to recover the carrying amount of the investment or inability of the investee
to sustain an earnings capacity that would justify the carrying amount of the investment.
The Company records other-than-temporary impairments for non-marketable cost method investments
and equity method investments in gains (losses) on equity investments. Other-than-temporary
impairments of equity investments were $0
截至2023年12月31日及2022年12月31日止年度分別為0美元。 |
商譽
本公司每年或更頻繁地評估商譽的減值
當事件發生或情況變化表明賬面價值可能無法收回時。在對商譽進行減值測試時,本公司可選擇利用定性評估來評估報告單位的公允價值是否比其賬面價值更有可能低於其賬面價值。如果定性評估顯示商譽減值的可能性較大,本公司將進行兩步減值測試。本公司根據兩步減值測試測試商譽減值,首先將淨資產賬面價值與報告單位的公允價值進行比較。如果公允價值被確定為低於賬面價值或定性因素表明商譽更有可能減值,則執行第二步
以估計商譽公允價值與賬面價值之間的差額計算減值金額。
本公司使用貼現現金流量估計報告單位的公允價值。對未來現金流的預測基於我們對未來淨銷售額和運營費用的最佳估計,主要基於預期的類別擴展、定價、市場細分市場份額和一般經濟狀況。
截至2023年12月31日,公司完成了所需的商譽減值測試,
並確定商譽因
當前的財務狀況而減值 本公司及本公司無法產生未來營業收入,且無實質性
銷售量的增長,這是非常不確定的。此外,公司預計
未來現金流量顯示商譽的可收回性沒有合理保證。
研究和開發費用
根據ASC主題730-10-25-1,本公司在研發成本中核算使用許可權的成本。本指南規定,在未來沒有替代用途的情況下,購買用於研發活動的產品權利必須在發生時計入研發費用
。
The
Company accounts for R&D costs in accordance with Accounting Standards Codification (“ASC”)
730, Research and Development (“ASC 730”). Research and development expenses
are charged to expense as incurred unless there is an alternative future use in other research
and development projects or otherwise. Research and development expenses are comprised of
costs incurred in performing research and development activities, including personnel-related
costs, facilities-related overhead, and outside contracted services including clinical trial
costs, manufacturing and process development costs for both clinical and preclinical materials,
research costs, and other consulting services. Non-refundable advance payment for goods and
services that will be used in future research and development activities are expensed when
the activity has been performed or when the goods have been received rather than when the
payment is made. In instances where the Company enters into agreements with third parties
to provide research and development services, costs are expensed as services are performed.
退休後和離職後福利
公司在臺灣的子公司採用了政府規定的定額供款
根據臺灣勞動退休金法(“法”)的規定。此類勞動法規
要求僱主每月向勞動養老基金繳納的繳費率
不得低於勞動者月工資的6%。根據該法, 公司每月向企業繳納相當於員工工資6%的供款
養老基金。公司對繳款以外的福利沒有法律義務
進行了此類員工福利的總金額(在發生時支銷)為
截至2023年12月31日及2022年12月31日止年度分別為10,314美元及13,031美元。除了
本公司不提供任何其他退休後或離職後福利。
基於股票的薪酬
公司使用公允價值方法計量與所有員工股票薪酬獎勵相關的費用,並根據FASB ASC主題
在必要的服務期內以直線方式在合併財務報表中確認此類費用718“薪酬--股票薪酬”。截至2023年12月31日和2022年12月31日的年度,員工股票薪酬支出總額分別為0美元和1,241,930美元。
本公司根據FASB ASC主題718 "薪酬—股票薪酬"和FASB ASC主題505—50 "以股權為基礎的
支付給非僱員的薪酬",對非僱員的股票薪酬進行了核算,該主題要求從非僱員獲得的服務成本按
的公允價值計量,業績承諾日期或服務完成並在提供服務期間確認之日期的較早者。截至2023年12月31日及2022年12月31日止年度,
非僱員股票薪酬支出總額分別為1,635,708美元及5,794,848美元。
受益轉換功能
公司可能會不時發行可轉換票據
,其中可能包含嵌入的受益轉換功能。在可轉換票據可轉換為的標的普通股的公允價值超過票據的剩餘未分配收益的情況下,在首次考慮將票據收益的一部分分配到認股權證的公允價值(如果已授予相關認股權證)後,存在受益轉換特徵。受益轉換功能的內在價值被記錄為債務折扣,並相應地
金額為額外實收資本。債務貼現在票據有效期內攤銷為利息支出,採用有效的
利息方法。
所得税
本公司採用資產負債法核算所得税,該方法允許根據未來年度實現税收優惠的可能性來確認和計量遞延税項資產。在資產負債法下,遞延税項是為財務報告用途的資產和負債的賬面金額與用於所得税的金額之間的臨時
差額而計提的淨税項影響。如果遞延税項更有可能在公司實現其收益之前到期,或未來的扣除額不確定,則為遞延税項資產提供估值扣除。
Under
ASC 740, a tax position is recognized as a benefit only if it is “more likely than
not” that the tax position would be sustained in a tax examination, with a tax examination
being presumed to occur. The evaluation of a tax position is a two-step process. The first
step is to determine whether it is more-likely-than-not that a tax position will be sustained
upon examination, including the resolution of any related appeals or litigations based on
the technical merits of that position. The second step is to measure a tax position that
meets the more-likely-than-not threshold to determine the amount of benefits recognized in
the financial statements. A tax position is measured at the largest amount of benefit that
is greater than 50 percent likely of being realized upon ultimate settlement. Tax positions
that previously failed to meet the more-likely-than-not recognition threshold should be recognized
in the first subsequent period in which the threshold is met. Previously recognized tax positions
that no longer meet the more-likely-than-not criteria should be de-recognized in the first
subsequent financial reporting period in which the threshold is no longer satisfied. Penalties
and interest incurred related to underpayment of income tax are classified as income tax
expense in the year incurred. No significant penalty or interest relating to income taxes
has been incurred for the years ended December 31, 2023 and 2022. GAAP also provides guidance
on de-recognition, classification, interest and penalties, accounting in interim periods,
disclosures and transition.
遞延税項資產的估值
計入估值撥備,以將公司的遞延税項資產減少至更有可能變現的金額。在評估評估免税額的必要性時,管理層除其他因素外,還考慮對未來應税收入的預測以及持續審慎和可行的税務籌劃策略。如果本公司確定存在足夠的負面證據,則將考慮對該司法管轄區的部分或全部遞延税項資產計入估值準備
。如果在計入估值免税額後,公司對未來應納税所得額的預測和在評估估值免税額需求時考慮的其他積極證據在事後證明是不準確的,則可能被證明更難支持其遞延税項資產的變現。
因此,可能需要額外的估值免税額,這將對其實際所得税税率和業績產生不利影響。相反,如果在計入估值準備後,本公司確定在計入估值準備的司法管轄區有足夠的積極證據,則本公司可以撤銷該司法管轄區的部分或全部估值準備。
在這種情況下,對遞延税項資產進行的調整將對其實際所得税税率產生有利影響,並在確定期間產生
結果。
普通股每股虧損
本公司根據ASC主題260“每股收益”計算
每股淨虧損。每股基本虧損的計算方法是將淨虧損除以期內已發行普通股的加權平均數。每股攤薄虧損的計算方法與每股基本虧損類似,只是分母增加,以包括潛在普通股等價物已發行及額外普通股為攤薄股份時將會發行的額外普通股數目。稀釋後每股收益不包括所有稀釋性
潛在股票,如果它們的影響是反稀釋的。
承付款和或有事項
公司採用了ASC主題450“或有事項”
小主題20來確定其關於或有損失的應計項目和披露。因此,或有損失的估計損失
在財務報表發佈前已有或可供
發佈的信息表明在財務報表日期資產很可能已減值或已發生負債且損失金額可合理估計時,應計入收入。與或有事項相關的法律費用在發生時計入費用。
如果或有損失不可能發生或無法合理估計,則在至少合理可能發生重大損失的情況下,在財務報表中披露或有損失。
外幣交易
對於本公司在臺灣的子公司,
外幣交易按交易發生時的有效匯率以新臺幣(“新臺幣”)記錄。外幣現金兑換新臺幣或外幣應收、應付款項結算時,因適用不同匯率而產生的損益,計入折算或結算當年的收益
。在資產負債表日,外幣資產和負債的餘額按現行匯率重新列報,由此產生的差額計入當期收入,但以外幣計價的股票投資除外,該差額在股東權益(虧損)報表中計入換算調整。
翻譯調整
本公司在臺灣的附屬公司的賬目均以新臺幣(“新臺幣”)結算,而其財務報表則以新臺幣(“新臺幣”)表示。此類財務報表
根據ASC 830《外幣事項》以新臺幣為本位幣折算成美元。根據報表,所有資產和負債按當前匯率折算,股東赤字按歷史匯率折算,損益表項目按當期平均匯率折算。由此產生的換算調整在其他全面收益(虧損)項下作為股東權益(虧損)的組成部分列報。
近期會計公告
In August 2020, the FASB issued ASU 2020-06,
Debt - Debt with Conversion and Other Options (Subtopic 470-20) and Derivatives and Hedging-Contracts in Entity’s Own Equity (Subtopic
815-40): Accounting for Convertible Instruments and Contracts in an Entity’s Own Equity (“ASU 2020-06”). ASU 2020-06 simplifies the accounting for convertible debt by eliminating the beneficial conversion and cash conversion accounting models. Upon adoption
of ASU 2020-06, convertible debt, unless issued with a substantial premium or an embedded conversion feature that is not clearly and
closely related to the host contract, will no longer be allocated between debt and equity components. This modification will reduce the
issue discount and result in less non-cash interest expense in financial statements. ASU 2020-06 also updates the earnings per share
calculation and requires entities to assume share settlement when the convertible debt can be settled in cash or shares. For contracts
in an entity’s own equity, the type of contracts primarily affected by ASU 2020-06 are freestanding and embedded features that
are accounted for as derivatives under the current guidance due to a failure to meet the settlement assessment by removing the requirements
to (i) consider whether the contract would be settled in registered shares, (ii) consider whether collateral is required to be posted,
and (iii) assess shareholder rights. ASU 2020-06 is effective for fiscal years beginning after December 15, 2023. Early adoption is permitted,
but no earlier than fiscal years beginning after December 15, 2020, and only if adopted as of the beginning of such fiscal year. The
Company is currently evaluating the impact that the standard will have on its consolidated financial statements.
2021年5月,FASB發佈了ASU 2021-04、每股收益(主題260)、債務修改和清償(主題470-50)、補償-股票補償(主題718)以及實體自身股權的衍生品和對衝合同(主題815-40):發行人對某些修改的會計
或獨立股權分類書面看漲期權的交換(“ASU 2021-04”)。ASU 2021-04就發行人應如何考慮條款或條件的修改或交換獨立的股權分類書面看漲期權(即認股權證)提供了指導,該期權在修改或交換後仍被歸類為以原始票據交換新票據。發行人應以修改或交換的權證的公允價值與緊接修改或交換前該權證的公允價值之間的差額來衡量修改或交換的效果,然後應用一個確認模型
,該模型包括四類交易和每一類的相應會計處理(股權發行、債務發起、債務修改以及與股權發行和債務發起或修改無關的修改)。ASU 2021-04適用於
2021年12月15日之後開始的財年的所有實體,包括這些財年內的過渡期。實體應
前瞻性地將ASU 2021-04中提供的指導應用於生效日期或之後發生的修改或交換。允許所有實體提前
採用,包括在過渡期間採用。如果一個實體選擇在過渡期內提早採用ASU 2021-04,則應在包括該過渡期的財政年度開始時應用指導意見。公司
目前正在評估該標準對其合併財務報表的影響。
估計和假設
在編制我們的合併財務報表時,我們使用影響報告金額和披露的估計和假設。我們的估計通常基於複雜的判斷、概率和假設,我們認為這些判斷、概率和假設是合理的,但本質上是不確定和不可預測的。我們還受到其他風險和不確定因素的影響,這些風險和不確定因素可能會導致實際結果與估計金額不同。
經營業績-截至2023年12月31日的年度與截至2022年12月31日的年度相比。
收入。截至二零二三年及二零二二年十二月三十一日止年度,我們分別產生152,430美元及969,783美元的收入。減少817,353美元,或約84%,
主要是由於正在進行的項目完成和等待新的批准。
運營費用。截至2023年12月31日止年度,我們的營運開支
為8,066,902美元,而2022年12月31日則為15,797,780美元。運營費用的減少主要是由於基於股票的薪酬和銷售、一般和行政費用減少了6,100,337美元,
以及研發費用減少了1,630,541美元。
其他收入(費用)。截至2023年12月31日止年度的其他支出為2,437,773美元,而2022年12月31日的其他收入為400,184美元。該變動
主要由於利息開支增加(主要來自應付可換股票據)所致,而被截至二零二三年十二月三十一日止年度的外匯增加
、股本證券投資虧損以及截至二零二三年十二月三十一日止年度的減值虧損及
投資虧損減少所抵銷。
截至2023年12月31日止年度的利息收入(支出)淨額為(2,307,859)美元
,而截至2022年12月31日止年度為(106,151)美元。增加(2,201,708)美元或約
2,074 %,主要是由於為適當的會計目的確認已轉換票據利息開支而導致利息開支增加所致。
淨虧損。截至二零二三年十二月三十一日止年度的淨虧損為10,910,288元,而截至二零二二年十二月三十一日止年度則為16,312,374元。本公司通過更有效地利用資金和停止
某些諮詢服務,在截至2023年12月31日止年度,從2022年起將淨虧損減少
5,061,086美元或約31%。
流動性
與資本資源
營運資金
| | |
截至12月31日,
2023 | | |
自.起
十二月三十一日,
2022 | |
| | |
| | |
| |
| 流動資產 | |
$ | 1,656,709 | | |
$ | 2,987,247 | |
| 流動負債 | |
$ | 5,932,490 | | |
$ | 5,543,628 | |
| 營運(赤字)資本 | |
$ | (4,275,781 | ) | |
$ | (2,556,381 | ) |
經營活動現金流
截至2023年12月31日及2022年12月31日止年度,經營活動所用現金淨額分別為4,235,845美元及7,398,391美元。數額減少3,162,546美元的主要原因是應收賬款、股本證券投資損失、庫存股票損失和出售、應計
費用和其他流動負債增加,但部分被淨虧損減少、股本證券投資出售收益、應收關聯方款項、預付費用、減值損失和股票補償所抵消;及
截至2023年12月31日止年度遞延税項的減少。
投資活動產生的現金流
截至2023年12月31日及
2022年12月31日止年度,投資活動所用現金淨額分別為360,186美元及1,721,684美元。金額減少1,361,498美元主要是由於股權投資和設備採購預付款減少,但被截至2023年12月31日止年度
長期投資預付款增加所抵消。
融資活動產生的現金流
截至2023年12月31日及
2022年12月31日止年度,融資活動提供的現金淨額分別為3,918,960美元及4,013,925美元。融資活動提供的現金淨額減少了94,965美元,原因是可換股票據和發行認股權證所得款項增加,部分被
普通股發行減少、短期貸款所得款項減少和短期票據償還
截至2023年12月31日止年度的短期票據償還所抵消。
表外安排
截至2023年12月31日,我們沒有任何
資產負債表外安排,這些安排對我們的財務狀況、財務狀況、收入或支出、經營業績、流動性、資本支出或資本資源的變化
具有或合理可能具有當前或未來影響
。
生意場
行業概述
生物技術產業專注於開發突破性產品和技術,通過高效的工業製造過程對抗各種疾病。生物技術
是世界經濟中一個重要的商業部門,對人類健康起着關鍵作用。從事生物技術的公司通常需要為其研發活動投入大量資本,而研發和商業化一種新藥或一種新醫療器械可能需要長達數十年的時間
。ABVC(“我們”或“公司”)是一家初創階段的生物技術公司,擁有七種新藥和一種正在開發的醫療設備的流水線,所有這些藥物都獲得了公司相關方的許可。
我們的使命
我們致力於打造一家成熟的生物技術公司,併成為生物製藥行業的先驅。我們的首席執行官Uttam Patil博士和公司創始人兼大股東蔣宗山博士瞭解生物技術行業的挑戰和機遇,並打算
通過開發治療中樞神經系統(CNS)和腫瘤學/血液病的創新植物藥物,為尚未得到滿足的重大醫療需求提供治療解決方案,並改善人類的健康和生活質量。
業務概述
截至本文發佈之日,該公司的最低收入來自通過BioKey銷售CDMO服務。然而,該公司的重點是通過仔細跟蹤亞太地區研究機構的新醫學發現或醫療器械技術來開發產品流水線
。臨牀前,疾病動物模型和I期安全性研究由公司的科學家和公司已知的其他專家仔細檢查,以根據公司的內部資質確定其認為有效和安全的藥物或醫療器械。一旦一種藥物或醫療器械被證明是進一步開發和最終商業化的良好候選藥物或醫療器械,ABVC將從原始研究人員那裏獲得該藥物或醫療器械的許可,並向美國、澳大利亞和臺灣備受尊敬的主要研究人員介紹藥物或醫療器械臨牀試驗計劃
。ABVC發現,在幾乎所有情況下,這些國家的研究機構都渴望與該公司合作,推進第二階段臨牀試驗。
已經或正在與ABVC合作進行第二階段臨牀試驗的機構包括:
| ● | 藥物:ABV-1504,嚴重抑鬱障礙(MDD),第二階段完成。NCE藥物首席研究員:Charles DeBattista醫學博士和Alan F.Schatzberg醫學博士,斯坦福大學醫學中心,Li醫學博士,醫學博士-臺北退伍軍人總醫院 |
| ● | 藥物:
ABV—1505,成人注意缺陷多動障礙(ADHD),II期第1部分完成。
主要研究者:Keith McBurnett,Ph.D.琳達·菲夫納博士University of
加利福尼亞州舊金山分校(UCSF),醫學院。II期,第2部分臨牀研究中心
包括加州大學舊金山分校和臺灣的5個地點。主要研究員是Keith McBurnett,
博士琳達·菲夫納博士加州大學舊金山分校(UCSF),學校
醫學;Susan Shur—Fen Gau,醫學博士,國立臺灣大學附屬醫院倪新章醫學博士
林口長庚紀念醫院;徐文君,醫學博士,高雄長庚紀念醫院 蘇東平醫學博士鄭新總醫院李正達醫學博士臺北退伍軍人總會
醫院第二階段,第二部分開始於1ST2022年第四季度在5台
網站.加州大學舊金山分校的研究中心在2年中加入了這項研究。發送2023年季度。主題
入組研究的人數已達到2023年12月中期分析的人數,
研究的中期分析工作正在進行中。 |
| ● | 藥物:ABV-1601,癌症患者的主要抑鬱,I/II期,NCE藥物首席研究員:斯科特·歐文,醫學,博士-雪松西奈醫學中心(CSMC)。第一階段臨牀研究將於2024年第一季度啟動。 |
| ● | 醫療
器械:ABV—1701,Vitargus ®在玻璃體切除手術中的II期研究已經啟動
在澳大利亞和泰國,主要研究者:Duangnate Rojanaporn,醫學博士,拉瑪提博迪 醫院;Thuss Sanguansak,醫學博士,兩個泰國研究中心的Srinagarind醫院和教授/博士。
Matthew Simunovic,悉尼眼科醫院;Elvis Ojaimi博士,東墨爾本眼科集團&
東墨爾本視網膜。第二階段研究於2023年第二季度開始,公司
正在通過新一批試驗產品改進Vitargus產品
產品 |
以下審判預計將於2024年第三季度開始:
| ● | 藥物:
ABV-1519,非小細胞肺癌治療,臺灣I/II期研究,首席研究員:
羅永鴻醫生,醫學博士,臺北退伍軍人總醫院(TVGH) |
| ● | 藥物:ABV-1703,晚期無法手術或轉移性胰腺癌,II期,首席研究員:安德魯·E·亨迪法爾,醫學-雪松西奈醫學中心(CSMC) |
完成第二階段試驗後,ABVC將尋求合作伙伴(通常是大型製藥公司)完成第三階段研究,並在獲得美國FDA、臺灣TFDA和其他國家/地區監管機構的批准後將藥物或醫療器械商業化。
GMP製造
ABVc擁有經過認證的GMP生產工廠,通過BioKey,該工廠有資格提供少量藥物,供其客户在從第一階段到第三階段的臨牀試驗中使用。該GMP工廠可以生產直接原料藥或混合填充劑膠囊、手動和自動膠囊、濕法制粒或託盤乾燥工藝、片劑壓片和包衣工藝,以及為ANDA和IND提交的固體劑型包裝。
BioKey工廠由GMP套間、產品開發區、分析實驗室、食品加工區、籠式GMP存儲區、接收區和兩個倉庫組成。該工廠於2008年12月進行了改造,並於2009年6月獲得了第一個藥品生產許可證。ABVc目前的藥品生產許可證允許它在2024年12月2日許可證到期之前,根據IND生產用於人體臨牀試驗的藥物產品。
2022年,BioKey開始生產以食用菌為基礎的膳食補充劑。這些蘑菇由幕府邁塔克加拿大有限公司提供,生長在受控的温度和潮濕的環境中,不含殺蟲劑和化學品。最初,新補充劑在美國和加拿大的銷售將以高端雜貨店和全球範圍內的在線分銷為目標。雖然目前有許多以蘑菇為基礎的補充劑可供客户使用,但BioKey相信其新系列具有顯著的競爭優勢,因為蘑菇的純度和一致性
本身超過了現有的任何食用菌,而且BioKey採用的提取工藝提供了特別強的
劑量。舞菇富含生物活性多糖,尤其是β-葡聚糖。這些多糖具有良好的免疫保護和抗腫瘤特性。BioKey已經開發出這種補充劑的片劑和液體版本。2022年在臺灣和加拿大分別完成了2批次和1批次的批量GMP生產
邁塔克蘑菇片和邁塔克蘑菇飲料,用於商業
推出。
舞茸中的β-葡聚糖已被證明
可降低膽固醇,從而改善動脈功能和整體心血管健康,降低心臟病的風險
。更進一步,研究表明舞茸中的β-葡聚糖具有增強免疫系統的作用1在一項針對絕經後乳腺癌患者的試驗中,口服舞曲提取物被證明具有免疫調節作用。
在紀念斯隆-凱特琳癌症中心進行的另一項試驗中,舞曲提取物被證明能增強骨髓增生異常綜合徵患者的中性粒細胞和單核細胞功能。它促進淋巴因子(蛋白質介體)和白介素類(分泌蛋白質)的產生,從而改善免疫反應。此外,臨牀試驗表明,β-葡聚糖可降低血糖水平,從而幫助激活胰島素受體,同時在糖尿病治療中減少胰島素抵抗。
BioKey與臺灣的一家藥品營銷公司Define Biotech Co.Ltd.簽訂了一份為期三年的經銷協議。Define Biotech Co.Ltd.主要在亞太地區銷售藥品、膳食補充劑和醫療產品。該協議授予Defined Biotech在中國和臺灣地區分銷這種新的膳食補充劑的獨家權利,以換取承諾在三年內購買價值300萬美元的新產品。
納斯達克上市
2021年8月5日,我們完成了1,100,000股的公開發行(“發售”),每個單位包括一股我們的普通股
(“普通股”),一股A系列認股權證(“A系列認股權證”),以每股6.30美元的行使價購買一股普通股,可行使至發行日期五週年,以及一份B系列認股權證(
“B系列認股權證”),以及A系列認股權證,“公開認股權證”)以每股10.00美元的行使價購買一股普通股,可行使至發行日五週年;認股權證的行權價格須受其中所述的若干調整及無現金行權條款所規限。本公司根據最初於2021年4月8日提交給美國證券交易委員會(以下簡稱“美國證券交易委員會”)的S-1表格註冊聲明(第333-255112號文件)(經修訂後的“原始註冊聲明”)、美國證券交易委員會宣佈於2021年8月2日生效的S-1表格註冊聲明(第333-258404號文件)及於2021年8月4日自動生效的S-1表格註冊聲明(“S-1MEF”)及原始註冊聲明完成發售。註冊聲明)。
單位定價為每單位6.25美元,扣除承銷折扣和發售費用前,總收益為6,875,000美元。
此次發售基於堅定的承諾進行。該普通股獲準在納斯達克資本市場上市,並於2021年8月3日開始
交易,股票代碼為“ABVC”。
2022年8月19日,我們收到納斯達克股票市場有限責任公司(“納斯達克”)的納斯達克上市資格部(“員工”)發來的短函
通知我們,根據納斯達克上市規則5550(A)(2)(“規則5550(A)(2)”),我們普通股的收盤價連續30個工作日低於在納斯達克資本市場繼續上市所需的最低每股1.00美元。
根據納斯達克上市規則5810(C)(3)(A),我們最初被要求在2月14日之前2023重新遵守規則
5550(A)(2)。由於我們在此日期之前沒有重新獲得合規,因此我們請求並收到了額外的180天,直到2023年8月14日
來遵守規則5550(A)(2)。
於2023年5月24日,吾等收到納斯達克證券市場有限責任公司(“納斯達克”)上市資格審核部(“職員”)發出的短板函件,通知
本公司目前不符合最低股東權益要求,或不符合上市證券市值或持續經營所得淨收入的替代方案,無法繼續在納斯達克資本市場上市。納斯達克上市規則
第5550(B)(1)條要求上市公司保持至少2500,000美元的股東權益,截至2023年3月31日,公司的股東權益為1,734,507美元。根據納斯達克規則,本公司有45個日曆日,即在2023年7月10日之前提交計劃,以重新獲得合規。在提交了恢復合規的計劃後,納斯達克於2023年7月10日批准該公司延期
至20203年8月30日,以遵守上市規則第5550(B)(1)條。2023年7月31日,該公司以登記直接發售的方式發行了300,000股普通股和200,000股預融資權證,行使價為每股0.01美元。根據這筆交易,股東權益增加了175萬美元。2023年8月1日,500,000美元的票據以每股3.50美元的價格轉換,持有人獲得了142,857股普通股。本次換股後,股東權益增加了50萬美元。
此外,於2023年8月14日,本公司與中滙聯合科技(成都)集團有限公司
簽訂了合作協議,據此,本公司收購了中滙擁有的若干物業的20%所有權和中滙擁有的一塊土地,以換取合計37萬股普通股。因此,股東權益增加了740萬美元。於2023年2月23日,本公司與Lind訂立證券購買協議,據此,本公司發行Lind一張本金為3,704,167美元的有擔保可轉換票據(“Lind發售”),購買價為3,175,000美元(“Lind票據”),可按初步轉換價格每股1.05美元轉換為普通股,並可予調整。於2023年8月24日,本公司開始償還Lind票據項下到期的每月分期付款;308,000美元已透過發行176,678股普通股(“每月股份”)償還,贖回股份價格(定義見Lind Note)為每股1.698美元。
根據Lind Note的條款,Lind將下一次每月付款金額增加至100萬美元,以致截至2023年9月,本公司連同每月股份,償還Lind共1,000,000美元。因此,股東權益額外增加了100萬美元。作為上述四項交易的結果,公司估計其股東權益將增加約1,065萬美元。2023年9月6日,納斯達克發佈了一封信,表示公司遵守了規則
第5550(B)(1)條,但指出,如果在公司下一次定期報告時,公司沒有證據表明遵守了規則,可能會
被摘牌。
名稱更改和Cusip編號
本公司股東於2020年股東周年大會(“股東周年大會”)上批准修訂本公司的公司章程,將本公司的公司名稱更改為“ABVC BioPharma,Inc.”,並批准並通過修訂證書以使其生效。內華達州國務卿於2021年3月8日批准了名稱更改,FINRA於2021年4月30日處理了我們的此類名稱更改請求。新名稱於2021年5月3日生效。在名稱變更前簽發的股票仍然有效,股東不需要因名稱變更而提交股票進行交換。新的公司名稱變更後簽發的
股票證書將印有公司的新名稱ABVC BioPharma,Inc.;現有
股票證書仍然有效。
該公司的CUSIP編號為0091F106。公司的股票代碼仍然是ABVC。
我們的管道
我們正在開發和研究ABV-1504,這是一種針對去甲腎上腺素的植物再吸收抑制劑。在臨牀試驗之前,我們對ABV-1504進行了放射性配基結合試驗。放射配基結合分析用於表徵藥物與其目標受體的結合效果。在ABV-1504的情況下,放射性配基結合分析的受體是去甲腎上腺素、多巴胺和5-羥色胺。去甲腎上腺素放射配基結合試驗於2007年5月3日至5月8日進行,多巴胺和5-羥色胺放射配基結合試驗於2007年11月26日至12月5日進行。ABV-1504對去甲腎上腺素的放射配基結合實驗結果為2.102μg/mlIC_(50),表明ABV-1504‘S對去甲腎上腺素有較強的抑制作用。多巴胺和5-羥色胺的放射配基結合試驗結果不如去甲腎上腺素,表明抑制效率較低。由於研究表明去甲腎上腺素抑制劑
可以緩解抑鬱水平,我們的研究團隊看到了ABV-1504‘S治療抑鬱症的潛力,決定
開始ABV-1504的臨牀試驗過程。
2013年,ABVC成功完成了ABV-1504的I期臨牀試驗。第一階段研究的主要目標是評估ABV-1504的安全性。在研究期間,根據體檢、生命體徵、實驗室數據、心電圖、哥倫比亞自殺嚴重程度評定量表評估結果和一些不良事件對安全終點進行評估。我們於2012年10月30日開始在臺灣招募健康的
人作為第一階段試驗的受試者。在第一階段試驗中,我們在臺北退伍軍人總醫院篩選了85名健康志願者,最終招募了30人作為試驗對象。我們將受試者分為四個隊列組,分別給每個隊列組的受試者口服ABV-1504膠囊380 mg、1140 mg、2280 mg和3800 mg。BioLite
第一次訪問第一個主題是在2012年11月13日,最後一次訪問主題是在2013年7月5日。在上述期間,沒有受試者發生嚴重不良事件,也沒有因任何不良事件而終止試驗。在整個治療期間,ABVC沒有觀察到任何具有臨牀意義的體格檢查、生命體徵、心電圖、實驗室測量和C-SSRS。然而,ABVC觀察到以下輕微的不良反應:在7名受試者的單劑380 mg隊列中,2名受試者有胃脹和1名便祕;在單劑2,280 mg的受試者中,1名受試者有嗜睡和1名口腔潰瘍受試者。相比之下,在由7名受試者組成的安慰劑組中,有2名受試者有嗜睡和1名受試者有口腔炎潰瘍。在整個試驗期間,ABVC沒有觀察到任何自殺或行為。ABV-1504‘S I期臨牀試驗結果表明,健康受試者口服ABV-1504在380-3800 mg劑量範圍內是安全和耐受性良好的。
ABVc於2014年3月獲得FDA的IND批准繼續進行ABV-1504的第二階段臨牀試驗,並於2014年6月獲得臺灣FDA對其第二階段試驗的IND批准。在第二階段試驗中,BioLite對72名MDD患者(試驗對象)進行了隨機、雙盲、安慰劑對照組研究,主要根據蒙哥馬利-奧斯伯格抑鬱評定量表(MADRS)評估ABV-1504‘S的療效和安全性。ABVc Via BioLite於2015年3月開始在臺北退伍軍人總醫院、林口長庚醫院、臺北市醫院鬆德分院、三軍總醫院、萬方醫院招募第二階段受試者,並開始在斯坦福抑鬱症研究診所招募MDD患者。前五個地點在臺灣,最後一個在美國。第二階段試驗的主要終點是看到受試者的MADRS總分在前六週內與安慰劑受試者的基線分數相比的變化。第二階段試驗的第二階段目標是評估ABV-1504在其他評定量表上的療效和安全性,次要終點為:(I)在第二週至第七週內顯示MADRS總分與基線分數的變化,以及(Ii)在第二、第四、第六週和第七週。
ABVC計劃在第二、第四、第六和第七週測量部分應答者(MADRS總分較基線下降25%至50%的受試者)和應答者(MADRS總分較基線下降50%或以上的受試者)的百分比。此外,ABVC打算根據安全評估和哥倫比亞自殺嚴重程度評定量表監測受試者從篩查階段到每個受試者最後一次探視的表現,並分析接受ABV-1504治療的受試者和安慰劑組在第二、第四、第六和第七週接受ABV-1504治療的受試者和安慰劑組的MADRS、HAM-D-17、HAM-A、DSS、CGI和哥倫比亞自殺嚴重程度評定量表得分的差異。
2019年5月23日,該公司公佈了ABV-1504的第二階段臨牀研究結果。臨牀研究結果表明,ABV-1504的活性藥物成分PDC-1421達到了II期臨牀試驗預定的主要終點,並顯著改善了MDD的症狀。第二階段臨牀研究是一項隨機、雙盲、安慰劑對照的多中心試驗,其中60名確診為中重度MDD的成年患者接受PDC-1421低劑量(380 Mg)或高劑量(2x380 Mg)的治療,與安慰劑相比,每天三次,持續六週。PDC-1421大劑量(2 x 380毫克)達到了預先指定的主要終點,通過意向治療(ITT)分析,蒙哥馬利-奧斯伯格抑鬱評定量表(MADRS)總分顯著降低了13.2分,從基線開始的6周治療期(總體治療效果)平均下降了13.2分,而安慰劑組下降了9.2分。按方案(PP)分析,PDC-1421對MDD的療效呈劑量依賴性,高劑量(2×380毫克)使MADRS總分較基線降低13.4分,低劑量(380毫克)使MADRS總分減少10.4分,而安慰劑組為8.6分。根據上述試驗結果,該公司已決定將大劑量配方用於ABV-1504的第三階段臨牀試驗。
| |
2. |
ABV-1505治療注意缺陷多動障礙(ADHD) |
我們從ABV-1504的相同API
開發了ADHD指示。此外,ABV-1505與ABV-1504具有相似的藥物作用機制,因為ABV-1505顯示出通過抑制去甲腎上腺素的重吸收來增加人類神經系統中去甲腎上腺素水平的潛力。由於ABV-1505‘S與ABV-1504有足夠的相似性,2016年1月,FDA根據其臨牀前研究和ABV-1504的一期試驗結果,批准了我們IND進行ABV-1505’S二期臨牀試驗的申請。
對於ADHD第二階段試驗,ABVC計劃在美國和臺灣招募最多105名ADHD患者作為試驗對象,ABVC打算向這些患者服用ABV-1505口服膠囊。ABVc設計了一項隨機、雙盲劑量遞增研究,與安慰劑對照組一起評估ABV-1505的療效和安全性,主要是對照ADHD評定量表-IV(“ADHD-RS-IV”)。第二階段試驗的主要終點是在長達八週的時間內,ADHD-RS-IV在各自基線分數的基礎上提高40%或更高。次要目標是確定ABV-1505在具有次要終點的其他評定量表上的療效和安全性
(I)從Conners的成人ADHD評定量表-自我報告中各自的基線分數改善ADHD症狀的總評分:簡寫版本(“CAARS-S:S”)18項,最多治療8周;和(Ii)在臨牀總體印象-ADHD-嚴重程度(“CGI-ADHD-S”)和臨牀總體印象-ADHD-改善(“CGI-ADHD-I”)兩個方面從受試者各自的基線分數獲得2分或更低的成績。加州大學舊金山分校(“UCSF”)
啟動了名為“PDC-1421治療成人注意缺陷多動障礙(ADHD)患者的II期耐受性和有效性研究”的第二階段第一部分臨牀試驗。第一部分,2020年1月14日。第一部分試驗是一項單中心、開放標籤、劑量遞增評估,在六個受試者中進行兩個劑量水平。最初對6名受試者進行安全性和有效性評估,低劑量(1粒PDC-1421膠囊,每天三次,TID),共28天。在第28天對進入高劑量(2粒TID)的
進行安全檢查點評估。通過檢查點的受試者接受為期28天的大劑量(2粒PDC-1421 TID)的安全性和有效性評估。2020年7月15日,最後一位患者最後一次就診(LPLV)標誌着
治療成人ADHD的ABV-1505第二階段第一部分臨牀試驗完成了最後一步。2020年10月24日,發佈了ABV-1505第二階段第一部分臨牀試驗的完整臨牀研究報告(CSR)。研究結果表明,PDC-1421膠囊在6例成人患者的治療和隨訪期內安全、耐受性好、有效。對於主要終點,從基線到治療8周,ITT組和PP組ADHD-RS-IV評分的改善百分比分別為83.3%(N=5)和80.0%(N=4)。在ADHD-RS-IV測試分數中,低劑量和高劑量的PDC-1421膠囊都通過了所需的40%的人羣,從而達到了主要終點。總體而言,這項研究的結果證明瞭PDC-1421的治療價值,支持ABV-1505治療成人ADHD的第二階段第二部分臨牀開發。
第二階段研究第二部分的臨牀方案為“PDC-1421治療患有注意力缺陷多動障礙(ADHD)的成人患者的第二階段耐受性和有效性研究,第二部分”是一項隨機、雙盲、安慰劑對照、平行的三組研究,最多可納入99名受試者。這項研究從2022年4月開始在臺灣的五個醫療中心開始。加州大學舊金山分校的網站是在第2年啟動的發送2023年的第四季度。這項研究的登記對象已達到2023年12月進行中期分析(69人)的人數,目前正在進行研究的中期分析。
我們從與ABV-1504相同的活性藥物成分中開發了一種治療癌症患者抑鬱的方法。ABV-1601與ABV-1504具有相似的藥物作用機制,ABV-1601顯示出通過抑制去甲腎上腺素的重吸收來增加人類神經系統中去甲腎上腺素水平的潛力。由於ABV-1601‘S與ABV-1504相似,食品和藥物管理局於2018年12月批准了我們的ABV-1601-001臨牀方案,其IND與ABV-1504(IND 112567)相同。
對於ABV-1601的第二階段試驗,ABVC計劃招募最多54名患有抑鬱症的癌症患者
,ABVC打算向這些患者提供ABV-1601口服膠囊。ABVc正在聘請美國錫達斯-西奈醫學中心的首席研究員,該中心設計了一項隨機、雙盲劑量遞增研究,並與對照對照組進行了比較,以評估ABV-1601的療效和安全性。主要針對蒙哥馬利-奧斯伯格抑鬱量表(MADRS)總分。第二階段試驗的主要終點是MADRS、醫院焦慮和抑鬱量表(HADS)、子量表(HADS-A和HADS-D)、服用PDC-1421的患者的臨牀總體印象量表(CGI)總分與對照組進行了比較。截至本文發佈日期,Cedars-Sinai醫學中心IRB委員會已經批准了第二階段臨牀方案的第一部分,該部分
是一項開放試驗。這項研究將於2024年啟動。
| 1. | ABV—1702 治療骨髓增生異常綜合徵(MDS) |
ABVc在2016年7月獲得美國食品和藥物管理局的IND批准後,開始了ABV-1702‘S第二階段臨牀試驗的準備工作。ABVC計劃在美國招募52名被診斷患有IPSS INT-1、IPSS INT-2或高危MDS或CMML的受試者,並可能將阿扎替丁作為受試者
處方的一部分。阿扎西丁是FDA批准的用於治療MDS的藥物。ABVc打算將ABV-1702口服液與阿扎替丁一起服用。第二階段試驗分為兩個部分,第一部分是確定ABV-1702與氮雜胞苷聯合使用的安全性和推薦劑量水平(“RDL”),第二部分是確定在已建立的建議劑量水平下ABV-1702是否減少了受試者呼吸系統中的殺菌和真菌感染。第一部分第二階段試驗的主要終點是通過測量ABV-1702‘S的禁用毒性來評估給予氮雜替丁的ABV-1702的安全性和緩解期分佈。第二階段第一部分的次要終點將確定在這種ABV-1702-氮雜替丁聯合治療下受試者的安全性、第一次服藥(第1天)後首次感染的時間、治療要求和感染持續時間的減少、免疫反應的增強、應答率的提高、進展、
和存活率。第二階段第二部分的主要目的是確定與對照組相比,在已建立的RDL下,ABV-1702是否降低了受試者呼吸系統中的細菌和真菌感染風險
與對照組相比,感染髮生率和因感染住院的發生率/頻率
。第二階段第二階段的次要終點是確定安全性、第一劑阿扎西丁治療週期(第一天)後首次感染的時間、所需劑量和感染持續時間的減少、免疫反應的增強、受試者在試驗條件下的應答率、進展和存活率的提高。
2016年4月,BioLite向FDA提交了一封信,迴應FDA的詢問,提供了有關擬議的第二階段試驗的更多信息。
公司預計將於2024年第四季度開始ABV—1702的II期臨牀試驗 並正在積極尋找合格的主要研究者和適當的研究地點,以
因此,研究的時間不能得到保證。
ABVc從Maitake提取液中開發了一種治療胰腺癌的新適應症,命名為ABV-1703,並將其授權給Rgene,以供其向FDA申請IND
。2017年8月25日,ABV-1703‘S二期試驗獲得美國食品藥品監督管理局批准。根據ABVC-Rgene共同開發協議,ABVC負責協調和進行ABV-1703的全球臨牀試驗,Rgene負責準備與FDA相關的申請。截至本文發佈之日,我們正在聘請美國錫達斯-西奈醫療中心進行第二階段臨牀試驗,並計劃在2023年第三季度啟動第二階段試驗。我們計劃在美國開始臨牀試驗後,將ABV-1703‘S二期臨牀試驗提交給臺灣FDA。
| 3. | ABV-1501三陰性乳腺癌--三陰性乳腺癌的綜合治療 |
| ● | ABV-1501是在BLI-1401-2的基礎上發展而來的,其有效藥物成分為Yukiguni Maitake
提取物404。紀念斯隆-凱特琳癌症中心(“MSKCC”)進行了灰樹花多糖提取物(灰樹菇)的I期臨牀試驗,該提取物
非常類似於雨果香提取物404。第一階段試驗的重點是灰樹花提取物對乳腺癌患者的免疫學作用。I期試驗的結果表明,口服舞菇多糖提取物與外周血液中可測得的免疫刺激和抑制作用有關。 |
| ● | 我們參照MSKCC maitake研究向美國FDA提出的第二階段臨牀試驗的ABV-1501研究新藥(“IND”)申請於2016年3月獲得美國FDA的第二階段IND批准。 |
| ● |
與BHK合作,向臺灣FDA(“TFDA”)提交臨牀試驗申請
由於
缺乏資金。 |
我們的合作協議
| I. | ABV-1701玻璃體替代玻璃體手術及與BioFirst的合作協議 |
2017年7月24日,我們的
全資子公司之一BriVision與BioFirst簽訂了一份合作協議(“BioFirst協議”),根據該協議,BioFirst授予BriVision全球許可,共同開發用於醫療目的的BFC—1401玻璃體切除術替代品(“BFC—1401”)
。BioFirst是本公司的關聯方,因為BioFirst和YuanGene Corporation(“YuanGene”)(本公司的控股股東)處於共同控制之下,均受YuanGene的控股受益股東
控制。
根據BioFirst協議,我們將與BioFirst共同開發BFC-1401或ABV-1701並將其商業化,並有義務在2018年9月30日或之前分兩期以現金或BriVision普通股的形式向BioFirst支付3,000,000美元。在簽署BioFirst協議時,將預付300,000美元,相當於根據合作協議應支付的總付款的10%。
當ABV-1701被再許可或商業化時,BriVision有權獲得未來許可淨收入或銷售淨利潤的50%。
2019年6月30日,公司與BioFirst簽訂了股票購買協議(“購買協議”),根據該協議,公司將向BioFirst發行428,571股公司普通股,代價為
公司就BioFirst合作協議欠BioFirst的3,000,000美元。有關BioFirst協議和購買
協議的更多信息,請參閲2017年7月24日和2019年7月12日提交的最新8-K表格報告。
2016年11月7日,BioFirst準備並提交的I期臨牀試驗申請
獲得澳大利亞人類研究倫理委員會(HREC)的批准,
並於2016年11月14日獲得澳大利亞治療商品管理局(TGA)的批准。
我們在悉尼視網膜診所和位於澳大利亞悉尼的診所Day Surgery成功完成了ABV-1701的I期臨牀試驗。這是第一階段臨牀試驗的唯一地點。審判於2016年11月17日開始,2018年7月結束,取得積極成果。該方案的標題為“Vitargus治療視網膜脱離的I期、單中心、安全性和耐受性研究”。
這項I期臨牀試驗的主要終點是評估玻璃體內注射Vitargus作為玻璃體替代物在玻璃體手術治療視網膜脱離中的安全性和耐受性。玻璃體內是藥物或其他物質的一種給藥途徑,其中物質被輸送到眼睛中。這項I期臨牀試驗的次要終點是在第90天評估視網膜附着和Virtag us的退化,並評估玻璃體切除手術後的最佳矯正視力(“BVCA”)。BVCA指的是一個人所能實現的最好的視力。HREC需要主端點和第二端點,以評估我們的I期臨牀試驗應用。在這項試驗中,我們總共招募了10名患者。2016年11月17日,我們獲得了數據和安全監測委員會對第一個科目的批准,此後又錄取了9個科目。在這項試驗中,將Vitargus注射到玻璃體切除眼的玻璃體腔內,玻璃體切割術後將玻璃體凝膠從玻璃體腔中取出。2020年8月24日,ABV-1701 I期臨牀試驗的完整臨牀研究報告(CSR)發佈。研究結果表明,ABV-1701(Vitargus)作為玻璃體替代品具有良好的耐受性,對眼組織沒有任何明顯的毒性。
此外,沒有跡象表明Vitargus的總體安全風險增加。在療效方面,參與者的視力有了顯著的改善。Vitargus的光學特性使患者能夠清楚地看到眼底,並便於在手術後立即對眼底進行可視化。此外,由於Vitargus是一種附着在視網膜上的穩定的半固態凝膠,它保持了它的位置,而不需要患者在手術後保持臉朝下。
ABV-1701,Vitargus®進行玻璃體切割手術,第二階段研究將於2月開始發送2023年的第四季度。澳大利亞和泰國共有四(4)個研究地點加入了這項多國家和多地點的臨牀研究。該公司正在通過新一批研究產品對Vitargus產品進行改進。
2017年5月26日,美國BriVision
Corporation與元基因公司(“Rgene”)(“Rgene”)訂立共同開發協議(“共同開發協議”),由元基因公司的控股受益人股東與本公司共同控制關聯方。根據聯合開發協議,BriVision和Rgene同意共同開發ABV-1507 HER2/neu陽性乳腺癌聯合療法、ABV-17胰腺癌聯合療法和ABV-1527卵巢癌聯合療法,並將其商業化。根據合作開發協議的條款,Rgene須於2017年8月15日前以現金或等值的Rgene股票向本公司支付3,000,000美元。這筆款項是對BriVision過去的研究工作和BriVision在共同開發協議簽署之前所做貢獻的補償,與BriVision和Rgene在本聯合開發協議中做出的任何未來承諾無關。除3,000,000美元外,本公司有權獲得Rgene未來淨許可收入或淨銷售利潤(如果有的話)的50%,任何開發成本將由BriVision和Rgene平分。
截至2017年6月1日,公司已將所有研究、技術、數據和開發數據交付給Rgene。由於Rgene與本公司均為關聯方,並由元基因公司及本公司的控股受益人股東共同控制
,本公司已於截至2017年9月30日止年度將與共同開發協議有關的3,000,000美元全數入賬為額外實收資本。在截至2017年12月31日的年度內,公司收到現金450,000美元。2018年12月24日,公司以新發行的Rgene普通股的形式收到餘額2,550,000美元,價格為新臺幣50元(約相當於每股1.6美元),
總計1,530,000股,佔截至2018年12月31日的權益法長期投資。在截至2018年12月31日的年度內,公司確認了549美元的投資虧損。2018年12月31日,公司根據公司對減值嚴重程度和持續時間的評估,以及對被投資方經營業績、市場狀況和監管或經濟環境的不利變化、Rgene經營結構的變化、額外資金需求以及Rgene維持業務的能力的定性和定量分析,決定完全
註銷這項投資。
所有已啟動的項目將由公司和Rgene管理和支持。
本公司與Rgene於2020年11月10日簽署了聯合開發協議修正案,據此,雙方同意刪除AB-1507 HER2/neu陽性乳腺癌聯合治療和AB 1527卵巢癌聯合治療,並在待共同開發和商業化的產品中增加ABV-1519 EGFR陽性非小細胞肺癌聯合治療和ABV-1526結腸癌/直腸癌聯合治療。
聯合開發協議的其他條款仍然有效。
2022年6月10日,公司擴大了與Rgene的共同開發合作伙伴關係。BioKey與Rgene簽訂了臨牀開發服務協議(“服務協議”)
,以指導某些Rgene藥物產品,用於治療非小細胞肺癌(NSCLC)的RGC-1501,用於治療胰腺癌的RGC-1502和用於治療結直腸癌患者的RGC 1503,通過完成符合美國FDA IND法規要求的第二階段臨牀研究(“Rgene研究”)。
根據《服務協議》的條款,
BioKey有資格在3年內獲得總計300萬美元的付款,每筆付款金額將由
在協議期間獲得的某些監管里程碑來確定。通過過去5年的一系列交易,本公司
與Rgene共同開發了服務協議涵蓋的三種藥物產品,使本公司擁有Rgene 31.62%
的股份。
作為Rgene研究的一部分,
公司同意向Rgene提供100萬美元貸款,Rgene為此向公司提供了5%的營運資金可轉換貸款(
“説明”)。如果票據完全轉換,公司將額外擁有Rgene 6.4%的股份。預計本公司將於2023年第一季度前以現金或轉換Rgene股份的方式從關聯方獲得未償還貸款。本公司可隨時按(I)相當於每股1.00美元的固定換股價格或(Ii)當時最新發行的股票價格的20%折扣(以較低者為準),將票據轉換為Rgene的普通股股份;換股價格將按附註所載
作出調整。服務協議將一直有效到最後一項專利到期之日,並自動續期5年,除非任何一方提前6個月書面通知終止。任何一方均可在30天內發出書面通知,以此為理由終止服務協議。
Rgene已進一步同意從2022年7月1日起向公司提供在Rgene董事會的席位,直至全部償還貸款。本公司已提名姜博士、首席戰略官和董事擔任該職位;江博士也是本公司最大的股東之一,持有本公司12.8%的股份。有關服務協議和説明的更多信息,請參閲2022年6月21日提交的Form 8-K的當前報告
。
BLEX 404是一種在《服務協議》涵蓋的臨牀開發中的新藥,它是從食用菌Maitake蘑菇(灰樹菇)中提取的。在紀念斯隆凱特琳癌症中心(MSKCC)對乳腺癌和骨髓增生異常綜合徵(MDS)患者進行的兩項I/II期臨牀研究中,已經證明瞭它的免疫學效果和安全性。
市場分銷戰略
我們主要專注於開發用於診斷、治癒、緩解或治療人類疾病的植物藥物。與我們的戰略合作伙伴一起,我們計劃一旦候選藥物符合當地政府對藥品和食品的監管規定,我們將在國際上營銷、分銷和銷售我們的藥物產品。目前,許多國家遵循歐洲藥品公司發佈的《人用藥品註冊技術要求國際協調理事會》(“ICH”)指南,為日本、美國和歐洲的藥品開發和新藥商業化提供質量和安全指南。我們所有的候選藥物首先通過美國FDA的新藥開發流程,然後從我們計劃分銷這些候選藥物的司法管轄區內相當於FDA的監管機構那裏尋求監管批准
。
知識產權
新的候選藥物依賴於或成為後續專利和專利申請的主題。
| 不是的。 |
|
狀態 |
|
專利編號
|
|
專利
開始
日期 |
|
專利
過期
日期 |
|
專利名稱
|
|
領土 |
|
專利
所有者(1)(2) |
| 1 |
|
已批准 |
|
DE202007003503 U1 |
|
8/23/2007 |
|
9/20/2026 |
|
新的聚半乳糖苷及其作為抗抑鬱藥的用途 劑 |
|
德國 |
|
MPITDC |
| 2 |
|
已批准 |
|
7531519 |
|
5/12/2009 |
|
9/20/2026 |
|
新的聚半乳糖苷及其作為抗抑鬱藥的用途 劑 |
|
美國 |
|
MPITDC |
| 3 |
|
已批准 |
|
4620652 |
|
11/20/2006 |
|
11/19/2026 |
|
新的聚半乳糖苷及其作為抗抑鬱藥的用途 劑 |
|
日本 |
|
MPITDC |
| 4 |
|
已批准 |
|
I 314453 |
|
9/21/2006 |
|
9/20/2026 |
|
新的聚半乳糖苷及其作為抗抑鬱藥的用途 劑 |
|
臺灣 |
|
MPITDC |
| 5 |
|
已批准 |
|
I389713 |
|
3/21/2013 |
|
10/13/2030 |
|
交聯氧化透明質酸用作
玻璃替代物 (3) |
|
臺灣 |
|
NHRI |
| 6 |
|
已批准 |
|
美國8197849 B2 |
|
6/12/2012 |
|
8/30/2030 |
|
交聯氧化透明質酸用作
玻璃替代物 |
|
美國 |
|
NHRI |
| 7 |
|
已批准 |
|
AU 2011/215775 B2 |
|
4/17/2014 |
|
2/9/2031 |
|
交聯氧化透明質酸用作
玻璃替代物 |
|
澳大利亞 |
|
NHRI |
| 8 |
|
已批准 |
|
KR 10-1428898 |
|
8/4/2014 |
|
2/9/2031 |
|
交聯氧化透明質酸用作
玻璃替代物 |
|
韓國 |
|
NHRI |
| 9 |
|
已批准 |
|
CA 2786911(C) |
|
10/6/2015 |
|
2/10/2031 |
|
交聯氧化透明質酸用作
玻璃替代物 |
|
加拿大 |
|
NHRI |
| 10 |
|
已批准 |
|
WO2011100469 A1 |
|
不適用(4) |
|
不適用(4) |
|
交聯氧化透明質酸用作
玻璃替代物 |
|
% |
|
NHRI |
| 11 |
|
已批准 |
|
第2534200集 |
|
4/8/2015 |
|
2/9/2031 |
|
交聯氧化透明質酸用作
玻璃替代物 |
|
歐洲聯盟(德國、英國、法國、
瑞士、西班牙、意大利) |
|
NHRI |
| 12 |
|
已批准 |
|
特發第
5885349號 |
|
2/9/2011 |
|
2/9/2031 |
|
交聯氧化透明質酸用作
玻璃替代物 |
|
日本 |
|
NHRI |
| 13 |
|
已批准 |
|
ZL 201180005494.7 |
|
12/24/2014 |
|
2/9/2031 |
|
交聯氧化透明質酸用作
玻璃替代物(3) |
|
中國 |
|
NHRI |
| 14 |
|
已批准 |
|
香港1178188 |
|
3/6/2015 |
|
6/21/2030 |
|
交聯氧化透明質酸用作
玻璃替代物(3) |
|
香港(5) |
|
NHRI |
| 15 |
|
已批准 |
|
美國16/936,032 |
|
9/4/2020 |
|
9/4/2040 |
|
遠志提取物用於治療重度抑鬱症
障礙 |
|
我們 |
|
BioLite |
| 16 |
|
已批准 |
|
TW I821593 |
|
11/1/2023 |
|
7/22/2040 |
|
遠志提取物用於治療重度抑鬱症
障礙 |
|
臺灣 |
|
BioLite |
| 17 |
|
已批准 |
|
US17/120,965 |
|
12/20/2020 |
|
12/20/2040 |
|
遠志提取物用於治療注意力
缺陷多動障礙 |
|
美國 |
|
BioLite |
| 18 |
|
已批准 |
|
TW 110106546 |
|
2/24/2021 |
|
2/24/2041 |
|
遠志提取物用於治療注意力
缺陷多動障礙 |
|
臺灣 |
|
BioLite |
| 19 |
|
已批准 |
|
TW I792427 |
|
02/11/2023 |
|
07/19/2041 |
|
保存角膜組織的保存液 |
|
臺灣 |
|
NHRI |
| 20 |
|
已批准 |
|
AU2021314052B2 |
|
04/09/2024 |
|
04/09/2041 |
|
遠志提取物用於治療
重性抑鬱障礙 |
|
澳大利亞 |
|
BioLite |
| 21 |
|
套用 |
|
202180001626. 2 |
|
|
|
|
|
遠志提取物用於治療重度抑鬱症
障礙 |
|
中國 |
|
|
| 22 |
|
套用 |
|
我的工作 2023502736 |
|
|
|
|
|
遠志提取物用於治療重度抑鬱症
障礙 |
|
日本 |
|
|
| 23 |
|
套用 |
|
21 846 424.6 |
|
|
|
|
|
遠志提取物用於治療重度抑鬱症
障礙 |
|
歐洲 |
|
|
| 24 |
|
套用 |
|
110106546 |
|
|
|
|
|
遠志提取物治療注意力缺陷和多動障礙 |
|
臺灣 |
|
|
| 25 |
|
套用 |
|
202180001615. 4 |
|
|
|
|
|
遠志提取物治療注意力缺陷和多動障礙 |
|
中國 |
|
|
| 26 |
|
套用 |
|
我的工作 2023536203 |
|
|
|
|
|
遠志提取物治療注意力缺陷和多動障礙 |
|
日本 |
|
|
| 27 |
|
套用 |
|
21 907 345.9 |
|
|
|
|
|
遠志提取物治療注意力缺陷和多動障礙 |
|
歐洲 |
|
|
| 28 |
|
套用 |
|
2021403197 |
|
|
|
|
|
遠志提取物治療注意力缺陷和多動障礙 |
|
澳大利亞 |
|
|
| (1) |
“MPITDC”
代表臺灣醫藥產業技術與發展中心。 |
| (3) |
專利名稱被翻譯成英文,原始專利名稱寫為“交聯氧化透明質酸作為眼球玻璃體之替代物”。 |
| (4) |
PTC項下專利的開始日期和到期日期以提交專利申請的特定參與司法管轄區的法律為準。我們隨後已將此類專利提交給上文第22號所列的司法管轄區。 |
| (5) |
國家人權機構獲得了
根據國家知識產權授予的專利(此處列為第24號)的註冊,在香港註冊的標準專利
中華人民共和國辦事處。 |
公司歷史和結構
ABVc於2002年2月6日根據內華達州法律註冊成立,擁有三家全資子公司:BriVision、BioLite Holding,Inc.和BioKey,Inc.BriVision於2015年7月在特拉華州註冊成立,目前在北美從事醫藥產品開發業務。
BioLite Holding於2016年7月27日根據內華達州法律註冊成立,授權持有5億股,面值0.0001美元。其主要子公司包括於2016年9月13日在英屬維爾京羣島註冊成立的BioLite BVI,Inc.(“BioLite BVI”)和成立於2006年2月的臺灣公司BioLite Inc.(“BioLite
臺灣”)。BioLite臺灣公司從事新藥研發已有超過12年的歷史。根據股份購買/交換協議(“股份購買/交換協議”),BioLite臺灣的若干股東以BioLite臺灣約73%的股權證券
交換BioLite Holding的普通股。因此,BioLite Holding通過BioLite BVI擁有BioLite臺灣約73%的股份。未加入本股份購買/交換協議的其他股東保留其在BioLite臺灣的股權。
BioKey於2000年11月20日在加利福尼亞州成立,該公司最初選擇專注於開發仿製藥,以抓住蓬勃發展的行業的機遇。
合併於2019年2月8日完成後,BioLite和BioKey成為ABVC的兩家全資子公司。
2023年11月,公司及其
子公司BioLite,Inc.(“BioLite”)各自與AiBtl BioPharma Inc.簽訂了多年期全球授權協議。
(“AIBL”)和BioLite的CNS藥物適應症為MDD(嚴重抑鬱症)和ADHD(注意力缺陷多動障礙)(“許可產品”)。許可證涵蓋許可產品的臨牀試驗、
註冊、製造、供應和分銷權。雙方決心在
許可產品的全球開發方面進行合作。雙方還在努力加強新藥開發和業務合作,包括技術、
互操作性和標準開發。根據各自的協議,ABVC和BioLite各自以每股10美元的價格獲得2300萬股AIBL股票
,如果達到某些里程碑,則各自可獲得350萬美元和相當於淨銷售額5%的特許權使用費,
最高可達1億美元。發行股份後,AIBL成為ABVC的附屬公司。
以下圖表説明了ABVC的公司結構:
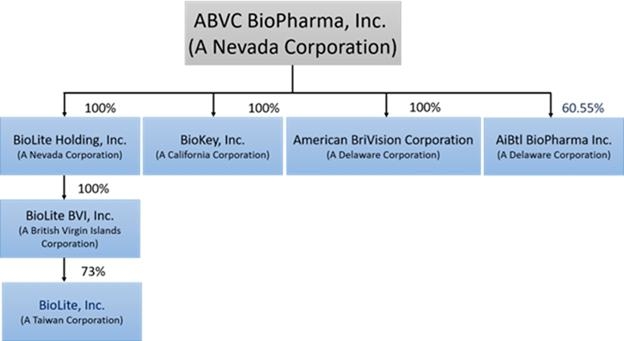
自2022年3月5日起,公司董事會批准修訂公司章程,刪除允許董事累計投票的第2.8條
,因為我們的公司章程明確禁止累計投票。由於我們的《公司章程》第
條未另有規定,董事應根據內華達州修訂後的《章程》的規定,在選舉中以多數票選出。
自2024年3月14日起,公司
董事會批准修訂公司章程,以修訂公司章程第2.8條,以修訂確定股東大會法定人數所需的股份數量
。該修正案將法定人數要求從多數改為有權就某一事項投票的33—1/3%
。
競爭
醫療保健行業競爭激烈
,隨着研究人員更多地瞭解疾病並開發新技術和治療方法,該行業將面臨重大而快速的技術變革。
我們行業中的重要競爭因素包括產品功效和安全性;組織技術的質量和廣度;組織員工的技能及其招聘和留住關鍵員工的能力;監管批准的時間和範圍;產品的平均售價;原材料的可用性和合格的製造能力;製造成本;知識產權和專利權及其保護;以及我們獲得合格合作伙伴的能力。市場是否接受我們目前的產品和候選產品取決於許多因素,包括:(I)相對於現有或替代療法或測試的潛在優勢,(Ii)類似類別產品的實際或預期安全性,(Iii)銷售、營銷、分銷能力和分銷能力的有效性,以及(Iv)FDA或外國監管機構提供的任何批准的範圍。
由於與我們可能競爭的其他公司相比,我們是一家小型生物製藥公司
,我們打算將我們的產品授權給規模更大的製藥、專業製藥和仿製藥公司,這些公司擁有財力、技術和人力資源,能夠在我們
所針對的市場中有效競爭。
我們預計,當我們的候選新藥進入市場時,隨着先進技術的出現以及當前品牌產品的仿製藥的推出,我們的許可合作伙伴將
面臨激烈且日益激烈的競爭。最後,針對我們目標的疾病
的新治療方法的開發可能會使我們的產品失去競爭力或過時。不能保證我們的任何候選新藥
將在臨牀上優於或在科學上優於我們競爭對手開發或推出的產品。
下表列出了研究、開發、商業化、分銷或銷售與我們的候選藥物競爭的藥物的一些生物製藥公司,而不是全部。
| 疾病 |
|
藥品名稱 |
|
製藥業
公司 |
|
總部 |
| 重度抑鬱障礙 |
|
欣百達口服液 |
|
禮來股份有限公司 |
|
在……裏面 |
| |
|
來克沙普羅口服 |
|
森林實驗室公司 |
|
新澤西州 |
| |
|
|
|
輝瑞製藥公司。 |
|
CT |
| |
|
|
|
|
|
|
| 注意力缺陷 |
|
Adderall XR |
|
夏爾發展有限責任公司 |
|
體量 |
| 多動症 |
|
利他林 |
|
諾華製藥公司 |
|
新澤西州 |
| |
|
地塞米林 |
|
Amedra製藥有限責任公司 |
|
帕 |
| |
|
|
|
|
|
|
| 骨髓增生異常 |
|
維達扎 |
|
Celgene公司 |
|
新澤西州 |
| 證候 |
|
達克根 |
|
Astex製藥公司 |
|
鈣 |
| |
|
|
|
|
|
|
| 三重陰性乳腺癌 |
|
阿瓦斯丁 |
|
基因泰克公司 |
|
鈣 |
| |
|
艾比特思(西妥昔單抗) |
|
ImClone系統公司 |
|
紐約 |
| |
|
|
|
|
|
|
| 胰腺癌 |
|
Abraxane,Abraxis BioScience LLC |
|
洛杉磯 |
|
鈣 |
| |
|
諾華製藥公司 |
|
斯坦 |
|
瑞士 |
| |
|
|
|
|
|
|
| 治療用的牡荊花 |
|
阿爾康實驗室公司 |
|
沃斯堡 |
|
TX |
| 視網膜脱離或玻璃體出血 |
|
阿卡多布塔 |
|
圖盧茲 |
|
法國 |
政府規章
目前,我們正專注於中樞神經系統、腫瘤/血液學和自身免疫領域的六種候選治療藥物的研究和開發,在我們開始上市之前,必須獲得監管部門的批准。此外,我們的cGMP設施正在接受FDA的審查。下面將討論ABVC當前和未來候選產品的監管審批流程和FDA法規。
藥品審批流程
FDA對藥品的審批程序
在美國,藥品受到FDA的嚴格監管。《聯邦食品、藥品和化粧品法》(以下簡稱《聯邦食品、藥品和化粧品法》)以及其他聯邦和州的法規和條例對藥品的研究、開發、測試、製造、儲存、記錄保存、批准、標籤、促銷和營銷、分銷、批准後的監測和報告、抽樣以及藥品的進出口等進行管理。不遵守適用的美國要求可能會使公司受到各種行政或司法制裁,如FDA拒絕批准待決的NDA、警告信、產品召回、產品扣押、完全或部分暫停生產或分銷、禁令、罰款、民事處罰和刑事起訴。在美國,藥品開發通常涉及在FDA的良好實驗室規範或GLP法規下進行令人滿意的非臨牀、實驗室和動物研究,開發和演示符合FDA規定的當前良好製造要求的製造工藝,包括規範製造、提交和接受IND申請的質量體系,該申請必須在美國開始人體臨牀試驗之前生效,並獲得機構審查委員會或IRBs的批准。在我們計劃進行臨牀試驗以在臨牀試驗中保護人類受試者的福利和權利的每個地點,
臨牀試驗,以確定藥物對於尋求FDA批准的每個適應症的安全性和有效性
,並提交FDA審查和批准NDA。滿足FDA要求通常需要數年時間,實際所需時間可能因產品或疾病的類型、複雜性和新穎性而有很大不同。
臨牀前測試通常包括實驗室對候選產品、其化學成分、配方、穩定性和毒性進行評估,以及某些動物研究以評估其潛在的安全性和有效性。這些臨牀前試驗的結果,連同化學、生產控制和分析數據
和臨牀試驗方案,其中詳細説明瞭試驗的目標、用於監測安全性的參數和要評估的有效性標準,以及其他要求,必須作為IND的一部分提交給FDA,該要求必須在
人體臨牀試驗開始之前生效。整個臨牀試驗及其方案必須符合所謂的良好臨牀實踐或GCP要求。術語GCP用於指代FDA的各種法律法規和國際科學標準,旨在保護患者的權利、健康和安全,定義臨牀試驗贊助商的角色,並確保臨牀試驗數據的完整性
。
IND在FDA收到後30天自動生效
,除非FDA在30天內對計劃進行的試驗提出擔憂或問題,並實施所謂的臨牀暫緩。臨牀前研究通常需要幾年時間才能完成,而且不能保證基於這些研究的IND將變得有效,從而允許臨牀測試開始。除了FDA對IND的審查外,每個希望參與擬議臨牀試驗的醫療站點都必須由獨立的IRB或道德委員會或EC審查和批准該方案。IRB除了考慮其他因素外,還考慮道德因素以及人類受試者的選擇和安全。臨牀試驗必須按照FDA的GCP要求進行。FDA和/或IRB可下令暫時或永久中止臨牀試驗或隨時停止特定的臨牀試驗地點,或對未能遵守相應實體管轄權下的要求施加
其他制裁。
支持NDA上市的臨牀試驗通常分三個連續階段進行,但這些階段可能會重疊。
在第一階段臨牀試驗中,通常將候選產品
引入健康受試者或具有新藥預期使用條件的患者
。試驗的主要目的是評估候選產品的安全性和人體對候選產品的耐受性。I期臨牀試驗通常包括不到50名受試者或患者。
在第二階段試驗期間,對候選產品進行一項或多項探索性試驗,在有限數量的疾病或醫療條件患者中進行研究
以:(I)進一步確定任何可能的副作用和安全風險,(Ii)評估候選產品對特定目標疾病或醫療條件的初步或潛在
療效,以及(Iii)評估劑量耐受性並確定第三階段試驗的最佳劑量。
進行第三階段試驗通常是為了證明臨牀療效,並在擴大的患者羣體中進一步測試安全性,目的是評估候選產品的總體風險-益處關係。第三階段試驗通常旨在達到特定的目標或終點,實現該目標或終點旨在證明候選產品的臨牀療效,併為批准藥物的標籤提供足夠的信息。
FDA自收到保密協議之日起有60天的時間,根據FDA關於申請是否足夠完整以允許進行實質性審查的門檻確定是否接受申請備案。一旦提交的申請被接受備案,FDA就開始進行深入的審查。
FDA已同意在審查NDA時的某些績效目標。大多數標準審評藥品的申請在十個月內進行審查;大多數優先審評藥品的申請在六個月內進行審查。優先審查可適用於FDA確定在治療方面取得重大進展或在沒有適當治療方法的情況下提供治療的藥物。
FDA可將標準審查和優先審查的審查過程再延長三個月,以考慮某些延遲提交的信息,或旨在澄清提交材料中已提供信息的信息。FDA還可以將新藥產品的申請或提出安全性或有效性難題的藥物產品的申請提交給諮詢委員會--通常是包括臨牀醫生和其他專家的小組--進行審查、評估,並就是否應批准申請提出建議。FDA不受諮詢委員會建議的約束,但它通常遵循此類建議。在批准NDA之前,FDA通常會檢查一個或多個臨牀站點,以確保
符合GCP。此外,FDA將檢查製造藥物的一個或多個設施。FDA不會批准該產品,除非符合cGMPs令人滿意,並且NDA包含的數據提供了大量的
證據,證明該藥物在所研究的適應症中是安全有效的。
FDA對保密協議和製造設施進行評估後,會出具批准信或完整的回覆信。一封完整的回覆信通常概述了提交文件中的不足之處,可能需要大量額外的測試或信息,以便FDA重新考慮申請。如果在重新提交保密協議時,且這些缺陷已得到FDA滿意的解決,FDA將簽發批准函。FDA已承諾在兩個月或六個月內審查此類重新提交的申請,具體取決於所包括的信息類型。批准函授權該藥物的商業營銷,並提供特定適應症的具體處方信息。作為NDA批准的條件
,FDA可能需要風險評估和緩解策略或REMS,以幫助確保藥物的益處大於潛在風險。
REMS可以包括藥物指南、醫療保健專業人員的溝通計劃和確保安全使用的要素,或ETASU。ETASU可包括但不限於處方或配藥的特殊培訓或認證、僅在特定情況下的配藥、特殊監控和患者登記簿的使用。對REMS的要求可能會對該藥物的潛在市場和盈利能力產生重大影響。此外,產品審批
可能需要大量的審批後測試和監控,以監控藥物的安全性或有效性。一旦獲得批准,如果沒有遵守監管標準或在初始營銷後發現問題,產品
的批准可能會被撤回。
審批後法規
即使候選產品獲得監管部門的批准,批准通常也僅限於特定的臨牀適應症。此外,即使在獲得監管部門批准後,後續
發現以前未知的產品問題可能會導致限制其使用,甚至完全從市場上召回該產品
。由我們製造或分銷的任何FDA批准的產品均受FDA持續監管,包括記錄保存要求和不良事件或經歷的報告。此外,藥品製造商及其分包商必須向FDA和州政府機構登記其機構,並接受FDA和州政府機構的定期檢查,以確保符合cGMP,這對我們和我們的合同製造商提出了嚴格的程序和文件要求。ABVC不能確定ABVC或其當前或未來的合同製造商或供應商是否能夠遵守cGMPs法規和FDA的其他法規要求。如果不遵守這些要求,可能會導致生產活動全部或部分暫停,FDA未能批准上市,以及撤回、暫停或吊銷上市批准。
如果FDA批准我們的一個或多個候選產品
,ABVC必須提供某些最新的安全性和有效性信息。產品變更,以及生產過程或生產設施的某些變更或其他審批後變更,可能需要FDA額外審查和批准。
藥品的標籤、廣告、促銷、營銷和分銷必須符合FDA和聯邦貿易委員會、
或聯邦貿易委員會的要求,其中包括直接面向消費者的廣告、標籤外促銷、行業贊助的科學和教育活動以及涉及互聯網的促銷活動的標準和法規。FDA和FTC擁有非常廣泛的執法權力,不遵守這些規定可能會受到懲罰,包括髮出警告信,指示我們糾正與監管標準的偏差,並採取執法行動,包括扣押、罰款、禁令和
刑事起訴。
外國監管部門的批准
在美國以外,ABVC是否有能力銷售我們的候選產品,還取決於它是否獲得了相應的外國監管機構的營銷授權,無論是否已獲得FDA的批准。大多數工業化國家的外國監管審批流程
通常包含與ABVC在FDA審批流程中遇到的風險類似的風險。管理進行臨牀試驗和上市授權的要求以及獲得必要批准所需的時間可能因國家/地區而異,
與FDA批准的要求也不同。
在我們銷售、銷售和進口產品的其他國家/地區,包括加拿大,ABVC將受到其他法規的約束。ABVC或其經銷商必須獲得所有必要的批准或許可,才能在這些市場營銷和/或進口我們的產品。
其他監管事項
產品批准後的製造、銷售、推廣和其他活動
除受FDA的監管外,還受許多監管機構的監管,包括在美國的醫療保險和醫療補助服務中心、衞生與公眾服務部的其他部門、藥品監督管理局、消費品安全委員會、聯邦貿易委員會、職業安全與健康管理局、環境保護局以及州和地方政府。在美國,銷售、營銷和科學/教育項目
還必須遵守州和聯邦欺詐和濫用法律。定價和返點計劃必須符合美國1990年《綜合預算調節法》的醫療補助返點要求,以及經《醫療和教育負擔能力調節法》(簡稱ACA)修訂的《醫療改革法》中的最新要求。如果向總務署聯邦供應計劃的授權用户提供產品,則適用其他法律和要求。處理任何受控物質必須
符合美國《受控物質法》和《受控物質進出口法》。產品必須符合美國《防止毒物包裝法》中適用的兒童保護包裝要求。製造、銷售、促銷和其他活動也可能受到聯邦和州消費者保護和不正當競爭法律的約束。
醫藥產品的分銷受其他要求和法規的約束,包括旨在防止未經授權銷售醫藥產品的廣泛記錄保存、許可、存儲和安全要求。
未能遵守監管要求
使公司面臨可能的法律或監管行動。根據具體情況,未能滿足適用的法規要求
可能會導致刑事起訴、罰款、監禁或其他處罰、禁令、召回或扣押產品、完全或部分暫停生產、拒絕或撤回產品批准,或拒絕允許公司簽訂供應合同,包括
政府合同。此外,即使一家公司遵守FDA和其他要求,有關產品安全性或有效性的新信息也可能導致FDA修改或撤回產品批准。禁止或限制銷售或撤回我們銷售的未來產品
可能會對我們的業務產生實質性的不利影響。
法規的變更或現有法規的解釋
可能會影響我們未來的業務,例如,要求:(I)更改我們的製造安排;
(Ii)添加或修改產品標籤;(Iii)召回或停產我們的產品;或(Iv)額外的記錄保存
要求。如果強制實施任何此類變化,可能會對我們的業務運營產生不利影響。
員工
截至2023年12月31日,我們(包括子公司)在美國和臺灣共有19名員工,其中16名為全職員工。
| | |
數量 | |
| 功能區 | |
員工 | |
| 高級管理層 | |
| 5 | |
| 研發 | |
| 11 | |
| 行政管理 | |
| 2 | |
| 會計核算 | |
| 5 | |
| 總計 | |
| 23 | |
ABVC相信,它與員工保持着良好的工作關係。ABVC為其員工提供具有競爭力的福利,包括愉快且有益的工作環境、面向職業的培訓和職業發展機會。ABVC相信其員工緻力於提供一流的服務。ABVC
未發生任何重大勞資糾紛。
法律訴訟
在正常的業務過程中,ABVC及其子公司可能會不時
捲入與其知識產權、產品責任、監管合規和/或其產品的營銷和廣告有關的法律訴訟和索賠,或受到其他法律訴訟和索賠的威脅。
截至本招股説明書日期,ABVC及其子公司沒有捲入或威脅任何法律訴訟和監管程序。
環境
ABVC力求遵守與環境質量有關的所有適用的法律和行政要求。遵守聯邦、州和地方環境法律的支出對ABVC的資本支出、運營結果或競爭地位沒有、也不會產生實質性影響。
屬性
我們的子公司BioLite的實驗室位於新竹生物醫學科技園,地址為美國證券交易委員會20號。臺灣新竹縣302竹北市聖義路2號(R.O.C.)。
2015年1月1日,BioLite臺灣與國家科學園區管理處(新竹市)簽訂租賃協議,租賃位於臺灣新竹縣的兩棟宿舍樓,租期為五年。大樓二樓的總租賃面積約為678平方米(相當於約7,298平方英尺)。租賃空間
約佔大樓總空間的1.9%。2020年1月1日,BioLite臺灣公司將合同延長了
五年。新的到期日為2024年12月31日。在租賃協議期間,租金每年都會以很小的百分比增加。BioLite分別為截至2023年12月31日和2022年12月31日的年度支付了50,572美元和60,104美元的實驗室空間租金費用。
另一家子公司BioKey的總部設在加利福尼亞州弗裏蒙特。BioKey的辦公室租約將於2026年2月28日到期,辦公室佔地約28,186平方英尺。
BioKey的辦公空間由辦公室、研究和生產實驗室以及獲得GMP認證的製造設施組成。
BioKey可以選擇從2026年2月28日起將其在弗裏蒙特的辦公室的租約延長5年,BioKey
可以再執行這一選項5年。截至2023年12月31日、2023年12月31日和2022年12月31日的年度,BioKey的總租金支出分別為353,466美元和328,051美元。
管理
下表列出了截至本招股説明書日期
的每位高管和董事高管的姓名、年齡、職位和任期。
| 名字 |
|
年齡 |
|
標題 |
| 尤金·江 |
|
37 |
|
董事會主席兼首席業務官(“CBO”) |
| 烏塔姆·帕蒂爾博士 |
|
38 |
|
行政總裁(“行政總裁”) |
| 利茲·周 |
|
35 |
|
首席財務官(“CFO”) |
| 宗善博士(T.S.)江 |
|
69 |
|
首席戰略官(首席戰略官)和董事 |
| 曾明江博士 |
|
62 |
|
董事 |
| 江長仁博士 |
|
67 |
|
董事 |
| 野里美·阪本 |
|
52 |
|
獨立董事 |
| 周延新 |
|
33 |
|
獨立董事 |
| 新會苗族 |
|
57 |
|
獨立董事 |
| 奧代拉·吉野信 |
|
73 |
|
獨立董事 |
| 徐車偉 |
|
42 |
|
獨立董事 |
| 舒陵江 |
|
67 |
|
董事 |
| 鍾宇民(Francis) |
|
58 |
|
獨立董事 |
| 金志新(Richard)博士 |
|
74 |
|
首席科學主任(“CSO”) |
下面列出的是截至本招股説明書發佈之日,我們每位董事和高管的某些簡歷信息。
自公司於2015年7月成立以來,董事長姜瑜一直擔任公司首席執行官和總裁,直至2017年9月15日辭職。他仍是董事會主席
。自2019年9月以來,他還擔任我們的CBO,並自2019年以來擔任BioKey,Inc.的CBO。自2015年6月以來,蔣先生還在BioLite Inc.擔任董事;自2012年以來,蔣先生還在BioFirst Corp.擔任董事。自2010年3月以來,他還擔任Genepro投資公司的首席執行官。蔣先生於2017年在臺灣大學獲得PMBA學位,並於2010年在阿靈頓的德克薩斯大學獲得EMBA學位。2009年,蔣先生獲得輔仁天主教大學體育學士學位。
首席執行官Uttam Patil博士於2023年6月21日被任命為公司首席執行官。帕蒂爾博士自2023年5月以來一直擔任該公司子公司BioKey,Inc.的首席運營和科學官;他還在Rgene Corporation(關聯方)工作,從2022年8月至2023年5月,從項目經理晉升為研發經理,
,自2023年5月起擔任研發經理。在此之前,Patil博士於2020年3月至2022年7月在國立師範大學擔任博士後研究員。2019年,Patil博士在韓國為初級化學家舉辦的有機化學研討會上發表了題為《基於核酸基功能化的單壁碳納米管與單鏈DNA雜交》的口頭演講,並因此獲得了“白金獎”。Patil博士擁有國立清華大學的化學博士學位和浦那大學的分析化學碩士學位,以及浦那大學的工業化學學士學位。
周利茲先生於2022年9月4日被任命為公司首席財務官兼首席會計官。他在2021年3月至2022年8月期間擔任公司財務總監。周先生在審計及融資行業擁有超過12年的經驗。他曾在一家家族理財室擔任財務經理,負責管理投資組合,處理財務和運營方面的事務。他還曾在香港一家本地投資公司工作,在香港首次公開招股過程中擔任財務顧問,以及
作為香港上市公司交易的獨立財務顧問準備意見書。周先生畢業於加州大學聖巴巴拉分校,獲文學學士學位,主修商業經濟學,主修會計。
董事首席戰略官蔣子鬆博士自2019年9月起擔任公司首席戰略官。江博士自2021年12月以來一直擔任BioKey,Inc.的首席執行官,自2013年以來一直擔任BioFirst Corp.的董事,並自2010年1月以來一直擔任BioLite,Inc.的子公司BioLite,Inc.的首席執行官兼董事長。在加入BioLite之前,江博士曾在臺灣多家生物科技公司
擔任總裁和/或董事長,包括1998年至2009年的植物健康公司和2008年至2009年的AmCad BioMed公司。此外,江博士還是多個生物技術協會的董事成員,如2006年至2008年的臺灣生物產業組織和2003年至2006年的臺灣中華草藥與生物技術發展協會。1981年至1987年任伊利諾伊大學助理教授,1987至1990年任新澤西州立大學羅格斯分校副教授,1990至1993年任國立臺灣大學、國立成功大學、東海大學等臺灣大學教授。江博士1976年在臺灣國立臺灣大學獲得工程與化學工程學士學位,1981年在美國西北大學獲得碩士和博士學位,2007年在臺灣國立臺灣大學獲得工商管理行政碩士學位(“EMBA”)。作為一名成功的企業家,江博士開發並商業化了pg2 LYO注射劑,這是一種治療癌症相關性疲勞的新藥。1998年至2009年,江天山博士在植物人健康公司擔任總裁,領導項目組開發PG2注射劑。本品是從一種中藥中提取、分離、純化而成。Pg2注射是為那些從嚴重疲勞中恢復困難的癌症患者準備的。在擔任總裁期間,江博士負責監督和管理植物健康公司的研發部、日常企業運營和業務。Pg2 LYO注射劑於2010年獲得臺灣食品藥品監督管理局批准其保密協議,並於2012年進入臺灣市場
。我們相信,江博士為我們的戰略發展和運營提供領導和技術指導。
董事曾明江博士自2017年以來一直擔任BioFirst Corp.的董事,並自2022年8月以來擔任SuperMicro Computer,Inc.的技術董事。江博士於2017年2月至2021年7月在臺灣工業技術研究院擔任技術董事
。在加入工業技術研究院擔任技術董事之前,江博士於2016年11月至2017年1月在本公司擔任首席信息官,愛立信於2013年至2016年擔任工程經理,工業技術研究院於2011年10月至2013年2月擔任董事副院長
。此外,江博士還在其他幾個研究機構工作,包括阿拉斯加大學費爾班克斯分校、國立臺灣大學和中正大學,他對雲計算和互聯網安全有濃厚的研究興趣,
特別是在虛擬化、軟件定義的數據中心、支持SDN的網絡和大數據分析領域。江博士1983年獲得臺灣大學電氣工程理學學士學位,1984年獲得臺灣大學電氣工程理學碩士學位,1988年在芝加哥伊利諾伊大學獲得電氣工程和計算機科學博士學位。曾明江博士為蔣宗山博士之兄弟,蔣宗山博士與其妻子合共擁有獅藝推廣公司80%股權,而獅藝推廣公司則透過獅藝推廣有限公司的全資附屬公司遠基公司持有本公司約69.3%的股權。
蔣昌仁博士,董事,自2013年以來一直擔任BioLite Inc.的董事
,自2015年以來一直擔任BioFirst Corp.的董事。自2016年以來,江醫生一直是尤金婦兒診所兒科的兒科醫生。在此之前,張仁醫生曾於1994年至2009年在臺灣衞生福利部基隆醫院兒科擔任主治醫生。在基隆醫院任職之前,
他在臺灣馬凱紀念醫院兒科、血液科和腫瘤科擔任了三年的主任醫師
直到1994年。蔣昌仁博士於1982年在臺灣臺北醫科大學獲得醫學博士學位(相當於臺灣醫學博士學位),並在馬凱紀念醫院開始他的職業生涯。我們相信,江博士在生物學方面的知識和醫療實踐經驗將使公司受益。
從2016年6月起,董事商家Norimi Sakamoto目前在幕府邁塔克加拿大有限公司提供董事服務。Sakamoto女士在2013年6月至2020年3月期間擔任MyLife Co.,Ltd.的首席執行官。Sakamoto女士於1997年在日本北海道住友株式會社開始了她的職業生涯。Sakamoto女士於1993年在戴維斯和埃爾金斯學院獲得旅遊和旅遊文學學士學位,並於1995年在新奧爾良大學獲得城市研究理學碩士學位。
董事的周延新自2011年以來一直擔任兆豐銀行的金融專家。周女士的職責主要包括客户服務和財務諮詢。
周女士於2010年獲得袁澤大學經濟學院金融與經濟學學士學位。
苗新輝,董事人,2021年8月至2022年5月在越Shan幼稚園擔任櫃枱經理。1988年8月至2021年7月,苗女士在東海大學附中幼兒園分校任幼兒園教師,兼任總務組組長。苗女士於1998年在臺中教育大學獲得教育學士學位。
2019年2月8日,董事大代拉先生被推選為董事董事會成員。他是一位企業家,創建了許多日本農業公司,包括我們的許可合作伙伴Yukiguni Maitake。1983年,Odaira先生成立了Yukiguni Maitake,該公司於1994年在日本上市。2015年,貝恩資本私募股權公司通過收購要約收購了Yukiguni Maitake。除了在前田製作所取得的成功,小原先生自1988年以來一直擔任日本製作所的首席執行官,從1989年起擔任製作所的首席執行官,並自1989年6月起擔任幕府製作所日本株式會社的董事。2015年,Odaira先生創立了兩家新公司,加拿大幕府幕府
Maitake加拿大有限公司和日本Odaira Kinoko研究有限公司。Odaira先生自2016年6月以來一直擔任幕府彌谷加拿大有限公司的首席執行官和董事。奧代拉在2019年2月至2019年4月期間擔任BioLite Inc.的董事顧問。Yoshinobu[br]Odaira於1963年畢業於市澤初中。我們相信,我們將受益於Odaira先生成功的商業經驗。
車維旭,董事,2016年8月起
受僱於中華郵政股份有限公司做文員,之前是一所初中的教師。2004年,Ms.Hsu在東海大學中國文學學院獲得學士學位。
蔣淑玲,董事,自2017年以來一直在多家公司擔任董事,包括BioLite,Inc.和BioFirst Corp,並於2022年開始擔任BioKey,Inc.的董事經理。1978年獲國立臺灣師範大學音樂學院學士學位,1983年獲西北大學音樂學院碩士學位。
鍾宇民,董事,從2018年7月至2022年5月,
是臺灣一家專注於突破性生物醫學技術公司的投資公司Maxpro Ventures的合夥人。在此之前,他於2016年6月至2018年6月在泰安科技擔任副總裁,泰安科技在臺灣是一家生物科技服務公司和生物科技風險投資基金管理公司。鍾先生於1987年獲臺灣大學化學學士學位,2006年獲臺灣大學工商管理碩士學位,1995年獲愛荷華大學藥學博士學位。
重要員工
以下員工不是執行主管,但預計會對我們的業務做出重大貢獻:
金志新博士,CSO。自2017年9月15日起,董事會委任金志新博士為本公司首席財務官。金志新博士,71歲,2017年7月退休。他曾於2016年8月至2017年7月擔任臺灣生物科技公司泰根生物科技有限公司(“泰根”)的顧問,並於2008年7月至2016年8月在臺根擔任高級副總裁副總經理,並於2005年6月至2008年7月在臺根研發部門擔任總裁副總裁。2003年1月至2005年6月,金博士在紐約奧爾巴尼分子研究公司擔任董事助理;2000年1月至2002年12月,金博士在奧爾巴尼分子研究公司藥物化學部擔任董事助理;1997年8月至2000年1月,金博士在奧爾巴尼分子研究公司化學開發部擔任董事助理。金博士於1980年獲猶他大學生物有機化學博士學位,1972年獲國立臺灣師範大學化學學士學位。
家庭關係
除曾明江博士、江宗山博士及江長仁博士為兄弟,江宗山先生為江宗山博士之子,小谷洋行與阪本隆美之婚姻關係及江樹齡博士與江博士之婚姻關係外,本公司各主管人員及董事之間並無家族關係。
法律訴訟
參與某些法律程序
在過去十年中,我們的現任董事、高管、發起人、控制人或被提名者均未:
|
● |
破產申請的標的
該人在破產時或在破產前兩年內是任何業務的普通合夥人或高管,或針對該業務而提出的呈請; |
|
● |
在刑事訴訟中被判有罪或正在接受刑事訴訟(不包括交通違法和其他輕微違法行為); |
|
● |
受任何有管轄權的法院或任何聯邦或州當局的任何命令、判決、
或法令的限制,
永久或暫時禁止、禁止、暫停或以其他方式限制其參與任何類型的業務、證券或銀行活動; |
|
● |
被有管轄權的法院(在民事訴訟中)發現,委員會或商品期貨交易委員會違反了聯邦或州的證券或商品法律。 |
|
● |
任何聯邦或州司法或行政命令、判決、法令或裁決的標的或一方,隨後未被推翻、暫停或撤銷,與涉嫌違反(A)任何聯邦或州證券或商品法律或法規;(B)任何涉及金融機構或保險公司的法律或法規有關,包括但不限於臨時或永久禁令、收回或歸還令、民事罰款或臨時或永久停止令或禁止令;或(C)禁止郵電欺詐或與任何商業實體有關的欺詐的任何法律或法規;或 |
|
● |
任何自律組織(如《交易法》(15 U.S.C.78c(A)(26))第3(A)(26)節所界定的)、任何註冊實體(如《商品交易所法》(7 U.S.C.1(A)(29))第1(A)(29)節所界定的)、或任何同等交易所、協會或任何自律組織(其後未撤銷、暫停或撤銷)的任何制裁或命令的主體或當事方。對其
成員或與成員關聯的人員擁有懲戒權限的實體或組織。 |
除非另有披露,否則我們目前
不是任何重大法律或行政訴訟的一方,也不知道有任何針對我們的未決法律或行政訴訟
。我們可能會不時成為在正常業務過程中產生的各種法律或行政訴訟的一方。
董事獨立自主
納斯達克規則要求董事會的多數成員必須是獨立的。董事會由11名董事組成,其中9名為非管理董事。董事會每年都會審查我們每一位董事與公司之間的任何直接或間接關係的重要性。董事會成員
沒有任何關係或安排需要根據S-K規則第404項進行披露。有關更多信息,請參閲本報告中的“某些
關係和關聯方交易”。基於本次審核,董事會已確定以下
現任董事為納斯達克規則所界定的“獨立董事”:Odaira先生及Chung and Mses。Sakamoto,周和苗。
作為審計和財務委員會、薪酬委員會以及提名和公司治理委員會成員的每個董事都是一個獨立的董事。
董事會委員會
審計委員會。
董事會審計委員會目前由周延新女士(主任委員)、苗新輝女士、Ms.Hsu車偉女士組成。審計委員會的職能包括保留我們的獨立註冊會計師事務所,審查和批准計劃的範圍,
建議的費用安排和公司年度審計的結果,審查公司會計和財務控制的充分性,以及審查公司獨立註冊會計師事務所的獨立性。董事會已
認定周女士、苗女士及Ms.Hsu分別為“獨立董事”(按納斯達克證券市場的上市標準)。
董事會還認定周女士是美國證券交易委員會適用定義
內的“審計委員會財務專家”。審計委員會受董事會批准的書面章程管轄,該章程的副本可在我們的網站www.abvcpharma.com上獲得。我們網站上包含的信息未通過引用併入本報告,也不構成本報告的任何
部分。我們已將網站地址作為事實參考,並不打算將其作為網站的活躍鏈接。
薪酬委員會。薪酬委員會目前由阪本真美女士(理事長)、苗新輝女士和Ms.Hsu車偉組成。薪酬委員會的職能包括批准向我們的高管提供的薪酬,並向
全體董事會建議向我們的董事,包括我們的董事長提供的薪酬。董事會已確定,根據董事證券交易所的上市標準,阪本女士、苗女士及Ms.Hsu各自為“獨立納斯達克”。此外,根據《交易法》第16b-3條的規定,薪酬委員會成員有資格成為“非僱員董事”,根據經修訂的1986年“國內收入法”第162(M)條,他們有資格成為“外部董事”。薪酬委員會受董事會批准的書面章程管轄,該章程的副本可在我們的網站www.abvcpharma.com上獲得。我們網站上包含的信息未通過引用併入本報告,也不構成本報告的任何
部分。我們已將網站地址作為事實參考,並不打算將其作為網站的活躍鏈接。
企業管治與提名委員會。[br}董事會公司管治及提名委員會由小代原先生(主席)、苗信惠女士及Ms.Hsu(董事)組成,根據納斯達克上市標準,彼等均為獨立納斯達克。公司治理和提名委員會負責監督董事會提名人選的遴選工作。公司治理和提名委員會考慮其成員、管理層、股東、投資銀行家和其他人確定的人員。
《董事》提名者評選指南
《公司治理和提名委員會章程》中規定了遴選被提名人的準則,其中一般規定被提名者:
| ● | 在商業、教育或公共服務方面取得顯著或顯著成就的; |
| ● | 是否應
擁有必要的智力、教育和經驗,為董事會作出重大貢獻,並將一系列技能、不同的觀點和背景
帶到董事會的審議中;以及 |
| ● | 應該
具有最高的道德標準,強烈的專業意識和強烈的奉獻精神
為股東的利益服務。 |
公司治理和提名委員會
在評估一個人的董事會成員候選人資格時,將考慮與管理和領導經驗、背景、誠信和專業精神有關的一些資格。提名委員會可能需要某些技能或特質,如財務或會計經驗,以滿足董事會不時出現的特定需求,同時還將考慮其成員的總體經驗和構成,以獲得廣泛和多樣化的董事會成員組合。董事會還將在我們的股東尋求推薦的候選人
參加下一屆年度股東大會(或如果適用的話,特別股東大會)選舉期間,考慮由我們的股東推薦的董事候選人。我們的股東
如果希望提名董事進入董事會,應遵循我們的章程中規定的程序。提名委員會
不區分股東和其他人推薦的提名人選。
董事會領導結構和在風險監督中的作用
我們有兩個不同的人擔任我們的首席執行官和董事長。我們的董事會主要負責代表我們的公司監督我們的風險管理流程。董事會接收並審查管理層、審計師、法律顧問和其他被認為適當的有關我們公司風險評估的定期報告。此外,董事會關注我們公司面臨的最重大風險和我們公司的總體風險管理戰略,並確保我們公司承擔的風險與董事會的風險偏好保持一致。董事會監督公司的風險管理,管理層負責日常風險管理流程。我們相信這種責任分工是應對公司面臨的風險的最有效方法,我們的董事會領導結構支持這種方法。
道德守則
我們通過了一項道德準則,現將其副本作為附件14.1附上。道德準則適用於我們的所有員工、高級管理人員和董事。本守則
構成美國證券交易委員會規則所界定的“道德守則”。代碼副本可從我們的網站
www.abvcpharma.com免費獲取。對適用於我們任何高管的道德守則條款的任何修改或豁免都將根據美國證券交易委員會的規則發佈在我們的網站上。
賠償
無論是我們的公司章程還是公司章程都不能阻止我們在內華達州修訂後的法規(NRS)允許的範圍內對我們的高級職員、董事和代理人進行賠償。
NRS第78.7502條規定,公司應賠償公司的任何董事、高級職員、僱員或代理人因與任何辯護有關而實際和合理地招致的費用,包括律師費,只要公司的董事、高級職員、僱員或代理人在任何訴訟的抗辯中勝訴,訴訟或訴訟程序
涉及第78.7502(1)或78.7502(2)節,或為其中的任何索賠、問題或事項辯護。
由於根據懷俄明州法律,可以允許董事、高級管理人員或控制公司的人員就1933年證券法產生的責任進行賠償,
我們獲悉,根據證券交易委員會的意見,此類賠償違反了證券法中所述的公共政策,
因此不可執行。
高管薪酬
下表列出了我們過去兩個已完成的財政年度中的每一個,在過去兩個財政年度中擔任首席執行官的人員以及在過去兩個財政年度中收入超過100,000美元的其他最高薪酬執行官的薪酬總額(統稱為“指定執行官”)。下表反映了指定
執行官的薪酬。
| 名稱和主要職位 | |
年 | |
薪金(元) | | |
獎金
($) | | |
股票大獎
($) | | |
期權大獎
($) (7) | | |
非股權激勵計劃薪酬
($) | | |
退休金的變動
價值和
不合格遞延薪酬收入
($) | | |
所有其他補償
($) | | |
總計
($) | |
| | |
| |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| |
| 霍華德·東(1) | |
2022 | |
| 200,000 | | |
| - | | |
| - | | |
| 248,386 | | |
| - | | |
| - | | |
| - | | |
| 448,386 | |
| | |
2023 | |
| 95,000 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 95,000 | |
| | |
| |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 利茲周星馳(2) | |
2022 | |
| 130,000 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 130,000 | |
| | |
2023 | |
| 180,000 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 180,000 | |
| | |
| |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 江宗山(3) | |
2022 | |
| 200,000 | | |
| - | | |
| - | | |
| 248,386 | | |
| - | | |
| - | | |
| - | | |
| 448,386 | |
| | |
2023 | |
| 200,000 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 200,000 | |
| | |
| |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 金志新(4) | |
2022 | |
| 200,000 | | |
| - | | |
| - | | |
| 248,386 | | |
| - | | |
| - | | |
| - | | |
| 448,386 | |
| | |
2023 | |
| 90,556 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 90,556 | |
| | |
| |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 尤金·江(5) | |
2022 | |
| 200,000 | | |
| - | | |
| - | | |
| 248,386 | | |
| - | | |
| - | | |
| - | | |
| 448,386 | |
| | |
2023 | |
| 200,000 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 200,000 | |
| | |
| |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 池良安(6) | |
2022 | |
| 133,333 | | |
| - | | |
| - | | |
| 248,386 | | |
| - | | |
| - | | |
| - | | |
| 381,719 | |
| | |
2023 | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | |
| | |
| |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | |
| 尤塔姆·帕蒂爾(1) | |
2022 | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | |
| | |
2023 | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | |
| (1) | Doong博士於2017年9月15日被任命為首席執行官。Doong博士後來於2023年6月21日辭去了公司首席執行官的職務。公司董事會任命Uttam Patil博士接替Doong博士擔任公司首席執行官。 |
| (2) |
周先生於2022年9月4日被任命為首席財務官。 |
| |
|
| (3) |
姜博士被任命為
CSTRO於2019年9月1日。姜博士還被任命為
2023年6月15日,公司首席服務官接替辭去
職務的King博士 CSO. |
| |
|
| (4) |
金博士被任命為 CSO於2017年9月15日。金博士後來辭去了他的 於2023年6月15日擔任公司的CSO。公司董事會任命
姜博士接替金博士擔任公司首席戰略官。 |
| |
|
| (5) |
Eugene醬於2019年9月1日被任命為CBO。 |
| |
|
| (6) |
安先生於2022年9月4日辭去本公司首席財務官職務。 |
| |
|
| (7) |
於二零二三年授出之購股權之加權平均授出日期公平值 使用布萊克—斯科爾斯期權定價模型計算的是2.79美元。因此,公司確認了股票補償費用
截至2023年12月31日止年度的1,635,709美元。於二零二三年並無授出購股權 |
薪酬彙總表的敍述性披露
除下文所載外,本公司並無為董事或行政人員提供退休金、退休或類似福利的安排或計劃。我們的董事和高級管理人員未來可能會根據董事會的決定獲得股票期權。本公司並無任何實質紅利或利潤分紅計劃,根據該計劃向本公司董事或主管人員支付或可能支付現金或非現金薪酬,但本公司董事會可酌情授予股份
期權。
股票期權計劃
本公司董事會於2020年9月12日批准並通過經修訂並重新修訂的2016年股權激勵計劃(以下簡稱《計劃》),該計劃的副本作為附件10.17附於本文件。
基於計劃的獎勵的授予
於2022年4月16日,本公司與5名董事訂立股票
購股權協議,據此,本公司根據經修訂的計劃授予購股權,按每股3美元的行使價購買合共761,920股普通股。期權在授予日授予,並在授予日起10年內可行使
。
截至本
報告日期,我們已根據該計劃授出可行使的購股權總數為2,587,104股普通股。
財政年度結束時的傑出股票獎勵
下表彙總了截至2023年12月31日,我們任命的每位高管持有的未行使期權、未授予股票和股權激勵計劃獎勵:
財政年度末未償還的股權獎勵
| 期權獎勵 | |
股票獎勵 |
| 名字 | |
證券數量
潛在的
未鍛鍊
選項(#)
可操練 | | |
數量
證券
潛在的
未鍛鍊
選項(#)
不能行使 | | |
股權激勵
計劃大獎:
數量
證券
潛在的
未鍛鍊身體
未賺取的期權
(#) | | |
選項
鍛鍊
價格
($) | | |
選擇權
期滿
日期 | |
數量
股票或
單位
庫存
還沒有
既得
(#) | |
市場
的價值
股票或
個單位
囤積那個
還沒有
既得
($) | | |
權益
激勵計劃
獎項:
數量
不勞而獲
股份、單位
或其他
權利,即
還沒有
已發佈
(#) | | |
股權激勵
計劃大獎:
市場或支出
非勞所得的價值
股份、單位或
其他權利
還沒有被
已發佈
($) | |
| 霍華德·杜昂 | |
| 85,715 | | |
| 10,715 | | |
| - | | |
| 2.00 | | |
2031年11月20日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 400,001 | | |
| - | | |
| - | | |
| 3.00 | | |
2032年10月15日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 152,384 | | |
| - | | |
| - | | |
| 3.00 | | |
2033年4月16日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| | | |
| | | |
| | | |
| | | |
| |
| |
| | | |
| | | |
| | |
| 赤良安 | |
| 54,762 | | |
| 9,524 | | |
| - | | |
| 2.00 | | |
2031年11月20日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 233,334 | | |
| - | | |
| - | | |
| 3.00 | | |
2032年10月15日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 152,384 | | |
| - | | |
| - | | |
| 3.00 | | |
2033年4月16日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| | | |
| | | |
| | | |
| | | |
| |
| |
| | | |
| | | |
| | |
| 江宗山 | |
| 34,105 | | |
| - | | |
| - | | |
| 2.00 | | |
2031年11月20日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 30,000 | | |
| - | | |
| - | | |
| 3.00 | | |
2032年10月15日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 152,384 | | |
| - | | |
| - | | |
| 3.00 | | |
2033年4月16日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| | | |
| | | |
| | | |
| | | |
| |
| |
| | | |
| | | |
| | |
| 金志新 | |
| 82,144 | | |
| 14,286 | | |
| - | | |
| 2.00 | | |
2031年11月20日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 316,667 | | |
| - | | |
| - | | |
| 3.00 | | |
2032年10月15日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 152,384 | | |
| - | | |
| - | | |
| 3.00 | | |
2033年4月16日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| | | |
| | | |
| | | |
| | | |
| |
| |
| | | |
| | | |
| | |
| 尤金·江 | |
| 72,418 | | |
| 12,193 | | |
| - | | |
| 2.00 | | |
2031年11月20日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 30,000 | | |
| - | | |
| - | | |
| 3.00 | | |
2032年10月15日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| 152,384 | | |
| - | | |
| - | | |
| 3.00 | | |
2033年4月16日 | |
- | |
| - | | |
| - | | |
| - | |
| | |
| | | |
| | | |
| | | |
| | | |
| |
| |
| | | |
| | | |
| | |
| Uttam Patil | |
| - | | |
| - | | |
| - | | |
| - | | |
| |
- | |
| - | | |
| - | | |
| - | |
董事的薪酬
董事可以獲得固定費用
和其他作為董事服務的報酬。董事會有權確定董事的薪酬。
在2023財年,董事會沒有以這種身份向董事支付或應計任何金額。我們在2023財年沒有向董事支付股票期權。
養老金、退休或類似福利計劃
我們沒有為董事或高管提供養老金、退休或類似福利的安排或計劃。我們沒有向我們的董事或高管支付或可能支付現金或非現金薪酬的實質性獎金或利潤分享計劃
,但董事會或其委員會可以酌情授予股票期權。
僱傭合同
Uttam Patil博士已於2023年6月23日與公司簽訂僱傭協議(“Patil僱傭協議”)
,根據該協議,他將根據公司的標準薪資慣例,通過股票期權獲得初始基本工資。截至本招股説明書發佈之日,帕蒂爾博士尚未收到任何股票期權。
於2022年9月4日,董事會委任陳先生為獨立非執行董事。
Leeds Chow先生擔任本公司首席財務官(“CFO”)兼首席會計官,自2022年9月
4日起生效,任期3年。
金志新博士已與本公司訂立
僱傭協議(“King僱傭協議”),根據該協議,他將獲得50,000元的年度基本工資
。截至2017年12月31日,我們以每股1.60美元的價格向金先生支付了10,416股公司普通股,而不是現金薪酬。根據King僱傭協議,King博士受聘為公司的CSO。對於高管的某些行為,例如對重罪、嚴重疏忽或不誠實行為的定罪或認罪,或不當行為或未能履行約定的職責,我們可以隨時因此而終止聘用,而無需通知或支付報酬。在
這種情況下,高管將無權因解僱而獲得任何遣散費或其他金額,並且高管享有所有其他福利的權利也將終止,除非適用法律另有規定。
我們也可以在一個月前發出書面通知,無故終止高管的僱傭。在我們解僱的情況下,我們需要向高管提供補償,包括相當於12個月基本工資的遣散費。如果執行幹事的職責和職責發生重大變化,或者執行幹事的年薪大幅減少,執行幹事可隨時提前一個月書面通知終止聘用。
在這種情況下,執行幹事將有權獲得相當於執行幹事
基本工資12個月的補償。2019年8月21日,出席會議的全體董事會成員一致選舉理查德·金博士為首席科學官(CSO),自2019年9月1日起生效,任期三年。2023年6月13日,Richard King博士辭去了CSO一職。公司董事會任命姜博士接替理查德·金博士擔任CSO。
2019年8月21日,出席會議的所有董事會成員
(除Eugene Jiang外)任命現任董事會主席Eugene Jiang先生為首席業務官,
自2019年9月1日起生效,任期三年。Eugene Jiang先生在董事會會議上回避了有關任命
為公司首席業務官的討論。合同又延長了三年。
2019年8月21日,出席會議的所有董事會成員
(除蔣宗山博士外)連任蔣宗山博士為首席戰略官,自
2019年9月1日起生效,任期三年。蔣宗山博士在董事會會議上回避了有關任命
公司首席戰略官的討論。合同又延長了三年。
某些受益所有者和管理層的安全所有權
下表列出了截至本文發佈之日我們普通股的實益所有權的某些信息
(I)據我們所知擁有超過5%(5%)已發行普通股的每個人(或關聯人集團),(Ii)每個董事高管和董事的被提名人,以及(Iii)我們的所有董事、高管和董事被提名人作為一個集團。
受益所有權根據
美國證券交易委員會規則確定,通常包括對證券的投票權或投資權。就本表而言,一個人或一組人被視為擁有該人有權在各自表日起60天內收購的任何普通股的“實益所有權”。就計算上述人士或團體所持普通股的流通股百分比而言,該人士或該等人士有權於各自表格日期起計60天內購入的任何股份均被視為該人士的已發行股份,但就計算任何其他人士的所有權百分比而言,則不被視為已發行股份。在此列名為實益擁有的任何股份並不構成承認實益擁有。
除非另有説明,否則列出的每個受益人的營業地址為44370 Old Ware Springs Blvd.,Fremont,CA 94538。除另有説明外,以下所列人士對其持有的所有普通股擁有獨家投票權和投資權,但權力可與配偶分享的除外。
截至4月[●],
2024年,我們有10,560,421股普通股已發行及發行在外。
| 實益擁有人姓名或名稱 |
|
金額和
性質
有益
所有權 |
|
|
百分比
類 |
|
| 烏塔姆·帕蒂爾博士 |
|
|
72,428 |
|
|
|
|
* |
| 尤金·江(1) |
|
|
147,373 |
|
|
|
1.4 |
% |
| 利茲·周 |
|
|
52,007 |
|
|
|
|
* |
| 周延新 |
|
|
41,956 |
|
|
|
|
* |
| 新會苗族 |
|
|
48,072 |
|
|
|
|
* |
| 江曾鳴博士 |
|
|
41,994 |
|
|
|
|
* |
| 野里美·阪本 |
|
|
41,854 |
|
|
|
|
* |
| 姜宗山博士(2)(4) |
|
|
590,843 |
|
|
|
5.6 |
% |
| 江長仁博士(3) |
|
|
42,082 |
|
|
|
|
* |
| 奧代拉·吉野信 |
|
|
57,758 |
|
|
|
|
* |
| 徐車偉 |
|
|
41,723 |
|
|
|
|
* |
| 舒陵江 |
|
|
1,628,464 |
|
|
|
15.4 |
% |
| 鍾宇民 |
|
|
41,943 |
|
|
|
|
* |
| 全體高級職員和董事(十四(14)人) |
|
|
2,848,497 |
|
|
|
27.0 |
% |
| 元基因公司(4) |
|
|
829,699 |
|
|
|
7.9 |
% |
| (1) | 尤金·江以直接持股方式持有147,373股。 |
| (2) | 蔣宗山博士透過持有袁氏公司的股份持有167,599股普通股,透過Rgene Corporation持有722股,透過BioFirst持有608股,透過BioLite持有45股,
通過獅藝持有3,227股,其餘418,642股直接持有。 |
| (3) | 蔣長仁博士通過持有BioFirst股份持有本公司普通股234股,通過Rgene持有1股,通過直接持股持有其餘41,847股。 |
| (4) | 蔣淑玲女士持有662,100股普通股
通過持有YuanGene Corporation的股權,通過Rgene Corporation的964股,
8,833股通過BioFirst,182股通過BioLite,48,761股通過Liongene,
通過Keypoint獲得21,313股股票,通過Genepro獲得1,012股股票,通過Lion獲得12,747股股票
藝術,其餘872552股通過直接所有權。 |
| (5) |
YuanGene Corporation是由
全資擁有的公司 Lion Arts由蔣淑玲(80%)和蔣宗山博士(20%)持有;然而,YuanGene任命Eugene Jiang為
對YuanGene持有的股份的唯一投票控制權,其主要辦事處地址為2ndB棟樓層,
SNPF廣場,薩瓦拉洛,阿皮亞,薩摩亞。 |
董事和高管的關聯方交易
除本文所披露者外,自2022年1月1日以來,概無董事高管、持有本公司普通股至少5%股份的股東或其任何家族成員於任何交易或擬進行的交易中擁有任何重大利益(直接或間接),而該等交易涉及的交易金額超過120,000美元,或佔本公司過去兩個完整財政年度年終總資產平均值的百分之一。
與Rgene公司達成共同開發協議
2020年11月10日,本公司與Rgene於2017年5月26日簽署了《聯合開發協議》修正案,據此,雙方同意刪除AB-1507 HER2/neu陽性乳腺癌聯合治療和AB 1527卵巢癌聯合治療,並在待共同開發和商業化的產品中增加ABV-1519 EGFR陽性非小細胞肺癌聯合治療和ABV-1526結腸癌/直腸癌聯合治療。
聯合開發協議的其他條款仍然有效。
與Rgene公司簽訂臨牀開發服務協議
2022年6月10日,該公司擴大了與Rgene的聯合開發合作伙伴關係。BioKey,Inc.與Rgene簽訂了臨牀開發服務協議(“服務協議”)
,以指導某些Rgene藥物產品,用於治療非小細胞肺癌(NSCLC)的RGC-1501,用於治療胰腺癌的RGC-1502和用於治療結直腸癌患者的RGC 1503,通過完成符合美國FDA IND法規要求的第二階段臨牀研究(“Rgene研究”)。服務協議將一直有效到最後一項專利到期,並自動續訂5年以上,除非任何一方提前6個月書面通知終止。
根據服務協議的條款,BioKey有資格在3年內獲得總計300萬美元的付款,
每筆付款金額將根據協議期間獲得的某些監管里程碑來確定。
與BioFirst公司達成合作協議
2020年11月4日,我們執行了與BioFirst於2017年7月24日簽署的合作協議修正案,將ABV-2001眼內沖洗解決方案和ABV-2002角膜存儲解決方案添加到我們的協議中。ABV-2002旨在用於角膜移植手術,以替代受損或患病的角膜,而ABV-2001在各種眼科手術中有更廣泛的用途。
最初,ABVC將專注於ABV-2002,這是一種在穿透性角膜移植(全層角膜移植)或內皮角膜移植(背層角膜移植)之前用來儲存供體角膜的溶液。根據ABVC的產品識別系統,該解決方案被命名為ABV-2002,該解決方案由一種特殊的多氨基酸組成,可保護眼睛組織免受手術前儲存期間外部滲透暴露造成的損害。ABV 2002中的特殊聚合物可以調節滲透壓以保持330到390 mOsm的範圍,從而允許在儲存期內角膜基質內的水化。基質水化可使(A)保持可接受的角膜透明度,(B)防止供體角膜腫脹。ABV-2002還含有一種在植物細胞壁中發現的豐富的酚類植物化學物質,具有抗氧化、抗菌和神經保護作用。
BioFirst公司的早期測試表明,在長期儲存期間,ABV-2002可能比目前可用的其他存儲介質更有效地保護角膜和視網膜,並且可以以更低的成本製造。ABV-2002被歸類為對患者風險最低的I類醫療設備;然而,由於缺乏資金,進一步的臨牀開發被擱置。
2018年5月11日,本公司與BioFirst(澳大利亞)
簽訂了一項總額為40,000美元的貸款協議,以滿足其營運資金需求。預付款的利率為0%,
應在2020年9月30日之前按需支付。此後,所有未償還的貸款將按年利率12%計息。2020年7月1日,本公司與澳大利亞BioFirst公司簽訂了一項361,487美元的貸款協議,以妥善記錄研發成本和基於2017年7月24日簽署的共同開發合同的退税分配。貸款原定於2021年9月30日到期,年利率為6.5%,然而,2021年9月7日,公司與BioFirst(澳大利亞)簽訂了一項67,873美元的貸款協議,以滿足其新項目需求。2021年12月1日,公司與BioFirst(澳大利亞)簽訂了一項250,000美元的貸款協議,以增加即將到來的項目的成本。貸款年利率為6.5%,於2022年11月30日到期。
截至2022年12月31日和2021年12月31日,未償還貸款總額和應計利息總額分別為1,028,556美元和491,816美元。
合資企業協議
於二零二一年十月六日(“完成日期”),本公司、日本公司LucidaimCo.,Ltd.(“Lucidaim”,連同本公司,“股東”)及日本BioLite Japan K.K.(“Biolite JP”)訂立
合資協議(“該協議”)。BioLite JP是一傢俬人有限公司(日本人Kabushiki Kaisha)
於2018年12月18日註冊成立,於協議日期擁有10,000股授權普通股,其中3,049股普通股
已發行及已發行(“普通股”)。緊接該協議簽署前,Lucidaim擁有1,501股普通股,而本公司擁有1,548股普通股。股東訂立合營公司,正式表明他們有意投資及經營畢麗特JP作為合營公司。合資企業的業務應為研究和開發藥品、醫療器械和數字媒體、投資、基金運營和諮詢、分銷和營銷補充劑
由Biite JP及其在日本的子公司,或任何其他地區或業務可能不時通過
協議修正案同意。交易的完成以所有必要的政府批准和接收為條件,
這些批准已經收到。
根據該協議及相關股份轉讓協議,本公司將無償轉讓54股普通股予Lucidaim,使轉讓後,Lucidaim將擁有1,555股普通股(51%),而本公司將擁有1,494股普通股(49%)。此外,根據該協議,Biite JP將有3名董事,包括1名由本公司委任的董事及2名由Lucdian am委任的董事。本公司
將任命Eugene醬為本公司現任董事長兼首席業務官,Lucidaim將任命大西美仁;
Biolite JP的現任董事董事長Toru Seo(也是BioLite日本的另一股東)被視為第二個Lucidaim董事。該協議進一步規定,本公司與Biite JP應將他們之間的研究合作和許可協議
轉讓給Biite JP或準備該協議(“許可協議”)。上述交易發生在完成日期
。
根據該協議,股東應
監督及管理Biite JP的業務及營運。董事無權因其作為董事提供的服務而獲得任何報酬
各股東可撤換其委任的董事。如果股東出售或處置其全部
普通股,該股東指定的董事必須提交辭呈。該協議還規定了必須經所有股東事先批准的某些公司行為(“保留事項”)。如果股東
無法就任何保留事項作出決定,則任何一個股東都可以在5天后
向另一個股東提交僵局通知,
之後必須將此事提交給每個股東的董事長,並本着善意解決糾紛。如果該爭議
在此後10天內仍未解決,則任一股東均可提出以特定價格以現金購買另一股東的全部普通股
;如果未肯定接受出售,則應按照出售要約的規定進行出售。
各股東均享有優先認購權,以購買有關數目的額外普通股,使該股東可在Biite JP發行任何新普通股時維持其於Biite
JP的持股比例。然而,該協議規定,公司將在
某些條件下喪失優先購買權。如果另一股東收到購買該股東普通股的要約,股東還保留優先購買權。
該協議還要求Biolite JP獲得金額為30,460,000日元(約272,000美元)的銀行貸款,作為其初始營運資金用途。根據《協議》,各股東同意在銀行要求擔保的情況下為此類銀行融資提供擔保。因此,本公司可能對銀行貸款承擔最高達14,925,400日元(約134,000美元)的責任,相當於最高銀行貸款的49%。
該協議進一步規定,Biite JP應按其利潤的至少1.5%發行年度股息,
如果其有足夠的現金這樣做的話。
根據該協議,本公司與BIOLITE
JP同意盡其最大努力於2021年12月底前簽署許可協議,但由於該協議尚未簽署,
雙方仍在繼續努力。本公司同意,代表畢麗特JP就許可協議條款進行的任何談判將由Lucidaime委任的董事處理。如本公司與該等Lucidaime董事未能就條款達成協議,Biolite JP可全權酌情決定不簽署許可協議,而不對本公司承擔任何責任。
該協議包含在股東或其子公司不再為股東後的兩年內的非要約和非競爭條款,此類限制性契約僅限於眼科領域或中樞神經領域的業務。BIOLITE
JP的活動產生的任何知識產權應屬於BIOLITE JP。
本協議包含標準的賠償條款
,但任何賠償方不得對單個責任承擔任何責任,除非賠償金額超過500,000日元(約4,500美元),且直至所有責任總額超過2,000,000日元(約18,000美元),然後僅在此類責任超過該限額的範圍內。
該公司為組建合資企業支付了15萬美元;意向書簽署後,BioLite日本的另一股東也支付了15萬美元。
本協議有效期為10年,除非
提前終止。該協議還允許一名股東在另一名股東違約時終止協議,如協議所述。
與BioLite,Inc.達成協議。
吾等於2015年12月29日與根據臺灣法律註冊成立的公司BioLite,Inc.及本公司附屬公司(“BioLite”)訂立合作協議,並於該協議(經修訂及修訂)(“該協議”)後簽訂兩份附錄。BioLite的大股東是公司的子公司之一,公司董事長是BioLite的董事成員,而江博士是公司的首席戰略官和董事的成員,是BioLite的主席。
根據該協議,該公司從BioLite獲得了獨家許可權,以開發和商業化用於治療目的的六種化合物。根據協議的條款,公司應向BioLite支付(I)高達1億美元的現金和公司股權或其在不同階段擁有的股權證券的里程碑付款(根據BioLite在協議中規定的某些里程碑成就所規定的時間表)和(Ii)當ABV-1501獲準在許可地區銷售時,相當於藥品淨銷售額5%的特許權使用費付款。如果BioLite未能及時達到任何里程碑,它可能無法收到公司的剩餘款項。根據協議,在第二階段臨牀試驗完成後,里程碑付款的15%將到期,並將分兩個階段支付:(I)不遲於2021年12月31日(“2021年12月付款”)
和(Ii)不遲於2022年12月31日支付10%。2022年2月12日,公司董事會決定,2021年12月的付款,相當於5,000,000美元,將通過註銷BioLite截至2021年12月31日欠公司的某些未償債務5,000,000美元來支付。2022年2月22日,雙方簽訂了一項協議修正案,允許公司通過免除BioLite欠公司的等值債務來支付根據協議到期的所有款項。
這是一筆關聯方交易,是在一定範圍內進行的。除了公司董事會批准協議條款的修改外,公司審計委員會也批准了這些條款的修改。董事會認為,註銷未償債務並將其用於2021年12月的付款符合本公司的最佳利益。
在獲得批准後,本公司與BioLite
簽訂了一份協議修正案,以反映修改後的付款方式。
房地產購買
於二零二四年二月六日,本公司與蜀陵江(“蜀陵”)訂立最終協議,據此,蜀陵將其擁有的位於臺灣桃園市的若干土地(“該土地”)的擁有權轉讓予本公司(“該協議”)。舒靈
為本公司旗下董事,與本公司首席戰略官蔣明江結婚,持有本公司約15.4%的已發行及已發行普通股。
作為該土地的代價,本公司將按每股3.50美元的價格向蜀陵支付(I)703,495股本公司普通股的限制性股份(“股份”)及(Ii)可購買最多1,000,000股本公司普通股的五年期認股權證,行使價為每股2.00美元。根據該協議,蜀陵還將把該土地的未償債務(約500,000美元)轉讓給本公司。
因此,雙方對交換的估值約為2,962,232美元。
其他關聯方交易
關聯方到期的:
(1)
|
2022年6月16日,本公司與Rgene簽訂了一項為期一年的可轉換貸款協議,本金為1,000,000美元,Rgene的利息為年息
5%,用於營運資金的使用,如果全部轉換,這將導致ABVC擁有Rgene 6.4%的額外股份。
公司可隨時將票據轉換為Rgene的普通股,價格為(I)相當於每股1.00美元的固定轉換價格
或(Ii)當時最新發行的股票價格的20%折扣,以較低者為準;轉換價格
如附註所述可予調整。本附註包括標準違約事件,以及交叉違約條款
,根據該條款,違反服務協議將觸發可轉換票據項下的違約事件,前提是在提供有關違約的5個工作日的書面通知後仍未得到糾正。 |
截至2023年12月31日,未償還貸款餘額為700,000美元;應計利息為45,573美元。
| (2) |
2022年,該公司與BioFirst(澳大利亞)簽訂了幾項貸款協議,總額為507,000美元,以增加即將到來的項目的成本。貸款期限為12個月,年利率為6.5%。截至2023年12月31日和2022年12月31日,未償還貸款餘額和分配的研究費分別為0美元和660,484美元;應計利息分別為0美元和92,171美元。未償還的金額於2023年結清。 |
致關聯方:
| (1) |
自2019年以來,BioFirst已向公司預付資金用於營運資金
。墊款的利息為每月1%(或相當於年息12%)。截至2022年12月31日,未償還餘額和應計利息的總額為188,753美元,其中包括來自貸款的147,875美元和來自費用分攤的40,878美元。未償還的金額將於2023年結清。 |
| (2) |
自2019年起,江氏向本公司墊付資金作為營運資金
用途。截至2023年12月31日、2023年12月31日和2022年12月31日,欠江家的未償還餘額分別為20,750美元和19,789美元。
這些貸款的利率為每月0%至1%,按需到期。 |
| (3) |
自2018年以來,公司股東向公司墊付資金用於營運資金。
墊款的年利率為12%至13.6224%。截至2023年12月31日和2022年12月31日,未償還本金和應計利息分別為152,382美元和151,450美元。截至2023年12月31日和2022年12月31日止年度,與這些貸款相關的利息支出分別為20,094美元和21,378美元。 |
發起人及某些控制人
我們的管理層或其他控制人員
均不為“發起人”(在《證券法》第405條的定義內),且在過去五年中,這些人員均未主動
建立我們的業務,或接收我們的任何債務或股權證券或出售此類證券所得,以換取財產或服務的貢獻。
證券説明
一般信息
公司的法定股本
包括:
我們的普通股可能按董事會不時確定的對價發行。我們的董事會可以在一個或多個系列中發行該等普通股,投票權應在一項或多項決議中説明。
普通股
截至本協議日期,共有10,560,421股普通股已發行和流通。普通股持有人有權就
提交股東投票的所有事項(包括董事選舉)對每股投一票。普通股持有人有權按比例收取董事會從合法可用的資金中宣佈的股息(
)。此類持有人沒有任何優先購買權或其他權利
認購額外股份。所有普通股持有人有權按比例分享任何資產,以便在公司清算、解散或清盤時分配給股東
,但須遵守當時尚未發行的優先股的優先股的優先分配權。
沒有適用於普通股的轉換、贖回或償債基金條款。所有普通股的流通股
均已繳足,且無須課税。
優先股
截至本協議日期,沒有優先
股票流通。根據本公司的公司章程,董事會被明確授權
發行最多20,000,000股優先股並規定其名稱。
以下對優先股的描述
以及對本公司任何特定優先股系列的條款的描述不完整。本公司董事會有權發行一個或多個系列的優先股,而無需股東採取進一步行動
,並確定授予或施加於優先股的權利、優先股、特權和限制。任何或所有這些權利
可能大於公司普通股的權利。通過參考修訂後的公司公司章程和與每個此類系列相關的指定證書,對這些描述的全部內容進行了限定。
轉換權
A系列可轉換優先股的每股最初可於任何時間由持有人選擇轉換為一股普通股,並於發行四週年時自動轉換為一股普通股(“轉換比率”),而持有人無須支付額外的
代價。
將A系列可轉換優先股轉換為普通股時,不得發行零碎股份,且不支付任何款項。吾等將在法律許可的範圍內,向
持有人支付相當於本公司董事會真誠釐定的該等零碎股份的當前公平市值的現金金額,以代替交付零碎股份
。
沒有到期、償債基金或強制贖回
A系列可轉換優先股沒有到期日,我們不需要在任何時候贖回A系列可轉換優先股。然而,我們可以選擇在任何時間將A系列可轉換優先股的所有流通股按相同的轉換比率轉換為我們的普通股,條件是我們已預付並分配了自A系列可轉換優先股發行以來的四年期末應計和應計的所有股息
。因此,除非A系列可轉換優先股的持有人或我們選擇將A系列可轉換優先股
轉換為普通股,否則A系列可轉換優先股將一直未償還,直至在發行四年紀念日自動轉換為普通股。A系列可轉換優先股也不受任何償債基金的影響。
投票權
A系列可轉換優先股的持有者享有與我們普通股持有者相同的投票權。
認股權證和期權
截至本公告日期,我們分別擁有1,307,102份及7,038,442份本公司尚未行使的購股權及認股權證。我們不會登記作為本S1中任何
認股權證基礎的普通股。
傳輸代理
我們普通股的轉讓代理和登記商是:Vstock Transfer,LLC;地址:紐約伍德米爾拉斐特廣場18號,郵編:11598;電話:(2128288436);網址:www.vstock Transfer
反收購條款
內華達州修訂後的法規
收購控股權法規。
內華達州的“收購控股權”法規包含有關收購內華達州某些公司的控股權的條款。這些“控制權股份”法律一般規定,任何在內華達州某些公司獲得“控股權”的人可被剝奪某些投票權,除非該公司的大多數無利害關係的股東
選擇恢復此類投票權。這些法規規定,只要某人收購主題公司的股份,如果不適用內華達州修訂後的法規的這些條款,
該人就獲得了“控制權益”,
使該人能夠在董事選舉中行使(1)五分之一或更多,但不到三分之一,(2)三分之一或更多,但不到多數或(3)多數或更多的投票權。一旦收購人超過其中一個門檻,其在收購該門檻的交易中以及在收購人收購或要約收購控股權之日之前的90天內收購的股份將成為適用上述投票限制的“控制權股份”。我們的公司章程和章程目前不包含與這些
法規相關的條款,除非我們的公司章程或在收購控股權後第十天生效的章程另有規定,否則如果我們(I)有200名或更多登記在冊的股東(其中至少有100名股東的地址在內華達州出現在我們的股票賬簿上)和(Ii)直接或通過
關聯公司在內華達州開展業務,這些法律將適用於我們。如果這些法律適用於我們,它們可能會阻止有興趣收購本公司重大
權益或控制權的公司或個人,無論此類收購是否符合我們股東的利益。
與利益相關股東的合併
法規。內華達州的“與利益相關股東的合併”法規禁止某些內華達州公司與任何被視為“利益股東”的人之間的某些業務“合併”,除非(I)公司董事會事先批准了該合併(或該人成為“利益股東”的交易),或者(Ii)該合併得到了董事會的批准,該公司60%的投票權並非由該利益股東、其關聯公司和聯營公司實益擁有。此外,在沒有事先批准的情況下,即使在這樣的兩年
期限之後,某些限制也可能適用。就這些法規而言,“有利害關係的股東”是指(X)直接或間接擁有該公司已發行有表決權股份百分之十或以上投票權的實益擁有人,或(Y)該公司的聯屬公司或聯營公司,並且在過去兩年內的任何時間直接或間接地是該公司當時已發行股份的百分之十或以上投票權的實益擁有人。“合併”一詞的定義足夠廣泛,足以涵蓋公司與“有利害關係的股東”之間最重大的交易。在符合法規規定的特定時間要求的情況下,公司可以選擇不受這些法規的管轄。我們尚未在公司章程中包含任何此類條款。
這些法規的效果可能是,如果公司無法獲得我們董事會的批准,可能會
阻止有興趣控制公司的各方這樣做。
出售股東
本招股説明書涉及不時發售及出售最多3,527,778股於Lind Note轉換時可發行的普通股、最多5,291,667股Lind認股權證相關普通股、最多211,667股PA認股權證相關普通股、最多342,857股普通股
,於2發送本金額為1,200,000美元的Lind票據,最多為1,000,000股普通股發送Lind認股權證,最多30,000股普通股發送PA認股權證,
最多285,714股普通股,可在3股全部轉換後發行研發Lind票據,本金為1,000,000美元,最多為3,000,000股普通股研發Lind認股權證;以及最多25,000股普通股
研發PA認股權證,由下表所列股東持有。我們登記這些股份是為了允許
出售股東及其質押人、受贈人、受讓人和其他利益繼承人(在本招股説明書發佈日期之後,從出售
股東處以贈與、合夥分配或其他非出售相關轉讓形式收到其股份),
在他們認為適當的時候,以“分配計劃”中所述的方式轉售這些股份。截至四月 [●]2024年,有10,560,421股普通股已發行和流通。
下表列出了:
| ● | 在本招股説明書規定的股份轉售前,出售股東在
之前實益擁有的普通股數量, |
| ● | 根據本招股説明書,可為出售股東的賬户
提供轉售的我們普通股的最大股數,以及 |
| ● | 在股票發行後,出售股東實益擁有的我們普通股的數量和百分比
(假設所有已發行股票都由出售股東出售)。 |
除下文所述外,出售股票的股東
通過與本公司的私下交易獲得了他們的證券。
每一個出售股票的股東可以隨時出售全部或部分股票。下表假設出售股票的股東將出售
出售的所有股票。然而,根據本招股章程,售股股東並無義務出售任何股份。
| 銷售股東名稱 | |
普通股
庫存
受益
之前擁有的
到提供 | | |
極大值
數量
共享
的
普普通通
待售股票
售出 | | |
數量
的股份
普普通通
庫存
擁有
之後
產品(1) | | |
百分比
所有權
之後
優惠(1)(2) | |
| Lind Global Fund II LP | |
| 11,448,016 | | |
| 11,448,016 | (3) | |
| - | | |
| 9.99 | % |
| 威爾明頓資本證券有限責任公司(4) | |
| - | | |
| 266,667 | (4) |
| | - | |
| | * |
| (1) |
由於我們無法控制上述出售股東中的每一位將出售多少股份(如果有的話),我們假設出售股東將出售本文中提供的所有股份,以確定他們在發售後將擁有多少股份及其在發售後的所有權百分比。 |
| |
|
| (2) |
所有的百分比都已四捨五入到最接近的百分之一。 |
| |
|
| (3) |
包括:(i)轉換林德票據時可發行的3,527,778股普通股,其根據每股1.05美元的初始換股價(定義見林德票據)計算,(ii)林德權證所依據的5,291,667股普通股,(iii)轉換2股後可發行的342,857股普通股,發送Lind Note,根據固定價格計算(定義見2ndLind Note)每股3.5美元,(Iv)1,000,000股普通股ndLind認股權證;(Vii)285,714股可於轉換後發行的普通股研發Lind Note,根據固定價格計算(定義見3研發林德注),每股3.5美元和(八)1,000,000股普通股相關的3研發林德搜查令。所有向Lind發行的票據及認股權證均載有阻止條款,以致不能行使該等條款,以致持有人連同其聯屬公司實益擁有該類別未償還權益(定義見向Lind發行的票據及認股權證)的9.99%以上。第二欄所列的普通股股數並不適用於此類阻止條款。Lind Global Fund II LP的地址是C/o the Lind Partners LLC,紐約麥迪遜大道444號,Floor 41,New York,NY 10022。Lind Global Partners II LLC是Lind Global Fund II LP的普通合夥人,可能被視為對Lind Global Fund II LP持有的股份擁有唯一投票權和處置權。Lind Global Partners II LLC的管理成員Jeff·伊斯頓可能被視為對Lind Global Fund II LP持有的股份擁有唯一投票權和處置權。 |
| (4) |
代表
PA認股權證相關的普通股股份,2發送認股權證和3rd
根據與Lind的三次交易發行的PA認股權證:自初始
與Lind的交易,30,000來自與Lind的第二次交易,25,000來自第三次交易
與林德的交易。PA Warrants,2發送認股權證和3研發PA
權證包含阻止條款,因此,權證不能在
行使將導致持有人及其附屬公司實益擁有超過
9.99%的未償還股權(定義見PA認股權證,2發送
認股權證和3研發(A)這一類的。普通股數量
第二欄中所列的庫存不適用此類阻斷規定。投資
和投票權控制權威爾明頓資本證券公司的地址,
LLC是600 Old Country Road,Suite 200,Garden City,NY 11530。威爾明頓是FINRA註冊的
經紀人 |
配送計劃
我們登記了11,714,683股普通股,其中包括先前在S—1表格(文件編號:333—271416)上登記的9,031,112股普通股,供出售股東轉售。
出售股票的股東及其任何質權人、受讓人、受讓人和其他利益繼承人可以隨時在股票交易所在的任何證券交易所、市場或交易設施或以私下交易的方式出售其持有的任何或全部普通股。這些銷售可能是固定的
,也可能是協商價格。出售股份的股東可以採用下列方式之一或者多種方式出售股份:
| ● | BLOCK
交易中,經紀交易商將嘗試以代理身份出售股票,但可能會定位
並以委託人的身份轉售部分BLOCK; |
| ● | 經紀自營商作為本金買入,並由經紀自營商代為轉售; |
| ● | 經紀自營商可以與出售股票的股東約定,以約定的每股價格出售一定數量的此類股票; |
出售股票的股東也可以根據修訂後的1933年證券法(“證券法”)第144條(如果有的話)出售股票,而不是根據本招股説明書。
如果出售股票的股東在任何特定時間認為收購價格不能令人滿意,則出售股東有唯一和絕對的酌情權,不接受任何收購要約或出售任何股份。
出售股票的股東或其質權人、受讓人、受讓人或其他利益繼承人也可以直接將股票出售給作為委託人的做市商和/或作為其本人或其客户的代理人的經紀交易商。此類經紀-交易商可從股票的銷售股東和/或買方以折扣、優惠或佣金的形式獲得補償,此類經紀-交易商可作為代理或作為本金或兩者向其出售股票,對特定經紀-交易商的補償可能超過慣常的
佣金。做市商和大宗買家購買這些股票將自負責任,風險自負。出售股票的股東可能會嘗試以大宗交易的方式將普通股出售給做市商或其他購買者,價格為每股價格可能低於當時的市場價格。我們不能保證本招股説明書中提供的全部或任何股份將發行給出售股東,或由出售股東出售。出售股份的股東及任何經紀、交易商或代理人在完成出售本招股説明書所提供的任何股份後,可被視為證券法、交易法及該等行為的規則及條例所界定的“承銷商”。在這種情況下,此類經紀自營商
或代理人收到的任何佣金和轉售其購買的股票的任何利潤可能被視為根據《證券法》
的承銷佣金或折扣。
我們被要求支付與股票登記相關的所有費用和支出,包括向出售股東支付法律顧問的費用和支出,但不包括經紀佣金或承銷商折扣。
或者,出售股票的股東可以通過承銷商出售本招股説明書中提供的全部或部分股份。出售股份的股東並未與潛在承銷商訂立任何協議,亦不能保證會簽訂任何此類協議。
出售股票的股東可以根據客户協議的保證金條款將其股票質押給其經紀人。如果出售股票的股東拖欠保證金貸款,經紀商可以不定期提供和出售質押的股票。出售股份的股東及參與股份出售或分銷的任何其他人士將受《交易法》的適用條款及該法案下的規則和條例的約束,包括但不限於規則M。這些條款可能會限制出售股份的股東或任何其他人士的某些活動,並限制購買和出售任何股份的時間。如果任何出售股票的股東被視為規則M所指的關聯購買者或分銷參與者,則出售股票的股東將不被允許
從事普通股賣空。此外,根據M規則,除特定的例外或豁免外,從事證券經銷的人在開始經銷前的一段時間內,不得同時從事與此類證券有關的做市活動和某些其他活動。此外,如果賣空被視為穩定活動,那麼賣空股東將不被允許從事賣空我們的普通股。
所有這些限制都可能影響股票的可銷售性。
如果出售股票的股東通知我們,它與經紀交易商就普通股的轉售達成了重大安排,則我們將被要求修改本招股説明書所屬的登記
聲明,並提交招股説明書附錄,描述出售股票的股東
與經紀交易商之間的協議。
根據金融行業監管局(FINRA)的指導方針,FINRA任何成員獲得的最高對價或折扣不得超過根據本招股説明書發行的證券總金額的8%。
我們的普通股、股息和
相關股東信息
市場信息。我們的普通股,
每股面值0.001美元(“普通股”),目前在納斯達克資本市場以“ABVC”報價。
持有人
截至四月 [●]2024年,我們擁有約656名普通股股東。
分紅
我們普通股的持有人有權獲得
我們的董事會我們的普通股從未支付過股息,我們也沒有
預計在可預見的將來,我們的普通股將支付股息。
根據股權補償計劃授權發行的證券
下表披露截至2023年12月31日止年度
有關
我們獲授權發行股本證券的薪酬計劃(包括個人薪酬安排)的資料,彙總如下:
股權薪酬計劃信息
| 計劃類別 | |
證券數量
待簽發
在
演練
傑出的
選項,
認股權證
和權利 | | |
加權的-
平均值
練習
價格
傑出的
選項,
認股權證
和權利 | | |
的股份
常見
庫存
剩餘
適用於
未來
發行
在權益下
補償
平面圖 | |
| 證券持有人批准的股權補償計劃 | |
| 2,587,104 | | |
$ | 2.79 | | |
| 3,860,211 | |
| 未經證券持有人批准的股權補償計劃 | |
| - | | |
| - | | |
| - | |
| 總計 | |
| 2,587,104 | | |
$ | 2.79 | | |
| 3,860,211 | |
法律事務
本招股説明書提供的證券的有效性由Hunter Taubman Fischer&Li有限責任公司為我們傳遞。
專家
ABVC BioPharma,Inc.的合併財務報表截至2023年和2022年12月31日 本招股説明書其他部分已由WWC P.C.審核。註冊會計師,獨立註冊
公共會計師事務所,如在本文其他地方出現的報告中所述,並
包括在依賴該公司作為會計專家的權威所提供的報告時
和審計。
地點
更多信息
我們是一家報告公司,在美國證券交易委員會提交年度、季度和特別報告以及其他信息。報告和其他信息的副本可在美國證券交易委員會的
公共資料室閲讀和複製,地址為華盛頓特區20549。您可以通過寫信給美國證券交易委員會並支付複印費來索要此類文檔的副本。您可以撥打美國證券交易委員會電話1-800-美國證券交易委員會-0330獲取公共資料室的運作信息。
美國證券交易委員會有一個網站http://www.sec.gov,其中包含通過電子方式向美國證券交易委員會備案的登記人的報告、委託書和信息聲明以及其他信息。
本招股説明書是我們向美國證券交易委員會提交的S-1表格註冊聲明的一部分。根據美國證券交易委員會的規則和規定,本招股説明書中遺漏了註冊説明書中的某些信息。我們還在註冊説明書中提交了不包括在招股説明書中的展品和時間表
。有關更多信息,您可以:
| ● | 在美國證券交易委員會公共資料室免費閲讀註冊聲明副本,包括展品和時間表
;或 |
| ● | 支付美國證券交易委員會規定的費用後,從美國證券交易委員會獲取一份副本。 |
我們向美國證券交易委員會提交定期報告、委託書和
其他信息。這些定期報告、委託書和其他信息將在美國證券交易委員會的公共參考設施和上文提到的美國證券交易委員會的網站上供查閲和複製。本次發行結束後,
您可以在合理可行的範圍內儘快免費獲取我們的10-K表格年度報告、10-Q表格季度報告、8-K表格當前報告以及根據交易法第13(A)或15(D)節向美國證券交易委員會提交或提交的那些報告的修正案
在美國證券交易委員會以電子方式存檔或提供這些材料後
。本招股説明書中包含的信息或可通過本網站訪問的信息不包含在本招股説明書中作為參考。
披露證監會對證券法責任賠償的立場
鑑於根據上述條款,我們的董事、高級管理人員和控制人可以
對根據1933年證券法產生的責任進行賠償,
我們已被告知,美國證券交易委員會認為此類賠償違反了證券法
所表達的公共政策,因此不可執行。如果董事、高級職員或控制人就正在登記的證券提出賠償要求,要求賠償該等責任(我們的一位董事、高級職員或控制人因成功抗辯任何訴訟、訴訟或訴訟而招致或支付的費用除外),除非我們的律師認為該問題已通過控制先例解決,向具有適當司法管轄權的法院提交我們的賠償是否違反《證券法》中所表達的公共政策以及是否受該問題的最終裁決的問題
。
財務報表和補充數據
我們的綜合財務報表及其附註
以及WWC P.C.的報告,我們的獨立註冊會計師事務所CPA,載於本報告第F—2頁至F—38頁。
目錄
| 頁 |
F-2 |
獨立註冊會計師事務所報告書(PCAOB ID 1171) |
| |
|
|
| 頁 |
F-4 |
截至2023年12月31日和2022年12月31日的合併資產負債表。 |
| |
|
|
| 頁 |
F-5 |
截至2023年12月31日和2022年12月31日的綜合經營報表和全面虧損。 |
| |
|
|
| 頁 |
F-6 |
截至2023年12月31日和2022年12月31日的合併現金流量表。 |
| |
|
|
| 頁面 |
F-7 |
截至2023年12月31日和2022年12月31日的合併股東權益(虧損)報表。 |
| |
|
|
| 頁面 |
F-8 |
合併財務報表附註。 |

獨立註冊會計師事務所報告{br
| 致: | 公司的董事會和股東 |
| ABVc BioPharma公司 |
對財務報表的幾點看法
本公司已審計所附ABVC BioPharma,Inc.及附屬公司(統稱“公司”)截至2023年12月31日、2023年及2022年的綜合資產負債表,以及相關的綜合經營報表及全面虧損、現金流量、股東權益(虧損)、
及相關附註(統稱為“財務報表”)。我們認為,財務報表在所有重要方面都公平地反映了本公司截至2023年12月31日和2022年12月31日的財務狀況,以及截至2023年12月31日的兩個年度的經營成果和現金流量,符合美國公認的會計原則
。
非常懷疑該公司是否有能力繼續作為持續經營的企業
隨附的財務報表
是在假設公司將作為持續經營企業繼續存在的情況下編制的。如財務報表附註2所述,本公司於截至2023年12月31日止年度錄得鉅額虧損。截至2023年12月31日,公司營運資金出現赤字,經營活動現金淨流出。這些情況令人對該公司是否有能力繼續經營下去產生很大的懷疑。附註2也説明瞭管理層在這些事項上的計劃。財務報表
不包括這種不確定性的結果可能導致的任何調整。
意見基礎
這些財務報表
由公司管理層負責。我們的責任是根據我們的審計對公司的財務報表
發表意見。我們是一家在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券法以及美國證券交易委員會和PCAOB適用的規則和法規,我們必須與公司保持獨立。
我們根據PCAOB的標準
進行審核。這些標準要求我們計劃和執行審計,以獲得關於財務報表是否沒有重大錯報的合理保證,無論是由於錯誤還是舞弊。本公司不需要對其財務報告的內部控制進行審計,我們也沒有受聘進行審計。作為我們審計的一部分,我們被要求
瞭解財務報告的內部控制,但不是為了表達對我們財務報告內部控制的有效性的意見
。因此,我們不表達這樣的意見。
我們的審計包括執行
評估財務報表重大錯報風險的程序,無論是由於錯誤還是欺詐,以及執行應對這些風險的程序
。這些程序包括在測試的基礎上審查與財務報表中的金額和披露有關的證據。我們的審計還包括評估管理層使用的會計原則和作出的重大估計,以及評估財務報表的整體列報。我們相信,我們的審計為我們的意見提供了合理的基礎。

關鍵審計事項
以下溝通的關鍵審計事項
是指與財務報表本期審計有關或需要
傳達給審計委員會的事項,並且:(1)與財務報表重要的賬目或披露有關,以及
(2)涉及我們特別具有挑戰性、主觀性或複雜的判斷。傳達關鍵審計事項不會以任何方式改變
吾等對綜合財務報表整體的意見,且吾等不會透過傳達以下關鍵審計
事項,就關鍵審計事項或與之相關的賬目或披露提供單獨意見。
通過普通股購買財產
如財務報表附註5所述,本公司收購該物業時訂立一份複雜的合作協議,並受一份複雜的合作協議規管。協議的條款
和條件規定在公司的財務
報表中對這些財產進行適當分類和確認。因此,由於
此類合作協議的複雜性,我們已將通過普通庫存購買財產和設備確定為關鍵審計事項。
我們為解決此關鍵審計事項而執行的主要審計程序
如下:(i)審查了合作協議和其他相關
文件,評估了條款和條件,(ii)通過詢問
管理層,瞭解了協議規定的結構,(iii)與合作協議中的交易對手確認其對
合作協議條款和條件的理解,並將其答覆與公司的(iv)測試了物業估值中使用的關鍵基礎數據的合理性、完整性、數學準確性和相關性。普通
庫存、額外支付的資本、財產和設備淨額受此關鍵審計事項的影響。
對第三方的股票補償
如
財務報表附註12所述,公司向第三方授予普通股,作為顧問提供服務的對價;這些
授予在公司經營業績中記錄為基於股票的補償費用。我們將
對非僱員的股票補償確認為關鍵審計事項,原因是管理層
作出了重大判斷和假設,
對此類補助進行了適當的估值和分配。
我們
為解決這一關鍵審計事項而執行的主要程序如下:(i)獲得並審查董事會會議記錄、董事會決議和服務合同,(ii)評估從接受補助金的非僱員處獲得的服務的公允價值的合理性,或者以合同開始時的公允價值計量,或服務合約完成日期前後,並
將該等金額與基於當時市場價值的補助金公平值進行比較。普通
股票、額外支付的資本和基於股票的薪酬受此關鍵審計事項的影響。
WWC,P.C.
註冊會計師
PCAOB ID號:1171
自2022年以來,我們一直擔任公司的審計師。
加利福尼亞州聖馬特奧
2024年3月13日
ABVc BioPharma公司及附屬公司
合併資產負債表
| | |
十二月三十一日,
2023 | | |
2022年12月31日
| |
| 資產 | |
| | |
| |
| 流動資產 | |
| | |
| |
| 現金和現金等價物 | |
$ | 60,155 | | |
$ | 85,265 | |
| 受限現金 | |
| 656,625 | | |
| 1,306,463 | |
| 應收賬款淨額 | |
| 1,530 | | |
| 98,325 | |
| 應收賬款—關聯方,淨額 | |
| 10,463 | | |
| 757,343 | |
| 應收關聯方款項—流動 | |
| 747,573 | | |
| 513,819 | |
| 短期投資 | |
| 79,312 | | |
| 75,797 | |
| 預付費用和其他流動資產 | |
| 101,051 | | |
| 150,235 | |
| 流動資產總額 | |
| 1,656,709 | | |
| 2,987,247 | |
| | |
| | | |
| | |
| 財產和設備,淨額 | |
| 7,969,278 | | |
| 573,978 | |
| 經營性租賃使用權資產 | |
| 809,283 | | |
| 1,161,141 | |
| 長期投資 | |
| 2,527,740 | | |
| 842,070 | |
| 遞延税項資產,淨額 | |
| - | | |
| 117,110 | |
| 預付費用--非流動費用 | |
| 78,789 | | |
| 135,135 | |
| 證券保證金 | |
| 62,442 | | |
| 58,838 | |
| 為長期投資提前還款 | |
| 1,274,842 | | |
| 2,838,578 | |
| 應收關聯方款項—非流動,淨額 | |
| 113,516 | | |
| 865,477 | |
| 總資產 | |
$ | 14,492,599 | | |
$ | 9,579,574 | |
| | |
| | | |
| | |
| 負債和權益 | |
| | | |
| | |
| 流動負債 | |
| | | |
| | |
| 銀行短期貸款 | |
$ | 899,250 | | |
$ | 1,893,750 | |
| 應計費用和其他流動負債 | |
| 3,696,380 | | |
| 2,909,587 | |
| 合同責任 | |
| 79,500 | | |
| 10,985 | |
| 應納税金 | |
| 112,946 | | |
| - | |
| 經營租賃負債--流動部分 | |
| 401,826 | | |
| 369,314 | |
| 因關聯方的原因 | |
| 173,132 | | |
| 359,992 | |
| 應付可轉換票據—第三方,淨額 | |
| 569,456 | | |
| - | |
| 流動負債總額 | |
| 5,932,490 | | |
| 5,543,628 | |
| | |
| | | |
| | |
| 租户保證金 | |
| 21,680 | | |
| 7,980 | |
| 經營租賃負債—非流動部分 | |
| 407,457 | | |
| 791,827 | |
| 總負債 | |
| 6,361,627 | | |
| 6,343,435 | |
| 承付款和或有事項 | |
| | | |
| | |
| 權益 | |
| | | |
| | |
| 優先股,面值0.001美元,授權2000萬股,無已發行和已發行股票 | |
| - | | |
| - | |
| 普通股,面值0.001美元,授權100,000,000股,已發行和已發行股票分別為7,940,298股和3,286,190股,分別截至2023年和2022年12月31日(1) | |
| 7,940 | | |
| 3,286 | |
| 額外實收資本 | |
| 82,636,966 | | |
| 67,937,050 | |
| 股票認購應收賬款 | |
| (451,480 | ) | |
| (1,354,440 | ) |
| 累計赤字 | |
| (65,420,095 | ) | |
| (54,904,439 | ) |
| 累計其他綜合收益 | |
| 516,387 | | |
| 517,128 | |
| 庫存股 | |
| (8,901,668 | ) | |
| (9,100,000 | ) |
| 股東權益總額 | |
| 8,388,050 | | |
| 3,098,585 | |
| 非控股權益 | |
| (257,078 | ) | |
| 137,554 | |
| 總股本 | |
| 8,130,972 | | |
| 3,236,139 | |
| | |
| | | |
| | |
| 負債和權益總額 | |
$ | 14,492,599 | | |
$ | 9,579,574 | |
| (1) |
上期業績已進行調整,以反映2023年7月25日生效的10股1股反向股票拆分。 |
附註是這些合併財務報表的組成部分。
ABVc BioPharma公司及附屬公司
合併經營報表和全面虧損
| |
|
截至十二月三十一日止的年度: |
|
| |
|
2023 |
|
|
2022 |
|
| 收入 |
|
$ |
152,430 |
|
|
$ |
969,783 |
|
| |
|
|
|
|
|
|
|
|
| 收入成本 |
|
|
302,037 |
|
|
|
286,415 |
|
| |
|
|
|
|
|
|
|
|
| 毛利(虧損) |
|
|
(149,607 |
) |
|
|
683,368 |
|
| |
|
|
|
|
|
|
|
|
| 運營費用 |
|
|
|
|
|
|
|
|
| 銷售、一般和行政費用 |
|
|
5,368,278 |
|
|
|
6,067,545 |
|
| 研發費用 |
|
|
1,062,916 |
|
|
|
2,693,457 |
|
| 基於股票的薪酬 |
|
|
1,635,708 |
|
|
|
7,036,778 |
|
| 總運營費用 |
|
|
8,066,902 |
|
|
|
15,797,780 |
|
| |
|
|
|
|
|
|
|
|
| 運營虧損 |
|
|
(8,216,509 |
) |
|
|
(15,114,412 |
) |
| |
|
|
|
|
|
|
|
|
| 其他收入(費用) |
|
|
|
|
|
|
|
|
| 利息收入 |
|
|
185,481 |
|
|
|
187,817 |
|
| 利息支出 |
|
|
(2,493,340 |
) |
|
|
(293,968 |
) |
| 經營性轉租收入 |
|
|
65,900 |
|
|
|
107,150 |
|
| 減值損失 |
|
|
- |
|
|
|
(110,125 |
) |
| 投資損失 |
|
|
- |
|
|
|
(7,446 |
) |
| 外匯變動損益 |
|
|
22,690 |
|
|
|
(259,463 |
) |
| 股權證券投資虧損 |
|
|
(221,888 |
) |
|
|
- |
|
| 其他收入(費用) |
|
|
3,384 |
|
|
|
(24,149 |
) |
| 其他收入(費用)合計 |
|
|
(2,437,773 |
) |
|
|
(400,184 |
) |
| |
|
|
|
|
|
|
|
|
| 撥備所得税前虧損 |
|
|
(10,654,282 |
) |
|
|
(15,514,596 |
) |
| |
|
|
|
|
|
|
|
|
| 所得税費用準備 |
|
|
256,006 |
|
|
|
797,778 |
|
| |
|
|
|
|
|
|
|
|
| 淨虧損 |
|
|
(10,910,288 |
) |
|
|
(16,312,374 |
) |
| |
|
|
|
|
|
|
|
|
| 非控股權益應佔淨虧損 |
|
|
(394,632 |
) |
|
|
110,865 |
|
| |
|
|
|
|
|
|
|
|
| 歸屬於ABVC及其子公司的淨虧損 |
|
|
(10,515,656 |
) |
|
|
(16,423,239 |
) |
| 外幣折算調整 |
|
|
(741 |
) |
|
|
(22,532 |
) |
| 綜合損失 |
|
$ |
(10,516,397 |
) |
|
$ |
(16,445,771 |
) |
| |
|
|
|
|
|
|
|
|
| 每股淨虧損: |
|
|
|
|
|
|
|
|
| 基本的和稀釋的 |
|
$ |
(2.43 |
) |
|
$ |
(5.19 |
) |
| |
|
|
|
|
|
|
|
|
| 已發行普通股加權平均數(1): |
|
|
|
|
|
|
|
|
| 基本的和稀釋的 |
|
|
4,335,650 |
|
|
|
3,166,460 |
|
| (1) |
上期業績已進行調整,以反映2023年7月25日生效的10股1股反向股票拆分。 |
附註是這些合併財務報表的組成部分。
ABVc BioPharma公司及附屬公司
合併現金流量表
截至2023年12月31日及2022年12月31日止年度
| | |
2023 | | |
2022 | |
| 經營活動的現金流 | |
| | |
| |
| 淨虧損 | |
$ | (10,910,288 | ) | |
$ | (16,312,374 | ) |
| 對淨虧損與經營活動中使用的現金淨額進行的調整: | |
| | | |
| | |
| 折舊 | |
| 28,531 | | |
| 23,799 | |
| 股票補償 | |
| 1,635,708 | | |
| 7,036,778 | |
| 估價損失存貨準備 | |
| - | | |
| 25,975 | |
| 壞賬準備 | |
| 1,455,101 | | |
| 184,589 | |
| 其他非現金費用 | |
| 2,413,746 | | |
| 32,350 | |
| 預付費用減值 | |
| - | | |
| 110,125 | |
| 股權證券投資虧損 | |
| 221,888 | | |
| - | |
| 遞延税費 | |
| 115,668 | | |
| 864,802 | |
| 經營性資產和負債變動情況: | |
| | | |
| | |
| 應收賬款減少(增加) | |
| 228,557 | | |
| (614,166 | ) |
| 預付費用和其他流動資產的減少(增加) | |
| 101,926 | | |
| 238,092 | |
| 減少(增加)關聯方應收賬款 | |
| (321,776 | ) | |
| (837,014 | ) |
| 應計費用和其他流動負債增加(減少) | |
| 786,793 | | |
| 1,608,784 | |
| 合同負債增加(減少) | |
| 68,515 | | |
| - | |
| 增加(減少)租户保證金 | |
| 13,700 | | |
| (2,600 | ) |
| 應納税金增加(減少) | |
| 112,946 | | |
| - | |
| 增加(減少)對關聯方的欠款 | |
| (186,860 | ) | |
| 242,469 | |
| 用於經營活動的現金淨額 | |
| (4,235,845 | ) | |
| (7,398,391 | ) |
| | |
| | | |
| | |
| 投資活動產生的現金流 | |
| | | |
| | |
| 購買設備 | |
| (21,201 | ) | |
| (119,692 | ) |
| 股權投資提前還款 | |
| (338,985 | ) | |
| (1,601,992 | ) |
| 用於投資活動的現金淨額 | |
| (360,186 | ) | |
| (1,721,684 | ) |
| | |
| | | |
| | |
| 融資活動產生的現金流 | |
| | | |
| | |
| 普通股發行 | |
| 1,050,000 | | |
| 3,663,925 | |
| 償還銀行短期貸款 | |
| (1,000,000 | ) | |
| - | |
| 發行認股權證所得款項 | |
| 2,406,338 | | |
| - | |
| 銀行短期貸款收益 | |
| - | | |
| 350,000 | |
| 可轉換應付票據的收益 | |
| 1,462,622 | | |
| - | |
| 融資活動提供的現金淨額 | |
| 3,918,960 | | |
| 4,013,925 | |
| | |
| | | |
| | |
| 匯率變動對現金及現金等價物和限制性現金的影響 | |
| 2,123 | | |
| (67,337 | ) |
| | |
| | | |
| | |
| 現金及現金等價物和限制性現金淨增(減) | |
| (674,948 | ) | |
| (5,173,487 | ) |
| | |
| | | |
| | |
| 現金及現金等價物和限制性現金 | |
| | | |
| | |
| 起頭 | |
| 1,391,728 | | |
| 6,565,215 | |
| 收尾 | |
$ | 716,780 | | |
$ | 1,391,728 | |
| | |
| | | |
| | |
| 補充披露現金流量 | |
| | | |
| | |
| 年內支付的現金: | |
| | | |
| | |
| 支付的利息費用 | |
$ | 33,180 | | |
$ | 285,465 | |
| 已繳納的所得税 | |
$ | 27,392 | | |
$ | 1,600 | |
| 非現金融資和投資活動 | |
| | | |
| | |
| 通過向第三方發行普通股購買財產和設備 | |
$ | 7,400,000 | | |
$ | - | |
| 發行普通股以轉換債務 | |
$ | 3,306,112 | | |
$ | - | |
附註是這些合併財務報表的組成部分。
ABVc BioPharma公司及附屬公司
股東權益合併報表(虧損)
截至2023年12月31日及2022年12月31日止年度
| | |
普通股
股票 | | |
庫存 | | |
其他內容 | | |
| | |
累計
其他 | | |
庫房
庫存 | | |
非 | | |
股東的 | |
| | |
第
個
股票(1) | | |
金額(1) | | |
訂閲
應收 | | |
已繳費
資本(1) | | |
累計赤字
| | |
全面
收入 | | |
數量
個共享(1) | | |
金額 | | |
控制
權益 | | |
合計
權益 | |
| 2021年12月31日的餘額
| |
| 2,893,089 | | |
$ | 2,893 | | |
$ | (2,257,400 | ) | |
$ | 58,139,700 | | |
$ | (38,481,200 | ) | |
$ | 539,660 | | |
| (27,535 | ) | |
$ | (9,100,000 | ) | |
$ | 26,689 | | |
$ | 8,870,342 | |
| 發行普通股以換取現金 | |
| 200,000 | | |
| 200 | | |
| - | | |
| 3,663,725 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 3,663,925 | |
| 發行諮詢服務普通股
| |
| 193,101 | | |
| 193 | | |
| - | | |
| 4,891,695 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 4,891,888 | |
| 基於股票的服務薪酬
| |
| - | | |
| - | | |
| 902,960 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 902,960 | |
| 基於股票的期權補償
| |
| - | | |
| - | | |
| - | | |
| 1,241,930 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 1,241,930 | |
| 本年度淨虧損
| |
| - | | |
| - | | |
| - | | |
| - | | |
| (16,423,239 | ) | |
| - | | |
| - | | |
| - | | |
| 110,865 | | |
| (16,312,374 | ) |
| 累計
交易調整 | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| (22,532 | ) | |
| - | | |
| - | | |
| - | | |
| (22,532 | ) |
| 2022年12月31日的餘額
| |
| 3,286,190 | | |
$ | 3,286 | | |
$ | (1,354,440 | ) | |
$ | 67,937,050 | | |
$ | (54,904,439 | ) | |
$ | 517,128 | | |
| (27,535 | ) | |
$ | (9,100,000 | ) | |
$ | 137,554 | | |
$ | 3,236,139 | |
| 發行普通股以換取現金 | |
| 300,000 | | |
| 300 | | |
| - | | |
| 1,049,700 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 1,050,000 | |
| 發行諮詢服務普通股
| |
| 51,941 | | |
| 52 | | |
| - | | |
| 732,696 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 732,748 | |
| 發行物業普通股
| |
| 370,000 | | |
| 370 | | |
| - | | |
| 7,399,630 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 7,400,000 | |
| 行使可轉換票據時發行普通股
| |
| 3,732,167 | | |
| 3,732 | | |
| - | | |
| 3,302,380 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 3,306,112 | |
| 與應付可轉換票據一起發行的認股權證 | |
| - | | |
| - | | |
| - | | |
| 1,706,338 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 1,706,338 | |
| 發行預融資權證
| |
| - | | |
| - | | |
| - | | |
| 700,000 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 700,000 | |
| 行使預融資權證
| |
| 200,000 | | |
| 200 | | |
| - | | |
| (200 | ) | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | |
| 基於股票的服務薪酬
| |
| - | | |
| - | | |
| 902,960 | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| 902,960 | |
| 本年度淨虧損
| |
| - | | |
| - | | |
| - | | |
| - | | |
| (10,515,656 | ) | |
| - | | |
| - | | |
| - | | |
| (394,632 | ) | |
| (10,910,288 | ) |
| 累計
交易調整 | |
| - | | |
| - | | |
| - | | |
| - | | |
| - | | |
| (741 | ) | |
| - | | |
| - | | |
| - | | |
| (741 | ) |
| 將
作為員工薪酬發放 | |
| - | | |
| - | | |
| - | | |
| (190,628 | ) | |
| - | | |
| - | | |
| 591 | | |
| 198,332 | | |
| - | | |
| 7,704 | |
| 餘額
於二零二三年十二月三十一日 | |
| 7,940,298 | | |
$ | 7,940 | | |
$ | (451,480 | ) | |
$ | 82,636,966 | | |
$ | (65,420,095 | ) | |
$ | 516,387 | | |
| (26,553 | ) | |
$ | (8,901,668 | ) | |
$ | (257,078 | ) | |
$ | 8,130,972 | |
| (1) |
上期業績已進行調整,以反映2023年7月25日生效的10股1股反向股票拆分。 |
附註是這些合併財務報表的組成部分。
ABVc BioPharma公司及附屬公司
合併財務報表附註
1.業務的組織和描述
ABVc BioPharma,Inc.(“公司”),
前身為美國BriVision(Holding)公司,是內華達州的一家公司,通過該公司的運營實體美國BriVision Corporation(“BriVision”),於2015年7月在特拉華州註冊成立,從事生物技術
以滿足未得到滿足的醫療需求,並專注於開發從植物中提取的新藥和醫療器械。BriVision通過仔細跟蹤亞太地區研究機構的新醫學發現或醫療設備技術,
開發其銷售渠道。該公司仔細檢查臨牀前、疾病動物模型和第一階段安全性研究,以確定BriVision
認為具有療效和安全性的藥物。一旦一種藥物看起來是開發和最終商業化的良好候選藥物,
BriVision將從最初的研究人員那裏獲得藥物或醫療設備的許可,並開始向美國、澳大利亞和臺灣受人尊敬的
主要研究人員介紹藥物臨牀計劃,以進行第二階段臨牀試驗。目前,該公司的藥物和醫療器械的臨牀試驗正在斯隆·凱特林紀念癌症中心(“MSKCC”)和MD安德森癌症中心等世界著名機構進行。BriVision在2015年7月21日成立之前沒有前身運營。
收購AiBtl BioPharma Inc.
2023年11月12日,公司及其
子公司BioLite,Inc.(“BioLite Taiwan”)各自與AiBtl BioPharma
Inc.簽訂了多年期全球許可協議。(“AIBL”,或被收購公司),用於本公司和BioLite臺灣的用於MDD(嚴重抑鬱症)和ADHD(注意力缺陷多動障礙)適應症的中樞神經系統藥物(統稱為“許可產品”)。潛在的
許可將涵蓋許可產品的臨牀試驗、註冊、製造、供應和分銷權。雙方
決定在全球範圍內合作開發許可產品。雙方還在努力加強新藥開發和業務合作,包括技術、互操作性和標準開發。根據各自的
協議,ABVC和BioLite Taiwan各自獲得了2300萬股AIBL股票,因此,本公司擁有AIBL的控股權益
。如果達到了某些里程碑,公司和BioLite臺灣將分別獲得3,500,000美元和相當於淨銷售額5%的專利費,最高可達1億美元。
該公司的結論是,收購的資產和承擔的負債不符合企業的定義,因為收購了有限數量的投入,但沒有獲得實質性業務
流程或產出跡象。因此,這筆收購被計入資產購買。購買對價
為2023年11月12日的非貨幣性資產(專利)和轉讓。股權於2023年12月15日轉讓給ABVC和BioLite臺灣。
2.流動資金和持續經營
隨附的財務報表是根據美國公認會計準則
編制的,該準則考慮在持續經營的基礎上繼續經營本公司。持續經營基礎假設資產已變現,負債在正常業務過程中按財務報表中披露的金額結算。本公司能否持續經營取決於其營銷和銷售其產品以產生正運營現金流的能力。
截至2023年12月31日的年度,本公司報告淨虧損10,910,288美元。截至2023年12月31日,公司營運資本赤字為4,275,781美元。此外,在截至2023年12月31日的年度內,公司經營活動的現金淨流出為4,235,845美元。這些條件令人對本公司能否繼續經營下去產生很大的疑問。
為了維持其支持公司經營活動的能力,公司可能需要考慮通過以下來源補充其可用的資金來源:
| ● | 可從臺灣銀行和其他金融機構獲得的其他融資來源;以及 |
管理層的計劃是繼續改善運營,以產生正現金流,並通過私募或公開發行,或關聯方或股東的財務支持來籌集額外資本。
如果公司無法產生正運營現金流,並籌集額外資本,則公司可能無法履行其短期義務。所有這些因素令人對本公司作為持續經營企業的持續經營能力產生重大懷疑。
截至2023年、2023年和2022年12月31日止年度的經審核財務報表均以持續經營為基礎編制,不包括任何調整以反映因本公司無法繼續經營而可能對資產的可回收性和分類或對資產的金額和負債分類造成的未來影響。
3.主要會計政策摘要
陳述的基礎
隨附的綜合財務報表乃根據美國公認會計原則(“美國公認會計原則”)及
美國證券交易委員會(“美國證券交易委員會”)的規定編制。所有重要的公司間交易和帳户餘額均已註銷。
對上一年度列報的重新分類
前一年未經審核的綜合資產負債表和未經審核的綜合現金流量表金額已重新分類,以便與本年度的列報保持一致。
這些重新分類對報告的經營業績沒有影響。
財政年度
本公司將其會計年度從10月1日至9月30日的期間更改為自1月1日至12月31日的期間,從2018年1月1日開始。
預算的使用
按照美國公認會計原則編制財務報表要求管理層作出估計和假設,即
會影響合併財務報表日期的資產和負債額、或有資產和負債的披露,以及報告期內的收入和支出。實際結果可能與
這些結果大不相同。
股票反向拆分
2023年7月25日,該公司提交了公司章程修正案證書,授權對其普通股的已發行和流通股進行10股1股的反向股票拆分。公司股東此前在2023年7月7日召開的公司特別股東大會上批准了反向股票拆分。實施反向股票拆分是為了減少已發行和已發行股票的數量,並增加公司普通股的每股交易價值,儘管這一結果並不能得到保證。反過來,本公司相信,股票反向拆分將使本公司能夠恢復遵守納斯達克資本市場的某些持續上市標準。本表格10-K中的所有
股票和相關財務信息反映了這種10股1股的反向股票拆分。
公允價值計量
FASB ASC 820“公允價值計量”
定義了按公允價值記錄的某些金融和非金融資產和負債的公允價值,建立了公允價值計量框架
,並擴大了關於公允價值計量的披露。它要求實體衡量其金融工具
以退出價格為基礎的公允價值,最大限度地使用可觀察單位,並最大限度地減少使用不可觀察投入來確定退出價格
。它建立了一個層次結構,對用於衡量公允價值的估值技術的投入進行優先排序。這一層次結構通過最大限度地使用可觀察到的投入和最大限度地減少不可觀察到的投入的使用,提高了公允價值計量和相關披露的一致性和可比性。可觀察投入是反映市場參與者將根據從獨立於本公司的來源獲得的市場數據為資產或負債定價時使用的
假設。不可觀察到的投入是反映公司自己對市場參與者將使用的假設的假設,這些假設是根據當時可獲得的最佳信息制定的資產或負債定價。該層次結構根據輸入的可靠性將輸入劃分為三個大致級別,如下所示:
| |
● |
第1級-投入是指公司在計量日期有能力獲得的相同
資產或負債在活躍市場的報價。該等工具的估值並不需要作出高度判斷,因為估值是以活躍市場的報價為基礎,而這些報價是隨時可得的。 |
| |
● |
第2級-活躍市場的報價以外的、截至計量日期可直接或間接觀察到的投入,例如類似資產或負債的報價;非活躍市場的報價
;或可觀察到的或可被可觀測的市場數據證實的其他投入,基本上
整個資產或負債的期限。 |
| |
● |
級別3-基於無法觀察到且未得到市場數據證實的投入進行估值。此類資產和負債的公允價值通常使用定價模型、貼現現金流法或類似技術來確定,這些方法結合了市場參與者在為資產或負債定價時將使用的假設。 |
本公司若干資產及負債的賬面價值,如現金及現金等價物、限制性現金、應收關聯方應收賬款、存貨、預付費用及其他流動資產、應計費用及其他流動負債,以及因到期時間較短而欠關聯方的約公允價值。本公司的短期銀行貸款、應付可轉換票據及應計利息的賬面價值接近其公允價值,因為借款條款與現行市場利率一致,且到期期限較短
。本公司長期銀行貸款的賬面價值接近公允價值,因為利率接近本公司可獲得的類似條款和期限的債務的市場利率。
信用風險集中
本公司面臨集中信用風險的金融工具主要包括現金和現金等價物。本公司將現金和臨時
現金投資於優質信貸機構,但這些投資可能超過臺灣中央存款保險公司和美國聯邦存款保險公司的保險限額。本公司並不以對衝、交易或投機為目的而訂立金融工具。
我們對客户進行持續的信用評估
,不需要抵押品。壞賬準備是基於對應收賬款可收回性的審查。
我們通過考察其歷史催收經驗和當前客户信用質量的趨勢以及其內部信貸政策來確定壞賬準備的金額。實際的信貸損失可能與我們的估計不同。
客户集中
截至2023年12月31日,公司最大的客户是膳食補充劑和膳食補充劑行業中專門從事膳食補充劑和治療藥物開發和商業化的客户,佔公司應收賬款總額的87.24%。
截至2022年12月31日,保健品行業專門從事膳食補充劑和治療藥物開發和商業化的主要客户
佔公司應收賬款總額的71.89%
;董事長為生物鑰匙公司董事董事會的第二大客户佔公司應收賬款總額的16.62%。
截至2023年12月31日止年度,最主要的客户在亞太地區分銷營養補充劑,佔公司總收入的80.04%。截至2022年12月31日止年度,一名主要客户(即本公司股東,在臺灣從事新藥開發和商業化工作)佔本公司總收入的93.22%。
現金和現金等價物
本公司將三個月或以下期限的高流動性投資視為購買時的現金等價物。截至2023年12月31日和2022年12月31日,公司的現金和現金等價物分別為60,155美元和85,265美元。本公司的部分現金存款存放在位於臺灣的金融機構,該機構目前有強制銀行賬户強制性保險的規定。本公司相信這家金融機構
具有較高的信用質量。
受限現金
受限現金主要包括在臺灣的儲備銀行賬户中持有的現金。截至2023年12月31日和2022年12月31日,公司的限制性現金分別為656,625美元和1,306,463美元,
。
庫存
庫存包括原材料、在製品、產成品和商品。存貨按成本或市價中較低者列報,並按移動加權平均成本計價。
市價是根據可變現淨值釐定的。公司定期審查其庫存的使用年限和週轉率,以確定是否有任何庫存已經過時或價值下降,並因已知和預期的過時庫存而產生運營費用
。
應收帳款和預計信用損失準備帳款
應收賬款按原始發票金額減去任何潛在壞賬準備後入賬。
本公司根據我們對各種因素的評估,對預期信貸和應收賬款損失準備和未開單應收賬款準備的預期信貸和可收回趨勢進行估計。這些因素包括歷史經驗、應收賬款餘額的年齡、客户的信用質量、當前經濟狀況
對未來經濟狀況的合理和可支持的預測,以及其他可能影響我們從客户那裏收回的因素。
該撥備是根據應收賬款餘額記錄的,並在綜合收益表中記錄了相應的費用。
實際收到的金額可能與管理層對信用價值和經濟環境的估計不同。在管理層確定不可能收回的情況下,將拖欠賬款
餘額與壞賬準備進行核銷。
截至2023年12月31日和2022年12月31日,預期信貸損失賬户的撥備分別為616,505美元和194,957美元。
收入確認
在2018財年,公司採用了會計準則編纂(“ASC”),主題606(ASC 606),與客户的合同收入,對截至2018年1月1日尚未完成的所有合同採用修改的
追溯方法,並將新的收入標準作為對2018年初累計赤字期初餘額的調整
,以產生累積影響。自2018年1月1日及之後開始的本公司
報告期的業績根據ASC 606列報,而上期金額不作調整,
繼續根據上期有效的會計準則進行報告。根據公司對截至2018年1月1日的現有合作協議的審查,公司得出結論,採用新的指導方針對公司在所述所有期間的收入沒有重大的
變化。
根據ASC 606,當其客户獲得承諾的商品或服務的控制權時,公司確認收入
,該金額反映了公司期望
以這些商品或服務為交換所獲得的對價。為確定公司認定在ASC 606範圍內的安排的收入確認,公司執行以下五個步驟:(I)確定與客户的合同;(Ii)確定合同中的履約義務;(Iii)確定交易價格;(Iv)將交易價格分配給合同中的履約義務
;以及(V)在公司履行履約義務時確認收入。只有當公司可能收取公司有權獲得的對價以換取公司轉讓給客户的
商品或服務時,公司才會將五步模式應用於合同。在合同開始時,一旦合同被確定在ASC 606的範圍內,公司將評估每份合同中承諾的貨物或服務,確定屬於履約義務的貨物或服務,並評估每一項承諾的貨物或服務是否不同。然後,公司將在履行履約義務時分配給各自履約義務的交易價格
確認為收入。
以下是公司
根據公司收到的付款類型確認收入的示例。
協作收入-公司
確認通過協作研究、開發和/或商業化協議產生的協作收入。這些協議的條款
通常包括向公司支付與以下一項或多項有關的款項:不可退還的預付許可費、開發和商業里程碑、研發成本的部分或全部報銷,以及許可產品淨銷售額的版税
。除許可產品淨銷售額的版税收入外,每種類型的支付都會帶來協作收入,這被歸類為版税收入。到目前為止,該公司尚未收到任何特許權使用費收入。通過將商品或服務的控制權轉讓給協作合作伙伴,在履行履行義務時確認收入。
作為這些安排的會計處理的一部分,公司應用判斷來確定履約義務是否不同,並在確定協作協議中確定的每個不同履約義務的獨立售價時進行假設。為了確定獨立的銷售價格,公司依據的假設可能包括預測收入、開發時間表、研發人員成本的報銷率、貼現率以及技術和監管成功的概率。
根據
合作協議,該公司有多項可交付成果,包括與授予技術許可證、監管和臨牀開發以及
營銷活動有關的可交付成果。對公司可交付成果的績效期的估計需要使用管理層的
判斷。管理層評估估計績效期間時考慮的重要因素包括但不限於
公司在開展臨牀開發、監管和生產活動方面的經驗。本公司每年檢討其合作協議項下的
估計履約期間,並按預期基準作出任何適當調整
。根據其合作協議對業績期間估計的未來變動可能影響未來收入確認的時間。
(I)不可退還的預付款項
如果公司知識產權的許可被確定有別於協議中確定的其他履約義務,公司將根據許可規定的相對獨立銷售價格與安排的總銷售價格相比,確認相關不可退還預付款的收入
。當許可證轉讓給協作合作伙伴,並且協作合作伙伴能夠使用許可證並從中受益時,確認收入。截至目前,收到的不可退還的預付費用僅用於補償公司在簽訂合作協議之前所做的研究工作和貢獻,而不涉及公司與合作伙伴之間未來在合作協議中的任何義務和承諾
。
(Ii)里程碑付款
根據與協作合作伙伴簽訂的基於特定開發、法規和商業活動的合作協議,公司有資格獲得里程碑式的付款
。管理層評估了觸發這些或有付款的事件的性質,並得出結論認為,這些事件分為兩類:(A)涉及履行公司與合作伙伴合作協議項下義務的事件,以及(B)不涉及履行公司與合作伙伴合作協議項下義務的事件。
前一類里程碑付款包括由合作協議中指定地區的開發和監管活動觸發的付款。管理層得出結論,這些付款中的每一筆都是實質性的里程碑付款。這一結論主要基於以下事實:(I)每個觸發事件代表一個特定的結果,只有通過公司成功執行其一個或多個可交付成果才能實現;(Ii)每個觸發事件的實現受到固有風險和不確定性的影響,並將導致應向公司支付額外的
付款;(Iii)每個里程碑付款不可退還;(Iv)完成每個里程碑需要付出大量努力,(V)相對於實現里程碑所創造的價值而言,每個里程碑付款的金額是合理的,(Vi)
預計預付款和潛在里程碑付款之間將經過相當長的一段時間,以及(Vii)里程碑付款僅與過去業績有關。根據前述規定,本公司確認來自這些里程碑付款的任何收入在相關觸發事件發生的期間內。
(三)多元素安排
本公司評估多種要素安排,以確定(1)安排中包括的交付成果,以及(2)各個交付成果是否代表獨立的會計單位,或者它們是否必須作為一個合併的會計單位來核算。此評估涉及主觀確定
,並要求管理層對各個交付成果以及此類交付成果是否與合同關係的其他方面分開進行判斷。交付項目被視為獨立的會計單位,前提是:(I)交付項目對客户具有獨立的價值,以及(Ii)如果安排包括相對於交付項目的一般退貨權,則認為未交付項目的交付或履行被認為是可能的且基本上在其控制範圍之內。在評估協作項下的項目是否具有獨立價值時,公司會考慮協作合作伙伴的研究、製造和商業化
能力以及相關專業知識在一般市場的可用性等因素。公司還會考慮其協作合作伙伴是否可以在未收到剩餘
要素的情況下將其他交付成果用於其預期用途、交付成果的價值是否取決於未交付項目,以及是否有其他供應商可以
提供未交付要素。
當ASC 606中的所有收入確認標準滿足特定會計單位時,公司確認分配給每個會計單位的安排對價
。如果可交付物不代表單獨的會計單位,公司將在公司合同期間或預計履約期內確認未交付要素的合併會計單位的收入,這通常是公司研發義務的期限。如果沒有可識別的業績模式或客觀上不存在可衡量的業績衡量標準,則本公司將在公司預期完成其業績義務的
期間以直線方式確認該安排下的收入。相反,如果可以確定向客户提供服務的績效模式,並且存在客觀可衡量的績效衡量標準,則公司將使用比例績效法在安排下確認收入
。確認的收入限於截至期間結束日使用直線法或按比例業績法確定的累計收到的付款金額或累計收入金額中的較小者。
在包括
里程碑付款的安排開始時,公司根據里程碑的或有
性質評估每個里程碑是否具有實質性,是否對雙方都有風險。該評估包括評估:(1)對價是否與公司實現里程碑的
業績相稱,或者是否因實現里程碑的業績而導致交付項目的價值提升;(2)對價僅涉及過去的業績;以及(3)相對於安排內的所有交付成果和付款條款,對價是合理的。該公司評估為實現特定里程碑而必須克服的科學、臨牀、監管、商業和其他風險等因素,以及在進行此評估時為實現特定里程碑所需的工作和投資水平。在確定一個里程碑是否滿足得出一個里程碑是實質性的結論所需的所有標準時,需要相當多的判斷。假設滿足所有其他
收入確認標準,如果沒有剩餘的績效義務或在剩餘的績效期間,不被視為實質性的里程碑
將被確認為已賺取的。
(4)特許權使用費和利潤分享付款
根據與合作伙伴的合作協議,公司有權獲得產品銷售的版税,按淨銷售額的一定比例收取。公司
根據ASC 606規定的收入確認標準確認這些活動的收入。根據這些標準,公司
將這些付款視為或有收入,並將其確認為適用的或有事項解決期間的收入。
來自研發活動服務的收入—與研發及監管活動相關的收入在執行
相關服務或活動時根據合同條款予以確認。公司通常在合同開始時只有一項履約義務,即提供研發服務。公司還可以向其
客户提供一個選項,要求公司在未來提供其他商品或服務,例如活性
藥物成分、API或IND/NDA/ANDA/510K提交。公司在合同開始時評估這些期權是否為
重要權利。如果本公司確定一項購股權是一項重大權利,本公司將將該購股權視為
單獨的履約義務。
如果公司有權從其客户那裏獲得指定研發費用的報銷,如果公司確定其提供的相關服務代表一項重大權利,則該公司將這些服務作為單獨的
履約義務進行核算。本公司還根據毛收入或淨收入列報的規定,確定研究和開發費用的報銷
是否應作為收入入賬或抵銷研究和開發費用。本公司在履行相關業績義務時,確認相應的收入或記錄相應的研發費用抵銷
。
然後,本公司通過審查本公司根據合同有資格獲得的對價金額(包括任何可變對價)來確定交易價格。根據未完成合同,對價通常包括固定對價和以潛在里程碑付款形式的可變對價
。在協議開始時,公司的交易價格通常包括支付給公司或由公司支付的款項
基於分配給項目的全職相當研究人員的數量和相關的研發費用。
公司通常不會在初始交易價格中包括公司未來可能收到的任何付款,因為付款的可能性不大。公司將在每個報告期重新評估交易總價,以確定公司
是否應在交易價格中包括額外付款。
公司根據每份合同中設定的開單時間表從客户那裏獲得付款。預付款和費用可在收到客户時或到期時記為預付款,並可能要求將收入確認推遲到未來一段時間,直到公司履行這些
安排下的義務。當公司的對價權利是無條件的時,金額被記錄為應收賬款。如果合同開始時的預期是從客户付款到向客户轉讓承諾的貨物或服務之間的時間
為一年或更短時間,則公司
不評估合同是否有重要的融資部分。
財產和設備,淨額
物業及設備淨額按成本
扣除累計折舊後列賬。維修及保養於發生時支銷。改善
相關資產功能或延長使用壽命的支出將被資本化。當物業和設備報廢或以其他方式處置時,相關收益或虧損計入營業收入。租賃物業裝修按
剩餘租賃期或資產估計可使用年限兩者中較短者以直線法折舊。折舊乃按直線法計算,包括資本租賃下之物業
及設備,一般按下列可使用年期計算:
| |
|
預計壽命
年 |
| 建築物和租賃設施的改進 |
|
5 ~ 50 |
| 機器和設備 |
|
5 ~ 10 |
| 辦公設備 |
|
3 ~ 6 |
在建工程
該公司收購建造
某些固定資產的建築。所有與固定資產建設有關的、在資產準備投入使用之前發生的直接和間接成本都作為在建工程資本化。在建工程不計提折舊。
在建工程轉移到特定的固定資產項目,這些資產在準備就緒後開始折舊。
長期資產減值準備
本公司已採用會計準則編撰
小標題360-10,財產、廠房和設備(“ASC 360-10”)。ASC 360-10要求,只要發生事件或情況變化表明資產的賬面金額可能無法收回,公司持有和使用的長期資產和某些可識別的無形資產就必須進行減值審查。本公司每年評估其長期資產的減值,或在事件和情況需要時更頻繁地評估減值。與可恢復性有關的事件可能包括業務狀況的重大不利變化、經常性虧損或預計無法在較長時期內實現盈虧平衡經營業績。如計提減值,則無形資產的賬面價值將根據對資產使用和最終處置所產生的未來貼現現金流量的估計進行調整。
ASC 360-10還要求以賬面價值或公允價值減去出售成本中的較低者報告資產處置。
長期股權投資
本公司收購股權投資以促進業務和戰略目標。本公司對非流通股和本公司無法控制被投資方的其他股權投資進行會計處理,原因如下:
| |
● |
當公司有能力對被投資人施加重大影響但不能控制時,權益法投資。其在收入或虧損中的比例份額按月確認,並計入股權投資的收益(虧損)。 |
需要作出重大判斷以確定本公司非流通股投資的估值是否存在減值
,因此本公司認為這是一項關鍵的會計估計。它的年度分析同時考慮了可能對被投資人的公允價值產生重大影響的定性和定量因素。對其投資的定性分析涉及瞭解被投資方的財務業績和近期前景、被投資方所在行業或地理區域的總體市場狀況變化,以及被投資方的管理和治理結構。對其投資的公允價值的量化評估是使用市場法和收益法進行的。
市場法包括使用私營和上市公司的可比財務指標以及最近幾輪融資。
收益法包括使用貼現現金流模型,這需要對被投資方的收入、成本和貼現率進行大量估計。由於新的發展或應用假設的變化,公司在確定是否存在減值時對這些因素的評估可能會
未來發生變化。
非暫時性減值
公司的長期股權投資
須接受定期減值審查。減值對收益的影響如下:
| |
● |
有價證券包括考慮一般市場情況、公允價值低於成本的持續時間和程度,以及我們持有投資一段足夠時間以在可預見的未來收回價值的能力和意圖。本公司還考慮與被投資方的財務健康狀況和業務前景有關的特定不利條件,可能包括行業和部門表現、技術、運營和融資現金流因素的變化,以及被投資方信用評級的變化。本公司在股權投資的收益(虧損)中記錄了非臨時性的有價證券減值和有價證券方法投資減值。 |
| |
● |
基於公司對減值嚴重程度和持續時間的評估,以及對被投資方經營業績的定性和定量分析;市場狀況和監管或經濟環境的不利變化;被投資方經營結構或管理層的變化;額外的資金需求;以及被投資方維持業務的能力。被投資人的一系列營業虧損或其他因素可能表明投資發生了非臨時性的減值,即使減值幅度超過了採用權益法確認的減值幅度,也應予以確認。投資價值的損失,除暫時性下降外,應當予以確認。價值損失的證據
可能包括但不一定限於,沒有能力收回投資的賬面價值,或被投資人無法
維持盈利能力,從而證明投資的賬面價值是合理的。本公司將非流通成本法投資和權益法投資的非暫時性減值計入權益投資的損益。
截至2023年12月31日和2022年12月31日的年度,股權投資的非臨時性減值分別為0美元和0美元。 |
商譽
本公司每年或更頻繁地評估商譽的減值
當事件發生或情況變化表明賬面價值可能無法收回時。在對商譽進行減值測試時,本公司可選擇利用定性評估來評估報告單位的公允價值是否更有可能低於其賬面價值。如果定性評估顯示商譽減值的可能性較大,本公司將進行兩步減值測試。本公司根據兩步減值測試測試商譽減值,首先將淨資產賬面價值與報告單位的公允價值進行比較。如果公允價值被確定為低於賬面價值或定性因素表明商譽更有可能減值,則執行第二步
以估計商譽公允價值與賬面價值之間的差額計算減值金額。
本公司使用貼現現金流量估計報告單位的公允價值。對未來現金流的預測基於我們對未來淨銷售額和運營費用的最佳估計,主要基於預期的類別擴展、定價、市場細分市場份額
和總體經濟狀況。
本公司於2023年12月31日完成了所需的商譽減值測試,並確定商譽已減值,原因是本公司目前的財務狀況,以及本公司無法在銷售額沒有大幅增加的情況下產生未來的營業收入,這一點具有很大的不確定性。此外,本公司預期未來現金流顯示商譽的可回收性並無合理保證。
可轉換應付票據
本公司對摺價發行的可轉換票據
進行會計處理,通過比較本金額和賬面價值,採用折現法計算。公司每月評估
折扣。期票的攤銷期為18個月。
受益轉換功能
公司可能會不時發行可轉換票據,其中可能包含嵌入的受益轉換功能。當可轉換票據可轉換為的標的普通股的公允價值超過票據的剩餘未分配收益時,在首次考慮將票據收益的一部分分配給認股權證的公允價值(如果已授予相關認股權證)後,存在受益轉換
特徵。受益轉換功能的內在價值被記錄為債務折扣,並與額外實收資本相對應。債務貼現按實際利息法在票據有效期內攤銷為利息支出
。
認股權證
本公司根據對權證具體條款的評估和FASB ASC 480中適用的權威指引
,將負債與權益(“ASC 480”)和ASC 815、衍生品和對衝(“ASC 815”)區分開來,將權證列為權益分類或負債分類工具。
評估考慮權證是否符合ASC 480規定的獨立金融工具,是否符合ASC 480規定的負債定義,以及認股權證是否滿足ASC 815規定的所有權益分類要求,包括
認股權證是否與公司自己的普通股掛鈎,以及權證持有人是否可能在公司無法控制的情況下要求“淨現金結算”,以及股權分類的其他條件。此
評估需要使用專業判斷,在權證發行時以及在權證未結清的每個季度
期間結束日進行。本公司決定,在進一步審閲認股權證協議後,根據認股權證協議發行的公開認股權證符合權益會計處理資格。
對於符合所有股權分類標準的
已發行或修改的權證,權證必須在發行時記錄為股權的組成部分
。對於不符合所有股權分類標準的已發行或修改的權證,權證
必須在發行當日及其之後的每個資產負債表日按初始公允價值計入負債。
權證估計公允價值的變化在經營報表上確認為非現金損益。
研究和開發費用
根據ASC主題730-10-25-1,本公司在研發成本中核算使用許可權的成本。本指南規定,在未來沒有替代用途的情況下,購買用於研發活動的產品權利必須在發生時計入研發費用
。
本公司按照會計準則編纂(“ASC”)730,研究與開發(“ASC 730”)對研發成本進行會計核算。研發費用
計入已發生的費用,除非將來在其他研發項目或其他方面有其他用途。
研發費用包括執行研發活動所發生的成本,包括與人員相關的成本、與設施相關的管理費用以及外部合同服務(包括臨牀試驗成本、臨牀和臨牀前材料的製造和過程開發成本、研究成本和其他諮詢服務)。將在未來研發活動中使用的貨物和服務的預付款不能退還
當活動已經完成或貨物已收到時,而不是在付款時,將計入費用。在公司與第三方簽訂協議以提供研發服務的情況下,成本在提供服務時計入費用。
退休後和離職後福利
本公司在臺灣的子公司採用
政府根據臺灣《勞動退休金法》(以下簡稱《法案》)規定的固定繳款計劃。此類勞動法規
要求用人單位每月向勞動養老基金繳納的繳費率不得低於勞動者月工資的6%。根據該法,公司每月向員工養老基金繳納相當於員工工資6%的繳費。除已繳款項外,本公司對其他利益並無法律責任。在截至2023年、2023年和2022年12月31日的年度內,該等員工
福利的支出總額分別為10,314美元和13,031美元。
除上述外,本公司不提供任何其他退休後或離職後福利。
基於股票的薪酬
本公司使用公允價值方法計量與所有員工股票薪酬獎勵相關的費用,並根據FASB ASC主題718“薪酬-股票薪酬”,在必要的服務期間
在合併財務報表中以直線基礎確認此類支出。
截至2023年12月31日和2022年12月31日的年度,員工股票薪酬支出總額分別為0美元和1,241,930美元。
本公司根據FASB ASC主題718 "薪酬—股票薪酬"和FASB ASC主題505—50 "以股權為基礎的
支付給非僱員的薪酬",對非僱員的股票薪酬進行了核算,該主題要求從非僱員獲得的服務成本按
的公允價值計量,業績承諾日期或服務完成並在提供服務期間確認之日期的較早者。截至2023年12月31日及2022年12月31日止年度,
非僱員股票薪酬支出總額分別為1,635,708美元及5,794,848美元。
所得税
本公司採用資產負債法核算所得税,該方法允許根據未來年度實現税收優惠的可能性來確認和計量遞延税項資產。在資產負債法下,遞延税項是為財務報告用途的資產和負債的賬面金額與用於所得税的金額之間的臨時
差額而計提的淨税項影響。如果遞延税項更有可能在本公司
實現其利益之前到期,或未來的扣除額不確定,則為遞延税項資產提供估值扣除。
根據ASC 740,只有當税務狀況在税務檢查中"更有可能"得到維持時,税務狀況才被確認為
福利,並假定進行税務檢查
。税務狀況評估分兩步進行。第一步是確定是否更有可能
税務狀況在審查後得到維持,包括根據該狀況的技術價值
解決任何相關上訴或訴訟。第二步是衡量符合"很可能"閾值的税務狀況,以確定財務報表中確認的利益金額
。税務狀況以最終結算時可能實現的最大利益金額衡量。以前未能達到"很可能"確認閾值
的税務頭寸應在達到閾值的第一個後續期間予以確認。
不再滿足"很可能"標準的先前確認的税務狀況,應在
閾值不再滿足的第一個後續財務報告期間取消確認。與少繳所得税有關的罰款和利息在發生年度分類為所得税費用
。截至2023年及2022年12月31日止年度,並無產生與所得税有關的重大罰款或利息。GAAP還提供了取消確認、分類、利息和罰款、中期會計、披露
和過渡方面的指導。
遞延税項資產的估值
計入估值撥備,以將公司的遞延税項資產減少至更有可能變現的金額。在評估評估免税額的必要性時,管理層除其他因素外,還考慮對未來應税收入的預測以及持續審慎和可行的税務籌劃策略。如果本公司確定存在足夠的負面證據,則將考慮對該司法管轄區的部分或全部遞延税項資產計入估值準備
。如果在計入估值免税額後,公司對未來應納税所得額的預測和在評估估值免税額需求時考慮的其他積極證據在事後證明是不準確的,則可能被證明更難支持其遞延税項資產的變現。
因此,可能需要額外的估值免税額,這將對其實際所得税税率和業績產生不利影響。相反,如果在計入估值準備後,本公司確定在計入估值準備的司法管轄區有足夠的積極證據,則本公司可以撤銷該司法管轄區的部分或全部估值準備。
在這種情況下,對遞延税項資產進行的調整將對其實際所得税税率和確定期間的結果產生有利影響
。
普通股每股虧損
本公司根據ASC主題260“每股收益”計算每股淨虧損。每股基本虧損的計算方法是將淨虧損除以期內已發行普通股的加權平均數。每股攤薄虧損的計算方法與每股基本虧損類似,不同之處在於分母增加以包括潛在普通股等價物已發行及額外普通股為攤薄股份時將會發行的額外普通股數目。稀釋後每股收益不包括所有稀釋性
潛在股票,如果它們的影響是反稀釋的。
承付款和或有事項
公司採用了美國會計準則主題450“或有事項”
小主題20來確定其應計項目和關於或有損失的披露。因此,當財務報表發出或可供發出前的資料顯示
於財務報表日期一項資產可能已減值或一項負債已產生,而虧損金額
可被合理估計時,或有虧損的估計虧損應計於收入項下。與或有事項相關的法律費用在發生時計入費用。如果或有損失
不可能發生或無法合理估計,則在至少合理地
可能發生重大損失的情況下,在財務報表中披露或有損失。
外幣交易
對於本公司在臺灣的子公司,
外幣交易按交易發生時的有效匯率以新臺幣(“新臺幣”)記錄。外幣現金兑換新臺幣或外幣應收、應付款項結算時,因適用不同匯率而產生的損益,在折算或結算當年計入收益。於資產負債表日,外幣資產及負債餘額按現行匯率重新列報,由此產生的差額計入當期收入,但以外幣計價的股票投資除外,該等差額在股東權益(虧損)報表下計入換算調整。
翻譯調整
本公司在臺灣的附屬公司的賬目均以新臺幣(“新臺幣”)結算,而其財務報表則以新臺幣(“新臺幣”)表示。此類財務報表
根據ASC 830《外幣事項》以新臺幣為本位幣折算成美元。根據該報表,所有資產和負債按當前匯率折算,股東虧損按歷史匯率折算,損益表項目按當期平均匯率折算。由此產生的換算調整在其他全面收益(虧損)項下作為股東權益(虧損)的組成部分列報。
近期會計公告
2020年8月,財務會計準則委員會發布了ASU 2020-06,債務
--帶有轉換和其他期權的債務(分主題470-20)和衍生工具和對衝-實體自有股權的合同
(分主題815-40):實體自有股權的可轉換工具和合同的會計(“ASU 2020-06”)。ASU
2020-06通過取消受益轉換和現金轉換會計模型,簡化了可轉換債務的會計核算。
採用ASU 2020-06後,可轉換債券將不再在債務和股權部分之間分配,除非發行時有很高的溢價或嵌入了與宿主合同不明顯和密切相關的轉換功能。這一修改將
降低發行折扣,並導致財務報表中的非現金利息支出減少。ASU 2020-06還更新了每股收益計算
,並要求實體在可轉換債務可以現金或股票結算時承擔股票結算。對於實體自身權益中的合同,主要受ASU 2020-06影響的合同類型是獨立的和嵌入特徵
,由於未能滿足和解評估,因此在當前指導下被列為衍生品,刪除了要求
考慮合同是否將以登記股份結算,(Ii)考慮是否需要公佈抵押品,
和(Iii)評估股東權利。ASU 2020-06從2023年12月15日之後的財年開始生效。允許提前採用,但不得早於2020年12月15日之後的財政年度,且只能在該財政年度開始時採用。公司
目前正在評估該標準對其合併財務報表的影響。
本公司目前正在評估上述標準將對其合併財務報表產生的影響。
4.合作協議
與關聯方BHK簽訂合作協議
| (i) | 2015年2月24日,BioLite臺灣公司和BioHopeKing Corporation(“BHK”)簽訂了共同開發協議(“BHK共同開發協議”),據此,BHK與BHK合作在除日本以外的亞洲國家開發和商業化BLI-1401-2(植物藥物)三重陰性乳腺癌(TNBC)療法(BLI-1401-2產品),以獲得所有相關知識產權,並與外部研究人員合作開發用於
醫藥用途。開發費用將由BHK和本公司各佔一半。BHK共同開發協議自產品在亞洲(日本除外)首次商業銷售之日起15年內有效。
|
2016年7月27日,BioLite臺灣和BHK同意
根據以下時間表修改里程碑付款的付款條款,總額為1,000萬美元:
| |
● |
簽署BHK共同開發協議:100萬美元,或總付款的10% |
| |
● |
根據FDA的審查要求,在首次研究新藥(IND)提交後,BioLite臺灣將向BHK提交所有數據:100萬美元,或總付款的10% |
| |
● |
完成第一期二期臨牀試驗:100萬美元,或總付款的10% |
| |
● |
在啟動第三階段臨牀試驗研究時:300萬美元,或總付款的30% |
| |
● |
根據新藥申請(NDA)提交:400萬美元,或總付款的40% |
2015年12月,BHK在簽署BHK共同開發協議後支付了不可退還的
預付現金100萬美元,即10,000,000美元的10%。公司得出的結論是,
交付物被視為單獨的會計單位,因為交付的項目對客户具有獨立的價值,
在2015年向BHK交付所有研究、技術和開發數據時,將此現金收入確認為合作收入。
收據用於補償BioLite臺灣在簽署本合作協議之前所做的過去研究工作和貢獻
,與BioLite臺灣和BHK在本合作協議中所作的任何未來承諾無關。
2016年8月,公司收到第二筆里程碑付款新臺幣31,649,000元,約相當於100萬美元,並確認截至2016年12月31日止年度的合作收入。截至本報告日期,公司尚未完成第一個II期臨牀試驗
。
除里程碑付款外,BioLite臺灣還有權收取BHK與BLI—1401—2產品相關淨銷售額的12%的使用費。截至2023年及2022年12月31日,本公司尚未根據BHK共同發展協議賺取特許權使用費。
(Ii)2015年12月9日,BioLite臺灣與BHK簽訂了另外兩項合作協議(“BHK合作協議”),與BHK合作,在亞洲(日本除外)共同開發和商業化用於“靶向嚴重抑鬱障礙”(BLI-1005產品)的BLI-1005和用於
“靶向炎症性腸病”(BLI-1006產品)的BLI-1006,以獲得所有相關知識產權,
並與外部研究人員合作開發用於醫藥的BLI-1006。開發成本將由BHK和本公司各佔一半。BHK共同開發協議將自產品在亞洲(日本除外)首次商業銷售之日起15年內有效。
2015年,當所有研究、技術和開發
數據交付BHK時,本公司確認現金收入共計5000萬新臺幣,約相當於160萬美元,作為合作收入。公司得出結論認為,交付物被視為單獨的會計單位,因為交付的物品
對客户具有獨立的價值,並在所有研究、技術、數據
和開發數據交付給BHK時將此付款確認為協作收入。現金收據用於補償
BioLite Taiwan在本BHK合作協議簽署前的過去研究工作和貢獻,與BioLite Taiwan
和BHK在本BHK合作協議中作出的任何未來承諾無關。
除總額為5,000萬新臺幣(約
相當於160萬美元)外,BioLite臺灣有權獲得未來淨授權收入或淨銷售利潤的50%。截至2023年及2022年12月31日,本公司尚未賺取BHK合作協議項下的特許權使用費。
與BioLite,Inc.的合作協議,
關聯方
本公司於2015年12月29日與BioLite,Inc.簽訂合作協議,然後簽訂經修訂的該協議的兩份附錄(“BioLite
協議”)。BioLite的大股東為本公司的附屬公司之一,本公司董事長蔣先生為本公司的董事成員,而本公司首席戰略官兼董事的姜博士為本公司的主席。
根據BioLite協議,公司
獲得了BioLite的六種化合物用於治療目的的獨家許可權和商業化。根據協議條款,公司應向BioLite支付(I)高達1億美元的現金和公司股權的里程碑付款,或根據BioLite在協議中規定的某些里程碑成就所規定的時間表,在不同階段支付其擁有的股權證券(“里程碑付款”)和(Ii)當ABV-1501獲準在許可地區銷售時,支付相當於藥品淨銷售額5%的特許權使用費
。如果BioLite未能及時達到任何里程碑,它
可能無法收到公司的其餘付款。
根據BioLite協議,在第二階段臨牀試驗完成後,里程碑付款的15%到期,並將分兩個階段支付:(I)不遲於2021年12月31日支付5%(“2021年12月付款”)和(Ii)不遲於2022年12月31日支付10%。
2022年2月12日,公司董事會
決定,2021年12月付款(相當於5,000,000美元)將通過註銷BioLite截至2021年12月31日至2023年12月31日欠公司的金額為5,000,000美元的某些未償債務來支付。
於2022年2月22日,各方訂立
BioLite協議修訂案,允許本公司透過豁免BioLite欠本公司的
相等價值債務,支付協議項下所有到期款項。
這是一筆關聯方交易。
與Rgene公司的共同開發協議,
關聯方
於二零一七年五月二十六日,BriVision與由袁氏控股受益人股東與本公司共同控制的關聯方Rgene Corporation(“Rgene”)訂立共同開發
協議(“共同開發協議”)(見附註12)。根據聯合開發協議,BriVision和Rgene同意共同開發ABV-1507 HER2/neu陽性乳腺癌聯合療法、ABV-1511胰腺癌聯合療法和ABV-1527卵巢癌聯合療法,並將其商業化。根據共同開發協議的條款,Rgene須於2017年8月15日前以現金或同等價值的Rgene股票向本公司支付3,000,000美元。這筆款項是對BriVision過去的研究工作和BriVision在共同開發協議簽署之前所做的貢獻的補償,與BriVision和Rgene在本聯合開發協議中做出的任何未來承諾無關。除3,000,000美元外,公司有權獲得Rgene未來淨許可收入或淨銷售利潤(如果有)的50%,任何開發成本將由BriVision和Rgene平分。
2017年6月1日,公司已向Rgene交付所有
研究、技術、數據和開發數據。由於Rgene和本公司均為關聯方,且受YuanGene Corporation和本公司的一名控股受益股東共同控制
,本公司已於截至2017年12月31日止年度將與共同開發協議有關的全部3,000,000美元記錄為額外實繳資本。截至2017年12月31日止年度,本公司已收到450,000美元現金。於2018年12月24日,本公司以
新發行的Rgene普通股股份的形式收到剩餘餘額2,550,000美元,價格為新臺幣50元(約相當於每股1.60美元),
共計1,530,000股,截至2018年12月31日,已計入權益法長期投資。截至2018年12月31日止年度,公司確認投資虧損549美元。2018年12月31日,本公司根據本公司對減值嚴重程度和持續時間的評估,以及對被投資單位經營業績的定性和定量分析,市場條件和監管或經濟環境的不利變化,
Rgene經營結構的變化,額外的資金需求,和Rgene繼續經營的能力所有已啟動的項目
將由公司和Rgene管理和支持。
公司與Rgene於2020年11月10日簽署了聯合開發協議修正案,據此,雙方同意刪除AB-1507 HER2/neu陽性乳腺癌聯合治療和AB 1527卵巢癌聯合治療,並在共同開發和商業化的產品中增加ABV-1519 EGFR陽性非小細胞肺癌聯合治療和ABV-1526結腸癌/直腸癌聯合治療。共同開發協議的其他條款
仍然完全有效。
2022年6月10日,公司擴大了與Rgene的共同開發
合作伙伴關係。在該日,BioKey,ABVC與Rgene簽訂了臨牀開發服務協議,指導三種
Rgene藥物產品,RGC—1501用於治療非小細胞肺癌(NSCLC),RGC—1502用於治療胰腺癌
和RGC 1503用於治療結直腸癌患者,根據美國FDA IND法規
要求完成II期臨牀研究。根據新服務協議的條款,BioKey有資格在3年
期間內收到總計300萬美元的付款,每次付款金額將根據協議期間獲得的某些監管里程碑確定。服務協議
應在最後一項專利到期日之前有效,並自動延長5年,除非任何一方提前終止
併發出六個月的書面通知。任何一方均可在30天內發出書面
通知的情況下終止服務協議。
通過過去
5年的一系列交易,本公司和Rgene共同開發了服務協議涵蓋的三種藥品,從而使本公司
擁有Rgene 31.62%的股份。
作為Rgene研究的一部分,本公司同意
向Rgene貸款100萬美元,為此Rgene已向本公司提供5%的營運資本可轉換貸款(以下簡稱“附註”)。
如果票據全部轉換,公司將擁有Rgene額外6.4%的股權。預計本公司將於二零二四年上半年前以現金或轉換瑞基因股份的方式從關聯方收到未償還貸款
。本公司可在
任何時間將票據轉換為Rgene的普通股股份,其中之一是(i)等於每股1.00美元的固定轉換價或(ii)當時最新發行股票價格的20%折扣,以較低者為準;轉換價可根據
票據中的規定進行調整。本附註包括標準違約事件,以及交叉違約條款,根據該條款,如果在發出有關違約的書面通知5個工作日後,
未得到糾正,則違反服務協議將觸發本附註項下的違約事件。倘發生違約事件,未償還本金及任何應計及未付利息應即時到期應付。
本服務協議有效期至
最後一項專利到期日,並自動續期5年,除非任何一方提前六個月發出書面通知終止本協議。任何一方均可在提前30天書面通知的情況下因故終止服務協議。
Rgene已進一步同意從2022年7月1日起向公司提供在Rgene董事會的席位,直到貸款全部償還為止。本公司已提名首席戰略官兼董事姜博士擔任該職位;姜博士也是本公司的最大股東之一,持有本公司12.8%的股份。
Rgene研究是一項關聯方交易。
與BioFirst公司的合作協議,
關聯方
2017年7月24日,BriVision與BioFirst Corporation(簡稱“BioFirst”)簽訂了一份合作協議(簡稱“BioFirst合作協議”),據此,BioFirst
授予本公司以下產品(簡稱“產品”)的醫療用途全球許可權:BFC-1401玻璃體切割替代品
。BioFirst為本公司之關聯方,原因為元基因股份有限公司之控股受益股東及
本公司為BioFirst之董事及普通股股東之一(見附註8)。
根據BioFirst合作協議,
公司將與BioFirst共同開發和商業化產品,並在2018年9月30日前以現金或公司股票
向BioFirst支付總額為3,000,000美元的款項。3,000,000美元的金額與BioFirst在《BioFirst合作協議》簽署前對BioFirst過去的研究
努力和貢獻的補償有關,與BioFirst和BriVision在本《BioFirst合作協議》中的任何未來
承諾無關。此外,本公司有權收取未來淨許可收入或淨銷售利潤(如有)的50%
,任何開發成本應由BriVision和
BioFirst平均分攤。
2017年9月25日,BioFirst向BriVision交付了
所有研究、技術、數據和開發數據。由於目前相關許可權並無其他未來用途,故本公司決定將3,000,000元全數支出。根據ASC 730-10-25-1,如果沒有替代未來
用途,則在研發活動中使用的產品權利的獲取必須立即計入研發費用
。因此,截至2017年12月31日止年度,全部3,000,000元已全數支銷為研發開支。
2019年6月30日,BriVision與BioFirst簽訂了股票
購買協議(“購買協議”)。根據購買協議,本公司向BioFirst發行了428,571股本公司普通股,作為公司欠BioFirst的3,000,000美元的代價(“總付款”),與本公司與BioFirst於2017年7月24日達成的某項合作協議(“合作
協議”)有關。根據合作協議,BioFirst授予該公司全球許可權,共同開發用於醫療目的玻璃體切除的BFC-1401或ABV-1701玻璃體替代品,作為支付全部款項的代價。
2019年8月5日,BriVision與BioFirst簽訂了第二份
股票購買協議(“購買協議2”)。根據購買協議2,本公司發行了414,702股公司普通股給BioFirst的代價為2,902,911美元,該公司欠BioFirst有關
一筆貸款提供給BriVision從BioFirst。
2020年11月4日,該公司與BioFirst簽署了《BioFirst協議》的修正案,在協議中增加了ABV-2001眼內沖洗液和ABV-2002角膜儲存液。ABV-2002用於角膜移植手術,用於替換受損或患病的角膜,而ABV-2001在各種眼科手術中有更廣泛的用途
。
最初,該公司將專注於ABV-2002,這是一種在穿透性角膜移植(全厚度角膜移植)或內皮角膜移植(背層角膜移植)之前用來儲存供體角膜的解決方案。ABV-2002是一種由一種特殊的多氨基酸組成的溶液,可保護眼組織免受手術前儲存期間外部滲透暴露造成的損害。ABV-2002中的特定聚合物可以調節滲透壓,以保持330到390 mOsM的範圍,從而允許在儲存期內角膜基質內的水化。基質水化可使(A)保持可接受的角膜透明度,(B)防止供體角膜腫脹。ABV-2002還含有一種在植物細胞壁中發現的豐富的酚類植物化學物質,可提供抗氧化劑、抗菌性能和神經保護。
BioFirst的早期測試表明,ABV—2002在長期儲存期間可能比目前可用的其他儲存介質更有效地保護角膜和視網膜,並且
可以以更低的成本生產。 由於缺乏資金,ABV—2002產品的進一步開發被擱置。
此外,BioFirst於2006年11月7日成立,專注於創新專利藥品的研發、製造和銷售。BioFirst
的技術來自國內研發機構的全球獨家授權。目前,主要研發產品為國家衞生研究院授權的玻璃體替代品(Vitargus®)。Vitargus是世界上第一個可生物降解的玻璃體替代品,通過最大限度地減少醫療併發症和減少額外手術的需要,它比目前的玻璃體替代品具有許多優勢。
Vitargus已開始在臺灣新竹生物醫學科技園建設GMP工廠,旨在建立一個供應全球市場的生產基地,並推動
臺灣可生物降解玻璃替代品製造中心的建設。該工廠的建成將使ABVC能夠在GMP認證的製藥廠以世界級的技術生產Vitargus。BioFirst的目標是在2024年完成建設。
上述權益是在2023年股票反向拆分之前。
5.財產和設備
截至2023年12月31日和2022年12月31日的財產和設備摘要如下:
| | |
2023年12月31日 | | |
十二月三十一日,
2022 | |
| 土地 | |
$ | 363,416 | | |
$ | 361,193 | |
| 在建工程 | |
| 7,400,000 | | |
| - | |
| 建築物和租賃設施的改進 | |
| 2,227,431 | | |
| 2,226,687 | |
| 機器和設備 | |
| 1,138,675 | | |
| 1,116,789 | |
| 辦公設備 | |
| 174,797 | | |
| 173,766 | |
| | |
| 11,304,319 | | |
| 3,878,435 | |
| 減去:累計折舊 | |
| (3,335,041 | ) | |
| (3,304,457 | ) |
| 財產和設備,淨額 | |
$ | 7,969,278 | | |
$ | 573,978 | |
在建工程包括
最近在中國成都收購的房產。本公司於2023年8月14日與中滙聯合集團有限公司(“中滙”)訂立合作協議。據此,本公司收購了若干物業的20%所有權和一幅土地,旨在共同開發該物業為ABVC特殊利益領域(如眼科、腫瘤學和中樞神經系統)的老年生活、長期護理和醫療保健保健中心。該計劃是為中國市場和這些利益的全球發展建立一個基地
。
該物業的估值為37,000,000美元;
根據本公司20%的所有權,本公司收購的價值為7,400,000美元。作為交換,本公司以每股20. 0美元的價格向中滙發行總計370,000股普通股(“股份”)。該等股份在交易結束日期後的
一年的禁售期。此外,雙方同意,在交易完成後一年後,
如果股份的市值或物業的價值增加或減少,雙方將
真誠協商以作出合理調整。
資產所有權認證正在申請
過程中。然而,本公司對該物業及相關地塊或合適的替代物業的所有權受到合作協議條款的保障,該協議具有法律約束力及可強制執行。
在建工程計劃在2024年底前完工。
截至2023年12月31日及2022年12月31日止年度的折舊開支分別為28,531美元及23,799美元。截至2023年12月31日及2022年12月31日,賬面價值分別約為363,416元及361,193元的土地已抵押以取得銀行貸款(見附註9銀行貸款)。
6.長期投資
| | |
所有權百分比 | | |
|
| | |
十二月三十一日, | | |
十二月三十一日, | | |
會計核算 |
| 關聯方名稱 | |
2023 | | |
2022 | | |
治療法 |
| Braingenesis生物技術有限公司。 | |
| 0.17 | % | |
| 0.17 | % | |
成本法 |
| Genepharm生物技術公司 | |
| 0.67 | % | |
| 0.67 | % | |
成本法 |
| BioHopeKing公司 | |
| 5.90 | % | |
| 5.90 | % | |
成本法 |
| BioFirst公司 | |
| 18.68 | % | |
| 15.51 | % | |
權益法 |
| Rgene公司 | |
| 26.65 | % | |
| 26.65 | % | |
權益法 |
| 關聯方名稱 |
|
被投資單位對本公司業務的依賴程度 |
| Braingenesis生物技術有限公司。 |
|
沒有特定的業務關係 |
| Genepharm生物技術公司 |
|
沒有特定的業務關係 |
| BioHopeKing公司 |
|
與該公司合作開發和商業化藥物 |
| BioFirst公司 |
|
向被投資方貸款,並提供研發支持服務 |
| Rgene公司 |
|
與該公司合作開發和商業化藥物 |
| | |
2023年12月31日 | | |
十二月三十一日,
2022 | |
| 非市場性成本法投資淨額 | |
| | |
| |
| Braingenesis生物技術有限公司。 | |
$ | 7,213 | | |
$ | 7,169 | |
| Genepharm生物技術公司 | |
| 22,021 | | |
| 21,887 | |
| BioHopeKing公司 | |
| 818,018 | | |
| 813,014 | |
| 小計 | |
| 847,252 | | |
| 842,070 | |
| 權益法投資,淨額 | |
| | | |
| | |
| BioFirst公司(a) | |
| 1,680,488 | | |
| - | |
| Rgene公司(b) | |
| - | | |
| - | |
| 總計 | |
$ | 2,527,740 | | |
$ | 842,070 | |
| (a) |
BioFirst公司(“BioFirst”): |
公司持有BioFirst Corporation的股權,根據ASC 323《投資—權益法和合資企業》("ASC 323")的規定,使用權益法對其股權投資進行會計處理。權益法
調整包括本公司按比例應佔被投資單位收入或虧損,以及
權益法要求的其他調整。截至2023年12月31日及2022年12月31日,本公司分別擁有BioFirst 18. 68%及15. 51%的普通股股份。
本公司為BioFirst的股權投資支付預付款
,以購買BioFirst將發行的額外股份,總額為2,688,578美元,截至2022年12月31日,記錄為長期投資預付款
。於2023年7月19日,本公司順利完成該項投資的註冊程序。初始
預付款為1,895,556美元,這是截至2022年12月31日預付款的一部分,並被轉換為994,450股BioFirst
股票。截至2023年12月31日,Biofirst長期投資預付款為1,124,842美元。
本公司股權法投資對象BioFirst的財務信息摘要如下:
資產負債表
| | |
2023年12月31日 | | |
十二月三十一日,
2022 | |
| 流動資產 | |
$ | 1,451,877 | | |
$ | 1,543,151 | |
| 非流動資產 | |
| 686,206 | | |
| 739,472 | |
| 流動負債 | |
| 2,286,058 | | |
| 2,663,051 | |
| 非流動負債 | |
| 347,193 | | |
| 103,447 | |
| 股東權益 | |
| (495,168 | ) | |
| (483,874 | ) |
營運説明書
| | |
截至的年度
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| 淨銷售額 | |
$ | 734 | | |
$ | 30,162 | |
| 毛利 | |
| 289 | | |
| 8,239 | |
| 淨虧損 | |
| (1,194,797 | ) | |
| (1,274,539 | ) |
| 使用權益法核算的投資損失份額 | |
| (221,888 | ) | |
| - | |
Rgene和本公司均受BioLite Inc.首席執行官兼董事長蔣宗山博士的共同控制。由於蔣宗山博士能夠對Rgene行使重大
影響力,但不能控制,因此公司決定按照ASC 323,投資—權益法和合資企業(“ASC 323”)的規定,使用權益法對其股權投資進行會計處理。權益法調整包括本公司
按比例應佔被投資單位收入或虧損以及權益法要求的其他調整。截至2023年12月31日和
2022年12月31日,本公司分別擁有Rgene 26.65%和26.65%的普通股股份。
本公司
權益法投資對象Rgene的財務信息摘要如下:
資產負債表
| | |
2023年12月31日 | | |
十二月三十一日,
2022 | |
| 流動資產 | |
$ | 50,538 | | |
$ | 68,302 | |
| 非流動資產 | |
| 250,716 | | |
| 303,893 | |
| 流動負債 | |
| 2,591,960 | | |
| 2,478,868 | |
| 非流動負債 | |
| 811 | | |
| 2,441 | |
| 股東虧損 | |
| (2,291,517 | ) | |
| (2,481,309 | ) |
營運説明書
| | |
截至的年度
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| 淨銷售額 | |
$ | - | | |
$ | - | |
| 毛利 | |
| - | | |
| - | |
| 淨虧損 | |
| (291,522 | ) | |
| (1,550,123 | ) |
| 使用權益法核算的投資損失份額 | |
| - | | |
| - | |
截至2023年12月31日、2023年12月31日及2022年12月31日止年度,並無處置長期投資。
各期股權證券投資損失構成如下:
| | |
截至十二月三十一日止的年度: | |
| | |
2023 | | |
2022 | |
| 權益法被投資人損失份額 | |
$ | (221,888 | ) | |
$ | - | |
7.可轉換應付票據
2023年2月23日,公司簽訂了證券購買協議
(“林德證券購買協議”),根據該協議,
公司向林德發行了本金額為3,704,167美元的有擔保可換股票據(“林德發行”),購買價格為3,175,000美元(“林德票據”),該票據可轉換為公司的普通股股份,初始轉換價格為每股1.05美元,可調整(“票據股份”)。公司還向林德發出普通股購買權證(“林德認股權證”)以每股1.05美元的初始行使價格購買至多5,291,667股本公司普通股,為期5年,但需調整,在此類發行或出售後立即,在發行或出售之前有效的行使價
應減少(且在任何情況下均不得增加)至等於為該等額外普通股股份支付的每股代價
的行使價。認股權證採用布萊克—斯科爾斯模型估值。
認股權證的公允價值被確定為1,225,543美元,並被記錄為債務貼現。
自Lind票據的發行日期起六個月開始,此後每一個(1)個月週年,公司應向Lind支付相當於308,650.58美元的金額,
直至Lind票據的未償還本金額在到期日之前或到期日之前或到期日(如更早)在加速時全額支付,
根據其條款轉換或贖回林德票據(“每月付款”)。公司
酌情決定,每月付款應以(i)現金、(ii)公司普通股股份或(iii)
現金和股份的組合方式支付;如果是股份制,股份數量的確定方法是:(x)以股份支付的本金額
除以(y)90%適用付款日期前20個交易日內5個最低每日VWAP的平均數。Lind附註
列出了公司在每月支付普通股股票之前必須滿足的某些條件。如果
公司每月以現金付款,公司還必須向林德支付該每月付款額5%的現金保險費。
Upon the occurrence of any Event of Default (as
defined in the Lind Note), the Company must pay Lind an amount equal to 120% of the then outstanding principal amount of the Lind
Note (the “Mandatory Default Amount”), in addition to any other remedies under the Note or the other Transaction Documents.
The Company and Lind entered into a letter agreement on September 12, 2023, pursuant to which the Mandatory Default Amount was reduced
to 115% of the then outstanding principal amount of the Lind Note; pursuant to the letter agreement, Lind also agreed to waive any default
associated with the Company’s market capitalization being below $12.5 million for 10 consecutive days through February 23, 2024,
but retained its right to convert its Note. In addition, if the Company is unable to increase its market capitalization and is unable
to obtain a further waiver or amendment to the Lind Note, then the Company could experience an event of default under the Lind Note, which
could have a material adverse effect on the Company’s liquidity, financial condition, and results of operations. The Company cannot
make any assurances regarding the likelihood, certainty, or exact timing of the Company’s ability to increase its market capitalization,
as such metric is not within the immediate control of the Company and depends on a variety of factors outside the Company’s control.
Lind保證書可通過無現金操作
行使。
認股權證行使價已
根據於二零二三年七月就證券購買協議發行普通股而重置為3. 5美元。
2023年11月17日,本公司與林德簽訂了另一份
證券購買協議,據此,本公司以1,000,000美元的購買價格向林德發行了本金為1,200,000美元的有擔保可換股票據,該票據可按轉換價格轉換為本公司普通股的股份,(i)3.50美元和(ii)
轉換前20個交易日內三個最低VWAP平均值的90%兩者中較小者。林德還將獲得一份為期5年的普通股購買權證,以每股2美元的初始行使價購買至多1,000,000股公司普通股,為期5年。認股權證採用布萊克—斯科爾斯模型估值。認股權證的
公允價值被確定為480,795美元,並記錄到債務貼現中。2024年2月29日,
提交了一份修正案,披露了由於納斯達克的要求,雙方對票據進行了修正,據此,轉換
價格的最低價為1.00美元(以下簡稱"修正案")。此外,修訂案要求公司向林德支付現金
,如果與轉換有關,轉換價被視為最低價。
於2023年及2022年12月31日
,可換股債券的總賬面值分別為569,456美元及0美元;應計
可換股利息均為0美元。
截至2023年及2022年12月31日止年度,與上述應付可換股票據有關的利息開支總額分別為2,412,951元及0元。
8.
應計費用和其他流動負債
截至所示期間,應計費用和其他流動負債
包括以下各項:
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| 應計研究與開發費用 | |
$ | 1,799,583 | | |
$ | 1,600,221 | |
| 應計薪酬和僱員福利 | |
| 1,184,505 | | |
| 568,865 | |
| 應計版税 | |
| 274,028 | | |
| 272,352 | |
| 其他 | |
| 438,264 | | |
| 468,150 | |
| 總計 | |
$ | 3,696,380 | | |
$ | 2,909,587 | |
9.銀行貸款
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| 國泰聯合銀行 | |
$ | 245,250 | | |
$ | 243,750 | |
| CTBC銀行 | |
| 654,000 | | |
| 650,000 | |
| 國泰銀行 | |
| - | | |
| 1,000,000 | |
| 總計 | |
$ | 899,250 | | |
$ | 1,893,750 | |
國泰聯合銀行
2016年6月28日,BioLite臺灣與國泰聯合銀行訂立為期一年的銀行貸款協議(“國泰聯合貸款協議”)
,信貸限額為新臺幣7,500,000元,相當於245,250元。該期限自二零一六年六月二十八日開始,到期日為二零一七年六月二十八日。
貸款餘額按最優惠利率加1. 31%的浮動利率計息。優惠利率以國泰銀行定期存款儲蓄利息
利率為基礎。本公司每年更新與銀行的協議。2022年9月6日,BioLite臺灣延長
國泰聯合貸款協議,本金額相同為新臺幣7,500,000元,相當於245,250元,為期一年,到期日為
2023年9月6日。於2023年9月6日,BioLite臺灣延長國泰聯合貸款協議,本金額相同為新臺幣7,500,000元,
相當於245,250元,為期一年,到期日為2024年9月6日。於2023年12月31日及2022年12月31日,實際年利率分別為2. 87%及2. 67%。貸款以BioLite臺灣的建築
和改善作抵押,同時也由公司董事長個人擔保。
截至2023年和2022年12月31日止年度的利息支出分別為6,856美元和5,960美元。
CTBC銀行
於2017年6月12日及2017年7月19日,BioLite臺灣
與CTBC Bank訂立兩份短期儲蓄擔保銀行貸款協議(“CTBC貸款協議”),信貸限額
分別為新臺幣10,000,000元(相當於327,000元)及新臺幣10,000,000元(相當於327,000元)。兩筆貸款的
到期日相同,均為2018年1月19日。2018年2月,BioLite Taiwan合併了兩筆貸款,並將與CTBC的貸款合同延長了一年
。本公司每年更新與銀行的協議。貸款結餘按固定年利率2. 5%計息。
貸款由在CTBC銀行的儲蓄賬户中存入的資金作為擔保。這筆貸款也由公司董事長和BioFirst個人擔保。截至2020年12月31日止年度,BioLite Taiwan已在CTBC銀行開立TCD賬户,以擔保
未來貸款。
截至2023年12月31日及2022年12月31日止年度的利息支出分別為15,610美元及12,220美元。
國泰銀行
於二零一九年一月二十一日,本公司根據本公司與國泰銀行於二零一九年一月八日訂立的商業貸款協議(“貸款協議”)
及本公司於同日籤立的承兑票據(“票據”)
自國泰銀行(“本行”)收到一筆金額為500,000美元的貸款
。貸款協議規定本金額為1,000,000美元的循環信貸額度,到期日
(“到期日”)為二零二零年一月一日。就貸款協議簽署的票據按等於百分之一(1%)和《華爾街日報》(
"指數")公佈的最優惠利率之和的利率(
"常規利率")計息,應計利息自2019年2月1日起每月支付。根據票據,本公司
應於到期日支付全部未償還本金加上應計未付利息,並可在到期日前提前支付部分或全部票據
,且不受罰款。如果公司拖欠票據,則違約利率應為百分之五(5%)
加上常規利率。
就票據和貸款協議而言,
2019年1月8日,Tsung Shann Jiang博士和George Lee博士各自簽署了一份商業擔保(以下簡稱“擔保”),以分別和單獨地為公司根據貸款協議和票據提供貸款,金額不超過500,000美元
,直至全部票據加上利息全部支付和清償。宋山江博士是
BioLite Holding,Inc.的董事長兼首席執行官。George Lee博士擔任BioKey董事會主席。2020年12月29日,本公司
與本行簽訂了新的貸款延期協議及存款賬户轉讓,允許宋善江博士及陳善江博士於2020年12月29日獲批准。
喬治·李將從擔保人名單中刪除作為擔保人。
此外,於2019年1月8日,本公司
與本公司全資附屬公司BioKey各自簽署了商業擔保協議(“擔保協議”),以
擔保貸款協議及票據項下的貸款。根據擔保協議,本公司及BioKey各自(各自為“授予人”,
及統稱為“授予人”)授予擔保品(定義為其中包括各授予人幾乎全部
資產)的擔保權益,以擔保銀行的利益。於二零二零年六月三十日,本公司將貸款協議
相同期限延長七個月,到期日為二零二零年十月三十一日。於2020年4月8日及2020年10月3日,本公司償還本金總額為350,000美元。於2020年12月3日,本公司重續貸款協議,本金額為650,000美元,為期10個月,到期日為2021年10月31日。於二零二一年十月三十一日,本公司重續本金額為650,000元之貸款協議,為期十二個月,於二零二二年十月三十日到期。於二零二一年九月二十四日,國泰銀行已將信貸額度由650,000元增至1,000,000元。貸款協議已獲進一步延期,並於二零二二年十二月三十一日到期。截至2022年12月31日,未償還貸款餘額為1,000,000美元。於二零二三年二月二十三日,國泰銀行之銀行貸款已悉數償還。於2023年及2022年12月31日,實際年利率分別為0%及8%,未償還貸款結餘為0元及1,000,000元。
截至2023年12月31日及2022年12月31日止年度的利息支出分別為10,209美元及46,957美元。
10.關聯方交易
在這些財務報表中報告的交易
的公司關聯方如下:
| 單位或個人名稱 |
|
與公司及其附屬公司的關係 |
| BioFirst公司(“BioFirst”) |
|
元基因控股受益人股東控制的實體 |
| BioFirst(Australia)Pty Ltd.(The“BioFirst(Australia)”) |
|
由BioFirst擁有100%股份;由袁基因的控股受益人股東控制的實體 |
| Rgene公司(“Rgene”) |
|
本公司股東;由元基因控股受益人股東控制的實體;Rgene主席為蔣宗山先生 |
| 尤金·江 |
|
原總裁、董事長 |
| 基因製藥公司(The GenePharm Inc.) |
|
生物鑰匙公司董事董事會的喬治·李博士是基因製藥公司的董事長。 |
| 江家 |
|
本公司控股股東蔣宗山先生、BioLite Holding Inc.及BioLite Inc.董事長兼首席執行官Rgene-Shann先生以及BioFirst董事會成員總裁
蔣宗山先生的妻子蔣淑玲女士是Keypoint的董事長和BioLite Inc.的董事會成員。
尤金·江是江先生和女士的兒子。江裕基先生為本公司主席、大股東及BioLite Inc.董事會成員。
蔣長仁先生為蔣宗山先生之兄弟,亦為本公司之董事。江美玲是江淑玲的兄弟姐妹。 |
| 徐哲偉 |
|
本公司的股東。 |
| BioHopeKing公司 |
|
ABVC控股受益股東控制的實體 |
| 海姆斯·巴爾加斯·魯斯曼 |
|
AiBtl BioPharma Inc.首席執行官。 |
應收賬款關聯方
截至所示期間,應收關聯方應收賬款包括
下列各項:
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| 基因製藥公司 | |
$ | - | | |
$ | 142,225 | |
| Rgene | |
| 10,463 | | |
| 615,118 | |
| 總計 | |
$ | 10,463 | | |
$ | 757,343 | |
與收入相關的各方
截至所示期間,應收關聯方收入包括
以下各項:
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| Rgene | |
$ | 2,055 | | |
$ | 904,043 | |
| 總計 | |
$ | 2,055 | | |
$ | 904,043 | |
關聯方應繳款項
截至所示期間,應收關聯方款項包括
以下各項:
關聯方到期-當期
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| Rgene | |
$ | 541,486 | | |
$ | 513,819 | |
| BioFirst | |
| 206,087 | | |
| - | |
| 總計 | |
$ | 747,573 | | |
$ | 513,819 | |
關聯方應收賬款--非流動、淨額
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| BioFirst(澳大利亞) | |
$ | 839,983 | | |
| $ 752,655 | |
| BioHopeKing公司 | |
| 113,516 | | |
| 112,822 | |
| 總計 | |
| 953,499 | | |
| 865,477 | |
| 減去:預期信貸損失準備賬户 | |
| (839,983 | ) | |
| - | |
| 網絡 | |
$ | 113,516 | | |
$ | 865,477 | |
| (1) |
於2022年6月16日,本公司與Rgene訂立一項為期一年的可轉換貸款協議,本金為1,000,000美元予Rgene,按5%的年利率計息,用作營運資金,若全部轉換,ABVC將額外擁有Rgene 6.4%的股權。本公司可隨時按(I)相當於每股1.00美元的固定換股價格或(Ii)當時最新發行的股票價格的20%折****r}(以較低者為準),將票據
轉換為Rgene的普通股;換股價格將按附註
所述作出調整。本附註包括標準違約事件,以及交叉違約條款,根據該條款,違反服務
協議將觸發可轉換票據項下的違約事件,如果在提供有關
違規的5個工作日的書面通知後仍未得到糾正。
截至2023年12月31日和2022年12月31日,未償還貸款餘額均為500,000美元;應計利息分別為38,819美元和13,819美元。
截至2023年12月31日,由於日常運營,本公司從Rgene獲得的其他應收賬款為2,667美元。 |
| (2) |
2020年7月1日,本公司與BioFirst(澳大利亞)簽訂了一項361,487美元的貸款協議,以妥善記錄研發成本和基於2017年7月24日簽署的共同開發合同的退税分配。這筆貸款原定於2021年9月30日到期,年利率為6.5%,但在2021年9月7日,公司與BioFirst(澳大利亞)簽訂了67,873美元的貸款協議,以滿足其新項目需求。2021年7月27日,公司向BioFirst(澳大利亞)償還了249,975英鎊的貸款。2021年12月1日,該公司與澳大利亞BioFirst公司簽訂了一項25萬美元的貸款協議,以增加即將到來的項目的成本。貸款將於2022年11月30日到期,年利率為6.5%。2022年,該公司與BioFirst(澳大利亞)簽訂了幾項貸款協議,總額為507,000美元,以增加即將到來的項目的成本。在2023年第一季度,公司與BioFirst(澳大利亞)簽訂了幾項貸款協議,總額為88,091美元,以增加即將到來的項目的成本。在2023年第二季度,公司與BioFirst(澳大利亞)簽訂了幾項貸款協議,總額為25,500美元,以增加即將到來的項目的成本。所有貸款期限為12個月,年利率為6.5%。就會計目的而言,應付及應付關聯方結餘均予以淨額撇除。截至2023年12月31日和2022年12月31日,未償還貸款餘額和分配的研究費分別為681,185美元和660,484美元;應計利息分別為158,798美元和92,171美元。未償還的金額於2023年結清。
結餘主要用於支付BioFirst(澳大利亞)用於研究和開發的預付款。BioFirst(澳大利亞)的業務狀況惡化,因此,該公司在截至2023年12月31日的一年中確認了839,983美元的預期信貸損失。 |
| (3) |
2015年2月24日,BioLite臺灣公司與BioHopeKing Corporation(“BHK”)簽訂共同開發協議(“BHK共同開發協議”,見注4)。開發費用將由BHK和本公司各佔一半。根據協議條款,BioLite向BHK發出相關開發成本。截至2023年12月31日,BHK到期的2023年和20212分別為113,516美元和112,822美元。 |
因關聯方的原因
應付關聯方的金額包括截至所述期間的以下
:
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| Bio First | |
$ | - | | |
$ | 188,753 | |
| 江家 | |
| 19,789 | | |
| 19,789 | |
| 歸功於股東 | |
| 152,382 | | |
| 151,450 | |
| 因為有一個董事 | |
| 961 | | |
| - | |
| 總計 | |
$ | 173,132 | | |
$ | 359,992 | |
| (1) |
自2019年以來,BioFirst已向公司預付資金,用於營運資本用途
。墊款的利息為每月1%(或相當於年息12%)。截至2022年12月31日,未償還餘額和應計利息的總額為188,753美元,其中包括147,875美元的貸款和40,878美元的費用分攤。未償還的
金額將從BioFirst於2023年到期的金額中扣除。
|
| (2) |
自2019年起,江氏向本公司預支資金作營運資金用途。截至2023年12月31日和2022年12月31日,欠江夫婦的未償餘額分別為19789美元和19789美元。這些貸款的利率為每月0%至1%,按需到期。 |
| (3) |
自2018年以來,公司股東已向公司墊付資金用於營運資金用途。墊款的年利率由12釐至13.6224釐不等。截至2023年12月31日和2022年12月31日,未償還本金和應計利息分別為152,382美元和151,450美元。截至2023年12月31日和2022年12月31日的年度,與這些貸款相關的利息支出分別為20,094美元和21,378美元。 |
| (4) |
截至2023年12月31日,因董事支付的961美元與AiBtl BioPharma Inc.的董事代表該實體支付的實體設立費用有關。 |
11.所得税
截至二零二三年及二零二二年十二月三十一日止年度的所得税開支包括以下各項:
| | |
截至十二月三十一日止的年度: | |
| | |
2023 | | |
2022 | |
| 當前: | |
| | |
| |
| 聯邦制 | |
$ | - | | |
$ | - | |
| 狀態 | |
| - | | |
| 2,400 | |
| 外國 | |
| 140,338 | | |
| - | |
| 總電流 | |
$ | 140,338 | | |
$ | 2,400 | |
| 延期: | |
| | | |
| | |
| 聯邦制 | |
$ | - | | |
$ | - | |
| 狀態 | |
| - | | |
| - | |
| 外國 | |
| 115,668 | | |
| 795,378 | |
| 延遲合計 | |
$ | 115,668 | | |
$ | 795,378 | |
| 所得税撥備總額 | |
$ | 256,006 | | |
$ | 797,778 | |
截至2023年及2022年12月31日的遞延
税項資產(負債)約包括:
| | |
十二月三十一日, | | |
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| 資產減值損失 | |
| 713,223 | | |
| 709,961 | |
| 淨營業虧損結轉 | |
| 5,568,391 | | |
| 5,866,623 | |
| 投資税收抵免 | |
| - | | |
| - | |
| 經營租賃負債 | |
| 213,482 | | |
| 213,482 | |
| 經營性租賃資產 | |
| (213,482 | ) | |
| (213,482 | ) |
| 遞延税項資產,總額 | |
| 6,281,614 | | |
| 6,576,584 | |
| 估值免税額 | |
| (6,281,614 | ) | |
| (6,459,474 | ) |
| 遞延税項資產,淨額 | |
| - | | |
| 117,110 | |
12.權益
2022年1月,本公司同意通過發行1,306,007股非限制性普通股(於授出日期價值為每股3. 29美元)支付
與公開發售相關的遞延服務費4,296,763美元。該等股份已於二零二二年一月發行。
2022年3月,公司向BarLew Holdings,LLC發行了75,000股普通股,用於諮詢和諮詢服務,金額為169,500美元,每股價值2.26美元。
於2022年5月,本公司與一名機構投資者訂立若干證券購買協議,內容涉及以每股2. 11美元的發行價發售及出售2,000,000股普通股。本公司普通股股票的發行總額為4,220,000美元,未扣除配售代理費和法律費用556,075美元。根據此次發行,該公司還將發行5年期認股權證
,以購買2,000,000股普通股,可按每股2.45美元的價格行使。截至2023年12月31日,該等認股權證已發行但尚未行使。
2022年7月10日,董事會根據Barlew Holdings,LLC與本公司於2022年7月1日達成的諮詢協議,批准向Barlew Holdings,LLC發行75,000股普通股,並根據Inverlew Advisors,LLC與本公司於2022年7月1日達成的諮詢協議,向Inverlew Advisors,LLC發行250,000股普通股。
2022年12月1日,公司向歐亞投資金融有限公司和Thalia Media有限公司發行了125,000股普通股和100,000股普通股,用於諮詢和諮詢服務。
2023年1月3日,本公司向一名顧問發行223,411股普通股,以提供2021年納斯達克上市諮詢服務。
2023年2月23日,本公司與林德全球基金II,LP(“林德”)簽訂了證券購買協議,據此,本公司向林德發行本金額為3,704,167美元的有擔保可換股票據,購買價為3,175,000美元,可按每股1.05美元的初始轉換價轉換為本公司普通股的股票,但可作調整。該公司還向林德發出普通股購買權證,以購買至多5,291,667股公司的普通股,初始行使價為每股1.05美元,為期5年,但須作出調整,即在此類發行或出售後立即,在發行或出售之前立即生效的行使價應予以下調(且在任何情況下均不得增加)至等於為該等額外普通股股份支付的每股代價
的行使價。認股權證採用布萊克—斯科爾斯模型估值。認股權證的公允價值
被確定為1,225,543美元,並被記錄為債務貼現。截至2023年12月31日止年度,本公司已向林德償還3,732,167股股份的證券,總額為3,306,112美元。
認股權證行使價已於2023年7月根據有關證券購買協議的普通股發行而重置為3. 5美元。截至2023年12月31日,認股權證尚未行使。
2023年7月27日,本公司訂立了該若干證券購買協議。有關在登記直接
發行中以每股0.001美元的行使價發行和出售300,000股
普通股,以及200,000份預先出資認股權證。根據購買協議,本公司同意按每股購買價3. 50美元出售股份及╱或預配資認股權證,所得款項總額為1,750,000美元(未扣除任何估計發售開支)。2023年8月1日,200,000份預存資金
認股權證已獲行使。
上述股權是在2023年7月反向股票
拆分之前。
2023年8月14日,本公司與中滙訂立合作協議。據此,本公司收購中輝擁有的位於中國四川樂山的一項物業及一幅土地的20%所有權。2023年第三季度,公司以每股20美元的價格向中滙發行了總計370,000股公司普通股。公司還向顧問發行了29,600股普通股,用於就上述交易提供
諮詢服務。
2023年11月17日,本公司與林德簽訂了另一份
證券購買協議,據此,本公司以1,000,000美元的購買價格向林德發行了本金為1,200,000美元的有擔保可換股票據,該票據可按轉換價格轉換為本公司普通股的股份,(i)3.50美元和(ii)
轉換前20個交易日內三個最低VWAP平均值的90%兩者中較小者。林德還將獲得一份為期5年的普通股購買權證,以每股2美元的初始行使價購買至多1,000,000股公司普通股,為期5年。認股權證採用布萊克—斯科爾斯模型估值。認股權證的
公允價值被確定為480,795美元,並記錄到債務貼現中。2024年2月
29日提交了一份修正案,披露由於納斯達克的要求,雙方對票據進行了修正,據此,轉換
價格的最低價為1.00美元(以下簡稱"修正案")。此外,修訂案要求公司向林德支付現金
,如果與轉換有關,轉換價被視為最低價。
13.股票期權
2020年10月30日,本公司發行了總計545,182股普通股,以代替修訂後的2016年股權激勵計劃下某些員工的未支付工資和未支付的諮詢費,換算價為每股2美元;換算後的工資和諮詢費總額為1,090,361美元。於2020年11月21日,本公司與該等
員工及顧問訂立認購協議及股票期權購買協議;據此,本公司授予認購權以購買545,182股本公司普通股以代替普通股。該等購股權於授出日期歸屬,並可於授出日期起計10年內行使。
於2021年10月15日,本公司與11名董事及3名僱員訂立
股票期權協議,據此,本公司根據經修訂的2016年股權激勵計劃授出購股權,以每股3美元的行使價購買合共1,280,002股普通股。該等購股權於授出日期歸屬
,自授出日期起計10年內可予行使。
於2022年4月16日,本公司與5名董事訂立購股權協議,據此,本公司同意根據2016年股權激勵計劃授出購股權以購買合共761,920股普通股,行使價為每股3美元,自授出日期起10年。
截至2023年12月31日已發行及尚未行使的購股權及其於截至該日止年度的活動如下:
| | |
| | |
| | |
加權的- | | |
| |
| | |
| | |
加權的- | | |
平均值 | | |
| |
| | |
| | |
平均值 | | |
合同 | | |
| |
| | |
數量 | | |
鍛鍊 | | |
生命 | | |
集料 | |
| | |
標的股份 | | |
價格
每股 | | |
剩餘
以年為單位 | | |
固有的
價值 | |
| 截至2023年1月1日的未償還款項 | |
| 2,587,104 | | |
$ | 2.79 | | |
| 8.74 | | |
| - | |
| 授與 | |
| - | | |
| - | | |
| - | | |
| - | |
| 被沒收 | |
| - | | |
| - | | |
| - | | |
| - | |
| 截至2023年12月31日的未償還債務 | |
| 2,587,104 | | |
| 2.79 | | |
| 7.74 | | |
$ | - | |
| 自2023年12月31日起可行使 | |
| 2,587,104 | | |
| 2.79 | | |
| 7.74 | | |
$ | - | |
| 已歸屬和預期歸屬 | |
| 2,587,104 | | |
$ | 2.79 | | |
| 7.74 | | |
$ | - | |
截至2023年12月31日和2022年12月31日的年度授予的股票期權的公允價值是根據布萊克-斯科爾斯期權定價模型計算的,該模型應用了以下假設:
| | |
截至的年度
12月31日 | |
| | |
2022 | |
| | |
| |
| 無風險利率 | |
| 2.79 | % |
| 預期期限(以年為單位) | |
| 5.00 | |
| 股息率 | |
| 0 | % |
| 預期波動率 | |
| 83.86 | % |
在截至2023年12月31日和2022年12月31日的年度內,公司分別向員工和某些顧問授予了購買0股和761,920股普通股的選擇權。截至2023年12月31日及2022年12月31日止年度內授出的購股權之加權平均授出日期公允價值分別為2.79美元及2.79美元。截至2023年12月31日,2016股權激勵計劃下共有3,860,211個期權可供授予。
與本公司股票期權相關的薪酬成本根據這些期權在授予日的公允價值在歸屬期間確認。因此,公司確認截至2023年、2023年和2022年12月31日止年度的股票薪酬支出分別為0美元和1,241,930美元。截至2023年12月31日和2022年,沒有未歸屬期權。截至2023年12月31日及2022年12月31日止年度內,並無行使任何期權。
上述股權是在2023年7月反向股票拆分之前。
14.每股虧損
每股基本虧損的計算方法為淨虧損除以本年度已發行普通股的加權平均數。每股攤薄虧損的計算方法是將淨虧損
除以截至2023年12月31日和2022年12月31日的年度內已發行的普通股和稀釋潛在普通股的加權平均數。
| | |
截至該年度為止 | |
| | |
2023年12月31日 | | |
十二月三十一日,
2022 | |
| 分子: | |
| | |
| |
| ABVC普通股股東應佔淨虧損 | |
$ | (10,856,656 | ) | |
$ | (16,423,239 | ) |
| | |
| | | |
| | |
| 分母: | |
| | | |
| | |
| 加權平均流通股: | |
| | | |
| | |
| 加權平均流通股-基本 | |
| 4,335,650 | | |
| 3,166,460 | |
| 股票期權 | |
| | | |
| | |
| 加權平均流通股-稀釋 | |
| 4,335,650 | | |
| 3,166,460 | |
| | |
| | | |
| | |
| 每股虧損 | |
| | | |
| | |
| -基本 | |
$ | (2.43 | ) | |
$ | (5.19 | ) |
| -稀釋 | |
$ | (2.43 | ) | |
$ | (5.19 | ) |
稀釋每股虧損計入了當證券或其他發行普通股的合同被行使並轉換為普通股時可能發生的潛在攤薄。
15.租約
本公司採用經修訂的追溯法採用FASB會計準則
編纂,主題842,租賃(“ASC 842”),選擇了實際的權宜之計,即
允許本公司在2019年1月1日採用該準則之前不重述其比較期間。
該公司在過渡到ASC 842允許的新標準時採用了以下實用的權宜之計:
| |
● |
重新評估到期或現有合同:本公司選擇在申請日不重新評估任何到期或現有合同是否包含租賃、任何到期或現有租賃的租賃分類以及任何現有租賃的初始直接成本的會計處理。 |
| |
● |
後見之明:本公司選擇在確定租賃期限(即考慮延長或終止租賃以及購買標的資產時)以及評估使用權資產減值時使用後見之明。 |
| |
● |
重新評估現有或到期的土地地役權:根據過渡實際權宜之計,本公司選擇不評估先前未根據ASC 840計入租約的現有或到期的土地地役權。展望未來,新的或修改後的土地地役權將根據ASU第2016-02號進行評估。 |
| |
● |
租賃和非租賃組成部分的分離:同時包含租賃和非租賃組成部分的租賃協議通常單獨入賬。 |
| |
● |
短期租賃確認豁免:公司還選擇了短期租賃確認豁免,對於期限低於12個月的租賃,不會確認ROU資產或租賃負債。 |
新租賃標準要求將綜合資產負債表上的租賃確認為使用權資產和租賃負債。ROU資產代表公司在租賃條款中使用標的資產的權利,租賃負債代表公司支付租賃產生的租賃款項的義務。經營租賃ROU資產及經營租賃負債乃根據目前
價值及未來於開始日期租賃期內的最低租賃付款確認。本公司未來的最低基本租金主要包括以最低租金為基礎的付款,以確定本公司的租賃負債。由於本公司的大部分租約並未提供隱含利率,因此本公司採用基於開始日期可得資料的估計遞增借款利率來釐定租賃付款的現值。
本公司根據超過12個月的現有經營租賃的未付租賃付款現值,確認租賃負債及相應的ROU資產。
ROU資產根據ASC 842轉換指南對現有租賃相關的應計及預付租金餘額、出租人提供的未攤銷租賃激勵及重組負債進行調整。經營租賃成本在租賃期內按直線確認為單一租賃成本,計入銷售、一般和行政費用。公共區域維護的可變租賃支付、財產税和其他運營費用在變動租賃支付所依據的事實和情況發生變化的期間確認為費用。
該公司沒有融資租賃。本公司的租賃主要包括各種經營租賃安排下的各種辦公和實驗室空間、複印機和車輛。
本公司的經營租賃的剩餘租期最長約為五年。
| | |
2023年12月31日 | | |
12月 31,
2022 | |
| 資產 | |
| | |
| |
| 經營性租賃使用權資產 | |
$ | 809,283 | | |
$ | 1,161,141 | |
| 負債 | |
| | | |
| | |
| 經營租賃負債(流動) | |
| 401,826 | | |
| 369,314 | |
| 經營租賃負債(非流動) | |
| 407,457 | | |
| 791,827 | |
補充信息
以下是公司
租賃費用的詳細信息:
| | |
截至十二月三十一日止的年度: | |
| | |
2023 | | |
2022 | |
| 經營租賃費用 | |
$ | 358,576 | | |
$ | 358,576 | |
與租賃相關的其他信息
如下:
| | |
截至的年度
十二月三十一日, | |
| | |
2023 | | |
2022 | |
| 為計入經營租賃負債的金額支付的現金 | |
$ | 385,659 | | |
$ | 358,576 | |
| | |
十二月三十一日,
2023 | | |
十二月三十一日,
2022 | |
| 加權平均剩餘租期: | |
| | |
| |
| 經營租約 | |
| 1.73年 | | |
| 2.48年 | |
| | |
| | | |
| | |
| 加權平均貼現率: | |
| | | |
| | |
| 經營租約 | |
| 1.5 | % | |
| 1.49 | % |
根據不可撤銷租約,今後五年及以後按現行費率支付的最低年度付款如下:
| |
|
經營租約 |
|
| 2024 |
|
$ |
404,745 |
|
| 2025 |
|
|
351,352 |
|
| 2026 |
|
|
56,916 |
|
| 2027 |
|
|
- |
|
| 此後 |
|
|
- |
|
| 未來最低租賃付款總額,未貼現 |
|
|
813,013 |
|
| 減去:推定利息 |
|
|
(3,730 |
) |
| 未來最低租賃付款的現值 |
|
$ |
809,283 |
|
16.承付款和或有事項
或有事件
在正常業務過程中,公司
可能會受到有關合同和僱傭關係以及各種其他事項的法律訴訟。本公司記錄因該等申索而產生的或有負債
經評估為可能出現虧損,而損失金額亦可合理估計。
管理層認為,截至2023年12月31日及截至2024年3月13日,並無未決或受威脅的申索及訴訟。
截至2024年3月13日,即綜合財務報表發佈之日。
17.收購
於2023年11月12日,本公司及其附屬公司BioLite,Inc.(“BioLite臺灣”)分別與AiBtl(“AIBL”或被收購公司)就本公司及BioLite臺灣的中樞神經系統藥物(統稱為“許可產品”)訂立為期多年的全球許可協議。潛在許可將涵蓋許可產品的臨牀試驗、註冊、製造、供應、和經銷權。
雙方決心在全球範圍內合作開發許可產品。雙方還在努力加強新藥開發和業務合作,包括技術、互操作性和標準開發。根據各自的協議,ABVC和BioLite臺灣分別獲得2,300萬股AIBL股票,因此,本公司擁有AIBL的控股權。如果達到某些里程碑,公司和BioLite臺灣公司均有資格獲得3500,000美元和相當於淨銷售額5%的特許權使用費,最高可達1億美元。
公司的結論是,收購的資產和承擔的負債不符合企業的定義,因為獲得的投入數量有限,但沒有獲得實質性的業務流程或產出跡象。因此,此次收購被
計入資產購買。購買的對價是非貨幣性資產(專利)和2023年11月12日的轉讓。股權於2023年12月15日轉讓給ABVC和BioLite臺灣。
| 現金和現金等價物 | |
$ | - | |
| 收購的總資產 | |
| - | |
| 應計費用 | |
| (243,888 | ) |
| 由於
董事 | |
| (498 | ) |
| 已購入的總負債 | |
| (243,386 | ) |
| 總對價(無形資產) | |
| - | |
18.後續活動
2024年1月12日,BioLite臺灣將CTBC貸款協議延長,本金金額相同,為新臺幣20,000,000元,相當於654,000元,為期一年。
於2024年1月17日,本公司與Lind訂立另一項證券購買協議,據此,本公司向Lind發行本金為1,000,000美元的有擔保可轉換票據,購買價為833,333美元,可轉換為本公司普通股股份,轉換價格為(I)3.50美元及(Ii)轉換前20個交易日內三個最低VWAP平均值的90%,兩者以較低者為準。Lind還將獲得為期5年的普通股認購權證,以每股2美元的初始行使價購買最多1,000,000股公司普通股。
於2024年2月29日提交的修正案披露,由於
納斯達克的要求,各方對該附註進行了修正案,根據該修正案,轉換價格的底價應為1.00美元(“修正案”)。此外,修訂規定,如與換股有關,換股價格被視為底價,本公司須向Lind支付現金。
2024年1月27日,該公司根據2016年股權激勵計劃向員工和董事授予1241,615股限制性股票,發行日期為2024年2月2日。這些
股票的限制期為三年。
於二零二四年二月六日,本公司與蜀陵江(“蜀陵”)訂立最終協議,據此,蜀陵將其擁有的位於臺灣桃園市的若干土地(“該土地”)的所有權轉讓予本公司(“該協議”)。作為該土地的代價,本公司按每股3.50美元的價格發行蜀陵(I)703,495股本公司普通股的限制性股份(“股份”)及(Ii)購買最多1,000,000股本公司普通股的五年期認股權證,行使價為每股2.00美元。
本公司已評估自2023年12月31日至2024年3月13日(該等綜合財務報表可供發佈的日期)的所有事項,除上述披露的事項外,並無其他後續事項需要在本公司的綜合財務報表中確認或披露。