

通過卓越的視力增益改變患者預後公司介紹 | 2024 年 4 月納斯達克(OPT);澳大利亞證券交易所(OPT.AX)附錄 99.1

免責聲明本演示文稿包括有關Opthea有限公司(ABN 32 006 340 567)(“Opthea” 或 “公司”)及其關聯公司和子公司(統稱為 “Opthea集團”)活動的一般背景信息。本演示截止日期為 2024 年 4 月 3 日(除非此處另有説明)。本演示文稿中包含的信息為摘要信息,並不聲稱完整,也不包含潛在投資者或買方在評估可能對Opthea的投資或收購Opthea證券時可能需要的有關Opthea集團的所有重要信息。本演示文稿中的信息如有更改,恕不另行通知。Opthea集團的任何成員或Opthea集團任何成員(均為Opthea一方,合為Opthea各方)的任何董事、高級職員、員工、顧問、代理人或代表均無義務更新或更正本演示文稿。本演示文稿包含美國聯邦證券法所指的前瞻性陳述,涉及重大風險和不確定性。除歷史事實陳述外,本演示文稿中包含的所有陳述,包括有關公司在開發產品的治療和商業潛力和預計市場機會規模、未來機會的可行性、未來的市場供需、臨牀試驗下完成患者入組的預期時間和營收數據的時機、我們的戰略、未來運營、未來財務狀況、未來收入、預計成本、管理層前景、計劃和目標的陳述,是前瞻性陳述。“預期”、“相信”、“估計”、“預期”、“打算”、“可能”、“計劃”、“預測”、“項目”、“目標”、“潛在”、“將”、“可能”、“應該”、“繼續” 等詞語以及類似的表述旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別詞。實際上,我們可能無法實現前瞻性陳述中披露的計劃、意圖或預期,您不應過分依賴我們的前瞻性陳述作為對未來事件的預測。實際業績或事件可能與我們在前瞻性陳述中披露的計劃、意圖和預期存在重大差異。本演示文稿中包含的前瞻性陳述反映了我們目前對未來事件的看法,除非適用法律要求,否則我們沒有義務更新任何前瞻性陳述。請參閲Opthea於2023年9月28日向美國證券交易委員會提交的20-F表年度報告以及未來向美國證券交易委員會提交的其他文件中列出的信息,包括風險因素,以瞭解可能導致實際業績與前瞻性陳述中的預測存在重大差異的關鍵因素,包括與以下相關的風險:未來資本需求、藥物療法的開發、測試、生產、營銷和銷售、監管的風險和潛在損失監管部門的批准、正在進行的證明索齊尼伯西普安全性、耐受性和治療療效的臨牀研究、對Opthea3期臨牀試驗數據一旦揭露的額外分析、3期臨牀試驗患者入組和臨牀研究機構的完成時間、合同製造商和勞動力成本、知識產權保護以及其他可能影響公司未來運營和財務業績的一般性因素。本演示文稿包括我們從行業出版物和研究、第三方進行的調查和研究中獲得的統計數據和其他行業和市場數據,以及我們自己對潛在市場機會的估計。本演示文稿中使用的所有市場數據都涉及許多假設和侷限性,提醒您不要過分重視此類數據。行業出版物和第三方的研究、調查和研究通常表明,他們的信息是從被認為可靠的來源獲得的,儘管它們不能保證此類信息的準確性或完整性。我們對候選產品的潛在市場機會的估計包括基於我們的行業知識、行業出版物、第三方研究和其他調查的幾個關鍵假設,這些假設可能基於少量樣本,可能無法準確反映市場機會。儘管我們認為我們的內部假設是合理的,但沒有獨立來源證實了這些假設。本演示文稿中包含的信息不構成投資或金融產品建議(也不是税收或法律建議),也無意用作做出投資決策的依據。該演示文稿僅供參考,不是澳大利亞法律或任何其他司法管轄區的法律規定的招股説明書或其他披露文件,也不包含招股説明書或其他披露文件中要求披露的所有信息。本演示文稿中提供的信息可能與為任何證券要約而準備的任何披露文件中提供的信息存在重大差異。它沒有考慮到任何特定投資者的投資目標、財務狀況、税收狀況或需求,在決定一項投資是否適當時應考慮這些因素。您必須考慮自己的投資目標、財務狀況和需求,並進行自己的獨立調查和查詢,包括就本演示文稿中包含的信息獲取適用於您所在司法管轄區的税務、法律、財務或其他專業建議。收件人不應依賴此演示來考慮任何特定交易的優點。本演示文稿可能包含第三方的商標和商品名稱,這些商標和商品名稱是其各自所有者的財產。本演示文稿中使用的第三方商標和商品名稱屬於相關所有者,使用並不代表任何Opthea集團的贊助、批准或關聯。

首創的 VEGF-C/D TRAP 旨在與標準護理抗血管內皮生長因子-A 療法的物質成分和使用方法相結合的專利有效期至 2034 年;Sozinibercept 有望成為 15 年多來首款改善視覺效果的產品滿足高未滿足需求的產品兩項大型關鍵試驗正在進行的大型市場機會濕性年齡相關性黃斑變性(濕性 AMD)是美國視力喪失的主要原因老年人,儘管廣泛使用,但仍影響了美國和歐洲約350萬名患者抗血管內皮生長因子-A的護理標準COAST入組已於2024年2月完成;ShoRe估計,第二季度 CY2024(截至2024年4月3日入組率為96%)兩項試驗的頭條數據預計在2025財年中期卓越的先導資產2b期顯示出優越性,具有良好的耐受性,在具有成熟臨牀實踐的不斷增長的市場中,Sozinibercept有可能改善數百萬濕性AMD患者的視力 Sozinibercept 專為與任何抗血管內皮生長因子-A 聯合使用而開發;不是與任何批准的療法競爭 MOA — 作用機制;SOC — 護理標準 *專利期限延長、數據和市場排他性(生物學為 12 年)專有技術

經驗豐富的領導團隊專業知識和往績對視網膜社區產生積極影響 Fred Guerard,PharmD,MS 首席執行官彼得·朗首席財務官梅根·鮑德温博士,MAICD 創始人、首席創新官兼執行董事朱迪思·羅伯遜首席商務官 Arshad M. Khanani,醫學博士,碩士,FASRS管理合夥人,Sierra Eye Associates臨牀研究總監兼獎學金主任,以及內華達大學裏諾醫學院臨牀教授管理團隊首席臨牀醫學顧問顧問委員會 Charles C. Wykoff,醫學博士,德克薩斯州視網膜顧問研究主任,研究和臨牀試驗委員會主席,美國視網膜顧問蒂姆·傑克遜,博士,醫學博士,FrcoPhth 國家衞生服務局,倫敦國王醫院學院醫院顧問,紐約大學醫學院臨牀專業醫學博士,紐約玻璃體視網膜黃斑顧問合夥人

儘管使用標準護理抗血管內皮生長因子-A療法進行治療,但大多數患者的視力效果並不理想 *根據隨機對照臨牀試驗數據;> 45% 的患者在最佳矯正視力(BCVA)方面未能實現≥2條線的改善;持久液體:SD-OCT ≥ 300 µM 或時域OCT ≥ 250 µM 1 Mettu PS,等。Prog Retin Eye Res. 2021 儘管接受了抗血管內皮生長因子-A 療法*的治療,但在 12 個月以上的時候視力會進一步喪失,黃斑積液會持續存在 > 60% > 45% 大多數患者無法達到 20/40 的視力大多數患者無法恢復日常活動,例如開車或閲讀
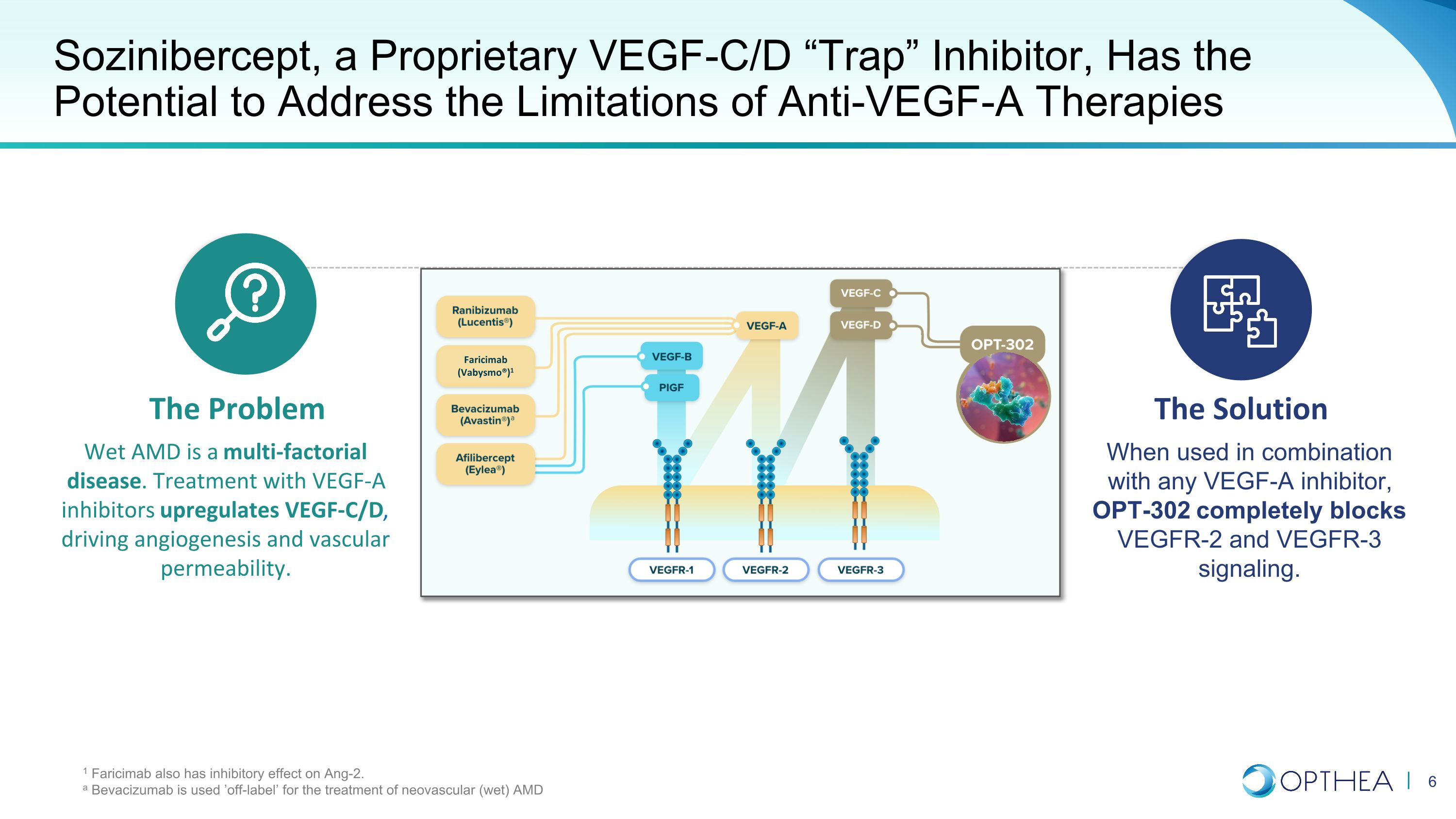
Sozinibercept 是一種專有的 VEGF-C/D “Trap” 抑制劑,有可能解決抗血管內皮生長因子-A 療法的侷限性。問題濕性 AMD 是一種多因素疾病。使用 VEGF-A 抑制劑治療可上調 VEGF-C/D,從而推動血管生成和血管通透性。當與任何 VEGF-A 抑制劑聯合使用時,OPT-302 可完全阻斷 VEGFR-2 和 VEGFR-3 信號傳導。1 法裏西單抗還對 Ang-2 有抑制作用。貝伐珠單抗被 “標籤外” 用於治療新生血管(濕性)AMD 法裏西單抗(Vabysmo®)1
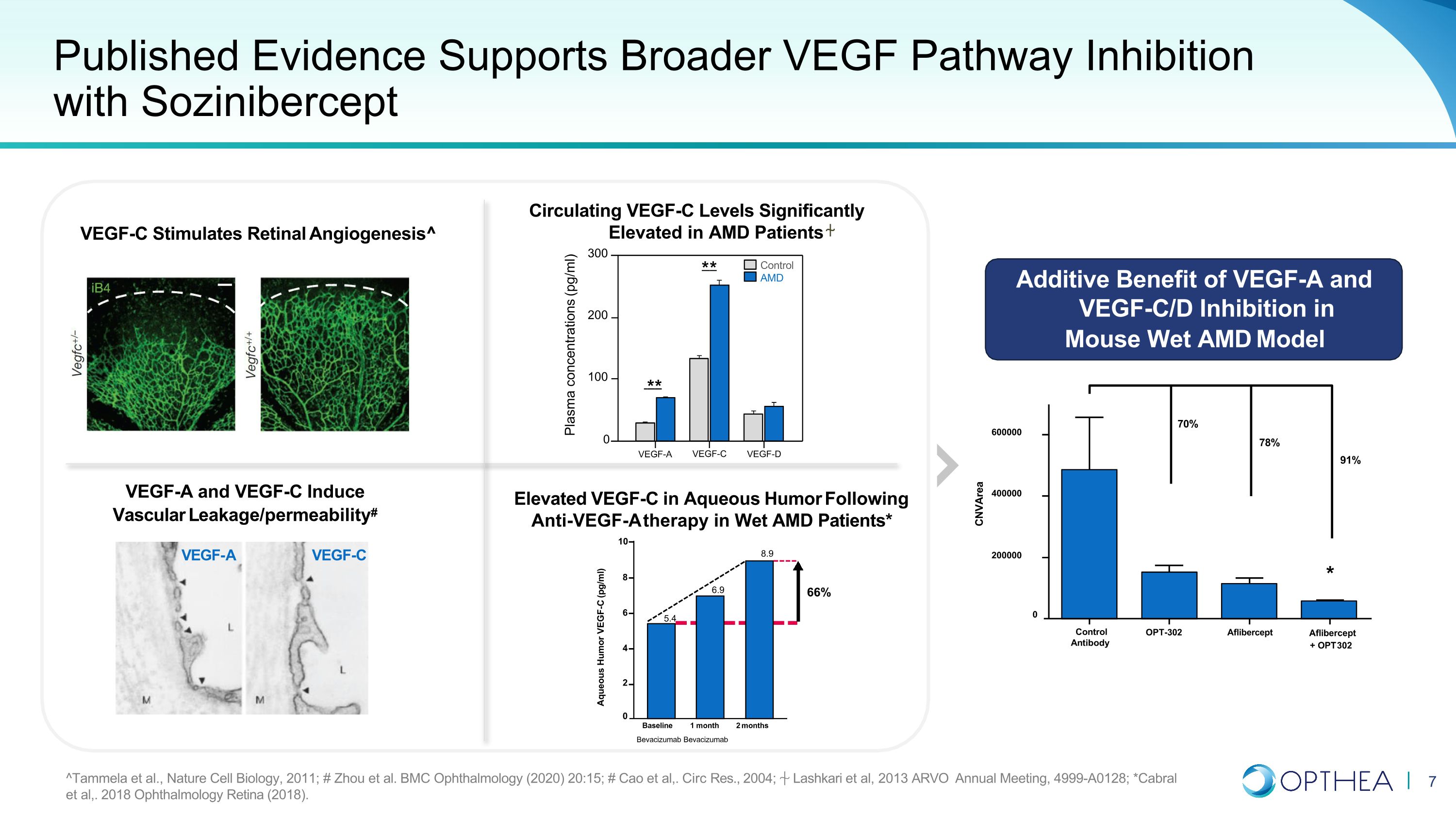
已發表的證據支持使用索齊尼伯西普 VEGF-A 和 VEGF-C 可更廣泛地抑制血管內皮生長因子通路 # VEGF-C VEGF-C 刺激視網膜血管生成^ AMD 患者循環血管內皮生長因子-C 水平顯著升高濕性 AMD 患者接受抗 VEGF-A 治療後血管內皮生長因子-C 升高* VEGF-A 和 VEGF-C/D Ind的附加益處小鼠濕式 AMD 模型中的抑制作用 **** 控制 AMD 血漿濃度 (pg/ml) 300 200 100 0 對照抗體 OPT-302 Aflibercept Aflibercept + OPT 302 CNVArea 70% 78% 91% * 0 200000400000 600000 水性幽默 VEGF-C (pg/ml) 10 8 66% 6 5.4 6.9 8.9 4 2 0 基線 1 個月 2 個月 Bevacizumab bevacizumab ^Tammela 等人,《自然細胞生物學》,2011 年;# Zhou 等人BMC 眼科 (2020) 20:15; # Cao 等人,.Circ Res.,2004 年;Lashkari 等人,2013 年 ARVO 年會,4999-A0128;*Cabral 等人,2018 年眼科視網膜(2018)。VEGF-A VEGF-C VEGF-D
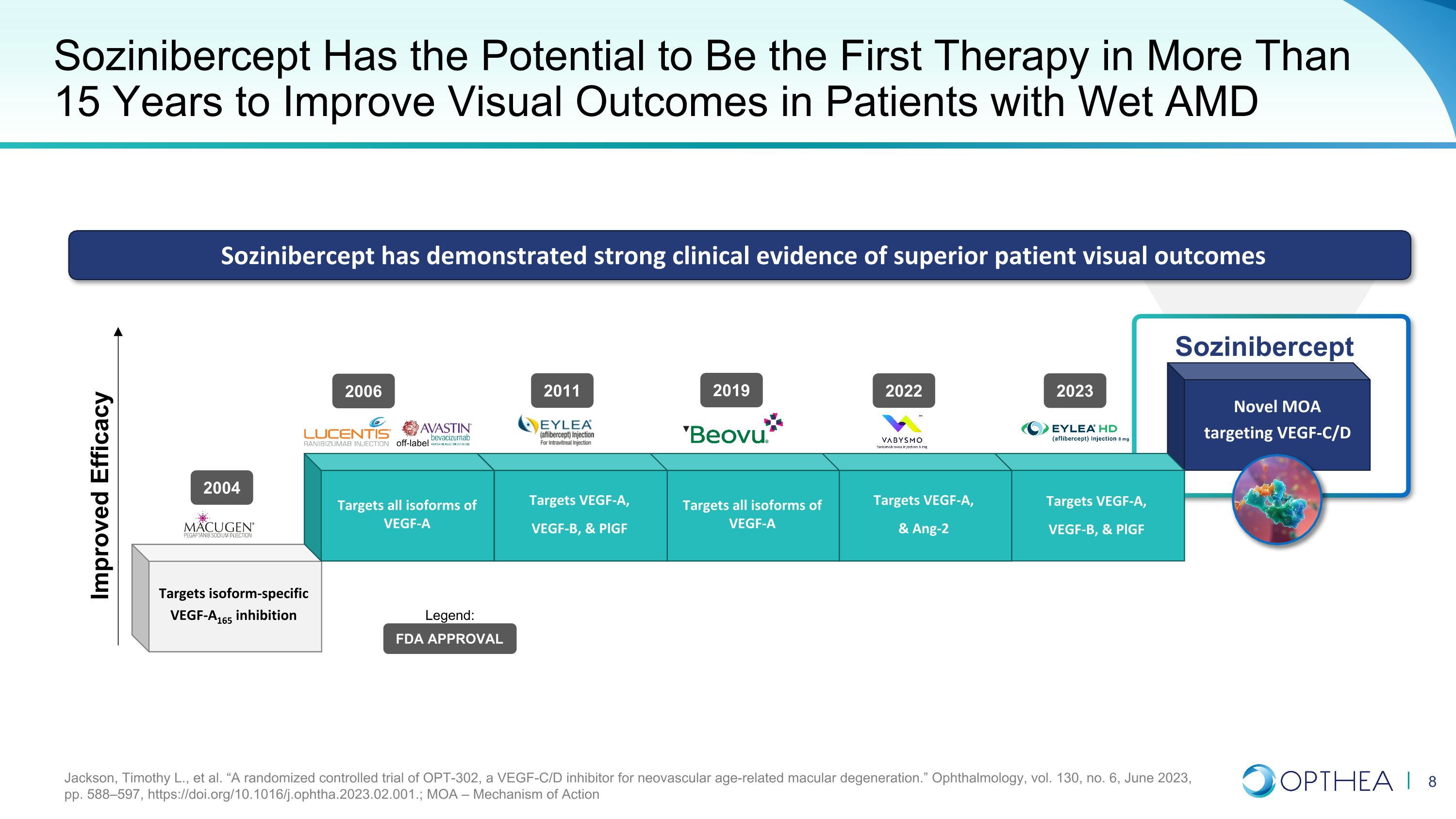
針對 VEGF-C/D 的新型 MOA Sozinibercept 靶向 VEGF-A、VEGF-B 和 pLGF 靶向 VEGF-A 和 Ang-2 靶向 VEGF-A 的所有亞型 Sozinibercept 有望成為 15 年來首種改善濕性 AMD 患者視覺效果的療法。靶向 VEGF-A 靶向所有異構體的 VEGF-A、VEGF-B 和 pLGF 靶向 VEGF-A 靶向所有亞型 VEGF-A VEGF-A165 抑制劑 Sozinibercept 已顯示出強有力的臨牀證據,表明患者視覺效果優異 2004 年 2006 年 2011 年 2022 年 FDA 未經標籤批准傳奇:Jackson、Timothy L. 等“一項針對新生血管年齡相關性黃斑變性的 VEGF-C/D 抑制劑 OPT-302 的隨機對照試驗。”《眼科學》,第 130 卷,第 6 期,2023 年 6 月,第 588—597 頁,https://doi.org/10.1016/j.ophtha.2023.02.001。;MOA — 2023 年行動機制 2019
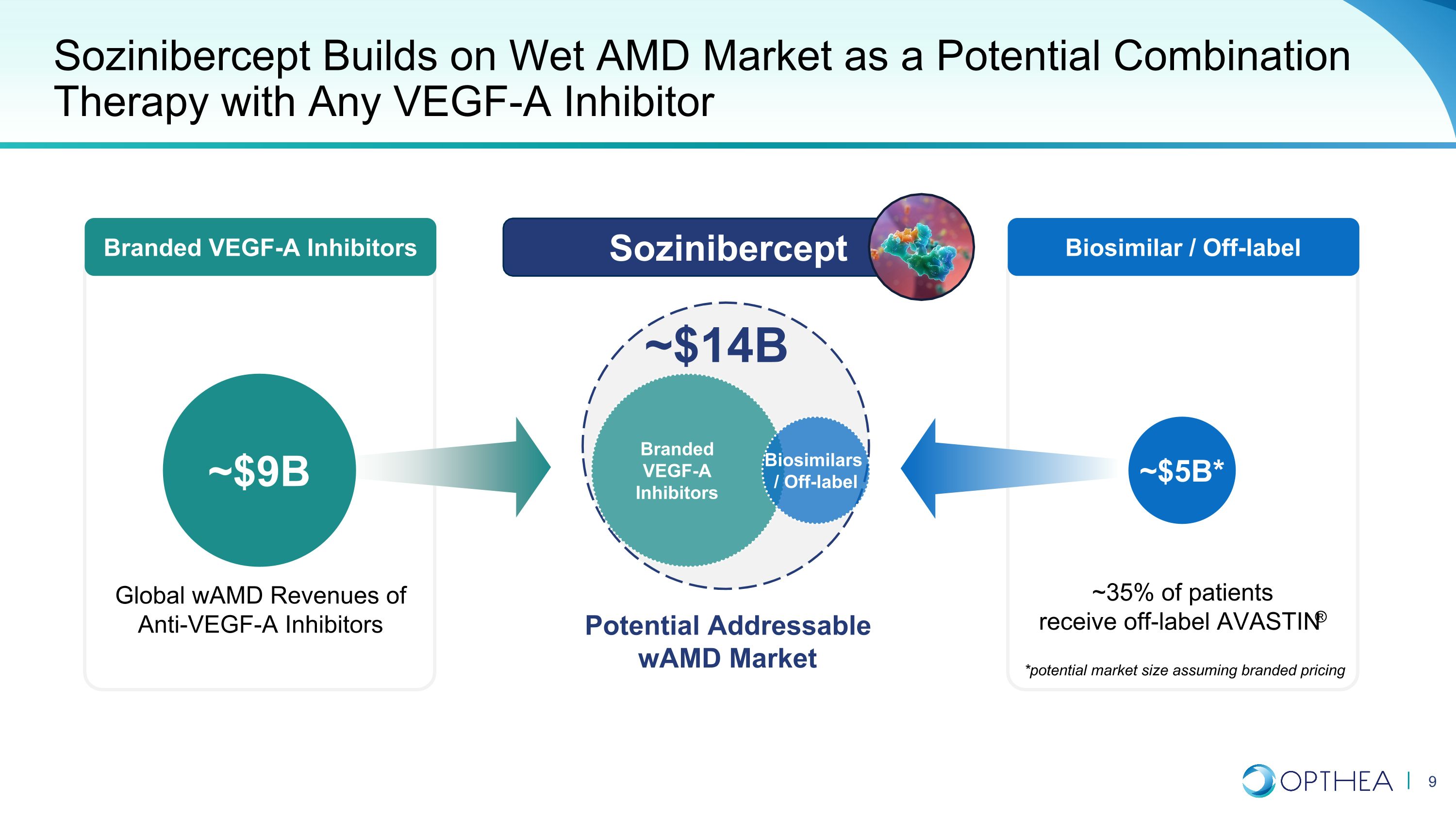
品牌VEGF-A抑制劑Sozinibercept建立在濕性AMD市場上,是任何VEGF-A抑制劑的潛在聯合療法,潛在的WamD市場約為90億美元~50億美元* Sozinibercept *潛在的市場規模(假設品牌定價)~35%的患者獲得標籤外的AVASTIN® 全球WAMD的抗VEGF-A抑制劑收入約140億美元品牌VEGF-A抑制劑生物仿製藥生物仿製藥/非標籤生物仿製藥/標籤外
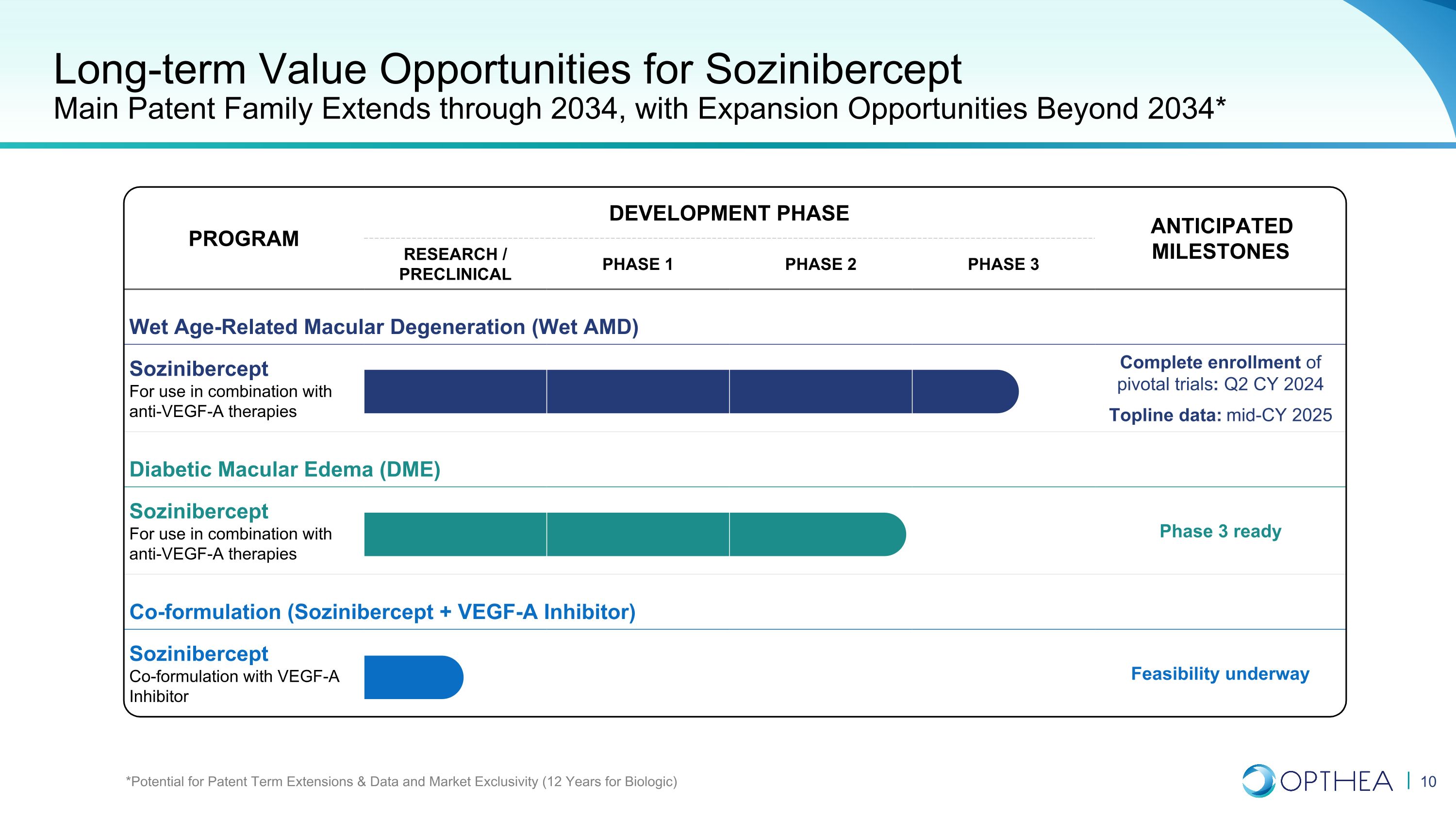
項目開發階段預期里程碑計劃研究/臨牀前第一階段第二階段第三階段預期里程碑濕性年齡相關性黃斑變性(Wet AMD)Sozinibercept 與抗血管內皮生長因子-A療法聯合使用完成關鍵試驗的註冊:2024財年第二季度主要數據:2025年中期糖尿病黃斑水腫(DME)Sozinibercept 與抗血管內皮生長因子-A療法聯合使用,第三階段準備就緒(Sozinibercept + VEGF-A 抑制劑)Sozinibercept 與 VEGF-A 抑制劑的聯合配方正在進行可行性長期價值SoziniberceptMain專利家族的機會將延續到2034年,擴張機會延至2034年* *專利期限延長、數據和市場排他性的潛力(生物學為12年)
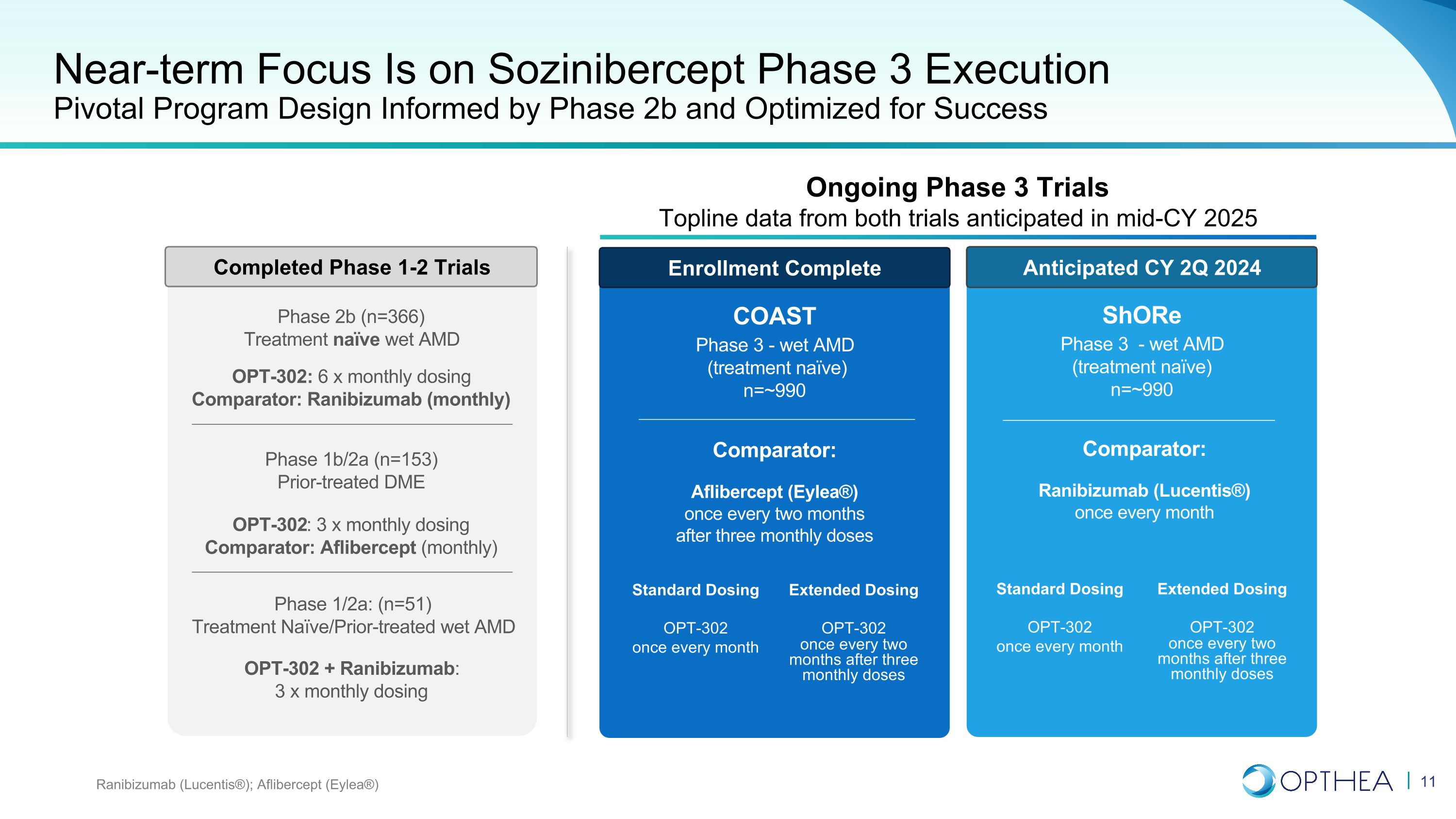
近期重點是索齊尼伯西普第三階段的執行關鍵項目設計以2b期為依據,經過優化以取得成功雷尼珠單抗(Lucentis®);Aflibercept(Eylea®)COAST 3期——濕法AMD(治療未成熟)n=~990 比較器:Aflibercept(Eylea®)在三個月給藥後每兩個月一次 Shore 第三階段——濕式 AMD(治療無效)ve) n=~990 比較器:雷尼珠單抗(Lucentis®)每月一次標準劑量 OPT-302 每月一次延長劑量 OPT-302 在三個月劑量後每兩個月一次標準劑量 OPT-302 每月一次延長劑量OPT-302 在三個月給藥後每兩個月一次 1/2a 階段:(n=51)先前治療的濕式 AMD OPT-302 + 雷尼珠單抗:3 x 月劑量 OPT-302:3 x 月劑量比較器:Aflibercept(每月)第 1b/2a 階段(n=153)先前治療的 DME OPT-302:6 x 月劑量比較器:雷珠單抗(每月)第 2b 階段(n=153)366) 預計 2024 財年第二季度完成 1-2 期試驗正在進行中 3 期試驗 Topline 數據預計將於 2025 財年中期完成
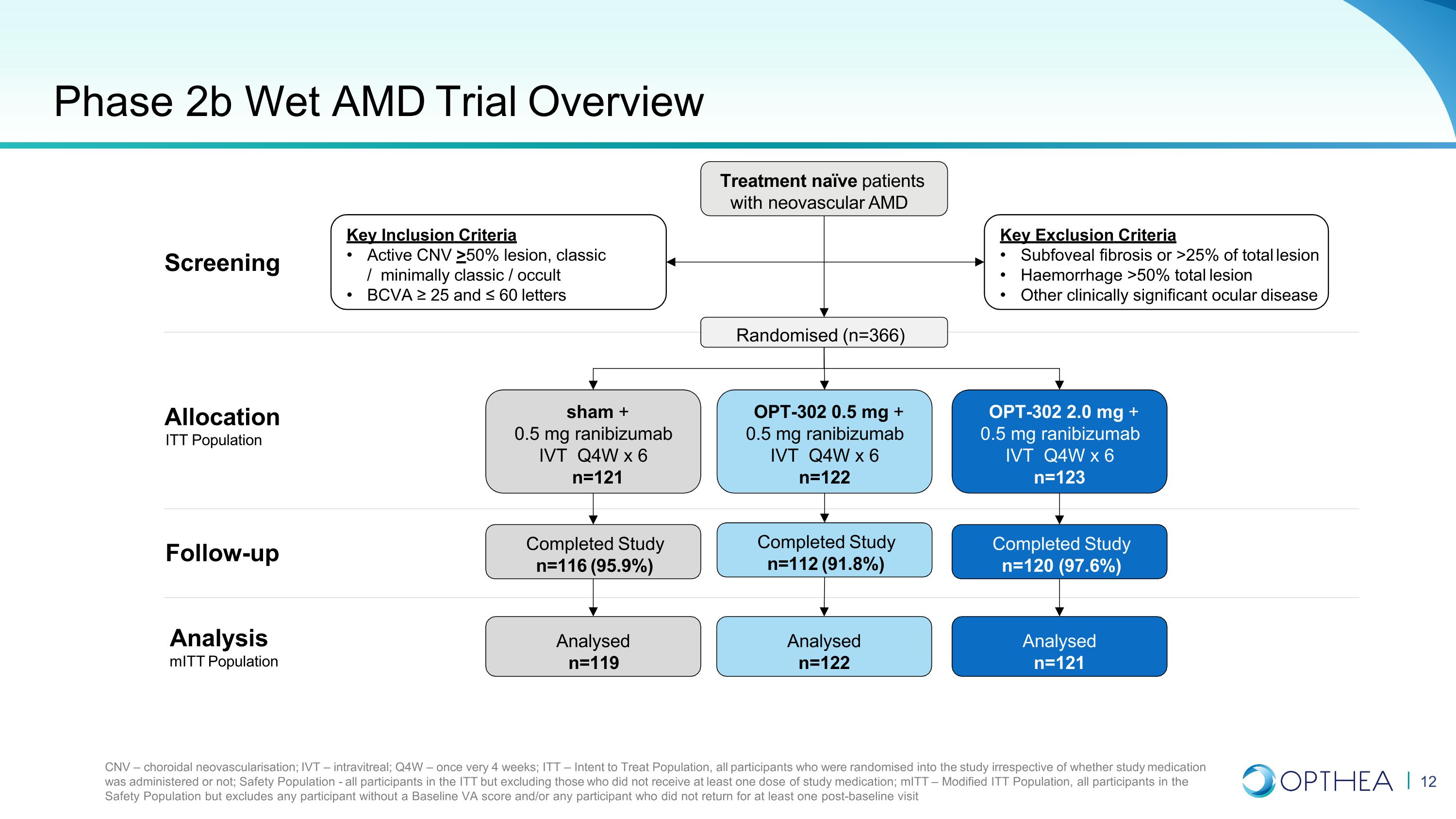
2b 期 Wet AMD 試驗概述治療新生血管 AMD 的天真患者關鍵排除標準中央凹下纖維化或病變總數的 25% 出血 > 50% 總病變其他具有臨牀意義的眼部疾病關鍵納入標準 Active CNV > 50% 病變,經典/最低限度經典/隱性 BCVA ≥ 25 和 ≤ 60 個字母 CNV — 脈絡膜新生血管;IVT — 靜脈注射 itreal;Q4W — 每 4 週一次;ITT — 意向治療人羣,無論是否使用研究藥物,所有參與者都被隨機分配到研究中;安全性人羣——ITT的所有參與者,但不包括未接受至少一劑研究藥物的參與者;MitT — 修改後的ITT人羣,安全人羣中的所有參與者,但不包括任何沒有基線 VA 評分的參與者和/或任何沒有返回至少一次基線後就診的參與者隨機隨訪(n=366)OPT-302 0.5 mg + 0.5 mg 蘭珠單抗 IVT Q4W x 6 n=122 sham + 0.5 mg ranibizumab IVT Q4W x 6 n=122 sham + 0.5 mg ranibizumab sham + 0.5 mg ranibizumab IVT Q4W x 6 n=121 OPT-302 2.0 mg + 0.5 mg ranibizumab IVT Q4W x 6 n=123 已完成研究 n=112 (91.8%) 已完成研究 n=112 (91.8%) 已完成研究 n=116 (95.9%)已完成的研究 n=120 (97.6%) 已分析 n=122 已分析 n=119 已分析 n=121 分析 MitT 人口分配 ITT 人羣篩查

2b 期主要和次要終點選擇預先指定的子組主要終點關鍵次要終點第 24 周 BCVA 與基線相比的平均變化第 24 周與基線相比增加 ≥ 15 個字母的患者比例第 24 週中心亞場厚度 (CST) 從基線到第 24 周的變化視網膜內和視網膜下積液的變化安全性和耐受性主要是經典病變、最低經典病變和隱性病變(分層因子)視網膜心絞痛在基線時檢測到/未檢測到腫瘤增生 (RAP) 息肉脈絡膜基線時檢測到/未檢測到血管病變 (PCV)
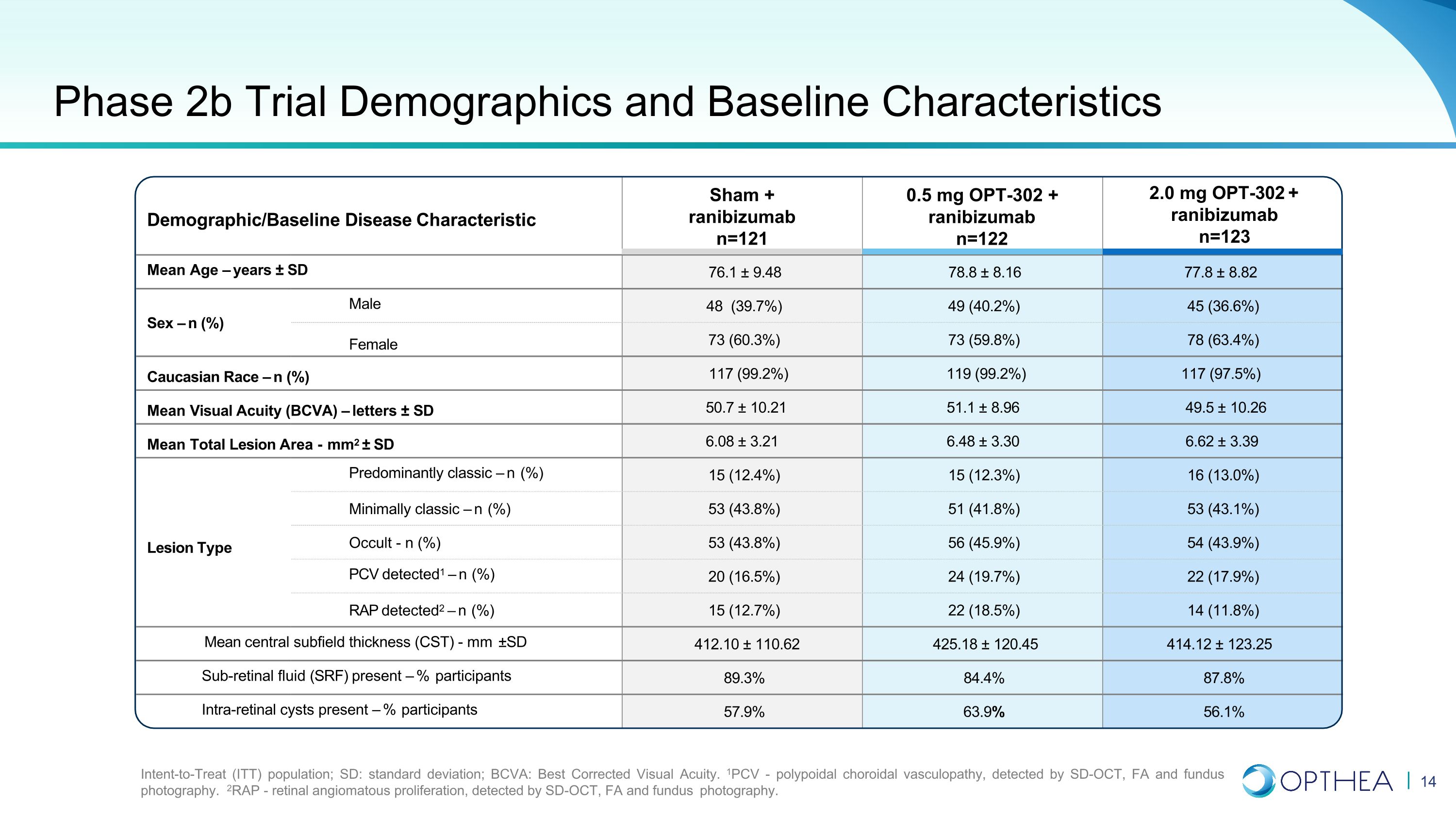
人口統計/基線疾病特徵 2.0 mg OPT-302 + 雷尼珠單抗 n=123 平均年齡 — 歲 ± SD 76.1 ± 9.48 ± 8.16 77.8 ± 8.82 性別 — n (%) 男性 48 (39.7%) 49 (40.2%) 45 (36.6%) 女性 73 (59.8%) 78 (63.4%) 高加索種族 — n (%) 49 (40.2%) 45 (36.6%) 女性 73 (59.8%) 78 (63.4%) 高加索種族 — n (%) 117 (99.2%) 119 (99.2%) 117 (97.5%) 平均視力 (BCVA) — 字母 ± SD 50.7 ± 10.21 51.1 ± 8.96 49.5 ± 10.26 平均總病變面積-mm2 ± SD 6.08 ± 3.21 6.48 ± 3.39 以經典為主 — n (%) 15 (12.4%) 15 (12.3%) 16 (13.0%) 最低限度經典 — n (%) 53 (43.8%) 51 (41.8%) 53 (43.1%) 病變類型隱匿性-n (%) 53 (43.8%) 56 (45.9%) 54 (43.9%) 檢測到的聚氯乙烯病毒1 — n (%) 20 (16.5%) 24 (19.7%) 22 (17.9%) 檢測到 RAP 2 — n (%) 15 (12.7%) 22 (18.5%) 14 (11.8%) 平均中心子場厚度 (CST)-mm ±SD 412.10 ± 110.62 425.62 425.62 425.62 18 ± 120.45 414.12 ± 123.25 存在視網膜下積液 (SRF) — 參與者百分比 89.3% 84.4% 87.8% 存在視網膜內囊腫 —% 參與者 57.9% 63.9% 56.1% 2b 期試驗人口統計學和基線特徵意向治療 (ITT) 人羣;SD:標準差;BCVA:最佳矯正視力。1PCV-息肉脈絡膜血管病變,通過 SD-OCT、FA 和眼底攝影檢測。2RAP-視網膜血管瘤增生,通過 SD-OCT、FA 和眼底攝影檢測。Sham + 雷尼珠單抗 n=121 0.5 mg OPT-302 + 雷珠單抗 n=122
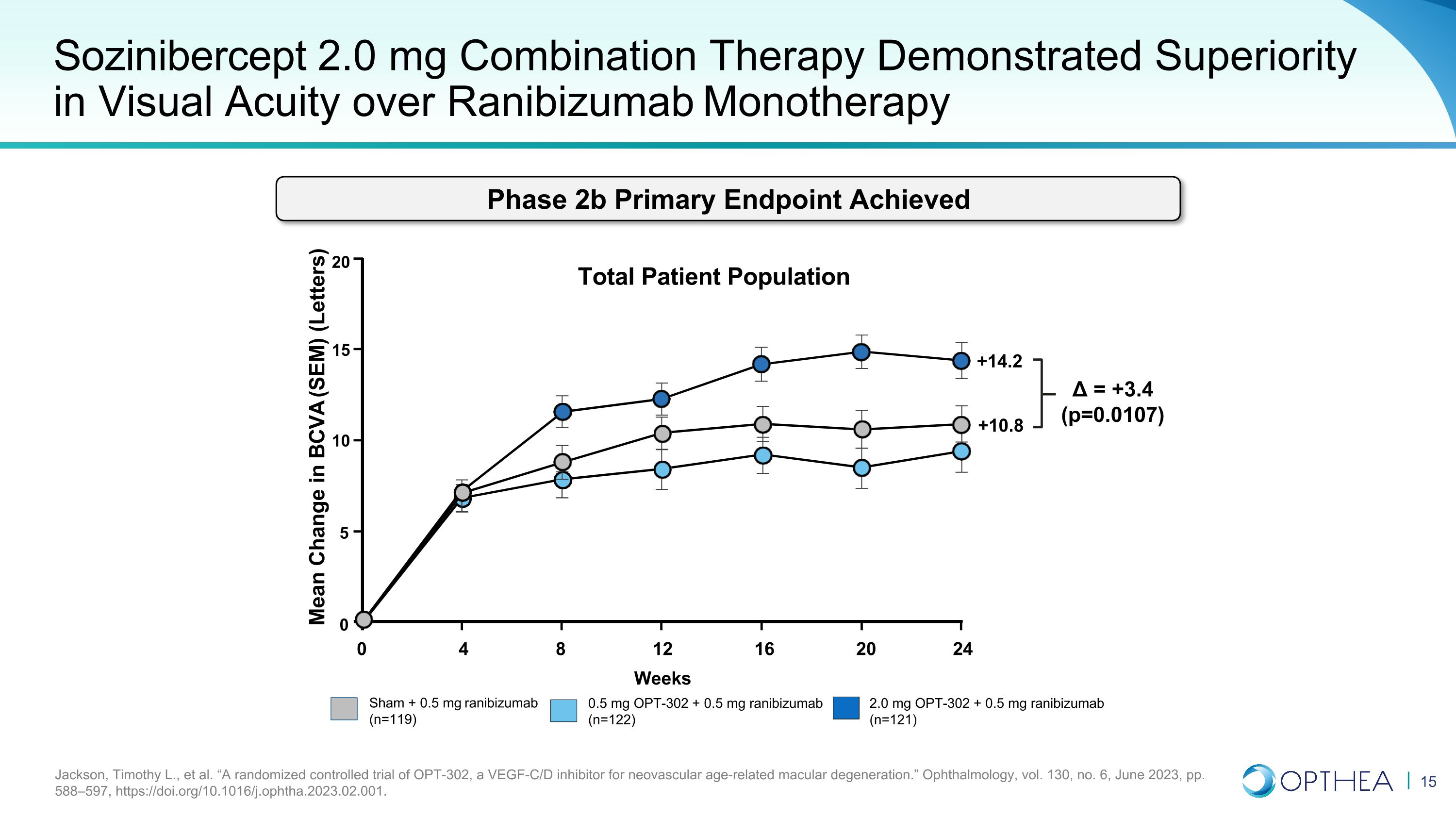
Sozinibercept 2.0 mg 聯合療法在視力方面顯示出優於雷珠單抗單一療法 Jackson、Timothy L. 等人“一項針對新生血管年齡相關性黃斑變性的 VEGF-C/D 抑制劑 OPT-302 的隨機對照試驗。”《眼科學》,第 130 卷,第 6 期,2023 年 6 月,第 588—597 頁,https://doi.org/10.1016/j.ophtha.2023.02.001。Sham + 0.5 mg 雷尼珠單抗 (n=119) 2.0 mg OPT-302 + 0.5 mg 雷尼珠單抗 (n=121) 0.5 mg OPT-302 + 0.5 mg 雷尼珠單抗 (n=122) BCVA (SEM) 的平均變化 (字母) = +3.4 (p=0.0107) 20 15 10 5 0 0 4 8 16 20 24 12 周患者總人羣 +14.2 +10.8 期 2b 主要終點已實現
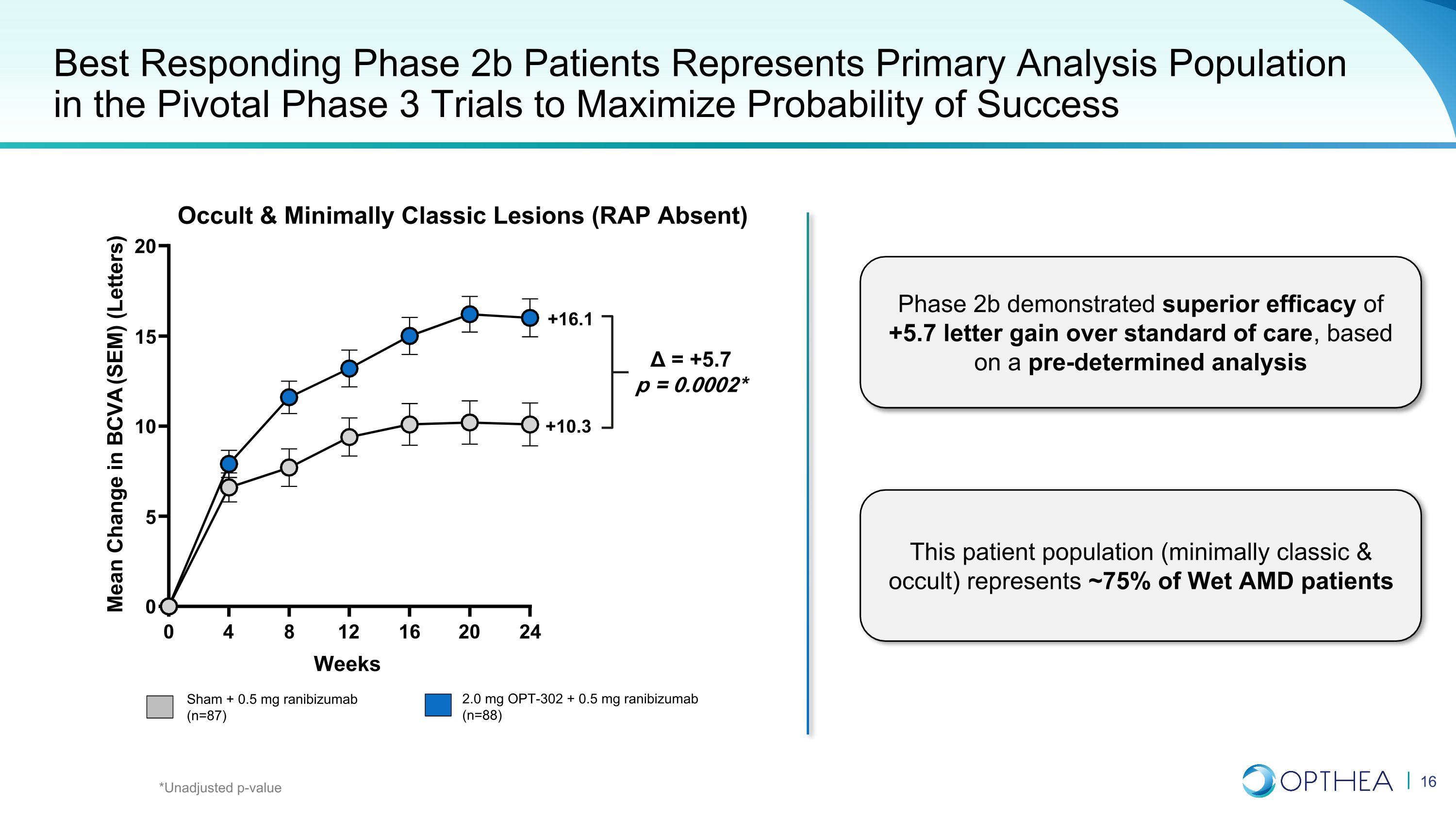
反應最佳的2b期患者代表了最大成功概率的關鍵3期試驗的主要分析人羣 Sham + 0.5 mg 雷尼珠單抗(n = 87)2.0 mg OPT-302 + 0.5 mg 雷尼珠單抗(n=88)+10.3 +16.1 = +5.7 p = 0.0002* 隱祕和最低經典病變(RAP 不存在)*未經調整的 p 值的 2b 期表現出優於+5.7 字母增益的療效護理標準,基於預先確定的分析該患者羣體(最低限度經典和隱祕性)約佔濕性AMD患者的75% 0 4 8 12 16 20 24 0 5 10 15 20 24 0 5 10 15 20 Weeks M e a n c ha n g e i n B C V A (S E M) (l e t t e r s) BCVA (SEM) 的平均變化(字母)

試驗:治療:患者人數:88 87 240 信函中的基線 BCVA:50.5 50.5 53.7 對照組在類似病變類型的患者羣體中在第 24 周表現優於 MARINA 試驗 OPT 2B +Ran 0.5 q4w +Ran 0.5 q4w Ran 0.5 q4w Ran 0.5 q4w OPT-302 + 雷珠單抗雷尼珠單抗 OPT 2B MARINA 是一項三期註冊試驗。不同試驗的基準 BCVA 值各不相同。隨機分配到治療組的患者人數(n,下表)。最佳矯正視力(BCVA)與基線相比的平均變化,如ETDRS字母(條形頂部)所示。與標準護理相比,+5.7 字母增益 MARINA BCVA 在第 24 周與基線相比的平均變化 — OPT-302 2b 期與 MARINA 試驗的隱匿性病變和最低限度經典病變
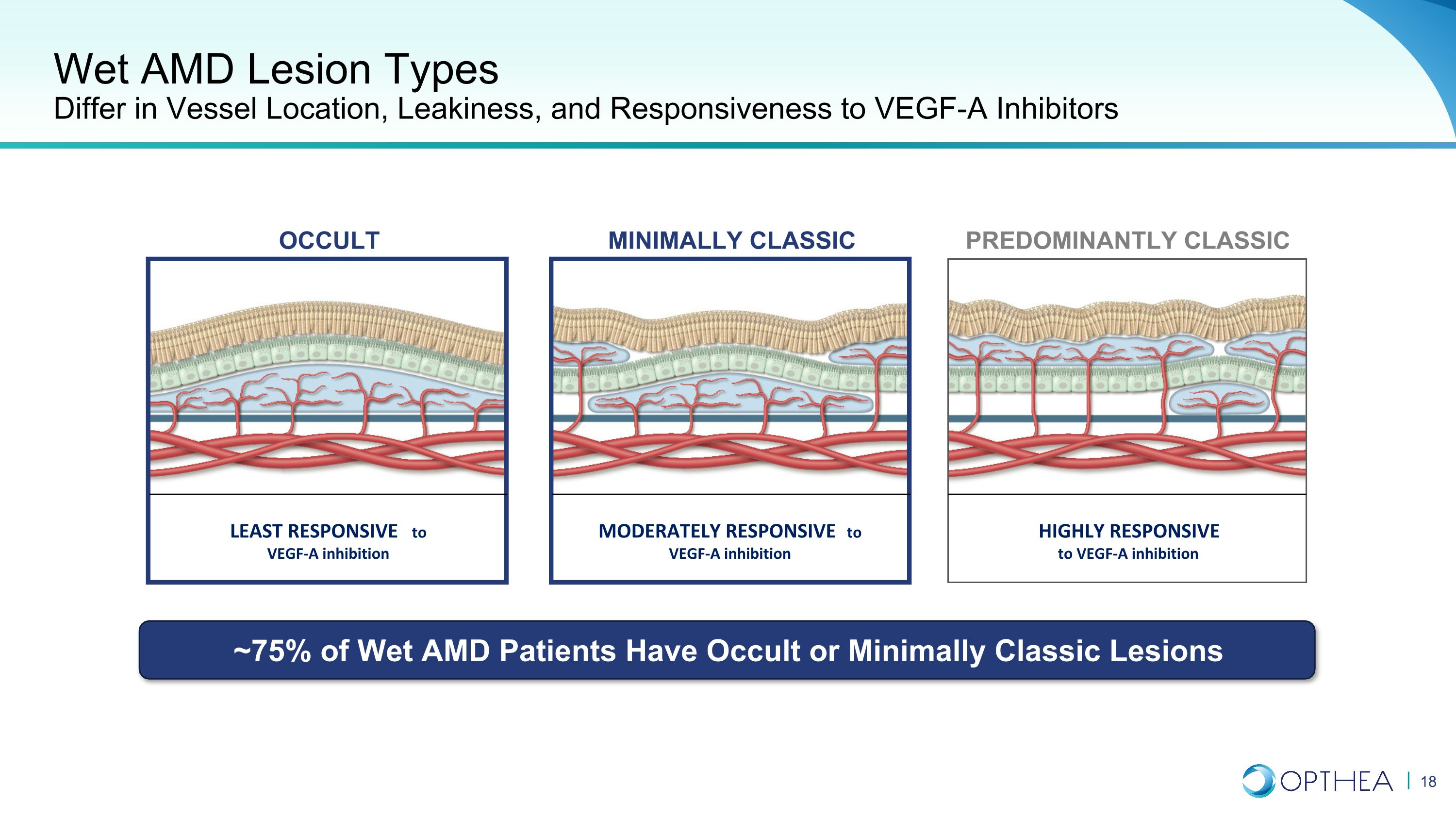
濕性 AMD 病變類型在血管位置、滲漏和對 VEGF-A 抑制劑的反應方面有所不同,對 VEGF-A 抑制反應最小 VEGF-A 抑制反應適度對 VEGF-A 抑制反應高度反應主要是經典的微型經典隱性病變 ~ 75% 的濕性 AMD 患者有隱性或微型經典病變
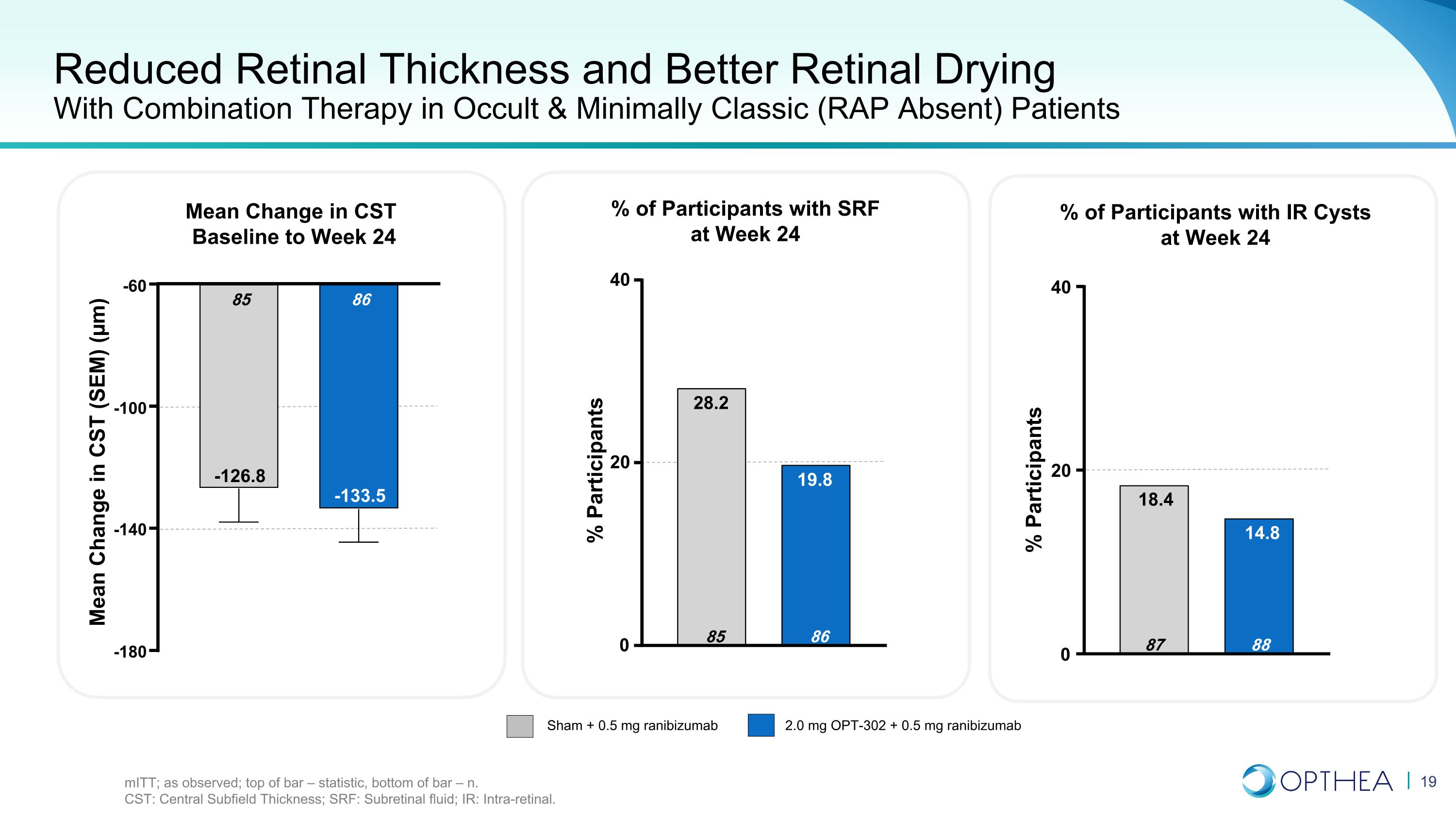
對隱匿和最低限度經典患者(無RAP)患者採用聯合療法,視網膜厚度降低,視網膜乾燥效果更好意味着CST基線變化至第24周 Sham + 0.5 mg OPT-302 + 0.5 mg ranibizumab 2.0 mg + 0.5 mg ranibizumab 受試者百分比第 24 周有 SRF 的參與者 24% 受試者 -180 -140 -100 -60 86 -133.5 85 85 -126.8 CST 的平均變化 (SEM) (µm) 0 20 40 88 14.8 87 18.4 0 20 40 86 19.8 85 28.2% 參與者 miTT;如觀測所見;柱頂部 — 統計數據,條形底部 — n. CST:中央子場厚度;SRF:視網膜下部液體;IR:視網膜內。
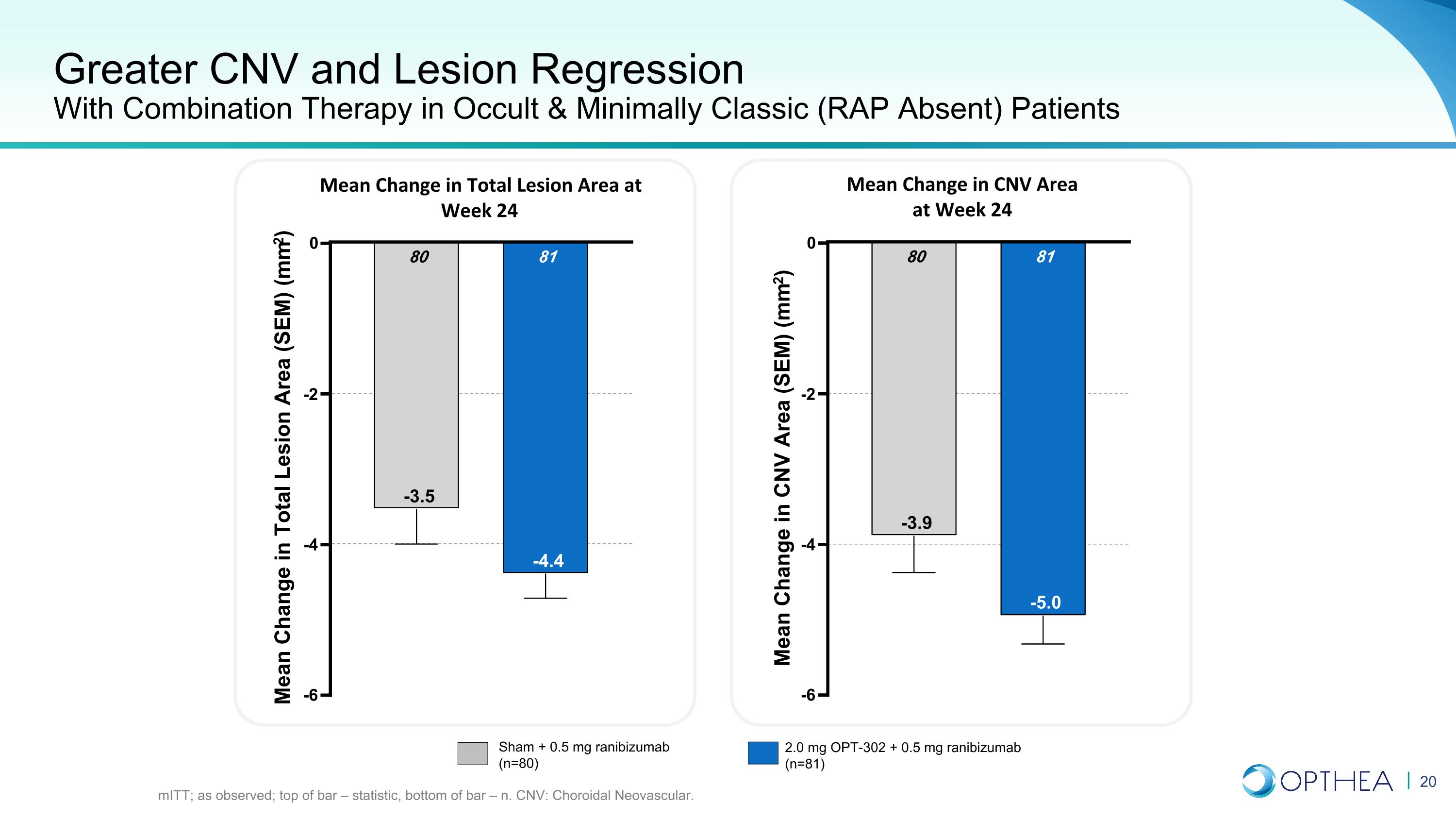
在隱匿和最低限度經典(無RAP)患者中使用聯合療法提高CNV和病變回歸率 mitT;如觀察;條形頂部 — 統計數據,柱底部 — n. CNV:脈絡膜新生血管。第 24 周總病變面積的平均變化 24 周 CNV 面積的平均變化 -6 -4 -2 0 81 -4.4 80 -3.5 總病變面積 (SEM) 的平均變化 (mm2) -6 -4 -2 0 81 -5.0 80 -3.9 CNV 面積 (SEM) (mm2) Sham 的平均變化 + 0.5 mg 雷尼珠單抗 (n=80) 2.0 mg OPT-302 + 0.5 mg ranibizumab (n=81)
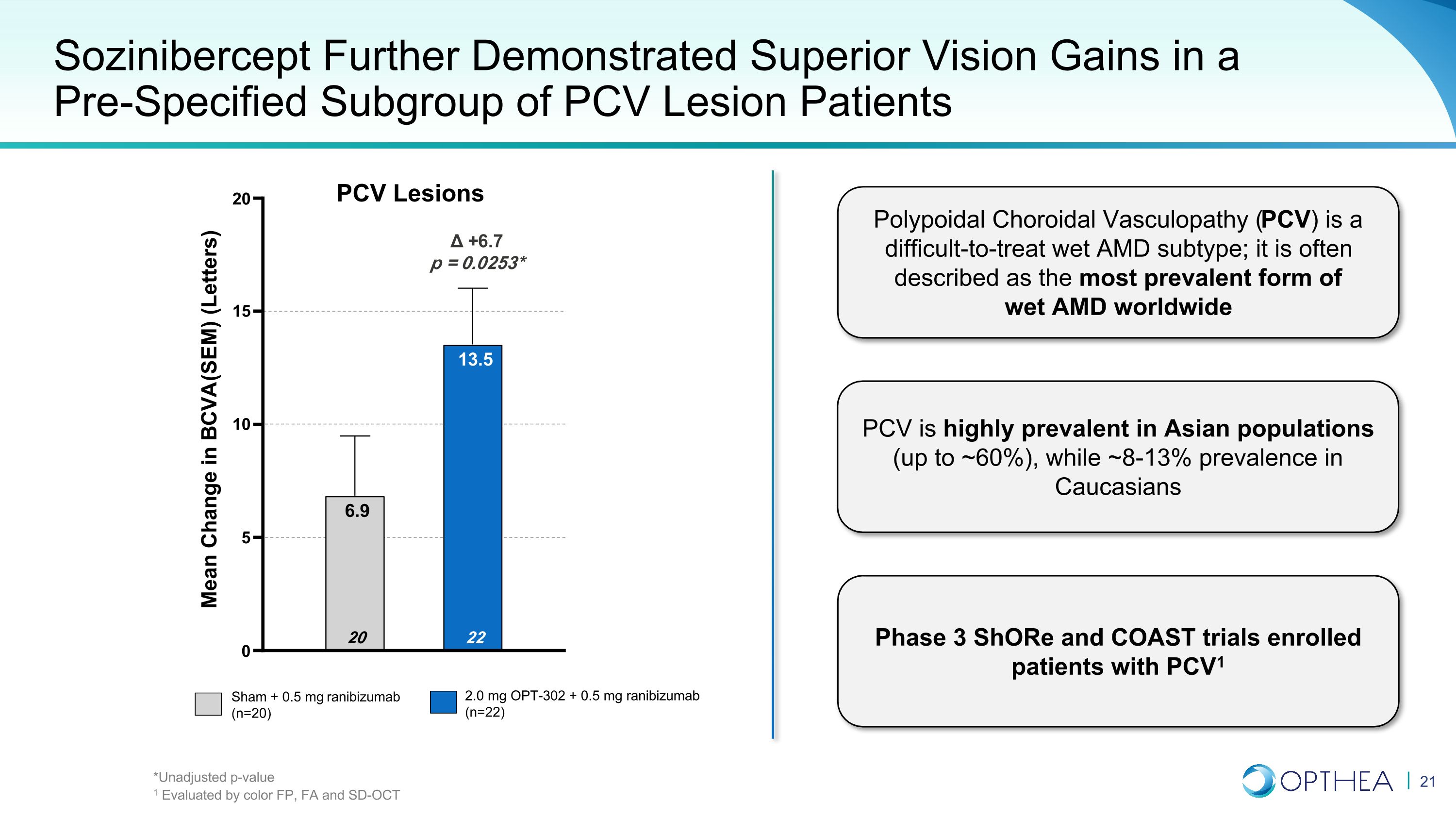
索齊尼伯西普在預先指定的肺炎病毒病變患者亞組中進一步顯示出優異的視力增益 Sham + 0.5 mg 雷尼珠單抗(n=20)2.0 mg OPT-302 + 0.5 mg 雷尼珠單抗(n=22)+6.7 p = 0.0253* 0 5 10 15 20 22 13.5 20 6.9 BCVA(SEM)(信件)息肉類脈絡膜血管病變的平均變化(字母))是一種難以治療的濕性AMD亞型;它通常被描述為全球最普遍的濕性AMD形式。PCV在亞洲人羣中非常普遍(高達約60%),而在高加索人羣中,約8-13%的患病率為3期Shore和COAST試驗招收的患者PCV1 PCV 病變 *未調整的 p 值 1 按顏色 FP、FA 和 SD-OCT 進行評估
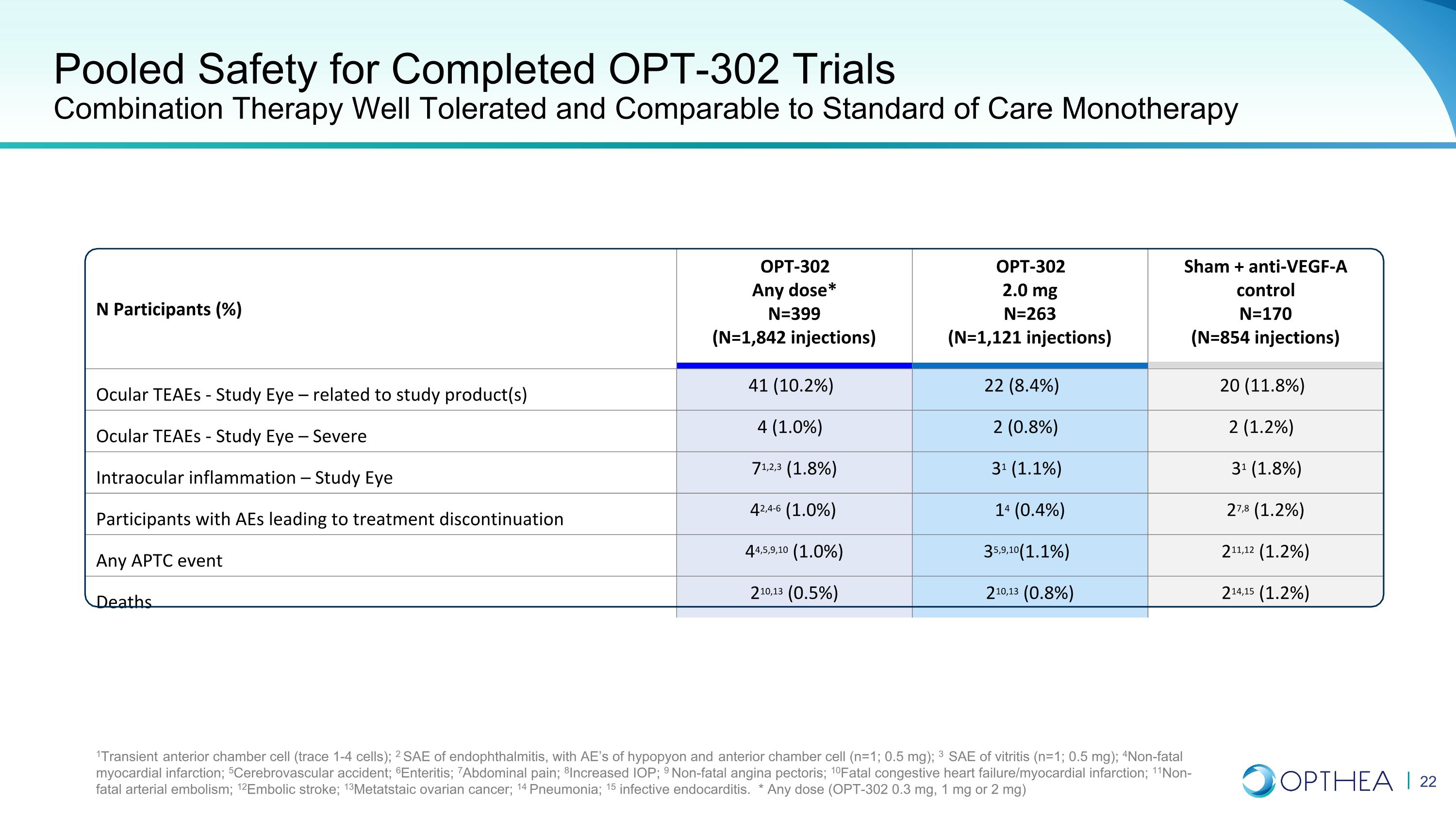
已完成的 OPT-302 試驗的合併安全性組合療法耐受性良好,可與標準單一療法相媲美 N 名參與者 (%) OPT-302 任何劑量* N=399(N = 1,842 次注射)OPT-302 2.0 mg N=263(N = 1,121 次注射)Sham + 抗 VEGF-A 對照 N=170(N = 854 次注射)Ocular TEAES-研究之眼 — 與研究產品相關 41 (10.1) 2%) 22 (8.4%) 20 (11.8%) 眼部 TEAES — 研究眼部 — 重度 4 (1.0%) 2 (0.8%) 2 (1.2%) 眼內炎症 — 研究眼睛 71,2,3 (1.8%) 31 (1.1%) 31 (1.8%) 31 (1.8%) AE 導致中止治療的參與者 42,4-6 (1.0%) 14 (0.4%) 27,8 (1.2%) 任何 APTC 事件 44,5,9,10 (1.0%) 35,9,10 (1.1%) 211,12 (1.2%) 死亡 210,13 (0.5%) 210,13 (0.8%) 214,15 (1.2%) 1瞬時性前房細胞(痕量 1-4 細胞);2 眼內炎的 SAE,伴有 AE 垂體和前房細胞(n=1;0.5 mg);3 SAE 玻璃體炎(n=1;0.5 mg);4非致命性心肌梗塞;5腦血管意外;6腸炎;7腹痛;8IOP 增加;9 非致命性心絞痛;10 致死性充血性心力衰竭/心肌梗塞;11非致命性動脈梗塞栓塞;12栓塞性中風;13變性卵巢癌症;14 肺炎;15 感染性心內膜炎。* 任何劑量(OPT-302 0.3 mg、1 mg 或 2 mg)
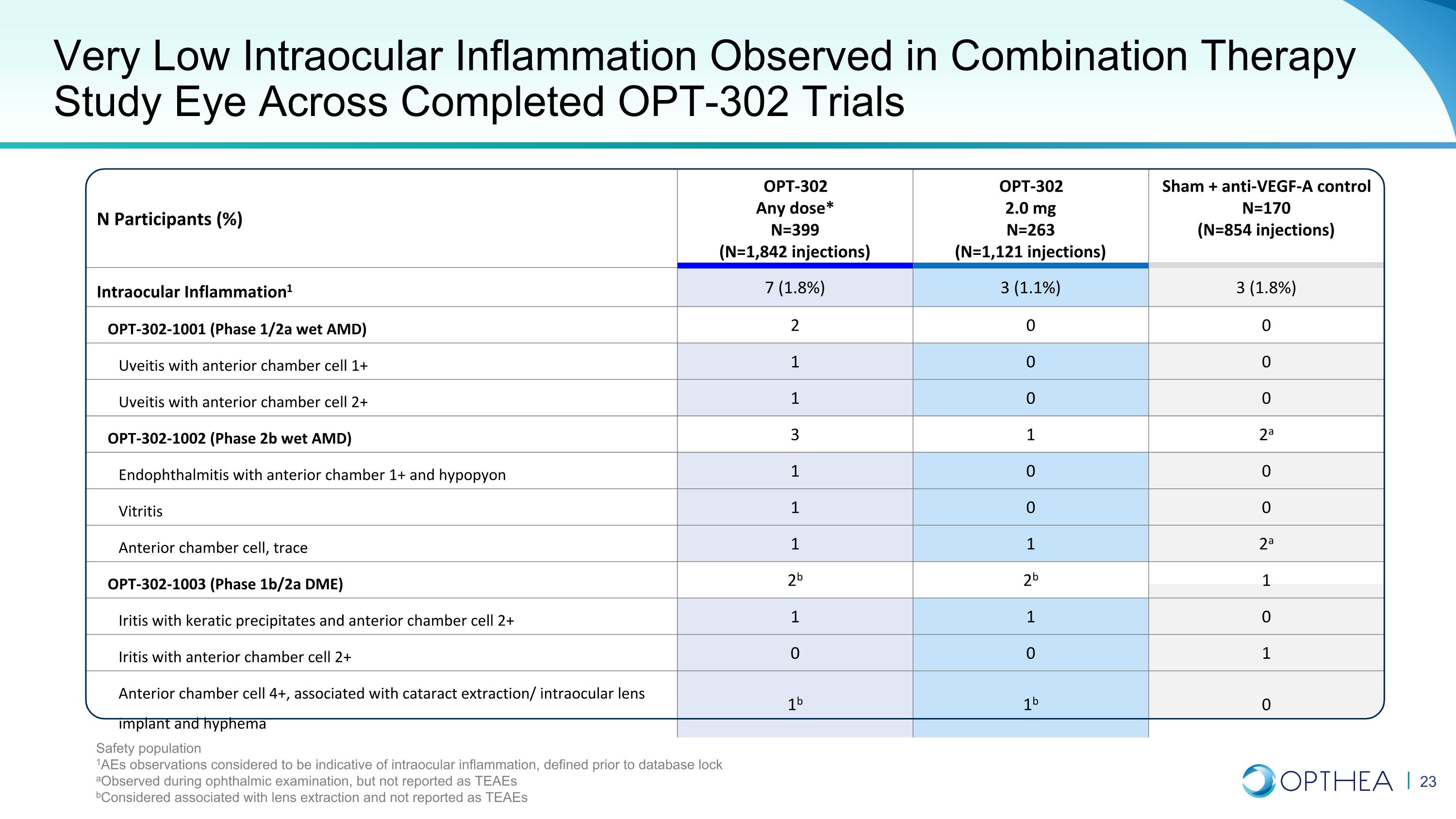
N 名參與者 (%) OPT-302 任意劑量* N=399(N=1,842 次注射)OPT-302 2.0 mg N=263(N=1,121 次注射)Sham + 抗 VEGF-A 對照 N=170(N=854 次注射)眼內炎症1 7(1.8%)3(1.8%)OPT-302-1001(1/2a 期濕式 AMD)2 0 0 伴前列的葡萄膜炎前房細胞 1+ 1 0 0 0 葡萄膜炎伴前房細胞 2+ 1 0 OPT-302-1002(2b 期濕性 AMD)3 1 2a 眼內炎伴前房 1+ 和垂體 1 0 0 0 玻璃體炎 1 0 0 0 前房細胞,痕跡 1 1 2a OPT-302-1003(期 1b/2a DME)2b 2b 1 虹膜炎伴有角膜沉澱物和前房細胞 2+ 1 1 0 虹膜炎伴前房細胞 2+ 0 0 1 前房細胞 4+,與白內障提取/人工晶狀體植入和前房積血有關 1b 1b 0 聯合療法研究中觀察到的極低眼內炎症在完成的 OPT-302 試驗中觀察到安全人羣 1aE 的觀察結果被認為表明眼內炎症,定義在眼科檢查期間觀察到的數據庫鎖定之前,但未報告為 TEAE b被認為與晶狀體摘除有關,未報告為 TEAE

3期臨牀項目以2b期結果為依據,針對成功進行了優化分層初步分析首先在高響應的隱祕人羣和最低限度經典人羣(無RAP)中進行,其次是患者總羣兩項強有力的關鍵性試驗,研究索齊尼伯西普與Eylea® 和Lucentis® 聯合治療的濕性AMD 3期患者,旨在支持廣泛標籤,可與任何VEGF-A抑制劑聯合使用,適用於所有濕性AMD患者(治療天真且事先接受過治療)

第 3 階段濕性 AMD 試驗 COAST 和 Shore 進展順利完成入組 CY2024 | Topline Data 2025 財年中期設計多中心、雙面罩、隨機 (1:1:1)、假對照治療天真濕性 AMD 患者監管質量 ~ 90% 權力,5% I 型錯誤率每項試驗樣本量 ~990 名患者每組:2 mg sozinibercept q4w 和 q8w,或假對照比較器 2 mg Eylea® q8w(COAST)和 0.5 mg Lucentis® q4w(Shore)

第 3 階段主要和次要終點第 52 周的主要療效終點支持 BLA 提交的主要療效終點主要次要終點(基線至第 52 周)第 52 周 BCVA 與基線的平均變化獲得≥15 個字母的參與者比例脈絡膜新生血管形成區域變化同時沒有視網膜下積液和視網膜內囊腫的參與者比例
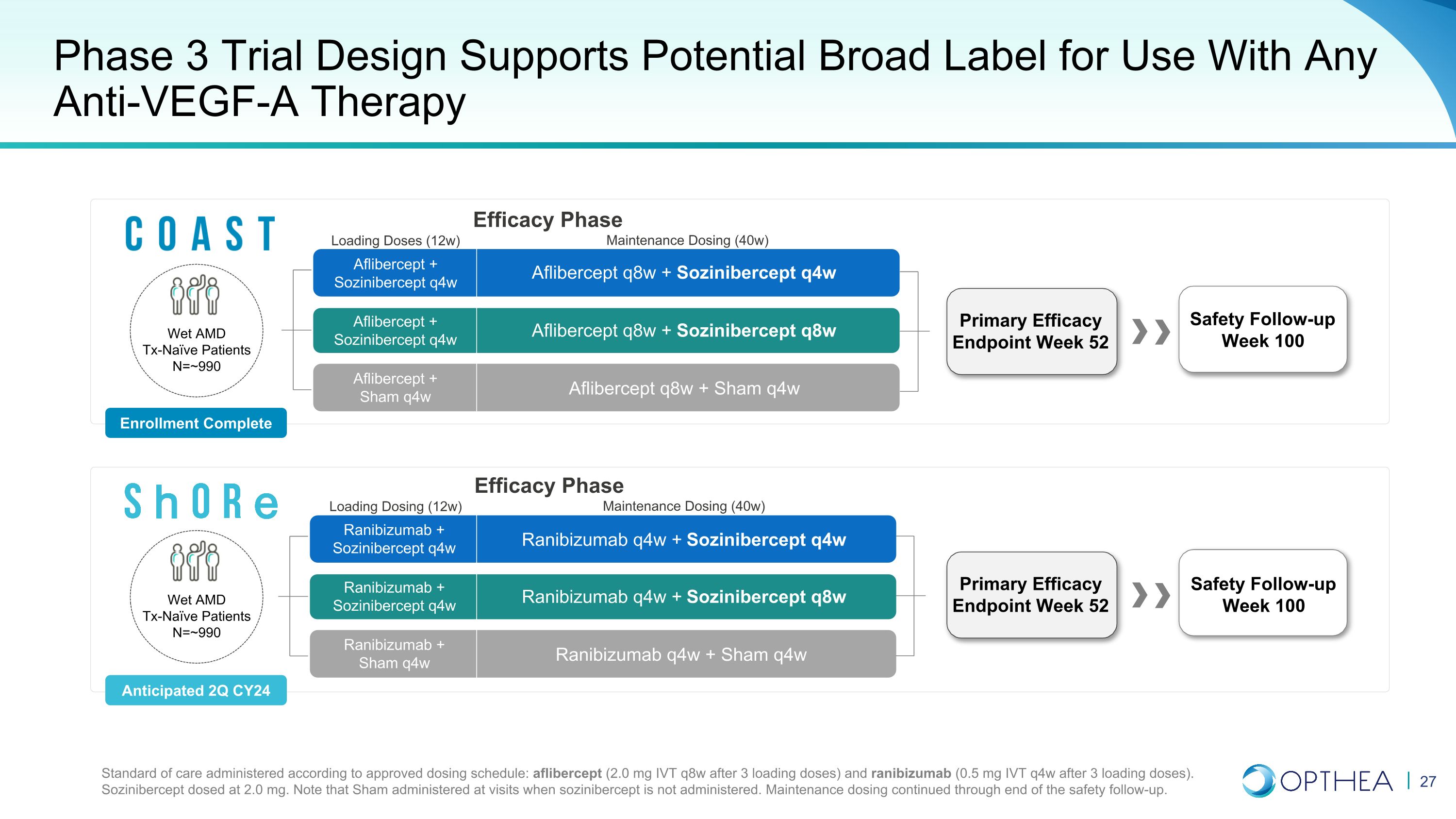
3期試驗設計支持任何抗血管內皮生長因子-A療法的潛在廣泛標籤雷尼珠單抗 q4w + 索茲尼伯西普 q4w q4w + Sham q4w 雷尼珠單抗 q4w + Sham q4w + Sozinibercept q4w q4w + Sozinibercept q4w q4w + Sozinibercept q4w q4w + Sozinibercept q4w aflibercept q8w + Sozinibercept q4w aflibercept q8w + Sham q4w Aflibercept q8w + Sozinibercept q8w 第 100 周安全隨訪根據批准的給藥時間表給予的護理標準:阿立貝西普(3 次加載劑量後為 2.0 mg IVT q8w)和雷尼珠單抗(負載 3 劑後為 0.5 mg IVT q4w)。索齊尼伯西普的劑量為2.0 mg。請注意,Sham 在不服用 sozinibercept 的就診時給藥。維護劑量一直持續到安全後續行動結束。主要療效終點第 52 周安全隨訪第 100 周 100 阿立貝西普 + 索茲尼伯西普 q4w Ablibercept q4w Ablibercept q4w Ablibercept + Sham q4w 雷尼單抗 + 索茲尼伯西普 q4w 雷尼伯西普 q4w Wet AMD Tx-Naieve 患者 =~990 人入組已完成預計 24 財年第二季度維持劑量 (40w) 加載劑量 (12w) 療效階段維持劑量 (40w) 加載劑量 (12w) 療效階段濕性 AMD Tx-Naieve 患者 N=~990
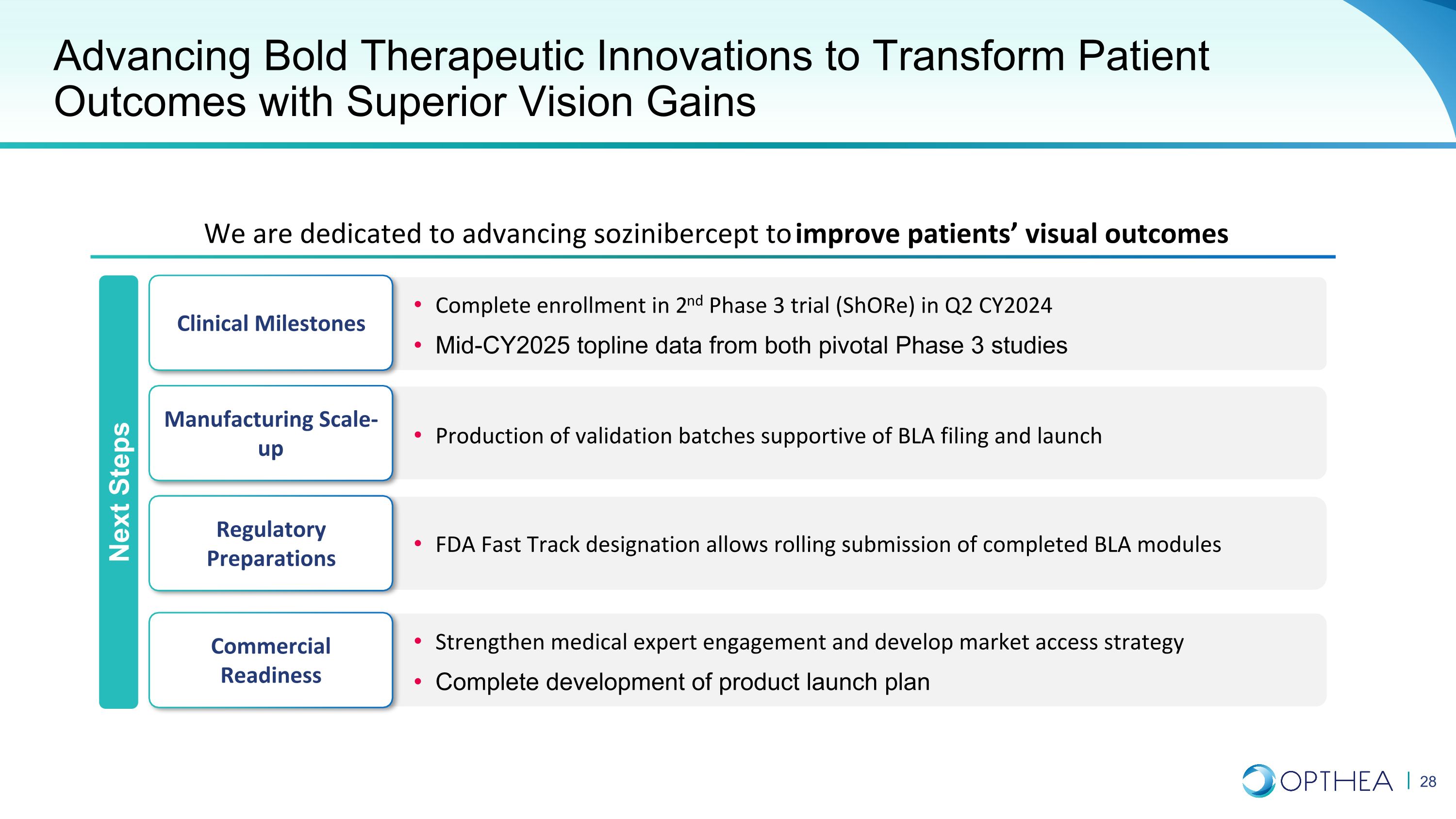
推進大膽的治療創新,以卓越的視力增益改變患者預後我們致力於推進索齊尼伯西普以改善患者的視覺效果臨牀里程碑製造業擴大監管制劑商業準備工作在 CY2024 第二季度完成第二階段三期試驗 (Shore) 的註冊來自兩項關鍵的三期研究的頭條數據 FDA Fast Track 指定允許滾動提交已完成的 BLA 模塊生產支持 BLA 申請和啟動的驗證批次加強醫學專家的參與並制定市場準入戰略完成產品發佈計劃的制定後續步驟

財務快照和企業活動財務概覽行情股票 OPT(澳大利亞證券/納斯達克)流通股票16.628億美元(普通股)/8,290萬美元(美國存託證券等價物)現金/現金等價物1 1.571億美元澳大利亞墨爾本辦公室新澤西州普林斯頓開發融資協議(DFA)根據DFA獲得的資金總額:1.7億美元為sozinibercept的開發提供非稀釋性資金 cept獲得批准,還款分為固定付款和可變付款,佔收入的7%,投資上限為4倍,如果臨牀試驗未達到主要終點,則不欠任何款項或者如果未獲得監管部門的批准 1 截至 2023 年 12 月 31 日

解決潛在約140億美元市場中大量濕性AMD患者羣體中未得到滿足的提高療效的醫療需求1 Sozinibercept不與任何經批准的以更好的視覺效果為目標的藥物差異化組合方法競爭推動商業價值首先也是唯一一種具有新穎和高度差異化MOA的抗VEGF-A療法表現出卓越視覺效果的療法。僅在近期或長期的資產中,有可能根據濕式AMD濃縮處方的療效來破壞治療模式美國激發潛力通過精益和有針對性的組織實現自我商業化的機會 2 3 4 MOA — 行動機制

謝謝!投資者關係和業務部聯繫人:info@opthea.com OPTHEA.COM | @OptheaLimited 關注我們:X 和 LinkedIn 納斯達克(OPT)| 澳大利亞證券交易所(OPT.AX)