美國
美國證券交易委員會
華盛頓特區,20549
表格
(標記一)
根據1934年《證券交易法》第13或15(D)條提交的年度報告 |
截至本財政年度止
或
根據1934年《證券交易法》第13或15(D)條提交的從 |
佣金文件編號
t
(註冊人的確切姓名載於其章程)
(述明或其他司法管轄權 公司或組織) |
(税務局僱主 識別號碼) |
(主要執行辦公室地址) |
(郵政編碼) |
註冊人的電話號碼,包括區號:(
根據該法第12(B)條登記的證券:
每個班級的標題 |
|
交易 符號 |
|
註冊的每個交易所的名稱 |
|
|
根據該法第12(G)條登記的證券:無
如果註冊人是證券法第405條規定的知名經驗豐富的發行人,請用複選標記表示。是☐
如果註冊人不需要根據《法案》第13條或第15條(d)款提交報告,則用複選標記進行標記。 yes ☐
用複選標記表示註冊人是否:(1)在過去12個月內(或註冊人需要提交此類報告的較短時間內)提交了1934年《證券交易法》第13或15(D)條要求提交的所有報告,以及(2)在過去90天內一直遵守此類提交要求。
用複選標記表示註冊人是否在過去12個月內(或在註冊人被要求提交此類文件的較短時間內)以電子方式提交了根據S-T規則第405條(本章232.405節)要求提交的每個交互數據文件。
用複選標記表示註冊人是大型加速申報公司、加速申報公司、非加速申報公司、較小的報告公司或新興成長型公司。請參閲《交易法》第12b-2條規則中“大型加速申報公司”、“加速申報公司”、“較小申報公司”和“新興成長型公司”的定義。
大型加速文件服務器 |
|
☐ |
|
加速文件管理器 |
|
☐ |
|
☒ |
|
規模較小的報告公司 |
|
||
|
|
|
|
新興成長型公司 |
|
如果是一家新興的成長型公司,用複選標記表示註冊人是否已選擇不使用延長的過渡期來遵守根據《交易所法》第13(A)節提供的任何新的或修訂的財務會計準則。
用複選標記表示註冊人是否提交了一份報告,證明其管理層根據《薩班斯-奧克斯利法案》(《美國聯邦法典》第15編,第7262(B)節)第404(B)條對其財務報告的內部控制的有效性進行了評估,該評估是由編制或發佈其審計報告的註冊會計師事務所進行的。
如果證券是根據該法第12(B)條登記的,應用複選標記表示登記人的財務報表是否反映了對以前發佈的財務報表的錯誤更正。
用複選標記表示這些錯誤更正中是否有任何重述需要對註冊人的任何執行人員在相關恢復期間根據第240.10D-1(B)條收到的基於激勵的補償進行恢復分析。☐
用複選標記表示註冊人是否是空殼公司(如《交易法》第12b-2條所定義)。是☐不是
根據納斯達克全球市場報告的註冊人普通股股票的收盤價1.26美元,註冊人的非關聯公司在2023年6月30日持有的有表決權股票的總市值約為 $
截至2024年3月21日,註冊人普通股的流通股數量為
以引用方式併入的文件
目錄表
|
|
頁面 |
第一部分 |
|
|
第1項。 |
業務 |
4 |
第1A項。 |
風險因素 |
42 |
項目1B。 |
未解決的員工意見 |
96 |
項目1C。 |
網絡安全 |
96 |
第二項。 |
屬性 |
97 |
第三項。 |
法律訴訟 |
97 |
第四項。 |
煤礦安全信息披露 |
97 |
|
|
|
第II部 |
|
|
第五項。 |
註冊人普通股市場、相關股東事項與發行人購買股權證券 |
98 |
第六項。 |
已保留 |
98 |
第7項。 |
管理層對財務狀況和經營成果的探討與分析 |
99 |
第7A項。 |
關於市場風險的定量和定性披露 |
114 |
第八項。 |
財務報表和補充數據 |
114 |
第九項。 |
會計與財務信息披露的變更與分歧 |
114 |
第9A項。 |
控制和程序 |
114 |
項目9B。 |
其他信息 |
115 |
項目9C。 |
關於妨礙檢查的外國司法管轄區的披露 |
115 |
|
|
|
第三部分 |
|
|
第10項。 |
董事、高管與公司治理 |
116 |
第11項。 |
高管薪酬 |
116 |
第12項。 |
某些實益擁有人的擔保所有權以及管理層和相關股東的事項 |
116 |
第13項。 |
某些關係和相關交易,以及董事的獨立性 |
116 |
第14項。 |
首席會計師費用及服務 |
116 |
|
|
|
第四部分 |
|
|
第15項。 |
展品和財務報表附表 |
117 |
第16項。 |
表格10-K摘要 |
119 |
|
|
|
簽名 |
|
|
i
前瞻性陳述
這份Form 10-K年度報告包含前瞻性陳述。我們打算將這類前瞻性陳述納入修訂後的1933年《證券法》第27A節和修訂後的1934年《證券交易法》第21E節中關於前瞻性陳述的安全港條款。除本Form 10-K年度報告中包含的歷史事實的陳述外,包括有關我們未來的經營結果和財務狀況、業務戰略、候選產品、臨牀開發計劃和預期、預期產品、產品批准、研發成本、成功的時間和可能性、以及未來經營和結果的管理計劃和目標的陳述,均屬前瞻性陳述。這些表述涉及已知和未知的風險、不確定性和其他重要因素,可能導致我們的實際結果、業績或成就與前瞻性表述中明示或暗示的任何未來結果、業績或成就大不相同。
在某些情況下,您可以通過“可能”、“將會”、“應該”、“預期”、“計劃”、“預期”、“可能”、“打算”、“目標”、“項目”、“設想”、“相信”、“估計”、“預測”、“潛在”或“繼續”或這些術語的否定或其他類似表述來識別前瞻性陳述。本年度報告中有關Form 10-K的前瞻性陳述僅為預測。這些前瞻性陳述主要基於我們目前對未來事件和財務趨勢的預期和預測,我們認為這些事件和財務趨勢可能會影響我們的業務、財務狀況和經營結果。這些前瞻性陳述僅在10-K表格年度報告發表之日發表,受一些重要因素的影響,這些因素可能導致實際結果與前瞻性陳述中的結果大不相同,包括本年度報告10-K表格中題為“風險因素”和“管理層對財務狀況和經營結果的討論和分析”部分所描述的風險、不確定因素和假設。這些前瞻性陳述存在許多風險,包括但不限於以下幾點:
1
由於前瞻性陳述本身就會受到風險和不確定性的影響,其中一些風險和不確定性是無法預測或量化的,有些是我們無法控制的,因此您不應依賴這些前瞻性陳述作為對未來事件的預測。我們的前瞻性陳述中反映的事件和情況可能不會發生,實際結果可能與前瞻性陳述中預測的結果大不相同。而且,新的風險因素和不確定因素可能會不時出現,管理層不可能預測到所有的風險因素和不確定因素。由於這些因素,我們不能向您保證本年度報告中關於Form 10-K的前瞻性陳述將被證明是準確的。除非適用法律要求,我們不打算公開更新或修改本文中包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、情況變化或其他原因。
您應完整閲讀這份Form 10-K年度報告和我們在Form 10-K年度報告中引用的文件,並瞭解我們未來的實際結果可能與我們預期的大不相同。我們通過這些警告性聲明對我們所有的前瞻性聲明進行限定。
所有提及的“Candel”、“我們”或“公司”均指Candel治療公司及其子公司。
與我們的業務相關的重大風險和其他風險摘要
我們的業務面臨許多風險和不確定因素,包括本10-K表格年度報告第I部分第1A項--風險因素中更全面描述的風險和不確定因素。在投資我們的普通股時,您應該仔細考慮這些風險和不確定性。影響我們業務的主要風險和不確定因素包括:
2
3
第一部分
項目1.業務
概述
我們是一家臨牀階段的生物製藥公司,專注於開發現成的病毒免疫療法,引發個性化的系統性抗腫瘤免疫反應,幫助患者抗擊癌症。我們的工程病毒旨在通過病毒直接介導的癌細胞細胞毒作用,誘導由於免疫原性細胞死亡而產生的全身抗腫瘤反應,從而釋放腫瘤新抗原,並在注射部位創造促炎微環境。這是為了導致針對注射的腫瘤和未注射的遠處轉移的原位疫苗接種。我們的病毒免疫治療方法利用腫瘤內注射基因工程病毒來誘導腫瘤細胞死亡,並引發全身抗腫瘤反應。局部給藥使我們能夠實現這些效果,同時將全身毒性降至最低。據信,這些病毒免疫療法誘導的免疫細胞針對患者特定的腫瘤抗原,潛在地改善免疫“熱”腫瘤的反應,同時滲透到腫瘤微環境,將免疫反應有限的非炎症性“冷”腫瘤轉變為“熱”腫瘤。雖然我們的候選產品直接注射到腫瘤中,但我們在臨牀前研究和臨牀試驗中觀察到了系統免疫反應,這可能表明我們的候選產品有可能誘導針對遠端未注射腫瘤的系統免疫反應,也稱為“非鏡檢”效應。
我們相信病毒免疫療法是當今最有前途的癌症治療方法之一。我們的目標是通過病毒免疫療法進一步改善患者的預後,為每種腫瘤類型選擇最佳載體、特定的轉基因和臨牀適應症,同時優化產品候選屬性,例如高效價配方、誘導系統性抗腫瘤免疫的腫瘤內給藥以及可能降低患者和臨牀醫生後勤障礙的儲存條件。
我們已經建立了兩個臨牀現成的病毒免疫治療平臺,分別基於新的、遺傳化腺病毒和單純皰疹病毒(HSV)的構建。
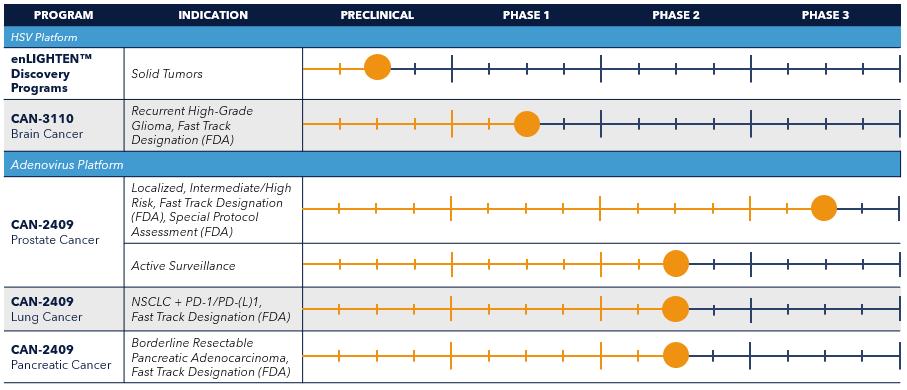
我們最先進的候選產品CAN-2409是現成的腺病毒候選產品,與前藥萬乃洛韋聯合使用,已在一系列實體腫瘤適應症中產生了良好的臨牀活性。CAN-2409目前正在進行以下臨牀試驗:
4
5
我們基於HSV的主要候選產品CAN-3110目前正處於研究人員贊助的第一階段臨牀試驗中,這是我們治療復發高級別膠質瘤(HGG)的初步目標適應症。2024年2月,我們宣佈FDA批准了CAN-3110的快速通道指定,用於治療復發的HGG患者,以提高總體生存率。這些患者SOC治療失敗,預後較差(預計總存活率
6
數據表明,CAN-3110耐受性良好,沒有觀察到劑量限制性毒性;單次給藥達到11.6個月的MOS;有證據表明持續存在單純皰疹病毒1型(HSV-1)抗原和與作用機制一致的HSV-1複製,以及強有力的證據表明免疫激活。2023年5月,我們在美國基因與細胞治療學會(ASGCT)年會上的口頭報告中展示了這項正在進行的臨牀試驗的臨牀和生物標記物數據,其中我們報告了截至2023年4月20日數據截止時,A組(n=41)持續11.8個月的MOS和B組(n=9)持續12.0個月的MOS。安全性和耐受性數據顯示,A組和B組均未出現劑量限制毒性。
2023年10月,我們聯合發表了一篇文章自然界據報道,使用CAN-3110治療的復發HGG患者的生存期延長與免疫激活有關。值得注意的是,新數據報告了66%的抗HSV1抗體陽性患者的存活率增加(平均為14.2個月)。免疫狀態與存活率呈正相關,既有先前存在HSV1抗體的患者(治療前),也有33%的患者在單次注射CAN-3110後出現抗HSV1抗體,儘管基線為陰性。在多灶性疾病患者的注射和非注射皮損中都觀察到了臨牀反應。在A組和B組均觀察到顯著的腫瘤反應,B組患者在接受CAN-3110治療大約一年後腫瘤體積持續縮小。這名患者的臨牀反應,在數據截止時的隨訪中,在沒有額外治療的情況下繼續。對治療後樣本的分析表明,注射和未注射的腫瘤組織中均有HSV抗原持續表達和複製的證據,與CD8+T細胞滲透有關。免疫激活的程度,通過基因圖譜和治療後樣本中免疫細胞的量化來衡量,與抗HSV1抗體的存在和存活率有關。存活率也與循環T細胞中T細胞庫的多樣性有關,這表明接受CAN-3110治療的患者能夠對病毒產生不同的免疫反應,在溶瘤過程中釋放的腫瘤抗原提高了存活率。
我們正在進行一項名為ARM C的臨牀試驗的擴展,在該試驗中,復發的HGG患者將接受CAN-3110的重複劑量方案(在四個月內最多注射六次)。來自ARM C的臨牀數據將有助於評估多次注射是否會增加MoS。這項臨牀試驗延期得到了突破癌症基金會的支持。
我們還在使用我們專有的INTUTEN?Discovery平臺設計其他新型的病毒免疫療法候選藥物,這是一個系統的、基於HSV的迭代發現平臺,利用人類生物學和先進的分析方法來創建實體腫瘤的新病毒免疫療法候選藥物。2022年10月,我們與賓夕法尼亞大學(UPenn)細胞免疫療法中心合作,研究基於我們的INSTUTEN Discovery平臺的新型病毒免疫療法候選者的影響,以加強賓夕法尼亞大學研究性CAR-T細胞療法在難以治療的實體腫瘤中的活性。
2023年11月,在SITC 2023年會期間,我們展示了兩張海報,描述了該平臺的關鍵要素以及來自啟迪發現平臺的第一個實驗代理的開發。這種名為Alpha-201 Macro1的新藥是一種研究中的病毒免疫療法,旨在幹擾CD47/Sirpα途徑並激活天然免疫監視。結果顯示,在肺癌和乳腺癌的臨牀前模型中,局部給藥後具有單一治療活性。在SITC上展示的其他臨牀前數據證實,INTUTEN®Advanced Analytics套件能夠預測武裝病毒載體的最佳基因有效載荷組合,從而能夠設計潛在的組合療法來克服腫瘤耐藥性,特別是在對ICI治療具有耐藥性的癌症中。
2024年3月,我們宣佈在美國癌症研究協會(AACR)2024年年會上接受一篇摘要,該摘要與我們的INITTEN®Discovery平臺的第二位候選人有關,這是一種用於誘導第三淋巴樣結構的一流多模式免疫療法,作為實體腫瘤的新治療策略。
我們目前在包括美國、歐洲和亞洲在內的主要市場擁有我們項目的開發權和商業化權利,使我們能夠在準備商業化努力時控制這些地區的開發並尋求批准。
我們於2003年6月在特拉華州成立,名稱為Advantagene,Inc.(Advantagene)。2019年12月,Advantagene授權了Periphagen的幾乎所有資產,Periphagen是一家專注於將HSV作為基因治療載體進行工程的公司,並於2020年9月從麻省總醫院(MGB)獲得了CAN-3110的授權。2020年12月,我們正式從Advantagene更名為Candel Treateutics,Inc.我們於2021年7月完成了首次公開募股。
我們的戰略
我們的目標是開發一流和一流的病毒免疫療法,以改變癌症患者的生活。我們計劃開發和商業化我們的兩個最先進的候選產品,CAN-2409和CAN-3110,用於
7
治療廣泛的實體腫瘤適應症,同時繼續通過我們的發現平臺建立我們的管道. 我們的策略的關鍵元素包括以下幾點:
我們的方法
傳統的癌症治療方法(化療、放療和手術)往往不能100%根除腫瘤細胞,這往往會導致腫瘤進展或復發。因此,對許多癌症患者來説,深刻而持久的反應仍然難以捉摸。傳統上,手術和/或放射治療用於局部腫瘤清除,而化療藥物的目標是全身清除腫瘤細胞。然而,這些治療方式往往受到毒性的限制。
免疫治療是一種相對較新的治療方式,它擴展了抗癌治療的範式。FDA批准的免疫療法包括細胞因子、細胞療法和抗體,包括ICIS。人們一直關注利用免疫系統的效應器T細胞臂進行腫瘤特異性免疫。過繼T細胞治療
8
已經顯示出積極的結果,但在實體腫瘤中活性有限,不能廣泛使用。疫苗方法的複雜性從多肽抗原到自體或同種異體腫瘤細胞產品。單抗原法的優點是易於製造和生產,但它們的根本缺點是可能與患者特定的腫瘤或免疫系統無關,或容易被抗性克隆繞過。細胞疫苗不容易擴展,而且異體疫苗可能不會攜帶患者腫瘤表達的相關抗原。抗PD-1和抗PD-L1抗體等ICIS改變了不同癌症適應症的治療模式。然而,只有大約15%到40%的患者對這種治療有反應。
我們專注於病毒免疫治療方法的開發,這些方法基於廣泛的研究歷史。最初,這些藥物的作用機制被認為只基於病毒誘導癌細胞溶解和溶解腫瘤的能力。後來,病毒免疫治療被證明可以誘導免疫原性細胞死亡。病毒衣殼蛋白的促炎作用可能會增強這種作用。隨着ICIS和免疫療法作為核心治療手段的戲劇性出現,病毒介導的免疫刺激方面的重要性變得更加廣泛。目前瞭解的病毒免疫療法的普遍作用機制是獨特的,它結合了抗腫瘤細胞毒成分和免疫刺激成分。總而言之,這些方式導致對注射的腫瘤產生“原位接種”效應,然後對未注射的遠處轉移瘤產生影響。
將這種治療方法與ICI治療或放射治療配對是基於強大的機制基礎,並在癌症的實驗模型中顯示出希望。據觀察,對ICI反應最差的腫瘤通常以低水平的淋巴細胞滲透和低水平的PD-L1表達或不表達為特徵;它們被稱為“冷”瘤。我們的重點領域之一是將免疫抑制的“冷”腫瘤轉化為免疫活性的“熱”腫瘤,從而提高它們對ICI或其他治療方法(如放射治療)的反應性。
病毒免疫治療的作用機制:
理想的臨牀屬性。病毒免疫療法具有對癌症治療很重要的屬性。這些藥物是現成的,它們已被證明可以刺激大多數患者的局部和系統免疫反應,導致個性化的抗腫瘤免疫反應。相比之下,個性化的細胞免疫療法需要針對每個患者特定的製造工藝。2015年,FDA批准了第一種病毒免疫療法,為這類藥物中的其他藥物可能具有類似的潛力提供了支持。此外,各種免疫療法的幾項臨牀試驗中顯示的安全性數據支持將病毒免疫療法與其他藥物結合的能力,因為重疊的副作用可能較少。
我們的免疫治療平臺。我們的兩個臨牀平臺,一個基於腺病毒,另一個基於HSV,提供不同和互補的屬性集,使我們能夠利用最適合特定臨牀應用的候選產品。
9
我們的病毒免疫治療平臺的關鍵特性包括:
我們的AdenoVirus平臺的主要特性包括:
我們的CAN-3110平臺的主要屬性包括:
INTUTEN?Discovery平臺的主要屬性包括:
10
我們的管道
我們擁有先進的後期和早期臨牀試驗流水線,擁有兩個最先進的候選產品CAN-2409和CAN-3110。

CAN-2409,前身為基因介導的細胞毒性免疫療法(GMCI),是我們最先進的候選產品。這是一種複製缺陷的腺病毒,已經過基因改造,可以表達編碼HSV-胸苷激酶的基因。這種酶在腫瘤部位激活前藥萬乃洛韋,這是一種廣泛可用的、通常耐受性良好的抗病毒藥物,產生強大的患者特異性抗腫瘤免疫反應。我們認為,行動機制有三個關鍵方面。首先,直接的細胞殺傷活性是基於萬乃洛韋轉化為一種有毒的核苷酸類似物,破壞DNA的合成和修復。這種現象優先發生在活躍分裂的癌細胞中,從而提供腫瘤特異性。這種DNA修復抑制也被假設為CAN-2409與放射治療聯合使用時令人鼓舞的臨牀前和臨牀活性背後的機制解釋,這種治療方法已知會導致DNA斷裂,需要修復才能繼續細胞存活。其次,腺病毒衣殼蛋白本身還通過建立促炎腫瘤微環境直接觸發免疫炎症反應,導致促炎細胞因子、趨化因子和黏附分子的表達,這些細胞因子、趨化因子和黏附分子有助於針對腫瘤抗原的最佳免疫條件,而腫瘤抗原是由形成的有毒核苷酸類似物直接釋放在腫瘤微環境中的。總之,這導致了抗腫瘤效應細胞的募集、激活和增殖,特別是CD8+細胞毒性T細胞。因此,腫瘤細胞的局部死亡釋放了許多可以被患者自己的免疫系統識別的抗原,從而訓練免疫系統識別、靶向和摧毀攜帶相同抗原的癌細胞,這些癌細胞已經擴散到身體的其他部位。
到目前為止,CAN-2409已經用於1000多名癌症患者,其中許多人正在進行安慰劑對照的隨機臨牀試驗。總體而言,我們已經在一系列實體腫瘤適應症中使用CAN-2409進行了10多項臨牀試驗。我們已經看到CAN-2409在單一治療和與放射治療、ICI治療、雄激素剝奪治療(ADT)、化療和手術相結合的環境中令人鼓舞的臨牀活性和良好的耐受性。根據我們迄今為止產生的全部臨牀數據,我們目前正在尋求肺癌、胰腺癌和前列腺癌的適應症,我們相信這些適應症都有巨大的潛力來滿足未得到滿足的需求。
11
我們正在與FDA達成協議,通過SPA流程與包括放射治療和可選ADT的SoC相結合,在新診斷的中高風險患者的侷限性前列腺癌中進行CAN-2409的3期臨牀試驗。我們的SPA讓FDA同意,如果我們在試驗中實現主要終點,我們試驗設計的關鍵終點和特定關鍵元素足以支持未來的營銷應用。該臨牀試驗是隨機、三盲、安慰劑對照的。它的目標是招募大約700名患者,並於2021年9月完全納入711名患者,預計2024年第四季度將公佈TOPLINE數據。我們還獲得了FDA的快速通道指定,用於開發CAN-2409與放射治療相結合的局部原發性前列腺癌,以提高局部控制率,減少復發和提高無瘤存活率。我們預計,如果試驗成功,如果我們獲得FDA的批准,CAN-2409可能會成為30多年來FDA批准的第一種新的藥物療法,作為美國每年超過10萬名新診斷為侷限性前列腺癌的患者的一線療法。
我們還完成了CAN-2409的第二階段臨牀試驗,作為積極監測下的新診斷前列腺癌患者的單一療法。這項試驗招募了187名患有低危、中危和某些高危侷限性前列腺癌的患者。我們預計將在2024年第四季度公佈背線數據。我們相信,如果這項試驗成功,可以將CAN-2409定位為低風險和中等風險前列腺癌患者的一線單一療法,從而有意義地擴大可尋址的患者羣體。
在NSCLC中,我們在一項聚焦於1期生物標記物的機會窗臨牀試驗中觀察到了CAN-2409的單一治療活性。2020年,我們啟動了一項第二階段臨牀試驗,評估CAN-2409與PD-(L)1檢查點抑制劑聯合用於對PD-(L)1ICI反應不足的患者。這項開放標籤臨牀試驗最初經過修改,目標是在兩個不同的隊列中招募大約80名III/IV期非小細胞肺癌患者。根據註冊時對ICI的響應來定義隊列。隊列1針對登記時患有穩定疾病的患者。隊列2納入ICI治療至少18周後進展性疾病的患者。患者將繼續使用他們最初的檢查點抑制劑進行治療,並將CAN-2409添加到他們的方案中。這項試驗的主要療效終點是根據RECIST標準衡量的腫瘤反應,包括總應答率(ORR)和/或疾病控制率(DCR)。我們在2022年6月的ASCO年會和2022年12月的研發日期間報告了這項試驗的初步數據。2023年9月宣佈的更新進一步支持了這些數據,該更新基於2023年8月1日的數據截止日期。在2023年9月的這份公告中,我們提供了最新的數據,顯示了局部和全身抗腫瘤活性的證據;進入試驗的疾病進展患者的DCR為77%(20/26);持續和持續的臨牀反應超過1年;腫瘤進展軌跡的有利變化;大多數患者RECIST靶點的腫瘤大小減小;14/21患者的未注射腫瘤大小減少(67%);1和2隊列的總有效率為13%(4/30);持久的疾病穩定轉化為令人鼓舞的無進展生存的初步證據;持續誘導局部和全身的細胞毒性T細胞反應;CD8+T細胞在腫瘤微環境中的滲透增加;全身性效應T細胞的擴張和外周血中可溶性顆粒酶B水平的增加;和良好的安全性/耐受性數據,大多數與治療相關的不良事件為1/2級。2023年12月,隨着我們完成隊列2的目標登記,這項研究的招募暫停。我們獲得了FDA的快速通道指定,用於CAN-2409聯合萬乃洛韋與培布羅利單抗聯合治療,以改善對一線PD-(L)1抑制劑治療耐藥的非小細胞肺癌III/IV期患者的生存或延緩進展,這些患者在2023年4月沒有激活分子驅動程序突變或已在定向分子治療中取得進展。我們預計將在2024年第二季度公佈TOPLINE總體生存數據。
在先前的1b期試驗中,與歷史試驗結果相比,在SOC的基礎上加用CAN-2409治療的胰腺癌患者顯示出比僅用現有SOC治療的患者的預期存活時間更長的存活時間。此外,在有治療前後腫瘤活檢的患者組中,觀察到CD8+腫瘤浸潤性淋巴細胞的數量在統計學上顯著增加。我們已經啟動了一項隨機的第二階段臨牀試驗,評估CAN-2409在交界性可切除胰腺癌中的作用。2023年3月,結合我們的成本管理和動態投資組合管理計劃,我們決定暫停這項隨機第二階段臨牀試驗的新登記,但需要額外的資金。儘管患者登記暫停,但我們在2023年第四季度提供了初步臨牀數據。 最初的數據顯示,在接受CAN-2409治療的患者中,患者的存活時間延長並持續,但在對照組中沒有。我們觀察到兩組患者在治療後24個月和36個月時的生存曲線分離,估計存活率為71%,而對照組的存活率為16.7%。2023年12月,我們獲得FDA指定的用於治療PDAC患者的CAN-2409加前藥(萬乃洛韋)的快速通道,以提高總體生存率。我們預計將在2024年第二季度提交最新的生存數據。
我們的第二個病毒免疫治療平臺是基於一種新型的下一代轉基因HSV,它可以誘導腫瘤特異性溶瘤。基於HSV的平臺使我們能夠生成複製能力強和複製缺陷的候選病毒產品,以及在載體中克隆最多五個轉基因的能力,這將使我們能夠針對不同的腫瘤環境優化我們的病毒圖譜。CAN-3110是我們第一個基於HSV的候選產品,其設計旨在增強特異性和腫瘤細胞殺傷力,同時將對健康組織的毒性降至最低。CAN-3110是
12
以前稱為rQNestin34.5v.2。研究人員贊助的1b期臨牀試驗正在進行中,使用CAN-3110作為我們複發性HGG的初始目標適應症,我們在2021年11月報告了更多的生物標記物結果。在2022年12月的研究和開發日期間,我們提供了最新的數據,表明該治療耐受性良好,沒有觀察到劑量限制毒性。這一點在2023年5月ASGCT年會上的一次口頭陳述中得到了進一步的支持,在會上,我們基於2023年4月20日的數據截止日期,報告了單劑服用A組11.8個月和B組12.0個月的MOS。此外,數據顯示免疫激活和持續的HSV-1抗原和HSV-1複製的證據與作用機制一致。單次注射CAN-3110治療的首批41名患者的臨牀和生物標記物數據發表在自然界2023年10月FDA已授予CAN—3110快速通道指定,用於治療複發性HGG患者,以提高2024年2月的總體生存率。我們目前正在評估多次劑量CAN—3110在複發性HGG中的作用,該研究得到了突破癌症基金會的支持。
基於CAN—3110的分子靶向,我們認為未來可以在更廣泛的適應症範圍中進行評估,如其他神經系統腫瘤、黑色素瘤、肉瘤、胃腸道間質瘤、甲狀腺腫瘤和乳腺癌。
此外,我們正在基於我們的INTUTEN?Discovery平臺開展新穎的發現項目。2023年11月,在SITC 2023年會期間,我們展示了兩張海報,描述了該平臺的關鍵要素以及來自INITTEN?Discovery平臺的第一個實驗代理的開發。第一種藥物是Alpha-201 Macro1,是一種研究中的病毒免疫療法,旨在幹擾CD47/Sirpα途徑並激活天然免疫監視。結果顯示,在肺癌的臨牀前模型中,局部給藥後具有單一治療活性。在SITC上展示的其他臨牀前數據證實,INTUTEN®Advanced Analytics套件能夠預測武裝病毒載體的最佳基因有效載荷組合,從而能夠設計潛在的組合療法來克服腫瘤耐藥性,特別是在對ICI治療具有耐藥性的癌症中。
2024年3月,我們宣佈在AACR 2024年年會上接受一篇摘要,該摘要與我們的INITTEN®Discovery平臺的第二位候選人有關,該平臺是一種一流的多模式免疫療法,用於誘導第三級淋巴結構,作為實體腫瘤的新治療策略。
市場機遇
我們擁有最先進的臨牀試驗的四個適應症是侷限性前列腺癌、非小細胞肺癌、胰腺癌和復發的HGG。這些類型的癌症提供了大量的市場機會,也使未來擴展到其他實體腫瘤的指徵成為可能。
侷限性前列腺癌
前列腺癌是美國男性癌症死亡的第二大原因,代表着很高的醫療負擔和未得到滿足的需求。前列腺癌治療市場預計到2026年將增長到161億美元以上。在美國,每年大約有20萬名男性被診斷出患有前列腺癌,每年有超過3萬人死亡。儘管大多數死亡發生在晚期轉移性疾病的患者中,但在美國,大多數前列腺癌患者每年約有15萬人在疾病的早期被初步診斷,其中約10.5萬人被認為具有中高進展風險,約4.5萬人被認為是低風險。
對於中高危患者,SOC是根治性前列腺切除術和放射治療,通常結合雄激素剝奪治療或化學去勢。這些治療具有很高的潛在改變生命的副作用,包括大小便失禁和勃起功能障礙。因此,對一種新的治療方法的需求尚未得到滿足,這種治療方法能夠預防或防止疾病發展到後期,而不會產生與目前的SOC相關的負擔沉重的副作用。權衡療效和與治療相關的副作用之間的平衡,約10%的中等風險患者和約40%的低風險患者在諮詢醫生後決定採用一種被稱為主動監測的密切監測方法,包括定期成像、生物標記物評估和活組織檢查。在這種早期、本地化的環境中,SoC留下了大量的需求未得到解決。
作為PSA篩查計劃的結果,大多數患者在疾病的早期階段被診斷為低級別、低體積、無症狀的前列腺癌。目前的篩查方法不足以確定哪些患者最有可能進展。由於目前可用的治療的副作用和併發症,人們非常希望推遲或防止需要根治性治療。因此,許多符合國家綜合癌症網絡(NCCN)低風險前列腺癌指南的前列腺癌患者選擇不接受治療,並接受名為主動監測(AS)的高強度監測計劃,作為他們首選的初始療程。然而,在確診的10年內,21%到38%的男性將發展為進展性癌症,需要侵入性治療。據報道,21%和41%的AS患者在兩年和五年內根據病情的進展而轉為積極治療,而接受AS治療的男性中約有17%選擇在確診後10年內在沒有任何證據的情況下轉向積極治療。
13
進展,強調了患者在被診斷為未經治療的前列腺癌時所經歷的焦慮水平,以及在這一早期治療路線中尚未得到滿足的重大需求。
據我們所知,FDA批准的唯一針對新診斷的侷限性前列腺癌的藥物幹預措施是化學去勢療法,也稱為ADT。局部疾病的SOC主要是手術、放射治療和/或ADT。由於ADT具有潛在的嚴重副作用,包括****、潮熱、情緒變化、抑鬱、對生活質量的影響等,這些激素治療僅適用於那些局部或轉移性前列腺癌風險最高的患者。同樣,前列腺摘除手術通常會導致排尿功能障礙和****,這些功能障礙可以持續數年,有時甚至是永久性的。在基線功能正常的男性中,大約三分之一的人會在前列腺切除術後報告尿路症狀和緊迫感增加,大多數男性在接受手術或放射治療後將經歷勃起功能障礙。
我們相信,CAN-2409可以為新診斷的本地化前列腺癌患者羣體的治療提供一個重要的商業機會,目標是減少疾病的進展或復發,而不會產生明顯的毒性,並提供一種可以在門診設施使用的產品。
非小細胞肺癌
近年來,ICI,特別是PD-1導向的藥物,已經改變了NSCLC的治療模式,併成為這一適應症的骨幹療法。超過六種ICI產品已被批准用於各種癌症適應症,還有許多其他相關候選藥物正在進行臨牀前和臨牀開發。2019年ICIS的全球銷售額約為230億美元,其中NSCLC佔總銷售額的50%至55%。NSCLC的商機是巨大的。據估計,2020年美國接受藥物治療的患者人數為75,160人;一線、二線和三線治療的患者分別為47,920人和21,990人。ICI在非小細胞肺癌中的應用已經成為SOC,在美國,大約49%的一線患者單獨使用ICI或與其他藥物聯合治療。儘管如此,60%的患者在接受ICI治療一年後反應不充分,80%的患者在三年後反應不佳。
我們相信,如果我們能夠證明按方案治療後總存活期超過12-14個月,CAN-2409將為治療對ICI反應不足的非小細胞肺癌患者提供一個重要的商業機會。
胰腺癌
美國癌症協會估計,2023年,美國約有64,050人(33,130名男性和30,920名女性)將被診斷出患有胰腺癌;今年將有約50,550人(26,620名男性和23,930名女性)死於胰腺癌。在腫瘤可以切除的情況下,治療方法是手術,然後是輔助放化療;在交界性可切除甚至可切除的疾病中,越來越多地使用新輔助放化療,以更好地降低復發風險。對於切除的患者,雖然手術和輔助方法(如FOLFORINOX)改善了MOS,但5年生存率仍然不高(20-30%),大多數腫瘤將復發(中位無復發生存期~1.5年)。雖然整個胰腺癌的臨牀研究和開發活動水平很高(超過150種研究產品處於第二階段或更晚的開發階段),但大多數產品都是針對轉移性疾病的。醫生們已經發現,在整個胰腺癌環境中,對更有效的治療選擇的需求仍然沒有得到滿足,包括需要進一步的方法來提高交界性/局部晚期患者的可切除性,以及提高切除患者的治癒率。據估計,有18,510名患者患有可切除的疾病,其中相當大一部分患者接受手術和輔助治療;在US/EU5中,有12,340名患者患有臨界可切除疾病,30,850名患者患有局部晚期腫瘤(大多數患者正在接受新的輔助/誘導治療)。
我們相信,如果我們能夠證實接受CAN-2409和SoC聯合治療的患者在開始治療兩年後的總存活率比單獨接受SoC治療的患者有所改善,那麼CAN-2409可以為治療臨界可切除的胰腺癌患者提供一個重要的商業機會。
高級別腦膠質瘤
膠質母細胞瘤是HGG最常見的形式,是一種相對罕見的癌症,在美國,一線藥物治療的流行人羣約有16,113名患者。前期的治療是手術切除,如果可能的話,再加上替莫唑胺和/或放射治療;然而,幾乎所有患者最終都會發展為復發疾病。
復發的膠質母細胞瘤的預後是可怕的;使用二線化療的MOS與6-9個月的MOS有關。對於復發的HGG患者,幾乎沒有藥物治療選擇,FDA上一次重大批准是在十多年前。阿瓦斯丁於2009年獲得批准,專門用於復發的膠質母細胞瘤患者,儘管註冊研究中沒有生存益處,但還是獲得了批准。急需新的藥物來治療復發的HGG患者。
14
我們認為,基於發表在《HGG》雜誌上的結果,CAN-3110為治療複發性HGG提供了一個重要的機會自然界2023年10月,僅注射一次CAN-3110,預期MOS幾乎翻了一番。
我們的候選產品
初步產品候選-CAN-2409
我們相信,基於腺病毒的CAN-2409具有不同於其他病毒免疫療法的有利特性。即,CAN-2409:
CAN-2409(國際非專利名稱:AGLATIMAGEN BASADEOVEC)是一種基於腺病毒的複製缺陷工程基因構建物,編碼源於單純皰疹病毒的胸苷激酶基因。它被直接注射到腫瘤或靶組織中。局部注射的目的是將全身靜脈注射相關的全身毒性降至最低,消除複雜的免疫逃避或腫瘤特異性靶向機制,並重新編程針對注射的腫瘤的免疫反應,同時激活針對注射的腫瘤和未注射的轉移的所需的全身抗腫瘤免疫反應。用腺病毒載體將HSV-胸苷激酶基因轉移到注射部位的腫瘤細胞中。HSV-胸苷激酶將FDA批准的非專利抗皰疹藥物,如我們用作前體藥物的更昔洛韋、阿昔洛韋和萬乃洛韋轉化為有毒的核苷酸類似物。這些藥物隨處可得,價格低廉,通常耐受性良好。轉導HSV-胸苷激酶基因的細胞以及正在複製或表現出DNA損傷的鄰近細胞在暴露於這些全身給藥的前藥物後會發生免疫原性細胞死亡,這些藥物在腫瘤微環境中轉化為有毒的代謝物。
前藥衍生的細胞毒核苷酸類似物旨在抑制DNA複製和修復,導致增殖的腫瘤細胞死亡,特別是正在進行放射或化療損傷修復的細胞。這種形式的細胞死亡是免疫原性的,並暴露出腫瘤抗原,可以引發進一步的腫瘤特異性免疫反應。此外,病毒本身會刺激顯著的免疫炎症反應。關鍵的促炎細胞因子以及趨化因子、黏附分子和共刺激分子在局部上調,導致炎症(熱)的腫瘤微環境,能夠進一步增強CD8+細胞毒腫瘤浸潤性淋巴細胞的激活和對各種釋放的腫瘤抗原的免疫。
這種局部效應為病毒免疫治療與諸如PD-1或PD-L1靶向抗體等ICIS的結合提供了強大的機制基礎。ICI試劑的工作原理是,當PD-L1配體與T細胞上的PD-1受體結合時,揭示腫瘤細胞上PD-L1配體提供的抑制信號。通過從藥理上阻斷這種抑制信號,已經證明T細胞可以被釋放出來攻擊癌細胞,並可以獲得深遠的臨牀益處,但這隻對少數患者有利。已經假設,通過優化患者適應性免疫系統對特定腫瘤抗原的識別,結合ICI治療誘導的T細胞的非特異性刺激,治療結果可以顯著改善。似乎需要信號的雙重性:如前所述,釋放檢查點抑制,同時向T細胞提供積極的刺激信號。MHC I類分子有效地將腫瘤特異性抗原呈遞給免疫系統,就提供了這樣一種特異的刺激信號。病毒免疫療法已被證明有助於腫瘤抗原的這種交叉呈遞,因此是PD-1或PD-L1檢查點阻斷的一個有吸引力的補充。
免疫系統是高度動態的,不同羣體的免疫細胞在全身持續傳播。這樣做的一個結果是,當T細胞被局部激活並重新編程以識別腫瘤特異性抗原時,它們可以在遠離原始腫瘤的部位發揮系統作用,驅動有效的免疫反應。這種非局域效應可能解釋了在癌症實驗模型中觀察到的遠距離、未注射部位的顯著影響。在前列腺癌的小鼠模型中,CAN-2409已經顯示出非鏡下效應。該模型使用了同基因前列腺細胞系RM-1,通過尾靜脈注射將其植入小鼠的側翼和全身,以模擬轉移性疾病,導致肺部腫瘤結節的出現。在用CAN-2409和全身性前藥單獨或聯合放射治療側翼腫瘤腫塊後,我們觀察到無論是注射還是未注射的轉移瘤都有有益的反應。使用CAN-2409導致腫瘤體積平均減少38%,在聯合用藥組腫瘤體積減少61%。值得注意的是,平均肺結節數量從對照組的20.5個減少到對照組的22.4個
15
接受放射治療的患者在CAN-2409組為13.0,在CAN-2409聯合放療時為6.6。我們還觀察了非小細胞肺癌患者對CAN-2409實驗性治療的異常反應。我們觀察到約三分之二出現多處病變的可評估患者的未注射病變消退。
研究表明,CAN-2409治療的活性依賴於CD8+T細胞參與的小鼠模型,該研究評估了CAN-2409治療和T細胞耗盡的排列。此外,來自成功用CAN-2409和前藥治療的小鼠的T細胞被證明足以抑制腫瘤的生長,當與AKR腫瘤模型細胞混合並移植到小鼠兩側皮下時。在未經處理的小鼠、用缺乏胸苷激酶基因的對照載體處理的小鼠的T細胞中,或者當AKR腫瘤細胞單獨異種移植時,沒有觀察到這種活性。這些數據與CAN-2409依賴T細胞的作用機制是一致的。此外,我們還發現前列腺癌、胰腺癌和非小細胞肺癌患者腫瘤部位CD8+T細胞的誘導。
第二個候選產品-CAN-3110
CAN-3110是一種改良的HSV,具有特殊的特性,可用於各種臨牀適應症。即,CAN-3110:
CAN-3110是一種工程HSV,其中負責病毒複製的基因ICP34.5的表達已置於腫瘤特異性巢蛋白啟動子的控制下。巢蛋白是一種細胞骨架蛋白,在膠質瘤細胞中過度表達,但在健康的成年人大腦中缺失。在CAN-3110中,ICP34.5的表達受Nestin啟動子的控制,使病毒能夠在腫瘤細胞中選擇性地複製。這種具有複製能力的HSV結構提供了腫瘤特異性的細胞溶解活性,同時保留了不表達巢蛋白的健康細胞。
對CAN-3110病毒基因組的這種改造使我們能夠維持ICP34.5的功能,ICP34.5是一種HSV蛋白,即使在幹擾素反應受到抑制的情況下,也可以在嚴格控制下僅在腫瘤細胞中複製病毒。
ICP34.5在其他對腫瘤選擇性較低的HSV溶瘤病毒中被缺失,目的是獲得良好的安全性,這可能導致病毒複製能力較差,產生有效的抗腫瘤免疫反應的能力有限。
我們的臨牀試驗
CaN-2409治療前列腺癌
我們已經完成了使用CAN-2409作為單一療法並聯合SoC治療非轉移性前列腺癌的多個1期和2期臨牀試驗。這些試驗產生了良好的耐受性和安全性數據,併為支持CAN-2409免疫激活、劑量水平和時間表提供了證據。到目前為止,我們已經對700多名侷限性前列腺癌患者使用了CAN-2409,其中大多數目前正在進行中的安慰劑對照隨機試驗。
單藥治療活性
在我們的第一階段試驗中,我們觀察到了我們認為是單一療法的CAN-2409的臨牀反應。在前列腺癌患者中,這些反應一直被觀察到,包括新診斷的局部疾病患者,以及那些即使在放射治療後癌症仍在進展的患者。
在新診斷的侷限性前列腺癌患者中,單一療法CAN-2409治療後的活檢分析顯示,與基線活檢相比,腺體結構改變、壞死和免疫細胞滲透增加。我們觀察到,在處理的樣本中,CD8+T細胞的數量增加了4倍,CD68+巨噬細胞的數量增加了3倍,顯示了CAN-2409注射後的免疫反應。
16
在另一項1/2期臨牀試驗中,前列腺癌在放射治療後進展並且PSA水平持續上升的患者接受了CAN-2409作為單一治療,劑量水平從1x10到1x10不等。8–1x1011病毒顆粒。在納入的36名患者中,有27名患者在單一的CAN-2409週期後觀察到PSA水平下降,這是通過治療後前3個月系列評估中的最佳PSA下降來衡量的。PSA雖然不是前列腺癌的一個不完美的生物標誌物,但仍被廣泛用於患者管理和活檢,因為PSA水平的上升,特別是PSA倍增時間與疾病進展有關。在同一項試驗中,我們觀察到,在這一耐藥患者羣體中,PSA倍增時間顯著改善(p=0.0271),從基線的15.9個月延長到單週期應用CAN2409後的42.5月。這項試驗中的一部分患者還接受了第二或第三個療程的CAN-2409注射。在這些患者中,大多數患者在重複注射後再次觀察到PSA水平比給藥前有所下降。
綜合療法
由於癌症患者的聯合治療日益普遍,將新型藥物與SoC治療相結合而不產生重疊毒性的能力變得越來越重要。我們相信,在我們的臨牀試驗中,CAN-2409產生的良好耐受性和安全性數據對我們當前和未來的發展計劃是令人鼓舞的,不僅是與其他藥物結合使用,也是不願接受更積極形式治療的低風險患者羣體的單一療法。我們在前列腺癌患者中使用CAN-2409聯合放射治療或雄激素剝奪治療的2期臨牀試驗的安全性數據顯示,未報告與4級治療相關的不良事件,僅有1例患者發生與3級治療相關的不良事件。預計流感樣症狀會很明顯,因為CAN-2409是一種已知的腺病毒基因結構,可以誘導全身免疫反應。超過50%的患者報告經常與病毒免疫激活有關的發燒和/或寒戰。這些症狀通常表現為早期和短暫的,通常發生在瘤內注射CAN-2409的晚上,並在第二天早上消失。這項研究中胃腸道不良事件的發生率與接受放射治療的患者的典型報告一致,放射治療是該人羣SOC的一部分。
我們之前的第二階段臨牀試驗數據使我們與FDA根據SPA就我們正在進行的第三階段臨牀試驗達成協議。雖然數據是有限的,因為我們沒有進行面對面的研究,但在我們的第二階段臨牀試驗中,我們觀察到接受CAN-2409聯合放射治療的中等風險患者的失敗率比其他四個類似患者羣體的同期試驗報告的失敗率低75%。這些其他臨牀試驗報告的失敗率在75%-79%之間,對應的累積複發率為21%-25%,而CAN-2409導致中等風險前列腺癌患者的複發率為5%。在這項臨牀試驗中,接受CAN-2409治療的患者的中位隨訪期為5.7年。同樣,這項臨牀試驗的結果也表明,與其他試驗相比,入選的低風險和高風險患者的複發率降低。此外,在2歲時可獲得的活檢中,93%觀察到病理完全應答(PCR)(在對照人羣中為37%-73%)。在這項試驗中,低風險患者的PSA達到了
在我們的2期試驗中使用的終點是免於失敗(FFF),由治療到發生臨牀或生化失敗之間的時間段定義。根據SPA協議,我們選擇無病生存(DFS)作為我們第三階段臨牀試驗的終點。DFS的定義要求對腫瘤進展進行客觀檢測。這在很大程度上與FFF重疊,因為它通常是由檢測到PSA水平升高(即生化故障)觸發的。我們還使用DFS參數重新分析了以前的第2階段數據,支持將DFS作為我們第3階段試驗的終點。
侷限性前列腺癌的潛在註冊3期臨牀試驗
我們正在開發CAN-2409作為一種潛在的治療選擇,以避免激素治療或手術幹預的長期嚴重副作用。根據我們到目前為止的臨牀試驗數據,我們相信,如果獲得批准,CAN-2409有可能成為30多年來第一個被批准用於侷限性前列腺癌患者的新的一線候選產品。我們目前正在進行CAN-2409的潛在註冊3期試驗,根據與FDA的SPA協議,在結合SOC放射治療的情況下,對新診斷的中高風險患者的侷限性前列腺癌進行單一關鍵試驗。
這項3期臨牀試驗完全納入了711名患者,隨機2:1。患者接受三個研究療程的CAN-2409治療,每個療程包括四次同時經直腸或會陰超聲引導的CAN-2409注射,然後是口服萬乃洛韋一個療程。第一次注射療程在開始放射治療前至少15天,但不超過8周。第二次注射療程在放療前0-3天進行。第三個也是最後一個注射療程在第二次注射後15-22天進行。在每次服用CAN-2409後,給予固定劑量的萬乃洛韋,為期14天。在整個試驗過程中,對患者實施SOC外放射治療,並根據治療醫生的決定選擇ADT。
試驗納入標準是基於符合NCCN中危標準的侷限性前列腺癌患者或只有一個NCCN高危特徵的患者。NCCN中等風險的定義是至少有以下一項
17
前列腺血清抗原(PSA)10~20 ng/ml,Gleason評分7分,TNM分期為T2b~T2c。患者也可能表現出一個高危特徵,可能包括PSA 20+ng/ml,Gleason評分8-10,或癌症達到T3a期,但不超過這些高危因素中的一個。
SPA具體規定了與FDA就第三階段試驗的統計設計和效力以及主要終點定義達成的協議。SPA表示,試驗經過充分設計,可以提供必要的數據,根據結果,這些數據可以支持生物製品許可證申請(BLA)的提交。SPA確實注意到了所有SPA的要點,即BLA的接受和批准是審查問題,BLA的批准將取決於實際臨牀試驗數據的質量、對所述主要終點的影響的穩健性、對次要終點的影響、對研究進行的有利評估,以及對安全信息和其他支持性數據的分析。我們有大約50個活躍的臨牀站點進行這項臨牀試驗,並於2021年9月完成了711名患者的登記。臨牀試驗的主要終點是DFS。這項試驗被設計成有90%的威力,危險比為0.5,阿爾法為0.05。我們假設根據上面提供的DFS定義,與安慰劑相比,主動ARM(CAN-2409)的事件發生率提高了15%。我們預計2024年第四季度來自這一3期臨牀試驗的TOPLINE數據。
主動監測的第二階段臨牀試驗
到目前為止的臨牀結果表明,CAN-2409作為單一療法可能會降低侷限性前列腺癌患者的生化失敗率。在AS環境下,我們將評估CAN-2409是否有可能延緩或阻止腫瘤進展到需要根治性治療的較晚階段。
2019年5月,該公司完成了其CAN-2409第二階段臨牀試驗的187名患者的登記,該試驗針對隨機2:1的中低風險、局部性、非轉移性前列腺癌患者。主要終點是活檢證實的無進展生存(PFS)。進展被定義為Gleason分級增加或腫瘤體積增加到>33%。由於主要終點是事件驅動的,2023年2月,根據對事件發生率的盲目審查,公司確定需要額外的時間進行患者隨訪,以收集足夠數量的事件。根據目前的事件發生速度,該公司目前預計2024年第四季度將提供背線數據。
用於非小細胞肺癌(NSCLC)的CAN-2409
為了評估CAN-2409觸發局部和全身免疫激活併產生“熱”腫瘤表型的可能性,我們設計並完成了一項針對可手術切除肺癌患者的臨牀試驗。在這項機制驗證的第一階段臨牀試驗中,腫瘤內注射新輔助劑CAN-2409的劑量增加,三週後腫瘤切除。具體目標是獲得生物學數據,以更好地瞭解CAN-2409對腫瘤微環境的影響,特別關注腫瘤內CD8+腫瘤浸潤性淋巴細胞的激活和功能,同時評估其對全身免疫反應的影響。通過將注射後的樣本與內部對照進行比較來評估CAN-2409的效果,內部對照包括每個患者自己的治療前針頭活檢和血液樣本,以及接受標準手術切除而沒有使用CAN-2409的匹配患者的外部隊列。結果顯示,在實驗性的CAN-2409單一治療後,腫瘤內和全身免疫顯著激活。對CAN-2409接種前後外周血單個核細胞的分析顯示,在CAN-2409接種3周後,其增殖和活化標誌物包括HLA-DR、CD38和Ki67的表達均顯著增加。這項臨牀試驗的其他相關發現包括T細胞激活的標誌物增加,如PD-1和CTLA-4,它們是ICI的靶標,已被批准用於非小細胞肺癌。
在這項非小細胞肺癌1期臨牀試驗中,2例患者出現3級脱水合並腎功能不全,2例患者出現3級尿瀦留,6例患者出現4級低淋巴細胞計數。值得注意的是,一位患有14.8釐米IIIA期肉瘤樣癌的70歲男性患者,在接受CAN-2409單一治療3周後,腫瘤體積縮小了近50%。總而言之,這些結果使我們相信,CAN-2409可以通過在肺癌患者中激發額外的免疫激活來提高非小細胞肺癌患者的ICI應答率。
CAN-2409和Checkpoint聯合治療對ICI反應不足的非小細胞肺癌患者的2期臨牀試驗
2020年,我們在對ICI反應不足的非小細胞肺癌患者中啟動了CAN-2409的第二階段臨牀試驗,納入了接受SoC ICI(如果有適應症的話,加上化療)的患者,同時接受兩個療程的CAN-2409和持續ICI。這項經過修訂的開放標籤臨牀試驗的目標是在兩個不同的隊列中招募大約80名III/IV期非小細胞肺癌患者。根據註冊時對ICIS的響應來定義隊列。隊列1針對的是病情穩定的患者,隊列2針對的是經過至少18周的ICI治療後疾病進展的患者。患者繼續接受他們最初的ICI治療,並將CAN-2409添加到他們的方案中。這項試驗的主要療效終點是由RECIST和/或疾病控制率衡量的應答率,總存活率是關鍵的研究終點。
18
我們在2022年6月的ASCO年會上報告了這項試驗的初步數據。在我們2022年12月的研發日期間。這些數據在2023年9月宣佈的更新中得到了進一步的支持,該更新基於2023年8月1日的數據截止點,其中我們提供了更新的數據,顯示了局部和全身抗腫瘤活性的證據;進入疾病進展試驗(隊列2)的患者的疾病控制率為77%(20/26);持續和持續的臨牀反應超過1年;腫瘤進展軌跡的有利變化;大多數患者RECIST靶點的腫瘤大小縮小;14/21名患者(67%)的未注射腫瘤大小減少;1和2個隊列的總有效率為13%(4/30);持久的疾病穩定轉化為令人鼓舞的無進展生存的初步證據;局部和全身細胞毒性T細胞反應的持續誘導;CD8+T細胞在腫瘤微環境中的滲透增加;效應性T細胞的系統性擴張和外周血中可溶性顆粒酶B水平的增加;以及良好的安全性/耐受性數據,大多數與治療相關的不良事件為1/2級。2023年12月,隨着我們完成隊列2的目標登記,這項研究的招募被暫停。
我們預計將在2024年第二季度公佈這項正在進行的第二階段臨牀試驗的TOPLINE總體生存數據。
治療胰腺癌的CAN-2409
在先前的1b期臨牀試驗中,與歷史試驗結果相比,在SOC的基礎上加用CAN-2409治療的胰腺癌患者顯示出比僅用現有SOC治療的患者的預期存活時間更長的存活時間。此外,在治療前和治療後腫瘤活檢的患者中,觀察到CD8+腫瘤浸潤性淋巴細胞的數量在統計學上顯著增加。此外,研究表明,與SoC結合使用時,CAN-2409的耐受性一般都很好。
我們目前正在進行CAN-2409在交界性可切除胰腺癌中的隨機第二階段臨牀試驗,目標登記多達54名患者。2023年3月,結合我們的成本管理和動態投資組合管理計劃,我們決定暫停這項隨機第二階段臨牀試驗的新登記,但需要額外的資金。儘管患者登記暫停,但我們提供了2023年第四季度的初步臨牀數據,數據截止日期為2023年8月21日。最初的數據顯示,在接受CAN-2409治療的患者中,存活率延長和持續,治療組和安慰劑組的存活率是分開的。在治療後24個月和36個月,在標準新輔助放化療的基礎上增加2-3個CAN-2409療程,然後嘗試手術切除,估計存活率為71.4%,相比之下,標準新輔助放化療之後僅嘗試手術切除的存活率為16.7%。我們預計將在2024年第二季度公佈這一生存數據的最新情況。
用於治療高級別膠質瘤的CAN-2409
CAN-2409治療高級別腦膠質瘤的3期臨牀試驗
在2022年12月的研發日上,我們宣佈,我們已經做出了投資組合和資源優先排序決定,將繼續使用CAN-3110治療複發性HGG,但不會繼續進行CAN-2409治療高級別膠質瘤的3期臨牀試驗。複發性HGG中的CAN-3110計劃可能成為未來擴展到HGG早期階段以及其他腦外以巢蛋白表達為特徵的實體腫瘤的臨牀試驗。
CAN-2409聯合Opdivo治療高級別腦膠質瘤的1期臨牀試驗
我們在新診斷的HGG患者中進行了一項1b期臨牀試驗,檢查CAN-2409和抗PD-1 nivolumab(Opdivo,BMS)與BMS和成人腦瘤聯合會合作的組合。這是第一次評估CAN-2409和nivolumab聯合治療HGG患者的臨牀試驗,目的是增強抗腫瘤T細胞的激活和擴增,並有可能獲得更好的臨牀結果。
這項1b期臨牀試驗的數據於2022年11月在波士頓舉行的第37屆癌症免疫治療學會(SITC)年會上公佈。在這項涉及35名可評估患者的試驗中,廣泛的生物標誌物分析表明,CAN-2409和nivolumab的組合導致激活的抗腫瘤CD4+和CD8+T細胞效應細胞在統計上顯著擴大,並減少了效應細胞上耗盡的標誌。OLINK蛋白質組學分析顯示促炎症細胞因子增加,包括幹擾素-γ、趨化因子CXCL9/10和CXCL11、單核細胞趨化蛋白-1、單核細胞趨化蛋白-3和顆粒酶A。單用CAN-2409後,在尼伏單抗開始治療前(治療後3周),觀察到全身免疫激活。MGMT啟動子甲基化患者大部切除組(n=10)的生存時間為30.6個月,次全切除組(n=5)為12.6個月。非甲基化MGMT患者的MOS分別為13.2個月(GTR)和15.9個月(STR)(n=4)。
CAN-2409聯合SoC治療高級別腦膠質瘤的1b/2期臨牀試驗
在我們對包括難以治療的膠質母細胞瘤在內的新診斷的HGGs患者進行的1b/2期臨牀試驗中,CAN-2409與目前的SoC聯合使用時,患者的存活率在統計上顯著高於
19
目前僅限SoC(手術、放射和替莫唑胺)。這項試驗比較了在4個臨牀地點接受CAN-2409加SOC治療的48名登記患者的總存活率與在MGB登記的134名只接受SOC治療的匹配對照組患者的總體存活率。結果顯示,單用SOC組患者的MOS13.5個月,而CAN2409加SOC組患者的MOS值為17.1月(P=0.0417)。重要的是,對手術中接受大體全切除(>95%的腫瘤切除)的患者子集(18名患者與對照組的44名患者)的預先計劃分析顯示,CAN-2409組的平均生存時間為25.1個月,而SOC組為16.3個月,大約改善了50%(p=0.0120)。在這一患者羣體中,三年後,每三名患者中就有一人在CAN-2409組中存活,而在SoC組中,每20名患者中就有一人存活。在研究結束時,接受CAN-2409治療的患者中有3人分別在43、62.1和88.5個月後存活,沒有進展。CAN-2409一般耐受性良好,大多數與治療相關的不良反應為1級或2級,很少有3級或4級事件的報告。
CAN-2409在其他癌症適應症中的機會
除了前列腺癌、肺癌、胰腺癌和腦癌的患者外,CAN-2409還在卵巢癌、惡性胸腔積液、兒童腦癌和視網膜母細胞瘤患者的小型早期探索性臨牀試驗中使用,支持上述耐受性和安全性。
CAN-3110治療複發性高級別腦膠質瘤
我們的第一個基於HSV的候選產品CAN-3110正在進行由研究人員贊助的1b階段臨牀試驗,用於治療複發性HGG。這是一項開放標籤、劑量遞增的臨牀試驗,適用於SOC失敗的患者。這項臨牀試驗的主要目的是分析在復發HGG患者中使用CAN-3110的安全性。在1x10的劑量範圍內沒有觀察到劑量限制毒性。6到1x1010以半對數增量表示的PFU。已有50多名患者接受了治療。
免疫組織化學研究顯示,治療後HSV抗原持續存在,CD8+細胞毒腫瘤浸潤性淋巴細胞浸潤,為CAN-3110的預期作用機制提供了支持。
我們尤其對少數患者的臨牀過程感到鼓舞,這些患者在膠質母細胞瘤復發時接受了單一的CAN-3110注射作為單一治療。1例患者最初被診斷為多中心性膠質母細胞瘤,最初接受SOC手術切除,然後進行替莫唑胺和放射治療,在復發後接受了CAN-3110單一治療,MRI顯示有兩個病變。一個位於額部的病變發生在最初切除腫塊的部位。第二個較大的腫塊是一個新的病變。患者通過立體定向將CAN-3110注射到注射的皮損中。在注射後第56天,兩個腫塊的體積都有明顯的減少。注射後第112天,兩個腫塊的體積進一步縮小,患者能夠重返工作崗位。患者最終發展為第三個病變,經歷了繼發於診斷程序的中風,並拒絕進一步治療,在進入試驗約15個月後死亡。第二名患者最初被診斷為位於顳葉的甲基化IV級HGG,接受了連續兩次切除和化療放射治療,以治療快速進展的疾病。患者在原始病變部位注射了CAN-3110(10E8 Pfus)。第91天進行的MRI掃描顯示注射部位強化。患者接受了額外的切除,但重要的是,組織學報告顯示主要是炎性組織,有高密度的腫瘤浸潤性淋巴細胞。患者在兩年多沒有接受任何額外治療的情況下,沒有發現疾病,在接受CAN-3110治療後的第717天,作為一名機動車事故的乘客去世。另一名患者最初被診斷為IV級星形細胞瘤,在接受次全切除、放化療和替莫唑胺輔助一線治療後,因復發而接受了CAN-3110治療。復發時,左側額葉有明顯腫塊。患者參加了第一階段臨牀試驗的B組,其中包括在注射CAN-3110之前使用環磷酰胺(24 mg/kg,1次/d,第2次)治療。治療後掃描顯示注射部位進行性減少強化伴空洞壞死。截至2024年2月,患者的臨牀情況保持穩定,在接受CAN-3110治療後的兩年內沒有需要額外的治療。我們發現這些病例報告是令人鼓舞的,因為在沒有同時治療的情況下,這些復發的HGG患者經歷了異常有利的病程,他們之前沒有進行SOC治療。此外,我們觀察到,截至2023年4月20日的截止日期,第一批41名患者在1b期試驗中的MoS為11.8個月。這一數據在一個由9名患者組成的獨立隊列中得到了證實(隊列B;MOS12.0個月)。CAN-3110治療後存活時間的延長與單純皰疹病毒1型血清陽性以及T細胞比例和T細胞受體β多樣性的變化有關。考慮到其他研究藥物在復發HGG患者中的歷史臨牀試驗中不到6-9個月的MOS,這些患者的SoC治療失敗,我們認為這是臨牀活動的令人鼓舞的證據。我們預計將在2024年下半年報告正在進行的1b期臨牀試驗的更多數據,包括多次注射CAN-3110的潛在好處。
協作和其他交易
我們是各種許可和合作協議的一方,根據這些協議,我們向第三方許可專利、專利申請和其他知識產權。這些許可證要求進行各種勤奮和財務支付。
20
這是我們的責任。我們預計未來將繼續簽訂這些類型的許可協議。我們認為以下許可和協作協議對我們的業務至關重要:
佩裏菲根。2019年12月9日,我們與Periphagen簽訂了一系列協議,包括獨家許可協議、更新協議、設備採購協議和知識產權轉讓協議,統稱為Periphagen協議,據此我們收購了Periphagen的某些資產和許可了Periphagen的某些權利(包括指定的專利權和專有技術,或許可的IP權利),主要包括對其技術平臺和臨牀前、開發階段病毒媒介組合的獨家權利,以及某些物理財產和設備。主要的資產類別是表達神經營養因子-3的單純皰疹病毒衍生資產(或NT-3資產)和其他單純皰疹病毒衍生資產(基因轉移神經資產)。根據許可協議,Periphagen授予我們全球獨家許可,有權在許可知識產權下通過多個層次授予再許可,以進行研究並開發、製造、製造、使用、使用、提供銷售、銷售、出口和進口包含許可知識產權的產品,用於除治療、診斷和預防非腫瘤性皮膚病和疾病(包括用作美容)之外的所有使用領域。
此外,根據Periphagen協議,我們承擔了某些承諾和義務,包括承擔Periphagen的本金1,000,000美元的貸款。該期票的合同利率為每年複利2%,到期未償餘額和應計利息於2027年11月到期,沒有中期分期付款。
對於Periphagen協議下的許可,我們在簽署時向Periphagen支付了811,000美元,並同意支付以下特許權使用費和其他付款:
如果我們被要求向第三方支付Periphagen協議涵蓋的任何產品的版税,我們可以將此類版税從在適用國家/地區欠Periphagen的版税中扣除,最高減幅為2/2。
與Periphagen的獨家許可協議(Periphagen許可協議)要求我們使用商業上合理的努力來完成NT-3 Asset的人體概念驗證臨牀試驗,其中包括某些特定的臨牀里程碑。如果我們未能使用此類努力,則受Periphagen許可協議中的爭議和升級條款的限制,我們可能會提交指定的付款來代替履行此類義務。如果我們未能做到這一點,Periphagen可能會因重大違約而終止Periphagen許可協議。2022年12月15日,Periphagen致函通知我們,我們未能根據我們與Periphagen於2019年12月9日簽訂的獨家許可協議(“Periphagen許可協議”),使用商業上合理的努力來完成NT-3資產的人體概念驗證臨牀試驗。2023年1月13日,我們向美國仲裁協會提出了針對Periphagen的仲裁要求,要求聲明Periphagen在12月15日的信函中未能遵守Periphagen許可協議中的爭議和升級條款。2023年3月10日,Periphagen對我們的仲裁要求提出了答覆和反訴。在反訴中,Periphagen要求聲明我們沒有使用商業上合理的努力來完成NT-3 Asset的人體概念臨牀試驗,並要求聲明進一步延長時間在科學上或商業上都是不合理的。我們否認了Periphagen的反訴。
2023年6月7日,雙方簽署了一項獨家許可協議修正案,解決了爭端,並導致仲裁終止。見第一部分,第3項“法律訴訟”。
21
Periphagen許可協議將於2069年12月9日晚些時候或版税期限結束時到期。到期後,我們將擁有一個全額支付的非獨家許可,可以製造、使用、銷售、提供銷售和進口任何包含許可知識產權的產品。使用費期限是指在逐個產品和國家/地區的基礎上,自該產品在該國家/地區首次商業銷售之日起至(I)該產品在該國家/地區的許可知識產權下的專利覆蓋或監管排他性到期之日;或(Ii)在該國家/地區存在一定數量的仿製藥競爭之日止的一段時間,但不得超過30年。
Periphagen許可協議可因以下原因終止:(I)為方便起見,我們事先向Periphagen發出90天的書面通知;(Ii)如果我們在補救期間後仍違反Periphagen協議,則Periphagen終止;或(Iii)如果我們破產、申請破產或以其他方式資不抵債或被置於破產管理程序,則由Periphagen終止。
布里格姆將軍(MGB)。2018年1月20日,我們與MGB簽訂了獨家期權協議(期權協議)。根據期權協議,吾等從MGB取得獨家全球獨家使用費許可,以開發及商業化若干MGB專利所涵蓋的產品,包括涵蓋用於治療或預防人類或動物癌症的基因療法及載體療法領域的CAN-3110專利,有關詳情已於期權協議(許可領域)中進一步詳述。作為MGB授予獨家選擇權的代價,我們向MGB支付了40,000美元的不可退還費用。
根據期權協議,吾等須盡合理努力與MGB訂立臨牀試驗協議。我們於2018年6月19日與MGB(MGB臨牀試驗協議)簽訂了這樣的臨牀試驗協議。根據MGB臨牀試驗協議,我們承諾根據選項協議中的協議摘要,為MGB實施指定的第一階段臨牀試驗提供高達750,000美元的匯款。
2020年9月15日,我們行使了選擇權,與MGB簽訂了獨家專利許可協議(MGB許可協議)。根據MGB許可協議,MGB向我們授予(A)在MGB的某些專利項下的獨家、收取特許權使用費的許可,以製造、製造、使用、使用、銷售和銷售該等許可專利涵蓋的某些產品(許可產品),並以其他方式實踐該等許可專利涵蓋的過程(許可過程);以及(B)根據MGB的某些其他專利項下的非獨家、收取特許權使用費的許可,允許我們製造、製造、使用、使用、銷售和銷售許可產品,但不得銷售或已經銷售許可過程。上述權利可再許可,但受MGB許可協議中規定的再許可條款的約束。在執行MGB許可協議時,我們支付了100,000美元的許可發放費。我們還同意償還MGB為準備、提交、起訴和維護許可專利權而招致和將招致的所有合理費用和支出,金額相當於141,268美元。
根據MGB許可協議,我們需要以商業上合理的努力開發許可領域的許可產品並向公眾提供,這些努力包括MGB許可協議中詳細説明的某些里程碑。
根據MGB許可協議,在許可產品首次商業銷售之前,我們必須從生效日期的四週年開始向MGB支付每年的許可費。在首次商業銷售許可產品後,我們被要求每年向MGB支付最低版税,這筆金額可以從第一次商業銷售後第四年開始的賺取的版税中扣除。
除了此類年度許可費和特許權使用費義務外,MGB許可協議還包含在臨牀和商業開發和銷售的各種臨牀、商業和銷售里程碑實現後的累計里程碑付款,金額最高可達39,000,000美元,其中某些里程碑適用於將任何許可產品作為單一療法開發和銷售,其中某些里程碑適用於將任何許可產品與另一種治療實體腫瘤的治療方式相結合的開發和銷售。
我們被要求在特許產品首次商業銷售時向MGB支付版税,版税隨着淨銷售額的增加而增加,從低個位數到高個位數不等。我們還同意對使用特定MGB專有技術開發的任何產品的淨銷售額支付個位數的版税,但這些產品不在許可專利權或衍生產品的涵蓋範圍內。
如果我們被要求向第三方支付特許權使用費,以避免因我們許可產品的開發和商業化而提出的專利侵權索賠,我們可以按照商定的百分比減少對MGB的任何產品(但不是衍生產品)的特許權使用費義務。對於任何產品的銷售,支付給MGB的特許權使用費不得低於預定的百分比,對於任何衍生產品的銷售,不得低於另一個百分比。
我們向MGB支付特許權使用費的義務以國家/地區為基礎終止,最晚的日期為(I)在該國家/地區的MGB許可協議中進一步詳細説明的專利權的有效主張停止之日,(Ii)在該國家/地區的法定或監管排他性終止之日,以及(Iii)第一次商業銷售後10年。
22
MGB許可協議還要求我們支付可歸因於再許可的任何非特許權使用費收入的一定百分比,包括(I)在給第二階段試驗中的第一名患者給藥之前發生此類再許可的情況下的第二分位數費率;(Ii)如果在第二階段試驗中給第一名患者給藥之後但在FDA(或其他主要市場國家的同等批准和監管機構)批准BLA之後發生此類再許可的情況下發生此類再許可的情況下的第一分之費率;以及(Iii)如果此類再許可發生在FDA(或另一主要市場國家的同等批准和監管機構)批准BLA之後發生的個位數費率。
MGB許可協議在(I)在最後一個有商業銷售的國家進行首次商業銷售10週年之日,(Ii)所有相關的已發佈專利和提交的專利申請已經到期或被放棄之日,以及(Iii)適用產品的市場獨家經營權到期之日的最後一天到期。
在以下情況下,MGB許可協議可能會被MGB終止:(I)如果我們未能在指定的治療期內支付協議條款下的任何欠款;(Ii)如果我們未能按照MGB許可協議維持保險;(Iii)如果我們申請破產;或(Iv)如果我們在指定的治療期後因非財務原因仍未履行MGB許可協議以補救違約。為方便起見,我們可以提前90天書面通知終止MGB許可協議。
文特根.2014年3月1日,我們與Ventagen,LLC(Ventagen)簽訂了獨家許可協議(The Ventagen Agreement)。Ventagen協議向Ventagen提供獨家許可,有權根據我們在Ventagen協議有效期內擁有或控制的任何世界範圍內擁有或控制的任何全球專利權和專有技術授予再許可(受某些條款和條件的約束),包括利用皰疹來源的TK蛋白通過病毒載體(如其中進一步規定)向腫瘤或其他組織輸送的適用技術,以研究、使用、使用、進口、進口、出口、出口、要約出售、銷售、分銷和營銷某些用於預防或治療人類癌症的產品和用於動物(或使用領域)的任何用途(許可產品)。在墨西哥、伯利茲、危地馬拉、洪都拉斯、薩爾瓦多、哥斯達黎加、尼加拉瓜、巴拿馬、哥倫比亞和玻利維亞(或領土)進行商業銷售和分銷。
根據Ventagen協議,Ventagen同意利用商業上合理的努力,在領土的使用領域開發和商業化特許產品。
Ventagen同意向我們支付1,000,000美元用於我們在2014年和2015年收到的研發費用,並同意在Ventagen實現特定數量的許可產品銷售後,向我們支付固定的未來里程碑付款2,500,000美元,如果超過指定門檻,我們的直接成本將受到一定的減免。
Ventagen還同意以成本價外加許可產品批發價的指定漲幅從我們購買臨牀或商業用途所需的所有臨牀和商業許可產品,受最低和最高價格的限制,直至版税期限結束,版税期限定義為自Ventagen協議生效日期開始,並以下列較晚者為準的國家/地區結束:(I)涉及許可產品的專利權最後到期日期;(Ii)自在適用國家/地區收到許可產品的營銷授權之日起12年;或(Iii)由第三方製造、擁有或控制的許可產品的仿製版本獲得市場許可的日期。如果我們不能或不願意根據Ventagen協議的條款製造供應品,Ventagen有權自己製造供應品,並將被要求向我們支付由Ventagen、其聯屬公司、代理商、再被許可人或最終用户銷售的每劑固定費用。我們還同意向Ventagen提供與Ventagen的發展計劃相關的某些服務。
Ventagen協議將於領土內所有國家的最終特許權使用費期限屆滿之日到期。Ventagen協議可以(I)由Ventagen在提前30天書面通知吾等後隨意終止,(Ii)如果Ventagen申請破產或資不抵債,由吾等在指定的通知期內終止,或(Iii)如果Ventagen在通知和補救違約的補救期限後仍嚴重違反Ventagen協議,則由吾等終止。Ventagen保留不可撤銷的、永久的、已付清的、免版税的許可證,並有權在版税期限到期後在領土內的每個國家使用、使用、租賃、進出口、要約銷售、生產、分銷和營銷經許可的產品。
我們目前的某些股東擁有Ventagen 49.5%的有表決權股票,但我們不擔任任何管理職位,也不經營Ventagen的日常運營。請參閲“某些關係和相關人員交易記錄”。
競爭
候選新產品的開發和商業化競爭激烈。在CAN-2409和CAN-3110方面,我們面臨來自主要製藥、專業製藥和生物技術公司等的競爭,在我們未來可能尋求開發或商業化的任何候選產品方面,我們也將面臨類似的競爭。我們在製藥、生物技術和其他相關市場展開競爭,這些市場開發用於癌症治療的免疫腫瘤療法。還有其他公司致力於開發治療癌症的病毒免疫療法,包括各種規模的大型製藥和生物技術公司的部門。已經商業化和/或
23
正在開發癌症免疫腫瘤療法的公司包括阿斯利康、百時美施貴寶、吉列德科學公司、默克公司、諾華公司、輝瑞公司和基因泰克公司。
我們的競爭對手開發的一些產品和療法基於與我們的方法相同或相似的科學方法,包括對腺病毒和單純皰疹病毒的病毒免疫療法的使用。其他有競爭力的產品和療法則基於完全不同的方法。我們知道,Replimune Group,Inc.,安進,Astellas Pharma,Inc.,Istari Oncology Inc.,Orca Treateutics,B.V.,CG Oncology,Inc.,ImmVira Co.,Ltd.,IconOVir Bio,Inc.和Fergene,Inc.等公司正在開發可能對我們目標適應症具有治療作用的病毒免疫療法。潛在的競爭對手還包括學術機構、政府機構和其他公共和私人研究組織,這些組織開展研究、尋求專利保護併為研究、開發、製造和商業化建立合作安排。
與我們相比,我們的許多競爭對手或未來可能競爭的公司在研發、製造、臨牀前測試、進行臨牀試驗、獲得監管批准和營銷批准藥物方面擁有更多的財務資源和專業知識。製藥和生物技術行業的合併和收購可能導致更多的資源集中在我們數量較少的競爭對手身上。規模較小或處於初創階段的公司也可能成為重要的競爭對手,特別是通過與大型和成熟公司的合作安排。這些競爭對手還在招聘和留住合格的科學和管理人員、建立臨牀試驗場地和為我們的臨牀試驗招募受試者以及在獲取與我們的計劃互補或必要的技術方面與我們競爭。
如果我們的競爭對手開發和商業化比我們或我們的合作者可能開發的任何產品更安全、更有效、副作用更少或更少的產品,或者更方便或更便宜的產品,我們可能會看到我們的商業機會減少或消失。我們的競爭對手也可能比我們更快地獲得FDA或外國監管機構對其產品的批准,這可能會導致我們的競爭對手在我們能夠進入市場之前建立強大的市場地位。影響我們所有候選產品成功的關鍵競爭因素,如果獲得批准,可能是它們的療效、安全性、便利性和價格(如果需要)、生物相似或仿製藥競爭的水平以及政府和其他第三方付款人是否可以報銷。
商業化
我們打算對我們的候選產品保留重要的開發權和商業權,如果獲得營銷批准,我們將在美國和其他地區單獨或可能與合作伙伴將我們的候選產品商業化。我們目前沒有銷售、營銷或商業產品分銷能力,也沒有將產品商業化的經驗。隨着我們候選產品的進一步發展,我們打算隨着時間的推移為美國以及可能的其他地區建立必要的基礎設施和能力。臨牀數據、可尋址患者羣體的規模、商業基礎設施和製造需求的規模以及合作機會都可能影響或改變我們的商業化計劃。
製造業
我們建立了一支運營領導團隊,在基於病毒的生物製品(包括病毒免疫療法產品和基因療法產品)的製造方面擁有豐富的經驗,並在為製造生物製品而設計的設施的建設、驗證、批准和運營方面擁有豐富的經驗。我們已經獲得了第三方合同製造組織,用於臨牀和商業規模生產我們的CAN-2409和CAN-3110候選產品。
知識產權
我們認為,根據BLA批准我們的CAN-2409和CAN-3110候選產品可能會導致根據《患者保護和平價醫療法案》(經《醫療保健和教育協調法案》(以下簡稱ACA)修訂)在美國獲得12年的數據獨佔權,在歐洲獲得10年的市場獨佔權,在其他市場獲得顯著的市場獨佔權,這將是對任何相關專利獨佔權的補充。
關於專利獨佔性,我們已經或正在為我們的CAN-2409和CAN-3110候選產品以及我們的啟迪發現平臺尋求專利保護。關於我們的候選產品CAN-2409,我們擁有一項美國專利和一項懸而未決的專利申請,該專利涉及一種將CAN-2409與免疫檢查點抑制劑結合使用的方法。已發佈的專利和正在申請的專利如果發佈,預計將於2034年到期。關於我們的候選產品CAN-3110,我們有權獲得在美國、澳大利亞、加拿大、中國、歐洲和日本頒發的成分物質專利以及在澳大利亞、歐洲和韓國正在申請的與CAN-3110相關的專利申請。已發佈的專利和正在申請的專利如果發佈,預計將於2036年到期。該專利系列是由MGB獨家授權給我們的。此外,我們還與MGB就一項未決的美國臨時專利申請達成了一項選擇權協議,該申請涉及使用生物標記物選擇接受CAN-3110治療的癌症患者以及管理接受CAN-3110治療的癌症患者的治療方案。聲稱優先於臨時專利申請的專利期限如果發佈,預計將於2044年到期。
24
關於我們的啟蒙?發現平臺,我們已經從Periphagen獨家授權了一系列專利,其中包括美國、歐洲和中國的物質組成專利,以及美國和中國正在處理的與我們啟蒙?發現平臺中使用的單純皰疹病毒載體相關的申請。已發佈的專利和正在申請的專利如果發佈,預計將於2037年到期。此外,我們擁有一項根據專利合作條約提交的未決國際專利申請,其中包含與我們的啟蒙發現平臺和使用方法中使用的HSV載體和候選有效載荷相關的物質組合權利要求。要求優先於國際專利申請的專利期限如果發佈,預計將於2043年到期。我們還擁有一項懸而未決的美國臨時專利申請,該申請涉及使用我們的HSV載體治療某些癌症患者的方法。聲稱優先於臨時專利申請的專利期限如果發佈,預計將於2044年到期。
政府監管
在美國,生物製品受《聯邦食品、藥品和化粧品法》(FD&C法)的監管,受《公共衞生服務法》(PHS法)的許可,以及其他聯邦、州、地方和外國的法規和法規的約束。除其他事項外,《食品和藥物管制法》和相應的法規對涉及生物製品的研究、開發、臨牀試驗、測試、製造、質量控制、批准、安全、功效、標籤、包裝、儲存、記錄保存、分銷、報告、營銷、促銷、進出口、廣告、批准後監測和批准後報告等方面進行管理。獲得監管批准的過程以及隨後遵守適當的聯邦、州、地方和外國法律和法規的過程需要花費大量的時間和財力,我們可能無法獲得所需的監管批准。
此外,即使我們的產品獲得了必要的監管批准,製藥公司也必須遵守無數聯邦、州和外國醫療法律、規則和法規,這些法律、規則和法規制約着我們業務的方方面面,包括但不限於我們與醫療保健專業人員、醫療機構、產品分銷商以及銷售和營銷人員的關係;政府和其他第三方支付人對我們產品的承保和報銷;以及數據隱私和安全。此類法律、規則和條例複雜、不斷演變,在許多情況下,沒有得到適用的監管機構或法院的廣泛解釋。我們需要在政策、程序、流程和系統上投入大量的時間和財政資源,以確保遵守這些法律、規則和法規,如果我們不這樣做,可能會導致聯邦或州監管機構施加鉅額罰款或其他處罰,導致聲譽損害,或以其他方式對我們的運營結果和財務狀況產生實質性的不利影響。
美國生物製品開發流程
FDA在生物製品候選產品獲準在美國上市之前所需的程序通常包括以下幾個方面:
25
臨牀前研究和IND過程
在人體上測試任何候選生物製品之前,候選產品進入臨牀前測試階段。臨牀前試驗,也稱為非臨牀研究,包括對產品的生物學特性、化學、毒性和配方的實驗室評估,以及評估候選產品潛在安全性和活性的動物研究。臨牀前試驗的進行必須符合聯邦法規和要求,包括GLP。
在美國開始對候選產品進行初步臨牀試驗之前,必須向FDA提交IND,FDA必須允許IND繼續進行。IND是對FD&C法案的豁免,該法案允許未經批准的候選產品在州際商業中運輸用於臨牀研究,並請求FDA允許此類研究產品在與此類試驗相關的人類身上使用。這種授權必須在州際運輸和管理之前獲得。為了支持IND的申請,臨牀試驗贊助商必須向FDA提交臨牀前試驗的結果,以及生產信息、分析數據、任何可用的臨牀數據或文獻以及建議的臨牀方案作為IND的一部分。IND必須在人體臨牀試驗開始前生效。一旦提交,IND在FDA收到後30天自動生效,除非FDA在30天內將IND全部或部分臨牀擱置。在這種情況下,IND贊助商和FDA必須在臨牀試驗或部分研究開始之前解決任何懸而未決的問題。因此,提交IND可能會導致FDA授權開始臨牀試驗,也可能不會。FDA還可以在臨牀試驗之前或臨牀試驗期間的任何時間對贊助商的IND施加臨牀限制,原因包括不合理或重大的安全問題、無法評估安全問題、缺乏合格的研究人員、誤導性或嚴重不完整的研究人員手冊、研究設計缺陷、幹擾同一或另一研究產品的充分和良好控制的研究的進行或完成、研究產品數量不足、缺乏有效性或不符合規定。如果FDA強制臨牀暫停,研究可能不會在沒有FDA授權的情況下重新開始,然後只有在FDA授權的條件下才能重新開始。
臨牀試驗
臨牀試驗涉及在合格的調查人員的監督下給健康的志願者或患者服用候選生物製品,這些調查人員通常是不受試驗贊助商僱用或控制的醫生。臨牀試驗是在詳細説明臨牀試驗的目標、給藥程序、受試者選擇和排除標準以及用於監測受試者安全性的參數和標準的協議下進行的,包括確保在某些不良事件發生時臨牀試驗將被停止的停止規則。每個方案和對方案的任何修改都必須作為IND的一部分提交給FDA。臨牀試驗必須根據FDA包含GCP要求的規定進行和監測,包括要求所有研究對象提供知情同意。代表參與臨牀試驗的每家機構的內部評審委員會必須在該機構開始任何臨牀試驗的計劃之前審查和批准該計劃,而且該委員會必須至少每年進行持續的審查和重新批准該試驗。IRB必須審查和批准向試驗對象提供的試驗方案和知情同意信息等。IRB的運作必須符合FDA的規定。如果臨牀試驗不是按照IRB的要求進行的,或者如果候選產品與患者受到意想不到的嚴重傷害有關,IRB可以暫停或終止對其機構或其所代表機構的臨牀試驗的批准。
一些試驗由試驗贊助商組織的一個由合格專家組成的獨立小組監督,該小組被稱為數據安全監測委員會(DSMB)。該小組根據只有該小組維護的對來自試驗的可用數據的訪問來授權試驗是否可以在指定的檢查點進行,並且如果確定對受試者存在不可接受的安全風險或其他理由,例如沒有顯示療效,則可以建議停止臨牀試驗。
關於某些臨牀試驗的某些信息也必須在特定的時間範圍內提交給NIH,以便在其www.example.com網站上公開傳播。
臨牀試驗通常分三個連續階段進行,這些階段可能重疊或合併:
26
2022年3月,FDA發佈了一份題為《擴展隊列:用於首個人類臨牀試驗以加快腫瘤學藥物和生物製品的開發》的最終指南,其中概述了開發人員如何在腫瘤學生物產品開發的早期階段(即第一個人體臨牀試驗)利用通常稱為無縫試驗設計的適應性試驗設計,將傳統的三個階段的試驗壓縮為一個稱為擴展隊列試驗的連續試驗。支持個人擴展隊列設計的信息包括在IND應用程序中,並由FDA進行評估。擴大隊列試驗可以潛在地提高生物製品開發的效率,減少開發成本和時間。
在某些情況下,FDA可能會要求,或者公司可能會自願在產品獲得批准後進行額外的臨牀試驗,以獲得有關該產品的更多信息。這些批准後的臨牀試驗,有時被稱為4期臨牀試驗,也可能是批准BLA的一個條件。未能在進行所需的4期臨牀試驗方面進行盡職調查可能會導致撤回對產品的批准。
在臨牀試驗的同時,公司通常會完成額外的動物研究,還會開發關於生物產品化學和物理特性的額外信息,並根據cGMP要求最終確定商業批量生產產品的工藝。為了幫助降低使用生物製品引入外來製劑的風險,《公共衞生服務法》(PHS法案)強調了對屬性無法準確定義的產品進行製造控制的重要性。製造過程必須能夠始終如一地生產高質量的候選產品批次,除其他外,贊助商必須開發測試最終生物製品的特性、強度、質量、效力和純度的方法。此外,必須選擇和測試適當的包裝,並進行穩定性研究,以證明候選生物製品在保質期內不會發生不可接受的變質。
FDA和EMA都為開發用於治療罕見疾病的候選生物製品提供了快速途徑,特別是具有高度未得到滿足的醫療需求的危及生命的疾病。這些生物製品候選可能有資格在有限的患者羣體中進行早期階段的單一臨牀試驗,在適當的管理機構審查試驗的設計、主要終點和結果後,該試驗可能被認為是關鍵或註冊試驗。被視為關鍵試驗或註冊試驗的要求的確定取決於適用的監管當局的科學判斷,這些要求在美國和歐洲聯盟可能有所不同。
在臨牀開發的所有階段,監管機構要求贊助商確保對所有臨牀活動、臨牀數據和臨牀試驗研究人員進行廣泛的監測和審計。詳細説明臨牀試驗結果的年度進展報告,特別是安全信息,必須提交給FDA。對於與研究藥物的使用相關的嚴重和意想不到的不良事件,必須迅速向FDA和調查人員提交書面IND安全報告,在某些情況下,提交任何來自同一藥物的其他研究、實驗室動物試驗或體外試驗的結果,表明對人類受試者有重大風險,或與方案或研究人員手冊中列出的嚴重可疑不良反應發生率相比,臨牀上嚴重可疑不良反應發生率的任何重要增加。贊助商必須在15個歷日內提交IND安全報告,在贊助商確定該信息有資格報告後。贊助商還必須在贊助商首次收到信息後七個歷日內,將任何意外的、致命的或危及生命的疑似不良反應通知FDA。
監管當局、IRB或贊助商可隨時以各種理由暫停臨牀試驗,包括髮現受試者面臨不可接受的健康風險,或試驗不太可能達到其所述的目標。一些試驗還包括由臨牀試驗贊助商組織的一個獨立的合格專家小組的監督,該委員會被稱為數據安全監測委員會,該委員會根據對試驗的某些數據的訪問,授權試驗是否可以在指定的檢查點進行,如果確定對受試者存在不可接受的安全風險或其他理由,如沒有顯示療效,可能會停止臨牀試驗。
美國審查和審批流程
27
假設根據所有適用的法規要求成功完成所有必需的測試,則產品開發、非臨牀研究和臨牀試驗的結果將作為BLA的一部分提交給FDA,請求批准將該產品用於一個或多個適應症的市場。BLA必須包括產品開發、實驗室和動物研究、人類臨牀試驗的結果、產品的製造和成分信息、建議的標籤和其他相關信息。測試和審批過程需要大量的時間和精力,而且不能保證FDA會接受BLA的備案,即使備案,也不能保證任何批准都會及時批准。
在提交申請後60天內,FDA審查BLA提交,以確定在FDA接受其備案和全面審查之前是否基本上完成。FDA可以拒絕提交其認為不完整或在提交時不能適當審查的任何BLA,並可以在完整的回覆信中要求提供更多信息。在這種情況下,必須重新提交BLA以及附加信息。重新提交的申請也要接受審查,以確定在FDA接受提交之前它是否基本上完成了。在大多數情況下,提交BLA需要繳納大量的申請使用費,儘管在某些情況下可以免除這筆費用。根據FDA根據《處方藥使用費法案》(PDUFA)對原始BLAS實施的績效目標和政策,FDA的目標是自提交日期起十個月,完成對標準申請的初步審查並回應申請人,以及自提交日期起六個月,完成優先審查的申請。FDA並不總是達到PDUFA的目標日期,FDA要求提供更多信息或澄清,在某些情況下,還要求召開諮詢委員會,因此審查過程往往會大大延長。這項審查通常需要12個月的時間,從BLA提交給FDA之日起算,因為FDA有大約兩個月的時間來做出“備案”決定。如果FDA要求或BLA贊助商在PDUFA目標日期之前的最後三個月內提供關於提交材料中已經提供的信息的額外信息或澄清,則審查過程和PDUFA目標日期可延長三個月。
一旦提交的申請被接受,FDA就開始對BLA進行深入的實質性審查。FDA審查BLA,以確定建議的產品對於其預期用途是否安全、純淨和有效,以及該產品是否按照cGMP生產,以確保其持續的安全性、純度和純度。FDA可以將新生物製品或生物製品的申請提交給諮詢委員會,通常是一個包括臨牀醫生和其他專家的小組,以審查、評估和建議是否應該批准申請以及在什麼條件下批准申請。FDA不受諮詢委員會建議的約束,但它在做出決定時會仔細考慮這些建議。在生物製品審批過程中,FDA還將確定是否需要風險評估和緩解戰略(REMS)來確保生物製品的安全使用。如果FDA得出結論認為需要REMS,則BLA的贊助商必須提交建議的REMS;如果需要,FDA將不會批准沒有REMS的BLA。
在批准BLA之前,FDA通常會檢查生產該產品的設施。FDA將不會批准該產品,除非它確定製造工藝和設施符合cGMP要求,並足以確保產品在所要求的規格下一致生產。此外,在批准BLA之前,FDA通常會檢查一個或多個臨牀地點,以確保臨牀試驗是按照IND試驗要求和GCP要求進行的。為了確保符合cGMP和GCP,申請者必須在培訓、記錄保存、生產和質量控制方面花費大量的時間、金錢和精力。
根據兒科研究公平法(PREA),新產品的BLA或補充BLA(例如,新的活性成分、新的適應症等)必須包含數據,以評估生物製品在所有相關兒科亞羣中聲稱的適應症的安全性和有效性,並支持對產品安全有效的每個兒科亞羣的劑量和給藥。FDA可以批准推遲提交數據,或者給予全部或部分豁免。除非法規另有要求,否則PREA不適用於任何已被授予孤兒稱號的生物製品。
在FDA對BLA進行評估並對生產試驗用藥品和/或其原料藥的生產設施進行檢查後,FDA可能會簽發批准函或完整回覆函。批准函授權該產品的商業營銷,並附有針對特定適應症的特定處方信息。完整回覆函將描述FDA在BLA中發現的所有缺陷,但如果FDA確定支持申請的數據不足以支持批准,則FDA可以在不首先進行所需檢查、測試提交的產品批次和/或審查擬議標籤的情況下發布完整回覆函。在發佈完整回覆函時,FDA可能會建議申請人為使BLA處於批准狀態而可能採取的行動,包括要求提供額外信息或澄清。如果不符合適用的監管標準,FDA可能會延遲或拒絕批准BLA,要求額外的測試或信息和/或要求上市後測試和監督,以監測產品的安全性或有效性。
28
如果一種產品獲得了監管部門的批准,批准可能會顯著地限於特定的疾病和劑量,或者使用的適應症可能會受到限制,包括患者亞羣,這可能會限制該產品的商業價值。此外,FDA可能會要求在產品標籤中包括某些禁忌症、警告、預防措施或相互作用。FDA可以以REMS的形式對產品的分銷、處方或配藥施加限制和條件,或以其他方式限制任何批准的範圍。FDA還可能以改變擬議的標籤或制定適當的控制和規範等為條件進行批准。一旦獲得批准,如果沒有保持對上市前和上市後要求的遵守,或者如果產品進入市場後出現問題,FDA可能會撤回產品批准。FDA可能要求一個或多個第4階段上市後試驗和監測,以進一步評估和監測產品在商業化後的安全性和有效性,並可能根據這些上市後試驗的結果限制產品的進一步銷售。此外,可能會建立新的政府要求,包括由新立法產生的要求,或者FDA的政策可能會改變,這可能會影響監管批准的時間表或以其他方式影響正在進行的開發計劃。
孤兒產品名稱
根據《孤兒藥品法》,FDA可以將用於治療罕見疾病或疾病的生物製品指定為孤兒,這種疾病或疾病通常是一種在美國影響不到20萬人或在美國影響20萬人或更多人的疾病或疾病,而且沒有合理的預期,即在美國開發和生產治療這種疾病或疾病的生物製品的成本將從產品的銷售中收回。在提交BLA之前,必須請求指定孤立產品。在FDA批准孤兒產品指定後,FDA公開披露治療劑的身份及其潛在的孤兒用途。孤立產品的指定不會在監管審查和批准過程中傳達任何優勢,也不會縮短監管審查和批准過程的持續時間。
孤兒產品指定使一方有權獲得財政激勵,如為臨牀試驗費用、税收優惠和用户費用減免提供贈款資金的機會。如果一種被指定為孤兒產品的產品隨後獲得了FDA對其具有這種指定的疾病或疾病的特定活性成分的第一次批准,該產品有權獲得孤兒產品排他性,這意味着FDA可能不會批准任何其他申請,包括完整的BLA,在七年內銷售相同的生物適應症,除非在有限的情況下,例如顯示出相對於具有孤兒產品排他性的產品的臨牀優勢。然而,競爭對手可能會因孤兒產品具有排他性的指示而獲得不同產品的批准,或者獲得對同一產品但對於孤兒產品具有排他性的不同指示的批准。如果競爭對手獲得FDA定義的相同生物製品的批准,或者如果確定候選產品包含在競爭對手的產品中,用於相同的適應症或疾病,孤立的產品排他性也可能在七年內阻止我們的產品獲得批准。如果被指定為孤兒產品的生物製品獲得了上市批准,其適應症範圍超過了指定的範圍,則該生物製品可能無權獲得孤兒產品獨家經營權。此外,如果FDA後來確定指定請求存在重大缺陷,或者如上所述,如果第二申請人證明其產品在臨牀上優於具有孤兒排他性的批准產品,或者批准產品的製造商無法保證足夠數量的產品滿足罕見疾病或疾病患者的需求,則可能失去孤兒藥物在美國的獨家營銷權。歐洲聯盟(EU)的孤兒藥物地位具有類似但不相同的好處。
加快發展和審查計劃
FDA有各種計劃,包括快速通道指定、突破性治療指定、加速批准和優先審查,旨在加快或簡化用於治療嚴重或危及生命的疾病或狀況的藥物和生物製品的開發和FDA審查過程。要有資格獲得快速通道指定,候選新藥和生物製品必須旨在治療嚴重或危及生命的疾病或病症,並證明有潛力解決這種疾病或病症未得到滿足的醫療需求。快速通道指定適用於產品和正在研究的特定適應症的組合。新藥或生物製劑的贊助商可以要求FDA在產品的臨牀開發過程中的任何時候將該藥物或生物製劑指定為快速通道產品。例如,指定快速通道的一個好處是,如果滿足某些條件,FDA可以在提交完整申請之前滾動考慮對營銷申請的部分進行審查,包括與FDA就提交部分申請的擬議時間表達成協議,以及在FDA可以啟動審查之前支付適用的用户費用。
根據FDA的突破性治療計劃,贊助商可以尋求FDA將其產品候選指定為突破性療法,如果候選產品旨在單獨或與一種或多種其他藥物或生物製品聯合治療嚴重或危及生命的疾病或狀況,並且初步臨牀證據表明,該產品可能在一個或多個臨牀重要終點顯示出比現有療法顯著的改善,例如在臨牀開發早期觀察到的顯著治療效果。突破性的治療指定伴隨着快速通道指定的所有好處。FDA可能會採取其他適當的行動來加快開發和
29
審查候選產品,包括與贊助商舉行會議,及時向贊助商提供建議,並與贊助商就開發計劃進行互動溝通。
如果候選產品治療嚴重或危及生命的疾病或狀況,並且如果獲得批准,將在嚴重疾病或狀況的治療、診斷或預防的安全性或有效性方面提供顯著改善,則候選產品有資格接受優先審查。FDA將嘗試將額外的資源用於評估指定為優先審查的新藥或生物製品的申請,以努力促進審查。根據優先審查,FDA的目標是在申請提交後的6個月內進行審查,而標準審查為10個月。優先審查的指定不會改變批准的科學/醫學標準或支持批准所需的證據質量。
關於腫瘤學產品,FDA可能會根據FDA腫瘤學卓越中心建立的實時腫瘤學審查(RTOR)審查申請。RTOR允許申請者預先提交申請的部分,以便FDA在提交完整的申請之前審查臨牀數據,旨在探索更有效的審查過程,以確保患者儘早獲得安全有效的治療,同時保持和提高審查質量。除其他事項外,考慮在RTOR下審查的藥物必須可能證明與現有治療相比,臨牀相關終點(S)有實質性改善,並且必須易於解釋終點。此外,申請的任何方面都不可能需要更長的審查時間,例如要求新的REMS。要確定獲得RTOR的資格,FDA需要申請者關鍵臨牀試驗(S)的頂級療效和安全性結果,以及臨牀試驗(S)的數據庫鎖定。FDA一般會在收到申請人的申請後二十(20)個工作日內做出是否接受RTR的決定。如果申請者不被錄取,申請者將遵循常規的申請提交程序。
此外,候選產品可能有資格獲得加速審批。被研究的藥物或生物製品在治療嚴重或危及生命的疾病方面的安全性和有效性,並提供比現有治療方法更有意義的治療效果的藥物或生物製品可能會獲得加速批准,這意味着它們可能會基於充分和受控的臨牀試驗,確定產品對替代終點的影響,該替代終點合理地可能預測臨牀益處,或者基於對除存活率或不可逆轉的發病率或死亡率之外的中間臨牀終點的影響,合理地預測不可逆轉的發病率或死亡率或其他臨牀益處,並考慮到病情的嚴重性、稀有性或流行率以及替代治療的可獲得性或缺乏。作為批准的一項條件,FDA通常要求獲得加速批准的藥物或生物製品的贊助商進行充分和良好控制的上市後臨牀試驗,這些試驗必須以盡職調查的方式進行,以驗證臨牀益處與替代終點的關係或最終結果與臨牀益處的關係,根據2022年食品和藥物綜合改革法案(FDORA),FDA可視情況要求此類試驗在批准之前或在批准加速批准的日期後的特定時間段內進行。此外,對於正在考慮加速批准的產品,FDA通常要求,除非該機構另有通知,否則所有打算傳播或出版的廣告和促銷材料都必須提交給該機構審查。根據FDORA,FDA增加了加快程序的權力,例如,如果驗證性試驗未能驗證產品的預期臨牀益處,則可以撤回在加速批准下批准的藥物或適應症的批准。
審批後要求
FDA在批准後繼續對生物製品進行嚴格和廣泛的監管,特別是在cGMP要求以及與記錄保存、不良反應報告、定期報告、產品抽樣和分銷以及產品的廣告和促銷有關的要求方面。要求產品製造商遵守cGMP法規中適用的要求,包括質量控制和質量保證以及記錄和文件的維護。其他適用於生物製品的批准後要求,包括報告可能影響分發產品的身份、效力、純度和總體安全性的cGMP偏差、記錄保存要求、報告不良反應、報告最新的安全和療效信息,以及遵守電子記錄和簽名要求。在BLA獲得批准後,該產品也可能需要正式批次發佈。作為製造過程的一部分,製造商被要求對產品的每一批進行某些測試,然後才能發佈供分銷。如果產品必須由FDA正式發佈,製造商將向FDA提交每批產品的樣品,以及顯示該批次生產歷史和製造商對該批次進行的所有測試結果的摘要的發佈協議。FDA還可能對許多產品進行某些驗證性測試,如病毒疫苗,然後再由製造商發佈批次供分銷。此外,FDA還進行與生物製品的安全性、純度、效力和有效性監管標準相關的實驗室研究。
製造商必須遵守FDA的廣告和促銷要求,例如與直接面向消費者的廣告相關的要求,禁止為產品批准的標籤中未描述的用途或在患者羣體中推廣產品(稱為“標籤外使用”),行業贊助的科學和教育活動,以及涉及互聯網的促銷活動。發現以前未知的問題或未能遵守
30
適用的管理要求可能導致對產品的銷售或從市場上撤回該產品的限制,以及可能的民事或刑事制裁。在產品開發過程、批准過程或批准後的任何時間未能遵守適用的美國要求,可能會使申請人或製造商受到行政或司法民事或刑事制裁以及負面宣傳。FDA的制裁可能包括拒絕批准待定申請、撤回批准、臨牀擱置、警告或無名信件、產品召回、產品扣押、完全或部分暫停生產或分銷、產品扣留或拒絕允許產品進出口、限制產品的營銷或製造、禁令、罰款、拒絕政府合同、強制糾正廣告或與醫生或其他利益相關者的溝通、取締、歸還、返還利潤或民事或刑事處罰。任何機構或司法執法行動都可能對我們產生實質性的不利影響。
生物製品製造商和其他參與生產和經銷批准的生物製品的實體必須向FDA和某些州機構登記其機構,並接受FDA和某些州機構的定期突擊檢查,以確保其遵守正在進行的法規要求,包括cGMP,這些法規對贊助商及其合同開發和製造組織(CDMO)提出了某些程序和文件要求。處方藥和生物製品的藥品供應鏈中涉及的製造商和其他方也必須遵守產品跟蹤和追蹤要求,並向FDA通報假冒、轉移、盜竊和故意摻假的產品或本來不適合在美國分銷的產品。因此,製造商必須繼續在生產和質量控制方面花費時間、金錢和精力,以保持cGMP合規性。在批准後發現產品的問題可能會導致對產品、製造商或批准的BLA持有者的限制,包括將該產品從市場上撤回。此外,對製造工藝或設施的更改通常需要事先獲得FDA的批准才能實施,對批准的產品的其他類型的更改,如增加新的適應症和額外的標籤聲明,也需要接受FDA的進一步審查和批准。
美國專利期限恢復與市場排他性
根據FDA批准生物製品的時間、期限和細節,贊助商的一些美國專利可能有資格根據哈奇-瓦克斯曼修正案獲得有限的專利期延長。哈奇-瓦克斯曼修正案允許專利恢復期限最長為五年,作為對產品開發和FDA監管審查過程中失去的專利期的補償。然而,專利期限恢復不能延長專利的剩餘期限,從產品批准之日起總共不能超過14年。專利期恢復期限一般為IND的生效日期和BLA提交日期之間的時間的一半加上BLA提交日期和該申請獲得批准之間的時間。只有一項適用於批准的生物製品的專利有資格延期,而且延期申請必須在專利到期之前提交。此外,一項專利只能延期一次,而且只能針對單一產品。美國專利商標局(USPTO)與FDA協商,審查和批准任何專利期延長或恢復的申請。將來,我們可能打算為我們的一項專利申請恢復專利期,如果適用,以延長其當前到期日之後的專利壽命,這取決於臨牀試驗的預期長度和提交相關BLA所涉及的其他因素。
一種生物製品可以在美國獲得兒科市場獨家經營權。如果獲得兒科獨家經營權,該生物製品的所有配方、劑型和適應症的現有專營期將增加6個月。這項為期6個月的專營權從其他專營性保護結束時開始,可根據FDA發佈的此類研究的“書面請求”自願完成兒科研究,條件是在授予兒科專營權時,還有不少於9個月的期限。
ACA包括一個副標題,稱為2009年生物製品價格競爭和創新法案(BPCIA),該法案為被證明與FDA許可的參考生物製品生物相似或可互換的生物製品創建了一個簡短的批准途徑。小靈通法案的這項修正案試圖將重複測試降至最低。生物相似性要求生物製品和參比製品在安全性、純度和效力方面沒有臨牀上有意義的差異,這可以通過分析研究、動物研究和臨牀試驗來證明。可互換性要求產品與參比產品具有生物相似性,並且該產品必須證明它可以預期產生與參比產品相同的臨牀結果,並且對於多次給藥的產品,可以在先前給藥後交換生物和參比生物,而不會增加安全風險或相對於獨家使用參比生物的療效降低的風險。然而,與生物製品更大且往往更復雜的結構相關的複雜性,以及此類產品的製造工藝,對FDA仍在制定的實施構成了重大障礙。
FDA將不會接受基於參考生物製品的生物相似或可互換產品的申請,直到參考產品首次獲得許可之日起四年,FDA將不會批准基於參考生物製品的生物相似或可互換產品的申請,直到參考產品第一次獲得許可之日起12年。“首次許可”通常指的是所涉特定產品的初始日期
31
在美國獲得執照。首次許可的日期不包括生物製品的許可日期(且新的專有期不適用於),如果許可是用於生物製品的補充劑,或用於生物製品的同一發起人或製造商(或許可人、利益相關者或其他相關實體)的後續申請,以進行導致新的適應症、給藥路線、給藥時間表、劑型、給藥系統、給藥裝置或強度的改變的改變(不包括對生物製品的結構的修改),或者用於對生物製品的結構的改變而不導致安全性、純度、或者是效力。BPCIA是複雜的,並繼續由FDA解釋和實施。此外,政府的建議還試圖縮短12年的參考產品專營期。BPCIA的其他方面,其中一些可能會影響BPCIA的排他性條款,也是最近訴訟的主題。因此,BPCIA的最終實施和影響受到重大不確定性的影響。
美國對陪伴診斷的監管
我們的候選產品可能需要使用體外診斷來確定合適的患者羣體。這些診斷通常被稱為伴隨診斷,作為醫療設備進行監管。在美國,《食品和藥物管理局法案》及其實施條例以及其他聯邦和州法律法規對醫療器械設計和開發、臨牀前和臨牀試驗、上市前批准或批准、註冊和上市、製造、標籤、儲存、廣告和促銷、銷售和分銷、進出口和上市後監督等方面進行了監管。除非適用豁免,否則配套診斷測試在商業分銷之前需要獲得市場許可或FDA的批准。適用於醫療器械的FDA營銷授權的兩種主要類型是上市前通知,也稱為510(K)批准,以及上市前批准(PMA批准)。
如果伴隨診斷的使用對於藥物或生物製品的安全有效使用是必不可少的,那麼FDA通常會要求在批准治療產品的同時批准或批准診斷。2014年8月6日,FDA發佈了一份最終指導文件,闡述了“體外伴隨診斷設備”的開發和批准程序。根據該指南,對於像我們的產品候選產品這樣的新候選產品,配套診斷設備及其對應的藥物或生物候選設備應同時獲得FDA的批准或批准,以用於治療產品標籤中指示的用途。該指南還解釋説,在候選生物產品的臨牀試驗中用於做出治療決定的配套診斷設備通常將被視為研究設備,除非該設備已被批准或批准用於預期用途。如果用於做出關鍵的治療決策,如患者選擇,根據FDA的調查設備豁免(IDE)法規,診斷設備通常將被視為重大風險設備。因此,診斷設備的贊助商將被要求遵守IDE規定。根據指南,如果診斷設備和藥物要一起研究以支持它們各自的批准,如果研究同時滿足IDE法規和IND法規的要求,這兩種產品可以在同一項調查研究中進行研究。指導意見規定,根據研究計劃和主題的細節,贊助商可以單獨提交IND,或同時提交IND和IDE。2016年7月,FDA發佈了一份指導文件草案,旨在進一步幫助治療產品的贊助商和體外伴隨診斷設備的贊助商解決與這些產品共同開發有關的問題。
FDA通常要求配套診斷旨在選擇對癌症治療有反應的患者,以便在批准治療的同時獲得對該診斷的PMA批准。與我們正在開發的那些治療候選藥物的審查一起,對這些體外伴隨診斷的審查涉及FDA生物製品評估和研究中心以及FDA設備和放射健康中心的審查的協調。PMA過程,包括臨牀和臨牀前數據的收集,以及提交給FDA和FDA的審查,可能需要幾年或更長時間。它包括嚴格的上市前審查,在此期間,申請人必須準備並向FDA提供有關該設備的安全性和有效性的合理保證,以及有關該設備及其部件的信息,其中包括設備設計、製造和標籤。PMA申請也需要繳納申請費。
某些設備的PMAS通常必須包括廣泛的臨牀前和充分且受控良好的臨牀試驗的結果,以確定該設備對於尋求FDA批准的每個適應症的安全性和有效性。特別是,對於診斷,申請人必須證明,當同一樣本由多個實驗室的多個用户多次測試時,該診斷產生可重現的結果。此外,作為PMA審查的一部分,FDA通常會檢查製造商的設施是否符合質量體系法規(QSR),該法規規定了詳細的測試、控制、文檔和其他質量保證要求。
如果FDA對PMA申請和製造設施的評估都是有利的,FDA將發出批准信或不批准信,其中通常包含確保PMA最終批准所必須滿足的一些條件,如標籤的更改,或特定的附加信息,如提交最終標籤,以確保PMA的最終批准。如果FDA得出結論認為已經滿足了適用的標準,FDA將為批准的適應症頒發PMA,這可能比申請人最初尋求的適應症更有限。PMA可以包括FDA認為必要的批准後條件
32
確保設備的安全和有效性,除其他外,包括對標籤、促銷、銷售和分銷的限制。
如果FDA對PMA或製造設施的評估不是很有利,FDA將發佈命令,拒絕批准PMA或發佈不可批准的命令。一封不能批准的信將概述申請中的不足之處,並在可行的情況下,確定使PMA獲得批准所需的條件。FDA還可能確定有必要進行額外的臨牀試驗,在這種情況下,PMA的批准可能會推遲幾個月或幾年,同時進行試驗,然後在PMA的修正案中提交數據。一旦獲得批准,如果沒有遵守批准後的要求、批准條件或其他監管標準,或者在初步營銷後發現問題,FDA可能會撤回PMA批准。PMA的批准不能得到保證,FDA最終可能會根據申請中的缺陷對PMA提交做出不可批准的決定,並要求額外的臨牀試驗或其他數據,這些數據的生成可能既昂貴又耗時,而且可能會大大推遲批准。
2024年1月,FDA宣佈打算啟動大多數體外診斷的重新分類程序,包括伴隨診斷。此外,FDA表示,除了重新分類過程外,FDA將繼續在個體體外診斷的初始分類中採用基於風險的方法,以確定新的測試是否可以通過從頭分類過程被歸類為II類。在這樣做的過程中,FDA表示,它可能會將大多數未來的伴隨診斷設備監管為II類設備,這可能會比受PMA途徑約束的III類醫療設備和體外診斷所需的開發、批准和上市後監管要求更少。
在設備投放市場後,它仍然受到嚴格的監管要求。醫療器械的銷售只能用於其許可或批准的用途和適應症。設備製造商還必須向FDA建立註冊和設備清單。醫療器械製造商及其供應商的製造流程必須遵守QSR的適用部分,其中包括醫療器械的設計、測試、生產、工藝、控制、質量保證、標籤、包裝和運輸的方法和文檔。美國食品和藥物管理局會定期對國內工廠的記錄和製造流程進行不定期檢查。FDA還可能檢查向美國出口產品的外國設施。
附加法規
除上述規定外,與環境保護和有害物質有關的州和聯邦法律,包括《職業安全與健康法》、《資源節約與回收法》和《有毒物質控制法》,都會影響我們的業務。這些法律和其他法律規範了我們對各種生物、化學和放射性物質的使用、處理和處置,這些物質用於我們的行動,以及由我們的行動產生的廢物。如果我們的運營導致環境污染或使個人暴露在危險物質中,我們可能會承擔損害賠償和政府罰款的責任。
美國以外的政府監管
除美國的法規外,我們還受到其他司法管轄區的各種法規的約束,其中包括研發、臨牀試驗、測試、製造、安全、功效、標籤、包裝、儲存、記錄保存、分銷、報告、廣告和其他涉及生物製品的促銷做法以及我們產品的授權和批准。由於生物來源的原材料面臨獨特的污染風險,它們的使用在一些國家可能會受到限制。
指導進行臨牀試驗、產品許可、定價和報銷的要求和程序因國家而異。在所有情況下,臨牀試驗都必須根據GCP以及源於《赫爾辛基宣言》的適用法規要求和倫理原則進行。如果我們未能遵守適用的外國監管要求,我們可能會面臨罰款、暫停臨牀試驗、暫停或撤回監管批准、產品召回、產品扣押、運營限制和刑事起訴等。
臨牀試驗法規
無論我們的產品是否獲得FDA的批准,我們都必須在開始臨牀試驗或在這些國家銷售該產品之前獲得外國監管機構的必要批准。美國以外的某些國家也有類似的程序,要求在人體臨牀試驗開始之前提交臨牀試驗申請,很像IND。例如,在歐盟,每項臨牀試驗的申請必須提交給每個國家的國家主管當局(NCA)和至少一個獨立的倫理委員會,很像FDA和IRB。根據2022年1月31日取代臨牀試驗指令2001/20/EC的臨牀試驗法規(EU)第536/2014號,現在通過臨牀試驗信息系統(CTIS)向多達30個歐盟/歐洲經濟區國家同時提出臨牀試驗授權申請,並只需一套文件。
33
臨牀試驗申請的評估分為兩部分(第一部分包括科學和醫藥產品文件,第二部分包括國家和患者層面的文件)。第一部分通過所有歐盟成員國主管當局的協調審查進行評估,在該審查中,已提交臨牀試驗授權申請(有關成員國)參考成員國編寫的報告草案。第二部分由每個有關成員國單獨評估。相關倫理委員會在評估程序中的作用仍由相關歐盟成員國的國家法律管轄,但總體相關時間表由臨牀試驗條例界定。《臨牀試驗規例》也為臨牀試驗贊助商提供了簡化的報告程序。
歐盟藥品審查和批准
在歐盟,醫藥產品只有在獲得營銷授權後才能商業化。要在歐盟獲得藥品監管部門的批准,我們必須提交上市授權申請(MAA)。集中銷售授權由歐盟委員會根據歐洲藥品管理局人用藥品委員會(CHMP)的意見,通過集中程序頒發,在整個歐盟和歐洲經濟區其他成員國(冰島、列支敦士登和挪威)(歐洲經濟區)(歐洲經濟區)有效。對於某些類型的產品,如生物技術藥品、孤兒藥品、高級治療藥品(即基因療法、體細胞療法或組織工程藥物),以及含有用於治療艾滋病毒、艾滋病、癌症、神經退行性疾病、糖尿病、自身免疫和其他免疫功能障礙以及病毒疾病的新活性物質的藥品,必須實行集中程序。對於含有歐盟尚未授權的新活性物質的產品,或構成重大治療、科學或技術創新或符合歐盟公共衞生利益的產品,集中程序是可選的。
根據中央程序,環境評估機構對重大影響評估進行評估的最長時限為210天,但不包括計時器停頓時間,屆時申請人須提供補充書面或口頭信息,以回答《氣候變化框架公約》提出的問題。停止計時可能會大大延長評估MAA的時間框架,使其超過210天。如果CHMP給出了肯定的意見,它會將意見和支持文件一起提供給歐盟委員會,後者將在收到EMA的建議後67天內發出營銷授權的最終決定。CHMP可在特殊情況下批准加速評估,特別是從治療創新的角度來看,當一種醫藥產品有望對公眾健康產生重大影響時。根據加速評估程序對重大影響評估進行評估的時限為150天,不包括時鐘停頓,但如果CHMP確定申請不再適合進行加速評估,它可能會恢復到中央程序的標準時限。
美國用來提交《血液法》的申請與歐洲聯盟的要求相類似,但可能有一些具體要求,例如關於高級治療藥物產品的(EC)第1394/2007號條例所載的要求,涵蓋基因治療、體細胞治療和組織工程藥物產品。
現在英國(包括大不列顛和北愛爾蘭)已經離開歐盟,英國不再受集中營銷授權的覆蓋(根據北愛爾蘭議定書,目前在北愛爾蘭繼續承認集中營銷授權)。2024年1月1日,MHRA建立了一個國際認可框架,根據該框架,MHRA在決定新的英國營銷授權的申請時,將考慮歐洲藥品管理局和某些其他監管機構做出的關於批准營銷授權的決定。
數據和市場排他性
在歐盟,在獲得營銷授權後,根據完整和獨立的數據包獲得批准的創新醫藥產品有資格獲得八年的數據獨佔和額外兩年的市場獨家。如果獲得批准,數據排他性將防止仿製藥或生物相似藥的申請人在歐盟申請仿製藥或生物相似藥上市授權時,在自參考產品首次在歐盟獲得授權之日起的八年內,參考該參考產品的檔案中包含的創新者的臨牀前和臨牀試驗數據。在額外的兩年市場排他期內,可以提交和授權仿製藥或生物相似的MAA,並可以參考創新者的數據,但在市場排他性到期之前,任何仿製藥或生物相似產品都不能投放歐盟市場。如果在這十年的頭八年中,營銷授權持有者獲得了對一個或多個新治療適應症的授權,而這些適應症在授權前的科學評估期間被認為與現有療法相比能夠帶來顯著的臨牀益處,那麼整個十年的期限將延長到最多十一年。不能保證一個產品會被EMA視為創新的醫藥產品,而且產品可能沒有資格獲得數據獨佔性。即使一種產品被認為是一種創新的醫藥產品,從而創新者獲得了規定的數據獨佔期,如果另一家公司獲得了基於MAA的營銷授權,該公司擁有完整和獨立的藥物試驗、臨牀前試驗和臨牀試驗數據包,該公司也可以銷售該產品的另一個版本。
34
孤兒指定和排他性
在歐盟被指定為孤兒的產品可以獲得十年的市場排他性,在此期間,不得向市場投放“類似的醫藥產品”。“類似醫藥產品”的定義是含有與批准的孤兒醫藥產品中所含的一種或多種類似活性物質的醫藥產品,其目的是用於相同的治療適應症。在遵守了兒科研究的商定兒科調查計劃(PIP)的情況下,孤兒藥品還可以在歐盟獲得額外兩年的市場排他性。任何補充保護證書(SPC)的延期不能基於孤兒的兒科研究。
歐盟對“孤兒藥品”的認定標準原則上與美國相似。根據條例(EC)141/2000第3條,如果一種產品符合以下標準,則該產品可被指定為孤兒藥品:(1)該產品旨在診斷、預防或治療危及生命或慢性衰弱的疾病;(2)或者(A)在提出申請時,此類疾病在歐盟的影響不超過萬分之五(5);或者(B)如果沒有孤兒身份帶來的好處,該產品不太可能在歐盟產生足夠的回報,以證明其開發所需的投資是合理的;以及(3)沒有令人滿意的診斷、預防或治療這種疾病的方法被授權在歐盟市場銷售,或者如果存在這種方法,產品將對(EC)847/2000條例所定義的受該疾病影響的人有重大好處。孤兒醫藥產品有資格獲得財政獎勵,如降低費用或免除費用,並在獲得營銷授權後,有權獲得經批准的治療適應症的十年市場排他性。孤兒指定申請必須在申請上市許可之前提交。如果孤兒被指定為孤兒,申請人將獲得MAA費用減免,但如果在提交營銷授權時該指定仍在等待中,則不會。孤兒指定不會在監管審查和批准過程中傳遞任何優勢,也不會縮短監管審查和批准過程的持續時間。
如果在第五年結束時確定該產品不再符合指定孤兒的標準,例如,如果該產品的利潤足夠高,不足以證明維持市場排他性是合理的,則10年的市場排他性可以減少到6年。此外,在下列情況下,可隨時對與授權孤兒產品具有相同適應症的類似醫藥產品授予營銷授權:
兒科發展
在歐盟,開發新醫藥產品的公司必須與EMA的兒科委員會(PDCO)就PIP達成一致,並必須根據該PIP進行兒科臨牀試驗,除非EMA已批准PIP中包含的一項或多項措施的特定產品豁免、類別豁免或延期。當公司想要為已經授權的藥物增加新的適應症、藥物形式或給藥路線時,這一要求也適用。PIP規定了生成數據以支持正在尋求營銷授權的產品的兒科適應症的時間和建議的措施。產品的MAA必須包括根據PIP進行的兒科臨牀試驗的結果,除非適用豁免,或者PDCO已批准推遲實施PIP的部分或全部措施,直到有足夠的數據證明該產品在成人中的有效性和安全性,在這種情況下,必須在晚些時候完成兒科臨牀試驗。獲得根據PIP進行的兒科臨牀試驗結果的營銷授權的產品,即使試驗結果為陰性,也有資格獲得SPC保護的六個月延長(前提是在提交產品SPC申請的同時或在SPC到期前的任何時候提出延長保護申請)。在孤兒藥品的情況下,可以將孤兒市場的專有權延長兩年。這一兒科獎勵受到特定條件的制約,在開發和提交符合PIP的數據時不會自動獲得。
審批後控制
在獲得批准後,上市授權的持有者必須遵守適用於醫藥產品的製造、營銷、推廣和銷售的一系列要求。這些措施包括:
35
上述歐盟規則一般適用於歐洲經濟區。
歐盟監管框架的改革
歐盟委員會在2023年4月提出了立法提案,如果得到實施,將取代歐盟目前對所有藥品(包括治療罕見疾病和兒童的藥品)的監管框架。歐盟委員會已將立法提案提交給歐洲議會和歐洲理事會進行審查和批准。2023年10月,歐洲議會公佈了對立法提案提出修正案的報告草案,歐洲議會將對此進行辯論。一旦歐盟委員會的立法建議獲得批准(修改或不修改),它們將被採納為歐盟法律。
英國脱歐與英國的監管框架
英國於2020年1月31日正式脱離歐盟,英國與歐盟締結了貿易與合作協定或TCA,該協定自2021年1月1日起臨時適用,自2021年5月1日起正式適用。TCA包括有關藥品的具體條款,其中包括相互承認GMP,檢查醫藥產品的製造設施和發佈的GMP文件,但沒有規定大規模相互承認英國和歐盟的藥品法規。目前,英國已通過《2012年人類藥品條例》(經修訂)(根據《北愛爾蘭議定書》,歐盟監管框架目前繼續適用於北愛爾蘭)實施歐盟關於醫藥產品營銷、推廣和銷售的立法。因此,除《歐盟臨牀試驗規例》外,英國的規管制度與現行的歐盟藥物規例大致一致,但由於英國的規管制度獨立於歐盟,而《藥物管制法》亦沒有就英國和歐盟的藥物法例作出相互承認的規定,因此這些制度日後可能會有更大的分別。然而,儘管根據TCA沒有對歐盟製藥立法進行批發承認,但根據MHRA於2024年1月1日實施的上述新的國際認可框架,MHRA在考慮英國營銷授權的申請時,可能會考慮EMA(和某些其他監管機構)批准營銷授權的決定。
2023年2月27日,英國政府和歐盟委員會宣佈了一項原則性的政治協議,以一套新的安排取代北愛爾蘭議定書,即被稱為《温莎框架》的安排。這一新框架從根本上改變了《北愛爾蘭議定書》下的現有制度,包括英國對醫藥產品的監管。特別是,MHRA將負責批准所有運往英國市場(即大不列顛及北愛爾蘭聯合王國)的醫藥產品,而EMA將不再在批准運往北愛爾蘭的醫藥產品方面發揮任何作用。MHRA將授予在英國銷售的所有醫藥產品在英國範圍內的單一營銷授權,使產品能夠在英國各地以單一包裝和單一授權銷售。2023年3月24日,歐盟-英國聯合委員會批准了温莎框架,因此英國政府和歐盟將制定立法措施,使其成為法律。2023年6月9日,MHRA宣佈,温莎框架的藥品方面將從2025年1月1日起適用。
醫療改革
在美國,已經並將繼續有許多立法倡議來控制醫療成本。例如,2010年,ACA獲得通過,它極大地改變了政府和私營保險公司為醫療保健融資的方式,並繼續對美國製藥業產生重大影響。除其他事項外,ACA使生物產品受到較低成本生物仿製藥的潛在競爭,根據醫療補助藥品返點計劃增加製造商所欠的最低醫療補助返點,將返點計劃擴大到登記在醫療補助管理型保健組織中的個人,對某些品牌處方藥的製造商建立年費和税收,並創建新的聯邦醫療保險D部分覆蓋缺口折扣計劃,其中製造商必須同意在其覆蓋間隔期內向符合條件的受益人提供適用品牌藥物談判價格的70%的銷售點折扣,作為根據聯邦醫療保險D部分為製造商的門診藥物覆蓋的條件。
36
自《反腐敗法》頒佈以來,美國提出並通過了其他立法修改:
此外,支付方法可能會受到醫療保健立法和監管舉措的變化的影響,這可能會限制聯邦和州政府為醫療保健產品和服務支付的金額,並導致對某些藥品的需求減少或額外的定價壓力。2022年《降低通貨膨脹率法案》(IRA)中的幾項條款可能會對我們的業務產生不同程度的影響,其中包括從2025年起將聯邦醫療保險D部分受益人的自付上限降低至2,000美元;對聯邦醫療保險D部分下的某些藥物施加新的製造商財務責任;允許美國政府就某些高成本藥物和生物製品的B部分和D部分價格上限進行談判,而不存在仿製藥或生物相似競爭;要求公司為某些價格增長快於通脹的藥品向聯邦醫療保險支付回扣,以及推遲限制藥房福利經理可以收取費用的回扣規則。此外,根據IRA,孤兒藥物不受聯邦醫療保險藥品價格談判計劃的影響,但前提是它們有一個孤兒名稱,並且唯一批准的適應症是針對該疾病或狀況的。如果一種產品獲得了多個孤兒稱號或有多個批准的適應症,它可能沒有資格獲得孤兒藥物豁免。****的實施目前受到正在進行的訴訟,質疑****的醫療保險藥品價格談判計劃的合憲性。****對我們的業務和整個醫療行業的影響尚不清楚。
此外,美國在特殊藥品定價實踐方面的立法和執法興趣也越來越大。具體地説,最近有幾項美國總統行政命令、國會調查以及擬議和頒佈的聯邦和州立法,旨在提高藥品定價的透明度,降低聯邦醫療保險下處方藥的成本,審查定價與製造商患者計劃之間的關係,以及改革政府計劃的藥品報銷方法。
總裁·拜登還發布了多項行政命令,試圖降低處方藥成本。2023年2月,衞生與公眾服務部還發布了一份提案,以迴應總裁·拜登2022年10月的一項行政命令,其中包括一項擬議的處方藥定價模型,該模型將測試有針對性的醫療保險支付調整是否足以激勵製造商完成通過FDA加速審批路徑批准的藥物的驗證性試驗。儘管其中一些措施和其他擬議中的措施可能需要通過額外的立法獲得授權才能生效,拜登政府可能會撤銷或以其他方式改變這些措施,但拜登政府和國會都表示,他們將繼續尋求新的立法措施來控制藥品成本。
在州一級,立法機構越來越多地通過立法並實施旨在控制藥品定價的法規,包括價格或患者報銷限制、折扣、對某些產品准入和營銷成本披露的限制以及透明度措施,在某些情況下,旨在鼓勵從其他國家進口和批量購買。此外,地區醫療當局和個別醫院越來越多地使用招標程序來確定哪些藥品和供應商將包括在他們的處方藥和其他醫療保健計劃中。這可能會降低我們的最終需求
37
或對我們的藥品定價造成壓力,這可能對我們的業務、財務狀況、經營業績和前景造成負面影響。
第三方付款人對付款金額的法定價格控制或其他限制可能會損害我們的業務、財務狀況、經營業績和前景。此外,地區醫療保健當局和個別醫院越來越多地使用招標程序來確定哪些藥品和哪些供應商將被納入其處方藥和其他醫療保健計劃。這可能會減少對我們藥物的最終需求或對我們的藥物定價造成壓力,從而可能對我們的業務、財務狀況、經營業績和前景造成負面影響。
承保和報銷
在美國和其他國家的市場上,根據自己的病情接受處方治療的患者和提供處方服務的提供者通常依賴第三方付款人來報銷全部或部分相關的醫療費用。因此,即使候選產品獲得批准,該產品的銷售在一定程度上也將取決於第三方付款人,包括美國的聯邦醫療保險和醫療補助等政府健康計劃、商業健康保險公司和管理型醫療機構為該產品提供保險和建立足夠的報銷水平的程度。在美國,有關新藥報銷的主要決定通常由衞生與公眾服務部下屬的CMS機構做出。CMS決定新藥是否以及在多大程度上將在聯邦醫療保險下覆蓋和報銷,而私人付款人往往在很大程度上遵循CMS。第三方付款人之間沒有統一的藥品保險和報銷政策。因此,藥品的承保範圍和報銷範圍因付款人而異。確定第三方付款人是否將為產品提供保險的過程可以與設置價格或報銷率的過程分開,一旦保險獲得批准,付款人將為產品支付費用。第三方付款人越來越多地挑戰所收取的價格,審查醫療必要性,審查醫療產品和服務的成本效益,並實施控制以管理成本。第三方付款人的承保範圍和報銷可能取決於幾個因素,包括第三方付款人對產品使用情況的確定:
第三方付款人可以將承保範圍限制在批准清單上的特定產品,也稱為配方表,該清單可能不包括特定適應症的所有批准產品。藥品的淨價可能會通過政府醫療保健計劃或私人付款人要求的強制性折扣或回扣,以及未來任何限制從可能以低於美國價格銷售的國家進口藥品的法律的放鬆來降低。我們不能確保我們商業化的任何候選產品都可以得到報銷,如果可以報銷,報銷的級別也是如此。此外,許多製藥商必須計算並向政府報告某些價格報告指標,如平均銷售價格和最佳價格。在某些情況下,當這些指標沒有準確和及時地提交時,可能會適用處罰。此外,這些藥品的價格可能會通過政府醫療保健計劃要求的強制性折扣或回扣來降低。支付方法可能會受到醫療保健立法和監管舉措的影響。
為了確保任何可能被批准銷售的產品的保險和報銷,公司可能需要進行昂貴的藥物經濟學研究,以證明該產品的醫療必要性和成本效益,這將需要在獲得FDA或其他類似監管批准所需成本之外的額外支出。此外,公司可能還需要向購買者、私人健康計劃或政府醫療計劃提供折扣。儘管如此,候選產品可能不被認為是醫學上必要的或具有成本效益的。一旦產品獲得批准,第三方付款人不承保產品的決定可能會減少醫生的使用率,並對銷售、我們的運營和財務狀況產生實質性的不利影響。此外,第三方付款人決定為產品提供保險並不意味着將批准足夠的報銷率。此外,一個付款人決定為一種產品提供保險並不能保證其他付款人也會為該產品提供保險和報銷,而且不同的付款人的保險和報銷水平可能有很大不同。
控制醫療成本已成為聯邦、州和外國政府的優先事項,產品價格一直是這一努力的焦點。各國政府對實施成本控制方案表現出極大的興趣,包括價格控制、限制報銷和要求替代仿製藥。採取價格控制和成本控制措施,以及在現有控制和措施的管轄區採取更具限制性的政策,可能進一步限制公司從銷售商品中獲得的收入,
38
任何認可的產品。保險政策和第三方付款人報銷率可能隨時更改。即使公司或其合作者獲得監管批准的一種或多種產品獲得了有利的覆蓋範圍和報銷狀態,未來可能會實施不太有利的覆蓋範圍和報銷率。
此外,在一些外國國家,藥物的擬議價格必須獲得批准,然後才能合法上市。各國對藥品定價的要求差別很大。例如,歐洲聯盟為其成員國提供了限制國家醫療保險系統報銷的醫藥產品範圍和控制人用醫藥產品價格的選擇。為了獲得報銷或定價批准,其中一些國家可能需要完成臨牀試驗,將特定候選產品的成本效益與目前可用的療法進行比較。成員國可以批准藥品的特定價格,也可以對將藥品投放市場的公司的盈利能力採取直接或間接控制制度。我們無法保證任何對藥品實行價格控制或報銷限制的國家/地區將允許對我們的任何候選產品進行優惠的報銷和定價安排。從歷史上看,在歐洲聯盟推出的產品並不遵循美國的價格結構,一般價格往往要低得多。
其他醫療保健法律和合規性要求
醫療保健提供者、醫生和第三方付款人將在我們獲得市場批准的任何產品的推薦和處方中發揮主要作用。我們的業務運營以及目前或未來與第三方付款人、醫療保健提供者和醫生的任何安排可能會使我們面臨廣泛適用的欺詐和濫用以及其他醫療法律和法規,這些法律和法規可能會限制我們開發、營銷、銷售和分銷我們獲得上市批准的任何藥物的業務或財務安排和關係。在美國,這些法律包括但不限於州和聯邦反回扣、虛假聲明、醫生透明度以及患者數據隱私和安全法律法規,包括但不限於下述法律法規。
除其他事項外,聯邦反回扣法規禁止個人和實體直接或間接、公開或隱蔽地以現金或實物形式直接或間接、公開或隱蔽地索要、提供、支付、接受或提供任何報酬(包括任何回扣、賄賂或某些回扣),以誘使或獎勵個人推薦或購買、訂購或推薦任何商品或服務,而這些商品或服務可根據聯邦醫療保險和醫療補助等聯邦醫療計劃進行全部或部分付款。個人或實體不需要實際瞭解聯邦《反回扣法令》或違反該法令的具體意圖即可實施違法行為。違規行為將被處以民事和刑事罰款,每一次違規行為都將受到懲罰,外加最高三倍的薪酬、監禁和被排除在政府醫療保健計劃之外。此外,政府可以斷言,就民事虛假索賠法而言,包括因違反聯邦反回扣法規而產生的物品或服務的索賠構成虛假或欺詐性索賠。
聯邦民事和刑事虛假索賠法律,包括《民事虛假索賠法》(FCA),禁止個人或實體故意向聯邦政府提交或導致提交虛假、虛構或欺詐性的付款或批准索賠;故意對虛假或欺詐性索賠或向聯邦政府支付或轉移金錢或財產的義務作出、使用或導致作出或使用虛假陳述或記錄材料;或故意隱瞞或故意逃避或不當減少向聯邦政府支付金錢或財產的義務。根據FCA,即使製造商沒有直接向政府付款人提交索賠,如果他們被認為“導致”提交虛假或欺詐性索賠,他們也可能被追究責任。FCA還允許充當“告密者”的個人代表聯邦政府提起訴訟,指控違反FCA的行為,並分享任何金錢追回。當一個實體被確定違反了聯邦民事虛假索賠法案時,政府可以對每個虛假索賠處以民事罰款和懲罰,外加三倍的損害賠償,並將該實體排除在聯邦醫療保險、醫療補助和其他聯邦醫療保健計劃之外。
聯邦民事罰款法律對向聯邦醫療保險或州醫療保健計劃受益人提供或轉移或支付報酬等行為處以民事罰款,如果此人知道或應該知道這可能會影響受益人對聯邦醫療保險或州醫療保健計劃可報銷服務的特定提供者、從業者或供應商的選擇,除非有例外情況。
1996年《健康保險可攜性和責任法案》(HIPAA)規定,明知和故意執行計劃或試圖執行計劃,以詐騙任何醫療福利計劃,包括私人付款人,明知和故意挪用或竊取醫療福利計劃,故意阻礙對醫療保健違法行為的刑事調查,或偽造、隱瞞或掩蓋與提供或支付醫療福利、項目或服務有關的重大事實或作出任何重大虛假陳述,均應承擔刑事和民事責任。與聯邦反回扣法規類似,個人或實體可能被判違反HIPAA,而不實際瞭解該法規或沒有違反該法規的具體意圖。
39
經2009年《健康信息技術促進經濟和臨牀健康法》(HITECH)及其各自的實施條例修訂的HIPAA,除其他外,對覆蓋的實體及其各自的業務夥伴提出了與可單獨識別的健康信息的隱私和安全有關的具體要求,包括強制性合同條款和要求實施此類信息的技術保障措施。HITECH還創建了新的民事罰款等級,修訂了HIPAA,使民事和刑事處罰在某些情況下直接適用於商業夥伴,並賦予州總檢察長新的權力,可以向聯邦法院提起民事訴訟,要求損害賠償或禁制令,以執行聯邦HIPAA法律,並尋求與提起聯邦民事訴訟相關的律師費和費用。
作為ACA的一部分,頒佈的《醫生支付陽光法案》對某些藥品、設備、生物製品和醫療用品製造商提出了新的年度報告要求,這些製造商可以根據聯邦醫療保險、醫療補助或兒童健康保險計劃支付費用,用於向醫生(目前定義為包括醫生、牙醫、視光師、足科醫生和脊椎按摩師)、某些其他註冊保健從業者和教學醫院以及醫生及其直系親屬持有的所有權和投資權益進行某些付款和“價值轉移”。
此外,除其他事項外,我們還須遵守上述各項醫療法律和法規的州和國外等價物,其中一些法律和法規的範圍可能更廣,無論付款人是誰,都可以適用。美國許多州都採用了類似於聯邦反回扣法規和虛假索賠法案的法律,並可能適用於我們的商業實踐,包括但不限於研究、分銷、銷售或營銷安排,以及涉及由非政府付款人(包括私人保險公司)報銷的醫療項目或服務的索賠。此外,一些州已經通過法律,要求製藥公司遵守2003年4月總監察長辦公室關於製藥製造商的合規計劃指南和/或美國製藥研究和製造商關於與醫療保健專業人員相互作用的準則。幾個州還實施了其他營銷限制,或要求製藥公司向州政府進行營銷或價格披露,並要求藥品銷售代表註冊。對於遵守這些州的要求需要什麼是模稜兩可的,如果我們不遵守適用的州法律要求,我們可能會受到懲罰。
聯邦消費者保護法和不正當競爭法廣泛監管市場活動和可能損害消費者的活動。
類似的州和外國法律法規,包括但不限於州反回扣和虛假索賠法,可能比上述規定的範圍更廣,並可能適用於付款人。一些州法律要求製藥公司遵守制藥行業的自願合規指南和相關的聯邦政府合規指南;要求製藥商向醫生和其他醫療保健提供者報告與支付和其他價值轉移相關的信息;限制營銷行為或要求披露營銷支出和定價信息。在某些情況下,國家和外國法律可能會管轄健康信息的隱私和安全。這些數據隱私和安全法律可能在很大程度上彼此不同,並且通常不會被HIPAA搶先,這可能會使合規工作複雜化。
這些法律的範圍和執行都是不確定的,並受到當前醫療改革環境的快速變化的影響。聯邦和州執法機構最近加強了對醫療保健公司與醫療保健提供者之間互動的審查,這導致了醫療保健行業的一系列調查、起訴、定罪和和解。政府當局可能會得出結論,認為我們的業務做法不符合當前或未來涉及適用欺詐和濫用或其他醫療保健法律和法規的現行或未來法規、法規或判例法。如果我們的運營被發現違反了任何這些法律或任何其他可能適用於我們的相關政府法規,我們可能會面臨重大的民事、刑事和行政處罰、損害賠償、罰款、監禁、交還、被排除在政府資助的醫療保健計劃之外(如Medicare和Medicaid)、聲譽損害、額外的監督和報告義務,如果我們受到公司誠信協議或類似和解的約束,以解決有關違反這些法律的指控,並削減或重組我們的業務。如果我們預期與之有業務往來的任何醫生或其他醫療保健提供者或實體被發現不遵守適用法律,他們可能會受到類似的行動、處罰和制裁。確保商業安排符合適用的醫保法,以及對政府當局可能進行的調查做出迴應,可能會耗費時間和資源,並可能分散公司對其業務的注意力。
員工與人力資本資源
截至2023年12月31日,我們有42名員工。在這些員工中,有31人履行研發職能。我們沒有一個員工由工會代表,我們相信我們與員工保持着良好的關係。
我們的人力資本目標包括識別、招聘、留住、激勵和整合我們現有的和新的員工、顧問和顧問。我們股權和現金的主要目的
40
激勵計劃是通過授予基於股票和現金的薪酬獎勵來吸引、留住和獎勵人員,以通過激勵這些人盡其所能實現我們的目標來增加股東價值和公司的成功。
法律訴訟
有時,我們可能會捲入訴訟或其他法律程序。2022年12月15日,Periphagen致函通知我們其索賠,即我們未能根據我們與Periphagen於2019年12月9日簽訂的獨家許可協議(Periphagen許可協議),使用商業上合理的努力完成NT-3資產的人體概念驗證臨牀試驗。2023年1月13日,我們向美國仲裁協會提出了針對Periphagen的仲裁要求,要求聲明Periphagen在12月15日的信函中未能遵守Periphagen許可協議中的爭議和升級條款。2023年3月10日,Periphagen對我們的仲裁要求提出了答覆和反訴。在反訴中,Periphagen要求聲明我們沒有使用商業上合理的努力來完成NT-3 Asset的人體概念臨牀試驗,並要求聲明進一步延長時間在科學上或商業上都是不合理的。我們否認了Periphagen的反訴。
2023年6月7日,雙方簽署了一項獨家許可協議修正案,解決了爭端,並導致仲裁終止。
除了與Periphagen的訴訟外,我們目前沒有參與任何被我們的管理層認為可能對我們的業務產生重大不利影響的訴訟或法律程序。無論結果如何,由於辯護和和解成本、管理資源轉移和其他因素,訴訟可能會對我們的業務、財務狀況、運營結果和前景產生不利影響。
企業信息
我們於2003年6月在特拉華州註冊成立。2020年11月30日,公司更名為坎德爾治療公司。我們的主要執行辦事處位於肯德里克大街117號,Suite450,Needham,Massachusetts 02494。我們的電話號碼是(617)916-5445,電子郵件地址是Investors@andeltx.com。我們的互聯網網址是www.andeltx.com。我們的Form 10-K年度報告、Form 10-Q季度報告、Form 8-K當前報告,包括證物、委託書和信息聲明,以及根據1934年證券交易法(經修訂)第13(A)、14和15(D)條提交或提供的報告的修正案,在我們以電子方式向美國證券交易委員會(美國證券交易委員會)提交或提供此類材料後,在合理可行的範圍內儘快可通過我們網站的“投資者”部分免費獲取。我們網站上的信息不是本Form 10-K年度報告或我們任何其他證券備案文件的一部分,除非通過引用特別將其併入本文。此外,我們向美國證券交易委員會提交的文件可通過美國證券交易委員會的互動數據電子申請系統查閲,網址為www.sec.gov。我們在任何證券備案文件中作出的所有陳述,包括所有前瞻性陳述或信息,都是在包含該陳述的文件日期作出的,除非法律要求我們這樣做,否則我們不承擔或承擔任何更新這些陳述或文件的義務。
我們的行為準則、企業管治指引以及我們的審計委員會、薪酬委員會和提名及企業管治委員會的章程可在我們網站的“企業管治”部分查閲。
41
第1A項。風險因素。
由於下面描述的風險和不確定性,我們未來的經營業績可能與本10-K表格年度報告中描述的結果大不相同。在評估我們的業務時,您應該仔細考慮以下有關風險的信息。如果實際發生以下任何風險,我們的業務、財務狀況、經營業績和未來增長前景都可能受到重大不利影響。我們目前不知道或我們目前認為無關緊要的其他風險和不確定性也可能損害我們的業務運營。在這種情況下,我們普通股的市場價格可能會下跌。此外,我們不能向投資者保證我們的假設和預期將被證明是正確的。重要因素可能導致我們的實際結果與前瞻性陳述中表明或暗示的結果大不相同。有關受這些風險因素限制的一些前瞻性陳述的討論,請參閲“前瞻性陳述”。可能導致或促成這種差異的因素包括下文討論的那些因素。
與我們的業務、財務狀況和資本要求相關的風險
我們是一家生物製藥公司,經營歷史有限,到目前為止還沒有從產品銷售中獲得任何收入。
生物製藥產品開發是一項投機性很強的工作,涉及很大程度的風險。我們於2003年6月根據特拉華州的法律註冊成立。自成立以來,我們幾乎所有的努力和財務資源都集中在籌集資金和開發我們最初的候選產品上。到目前為止,我們主要通過向私募股權融資的外部投資者發行和出售我們的可轉換優先股,以及我們的普通股首次公開募股(IPO)的收益來為我們的運營提供資金。從我們成立到2023年12月31日,我們從這類交易中總共籌集了1.452億美元的毛收入。此外,在2022年2月,我們根據與SVB的貸款協議借入了2,000萬美元。截至2023年12月31日,我們的現金和現金等價物為3540萬美元。自成立以來,我們每年都出現淨虧損,截至2023年12月31日,我們累計虧損1.37億美元。截至2023年12月31日和2022年12月31日的年度,我們報告的淨虧損分別為3790萬美元和1880萬美元。我們沒有獲準商業銷售的產品,因此從未從產品銷售中獲得任何收入,我們預計在可預見的未來也不會這樣做。我們的任何候選產品都沒有獲得監管部門的批准,即使我們的臨牀開發工作取得了積極的數據,我們的候選產品也可能得不到監管部門的批准,也可能無法以允許我們盈利的價格成功推出和銷售。
我們預計,在未來幾年和可預見的未來,我們將繼續產生鉅額費用和運營虧損。我們之前的虧損,加上預期的未來虧損,已經並將繼續對我們的股東權益和營運資本產生不利影響。
自成立以來,我們已經發生了重大的運營虧損,並預計在可預見的未來我們還將繼續虧損。
我們幾乎所有的運營虧損都是由與我們的研發計劃相關的成本以及與我們的運營相關的一般和行政成本造成的。我們預計,隨着我們候選產品的臨牀試驗的開始和繼續,我們的研究和開發費用將大幅增加。此外,如果我們的候選產品獲得市場批准,我們將產生大量的銷售、營銷和製造費用。作為一家上市公司,我們正在招致與運營相關的額外成本。因此,在可預見的未來,我們預計將繼續遭受重大且不斷增加的運營虧損。由於與開發藥品相關的眾多風險和不確定性,我們無法預測未來虧損的程度或何時實現盈利(如果有的話)。即使我們真的實現了盈利,我們也可能無法維持或提高季度或年度的盈利能力。
我們未來的虧損數額是不確定的,我們的季度和年度經營業績可能會大幅波動,或者可能會低於投資者或證券分析師的預期,每一項都可能導致我們的股價波動或下跌。
42
這些因素的累積影響可能會導致我們的季度和年度經營業績出現巨大波動和不可預測。因此,在不同時期比較我們的經營業績可能沒有意義。這種變化性和不可預測性也可能導致我們無法滿足行業或金融分析師或投資者對任何時期的預期。如果我們的收入或經營業績低於分析師或投資者的預期,或低於我們向市場提供的任何預測,或者如果我們向市場提供的預測低於分析師或投資者的預期,我們普通股的價格可能會大幅下跌。即使我們已經滿足了我們可能提供的任何先前公開聲明的指導,這樣的股價下跌也可能發生。
我們沒有任何獲準商業銷售的產品,也沒有從產品銷售中獲得任何收入。
我們盈利的能力取決於我們創造收入的能力。到目前為止,我們還沒有從我們的候選產品中產生任何收入,我們預計在不久的將來也不會從產品銷售中產生任何收入。除非我們獲得市場批准,並開始銷售我們的一個或多個候選產品,否則我們預計不會產生可觀的收入。我們創造收入的能力取決於許多因素,包括但不限於,我們的能力:
43
如果我們不能及時或根本實現這些因素中的一個或多個,我們可能會遇到重大延誤或無法成功地將我們的候選產品商業化,這將對我們的業務造成嚴重損害。如果我們的候選產品得不到監管部門的批准,我們可能無法繼續運營。
人們對我們作為一家持續經營的企業繼續存在的能力有很大的懷疑。我們將需要籌集大量額外資金,這些資金可能無法以可接受的條件提供,或者根本不能提供。如果我們無法在需要的時候籌集資金,我們將被迫推遲、減少或取消一些產品開發計劃或商業化努力。
醫藥產品的開發是資本密集型的。我們目前正在通過一些潛在適應症的臨牀開發來推進我們的候選產品。我們預計,與我們正在進行的活動相關的費用將大幅增加,特別是當我們繼續正在進行的臨牀試驗或啟動未來的試驗,並對我們的候選產品進行研究和開發,並尋求市場批准的時候。此外,根據監管部門批准的情況,或者如果我們的任何候選產品獲得營銷批准,我們預計將產生與產品銷售、營銷、製造和分銷相關的鉅額商業化費用。如果我們選擇為我們的候選產品尋求更多的跡象和/或地理位置,或者以其他方式比我們目前預期的更快地擴張,我們可能還需要更快地籌集額外資金。此外,作為一家上市公司,我們還會產生額外的運營成本。因此,我們將需要獲得與我們的持續業務有關的大量額外資金。如果我們無法在需要時或在有吸引力的條件下籌集資金,我們將被迫推遲、減少或取消某些研發計劃或未來的商業化努力,並可能無法按預期擴大我們的業務或以其他方式利用我們的商機,這可能會對我們的業務、財務狀況和運營結果產生重大影響。
我們預計,我們現有的現金和現金等價物將足以為我們目前的運營計劃提供資金,直至2024年第四季度。然而,我們未來的資本需求將取決於許多因素,並可能因此而大幅增加,包括:
44
識別潛在候選產品並進行臨牀前開發測試和臨牀試驗是一個耗時、昂貴且不確定的過程,需要數年才能完成,我們可能永遠無法生成獲得上市批准和實現產品銷售所需的必要數據或結果。此外,我們的候選產品,如果獲得批准,可能無法取得商業成功。我們的商業收入(如有的話)將來自銷售我們預計多年內不會上市的產品(如有的話)。因此,我們將需要繼續依賴額外融資以實現我們的業務目標。
截至2023年12月31日,我們的現金和現金等價物為3540萬美元。根據我們目前的業務計劃,在我們截至2023年12月31日的年度財務報表發佈後的一年內,我們作為一家持續經營的企業繼續經營的能力存在很大疑問,我們需要籌集大量額外資金來完成所有正在進行的試驗並執行我們的業務計劃。我們可能無法獲得足夠的金額或我們可以接受的條款(如果有的話)。此外,任何融資條款可能會對我們股東的持股或權利產生不利影響,而我們發行額外證券(無論是股權或債務),或發行此類證券的可能性,可能會導致我們股票的市場價格下跌。此外,我們籌集額外資金的努力可能會轉移我們的管理層對他們日常活動的注意力,這可能會對我們及時開發我們的候選產品的能力產生不利影響。
出售額外的股權或可轉換證券將稀釋我們所有的股東。債務的產生將導致固定支付義務的增加,我們可能需要同意某些限制性公約,例如對我們產生額外債務的能力的限制,對我們獲取、銷售或許可知識產權的能力的限制,以及可能對我們開展業務的能力產生不利影響的其他運營限制。我們也可能被要求通過與合作伙伴的安排或其他方式尋求資金,而不是在其他情況下是可取的,並且我們可能被要求放棄對我們的一些技術或候選產品的權利或以其他方式同意對我們不利的條款,其中任何一項都可能對我們的業務、運營結果和前景產生重大不利影響。
如果我們不能及時獲得足夠的資金,我們可能被要求修改我們的業務計劃和戰略,並可能減少、推遲或中斷我們的一項或多項臨牀試驗、我們的研究努力、產品開發、未來的商業化努力,或者可能導致我們無法擴大我們的業務或以其他方式利用我們的商機。因此,我們的業務、財務狀況和經營結果可能會受到重大影響。
我們的公司重組和相關的裁員可能不會帶來預期的節省,可能會導致總成本和支出高於預期,並可能擾亂我們的業務。
2023年11月,我們進行了一次組織重組,大幅裁員。由於不可預見的困難、延誤或意外成本,我們可能無法完全或部分實現我們的重組努力帶來的預期收益、節省和成本結構的改善。如果我們不能從重組中實現預期的運營效率和成本節約,我們的運營業績和財務狀況將受到不利影響。此外,我們的重組計劃可能會擾亂我們的運營。例如,我們的裁員可能會產生意想不到的後果,例如在實施我們的業務戰略方面增加困難,包括留住我們的剩餘員工。我們的重組可能會導致與裁員相關的員工訴訟,這可能會代價高昂,並使管理層無法完全專注於業務。
未來的任何增長都將給管理層成員帶來重大的額外責任,包括需要確定、招聘、維持和整合更多的員工。由於我們的資源有限,我們可能無法有效地管理我們的運營或招聘和留住合格的人員,這可能會導致我們的基礎設施和運營中的薄弱環節,我們可能無法遵守法律和法規要求的風險,以及員工的流失和剩餘員工的生產率下降。例如,如果我們選擇繼續追求這些職能,裁員可能會對我們的臨牀、監管、技術運營和商業職能產生負面影響,這將對我們成功開發並最終將我們的候選產品商業化的能力產生負面影響。我們未來的財務業績以及開發我們的候選產品或額外資產的能力將在一定程度上取決於我們有效管理未來任何增長或重組的能力。
我們已經產生了債務,我們可能會產生額外的債務,這可能會對我們的財務狀況產生不利影響。
於2022年2月24日,吾等與作為貸款人(SVB)的硅谷銀行訂立貸款及擔保協議(貸款協議),根據該協議,SVB已同意向吾等提供本金總額高達2,500萬美元的定期貸款。我們的負債可能會對我們的股東產生重要後果。例如,它:
45
上述任何因素都可能對我們的業務、財務狀況、經營業績和現金流產生重大不利影響。貸款協議還包括某些契約,其中包括對額外債務、進行某些處置、在某些情況下支付股息以及進行某些收購和投資的限制。任何未能遵守貸款協議的條款、契諾及條件,可能會限制吾等動用額外定期貸款的能力,並可能導致貸款人有權加速吾等負債的該等協議下的違約事件,從而可能對吾等的業務、財務狀況及經營業績產生重大不利影響。
最近利率的上升增加了我們的借貸成本,並可能影響我們通過借款(如銀行信貸額度和公開或私人出售債務證券)獲得營運資金的能力,這可能會導致流動性降低、營運資本減少以及對我們業務的其他不利影響。
根據貸款協議,我們的未償債務的一部分按浮動利率計息。為了滿足我們的流動性需求,我們在一定程度上依賴於借入的浮動利率資金,未來可能會繼續這樣做。繼續提高利率可能會增加新債務和償還未償債務的成本,並可能對我們的運營業績、財務狀況、流動資金和現金流產生重大不利影響。
影響金融服務業的不利事態發展,例如涉及流動性、違約或金融機構或交易對手方不履行義務的實際事件或擔憂,可能會對我們當前和預計的業務運營以及我們的財務狀況和運營結果產生不利影響。
涉及流動性有限、違約、業績不佳或影響金融服務業或金融服務業其他公司的其他不利發展的實際事件,或對任何此類事件或其他類似風險的擔憂或傳言,過去和未來可能會導致整個市場的流動性問題。例如,2023年3月10日,SVB被加州金融保護和創新部關閉,後者指定聯邦存款保險公司(FDIC)為接管人。同樣,2023年3月12日,Signature Bank和Silvergate Capital Corp.分別被捲入破產管理程序。儘管財政部、美聯儲和聯邦存款保險公司的一份聲明指出,SVB的所有儲户在關閉僅一個工作日後就可以取用他們的所有資金,包括無保險存款賬户中的資金、信貸協議下的借款人、信貸協議下的借款人、信貸協議下的信用證和某些其他金融工具、簽名銀行或FDIC接管的任何其他金融機構,但可能無法提取其中未提取的金額。如果我們的任何貸款人或任何此類票據的交易對手被置於破產管理狀態,我們可能無法獲得此類資金。根據與SVB於2022年2月簽訂並於2023年6月修訂的2,500萬美元定期貸款安排,我們目前有一筆2,000萬美元的未償還貸款。根據貸款協議的條款,我們不再能夠借入500萬美元的額外總本金。此外,如果我們的任何客户、供應商或與我們有業務往來的其他方無法根據此類工具或與此類金融機構的貸款安排獲得資金,則這些各方向我們支付債務或達成要求向我們支付額外款項的新商業安排的能力可能會受到不利影響。在這方面,SVB信貸協議和安排的交易對手,如我們,以及第三方,如信用證受益人(其中包括),可能會受到SVB關閉的直接影響,而更廣泛的金融服務業對流動性的擔憂仍然存在不確定性。類似的影響過去也曾發生過,例如在2008-2010年金融危機期間。
通貨膨脹和利率的快速上升導致之前發行的利率低於當前市場利率的政府債券的交易價值下降。儘管美國財政部、聯邦存款保險公司和聯邦儲備委員會已經宣佈了一項計劃,向以金融機構持有的某些此類政府證券為擔保的金融機構提供高達250億美元的貸款,以降低出售此類工具可能造成的潛在損失的風險,但金融機構對客户提款的廣泛需求或金融機構對立即流動性的其他需求可能會超出此類計劃的能力。此外,不能保證美國財政部、聯邦存款保險公司和聯邦儲備委員會在未來其他銀行或金融機構關閉的情況下會提供未投保資金的渠道,或者他們會及時這樣做。
儘管我們認為有必要或適當地評估我們的銀行和客户關係,但我們獲得資金來源和其他信貸安排的機會可能會受到影響我們的因素的嚴重影響,這些因素可能會影響我們、與我們有直接信貸協議或安排的金融機構,或者整個金融服務業或整體經濟,這些資金來源和其他信貸安排足以為我們當前和預計的未來業務提供資金或資本。這些因素可能包括,除其他外,諸如流動性限制或失敗、履行各種金融、信貸或流動性協議或安排所規定的義務的能力、金融市場的中斷或不穩定。
46
服務行業或金融市場,或對金融服務行業公司前景的擔憂或負面預期。這些因素可能涉及與我們有金融或業務關係的金融機構或金融服務業公司,但也可能包括涉及金融市場或一般金融服務業的因素。
涉及一項或多項該等因素的事件或關注的結果可能包括對我們當前及預計業務營運以及我們的財務狀況及經營業績造成的各種重大及不利影響。 這些可能包括但不限於以下內容:
此外,投資者對美國或國際金融體系的擔憂可能會導致不太有利的商業融資條款,包括更高的利率或成本以及更嚴格的財務和運營契約,或者對獲得信貸和流動性來源的系統性限制,從而使我們更難以可接受的條款獲得融資,甚至根本不融資。除其他風險外,任何可用資金或現金和流動資金來源的減少都可能對我們履行運營費用、財務義務或履行其他義務的能力產生不利影響,導致違反我們的財務和/或合同義務,或導致違反聯邦或州工資和工時法。上述任何影響,或由上述因素或其他相關或類似因素導致的任何其他影響,可能對我們的流動資金、我們當前和/或預期的業務運營以及財務狀況和運營結果產生重大不利影響。
此外,宏觀經濟或金融服務業的任何進一步惡化都可能導致我們的客户或供應商的損失或違約,進而可能對我們當前和/或預期的業務運營以及運營結果和財務狀況產生重大不利影響。例如,客户可能在到期時無法付款、根據與我們的協議違約、破產或宣佈破產,或者供應商可能決定不再作為客户與我們打交道。此外,客户或供應商可能會受到上述任何流動性或其他風險的不利影響,這些風險可能會對我們造成重大不利影響,包括但不限於延遲獲得或失去獲得未投保存款的機會,或失去利用涉及陷入困境或破產的金融機構的現有信貸安排的能力。任何客户或供應商的破產或資不抵債,或任何客户未能在到期時付款,或客户或供應商的任何違約或違約,或任何重大供應商關係的喪失,都可能導致我們的重大損失,並可能對我們的業務產生重大不利影響。
產品開發相關風險
我們的業務依賴於我們最先進的候選產品CAN-2409以及CAN-3110和我們推進到臨牀的任何其他候選產品的成功。我們所有的候選產品都需要進一步的開發,然後我們才能尋求監管部門的批准並將產品投入商業使用。
我們目前沒有獲準商業銷售的產品,可能永遠無法開發出適銷對路的產品。我們預計,未來幾年我們的大部分努力和支出將致力於我們的CAN-2409計劃,這是我們目前最先進的候選產品。
如果我們開發的CAN-2409、CAN-3110或任何其他候選產品遇到安全或功效問題、開發延遲、監管問題或其他問題,我們的開發計劃和業務將受到嚴重損害。我們不能保證,即使我們獲得了監管部門的批准,我們開發的CAN-2409、CAN-3110或任何其他候選產品也將獲得監管部門的批准或成功商業化。如果我們被要求停止開發CAN-2409、CAN-3110或任何未來的候選產品,或者如果CAN-2409、CAN-3110或任何
47
如果未來的候選產品沒有獲得監管部門的批准或無法獲得重大的市場認可,我們實現盈利的能力將推遲多年,如果有的話。
此外,即使我們獲得監管部門對CAN-2409、CAN-3110或我們開發的任何其他候選產品的批准,我們仍將需要開發商業基礎設施、擴大我們的製造能力或發展與合作伙伴的關係以實現商業化,建立商業上可行的定價結構,並從第三方付款人那裏獲得保險和足夠的補償,包括政府醫療保健計劃。如果我們或任何未來的合作伙伴不能成功地將CAN-2409、CAN-3110或我們開發的任何其他候選產品商業化,我們可能無法產生足夠的收入來繼續我們的業務。
我們的臨牀前研究和臨牀試驗可能無法充分證明我們任何候選產品的安全性和有效性,這將阻礙或延遲開發、監管批准和商業化。
在我們的候選產品,包括CAN-2409、CAN-3110或我們開發的任何其他候選產品的商業銷售獲得監管部門的批准之前,我們必須通過漫長、複雜和昂貴的臨牀前研究和臨牀試驗,證明我們用於每個目標適應症的候選產品的安全性和有效性。在臨牀前研究和臨牀試驗過程中,失敗隨時可能發生,失敗的風險很高,因此我們可能永遠不會成功地開發出適銷對路的產品。我們可能進行的任何臨牀前研究或臨牀試驗可能不會證明獲得監管部門批准將我們的任何候選產品推向市場所需的安全性和有效性。如果我們正在進行的或未來的臨牀前研究和臨牀試驗的結果對於我們的候選產品的安全性或有效性沒有定論,如果我們沒有達到具有統計和臨牀意義的臨牀終點,或者如果我們的候選產品存在相關的安全問題,我們可能會阻止或推遲獲得此類候選產品的上市批准。在某些情況下,由於許多因素,同一候選產品的不同臨牀前研究和臨牀試驗的安全性或有效性結果可能存在顯著差異,包括方案中規定的試驗程序的變化、患者羣體的大小和類型的差異、臨牀試驗方案的變化和遵守以及臨牀試驗參與者的退學率。雖然我們目前正處於用於前列腺癌的CAN-2409的第三階段臨牀試驗,並處於CAN-3110的臨牀開發的早期階段,但與許多腫瘤學療法一樣,很可能存在與使用它們相關的副作用。我們的試驗結果可能會顯示副作用的嚴重程度和普遍性,這是不可接受的。在這種情況下,我們的試驗可能被暫停或終止,FDA或類似的外國監管機構可以命令我們停止進一步開發或拒絕批准我們的任何或所有目標適應症的候選產品。與治療相關的副作用也可能影響患者招募或納入患者完成臨牀試驗的能力,或導致潛在的產品責任索賠。任何這些情況都可能對我們的業務、財務狀況和前景造成重大損害。
我們的候選產品在臨牀試驗中引起了與靶標毒性相關的副作用,如發燒、寒戰、肌肉疼痛和其他流感樣症狀。在我們的臨牀試驗中觀察到的最常見的副作用是一過性的、注射部位相關的反應和流感樣症狀。具體症狀在很大程度上取決於腫瘤部位(注射部位)。參與我們試驗的患者經歷了3級和4級治療相關的副作用,包括血液異常。這些症狀包括髮熱、泌尿生殖系統毒性、天冬氨酸轉氨酶/丙氨酸氨基轉移酶(AST/ALT)升高、膽紅素升高、偏癱或言語障礙惡化(在對HGG的研究中)、失眠、頭痛、傷口併發症、膿胸、運動神經病症狀/體徵、一過性淋巴細胞減少、脱水伴腎功能不全、尿瀦留、腹痛加重和脂肪酶升高。相同副作用的不同命名法可用於不同的試驗(即淋巴細胞減少或淋巴細胞計數降低)。如果觀察到的靶標毒性達到不可接受的水平,或者如果我們的候選產品具有意想不到的特性,我們可能需要放棄它們的開發,或者將開發限制在更狹窄的用途或子羣中,在這些用途或子羣中,從風險-收益的角度來看,不良副作用或其他特性不那麼普遍、不那麼嚴重或更容易接受。此外,我們的候選產品可能會引起我們迄今尚未觀察到的不良副作用。許多化合物最初在治療癌症的早期測試中表現出了希望,但後來發現它們會產生副作用,阻止這種化合物的進一步發展。除了我們正在進行的CAN-2409和CAN-3110的臨牀試驗外,患者已經並可能繼續在擴大准入或“同情使用”計劃下接受CAN-2409和/或CAN-3110的治療。如果在該計劃中接受治療的患者的體驗與我們正在進行或計劃中的公司贊助的CAN-2409和/或CAN-3110試驗的結果不一致或不太有利,這可能會對人們對CAN-2409和/或CAN-3110、我們其他候選產品或我們業務的看法產生負面影響。此外,由於這些不一致或不利的結果,FDA或類似的外國監管機構可能會要求我們獲得並提交更多臨牀數據,這可能會推遲CAN-2409和/或CAN-3110或我們的其他候選產品的臨牀開發或上市批准。
我們不時宣佈或公佈的臨牀試驗的中期、主要和初步數據可能會隨着更多患者數據的獲得而發生變化,並受到監管審計和驗證程序的約束,這可能會導致最終數據發生重大變化。
48
有時,我們可能會公佈臨牀試驗的中期、背線或初步數據。我們可以決定在一定數量或百分比的患者入選後,或僅在全部隨訪期的一部分之後,但在試驗完成之前,對數據進行中期分析。同樣,在最終試驗結果完成之前,我們可能會報告主要和關鍵次要終端的背線或初步結果。隨着更多患者數據或分析的出現,我們臨牀試驗的初步、主要和中期數據可能會發生變化。我們臨牀試驗的初步、主要或中期數據不一定能預測最終結果,可能會隨着患者登記的繼續、更多患者數據的出現以及我們發佈最終臨牀試驗報告而導致一個或多個臨牀結果發生重大變化。這些數據還需遵守審計和核查程序,這可能會導致最終數據與我們以前公佈的初步數據有很大不同。因此,在最終數據可用之前,應謹慎地查看初步、中期和背線數據。與中期數據相比,最終數據的重大不利變化可能會嚴重損害我們的業務前景。
此外,包括監管機構在內的其他人可能不接受或同意我們的假設、估計、計算、結論或分析,或者可能以不同的方式解釋或權衡數據的重要性,這可能會影響特定計劃的價值、特定候選產品或產品的批准或商業化,以及我們公司的總體情況。此外,我們選擇公開披露的有關特定研究或臨牀試驗的信息通常是基於廣泛的信息,您或其他人可能不同意我們確定的重要信息或其他適當信息包括在我們的披露中。
如果我們報告的中期、背線或初步數據與更完整的結果不同,或者如果包括監管機構在內的其他人不同意得出的結論,我們為我們的候選產品獲得營銷授權並將其商業化的能力可能會受到損害,這可能會損害我們的業務、經營業績、前景或財務狀況。
我們在確定其他候選產品或適應症方面可能不會成功。由於我們的資源和資金有限,我們必須優先開發某些候選產品和適應症;這些決定可能被證明是錯誤的,可能會對我們的業務產生不利影響。
儘管我們打算探索其他治療機會,但除了我們目前正在開發的候選產品和適應症外,由於多種原因,我們可能無法確定用於臨牀開發的成功候選產品或其他適應症。如果我們不能確定其他潛在的候選產品或開發的適應症,我們的業務可能會受到實質性的損害。
為了開發我們計劃中的候選產品以獲得更多適應症,並確定新的候選產品和疾病靶點,研究計劃需要大量的技術、財政和人力資源,無論它們最終是否成功。我們的研究計劃最初可能在確定潛在適應症和/或候選產品方面表現出希望,但由於多種原因未能產生臨牀開發結果,包括:
由於我們的財力和人力資源有限,我們打算最初將重點放在研究項目和產品候選上,以獲得有限的適應症。因此,我們可能會放棄或推遲尋找其他候選產品或後來被證明具有更大商業潛力或更大成功可能性的其他跡象。我們的資源分配決策可能會導致我們無法利用可行的商業產品或有利可圖的市場機會。例如,在2022年11月在波士頓舉行的SITC年會上,由於CAN-3110在複發性HGG中的臨牀活性前景良好,我們做出了投資組合和資源決定,將CAN-3110優先用於複發性HGG,而不在HGG中進行CAN-2409的3期臨牀試驗。
因此,不能保證我們能夠為我們的候選產品確定更多的治療機會,或者通過內部研究計劃開發合適的潛在候選產品,這可能會對我們未來的增長和前景產生實質性的不利影響。我們可能會將我們的努力和資源集中在潛在的候選產品或其他最終被證明不成功的潛在計劃上。
我們候選產品的早期研究和試驗結果可能不能預測未來的試驗結果。
臨牀前研究和早期臨牀試驗的成功並不能確保以後的臨牀試驗也會成功。儘管在臨牀前研究和初步臨牀試驗中取得了進展,但臨牀試驗後期階段的候選產品可能無法顯示出預期的安全性和有效性特徵。隨着我們開始新的臨牀試驗並繼續我們的
49
對於正在進行的臨牀試驗,可能會出現可能暫停或終止此類臨牀試驗的問題。生物技術和製藥行業的一些公司在臨牀試驗中遭遇了重大挫折,即使在早期的臨牀前研究或臨牀試驗中取得了積極的結果。除其他外,這些挫折是由臨牀試驗進行期間的臨牀前發現以及在臨牀試驗中進行的安全性或有效性觀察造成的,包括以前未報告的不良事件。儘管在早期的研究和試驗中有任何潛在的有希望的結果,但我們不能確定我們不會面臨類似的挫折。此外,我們的臨牀前動物研究的結果,包括我們的腫瘤學小鼠研究和其他動物研究,可能不能預測人類臨牀試驗的結果。例如,我們處於臨牀前開發階段的腫瘤學候選產品可能在患者身上表現出與實驗室動物研究不同的化學和生物特性,或者可能以不可預見或有害的方式與人類生物系統相互作用。
此外,一些過去的、正在進行的和計劃中的臨牀試驗採用了“開放標籤”研究設計,包括我們的非小細胞肺癌試驗與ICI相結合。“開放標籤”臨牀試驗是指患者和研究人員都知道患者是否正在接受研究產品候選,或者是現有的批准藥物或安慰劑。最典型的是,開放標籤臨牀試驗只測試候選的研究產品,有時可能會在不同的劑量水平上進行測試。開放標籤臨牀試驗受到各種限制,可能會誇大任何治療效果,因為開放標籤臨牀試驗的患者在接受治療時是知道的。開放標籤臨牀試驗可能會受到“患者偏見”的影響,即患者認為他們的症狀已經改善,僅僅是因為他們意識到接受了實驗性治療。此外,被選中進行早期臨牀研究的患者通常包括最嚴重的患者,儘管採用了新的治療方法,但他們的症狀可能已經改善。此外,開放標籤臨牀試驗可能會受到“調查者偏見”的影響,即那些評估和審查臨牀試驗的生理結果的人知道哪些患者接受了治療,並可能在瞭解這一知識的情況下更有利地解釋治療組的信息。開放標籤試驗的結果可能不能預測我們的任何候選產品的未來臨牀試驗結果,當在使用安慰劑或主動對照的受控環境中進行研究時,我們包括開放標籤臨牀試驗。
我們的候選產品是基於一種治療癌症的新方法,這使得很難預測產品候選開發和隨後獲得監管批准的時間和成本(如果有的話)。
我們將研發工作集中在我們的CAN-2409和CAN-3110候選產品上,我們未來的成功在很大程度上取決於這些治療方法的成功開發。特別是,CAN-2409使用腺病毒來激活先天和獲得性免疫系統。據我們所知,目前還沒有FDA批准的使用腺病毒治療癌症的產品。
我們預計,我們候選產品的新穎性將在獲得監管部門批准方面帶來進一步的挑戰。到目前為止,全球範圍內或FDA批准的病毒免疫療法很少。雖然第一種溶瘤病毒免疫療法talimogene laherparepvec(Imlyic,Amgen)已獲得FDA批准,但監管機構審查的病毒免疫療法候選產品相對較少,如CAN-2409和CAN-3110。這可能會延長監管審查過程,增加我們的開發成本,並推遲或阻止我們候選產品的商業化。此外,任何獲得批准的病毒免疫療法都可能受到廣泛的批准後監管要求,包括與製造、分銷和推廣有關的要求。我們可能需要投入大量時間和資源來遵守這些要求。
FDA還可能要求一個專家小組,稱為諮詢委員會,審議支持許可的安全性和有效性數據的充分性。諮詢委員會的意見雖然沒有約束力,但可能會對我們根據完成的臨牀試驗獲得候選產品許可證的能力產生重大影響,因為FDA經常遵守諮詢委員會的建議。因此,我們候選產品的監管審批途徑可能是不確定的、複雜的、昂貴的和漫長的,可能無法獲得批准。
此外,我們的候選產品是活的基因修飾病毒,FDA、歐洲藥品管理局(EMA)和其他類似的外國監管機構和其他公共衞生機構,如疾病控制和預防中心以及參與臨牀研究的醫院,已經建立了額外的安全和傳染性規則和程序,這可能會為我們的媒介的開發、製造或使用設置額外的障礙。這些障礙可能會導致臨牀試驗的進行或獲得監管部門對我們候選產品的進一步開發、製造或商業化的批准的延遲。我們還可能在將我們的流程轉移給商業合作伙伴時遇到延遲,這可能會阻止我們完成臨牀試驗或將我們的候選產品及時或有利可圖地商業化(如果有的話)。
此外,在開發使用腺病毒的產品方面,歷史上的臨牀試驗經驗有限。此外,我們的臨牀試驗的設計和進行不同於以前在這一領域進行的臨牀試驗的設計和進行。特別是,美國和包括歐洲在內的其他司法管轄區的監管當局尚未就如何結合護理標準來衡量和證明新診斷的中高危患者侷限性前列腺癌的療效發佈明確的指導意見。
50
(SoC)。因此,我們的臨牀試驗的設計或結果不能令人滿意以支持上市批准的風險很大。例如,在我們研究CAN-2409治療前列腺癌的第三階段臨牀試驗中,終點是無病生存(DFS)終點,最終結果預計在最後一名患者接受治療24個月後,這一終點尚未在之前的試驗中使用,儘管存在SPA,監管機構可能仍不會接受其作為批准的基礎。即使這種新型終端在美國被接受為批准的基礎,我們也不能確定美國以外的監管機構是否會接受此類終端,或者不會要求我們進行額外的驗證研究,以支持此類終端在這些司法管轄區獲得批准的適宜性。
我們正在開發,未來也可能開發其他候選產品,與其他療法相結合,這將使我們面臨與任何前藥或任何與我們的候選產品結合使用的製劑相關的額外風險。
我們的CAN-2409候選產品正在開發中,將與前藥萬乃洛韋聯合使用,萬乃洛韋是一種口服小分子藥物,用於治療皰疹感染。在未來,我們可能會開發其他候選產品,與目前批准的一種或多種其他療法一起使用。即使我們開發的任何候選產品獲得上市批准或商業化,以便與其他現有療法聯合使用,我們仍將面臨FDA或類似的外國監管機構可能撤銷對與我們的候選產品聯合使用的療法的批准,或者這些現有療法可能出現安全性、有效性、製造或供應問題的風險。聯合療法通常用於癌症的治療,如果我們開發任何候選產品與其他藥物或癌症以外的適應症聯合使用,我們將面臨類似的風險。這可能導致我們自己的產品被從市場上撤下,或者在商業上不那麼成功。
如果FDA或類似的外國監管機構撤銷對這些其他藥物的批准,或者如果我們選擇結合我們開發的任何候選產品進行評估的藥物出現安全性、有效性、製造或供應問題,我們可能無法獲得批准。
我們還可能結合FDA或類似的外國監管機構尚未批准上市的一種或多種其他癌症療法來評估我們未來的候選產品。我們將不能將我們開發的任何候選產品與任何最終未獲得營銷批准的此類未經批准的癌症療法結合在一起銷售。此外,未經批准的療法面臨與我們目前正在開發和臨牀試驗的候選產品相同的風險,包括可能出現嚴重的不良反應、臨牀試驗延遲以及缺乏FDA批准。
免疫腫瘤學領域的負面發展,特別是病毒免疫療法,可能會損害公眾對我們任何候選產品的看法,並對我們的業務產生負面影響。
基於腺病毒或單純皰疹病毒的候選產品的商業成功將在一定程度上取決於公眾對免疫腫瘤學,特別是病毒免疫療法的接受程度。我們可能開發的CAN-2409、CAN-3110或任何其他基於腺病毒或HSV的候選產品的臨牀試驗中的不良事件,或其他開發類似產品的臨牀試驗和由此產生的宣傳,以及未來免疫腫瘤學領域可能發生的任何其他負面發展,包括與競爭對手的療法有關,都可能導致對我們可能開發的任何基於腺病毒或HSV的候選產品的需求減少。這些事件也可能導致暫停、中斷、臨牀暫停或修改我們的臨牀試驗。如果公眾的認知受到使用病毒免疫療法不安全的説法的影響,無論是與我們的療法或我們競爭對手的療法有關,我們的候選產品可能不會被公眾或醫學界接受,潛在的臨牀試驗對象可能會被勸阻參加我們的臨牀試驗。此外,國家或州政府對公眾負面看法的反應可能會導致新的立法或法規,可能會限制我們開發或商業化任何候選產品、獲得或維持監管批准或以其他方式實現盈利的能力。更具限制性的法律制度、政府法規或負面輿論將對我們的業務、財務狀況、前景和運營結果產生不利影響,並可能延遲或損害我們候選產品的開發和商業化,或對我們可能開發的任何產品的需求。因此,我們可能無法繼續或可能延遲執行我們的發展計劃。
我們的候選產品由修改過的病毒組成。與傳染病和免疫腫瘤學領域的其他非基於病毒的產品相比,基於病毒的其他免疫療法產品(如溶瘤病毒)臨牀試驗的不利發展可能會對我們的技術造成不成比例的負面影響。生物製藥行業未來的負面發展也可能導致政府更嚴格的監管,更嚴格的標籤要求,以及在我們產品的測試或批准方面可能的監管延遲。任何更嚴格的審查都可能推遲或增加我們的候選產品獲得市場批准的成本。
招募患者的困難可能會推遲或阻止我們候選產品的臨牀試驗,並最終推遲或阻止監管部門的批准。
確定並使患者有資格參與我們候選產品的臨牀試驗對我們的成功至關重要。我們臨牀試驗的完成時間部分取決於我們招募病人蔘與試驗的速度。
51
測試我們的候選產品,如果我們在登記時遇到困難,我們可能會在臨牀試驗中遇到延遲。如果我們無法根據FDA或類似的外國監管機構的要求,或根據需要為給定的試驗提供適當的統計數據,我們可能無法為我們的候選產品啟動或繼續臨牀試驗,並無法找到並招募足夠數量的合格患者參與這些試驗。特別是,由於我們專注於開發CAN-3110的腦癌患者,我們招募符合條件的患者的能力可能有限,或者由於符合條件的患者人數較少,登記速度可能比我們預期的要慢。此外,我們招收患者的能力可能會因未來的任何公共衞生危機而延遲,我們無法預測這種延遲的全部程度和範圍。
除了我們計劃的臨牀試驗的潛在目標人羣很少,特別是在腦癌方面,資格標準將進一步限制可用的試驗參與者池,因為我們將要求患者具有特定的特徵,如疾病進展的特定嚴重程度或階段,才能將他們包括在試驗中。此外,尋找符合條件的患者的過程可能被證明是昂貴的。我們也可能無法識別、招募和招募足夠數量的患者來完成我們的臨牀試驗,原因包括接受評估的候選產品的已知風險和好處、競爭療法和臨牀試驗的可用性和有效性、潛在患者的臨牀試驗地點的鄰近和可用性、患者腫瘤的基因測序信息的可用性以便我們能夠識別具有目標基因突變的患者以及醫生的患者轉介做法。如果患者出於任何原因不願參與我們的研究,招募患者、進行研究和獲得監管部門對潛在產品的批准的時間可能會推遲。患者的登記還取決於許多因素,包括:
由於合格臨牀研究人員的數量有限,我們預計將在一些競爭對手使用的相同臨牀試驗地點進行我們的一些臨牀試驗,這將減少可供我們在這些臨牀試驗地點進行臨牀試驗的患者數量。
如果我們延遲完成或終止任何候選產品的臨牀試驗,我們候選產品的商業前景將受到損害,我們從這些候選產品中獲得產品收入的能力可能會被推遲或阻止。
即使我們當前或未來的候選產品獲得了營銷批准,我們當前或未來的候選產品也可能無法獲得廣泛的市場接受,這將限制我們從他們的銷售中獲得的收入。
如果FDA或其他適用的監管機構批准,我們當前或未來候選產品的商業成功將取決於醫學界(包括醫生、患者和醫療保健付款人)對我們當前或未來候選產品的認知和接受程度。市場是否接受我們當前或未來的候選產品,如果獲得批准,將取決於許多因素,其中包括:
52
如果我們當前或未來的候選產品獲得批准,但沒有達到患者、醫生和付款人足夠接受的程度,我們可能無法從當前或未來的候選產品中產生足夠的收入來實現或保持盈利。在批准報銷之前,醫療保健付款人可能會要求我們證明我們當前或未來的候選產品除了治療這些目標適應症外,還會為患者提供遞增的健康益處。我們教育醫療界、患者組織和第三方付款人瞭解我們當前或未來候選產品的好處的努力可能需要大量資源,而且可能永遠不會成功。
我們面臨着激烈的競爭,這可能會導致其他人比我們更成功地發現、開發或商業化候選產品。
候選新產品的開發和商業化競爭激烈。在CAN-2409和CAN-3110方面,我們面臨來自主要製藥、專業製藥和生物技術公司等的競爭,在我們未來可能尋求開發或商業化的任何候選產品方面,我們也將面臨類似的競爭。我們在製藥、生物技術和其他相關市場展開競爭,這些市場開發用於癌症治療的免疫腫瘤療法。還有其他公司致力於開發治療癌症的病毒免疫療法,包括各種規模的大型製藥和生物技術公司的部門。已經商業化和/或正在開發癌症免疫腫瘤學療法的大型製藥和生物技術公司包括阿斯利康、百時美施貴寶、Gilead Sciences、默克、諾華、輝瑞、Regeneron和羅氏/基因泰克。
我們的競爭對手開發的一些產品和療法基於與我們的方法相同或相似的科學方法,包括對腺病毒和單純皰疹病毒的病毒免疫療法的使用。其他有競爭力的產品和療法則基於完全不同的方法。我們知道,Replimune、Amgen、ImmVira、Fergene和IconOVir等公司正在開發病毒免疫療法,這些療法可能對我們目標的適應症具有治療作用。潛在的競爭對手還包括學術機構、政府機構和其他公共和私人研究組織,這些組織開展研究、尋求專利保護併為研究、開發、製造和商業化建立合作安排。
與我們相比,我們的許多競爭對手或未來可能競爭的公司在研發、製造、臨牀前測試、進行臨牀試驗、獲得監管批准和營銷批准藥物方面擁有更多的財務資源和專業知識。製藥和生物技術行業的合併和收購可能導致更多的資源集中在我們數量較少的競爭對手身上。規模較小或處於初創階段的公司也可能成為重要的競爭對手,特別是通過與大型和成熟公司的合作安排。這些競爭對手還在招聘和留住合格的科學和管理人員、建立臨牀試驗場地和為我們的臨牀試驗招募受試者以及在獲取與我們的計劃互補或必要的技術方面與我們競爭。
53
如果我們的競爭對手開發和商業化比我們或我們的合作者可能開發的任何產品更安全、更有效、副作用更少或更少的產品,或者更方便或更便宜的產品,我們可能會看到我們的商業機會減少或消失。我們的競爭對手也可能比我們更快地獲得FDA或外國監管機構對其產品的批准,這可能會導致我們的競爭對手在我們能夠進入市場之前建立強大的市場地位。影響我們所有候選產品成功的關鍵競爭因素,如果獲得批准,可能是它們的療效、安全性、便利性和價格(如果需要)、生物相似或仿製藥競爭的水平以及政府和其他第三方付款人是否可以報銷。
與政府監管和我們的候選產品商業化相關的風險
FDA和類似的外國監管機構的監管審批過程宂長、耗時,而且本質上是不可預測的。如果我們不能獲得或在獲得所需的監管批准方面遇到延誤,我們將無法像預期的那樣將CAN-2409、CAN-3110和未來的候選產品商業化,我們的創收能力可能會受到實質性損害。
獲得FDA和類似的外國監管機構批准所需的時間是不可預測的,但通常需要在臨牀試驗開始後多年,並取決於許多因素,包括監管機構的相當大的酌情決定權。此外,批准政策、法規或獲得批准所需的臨牀數據的類型和數量可能會在候選產品的臨牀開發過程中發生變化,並可能因司法管轄區而異。這些法規要求可能要求我們修改我們的臨牀試驗方案,包括遵守我們從FDA收到的任何適用的SPA方案;進行額外的臨牀前研究或臨牀試驗,可能需要監管或獨立的IRB批准;或以其他方式導致申請獲得批准或拒絕的延遲。任何延遲獲得或未能獲得所需批准的情況都可能對我們從特定候選產品獲得收入的能力產生重大不利影響,這可能會對我們的業務、財務狀況、運營業績、股票價格和前景造成重大損害。
監管機構在審批過程中擁有相當大的自由裁量權,可以拒絕接受任何申請,也可以決定我們的數據不足以獲得批准,需要進行額外的臨牀前、臨牀或其他研究。此外,對從臨牀前和臨牀試驗中獲得的數據的不同解釋可能會推遲、限制或阻止候選產品的上市批准。監管批准所需的臨牀前研究和臨牀試驗的數量和類型也因候選產品、候選產品針對的疾病或情況以及適用於任何特定候選產品的法規而異。批准政策、法規或獲得批准所需的臨牀數據的類型和數量可能會在候選產品的臨牀開發過程中發生變化,並可能因司法管轄區而異,對從臨牀前研究或臨牀試驗獲得的數據可能存在不同的解釋,其中任何一種解釋都可能導致批准的延遲或限制或不批准申請的決定。CAN-2409、CAN-3110和未來的候選產品可能永遠不會獲得我們開始產品銷售所需的適當監管批准。
如果我們在獲得批准方面遇到延誤,如果我們未能獲得對CAN-2409、CAN-3110或任何未來候選產品的監管批准,或者如果候選產品的標籤不包括該候選產品成功商業化所必需或需要的標籤聲明,則該候選產品的商業前景可能會受到損害,我們從該候選產品獲得收入的能力可能會受到實質性損害。
CAN-2409、CAN-3110或未來的候選產品可能會導致不良副作用或具有其他特性,這些特性可能會推遲或阻止其監管批准,限制已批准標籤的商業形象,或在上市批准後導致重大負面後果(如果有的話)。由CAN-2409、CAN-3110和未來的候選產品引起的嚴重不良事件或不良副作用可能會導致我們、IRBs和其他審查實體或監管機構中斷、推遲或停止臨牀試驗,並可能導致更嚴格的標籤或FDA或類似外國監管機構推遲或拒絕監管批准。例如,如果在臨牀或臨牀前測試中發現不良副作用導致對新療法的安全性提出擔憂,FDA或類似的外國監管機構可能會命令我們停止進一步開發,拒絕批准候選產品,或在就是否批准候選產品做出最終決定之前發出信函,要求提供更多數據或信息。FDA或類似的外國監管機構,或IRBs和其他審查實體,也可能要求或我們可能自願制定在臨牀開發期間管理不良事件的策略,其中可能包括對我們的登記標準的限制、停止標準的使用、對研究設計的調整,或由數據監控委員會監控安全數據等策略。例如,參加我們正在進行的CAN-2409和CAN-3110臨牀試驗的患者經歷了輕到中度的不良事件,主要包括流感樣症狀和注射部位反應。針對這些不良事件,我們採取了預防措施,包括靜脈輸液、止吐劑和退熱藥。FDA或類似的外國監管機構對額外數據或信息的要求也可能導致對CAN-2409、CAN-3110和未來產品候選產品的批准大幅延誤。
此外,臨牀試驗的本質是利用潛在患者羣體的樣本。在患者數量和暴露時間有限的情況下,候選產品罕見而嚴重的副作用可能只會暴露出來
54
當更多的患者接觸到該候選產品時,或者當患者接觸更長時間時。
由CAN-2409、CAN-3110或任何未來候選產品引起的不良副作用還可能導致FDA或類似的外國監管機構拒絕對任何或所有目標適應症的監管批准,或在我們的產品標籤中包含不利信息,例如對產品可能用於營銷或分銷的指定用途的限制、具有重大安全警告的標籤(包括盒裝警告、禁忌症和預防措施)、沒有成功商業化所必需或可取的聲明的標籤,或可能導致昂貴的上市後測試和監督要求或其他要求,包括提交風險評估和緩解策略(REMS),以監控產品的安全性或有效性,從而阻止我們將CAN-2409、CAN-3110和未來的候選產品商業化併產生收入。任何此類限制或限制都可能同樣影響我們可能獲得的CAN-2409和CAN-3110的任何補充營銷批准。不良副作用可能會限制任何經批准的產品的潛在市場,或可能導致對製造工藝的限制,產品的銷售和營銷中斷,或撤回產品批准。我們還可能被起訴,並對給患者造成的傷害承擔責任,或者受到罰款、禁令或施加民事或刑事處罰。
如果CAN-2409、CAN-3110和未來的候選產品與嚴重的不良事件或不良副作用相關,或者具有意想不到的特性,我們可能需要放棄開發或將該候選產品的開發限制在某些用途或子羣中,在這些用途或子羣中,從風險-收益的角度來看,不良副作用或其他特徵不太普遍、不太嚴重或更容易接受。與治療相關的副作用可能會影響患者招募或納入患者完成試驗的能力,或導致潛在的產品責任索賠。這些情況中的任何一種都可能對我們的業務、財務狀況、經營結果、股價和前景造成實質性損害。
FDA就CAN-2409在中高風險患者中新診斷的侷限性前列腺癌的關鍵第三階段臨牀試驗的研究設計同意進行特別協議評估,但不保證監管審查的任何特定結果,包括最終批准,也可能不會導致成功的審查或批准過程。
我們已經獲得FDA的同意,同意我們的關鍵的3期臨牀試驗的設計和規模,CAN-2409用於新診斷的中高風險患者的侷限性前列腺癌,結合SoC通過特殊方案評估(SPA)。FDA的SPA程序旨在通過允許FDA評估某些臨牀或動物研究的擬議設計和規模,包括旨在形成確定候選產品療效的主要基礎的臨牀試驗,來促進FDA對藥物和生物製品的審查和批准。根據臨牀試驗贊助商的具體要求,FDA將對該方案進行評估,並回答贊助商關於方案設計以及科學和監管要求的問題。FDA的目標是在收到請求後45天內完成SPA審查。FDA最終評估試驗方案設計的特定元素,如進入標準、劑量選擇、終點和/或計劃分析是否可接受,以支持監管機構就所研究適應症的有效性批准該產品。FDA和贊助商之間關於SPA的所有交流必須清楚地記錄在SPA信函或贊助商和FDA之間的會議記錄中。
儘管FDA可能會同意SPA,但SPA協議並不保證產品獲得批准。即使FDA同意在SPA流程下審查的協議中提出的設計、執行和分析,FDA也可以在某些情況下撤銷或更改其協議。特別是,如果出現在SPA協議簽訂時尚未認識到的公共衞生問題,出現其他有關產品安全或療效的新的科學問題,贊助公司未能遵守商定的試驗方案,或贊助商在SPA變更請求中提供的相關數據、假設或信息,或被發現為虛假或遺漏相關事實,則SPA協議對FDA不具約束力。雖然我們已經為我們的3期臨牀試驗獲得了SPA協議,但我們隨後對協議進行了微小的修改,還沒有獲得與修改後的協議相關的SPA修正案。
此外,即使在SPA協議最終敲定後,SPA協議也可能被修改,這種修改將被認為對FDA審查部門具有約束力,除非在上述情況下,如果FDA和贊助商書面同意修改該協議。一般説來,這樣的修改是為了改進研究。FDA在解釋SPA協議的條款以及作為SPA協議主題的任何研究的數據和結果時,保留了很大的自由度和自由裁量權。
此外,如果FDA撤銷或改變其在SPA下的協議,或者對從臨牀試驗收集的數據的解釋與我們不同,FDA可能認為這些數據不足以支持監管部門批准CAN-2409用於前列腺癌的申請。
55
FDA的快速通道指定,即使授予了CAN-2409和CAN-3110,或者如果針對任何其他未來的候選產品,可能不會導致更快的開發或監管審查或批准過程,也不會增加我們的候選產品獲得上市批准的可能性。
如果一種藥物或生物製劑用於治療嚴重或危及生命的疾病,而該產品顯示出解決這種疾病未得到滿足的醫療需求的潛力,則產品贊助商可以申請FDA針對特定適應症的快速通道指定。我們已獲準使用CAN2409作為快車道,用於:(1)結合放射治療治療侷限性原發性前列腺癌,以提高局部控制率;(2)用萬乃洛韋聯合培布羅珠單抗治療對一線PD-(L)1抑制劑治療耐藥且無激活分子驅動因素突變的III/IV期非小細胞肺癌患者,以提高存活率或延緩病情進展;以及(3)用前體藥物(Valacylovir)治療胰腺癌,以提高總體存活率。CAN-3110還被批准用於治療復發的高級別膠質瘤患者的快速通道,以提高總體存活率。我們還可能根據需要為我們未來的某些候選產品尋求快速通道認證。然而,不能保證FDA會將這一地位授予CAN-3110、CAN-2409或我們建議的任何候選產品。根據FDA提供的政策和程序,快速通道開發產品的贊助商提交的營銷申請可能有資格優先審查,但快速通道指定並不保證任何此類資格或最終獲得FDA的上市批准。FDA擁有廣泛的自由裁量權,是否授予快速通道認證,因此,即使我們認為特定的候選產品有資格獲得這種認證,也不能保證FDA會決定授予它。即使我們已經獲得了CAN-2409和CAN-3110的快速通道認證,或者即使我們獲得了未來產品候選的快速通道認證或CAN-2409和CAN-3110中的其他適應症,我們也可能不會經歷比傳統FDA程序更快的開發過程、審查或批准,而且獲得快速通道認證並不能保證FDA的最終批准。此外,如果FDA認為我們的臨牀開發計劃的數據不再支持快速通道指定,它可能會撤回該指定。此外,FDA可以隨時撤回任何快速通道的指定。
FDA的突破性治療指定,即使授予我們的任何候選產品,也可能不會導致更快的開發或監管審查或批准過程,也不會增加我們的候選產品獲得上市批准的可能性。
我們可能會為我們未來的一些或所有候選產品尋求突破性的治療指定。突破性療法是指旨在單獨或與一種或多種其他藥物或生物製品聯合治療嚴重或危及生命的疾病或狀況的藥物或生物製劑,初步臨牀證據表明,該藥物或生物製劑可能在一個或多個臨牀重要終點顯示出比現有療法有實質性改善的效果。被指定為突破性療法的候選產品的贊助商有資格獲得FDA關於開發高效藥物開發計劃的更深入的指導,有高級管理人員參與的組織承諾,以及滾動審查和優先審查的資格。被FDA指定為突破性療法的藥物和生物製品也可能有資格獲得其他快速批准計劃,包括加速批准。
指定為突破性療法是FDA的自由裁量權。因此,即使我們認為我們的候選產品之一符合被指定為突破性療法的標準,FDA也可能不同意,而是決定不做出這樣的指定。在任何情況下,與開發和考慮批准的未獲得突破性治療指定的候選產品相比,收到候選產品的突破性治療指定可能不會導致更快的開發過程、審查或批准,也不能確保FDA的最終批准。此外,即使我們的一個或多個候選產品符合突破性療法的條件,FDA稍後也可能決定該產品不再符合資格條件。因此,即使我們可能為CAN-2409、CAN-3110或我們未來用於治療各種癌症的部分或全部候選產品尋求突破性的治療指定,也不能保證我們將獲得突破性的治療指定。
FDA的加速批准,即使批准了我們當前或未來的某些候選產品,也可能不會帶來更快的開發或監管審查或審批過程,也不會增加我們的候選產品獲得上市批准的可能性。
我們可能會使用FDA的加速審批程序尋求對我們當前或未來的某些候選產品的批准。如果一種產品治療嚴重或危及生命的疾病,通常比現有的治療方法提供有意義的優勢,並對合理地可能預測臨牀益處的替代終點產生影響,則該產品可能有資格獲得加速批准。作為批准的一項條件,FDA可能要求獲得加速批准的產品的贊助商進行充分和良好控制的上市後臨牀試驗。這些驗證性試驗必須在贊助商盡職調查的情況下完成,根據2022年食品和藥物綜合改革法案(FDORA),FDA被允許酌情要求此類試驗在批准之前或在批准加速批准之日後的特定時間段內進行。FDORA還要求贊助商每180天向FDA發送此類驗證性試驗狀態的最新信息,包括實現登記目標的進展情況,以及
56
FDA必須立即公開發布這一信息。FDORA還賦予FDA更大的權力,如果贊助商未能及時進行此類試驗,向FDA發送必要的更新,或者如果此類批准後研究未能驗證藥物的預期臨牀益處,FDA可以迅速撤回對獲得加速批准的藥物或生物製劑的批准。根據FDORA,FDA有權對沒有進行盡職調查的公司採取行動,例如對沒有進行任何批准後確認性試驗或及時向該機構提交進展報告的公司開出罰款。此外,除非FDA另行通知,否則FDA目前要求對獲得加速批准的產品的促銷材料進行預先批准,這可能會對該產品的商業推出時間產生不利影響。即使我們確實獲得了加速批准,我們也可能不會經歷更快的開發或監管審查或批准過程,並且獲得加速批准並不能保證產品的加速批准最終將轉換為傳統的FDA批准。
我們可能會尋求我們的候選產品進入實時腫瘤學審查(RTOR)。該計劃可能不會加快監管審查或審批過程,也不會增加我們的候選產品(S)獲得上市批准的可能性。
參與區域發展研究是自願的。我們接受RTOR並不保證或影響我們的申請獲得批准,我們的申請與不包括在RTOR中的申請一樣受到相同的法定和監管要求的批准。雖然選擇RTOR的應用程序已獲得早期批准,但即使我們的應用程序被選擇RTOR,情況可能並非如此。如果FDA在任何時候確定我們參與RTOR(如果選擇)不再合適,FDA可以撤銷我們的接受,並指示我們遵循常規提交程序進行上市批准。
即使我們的開發工作成功,我們也可能無法在美國或其他司法管轄區獲得對CAN-2409、CAN-3110或任何未來候選產品的監管批准,這將阻止我們將CAN-2409、CAN-3110和未來的候選產品商業化。即使我們獲得了對CAN-2409、CAN-3110和未來候選產品的監管批准,任何此類批准都可能受到限制,包括關於批准的適應症或患者羣體的限制,這可能會削弱我們成功將CAN-2409、CAN-3110或任何未來候選產品商業化的能力。
在我們獲得FDA或類似的外國監管機構的監管批准之前,我們不被允許營銷、推廣或銷售CAN-2409、CAN-3110或任何未來的候選產品,而且我們可能永遠也不會獲得這樣的監管批准。為了獲得上市批准,需要向監管機構提交廣泛的臨牀前和臨牀數據以及每種治療適應症的支持信息,以確定候選產品對該適應症的安全性和有效性。獲得上市批准還需要向監管機構提交有關產品製造過程的信息,並由監管機構檢查製造設施和臨牀試驗地點。如果我們沒有得到FDA和類似的外國監管機構對任何CAN-2409、CAN-3110和未來候選產品的批准,我們將無法在美國或其他司法管轄區將此類候選產品商業化。如果在任何司法管轄區內,在獲得批准和將CAN-2409、CAN-3110和未來的候選產品商業化方面出現重大延誤,我們的業務、財務狀況、運營結果、股票價格和前景都將受到嚴重損害。即使CAN-2409、CAN-3110和未來的候選產品獲得批准,他們也可能:
我們之前沒有向FDA提交過生物製品許可證申請(BLA),或向可比的外國監管機構提交過類似的營銷申請,針對CAN-2409、CAN-3110或任何候選產品,我們不能保證我們最終會成功地獲得監管部門的批准,這些聲明是成功營銷所必需的或可取的。
產品候選製造或配方的更改可能會導致額外的成本或延遲。
隨着候選產品從臨牀前研究到後期臨牀試驗的批准和商業化,開發計劃的各個方面,如製造方法和配方,在努力優化過程和結果的過程中進行更改是很常見的。這些變化中的任何一個都可能導致CAN-2409、CAN-3110或任何未來的候選產品表現不同,並影響計劃中的臨牀試驗或使用改變後的材料進行的其他未來臨牀試驗的結果。第三方製造商和製造流程的改變也可能需要額外的測試,或通知FDA或類似的外國監管機構,或獲得其批准。由於臨牀規模製造和商業規模製造業務的發展,這些變化可能會進一步推遲。這可能會推遲臨牀試驗的完成,需要進行銜接的臨牀試驗或研究,需要重複一個或多個臨牀試驗,增加臨牀試驗成本,
57
批准CAN-2409、CAN-3110和未來的候選產品,並危及我們開始產品銷售和創造收入的能力。
美國食品和藥物管理局、美國證券交易委員會和其他政府機構的資金不足可能會阻礙他們聘用和留住關鍵領導層和其他人員的能力,阻止新產品和服務的及時開發或商業化,或者以其他方式阻止這些機構履行我們業務運營可能依賴的正常業務職能,這可能會對我們的業務產生負面影響。
FDA審查和批准新產品的能力可能受到各種因素的影響,包括政府預算和資金水平、僱用和留住關鍵人員以及接受用户費用支付的能力,以及法律、法規和政策變化。因此,該機構的平均審查時間近年來一直在波動。此外,政府為美國證券交易委員會和我們的業務可能依賴的其他政府機構提供的資金,包括那些為研發活動提供資金的機構,都受到政治進程的影響,而政治進程本身就是不穩定和不可預測的。
FDA和其他機構的中斷也可能會減緩新產品候選產品被必要的政府機構審查和/或批准所需的時間,這將對我們的業務產生不利影響。例如,在過去的幾年裏,美國聯邦政府已經關閉了幾次,某些監管機構,如食品和藥物管理局和美國證券交易委員會,不得不讓食品和藥物管理局、美國證券交易委員會和其他政府僱員休假,並停止關鍵活動。如果政府長期停擺,可能會嚴重影響FDA及時審查和處理我們提交的監管文件的能力,這可能會對我們的業務產生實質性的不利影響。美國聯邦政府可能停擺也可能增加全球經濟和金融市場的不確定性和波動性,這可能會對我們的業務產生負面影響。此外,未來政府關門可能會影響我們進入公開市場並獲得必要資本的能力,以便適當地資本化和繼續我們的業務。
即使CAN-2409、CAN-3110或任何未來的候選產品獲得監管批准,我們也將受到持續義務和持續的監管審查的約束,這可能會導致大量額外費用,並限制我們製造和營銷產品的方式。
我們可能獲得上市批准的任何候選產品都將受到FDA和類似外國監管機構的廣泛和持續的要求和審查,包括與該產品的製造過程、批准後的臨牀數據、標籤、包裝、分銷、不良事件報告、儲存、記錄、出口、進口、廣告、營銷和促銷活動相關的要求。這些要求還包括為我們在批准後進行的任何臨牀試驗提交安全和其他上市後信息,包括生產偏差和報告、註冊和上市要求、支付年費、繼續遵守當前的良好製造規範(CGMP)、與製造、質量控制、質量保證和相應的記錄和文件維護相關的要求以及良好臨牀實踐(GCP)。
FDA和類似的外國監管機構將繼續密切監測任何產品的安全狀況,即使在批准後也是如此。如果FDA或類似的外國監管機構在批准任何CAN-2409、CAN-3110和未來的候選產品後意識到新的安全信息,他們可能會撤回批准,發佈公共安全警報,要求更改標籤或建立REMS或類似戰略,對產品的指示用途或營銷施加重大限制,或對可能代價高昂的批准後研究或上市後監督施加持續要求。任何此類限制都可能限制該產品的銷售。
我們和我們的任何供應商或合作伙伴,包括我們的CDMO,可能會受到FDA的定期突擊檢查,以監控和確保遵守cGMP和其他FDA監管要求。製造商和製造商的工廠必須符合FDA和類似的外國監管機構的廣泛要求,包括確保質量控制和製造程序符合cGMP法規和適用的產品跟蹤和追蹤要求。申請持有人必須進一步通知FDA,並根據變更的性質,獲得FDA對產品和製造變更的預先批准。
此外,後來發現以前未知的不良事件,或產品不如之前想象的有效,或任何產品、製造商或製造工藝存在其他問題,或在批准前後未能遵守監管要求,可能會產生各種負面結果,包括:
58
這些事件中的任何一項都可能阻止我們實現或保持市場對任何特定產品的接受程度,或者可能大幅增加將該產品商業化的成本和費用,這反過來可能會推遲或阻止我們從其營銷和銷售中獲得大量收入。這些事件中的任何一項都可能進一步對我們的運營和業務產生其他重大和不利影響,並可能對我們的業務、財務狀況、運營結果、股票價格和前景產生不利影響。
此外,FDA的政策或類似的外國監管機構的政策可能會改變,並可能對我們獲得上市批准的任何候選產品施加廣泛和持續的監管要求和義務。如果我們緩慢或無法適應現有要求的變化或採用新的要求或政策,或者如果我們無法保持監管合規,我們可能會失去我們可能獲得的任何營銷批准,並受到監管執法行動的影響,這將對我們的業務、前景和實現或維持盈利的能力產生不利影響。
FDA或類似的外國監管機構的監管批准僅限於那些已批准的特定適應症和條件,如果我們被確定為促進將我們的產品用於未經批准的或“標籤外”用途,或以與批准的標籤不一致的方式使用,導致我們的聲譽和業務受到損害,我們可能會受到鉅額罰款、刑事處罰、禁令或其他執法行動。
我們必須遵守任何獲得上市批准的候選產品的廣告和促銷要求。與治療學有關的宣傳溝通受到各種法律和監管限制,並受到FDA、司法部、衞生與公眾服務部監察長辦公室(HHS)、州總檢察長、國會議員和公眾的持續審查。當FDA或類似的外國監管機構發佈對候選產品的監管批准時,監管批准僅限於產品被批准用於的特定用途和適應症。如果我們不能獲得FDA對CAN-2409、CAN-3110和未來候選產品的預期用途或適應症的批准,我們可能不會將它們用於這些適應症和用途,即所謂的標籤外用途,我們的業務、財務狀況、運營結果、股票價格和前景將受到實質性損害。我們還必須充分
59
證實我們對任何產品的任何聲明,包括將這些產品與其他公司的產品進行比較的聲明,並必須遵守FDA關於促銷和廣告內容的嚴格要求。
醫生可以選擇為產品標籤中沒有描述的用途以及不同於在臨牀試驗中測試並經監管機構批准的用途開出產品處方。美國的監管機構一般不會限制或規範醫生在行醫過程中選擇治療的行為。然而,監管機構確實限制了生物製藥公司關於標籤外使用的溝通。
如果我們被發現非法推廣任何CAN-2409、CAN-3110和未來的候選產品,我們可能會面臨重大責任和政府罰款。FDA和其他機構積極執行有關產品推廣的法律法規,特別是那些禁止推廣標籤外用途的法律法規,被發現不當推廣產品的公司可能會受到重大制裁。聯邦政府已對涉嫌不當促銷的公司處以鉅額民事和刑事罰款,並禁止幾家公司從事標籤外促銷。FDA還要求公司簽訂同意法令或永久禁令,根據這些法令或永久禁令,改變或限制特定的促銷行為。在美國,根據聯邦和州法規,在獲得批准後,從事任何產品的不允許促銷活動,用於標籤外用途,也可能使我們面臨虛假聲明和其他訴訟。這些法律包括欺詐、濫用和消費者保護法,這可能導致民事、刑事處罰和罰款,與政府當局達成的協議實質上限制了我們推廣或分銷治療產品和開展業務的方式。這些限制可能包括公司誠信協議、暫停或被排除在聯邦和州醫療保健計劃的參與之外,以及暫停和禁止政府合同以及拒絕根據現有政府合同下達的命令。這些《虛假索賠法》針對藥品和生物製品製造商的訴訟在數量和廣度上都大幅增加,導致了與某些銷售做法和促進標籤外使用有關的幾項重大民事和刑事和解。此外,虛假索賠法案的訴訟可能會使製造商面臨私人付款人基於欺詐性營銷做法的後續索賠。訴訟的增加增加了生物製藥公司不得不為虛假索賠訴訟辯護、支付和解罰款或恢復原狀以及刑事和民事處罰、同意遵守繁重的報告和合規義務,並被排除在聯邦醫療保險、醫療補助或其他聯邦和州醫療保健計劃之外的風險。如果我們不依法推廣我們批准的產品(如果有的話),我們可能會受到此類訴訟,如果我們不能成功地對抗此類訴訟,這些訴訟可能會對我們的業務、財務狀況、運營結果、股票價格和前景產生實質性的不利影響。
在美國,生物製藥產品的推廣受到FDA的額外要求和對促銷聲明的限制。如果在CAN-2409、CAN-3110或任何未來的候選產品獲得上市批准後,FDA確定我們的促銷活動違反了與產品促銷有關的法規和政策,它可以要求我們修改我們的促銷材料或使我們受到監管或其他執法行動,包括髮出警告信或無標題信函、暫停或從市場上撤回經批准的產品、請求召回、支付民事罰款、返還資金、實施經營限制、禁令或刑事起訴,以及其他執法行動。同樣,外國司法管轄區的行業守則可能禁止公司從事某些促銷活動,而各國的監管機構可能會強制執行違反此類守則的行為,並處以民事處罰。如果我們成為監管和執法行動的對象,我們的業務、財務狀況、運營結果、股價和前景將受到實質性損害。
我們可能無法在我們預期的時間內提交IND或IND修正案以開始額外的臨牀試驗,即使我們能夠,FDA或類似的外國監管機構也可能不允許我們繼續進行。
FDA或類似的外國監管機構可能會要求我們單獨提交IND,以進行我們計劃對當前最先進的候選產品CAN-2409和CAN-3110進行的額外臨牀試驗。我們可能無法在我們預期的時間內提交當前候選產品和任何未來候選產品所需的任何其他IND。例如,如果我們無法訪問非活動或撤回的IND的早期數據,我們可能會遇到延遲。此外,我們不能確定提交IND將導致FDA或類似的外國監管機構允許開始進一步的臨牀試驗,或者一旦開始,不會出現暫停或終止臨牀試驗的問題。此外,即使這些監管機構同意IND中規定的臨牀試驗的設計和實施,我們也不能保證這些監管機構未來不會改變他們的要求。這些考慮也適用於我們可能提交的新的臨牀試驗,作為現有IND的修正案或新的IND。如果未能在預期時間內提交IND以獲得監管部門對我們試驗的批准,可能會阻止我們及時完成臨牀試驗或將我們的產品商業化。與我們的議定書和修正案的審查和授權有關的類似風險也與可比的外國監管機構有關。
如果獲得批准,我們作為生物製品監管的研究產品可能面臨通過簡化監管途徑獲得批准的生物仿製藥的競爭。
患者保護和平價醫療法案,經2010年醫療保健和教育協調法案(統稱為ACA)修訂,包括一個副標題,稱為2009年生物製品價格競爭和創新法案
60
(BPCIA),它為與FDA許可的參考生物製品生物相似或可互換的生物製品創建了一個簡短的批准路徑。根據BPCIA,生物相似產品的申請必須在參考產品首次獲得FDA許可的四年後才能提交給FDA。此外,FDA對生物相似產品的批准可能要到參考產品首次獲得許可之日起12年後才能生效。在這12年的獨佔期內,如果FDA批准競爭產品的BLA,該競爭產品包含贊助商自己的臨牀前數據和充分且受控良好的臨牀試驗數據,以證明另一家公司的產品的安全性、純度和有效性,則另一家公司仍可能銷售該參考產品的競爭版本。這項法律很複雜,FDA仍在解釋和實施。因此,其最終影響、實施和意義都存在不確定性。
我們認為,我們的任何根據BLA被批准為生物製品的候選產品都應該有資格獲得12年的專營期。然而,由於國會的行動、確定我們的候選人之一的批准不構成“首次許可”或其他原因,或者FDA不會將我們的研究藥物視為競爭產品的參考產品,可能會比預期更早地創造仿製藥競爭的機會,這可能會縮短或無法獲得這種獨家專利。此外,一旦獲得許可,生物相似物將在多大程度上取代我們的任何一種參考產品,其方式類似於非生物產品的傳統仿製藥替代,目前尚不清楚,這將取決於一些仍在發展中的市場和監管因素。
如果競爭對手能夠獲得參照我們產品的生物仿製藥的營銷批准,我們的產品可能會受到此類生物仿製藥的競爭,隨之而來的是競爭壓力和後果。
我們候選產品的潛在市場規模很難估計,如果我們的任何假設不準確,我們候選產品的實際市場可能比我們估計的要小。
我們目前和未來的目標患者羣體是基於我們對我們候選產品可能解決的某些類型適應症的發病率或流行率的信念和估計,這些估計來自各種來源,包括科學文獻和臨牀調查。我們的預測可能被證明是錯誤的,潛在患者的數量可能會低於預期。我們候選產品的全部潛在市場機會最終將取決於許多因素,包括最終標籤中包括的診斷和治療標準(如果被批准在特定適應症中銷售)、醫學界的接受度、患者准入、競爭療法的成功以及產品定價和報銷。此外,病毒免疫療法的市場機會很難估計,因為它是一個新興領域,幾乎沒有全球或FDA批准的療法,這些療法都還沒有得到廣泛的市場接受。即使我們為我們的候選產品獲得了相當大的市場份額,因為潛在的目標人羣可能很少,如果沒有獲得監管部門對更多適應症的批准,我們可能永遠不會實現盈利。
醫療改革措施可能對我們的業務及經營業績造成重大不利影響。
美國和許多外國司法管轄區已經制定或提議了影響醫療保健系統的立法和監管改革,這些改革可能會阻止或推遲我們當前或未來的候選產品或任何未來候選產品的上市審批,限制或規範審批後的活動,並影響我們以盈利方式銷售獲得營銷批准的產品的能力。在美國和其他地方的政策制定者和支付者中,有很大的興趣推動醫療保健系統的改革,其既定目標是控制醫療成本、提高質量和/或擴大獲得醫療保健的機會。在美國,製藥業一直是這些努力的重點,並受到重大立法倡議的重大影響。聯邦和州一級已經有並可能繼續有立法和監管建議,旨在擴大醫療保健的可獲得性,並遏制或降低醫療保健成本。我們無法預測未來可能採取的舉措。更多信息見第一部分,項目1“企業--保健改革”。
政府、保險公司、管理醫療組織和其他醫療服務付款人繼續努力控制或降低醫療成本,可能會對以下方面產生不利影響:
已經提出了立法和監管建議,以擴大批准後的要求,並限制藥品和生物產品的銷售和促銷活動。我們不能確定是否會頒佈更多的立法變化,或者FDA的法規、指南或解釋是否會改變,或者這些變化對我們的候選產品的上市批准(如果有)可能會產生什麼影響。此外,通過以下方式加強審查
61
國會對FDA的審批程序可能會大大推遲或阻止上市審批,以及使我們受到更嚴格的產品標籤和上市後測試等要求的影響。
此外,美國和海外的政府和第三方支付機構越來越多地限制或降低醫療費用,可能會導致此類組織限制新批准產品的覆蓋範圍和報銷水平,因此,他們可能無法為我們的候選產品支付或提供足夠的支付。在美國,對特種藥品定價做法的立法和執法興趣越來越大。
我們預計,已經採取和未來可能採取的醫療改革措施可能會導致更嚴格的覆蓋標準,並對我們獲得批准的任何產品的價格造成額外的下行壓力,並可能嚴重損害我們未來的收入。聯邦醫療保險或其他政府計劃報銷的任何減少都可能導致私人支付者支付的類似減少。實施成本控制措施或其他醫療改革可能會阻止我們創造收入、實現盈利或將我們的產品商業化。
如果在未來,我們無法建立銷售和營銷以及患者支持能力,或無法與第三方達成協議來銷售和營銷我們當前或未來的候選產品,那麼如果我們當前或未來的候選產品獲得批准,我們可能無法成功地將其商業化,我們可能無法產生任何收入。
我們目前沒有銷售或營銷基礎設施,在銷售、營銷、患者支持或產品分銷方面經驗有限。為了使我們保留銷售和營銷職責的任何已獲批准的候選產品取得商業成功,我們必須建立我們的銷售、營銷、患者支持、管理和其他非技術能力,或與第三方安排執行這些服務。未來,如果我們當前或未來的候選產品獲得批准,我們可能會選擇構建集中的銷售和營銷基礎設施,以銷售當前或未來的候選產品,或與我們的合作者一起參與銷售活動。
建立我們自己的銷售和營銷以及患者支持能力以及與第三方達成執行這些服務的安排都涉及風險。例如,招聘和培訓一支銷售隊伍既昂貴又耗時,可能會推遲任何藥物的推出。如果我們招募銷售隊伍並建立營銷能力的候選產品的商業發佈因任何原因而推遲或沒有發生,我們將過早或不必要地產生這些商業化費用。這可能代價高昂,如果我們不能留住或重新定位我們的銷售和營銷人員,我們的投資將會損失。
可能會阻礙我們將當前或未來的候選產品商業化的因素包括:
如果我們與第三方達成銷售、營銷、患者支持和分銷服務的安排,我們的藥品收入或這些藥品收入給我們帶來的盈利能力可能會低於我們營銷和銷售我們自己開發的任何當前或未來的候選產品。此外,我們可能無法成功地與第三方達成銷售和營銷我們當前或未來候選產品的安排,或者可能無法以對我們有利的條款這樣做。我們很可能對這些第三方几乎沒有控制權,他們中的任何一方都可能無法投入必要的資源和注意力來有效地銷售和營銷我們當前或未來的候選產品。如果我們不能成功地建立銷售和營銷能力,無論是我們自己還是與第三方合作,我們都不會成功地將我們當前或未來的候選產品商業化。此外,我們的業務、經營業績、財務狀況和前景都將受到重大不利影響。
如果我們獲得監管部門批准的任何候選產品不能獲得醫生、患者、醫療保健支付者和醫療界的廣泛市場接受,我們從其銷售中產生的收入將是有限的。
即使我們的候選產品獲得監管部門的批准,它們也可能無法獲得醫生、患者、醫療保健付款人和醫學界其他人的市場認可。商業成功還將在很大程度上取決於第三方付款人(包括私人保險提供商和政府付款人)對我們的產品候選產品的承保和報銷。市場對任何經批准的產品的接受程度將取決於多個因素,包括:
62
如果任何候選產品獲得批准,但沒有達到醫生、醫院、醫療保健付款人和患者足夠的接受度,我們可能無法從這些產品中產生足夠的收入,我們可能無法盈利,這將對我們的業務產生重大不利影響。
如果我們不能開發更多的候選產品,我們的商業機會可能會受到限制。
我們預計最初將開發我們最先進的候選產品CAN-2409和CAN-3110。然而,我們戰略的一個關鍵部分是追求更多候選產品的臨牀開發。開發、獲得市場批准並將其他候選產品商業化將需要大量額外資金,並將受到醫療產品開發固有的失敗風險的影響。我們不能向您保證,我們將能夠在開發過程中成功推進這些額外的候選產品中的任何一個。
即使我們獲得了FDA或類似的外國監管機構的批准,可以銷售更多用於治療實體腫瘤的候選產品,我們也不能向您保證任何此類候選產品將成功商業化,被市場廣泛接受,或比其他商業上可用的替代產品更有效。如果我們不能成功地開發和商業化更多的候選產品,我們的商業機會可能會受到限制,我們的業務、財務狀況、運營結果、股票價格和前景可能會受到實質性的損害。
我們與客户和第三方付款人的關係將受到適用的反回扣、欺詐和濫用以及其他醫療法律法規的約束,這可能使我們面臨刑事制裁、民事處罰、被排除在政府醫療計劃之外、合同損害、聲譽損害以及利潤和未來收入減少。
儘管我們目前市場上沒有任何藥物,但如果我們開始將當前或未來的候選產品商業化,我們將受到額外的醫療保健法律和法規要求以及聯邦政府以及我們開展業務的州和外國政府的執行。醫療保健提供者、醫生和第三方付款人在我們獲得市場批准的任何當前或未來候選產品的推薦和處方中扮演主要角色。我們未來與第三方付款人和客户的安排可能會使我們面臨廣泛適用的欺詐和濫用以及其他醫療法律法規,這些法律和法規可能會限制我們營銷、銷售和分銷我們獲得營銷批准的當前或未來候選產品的業務或財務安排和關係。
由於這些法律的廣泛性,以及法定例外情況和可用避風港的狹窄,我們的一些商業活動可能會受到挑戰,可能不符合其中一項或多項此類法律、法規和指導。執法部門越來越注重執行欺詐和濫用法律,我們的一些做法可能會受到這些法律的挑戰。確保我們未來與第三方的業務安排符合適用的醫療法律和法規,可能涉及鉅額成本。政府當局可能會得出結論,認為我們的業務做法不符合當前或未來涉及適用欺詐和濫用或其他醫療保健法律和法規的現行或未來法規、法規或判例法。如果我們的業務,包括預期由我們的銷售團隊進行的活動,被發現違反了任何這些法律或任何其他可能適用於我們的政府法規,我們可能會受到重大的民事、刑事和行政處罰,損害賠償,罰款,被排除在政府資助的醫療保健計劃之外,如Medicare和Medicaid,以及我們業務的削減或重組,以及額外的
63
如果我們受到公司誠信協議或其他協議的約束,以解決有關不遵守這些法律的指控,則我們將承擔報告義務和監督,其中任何一項都可能對我們的業務運營能力和財務業績產生不利影響。
如果我們從我們贊助的臨牀試驗中獲得可識別的患者健康信息,我們可能面臨潛在的責任。
大多數醫療保健提供者,包括我們可以從其獲得患者健康信息的某些研究機構,都受到HIPAA頒佈的、經HITECH修訂的隱私和安全法規的約束。我們目前沒有被歸類為HIPAA的承保實體或業務夥伴,因此不直接受到HIPAA的要求或處罰。然而,任何人都可以根據HIPAA的刑事條款直接或根據協助和教唆或共謀原則被起訴。因此,根據事實和情況,如果我們在知情的情況下從HIPAA覆蓋的醫療保健提供者或研究機構收到個人可識別的健康信息,而該醫療保健提供者或研究機構未滿足HIPAA關於披露個人可識別的健康信息的要求,則我們可能面臨重大刑事處罰。此外,在未來,我們可能會保留在整個臨牀試驗過程中、在我們的研究合作過程中以及直接從個人(或他們的醫療保健提供者)那裏獲得的敏感個人身份信息,包括健康信息,如果我們選擇實施此類計劃,這些個人(或他們的醫療保健提供者)可能會登記患者援助計劃。因此,我們可能會受到州法律的約束,要求在個人信息被泄露時通知受影響的個人和州監管機構,這是比HIPAA保護的健康信息更廣泛的信息類別。
外國數據保護法,包括歐盟的一般數據保護條例(EU GDPR)和英國(或英國)的同等法律(英國GDPR,連同歐盟GDPR,GDPR)也可能適用於我們對與健康相關的和其他個人數據的處理。
GDPR對歐洲經濟區(EEA)或英國境內個人個人數據的控制者和處理者提出了嚴格的要求。GDPR適用於在歐洲經濟區或英國設立的任何公司,以及歐洲經濟區或英國以外的公司,如果他們收集和使用與向歐洲經濟區或英國的個人提供商品或服務或監測他們的行為有關的個人數據。GDPR與歐洲經濟區成員國和英國管理個人數據處理的國家立法、法規和指導方針一起,對收集、分析和傳輸個人數據的能力施加了嚴格的義務和限制,包括來自臨牀試驗和不良事件報告的健康數據。具體而言,這些義務和限制涉及與個人數據有關的個人的同意、向個人提供的信息、將個人數據轉移出歐洲經濟區或聯合王國、違反安全規定的通知、個人數據的安全和保密,以及對違反數據保護義務的行為施加可能的鉅額罰款。必須遵守GDPR的公司面臨更多的合規義務和風險,包括更強有力的數據保護要求的監管執法,以及如果不合規可能被罰款高達2000萬歐元(1,750萬GB)或不合規公司全球年收入的4%,以金額較大者為準。目前,歐盟GDPR和英國GDPR基本保持一致,但英國在其數據改革法案中宣佈了改革該國數據保護法律框架的計劃,這將引入與歐盟GDPR不同的重大變化。這可能會導致額外的合規成本,並可能增加我們的整體風險敞口,因為我們可能不再能夠在歐洲經濟區和英國採取統一的方法,我們將需要修改我們的流程和程序,以與新框架保持一致。
GDPR還對歐洲經濟區和英國及其他國家的個人數據的國際轉移施加限制,而歐盟委員會或英國政府沒有就這些國家發佈所謂的“充分性決定”或“充分性法規”(稱為“第三國”),除非轉移的各方已實施具體的保障措施來保護被轉移的個人數據。這包括制定歐盟委員會關於在歐洲經濟區以外轉移的標準合同條款,以及關於在英國以外轉移個人數據的類似轉移機制,即國際數據轉移協議或附錄(IDTA)。根據歐盟GDPR和英國GDPR,出口商還被要求在個案基礎上評估數據傳輸的風險,包括對目的地國的法律進行分析。
2023年7月,歐盟委員會通過了歐盟-美國數據隱私框架(框架)的充分性決定,該框架是歐盟-美國隱私盾牌框架的繼任者,歐盟法院於2020年宣佈該框架無效。根據新的充分性決定,個人數據可以安全地從歐盟流向參與該框架的美國公司,而不必建立額外的數據保護保障措施。然而,該框架已經在歐洲法院受到挑戰,這可能導致其無效。
實施機制以努力確保遵守GDPR和歐洲經濟區成員國和英國的相關當地立法可能是繁重的,可能會中斷或推遲我們的發展活動,並對我們的業務、財務狀況、運營結果和前景產生不利影響。除上述外,違反GDPR或其他適用的隱私和數據保護法律法規可能會導致監管調查、聲譽損害,以及下令停止/改變我們對數據的使用、執行通知或潛在的民事索賠,包括集體訴訟類型的訴訟。
64
此外,美國政府越來越多地通過嚴格的隱私法。加利福尼亞州最近頒佈並提出了加州消費者隱私法(CCPA)的配套法規,該法案於2020年1月1日生效。CCPA為加州消費者創造了新的個人隱私權(如法律所定義),並對處理消費者或家庭個人數據的實體規定了更多的隱私和安全義務。CCPA要求覆蓋的公司向消費者提供有關其數據收集、使用和共享做法的某些披露,併為受影響的加州居民提供選擇退出某些個人信息銷售或轉移的方法。截至2020年3月28日,加利福尼亞州總檢察長已經提出了各種版本的配套法規草案,但尚未最終敲定。儘管推遲了法規的通過,加利福尼亞州總檢察長於2020年7月1日開始對違規者採取執法行動。雖然目前受HIPAA和臨牀試驗法規約束的受保護健康信息有例外情況,但CCPA可能會影響我們的業務活動。2020年8月14日,實施條例定稿,自當日起施行。雖然HIPAA管轄的臨牀試驗數據和信息目前不受當前版本的CCPA的約束,但其他個人信息可能適用,對CCPA的可能更改可能會擴大其範圍。我們繼續監測CCPA可能對我們的業務活動產生的影響。
此外,一項新的加州投票倡議,加州隱私權法案(CPRA)於2020年11月獲得通過。自2023年1月1日起,CPRA對該法律涵蓋的公司施加了額外的義務,並將大幅修改CCPA,包括擴大消費者對某些敏感個人信息的權利。《公民權利法》還設立了一個新的國家機構,該機構將被賦予執行和執行《公民權利法》和《公民權利法》的權力。CCPA和CPRA的影響可能是重大的,可能要求我們修改我們的數據收集或處理慣例和政策,併產生大量成本和開支,以努力遵守和增加我們在監管執法和/或訴訟中的潛在風險。
此外,2021年3月2日,弗吉尼亞州頒佈了《消費者數據保護法》(CDPA)。CDPA將於2023年1月1日起生效。CDPA將規範企業如何收集和共享個人信息。CDPA將企業稱為“控制者”。該法律適用於在弗吉尼亞州開展業務的公司或面向弗吉尼亞州居民的產品或服務:(1)每年控制或處理至少100,000名弗吉尼亞州居民的個人數據;或(2)控制或處理至少25,000名弗吉尼亞州居民的個人數據,並從出售個人數據獲得超過50%的總收入。雖然CDPA包含了許多與CCPA和CPRA類似的概念,但在範圍、適用和執法方面也存在幾個關鍵差異,這些差異將改變管制員的運營實踐。新法律將影響控制器收集和處理個人敏感數據、進行數據保護評估、將個人數據傳輸到附屬公司以及迴應消費者權利請求的方式。此外,2021年7月8日,科羅拉多州州長簽署了科羅拉多州隱私法(CPA),使之成為法律。CPA與弗吉尼亞州的CPDA非常相似,但也包含了額外的要求。這項新措施適用於在科羅拉多州開展業務或生產或提供商業產品或服務的公司,這些公司故意針對該州居民,並且:(1)在一個日曆年度內控制或處理至少10萬名科羅拉多州居民的個人數據;或(2)從銷售個人數據中獲得收入或獲得商品或服務價格的折扣,並處理或控制至少2.5萬名科羅拉多州居民的個人數據。
此外,2022年3月24日,猶他州州長簽署了猶他州消費者隱私法(UCPA),使之成為法律。《反海外腐敗法》將於2023年12月31日生效。此外,2022年5月,康涅狄格州州長拉蒙特簽署了康涅狄格州數據隱私法(CTDPA),使之成為法律。UCPA和CTDPA在很大程度上依賴於弗吉尼亞州和科羅拉多州的前輩。有了CTDPA,康涅狄格州成為第五個頒佈全面隱私法的州。美國超過一半的州和美國國會提出了新的隱私和數據安全法律。隨着許多其他司法管轄區提出法案,其他州仍很有可能效仿。此類擬議立法如果獲得通過,可能會增加額外的複雜性、要求變化、限制和潛在的法律風險,需要在合規計劃、影響戰略和以前有用的數據的可用性方面投入額外的資源,並可能導致合規成本增加和/或業務實踐和政策的變化。在美國不同的州存在全面的隱私法將使我們的合規義務更加複雜和代價高昂,並可能增加我們可能受到執法行動或以其他方式因不合規而招致責任的可能性。
地區、國家和美國州數據保護法的數量和複雜性不斷增加,以及全球各地法律或法規的其他變化,特別是與加強對某些類型的敏感數據的保護相關的法律或法規,例如來自我們臨牀試驗的醫療保健數據或其他個人信息,可能會導致政府對我們採取執法行動和重大處罰,並可能對我們的業務、財務狀況或運營結果產生重大不利影響
此外,某些健康隱私法、數據泄露通知法、消費者保護法和基因測試法可能直接適用於我們和/或我們合作者的運營,並可能對我們收集、使用和傳播個人健康信息施加限制。我們或我們的合作者可能獲得健康信息的患者,以及可能與我們共享此信息的提供者,可能擁有限制我們使用和披露信息的能力的法定或合同權利。我們可能需要花費大量資本和其他資源,以確保持續遵守適用的隱私和數據安全法律。聲稱
65
我們侵犯了個人的隱私權或違反了我們的合同義務,即使我們被發現沒有責任,辯護也可能是昂貴和耗時的,並可能導致可能損害我們業務的負面宣傳。
如果我們或第三方合同研究組織(CRO)或其他承包商或顧問未能遵守適用的聯邦、州/省或地方監管要求,我們可能會受到一系列監管行動的影響,這些監管行動可能會影響我們或我們的承包商開發和商業化我們的候選療法的能力,可能會損害或阻止我們能夠商業化的任何受影響療法的銷售,或者可能會大幅增加我們療法的開發、商業化和營銷的成本和支出。任何威脅或實際的政府執法行動也可能產生負面宣傳,並要求我們投入大量資源,否則這些資源可以用於我們業務的其他方面。越來越多地使用社交媒體可能會導致責任、數據安全遭到破壞或聲譽受損。
此外,除其他外,我們還須遵守上述每項醫保法的其他州和外國對等法律,其中一些法律的範圍可能更廣,可能適用於無論付款人如何。
如果我們不遵守環境、健康和安全法律法規,我們可能會被罰款或罰款,或者產生成本,這可能會對我們的業務成功產生實質性的不利影響。
我們受到許多環境、健康和安全法律和法規的約束,包括那些管理實驗室程序以及危險材料和廢物的處理、使用、儲存、處理和處置的法律和法規。我們的行動涉及使用危險和易燃材料,包括化學品、生物和放射性材料。我們的業務還會產生危險廢物產品。我們通常與第三方簽訂合同,處理這些材料和廢物。我們不能消除這些材料造成污染或傷害的風險。如果我們使用危險材料造成污染或傷害,我們可能要對由此造成的任何損害負責,任何責任都可能超出我們的資源範圍。我們還可能產生與民事或刑事罰款和處罰相關的鉅額費用。
雖然我們維持工人補償保險,以支付因使用危險材料導致員工受傷而可能產生的成本和開支,但該保險可能不足以支付潛在的責任。我們不為可能因我們儲存或處置生物、危險或放射性材料而對我們提出的環境責任或有毒侵權索賠維持保險。
與員工事務、管理增長和一般業務運營相關的風險
未來的任何公共衞生危機可能會影響我們完成正在進行的臨牀試驗以及啟動和完成其他臨牀前研究、計劃中的臨牀試驗或未來臨牀試驗的能力,擾亂監管活動,擾亂我們的製造和供應鏈,或對我們的業務和運營產生其他不利影響。此外,未來任何公共衞生危機都可能導致金融市場的重大混亂,並可能對全球經濟造成不利影響,這兩者都可能對我們的業務、運營和籌集資金的能力造成不利影響。
未來的任何公共衞生危機可能會導致各國政府採取措施,通過隔離、旅行限制、加強邊境審查和其他措施來減緩公共衞生危機的蔓延。政府為應對未來任何公共衞生危機而採取的措施也可能對企業和商業產生直接和間接的重大影響,因為可能出現勞動力短缺;供應鏈可能中斷;設施和生產可能暫停;對醫療服務和用品等某些商品和服務的需求可能激增,而對旅行等其他商品和服務的需求可能下降。未來任何公共衞生危機在多大程度上可能對我們的業務或我們所依賴的第三方的業務產生影響,取決於許多因素,這些因素高度不確定,無法有把握地預測。此外,我們臨牀試驗、臨牀前研究和生產活動的進行取決於臨牀試驗場地、CRO、CDMO、研究人員和調查人員、監管機構人員和物流提供商的可用性,所有這些都可能在未來受到任何未來公共衞生危機的不利影響。
未來任何公共衞生危機對我們的臨牀試驗招募或留住患者、我們的供應商為我們的候選產品提供材料的能力或監管審查過程可能產生的任何負面影響都可能導致產品開發活動的延遲,這可能會對我們獲得候選產品的營銷批准和商業化的能力產生實質性的不利影響,增加我們的運營費用,影響我們籌集額外資本的能力,並對我們的財務業績產生實質性的不利影響。
未來的任何公共衞生危機都可能導致未來的混亂,這可能會對我們通過公開募股或私募籌集額外資金的能力產生不利影響,還可能影響我們股票價格和交易的波動性。此外,未來任何公共衞生危機都有可能影響世界各地的經濟,這可能會對我們的業務和運營造成不利影響。
我們未來的成功取決於我們留住關鍵高管的能力,以及吸引、留住和激勵合格人才的能力。
66
我們高度依賴我們的高管以及我們管理、科學和臨牀團隊的其他主要成員的研發、臨牀、財務、運營和其他業務專業知識。雖然我們已經與我們的高管簽訂了僱傭協議,但他們中的每一位都可以隨時終止與我們的僱傭關係。我們不為我們的任何高管或其他員工提供“關鍵人物”保險。招聘和留住合格的科學、臨牀、製造、會計、法律以及銷售和營銷人員也將是我們成功的關鍵。2023年12月11日,Jason A.Amello辭去了公司首席財務官、首席財務官和首席會計官的職務,自2024年1月12日起生效。阿梅洛先生將繼續擔任公司的顧問,以支持他的職責過渡。2024年1月12日,董事會一致任命Charles Schoch為公司臨時首席財務官、首席財務官和首席會計官,自2024年1月12日起生效。
失去高管或其他關鍵員工的服務可能會阻礙我們研發和商業化目標的實現,並嚴重損害我們成功實施業務戰略的能力。此外,更換高管和關鍵員工可能很困難,而且可能需要較長的時間,因為我們行業中擁有成功開發、獲得營銷批准和產品商業化所需的技能和經驗的個人數量有限。從這個有限的人才庫中招聘的競爭非常激烈,鑑於眾多製藥和生物技術公司之間對類似人員的競爭,我們可能無法以可接受的條件聘用、培訓、留住或激勵這些關鍵人員。我們還面臨着從大學和研究機構招聘科學和臨牀人員的競爭。此外,我們依靠顧問和顧問,包括科學和臨牀顧問,幫助我們制定我們的研發和商業化戰略。我們的顧問和顧問可能受僱於我們以外的僱主,並可能根據與其他實體簽訂的諮詢或諮詢合同作出承諾,這可能會限制我們獲得他們的機會。作為一家上市公司,我們的成功還取決於實施和維護內部控制以及我們財務報告的準確性和及時性。如果我們不能繼續吸引和留住高素質的人才,我們推行增長戰略的能力將受到限制。
我們預計將擴大我們的開發、製造和監管能力,並可能實施銷售、營銷和分銷能力,因此,我們可能在管理我們的增長方面遇到困難,這可能會擾亂我們的運營。
隨着我們尋求通過臨牀試驗和商業化來推進我們的候選產品,我們將需要擴大我們的開發、監管、製造、營銷和銷售能力,或者與第三方簽訂合同來提供這些能力。我們預計我們的員工數量和業務範圍將會增長,特別是在藥物開發、臨牀、監管事務以及如果任何候選產品獲得營銷批准、銷售、營銷和分銷方面。為了管理我們預期的未來增長,我們必須繼續實施和改進我們的管理、運營和財務系統,擴大我們的設施,並繼續招聘和培訓更多合格的人員。由於我們的財務資源有限,以及我們的管理團隊在管理一傢俱有如此預期增長的公司方面的經驗有限,我們可能無法有效地管理我們業務的擴張,或招聘和培訓更多合格的人員。我們業務的擴張可能會導致巨大的成本,並可能轉移我們的管理和業務發展資源。任何無法管理增長的情況都可能推遲我們業務計劃的執行或擾亂我們的運營。
社交媒體平臺的使用越來越多,帶來了新的風險和挑戰。
社交媒體越來越多地被用來交流我們的臨牀開發計劃和我們的療法正在開發用於治療的疾病,我們打算在我們的產品候選獲得批准後,在我們的商業化努力中利用適當的社交媒體。生物技術和生物製藥行業的社交媒體實踐在繼續發展,與這種使用有關的法規和監管指南也在不斷髮展,但並不總是明確的。這一變化帶來了不確定性和不遵守適用於我們業務的法規的風險,導致可能對我們採取監管行動,以及可能與標籤外營銷或其他被禁止活動相關的訴訟,以及FDA、美國證券交易委員會和其他監管機構的更嚴格審查。例如,患者可以使用社交媒體渠道來評論他們在正在進行的盲目臨牀試驗中的經歷,或者報告所謂的不良事件。如果發生此類披露,可能會對試用登記產生不利影響,我們可能無法監控和遵守適用的不良事件報告義務,或者我們可能無法在社交媒體產生的政治和市場壓力下捍衞我們的業務或公眾的合法利益,這是因為我們對我們的候選產品的言論受到限制。在任何社交網站上,也存在不適當地披露敏感信息或負面或不準確的帖子或評論的風險。此外,我們可能會在社交媒體上遇到關於我們的公司、管理層、候選產品或產品的攻擊。如果發生任何此類事件或我們未能遵守適用的法規,我們可能會承擔責任、面臨監管行動或對我們的業務造成其他損害。
我們的內部計算機系統,或我們未來可能使用的第三方CRO的計算機系統,或其他承包商或顧問的系統,可能會出現故障或發生安全事件,這可能會導致我們候選產品的開發計劃受到實質性破壞。
67
儘管我們實施了安全措施,我們的內部計算機系統以及我們未來可能使用的CRO的系統,但信息技術供應商和其他承包商和顧問很容易受到計算機病毒、網絡攻擊和其他未經授權的訪問、自然災害、恐怖主義、戰爭以及電信和電氣故障的破壞。如果發生這樣的事件並導致我們的運營中斷,可能會導致我們的候選產品開發計劃發生實質性中斷。例如,已完成、正在進行或計劃中的臨牀試驗中的臨牀試驗數據丟失可能會導致我們的監管審批工作延遲,並顯著增加我們恢復或複製數據的成本。如果任何中斷或安全事件導致我們的數據或應用程序丟失或損壞,或不適當地披露個人、機密或專有信息,我們可能會招致責任,我們的任何候選產品的進一步開發可能會被推遲。此外,我們的責任和網絡保險在類型或金額上可能不足以涵蓋我們對安全事件、網絡攻擊或其他相關責任的索賠。
網絡攻擊的頻率、複雜性和強度都在增加,並且變得越來越難以檢測。它們往往是由資源豐富、技術熟練的各方實施的,包括民族國家、有組織犯罪集團、“黑客活動家”以及粗心大意或懷有惡意的員工或承包商。網絡攻擊包括部署有害的惡意軟件和按鍵記錄器、勒索軟件、拒絕服務攻擊、惡意網站、使用社會工程(包括網絡釣魚攻擊)以及其他方式來影響我們的技術系統和數據的保密性、完整性和可用性。網絡攻擊還包括製造、硬件或軟件供應鏈攻擊,這些攻擊可能導致產品或代工產品的製造延遲,或導致數據隱私或安全事件。我們的業務合作伙伴面臨着類似的風險,任何與他們的系統相關的安全事件都可能對我們的安全或我們的系統或數據的安全產生不利影響。此外,我們越來越多地使用雲技術增加了這些第三方和其他運營風險,雲或其他技術服務提供商未能充分保護其系統和防止網絡攻擊可能會擾亂我們的運營,並導致挪用、腐敗或丟失機密或適當信息。員工遠程工作增加了網絡攻擊的風險。遠程工作增加了我們可能容易受到網絡安全相關事件(如網絡釣魚攻擊和其他安全威脅)的風險。
儘管我們開發和維護旨在防止這些事件發生的系統和控制,但不能保證我們的內部信息技術系統或我們第三方承包商的系統,或我們的顧問為實施足夠的安全和控制措施所做的努力,將足以保護我們免受系統故障時的故障、服務中斷、數據惡化或丟失,或防止數據在網絡攻擊、安全事件、工業間諜攻擊或可能導致金融、法律、商業或聲譽損害的內部威脅攻擊時被竊取或損壞。
如果發生與我們或我們供應商的信息技術系統相關的重大安全事件,可能會損害市場對我們網絡安全措施有效性的看法,並可能損害我們的聲譽和信譽。我們可能需要花費大量資金和其他資源來修復或更換信息系統或網絡,包括部署額外人員和保護技術、培訓員工以及聘請第三方專家和顧問的成本,這可能會對我們的業務、財務狀況和運營結果產生實質性和不利影響。此外,我們可能會受到監管行動和/或個人和團體在私人訴訟中提出的索賠,這些訴訟涉及與數據收集和使用做法和其他數據隱私法律和法規有關的隱私問題,包括對濫用或不當披露數據的索賠,以及不公平或欺騙性的做法。
.
我們的行動或我們所依賴的第三方的行動可能會受到自然災害、大流行、戰爭或其他災難性事件的影響。
我們依賴我們的員工和顧問、CDMO和CRO,以及監管機構和其他方面,來繼續我們的業務運營。雖然我們維持災難恢復計劃,但它們可能無法充分保護我們。儘管我們對自然災害或其他災難性事件採取了任何預防措施,但這些事件,包括恐怖襲擊、大流行、戰爭颶風、火災、洪水和冰雪風暴,可能會對我們的研發、臨牀前研究、臨牀試驗以及最終對我們產品的商業化造成重大幹擾。自然災害、戰爭爆發、敵對行動升級和恐怖主義行為或其他“天災”等事件對基礎設施造成的長期破壞,特別是涉及我們設有辦事處、製造廠或臨牀試驗地點的城市,可能會對我們的業務產生不利影響。例如,2022年2月下旬,俄羅斯軍隊對烏克蘭發動了重大軍事行動,該地區可能會發生持續的衝突和破壞。對烏克蘭的影響,以及其他國家採取的行動,包括加拿大、英國、歐盟、美國和其他國家和組織對俄羅斯、烏克蘭和白俄羅斯的官員、個人、地區和行業實施的新的、更嚴厲的制裁,以及每個國家對此類制裁、緊張局勢和軍事行動的潛在反應,都可能對公司的運營產生不利影響。這些國家可能會對俄羅斯或其他地方的政府或其他個人或組織實施進一步的制裁或其他限制性行動。此外,2023年10月,哈馬斯對以色列發動攻擊,以色列向哈馬斯宣戰,截至本日,武裝衝突仍在繼續
68
歸檔。破壞性事件的影響可能以目前無法預見的方式影響全球經濟以及金融和商品市場。雖然我們承保業務中斷保險單,並在合同中通常有條款在某些情況下保護我們,但我們的保險範圍可能無法應對或不足以補償我們可能發生的所有損失。任何影響我們、我們的CDMO或CRO、監管機構或與我們接觸的其他各方的自然災害或災難性事件都可能對我們的運營和財務業績產生重大負面影響。
我們的披露控制和程序可能無法阻止或檢測所有錯誤或欺詐行為。
作為一家上市公司,我們必須遵守《交易法》的定期報告要求。我們設計我們的披露控制和程序是為了合理地確保我們必須在根據交易所法案提交或提交的報告中披露的信息被累積並傳達給管理層,並在美國證券交易委員會規則和表格中指定的時間段內進行記錄、處理、彙總和報告。我們相信,任何披露控制和程序或內部控制和程序,無論構思和運作如何完善,都只能提供合理的、而不是絕對的保證,確保控制系統的目標得以實現。這些固有的侷限性包括這樣的現實,即決策過程中的判斷可能是錯誤的,故障可能因為簡單的錯誤或錯誤而發生。例如,我們的董事或高管可能無意中未能披露新的關係或安排,導致我們未能進行必要的關聯方交易披露。此外,某些人的個人行為、兩個或兩個以上人的串通或未經授權超越控制,都可以規避控制。因此,由於我們的控制系統的固有限制,由於錯誤或欺詐而導致的錯誤陳述可能會發生,並且不會被發現。
如果我們發現未來財務報告的內部控制存在重大缺陷,或未能保持有效的內部控制系統,我們可能無法準確或及時地報告我們的財務狀況或經營結果,這可能對我們的業務和我們普通股的市場價格產生不利影響。
我們須遵守《薩班斯-奧克斯利法案》和適用的《美國證券交易委員會》規則和條例的要求,即要求就我們的財務報告內部控制提交年度管理報告。重大缺陷是財務報告內部控制的缺陷或缺陷的組合,使得我們的年度或中期財務報表的重大錯報有合理的可能性無法及時防止或發現。
我們不能向您保證,我們不會發現財務報告內部控制中的重大弱點。此外,我們的獨立註冊會計師事務所沒有根據《薩班斯法案》的規定對我們的財務報告內部控制進行評估,因為沒有要求這樣的評估。如果我們的獨立註冊會計師事務所根據《薩班斯法案》的規定對我們的財務報告內部控制進行評估,可能已經發現了一個或多個重大弱點。如果我們在財務報告的內部控制中發現未來的重大弱點,或者如果我們以其他方式未能維持有效的內部控制系統,我們的財務報告的準確性和時機可能會受到不利影響,我們可能無法保持遵守證券法關於及時提交定期報告的要求,以及適用的證券交易所上市要求,投資者可能對我們的財務報告失去信心,我們普通股的市場價格可能會因此下跌。
如果我們不能保持有效的財務報告內部控制制度,我們可能無法準確地報告我們的財務結果或防止舞弊。因此,股東可能會對我們的財務和其他公開報告失去信心,這將損害我們的業務和我們普通股的交易價格。
對財務報告的有效內部控制對於我們提供可靠的財務報告是必要的,並與適當的披露控制和程序一起旨在防止欺詐。任何未能實施所需的新的或改進的控制措施,或在執行過程中遇到的困難,都可能導致我們無法履行我們的報告義務。此外,我們根據第404條進行的任何測試,或我們的獨立註冊會計師事務所隨後進行的任何測試,可能會揭示我們在財務報告內部控制方面的缺陷,這些缺陷被認為是重大弱點,或可能需要對我們的財務報表進行前瞻性或追溯性更改,或發現需要進一步關注或改進的其他領域。不良的內部控制也可能導致投資者對我們報告的財務信息失去信心,這可能會損害我們的業務,並對我們的股票交易價格產生負面影響。
我們須按季度披露內部監控及程序的變動,而管理層須每年評估該等監控的有效性。然而,只要我們是《就業法》下的EGC,我們的獨立註冊會計師事務所將無需根據第404條證明我們對財務報告的內部控制的有效性。我們可以做長達五年的EGC。吾等對內部監控及程序的評估未必能發現吾等對財務報告的內部監控存在重大弱點。我們對財務報告的內部控制存在重大缺陷,
69
可能導致財務報表重報,並要求我們承擔補救費用,這可能對我們股票的交易價格產生負面影響。
與法律和合規事務相關的風險
我們面臨潛在的產品責任風險,如果針對我們的索賠成功,我們可能會招致重大責任,並不得不限制任何經批准的產品和/或我們的候選產品的商業化。
在臨牀試驗中使用我們的候選產品,以及銷售我們獲得監管部門批准的任何產品,都會使我們面臨產品責任索賠的風險。我們面臨着與在人體臨牀試驗中測試我們的候選產品相關的固有產品責任風險,包括與我們的研究人員的行為和疏忽有關的責任,如果我們以商業方式銷售我們可能開發的任何候選產品,我們將面臨更大的風險。例如,如果我們開發的任何候選產品據稱在臨牀測試、製造、營銷或銷售過程中造成傷害或被發現不適合,我們可能會被起訴。任何此類產品責任索賠可能包括對製造缺陷、設計缺陷、未能就產品固有危險發出警告、疏忽、嚴格責任或違反保修的指控。根據州消費者保護法,索賠也可以主張。消費者、醫療保健提供者或其他使用、管理或銷售我們產品的人可能會對我們提出產品責任索賠。如果我們不能成功地針對這些索賠為自己辯護,我們將承擔重大責任或被要求限制我們候選產品的商業化。即使是成功的防禦也需要大量的財政和管理資源。無論是非曲直或最終結果,賠償責任可能導致:
我們相信我們已經為我們的業務運營提供了足夠的保險。然而,我們的保險覆蓋範圍可能不會報銷我們,或者可能不足以報銷我們可能遭受的任何費用或損失。此外,保險範圍正變得越來越昂貴,未來我們可能無法以合理的成本或足夠的金額維持保險範圍,以保障我們免受因責任而造成的損失。我們打算擴大我們的保險覆蓋範圍,以包括商業產品的銷售,如果我們獲得FDA或類似的外國監管機構對我們正在開發的產品的批准,但我們可能無法為任何獲準上市的產品獲得商業上合理的產品責任保險,或者根本無法獲得。未能以可接受的成本獲得和保留足夠的產品責任保險,可能會阻止或阻礙我們開發的產品的商業化。有時,在基於治療學的集體訴訟中會做出大筆判決,這些訴訟產生了意想不到的副作用。一項成功的產品責任索賠或一系列針對我們的索賠可能會導致我們的股票價格下跌,如果判斷超出我們的保險範圍,可能會減少我們的現金,並對我們的業務、財務狀況、運營結果、股票價格和前景造成實質性損害。
我們必須遵守美國《反海外腐敗法》和其他反腐敗法律,以及進出口管制法律、海關法、制裁法律和其他管理我們業務的法律。如果我們不遵守這些法律,我們可能會受到民事或刑事處罰、其他補救措施和法律費用,這可能會對我們的業務、財務狀況、運營結果、股票價格和前景產生不利影響。
我們的運營受到反腐敗法律的約束,包括《反海外腐敗法》(FCPA)和其他適用於我們開展業務的國家/地區的反腐敗法律。《反海外腐敗法》和這些其他法律一般禁止我們和我們的員工和中介機構向政府官員或其他人行賄、受賄或向其他人支付其他被禁止的款項,以獲得或保留業務或獲得一些其他商業利益。我們還可能參與與第三方的合作和關係,如果這些第三方的行為不符合規定,我們可能會受到
70
《反海外腐敗法》或當地反腐敗法規定的責任。此外,我們無法預測未來監管要求的性質、範圍或影響,我們的國際業務可能受到這些要求的約束,也無法預測現行法律可能被管理或解釋的方式。
我們還須遵守管理我們國際業務的其他法律和法規,包括由美國政府管理的法規,包括適用的進出口管制法規、對國家和個人的經濟制裁、反洗錢法、海關要求和貨幣兑換法規,統稱為貿易管制法。
我們不能保證我們將完全有效地確保我們遵守所有適用的反腐敗法律或其他法律要求,包括貿易控制法。如果我們不遵守適用的反腐敗法律或貿易管制法律,我們可能會受到刑事和民事處罰、返還和其他制裁和補救措施,以及法律費用,這可能會對我們的業務、財務狀況、經營業績、股票價格和前景產生不利影響。同樣,對美國或其他當局可能違反這些反腐敗法律或貿易管制法律的任何調查,也可能對我們的聲譽、我們的業務、財務狀況、運營結果、股價和前景產生不利影響。
如果我們不遵守聯邦和州醫保法,包括欺詐和濫用以及健康和其他信息隱私和安全法律,我們可能面臨重大處罰,我們的業務、財務狀況、運營結果、股價和前景將受到實質性損害。
我們受到許多聯邦和州醫療保健法律的約束,例如聯邦反回扣法案、聯邦民事和刑事虛假索賠法案、民事罰款法案、醫療補助藥品返點法案和其他價格報告要求、1992年退伍軍人醫療法案(VHCA)、HIPAA、FCPA、ACA和類似的州法律。即使我們不會也不會控制醫療服務的轉介或直接向Medicare、Medicaid或其他第三方付款人收費,某些聯邦和州醫療法律以及與欺詐和濫用、報銷計劃、政府採購和患者權利有關的法規現在和將來都適用於我們的業務。我們將受到聯邦政府以及我們開展業務的州和外國司法管轄區的醫療欺詐和濫用以及患者隱私監管。在歐盟,數據隱私法一般比美國的法律更嚴格,幷包括收集歐盟人員的個人數據或將歐盟以外的個人數據轉移到美國的具體要求,以確保歐盟的數據隱私標準將適用於此類數據。有關更多信息,請參閲第一部分,項目1“商業-其他醫療保健法律和合規要求”。
如果我們或我們的運營,包括我們與醫生和其他醫療保健提供者的安排,其中一些人獲得了作為所提供服務的補償的股票期權或業務中的其他經濟利益,被發現違反了任何聯邦或州醫療保健法,或適用於我們的任何其他政府法律或法規,我們可能會受到懲罰,包括民事、刑事和行政處罰、損害、罰款、歸還、暫停和剝奪政府合同的資格、拒絕現有政府合同下的命令、排除參與美國聯邦或州醫療保健計劃、公司誠信協議以及削減或重組我們的業務。其中任何一項都可能對我們的業務運營能力和財務業績產生實質性的不利影響。如果我們預期與之開展業務的任何醫生或其他醫療保健提供者或實體被發現不遵守適用法律,則可能會受到刑事、民事或行政制裁,包括但不限於被排除在參與政府醫療保健計劃之外,這也可能對我們的業務產生重大影響。
儘管有效的合規計劃可以降低因違反這些法律而受到調查和起訴的風險,但這些風險不能完全消除。此外,實現並持續遵守適用的聯邦、州和外國隱私、數據保護、安全、報銷和欺詐法律可能會被證明代價高昂。任何因違反這些法律而對我們採取的行動,即使我們成功地進行了辯護,也可能導致我們招致鉅額法律費用,並轉移我們管理層對業務運營的注意力。
確保我們的內部運營和未來與第三方的業務安排符合適用的醫療法律和法規,將涉及大量成本。政府當局可能會得出結論,認為我們的業務做法不符合當前或未來涉及適用欺詐和濫用或其他醫療保健法律和法規的現行或未來法規、機構指導或判例法。如果我們的業務被發現違反了上述任何法律或任何其他可能適用於我們的政府法律和法規,我們可能會受到重大處罰,包括行政、民事和刑事處罰、損害賠償、罰款、交還、被排除在聯邦和州醫療保健計劃之外、個人監禁、名譽損害、削減或重組我們的業務,以及如果我們受到公司誠信協議或其他協議的約束,以解決有關不遵守這些法律的指控,以及額外的報告義務和監督。此外,防禦任何此類行動都可能是昂貴和耗時的,並可能需要大量的財政和人力資源。因此,即使我們成功地抵禦了任何可能對我們提起的此類訴訟,我們的業務也可能受到損害。如果我們預期與之開展業務的任何醫生或其他提供者或實體被發現不符合適用法律,他們可能
71
受到刑事、民事或行政制裁,包括被排除在政府資助的醫療保健計劃和監禁之外。如果發生上述任何一種情況,我們的業務運營能力和我們的運營結果可能會受到不利影響。
税法或其實施或解釋的變化可能會對我們的業務和財務狀況產生不利影響。
税法的變化可能會對我們的業務或財務狀況產生不利影響。任何新的税收都可能對我們的業務和財務表現產生不利影響。此外,現有的税收法律、法規、規則、法規或條例可能被解釋、更改、修改或適用於我們。例如,根據修訂後的1986年國內税法第174條,在2021年12月31日之後的納税年度,在美國發生的研發費用將被資本化和攤銷,這可能會對我們的現金流產生不利影響。此外,目前還不確定各州是否以及在多大程度上會遵守美國聯邦所得税法的變化。我們敦促我們普通股的潛在投資者就最近頒佈的任何税法或擬議的法律變化以及投資或持有我們普通股的潛在税收後果諮詢他們的法律和税務顧問。
我們利用我們的淨營業虧損結轉和某些其他税務屬性的能力可能是有限的。
根據該守則第382及383條,如一間公司經歷“所有權變更”(一般定義為5%股東在三年期間的股權所有權變動超過50%(按價值計算)),則該公司利用其變動前淨營業虧損結轉及其他變動前税項屬性抵銷變動後應課税收入的能力可能有限。由於我們最近的私募、IPO和過去三年發生的其他交易,我們可能經歷了一次“所有權變更”。我們還可能在未來經歷所有權的變化,因為我們的股票所有權隨後發生了變化。截至2023年12月31日,我們結轉的美國聯邦和州淨運營虧損分別為8,620萬美元和7,960萬美元,分別於2027年和2032年到期,如果我們經歷“所有權變更”,這一虧損可能會受到限制。根據TCJA降低公司税率可能會導致我們的淨營業虧損結轉和其他可供我們使用的遞延税項資產的經濟效益減少。根據現行聯邦税法,2017年12月31日之後產生的聯邦淨營業虧損不會到期,但不允許結轉。此外,根據美國現行聯邦税法,在2017年12月31日之後產生的淨營業虧損,允許我們在任何納税年度扣除的金額不得超過該年度應納税所得額的80%,在該年度確定應納税所得額時,不考慮淨營業虧損扣除本身。此外,截至2023年12月31日,我們有7740萬美元的美國聯邦淨營業虧損結轉,這些虧損不會到期,但僅限於相當於年度應納税所得額80%的年度扣減。
如果第三方付款人未能為我們的候選產品提供足夠的承保範圍、報銷和付款率,或者如果健康維護組織或長期護理機構選擇使用成本較低或被認為更具價值的療法,我們的收入和盈利前景將受到限制。
在國內外市場,我們產品的銷售將在一定程度上取決於承保範圍和第三方付款人的報銷。此類第三方付款人包括政府健康計劃,如Medicare和Medicaid,管理型醫療保健提供者,私人健康保險公司和其他組織。覆蓋範圍的決定可能取決於臨牀和經濟標準,當更成熟或更低成本的治療替代品已經可用或隨後可用時,這些標準不利於新的治療產品,即使我們的產品在同一類別中是獨一無二的。如果無法獲得報銷,或僅限於有限的級別,我們的候選產品可能在競爭中處於劣勢,我們可能無法成功地將我們的候選產品商業化。即使提供了保險,批准的報銷金額也可能不足以讓我們建立或保持足夠的市場份額,以實現我們或他們的投資的足夠回報。或者,為了獲得有利的補償條款,我們可能需要在定價上做出妥協,並阻止我們實現相對於成本的足夠利潤率。更多信息見第一部分,項目1“業務--承保和補償”。
與第三方付款人覆蓋範圍和新批准的治療藥物的報銷有關的不確定性很大。新治療產品的營銷批准、定價和報銷因國家而異。當前和未來的立法可能會大幅改變審批要求,這可能會涉及額外的成本,並導致獲得批准的延遲。一些國家要求批准一種治療藥物的銷售價格,然後才能將其上市。在許多國家,定價審查期從批准營銷或產品許可後開始。在一些國外市場,即使在獲得初步批准後,處方藥生物藥品的定價仍然受到政府的持續控制。因此,我們可能會獲得產品在特定國家/地區的營銷批准,但隨後會受到價格法規的約束,這些法規會推遲產品的商業發佈,可能會推遲很長時間,這可能會對我們在該國家/地區銷售該產品所產生的收入產生負面影響。不利的定價限制可能會阻礙我們收回在一個或多個候選產品上的投資的能力,即使我們的候選產品獲得了市場批准。我們是否有能力將我們的候選產品商業化,部分取決於政府衞生行政部門、私人健康保險公司和其他機構為這些產品和相關治療提供保險和報銷的程度。
72
組織。監管機構和第三方付款人,如私人健康保險公司和健康維護組織,決定他們將覆蓋哪些藥物並建立報銷水平。醫療保健行業非常關注成本控制,無論是在美國還是在其他地方。幾家第三方付款人要求公司向他們提供價目表價格的預定折扣,正在使用首選藥物清單來利用競爭類別的更大折扣,無視類別內的治療差異化因素,正在挑戰治療收費,並正在根據業績目標談判價格優惠。
假設保險獲得批准,由此產生的報銷付款率可能不夠高。如果付款人要求我們的候選產品支付最高金額,或施加限制使其難以獲得報銷,提供商可能會選擇使用與我們的候選產品相比更便宜的療法。此外,如果付款人要求高額共同償付,受益人可能會尋求替代療法。我們可能需要進行上市後研究,以證明任何產品的成本效益,使醫院、其他目標客户及其第三方付款人滿意。這樣的研究可能需要我們投入大量的管理時間以及財政和其他資源。我們的產品最終可能不會被認為具有成本效益。可能無法獲得足夠的第三方保險和報銷,使我們能夠維持足夠的價格水平,以實現產品開發投資的適當回報。
此外,如果商業價格的漲幅超過消費者物價指數-Urban,聯邦計劃將以強制額外回扣和/或折扣的形式對治療藥物製造商進行處罰,這些回扣和/或折扣可能會影響我們提高商業價格的能力。一些州也已經通過或正在考慮立法,以防止價格大幅上漲。監管機構和第三方付款人試圖通過限制特定藥物的覆蓋範圍和報銷金額來控制成本,這可能會影響我們銷售候選產品的盈利能力。這些付款人可能不會認為我們的產品(如果有)具有成本效益,並且我們的客户可能無法獲得保險和報銷,或者可能不足以使我們的產品(如果有)在競爭的基礎上進行營銷。成本控制舉措可能會導致我們降低、折扣或回扣我們或他們可能為產品制定的價格的一部分,這可能會導致產品收入低於預期。如果我們產品的實際價格(如果有的話)下降,或者如果政府和其他第三方付款人沒有提供足夠的保險或補償,我們的收入和盈利前景將受到影響。
此外,第三方付款人越來越需要新技術的益處和臨牀結果的更高水平的證據,與其他療法進行基準比較,尋求基於性能的折扣,並對收取的價格提出挑戰。我們不能確保我們商業化的任何候選產品都有覆蓋範圍,如果有的話,報銷費率是否足夠。如果我們無法迅速從政府資助和私人支付人那裏為我們獲得營銷批准的任何候選產品獲得保險和足夠的付款率,可能會對我們的經營業績、我們籌集產品商業化所需資金的能力以及我們的整體財務狀況產生實質性的不利影響。
我們的員工、獨立承包商、顧問、商業合作伙伴、主要調查人員、CRO或CDMO可能從事不當行為或其他不當活動,包括不遵守監管標準和要求以及內幕交易,這可能會對我們的業務產生重大不利影響。
我們面臨着員工欺詐或其他不當行為的風險。員工、獨立承包商、顧問、商業合作伙伴、主要調查人員、CDMO或CRO的不當行為可能包括故意、魯莽、疏忽或無意未能遵守FDA的規定,遵守適用的欺詐和濫用法律,向FDA提供準確的信息,正確計算聯邦計劃所需的定價信息,準確報告財務信息或數據,或向我們披露未經授權的活動。這種不當行為還可能涉及對臨牀試驗過程中獲得的信息的不當使用或虛假陳述,這可能導致監管制裁和對我們的聲譽造成嚴重損害。並非總是能夠識別和阻止此類不當行為,我們為發現和防止此類活動而採取的預防措施可能無法有效控制未知或未管理的風險或損失,或保護我們免受因不遵守此類法律或法規而引起的政府調查或其他行動或訴訟。此外,即使政府認為索賠沒有價值並拒絕幹預,舉報人也有可能對我們提起虛假索賠法案的訴訟,這可能要求我們招致針對此類索賠的辯護費用。如果對我們採取任何此類行動,而我們未能成功地為自己辯護或維護自己的權利,這些行動可能會對我們的業務、財務狀況、運營結果、股價和前景產生重大影響,包括施加鉅額罰款或其他制裁。
2024年3月15日,我們通知Aguar-Cordova博士,我們發現,在他擔任首席執行官期間,可能在他擔任首席科學官期間,他涉嫌(I)指示公司人員偽造提交給FDA的CAN-2409無菌測試結果,以及(Ii)未能針對同一計劃實施適當且合規的穩定性測試計劃。在發現這些缺陷後,我們立即更新了穩定性測試計劃,以使其完全符合要求,並向FDA提交了有關更新後的計劃和我們之前的測試結果的更多信息和數據。經過內部審查和分析,我們還
73
確定服用CAN-2409劑量的試驗參與者沒有風險,而且與已發現的缺陷相關的臨牀數據的完整性不存在風險。在2024年3月15日的信中,我們還要求阿吉拉爾-科爾多瓦博士辭去董事會職務,立即生效。2024年3月26日,阿吉拉爾-科爾多瓦博士作為迴應否認了這些指控。
違反環境、健康和安全法律法規或根據環境、健康和安全法律法規承擔責任可能會使我們面臨罰款、處罰或其他成本,這些成本可能會對我們的業務成功產生實質性的不利影響。
我們受到許多環境、健康和安全法律和法規的約束,包括那些管理實驗室程序、處理、使用、儲存、處理和處置危險材料和廢物以及清理受污染場地的法律和法規。我們的行動涉及使用危險和易燃材料,包括化學品、生物和放射性材料。我們的業務還會產生危險廢物產品。我們將因違反與我們的運營或財產相關的環境要求或根據環境要求承擔責任而招致鉅額成本,包括罰款、處罰和其他制裁、調查和清理費用以及第三方索賠。雖然我們通常與第三方簽訂合同,處置我們運營中的危險材料和廢物,但我們不能消除這些材料造成污染或傷害的風險。如果我們使用危險材料造成污染或傷害,我們可能要對由此造成的任何損害負責,任何責任都可能超出我們的資源範圍。我們還可能產生與民事或刑事罰款和處罰相關的鉅額費用。
雖然我們維持工人補償保險,以支付因使用危險材料導致員工受傷而可能產生的成本和開支,但該保險可能不足以支付潛在的責任。我們不為可能因我們儲存或處置生物、危險或放射性材料而對我們提出的環境責任或有毒侵權索賠維持保險。
與我們對第三方的依賴有關的風險
對於某些候選產品,我們依賴或將依賴開發和商業化合作夥伴來開發和進行臨牀試驗,獲得監管部門對候選產品的批准,如果獲得批准,則營銷和銷售候選產品。如果這樣的合作者沒有達到預期的表現,我們從這些候選產品中獲得未來收入的潛力將顯著降低,我們的業務將受到損害。
對於某些候選產品,我們依賴或將依賴我們的開發和商業合作伙伴來開發、進行臨牀試驗,如果獲得批准,還將使候選產品商業化。我們不能保證我們的合作者將在這些合作中取得成功,或者他們將為這些合作投入足夠的資源。如果我們當前或未來的合作和商業化合作夥伴沒有以我們期望的方式表現,或未能及時履行他們的責任,或者如果我們與他們的協議終止,或者如果他們獲得的臨牀數據的質量或準確性受到損害,與他們和我們的候選產品和產品相關的臨牀開發、監管批准和商業化努力可能會被推遲或終止,我們可能需要自費承擔候選產品的臨牀開發責任。此外,我們從這些協作和候選產品中創造收入的能力將取決於這些協作者以我們期望的方式執行或及時履行其責任的能力,而協作者的延遲或其他協作合同義務導致的延遲可能會導致我們披露數據的能力的延遲。
我們目前的合作以及我們參與的任何未來合作都面臨許多風險,包括:
74
此外,某些合作和商業化協議為我們的合作者提供了終止此類協議的權利,這些權利可能會或可能不會受到條件的限制,如果行使這些權利,將對我們的產品開發工作產生不利影響,並可能使我們難以吸引新的合作者。例如,我們與MGB的許可協議可能會被MGB終止,原因包括我們未能支付費用、我們未能按照協議維持適當的保險、如果我們申請破產,或者如果我們在指定的補救期限後仍因非財務原因違約以補救違約。如果終止任何合作或商業化協議,我們可能會被要求限制此類候選產品或產品的開發和商業化的規模和範圍;我們可能需要尋求額外的資金來為進一步開發或尋找替代戰略合作提供資金;我們從此類候選產品或產品的特許權使用費和里程碑付款中獲得未來收入的潛力將大幅減少、延遲或取消;這可能會對我們的業務和未來增長前景產生不利影響。我們在合作終止後收回有形和無形資產以及推進候選產品或產品所需的知識產權的權利可能會受到合同的限制,並且我們可能無法在終止後推進計劃。
由於上述原因,我們目前和未來的任何合作協議可能不會以最有效的方式或根本不會導致我們候選產品的開發或商業化。如果我們的合作伙伴參與業務合併,我們對產品開發或商業化計劃的持續追求和重視可能會被推遲、減少或終止。如果我們的一個合作者終止了與我們的協議,我們可能會發現更難吸引新的合作者,我們在商業和金融界的聲譽可能會受到不利影響。根據我們當前或任何未來的合作協議,任何未能成功開發我們的候選產品或將其商業化的情況都可能對我們的業務、財務狀況、運營結果和前景產生重大和不利的影響。
如果與我們的開發和商業化合作夥伴或許可方發生衝突,他們可能會出於自身利益行事,這可能會與我們公司的利益背道而馳。
在未來,我們可能會與我們的開發和商業化合作者或許可方發生分歧。由於以下一個或多個原因,我們與第三方的協作和許可安排可能會發生衝突:
與我們的開發和商業化合作夥伴或許可方的衝突可能會對我們的業務、財務狀況或運營結果和未來增長前景產生重大不利影響。
75
我們依賴第三方,包括獨立的臨牀研究人員和CRO來進行和贊助我們候選產品的一些臨牀試驗。如果第三方未能履行其在候選產品臨牀開發方面的義務,可能會推遲或削弱我們為候選產品獲得監管批准的能力。
我們一直依賴並計劃繼續依賴第三方,包括獨立的臨牀研究人員、學術合作伙伴、醫療機構、監管事務顧問和第三方CRO,來進行我們的臨牀前研究和臨牀試驗,在某些情況下還包括贊助此類臨牀試驗,並與監管機構接觸,併為我們正在進行的臨牀前和臨牀項目監控和管理數據。雖然我們已經或將會達成協議,規範此類第三方的活動,但我們將只控制他們活動的某些方面,對他們的實際表現影響有限。
在某些情況下,這些第三方中的任何一方都可以終止與我們的僱傭關係。我們可能無法達成替代安排,或以商業上合理的條款這樣做。此外,當一個新的合同研究機構開始工作時,有一個自然的過渡期。因此,可能會出現延誤,這可能會對我們滿足預期臨牀開發時間表的能力產生負面影響,並損害我們的業務、財務狀況和前景。
我們仍然有責任確保我們的每一項臨牀前研究和臨牀試驗都是根據適用的方案以及法律、法規和科學標準進行的,我們對這些第三方的依賴不會免除我們的監管責任。我們和我們的第三方承包商和CRO被要求遵守GCP要求,這些要求是FDA、EEA成員國的主管當局和類似的外國監管機構對我們臨牀開發中的所有產品執行的法規和指導方針。監管機構通過定期檢查試驗贊助商、主要調查人員和試驗地點來執行這些GCP要求。如果我們未能對我們的任何學術合作伙伴或CRO進行足夠的監督,或者如果我們或我們的任何學術合作伙伴或CRO未能成功履行其合同職責或義務,未能滿足預期的截止日期,或者如果他們獲得的臨牀數據的質量或準確性因未能遵守我們的臨牀規程或監管要求而受到損害,或由於任何其他原因,我們的臨牀試驗中產生的臨牀數據可能被認為是不可靠的,FDA、EMA或類似的外國監管機構可能會要求我們在批准我們的上市申請之前進行額外的臨牀試驗。我們不能向您保證,在對我們、我們的學術合作伙伴或我們的CRO或提供與我們的臨牀試驗相關的服務的第三方進行監管檢查後,這些監管機構將確定我們的任何臨牀試驗符合GCP規定。此外,我們的臨牀試驗必須使用根據適用的cGMP法規生產的產品進行。我們不遵守這些規定可能需要我們重複臨牀試驗,這將推遲監管部門的批准過程。
此外,代表我們進行臨牀試驗的第三方不是我們的員工,除了根據我們與這些承包商的協議我們可以獲得的補救措施外,我們無法控制他們是否為我們正在進行的開發計劃投入了足夠的時間、技能和資源。這些承包商還可能與其他商業實體有關係,包括我們的競爭對手,他們可能還在為這些實體進行臨牀試驗或其他藥物開發活動,這可能會阻礙他們在我們的臨牀項目上投入適當時間的能力。如果這些第三方,包括臨牀研究人員,沒有按照法規要求或我們規定的規程成功履行合同職責、在預期期限內完成或進行我們的臨牀試驗,我們可能無法獲得或延遲獲得我們候選產品的上市批准。如果發生這種情況,我們將無法成功地將我們的候選產品商業化,或者可能會推遲努力。
此外,對於正在或可能進行的研究人員贊助的試驗,我們不控制這些試驗的設計或進行,FDA或EMA可能不會因為任何一個或多個原因(包括試驗設計或執行的要素、安全問題或其他試驗結果)而認為這些研究人員贊助的試驗不能為未來的臨牀試驗或市場批准提供足夠的支持,無論是由我們還是第三方控制。我們期望這類安排將為我們提供關於調查員贊助試驗的某些信息權,包括能夠獲得許可證,以獲得使用和參考調查員贊助試驗產生的數據的許可,包括我們自己提交的監管文件。然而,我們不能控制研究人員贊助試驗的數據的時間和報告,也不擁有研究人員贊助試驗的數據。如果我們不能確認或複製研究人員贊助的試驗結果,或者如果獲得陰性結果,我們可能會進一步推遲或阻止進一步的臨牀開發。此外,如果研究人員或機構違反了他們在候選產品臨牀開發方面的義務,或者如果事實證明,與我們可能獲得的第一手知識相比,數據不夠充分,那麼我們自己設計和進行任何未來臨牀試驗的能力可能會受到不利影響。此外,FDA或EMA可能不同意我們對這些研究人員贊助的試驗產生的臨牀前、生產或臨牀數據的參考權利的充分性,或我們對這些研究人員贊助的試驗的臨牀前、生產或臨牀數據的解釋。如果是這樣的話,FDA或EMA可能會要求我們獲得並提交額外的臨牀前、生產或臨牀數據。
76
如果我們可能依賴的製造商未能及時按照我們要求的數量生產我們的候選產品,或者未能遵守適用於生物製藥製造商的嚴格法規,我們可能會在候選產品的開發和商業化方面面臨延誤,或者無法滿足對我們候選產品的需求,並可能損失潛在的收入。
我們還希望在第三方製造商為我們的候選產品CAN-2409開發商業規模的製造。我們可能會在第三方製造商那裏開發CAN-3110的臨牀製造能力。我們不能保證我們的臨牀產品供應不會受到限制、中斷,或質量令人滿意,或繼續以可接受的價格供應。特別是,我們的CDMO的任何替換都需要大量的努力和專業知識,因為合格的替換人員可能數量有限。在獲得符合必要質量標準的我們候選產品的充足供應方面的任何延誤,包括未來任何公共衞生危機造成的延誤,都可能延誤我們的開發或商業化。
我們可能無法成功地為我們的任何候選產品或計劃建立製造關係或其他替代安排。我們的候選產品可能會與其他產品和候選產品競爭製造設施。在cGMP法規下運營的製造商數量有限,它們都有能力為我們製造和填充我們的病毒式產品,並願意這樣做。如果我們現有的第三方製造商或我們未來參與的第三方停止與我們合作,我們很可能會在為我們獲得足夠數量的候選產品以滿足商業需求或推進臨牀試驗方面遇到延誤,而我們正在尋找和鑑定替代供應商。如果由於任何原因,我們無法獲得足夠的候選產品或用於製造它們的治療物質的供應,我們將更難開發我們的候選產品並有效地競爭。此外,即使我們確實建立了此類合作或安排,我們的第三方製造商也可能違反、終止或不續簽這些協議。
我們在準備候選產品或組件的商業化生產過程中遇到的任何問題或延遲都可能導致產品開發時間表的延遲以及FDA或類似的外國監管機構對候選產品的批准,或者可能會削弱我們以可接受的成本和質量生產商業批量或此類數量的能力,這可能會導致我們候選產品的臨牀開發和商業化的延遲、阻止或損害,並可能對我們的業務、財務狀況、運營結果、股票價格和前景造成實質性損害。
生物製藥產品的製造需要大量的專業知識和資本投資,包括開發先進的製造技術和工藝控制。治療藥物製造商在生產中經常遇到困難,特別是在擴大初步生產方面。這些問題包括生產成本和產量方面的困難,質量控制方面的困難,包括候選產品的穩定性和質量保證測試,合格人員或關鍵原材料的短缺,以及遵守嚴格執行的聯邦、州和外國法規。我們的CDMO可能不會按約定執行。如果我們的製造商遇到這些或其他困難,我們在臨牀試驗中向患者提供候選產品的能力可能會受到威脅。
我們候選產品的CDMO可能無法符合我們的規範、適用的cGMP要求或其他FDA、州或外國法規要求。對生產過程的不良控制可能會導致引入外來試劑或其他污染物,或導致候選產品的性能或穩定性發生意外變化,而這些變化在最終產品測試中可能無法檢測到。如果我們的CDMO不能成功地製造符合我們的規格和FDA或其他監管機構嚴格監管要求的材料,他們將無法確保或保持其製造設施的監管批准。任何此類偏差也可能需要我們或第三方實施的可能代價高昂和/或耗時的補救措施,其中可能包括暫時或永久暫停臨牀試驗或暫時或永久關閉設施。強加給我們或與我們簽訂合同的第三方的任何此類補救措施都可能對我們的業務造成實質性損害。在獲得符合適用法規要求的產品或候選產品方面的任何延誤都可能導致臨牀試驗、產品批准和商業化的延誤。這也可能需要我們進行額外的研究。
雖然我們對我們的候選產品和治療物質的製造負有最終責任,但除了通過我們的合同安排外,我們幾乎無法控制我們的製造商是否遵守這些法規和標準。如果FDA或類似的外國監管機構不批准這些設施用於生產我們的候選產品,或者如果它在未來撤回任何此類批准,我們可能需要尋找替代製造設施,這將嚴重影響我們開發、獲得監管機構批准或營銷我們的候選產品的能力(如果獲得批准)。任何新的製造商都需要獲得或開發必要的製造技術,並獲得必要的設備和材料,這可能需要大量的時間和投資。我們還必須獲得FDA和適用的可比外國監管機構的批准,才能使用任何新的製造商進行商業供應。如果依賴一家新的製造商進行商業生產,監管當局還可能要求進行額外的研究。在某些情況下,製造我們的候選產品所需的技術技能可能是原始CDMO獨有的或專有的,我們可能具有
77
可能存在困難,或合同限制禁止我們將此類技能轉讓給備用供應商或替代供應商,或者我們可能根本無法轉讓此類技能。此外,如果我們因任何原因被要求更換CDMO,我們將被要求核實新的CDMO保持符合質量標準和所有適用法規的設施和程序。我們還需要驗證,例如通過製造可比性研究,任何新的製造工藝將根據先前提交給FDA或其他監管機構或經FDA或其他監管機構批准的規格來生產我們的產品或候選產品。與新CDMO驗證相關的延遲可能會對我們開發候選產品或一旦獲得批准,及時或在預算內將這些候選產品商業化的能力產生負面影響。此外,製造商的變化通常涉及製造程序和工藝的變化,這可能要求我們在臨牀試驗中使用的先前臨牀供應與任何新制造商的供應之間進行過渡性研究。我們可能不能成功地證明臨牀用品的可比性,這可能需要進行額外的臨牀試驗。因此,更換製造商可能涉及大量成本,並可能導致我們期望的臨牀和商業時間表的延遲。
不遵守適用的監管要求,包括定期監管檢查,可能會導致對我們的製造商或我們採取監管執法行動(包括罰款和民事和刑事處罰,包括監禁)、暫停或限制生產、禁令、延遲或拒絕批准產品或批准產品的補充劑、臨牀持有或終止臨牀試驗、警告或無標題信件、監管當局就候選產品的安全問題向公眾發出警告、拒絕允許產品進出口、產品扣押、扣留或召回、操作限制、根據民事虛假索賠法提起的訴訟、公司誠信協議、同意法令、撤回產品批准,環境或安全事故及其他責任。如果由於我們的製造商未能遵守適用的法律或其他原因,所供應的任何數量的產品的安全性受到影響,我們可能無法獲得監管部門對我們的候選產品的批准或成功將其商業化。
任何未能或拒絕為我們可能開發的候選產品供應我們的候選產品或組件都可能會推遲、阻止或損害我們的臨牀開發或商業化努力。我們製造商的任何改變都可能代價高昂,因為任何新安排的商業條款都可能不那麼有利,而且與必要技術和工藝轉讓有關的費用可能會很高。
我們的一些候選產品正在並可能在由我們以外的組織或機構贊助的第三方研究和臨牀試驗中進行研究,或者在研究人員贊助的臨牀試驗中進行研究,這意味着我們對此類試驗的進行幾乎沒有控制,這可能會對我們獲得市場批准或某些監管排他性的能力產生不利影響。
我們已經並可能繼續提供並以其他方式支持第三方研究,包括研究人員贊助的臨牀試驗。研究人員贊助的臨牀試驗與本“風險因素”一節中與我們內部贊助的臨牀試驗相關的風險相似,但由於我們不是這些試驗的贊助商,我們對這些試驗的方案、管理或進行的控制較少,包括對患者的隨訪和治療後持續收集數據。此外,我們已經並可能繼續使用非我們提供的CAN-3110和CAN-2409進行第三方臨牀研究。這些試驗的進行或結果可能會對我們的發展計劃產生負面影響,儘管我們對這些試驗幾乎沒有參與或控制。因此,我們面臨着與研究人員贊助的試驗進行方式相關的額外風險。特別是,對於我們提供藥品的審判,我們可能會在訴訟中被點名,這將導致與法律辯護相關的成本增加。其他風險包括與調查人員或管理人員溝通的困難或延誤、程序延誤和其他時間問題,以及在解釋數據方面的困難或分歧。與我們自己設計的臨牀試驗相比,第三方研究人員可能會設計具有更難實現的臨牀終點的臨牀試驗,或者以其他方式增加臨牀試驗結果為陰性的風險。研究人員贊助的臨牀試驗的負面結果可能會對我們為我們的候選產品獲得監管部門批准的努力以及公眾對我們候選產品的看法產生實質性的不利影響。因此,我們缺乏對FDA和其他監管機構關於研究人員贊助試驗的進行和時間以及與其溝通的控制,可能會使我們面臨額外的風險和不確定性,其中許多風險和不確定性是我們無法控制的,而這些風險和不確定性的發生可能會對我們候選產品的商業前景產生不利影響。此外,正在調查我們尚未提供的候選產品的第三方可能會在我們之前尋求並獲得監管機構對候選產品的批准,這可能會對我們的發展戰略和我們本來有資格獲得的某些排他性產品的資格產生不利影響。
我們已經完成並可能在未來完成過去不是、也可能不會以公平原則進行的關聯方交易。
我們過去一直並將繼續參與與我們的創始人兼前首席科學官Estuardo Aguar-Cordova和我們的前首席醫療官Laura Aguar的某些附屬實體的某些交易。例如,我們已經與Ventagen,LLC(Ventagen)簽訂了獨家許可協議,Ventagen,LLC(Ventagen)是一家由Estuardo Aguar-Cordova和Laura Aguar擁有部分股權(49.5%),但不受管理的實體,使用全球專利
78
由我們擁有或控制的權利和專有技術,包括利用皰疹病毒來源的TK蛋白通過病毒載體將TK蛋白輸送到腫瘤或其他組織的適用技術。
2008年1月,我們與Ellka Holdings,LLC(Ellka)就我們在馬薩諸塞州奧本代爾運營的空間簽訂了一份運營租賃協議,租期至2022年12月31日。2016年5月,我們與Ellka簽訂了第二份租賃協議,為員工提供居住空間,也是在馬薩諸塞州的奧本代爾。我們於2018年7月26日簽訂了該空間的第二份租約,該租約於2019年7月31日到期。Ellka最初成立於2007年,是一家有限責任公司,目的是收購和管理勞拉·阿吉拉爾和愛德華·阿吉拉爾-科爾多瓦及其子女信託擁有的投資物業。Ellka由勞拉·阿吉拉爾和愛德華·阿吉拉爾-科爾多瓦以及他們的直系親屬擁有和運營。儘管我們認為這些交易是在公平的基礎上進行的,但與與非關聯方的交易相比,條款可能對我們不那麼有利。
截至2024年3月21日,愛德華多·阿吉拉爾-科爾多瓦和勞拉·阿吉拉爾實益擁有我們普通股6,200,755股,約佔截至該日期我們已發行股本總額的21.1%。因此,它們將繼續對所有業務決策產生重大影響,包括關於我們章程修正案、其他基本公司交易(如合併、資產出售和出售公司)等事項的重大影響,以及其他方面將能夠影響我們的業務和事務。關於首次公開募股,我們通過了一項書面的關聯人交易政策,闡述了我們關於關聯人交易的識別、審查、考慮和監督的政策和程序。
我們對第三方的依賴要求我們分享我們的商業祕密,這增加了競爭對手發現這些祕密或我們的商業祕密被挪用或披露的可能性。
因為我們依賴第三方生產我們的候選產品,而且我們與各種組織和學術機構合作開發我們的候選產品,我們有時必須與他們分享商業祕密。我們尋求通過在開始研究或披露專有信息之前與我們的合作者、顧問、員工和顧問簽訂保密協議、材料轉讓協議、合作研究協議、諮詢協議或其他類似協議來部分保護我們的專有技術。這些協議通常限制第三方使用或披露我們的機密信息(如商業祕密)的權利。
儘管在與第三方合作時採用了合同條款,但共享商業祕密和其他機密信息的需要增加了此類商業祕密被我們的競爭對手知曉、被無意中納入其他人的技術中、或在違反這些協議的情況下被披露或使用的風險。鑑於我們的專有地位在一定程度上基於我們的專有技術和商業祕密,競爭對手發現我們的商業祕密或其他未經授權的使用或披露將損害我們的競爭地位,並可能對我們的業務產生重大不利影響。
此外,這些協議通常會限制我們的合作者、顧問、員工和顧問發佈可能與我們的商業祕密相關的數據的能力。我們的學術合作者通常有權發佈數據,只要我們事先得到通知,並可能推遲發佈一段指定的時間,以確保我們的合作產生的知識產權。在其他情況下,出版權由我們獨家控制,儘管在某些情況下,我們可能與其他各方共享這些權利。儘管我們努力保護我們的商業祕密,但我們的競爭對手可能會發現我們的商業祕密,無論是通過違反這些協議、獨立開發或公佈信息(包括我們的商業祕密),在我們在公佈時沒有專有權或其他保護權利的情況下。競爭對手發現我們的商業祕密將損害我們的競爭地位,並對我們的業務產生不利影響。
有關知識產權的風險
我們開發和商業化某些候選產品的權利受制於並在未來部分受制於第三方授予我們的許可證的條款和條件。如果我們未能履行我們當前或未來知識產權許可協議下的義務,或者我們與當前或任何未來許可方的業務關係受到幹擾,我們可能會失去對我們的業務至關重要的知識產權。
我們正在並預計將繼續依賴第三方許可方獲得某些專利和其他知識產權,這些專利和知識產權對於我們的一些候選技術和產品的開發是重要或必要的。例如,我們依賴於MGB和Periphagen的許可來獲得某些專利權。這些許可協議對我們施加,我們預計未來的任何許可協議都將對我們施加特定的勤奮、里程碑付款、特許權使用費、商業化、開發和其他義務,並要求我們遵守開發時間表,或盡最大努力或商業上合理的努力來開發和商業化許可產品,以維護許可。
此外,如果我們嚴重違反協議並且未能在指定時間內糾正此類違規行為,或者在我們經歷某些破產事件時,我們的許可人有權或在未來有權終止許可。
79
儘管我們盡了最大努力,我們當前或任何未來的許可方可能會得出結論,我們嚴重違反了許可協議,因此可能會終止許可協議。如果我們的任何許可協議終止,我們可能會失去開發和商業化我們的某些候選產品和技術的權利,失去專利保護,在我們的某些候選產品和技術的開發和商業化方面遇到重大延誤,並承擔損害賠償責任。如果這些許可終止,或者如果基礎知識產權未能提供預期的排他性,我們的競爭對手或其他第三方可以自由尋求監管部門的批准,並銷售與我們相同或具有競爭力的產品和技術,我們可能被要求停止對我們的某些候選產品和技術進行開發和商業化。此外,我們可能尋求從我們的許可方獲得更多許可,在獲得此類許可時,我們可能會同意以對許可方更有利的方式修改我們的現有許可,包括同意允許包括我們的競爭對手在內的第三方獲得受我們現有許可約束的部分知識產權的許可的條款,並與我們可能開發的任何候選產品和我們的技術競爭。上述任何一項都可能對我們的競爭地位、業務、財務狀況、經營結果和前景產生重大不利影響。
根據許可協議,可能會發生關於知識產權的爭議,包括:
此外,我們的許可協議是複雜的,未來的許可協議也可能是複雜的,此類協議中的某些條款可能會受到多種解釋的影響。可能出現的任何合同解釋分歧的解決可能會縮小我們認為是我們對相關知識產權或技術的權利的範圍,或者增加我們認為是我們在相關協議下的勤奮、開發、監管、商業化、財務或其他義務。此外,如果圍繞我們許可的知識產權的糾紛或與我們的許可協議相關的任何其他爭議阻礙或損害我們以商業上可接受的條款維護當前許可協議的能力,我們可能無法成功地開發受影響的候選產品和技術並將其商業化。上述任何一項都可能對我們的業務、財務狀況、經營結果和前景產生重大不利影響。
我們未來可能簽訂的許可協議可能是非排他性的。因此,第三方也可以從該許可方獲得關於根據該許可協議向我們許可的知識產權的非排他性許可。因此,這些許可協議可能不會為我們提供獨家使用該許可專利和其他知識產權的權利,或者可能不會為我們提供在所有相關使用領域以及我們希望開發或商業化我們的技術和我們未來可能開發的任何候選產品的所有地區使用該專利和其他知識產權的獨家權利。
此外,我們的一些授權專利和其他知識產權在未來可能會受到第三方利益的影響,例如共同所有權。如果我們無法獲得此類第三方共同所有人在此類專利和其他知識產權中的權益的獨家許可,這些第三方共同所有人可能能夠將其權利許可給其他第三方,包括我們的競爭對手,而我們的競爭對手可以銷售與之競爭的產品和技術。我們或我們的許可人可能需要我們許可專利和其他知識產權的任何此類共同所有人的合作,以便針對第三方強制執行這些專利和其他知識產權,而此類合作可能不會提供給我們或我們的許可人。
此外,我們可能無法完全控制我們從第三方授權的專利和專利申請的準備、提交、起訴、維護、執行和辯護。我們的許可人對許可專利和專利申請的提交、起訴和維護、針對侵權者的專利執法或針對有效性挑戰或可執行性主張的辯護可能不如我們自己進行,因此,我們不能確定這些專利和專利申請的準備、提交、起訴、維護、強制執行和辯護將以符合我們業務最佳利益的方式進行。如果我們的許可人未能提交、起訴、維護、強制執行和保護這些專利和專利申請,或者失去對這些專利或專利申請的權利,我們獲得許可的權利可能會減少或取消,我們的權利
80
開發和商業化我們的任何技術和我們可能開發的屬於此類許可權標的的任何候選產品可能會受到不利影響,我們可能無法阻止競爭對手或其他第三方製造、使用和銷售競爭產品。
此外,我們擁有的和許可中的專利權可能會受到一個或多個第三方的權利保留。當在政府資助下開發新技術時,為了確保與技術相關的專利權的所有權,此類資助的接受者必須遵守某些政府規定,包括及時向美國政府披露此類專利權所要求的發明,並及時選擇此類發明的所有權。不履行這些義務可能導致相關專利或專利申請的權利喪失或無法強制執行。
我們的成功在一定程度上取決於我們保護知識產權的能力。保護我們的專有權利和技術是困難和昂貴的,我們可能無法確保它們的保護。
我們的業務將在很大程度上取決於獲得和維護對我們的專利技術和我們的候選產品、它們的配方、聯合療法、用於製造它們的方法和治療方法的專利、商標和商業祕密保護,以及成功地保護這些專利免受第三方挑戰。我們阻止未經授權的第三方製造、使用、銷售、提供銷售或進口我們的候選產品的能力取決於我們在涵蓋這些活動的有效和可執行專利下擁有的權利的程度,以及法院是否會發布禁制令補救措施。如果我們無法為我們開發的任何產品或技術獲得並保持專利保護,或者如果獲得的專利保護範圍不夠廣泛,我們的競爭對手可能會開發和商業化與我們類似或相同的產品和技術,我們將可能開發的任何候選產品商業化的能力可能會受到不利影響。
專利申請過程既昂貴又耗時,我們可能無法以合理的成本或及時地提交和起訴所有必要或可取的專利申請。此外,我們可能不會在所有相關市場追求、獲得或維持專利保護。我們也有可能在獲得專利保護為時已晚之前,無法確定我們的研發成果中可申請專利的方面。此外,在某些情況下,我們可能無權控制專利申請的準備、提交和起訴,或維護專利,包括我們從第三方獲得許可或許可給第三方並依賴於我們的許可人或被許可人的技術。
生物技術和生物製藥領域專利的強度涉及複雜的法律和科學問題,可能不確定。我們擁有的或許可中的專利申請可能無法產生已頒發的專利,其聲明涵蓋我們的候選產品或其在美國或其他國家/地區的使用。即使專利確實成功頒發,第三方也可能對其有效性、可執行性或範圍提出質疑,這可能導致此類專利被縮小、無效或無法強制執行。此外,即使它們沒有受到挑戰,我們的專利和專利申請也可能無法充分保護我們的技術,包括我們的候選產品,或者阻止其他人圍繞我們的聲明進行設計。如果我們持有的專利申請和專利對我們的候選產品提供的保護的廣度或強度受到威脅,可能會阻止公司與我們合作開發我們的候選產品,並威脅到我們將其商業化的能力。此外,如果我們在臨牀試驗中遇到延遲,我們可以在專利保護下銷售我們的候選產品的時間將會縮短。
我們不能確定我們是第一個提交與我們的技術相關的、針對我們的候選產品的專利申請,如果不是,我們可能被排除在為我們的技術,包括我們的候選產品獲得專利保護之外。
我們不能確定我們是第一個發明未決專利申請和專利所涵蓋的發明的人,如果我們不是,我們可能會受到優先權糾紛的影響。此外,對於所有權利要求都有權在2013年3月16日之前獲得優先權日期的美國申請,可以由第三方發起幹預程序或由美國專利商標局提起訴訟,以確定誰最先發明瞭我們的申請和專利的專利權利要求所涵蓋的任何主題。同樣,對於至少有一項權利要求在2013年3月16日之前無權享有優先權日期的美國申請,可以提起派生程序,以確定專利權利要求的標的物是否源自先前發明人的披露。
我們可能被要求放棄某些專利的部分或全部期限或某些專利申請的全部期限。可能有我們不知道的現有技術可能會影響專利或專利申請權利要求的有效性或可執行性。也可能存在我們知道但我們不認為會影響索賠的有效性或可執行性的現有技術,但最終可能會被發現影響索賠的有效性或可執行性。我們不能保證,如果受到挑戰,我們的專利將被法院宣佈為有效或可強制執行,或者即使被發現有效和可強制執行,也將充分保護我們的候選產品,或者將被法院裁定為被競爭對手的技術或產品侵犯。我們可能會分析我們認為與我們的活動相關的競爭對手的專利或專利申請,並認為我們可以針對我們的候選產品自由運營,但我們的競爭對手可能會提出索賠,包括我們認為無關的專利,這阻礙了我們的努力或可能導致我們的產品候選或我們的活動侵犯了此類索賠。這個
81
存在這樣一種可能性,即其他公司將在不侵犯我們的專利或其他知識產權的獨立基礎上開發與我們的產品具有相同效果的產品,或者將圍繞可能發佈的涵蓋我們產品的專利的權利要求進行設計。
美國和其他國家的專利法或專利法解釋的變化可能會降低我們許可的專利的價值或縮小我們的專利保護範圍。此外,外國的法律可能不會像美國的法律那樣保護我們的權利。例如,在人體治療方法的可專利性方面,歐洲專利法比美國專利法限制更多,而中國破產法可能不會為被許可人提供與美國破產法相同的保護。
此外,在美國,專利改革立法可能會增加圍繞我們專利申請的起訴以及我們已頒發專利的執行或保護的不確定性和成本。根據2013年頒佈的《萊希-史密斯美國發明法》(《美國發明法》),美國從“先發明”轉變為“先申請”制度。在“先提交文件”制度下,假設其他可專利性要求得到滿足,第一個提交專利申請的發明人通常將有權獲得該發明的專利,而無論是否有另一位發明人較早地作出了該發明。美國發明法包括對美國專利法的其他一些重大變化,包括影響專利申請起訴方式的條款,重新定義現有技術,並建立新的授權後審查制度。隨着美國專利商標局繼續制定與《美國發明法》相關的新法規和程序,這些變化的影響尚不清楚。此外,企業在生物藥品開發和商業化方面的專利地位尤其不確定。美國最高法院最近的裁決縮小了某些情況下可獲得的專利保護範圍,並在某些情況下削弱了專利所有者的權利。這一系列事件在專利一旦獲得後的有效性和可執行性方面造成了不確定性。根據美國國會、聯邦法院和美國專利商標局未來的行動,管理專利的法律和法規可能會以不可預測的方式發生變化,這可能會增加圍繞我們專利申請起訴的不確定性和成本,並對我們現有的專利組合以及我們未來保護和執行知識產權的能力產生重大不利影響。
此外,歐盟於2023年6月設立了統一專利法院(UPC)。UPC是一個普通的專利法院,負責審理對歐盟成員國有效的專利侵權和撤銷程序。這可以使第三方能夠在UPC的單一程序中尋求撤銷我們的任何歐洲專利,而不是通過在歐洲專利有效的每個司法管轄區的多個程序。任何此類專利保護的撤銷和喪失都可能對我們的業務以及我們將我們的技術和產品商業化或獲得許可的能力產生實質性的不利影響。此外,UPC的控制法律和法規將隨着時間的推移而發展,並可能對我們執行或保護我們歐洲專利的有效性的能力產生不利影響。對於我們的歐洲專利和申請,我們已經選擇退出UPC,並可能決定退出任何未來的歐洲專利和UPC的專利申請。然而,如果不滿足某些手續和要求,我們的歐洲專利和專利申請可能會因不符合規定而受到質疑,並被置於UPC的管轄範圍內。我們不能確定我們的歐洲專利和專利申請是否會避免落入UPC的管轄範圍,即使我們選擇或在未來選擇退出UPC。
我們無法預測我們目前正在進行的許可中的專利申請是否將作為專利發佈,已經發布或可能發佈的任何專利的聲明是否將為我們提供競爭優勢或阻止競爭對手圍繞聲明進行設計,以非侵權的方式開發競爭技術,或者我們或我們的許可人是否能夠在未來成功地尋求與我們當前候選產品或未來產品和候選產品相關的專利申請。此外,專利申請和審批過程既昂貴又耗時。我們或我們的許可人可能無法以合理的成本或以及時的方式提交和起訴所有必要或可取的專利申請。此外,我們或任何未來的合作伙伴、合作者或被許可人在獲得專利保護之前,可能無法確定在開發和商業化活動過程中作出的發明的可申請專利的方面。因此,我們可能會錯過尋求額外專利保護的潛在機會。
即使我們授權的專利申請以專利的形式發佈,它們的發佈形式可能不會為我們提供任何有意義的保護、阻止競爭對手與我們競爭或以其他方式為我們提供任何競爭優勢。我們的競爭對手可能能夠通過以非侵權方式開發類似或替代技術或產品來規避我們的專利權。我們的競爭對手也可能尋求批准,以營銷他們自己的產品,與我們的候選產品相似或在其他方面與我們競爭。或者,我們的競爭對手可以通過向FDA提交簡化的BLAS來尋求銷售任何批准的產品的仿製版本,在此過程中,他們可能會聲稱我們許可的專利是無效的、不可強制執行的或沒有受到侵犯。在這種情況下,我們可能需要捍衞或維護我們的知識產權,或者兩者兼而有之,包括通過提起訴訟指控專利侵權。在任何這類訴訟中,法院或其他有管轄權的機構可能會發現我們許可的專利無效或不可強制執行,或者我們的競爭對手正在以非侵權的方式競爭。因此,即使我們擁有未經許可的有效和可強制執行的專利,這些專利仍然不能提供針對競爭產品或過程的保護。
82
足以實現我們的業務目標。上述任何一項都可能對我們的競爭地位、業務、財務狀況、經營結果和前景產生重大不利影響。
未來對我們所有權的保護程度是不確定的,因為法律手段只能提供有限的保護,可能無法充分保護我們的權利,或允許我們獲得或保持我們的競爭優勢。例如:
我們可能會在未來簽訂許可或其他合作協議,這些協議可能會對我們。如果我們未能履行與第三方簽訂的此類未來協議所規定的義務,我們可能會失去對我們未來業務可能非常重要的許可權。
為了努力擴大我們的候選產品渠道,我們可能會在未來簽訂某些許可或其他合作協議,以便將權利授予其他候選產品。此類協議可能會將各種盡職調查、里程碑付款、特許權使用費、保險或其他義務強加給我們。如果我們未能履行這些義務,我們的許可方或合作伙伴可能有權終止相關協議,在這種情況下,我們將無法開發或營銷此類許可知識產權涵蓋的產品。
此外,根據許可協議,可能會產生關於知識產權的爭端,包括:
83
此外,我們目前從第三方獲得知識產權或技術許可的協議很複雜,此類協議中的某些條款可能會受到多種解釋的影響。任何可能出現的合同解釋分歧的解決可能會縮小我們認為是我們對相關知識產權或技術的權利的範圍,或者增加我們認為是相關協議下我們的財務或其他義務,這兩種情況中的任何一種都可能對我們的業務、財務狀況、運營結果和前景產生實質性的不利影響。此外,如果圍繞我們許可的知識產權的糾紛阻礙或損害我們以商業上可接受的條款維持目前的許可安排的能力,我們可能無法成功開發和商業化受影響的候選產品,這可能會對我們的業務、財務狀況、運營結果和前景產生實質性的不利影響。
此外,我們可能對這些許可內專利和專利申請的維護和起訴,或可能與我們許可內知識產權相關的任何其他知識產權的維護和起訴擁有有限的控制權。例如,我們不能確定任何未來許可人的此類活動已經或將會遵守適用的法律和法規,或將產生有效和可強制執行的專利和其他知識產權。我們對許可人對知識產權第三方侵權者提起侵權訴訟的方式有有限的控制,或對授權給我們的某些知識產權進行辯護。許可人的侵權訴訟或辯護活動可能不像我們自己進行的那樣激烈。
如果我們不能保護我們的商業祕密的機密性,我們的商業和競爭地位將受到損害。
除了專利保護外,我們還依賴專有技術和商業祕密保護,以及與我們的員工、顧問和第三方簽訂的保密協議和發明轉讓協議,以保護我們的機密和專有信息,特別是在我們認為專利保護不合適或不可能獲得的情況下。除了合同措施外,我們還試圖使用物理和技術安全措施來保護我們專有信息的機密性。例如,在員工或擁有授權訪問權限的第三方盜用商業祕密的情況下,此類措施可能不會為我們的專有信息提供足夠的保護。我們的安全措施可能無法阻止員工或顧問盜用我們的商業祕密並將其提供給競爭對手,我們對此類不當行為採取的追索權可能無法提供充分的補救措施來充分保護我們的利益。強制執行一方非法披露或挪用商業祕密的主張可能是困難、昂貴和耗時的,結果是不可預測的。此外,商業祕密可能是由其他人以阻止我們進行法律追索的方式獨立開發的。例如,我們的研究發展戰略包括建立癌細胞、免疫細胞和病毒的共培養。我們建立這些共培養體系並在這些檢測中測試我們的實驗試劑的技術是專有的和保密的。如果一個或多個第三方獲得或以其他方式能夠複製這些技術,我們的研究開發戰略的一個重要功能和差異化將向潛在競爭對手提供。如果我們的任何機密或專有信息,如我們的商業祕密,被泄露或挪用,或者如果任何此類信息是由競爭對手獨立開發的,我們的競爭地位可能會受到損害。
此外,美國以外的法院有時也不太願意保護商業機密。如果我們選擇訴諸法庭來阻止第三方使用我們的任何商業祕密,我們可能會產生鉅額費用。即使我們勝訴,這些訴訟也可能會消耗我們的時間和其他資源。儘管我們採取措施保護我們的專有信息和商業祕密,包括通過與我們的員工和顧問簽訂合同的方式,但第三方可以獨立開發基本相同的專有信息和技術,或以其他方式獲取我們的商業祕密或披露我們的技術。
因此,我們可能無法有意義地保護我們的商業祕密。我們的政策是要求我們的員工、顧問、外部科學合作者、贊助研究人員和其他顧問在與我們開始僱傭或諮詢關係時執行保密協議。這些協議規定,在與我方關係的過程中,個人或實體所瞭解的與我方業務或財務有關的所有機密信息均應保密,不得向第三方披露。
84
除非在特定情況下。就員工而言,協議規定,由個人構思的、與我們當前或計劃中的業務或研發有關的、或在正常工作時間內、在我們的辦公場所內進行的、或使用我們的設備或專有信息的所有發明都是我們的專有財產。此外,我們還採取了其他適當的預防措施,例如物理和技術安全措施,以防止第三方盜用我們的專有技術。我們還制定了政策並進行了培訓,為我們在保護商業祕密方面的期望提供指導,並就最佳做法提供建議。
第三方對知識產權侵權的索賠可能會阻礙或推遲我們的產品發現和開發工作。
我們的商業成功部分取決於我們開發、製造、營銷和銷售候選產品以及使用我們的專有技術而不侵犯第三方專有權利的能力。在生物技術和生物製藥行業,有大量涉及專利和其他知識產權的訴訟,以及挑戰專利的行政訴訟,包括干涉,派生, 各方間美國專利商標局的複審、授予後複審和複審程序,或外國司法管轄區的異議和其他類似程序。我們可能面臨或受到擁有專利或其他知識產權的第三方的未來訴訟的威脅,這些第三方聲稱我們的候選產品和/或專有技術侵犯了他們的知識產權。在我們正在開發我們的候選產品的領域中,存在着大量由第三方擁有的美國和外國頒發的專利和未決的專利申請。隨着生物技術和生物製藥行業的擴張和專利的頒發,我們的候選產品可能會引發侵犯他人專利權的索賠的風險增加。此外,包括我們在內的行業參與者並不總是清楚哪些專利涵蓋各種類型的藥物、產品或它們的使用或製造方法。因此,由於在我們的領域中頒發的專利和提交的專利申請數量眾多,第三方可能會聲稱他們擁有包含我們候選產品、技術或方法的專利權。
如果第三方聲稱我們侵犯了其知識產權,我們可能會面臨一些問題,包括但不限於:
我們的一些競爭對手可能比我們更有效地承受複雜專利訴訟的費用,因為他們擁有更多的資源。此外,任何訴訟的發起和繼續產生的任何不確定性都可能對我們籌集繼續運營所需資金的能力產生重大不利影響,或者可能對我們的業務、運營結果、財務狀況和前景產生重大不利影響。此外,由於與知識產權訴訟或行政訴訟有關的大量披露要求,我們的一些機密信息可能會因披露而被泄露。
我們的合作者可以主張對他們從我們支持的研究中開發的發明的所有權或商業權,或者我們通過使用他們提供給我們的組織樣本或其他生物材料開發的發明,或者其他合作產生的發明。
我們與多個機構,大學,醫療中心,醫生和研究人員在科學問題上合作,並期望繼續達成更多的合作協議。在某些情況下,我們與這些合作者沒有書面協議,或者我們的書面協議不涉及知識產權。此外,我們依靠眾多第三方為我們提供組織樣本和生物材料,用於開展研究活動和開發候選產品。如果我們無法成功地就我們使用第三方合作者的材料而產生的任何發明達成足夠的所有權和商業權利,或者如果出現爭議,
85
就使用合作者的樣本或研究所開發的數據而開發的知識產權而言,我們在利用這些發明或發展的市場潛力方面的能力可能會受到限制。
第三方可能會聲稱我們在未經授權的情況下使用他們的專有技術。
可能存在我們目前不知道的第三方專利,包括我們候選產品的組成、使用或製造的物質、材料、配方、製造方法或處理方法的權利要求。可能存在我們目前不知道的當前正在處理的專利申請,這些申請可能會導致我們的候選產品或其使用或製造可能會侵犯已頒發的專利。此外,第三方可能會在未來獲得專利,並聲稱使用我們的技術侵犯了這些專利。如果有管轄權的法院持有任何第三方專利,以涵蓋我們的候選產品、用於製造我們候選產品或材料的中間體、我們配方或使用方法的各個方面,則任何此類專利的持有者可能能夠阻止我們開發和商業化候選產品的能力,除非我們獲得了許可,或者直到該專利到期或最終被確定為無效或不可執行。在任何一種情況下,這樣的許可可能都不會以商業上合理的條款或根本不存在。如果我們不能以商業上合理的條款獲得第三方專利的必要許可,或者根本不能,我們將候選產品商業化的能力可能會受到損害或推遲,這反過來可能會嚴重損害我們的業務。即使我們獲得了許可,它也可能是非排他性的,從而使我們的競爭對手能夠訪問向我們許可的相同技術。此外,如果我們的專利和專利申請提供的保護的廣度或強度受到威脅,可能會阻止公司與我們合作,授權、開發或商業化當前或未來的候選產品。
對我們提出索賠的各方可能會尋求並獲得禁令或其他公平救濟,這可能會有效地阻止我們進一步開發和商業化我們的候選產品。對這些索賠的辯護,無論其是非曲直,都將涉及鉅額訴訟費用,並將大量轉移我們業務中的員工資源。如果針對我們的侵權索賠成功,我們可能必須支付大量損害賠償,包括故意侵權的三倍損害賠償金和律師費、從第三方獲得一個或多個許可證、支付版税或重新設計我們的侵權產品,這可能是不可能的,或者需要大量的時間和金錢支出。我們無法預測是否會有這樣的許可證,或者是否會以商業合理的條款提供。此外,即使在沒有訴訟的情況下,我們也可能需要從第三方獲得許可證,以推進我們的研究或允許我們的候選產品商業化。我們可能無法以合理的成本或合理的條款獲得這些許可證中的任何一項,如果有的話。在這種情況下,我們將無法進一步開發和商業化我們的候選產品,這可能會嚴重損害我們的業務。
第三方可能聲稱我們的員工或顧問錯誤地使用或披露機密信息、挪用商業祕密或違反與競爭對手的競業禁止或競業禁止協議。
就像在生物技術和生物製藥行業中常見的那樣,我們僱用的個人以前曾受僱於大學或其他生物技術或生物製藥公司,包括我們的競爭對手或潛在競爭對手。儘管目前沒有針對我們的索賠待決,儘管我們努力確保我們的員工和顧問在為我們工作時不使用他人的專有信息或專有技術,但我們或我們的員工、顧問或獨立承包商可能會因疏忽或以其他方式使用或披露前僱主或其他第三方的知識產權,包括商業祕密或其他專有信息。我們還可能被指控導致員工違反競業禁止協議或競業禁止協議的條款,或者我們或這些個人無意中或以其他方式使用或披露了前僱主、競爭對手或其他方的所謂商業祕密或其他專有信息。可能有必要提起訴訟來抗辯這些指控。如果我們不能為任何此類索賠辯護,除了支付金錢損害賠償外,我們還可能失去寶貴的知識產權或人員。即使我們成功地對此類索賠進行抗辯,與知識產權索賠有關的訴訟或其他法律程序也可能導致我們招致鉅額費用,並可能分散我們的技術和管理人員的正常責任。此外,可能會公佈聽證會、動議或其他臨時程序或事態發展的結果,如果證券分析師或投資者認為這些結果是負面的,可能會對我們普通股的價格產生重大不利影響。這種類型的訴訟或訴訟可能會大幅增加我們的運營損失,並減少我們可用於開發活動的資源。我們可能沒有足夠的財政或其他資源來適當地進行此類訴訟或法律程序。我們的一些競爭對手可能比我們更有效地承擔這類訴訟或訴訟的費用,因為他們的財政資源要大得多。
專利訴訟或其他知識產權相關訴訟的發起和繼續所產生的不確定性可能會對我們在市場上的競爭能力產生不利影響。
我們可能無法成功地獲得或保持必要的權利,以便以可接受的條款開發任何未來的候選產品。
86
由於我們的計劃可能涉及其他候選產品,可能需要使用第三方持有的專有權,因此我們業務的增長可能在一定程度上取決於我們獲得、授權或使用這些專有權的能力。
我們的候選產品可能還需要特定的配方才能有效和高效地工作,這些權利可能由其他人持有。我們可能會開發含有我們的化合物和預先存在的生物製藥化合物的產品。我們可能無法從第三方獲得我們認為對我們的業務運營必要或重要的任何成分、使用方法、工藝或其他第三方知識產權,或無法對其進行許可。我們可能無法以合理的成本或合理的條款獲得這些許可證中的任何一項,如果有的話,這將損害我們的業務。我們可能需要停止使用這種第三方知識產權所涵蓋的成分或方法,並可能需要尋求開發不侵犯此類知識產權的替代方法,這可能會導致額外的成本和開發延遲,即使我們能夠開發這種可能不可行的替代方法。即使我們能夠獲得許可,它也可能是非排他性的,從而使我們的競爭對手能夠訪問向我們許可的相同技術。在這種情況下,我們可能需要花費大量時間和資源來開發或許可替代技術。
此外,我們有時與學術機構合作,根據與這些機構的書面協議,加速我們的臨牀前研究或開發。在某些情況下,這些機構為我們提供了一個選項,讓我們就合作產生的任何機構技術權利進行談判。無論如何,我們可能無法在指定的時間內或在我們可接受的條款下協商許可證。如果我們無法做到這一點,該機構可能會將知識產權提供給其他人,這可能會阻礙我們繼續執行我們的計劃。如果我們無法成功取得所需第三方知識產權的權利或維持現有知識產權,我們可能不得不放棄該項目的開發,我們的業務和財務狀況可能受到影響。
第三方知識產權的許可和收購是一個競爭領域,可能比我們更成熟或擁有更多資源的公司也可能採取我們認為必要或有吸引力的第三方知識產權許可或收購戰略,以便將我們的候選產品商業化。更成熟的公司可能比我們更具競爭優勢,因為它們的規模、現金資源以及更強的臨牀開發和商業化能力。不能保證我們能夠成功完成此類談判,並最終獲得圍繞我們可能尋求收購的其他候選產品的知識產權。
我們可能會捲入保護或強制執行我們的專利或我們許可人的專利的訴訟,這可能是昂貴、耗時和不成功的。
競爭對手可能會侵犯我們的專利或我們當前或未來許可方的專利。為了對抗侵權或未經授權的使用,我們可能會被要求提出侵權索賠,這可能是昂貴和耗時的。此外,在侵權訴訟中,法院可以裁定我們的一項或多項專利無效或不可強制執行,或以我們的專利不涵蓋相關技術或其他原因為由拒絕阻止另一方使用相關技術。任何訴訟或辯護程序中的不利結果可能會使我們的一項或多項專利面臨被宣佈無效、無法強制執行或狹義解釋的風險,並可能使我們的專利申請面臨無法發佈的風險。對這些索賠的辯護,無論其是非曲直,都將涉及鉅額訴訟費用,並將大量轉移我們業務中的員工資源。
我們可以選擇挑戰第三方美國專利中權利要求的專利性,方法是請求美國專利商標局審查專利權利要求單方面重新考試,各方間審查或撥款後審查程序。這些程序是昂貴的,可能會消耗我們的時間或其他資源。我們可以選擇在歐洲專利局(EPO)或其他外國專利局的專利反對程序中挑戰第三方的專利。這些反對訴訟的費用可能是巨大的,並可能消耗我們的時間或其他資源。如果我們未能在美國專利商標局、歐洲專利局或其他專利局獲得有利的結果,我們可能會面臨第三方的訴訟,指控我們的候選產品或專有技術可能侵犯了我們的專利。
此外,由於美國的一些專利申請可能在專利頒發之前保密,美國和許多外國司法管轄區的專利申請通常在提交後18個月才公佈,科學文獻中的出版物往往落後於實際發現,我們不能確定其他人沒有就我們擁有和授權的已頒發專利或我們正在審理的申請所涵蓋的技術提交專利申請,或者我們或如果適用的話許可方是第一個發明該技術的人。我們的競爭對手可能已經提交,並可能在未來提交專利申請,涵蓋與我們類似的產品或技術。任何此類專利申請可能優先於我們擁有的和授權內的專利申請或專利,這可能要求我們獲得涵蓋此類技術的已發佈專利的權利。如果另一方就類似於由我們擁有或向我們許可的發明提交了美國專利申請,則我們或許可人可能必須參與USPTO宣佈的幹擾或派生程序,以確定發明在美國的優先權。如果我們或我們的許可人之一是涉及美國
87
對於我們擁有的或授權給我們的發明的專利申請,即使我們成功了,我們也可能會招致大量成本,轉移管理層的時間,並消耗其他資源。
由第三方引起或由我們提起或由美國專利商標局宣佈的幹擾或派生程序可能是必要的,以確定與我們的專利或專利申請或我們許可人的發明有關的發明的優先權。不利的結果可能導致我們當前專利權的喪失,並可能要求我們停止使用相關技術或試圖從勝利方那裏獲得許可權。如果勝利方不以商業上合理的條款向我們提供許可,或者根本不向我們提供許可,或者如果提供了非獨家許可,而我們的競爭對手獲得了相同的技術,我們的業務可能會受到損害。訴訟或幹預程序可能導致不利於我們利益的決定,即使我們成功,也可能導致鉅額成本,並分散我們的管理層和其他員工的注意力。我們可能無法單獨或與我們的許可人一起防止盜用我們的商業祕密或機密信息,特別是在法律可能不像美國那樣充分保護這些權利的國家。
此外,由於知識產權訴訟需要大量的披露,在這類訴訟期間,我們的一些機密信息可能會因披露而被泄露。此外,可能會公佈聽證會、動議或其他臨時程序或事態發展的結果。如果證券分析師或投資者認為這些結果是負面的,可能會對我們普通股的價格產生重大不利影響。
獲得和維護我們的專利保護有賴於遵守政府專利機構提出的各種程序、文件提交、費用支付和其他要求,如果不符合這些要求,我們的專利保護可能會減少或取消。
任何已頒發專利的定期維護費應在專利有效期內分幾個階段支付給美國專利商標局和外國專利代理機構。美國專利商標局和各種外國政府專利機構要求在專利申請過程中和專利頒發後遵守一些程序、文件、費用支付和其他規定。雖然在許多情況下,可以根據適用規則通過支付滯納金或通過其他方式糾正疏忽失效,但在某些情況下,不遵守規定可能導致專利或專利申請被放棄或失效,從而導致相關法域的專利權部分或全部喪失。可能導致專利或專利申請被放棄或失效的不合規事件包括但不限於:未能在規定的時限內對官方行動做出迴應,未支付費用,以及未能適當地使其合法化並提交正式文件。在某些情況下,即使是無意的不合規事件也可能永久和不可挽回地危及專利權。在這種情況下,我們的競爭對手可能會進入市場,這將對我們的業務產生實質性的不利影響。
如果在法庭或美國專利商標局提出質疑,涵蓋我們候選產品的已頒發專利可能被認定為無效或不可強制執行,或者可能在第一個產品獲得上市批准之前到期。
如果我們或我們的一個許可方對第三方提起法律訴訟,以強制執行我們候選產品的專利,被告可以反訴我們候選產品的專利(如適用)無效和/或不可執行。在美國的專利訴訟中,被告反訴無效和/或不可撤銷是司空見慣的,第三方可以根據許多理由主張專利無效或不可撤銷。第三方也可以向美國或國外的行政機構提出類似的要求,即使是在訴訟範圍之外。這些機制包括重新審查、當事人之間的審查、批准後的審查以及外國司法管轄區的同等程序(例如,異議程序)。該等訴訟可能導致撤銷或修訂我們的專利,使其不再涵蓋我們的候選產品。在法律上宣佈無效和不可撤銷之後,結果是不可預測的。例如,關於有效性問題,我們無法確定是否存在無效的現有技術,而我們、我們的專利顧問和專利審查員在起訴期間並不知道這一點。如果被告在無效和/或不可撤銷的法律主張上佔上風,或者如果我們無法充分保護我們的權利,我們將失去至少部分,甚至可能是全部的專利保護。這種專利保護的喪失可能對我們的業務以及我們商業化或許可我們的技術和候選產品的能力產生重大不利影響。
同樣,我們擁有一項與我們的候選CAN-2409產品相關的美國專利,該專利將於2034年到期,而我們從MGB和Periphagen獲得許可的與我們基於HSV的產品候選相關的美國和非美國專利預計將分別於2036年和2037年到期,而不考慮任何可能的專利期限延長。我們最早的專利可能會在我們的第一個產品在美國或外國司法管轄區獲得上市批准之前或之後不久到期。一旦我們現有的專利到期,我們可能會失去排除其他人實施這些發明的權利。這些專利的到期也可能對我們的業務、運營結果、財務狀況和前景產生類似的重大不利影響。我們擁有與我們的專有技術或我們的候選產品相關的未決專利申請,如果作為專利發佈,這些申請預計將從2034年到2044年到期,而不考慮任何可能的專利期限調整或延長。然而,我們不能保證美國專利商標局或相關的外國專利機構會批准其中任何一項專利申請,也不能保證專利的期限足以保護專有技術或候選產品。
88
我們的外國知識產權有限,可能無法在全球範圍內保護我們的知識產權。
我們在美國以外的知識產權有限。在世界各國申請、起訴和捍衞候選產品專利的費用將高得令人望而卻步,而且我們在美國以外的一些國家的知識產權可能沒有美國那麼廣泛。此外,一些外國的法律對知識產權的保護程度不如美國的聯邦和州法律。因此,我們可能無法阻止第三方在美國以外的所有國家/地區實施我們的發明,或在美國或其他司法管轄區銷售或進口使用我們的發明製造的產品。競爭對手可以在我們沒有獲得專利保護的司法管轄區使用我們的技術來開發自己的產品,此外,還可以將其他侵權產品出口到我們擁有專利保護但執法力度不如美國的地區。這些產品可能會在我們沒有任何已頒發專利的司法管轄區與我們的產品競爭,而我們的專利主張或其他知識產權可能不能有效或不足以阻止他們競爭。
許多公司在外國司法管轄區保護和捍衞知識產權方面遇到了重大問題。某些國家的法律制度,特別是某些發展中國家的法律制度,不贊成強制執行專利、商業祕密和其他知識產權保護,特別是與生物製藥產品有關的專利、商業祕密和其他知識產權保護,這可能使我們很難阻止侵犯我們的專利或針對第三方銷售競爭產品的行為,這些行為總體上侵犯了我們的專有權。第三方在外國司法管轄區發起訴訟,挑戰我們專利權的範圍或有效性,可能會導致鉅額成本,並將我們的努力和注意力從我們業務的其他方面轉移出去。在外國司法管轄區強制執行我們的專利權的訴訟程序可能會導致鉅額成本,並將我們的努力和注意力從我們業務的其他方面轉移出去,可能會使我們的專利面臨被無效或狹義解釋的風險,可能會使我們的專利申請面臨無法發佈的風險,並可能引發第三方對我們提出索賠。我們可能不會在我們發起的任何訴訟中獲勝,所判給的損害賠償或其他補救措施(如果有的話)可能沒有商業意義。因此,我們在世界各地執行我們的知識產權的努力可能不足以從我們開發或許可的知識產權中獲得顯著的商業優勢。
專利條款可能不足以在足夠長的時間內保護我們在候選產品上的競爭地位。
專利的壽命是有限的。在美國,如果及時支付所有維護費,專利的自然失效時間通常是自其在美國最早的非臨時申請日期起20年。專利期限調整和/或延長等各種延長可能是可用的,但專利的有效期及其提供的保護是有限的。即使獲得了涵蓋我們候選產品的專利,一旦專利有效期到期,我們可能會接受來自競爭產品的競爭。考慮到新產品候選產品的開發、測試和監管審查所需的時間,保護這些候選產品的專利可能會在這些候選產品商業化之前或之後不久到期。因此,我們擁有和許可的專利組合可能不會為我們提供足夠的權利,以排除其他公司將與我們相似或相同的產品商業化。
如果我們沒有為我們可能開發的任何候選產品獲得專利期限延長和數據獨佔權,我們的業務可能會受到實質性損害。
根據FDA對我們可能開發的任何候選產品的上市批准的時間、期限和細節,我們的一項或多項美國專利可能有資格根據1984年《哈奇-瓦克斯曼修正案》的《藥品價格競爭和專利期限恢復行動》獲得有限的專利期延長。哈奇-瓦克斯曼修正案允許專利展期最長為五年,作為對FDA監管審查過程中失去的專利期的補償。一項專利期限的延長不得超過自產品批准之日起共計14年的時間,只能延長一項專利,並且只能延長涉及經批准的藥物、其使用方法或者其製造方法的權利要求。但是,我們可能因為在測試階段或監管審查過程中未能進行盡職調查、未能在適用的最後期限內提出申請、未能在相關專利到期前提出申請或未能滿足適用的要求等原因而無法獲得延期。此外,專利保護的適用期限或範圍可能比我們要求的要短。如果我們無法獲得專利期限的延長,或者任何此類延長的期限比我們要求的要短,我們的競爭對手可能會在我們的專利到期後獲得競爭產品的批准,我們的業務、財務狀況、運營結果和前景可能會受到實質性損害。
如果我們的商標和商號沒有得到充分的保護,那麼我們可能無法在我們感興趣的市場上建立起知名度,我們的業務可能會受到不利影響。
我們的商標或商號可能會受到挑戰、侵犯、規避或宣佈為通用商標,或被確定為侵犯了其他商標。我們可能無法保護我們對這些商標和商品名稱的權利,或者可能被迫停止使用這些名稱,我們需要這些名稱來讓潛在的合作伙伴或客户在我們的
89
感興趣的市場。如果我們不能根據我們的商標和商號建立名稱認可,我們可能無法有效競爭,我們的業務可能會受到不利影響。
與我們普通股相關的風險
我們普通股的價格可能會波動很大,這可能會給股東造成重大損失。
我們的股價可能會繼續波動。一般的股票市場,特別是生物製藥公司的市場經歷了極端的波動,這種波動往往與特定公司的經營業績無關。由於這種波動性,你可能無法以或高於購買時的價格出售普通股。我們普通股的市場價格可能受到許多因素的影響,包括:
如果我們未能遵守納斯達克的持續上市要求,可能會導致我們的普通股被摘牌。
我們的普通股目前在納斯達克全球市場(納斯達克)掛牌交易。我們必須滿足納斯達克的持續上市要求,才能保持我們的普通股在納斯達克上市。2023年11月15日,我們收到納斯達克上市資格部(工作人員)的一封信,通知我們,在之前的30個工作日裏,我們普通股的收盤價連續30個工作日低於納斯達克上市規則第5450(A)(1)條規定的繼續在納斯達克上市所需的每股最低買入價(買入價要求)。2023年12月28日,工作人員通知我們,截至2023年12月28日,我們已重新遵守投標價格要求,此事已結案。
如果我們在維持必要的上市要求方面存在缺陷,我們的普通股可能會被摘牌。如果我們的普通股退市,我們普通股活躍的交易市場可能無法持續,我們普通股的市場價格可能會下降。我們普通股的退市可能會對我們通過公開或非公開出售股權證券籌集額外資本的能力產生不利影響,將嚴重影響投資者交易我們證券的能力,並將對我們普通股的價值和流動性產生負面影響。退市還可能帶來其他負面結果,包括員工可能失去信心、機構投資者失去興趣以及業務發展機會減少。
90
通過出售大量普通股籌集額外資本,或認為可能會出售大量普通股,可能會對我們的股東造成稀釋,可能導致我們的股價下跌,可能會限制我們的運營,或要求我們放棄對我們的技術或當前或未來候選產品的權利。
在此之前,如果我們能夠產生可觀的產品收入,我們預計將通過私募和公開股權發行、債務融資、合作、戰略聯盟以及營銷、分銷或許可安排來為我們的現金需求提供資金。我們目前沒有任何承諾的外部資金來源。在我們通過出售普通股或可轉換或可交換為普通股的證券籌集額外資本的情況下,您的所有權權益將被稀釋,這些證券的條款可能包括清算或其他可能對您作為普通股股東的權利產生重大不利影響的優惠。2022年8月,我們提交了一份S-3表格(經修訂,貨架)的註冊聲明,根據該聲明,我們可以在銷售中發行最多7,500萬美元的普通股,被視為1933年證券法(修訂後的證券法)所定義的“在市場上發行”(ATM計劃),以及最多2億美元的普通股、優先股、債務證券、認股權證和/或單位。截至2024年3月21日,我們已根據自動取款機計劃出售和發行了109,485股普通股,總淨收益為20萬美元。根據本註冊聲明或其他規定進行的任何證券出售或發行都可能導致我們的股東被稀釋,並可能導致我們的股票價格下跌。由於美國證券交易委員會的“嬰兒貨架規則”,禁止公開流通股低於7,500萬美元的公司在12個月內根據貨架登記聲明發行超過此類公司公開流通股三分之一的證券,因此我們目前只能發行有限數量的股票,這些股票加起來不能超過使用我們的貨架的公開流通股的三分之一。儘管可能有替代的公共和私人交易結構,但這些可能需要額外的時間和成本,可能會對我們施加運營限制,並且可能不會以有吸引力的條款提供。
債務融資如果可行,將增加我們的固定支付義務,並可能涉及一些協議,其中包括限制或限制我們採取特定行動的能力的契約,例如招致額外債務、獲取、出售或許可知識產權、進行資本支出、宣佈股息或其他可能對我們的業務開展能力產生不利影響的經營限制。我們還可能被要求在債務融資方面達到某些里程碑,如果未能在某些日期實現這些里程碑,可能會迫使我們放棄某些技術或候選產品的權利,或者以其他方式同意對我們不利的條款,這可能會對我們的業務、運營業績和前景產生重大不利影響。
如果我們通過與第三方的其他合作、戰略聯盟或營銷、分銷或許可安排來籌集資金,我們可能不得不放棄對我們的知識產權、未來收入流、研究計劃或當前或未來候選產品的寶貴權利,或者以可能對我們不利的條款授予許可。如果我們無法在需要時通過股權或債務融資籌集更多資金,我們可能會被要求推遲、縮減或停止我們一個或多個候選產品的開發和商業化,推遲我們潛在的許可證內或收購,或者授予我們開發和營銷我們本來更願意自己開發和營銷的當前或未來候選產品的權利。
我們是JOBS法案中定義的“新興成長型公司”和1934年修訂後的證券交易法(交易法)中定義的“較小的報告公司”,我們將能夠利用適用於新興成長型公司和較小報告公司的減少的披露要求,這可能會降低我們的普通股對投資者的吸引力,並對我們的普通股的市場價格產生不利影響。
我們是一家“新興成長型公司”,正如2012年的JumpStart Our Business Startups Act(JOBS法案)所定義的那樣。我們將一直是一家新興的成長型公司,直到(I)財政年度的最後一天,我們的年度總收入達到或超過12.35億美元;(Ii)2026年12月26日;(Iii)我們在過去三年中發行了超過10億美元的不可轉換債券;或(Iv)根據美國證券交易委員會(Securities And Exchange Commission)的規則,我們被視為大型加速申報公司的日期,這意味着截至6月30日,非關聯公司持有的普通股的市值超過7億美元。只要我們仍然是一家新興成長型公司,我們就被允許並打算依賴於適用於其他非新興成長型公司的上市公司的某些披露要求的豁免。這些豁免包括:
91
我們可能會選擇利用部分(但不是全部)可用的豁免。我們利用了這份Form 10-K年度報告中減少的報告負擔。特別是,我們只提供了兩年的經審計財務報表和相應減少的“管理層對財務狀況和經營結果的討論和分析”披露,而且我們沒有包括如果我們不是一家新興成長型公司所需的所有高管薪酬信息。我們無法預測,如果我們依賴這些豁免,投資者是否會發現我們的普通股吸引力下降。如果一些投資者因此發現我們的普通股吸引力下降,我們的普通股可能會有一個不那麼活躍的交易市場,我們的股價可能會更加波動。
此外,《就業法案》規定,新興成長型公司可以利用延長的過渡期來遵守新的或修訂後的會計準則。這允許新興成長型公司推遲採用某些會計準則,直到這些準則適用於私營公司。在我們仍是一家新興成長型公司期間,我們已選擇將延長的過渡期用於新的或修訂的會計準則;然而,我們可能會提前採用某些新的或修訂的會計準則。
根據《交易法》的定義,我們也是一家“較小的報告公司”。即使我們不再符合新興成長型公司的資格,我們仍可能繼續是一家規模較小的報告公司。在確定我們的非關聯公司持有的有投票權和無投票權的普通股在我們第二財季的最後一個營業日超過2.5億美元,或我們在最近結束的財年的年收入超過1億美元,以及我們的非關聯方持有的有投票權和無投票權的普通股在我們第二財季的最後一個營業日超過7億美元后,我們可能會利用某些規模較小的報告公司在下一財年之前可獲得的某些大規模披露。
儘管我們仍在評估JOBS法案,但我們目前打算利用部分(但不是全部)降低的監管和報告要求,只要我們有資格成為“新興成長型公司”和“較小的報告公司”。我們已選擇利用這一豁免,因此,我們不受與其他非新興成長型公司或較小報告公司的公眾公司相同的新或修訂會計準則的約束。因此,美國公認會計原則規則或其解釋的變化、採用新的指導或應用現有指導來改變我們的業務可能會對我們的財務狀況和運營結果產生重大影響。此外,只要我們符合“新興成長型公司”的資格,我們的獨立註冊會計師事務所就不會被要求提供關於我們財務報告內部控制有效性的證明報告,這可能會增加我們財務報告內部控制的重大弱點或重大缺陷未被發現的風險。同樣,只要我們符合“較小的報告公司”或“新興成長型公司”的資格,我們就可能選擇不向您提供某些信息,包括某些財務信息和某些關於我們高管薪酬的信息,否則我們將被要求在提交給美國證券交易委員會的文件中提供這些信息,這可能會增加投資者和證券分析師評估我們公司的難度。我們無法預測投資者是否會因為我們可能依賴這些豁免而發現我們的普通股吸引力下降。如果一些投資者因此發現我們的普通股吸引力下降,我們的普通股可能會出現不那麼活躍的交易市場,我們的股價可能會更加波動,可能會下跌。
作為一家上市公司,我們的運營成本將會增加,我們的管理層將需要投入大量時間來實施新的合規舉措和公司治理實踐。
作為一家上市公司,尤其是在我們不再是一家“新興成長型公司”之後,我們產生了大量的法律、會計和其他費用,這是我們作為一傢俬營公司沒有發生的。我們必須遵守交易法的報告要求,其中包括我們必須向美國證券交易委員會提交有關我們的業務和財務狀況的年度、季度和當前報告。此外,美國證券交易委員會和納斯達克隨後實施的SOX法案和規則對上市公司提出了各種要求,包括建立和維持有效的信息披露、財務控制和公司治理做法。我們的管理層和其他人員將需要投入大量時間來實施這些合規倡議。此外,2010年7月頒佈了《多德-弗蘭克華爾街改革和消費者保護法》(《多德-弗蘭克法案》)。多德-弗蘭克法案中有重要的公司治理和高管薪酬相關條款,要求美國證券交易委員會在這些領域採取額外的規章制度,例如“薪酬話語權”和代理訪問。新興成長型公司可能會在更長的時間內,從首次公開募股(IPO)定價之日起最長5年的時間裏,實施其中許多要求。我們打算利用這些延長的過渡期,但不能保證我們不會被要求比預算或計劃更早地執行這些要求,從而產生意外費用。股東激進主義、當前的政治環境以及當前高度的政府幹預和監管改革可能會導致大量新的監管和披露義務,
92
這可能會導致額外的合規成本,並影響我們以目前無法預料的方式運營業務的方式。
我們預計,適用於上市公司的規則和法規將大幅增加我們的法律和財務合規成本,並使一些活動更加耗時和昂貴。如果這些要求將我們管理層和員工的注意力從其他業務上轉移開,它們可能會對我們的業務、財務狀況和運營結果產生實質性的不利影響。增加的成本將減少我們的淨收益或增加我們的淨虧損,並可能要求我們降低其他業務領域的成本或提高我們產品或服務的價格。例如,我們預計這些規章制度將使我們維護董事和高級管理人員責任保險變得更加困難和昂貴。我們無法預測或估計為響應這些要求而可能產生的額外成本的金額或時間。這些要求的影響也可能使我們更難吸引和留住合格的人員加入我們的董事會、董事會委員會或擔任高管。
根據第404條,我們必須提交管理層關於財務報告的內部控制的報告,包括由我們的獨立註冊會計師事務所出具的財務報告內部控制的認證報告。然而,儘管我們仍然是一家新興的成長型公司,我們將不會被要求包括由我們的獨立註冊會計師事務所發佈的關於財務報告的內部控制的認證報告。為了在規定的時間內遵守第404條,我們將參與記錄和評估我們對財務報告的內部控制的過程,這既昂貴又具有挑戰性。在這方面,我們將需要繼續提供內部資源,可能聘請外部顧問,並通過詳細的工作計劃,以評估和記錄財務報告內部控制的充分性,繼續酌情采取步驟改進控制程序,通過測試驗證控制措施是否如文件所述發揮作用,並實施財務報告內部控制的持續報告和改進程序。儘管我們做出了努力,但我們和我們的獨立註冊會計師事務所都有可能在規定的時間框架內得出結論,證明我們對財務報告的內部控制是有效的,符合第404條的要求。這可能會導致金融市場因對我們財務報表的可靠性失去信心而產生不利反應。此外,如果我們不能繼續滿足這些要求,我們可能無法繼續在納斯達克上市。
我們的現有股東在公開市場上出售大量普通股可能會導致我們的股票價格下跌。
如果我們的現有股東在公開市場上出售或表示有意出售大量我們的普通股,我們普通股的交易價格可能會下降。截至2024年3月21日,我們共有29,347,468股普通股流通股。
此外,根據我們的2021年計劃和我們的2021年員工股票購買計劃為未來發行而保留的普通股,在證券法下各種歸屬時間表、規則144和規則701的規定允許的範圍內,將有資格在公開市場上出售。如果這些額外的普通股在公開市場上出售,或者如果人們認為它們將被出售,我們普通股的交易價格可能會下降。
持有我們普通股的8,884,661股的持有者有權根據證券法登記他們的股份。根據《證券法》登記這些股份將導致這些股份根據《證券法》不受限制地自由交易,但附屬公司持有的股份除外,如《證券法》第144條所界定。這些股東的任何證券出售都可能對我們普通股的交易價格產生實質性的不利影響。
由於我們預計在可預見的未來不會對我們的股本支付任何現金股息,因此資本增值(如果有的話)將是您唯一的收益來源。
我們從未宣佈或支付過我們股本的現金股息。我們目前打算保留我們未來的所有收益,如果有的話,為我們業務的增長和發展提供資金。此外,未來任何債務協議的條款可能會阻止我們支付股息。因此,我們普通股的資本增值(如果有的話)將是您在可預見的未來唯一的收益來源。
我們的高管、董事、主要股東及其關聯公司對我們公司具有重大影響力,這將限制您影響公司事務的能力,並可能推遲或阻止公司控制權的變更。
我們的高管、董事、主要股東及其關聯公司的現有持有量總計實益擁有我們約60.6%的已發行普通股,Estuardo Aguar-Cordova和Laura Aguar(共同直接和間接)實益擁有我們約21.1%的已發行普通股,與PBM Capital Group LLC(PBM Capital)有關聯的實體和個人實益擁有我們約29.1%的已發行普通股。因此,如果這些股東共同行動,他們將能夠影響我們的管理和事務,以及提交給我們股東批准的事項的結果,
93
包括選舉董事和任何合併、合併或出售我們所有或幾乎所有資產。投票權集中在這些股東中間,可能會對我們普通股的價格產生不利影響。此外,這種所有權集中可能通過以下方式對我們普通股的市場價格產生不利影響:
我們的章程文件和特拉華州法律中的反收購條款可能會推遲或阻止控制權的變更,這可能會限制我們普通股的市場價格,並可能阻止或挫敗我們的股東更換或罷免我們目前管理層的嘗試。
我們修訂和重述的公司註冊證書以及修訂和重述的章程中包含的條款可能會推遲或阻止我們公司的控制權變更或我們的股東可能認為有利的董事會變更。其中一些規定包括:
此外,由於我們是在特拉華州註冊成立的,我們受特拉華州公司法第203條的規定管轄,該條款可能禁止股東擁有我們已發行有表決權股票的15%或更多的某些業務合併。這些反收購條款以及我們修訂和重述的公司註冊證書以及修訂和重述的章程中的其他條款可能會使股東或潛在收購者更難獲得我們董事會的控制權,或者發起當時的董事會反對的行動,還可能推遲或阻礙涉及我們公司的合併、收購要約或代理權之爭。這些規定還可能阻止代理權競爭,並使您和其他股東更難選舉您選擇的董事或導致我們採取您希望的其他公司行動。任何延遲或阻止控制權變更、交易或董事會變動都可能導致我們普通股的市場價格下跌。
我們的章程將某些法院指定為可能由我們的股東發起的某些類型的訴訟和訴訟的唯一和獨家論壇,這可能會限制我們的股東在與我們或我們的董事、高級管理人員或員工的糾紛中獲得有利的司法論壇的能力。
我們的章程規定,除非我們以書面形式同意替代法院,否則特拉華州衡平法院將是任何州法律索賠的唯一和排他性法院,這些索賠涉及(I)代表我們提起的任何派生訴訟或訴訟,(Ii)任何聲稱我們的任何董事、高級管理人員和員工違反對我們或我們股東的受託責任的訴訟,(Iii)根據特拉華州公司法的任何規定提出索賠的任何訴訟,我們經修訂及重述的公司註冊證書或經修訂及重述的法律或(Iv)任何聲稱受內務原則管轄的訴訟,在每一案件中,均受衡平法院對被指名為被告的不可或缺的各方或特拉華論壇條款擁有個人管轄權的訴訟管轄。特拉華論壇條款不適用於根據《證券法》或《交易法》產生的任何訴訟理由。我們修訂和重述的附例進一步規定,除非我們以書面形式同意選擇替代法院,否則美國馬薩諸塞州地區法院將是解決根據證券法或聯邦法院條款提出的任何申訴的唯一和獨家論壇,因為我們的主要辦事處位於馬薩諸塞州尼達姆。此外,我們修訂和重述的章程規定,任何購買或以其他方式獲得我們普通股股份權益的個人或實體
94
被視為已知悉並同意上述條款;然而,如果股東不能也不會被視為放棄遵守聯邦證券法及其下的規則和條例。
我們修訂和重述的章程中的特拉華論壇條款和聯邦論壇條款可能會給股東在尋求任何此類索賠時帶來額外的訴訟費用,特別是如果股東不居住在特拉華州或馬薩諸塞州聯邦或其附近。此外,我們修訂和重述的章程中的論壇選擇條款可能會限制我們的股東在論壇上提出他們認為有利於與我們或我們的董事、高管或員工發生糾紛的索賠的能力,這可能會阻止針對我們和我們的董事、高管和員工的此類訴訟,即使訴訟如果成功,可能會使我們的股東受益。此外,雖然特拉華州最高法院於2020年3月裁定,根據特拉華州法律,旨在要求根據證券法提出索賠的聯邦法院選擇條款在表面上是有效的,但其他法院是否會執行我們的聯邦論壇條款仍存在不確定性。如果聯邦論壇的條款被發現不可執行,我們可能會產生與解決此類問題相關的額外費用。聯邦論壇的條款還可能對聲稱該條款不可執行或無效的股東施加額外的訴訟費用。特拉華州衡平法院和美國馬薩諸塞州地區法院也可能做出與其他法院不同的判決或結果,包括考慮訴訟的股東可能位於或將選擇提起訴訟的法院,此類判決可能或多或少對我們的股東有利。
如果證券分析師不發表關於我們業務的研究或報告,或者如果他們發表對我們股票的負面評價,我們的股票價格可能會下跌。
我們普通股的交易市場在一定程度上依賴於行業或金融分析師發佈的關於我們或我們業務的研究和報告。我們可能永遠不會獲得行業或金融分析師的研究報道。如果沒有或很少分析師開始對我們進行報道,我們股票的交易價格可能會下降。即使我們確實獲得了分析師的報道,如果一名或多名跟蹤我們業務的分析師下調了他們對我們股票的評估,我們的股票價格也可能會下跌。如果這些分析師中的一位或多位不再跟蹤我們的股票,我們可能會失去我們股票在市場上的可見度,這反過來可能會導致我們的股價下跌。
我們可能會受到證券訴訟的影響,這是昂貴的,可能會轉移管理層的注意力。
我們普通股的市場價格可能會波動。整個股市,尤其是納斯達克和生物製藥公司,經歷了極端的價格和成交量波動,這些波動往往與這些公司的經營業績無關或不成比例。特別是,由於新冠肺炎疫情,製藥、生物製藥和生物技術公司的交易價格波動很大,未來可能會因為類似的公共衞生危機而波動。過去,經歷過股票市場價格波動的公司會受到證券集體訴訟的影響。我們未來可能會成為這類訴訟的目標。針對我們的證券訴訟可能導致鉅額成本,並將我們管理層的注意力從其他業務上轉移,這可能會嚴重損害我們的業務。
由於我們在2018年11月發行了認股權證,購買了總計7,344,968股普通股,我們已發行普通股的數量可能會大幅增加。
關於2018年11月13日發行的B系列可轉換優先股(B系列優先股),我們向B系列優先股的購買者發行了認股權證,以每股6.81美元的價格購買3,672,484股普通股(B系列權證),這些認股權證在發行時是完全可以行使的,現在仍然是完全可以行使的。B系列認股權證包含允許無現金行使的條款。
此外,我們還向同一股東發行了額外的5年期認股權證,以每股6.81美元的價格購買3,672,484股普通股(B系列有條件認股權證),如果我們完成了滿足某些財務里程碑或實現某些股價的未來融資,這些認股權證將可行使,如下所示:
95
2021年6月24日,我們的董事會批准,2021年7月14日,我們的股東批准了對B系列權證和B系列有條件認股權證條款的修訂,將到期日從2023年11月延長至2025年11月,自IPO結束時起生效。此外,有條件B系列認股權證的行權期已予修訂,以便在上述未來融資里程碑或某些股價目標達成的情況下,有條件B系列認股權證只能在出售公司的同時以現金或無現金行使方式行使,或在2025年11月以無現金行使方式行使。
我們在發行時將B系列認股權證作為股東權益的組成部分,其估計公允價值為210萬美元,並將有條件B系列認股權證作為負債記錄在綜合資產負債表上,因為用於計算結算的股份數量不是固定數量的股份。有條件的B系列認股權證在每個報告日期根據其公允價值重新計量,公允價值的變動被確認為綜合經營報表中淨額的其他收入(費用)的組成部分。我們將繼續確認有條件B系列認股權證的公允價值變化,直到每一份有條件B系列認股權證被行使、到期或符合股權分類資格。
假設有條件的B系列認股權證全部歸屬,而不是淨行使,則這些認股權證的全部行使將導致額外的7,344,968股普通股流通股,導致持有我們普通股的股東的股權被大幅稀釋。此外,如果這些認股權證的持有人,包括PBM Capital,全面行使這些認股權證,這些持有人可能會對任何股東投票的結果產生重大影響,包括選舉董事和批准合併或其他企業合併交易。
項目1B。未解決的員工評論。
沒有。
項目1C。網絡安全.
網絡安全風險管理與策略
Candel根據我們的業務規模實施了符合行業標準的網絡安全風險管理流程。我們的網絡安全風險管理流程旨在評估、識別和緩解當前和新出現的網絡安全威脅帶來的風險。
我們使用各種工具和流程來實現這些目標,包括政策和程序、風險評估和測試。此外,我們還要求員工參加網絡安全風險意識培訓和網絡釣魚練習。
我們的網絡安全風險管理流程得到了第三方服務提供商的支持,其中包括一家託管服務提供商,該提供商協助公司提供威脅監控、網絡安全事件響應和升級服務等。我們依賴第三方服務提供商來協助我們的網絡安全實踐,包括漏洞評估、滲透測試和管理IT環境。我們讓新供應商能夠訪問關鍵系統或數據的流程包括供應商問卷、合同義務,以及在認為合適的情況下審查供應商審計報告。
我們的事件管理流程包括向高級管理層報告,包括首席財務官、監管和質量保證部副總裁、首席執行官和GxP Systems董事,並在適當的情況下向董事會報告。到目前為止,我們尚未發現任何對我們造成重大影響或合理地可能對我們產生重大影響的網絡安全事件或威脅,包括我們的業務戰略、運營結果或財務狀況。然而,與我們行業中的其他公司一樣,我們和我們的第三方供應商有時也會遇到可能影響我們的信息或系統的威脅。如需瞭解更多信息,請參閲本年度報告表格10-K中的第1A項“風險因素”。
網絡安全治理
董事會已將對公司網絡安全風險管理計劃的監督授權給審計委員會,包括負責審查和討論網絡安全風險,實施風險管理計劃、控制程序和程序,以及對威脅情況進行高級別審查。
我們的高級董事,信息技術(高級董事,IT)負責我們的網絡安全風險管理計劃的戰略領導和日常管理。擔任這一職務的個人擁有30多年的信息技術管理經驗和5年以上的網絡安全風險管理經驗。
96
我們的高級董事IT與我們的第三方託管IT服務提供商和董事IT定期舉行會議,以審查和評估我們的網絡安全風險管理流程。資深董事IT總監向我們的首席財務官報告調查結果,首席財務官每年向我們的審計委員會提交有關網絡安全風險、緩解策略的最新情況,並在必要時向事件應對活動提交報告。此外,我們的審計委員會會在必要時向董事會全體成員通報與網絡安全風險管理有關的事項。
項目2.財產
我們的主要辦公室位於馬薩諸塞州02494,Needham,Suite450,肯德里克大街117號,在這裏我們租用了大約15,000平方英尺的辦公和實驗室空間。我們租用這個空間的租約將於2026年8月31日終止。
項目3.法律訴訟
有時,我們可能會捲入訴訟或其他法律程序。
我們目前沒有參與任何我們管理層認為可能對我們的業務產生重大不利影響的訴訟或法律程序。無論結果如何,由於辯護和和解成本、管理資源轉移和其他因素,訴訟可能會對我們的業務、財務狀況、運營結果和前景產生不利影響。
第4項礦山安全信息披露
不適用。
97
第II部
項目5.登記市場新臺幣普通股、相關股東事項及發行人購買股權證券。
市場信息
我們的普通股在納斯達克全球市場上以CADL為代碼進行交易,並於2021年7月27日開始公開交易。在此之前,我們的普通股沒有公開市場。
2024年3月21日,我們普通股的登記持有者約有118人。股東的實際數量超過了記錄持有人的數量,包括作為受益者的股東,但其股票是由經紀人和其他被提名人以街頭名義持有的。登記在冊的股東人數也不包括其股份可能由其他實體以信託形式持有的股東。
股利政策
我們從未宣佈或支付過我們的股本的任何股息。我們目前打算保留所有可用資金和任何未來收益(如果有的話),為我們業務的發展和擴張提供資金,我們預計在可預見的未來不會支付任何現金股息。未來是否派發股息,將由本公司董事會自行決定。投資者不應期望獲得現金股利而購買我們的普通股。
未登記的股權證券銷售和收益的使用
近期出售的未註冊股權證券
沒有。
收益的使用
在首次公開招股中,我們所有普通股的發售和出售是根據證券法根據《證券法》登記的,登記聲明採用S-1表格(Reg.(第333-257444號),經修訂,於2021年7月26日被美國證券交易委員會宣佈生效。我們向美國證券交易委員會提交的截至2022年12月31日的Form 10-K年度報告所得淨收益的預期用途沒有實質性變化。
發行人及關聯購買人購買股權證券
沒有。
第六項。[已保留].
不適用。
98
第七項:管理層對財務狀況和經營成果的討論和分析。
您應閲讀以下對我們的財務狀況和經營結果的討論和分析,以及我們的合併財務報表和本年度報告中其他部分以Form 10-K格式包含的相關説明和其他財務信息。本討論和分析中包含的一些信息包含涉及風險和不確定性的前瞻性陳述。您應閲讀本年度報告10-K表格中標題為“風險因素”的部分,以討論可能導致實際結果與下文所述結果大不相同的重要因素。
概述
我們是一家臨牀階段的生物製藥公司,專注於開發現成的病毒免疫療法,引發個性化的系統性抗腫瘤免疫反應,幫助患者抗擊癌症。我們的工程病毒旨在通過病毒直接介導的癌細胞細胞毒作用,誘導由於免疫原性細胞死亡而產生的全身抗腫瘤反應,從而釋放腫瘤新抗原,並在注射部位創造促炎微環境。這是為了導致針對注射的腫瘤和未注射的遠處轉移的原位疫苗接種。我們的病毒免疫治療方法利用腫瘤內注射基因工程病毒來誘導腫瘤細胞死亡,並引發全身抗腫瘤反應。局部給藥使我們能夠實現這些效果,同時將全身毒性降至最低。據信,這些病毒免疫療法誘導的免疫細胞針對患者特定的腫瘤抗原,潛在地改善免疫“熱”腫瘤的反應,同時滲透到腫瘤微環境,將免疫反應有限的非炎症性“冷”腫瘤轉變為“熱”腫瘤。雖然我們的候選產品直接注射到腫瘤中,但我們在臨牀前研究和臨牀試驗中觀察到了系統免疫反應,這可能表明我們的候選產品有可能誘導針對遠端未注射腫瘤的系統免疫反應,也稱為“非鏡檢”效應。
我們相信病毒免疫療法是當今最有前途的癌症治療方法之一。我們的目標是通過病毒免疫療法進一步改善患者的預後,為每種腫瘤類型選擇最佳載體、特定的轉基因和臨牀適應症,同時優化產品候選屬性,例如高效價配方、誘導系統性抗腫瘤免疫的腫瘤內給藥以及可能降低患者和臨牀醫生後勤障礙的儲存條件。
我們已經建立了兩個臨牀現成的病毒免疫治療平臺,分別基於新的、遺傳化腺病毒和單純皰疹病毒(HSV)的構建。
我們最先進的候選產品CAN-2409是現成的腺病毒候選產品,與前藥萬乃洛韋聯合使用,已在一系列實體腫瘤適應症中產生了良好的臨牀活性。CAN-2409目前正在進行以下臨牀試驗:
99
100
我們基於HSV的主要候選產品CAN-3110目前正處於研究人員贊助的第一階段臨牀試驗中,這是我們治療復發高級別膠質瘤(HGG)的初步目標適應症。2024年2月,我們宣佈FDA批准了CAN-3110的快速通道指定,用於治療復發的HGG患者,以提高總體生存率。
101
這些患者SOC治療失敗,預後較差(預計總存活率
2023年10月,我們聯合發表了一篇文章自然界據報道,使用CAN-3110治療的復發HGG患者的生存期延長與免疫激活有關。值得注意的是,新數據報告了66%的抗HSV1抗體陽性患者的存活率增加(平均為14.2個月)。免疫狀態與存活率呈正相關,既有先前存在HSV1抗體的患者(治療前),也有33%的患者在單次注射CAN-3110後出現抗HSV1抗體,儘管基線為陰性。在多灶性疾病患者的注射和非注射皮損中都觀察到了臨牀反應。在A組和B組均觀察到顯著的腫瘤反應,B組患者在接受CAN-3110治療大約一年後腫瘤體積持續縮小。這名患者的臨牀反應,在數據截止時的隨訪中,在沒有額外治療的情況下繼續。對治療後樣本的分析表明,注射和未注射的腫瘤組織中均有HSV抗原持續表達和複製的證據,與CD8+T細胞滲透有關。免疫激活的程度,通過基因圖譜和治療後樣本中免疫細胞的量化來衡量,與抗HSV1抗體的存在和存活率有關。存活率也與循環T細胞中T細胞庫的多樣性有關,這表明接受CAN-3110治療的患者能夠對病毒產生不同的免疫反應,在溶瘤過程中釋放的腫瘤抗原提高了存活率。
我們正在進行一項名為ARM C的臨牀試驗的擴展,在該試驗中,復發的HGG患者將接受CAN-3110的重複劑量方案(在四個月內最多注射六次)。來自ARM C的臨牀數據將有助於評估多次注射是否會增加MoS。這項臨牀試驗延期得到了突破癌症基金會的支持。
我們還在使用我們專有的INTUTEN?Discovery平臺設計其他新型的病毒免疫療法候選藥物,這是一個系統的、基於HSV的迭代發現平臺,利用人類生物學和先進的分析方法來創建實體腫瘤的新病毒免疫療法候選藥物。2022年10月,我們與賓夕法尼亞大學(UPenn)細胞免疫療法中心合作,研究基於我們的INSTUTEN Discovery平臺的新型病毒免疫療法候選者的影響,以加強賓夕法尼亞大學研究性CAR-T細胞療法在難以治療的實體腫瘤中的活性。
2023年11月,在SITC 2023年會期間,我們展示了兩張海報,描述了該平臺的關鍵要素以及來自啟迪發現平臺的第一個實驗代理的開發。這種名為Alpha-201 Macro1的新藥是一種研究中的病毒免疫療法,旨在幹擾CD47/Sirpα途徑並激活天然免疫監視。結果顯示,在肺癌和乳腺癌的臨牀前模型中,局部給藥後具有單一治療活性。在SITC上展示的其他臨牀前數據證實,INTUTEN®Advanced Analytics套件能夠預測武裝病毒載體的最佳基因有效載荷組合,從而能夠設計潛在的組合療法來克服腫瘤耐藥性,特別是在對ICI治療具有耐藥性的癌症中。
2024年3月,我們宣佈在美國癌症研究協會2024年年會上接受一篇摘要,該摘要與我們的INITTEN®Discovery平臺的第二位候選人有關,這是一種一流的多模式免疫療法,用於誘導第三級淋巴結構,作為實體腫瘤的新治療策略。
我們目前在包括美國、歐洲和亞洲在內的主要市場擁有我們項目的開發權和商業化權利,使我們能夠在準備商業化努力時控制這些地區的開發並尋求批准。
我們於2003年6月在特拉華州成立,名稱為Advantagene,Inc.(Advantagene)。2019年12月,Advantagene授權了Periphagen的幾乎所有資產,Periphagen是一家專注於將HSV作為基因治療載體進行工程的公司,並於2020年9月從麻省總醫院(MGB)獲得了CAN-3110的授權。2020年12月,我們正式從Advantagene更名為Candel Treateutics,Inc.我們於2021年7月完成了首次公開募股。
截至2023年12月31日,我們的現金和現金等價物為3540萬美元。根據財務會計準則委員會(FASB)會計準則彙編,205-40,財務報表的列報-
102
對於持續經營的公司,我們需要評估我們在綜合財務報表發佈之日之後的一年展望期間繼續作為持續經營公司的能力。根據我們目前的運營計劃以及現有的現金和現金等價物,我們認為,在這些合併財務報表發佈後的一年內,我們作為一家持續經營的企業繼續經營的能力存在重大疑問。為了在這一年之後維持其未來的運作,我們將需要額外的資金。我們預計將通過公共或私人股本或債務融資、政府贈款和其他來源為我們的現金需求提供資金,其中可能包括與第三方的合作、戰略聯盟和許可安排。不能保證我們將成功地以可接受的條件獲得足夠的資金(如果有的話),並可能被迫推遲、減少或取消其部分或全部研究、臨牀試驗、產品開發或未來的商業化努力,這可能對我們的業務前景或我們作為持續經營企業的能力產生重大不利影響。
所附合並財務報表不包括這一不確定性結果可能導致的任何調整。因此,綜合財務報表的編制是基於假設我們將繼續作為一家持續經營的企業,並考慮在正常業務過程中實現資產以及償還負債和承諾。
協作
我們是許多許可和合作協議的一方,根據這些協議,我們向第三方許可專利、專利申請和其他知識產權。
佩裏菲根。2019年12月9日,我們與Periphagen簽訂了一系列協議,包括獨家許可協議、更新協議、設備採購協議和知識產權轉讓協議,統稱為Periphagen協議,據此我們收購了Periphagen的某些資產和許可了Periphagen的某些權利(包括指定的專利權和專有技術,或許可的IP權利),主要包括對其技術平臺和一系列臨牀前、開發階段病毒媒介的獨家權利。主要的資產類別是表達神經營養因子-3的單純皰疹病毒衍生資產(或NT-3資產)和其他單純皰疹病毒衍生資產(基因轉移神經資產)。根據許可協議,Periphagen授予我們全球獨家許可,有權在許可知識產權下通過多個層次授予再許可,以進行研究並開發、製造、製造、使用、使用、提供銷售、銷售、出口和進口包含許可知識產權的產品,用於除治療、診斷和預防非腫瘤性皮膚病和疾病(包括用作美容)之外的所有使用領域。
2023年6月7日,我們簽署了獨家許可協議修正案。根據修正案,我們對NT-3資產和基因轉移神經資產的權利恢復到Periphagen,我們不再有關於NT-3資產或基因轉移神經資產的任何義務(包括但不限於勤勉義務和支付義務)。對於剩餘的許可知識產權,我們保留了全球獨家許可的權利,有權在許可知識產權下通過多個層次授予再許可,以進行研究,並在治療、診斷和預防腫瘤疾病和疾病領域開發、製造、製造、使用、使用、提供銷售、銷售、出口和進口包含許可知識產權的產品。
布里格姆將軍(MGB)。2018年1月20日,我們與MGB簽訂了獨家期權協議(期權協議)。根據期權協議,吾等從MGB取得獨家權利,就若干MGB專利所涵蓋的產品(包括涵蓋基因療法及溶瘤載體療法以治療或預防人類或動物癌症的CAN-3110專利)進行全球特許使用費許可的開發及商業化,有關詳情已於期權協議(特許領域)中進一步詳述。作為MGB授予獨家選擇權的代價,我們向MGB支付了40,000美元的不可退還費用。
根據期權協議,吾等須盡合理努力與MGB訂立臨牀試驗協議。我們於2018年6月19日與MGB(MGB臨牀試驗協議)簽訂了這樣的臨牀試驗協議。根據《MGB臨牀試驗協議》,我們承諾根據《選項協議》中的協議摘要,免除對MGB實施指定的第1期臨牀試驗的財政支持。
2020年9月15日,我們行使了選擇權,與MGB簽訂了獨家專利許可協議(MGB許可協議)。根據MGB許可協議,MGB向我們授予(A)在MGB的某些專利下的獨家、收取版税的許可,以製造、製造、使用、使用、銷售和銷售該等許可專利所涵蓋的某些產品(許可產品),並以其他方式實踐該等許可專利所涵蓋的過程(許可過程);以及(B)根據MGB的某些其他專利,授予我們一項非獨家的、收取特許權使用費的許可,以製造、製造、使用、使用、銷售和銷售許可產品,但不得銷售或已經銷售許可過程。上述權利可再許可,但受MGB許可協議中規定的再許可條款的約束。在簽署MGB許可協議時,吾等支付了許可發放費,並同意償還MGB因準備、提交、起訴和維護許可專利權而產生和將產生的所有合理費用和開支。
103
文特根。2014年3月1日,我們與關聯方Ventagen簽訂了獨家許可協議(Ventagen協議)。Ventagen協議向Ventagen提供獨家許可,有權根據我們在Ventagen協議有效期內擁有或控制的任何世界範圍內擁有或控制的任何全球專利權和專有技術授予再許可(受某些條款和條件的約束),包括利用皰疹來源的TK蛋白通過病毒載體(如其中進一步規定)傳遞到腫瘤或其他組織的適用技術,以研究、使用、使用、進口、進口、出口、出口、要約銷售、銷售、分銷和營銷某些用於預防或治療人類癌症和任何用於動物(或使用領域)的產品,或許可產品,在墨西哥、伯利茲、危地馬拉、洪都拉斯、薩爾瓦多、哥斯達黎加、尼加拉瓜、巴拿馬、哥倫比亞和玻利維亞進行商業銷售和分銷。我們的某些股東持有Ventagen 49.5%的股份。
企業重組
2023年11月,我們的董事會批准了一項重組計劃,重點是繼續和擴大CAN-3110的開發以及啟迪TM發現平臺,這導致我們的員工減少了約45%。每名受影響的員工均於2023年12月離職。因此,該公司發生了70萬美元與受影響員工的遣散費有關的費用,包括遣散費和醫療保險費的有限報銷。一旦支付了剩餘的4.6萬美元未支付遣散費,重組計劃預計將於2024年第一季度完成。
我們運營結果的組成部分
收入
到目前為止,我們還沒有從產品銷售中獲得任何收入,在可預見的未來也不會從產品銷售中獲得任何收入。我們將2014年和2015年從Ventagen獲得的100萬美元研發服務收入確認為研發服務收入,該公司獲得了在某些國家/地區開發用於商業銷售和開發的產品的獨家許可。我們確認了我們根據許可協議提供服務期間的收入,並於2022年12月31日完全確認了收入。
運營費用
自成立以來,我們的運營費用僅包括研發成本以及一般和行政成本。
研究和開發費用
研究和開發費用主要包括我們為兩種主要候選藥物CAN-2409和CAN-3110的產品開發活動產生的成本。我們按所發生的費用來支付研究和開發費用。這些措施包括:
104
我們預計,在可預見的未來,我們的研發費用將繼續大幅增加,並將佔我們總費用的更大比例,因為我們完成了臨牀試驗並開始進行更多的臨牀試驗,繼續發現和開發更多的候選產品,並發展和擴大我們的製造能力。處於臨牀開發後期階段的候選產品通常比處於臨牀開發早期階段的候選產品具有更高的開發成本,這主要是因為後期臨牀試驗的規模和持續時間都有所增加。
我們不能確定CAN-2409和CAN-3110或我們可能開發的任何其他候選產品的未來臨牀試驗的持續時間和成本,也不能確定我們是否、何時或在多大程度上將從我們獲得市場批准的任何候選產品的商業化和銷售中產生收入。目前,我們無法準確估計或知道完成任何當前或未來候選產品的臨牀開發或獲得監管部門批准所需努力的性質、時間和成本。CAN-2409和CAN-3110以及我們可能開發的任何其他候選產品的臨牀試驗和開發的持續時間、成本和時間將取決於各種因素,包括:
這些變量中的任何一個在候選產品開發方面的結果發生變化,都可能顯著改變與該候選產品開發相關的成本和時間。我們的任何候選產品都可能永遠無法獲得監管部門的批准。
105
一般和行政費用
一般和行政費用主要包括高管、財務、業務發展和行政職能人員的工資和其他相關成本,包括基於股票的薪酬。一般和行政費用還包括與知識產權和公司事務有關的法律費用;會計、審計、税務和諮詢服務的專業費用;包括董事和高級管理人員保險在內的保險費用;差旅費用;與設施有關的費用,包括直接折舊成本和設施租金和維護費用,以及未具體歸因於研究和開發活動的其他運營成本。
我們預計,隨着我們增加員工人數,以支持我們持續的臨牀開發和製造活動,並滿足上市公司的要求,未來我們的一般和行政費用將會增加。我們預計與上市公司相關的費用將增加,包括與保持遵守交易所上市和美國證券交易委員會(美國證券交易委員會)要求相關的會計、審計、法律、監管和税務相關服務的成本;董事和高管保險成本;以及投資者和公關成本。
補助金收入
贈款收入包括從馬薩諸塞州生命科學中心獲得的贈款。
利息收入
利息收入包括投資現金等價物所賺取的金額。
利息支出
利息支出包括我們與硅谷銀行(SVB)的貸款協議下的債務利息支出。
權證責任的公允價值變動
關於2018年11月13日發行的B系列優先股,我們向B系列優先股的購買者發行了認股權證,以每股6.81美元的行使價購買最多7,344,968股我們的普通股。我們還向NC InCorporation Ohio Trust發行了認股權證,這是一家由我們出資的不可撤銷信託基金,以每股1.46美元的行使價購買162,740股我們的普通股,面值為0.01美元,受認股權證協議(NC Ohio認股權證)中規定的調整的影響。其中某些認股權證在我們的資產負債表上記錄為負債。作為負債記錄的認股權證在每個報告日期按其公允價值重新計量,公允價值變動確認為綜合經營報表中淨額的其他收入(費用)的組成部分。我們將繼續確認認股權證公平值的變動,直至該等認股權證獲行使、到期或符合權益分類資格為止。認股權證的公允價值是根據市場上無法觀察到的重大投入來確定的。權證的公允價值採用多種估值方法,包括蒙特卡洛法、期權定價法、概率加權預期收益法和混合法,所有這些方法都包含了假設和估計,以對普通權證進行估值。當公司預計在不久的將來發生流動性事件時,通常會使用混合方法,它是期權定價方法和概率加權預期回報方法的組合。影響公允價值計量的估計和假設包括普通股相關股份的每股公允價值、無風險利率、預期股息率和認股權證的剩餘合同期限。因此,公允價值可能不能被簡單的模型適當地捕捉到。
所得税
自我們成立以來,我們產生了累計的聯邦和州淨營業虧損以及研發信貸結轉,由於在各自的結轉期內使用這些税收屬性的不確定性,我們沒有記錄任何淨税收優惠。
截至2023年12月31日,我們的聯邦淨營業虧損結轉(NOL)約為8,620萬美元,州NOL約為7,960萬美元,可用於抵消未來的應税收入。我們的聯邦NOL包括880萬美元,可用於在2037年前減少未來的應税收入,以及大約7740萬美元的NOL,這些NOL不會過期,可用於無限期減少未來的應税收入。到2033年,州NOL可以抵消未來的應税收入。截至2023年12月31日,我們還有聯邦和州研發税收抵免結轉,分別為450萬美元和220萬美元,可分別抵消2043年和2038年的聯邦和州税收負擔。
未來税收優惠的實現取決於許多因素,包括我們在NOL期間產生應税收入的能力。本公司管理層已評估對本公司遞延税項資產變現有影響的正面及負面證據,主要包括營業虧損結轉淨額及若干税項抵免。
106
管理層已考慮到我們自成立以來累計淨虧損的歷史,以及自成立以來我們缺乏產品收入,並確定我們更有可能無法實現其遞延税項資產的好處。因此,在2023年12月31日設立了全額估值免税額。
如果重要股東的所有權權益在三年內累計變化超過50%,則NOL和税收抵免結轉可能受到年度限制,這是1986年《國內税法》(修訂)第382和383條以及類似的州規定所規定的。這些所有權的變化可能會限制每年可用於抵消未來應納税所得額的NOL數量。一般而言,根據《守則》第382節(第382節)的定義,所有權變更是指在三年內將某些股東或公共團體在公司股票中的所有權增加50%以上的交易。我們已經完成了幾筆融資,但尚未確定是否會對我們的北環線施加這樣的限制。在使用北環線之前,我們會作出這樣的決定。
經營成果
下表彙總了截至2023年12月31日和2022年12月31日的年度運營結果(單位:千):
|
|
截至十二月三十一日止的年度: |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
變化 |
|
|||
研發服務收入 |
|
$ |
— |
|
|
$ |
125 |
|
|
$ |
(125 |
) |
運營費用: |
|
|
|
|
|
|
|
|
|
|||
研發 |
|
|
24,506 |
|
|
|
20,787 |
|
|
|
3,719 |
|
一般和行政 |
|
|
13,885 |
|
|
|
14,060 |
|
|
|
(175 |
) |
總運營費用 |
|
|
38,391 |
|
|
|
34,847 |
|
|
|
3,544 |
|
運營虧損 |
|
|
(38,391 |
) |
|
|
(34,722 |
) |
|
|
(3,669 |
) |
補助金收入 |
|
|
— |
|
|
|
48 |
|
|
|
(48 |
) |
利息收入 |
|
|
2,081 |
|
|
|
1,218 |
|
|
|
863 |
|
利息支出 |
|
|
(2,595 |
) |
|
|
(1,708 |
) |
|
|
(887 |
) |
認股權證負債的公允價值變動 |
|
|
966 |
|
|
|
16,370 |
|
|
|
(15,404 |
) |
淨虧損 |
|
$ |
(37,939 |
) |
|
$ |
(18,794 |
) |
|
$ |
(19,145 |
) |
截至二零二三年及二零二二年十二月三十一日止年度之比較
收入
在截至2023年12月31日和2022年12月31日的財年,我們的研發服務收入分別為零和10萬美元。這意味着我們在2014年和2015年從關聯方Ventagen收到的100萬美元中的一部分被確認為研發服務收入,這筆收入在我們提供服務期間確認,並在2022年12月31日完全確認。
研究和開發費用
下表概述我們截至二零二三年及二零二二年十二月三十一日止年度的研發開支(以千計):
|
|
截至十二月三十一日止的年度: |
|
|
增加 |
|
||||||
|
|
2023 |
|
|
2022 |
|
|
(減少) |
|
|||
與員工相關 |
|
$ |
13,362 |
|
|
$ |
12,688 |
|
|
$ |
674 |
|
臨牀發展 |
|
|
7,940 |
|
|
|
5,608 |
|
|
|
2,332 |
|
固定資產銷售折舊、減值和損失 |
|
|
1,419 |
|
|
|
777 |
|
|
|
642 |
|
臨牀前研究 |
|
|
660 |
|
|
|
629 |
|
|
|
31 |
|
入住率 |
|
|
526 |
|
|
|
442 |
|
|
|
84 |
|
招聘 |
|
|
286 |
|
|
|
371 |
|
|
|
(85 |
) |
其他 |
|
|
313 |
|
|
|
272 |
|
|
|
41 |
|
|
|
$ |
24,506 |
|
|
$ |
20,787 |
|
|
$ |
3,719 |
|
研發費用從截至2022年12月31日的年度的2080萬美元增加到截至2023年12月31日的2450萬美元。這一增長主要是由於支持CAN-2409計劃的製造和監管成本增加導致臨牀開發成本增加了230萬美元,股票薪酬支出導致員工薪酬成本增加了70萬美元,以及0.6美元
107
固定資產相關費用增加100萬美元,包括製造設備的減值費用40萬美元。
一般和行政費用
下表彙總了截至2023年12月31日和2022年12月31日的年度的一般和行政費用(單位:千):
|
|
截至十二月三十一日止的年度: |
|
|
增加 |
|
||||||
|
|
2023 |
|
|
2022 |
|
|
(減少) |
|
|||
與員工相關 |
|
$ |
7,573 |
|
|
$ |
6,455 |
|
|
$ |
1,118 |
|
專業和諮詢費 |
|
|
3,666 |
|
|
|
3,629 |
|
|
|
37 |
|
保險 |
|
|
1,597 |
|
|
|
2,384 |
|
|
|
(787 |
) |
信息技術成本 |
|
|
263 |
|
|
|
76 |
|
|
|
187 |
|
入住率 |
|
|
161 |
|
|
|
184 |
|
|
|
(23 |
) |
招聘 |
|
|
159 |
|
|
|
775 |
|
|
|
(616 |
) |
其他 |
|
|
466 |
|
|
|
557 |
|
|
|
(91 |
) |
|
|
$ |
13,885 |
|
|
$ |
14,060 |
|
|
$ |
(175 |
) |
一般和行政費用從截至2022年12月31日的年度的1410萬美元減少到截至2023年12月31日的年度的1390萬美元。減少的主要原因是保險費用減少80萬美元,這是由於董事和高級管理人員保險費用降低以及徵聘費用減少60萬美元所致。這些減少被員工薪酬增加110萬美元所抵消,這是由於全年一般和行政員工人數增加所致。
補助金收入
截至2023年12月31日的年度沒有贈款收入,而截至2022年12月31日的年度為4.8萬美元。截至2022年12月31日的年度贈款收入與確認來自馬薩諸塞州生命科學中心的贈款收入有關。
利息收入
截至2023年12月31日的一年,利息收入為210萬美元,而截至2022年12月31日的一年,利息收入為120萬美元,代表我們現金等價物的收益。利息收入的增加是利率上升的結果,與截至2022年12月31日的年度相比,利率上升為截至2023年12月31日的年度產生了更高的現金等價物回報。
利息支出
截至2023年12月31日的年度的利息支出為260萬美元,而截至2022年12月31日的年度的利息支出為170萬美元,這是我們未償債務的利息支出。利息支出的增加是由於利率上升導致截至2023年12月31日的年度的定期貸款浮動利率高於截至2022年12月31日的年度。
權證責任的公允價值變動
我們權證負債的公允價值變化是截至2023年12月31日的年度的公允價值減少了100萬美元,而截至2022年12月31日的年度的公允價值減少了1640萬美元。認股權證負債的公允價值變動主要是由我們股票價格的基礎價值變動推動的。
流動性與資本資源
自成立以來,我們沒有從產品銷售中獲得任何收入,併發生了重大的運營虧損。我們預計,在可預見的未來,隨着我們推進候選產品的臨牀開發,我們將繼續招致鉅額費用和運營虧損。我們預計,我們的研發以及一般和管理成本將繼續大幅增加,包括為我們的候選產品進行臨牀試驗,發展我們的製造能力,其中可能包括與合同製造商建立關係以支持我們的候選產品CAN-2409的商業推出的成本,以及與裝備我們的實驗室和製造設施以支持臨牀試驗和商業化相關的成本,以及為我們的運營提供一般和行政支持的成本,包括與上市公司運營相關的成本。因此,我們將需要額外的資本來為我們的運營提供資金,我們可以通過額外的股權或債務融資、合作、許可安排或其他來源獲得這些資金。根據目前的計劃和假設,
108
我們預計,我們現有的現金和現金等價物將足以為我們目前的運營計劃提供資金,直至2024年第四季度。
我們目前沒有任何批准的產品,也從未從產品銷售中獲得任何收入。我們的運營資金主要來自政府撥款的收益以及出售可轉換票據、普通股和我們的可轉換優先股的收益。截至2023年12月31日,我們已經籌集了大約1.608億美元,其中包括1560萬美元的政府贈款,6610萬美元的可轉換優先股銷售,以及7910萬美元的首次公開募股(IPO)普通股銷售。截至2023年12月31日,我們的現金和現金等價物總計3540萬美元。截至2023年12月31日,我們有2130萬美元的債務。從2023年12月31日到2024年3月21日,我們通過ATM計劃(定義如下)籌集了20萬美元。
於2022年2月24日,吾等與SVB訂立貸款及擔保協議貸款協議,據此,SVB同意向吾等提供本金總額為2,000萬元的定期貸款。我們在簽訂貸款協議時借了2000萬美元。在2022年12月31日或之前的任何時間,只要實現了以下所有里程碑,我們可以借入不超過500萬美元的額外本金,包括:(A)來自我們的CAN-2409 NSCLC臨牀試驗的陽性2期臨牀活動數據,(B)我們的第一位患者在我們的3期CAN-2409高級別膠質瘤臨牀試驗中的劑量;以及(C)在2022年12月31日或之前,從向SVB接受的投資者發行和銷售股票獲得的至少7500萬美元的現金淨收益。在2022年12月31日或之前,我們沒有借入任何額外的本金總額。定期貸款以吾等的所有財產、權利及資產作抵押,但吾等的知識產權除外,該等知識產權須受貸款協議項下的負質押約束。
定期貸款的年利率為浮動利率,相當於(A)5.75%和(B)最優惠利率(如《華爾街日報》貨幣利率部分所公佈)加2.50%兩者中的較大者。我們需要按月支付利息,從2024年2月1日開始,我們將連續24期本金加按月支付的應計利息。定期貸款將於2026年1月1日到期。在全額償還定期貸款後,我們將被要求支付相當於正在償還的任何基金定期貸款的原始本金4.50%的最後付款費用。貸款協議允許自願預付所有(但不少於全部)SVB定期貸款,但須根據預付時間收取1%至3%的預付款溢價。
2022年8月5日,我們向美國證券交易委員會提交了一份S-3表格(經修訂,即書架)的書架登記聲明,其中包括我們發行、發行和出售總計2億美元的我們的普通股、優先股、債務證券、權證和/或其任何組合單位。我們同時與作為銷售代理的Jefferies LLC簽訂了一項銷售協議,規定我們將不時根據貨架(自動取款機計劃)發行和銷售高達7500萬美元的普通股。2022年8月12日,美國證券交易委員會宣佈《貨架》生效。自2023年12月31日至2024年3月21日,我們已根據自動櫃員機計劃出售和發行了109,485股普通股,總淨收益為20萬美元。
截至2023年12月31日,我們的累計赤字為1.37億美元,沒有產生任何產品銷售。我們不知道何時或是否會從產品銷售中獲得收入。我們不會從產品銷售中獲得可觀的收入,除非我們獲得監管部門的批准,並將我們當前或未來的候選產品之一商業化。我們資本的主要用途是,我們預計將繼續是薪酬和相關費用、第三方臨牀和合同製造成本、法律和其他監管費用以及一般管理費用。我們預計在可預見的未來我們將繼續產生虧損,隨着我們繼續開發我們的候選產品並尋求監管部門的批准,並開始將任何批准的產品商業化,我們預計虧損將會增加。我們的產品開發存在風險,可能會遇到不可預見的費用、困難、併發症、延誤等未知因素,可能會對我們的業務產生不利影響。我們將需要大量的額外資金來為我們的運營提供資金,並繼續執行我們的戰略,我們將尋求一系列選擇來獲得更多資金。
如果我們通過與第三方的合作、戰略聯盟或營銷、分銷或許可安排籌集更多資金,我們可能被要求放棄對我們的技術、未來收入來源、研究計劃或候選產品的寶貴權利,或者以可能對我們不利的條款授予許可證。如果我們無法在需要時或在可接受的條件下籌集資金,這將對我們的財務狀況產生負面影響,我們可能被迫推遲、減少或取消我們的研究、臨牀試驗、產品開發或未來的商業化努力。
現金流
下表彙總了所列期間我們的現金來源和使用情況(以千計):
109
|
|
截至十二月三十一日止的年度, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
用於經營活動的現金淨額 |
|
$ |
(34,244 |
) |
|
$ |
(31,419 |
) |
用於投資活動的現金淨額 |
|
|
(280 |
) |
|
|
(1,297 |
) |
融資活動提供的現金淨額(用於) |
|
|
(121 |
) |
|
|
19,974 |
|
現金和現金等價物淨減少 |
|
$ |
(34,645 |
) |
|
$ |
(12,742 |
) |
截至2023年12月31日及2022年12月31日止年度的現金流量
經營活動
在截至2023年12月31日的一年中,經營活動中使用的現金淨額為3420萬美元,主要包括淨虧損3790萬美元,原因是我們發生了與臨牀項目相關的費用,在2023年第四季度重組前增加了員工人數,以及與上市公司運營相關的成本。此外,由於認股權證負債公允價值的變化,我們有100萬美元的非現金收入。非現金收入被520萬美元的非現金費用部分抵消,非現金費用主要與基於非現金的股票薪酬和折舊費用有關。業務活動中使用的現金淨額也受到業務資產和負債變化50萬美元的影響,這主要是由於與租賃有關的負債減少50萬美元和應計費用減少30萬美元。這些變化被預付費用和其他流動資產減少50萬美元部分抵消。
在截至2022年12月31日的一年中,經營活動中使用的現金淨額為3140萬美元,主要包括1880萬美元的淨虧損,這是因為我們發生了與臨牀項目相關的費用、增加了員工人數以及與上市公司運營相關的成本。此外,由於認股權證負債公允價值的變化,我們的非現金收入為1640萬美元,但被310萬美元的非現金股票補償和折舊費用部分抵消。用於經營活動的現金淨額也受到經營資產和負債變化10萬美元的影響,主要是由於應計費用增加130萬美元,預付費用和其他流動資產減少40萬美元。應付賬款減少120萬美元,與租賃有關的負債減少50萬美元,部分抵消了這些變化。
投資活動
截至2023年12月31日的年度,用於投資活動的現金淨額為30萬美元,其中包括購買固定資產,但出售固定資產的收益部分抵消了這一淨額。
截至2022年12月31日的年度,用於投資活動的現金淨額為130萬美元,這是由於130萬美元用於購買固定資產。
融資活動
在截至2023年12月31日的一年中,用於融資活動的現金淨額為10萬美元,其中包括與既有限制性股票單位預扣税款相關的付款。
截至2022年12月31日的年度,融資活動提供的現金淨額為2,000萬美元,主要包括與SVB的定期貸款淨收益1,990萬美元。
資金需求
我們預計,未來與我們正在進行的活動相關的運營費用將大幅增加,特別是隨着我們通過研發、臨牀試驗推進CAN-2409和CAN-3110,以及發展我們的製造能力,隨着我們研究和開發包括臨牀前活動在內的其他候選產品,以及我們為上市批准和商業化做準備。我們還預計會產生與上市公司運營相關的額外成本。
具體地説,我們的成本和支出將增加,因為我們:
110
我們相信,截至2023年12月31日的現有現金和現金等價物將使我們能夠為2024年第四季度的運營費用和資本支出需求提供資金。我們基於可能被證明是不正確的假設做出了這一估計,我們可以比目前預期的更快地利用我們的可用資本資源。
由於與治療藥物的研究、開發和商業化相關的許多風險和不確定性,很難確定地估計我們所需的營運資金數額。我們未來的撥款需求將視乎多項因素而定,包括:
在我們能夠從產品銷售中獲得可觀的收入之前,如果有的話,我們預計將通過公共或私人股本或債務融資和其他來源的組合來滿足我們的現金需求,其中可能包括合作、戰略聯盟和與第三方的許可安排。我們沒有任何承諾的外部資金來源。在我們通過出售股權或可轉換債務證券籌集額外資本的情況下,您的所有權權益可能會被稀釋,這些證券的條款可能包括清算或其他可能對您作為普通股股東的權利產生不利影響的優惠。債務融資和股權融資(如果可行)可能涉及的協議包括限制或限制我們採取特定行動的能力的限制性契約,例如招致額外債務、進行資本支出或宣佈股息,這些行動可能對我們的業務經營能力產生不利影響,此外,貸款協議中包含的限制性契約也可能影響我們的經營能力。如果我們通過其他渠道籌集更多資金,如合作協議、戰略聯盟、許可安排或營銷和分銷安排,我們可能不得不放棄對我們的技術、未來收入來源、產品開發和研究計劃或產品候選的寶貴權利,或者以可能對我們不利的條款授予許可證。如果我們無法在需要時籌集更多資金,我們可能會被要求推遲、限制、減少或終止我們的產品開發或未來的商業化努力,或者授予我們開發和營銷我們本來更願意自己開發和營銷的產品或候選產品的權利。
合同義務和承諾
我們的主要合同義務是我們的設施租賃、與SVB的貸款協議和Periphagen Note。下表彙總了將於2023年12月31日到期的合同義務(單位:千):
111
|
|
按期間到期的付款 |
|
|||||||||||||
|
|
(單位:千) |
|
|||||||||||||
|
|
共計 |
|
|
少於 |
|
|
1至3 |
|
|
3至5個 |
|
||||
經營租賃債務(1) |
|
$ |
1,626 |
|
|
$ |
598 |
|
|
$ |
1,028 |
|
|
$ |
— |
|
與SVB簽訂的貸款協議(2) |
|
|
22,514 |
|
|
$ |
10,976 |
|
|
$ |
11,538 |
|
|
|
— |
|
周圍性筆記(三) |
|
|
1,352 |
|
|
|
— |
|
|
|
— |
|
|
|
1,352 |
|
總計 |
|
$ |
25,492 |
|
|
$ |
11,574 |
|
|
$ |
12,566 |
|
|
$ |
1,352 |
|
有關這些協議的更多信息,請參閲本年度報告Form 10-K中其他部分的財務報表和相關腳註。
我們還在正常業務過程中與醫院、診所、大學和其他第三方簽訂臨牀試驗和測試合同,並與建築承包商和工藝開發商簽訂合同,建設我們的製造設施。這些合同不包含最低購買承諾,我們可以提前書面通知取消合同。取消時應支付的款項僅包括截至取消之日為止所提供服務的付款或發生的費用,包括我們服務提供商的不可取消義務。由於不知道這些付款的數額和時間,上表不包括這些付款。
關鍵會計估計
我們管理層對財務狀況和經營結果的討論和分析是以我們的財務報表為基礎的,這些報表是根據美國公認會計準則編制的。在編制我們的財務報表和相關披露時,我們需要作出估計和假設,以影響我們財務報表中報告的資產和負債、成本和費用以及或有資產和負債的披露。我們對這些項目進行監測和分析,以瞭解事實和情況的變化,這些估計可能在未來發生重大變化。我們根據歷史經驗、已知趨勢和事件以及我們認為在當時情況下合理的各種其他因素作出估計,這些因素的結果構成對資產和負債的賬面價值作出判斷的基礎,而這些資產和負債的賬面價值從其他來源看起來並不明顯。我們在持續的基礎上評估我們的估計和假設。在不同的假設或條件下,我們的實際結果可能與這些估計值大不相同。
雖然我們的主要會計政策在本年度報告10-K表格中其他地方的綜合財務報表附註中有更詳細的描述,但我們認為以下會計政策對我們編制綜合財務報表時使用的判斷和估計最重要。
應計研究與開發費用
作為編制財務報表過程的一部分,我們需要估計我們應計的研發費用。這一過程包括審查未結合同和採購訂單,與我們的人員溝通以確定代表我們執行的服務,以及在我們尚未收到發票或以其他方式通知實際成本的情況下,估計所執行的服務水平和服務產生的相關成本。我們的大多數服務提供商都按照預定的時間表或在達到合同里程碑時向我們開出欠款發票,但有些服務提供商需要預付款項。我們根據我們當時所知的事實和情況,在財務報表中對截至每個資產負債表日期的應計費用進行估計。我們定期與服務提供商確認這些估計的準確性,並在必要時進行調整。估計應計研究和開發費用的例子包括支付給下列人員的費用:
實際提供的服務可能與我們的估計不同,從而導致對未來期間的研發成本或庫存進行調整。這些估計的變化會導致我們的應計項目發生重大變化,這可能會對我們的運營結果產生重大影響。
112
權證公允價值的確定
關於2018年11月發行的B系列可轉換優先股,本公司發行了認股權證,以購買普通股股份,其中某些認股權證在資產負債表上顯示為負債。認股權證的公允價值是根據市場上無法觀察到的重大投入確定的。權證的公允價值採用多種估值方法,包括蒙特卡洛法、期權定價法、概率加權預期收益法和混合法,所有這些方法都包含了假設和估計,以對普通權證進行估值。當公司預計在不久的將來發生流動性事件時,通常會使用混合方法,它是期權定價方法和概率加權預期回報方法的組合。影響公允價值計量的估計和假設包括首次公開發售前普通股相關股份的每股公允價值、無風險利率、預期股息收益率、相關優先股價格的預期波動率以及認股權證的剩餘合同期限。模型中影響普通股認股權證公允價值的最重要假設是公司普通股在每個重新計量日期的公允價值。在首次公開募股之前,該公司通過考慮最近出售的優先股、從第三方估值獲得的結果以及其他被認為相關的因素來確定相關普通股的每股公允價值。
基於股票的薪酬
我們根據授予日的公允價值來衡量授予我們的員工、董事、顧問和顧問的股票期權和其他基於股票的獎勵,獎勵扣除實際沒收後,在必要的服務期內,通常是相應獎勵的歸屬期。對於授予非僱員的基於股票的獎勵,補償費用在歸屬期間確認,該期間近似於該等非僱員提供服務的期間。
我們使用Black-Scholes期權定價模型估算授予日每個股票期權的公允價值,該模型使用我們普通股的公允價值和我們對普通股預期波動率、我們股票期權的預期期限、接近我們股票期權預期期限的一段時間的無風險利率以及我們的預期股息收益率所做的假設作為輸入。
近期會計公告
對可能影響我們財務狀況、經營結果或現金流的最近會計聲明的描述,在本年度報告10-K表其他部分包括的經審計的綜合財務報表的附註2中披露。
新興成長型公司的地位
2012年4月,《2012年創業啟動法案》(JOBS Act)頒佈。JOBS法案第107條規定,“新興成長型公司”或EGC可以利用經修訂的1933年證券法(證券法)第7(A)(2)(B)條規定的延長過渡期,以遵守新的或修訂的會計準則。因此,企業會計準則委員會可以推遲採用某些會計準則,直到這些準則適用於私營公司。在我們仍是一家新興成長型公司期間,我們已選擇將延長的過渡期用於新的或修訂的會計準則;然而,我們可能會提前採用某些新的或修訂的會計準則。
我們將一直是一家新興的成長型公司,直到出現以下最早的情況:(1)本財年的最後一天,我們的年收入超過12.35億美元;(2)我們有資格成為“大型加速申報公司”的日期,非關聯公司持有至少7.00億美元的股權證券;(3)我們在之前三年期間發行了超過10億美元的不可轉換債務證券;以及(4)在我們首次公開募股五週年後結束的財年的最後一天。
113
第7A項。關於市場風險的定量和定性披露。
根據修訂後的1934年《證券交易法》第12b-2條的定義,我們是一家較小的報告公司,不需要根據這一項提供信息。
項目8.財務報表和補充數據
我們的綜合財務報表,連同我們獨立註冊會計師事務所的報告,從截至2023年12月31日的年度報告F-1頁開始。
第九項會計和財務披露方面的變更和分歧。
沒有。
第9A項。控制和程序。
對控制和程序有效性的限制
我們的管理層認識到,任何控制和程序,無論設計和操作多麼良好,都只能為實現其目標提供合理的保證,我們的管理層必須在評估可能的控制和程序的成本-收益關係時應用其判斷。
信息披露控制和程序的評估
我們的管理層負責建立和維護對財務報告的充分內部控制(根據1934年《證券交易法》修訂後的第13a-15(F)條規定)。我們維持《1934年證券交易法》(修訂後的《交易法》)第13a-15(E)和15d-15(E)條所定義的“披露控制和程序”,旨在確保我們根據交易法提交或提交的報告中需要披露的信息:(1)在美國證券交易委員會的規則和表格規定的時間內記錄、處理、彙總和報告;(2)積累並酌情傳達給我們的管理層,包括我們的主要高管和首席財務官,以便及時做出關於所需披露的決定。我們的管理層認識到,任何控制和程序,無論設計和操作多麼良好,都只能為實現其目標提供合理的保證,我們的管理層必須在評估可能的控制和程序的成本效益關係時應用其判斷。我們的披露控制和程序旨在為實現其控制目標提供合理保證。
我們的管理層在我們的首席執行官和首席財務官(分別是我們的首席執行官和首席財務官)的參與下,評估了截至2023年12月31日我們的披露控制程序的有效性。根據對我們截至2023年12月31日的披露控制和程序的評估,我們的首席執行官和首席財務官得出結論,截至該日期,我們的披露控制和程序在合理的保證水平下是有效的。
管理層關於財務報告內部控制的報告
我們的管理層負責建立和維護對財務報告的充分內部控制。對財務報告的內部控制在《交易法》第13a-15(F)和15d-15(F)條中被定義為一種程序,由公司的主要執行人員和主要財務官或履行類似職能的人員設計或在其監督下進行,並由公司的董事會、管理層和其他人員實施,以根據公認的會計原則對財務報告的可靠性和為外部目的編制財務報表提供合理保證,包括下列政策和程序:
由於其固有的侷限性,財務報告的內部控制可能無法防止或發現錯誤陳述。對未來期間進行任何有效性評估的預測都有這樣的風險,即由於條件的變化,控制措施可能變得不充分,或者對政策或程序的遵守程度可能惡化。在我們主要行政人員和主要財務人員的監督和參與下
114
我們的管理層根據特雷德韋委員會贊助組織委員會制定的標準評估了截至2023年12月31日的財務報告內部控制的有效性-綜合框架(2013)。基於這一評估,管理層得出結論,我們對財務報告的內部控制自2023年12月31日起有效。
這份10-K表格的年度報告不包括我們的獨立註冊會計師事務所關於財務報告的內部控制的證明報告,因為就業法案為“新興成長型公司”確立了豁免。
財務報告內部控制的變化
在截至2023年12月31日的三個月內,我們對財務報告的內部控制(根據《交易法》第13a-15(F)和15(D)-15(F)條的定義)沒有發生重大影響或合理地可能對我們的財務報告內部控制產生重大影響的變化。
項目9B。其他信息。
在截至2023年12月31日的三個月內,我們的任何董事或高級管理人員(如修訂後的1934年《證券交易法》第16a-1(F)條所界定)
項目9C。關於妨礙檢查的外國司法管轄區的披露.
不適用。
115
第三部分
項目10.董事、行政人員和公司治理
第10條所要求的信息將包括在我們提交給美國證券交易委員會(美國證券交易委員會)的關於我們2024年股東年會的最終委託書中,並通過引用併入本文。
第11項.行政人員薪酬
第11條所要求的信息將包括在我們提交給美國證券交易委員會的關於我們2024年股東年會的最終委託書中,並通過引用併入本文。
第12項:某些實益所有人的擔保所有權和管理層及相關股東事項。
第12條所要求的信息將包括在我們提交給美國證券交易委員會的關於我們2024年股東年會的最終委託書中,並通過引用併入本文。
第十三條某些關係和相關交易,以及董事的獨立性。
第13條所要求的信息將包括在我們提交給美國證券交易委員會的關於我們2024年股東年會的最終委託書中,並通過引用併入本文。
第14項。首席會計師費用及服務.
我們的獨立公共會計師事務所是KPMG LLP,Boston,Massachusetts,PCAOB Auditor ID
第14條所要求的信息將包括在我們提交給美國證券交易委員會的關於我們2024年股東年會的最終委託書中,並通過引用併入本文。
116
第四部分
項目15.證物和財務報表附表
關於本報告所列財務報表一覽表,請參閲本年度報告F-1頁表格10-K中的綜合財務報表索引,作為參考併入本項目。
財務報表附表已被省略,因為它們要麼不是必需的,要麼不適用,或者這些信息已列入合併財務報表或其附註。
展品:
展品 數 |
|
描述 |
3.1 |
|
Candel Therapeutics,Inc.修訂和重述的註冊證書。(通過引用2021年7月30日向SEC提交的註冊人當前表格8—K報告的附件3.1) |
3.2 |
|
Candel Therapeutics,Inc.修訂和重申的章程(通過引用2021年7月30日向SEC提交的註冊人當前表格8—K報告的附件3.2) |
4.1 |
|
普通股股票樣本(參照2021年7月16日向美國證券交易委員會備案的註冊人登記説明書S-1/A表格(檔號333-257444)附件4.1併入) |
4.2 |
|
證券説明(參考註冊人於2022年3月29日向美國證券交易委員會提交的10-K表格年度報告的附件4.2) |
4.3 |
|
投資者權利協議(參考2021年6月25日提交給美國證券交易委員會的登記人登記聲明S-1/A表格(文件編號333-257444)附件4.2併入) |
4.4 |
|
2018年11月無條件購買普通股認股權證表格(參考2021年7月16日提交給美國證券交易委員會的註冊人登記説明書S-1/A表格(文件編號333-257444)附件4.3併入) |
4.5 |
|
2018年11月普通股購買條件認股權證表格(參考2021年7月16日提交給美國證券交易委員會的註冊人登記説明書S-1/A表格(文件編號333-257444)附件4.4併入) |
4.6 |
|
購買A系列可轉換優先股認股權證表格(參考2021年6月25日提交給美國證券交易委員會的註冊人註冊説明書S-1/A表格(文件編號333-257444)附件4.5併入) |
10.1# |
|
經修訂的2015年股票計劃及其授予協議的格式(通過引用附件10.1併入2021年7月16日提交給美國證券交易委員會的註冊人註冊説明書S-1/A表格(文件編號333-257444)) |
10.2# |
|
2021年股票期權和激勵計劃及其獎勵協議的格式(通過引用附件10.2併入2021年7月16日提交給美國證券交易委員會的註冊人登記説明書S-1/A表格(文件編號333-257444)) |
10.3# |
|
高管現金激勵獎金計劃(參照2021年7月16日向美國證券交易委員會提交的註冊人登記説明書S-1/A表格(檔號333-257444)附件10.3併入) |
10.4# |
|
員工購股計劃(參考2021年7月16日向美國證券交易委員會提交的登記人登記説明書S-1/A表格(文件編號333-257444)附件10.4) |
10.5# |
|
由Advantagene,Inc.d/b/a Candel Treeutics和Paul Peter Tak,M.D.,Ph.D.於2020年9月12日簽訂的僱傭協議(通過參考2021年7月16日提交給美國證券交易委員會的註冊人註冊聲明S-1/A表格(文件編號333-257444)的附件10.5.1併入) |
10.6# |
|
賠償協議書表格(參考2021年7月16日向美國證券交易委員會提交的註冊人登記聲明S-1/A表格(檔號333-257444)附件10.6) |
10.7 |
|
Advantagene,Inc.和Ventagen,LLC之間的獨家許可協議,日期為2014年3月1日(通過參考2021年7月16日提交給美國證券交易委員會的註冊人註冊聲明S-1/A表格(文件編號333-257444)附件10.7併入) |
10.8 |
|
由Advantagene,Inc.,d/b/a Candel Treateutics和Periphagen,Inc.於2019年12月9日簽訂的獨家許可協議(通過引用附件10.8併入2021年7月16日提交給美國證券交易委員會的註冊人註冊説明書S-1/A表格(文件編號333-257444)中) |
10.9 |
|
Advantagene公司和MassGeneral Brigham(前身為Brigham and Women‘s Hospital,Inc.)之間的獨家專利許可協議日期:2020年9月15日(合併 |
117
|
|
參考2021年7月16日向美國證券交易委員會備案的註冊人S-1/A表格(檔號333-257444)第10.9號) |
10.10 |
|
截至2019年2月4日,由117 Kendrick DE有限責任公司與註冊人租用馬薩諸塞州李約瑟肯德里克街117號的房產(通過參考2021年7月16日提交給美國證券交易委員會的註冊人S-1/A表格(文件編號333-257444)中的附件10.10併入) |
10.11 |
|
註冊人與硅谷銀行之間的貸款和擔保協議,日期為2022年2月24日(通過引用附件10.11併入註冊人於2022年3月29日提交給美國證券交易委員會的10-K表格年度報告中) |
10.12# |
|
坎德爾治療公司和弗朗西絲卡·巴龍於2022年2月3日簽訂的僱傭協議(通過引用附件10.12併入註冊人於2022年3月29日提交給美國證券交易委員會的10-K表格年度報告中) |
10.13# |
|
坎德爾治療公司和蘇珊·斯圖爾特於2021年10月19日簽訂的諮詢協議(通過引用附件10.13併入註冊人於2022年3月29日提交給美國證券交易委員會的10-K表格年度報告中) |
10.14# |
|
Candel Treeutics和Seshu Tyagarajan於2022年4月14日簽訂的僱傭協議(通過引用附件10.8併入註冊人於2022年5月12日提交給美國證券交易委員會的Form 10-Q季度報告中) |
10.15# |
|
坎德爾治療公司和傑森·A·阿梅洛於2022年9月21日簽訂的僱傭協議(通過引用附件10.1併入註冊人於2022年11月10日提交給美國證券交易委員會的10-Q表格季度報告中) |
10.16** |
|
Candel Treeutics和SAFC Carlsad,Inc.簽訂的《主生產服務協議》,2022年11月3日生效(通過引用附件10.16併入註冊人於2023年3月30日提交給美國證券交易委員會的Form 10-K年度報告中) |
10.17** |
|
對Candel Treateutics,Inc.和Periphagen,Inc.於2023年6月7日簽訂的獨家許可協議的修正案(通過引用註冊人於2023年8月10日提交給美國證券交易委員會的Form 10-Q季度報告的附件10.1而併入) |
10.18 |
|
坎德爾治療公司和硅谷銀行之間貸款和擔保協議的第一修正案,日期為2023年6月14日(通過引用附件10.2併入註冊人於2023年8月10日提交給美國證券交易委員會的10-Q表格季度報告中) |
10.19#* |
|
Candel Treateutics,Inc.和Jason A.Amello之間的諮詢,日期為2024年1月12日 |
21.1 |
|
子公司清單(參照註冊人於2022年3月29日向美國證券交易委員會提交的10-K表格年度報告附件21.1併入) |
23.1* |
|
獨立註冊會計師事務所畢馬威會計師事務所同意 |
24.1* |
|
授權書(包括在簽名頁上) |
31.1* |
|
依照依照2002年《薩班斯-奧克斯利法案》第302節通過的1934年《證券交易法》第13a-14(A)和15d-14(A)條頒發的首席執行官證書 |
31.2* |
|
根據依照2002年《薩班斯-奧克斯利法案》第302節通過的1934年《證券交易法》第13a-14(A)和15d-14(A)條對首席財務官的證明 |
32.1*+ |
|
根據2002年《薩班斯-奧克斯利法案》第906條通過的《美國法典》第18編第1350條對首席執行官和首席財務官的認證 |
97.1* |
|
賠償追討政策 |
101.INS |
|
內聯XBRL實例文檔-實例文檔不顯示在交互數據文件中,因為XBRL標記嵌入在內聯XBRL文檔中。 |
101.SCH |
|
內聯XBRL分類擴展架構文檔 |
101.CAL |
|
內聯XBRL分類擴展計算鏈接庫文檔 |
101.DEF |
|
內聯XBRL分類擴展定義Linkbase文檔 |
101.LAB |
|
內聯XBRL分類擴展標籤Linkbase文檔 |
101.PRE |
|
內聯XBRL分類擴展演示文稿Linkbase文檔 |
104 |
|
封面交互數據文件(嵌入內聯XBRL文檔中) |
*現送交存檔。
+ 本協議附件32.1中提供的證明被視為以表格10—K與本年度報告一起提供,並且將不被視為根據1934年證券交易法第18條(經修訂)之目的“存檔”,除非註冊人以引用方式特別納入該文件。
#表示管理合約或任何補償計劃、合約或安排
118
* * 本展覽的部分已被刪除,方法是編輯一部分文字,並將其替換為"[***]"因為它們都是(i)不重要的,以及(ii)註冊人視為私人或機密的信息類型。
項目16.表格10-K摘要
不適用。
119
合併財務報表索引
|
頁面
|
獨立註冊會計師事務所報告 |
F-2 |
合併資產負債表 |
F-3 |
合併業務報表 |
F-4 |
股東權益合併報表 |
F-5 |
合併現金流量表 |
F-6 |
合併財務報表附註 |
F-7 |
F-1
獨立註冊會計師事務所報告
致股東和董事會
坎德爾治療公司:
對合並財務報表的幾點看法
我們審計了Candel治療公司及其子公司(本公司)截至2023年12月31日和2022年12月31日的合併資產負債表、截至2023年12月31日的各年度的相關綜合經營報表、股東權益和現金流量以及相關附註(統稱為綜合財務報表)。我們認為,綜合財務報表在所有重要方面都公平地反映了公司截至2023年12月31日和2022年12月31日的財務狀況,以及截至那時為止的每一年的經營結果和現金流量,符合美國公認會計原則。
持續經營的企業
隨附的綜合財務報表的編制假設公司將繼續作為一家持續經營的企業。正如綜合財務報表附註1所述,本公司自成立以來錄得累計虧損、經營虧損及營運現金負流量,並預期在可預見的未來將繼續蒙受該等虧損及負現金流量,令人對其作為持續經營企業的能力產生重大懷疑。附註1也説明瞭管理層在這些事項上的計劃。合併財務報表不包括可能因這種不確定性的結果而產生的任何調整。
意見基礎
這些合併財務報表由公司管理層負責。我們的責任是根據我們的審計對這些合併財務報表發表意見。我們是一家在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券法以及美國證券交易委員會和PCAOB的適用規則和法規,我們必須與公司保持獨立。
我們是按照PCAOB的標準進行審計的。這些準則要求我們計劃和執行審計,以獲得關於合併財務報表是否沒有重大錯報的合理保證,無論是由於錯誤還是舞弊。本公司並無被要求對其財務報告的內部控制進行審計,我們也沒有受聘進行審計。作為我們審計的一部分,我們被要求瞭解財務報告的內部控制,但不是為了對公司財務報告內部控制的有效性發表意見。因此,我們不表達這樣的意見。
我們的審計包括執行評估合併財務報表重大錯報風險的程序,無論是由於錯誤還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查關於合併財務報表中的金額和披露的證據。我們的審計還包括評價管理層使用的會計原則和作出的重大估計,以及評價合併財務報表的整體列報。我們相信,我們的審計為我們的觀點提供了合理的基礎。
/s/
我們自2019年以來一直擔任本公司的審計師
2024年3月28日
F-2
坎德爾治療公司
鞏固的基礎噴槍牀單
(單位為千,不包括每股和每股金額)
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
資產 |
|
|
|
|
|
|
||
流動資產: |
|
|
|
|
|
|
||
現金和現金等價物 |
|
$ |
|
|
$ |
|
||
預付費用和其他流動資產 |
|
$ |
|
|
|
|
||
流動資產總額 |
|
|
|
|
|
|
||
固定資產,淨額 |
|
$ |
|
|
|
|
||
使用權資產租賃 |
|
$ |
|
|
|
|
||
受限現金 |
|
$ |
|
|
|
|
||
其他資產 |
|
$ |
|
|
|
— |
|
|
總資產 |
|
$ |
|
|
$ |
|
||
負債與股東權益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
應付帳款 |
|
$ |
|
|
$ |
|
||
應計費用 |
|
$ |
|
|
|
|
||
應付銀行定期貸款的流動部分 |
|
$ |
|
|
|
— |
|
|
租賃負債的當期部分 |
|
$ |
|
|
|
|
||
其他流動負債 |
|
$ |
— |
|
|
|
|
|
流動負債總額 |
|
|
|
|
|
|
||
遞延收入 |
|
$ |
— |
|
|
|
|
|
應付銀行的定期貸款 |
|
$ |
|
|
|
|
||
其他長期債務 |
|
$ |
|
|
|
|
||
租賃負債,扣除當期部分 |
|
$ |
|
|
|
|
||
認股權證法律責任 |
|
$ |
|
|
|
|
||
總負債 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
股東權益: |
|
|
|
|
|
|
||
優先股,$ |
|
$ |
|
|
|
|
||
普通股,$ |
|
$ |
|
|
|
|
||
庫存股(按成本計算) |
|
$ |
( |
) |
|
|
( |
) |
額外實收資本 |
|
$ |
|
|
|
|
||
累計赤字 |
|
$ |
( |
) |
|
|
( |
) |
股東權益總額 |
|
|
|
|
|
|
||
總負債和股東權益 |
|
$ |
|
|
$ |
|
||
附註是這些合併財務報表的組成部分。
F-3
坎德爾治療公司
業務處合併報表口糧
(單位為千,不包括每股和每股金額)
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
研發服務收入,關聯方 |
|
$ |
— |
|
|
$ |
|
|
運營費用: |
|
|
|
|
|
|
||
研發 |
|
|
|
|
|
|
||
一般和行政 |
|
|
|
|
|
|
||
總運營費用 |
|
|
|
|
|
|
||
運營虧損 |
|
|
( |
) |
|
|
( |
) |
其他收入(支出): |
|
|
|
|
|
|
||
補助金收入 |
|
|
— |
|
|
|
|
|
利息收入 |
|
|
|
|
|
|
||
利息支出 |
|
|
( |
) |
|
|
( |
) |
認股權證負債的公允價值變動 |
|
|
|
|
|
|
||
其他收入(費用)合計,淨額 |
|
|
|
|
|
|
||
淨虧損和綜合虧損 |
|
$ |
( |
) |
|
$ |
( |
) |
每股基本和稀釋後淨虧損 |
|
$ |
( |
) |
|
$ |
( |
) |
加權平均已發行普通股、基本普通股和稀釋後普通股 |
|
|
|
|
|
|
||
附註是這些合併財務報表的組成部分。
F-4
Candel ThErapeutics,Inc.
合併報表股東權益
(單位為千,不包括每股和每股金額)
|
普通股 |
|
|
庫存股 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
股份 |
|
|
金額 |
|
|
股份 |
|
|
金額 |
|
|
其他內容 |
|
|
累計 |
|
|
股東的 |
|
|||||||
截至2021年12月31日的餘額 |
|
|
|
$ |
|
|
|
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
行使的期權 |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||||
收購的庫存股 |
|
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
— |
|
|
|
|
|
|
( |
) |
|||
基於股票的薪酬 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
公允價值變動 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
淨虧損 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2022年12月31日的餘額 |
|
|
|
$ |
|
|
|
( |
) |
|
$ |
( |
) |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
基於股票的薪酬 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
受限制股票單位歸屬,淨額 |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
公允價值變動 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
淨虧損 |
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
截至2023年12月31日的餘額 |
|
|
|
$ |
|
|
|
( |
) |
|
$ |
( |
) |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
附註是這些合併財務報表的組成部分。
F-5
坎德爾治療公司
Cas綜合報表h流量
(單位為千,不包括每股和每股金額)
|
|
截至的年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
經營活動的現金流: |
|
|
|
|
|
|
||
淨虧損 |
|
$ |
( |
) |
|
$ |
( |
) |
對淨虧損與經營活動中使用的現金淨額進行的調整: |
|
|
|
|
|
|
||
折舊費用 |
|
|
|
|
|
|
||
固定資產減值準備 |
|
|
|
|
|
— |
|
|
出售固定資產損失 |
|
|
|
|
|
— |
|
|
非現金股票薪酬費用 |
|
|
|
|
|
|
||
非現金租賃費用 |
|
|
|
|
|
|
||
非現金利息支出 |
|
|
|
|
|
|
||
認股權證負債的公允價值變動 |
|
|
( |
) |
|
|
( |
) |
債務貼現的增加 |
|
|
|
|
|
|
||
經營性資產和負債變動情況: |
|
|
|
|
|
|
||
預付費用和其他流動資產 |
|
|
|
|
|
|
||
其他資產 |
|
|
( |
) |
|
|
— |
|
應付帳款 |
|
|
|
|
|
( |
) |
|
應計費用 |
|
|
( |
) |
|
|
|
|
遞延收入 |
|
|
( |
) |
|
|
|
|
租賃責任 |
|
|
( |
) |
|
|
( |
) |
用於經營活動的現金淨額 |
|
|
( |
) |
|
|
( |
) |
投資活動產生的現金流: |
|
|
|
|
|
|
||
固定資產購置 |
|
|
( |
) |
|
|
( |
) |
出售固定資產所得款項 |
|
|
|
|
|
— |
|
|
用於投資活動的現金淨額 |
|
|
( |
) |
|
|
( |
) |
融資活動的現金流: |
|
|
|
|
|
|
||
銀行定期貸款所得淨額 |
|
|
— |
|
|
|
|
|
與既得限制性股票單位預扣税有關的付款 |
|
|
( |
) |
|
|
— |
|
行使期權所得收益 |
|
|
— |
|
|
|
|
|
融資活動提供的現金淨額(用於) |
|
|
( |
) |
|
|
|
|
現金淨減少 |
|
|
( |
) |
|
|
( |
) |
期初現金、現金等價物和限制性現金 |
|
|
|
|
|
|
||
期末現金、現金等價物和限制性現金 |
|
$ |
|
|
$ |
|
||
補充現金流信息: |
|
|
|
|
|
|
||
繳納税款的現金 |
|
$ |
— |
|
|
$ |
|
|
支付利息的現金 |
|
$ |
|
|
$ |
|
||
非現金信息的補充披露: |
|
|
|
|
|
|
||
取得使用權資產所產生的租賃負債 |
|
$ |
— |
|
|
$ |
|
|
應付賬款和應計費用中的資本支出 |
|
$ |
— |
|
|
$ |
|
|
行使期權的普通股交易所 |
|
$ |
— |
|
|
$ |
|
|
附註是這些合併財務報表的組成部分。
F-6
坎德爾治療公司
關於合併鰭片的説明財務報表
1.陳述的組織和依據
Candel治療公司,前身為Advantagene,Inc.(該公司),是一家臨牀階段生物製藥公司,於2003年6月在特拉華州註冊成立。2020年11月30日,該公司更名為Candel Treateutics,Inc.該公司專注於開發現成的病毒免疫療法,引發個性化的系統性抗腫瘤免疫反應,幫助患者抗擊癌症。該公司的工程病毒旨在通過病毒介導的直接細胞毒性在癌細胞中誘導免疫原性細胞死亡,從而釋放腫瘤新抗原,並在注射部位創造促炎微環境。這是為了導致針對注射的腫瘤和未注射的遠處轉移的原位疫苗接種。該公司已經建立了兩個現成的病毒免疫治療平臺和
該公司受到生物技術行業早期公司常見的風險和不確定因素的影響,包括但不限於競爭對手對新技術創新的開發、對關鍵人員的依賴、對專有技術的保護、對政府法規的遵守以及獲得額外資本為運營提供資金的能力。目前正在開發的候選產品在商業化之前將需要大量額外的研究和開發努力,包括臨牀前和臨牀測試以及監管部門的批准。這些努力需要大量額外資本、充足的人員和基礎設施以及廣泛的合規報告能力。即使該公司的產品開發努力取得了成功,該公司何時(如果有的話)將從產品銷售中實現收入也是不確定的。
自成立以來,該公司的運營資金主要來自出售其可轉換票據和股本的收益以及債務借款。該公司自成立以來發生經常性虧損,包括淨虧損$
2022年8月5日,本公司向美國證券交易委員會提交了S-3表格(現已修訂)的擱置登記書,其中包括我們提供、發行和銷售的擱置登記説明書,總額高達$
該公司的現金和現金等價物為$
合併財務報表不包括這一不確定性結果可能導致的任何調整。因此,綜合財務報表的編制是基於假設本公司將繼續作為一家持續經營的企業,並考慮在正常業務過程中實現資產以及償還負債和承諾。
2.主要會計政策摘要
F-7
陳述的基礎
隨附的綜合財務報表是根據財務會計準則委員會(FASB)制定的會計準則編制的。FASB制定了公認會計原則(GAAP),公司遵循該原則,以確保其財務狀況、經營結果和現金流得到一致的報告。在這些財務報表附註中提及財務會計準則委員會發布的公認會計原則時,應參照財務會計準則彙編(ASC)。該公司已將與其上期業績相關的某些金額重新分類,以符合其本期列報。
合併原則
合併財務報表包括Candel治療公司及其全資子公司Candel治療證券公司的賬目。所有公司間交易和餘額均已註銷。
細分市場信息
經營部門被定義為企業的組成部分,其獨立的離散信息可供首席經營決策者在決定如何分配資源和評估業績時進行評估。本公司和本公司的首席運營決策者、本公司的首席執行官將本公司的運營和業務管理視為運營部門。該公司僅在美國運營。
新興成長型公司
本公司是一家新興的成長型公司,根據2012年的JumpStart Our Business Startups Act(JumpStart Our Business Startups Act)的定義。根據《就業法案》,新興成長型公司可以推遲採用在《就業法案》頒佈後發佈的新的或修訂後的會計準則,直到這些準則適用於私營公司。本公司已選擇使用此延長過渡期以符合新的或經修訂的會計準則,該等新會計準則或經修訂的會計準則對上市公司及私人公司具有不同的生效日期,直至(I)不再是新興成長型公司或(Ii)明確及不可撤銷地選擇退出就業法案所規定的延長過渡期。因此,這些合併財務報表可能無法與截至上市公司生效日期遵守新的或修訂的會計聲明的公司進行比較。
預算的使用
根據公認會計原則編制公司合併財務報表時,管理層需要作出估計和假設,以影響財務報表日期的資產、負債和相關或有資產和負債的報告金額以及報告期內報告的收入和費用金額。公司管理層持續評估其估計,包括但不限於管理層對應計費用的判斷、基於股票的期權獎勵的估值、認股權證的估值和所得税。實際結果可能與這些估計不同。
現金和現金等價物
本公司認為,自購買之日起三個月或以下的原始最終到期日購買的所有高流動性投資均為現金等價物。現金和現金等價物包括購買時到期日少於三個月的有價證券。現金等價物按公允價值報告。
受限現金
該公司擁有$
公允價值計量
本公司的若干資產及負債根據公認會計原則按公允價值列賬。公允價值被定義為在計量日市場參與者之間的有序交易中,為資產或負債在本金或最有利的市場上轉移負債而收取或支付的交換價格。用於計量公允價值的估值技術必須最大限度地利用可觀察到的投入,最大限度地減少使用不可觀察到的投入。按公允價值列賬的金融資產和負債應在公允價值層次的下列三個級別之一進行分類和披露,其中前兩個級別被視為可見,最後一個級別被視為不可見:
F-8
由於這些資產和負債的短期性質,現金和現金等價物(被視為第1級計量)、應付賬款和應計費用的賬面價值接近其公允價值。由於浮動利率,本公司定期貸款的賬面價值接近公允價值。 本公司的權證負債按公允價值列賬,分類為第三級計量。
財產和設備
財產和設備包括實驗室和製造設備、網絡和計算機設備、傢俱和固定裝置以及租賃改進。
資產 |
|
預計使用壽命 |
網絡和計算機設備 |
|
|
實驗室設備 |
|
|
製造設備 |
|
|
傢俱和固定裝置 |
|
|
租賃權改進 |
|
租契
本公司於2022年1月1日採用ASC 842,並根據ASU 2016-02選擇過渡方法,根據該方法,本公司將所有租期超過12個月的租約的使用權資產和租賃負債記錄在資產負債表上。該公司還選擇採用旨在簡化過渡的實際權宜之計。因此,本公司僅對截至2022年1月1日的現有租約適用ASC 842。本公司確定一項安排在開始時是否為租約或包含租約。
租賃使用權資產是指公司在租賃期內使用標的資產的權利,租賃負債是公司支付租賃所產生的租賃款項的義務。租賃使用權資產及租賃負債於租賃開始日按租賃期內將支付的租賃付款現值確認。租賃使用權資產等於租賃負債,並根據預付租金、初始直接成本和激勵進行調整。由於本公司的租約並無提供隱含利率,因此本公司根據租賃開始日可得的資料,採用遞增借款利率釐定租賃付款的現值。租賃條款可包括在合理確定公司將行使該選擇權時延長或終止租約的選擇權。經營租賃費用在租賃期內以直線法確認。本公司已選擇不將ASC 842的確認要求應用於短期租賃,該短期租賃的定義為於租賃開始日租期為12個月或以下的租賃,且不包括購買本公司合理地確定將行使的標的資產的選擇權。
對於採用ASC 842後簽訂或修改的包括租賃和非租賃組成部分的房地產租賃協議,本公司已選擇將租賃和非租賃組成部分(如公共區域維護費)作為單一租賃組成部分計入。
信用風險的集中度
可能使公司面臨集中信用風險的金融工具主要包括現金和現金等價物。該公司定期在經認可的金融機構保持超過聯邦保險限額的存款。本公司將現金存入信用質量較高的金融機構,並未在該等賬户上蒙受任何損失,亦不相信除與商業銀行關係有關的正常風險外,本公司不會面臨任何不尋常的信貸風險。
長期資產減值準備
待持有和使用的長期資產在發生事件或商業環境變化表明資產的賬面價值可能無法完全收回時,進行可回收測試。本公司在決定何時進行減值審核時考慮的因素包括與預期有關的業務表現顯著欠佳、行業或經濟趨勢出現重大負面影響,以及資產用途的重大改變或計劃改變。如果執行減值審查以評估長期資產組的可恢復性,則
F-9
該公司將長期資產集團的使用和最終處置預計產生的未貼現現金流的預測與其賬面價值進行了比較。當資產組的使用預期產生的估計未貼現未來現金流量少於其賬面金額時,將確認減值損失。減值虧損將基於減值資產組的賬面價值超過其公允價值的部分,這是根據貼現現金流量確定的。長期資產包括固定資產和經營租賃資產。
在2023年第三季度和第四季度,公司記錄的減值費用總額約為$
收入確認
公司採用會計準則編碼(ASC),主題606,與客户的合同收入(ASC 606)。本標準適用於與客户簽訂的所有合同,但屬於其他標準範圍的合同除外,如租賃、保險、合作安排和金融工具。根據ASC 606,實體在其客户獲得對承諾的商品或服務的控制權時確認收入,其金額反映了實體預期為換取這些商品或服務而獲得的對價。為了確定實體確定屬於ASC606範圍內的安排的收入確認,該實體執行以下五個步驟:(I)識別與客户的合同(S);(Ii)識別合同中的履約義務;(Iii)確定交易價格;(Iv)將交易價格分配給合同中的履約義務;以及(V)當實體履行履約義務時(或作為履行義務時)確認收入。只有當實體有可能收取其有權獲得的對價以換取其轉讓給客户的商品或服務時,公司才會將五步模式應用於合同。在合同開始時,一旦合同被確定在ASC 606的範圍內,公司就評估每個合同中承諾的商品或服務,並確定那些是履行義務,然後評估每個承諾的商品或服務是否不同。然後,公司確認在履行履約義務時分配給各自履約義務的交易價格的金額為收入。
研究與開發成本和應計項目
研發費用包括工資和福利、材料和用品、臨牀前和臨牀試驗費用、股票補償費用、設備折舊、合同服務和其他外部費用。本公司已與臨牀和研究機構、合同研究機構和其他公司簽訂了各種與研發相關的合同。這些協議通常是可以取消的,相關付款在發生時被記錄為研究和開發費用。某些開發活動的成本,如製造、臨牀前和臨牀試驗費用,是根據對完成特定任務的進度的評估來確認的。這些活動的付款依據個別安排的條款,這些條款可能不同於所發生的費用模式,並在財務報表中作為預付或應計研究和開發費用反映。未來收到的用於研究和開發活動的貨物或服務的不可退還的預付款將延期並資本化。資本化金額在相關貨物交付或提供服務時計入費用。如果獲得許可的技術或獲得的知識產權尚未達到技術可行性且未來沒有其他用途,則獲得技術許可和知識產權所產生的成本將計入收購的研發費用和正在進行的研發。
專利費用
與專利申請的準備、提交、維護和起訴相關的所有與專利有關的成本均計入因支出收回的不確定性而產生的費用。發生的金額被歸類為一般費用和行政費用。
基於股票的薪酬
該公司根據ASC主題718--薪酬--股票薪酬(ASC 718)對其基於股票的薪酬進行會計處理。ASC 718要求向員工和董事支付的所有基於股份的付款在綜合經營報表中根據其授予日期的公允價值確認為費用。此外,根據FASB會計準則更新(ASU)2016-09確定了幾個基於股票的支付交易領域的簡化領域,公司將非員工補助金視為員工補助金。該公司使用布萊克-斯科爾斯期權定價模型對授予員工和非員工的股票期權的公允價值進行了估計。本公司認為,授予非僱員的股票期權的公允價值比所提供服務的公允價值更可靠地確定。
F-10
布萊克-斯科爾斯期權定價模型需要基於某些主觀假設的投入,包括(A)預期股價波動,(B)預期獎勵期限,(C)無風險利率和(D)預期股息。由於缺乏特定公司的歷史波動率和隱含波動率數據,本公司的預期波動率計算依據是本公司的歷史波動率和一組具有代表性的上市公司的歷史波動率,這些公司具有與公司相似的特徵,包括產品開發階段和生命科學行業重點。歷史波動率是根據與預期期限假設相稱的一段時間計算的。本公司採用《美國證券交易委員會員工會計公告第107號》規定的簡化方法--股份支付--來計算授予員工的期權的預期期限,因為公司沒有足夠的歷史行使數據來提供合理的基礎來估計預期期限。該預期條款適用於股票期權授予組作為一個整體,因為公司預計其員工羣體中不會有實質性不同的行使或歸屬後終止行為。對於授予非僱員的期權,本公司使用以股份為基礎的付款的合同條款作為預期期限假設的基礎。無風險利率以期限與股票期權預期期限一致的國庫工具為基礎。預期股息收益率假設為
本公司一般按所需服務期間(一般為歸屬期間)以直線方式將其以股份為基礎的薪酬獎勵的公允價值支出予僱員及非僱員。
政府補助金
該公司已申請撥款,以償還馬薩諸塞州生命科學中心某些合格運營支出的支出,包括與員工相關的成本。當有合理保證,公司將遵守贈款安排所附的條件,並且贈款將被收到時,公司確認政府贈款。
政府贈款記為贈款收入,並在合併業務報表中歸類為其他收入。該公司承認政府對
所得税
該公司按照美國會計準則第740主題--所得税(ASC 740)--採用資產和負債法核算所得税,該主題要求為財務報表或公司納税申報單中確認的事件的預期未來税收後果確認遞延税項資產和負債。遞延税項資產及負債乃根據財務報表與資產及負債的税基之間的差額,採用預期差額將撥回的年度的現行税率釐定。遞延税項資產和負債的變動計入所得税準備。本公司評估其遞延税項資產從未來應課税收入中收回的可能性,並根據現有證據的權重,認為所有或部分遞延税項資產更有可能無法變現,並通過計入所得税費用建立估值撥備。透過估計預期未來應課税溢利及考慮審慎及可行的税務籌劃策略,評估收回遞延税項資產的潛力。於2023年12月31日、2023年12月31日及2022年12月31日,本公司認為其遞延税項資產須計提全額估值準備(見附註12)。
公司通過應用兩步法來確定應在財務報表中確認的税收優惠金額,從而對所得税中的不確定性進行了核算。首先,必須對税收狀況進行評估,以確定税務機關在外部審查後維持這種狀況的可能性。如果税務狀況被認為更有可能持續,則該税項將被評估為將在合併財務報表中確認的利益金額。可以使用的福利金額是具有大於
每股淨虧損
每股基本淨虧損的計算方法為:普通股股東應佔淨虧損除以當期已發行普通股的加權平均股數。每股攤薄淨虧損以期內已發行普通股的加權平均數計算,如攤薄,則以普通股潛在股數的加權平均數計算。在公司報告普通股股東應佔淨虧損的期間,稀釋後每股淨虧損與每股基本淨虧損相同,因為如果普通股的稀釋股票具有反攤薄的效果,則不應假定其已發行。稀釋後每股淨虧損相同
F-11
截至2023年12月31日和2022年12月31日止年度的每股基本淨虧損由於這些期間的損失,普通股工具的所有潛在股份都是反攤薄的。
近期發佈的會計準則
2023年10月,財務會計準則委員會發布了ASU2023-06,披露改進:編撰修正案,以迴應美國證券交易委員會的披露更新和簡化倡議,修改了與財務會計準則編撰主題相關的披露或列報要求。每一修正案的生效日期將是美國證券交易委員會從S-X法規或S-K法規中刪除該相關披露的生效日期,禁止及早採用。如果到2027年6月30日,美國證券交易委員會仍未從S-X條例或S-K條例中刪除適用要求,則相關修正案的未決內容將從編撰中刪除,且不會對任何實體生效。本公司目前正在評估ASU 2023-06可能對其合併財務報表和相關披露產生的潛在影響。
2023年11月,FASB發佈了ASU 2023-07,分部報告:對可報告分部披露的改進,修訂了ASC 280中的指導,分部報告本ASU中的修訂擴大了分部披露要求,包括針對具有單一可報告分部的實體的新分部披露要求,以及其他披露要求。ASU的修正案在2023年12月15日之後的年度期間內對公共企業實體有效。允許及早領養。本公司目前正在評估採用ASU 2023-07可能對其綜合財務報表和相關披露產生的潛在影響。
2023年12月,FASB發佈了ASU 2023-09《所得税披露的改進》,修訂了ASC 740《所得税》中的指導意見。ASU的目的是提高所得税披露的透明度,方法是要求(1)税率調節中的類別一致和更大程度的信息分類,以及(2)按司法管轄區分列繳納的所得税。它還包括一些其他修訂,以提高所得税披露的有效性。ASU的修正案在2024年12月15日之後的年度期間內對公共企業實體有效。允許及早領養。採用可以是前瞻性的,也可以是追溯性的,公司將前瞻性地採用此ASU基礎。本公司目前正在評估ASU 2023-09可能對其合併財務報表和相關披露產生的潛在影響。
3.金融資產和負債的公允價值
下表介紹了該公司按公允價值經常性計量的金融資產和負債的信息,並顯示了用於確定此類公允價值的公允價值等級(以千計):
|
|
截至公允價值計量 |
|
|||||||||||||
|
|
1級 |
|
|
2級 |
|
|
3級 |
|
|
共計 |
|
||||
負債: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
認股權證法律責任 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
總計 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
||
|
|
截至公允價值計量 |
|
|||||||||||||
|
|
1級 |
|
|
2級 |
|
|
3級 |
|
|
共計 |
|
||||
負債: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
認股權證法律責任 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
總計 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
||
權證責任的估值
關於2018年11月13日發行的B系列可轉換優先股,本公司發行了認股權證,以購買普通股股份,其中某些認股權證在資產負債表上顯示為負債,見附註10。認股權證負債的公允價值是根據市場上不可觀察到的重大投入確定的,這是公允價值層次中的第三級計量。權證負債的公允價值採用多種估值方法,包括蒙特卡洛法、期權定價法、概率加權預期收益率法和混合法,所有這些方法都包含了假設和估計,以對普通權證進行估值。當公司預計在不久的將來發生流動性事件時,通常會使用混合方法,它是期權定價方法和概率加權預期回報方法的組合。影響公允價值計量的估計和假設包括普通股相關股份的每股公允價值、無風險利率、預期股息收益率、相關普通股價格的預期波動率以及
F-12
認股權證的剩餘合同期限。模型中影響普通股認股權證公允價值的最重要假設是公司普通股在每個重新計量日期的公允價值。
下表提供了公司權證負債的總公允價值的前滾,其公允價值由第三級投入確定(以千為單位):
|
|
B系列 |
|
|
2021年12月31日的餘額 |
|
$ |
|
|
公允價值變動 |
|
|
( |
) |
2022年12月31日的餘額 |
|
$ |
|
|
公允價值變動 |
|
|
( |
) |
2023年12月31日的餘額 |
|
$ |
|
|
4.固定資產,淨額
固定資產,淨額包括以下內容(以千計):
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
實驗室設備 |
|
$ |
|
|
$ |
|
||
製造設備 |
|
|
|
|
|
|
||
傢俱和固定裝置 |
|
|
|
|
|
|
||
網絡和計算機設備 |
|
|
|
|
|
|
||
租賃權改進 |
|
|
|
|
|
|
||
固定資產總額 |
|
$ |
|
|
$ |
|
||
減去:累計折舊 |
|
|
( |
) |
|
|
( |
) |
固定資產,淨額 |
|
$ |
|
|
$ |
|
||
折舊費用為$
5.應計費用
應計費用包括以下各項(以千計):
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
工資單和員工相關費用 |
|
$ |
|
|
$ |
|
||
第三方研發費用 |
|
|
|
|
|
|
||
專業費用和其他費用 |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
6.定期貸款
在……上面
定期貸款按浮動年利率計息,相等於(A)項之較高者。
F-13
貸款得到回報。貸款協議允許自願提前償還全部(但不少於全部)SVB定期貸款,預付溢價為
截至二零二三年及二零二二年十二月三十一日止年度,本公司錄得與貸款協議有關的利息開支, $
該公司產生了$
截至十二月三十一日止的年度: |
|
|
|
|
2024 |
|
$ |
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
本金總額 |
|
|
|
|
最後付款費 |
|
|
|
|
減去:債務貼現 |
|
|
( |
) |
債務貼現的增加 |
|
|
|
|
賬面淨額 |
|
$ |
|
|
較小電流部分 |
|
$ |
( |
) |
長期部分 |
|
$ |
|
|
本公司定期貸款的賬面價值接近公允價值。
7.其他長期債務
周圍音
2019年12月9日,公司與專注於基因治療載體開發的生物製藥公司Periphagen,Inc.(Periphagen)簽訂了一系列資產購買協議。根據資產購買協議的條款,公司假定為#美元。
8.租約
2019年2月4日,本公司簽署了位於馬薩諸塞州李約瑟市肯德里克街117號的公司總部的租賃協議。該設施由一個
截至二零二三年及二零二二年十二月三十一日止年度各年,本公司錄得 $
截至2023年及2022年12月31日止年度各年計入租賃負債的金額支付的現金為 $
|
|
截至十二月三十一日止的年度: |
|
||||
其他信息 |
|
2023 |
|
2022 |
|
||
經營租賃使用的經營現金流量(千元) |
|
$ |
|
$ |
|
||
加權平均剩餘租賃年限(年) |
|
|
|
|
|
||
加權平均增量借款利率 |
|
|
% |
|
% |
||
根據不可撤銷租賃之未來租賃付款, 2023年12月31日,情況如下(單位:千):
F-14
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
未來租賃支付總額 |
|
|
|
|
減去:推定利息 |
|
|
( |
) |
租賃總負債 |
|
$ |
|
9.普通股和優先股
優先股
本公司已授權
普通股
本公司已授權
預留普通股
截至以下日期,公司已預留以下普通股供未來發行:
|
|
十二月三十一日, |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
未償還股票期權 |
|
|
|
|
|
|
||
未歸屬限制性股票 |
|
|
|
|
|
|
||
股票期權計劃下可供未來授予的股票 |
|
|
|
|
|
|
||
認股權證 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
貨架登記和市場上的產品
2022年8月5日,公司向美國證券交易委員會提交了貨架備案,其中包括我們總計高達$
10.手令
截至2009年,本公司有下列尚未行使的普通股購買權證, 2023年12月31日和2022年12月31日:
認股權證 |
|
的股份 |
|
|
鍛鍊身體 |
|
|
到期日期 |
||
B系列認股權證 |
|
|
|
|
$ |
|
|
|||
有條件B系列權證 |
|
|
|
|
$ |
|
|
|||
NC Ohio Trust |
|
|
|
|
$ |
|
|
|||
B系列認股權證
F-15
就二零一八年十一月十三日發行B系列可換股優先股(B系列優先股)而言,本公司向B系列優先股的買方發行以購買
此外,本公司向同一股東增發,
於2021年6月24日,本公司董事會批准及於2021年7月14日,股東批准對B系列認股權證及B系列附條件認股權證的條款作出修訂,將到期日由
該公司在發行時將B系列認股權證記錄為股東權益的組成部分,其估計公允價值為#美元
北卡羅來納州俄亥俄州信託認股權證
2019年3月20日,本公司成立了由本公司出資的不可撤銷信託--NC俄亥俄信託公司。信託協議中的受益人過去為本公司提供的服務超過
11.股票期權、限制性股票和基於股票的薪酬
股權激勵計劃
這個修訂後的公司2015年股票計劃(2015計劃)規定,公司可以向公司員工、董事會成員和顧問出售或發行普通股或限制性普通股,或授予用於購買普通股的激勵性股票期權或不合格股票期權。2015年計劃由董事會管理,行使價格、歸屬和其他限制由其
F-16
謹慎行事。所有股票期權的授予都是非法定的股票期權,但根據修訂後的《1986年國税法》,向打算作為激勵性股票期權資格的員工授予的期權除外。激勵性股票期權的授予不得低於授予之日公司普通股的公允市值,該公允市值由董事會根據其唯一的酌情權真誠決定。非限制性股票期權可按董事會自行決定的行權價格授予,授予期限可能有所不同。行權期一般為
2021年7月14日,本公司2021年股權激勵計劃(簡稱2021年方案)獲得本公司股東批准,於首次公開募股完成後生效,作為2015年方案的繼承者。
股票期權
股票期權活動概述如下:
|
|
數量 |
|
|
加權的- |
|
|
加權的- |
|
|
集合體 |
|
||||
截至2022年12月31日的未償還債務 |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
授與 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
已鍛鍊 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
取消、沒收或過期 |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
截至2023年12月31日的未償還債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
自2023年12月31日起可行使 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
截至2023年12月31日未歸屬 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2015年計劃允許參與者使用他們以前購買的普通股,以行使股票期權的行使日期的公允價值為基礎。在行使股票期權購買時,
授出購股權之公平值乃於授出日期根據下列假設採用柏力克—舒爾斯期權定價模式估計:
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
預期購股權年期(年) |
|
|
|
|
||||
無風險利率 |
|
|
|
|
||||
預期波動率 |
|
|
|
|
||||
預期股息收益率 |
|
|
% |
|
|
% |
||
截至2023年及2022年12月31日止年度各年歸屬的購股權的總內在價值為:
限售股單位
根據涵蓋普通股的受限制股票單位協議的條款,與受限制股票單位有關的普通股股份須按時間歸屬。倘受限制股票單位與本公司之關係終止,則該等受限制股票單位將即時沒收予本公司。
限制性股票活動概述如下:
F-17
|
|
數量 |
|
|
加權的- |
|
||
未歸屬於2022年12月31日 |
|
|
|
|
$ |
|
||
授與 |
|
|
|
|
$ |
|
||
既得 |
|
|
( |
) |
|
$ |
|
|
被沒收 |
|
|
( |
) |
|
$ |
|
|
未歸屬於2023年12月31日 |
|
|
|
|
$ |
|
||
截至2023年及2022年12月31日止年度各年歸屬的受限制股票單位的總公允價值為: $
基於股票的薪酬
截至年度的基於股票的薪酬支出二零二三年及二零二二年十二月三十一日於綜合經營報表分類如下(以千計):
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
研發 |
|
$ |
|
|
$ |
|
||
一般和行政 |
|
|
|
|
|
|
||
基於股票的薪酬費用總額 |
|
$ |
|
|
$ |
|
||
截至2023年12月31日及2022年12月31日,與未歸屬股票獎勵有關的未確認賠償成本總額為美元。
12.所得税
由於公司2023年和2022年淨虧損,以及下文討論的遞延税項資產淨額的全額估值撥備,
本公司法定所得税率與本公司實際所得税率的對賬如下:
|
|
截至的年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
按美國法定税率計算的收入 |
|
|
% |
|
|
% |
||
永久性調整 |
|
|
( |
)% |
|
|
( |
)% |
按照市值計算之估值 |
|
|
% |
|
|
% |
||
扣除聯邦福利後的州税 |
|
|
% |
|
|
% |
||
估值免税額 |
|
|
( |
)% |
|
|
( |
)% |
税收抵免 |
|
|
% |
|
|
% |
||
|
|
|
|
|
|
|
||
2023年10月4日,馬薩諸塞州州長簽署了一項法案,其中包括採用單一的銷售分攤係數,自2025年1月1日起生效。根據ASC 740的要求,本公司已在税法頒佈期間計入了這項税法變化的遞延税項影響,這將影響其國家遞延税項資產的減少。税法變化的影響被估值免税額的變化所抵消。
遞延所得税資產淨額 2023年12月31日和2022年12月31日包括以下(單位:千):
F-18
|
|
截至的年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
遞延税項資產: |
|
|
|
|
|
|
||
*淨營業虧損 |
|
$ |
|
|
$ |
|
||
無形資產 |
|
|
|
|
|
|
||
*應計費用和其他 |
|
|
|
|
|
|
||
*遞延收入 |
|
|
|
|
|
|
||
--租賃責任 |
|
|
|
|
|
|
||
**股票薪酬 |
|
|
|
|
|
|
||
資本化研發支出 |
|
|
|
|
|
|
||
學分 |
|
|
|
|
|
|
||
遞延税項資產總額 |
|
|
|
|
|
|
||
估值免税額 |
|
|
( |
) |
|
|
( |
) |
遞延税項資產淨額 |
|
|
|
|
|
|
||
遞延税項負債: |
|
|
|
|
|
|
||
使用權資產 |
|
|
( |
) |
|
|
( |
) |
其他人 |
|
|
( |
) |
|
|
( |
) |
遞延税項負債總額 |
|
|
( |
) |
|
|
( |
) |
遞延税項淨資產(負債) |
|
$ |
|
|
$ |
|
||
截至2023年12月31日該公司的聯邦和州淨經營虧損結轉總額約為美元,
截至2023年12月31日,該公司的聯邦和州税收抵免結轉總額約為$
本公司管理層已評估對其遞延税項資產變現有正面及負面影響的證據,該等遞延税項資產主要包括淨營業虧損結轉及若干税項抵免。管理層考慮了公司自成立以來累計淨虧損的歷史,以及自成立以來產品收入的缺乏,並確定公司更有可能無法實現其遞延税項資產的好處。因此,在2023年12月31日和2022年設立了全額估值免税額。
經修訂的1986年《國內税法》第382節(第382節)載有限制所有權變更公司利用其營業淨虧損(NOL)和截至所有權變更之日存在的税收抵免的能力的規則。根據規定,這樣的所有權變更通常是指在三年滾動期間內公司股票所有權超過50%的任何變更。這些規則通常側重於規則認為直接或間接擁有一家公司5%或以上股票的所有股票的所有權變化,以及該公司新發行股票引起的任何所有權變化。該公司尚未確定是否會對其可用淨營業虧損設定這樣的限制。本公司將在利用未來任何淨營業虧損之前做出這樣的決定。
截至該年度的遞延税項資產估值準備變動情況摘要2023年12月31日、2022年12月31日和2022年12月31日(單位:千):
|
|
截至的年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
估值免税額 |
|
$ |
|
|
$ |
|
||
計入所得税撥備的增加 |
|
|
|
|
|
|
||
計入所得税準備的減少額 |
|
|
|
|
|
|
||
估值免税額 |
|
$ |
|
|
$ |
|
||
該公司在美國以及各個州和地方司法管轄區提交所得税申報單。
13.與關聯方簽訂的獨家許可協議
F-19
2014年3月,本公司與Ventagen,LLC(Ventagen)簽訂獨家許可協議,使Ventagen有權開發產品,用於在墨西哥、伯利茲、危地馬拉、洪都拉斯、薩爾瓦多、哥斯達黎加、尼加拉瓜、巴拿馬、哥倫比亞和玻利維亞(領土)進行商業銷售和分銷。Ventagen向該公司支付了$
該公司已經完全確認了美元
14.技術許可協議
2018年1月20日,本公司與MGB訂立獨家期權協議(期權協議)。根據期權協議,本公司已從MGB獲得獨家權利,談判製造、開發和商業化rQNestin的獨家許可證,rQNestin是一種用於治療某些類型癌症的轉基因溶瘤單純皰疹病毒。根據期權協議,公司將支持根據待談判的臨牀試驗協議的條款在MGB進行臨牀試驗,公司已承諾匯出$
於2020年9月15日,本公司行使與MGB的期權協議,並與MGB訂立獨家全球專利許可協議(MGB許可)。關於MGB許可證,該公司支付了#美元的費用。
15.承付款和或有事項
擔保
根據ASC 460,本公司已將下文所述的擔保確定為可撤銷擔保。
在特拉華州法律允許的情況下,當高級職員或董事以高級職員或董事身份應公司要求提供服務時,如果發生某些事件或事件,公司可向高級職員和董事作出賠償。該公司未來可能被要求支付的最大潛在金額是無限的;然而,該公司擁有董事和高級管理人員保險,應限制其風險敞口,並使其能夠收回未來支付的任何金額的一部分。
本公司是在正常業務過程中籤訂的多項協議的一方,這些協議包含典型的條款,即本公司有義務在發生某些事件時賠償此類協議的其他各方。此類賠償義務通常自適用協議簽署之日起生效,有效期與適用的訴訟時效相同。根據該等賠償條款,本公司未來潛在的總負債總額並不確定。
該公司根據一項於#年到期的不可撤銷經營租約租賃辦公空間。
F-20
西裝,因違反、違反或不履行任何契約或租賃條件而直接導致的索賠、要求、責任和行為。
截至2023年12月31日,該公司擁有
法律訴訟
有時,我們可能會捲入訴訟或其他法律程序。2022年12月15日,Periphagen致函通知我們其索賠,即我們未能根據我們與Periphagen於2019年12月9日簽訂的獨家許可協議(Periphagen許可協議),使用商業上合理的努力完成NT-3資產的人體概念驗證臨牀試驗。2023年1月13日,我們向美國仲裁協會提出了針對Periphagen的仲裁要求,要求聲明Periphagen在12月15日的信函中未能遵守Periphagen許可協議中的爭議和升級條款。2023年3月10日,Periphagen對我們的仲裁要求提出了答覆和反訴。在反訴中,Periphagen要求聲明我們沒有使用商業上合理的努力來完成NT-3 Asset的人體概念臨牀試驗,並要求聲明進一步延長時間在科學上或商業上都是不合理的。我們否認了Periphagen的反訴。
2023年6月7日,雙方簽署了一項獨家許可協議修正案,解決了爭端,並導致仲裁終止,沒有任何財務影響。
除了與Periphagen的訴訟外,我們目前沒有參與任何被我們的管理層認為可能對我們的業務產生重大不利影響的訴訟或法律程序。無論結果如何,由於辯護和和解成本、管理資源轉移和其他因素,訴訟可能會對我們的業務、財務狀況、運營結果和前景產生不利影響。
16.每股淨虧損
每股淨虧損
普通股股東應佔每股基本和攤薄淨虧損計算如下(不包括每股和每股數據,單位為千):
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
分子: |
|
|
|
|
|
|
||
淨虧損 |
|
$ |
( |
) |
|
$ |
( |
) |
分母: |
|
|
|
|
|
|
||
加權平均已發行普通股-基本和稀釋後普通股 |
|
|
|
|
|
|
||
每股淨虧損--基本虧損和攤薄虧損 |
|
$ |
( |
) |
|
$ |
( |
) |
本公司的潛在攤薄證券已被排除在每股攤薄淨虧損的計算之外,因為這將減少每股淨虧損。因此,用於計算基本每股淨虧損和稀釋後每股淨虧損的加權平均普通股流通股數量是相同的。
在計算稀釋後每股淨虧損時,公司不包括下列潛在普通股,因為計入這些股份會產生反攤薄效果。
|
|
截至十二月三十一日止的年度: |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
普通股的已發行認股權證 |
|
|
|
|
|
|
||
已發行股票期權(已轉換為普通股) |
|
|
|
|
|
|
||
未歸屬限制性股票 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
17.企業重組
F-21
2023年11月,公司董事會批准了重整計劃,重點是繼續和擴大CAN-3110的開發以及啟迪TM發現平臺,這導致公司的員工人數減少了大約
在美元中
F-22
簽名
根據1934年《證券交易法》第13或15(D)節的要求,登記人已正式安排由正式授權的下列簽署人代表其簽署本報告.
|
|
坎德爾治療公司 |
|
|
|
|
|
日期:2024年3月28日 |
|
發信人: |
/S/保羅·彼得·德 |
|
|
|
Paul Peter Tak,醫學博士 |
|
|
|
總裁與首席執行官 |
授權委託書
每名個別簽署如下的人士,現組成並委任保羅·德彼得和查爾斯·舒克為其真正合法的事實受權人和代理人,並在沒有其他人的情況下具有全面的替代和重新替代的權力,以及以每個人的名義和代表以下所述的個人和身份籤立,並以表格10-K的格式提交對本年度報告的任何和所有修訂,以及向證券交易委員會提交本年度報告及其所有證物和與此相關的其他文件。授予上述事實代理人和代理人及其每一人作出和執行每一項作為和事情的全部權力和權力,批准和確認上述事實代理人和代理人或他們中的任何一人或他們或他們的替代者可以合法地作出或導致作出的所有行為和事情。
根據1934年《證券交易法》的要求,本報告已由以下注冊人以登記人的身份在指定日期簽署。
名字 |
|
標題 |
|
日期 |
|
|
|
|
|
/S/保羅·彼得·德 |
|
總裁與首席執行官 (首席行政主任) |
|
2024年3月28日 |
Paul Peter Tak,醫學博士,FMedSci |
|
|
|
|
|
|
|
|
|
/S/查爾斯·肖赫 |
|
臨時首席財務幹事(首席財務和會計幹事) |
|
2024年3月28日 |
查爾斯·肖赫 |
|
|
|
|
|
|
|
|
|
/s/Paul B.曼寧 |
|
主席 |
|
2024年3月28日 |
保羅·B·曼寧 |
|
|
|
|
|
|
|
|
|
/s/Edward J. Benz Jr. |
|
董事 |
|
2024年3月28日 |
Edward J. Benz,Jr. |
|
|
|
|
|
|
|
|
|
/s/Chris Martell |
|
董事 |
|
2024年3月28日 |
克里斯·馬特爾 |
|
|
|
|
|
|
|
|
|
撰稿S/蕾妮·蓋塔 |
|
董事 |
|
2024年3月28日 |
蕾妮·蓋塔 |
|
|
|
|
|
|
|
|
|
/s/Gary Nabel |
|
董事 |
|
2024年3月28日 |
加里·納貝爾博士M.D. |
|
|
|
|
|
|
|
|
|
/s/Estuardo Aguilar—Cordova |
|
董事 |
|
2024年3月28日 |
Estuardo Aguilar—Cordova,醫學博士博士 |
|
|
|
|
|
|
|
|
|
/s/Joseph Papa |
|
董事 |
|
2024年3月28日 |
約瑟夫·帕帕
|
|
|
|
|
/s/阮 |
|
董事 |
|
2024年3月28日 |
Diem Nguyen博士MBA
|
|
|
|
|
/s/Nicoletta Loggia |
|
董事 |
|
2024年3月28日 |
Nicoletta Loggia博士R.Ph |
|
|
|
|
F-23