| 迎接罕見 疾病治療的 挑戰 納斯達克:SNGX 2024 年 4 月 3 日 |
| 前瞻性陳述 本演示文稿包含前瞻性陳述。本演示文稿中包含的除歷史事實陳述以外的所有陳述,包括有關我們未來的經營業績和財務狀況、業務 戰略、潛在產品和候選產品及其開發、監管部門的批准、 將我們的產品和候選產品商業化以及吸引合作者的能力、我們的產品 候選產品的報銷、研發成本、成功的時機和可能性、 未來運營的管理計劃和目標的陳述,我們的能力 前瞻性陳述,為我們的候選產品及其開發、競爭療法以及當前和預期的產品和候選產品的未來業績獲得和維持知識產權保護。這些陳述涉及已知和未知的風險和不確定性,例如 COVID-19 疫情期間經歷的 ,以及可能導致我們的實際業績、業績或 成就與 前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異的其他重要因素,其中許多在我們向 證券交易委員會提交的報告和其他文件中詳細披露。由於前瞻性陳述本質上受風險和 不確定性的影響,其中一些無法預測或量化,有些是我們無法控制的,因此 您不應依賴這些前瞻性陳述作為對未來事件的預測。 我們的前瞻性陳述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中預測的 存在重大差異。除非適用法律要求,否則我們不計劃公開更新或 修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、 情況變化還是其他原因。本演示文稿中包含的某些信息以及本演示期間口頭陳述 涉及或基於從第三方 來源獲得的研究、出版物、調查和其他數據。此外,沒有獨立消息來源評估過Soligenix, Inc.內部 估計值的合理性或準確性,也不得依賴本演示文稿中提供的與或 基於此類內部估計的任何信息或陳述。 2 |
| 公司簡介 Soligenix, Inc. 是一家處於後期階段的生物製藥公司,專注於 開發和商業化用於治療醫療需求未得到滿足的罕見疾病的產品 兩個重點領域: ➢ 專業生物治療板塊,致力於為 孤兒病以及腫瘤和炎症領域未得到滿足的醫療需求領域開發產品 ➢ A 公共衞生解決方案部門,為蓖麻毒暴露、新興和抗生素領域的軍用 和民用應用開發疫苗和療法耐藥性 傳染病和病毒性疾病,包括埃博拉、馬爾堡和 COVID-19 3 |
| 投資亮點 ➢ 由多種快速通道和/或孤兒指定產品組成的強大產品管道,全球年銷售額有可能帶來約20億美元的巨大商業回報 ➢ 臨牀後期資產,其中一項成功讀出3期數據 o 皮膚T細胞淋巴瘤(Hybryte™ 或 SGX301) — 在第一項3期研究中取得積極的統計學顯著結果;發表的JAMA皮膚病學 — EMA接受了第二項類似設計的3期確認性研究;美國食品藥品管理局的討論仍在進行中 — 確認性三期雙重研究2024年下半年將啟動對約80名患者的盲目安慰劑對照研究——在未得到滿足的醫療需求領域有重大商業機會;估計全球市場潛力超過2.5億美元 o 牛皮癬(SGX302) — 1/2期概念驗證(POC)研究取得了積極且具有統計學意義的結果 — 針對輕度至中度牛皮癬的2a期研究正在進行中;4組隊列中有2人取得了臨牀成功 2 名患者 — 在未得到滿足的醫療需求領域具有重大商業機會;估計全球市場潛力>10億美元 o 白塞氏病 (SGX945) —白塞氏病口瘡性潰瘍的2a期研究;美國食品藥品管理局批准IND和協議,獲得快速通道稱號 — 在未滿足的醫療需求領域有重大商業機會;估計全球市場潛力>2億美元 ➢ 與生物技術、學術界和政府機構的合作 ➢ 非稀釋性政府資金有助於支付運營費用 o NIH 撥款,支持疫苗開發;可能獲得多達 3 次優先審查代金券 (PRV) ➢ 經驗豐富的管理團隊和有成功記錄的知名顧問 4 |
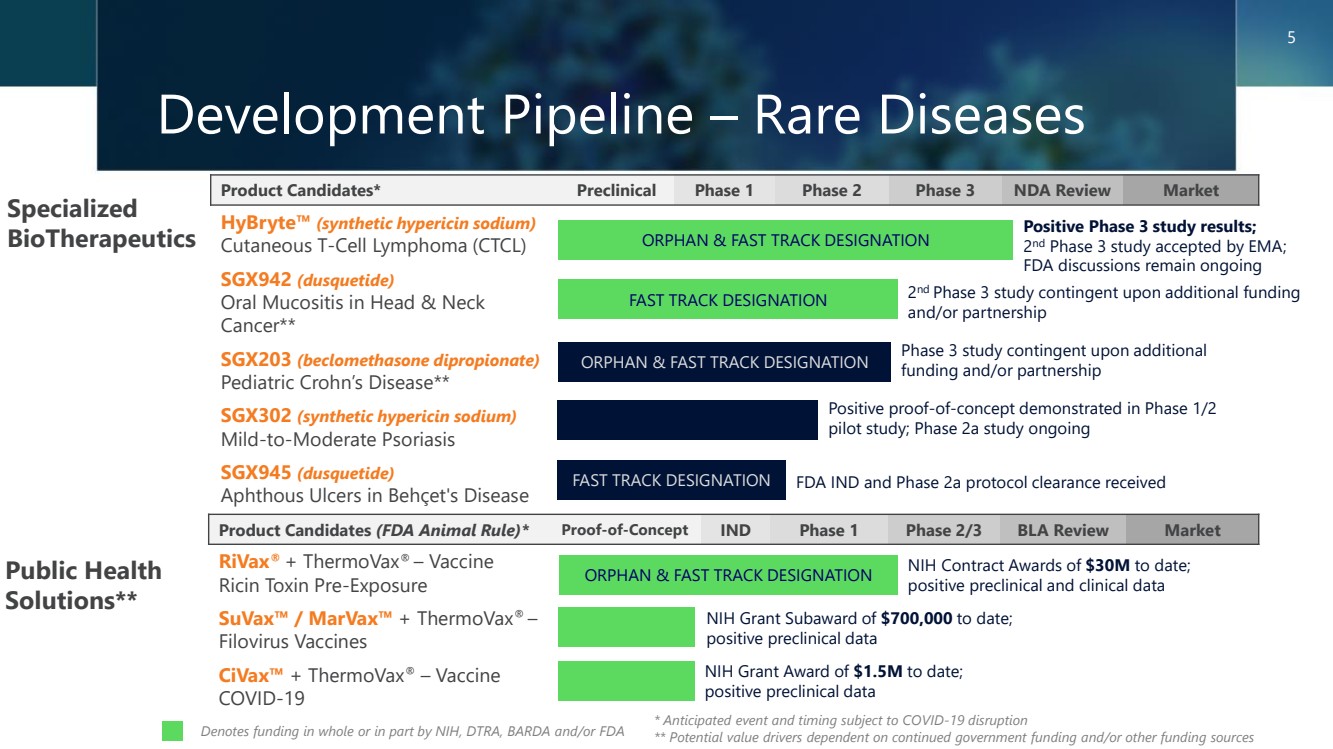
| 研發管道——罕見疾病 候選產品* 臨牀前第一階段第二階段第三階段保密協議審查市場 Hybryte™(合成金絲桃素鈉) 皮膚 T 細胞淋巴瘤 (CTCL) SGX942 (disquetide) 口腔粘膜炎 SGX203(二丙酸倍氯米鬆) (二丙酸倍氯米鬆) br} 小兒克羅恩氏病** SGX302(合成金絲桃素鈉) 輕度至中度牛皮癬 SGX945(disquetide) 白塞氏病中的口瘡性潰瘍 專業 生物療法 公共衞生 解決方案** 候選產品(美國食品藥品管理局動物規則)*概念驗證 IND 第 1 階段 2/3 期 BLA 審查市場 rivaX® + ThermoVax® — 疫苗 蓖麻毒素預暴露 suVax™/MarVax™ + ThermoVax® — Filovax™ + ThermoVax® — 疫苗 COVID-19 第 2 期和/或合作 * 預期事件和時間可能會受到 COVID-19 幹擾 ** 潛在的價值驅動因素取決於持續的政府資助和/或其他資金來源 第 3 階段研究視額外的 資金和/或合作伙伴關係而定 積極的概念驗證在1/2期試點研究中得到證實;2a期研究正在進行中 美國國立衞生研究院迄今已授予3000萬美元的合同; 陽性的臨牀前和臨牀數據 第二期3期研究獲得EMA接受; FDA的討論仍在進行中 表示全部或部分資金由美國國立衞生研究院、DTRA、BARDA和/或 FDA ORPHAN & FAST TRACK 指定 br} 快速通道指定 孤兒和快速通道指定 孤兒和快速通道指定 5 美國國立衞生研究院迄今為止撥款150萬美元; 積極的臨牀前數據 迄今為止美國國立衞生研究院撥款70萬美元; 臨牀前數據陽性 FAST TRACK 認證已獲得 FDA IND 和 2a 期方案批准 |
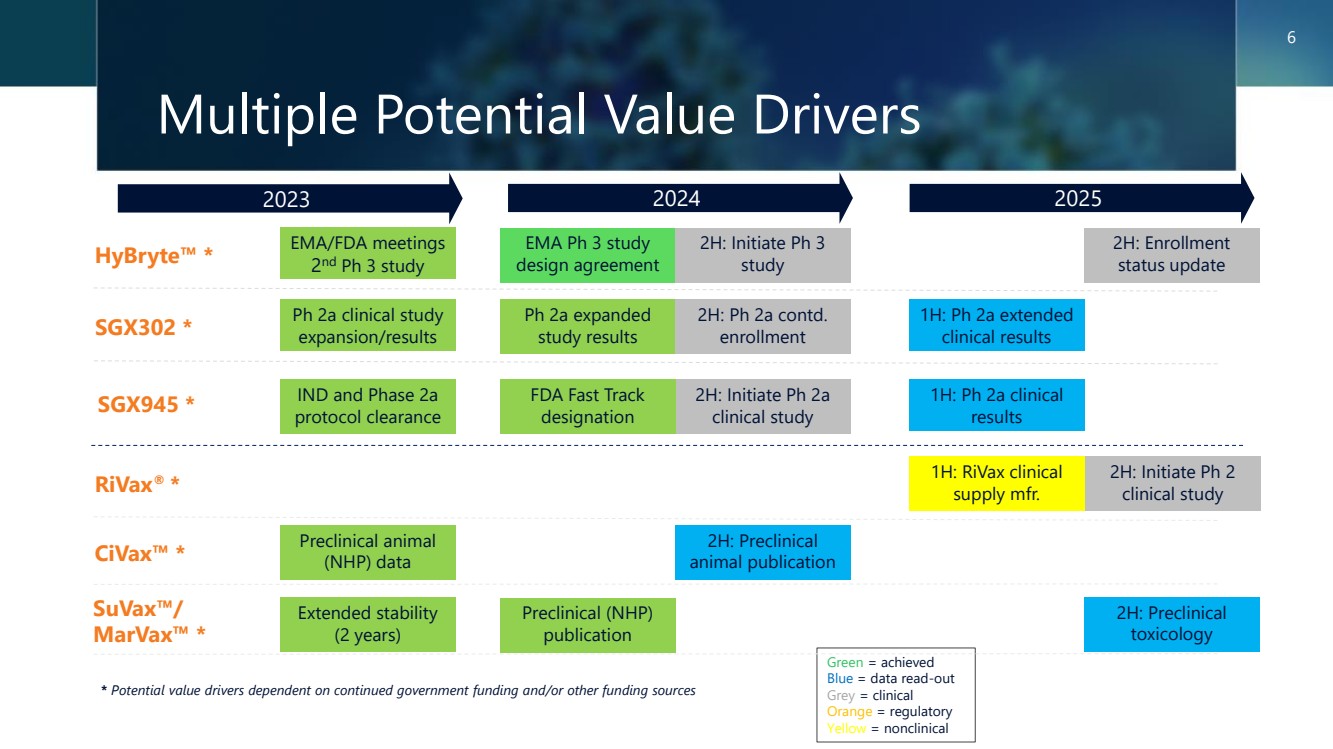
| 多種潛在價值驅動因素 2023 2025 * 潛在價值驅動因素取決於持續的政府資金和/或其他資金來源 綠色 = 已實現 藍色 = 數據讀出 灰色 = 臨牀 橙色 = 監管 黃色 = 非臨牀 6 HybryTE™ * CivaX™ * suvaX™/ MarvaX™ * SGX302 * Ph 2a 臨牀研究 擴展/結果 臨牀前 (NHP) 出版物 臨牀前動物 (NHP) 數據 EMA/FDA 會議 第 2 期和第 3 期研究 SGX945 * IND 和 2a 期 協議許可 擴展穩定性 (2年) EMA 第 3 期研究 設計協議 2H:啟動 Ph 3 研究 2H:入學 狀態更新 Ph 2a 擴大 研究結果 2H:Ph 2a 續 入學 1H:Ph 2a 延長 臨牀結果 2H:啟動 Ph 2a 臨牀研究 1H:Ph 2a 臨牀 結果 1H:rivaX 臨牀 供應 mfr。 2H:啟動 Ph 2 臨牀研究 2H:臨牀前 動物出版物 2H:臨牀前 毒理學 毒理學 FDA Fast Track 認定 |
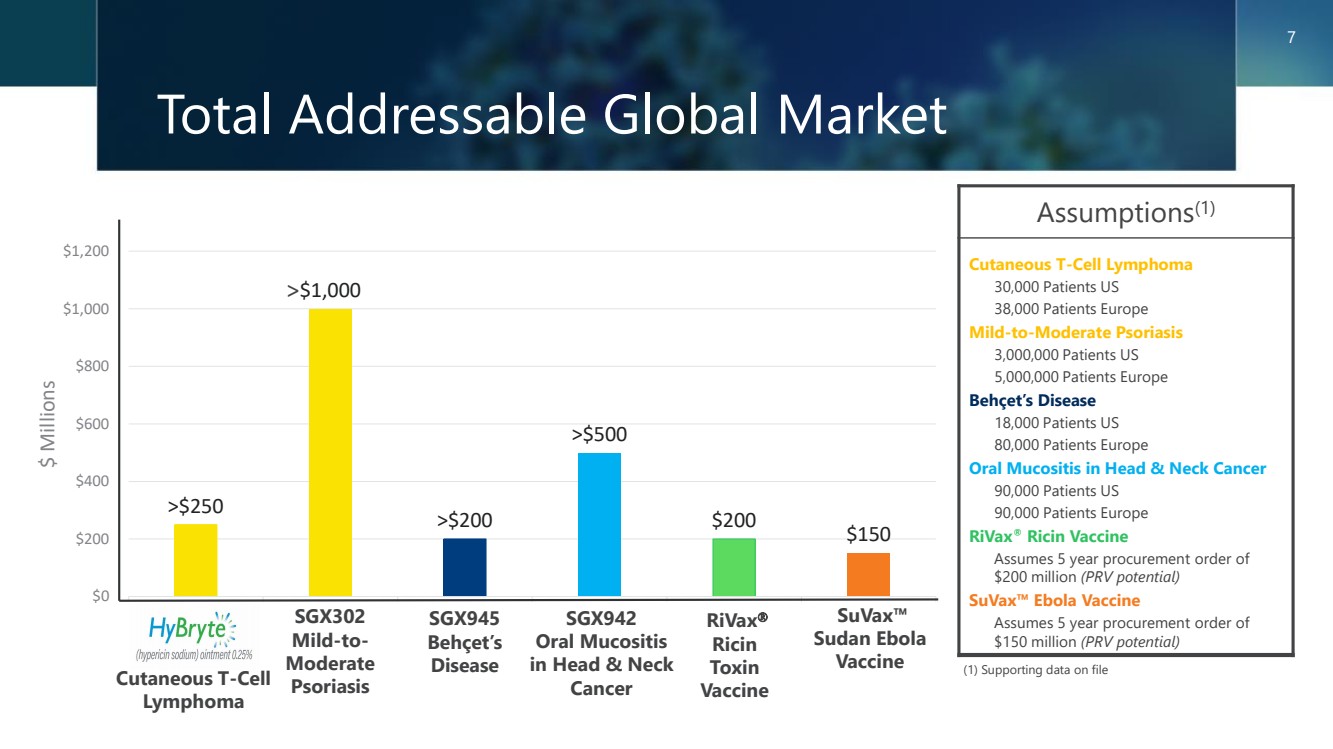
| >250 美元 1,000 美元 >200 美元 >200 美元 150 美元 200 美元 400 美元 600 美元 800 美元 1,200 美元 全球潛在市場總額 假設 (1) 皮膚 T 細胞淋巴瘤 30,000 名患者美國 38,000 名患者歐洲 38,000 名患者歐洲 3,000,000 名患者美國 5,000,000 名患者歐洲 Be000,000 名患者 Hcet's Disease 18,000 名患者美國 80,000 名患者歐洲 90,000 名患者美國 90,000 名患者歐洲 rivaX® 蓖麻毒疫苗 假設 2 億美元(潛在的PRV) 埃博拉™疫苗 假設 5 年採購訂單為 1.5 億美元(PRV 潛力) (1) 存檔的支持數據 SGX302 輕度至中度 牛皮癬 rivaX 毒素 毒素 疫苗 疫苗 7 SGX942 頭頸部口腔粘膜炎 cancer > suvaX x™ 蘇丹埃博拉 疫苗 皮膚 T 細胞 淋巴瘤 SGX945 白塞氏病 |
| Specialized BioTherapeutics 靶向治療腫瘤和炎症的方法 8 |
| 專業生物治療細分市場 9 個商業目標 — 腫瘤學和炎症領域未得到滿足的醫療需求 * 預期事件和時間可能會受到 COVID-19 幹擾 **潛在價值驅動因素取決於持續的政府資助和/或其他資金來源 表示美國國立衞生研究院、DTRA、BARDA 和/或 FDA 候選產品提供全部或部分資金 候選產品* 臨牀前 1 期第 2 階段 3 期保密協議審查市場 Hybryte™ (合成金絲桃素鈉) 皮膚 T 細胞淋巴瘤 (CTCL) SGX942 (dusquetide) 頭頸部口腔粘膜炎 癌症** SGX203(倍氯米鬆二丙酸酯) 小兒克羅恩氏病** SGX302(合成金絲桃素鈉) 輕度至中度牛皮癬 SGX945(dusquetide) 第 2 期三期研究視額外資金而定 和/或夥伴關係 3 期研究視額外資金而定 } 資金和/或合作伙伴關係 1/2 期試點研究顯示出積極的概念驗證;2a 期研究正在進行中 孤兒和快速通道認定 快速通道認定 孤兒和快速通道認定 孤兒和快速通道認定 FDA 快速通道認定IND 和 2a 期方案批准獲得了 陽性的 3 期研究結果; 第 2 期 3 期研究獲得 EMA 接受; FDA 的討論仍在進行中 |
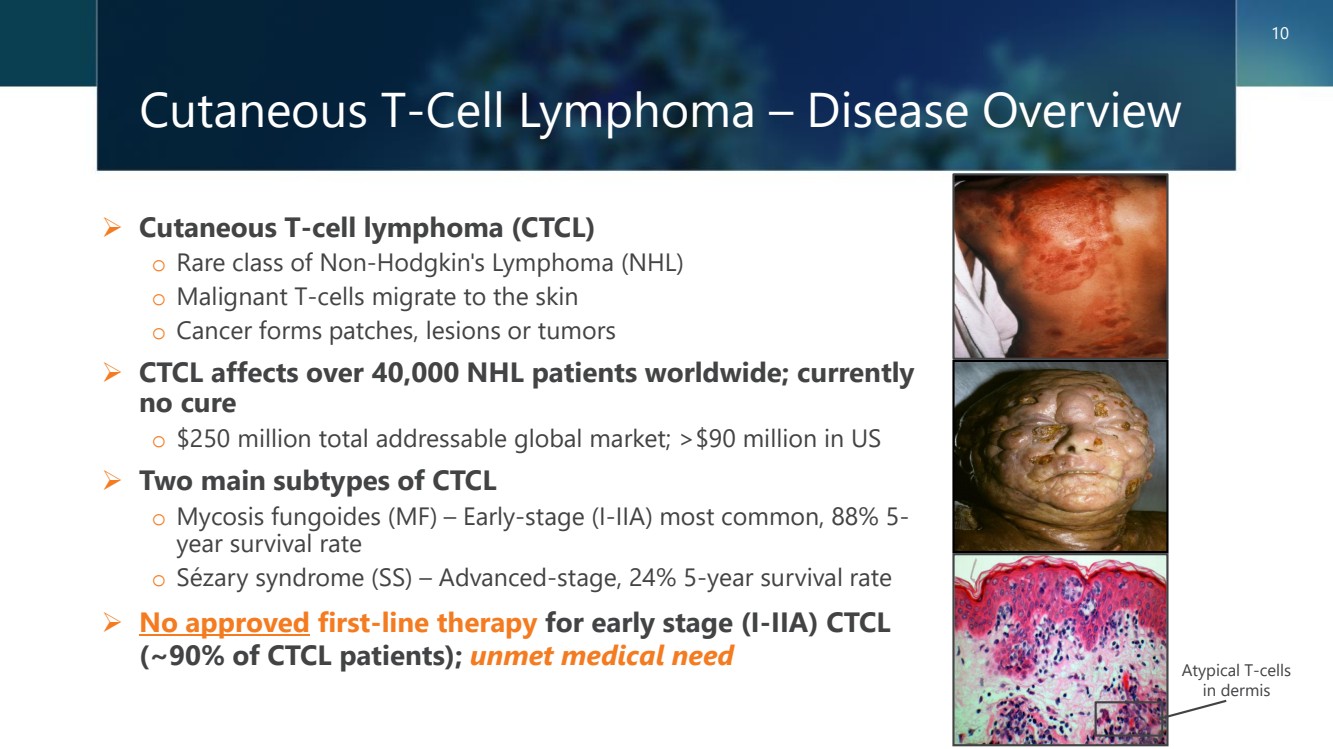
| 皮膚 T 細胞淋巴瘤 — 疾病概述 ➢ 皮膚 T 細胞淋巴瘤 (CTCL) o 罕見的非霍奇金淋巴瘤 (NHL) o 惡性 T 細胞遷移到皮膚 o 癌症形成斑塊、病變或腫瘤 ➢ CTCL 影響全球超過 40,000 名 NHL 患者;目前 o 250 美元全球總共有100萬個潛在市場;美國有超過9000萬美元 ➢ CTCL o 真菌病(MF)的兩種主要亞型 — 早期(I-IIA)最常見,88% 5- o 塞扎裏綜合症(SS)— 晚期,24% 的 5 年存活率 ➢ 否獲批用於早期 (I-IIA) CTCL (約 90% 的 CTCL 患者)的一線療法;未滿足的醫療需求 真皮中的 10 個非典型 T 細胞 |
| Hybryte™ — 合成金絲桃素鈉 軟膏 + 光激活,同類首創 ➢ 治療安全且耐受性良好 o 報告的不良反應極少 − 其他以急性 和慢性副作用為特徵的 CTCL 治療 o 使用可見熒光光 − 不致癌,不像其他紫外線光療 或光動力療法 11 ➢ 美國/歐盟孤兒名稱;美國快速治療狀態 ➢ 快速治療反應 o 3 期數據顯示,早在 6 周內即可顯示出具有統計學意義的 療效,且反應改善 到 12 周之間周 (40%) 和 18 周 (49%) − 大多數早期 CTCL 治療至少需要 12 個月 才能觀察到具有統計學意義的反應 o 對斑塊和更深層的斑塊病變有效 其他早期 CTCL 治療已知對斑塊有用 但對斑塊缺乏療效 EPIDERMIS DERMIS FAT UV Light 藍光 綠光 黃光 紅光 + 可見光 |
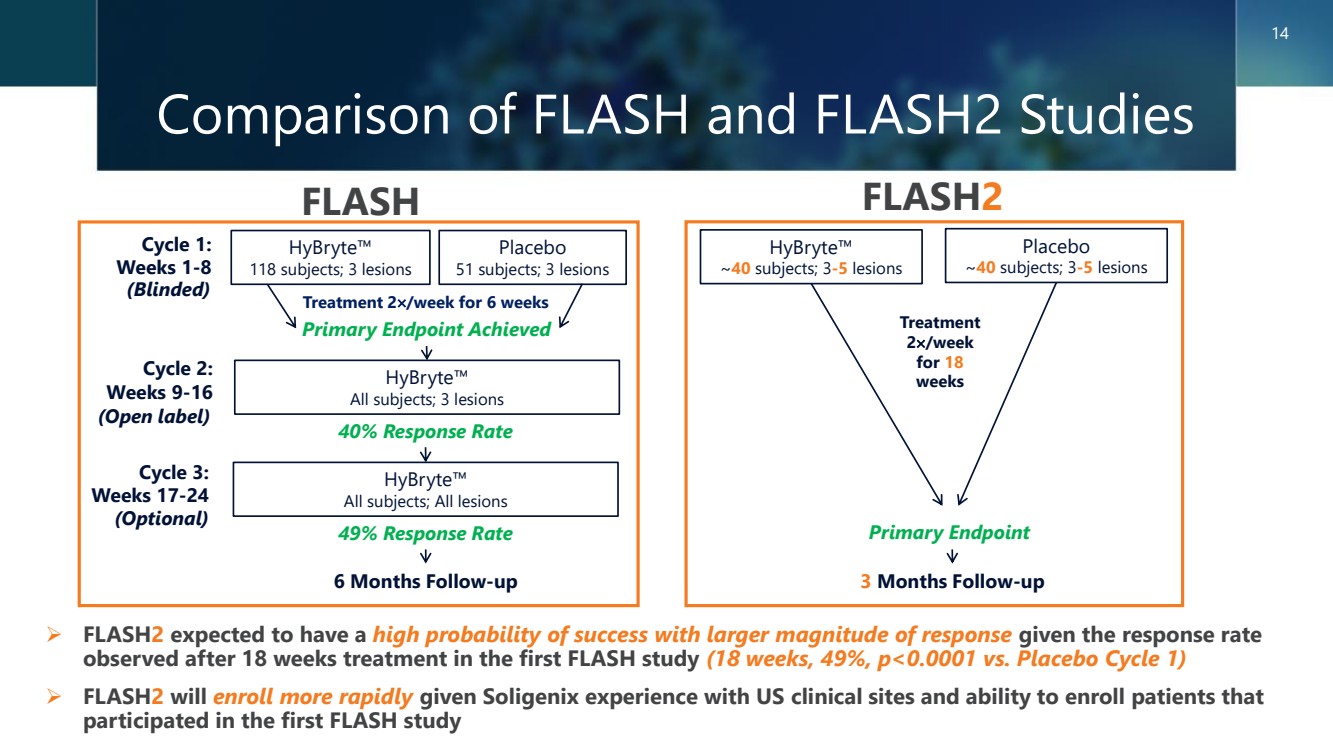
| Hybryte™ — 3 期臨牀試驗 被稱為 “FLASH”(熒光燈和合成金絲桃素) 研究 ➢ 雙盲、安慰劑對照、隨機 o 隨機化 2:1(Hybryte™ [合成金絲桃素 0.25%]: 安慰劑) ➢ 次要終點 o 治療反應(包括持續時間)、 改善程度、復發時間和安全性 Hybryte™ 118 名受試者 3 個病變 安慰劑 51 個受試者 3 個病變 Hybryte™ 所有受試者 所有病變 週期 1: 第 1-8 週週期 2: 第 9-16 週週期 3: 周 17-24(可選) 主要 終點達到 6 個月隨訪 o 週期 1 完成:主要終點(反應率) 具有統計學意義(p=0.04) − 主要終點:百分比™根據綜合評估 在第 1 週期(第 8 周) o 週期 2 結束時 3 個指數病變的指數病變嚴重程度 (CAILS) 評分評估得出 ≥ 50% 的累積減少的患者完成: 治療反應的統計學意義顯著改善 40% (p |
| Hybryte™ — 發展狀況 ➢ 陽性 3 期 FLASH 研究於 2020 年成功完成 o CTCL o FDA 和 EMA 有史以來最大的雙盲、隨機、安慰劑對照臨牀試驗需要進行第二項確認性三期臨牀試驗 ➢ 第二項確認性三期研究 (FLASH2) 採用類似的設計,但 雙盲、安慰劑對照的治療持續時間為18周,而第一項僅為6周 br} FLASH 研究;與 EMA o 研究一致,將在美國和歐洲招收約 80 名患者 o 關鍵標準:納入/排除和主要終點相同 ➢ FLASH2 研究將在 2H2024 中啟動 o 入組預計需要大約 18 個月 o 對之前在第一項 FLASH 研究中接受治療的患者進行入組 ➢ FLASH 和 FLASH2 試驗,以支持全球潛在的上市批准 13 |
| FLASH 和 FLASH2 研究的比較 14 FLASH FLASH2 ➢ FLASH2 在第一項 FLASH 研究(18 周,49%,p)治療 18 周後觀察到的緩解率 ,預計成功的可能性很高,反應幅度更大 |
| ➢ 由於早期 階段 CTCL 和長期治療 週期的慢性質,臨牀醫生首先選擇安全性更好的療法 , 最重要的 ➢ 臨牀醫生認為迫切需要 額外治療方案, 副作用較少 ➢ NB UVB 和 PUVA 不是靶向 療法,長期使用會產生嚴重的副作用(例如, } 黑色素瘤) ➢ NB UVB 用於 早期CTCL患者的20%-50%,儘管 未獲得批准 當前的治療格局 Empiric Tx CTCL Dx Tx ”[我們]只有兩種經美國食品藥品管理局批准的具有大量副作用的藥物。” — 卓越中心的專業皮膚科醫生 早期CTCL治療範式 (通常在 DX 之前,不常有效;未獲準用於 CTCL) (未獲批准 用於 CTCL) (第二行) 局部用藥 視黃醇(第 2 個 系列) PUVA3(未獲批准 用於 CTCL) 來源:Soligenix 初級市場研究 1 = 尚待美國食品藥品管理局批准。2 = 窄帶紫外線 B 光療。3 = 補骨脂素 + 紫外線 A 光療。 早期改進 當前治療模式的重大機會 CTCL (已獲得 CTCL 第一線批准)1 15 |
| Hybryte™ 一個重要的商業機會 解決明顯未得到滿足的需求 ➢ 臨牀醫生認為需要更多副作用更少的治療方案 ➢ 大多數患者在病程中循環接受幾種治療 ➢ 早期 CTCL 的慢性質和對當前療法的不滿 為 Hybryte™ ➢ 皮膚提供了機會™;快速反應,效果相等貼片 和斑塊 ➢ 真皮如 Hybryte 的安全性™;使用安全的可見光與紫外線照射 ➢ 5 個皮膚中的 4 個可能會開出Hybryte™ ➢ 計劃推出的重點是大批量CTCL專家 ➢ 目標銷售隊伍約為20名代表;覆蓋超過 80% 的大批量處方者 ➢ 與醫療器械公司達夫林合作,為客户提供便捷的端到端 業務解決方案 ➢ 治療不會對付款人產生重大財務影響;准入壁壘低/無可以在現有 CPT 代碼下進行賠償 ➢ 競爭對手的劣質二線產品也實現了類似的銷售額 ➢ 生命週期管理上行空間,有可能過渡到家用設置 未滿足的需求 正面 反饋 銷售額 潛在銷售額 WW 年度 淨銷售額 高效 商業化 來源:Soligenix 主要市場研究 16 |
| 牛皮癬和 SGX302(合成金絲桃素) ➢ 由 T 細胞失調引起 o 影響全球 60-1.25 億人 o 影響美國 800 萬人 ➢ SGX302 — 可見光激活光動力療法 o 活性成分與 Hybryte 相同™ o 專注於輕度至中度患者,尤其是大多數患有輕度中度斑塊病的患者 o 陽性1/2期試點研究完成 o 2a 期臨牀試驗正在進行中;對最初五名患者(隊列 1)的評估顯示出明確的生物 信號;隨後的四名患者(隊列 2)使用加速光照時間表進行治療,兩名患者 在18周的治療期內取得臨牀成功(IGA分數為1) ➢ 優點 o 銀屑病的其他光動力學/光療方法使用紫外線,有明顯的副作用 o 其他皮膚導向療法療效有限或可能導致局部皮膚損傷 o 無法治療嚴重疾病(因此無法與之競爭生物製劑或全身療法) o 可能在臨牀或家中使用 ➢ 針對輕度皮膚的靶向治療至中度牛皮癬患者(約 70% 的牛皮癬 患者);市場機會得不到充分利用 17 |
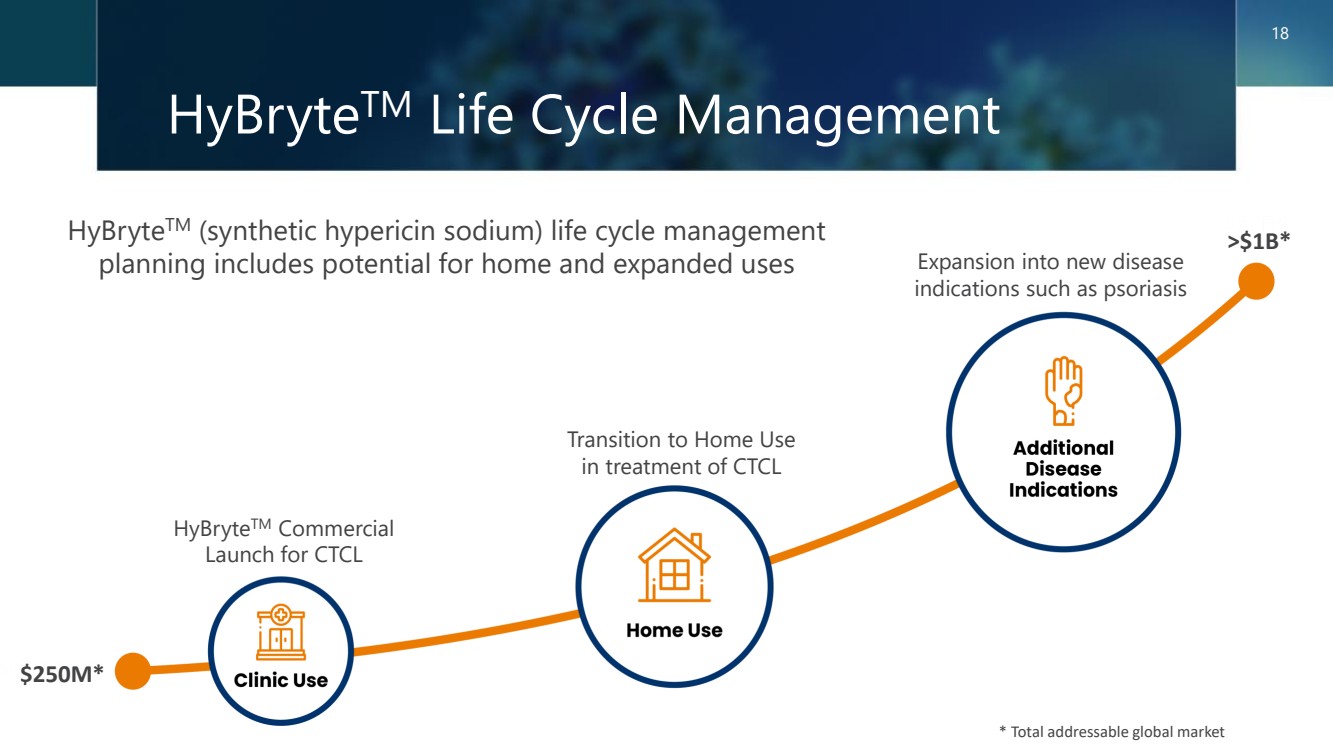
| HybryteTM 生命週期管理 18 * 全球總市場 HybryteTM(合成金絲桃素鈉)生命週期管理 規劃包括家庭和擴展用途的潛力 * 全球總市場 2.5億美元* >10億美元* HybryteTM 商用 上市 CTCL 過渡到家用 CTCL 的治療擴展到銀屑病等新疾病 適應症 |
| 公共衞生解決方案 解決行業和政府的關鍵問題 19 |
| 公共衞生解決方案板塊 由政府資助 — 民用和軍事用途醫療對策 (MCM) 獲得 FDA MCM 批准後,有可能獲得: ➢ 最多 3 張優先審查券(PRV 售價約為 1 億美元) 用於未來計劃或出售,和/或 ➢ 政府採購合同 用於供應國家戰略儲備 * 預計活動和時間主題對 COVID-19 的幹擾 ** 潛在的價值驅動因素取決於持續的政府資金和/或其他資金來源 表示資金流入全部或部分由 NIH、DTRA、BARDA 和/或 FDA 20 個候選產品(FDA 動物規則)* ** 概念驗證 IND 第 1 階段 2/3 階段 BLA 審查市場 rivaX® + ThermoVax® — 疫苗 蓖麻毒素預暴露 suvax™/MarVax™ + ThermoVax® — 絲狀病毒疫苗 CivaX™ + ThermoVax® — 疫苗 美國國立衞生研究院迄今已授予3000萬美元的合同; 積極的臨牀前和臨牀數據 ORPHAN & FAST TRACK DESIGNATION 美國國立衞生研究院迄今已獲得150萬美元的臨牀前撥款; 臨牀前陽性數據 臨牀前數據為70萬美元; 陽性臨牀前數據 COVID-19 |
| suVaX™/MarVaX™ — 絲狀病毒疫苗 候選疫苗 耐高温單瓶二價 SUDV + MARV 疫苗提供 100% 防護 SUDV 和 MARV 挑戰: 發表於疫苗市場 機會 Oportunity ➢ 絲狀病毒感染(扎伊爾埃博拉病毒、蘇丹 埃博拉病毒、馬爾堡病毒)是致命的; 只有扎伊爾毒株疫苗可用, 需要 ≤ -60°C 的運輸/存儲 ➢ 疾病流行地區受益於 避免冷鏈配送的能力 ➢ 政府將 開發活動置於優先地位,馬爾堡 } 馬爾堡病毒和蘇丹埃博拉病毒地區 醫療需求未得到滿足 ➢ SuVaX™ /Marvax™ 可能有資格獲得 優先審查券 開發 狀態 ➢ 在美國國立衞生研究院撥款下與夏威夷大學 合作 Bi-和 Tri-br} 價混合物是可行的 ➢ 已證明在 40°C/104°F 下至少有兩年的穩定性。➢ ➢ 21 0 7 1 4 2 1 2 2 2 2 5 5 5 0 0 S U D D V C h a lle n g e a t W e k 1 2 D a y s P o s s t C h a lle n g e % S u rv iv a l S U D V G P + C o V S e p a ra a ra a l % S u rv iv a l S U D G P + C o V S e p a ra C o V C o m b S U D V G P + M A R V G P + C o V M B C O M b C O M b C O M b C O M b C O M b C O N T R O L |
| 經驗豐富的管理層和董事會 Christopher J. Schaber, 博士 董事長、 總裁兼首席執行官 • 30 年的經驗 • 急性療法(聯合創始人) • 奧美達製藥 • 脂質體公司 • 惠氏艾爾斯特 醫學博士 Richard Straube,醫學博士 br} 首席醫學官 • 35 年的經驗 • Stealth Peptides Inc. • INO Therapeutics • Ohmeda Pharmicals • Centor ,博士 ,首席科學官 • 20 年經驗 • Inimex Pharmicals • ESSA製藥公司 • Kinetek Pharmicals 喬納森·瓜裏諾, 註冊會計師,CGMA 首席財務官 • Hepion Pharmicals, Inc. • 科文斯公司 • 貝萊德公司 • 普華永道會計師事務所 } Gregg Lapointe, 註冊會計師,工商管理碩士 • 30 年經驗 • Cerium Pharmicals(首席執行官) 曾任職於 Sigma-Tau 製藥、普華永道 阿斯頓強生 黛安·帕克斯 • 30 年經驗 凱特製藥、Pharmacyclics、 安進 Tech 羅伯特·魯賓,醫學博士 • 40 年的經驗 • 喬治敦醫學院 • 曾任勒温集團 • 前美國助理外科醫生 傑羅姆·澤爾迪斯,醫學博士, 博士 • 35 年的經驗 • 曾任職於 Celgene Corporation (CMO), Sandoz,索倫託詹森研究所, Celularity,nexImmune 22 |
| In Summary ➢ Robust pipeline consisting of multiple fast track and/or orphan designated products, with potential for significant commercial returns of ~$2B in global annual sales ➢ Late clinical-stage assets, one with successful Phase 3 data readout o Cutaneous T-cell lymphoma (HyBryte™ or SGX301) – Positive statistically significant results achieved in first Phase 3 study; published JAMA Dermatology – Second confirmatory Phase 3 study of similar design accepted by EMA; FDA discussions remain ongoing – Confirmatory Phase 3 double-blind, placebo-controlled study in ~80 patients to initiate in 2H 2024 – Significant commercial opportunity in area of unmet medical need; estimated global market potential >$250M o Psoriasis (SGX302) – Positive and statistically significant results achieved in Phase 1/2 proof of concept (POC) study – Phase 2a study in mild-to-moderate psoriasis ongoing; clinical success achieved in 2 of 4 Cohort 2 patients – Significant commercial opportunity in area of unmet medical need; estimated global market potential >$1B o Behçet's disease (SGX945) – Phase 2a study in aphthous ulcers in Behçet's Disease; FDA IND & protocol cleared, fast track designation received – Significant commercial opportunity in area of unmet medical need; estimated global market potential >$200M ➢ Collaborations with biotech, academia and government agencies ➢ Non-dilutive government funding helps cover operating expenses o NIH grant awards supporting vaccine development; potential for up to 3 Priority Review Vouchers (PRVs) ➢ Experienced management team and renowned advisors with record of success 23 |
| Thank you www.soligenix.com NASDAQ: SNGX 24 Follow us on: facebook.com/soligenix/ twitter.com/Soligenix_Inc linkedin.com/company/soligenix-inc-/ youtube.com/c/SoligenixInc |