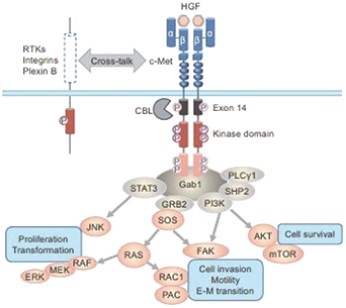
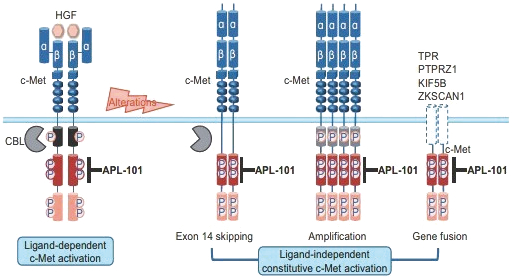
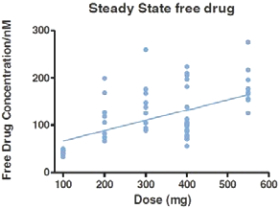
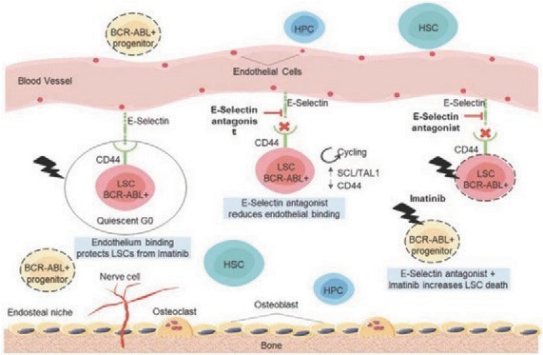
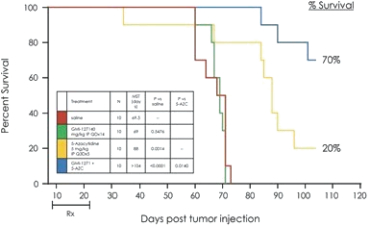
阿波倫組學的結構
下圖描繪了阿波利經濟學組織結構的簡化版本。

注1:Apollology通過其美國總部的Apollology US和中國的全資子公司Crownmab開展業務 。Apollology US和Crownmab開展與腫瘤學生物製劑相關的研究和開發活動,以促進候選產品的發現和開發,並擴大Apollology的全球業務。Apollology HK是一家控股Crownmab和Crown Bochang(通過Crownmab)的中介控股公司,自成立以來一直沒有從事任何業務 。Apollology AU擁有某些知識產權,並與澳大利亞的Apollology臨牀試驗相關活動的供應商接洽,但它沒有任何其他業務運營、員工或辦公場所。皇冠博創是Apollonomy的全資附屬公司及Crownmab在中國的直接附屬公司,一直是某些業務活動由Crownmab進行的合約的訂約方。皇冠博創 沒有從事任何經營活動,也沒有任何員工或辦公場所。
注2:阿波倫公司的公司結構不包含VIE,阿波倫公司未來無意在中國設立或使用任何VIE。
注3:見副標題。控股 公司結構下面從第16頁開始,瞭解有關現金如何在ApollEconomics及其子公司之間轉移的更多信息。
附註4: 投資Apollonomy證券並不是購買該等於美國或中國的營運附屬公司的股權證券,而是購買本身並無重大業務的開曼羣島控股公司的股權證券。
中華人民共和國監管事項
我們在大中國地區開展部分業務,我們和我們的中國子公司受中國法律的約束,其中包括對外國投資和數據安全的限制。中國政府一直在尋求對總部設在內地的公司中國在海外融資施加更多控制和限制,這種努力可能會繼續下去,也可能會在未來加大力度。中國政府對海外發行和/或外國投資內地發行人中國施加更多控制權,可能導致阿波羅經濟學中國子公司的運營發生實質性變化。
12