

附錄 99.2 恢復平衡。更新生活。2b 期 HARMONY 數據 演示:2024 年 3 月 4 日對肝硬化前 MASH 患者進行為期 96 周的依魯西弗明 (EFX) 治療的頭條結果

前瞻性陳述本演示文稿和隨附的 口頭評論可能包含AkeroTherapeutics, Inc.(“我們”、“我們的”、“Akero” 或 “公司”)的 “前瞻性陳述”,這些陳述與我們的業務、運營和財務狀況有關,包括但不限於當前的信念、預期和假設:我們的業務;未來的計劃和戰略,包括我們對治療潛力和臨牀益處的 期望Efruxifermin(“EFX”),以及EFX的劑量、安全性和耐受性;我們的EFX發展計劃,包括我們對EFX作為 基礎MASH療法潛力的信念;我們的臨牀前和臨牀結果,包括我們的安全性/耐受性、實驗室措施和來自2b HARMONY研究和其他相關里程碑的活檢數據;以及從中獲得陽性結果的可能性 臨牀研究不一定能預測未來或正在進行的臨牀研究的結果;風險與競爭格局有關。諸如(但不限於)“期待”、“相信”、 “期望”、“預測”、“估計”、“打算”、“計劃”、“將”、“應該” 和 “可以” 等詞語以及類似的表達方式或詞語可識別前瞻性 陳述。新的風險和不確定性可能會不時出現,因此不可能預測所有的風險和不確定性。除非法律要求,否則即使將來有新的信息,我們也沒有義務公開更新這些前瞻性陳述,或者 更新實際結果可能與前瞻性陳述中預期的結果存在重大差異的原因。有關這些以及其他風險和不確定性以及其他 重要因素的討論,其中任何一個都可能導致我們的實際業績與前瞻性陳述中包含的有所不同,請參閲我們最近向美國證券交易委員會提交的10‐K表年度報告和 表10‑Q季度報告中題為 “風險因素” 的部分,以及對潛在風險、不確定性和其他重要因素的討論我們隨後向美國證券交易所 委員會提交的其他文件。本演示文稿中的所有信息均截至本文發佈之日,除非法律要求,否則我們沒有義務更新這些信息。本演示文稿中包含的某些信息涉及或基於研究、 出版物、調查和其他從第三方來源獲得的數據以及公司自己的內部估計和研究。儘管該公司認為截至本演示文稿之日這些第三方來源是可靠的,但 它尚未獨立核實,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性做出任何陳述。此外,本演示文稿中包含的所有市場數據 都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。最後,儘管我們認為自己的內部研究是可靠的,但此類研究尚未得到任何 獨立來源的證實。©2024 AKERO THERAPEUTICS。2

EFRUXIFERMIN (EFX):一種雙價 fc-FGF21 融合蛋白 96 周 ≥1 階段纖維化改善後顯著效果混合纖維化纖維化和分辨率 MASH 分辨率改善 ©2024 AKERO THERAPEUTICS。3

HARMONY 試驗設計:肝硬化前 (F2-F3) MASH 在 24 和 96 周進行肝組織學檢查第 96 周主要分析第 24 周主要終點 •≥ 1 或 2 階段纖維化改善且無惡化 •≥ 1 階段纖維化改善 • MASH 解除且無纖維化惡化以及 MASH 無惡化 • 纖維化改善和 MASH 分辨率 • 第 24 周主要終點完全開啟;不是全力支持 96 周終點 72 周長期隨訪 24 周安慰劑安慰劑 EFX 28mg EFX 28mg EFX 50mg EFX 50mg EFX 50mg EFX 50mg EFX 50mg 篩查第 24 周 96 周肝活檢活檢肝活檢 ©2024 AKERO THERAPEUTICS。4 期 2b 篩查隨機分組
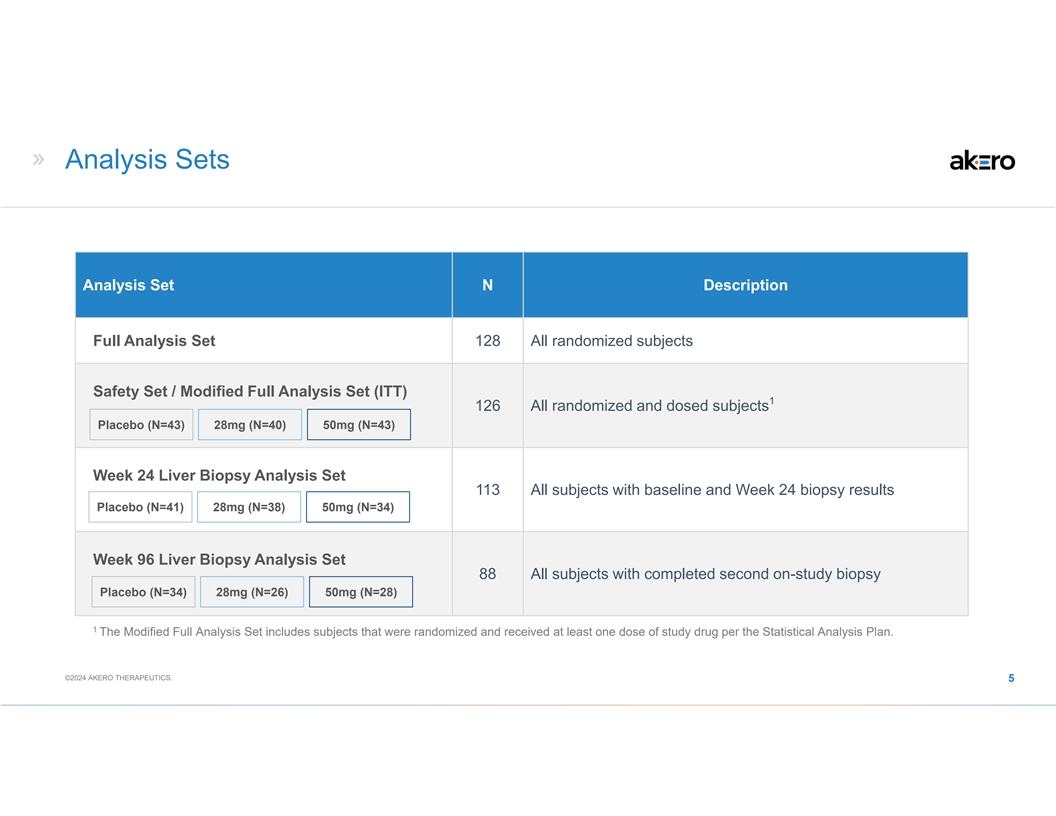
分析集分析集 N 描述完整分析集 128 全部 隨機受試者安全套裝/修改後的完整分析集 (ITT) 1 126 所有隨機和給藥受試者安慰劑 (N=43) 28mg (N=40) 50mg (N=43) 第 24 周肝活檢分析集 113 所有具有基線和第 24 周活檢結果的受試者安慰劑 (N=41) 28mg (N=38) 50mg (N=38) 50mg (N=34) 第 96 周肝活檢分析套裝 88 所有完成第二次研究活檢的受試者安慰劑 (N=34) 28mg (N=26) 50mg (N=28) 1 修改後的完整分析套裝包括隨機分組並在 接受治療的受試者根據統計分析計劃,至少服用一劑研究藥物。©2024 AKERO THERAPEUTICS。5

基線人口統計安慰劑 EFX 28mg EFX 50mg 參數(單位)(N = 43) (N = 42)(N = 43)年齡(歲)55 57 52 性別(% 女性)63 69 53 體重(kg)108 104 103 2 型糖尿病(%)65 76 70 1 纖維化階段(% F3)70 64 63 基線時接受 GLP-1 治療的患者比例(%)21 18 9 增強型肝纖維化 (ELF) 評分 9.8 9.7 9.8 2 Pro-C3 (μg/L)(第 2 代 ELISA)125 113 145 3 按 VCTE(FibroScan)得出的肝硬度(kPa)15 14 16 4 按 MRI-PDFF 得出的肝脂肪分數(%)17.1 18.5 17.5 MASLD 活性評分 (MAS) 5.4 5.1 5.6 丙氨酸氨基轉移酶 (ALT) (U/L) 62 5063 天門冬氨酸氨基轉移酶 (AST) (U/L) 57 42 52 1 2 3 4 所有患者纖維化階段 2 (F2) 或 3 期 (F3);Procollagen 3 N 末端丙肽;振動控制瞬態彈性成像;磁共振成像質子密度脂肪 分數 ©2024 AKERO THERAPEUTICS。源數據:完整分析集 (FAS) 6

≥1 階段纖維化改善,MASH 無惡化: 在第 96 周觀察到 50 mg EFX 有統計學上的顯著反應纖維化改善 ≥1 階段,第 96 周 MASH 沒有惡化初步分析 *** 80% 75% 60% 46% 40% 2 ITT 分析安慰劑 EFX 28mg EFX 50mg 24% (N=43) (N=43) 20% ** 19% 49% 2 所有缺失的活檢均歸咎為無反應者 0% ** p

≥1 階段纖維化改善且無惡化 MASH: 持續、廣泛和持久的反應纖維化改善 ≥1 階段,MASH 在第 96 周沒有惡化 1 2 第 24 周持續和新反應者中有 *** 80% 75% 3,5 安慰劑 EFX 28mg EFX 50mg (N=12) (N=12) 60% 新增 (n=10) 2 (40%) 10 (83%) 11 (92%) 46% 新增 (n=2) 40% 第 24 周無反應者的比例 4,5 在第 96 周有新反應 24% 持續安慰劑 EFX 28mg EFX 50mg 持續 20% (n=11) (n=10) (N=29) (N=14) (N=16) (n=6) 6 (21%)) 2 (14%) 10 (63%) Sust。(n=2) 0% 安慰劑 EFX 28mg EFX 50mg 1 3 在第 24 周進行第 96 周活檢的受訪者中 N=34 N=26 N=28 4 在第 24 周進行第 96 周活檢的無反應者中 1 2 *** 5 響應者;第 96 周的響應者 p

EFX 纖維化改善情境:肝硬化前 MASH:纖維化改善≥1階段 且MASH Efruxifermin Pegozafermin Denifanstat 瑞斯美替羅塞瑪魯肽曲塞肽舒沃杜肽2b期 (F2-F3) 2b期 (F2-F3) 2b 期 (F2-F3) 3 期 (F1-F3) 2b 期 (F2-F3) pH2b期 () pH2b期 b (F2-F3) Ph 2b (F1-F3) 96 Wks/ 66% F3 24 Wks/ 65% F3 52 Wks/ 65% F3 52 Wks/?% F3 52 Wks/ 62% F3 72 Wks/ 69% F3 52 Wks/?% F3 48 Wks/?% F3 共識閲讀共識讀數?閲讀統計學綜合共識讀數 1 1 1 2 2 完成者完成者 ITT ITT *** *** 75% 46% 43% **** 41% 33% 32% ***** 26% *** 26% *** 24% *22% 24% * 22% 纖維化纖維化 18% 改善未有 14% 公開報道的這款 GLP-1R/GCGR 7% 雙激動劑 安慰劑 28mg 50mg 安慰劑 15mg 30mg 安慰劑 50mg 安慰劑 80mg 100mg 安慰劑 0.2mg 0.4mg 所有劑量組 (N=34) (N=26) (N=28) (N=61) (N=61) (N=66) (N=81) (N=318) (N=316) (N=321) (N=321) (N=58) (N=59) (N=56)(N196) (N=295) 1 2 注:這些數據來自不同時間點的不同臨牀試驗,有基線活檢和研究結束活檢;缺失活檢歸因於無反應者在試驗設計和患者羣體中的差異。因此, 無法進行跨試驗比較 Pegozafermin——89Bio(2023)3月22日公司介紹;Denifanstat — Sagimet(2024)1月22日新聞稿;也沒有進行過正面交叉臨牀試驗。Resmetirom — Madrigal (2022) 12 月 19 日新聞稿;Semaglutide-Newsome 等人(2021)New Engl J Med 384、1113-* ** *** 24;替塞帕肽 — clinicaltrials.gov,NCT04771273;所有商標均為財產 p NCT04166773

2 階段纖維化改善且 MASH 沒有惡化:統計學上 兩組 EFX 均觀察到顯著反應纖維化改善 2 階段,MASH 在第 96 周沒有惡化 1 初步分析 40% *** *** 31% 30% 20% 2 ITT 分析安慰劑 EFX 28mg EFX 50mg (N=40) (N=43) 10% **** 2% 23% 3% 2 活檢缺失的受試者被歸咎為無反應者 0% ** p

EFX 纖維化改善情境:肝硬化前 MASH:纖維化改善≥2階段 且MASH Efruxifermin Resmetirom Semaglutide 2b 期(F2-F3)3 期(F1-F3)2b 期(F2-F3)96 Wks/66% F3 52 Wks/62% F3 72 Wks/69% F3 共識讀者兩位讀者共識讀者 1 2 2 完成者 ITT ITT ** ** 36% ** ** 31% 26% 22% 20% 僅改善纖維化(未報告 MASH 惡化)10% 8% 3% 3% 安慰劑 28mg 50mg 安慰劑 80mg 100mg 安慰劑 80mg 100mg 安慰劑 0.2mg 0.4mg(N = 34)(N = 26)(N = 28)(N = 318)(N = 321)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = 58)(N = =59) (n=56) 1 2 注意:這些 數據來自不同時間點的不同臨牀試驗,有基線活檢和研究結束活檢;缺失的活檢歸因於試驗設計和患者羣體中無反應者的差異。因此,無法進行跨試驗 比較Pegozafermin-89Bio(2023)3月22日公司介紹;Denifanstat — Sagimet(2024)1月22日新聞稿;也沒有進行過正面交叉臨牀試驗。Resmetirom — Madrigal (2022) 12 月 19 日新聞稿;Semaglutide-Newsome 等人 (2021) New Engl J Med 384、1113-24 ** p

≥1 階段纖維化改善,MASH 無惡化: 在 F3 患者中觀察到 50 mg EFX 纖維化改善 ≥1 階段,MASH 在第 96 周沒有惡化 1 F3 纖維化子集 *** *** 68% 2 階段 (n=8) 40% 2 階段 (n=5) 14% 1 階段 (n=5) 1 階段 (n=3) 1 階段 (n=1)) 安慰劑 EFX 28mg EFX 50mg N=22 N=15 N=19 1 *** 基線和第 96 周活檢時為 F3 的患者 p

MASH 分辨率和纖維化無惡化:統計學上 兩組 EFX 均觀察到顯著反應 MASH 分辨率且無纖維化惡化第 96 周 1 初步分析 70% ** ** 60% 57% 50% 40% 2 ITT 分析 30% 24% 安慰劑 EFX 28mg EFX 50mg 20% (N=40) (N=43) * 19% 40% 37% 10% 2 活檢缺失的受試者被歸咎為無反應者 0% * p

≥1 階段纖維化改善和 MASH 分辨率:統計學上 在兩個 EFX 組中均觀察到顯著的反應纖維化改善 ≥1 階段和 MASH 分辨率 96 1 初步分析 60% ** *** 42% 40% 30% ** 42% 30% 2 ITT 分析安慰劑 EFX 28mg 28mg 20% (N=43) (N=43) 9% ** 10% 28% 35% 2 ITT 分析安慰劑 EFX 28mg 50mg 20% (N=43) (N=43) 9% ** 10% 28% 35% 2 受試者活檢缺失被歸咎為無反應者 0% ** p

非侵入性標誌物的統計學顯著下降反映 纖維化的組織學改善 LS 從基線到第 96 周的平均變化 ELF 評分 Pro-C3 (ng/mL) (GEN2 ELISA) 肝硬度 (kPa) 0.0 0 2 -0.1 -10 0 -0.2 -0.6 † -20 -17 -0.4 -30 -4 * -4.0 -40 -0.8 -6 †† -40 -0.7 -0.8 *-50 -8 -7.2 ** -0.8 ** -51 -1.0 -60 -10 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg n=27 n=25 ** p

肝損傷標誌物的統計學顯著改善 持續到第 96 周 ALT AST LS 與基線的平均變化百分比 LS 平均變化百分比:50-63 U/L 基線:42-57 U/L 20% 10% 10% 0% 0% -10% ***** -20% *** -30% *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** -40% *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** -50% *** -50% *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** -60% -60% BL W8 W16 W24 W32 W40 W48 W56 W64 W72 W80 W88 W96 BL W8 W16 W24 W40 W48 W56 W64 W72 W80 W88 W80 W88 W96 安慰劑 28mg EFX 50mg EFX 安慰劑 28mg EFX 50mg EFX *** *** p

治療緊急不良事件 (TEAE) 從基線到第 96 周安慰劑 EFX 28mg EFX 50mg TEAE 概述 (N=43) (N=40) (N=43) TEAE 導致死亡 0 (0%) 0 (0%) 0 (0%) a a b b 與藥物相關的嚴重不良事件 (SAEs) 0 (0%) 1 (2%) c d d e, f 與藥物無關的 SAE 4 (9%) 3 (8%) 6 (14%) G、h g、h i、j i、j 藥物相關的 TEAE 導致停藥 0 (0%) 4 (10%) 3 (7%) k、l k、l 非藥物相關的 TEAE 導致停藥 0 (0%) 0 (0%) 2 (5%) 最常見 (≥ 15%) 藥物相關的 TEAE 安慰劑 EFBO X 28mg EFX 50mg 腹瀉 7 (16%) 16 (40%) 16 (37%)噁心 5 (12%) 12 (30%) 14 (33%) 食慾增加 3 (7%) 7 (18%) 10 (23%) 10 (23%) 注射部位紅斑 6 (14%) 8 (20%) 7 (16%) 注射部位瘀傷 2 (5%) 6 (15%) 3 (7%) a 28mg EFX,藥物相關的 SAE(第 24 周後):胰腺炎(非 在影像學檢查中確認並在 24 年內出院小時) b 50mg EFX,藥物相關 SAE(之前曾報道):食管炎 c 安慰劑,非藥物相關的 SAE(第 24 周後):(1)闌尾炎;(2)骨關節炎;(3)胸痛;非心臟性的;(4)缺氧 d 28mg EFX,非藥物相關的 SAE(第 24 周後):(1)胃炎;(2)腳踝;下肢骨折(車禍);(3)冠狀動脈痙攣;驚恐發作 e 50mg EFX,與藥物無關 SAE(先前報道):(1)COVID-19 病毒感染;(2)面部水腫;(3)急性壞死性胰腺炎 f 50mg EFX,非藥物相關的 SAE(第 24 周後):(1)非典型胸痛(非心臟輻射)背部;(2)急性胸痛;(3)急性呼吸衰竭 g 28mg EFX,藥物相關不良反應導致 停藥(先前曾報道):(1)食慾增加和體重增加;(2)腹瀉;h 28mg EFX,藥物相關不良反應導致停藥(第 24 周後):(1)胰腺炎(SAE 上文報道);(2)腹瀉 i 50 mg EFX,藥物相關的 AE 導致停藥(先前曾報道):(1)食道炎和嘔吐;(2)噁心 j 50mg EFX,與藥物相關的不良反應導致停藥(第 24 周後):(1)腹瀉 k 50mg EFX,非藥物相關的 AE 導致停藥 (先前報道):(1)淋巴結腫大 l 50mg EFX,與藥物無關的 AE 導致停藥(第 24 周後):(1)急性壞死性胰腺炎來源數據:安全套裝 17 ©2024 AKERO THERAPEUTICS。

安全概述血壓 • 第 96 周收縮壓和舒張壓與 安慰劑沒有統計學差異 96 肝功能和止血標誌物 1 2 3 • 保持穩定,包括血小板、膽紅素、INR、MELD 和 CP 評分進展為肝硬化 • 各劑量組骨骼 礦物質密度 (BMD) 均衡 • HARMONY 中的大多數患者處於絕經後年齡,其中每年骨密度損失通常預計為1%至1.5% • 在第48周,腰椎和股骨 頸部區域與安慰劑相比沒有顯著變化 • 安慰劑組到第96周,腰椎骨密度增加了約1% • 在第96周,腰椎(均為EFX組,均為3-4%)和股骨頸區域( )與安慰劑相比顯著降低

96 周後脂蛋白分佈的改善 LS 從 基線到第 96 周的平均變化 (%) 甘油三酯 (% 變化) 非高密度脂蛋白 (% 變化) LDL (% 變化) 15% 10% 40% 8% 10% 10% 10% 10% 10% *5% 3% 3% 0% *-5% 0% 20% 18% -10% -5% -5% 10% *-15% 10% *15% -20% *** 5% 5% 30% 3% 0% *-5% 0% 20% -2% -15% -5% 10% *15% -20% *** -20% -10% -25% -10% 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg n=26 n=27 *** p
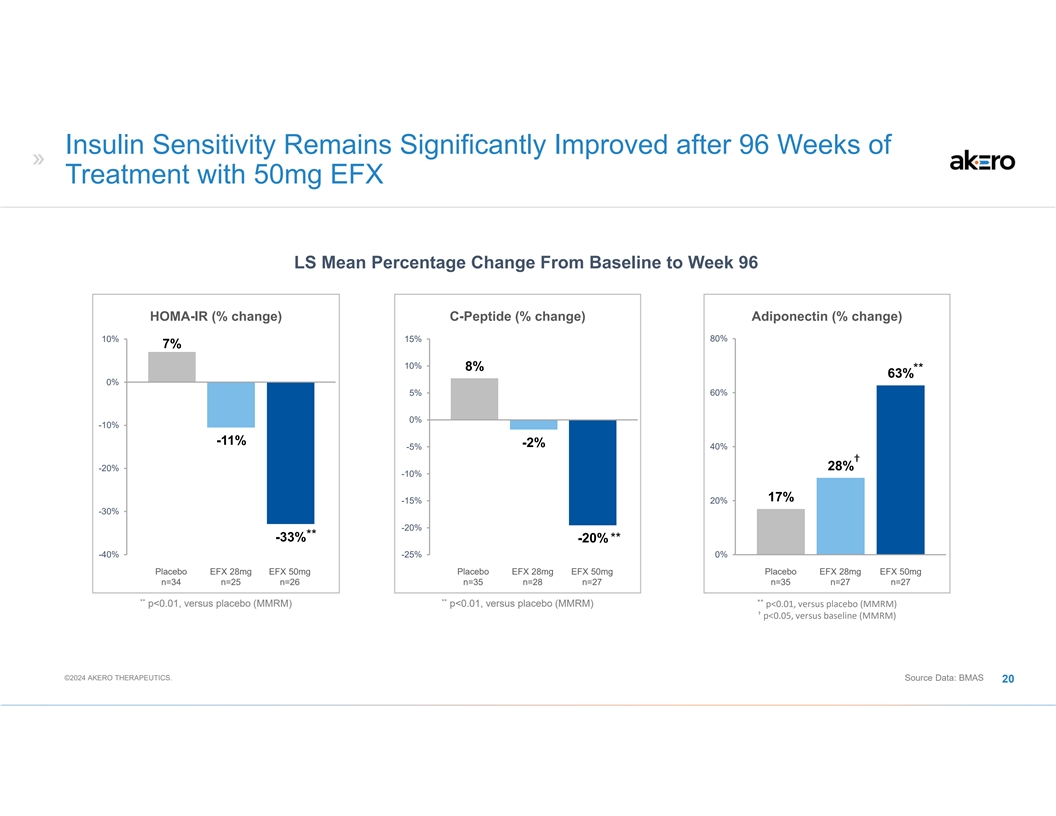
使用 50 毫克 EFX LS 治療 96 周後,胰島素敏感性仍顯著改善 HOMA-IR(變化百分比)C 肽(% 變化)脂聯素(% 變化)80% 10% 7% 10% 10% 10% 10% 8% ** 63% 0% 0% -10% -11% -2% 40% † 28% -20% -10% -10% -10% -10% -20% 20% -20% 20% -33% ** 63% 0% 0% -10% -11% -2% -20% ** -40% -25% 0% 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg 安慰劑 EFX 28mg EFX 50mg n=34 n=25 n=26 n=35 n=27 ** p
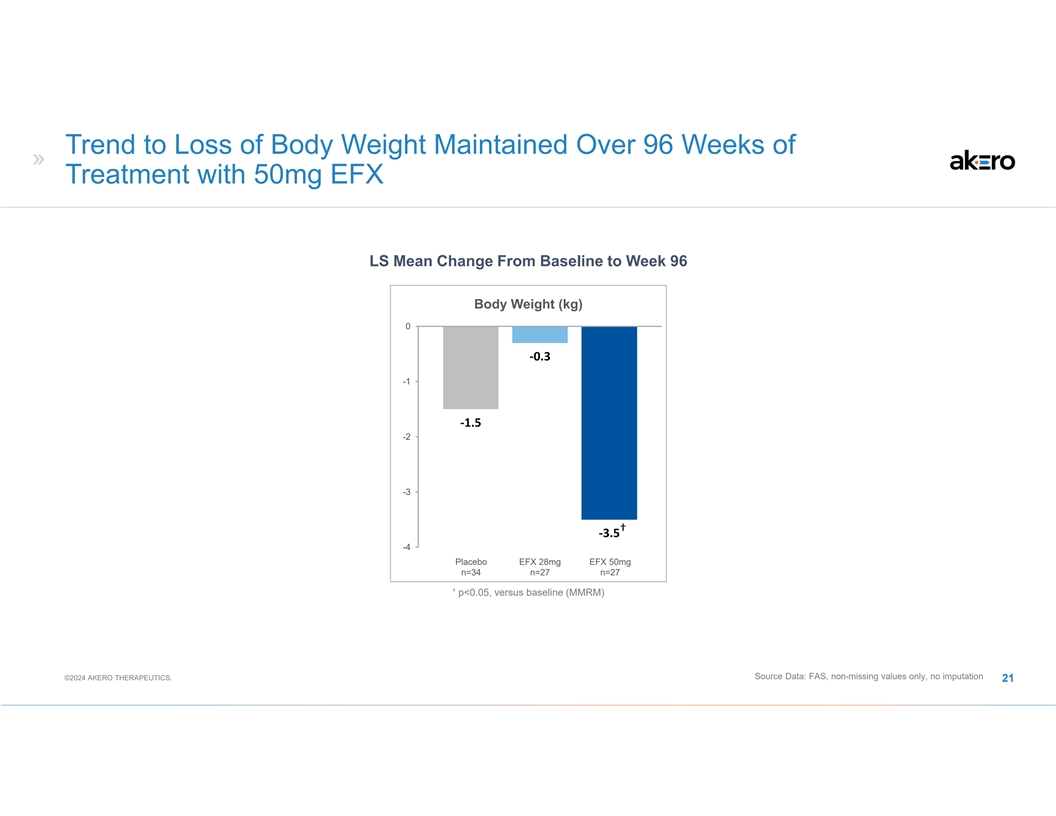
使用 50mg EFX LS 治療 96 周內保持體重減輕的趨勢從基線到第 96 周的平均體重變化 (kg) 0 ‐0.3 -1 -1 ‐1.5 -2 -3 † ‐3.5 -4 安慰劑 EFX 28mg EFX 50mg n=34 n=27 † p

要點:96 周後 50 毫克 EFX 史無前例的深度廣泛耐用 晚期 24 周纖維化 ≥1 階段轉化為第 96 周 2 期改善纖維化反應者 F3 1 2 3 的非纖維化改善 4 5 名反應患者 *** 6 6 *** 75% 對 24% 36% 對 3% 63% 對 20% 92% 對 40% 68% 對 14%(50mg EFX 對比 14%)(50mg EFX 對比安慰劑)(50mg EFX 對比安慰劑)(50mg EFX 對比安慰劑)(50mg EFX 對比安慰劑)(50mg EFX 對比安慰劑)*** p

AKERO THERAPEUTICS 601 Gateway Boulevard 納斯達克:AKRO 納斯達克:AKRO 套房 350 加利福尼亞州南舊金山 94080