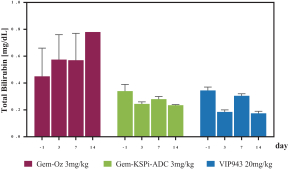
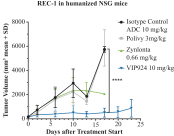
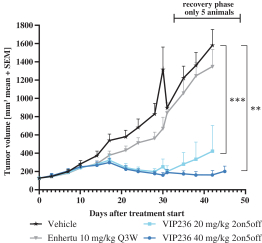
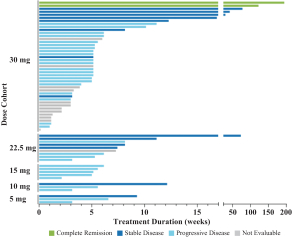
| • | 有效載荷設計用於: |
| • | 使用我們的蜂窩捕捉器降低滲透性™確保癌細胞蓄積的技術 |
| • | 以較低的流出量增加滲透性,以便在TME中釋放。 |
VersAptx平臺使我們能夠針對特定目標優化這些技術,並開發旨在解決第一代生物結合物的安全性和有效性挑戰的生物結合物。
下圖總結了我們多樣化的渠道:

我們卓有成效的管理團隊在腫瘤學方面擁有超過120年的集體經驗,在成功的藥物開發、審批和價值創造方面有着久經考驗的記錄。他們從Pharmacclics LLC、Acerta Pharma LLC、阿斯利康、拜耳股份公司、安進、基因泰克公司、禮來公司和強生公司等領先公司吸引人才,為多項藥物審批和重磅退出做出了重大貢獻,包括以70億美元收購Acerta Pharma的Calquence®阿斯利康和價值9.75億美元的Imbrovica®Janssen PharmPharmticals(現為強生創新醫藥)和Pharmaccle ics之間的合作伙伴關係。
我們相信,我們多樣化的渠道,包括我們的下一代VersAptx平臺和我們的管理團隊,使我們能夠成功地為患者開發範式轉換療法。
戰略
我們的目標是通過開發安全、有效和耐受性良好的差異化和新療法,成為領先的生物製藥公司。我們力求通過實施以下戰略來實現這一目標:
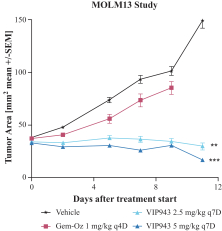
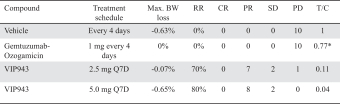
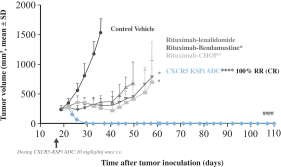
| • | VIP943、VIP236和Enitociclib在臨牀開發和治療中的進展證明-概念 |
| • | 在2025年底或2026年初將VIP924進展為IND應用程序 |
| • | 利用我們的下一代VersAptx平臺擴展我們的渠道,並與其他公司合作開發獨特、安全和有效的ADC和SMDC |
| • | 形成戰略合作伙伴關係/協作,最大限度地發揮我們的渠道和VersAptx平臺的潛力 |
7