
附錄 99.1

1 © 2024,Iovance Biotherapeutics, Inc. © 2024,Iovance Biotherapeutics, Inc. 公司概述 2024 年 1 月 1

2 © 2024,Iovance Biotherapeutics, Inc. 前瞻性陳述本新聞稿中討論的某些事項是1995年《私人證券訴訟改革法》(“PSLRA”)所指的 “公司”、“我們” 或 “我們的”)的 “前瞻性聲明”。除歷史事實陳述外,本新聞稿中所有此類書面或口頭陳述均為前瞻性陳述,意在PSLRA提供的前瞻性聲明的安全港中進行報道。在不限制前述內容的情況下,在某些情況下,我們可能會使用諸如 “預測”、“相信”、“潛在”、“繼續”、“估計”、“預測”、“計劃”、“打算”、“預測”、“指導”、“展望”、“可能”、“可能”、“將”、“應該” 等術語或其他表達未來事件不確定性的詞語 o utc 來了,旨在確定前瞻性陳述。前瞻性陳述基於管理層的經驗以及對歷史趨勢、當前狀況、預期未來發展和其他被認為合適的因素的假設和評估。本新聞稿中的前瞻性聲明是自本新聞稿發佈之日起發表的,我們沒有義務更新或修改任何此類聲明,無論是由於新信息、未來事件還是其他原因。前瞻性陳述不能保證未來的表現,並且受風險、不確定性和其他因素的影響,其中許多因素是我們無法控制的,這些因素可能導致實際結果、活動水平、業績、成就和發展與這些粗魯陳述所表達或暗示的實質性差異。我們向美國證券交易委員會提交的文件中標題為 “風險因素” 的章節描述了可能導致實際業績、發展和業務決策與前瞻性陳述存在重大差異的重要因素,包括我們最新的10-K表年度報告和10-Q表季度報告,包括但不限於我們業務中固有的以下重大已知和未知風險和不確定性:COV ID的影響-19 大流行;風險與發生的時間和我們的能力有關成功開發、提交、獲得或維持美國食品藥品監督管理局(“FDA”)、歐洲藥品監督管理局(“EMA”)或其他監管機構對我們的候選產品的批准或其他行動,以及我們成功將獲得 FDA、EMA 或其他監管機構批准的任何候選產品商業化的能力;無論臨牀試驗是我們的關鍵研究和隊列以及與 FDA 的會晤的結果,E MA 或其他監管機構可能通過以下方式支持註冊研究和後續批准:FDA、EMA或其他監管機構,包括已批准的單臂IOV-LUN-202試驗可能不支持註冊的風險;正在進行的臨牀試驗或隊列的初步和中期臨牀結果,可能包括療效和安全性結果,可能無法反映在我們正在進行的臨牀試驗或這些試驗中的亞組的最終分析中,也可能反映在其他先前的試驗或隊列中;非病風險可能需要根據我們的試驗和基於美國食品藥品管理局和其他監管機構的試驗中的隊列進行調整意見;不斷變化的宮頸癌患者護理格局可能影響我們在該適應症中的臨牀試驗的風險;根據FDA、EMA或其他監管機構的反饋,我們可能需要進行更多臨牀試驗或修改正在進行或未來的臨牀試驗的風險;我們對臨牀試驗結果的解釋或與FDA、EMA或r監管機構的溝通可能與對此類結果的解釋有所不同或此類監管機構的通信(包括先前與美國食品和藥物管理局的BLA會晤和/或我們先前與美國食品藥品管理局就我們的非小細胞肺癌臨牀試驗舉行的會議);FDA、EMA或其他監管機構可能不批准或可能推遲批准我們提交的轉移性黑色素瘤Lifileucel的BLA申請的風險;市場對我們的候選產品的接受以及支付方可能在美國和其他國際上對其進行補償(如果獲得批准)市場;我們使用第三方製造商或我們自己的設施生產療法的能力或能力可能會有不利影響我們潛在的商業發佈;我們贊助的試驗可能無法反映在我們贊助的試驗中;成功整合最近收購的Proleukin的風險;我們產品的成功開發或商業化可能無法從產品銷售中產生足夠收入的風險,我們可能在短期內或根本無法盈利;意外支出可能減少我們估計的風險現金餘額和預測以及增加我們的估計資本需求;以及其他不在我們控制範圍內的因素,包括總體經濟狀況和監管發展。

3 © 2024,Iovance Biotherapeutics, Inc. 在為癌症患者創新、開發和交付 TIL 療法方面處於全球領先地位平臺人員和資產合作伙伴與合作者縮寫:bla=生物製劑許可證申請;BTD=突破性療法稱號;LCM=與美國食品藥品監督管理局的後期週期會議;RMAT =再生醫學高級療法指定22天專有製造工藝 90% 以上患者截至23年9月30日,接受Iovance的現金頭寸約為4.28億美元 60+ 美元,以及國際專利 500 多名員工德克薩斯大學醫學博士安德森癌症中心 3 © 2024,Iovance Biotherapeutics, Inc. 3 1 1 指定臨牀活躍臨牀試驗 7 種腫瘤類型 5 LCM 快速通道成功後 BLA 審查步入正軌 BTD RMAT 1
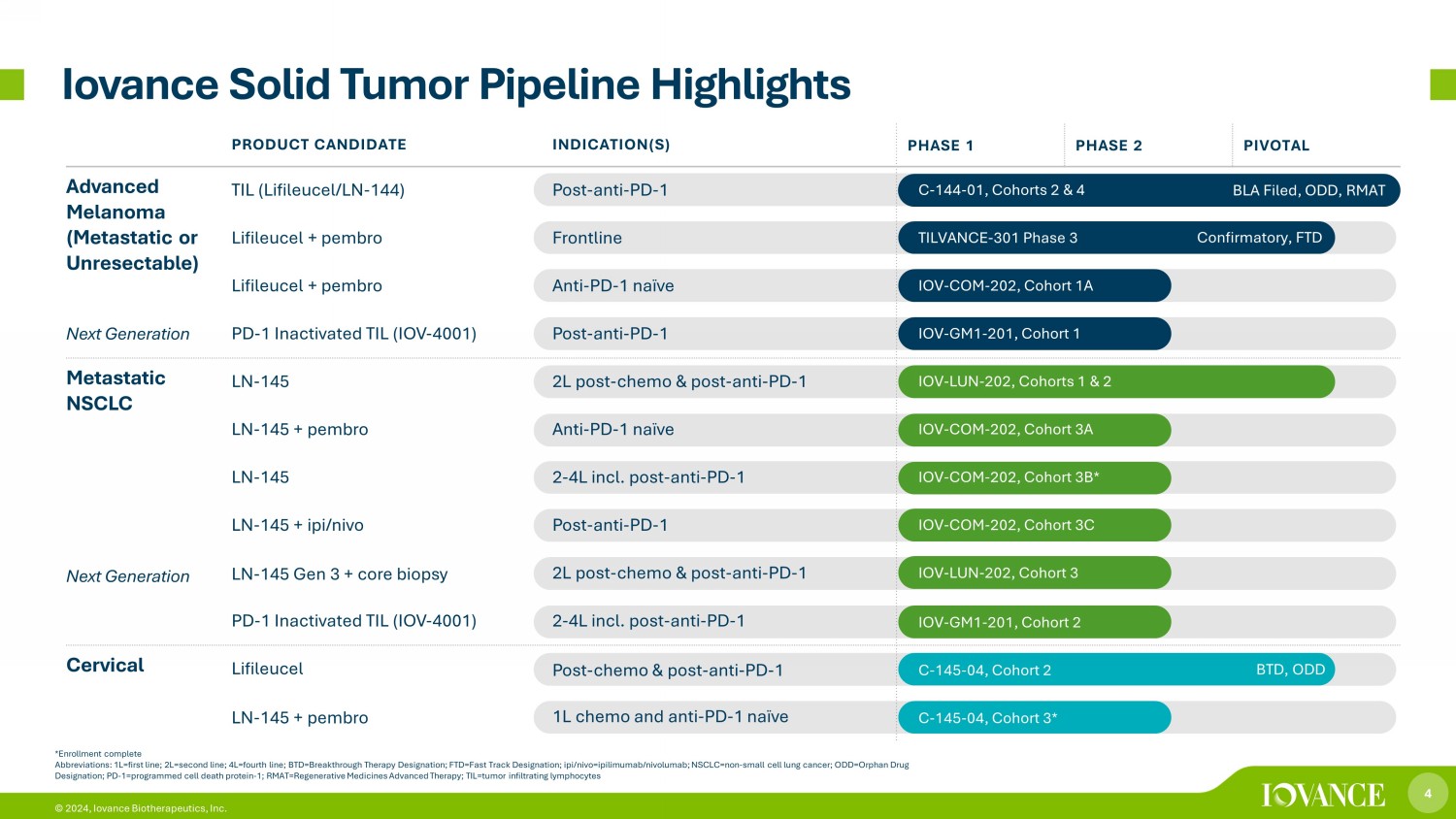
4 © 2024,Iovance Biotherapeutics, Inc. *註冊完整縮寫:1L=第一行;2L=第二行;4L=第四行;btd=突破性療法稱號;ftd=快速通道指定n;ipi/nivo=ipilimumab/nivolumab;nsclc=non——小細胞肺癌;ODD=孤兒藥物名稱;PD-1=孤兒藥名稱;PD-1=孤兒藥名稱程序性細胞死亡蛋白-1;RMAT=再生藥物高級療法;til=腫瘤浸潤淋巴試驗 Iovance 實體瘤管線要點確認,FTD BLA 已提交,ODD,RMAT BTD,ODD 候選產品適應症(S)第 1 階段 2 關鍵進展黑色素瘤(轉移性或不可切除性)下一代 TIL(LifiLeucel/Ln-144)術後-抗 PD-1 C-144-01,隊列 2 和 4 Lifileucel + pembro Frontline TILVANCE-301 階段 3 Lifileucel + pembro Anti-PD-1 naive IOV-COM-202,隊列 1A PD-1 滅活 TIL (IOV)-4001) 後——抗——PD——1 IOV——GM1-201,隊列 1 轉移性非小細胞肺癌下一代 LN——145 2L 後——化療和術後——抗PD——1 IOV——LUN——202,隊列 1 和 2 LN——145 + pembro Anti-PD-1 naive IOV——COM-202,隊列 3A LN-145 2-4L,隊列 3A LN-145 2-4L post — 反 PD — 1 IOV — COM — 202,隊列 3B* LN-145 + ipi/nivo Post-抗 PD-1 IOV-COM-202,隊列 3C LN-145 第 3 代 + 核心活檢 2L 後-化療和後-抗 PD-1 IOV-LUN-202,隊列 3 PD-1 滅活 TIL (IOV-4001) 2-4L 包括後抗-PD-1 IOV-GM 1-201,隊列 2 子宮頸 Lifileucel 術後——化療和術後——抗 PD-1 C-145-04,隊列 2 LN-145 + pembro 1L 化療和抗 PD-1 naive C-145-04,隊列 3*
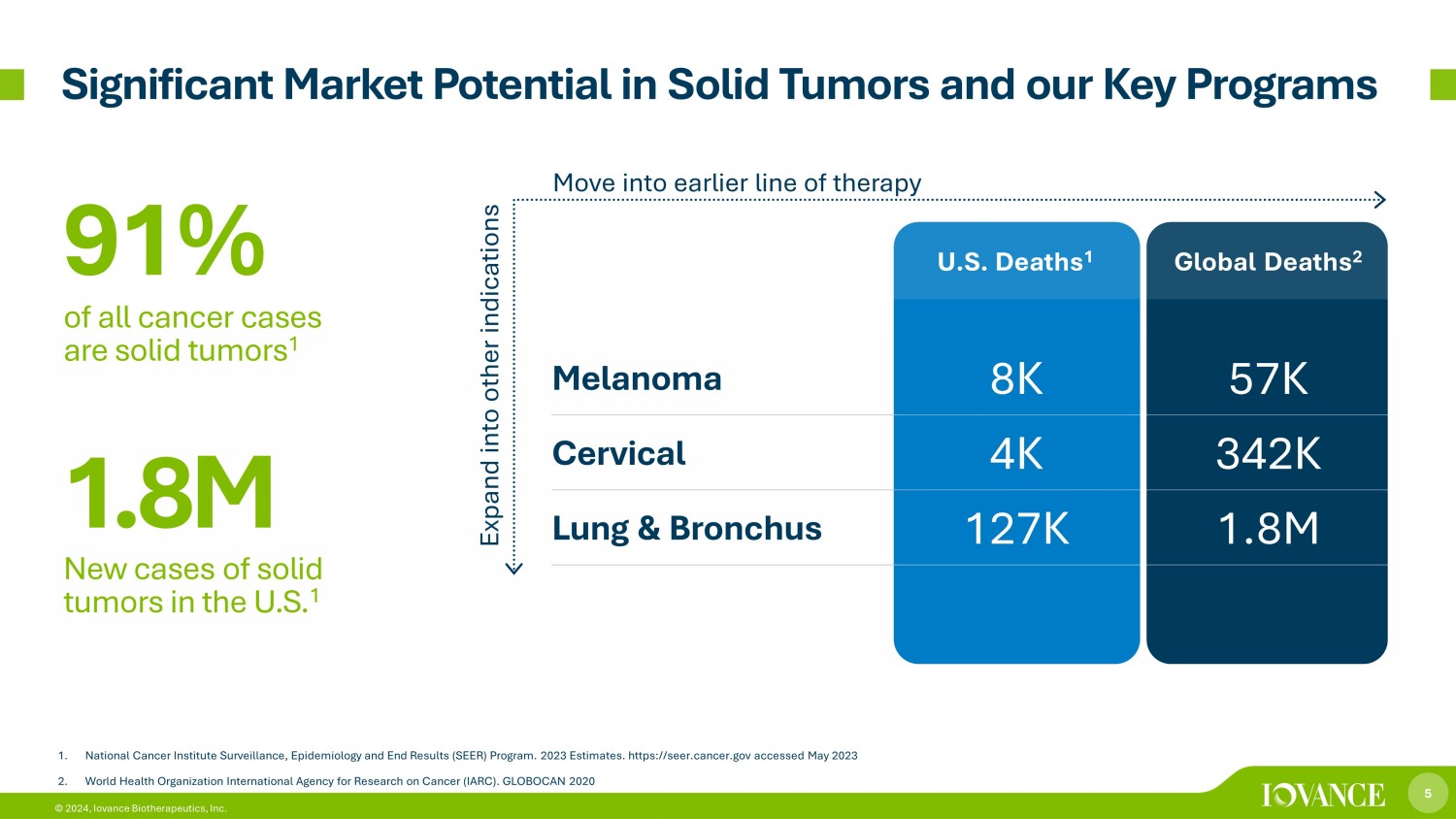
5 © 2024,Iovance Biotherapeutics, Inc. 1.美國國家癌症研究所監測、流行病學和最終結果(SEER)計劃。2023 年估計。https://seer.cancer.gov acc acc 2023 年 5 月 2.世界衞生組織國際癌症研究機構(IARC)。GLOBOCAN 2020 美國死亡人數 1 全球死亡人數 2 黑色素瘤 8K 57K 宮頸 4K 342K 肺部和支氣管 127K 180 萬 91% 的癌症病例為實體瘤 1 180 萬美國實體瘤新發病例 1 擴展到其他適應症進入早期療法實體瘤和我們的關鍵項目具有顯著的市場潛力
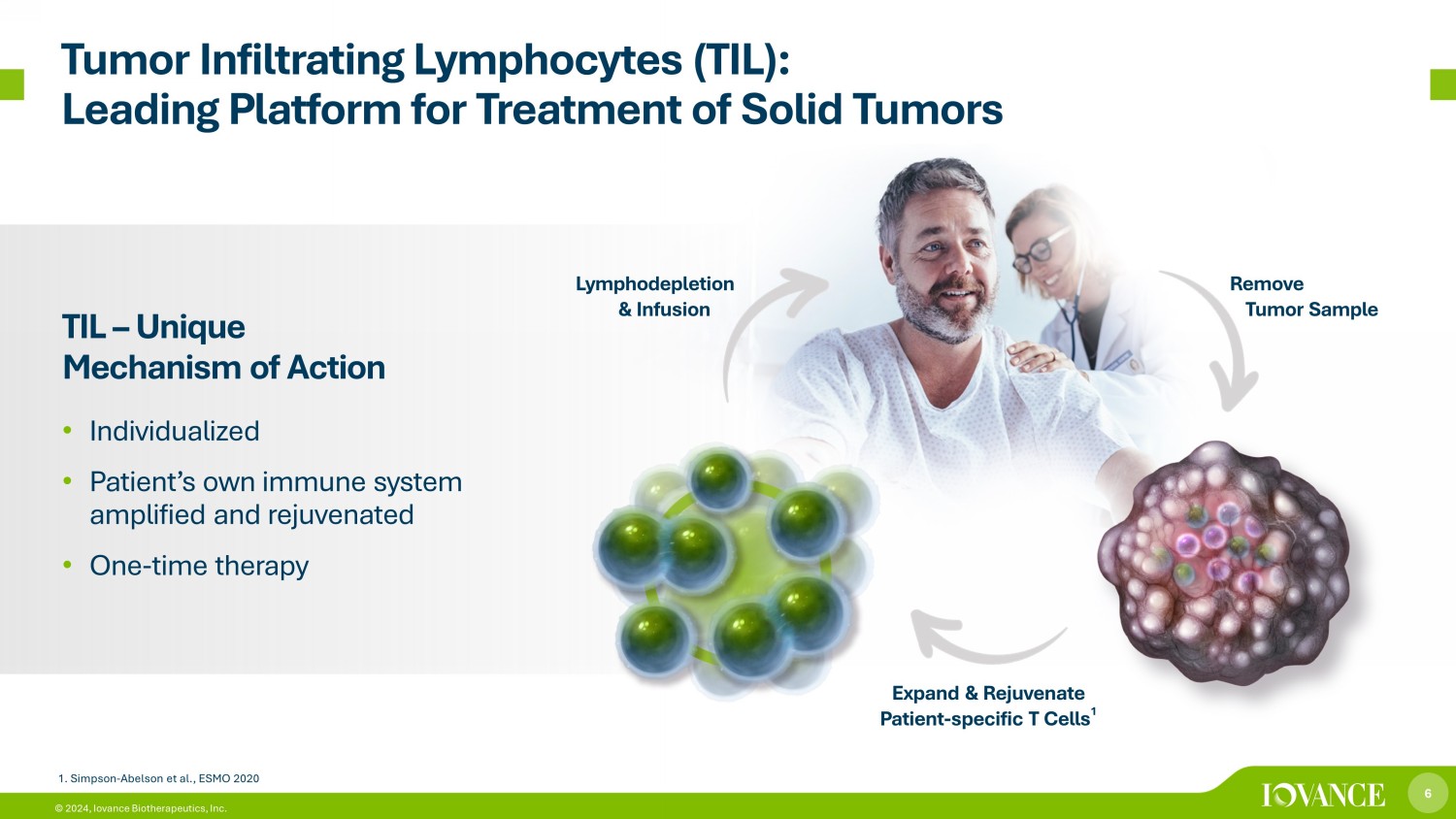
6 © 2024,Iovance Biotherapeutics, Inc. 腫瘤浸潤淋巴細胞 (TIL):實體瘤治療的領先平臺 TIL — 獨特的作用機制 • 個性化 • 患者自身免疫系統增強和恢復活力 • 一次性療法移除腫瘤樣本擴大和恢復活力-特異性 T 細胞 1 淋巴消耗和輸液 1.辛普森-阿伯森等人,ESMO 2020

7 © 2024,Iovance Biotherapeutics, Inc. 腫瘤 TIL 作用機制 TIL 外周血管腫瘤細胞 TIL 腫瘤牀 TIL 溶解腫瘤細胞 T-細胞受體腫瘤新抗原肽 MHC-I/II 趨化因子受體循環遷移肽抗原識別裂解(腫瘤殺死)趨化因子 TIL IFN Granzyme Perforin TIL TIL 療法部署數十億個個體化患者-特異性克隆 TIL 細胞可識別和靶向實體瘤患者中多種非重疊的新抗原溶解腫瘤細胞

8 © 2024,Iovance Biotherapeutics, Inc. 簡化了 22 天 GMP 製造流程 1 2 患者攝入腫瘤樣本採購 3 4 NMA-LD TIL 5 6 IL-2 恢復/出院 4 2 第 2 代流程:22 天 8 © 2024,Iovance Biotherapeutics, Inc.縮寫:GMP= 良好生產規範;IL-2=白介素-2;NMA-LD=mynonnonMynonmonLoalablative 淋巴消耗

9 © 2024,Iovance Biotherapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics Cell Therapeutics, Inc.:i CTC 在費城海軍造船廠建造 136,000 英尺,投資 8,500 萬美元 LEED 金牌認證臨牀供應於 2021 年第 3 季度成功完成 FDA 許可前檢查預計

10 © 2024,Iovance Biotherapeutics, Inc. Iovance Cell Therapeutics, Inc. Iovance Cell Therapeutics, Inc.(i CTC):為數千名癌症患者建設年度能力建設第 1 期 iCTC 今天 100 名患者/年 100 名患者在商用 4 個獨立彈性套件中為臨牀 2 期 iCTC 擴展 1 個 5,000 多名患者/年 24 商用核心套件 4 個獨立彈性套件用於臨牀 4 期 i CTC+ 額外站點 10,000 多名患者/年 i CTC 鄰近和新建站點2 Automation 10 © 2024,Iovance Biotherapeutics, Inc. 1.在現有外殼中擴展 2.可選擇在相鄰地塊上建房
11 © 2024,Iovance Biotherapeutics, Inc. 11 晚期黑色素瘤的 Iovance TIL 療法

12 © 2024,Iovance Biotherapeutics, Inc. 美國轉移性黑色素瘤治療的醫療需求未得到滿足的 ICI(抗 PD-1)療法和 BRAF/MEK 抑制劑 BRAF/MEK 抑制劑 BRAF/MEK 抑制劑 ORR 4-10% 5 MoS ~7-8 個月 6 抗 PD-1 免疫療法 21%-33% ORR 4 可用護理:9.9K 6.3K 4.8K 1L 2L 3L-4L 黑色素瘤藥物——2021 年接受治療的人羣 3 不可切除/轉移(美國)1L 2L+ 縮寫:1L=一線療法,2L=二線療法,3L=三線療法,4L=四線療法;ici=免疫檢查 poi nt 抑制劑;ORR = 客觀反應率;mos = 總存活率中位數;PD-1=編程細胞死亡蛋白-1 15k 美國每年的晚期黑色素瘤新發病例 1 8k 美國每年死亡人數 2 1根據二級和初級市場研究估算的不可切除或轉移性黑色素瘤的美國發病率(2021 年)2.美國國家癌症研究所監測、流行病學和最終結果(SEER)計劃。2023 年估計。https://seer.cancer.gov 已於 2023 年 5 月訪問 3.Clarivate DRG 疾病概況 (2021) 4.Keytruda USPI 5.Keytruda USPI(4%)和韋伯等人,《Lancet Oncol 2015》(ICC 10%)6。Kirchburger 等人,2016 年 Eur J Cancer 和 Goldinger 等人,J Clin Oncol 2018
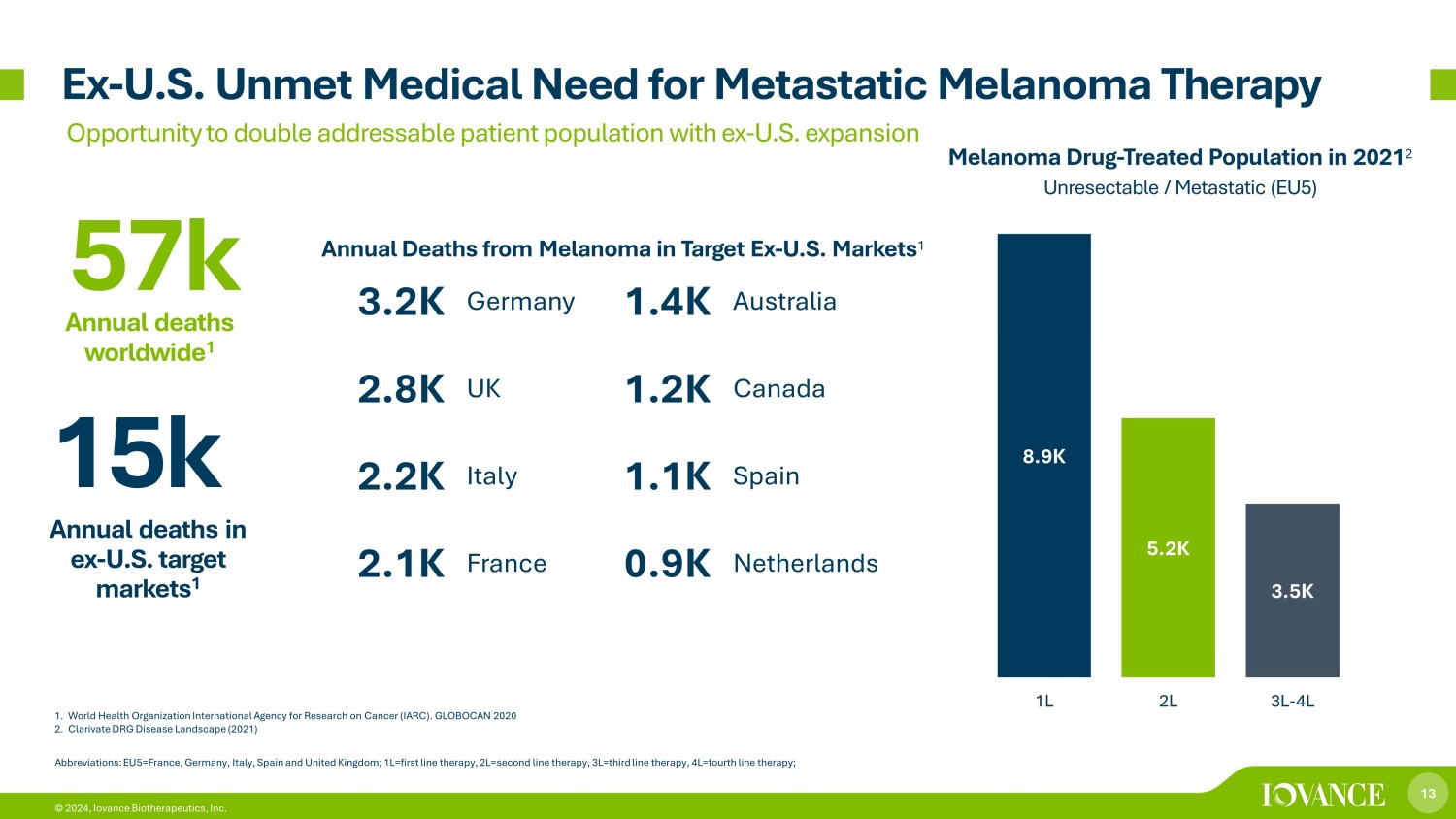
13 © 2024,Iovance Biotherapeutics, Inc. 1.世界衞生組織國際癌症研究機構(IARC)。GLOBOCAN 2020 2.Clarivate DRG 疾病概況(2021 年)例如-美國未滿足的轉移性黑色素瘤治療醫療需求通過擴張將可解決的患者人數增加一倍的機會 8.9K 5.2K 3.5K 1L 2L 3L-4L 黑色素瘤藥物——2021 年接受治療的人羣 2 不可切除/轉移(EU5)縮寫:EU5=法國、德國、意大利、西班牙和英國;1L=第一行療法,2L=二線療法,3L=第三線電子療法,4L=四線療法;前美國目標市場1.5萬人年死亡人數 1 3.2K 德國 1.4K 澳大利亞 2.8K 英國 1.2K 加拿大 2.2K 意大利 1.1K 西班牙 2.1K 英國 1.2K 加拿大 2.1K 意大利 1.1K 西班牙 2.1K法國 0.9K 荷蘭 57k 全球年死亡 1 Target Ex-美國市場每年死於黑色素瘤 1
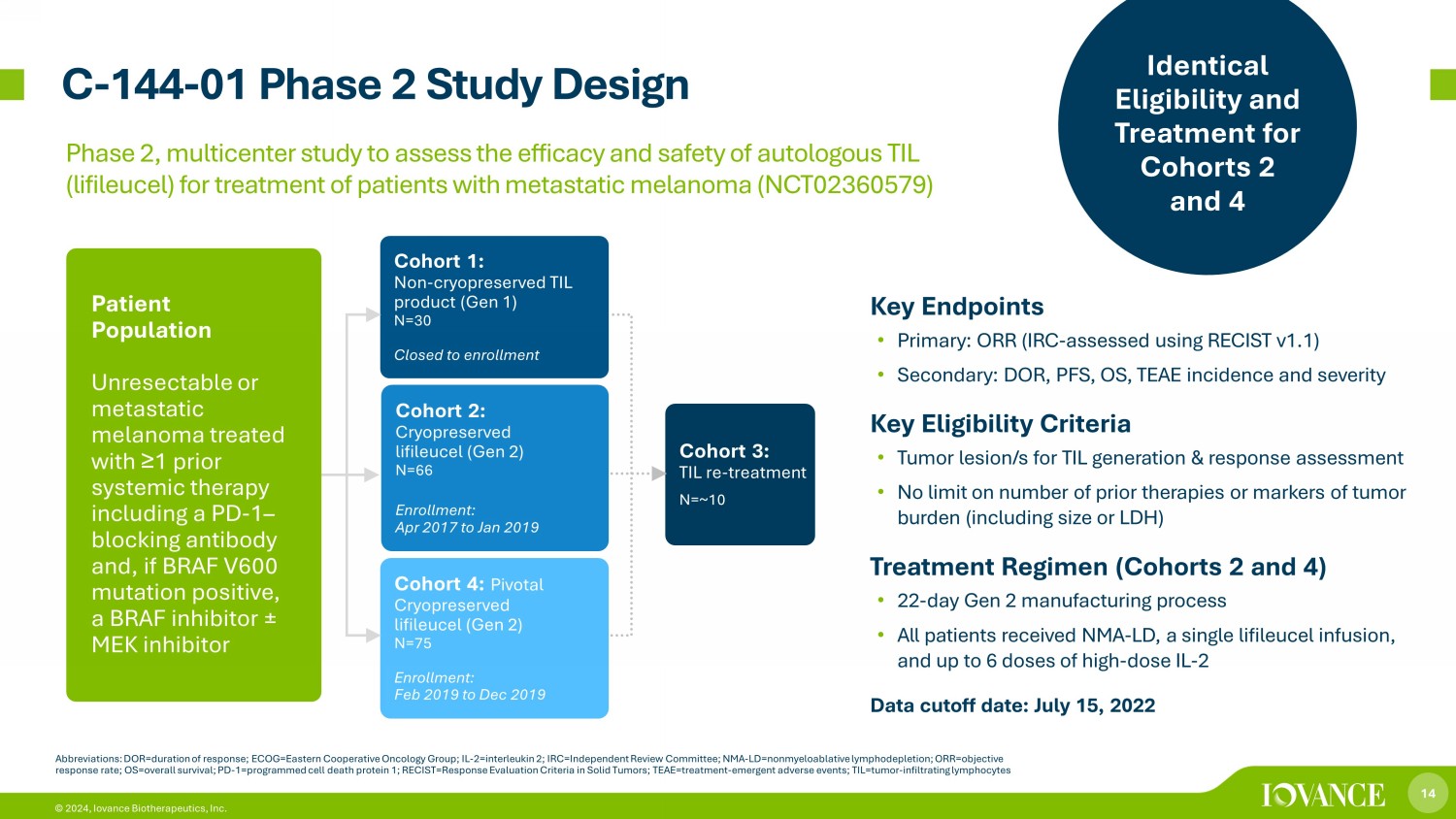
14 © 2024,Iovance Biotherapeutics, Inc. C-144-01 第二階段研究設計縮寫:dor=反應時間;ECOG=東方合作腫瘤學小組;IL-2=白介素2;IRC=獨立審查委員會;NMA-LD= 非骨髓性淋巴消耗;ORR = 客觀反應率;OS = 總存活率;PD-1=編程細胞死亡蛋白 1;recist=實體瘤的反應評估標準;T eae=治療——緊急不良事件;til=腫瘤——浸潤淋巴細胞隊列 1:非冷凍保存的 TIL 產品(第 1 代)N=30 已關閉入組隊列 2:Cryopreservered lifileucel(第 2 代)N=66 入組:2017 年 4 月至 2019 年 1 月隊列 3:TIL 再治療 N=~10 患者羣體接受了 ≥ 1 種全身治療,包括 PD-1 — 阻斷抗體,如果 BRAF V600 突變呈陽性,則使用 BRAF 抑制劑 ± MEK 抑制劑隊列 4:關鍵冷凍保存 lifileucel (Gen) 2) N=75 入組:2019 年 2 月至 2019 年 12 月關鍵終點 • 主要:ORR(IRC-使用 RECIST v1.1 進行評估)• 次要:DOR、PFS、OS、TEAE 發病率和嚴重程度關鍵資格標準 • TIL 的腫瘤病變/s生成和反應評估 • 對先前療法的數量或腫瘤負擔標誌物(包括大小或 LDH)治療方案(第 2 組和第 4 組)不設限制 • 第 2 代製造流程 22 天 • 所有患者都接受了 NMA-LD、單次利弗利賽爾輸液和最多 6 劑高劑量 IL-2 數據截止日期:2022年7月15日第 2 期和第 4 組的相同資格和治療,評估自體 TIL(lifileucel)治療轉移性黑色素瘤患者的療效和安全性的多中心研究(NCT02360579)
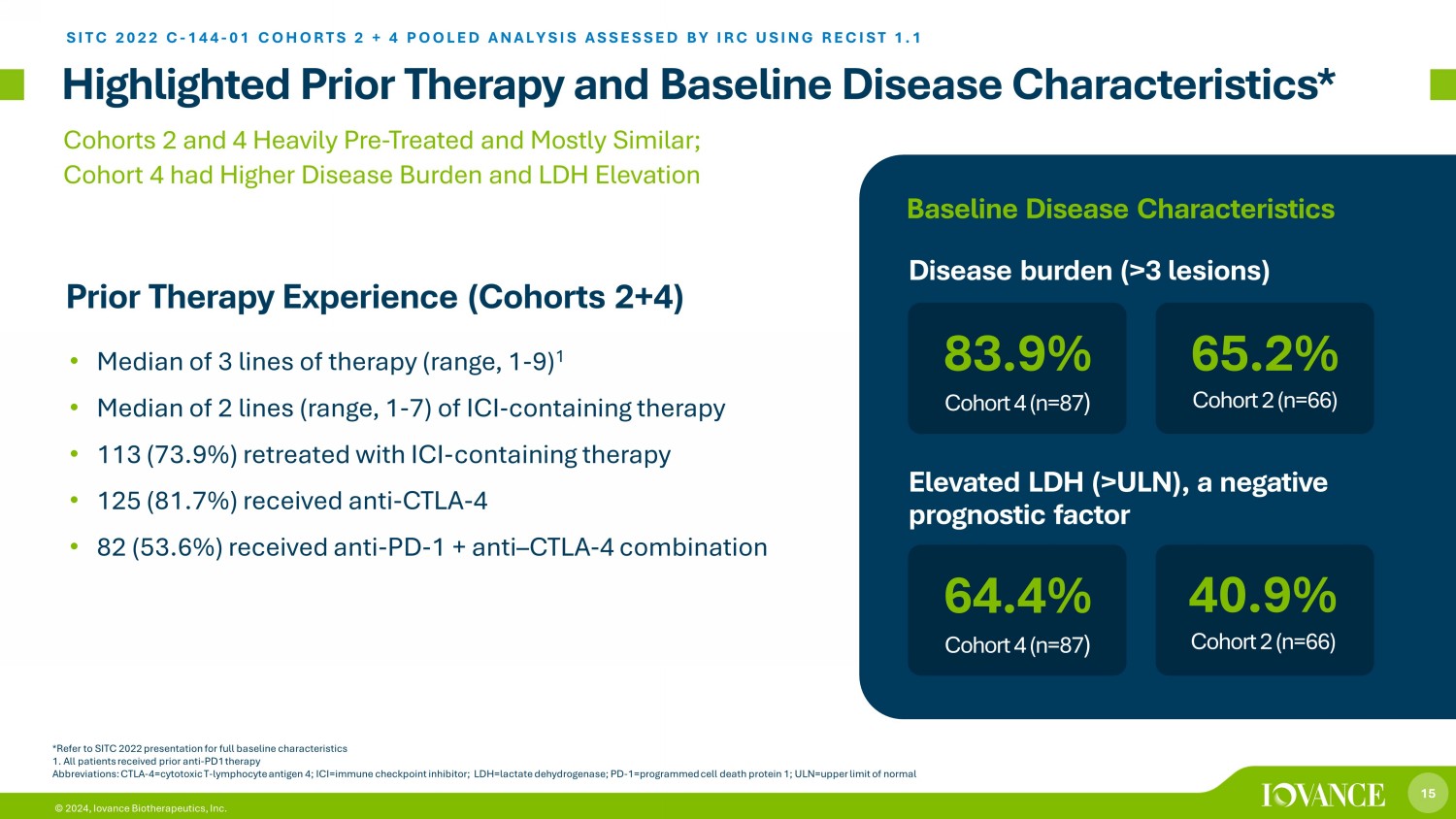
15 © 2024,Iovance Biotherapeutics, Inc. 重點介紹了先前的治療和基線疾病特徵* *有關完整的基線特徵,請參閲SITC 2022的演講 1。所有患者先前接受過抗 PD1 治療縮寫:CTLA-4 = 細胞毒性 T-淋巴細胞抗原 4;ICI = 免疫檢查點抑制劑;LDH = 乳酸脱氫酶;PD-1=progra mmed 細胞死亡蛋白 1;ULN = 正常值上限 • 3 條療法的中位數(範圍,1-7)ICI-含有 ICI 的療法 • 113(73.9%)使用 ICI 含療法撤退 • 125(81.7%)接受了抗 CTLA-4 • 82(53.6%)接受了抗 PD-1 + 抗 — CTLA-4 組合 2 和 4 嚴重預處理且基本相似;隊列 4有較高的疾病負擔和 LDH 升高的先前治療經歷(隊列 2+4)SITC 2022 C-144-01 隊列 2 + 4 彙總分析 IRC 使用 RECIST 進行評估 1.1 64.4% 隊列 4 (n=87) 疾病負擔 (>3 個病變) 40.9% 隊列 2 (n=66) 83.9% 隊列 4 (n=87) 65.2% 隊列 2 (n=66) 65.2% 隊列 2 (n=66)) LDH 升高 (>ULN),一種不利的預後因素基線疾病特徵

16 © 2024,Iovance Biotherapeutics, Inc. 在 ≥ 30% 的患者中使用安全性非血液學 TEAE *,† *根據CTCAE v4.03;安全性分析集(N = 156)。† 5 級 TEAE 包括肺炎(n=1)、急性呼吸衰竭(n=1)、心律失常(n=1)和腹內出血(n=1)。如果患者在不同的時間點出現同一 AE 的新發作,則計算所有出現 AE 的次數。如果由於同一 AE 的毒性等級下降而在電子病例報告表上報告了多個記錄病例,則對該事件進行一次統計,報告了最高等級。第 12 個月之後報告了 15 個事件(1 級,n = 7;2 級,n=6;3 級,n=1;等級 5,n=1)縮寫:AE=不良事件;d=日;IL-2=interleukleuks 2 內;M,月;NMA-LD = 非骨髓性淋巴消耗;TEAE = 治療-em 緊急不良事件 • 6 IL 的中位數-給藥 2 劑 • 所有患者經歷 ≥ 1 次 TEAE(任何等級);94.9% 的患者經歷 ≥ 1 次3/4 級 TEAE • TEAE 與 NMA-LD 和 IL-2 的已知安全特徵一致,與先前的報告一致 • TEAE 的發病率在利弗利賽爾輸液後的前 2 周內迅速下降首選期限,n (%) 任何 3/4 級寒戰 117 (75.0) 8 (5.1) Pyrexia 81 (51.9) 17 (10.9) 發熱性中性粒細胞減少症 65 (41.7) 65 (41.7) 低磷血癥 58 (37.2) 41 (26.3) 低血壓 52 (33.3) 17 (10.9) 疲勞 51 (32.7) 6 (3.8) 腹瀉 48 (30.8) 2 (1.3) 首選術語,n (%) 3/4 級白細胞減少症 156 (100.0) 淋巴細胞減少 156 (100.0) 中性粒細胞減少 156 (100).0) 血小板減少症 147 (94.2) 貧血 111 (71.2) 3/4 級血液學實驗室異常* *UDGH SITC 2022 C-144-01 COHORTS 2 + 4 彙總分析由 IRC 使用 RECIST 1.1 進行評估 AE 的短暫性和可控性質支持使用 Lifileucel 一次性治療的潛在益處

17 © 2024,Iovance Biotherapeutics, Inc.的客觀反應率(ORR)為 31.4% SITC 2022 C-144-01 COHORTS 2 + 4 彙總分析 IRC 使用 RECIST 進行評估 1.1 評估的 ORR *患者目標病變不可接受,非 CR/NON-PD 的總體反應最佳 6 名患者 † 無法對反應進行評估(5 是由於過早死亡;1 是由於新的抗癌療法)縮寫:CR,=完全迴應;IRC=獨立審查委員會;ORR = 客觀迴應率;PD=進行性疾病;PR= 部分反應;sd=穩定疾病隊列 2 (n=66) 隊列 4 (n=87) 隊列 2+4 (n=153) ORR,n (%) 23 (34.8) 25 (28.7) 48 (31.4) (95% 置信區間) (23.5, 47.6) (19.5, 39.4) (24.1, 39.4) 最佳總體反應,n (%) CR 5 (7.6) 4 (4.6) 9 (5.9) PR 18 (27.3) 21 (24.1) 39 (25.5) SD 24 (36.4) 47 (54.0) 71 (46.4) 非 CR/非 PD* 1 (1.5) 0 1 (0.7) PD 15 (22.7) 12 (13.8) 27 (17.6) 不可評估 3 (4.5) 3 (3.4) 6 (3.9)) • 從切除到 lifileucel 輸液的平均時間 33 天 • 94.7% 的患者按規格生產 Lifileucel • 中位數注入的 TIL 細胞數量為 21.1 × 10 9(範圍,1.2 × 10 9 到 99.5 × 10 9)
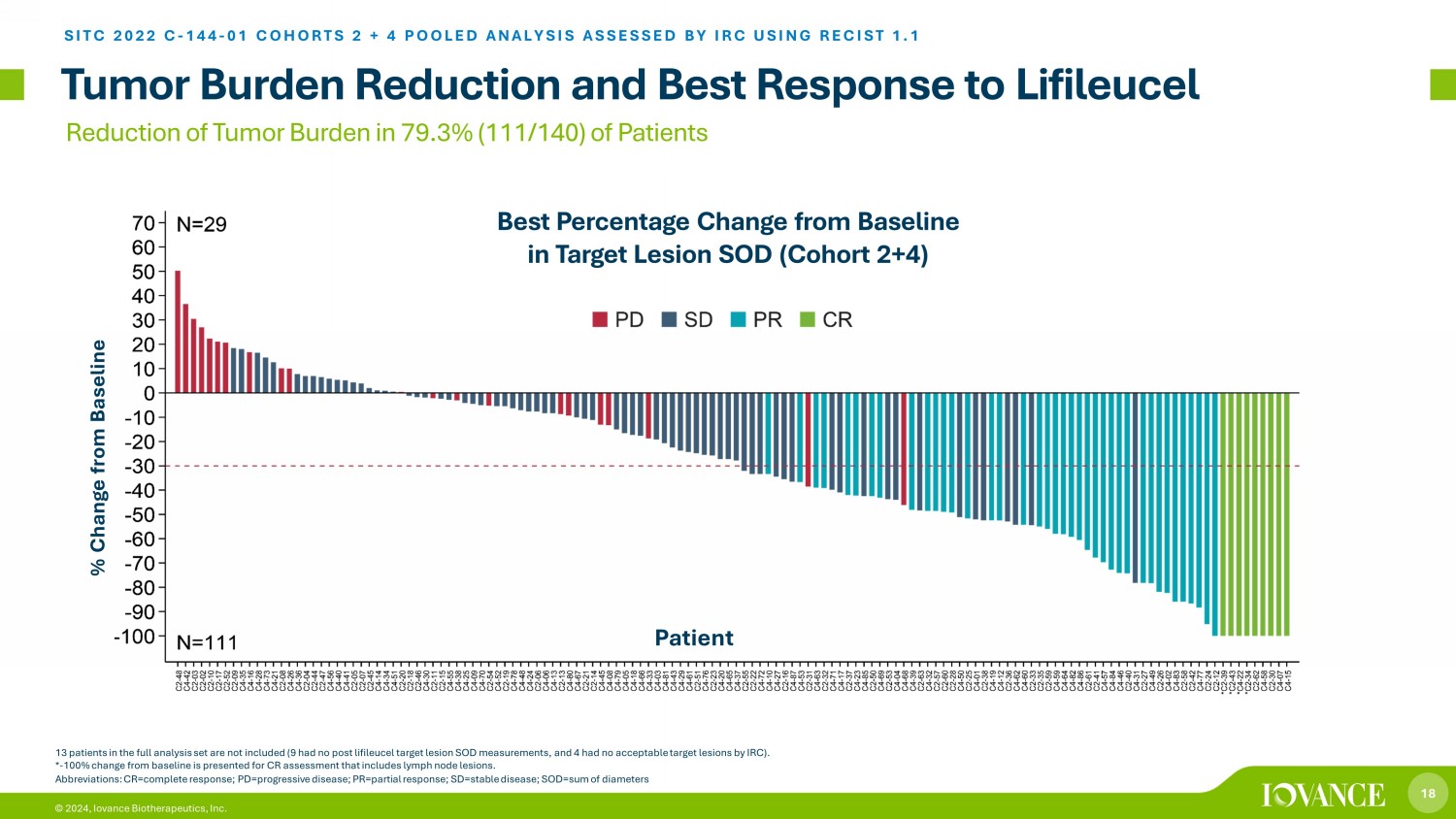
18 © 2024,Iovance Biotherapeutics, Inc. 腫瘤負擔減輕和對Lifileucel的最佳反應 SITC 2022 C-144-01 COHORTS 2 + 4 彙總分析 IRC 使用 RECIST 1.1 評估了完整分析集合中的 13 名患者(9 名患者沒有接受過利弗萊採後靶區病變測量,4 名患者沒有 IRC 的 acc ep 表目標病變)。*-與 100% 相比變化為包括淋巴結病變在內的 CR 評估提供了基線。目標病變 SOD(隊列 2+4)與基線相比的最佳百分比變化 79.3%(111/140)患者腫瘤負擔縮寫:CR=完全反應;pd=進展性疾病;pr=部分反應;sd=穩定疾病;SOD=直徑總和與基線患者相比變化百分比
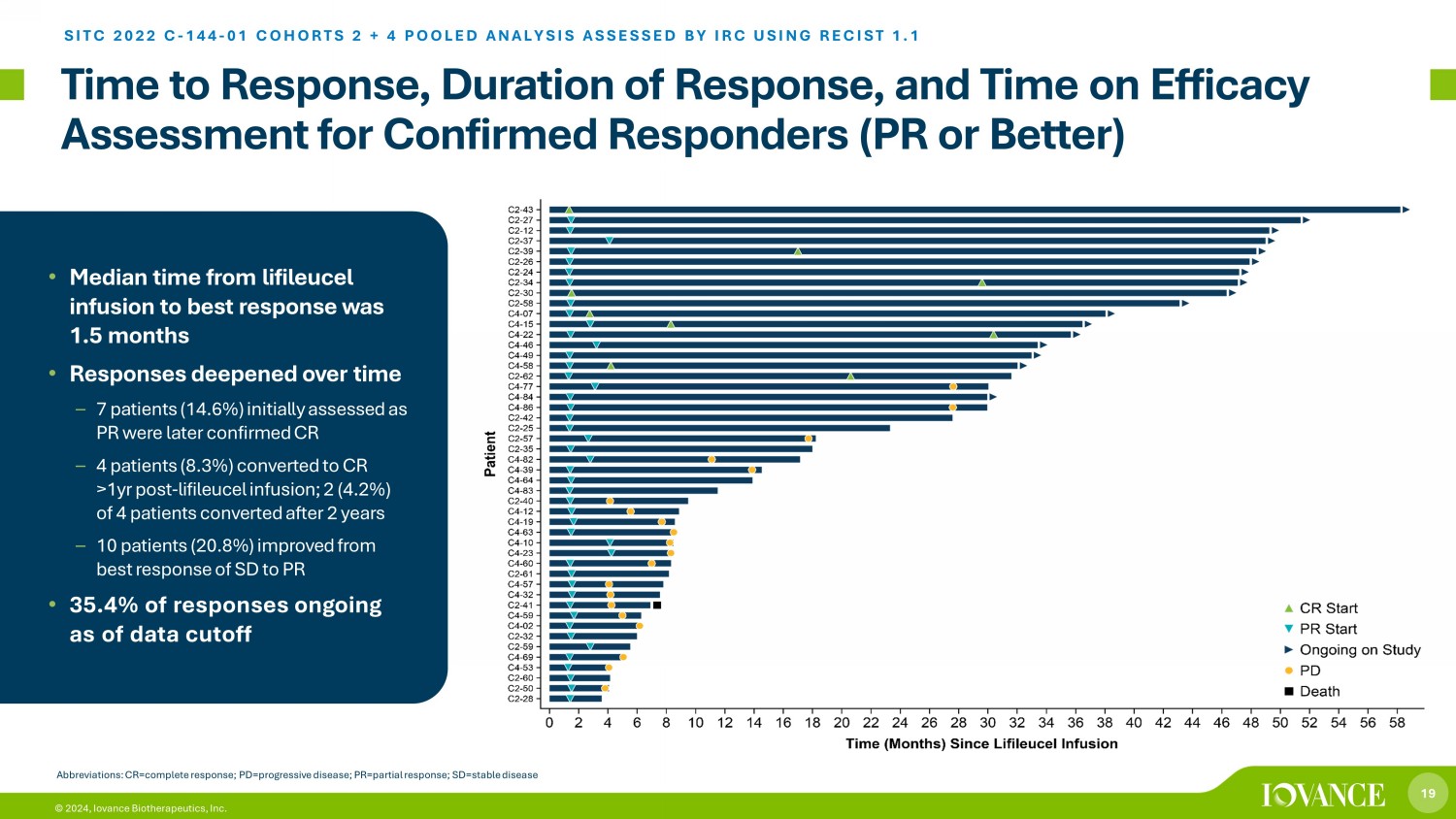
19 © 2024,Iovance Biotherapeutics, Inc. 對確診的應答者(PR 或更好)的反應時間、反應時間和療效評估時間 SITC 2022 C-144-01 COHORTS 2 + 4 彙總分析由 IRC 使用 RECIST 1.1 進行評估 • 從利弗賽爾輸液到最佳反應的平均時間為1.5個月 • 反應隨着時間的推移而加深——7名患者(14.6%)最初被評估為公關者(14.6%)CR — 4 名患者(8.3%)在 lifileucel 輸液 1 年後轉化為 CR;4 名患者中 2 名(4.2%)在 2 年後轉換 — 10 名患者(20.8%)較最佳水平有所改善SD 對 PR 的反應 • 35.4% 的答覆截至數據截止日期仍在進行縮寫:CR=完全響應;pd=進行性疾病;pr=部分反應;sd=穩定疾病
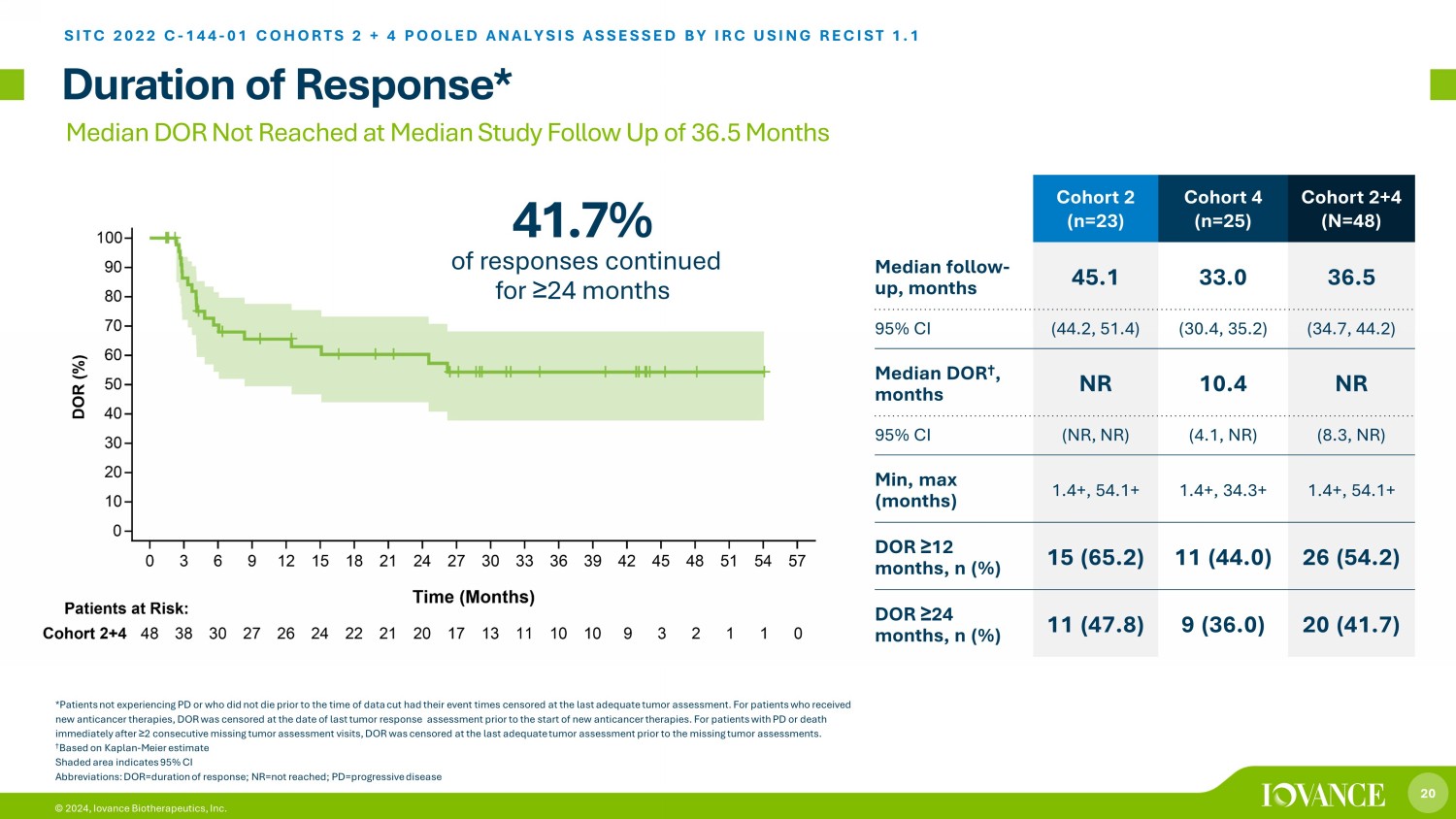
20 © 2024,Iovance Biotherapeutics, Inc. 隊列 2 (n=23) 隊列 4 (n=25) 隊列 2+4 (N=48) 隨訪中位數,45.1 33.0 36.5 95% 置信區間 (44.2、51.4) (30.4、35.2) (34.7、44.2) 中位數 DOR †,月份 NR 10.4 NR 95% 置信區間(NR,NR)(30.4、35.2) 中位數 4.1、NR) (8.3, NR) 最小、最大(月)1.4+、54.1+ 1.4+、34.3+ 1.4+、54.1+ ≥ 12 個月,n (%) 15 (65.2) 11 (44.0) 26 (54.2) ≥ 24 個月,n (%) 11 (47.8) 9 (36.0) 20 (41.7) 響應時間* SITC 2022 C-144-01 COHORTS 2 + 4 彙總分析,由 IRC 使用 RECIST 1.1 進行評估 *未患有 PD 或之前未死亡的患者直到截取數據時,他們的活動時間都經過審查,直到最後一次進行腫瘤評估。對於接受新抗癌療法的患者,在新的抗癌療法開始之前的最後一次腫瘤反應評估之日對DOR進行了審查。對於 PD 患者或在連續 ≥ 2 次缺失腫瘤評估就診後立即死亡的患者,在缺失腫瘤評估前的最後一次充分腫瘤評估中對 DOR 進行了審查。† 根據卡普蘭——邁爾估計,陰影區域表示 95% 置信區間縮寫:dor=反應持續時間;nr=未達到;pd=進行性疾病中位數 DOR 在研究隨訪中位數 36.5 個月時未達到 41.7% 的反應持續了 ≥ 24 個月
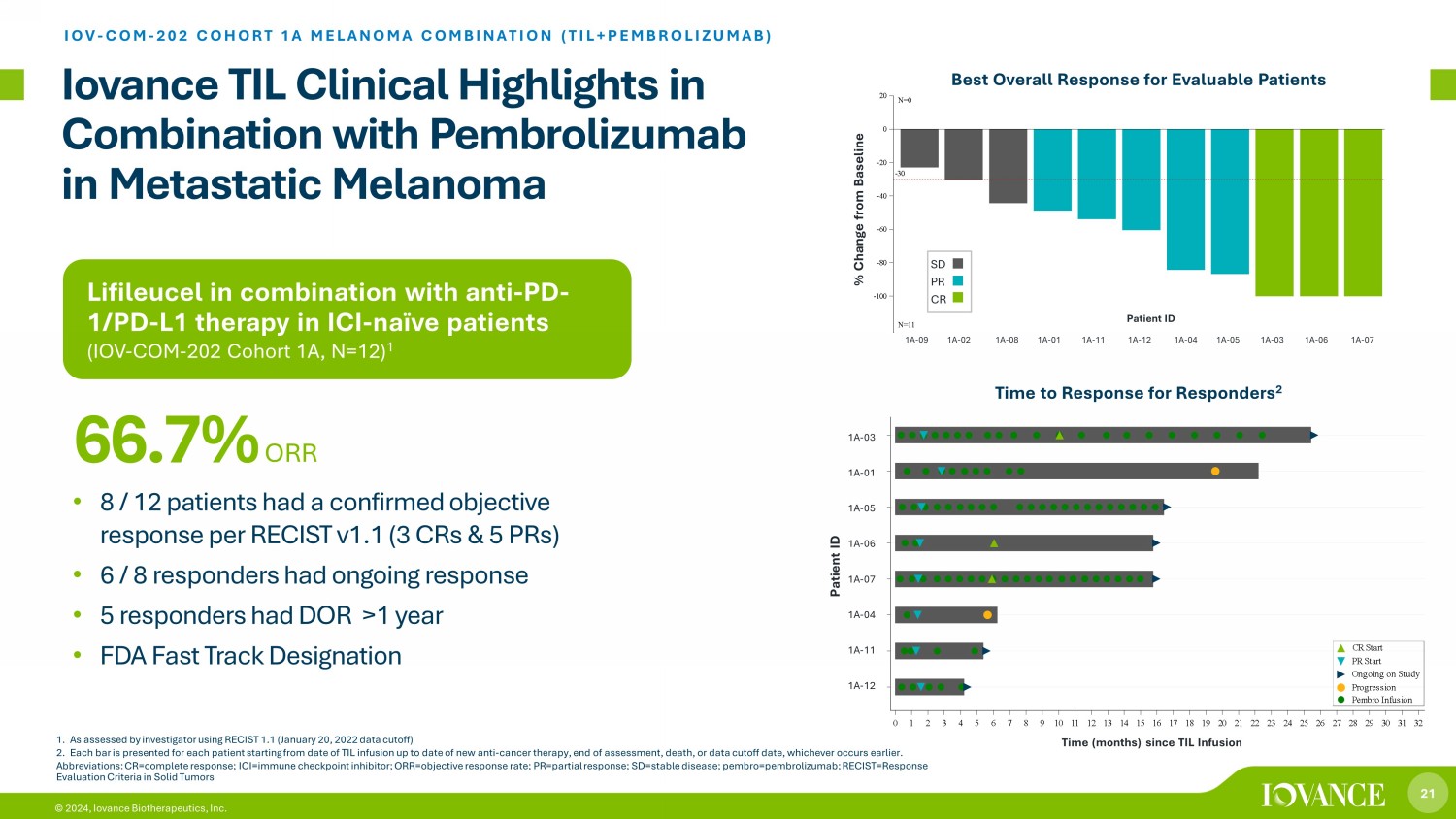
21 © 2024,Iovance Biotherapeutics, Inc. Lifileucel 與 ICI 天真患者的抗 PD-1/PD-L1 療法(IOV-COM-202 隊列 1A,N=12)1 Iovance TIL 與派姆羅利珠單抗聯合治療轉移性黑色素瘤的臨牀亮點 IOV-COM-202 隊列 1A 黑色素瘤組合(TIL+PEMBROLIZUMAB)ZUMAB) • 根據 RECIST v1.1(3 個 CR 和 5 個 PR),8/12 名患者的客觀反應已得到確認 • 6/8 名受訪者的反應持續不斷 • 5 名受訪者的 DOR 大於 1 年 • FDA 快速通道認證 66.7% ORR 1。根據調查人員使用RECIST 1.1(2022年1月20日數據截止日期)評估的結果2。從TIL輸液之日起至新的抗癌療法的最新日期、評估結束、死亡或數據截止日期(以較早者為準),為每位患者提供每個條形圖。縮寫:cr=完全反應;ICI=免疫檢查點抑制劑;ORR = 客觀反應率;pr=部分反應;sd=st abl e 疾病;pembro=pembrolizumab;recist=實體瘤反應評估標準 TIL 輸液以來的時間(月)1A-12 1A-04 1A-06 1A-05 1A-01 1A-03 S u b j e c t s 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 自 TIL 輸液以來的時間(月)Pembro 輸液進展正在進行中 PR 開始 CR 開始時間(月)自 TIL 輸液 1A-03 1A-01 1A-05 1A-05 1A-06 1A-06 1A-06 1A-071A-04 1A-11 1A-11 1A-04 1A-03 1A-06 1A-04 1A-09 1A-08 1A-08 1A-01 1A-01 1A-01 1A-12 1A-04 1A-05 1A-05 1A-03 1A-06 1A-07 1A-07 -100 -80 -40 -20% C h a n g e f r o m b a s e l i n e n=0 N=11 隊列 1A 與基線 SD PR CR 1A-09 1A-02 1A-08 1A-01 1A-11 1A-12 1A-04 1A-04 1A-05 1A-03 1A-03 1A-06 1A-07 患者 ID 可評估患者的最佳總體反應

22 © 2024,Iovance Biotherapeutics, Inc. 1:1 隨機分配 TILVANCE-301 全球三期和一線晚期黑色素瘤中的確認性試驗 LIFILEUCEL + PEMBROLIZUMAB 縮寫:BIRC,盲人獨立審查委員會;ORR = 客觀反應率;pd=進行性疾病;PD-1,程序 d 細胞死亡蛋白-1;pfs=無進展生存組 A:lieufileufile cel plus pembrolizumab 長期隨訪患者羣體不可切除或轉移性黑色素瘤;之前沒有治療過轉移性疾病 N=670 Arm B:單獨使用 pembrolizumab 與 FDA 合作的研究設計協議 • 雙重主要終點:ORR 和 PFS • 一線黑色素瘤註冊 • 證實抗PD-1 黑色素瘤獲得全面批准後 • 首位患者在 BIRC 之後隨機分配 2Q23 交叉選擇 lifileucel-PD 已確診的隨機多中心研究,可選擇交叉治療,為所有患者提供可能接受 Iifileucel (NCT05727904) 的治療

23 © 2024,Iovance Biotherapeutics, Inc. Proleukin® 交易的戰略利益 • Proleukin®(aldesleukin,人體重組 IL-2)的全球版權及相關收入 • 為lifileucel方案提供安全的IL-2供應鏈 • 降低臨牀試驗成本和未來的COGS • TIL商業化預計將獲得可觀的額外收入 1.677億英鎊的預付投資由現有現金關鍵數字融資 4170 萬在首次獲得 lifileucel 批准後,收購於 2023 年 5 月 18 日完成
24 © 2024,Iovance Biotherapeutics, Inc. 24 非小細胞肺癌的 Iovance TIL 療法

25 © 2024,Iovance Biotherapeutics, Inc. 1.美國國家癌症研究所監測、流行病學和最終結果(SEER)計劃。2023 年估計。https://seer.cancer.gov acc acc 2023 年 5 月 2.美國癌症協會,肺癌。https://www.cancer.org/cancer/types/lung-cancer/about.html 已於 2023 年 7 月訪問 3.國家癌症數據庫,評估了超過100萬名患者的非小細胞肺癌存活率。Lou Y 等人十年來非小細胞肺癌患者的存活趨勢:學術中心初始治療的影響。癌症醫學。2018. 4.Clarivate DRG 疾病概況(2021)縮寫:EU5=法國、德國、意大利、西班牙和英國;1L=一線療法,2L=二線療法,3L=三線e療法,4L=四線療法;mos=晚期非小細胞肺癌(NSCLC)總體存活率中位數潛在市場解決轉移性非小細胞肺癌Iovance TIL臨牀項目中未得到滿足的大量需求:• 3項試驗的6個隊列•多種治療方案•不同的人羣和疾病階段美國的年死亡人數美國每年死亡人數為12.7萬人 1 10.7萬 5.16K 19.0K 11.6K 11.6K 46.2K 12.3K 1L 2L 3L 美國 EU5 非小細胞肺癌藥物——2022年接受治療的人羣第四階段(美國和歐盟 5)4 美國癌症死亡的主要原因,約佔五分之一的癌症相關死亡 2 9% 5 年存活率 2 和真實世界總存活率

26 © 2024,Iovance Biotherapeutics, Inc. IOV-LUN-202 試驗設計對抗 PD 1 NSCLC 後患者 LN-145 † 的二期多中心研究 (NCT04614103) * 終點 • 主要:IRC 的 ORR • 次要:安全性* 美國食品藥品管理局於 2023 年 12 月 22 日對IOV-LUN-202試驗進行了臨牀擱置。新患者的註冊已暫停。之前接受過治療的患者將繼續接受監測和跟蹤。已經接受腫瘤切除術的患者將繼續接受 LN-145 TIL 治療方案,並採取額外的預防措施和風險緩解措施... † 第 2 代 TIL 產品 † 第 3 代隊列患者無法接受手術採集,TIL 從核心活檢中生長出來。縮寫:Anti-PD-1,抗程序性細胞死亡抑制劑;IRC,獨立審查委員會;NSCLC,非小細胞肺癌;ORR,客觀反應率; TPS,腫瘤比例分數 Iovance TIL Therapy LN-145 在 NSCLC IOV-LUN-202 中旨在招收晚期患者非小細胞肺癌的醫療需求大量未得到滿足,但在抗 PD-1 治療後先前的治療線路有限。患者羣體不可切除或轉移性非小細胞肺癌,在先前的抗 PD-1 治療和化療期間或之後有進展,約有 40 個部位並且在美國、加拿大、歐洲正在擴大。隊列 1: 的非小細胞肺癌患者
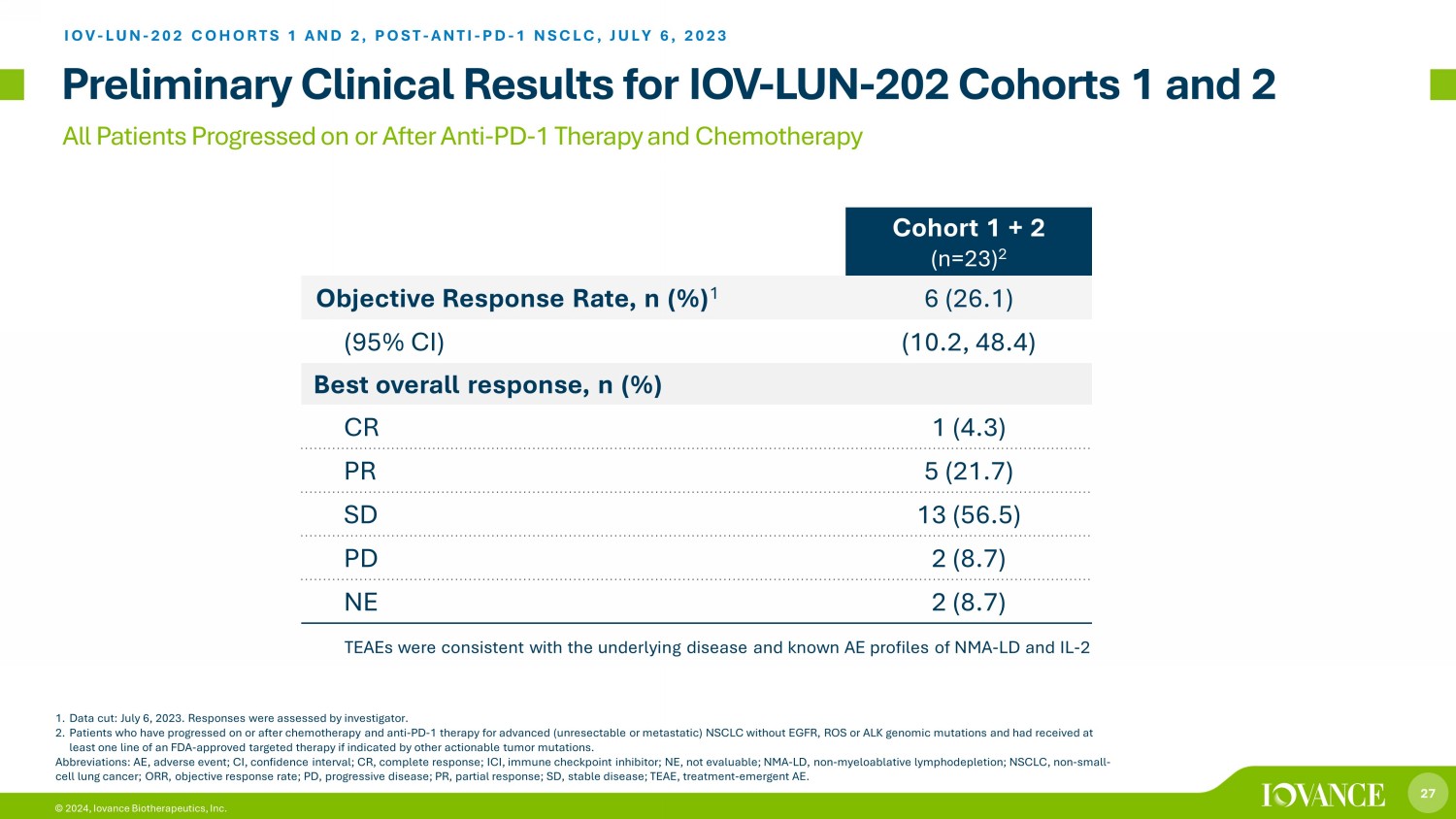
27 © 2024,Iovance Biotherapeutics, Inc. 所有患者在抗PD-1治療和化療後均取得進展 IOV-LUN-202 隊列 1 和 2 的初步臨牀結果 1。數據削減:2023年7月6日。調查人員對答覆進行了評估。2.在沒有表皮生長因子、活性氧或ALK基因組突變的晚期(不可切除或轉移的)非小細胞肺癌的化療和抗PD-1治療後出現進展的患者,如果有其他可操作的腫瘤突變指示,則接受過至少一個FDA批准的靶向療法的患者。縮寫:AE,不良事件;CI,置信區間;CR,完全反應;ICI,免疫檢查點抑制劑;NE,不可用;NMA-LD,非骨髓性淋巴消耗;NSCLC,非小細胞肺癌;ORR,客觀反應率;PD,進行性疾病;PR,部分反應;SD,穩定疾病;TEAE,治療時間非急性腦炎。Iovance TIL Therapy LN-145 在 NSCLC 隊列 1 + 2 (n=23) 2 中客觀反應率,n (%) 1 6 (26.1) (95% CI) (10.2, 48.4) 最佳總體反應,n (%) CR 1 (4.3) PR 5 (21.7) SD 13 (56.5) PD 2 (8.7) NE 2 (8.7) IOV-LUN-202 COHORTS 1 而且 2,POST-ANTI-PD-1 NSCLC,2023 年 7 月 6 日 TEAE 與 NMA-LD 和 IL 的潛在疾病和已知 AE 概況一致-2
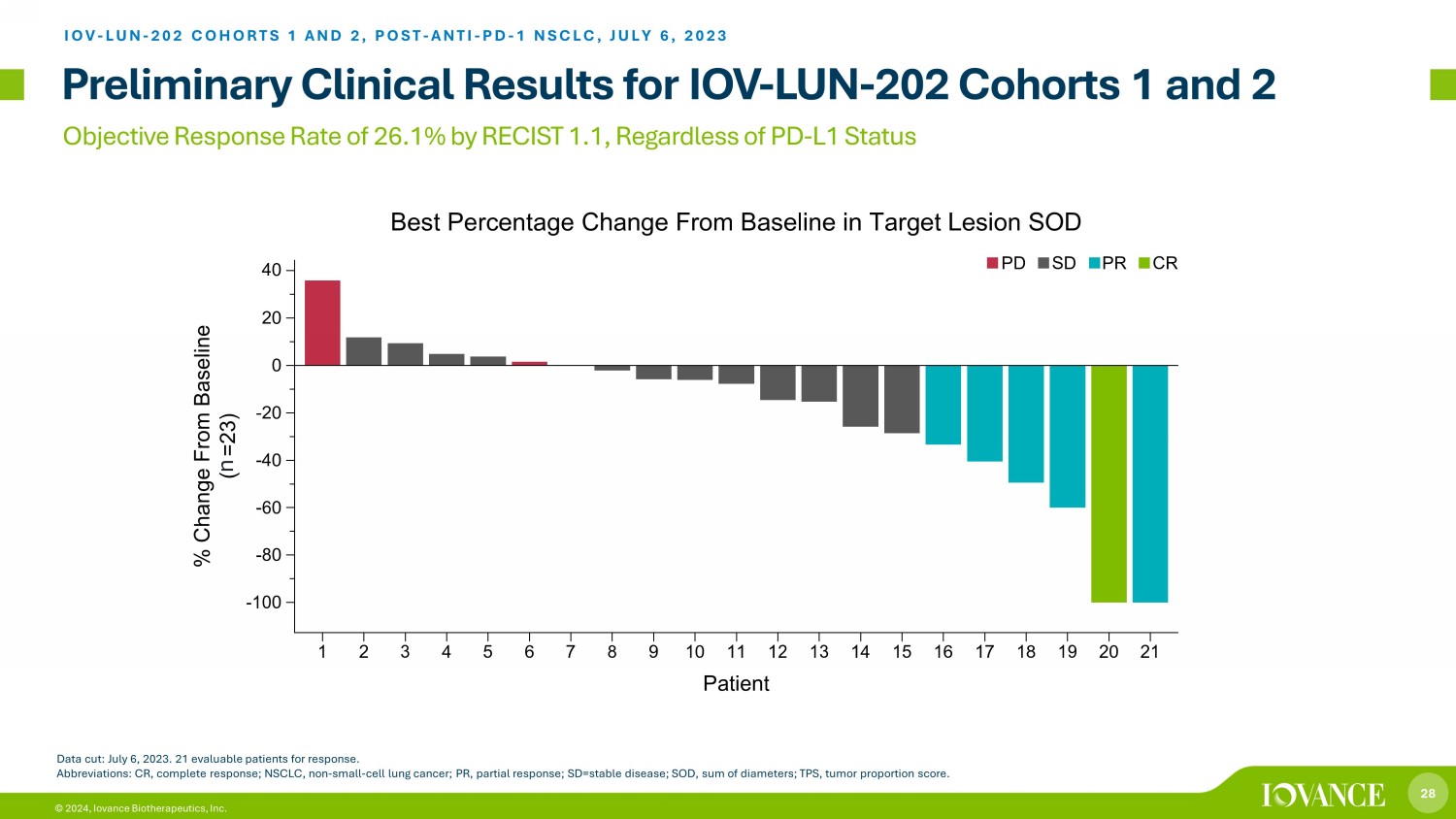
28 © 2024,根據RECIST 1.1,Iovance Biotherapeutics, Inc.的目標回覆率為26.1%,無論PD-L1狀態如何,IOV-LUN-202隊列1和2 IOV-LUN-202隊列1和2,POST-ANTI-PD-1 NSCLC的初步臨牀結果,2023年7月6日截止日期:2023年7月6日。21名可評估患者的反應。縮寫:CR,完全反應;NSCLC,非小細胞肺癌;PR,部分反應;SD = 穩定疾病;SOD,二米總和;TPS,腫瘤比例分數。n
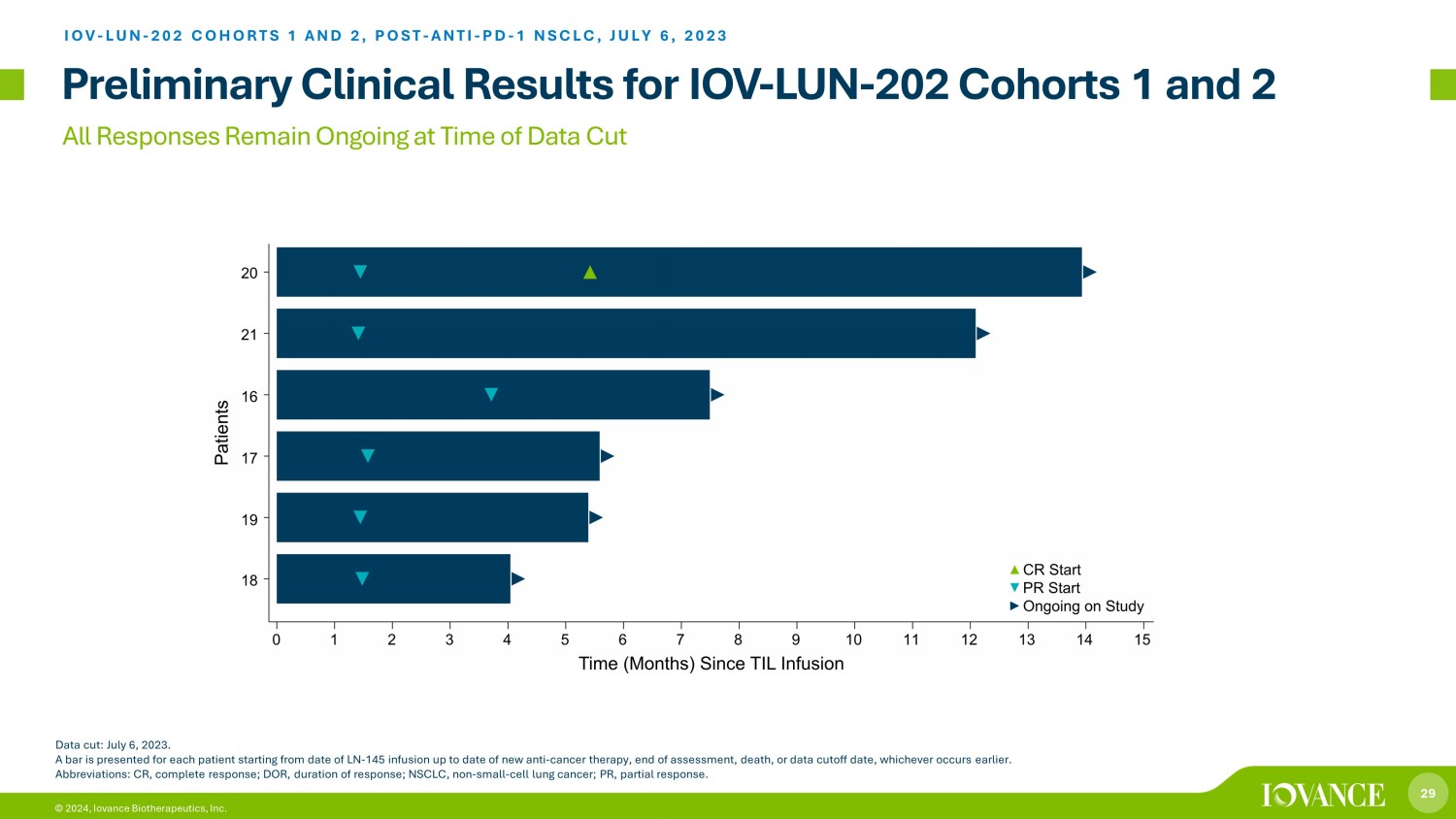
29 © 2024,Iovance Biotherapeutics, Inc. 截止數據時:2023年7月6日,所有回覆仍在進行中。從注射LN-145之日起,到新的抗癌療法的最新日期、評估結束、死亡或數據截止日期,以較早者為準,為每位患者提供一個條形圖。縮寫:CR,完全反應;DOR,反應持續時間;NSCLC,非小細胞肺癌;PR,部分反應。IOV-LUN-202 隊列 1 和 2,POST-ANTI-PD-1 NSCLC,2023 年 7 月 6 日 IOV-LUN-202 隊列 1 和 2 的初步臨牀結果

30 © 2024,Iovance Biotherapeutics, Inc. ICI 中的 TIL 概念驗證——無論病情如何,均為天真非小細胞肺癌——L1 狀態隊列 3A 摘要 IOV-COM-202 隊列 3A 非小細胞肺癌組合(TIL+PEMBROLIZUMAB),WCLC 口頭報告(2023 年 6 月 26 日數據截圖)隊列 3A 結果支持將 TIL 療法添加到前線 Pembrolizumab Zumab + 化療組合方案隨訪 18.2 個月時的臨牀活性 1 • ICI 初生亞組和 TPS 評分的活性 • 表皮生長因子 WT 病非小細胞肺癌患者的 58.3% (7/12) ORR 和 3 種持續反應 • 安全性與Iovance TIL 聯合研究 • 支持針對一線表皮生長因子 WT 病患者的註冊試驗設計篩查 Pembrolizumab 給藥(單劑量)NMA-LD Cy/Flu Lifileucel/LN-145 輸液 IL-2 ≤6 劑量 Pembrolizumab Q3W 或 Q6W 療效隨訪入組/手術切除評估期:第 0 天至 EOA GMP 製造 EOA 新療法的進展 EOS EOT 長期隨訪 1.舍恩菲爾德等WCLC 2023 縮寫:cy/flu、阿糖胞苷/氟達拉濱;EGFR,表皮生長因子受體;ICI,免疫檢查點抑制劑;IL-2,白介素-2;NMA-LD,非骨髓消融性淋巴消耗;TPS,腫瘤比例評分;WT,野生型
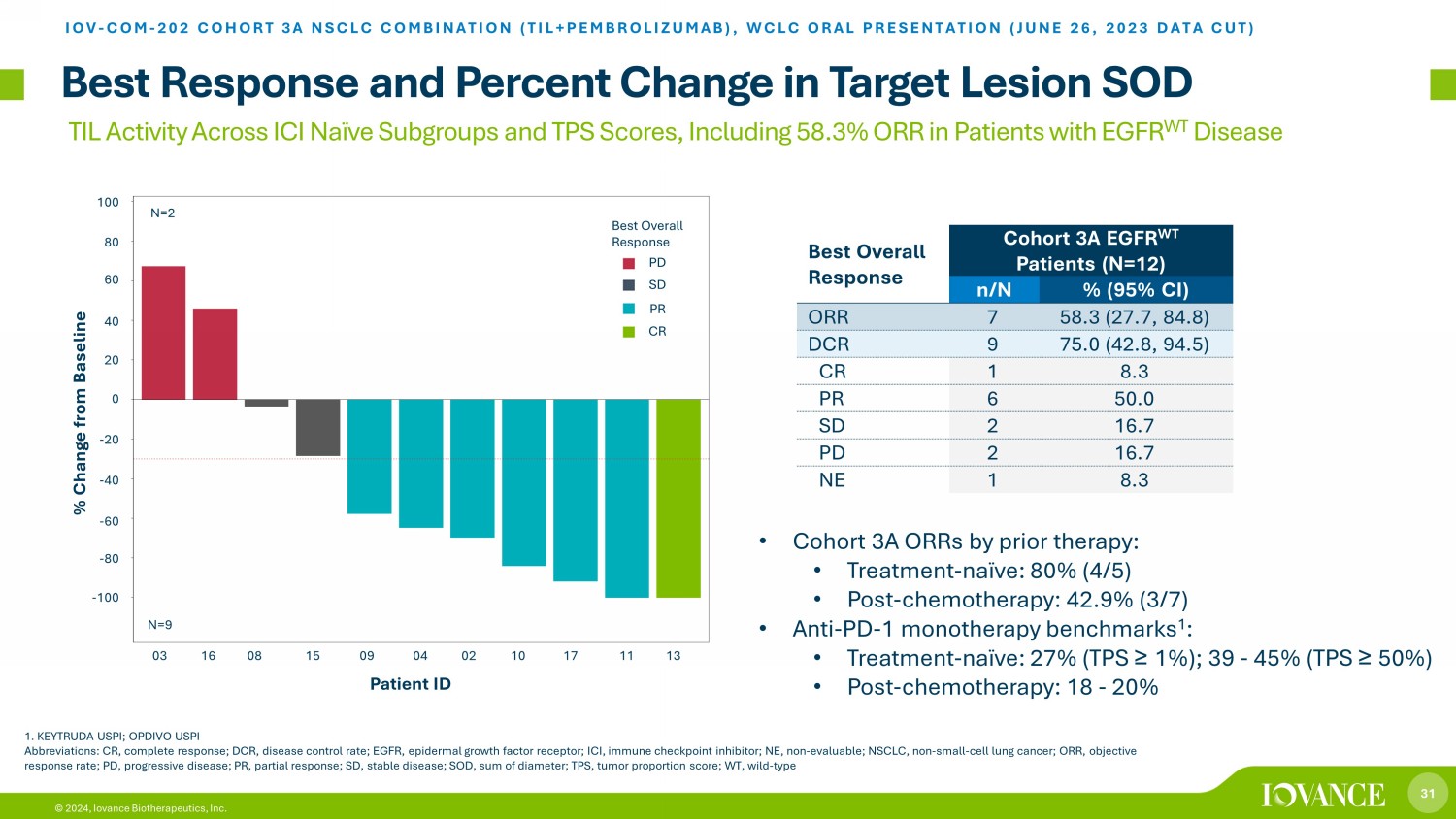
31 © 2024,Iovance Biotherapeutics, Inc. ICI Naieve 亞組的 TIL 活性和 TPS 分數,包括 EGFR WT 病最佳反應患者的 58.3% ORR 和靶損變動百分比 SOD IOV-COM-202 隊列 3A 非小細胞肺癌組合(TIL+PEMBROLIZUMAB),WCLC口頭報告(2023年6月26日數據截圖)1。KEYTRUDA USPI;OPDIVO USPI 縮寫:CR,完全反應;DCR,疾病控制率;EGFR,表皮生長因子受體;ICI,免疫檢查點抑制劑;NSCLC,非小細胞肺癌;ORR,客觀反應率;PD,進行性疾病;PR,穩定疾病;SOD,直徑總和;PS,腫瘤比例 sc ore;WT,野生型最佳總體反應隊列 3A 表皮生長因子 WT 患者(N=12)n/n%(95% 置信區間)ORR 7 58.3(27.7,84.8)DCR 9 75.0(42.8,94.5)CR 1 8.3 PR 6 50.0 SD 2 16.7 PD 2 16.7 NE 1 8.3 • 隊列 3A 75.0(42.8,94.5)CR 1 8.3 PR 6 50.0 SD 2 16.7 PD 2 16.7 NE 1 8.3 • 隊列 3A先前治療的ORR:• 治療——天真:80%(4/5)• 化療後:42.9%(3/7)• 抗 PD-1 單一療法基準 1:• 治療-天真:27%(TPS ≥ 1%);39-45%(TPS ≥ 50%)• 化療後:18-20% 60 40 20-20-40-60-80 3A-03 3A-16 3A-16 A-08 3A-15 3A-09 3A-04 3A-02 3A-10 3A-17 3A-11 3A-13 -100 -80 -60 -20 0 20 40 60 100% C h h h a n g e f r o m b a s e l i n e l i n e n e a s e l i n e n=2 N=9 CRPRSDPD 最佳整體反應患者編號 03 16 08 15 09 04 02 10 11 13-100-80-60-40-20 0 20 40 60 80 100% 與基線相比變化 N=9 N=2 總體最佳迴應 PD SD PR CR

32 © 2024,Iovance Biotherapeutics, Inc. 對已確診的表皮生長因子 WT 反應者的研究時間(n=7)IOV-COM-202 隊列 3A 非小細胞肺癌組合(TIL+PEMBROLIZUMAB),WCLC 口頭報告(2023 年 6 月 26 日數據截圖)持久反應者包括 3 名錶皮生長因子 WT 病的持續應答者,研究隨訪時間中位數為 18.2 個月,每位患者均有禁忌從注射LN-145之日起至新的抗癌療法、評估結束、死亡或數據截止日期,以較早者為準。a. 根據現場報告和中心實驗室數據之間的裁定;b.患者先前接受過新輔助放化療;縮寫:BOR,最佳總體反應;CR,完全反應;NSCLC,非小細胞肺癌;NSQ,非鱗狀肺癌;ORR,客體活性反應率;PD-L1,程序性死亡配體 1;PR,部分反應;Pt,患者;SOD,直徑總和;SQ,鱗狀;TPS,腫瘤比例評分; WT,野生——3A-10 型 3A-09 3A-17 3A-04 3A-02 3A-13 3A-11 S u b j e c t s 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 個時間(月)Pembro 輸液進展正在進行中 PR 開始 CR開始 Pt ID Prior ICI Prior Chemo PD-L1 TPS a (%) SQ 或 NSQ BOR 11 不是

33 © 2024,Iovance Biotherapeutics, Inc. 隨着時間的推移反應加深是 EGFR WT 患者靶病變 SOD 的一次性免疫療法變化的特徵(n=11)IOV-COM-202 隊列 3A 非小細胞肺癌組合(TIL+PEMBROLIZUMAB),WCLC 口頭陳述(2023 年 6 月 26 日數據剪切)縮寫:CR,完整反應;表皮生長因子、表皮生長因子生長因子受體;NSCLC,非小細胞肺癌;PR,部分分辨率;SD,穩定疾病;PD,進行性疾病;WT,野生型最佳總體反應 PD SD PR CR 訪問量 60 40-100-80-60-40-20 0 20 20 4060 80 與基準日相比的基準百分比變化 42 天 84 天 126 個月 6 個月 9 個月 12 個月 18 點 3 (PD) 第 8 點 (SD) 第 15 (SD) 第 9 點 (PR) 第 10 點 (PR) 第 17 點 (PR*) 第 13 點 (CR*) 第 11 點 (PR*) 第 4 點 (PR) *持續回覆第 16 點 (PD) 第 2 點 (PR) 3A-03 (PD)) 3A-15 (SD) 3A-08 (SD) 3A-04 (PR) 3A-11 (PR) 3A-17 (PR) 3A-02 (PR) 3A-09 (PR) 3A-09 (PR) 3A-13 (CR) 基準日 42 天 84 天 126 個月六個月九個月 15 個月 18 訪問 -100 -80 -60 -20 20 40 60 80 P e r c e n t C h a n g e CRPRSDPD 最佳迴應
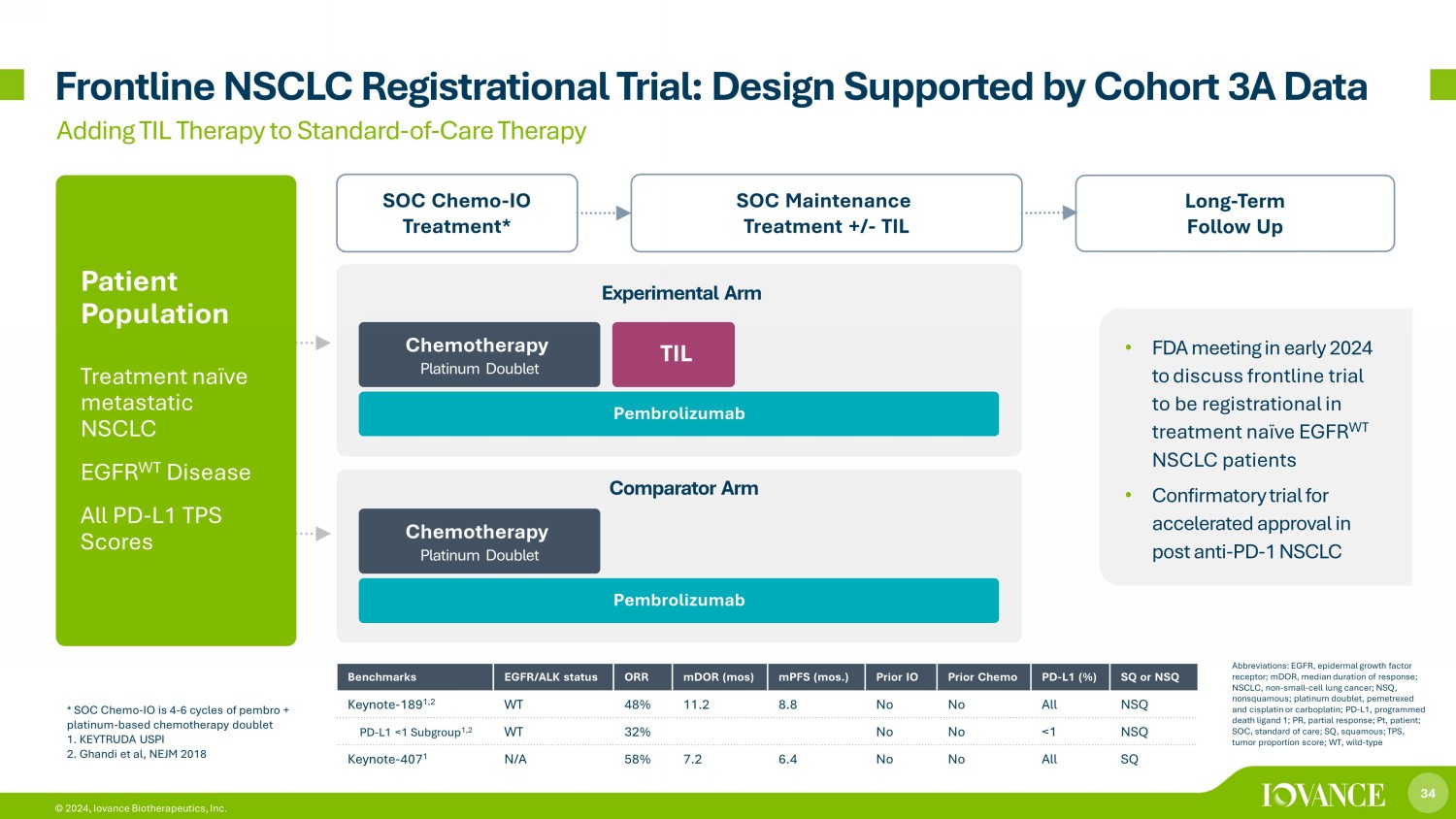
34 © 2024,Iovance Biotherapeutics, Inc. Frontline NSCLC 註冊試驗:由隊列 3A 數據支持的設計長期隨訪 SOC 維持治療 +/-TIL SOC Chemo-IO 治療* 將 TIL 療法添加到標準護理療法中 TIL 患者羣體治療天真轉移性非小細胞肺癌 EGFR WT 疾病所有 PD-L1 TPS 評分化療鉑金二聯* SOC Chemo-IO 4-6 個週期的 pembro + 鉑基化療 doublet 1。KEYTRUDA USPI 2.Ghandi 等人,NEJM 2018 年基準 EGFR/ALK 狀態 ORR mDoR(最多)MPF(mos.)Prior IO Prior Chemo PD-L1 (%) SQ 或 NSQ Keynote-189 1,2 WT 48% 11.2 8.8 否否所有 NSQ PD-L1
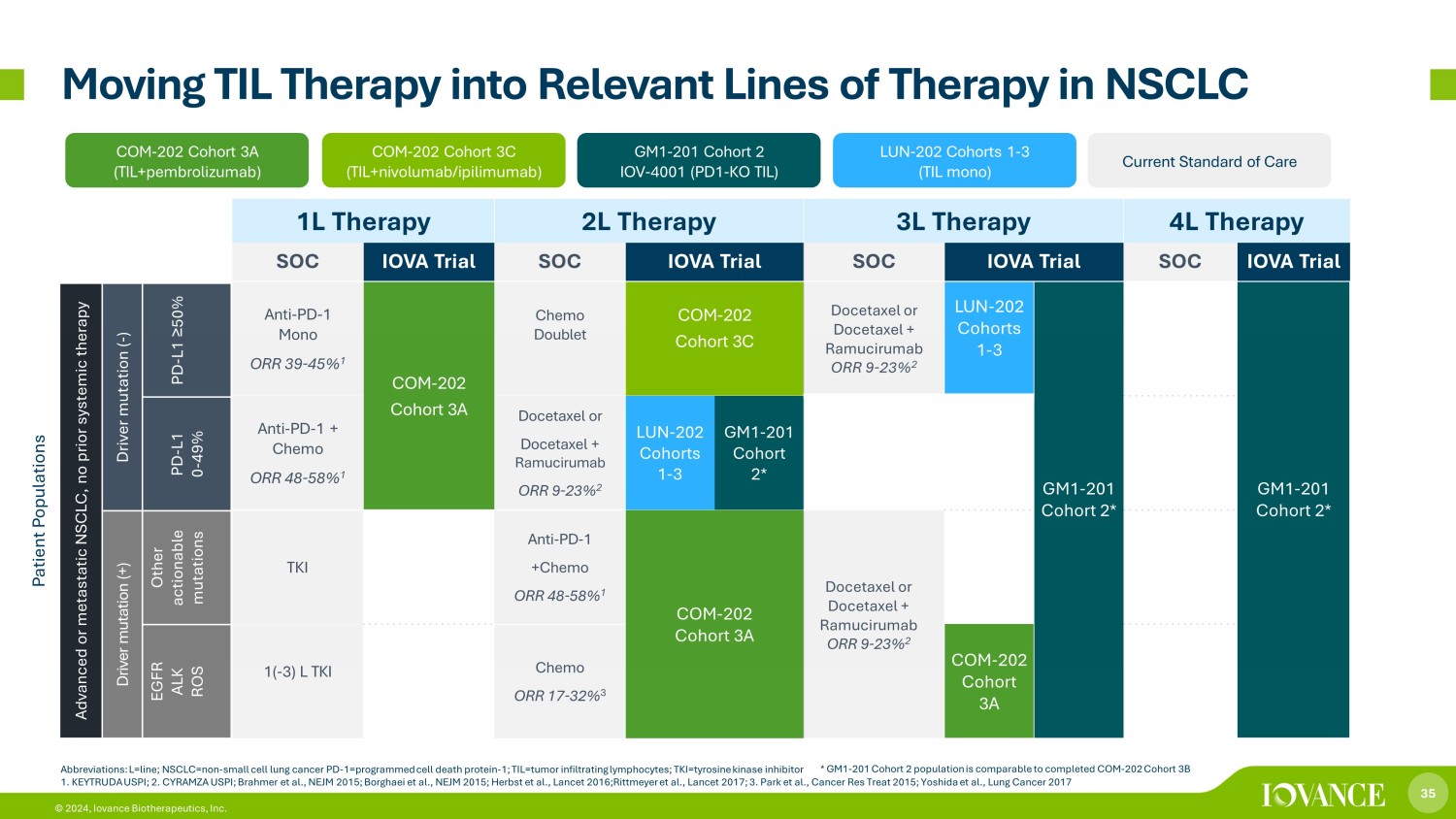
35 © 2024,Iovance Biotherapeutics, Inc. 1L 療法 2L 療法 3L 療法 4L 療法 SOC IOVA 試驗 SOC IOVA 試驗 SOC IOVA 試驗 SOC IOVA 試驗 ANTI-PD-1 單 ORR 39-45% 1 COM-202 隊列 3A Chemo Doublet COM-202 隊列 3C 多西他賽或多西他賽 + 拉穆西魯單抗 ORR 9-23% 2 LUN 202 Horts 1-3 GM1-201 隊列 2* GM1-201 隊列 2* 抗 PD-1 + 化療 ORR 48-58% 1 多西他賽或多西他賽 + Ramucirumab ORR 9-23% 2 LUN-202 隊列 1-3 GM1-201 隊列 2* TKI 抗-PD-1 +Chemo ORR 48-58% 1 COM-202 隊列 2* TKI 抗-PD-1 +Chemo ORR 48-58% 1 COM-202 隊列 3A 多西他賽或多西他賽+Ramucirumab ORR 9-23% 2 1 (-3) L TKI Chemo ORR 17-32% 3 COM-202 隊列 3A * GM1-201 隊列 2 人羣與已完成的 COM-202 隊列 3B 將 TIL 療法轉入 NSCLC 的相關治療線路相當 COM-202 隊列 3A (til+pembrolizumab) LUN-202 隊列 1-3 (TIL mono) COM-202 隊列 3C (TIL+ nivolumab /i pilimumab) GM1-201 隊列 2 IOV-4001 (PD1-KO TIL) 當前護理標準患者羣體晚期或轉移性非小細胞肺癌,先前未進行全身治療驅動突變 (-) PD-L1 ≥ 50% PD-L1 0-49% 驅動突變 (+) 其他可操作的突變 EGFR ALK ROS 縮寫:L=Line;nsclc=non——小細胞肺癌 PD-1=編程細胞死亡蛋白——1;til=腫瘤浸潤淋巴細胞;TKI=酪氨酸激酶抑制劑 1。KEYTRUDA USPI;2.CYRAMZA U S PI;Brahmer 等人,NEJM 2015;Borghaei 等人,NEJM 2015;Herbst 等人,《柳葉刀》2016;Rittmeyer 等人,《柳葉刀》2017;3.Park 等人,《2015 年癌症研究治療》;Yoshida 等人,2017 年肺癌

36 © 2024,Iovance Biotherapeutics, Inc. 36 上市準備工作

37 © 2024,Iovance Biotherapeutics, Inc. i CTC 專為大批量 TIL 製造和靈活性而設計 • 核心套件:TIL 商業製造 • 靈活的套件:臨牀供應、管道擴張和先進製造 • 集成的質量控制、供應鏈和信息技術系統 • 100 多名員工,在發佈前及以後將增加員工 • iovance Biotherapeutics, Inc.

38 © 2024,Iovance Biotherapeutics, Inc. 瞄準潛在的授權治療中心 (ATC) 潛在的 ATC Iovance 臨牀試驗地點 1 1.ClinicalTrials.gov 縮寫:ATC=授權治療中心;nccn=全國綜合癌症網絡;KOL=關鍵意見領袖;bmt=骨髓移植靶向注意事項 • 患者數量 • NCCN狀態,KOL • 現有細胞療法/ BMT • 住院容量 • Iovance 臨牀試驗推動需求 • 首要客户優先級 • 社區轉診約 30 個 ATC 預批准入職;預計在 90 天后 90 天內完成 50 個 ATC-PDUFA

39 © 2024,Iovance Biotherapeutics, Inc. 55% 商業醫療保險 IPPS 豁免 4% 17% Medicare Advantage 8% Medicare FFS 7% Medicaid 9% 其他賦能市場準入轉移性黑色素瘤支付者混合物 1.轉移性黑色素瘤保險索賠分析,TIL-在 ATC 環境中接受治療的符合條件的患者(2018 年 1 月 1 日 — 2021 年 6 月 30 日)。Medicai d為6%的醫療補助優勢和1%的醫療補助費——服務費;對於12%的Medicare FFS生活,11家PPS——免税醫院由Medicare FFS按成本(約4%)報銷,剩餘的Medicare FFS壽命(約8%)根據DRG-018付款方式報銷,NTAP/異常值補助金可能會增加醫療保險報銷總額。其他部分包括現金、自保、弗吉尼亞州和其他無法識別的索賠。縮略語:FFS=Fee——用於——服務;ICD-10 PCS=國際疾病分類,第十修訂版,程序編碼系統;NTAP = 新技術附加付款人意識到大量未得到滿足的需求、缺乏治療選擇和生命的臨牀價值預期准入 • 與負責約90%的承保生命的付款人互動 • 預計將有強勁的醫院報銷——住院補償方法已制定——預計主要付款人將佔大部分供應商成本 • 預計承保範圍與 CAR 相似-Ts
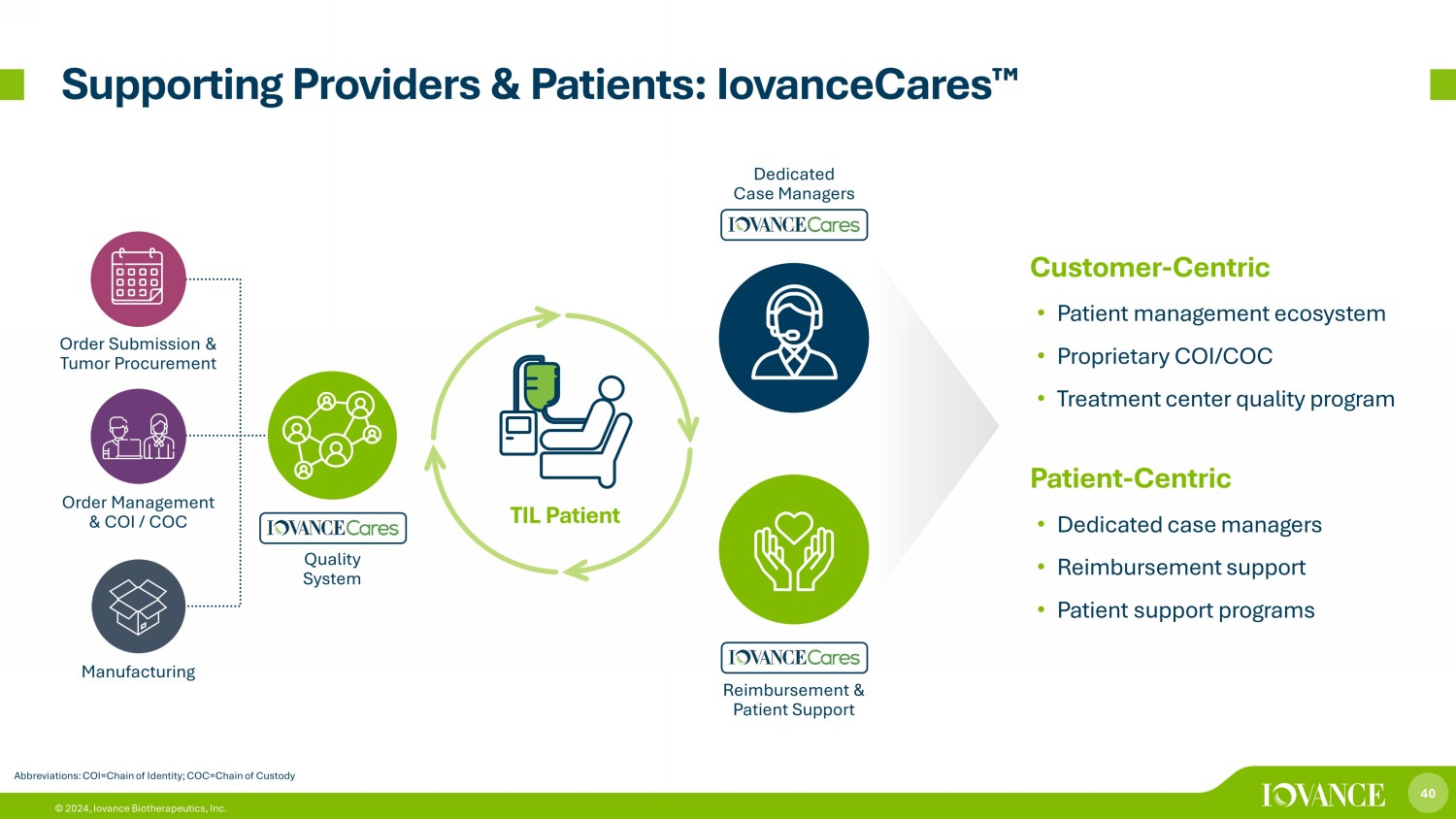
40 © 2024,Iovance Biotherapeutics, Inc. 支持提供商和患者:iovanceCares 縮寫:COI=身份鏈;COC=監管鏈以客户為中心 • 患者管理生態系統 • 專有COI/COC • 治療中心質量計劃以患者為中心 • 專屬病例經理 • 報銷支持 • 患者支持計劃質量體系專業個案經理報銷和患者支持訂單提交和腫瘤採購訂單管理和COI/COC製造 TIL 病人
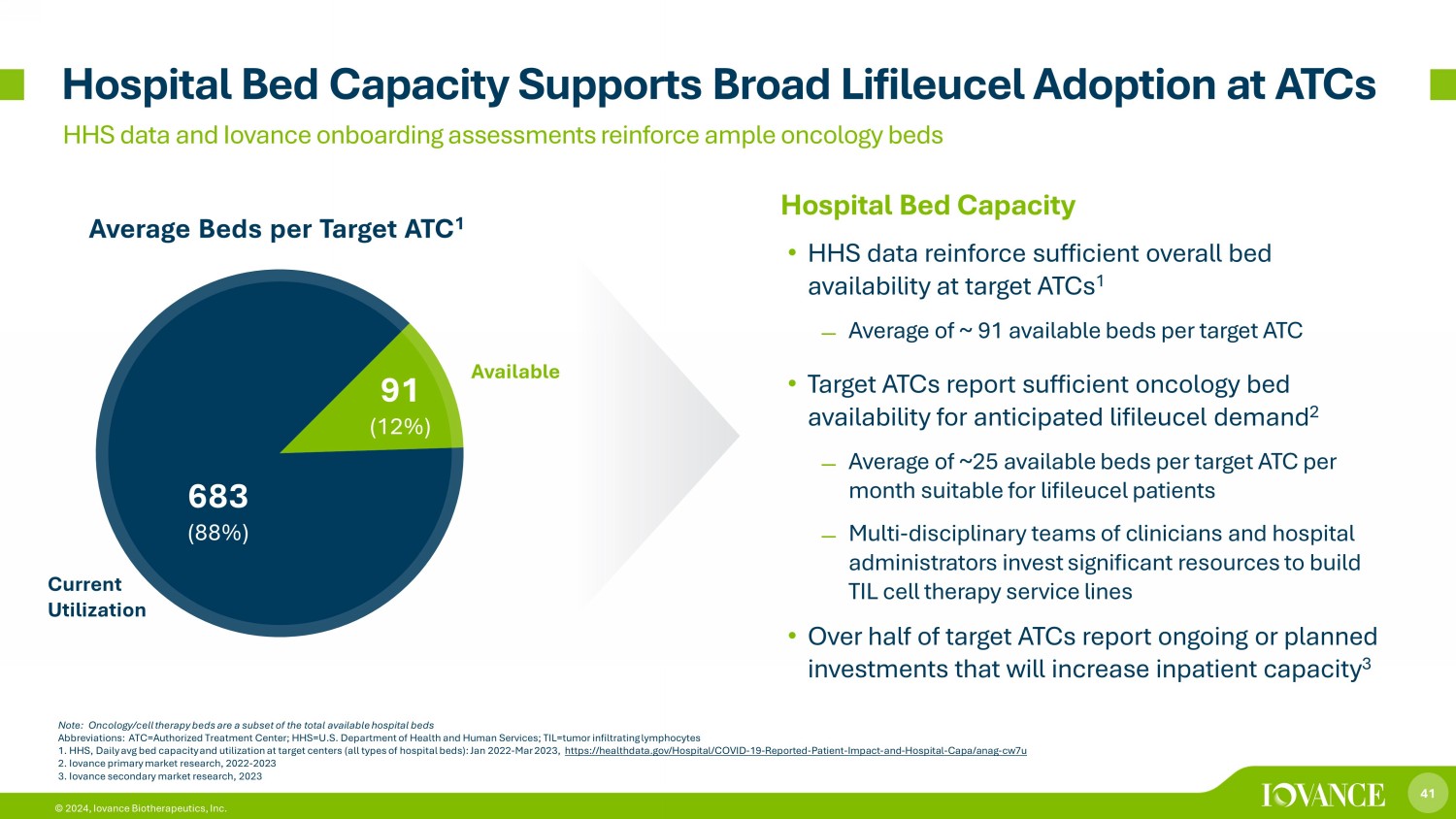
41 © 2024,Iovance Biotherapeutics, Inc. 的醫院牀位容量 • HHS 數據證實了目標 ATC 的總體牀位供應量充足 1-每個目標 ATC 的可用牀位平均約為 91 張 • 目標 ATC 報告腫瘤牀位充足,可滿足預期的生命細胞需求 2-每個目標 ATC 每月平均有大約 25 張可用牀位,適合lifileucel患者,由臨牀醫生和醫院管理人員組成的多學科團隊投入大量資源建立 TIL 細胞療法服務熱線 • 超過一半的目標 ATC 報告説正在進行或計劃中投資將增加住院容量 3 張目標平均牀位 ATC 1 病牀容量支持 ATC 廣泛採用 Lifileucel HHS 數據和 Iovance 入職評估強化了充足的腫瘤病牀注意:腫瘤學/細胞療法牀位是可用病牀總數的子集縮寫:ATC=授權治療中心;HHS=美國衞生與公共服務部;til=腫瘤浸潤淋巴細胞 1。HHS,目標中心(所有類型的醫院病牀)的每日平均牀位容量和利用率:2022年1月至2023年3月,https://healthdata.gov/Hospital/COVID-19-已報告-患者-影響-和-醫院-CAPA/Anag-cw7u 2。Iovance 主要市場研究,2022-2023 3 3 3.Iovance 二級市場研究,2023 683 (88%) 91 (12%) 可用電流

42 © 2024,Iovance Biotherapeutics, Inc. 42 其他 TIL 療法臨牀項目亮點

43 © 2024,Iovance Biotherapeutics, Inc. 1/2 階段開放——標籤先入——人體研究:IOV-GM1-201 個終點 • 第 1 階段:安全性 • 第 2 階段:研究者評估的 RECIST v1.1 的客觀反應率 (ORR) • 次要終點包括完全反應率 (CR)、反應持續時間 (DOR)、疾病控制率 (DCR)、自由進展存活率 (PFS)、總體存活率 (OS)、安全性和耐受性、可行性研究更新 • 22 年第 3 季度:第一批接受治療的患者隊列 1:不可切除或轉移的黑色素瘤後-抗 PD-1/L1,後-BRAF/MEKBRAF 突變患者的抑制劑隊列 2:III 期或 IV 期 NSCLC 後-抗 PD-1/L1 或靶向治療後,以及化療或抗 PD-1/L1 患者羣體患有不可切除或轉移性黑色素瘤或晚期 NSCLC 的成年人 N=53 轉基因,PD-1 滅活 TIL 治療 IOV-4001 用於先前治療的轉移性黑色素瘤和 NSCLC (NCT05361174) 下一代 TIL 療法 IOV-4001 nsclc=非小細胞肺癌
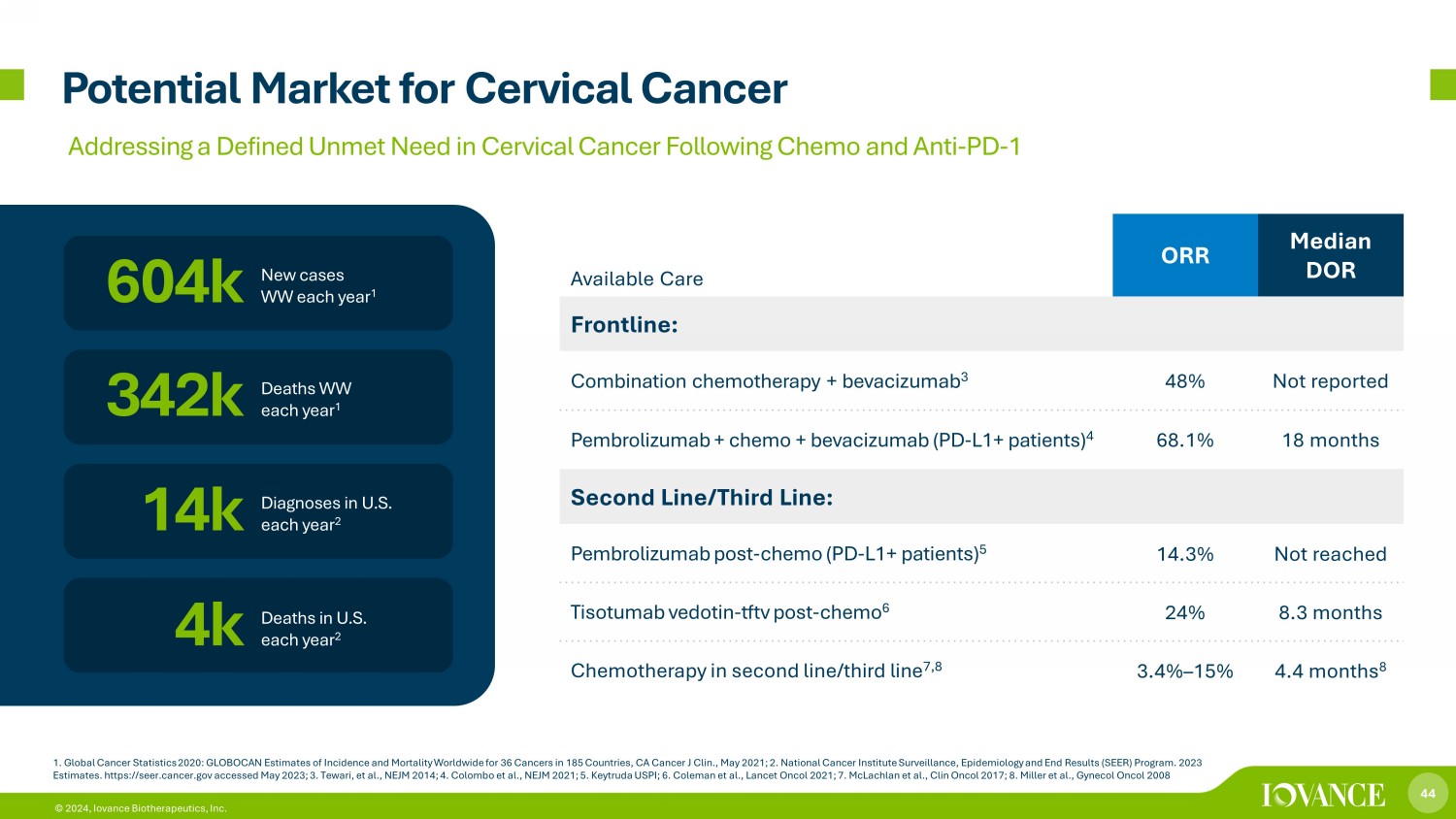
44 © 2024,Iovance Biotherapeutics, Inc. 宮頸癌的潛在市場 1.2020年全球癌症統計:GLOBOCAN對全球185個國家36種癌症的發病率和死亡率估計,CA Ca ncer J Clin。,2021年5月;2.美國國家癌症研究所監測、流行病學和最終結果(SEER)計劃。2023 年估計。https://seer.cancer.gov 已於 2023 年 5 月訪問;3.Tewari 等人,NEJM 2014;4.科倫坡等人,NEJM 2021;5.Keytruda 美國 PI;6.Coleman 等人,《Lancet Oncol 2021》;7.McLachlan 等人,Clin Oncol 2017;8.Miller 等人,Gencheol Oncol 2008 年新增病例 WW 每年美國有 1 60.4 萬例 14k 診斷 2 342k 4k 全球每年 1 人死亡 2 可用護理 ORR 前線中位數:聯合化療 + 貝伐珠單抗 3 48% 未報告 Pembrolizumab + chemo + bevacizumab(PD-L1+ 患者)4 68.1% 18 個月 18 個月未報告 Pembrolizumab + 化療 + 貝伐珠單抗(PD-L1+ 患者)4 68.1% 18 個月線路:Pembrolizumab 後——化療(PD-L1+ 患者)5 14.3% 未達到 Tisotumab vedotin——tftv 發佈——化療 6 24% 8.3 個月二線/三線化療 7,8 3.4% — 15% 4.4 個月 8 解決明確的未滿足問題化療和抗PD後宮頸癌的需求-1
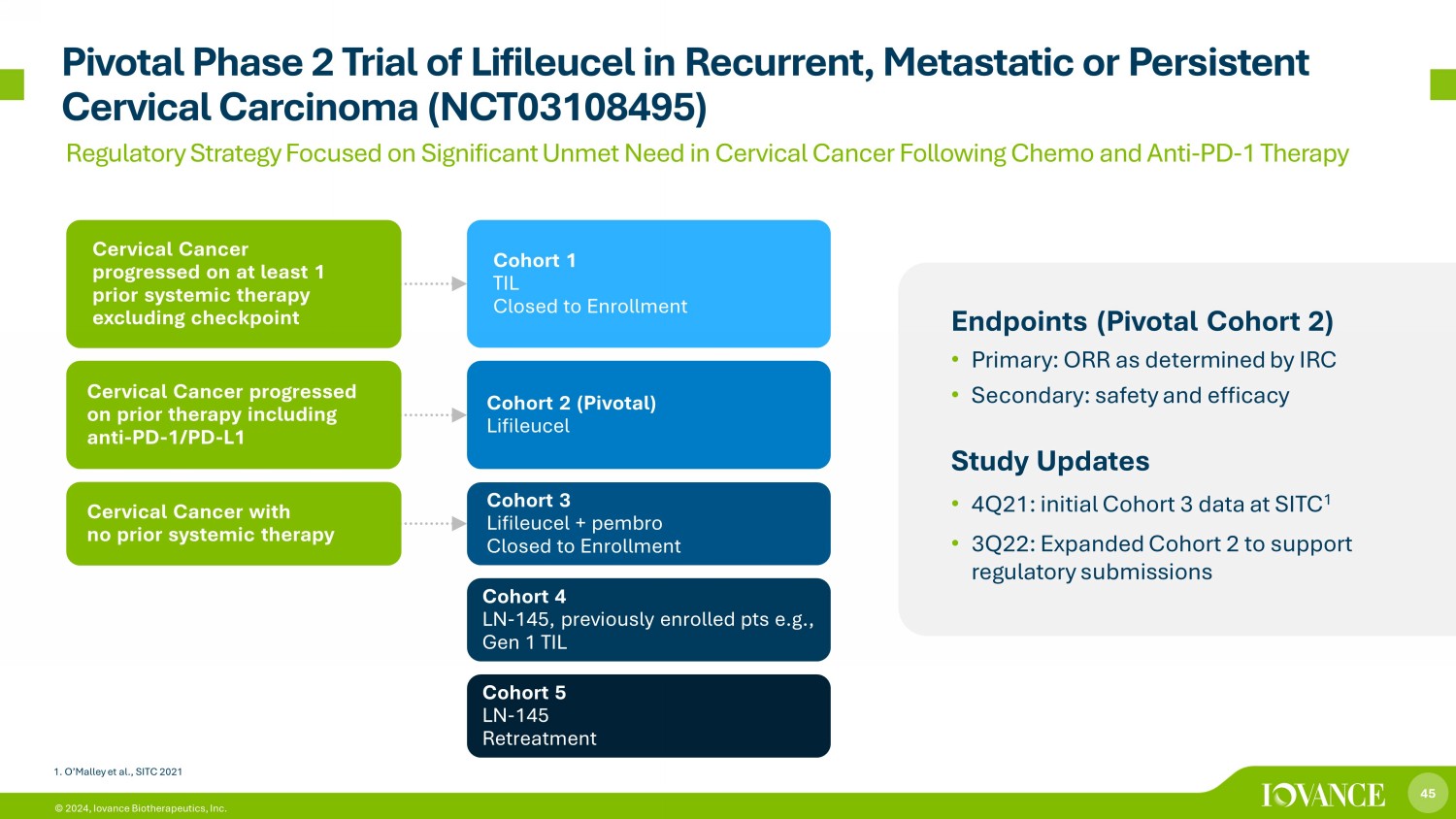
45 © 2024,Iovance Biotherapeutics, Inc. Lifileucel在復發、轉移性或持續性宮頸癌(NCT03108495)終點中的關鍵性2期試驗(關鍵隊列2)• 主要:IRC確定的ORR • 次要:安全性和有效性研究更新 • 2021年第四季度:SITC 1的初始隊列3數據•2022年第三季度:擴大隊列2以支持監管機構提交隊列1 TIL已停止入組 2 (Pivotal) Lifileucel 隊列 3 Lifileucel + pembro 已關閉入組隊列 4 LN-145,之前註冊的 pts,例如,第 1 代 TIL 隊列 5 LN-145 再治療宮頸癌在先前的至少1次全身治療中進展不包括檢查點子宮頸癌在先前的治療中進展,包括抗PD-1/PD-L1宮頸癌,之前沒有進行全身治療 1.O'Malley等人,《SITC 2021年監管戰略》側重於化療和抗PD-1療法後宮頸癌未得到滿足的重大需求

46 © 2024,Iovance Biotherapeutics, Inc. 46 下一代研究項目
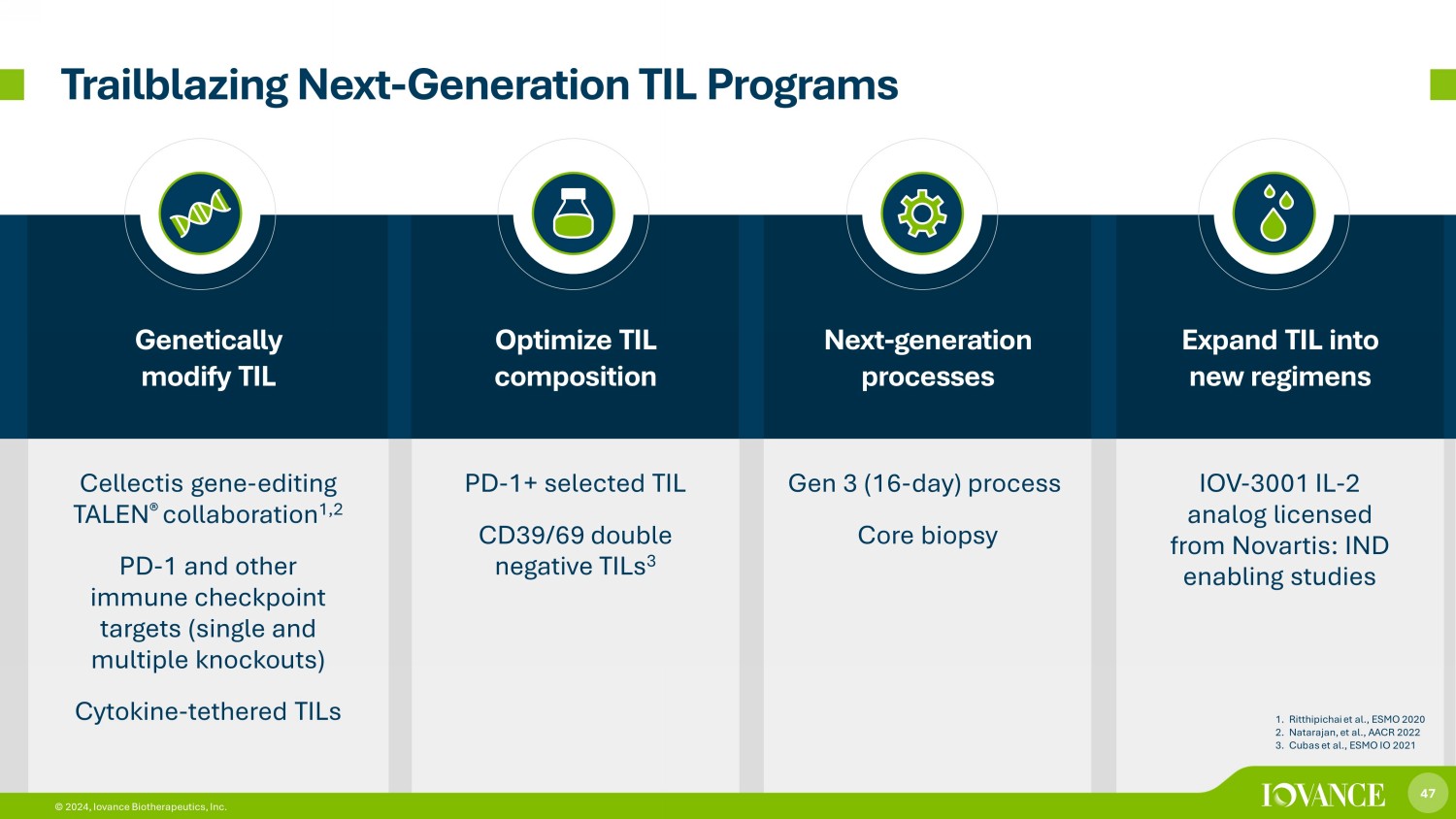
47 © 2024,Iovance Biotherapeutics, Inc. 進行基因修改 TIL 優化 TIL 成分下一代流程將 TIL 擴展到新方案 Cellectis 基因-編輯 TALEN® 合作 1,2 PD-1 和其他免疫檢查點靶標(單一和多重敲除)細胞因子-聯機 TilS PD-1+ 精選 TIL CD39/69 雙陰性 TIL 3 代(16 天)流程核心活檢 IOV-3001 IL-2 模擬器獲得諾華許可:IND 支持研究 “開拓下一代 TIL 計劃” 1。Ritthipichai 等人,ESMO 2020 2.Natarajan 等人,AACR 2022 3.Cubas 等人,ESMO IO 2021 47 © 2024,Iovance Biotherapeutics, Inc.

48 © 2024,Iovance Biotherapeutics, Inc. 48 公司摘要和里程碑

49 © 2024,Iovance Biotherapeutics, Inc. 2023 年 9 月 30 日(以百萬計)現金、現金等價物、投資、限制性現金427.8 美元 1 已發行普通股 255.8 股已發行優先股 2.9 2 已發行的股票期權和限制性股票單位 23.1 1.包括截至2023年9月30日的6,640萬美元的限制性現金。2.優先股按轉換後的基礎上列示好吧——為追求TIL商業化而資本化的現金流到2025年已經足夠了**包括2024年來自lifileucel和Proleukin® 的預期收入

50 © 2024,Iovance Biotherapeutics, Inc. Broad,Iovance——在TIL Therapy TIL產品和成分方面擁有的知識產權:第二代、第三代、共興奮劑的使用、TIL、穩定和短暫的基因修飾、低温保存 1 腫瘤樣本採購 3 4 NMA-LD TIL 輸液 5 IL-2 輸液 4 2 TIL 來自:• 腫瘤 • 骨髓浸潤淋巴細胞 • 外周血液淋巴細胞 • 冷凍腫瘤技術 • 殘留 TIL 和消化過程 • TIL 和 ICI 的組合,包括 PD-1 抗體 • 患者亞羣 IL-2 變體和方案 x60 多項已獲授權或允許的美國和國際專利 x TIL 產品的物質成分 x 各種癌症的治療方法 x 製造工藝

51 © 2024,Iovance Biotherapeutics, Inc. 公司要點開創治療癌症的變革性方法在未得到滿足的癌症需求中擁有巨大市場機遇首個細胞療法獲準用於實體瘤高效且可擴展的專有製造設施基礎設施在商業上取得成功 • 最初的重點是ICI後期實體瘤 • 擴展到聯合療法、早期療法和基因改造 • 黑色素瘤、非小細胞肺癌和宮頸癌的關鍵後期試驗 • 先進-轉基因 TIL 的人體試驗,PD-1 已失活 • BLA 通過優先審查和 RMAT 申請了用於晚期黑色素瘤的 lifileucel • TILVANCE-301 使用 FTD 進行的 3 期一線晚期黑色素瘤確認試驗 • 非小細胞肺癌和宮頸癌 (BTD) 的明確註冊策略 • 內部製造的 Iovance 細胞療法中心 (i CTC) • 合同製造商增加產能 • 為期 22 天的快速第 2 代製造,成功率超過 90% • >使用 Iovance 專有工藝治療 700 名患者 • 完全整合的公司 • 經驗豐富的跨職能細胞療法團隊 • 合作美國領先的癌症中心將開發TIL服務——線路能力 • iovanceCares的專有平臺 • Proleukin® 整合 51 © 2024,Iovance Biotherapeutics, Inc. 縮寫:BLA,生物製劑許可申請;BTD,突破性療法名稱;FTD,快速通道名稱;ICI,i mmu ne 檢查點抑制劑;NSCLC,非小細胞肺癌;PD-1,程序性細胞死亡蛋白質-1;RMAT,再生藥物高級療法;TIL,腫瘤信息滲透淋巴細胞。

52 © 2024,Iovance Biotherapeutics, Inc. 監管 □ BLA:在 2023 年第一季度完成了抗PD-1 晚期黑色素瘤的 lifileucel 的滾動提交;後期週期會議已完成,BLA 有望實現 PDUFA 日期 □ 前線美國監管機構文件:啟動美國前市場申報準備工作管道 □ 黑色素瘤:招收患者參加一線晚期黑色素瘤確診試驗 □ NSCLC:報告數據並繼續入組 IOV-LUN-202、IOV-COM-202、IOV-GM1-202、IOV-GM1-201 試驗 □ 子宮頸:招收更多患者進行註冊第 2 組 □ 研究:將新產品推向臨牀,包括其他轉基因 TIL 療法制造 □ 執行 GMP 商業準備活動以支持 BLA 批准,包括通過 PLI 檢查 □ 在發佈時供應lifileucel:提高 iCTC 和 CDMO 產能,為上市做準備 □ 完成交易併成功整合 Proleukin® 業務 2023 年裏程碑

53 © 2024,Iovance Biotherapeutics, Inc. 監管 □ 獲得 FDA 批准用於晚期黑色素瘤的 lifileucel(PDUFA 日期:2024 年 2 月 24 日)□ 於 2024 年上半年提交 EMA 監管機構申報 □ 在 2024 年下半年提交更多前美國申報 □ 與 FDA 會面,討論 NSCLC 註冊路徑/前線研究管道 □ 報告臨牀和臨牀前數據 □ 恢復IOV-LUN的註冊-202 □ 啟動子宮內膜癌的二期試驗 □ 繼續招募患者參與晚期黑色素瘤、非小細胞肺癌和婦科癌的臨牀試驗 □將新產品推向臨牀,包括更多轉基因 TIL 療法的製造 □ 滿足患者對商業上市和臨牀試驗的需求 □ 進一步擴大產能以滿足美國和美國以外的需求商用 □ 進行商業發佈(24 年第 1 季度)□ 在 PDUFA 之日起 90 天內上線 50 台 ATC 預計里程碑 2024 年裏程碑

54 © 2024,Iovance Biotherapeutics, Inc. © 2024,Iovance Biotherapeutics, Inc. 謝謝