目錄表
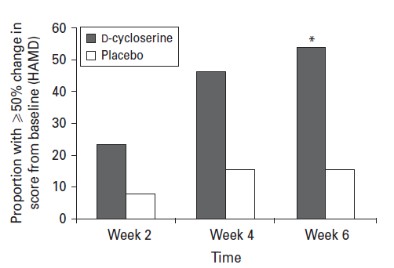
抗精神病藥物)。這種協同效應現在已經在實驗室齧齒動物行為實驗和多個第二階段臨牀試驗中得到證明,並導致在美國和多個外國司法管轄區授予物質組合物專利。賈維特隨後觀察到,當抑鬱症患者接受NMDA拮抗劑DC與抗抑鬱藥聯合治療時,他們表現出更強的抗抑鬱效果,但沒有表現出之前報道的幻覺和其他NMDA效應。他進一步觀察到,DCs似乎減少了所有已知的5-羥色胺靶向抗抑鬱藥常見的一些抗抑鬱藥副作用(靜坐不能)。
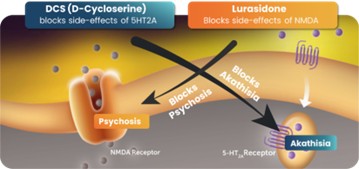
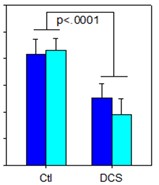
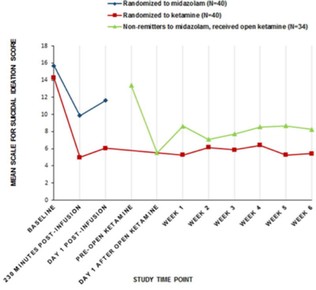
圖1抑制NMDA受體的藥物阻斷由5-羥色胺靶向藥物和5-羥色胺靶向藥物引起的靜坐不能,進而阻斷NMDA抑制劑的迷幻作用的物質的協同組成。美國專利10583138的基礎。消息來源:NeuroRx,Inc.
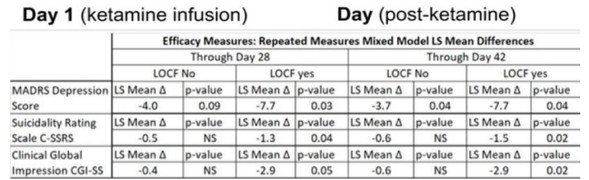
這些專利發現支持NRX-101,這是第一個獲得快速通道指定和突破性治療指定的研究用口服抗抑鬱藥,以及FDA針對ASIB患者嚴重雙相抑鬱的特別協議。NRX致力於該產品和其他產品的研究、開發和未來的商業化,用於治療在雙相抑鬱和嚴重抑鬱障礙(“MDD”)以及創傷後應激障礙(PTSD)和潛在的慢性疼痛中患有自殺意念的患者。抑制大腦NMDA受體而不受氯胺酮限制的藥物引起了人們的極大興趣,自從發現氯胺酮在減少抑鬱和自殺意念方面具有強大的效果以來,人們一直在探索用於治療上述疾病的藥物。我們認為,NRX-101和我們將不同分子結合在一起的知識產權可能會產生使用NMDA抑制藥物用於此目的的競爭優勢,因為其他化合物可能會受到不利因素的限制,如神經毒性(長期使用)、幻覺、潛在的習慣性(即成癮特性)、血壓升高和/或缺乏口服生物利用度。
這種協同效應是下文所述專利組合背後的一項關鍵發現。科學發現表明,NMDA藥物的一些副作用可以被5-HT2A藥物阻斷,反過來,NMDA成分可以阻止靜坐不能,這是5-HT2A阻斷藥物的已知副作用,眾所周知,它容易導致自殺。這種雙重目標的方法是我們全球專利組合的主要基礎,目前包括38項未決申請,以及多個司法管轄區的48項已授權專利,涵蓋物質的組成和使用方法(見“NRX專利組合”)。此組合中的相關專利和專利申請由NeuroRx擁有,由GlyTech,LLC(“GlyTech”)獨家授權給NeuroRx,GlyTech是一家特拉華州的有限責任公司,由Daniel·賈維特博士全資擁有(“GlyTech許可證”),或由Sarah Herzog Memory Hospital Ezrat Nashim(“SHMH”)獨家授權給NeuroRx,後者是根據以色列法律組織的非營利性組織(“SHMH許可證”)。
NeuroRx擁有一項美國合成物質專利,涵蓋NRX-101。GlyTech許可下的專利涵蓋物質的組成(包括NRX-101和流水線治療候選藥物)和使用方法(包括使用NRX-101治療有自殺意念的躁鬱症和治療創傷後應激障礙的方法),已在美國、歐洲(包括歐洲專利公約18個成員國的驗證)、日本、澳大利亞和中國獲得授權。
12