
藍鳥生物摩根大通2024年1月在納斯達克發表演講:BLUE 附錄 99.2

機密的前瞻性陳述 2 這些幻燈片和隨附的口頭陳述包含前瞻性陳述和信息。使用 “可能”、“可能”、“將”、“應該”、“期望”、“計劃”、“預測”、“相信”、“估計”、“項目”、“打算”、“未來”、“潛在” 或 “繼續” 等詞語以及其他類似的表述旨在識別前瞻性陳述。例如,我們就我們對我們的計劃和療法的期望發表的所有聲明,包括但不限於監管機構申報和批准的時間或可能性;我們的製造和商業化計劃,包括但不限於患者對我們療法的需求、我們建立商業基礎設施以支持及時、公平獲得我們的療法的能力、我們成功與付款人和CMMI合作的能力、我們對激活QTC時機的期望,以及我們對時機的期望我們的 QTC 規模網絡以及我們的療法在QTC上市的時機;我們療法的潛在市場;截至2023年12月31日的未經審計的初步現金狀況;以及我們的現金流都具有前瞻性。所有前瞻性陳述均基於管理層的估計和假設,儘管我們認為這些估計和假設是合理的,但本質上是不確定的。所有前瞻性陳述都受到風險和不確定性的影響,這些風險和不確定性可能導致實際結果與我們的預期存在重大差異。這些陳述還受到許多重大風險和不確定性的影響,這些風險和不確定性在我們最新的10-Q表季度報告以及我們隨後向美國證券交易委員會提交的文件中都有描述。任何前瞻性陳述僅代表其發表之日。除非法律要求,否則我們沒有義務公開更新或修改任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。

CONFIDENTIAL 3 讓患者及其家人有更多的藍鳥時光

機密唯一一家擁有三種 FDA 批准產品的商業基因療法公司 4

機密信息隨着商業發佈而勢頭增強;有機會為患者和股東創造巨大價值 5 13K — 1.5K 患者可能有資格獲得 ZYNTEGLO™ 的β地中海貧血 40 名患者可能有資格獲得 SKYSONA™ 腦腎上腺素白質營養不良症患者 F U TU RE G ROW TH CI CO M M ER CI AL O PP O RT U N IT Y 患者數量 2萬名患者可能有資格獲得 LYFEGNIA™ 鐮狀細胞病
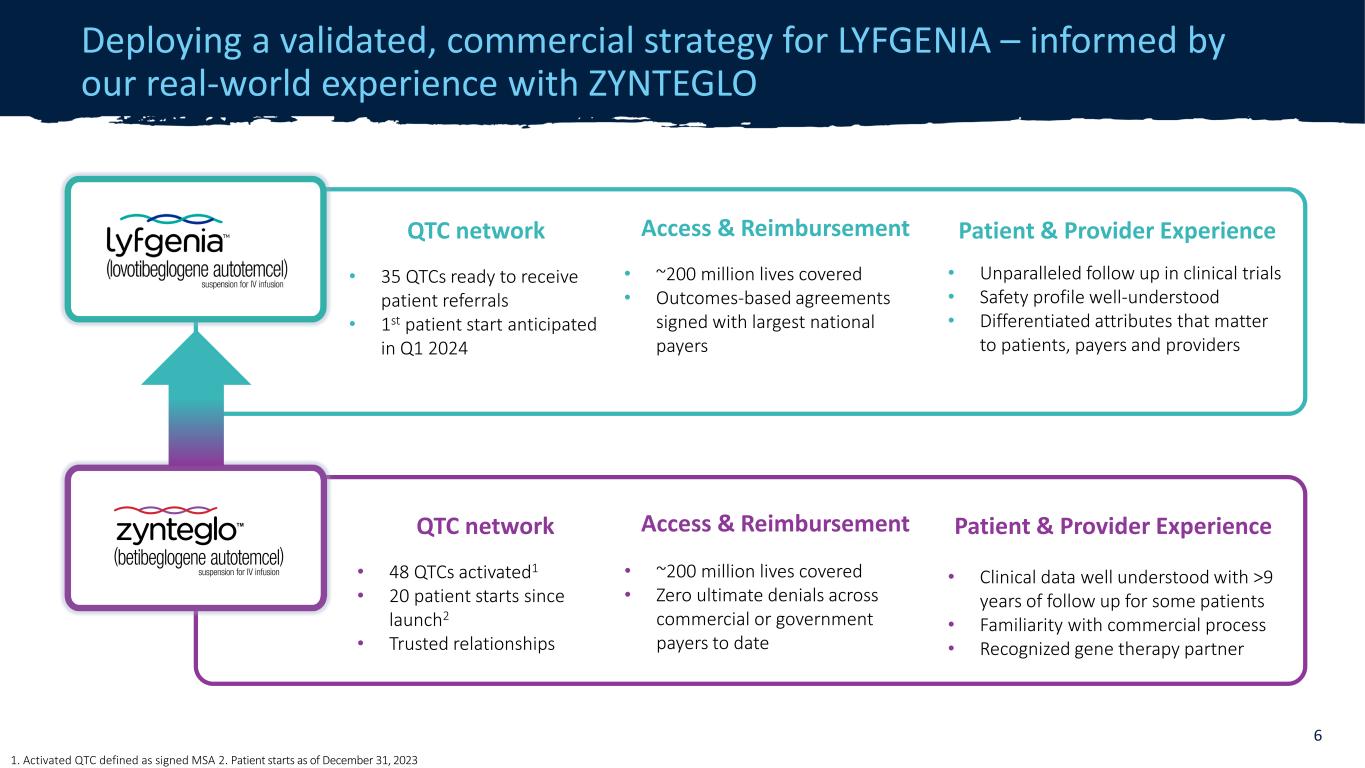
機密訪問和報銷 • 覆蓋約2億人的生命 • 與最大的全國支付方簽署了基於結果的協議患者和提供者經驗 • 臨牀試驗中無與倫比的後續行動 • 安全概況廣為人知 • 對患者、付款人和提供者至關重要的差異化屬性 QTC 網絡 • 35 個 QTC 準備接受患者轉診 • 第一位患者預計於 2024 年第一季度開始為 LYFGENIA 部署經過驗證的商業策略——以我們在ZYNTEGLGENIA的實際經驗為依據 O 6 QTC 網絡 • 48 個 QTC 已激活1 • 20 名患者自啟動以來開始2 • 可信關係訪問和報銷 • 覆蓋約2億條生命 • 迄今為止,商業或政府支付方的最終拒絕次數為零患者和提供者體驗 • 臨牀數據廣為人知,對某些患者進行了超過9年的隨訪 • 熟悉商業流程 • 公認的基因療法合作伙伴 1.已激活 QTC,定義為已簽名的 MSA 2。患者從 2023 年 12 月 31 日開始治療

7 QTC 網絡

機密 48 個合格治療中心 (QTC) 已激活 ZYNTEGLO 並迅速加入 LYFGENIA 8 35 個 QTC 已準備好接收 SCD 患者轉診現已激活 ZYNTEGLO QTC* Shading 表示目標 SCD 市場計劃於 2024 年 QTC 擴張 100% 的 ZYNTEGLO QTC 已啟動 LYFGENIA 的激活程序預計 ZYNTEGLO 網絡將完全激活在 2024 年第一季度末之前適用於 LYFGENIA *已激活 QTC 定義為已簽署的 MSA

機密優化的 QTC 網絡旨在覆蓋患有 SCD 9 1 的個人。潛在的潛在目標人口為20,000;2. 70% 的數字得到了七年的內部和外部市場研究的支持;3.存檔數據;4.科莫多聲稱數據對基因療法的強勁需求有望滿足患者的需求 95% 的 SCD 患者2 距離計劃的 QTC3 在 200 英里以內 88% 的目標 SCD 患者正在醫療系統中積極接受治療4 80%的提供者希望自己的機構同時提供LYFEGNIA及其競爭對手3 > 70% 的SCD患者1如果得到醫生的推薦會考慮基因療法2

准入和報銷 10

ZYNTEGLO的機密價值得到認可,合同或保險單涵蓋了約1,12億人的生命 ~ 90% 公佈的保險單對ZYNTEGLO持積極態度 ZYNTEGLO迄今為止,商業和政府支付方最終拒絕了β-地中海貧血患者獲得准入

機密經過驗證的准入和報銷策略旨在實現及時、公平地獲得LYFGENIA治療鐮狀細胞病12簽署了代表約2億受保人壽的基於結果的協議與超過15家醫療補助機構進行了深入的討論1 積極參與CMMI進行創新支付示範(預計2025年)鼓勵付款人互動表現出強勁而持續的臨牀益處(持續超過5年)反映了減少或消除VOE的終身影響 •醫療保健利用率•未來收益•生活機會310萬美元價格與價值掛鈎有意義的風險分擔與VOE相關的住院患者跟蹤了3年商業付款人和醫療補助選項旨在提供可預測性和易操作性基於結果的協議產品 1.數據基於2012年每1,000名醫療補助受益人的SCD患病率。

13 治療經驗
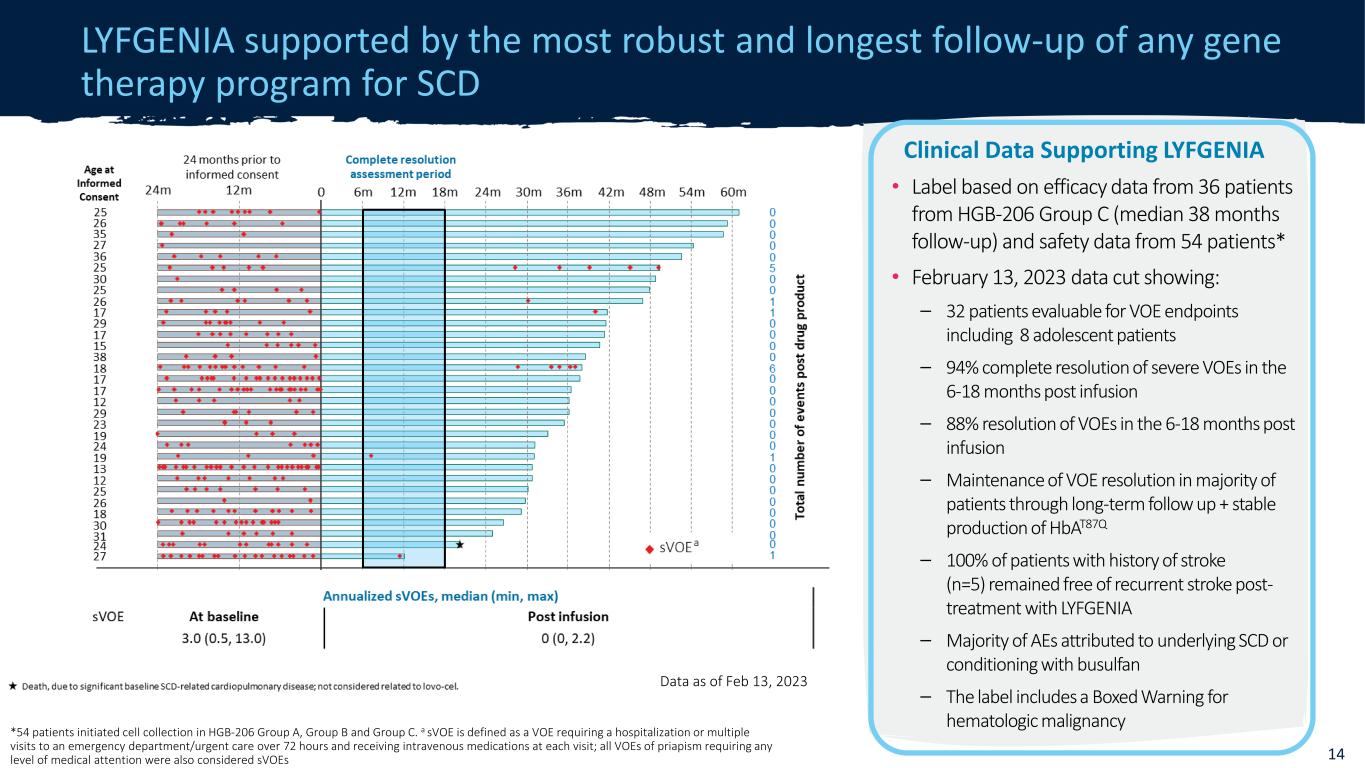
機密 LYFGENIA 得到所有基因治療計劃中最有力、最長的 SCD 數據的隨訪支持,截至 2023 年 2 月 13 日 14 *54 名患者啟動了 HGB-206 A 組、B 組和 C 組的細胞採集。sVoE 被定義為需要住院或多次就診超過 72 小時的急診科/緊急護理並在每次就診時接受靜脈藥物治療的 VOE;所有陰莖異常勃起的 VOE 需要任何程度的醫療救助還被視為支持 LYFGENIA 的 SVoE 臨牀數據 • 基於來自 36 名患者的療效數據來自 HGB-206 C 組(中位數 38 個月隨訪)和 54 名患者的安全性數據* • 2023 年 2 月 13 日截止的數據顯示:— 32 名患者可對 VOE 終點進行評估,包括 8 名青少年患者 — 輸液後 6-18 個月內重度 VOE 完全消退 94% — 輸液後 6-18 個月內 VOE 分辨率達到 88% — 通過長期隨訪維持大多數患者的VOE分辨率+ Hbat87q的穩定產生 — 100% 有中風史的患者(n=5)在接受LYFGENIA治療後仍然沒有復發的中風——大多數歸因於潛在的 SCD 或使用白消安調理的不良反應——標籤上包含血液系統惡性腫瘤的方框警告
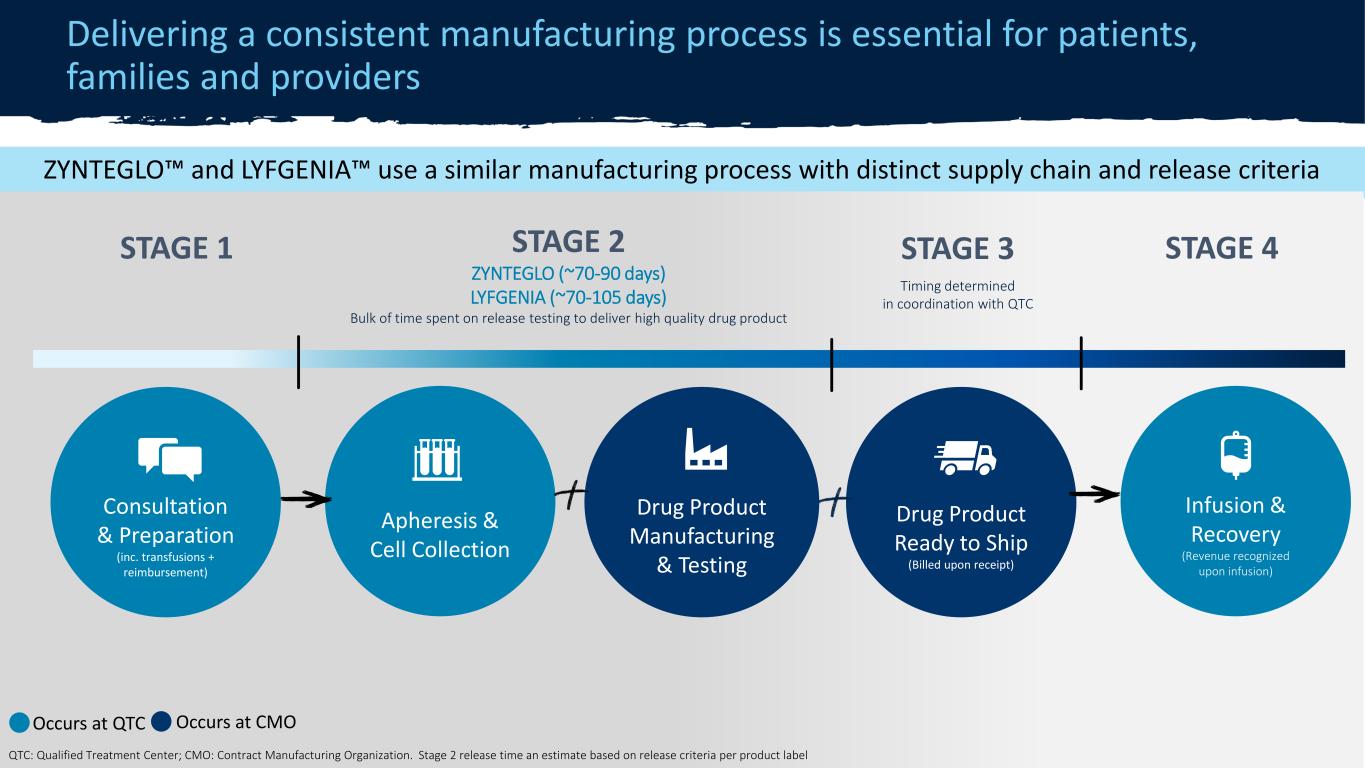
機密 ZYNTEGLO® 製造流程提供一致的製造流程對患者、家屬和醫療服務提供者至關重要 15 階段 2◇ 70-90 天大部分時間用於發佈測試,以交付高質量藥物產品血液分離和細胞收集藥物產品製造和測試藥物產品準備就緒(QTC 計費)輸液和恢復(輸液後確認收入)諮詢和準備(包括超額輸血 + 報銷確認)第 1* 階段 *發生在 QTC ◇ 發生在 CMO QTC:合格治療中心;首席營銷官:合同製造組織在臨牀試驗中,大約20%的病例出現了回憶。在商業環境中,所有患者都有 [已完成]回憶後的治療過程。ZYNTEGLO™ 和 LYFGENIA™ 使用相似的製造工藝,具有不同的供應鏈和發佈標準第 2 階段 ZYNTEGLO(約 70-90 天)LYFGENIA(約 70-105 天)用於交付高質量藥物產品的發佈測試的大部分時間(按收據計費)諮詢和準備(包括輸血 + 報銷)第 1 階段 4 發生在 QTC 發生在 CMO QT Lified 治療 C inter;CMO:合約製造和組織。第 2 階段發佈時間根據每個產品標籤的發佈標準估算第 3 階段與 QTC 協調確定時機

機密LYFGENIA的差異化屬性對患者、付款人和提供者都很重要 16 以臨牀特徵為基礎——包括>5年的隨訪、深入的安全性分析和針對SCD併發症的數據,包括中風細胞採集在臨牀試驗中,85% 的必填項

17 2 潛在的數十億美元機會,美國約有22,000名患者可尋址;制定了商業戰略和預計的患者和醫生需求經驗豐富的商業基因療法團隊完全有能力在血紅蛋白病領域處於領先地位 18個月的商業化起步——相同的治療醫生,相同的QTC,相同的支付者 1 3 具有深厚基因療法專業知識、製造經驗和商業基礎設施的知名基因療法領導者

SKYSONA™ 18

CONFIDENTIALI SKYSONA™ 用於腦腎上腺白質營養不良症商用 • SKYSONA 可減緩 4-17 歲患有早期活動性腦腎上腺皮質營養不良症 (CALD) 的男孩的神經系統功能障礙進展 • 自啟動以來有 6 名患者開始治療*;激活了 4 個 QTC;政府和商業支付方最終拒絕的案例為零 • 所有臨牀試驗均治療了 67 名患者 • 加速批准基於對11名患者的事後分析;估計在24個月時出現嚴重功能障礙無存活的可能性為72% • 5名男孩接受了治療臨牀試驗開發了骨髓增生異常綜合徵;標籤中包含血液系統惡性腫瘤的方框警告** 21患者開始治療定義為細胞採集(血液分離);Activated QTC定義為具有MSA簽名的合格治療中心。*患者自2023年12月31日起開始接受**藍鳥密切監測接受SKYSONA治療的患者的潛在和確診的血液系統惡性腫瘤病例,隨着時間的推移,預計還會出現更多病例。藍鳥定期與主治醫生和監管機構溝通。

閉幕 20

機密知名基因療法領導者有望為股東創造價值 21 確立的臨牀領導地位 • 10 多年的基因療法研究 • 200 多名患者接受了治療 • 8 項臨牀試驗顯示監管成功 • LVV 平臺建立了良好的往績記錄 • 3 家獲美國食品藥品管理局批准的基因療法商業基因療法領導者 • 擴展了三次商業發佈 • 協同移植和細胞療法基礎設施 • 可靠的報銷當前財務狀況未經審計的2.75億美元現金、現金等價物、限制性現金和有價證券餘額20231 年 12 月 31 日,預計在 2024 年 LYFGENIA、ZYNTEGLO 和 SKYSONA 共有 85-105 名患者開始發病 1.現金餘額包含5300萬美元的限制性現金;2.Cash Runway 使用現金餘額/淨消耗率(收入中的現金減去支付的支出現金)計算,包括現金、現金等價物和有價證券,不包括限制性現金;患者起始定義為細胞收款今天資產負債表上的零負債評估額外的非稀釋性資金以實現2025年第一季度的短期盈利能力現金跑道

CONFIDENTIAL bluebird 作為一家獨立的基因療法公司佔有獨特的戰略地位 22 • 基因療法研究已有 10 年以上 • 200 名患者接受了治療 • 8 項臨牀試驗 • LVV 平臺的良好記錄 • 3 次商業化發佈 • 移植和細胞療法基礎設施 • 久經考驗的報銷CL in ic al c om pa ni es Large cap pharm a 製造體驗研發專業知識商業基礎設施
