
1 Avalo治療公司(AVTX)Avalo收購抗IL-1β單抗並宣佈2024年3月進行高達1.85億美元的私人配售展覽99.2

2本陳述可包括根據1995年《私人證券訴訟改革法》所作的前瞻性陳述。前瞻性陳述是指非歷史事實的陳述。此類前瞻性陳述會受到重大風險和不確定性的影響,這些風險和不確定性可能會因各種因素而發生變化(其中許多因素不在Avalo的控制範圍之內),這可能會導致實際結果與前瞻性陳述不同。此類陳述可包括但不限於,與Avalo的計劃、目標、預測、期望和意圖有關的陳述,以及由以下詞語標識的其他陳述:“項目”、“可能”、“可能”、“將”、“應該”、“繼續”、“尋求”、“目標”、“預測”、“相信”、“預期”、“預期”、“估計”、“打算”、“計劃,“潛在的”或類似的表述(包括用在否定中),或通過對未來事項的討論,例如:滿足與私募有關的慣常成交條件;這些風險包括但不限於私募所得資金的預期用途;AVTX-009與我們業務的整合;藥物開發成本、試驗結果的公佈時間以及其他風險,包括對研究人員的依賴和患者在臨牀試驗中的招募;對關鍵人員的依賴;監管風險;總體經濟和市場風險及不確定性,包括那些導致烏克蘭和中東戰爭的風險;以及Avalo在提交給美國證券交易委員會的文件中詳細描述的其他風險,這些文件可在www.sec.gov上查閲。實際結果可能與前瞻性陳述中陳述的結果不同。除適用法律另有要求外,Avalo明確表示不承擔任何義務或承諾公開發布本文中包含的任何前瞻性陳述的任何更新或修訂,以反映Avalo對此的預期的任何變化,或任何陳述所基於的事件、條件或情況的任何變化。前瞻性陳述
3支經驗豐富的團隊,在晚期免疫學開發方面有良好的業績記錄納斯達克上市:AVTX私人公司主要由第二階段就緒的抗IL-1β單抗和相關資產組成降低了MOA的風險目標適應症AlmataBio公司在治療炎症的生物製藥方面的領先企業,重點是AVTX-009(抗IL-1β單抗)紫癜性汗腺炎2026年上市結果:AVTX在收購AVTX-009的同時,Avalo宣佈進行高達1.85億美元的管道融資,提供進入2027年的現金跑道Avalo治療公司和AlmataBio公司:一項適合推動長期增長的強大戰略

4個化合物適應症PreClin P1 P2 P3預期里程碑AVTX-009抗IL-1β單抗化膿性汗腺炎(HS)P2 TOPLINE結果2026年自身免疫適應症待定下一代IL-1β(延長半衰期)--待定Quisvalimab AVTX-002,抗光單抗--戰略審查AVTX-008BTLA激動劑融合蛋白--戰略審查Avalo治療流水線

5·在HS中實現最佳疾病特徵的可能性-高效和有利的半衰期可能允許在其他自身免疫性疾病中改善療效和方便的給藥潛力·支持IL-1β在HS中的關鍵臨牀證據-在一項大型、控制良好的第二階段試驗(NCT05139602)中,lutikizumab在HS中驗證了IL-1β靶向。儘管患者更嚴重,但療效與其他HS療法相當1-臨牀證據表明,抗IL-1α療法在HS2中無效。3-MAS825(IL-1β/IL-18雙特異性)在第二階段隨機對照研究(NCT03827798)中顯示陽性結果(NCT03827798)4-單特異性IL-1β抑制作用可能優於針對未經驗證的靶點(IL-18)或已知對療效無貢獻的雙特異性藥物(IL-1α)-我們認為AVTX-009在HS中成功的可能性很高·HS有望成為數十億美元的市場·HS Topline結果預計將在2026年實現現金跑道進入2027年執行摘要和發展時間表1.金寶AB,等人的研究。介紹地點:美國皮膚病學會;2024年3月8日至12日;加利福尼亞州聖地亞哥。更新日期:2023年11月13日。訪問時間為2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308 NCT04019041 3.臨牀試驗.gov標識:NCT04019041.更新日期:2023年7月27日。訪問時間為2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308://4.Kimball AB,et al.發表於:美國皮膚病學會;2024年3月8日至12日;加利福尼亞州聖地亞哥

在製藥和生物技術領域擁有60年的成功領導、產品開發和商業化經驗,醫學博士首席執行官、董事會主席Garry A.Neil、項目管理、企業基礎設施、臨牀運營Colleen Matkowski高級副總裁、全球監管事務、質量保證Dino C.Miano、博士高級副總裁、CMC、技術運營首席財務官Chris Sullivan經驗豐富的管理團隊
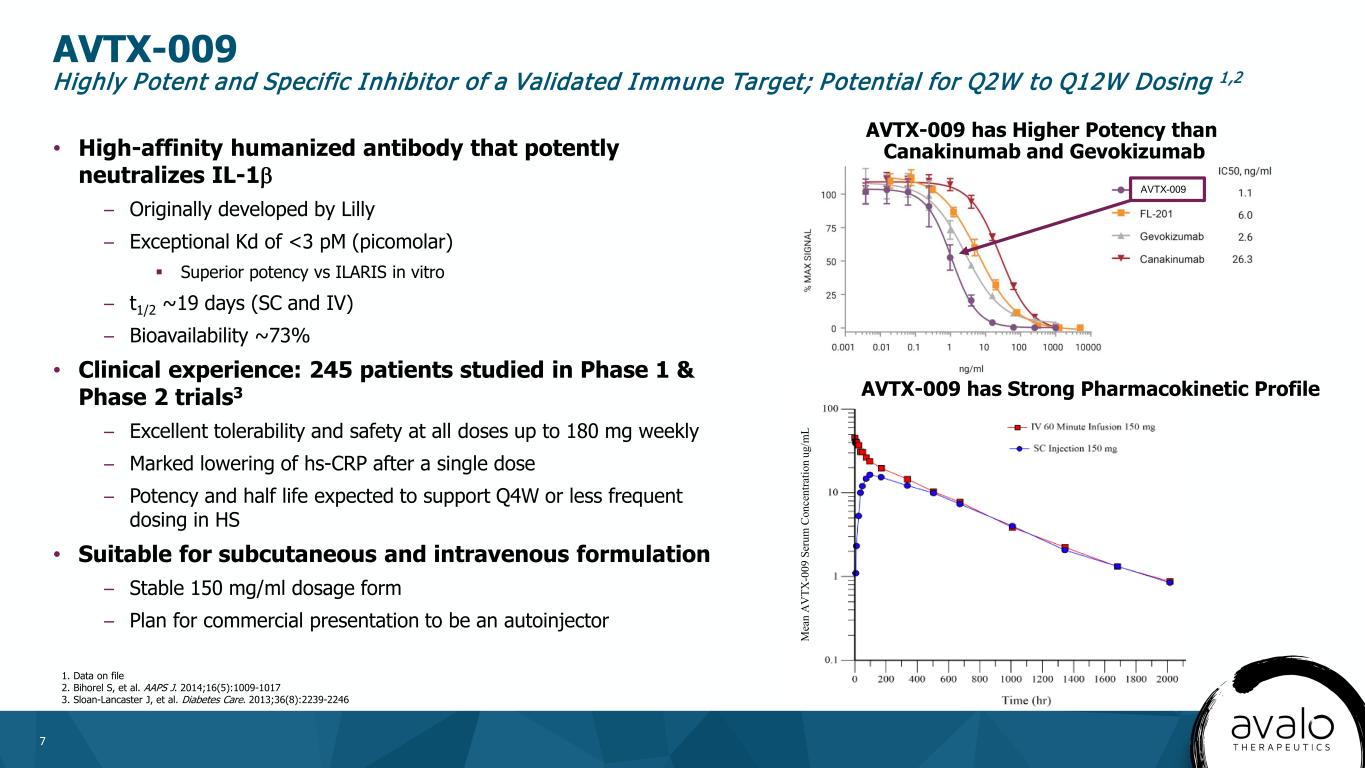
7·高親和力人源化抗體,可有效中和IL-1β-最初由禮來公司開發-例外KD
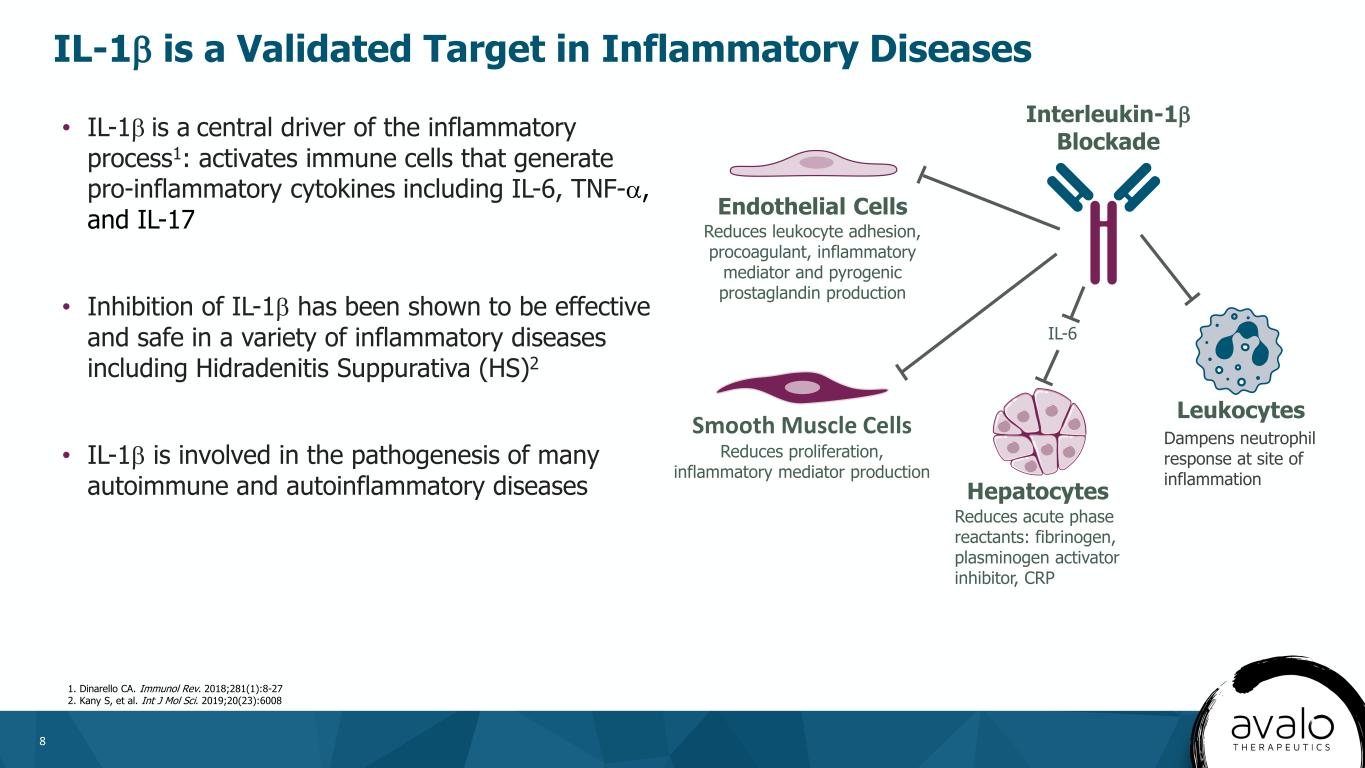
8·IL-1β是炎症過程的中心驅動力1:激活產生包括IL-6、腫瘤壞死因子-α和IL-17在內的致炎細胞因子的免疫細胞·抑制IL-1β已被證明在包括化膿性汗腺炎(HS)在內的多種炎症性疾病中有效和安全2·IL-1β參與許多自身免疫性和自身炎症性疾病的發病機制白介素1β阻斷內皮細胞減少白細胞黏附、促凝劑、炎症介質和熱原前列腺素產生平滑肌細胞減少增殖,炎症介質產生肝細胞減少急性期反應物:纖維蛋白原、纖溶酶原激活物抑制物、C反應蛋白、白細胞IL-1。《免疫雜誌》2018年版;281(1):8-27。2.加尼·S等。INT J MOL Sci。2019;20(23):6008 IL-1β是炎症性疾病抑制炎症部位中性粒細胞反應的有效靶點

9化膿性汗腺炎(HS)
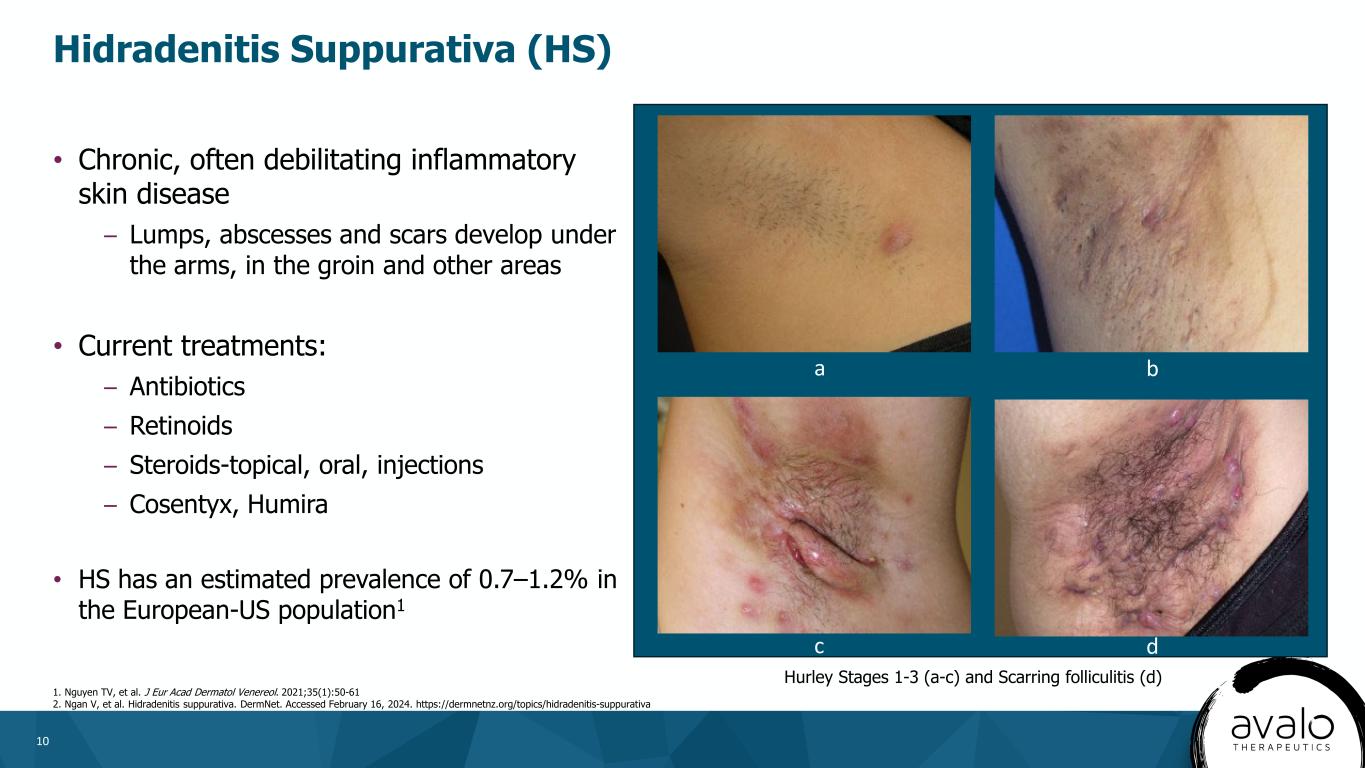
10·慢性、通常使人衰弱的炎症性皮膚病--腋下、腹股溝和其他部位形成腫塊、膿腫和疤痕·目前的治療方法:-抗生素-維甲酸-類固醇-外用、口服、注射-Cosentyx,Humira·HS在歐美人羣中的患病率估計為0.7-1.2%。1化膿性汗腺炎(HS)1.Nguyen TV等人。J EUR阿卡德皮膚醇和維那醇。2021;35(1):50-61 2.顏維等.化膿性汗管炎。DermNet。訪問時間為2024年2月16日。Https://dermnetnz.org/topics/hidradenitis-suppurativa-Hurley分期1-3(a-c)和瘢痕性毛囊炎(D)c d a b

11·HS的炎性下跌是由各種外界刺激-吸煙、生物失調或機械應激-觸發的·IL-1β是導致毛囊皮脂單位破壞的炎性下跌的關鍵驅動因素-皮損中IL-1β水平升高4-抗IL-1藥物的臨牀療效觀察IL-1β與HS1的病理生理學密切相關1.Calabrese L,等。生物分子。2024年;14(2):175 2.沃森ARJV等人。J·維斯特·皮馬託。2020;140(7):1463-1466.e2 3.Kelly G等人BrJ皮馬託爾。2015;173(6):1431-1439 4.Marzano AV,et al.皮膚科。2022;238(5):860-869 DAMPS,損傷相關的分子模式分子;DC,樹突狀細胞;IL,白介素性;IL-R,白介素受體;PAMPs,病原體相關的分子模式分子。

12最近HS試驗的生物製品的基線患者特徵Lutik izumab試驗招募了比競爭對手試驗更嚴重的患者1.Kimball AB等人。N Engl J Med.2016;375:422-34;2.Kimball AB等人。柳葉刀。2023年3月17日至21日在洛杉磯新奧爾良的美國皮膚病學會和2023年10月11日至14日在德國柏林的歐洲皮膚病和性病學學會的演講4.研發演示-結果米拉試驗2023年6月26日https://ir.moonlaketx.com/static-files/86c71a51-5836-4f1c-9a2c-45e440a50d75 5.在美國皮膚病學會(AAD 2024年)上的演講,2024年3月8日至12日,加利福尼亞州聖地亞哥,患者特徵adalimumab Pioneer I/II1 secukinumab陽光/SUNEISE2 bimekizumab BIRA4 lutikizumab NCT051396025年齡(年),平均34.9-37.8 35.5-37.3 36.7/36.6 37.6 37.0-39.5性別,女性,%59.5-69.3 54-57 63.0/50.7 53.8-67.6種族,白人,%75.8-87.7 74-81 77.8/81.5 85.0 64.9-88.9 BMI,公斤/平方米,平均31.3-34.5 31.4-32.8 33.8/32.3 33.7 33.0-34.1吸煙,目前為52.9-67.3 50-58 43.0/48.1 46.6 24.3-46.2年,平均8.8-9.9 6.6-8.2 9.0/7.0 8.5 10.0-13.2個病灶,平均計數-DT10.7-14.4 3.0-4.6 12.6-13.9 3.2-3.6 16/16.5 3.8/3.4 14.0 3.5 11.4-17.0 5.7-8.7 Hurley分期,%-I-II-III 052.3-54.6 45.4-47.7 2-6 51-60 28-46 050.3/61.1 49.7/38.9 063.7 36.3 25.6-35.1 64.9-74.4以前的生物使用,%0 20-26 25.0/13.2 17.5 100腫瘤壞死因子失敗進入標準
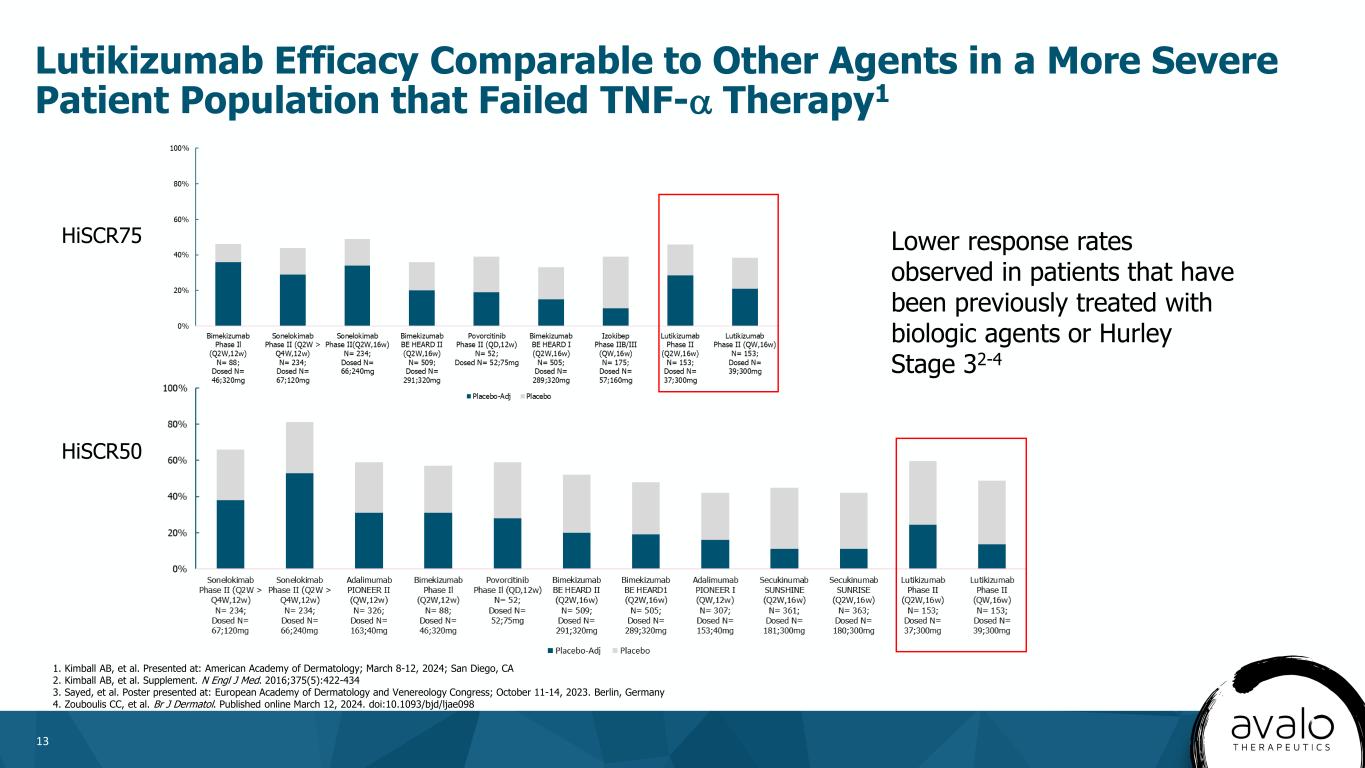
13 Lutikizumab在腫瘤壞死因子-α治療失敗的更嚴重的患者羣體中的療效與其他藥物相當1 HiSCR75在以前接受過生物藥物或Hurley分期32-4 1的患者中觀察到的應答率較低。發表於:美國皮膚病學會;2024年3月8日至12日;加利福尼亞州聖地亞哥。副刊。N Engl J Med.2016;375(5):422-434海報出現在:歐洲皮膚病和性病學學會大會上;2023年10月11日至14日。德國柏林4.Zouboulis CC等人BrJ皮馬託爾。2024年3月12日在線發佈。DOI:10.1093/bjd/ljae098 HiSCR50
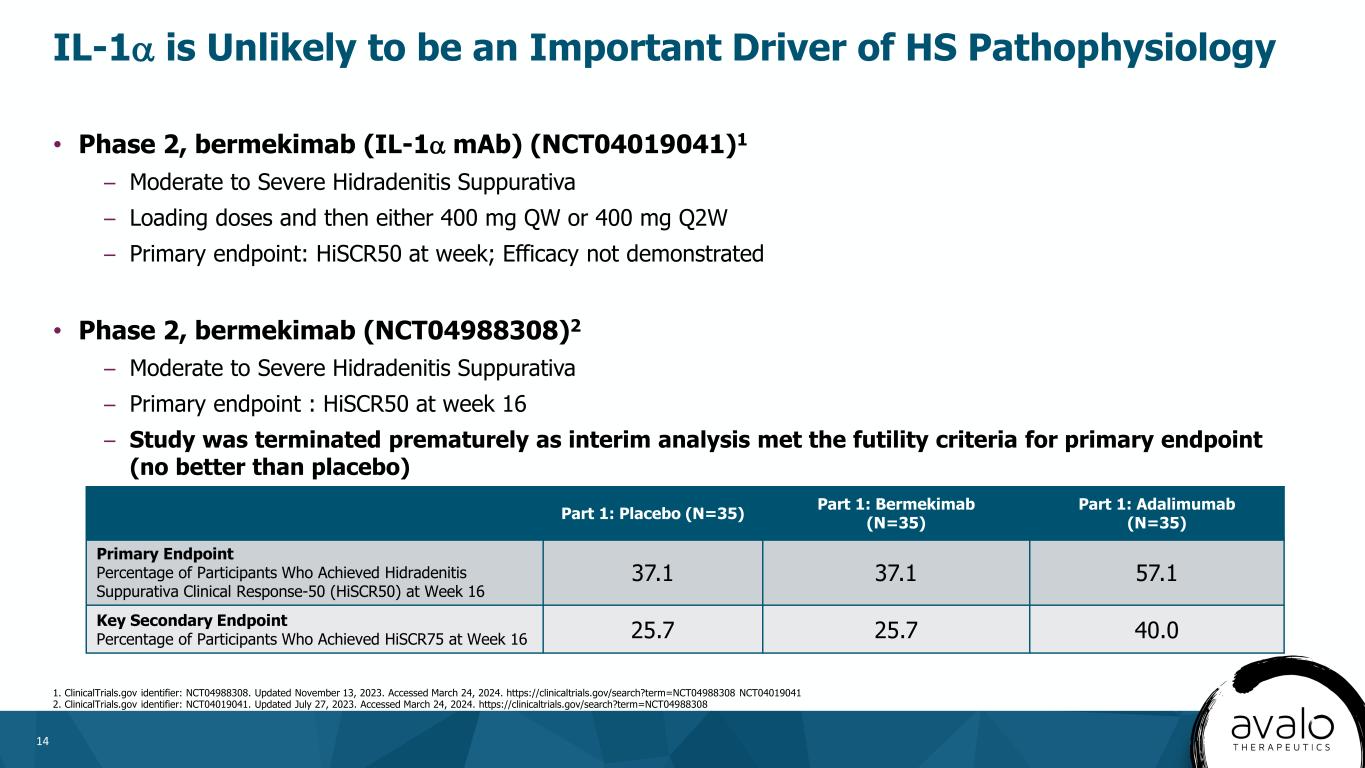
14·第二階段,Bermekimab(IL-1α單抗)(NCT04019041)1-中至重度化膿性汗腺炎負荷劑量,然後400mgQW或400mgQ2W-主要終點:每週HSCR50;未證明療效·2期,bermekimab(NCT04988308)2-中重度化膿性汗腺炎-主要終點:HSCR50在第16周-研究過早終止,因為中期分析滿足主要終點的無效標準(不比安慰劑好)IL-1α不太可能是HS病理生理學HSCR1的重要驅動因素1。更新日期:2023年11月13日。訪問時間為2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308 NCT04019041 2.臨牀試驗.gov標識:NCT04019041.更新日期:2023年7月27日。訪問時間為2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308://第1部分:安慰劑(N=35)第1部分:Bermekimab(N=35)第1部分:Adalimumab(N=35)在第16周達到化膿性汗腺炎臨牀反應-50(HiSCR50)的參與者的主要終點百分比在第16周達到HiSCR75的參與者百分比37.1 37.1 57.1在第16周達到HiSCR75的參與者百分比25.7 25.7 40.0
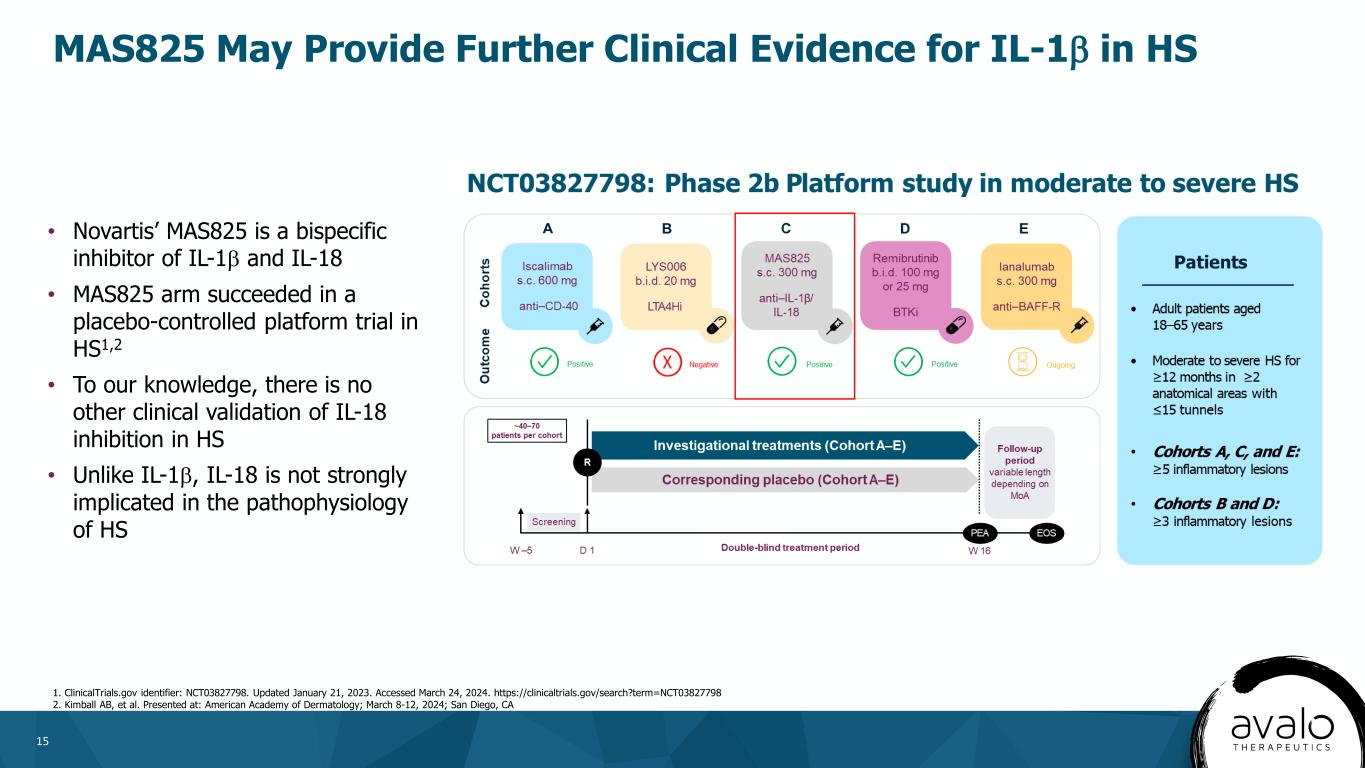
15MAS825可能為IL-1β在HS 1中的臨牀應用提供進一步的證據。更新日期:2023年1月21日。訪問時間為2024年3月24日。Https://clinicaltrials.gov/search?term=NCT03827798 2.金博爾AB等人。諾華公司的MAS825是一種IL-1β和IL-18的雙特異性抑制劑·MAS825 ARM成功地在HS1中進行了安慰劑對照平臺試驗2·據我們所知,在HS中沒有其他臨牀驗證對IL-18的抑制作用·與IL-1β不同,IL-18與HS的病理生理學關係不大

16·估計28%的HS病例為Hurley 2期,另外4%為Hurley 34期·有大量患者明顯需要改進治療方案1.Biotech Value Advisors LLC的獨立市場分析2.Nguyen TV等人。J EUR阿卡德皮膚醇和維那醇。2021;35(1):50-61 3.Garg A等人JAMA皮膚醇。2017年;153(8):760-764 4.截止日期2/15/24·據估計,美國有0.7-1.2%的人患有HS,儘管一些估計高達2-4%2潛在的潛在市場·HS似乎被低估和報告,健康記錄中報告的病例估計佔美國人口的0.1%3·我們認為,要獲得最佳結果,量身定製的治療將需要獲得多種療法,以滿足HS的多個目標大型未滿足的需求全球HS市場具有數十億美元的銷售潛力幾個已獲批准的產品的贊助商預計年銷售額為1.5-3B1 HS影響美國約240-400萬人~105,000赫爾利階段2/3~330,000人已被診斷為HS

17個關鍵次級/探索性終點AVTX-009治療化膿性汗腺炎參與者的有效性和安全性關鍵次級終點:·HiSCR50、HiSCR90和HiSCR100·安全性和耐受性·PK探索性終點:·生物標記物--CRP、IL-6,潛在的其他生物標記物·臨牀診斷化膿性汗腺炎(HS)至少在基線前一年,由研究人員確定。·基線時總膿腫和炎性結節(AN)計數>5·HS病變必須至少存在於兩個不同的解剖區域。·必須針對HS關鍵納入標準的抗腫瘤壞死因子治療失敗隨機化n=~165分(1:1:1)16w主要終點(HiSCR75)AVTX-009 300毫克SC Q4W安慰劑主要研究終點主要終點:在16周內獲得汗腺炎化膿性臨牀反應的參與者百分比HiSCR75建議化膿性汗腺炎(HS)第二階段研究安全隨訪3個月開放標籤延長響應者AVTX-009 150 mg SC Q2W Lo in g D OS 600 mg 300 mg PBO試驗有80%的能力顯示每個單獨手臂的HiSCR75反應(基於Lukizumab階段2 HiSCR75)

18個潛在的附加適應症

19·IL-1β在炎症性疾病中發揮核心作用-IL-1β是炎症性小體激活產生的關鍵細胞因子-調節的炎症性小體激活異常參與了克羅恩病(CD)的發病機制·IL-1驅動的間質-中性粒細胞相互作用定義了對當前治療無效的患者子集2,3·觀察到IBD患者和HS4,5患者的重疊IL-1β在IBD中的作用://doi.org/10.3389/fimmu.2018.02566 1.毛L,等。前置免疫系統。2018年;9:2566 2.弗里德里希·M等人。奈特·梅德。2021年;27(11):1970-1981。3.卡德爾·MZ,卡澤·A·納特·梅德。2021年;27(11):1870-1871年4.陳衞東,遲浩田。JAMA皮膚醇。2019;155(9):1022-1027 5.張明等。世界J臨牀病例。2021;9(15):3506-3516

20·炎症性腸病治療的目標是緩解--目前的治療方法只有一小部分炎症性腸病患者獲得緩解·AbbVie計劃評估lutikizumab,雙變構域白細胞介素1α/1β拮抗劑作為UC的單一療法,並與克羅恩的SKYRIZI聯合治療--…我們相信lutikizumab具有聯合使用的潛力,以提供轉化水平的IBD療效。我們計劃評估Lutikizumab和Skyrizi…的組合方法我們對炎症性腸病的第二階段研究預計將於今年晚些時候開始。“--羅帕爾·塔卡爾,全球治療公司首席醫療官高級副總裁--來自AbbVie 4Q23收益電話會議記錄·將抗IL-1β作為單一療法和最近啟動的IL-1炎症性腸病試驗相結合,有機會提高IBD患者的療效

21執行摘要

22·在HS中實現最佳疾病特徵的可能性-高效和有利的半衰期可能允許在其他自身免疫性疾病中改善療效和方便的給藥潛力·支持IL-1β在HS中的關鍵臨牀證據-在一項大型、控制良好的第二階段試驗(NCT05139602)中,lutikizumab在HS中驗證了IL-1β靶向。儘管患者更嚴重,但療效與其他HS療法相當1-臨牀證據表明,抗IL-1α療法在HS2中無效。3-MAS825(IL-1β/IL-18雙特異性)在第二階段隨機對照研究(NCT03827798)中顯示陽性結果(NCT03827798)4-單特異性IL-1β抑制作用可能優於針對未經驗證的靶點(IL-18)或已知對療效無貢獻的雙特異性藥物(IL-1α)-我們認為AVTX-009在HS中成功的可能性很高·HS有望成為數十億美元的市場·HS Topline結果預計將在2026年實現現金跑道進入2027年執行摘要和發展時間表1.金寶AB,等人的研究。介紹地點:美國皮膚病學會;2024年3月8日至12日;加利福尼亞州聖地亞哥。更新日期:2023年11月13日。訪問時間為2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308 NCT04019041 3.臨牀試驗.gov標識:NCT04019041.更新日期:2023年7月27日。訪問時間為2024年3月24日。Https://clinicaltrials.gov/search?term=NCT04988308://4.Kimball AB,et al.發表於:美國皮膚病學會;2024年3月8日至12日;加利福尼亞州聖地亞哥

23附錄

24·2024年3月,Avalo進行了一項私募融資:·總收益高達1.85億美元,交易結束時初始資金為1.156億美元·預計交易結束時淨收益約為1.05億美元,預計將為2027年提供現金通道·預計將於2024年3月28日完成·在折算基礎上,計入收購AlmataBio,Inc.和融資(不包括行使1200萬份認股權證)後,Avalo已發行普通股的總數量約為2340萬股·以下數據是截至12月31日的數據:2023年,不包括上述交易:·現金及現金等價物-740萬美元·普通股流通股-80萬股·完全稀釋股份-80萬納斯達克:AVTX金融及投資者信息1包括1.156億美元的預付資金,以及在充分行使已發行認股權證時將收到的6940萬美元。認股權證可按每股普通股約5.8美元的價格行使,並可行使普通股或同等金額(轉換為普通股)的無投票權可轉換優先股,如果達到適用於每個持有人的某些實益所有權限制,則可行使認股權證,直至發行起五年前或在AVTX-009治療化膿性汗腺炎的第二階段試驗中首次用藥的公開宣佈後30天為止。2淨收益包括私募融資和收購AlmataBio,Inc.的估計交易成本。估計交易成本不包括在私募融資結束時應向前AlmataBio股東支付的750萬美元里程碑付款。

25納斯達克:AVTX www.avalotx.com