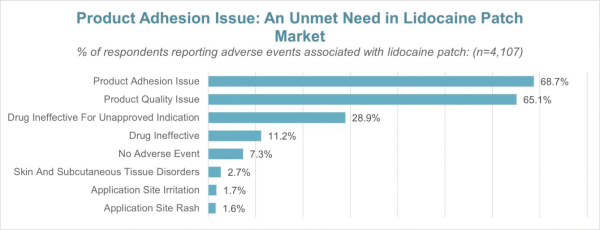
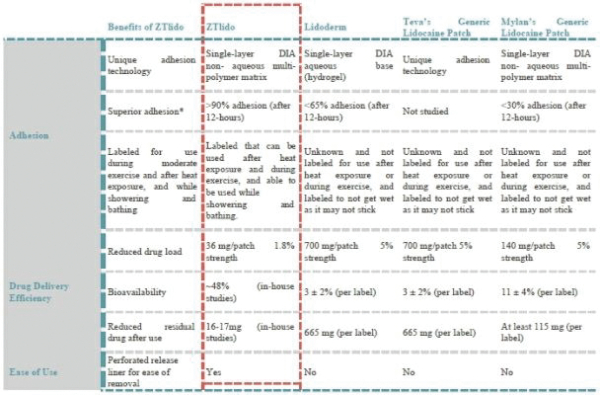
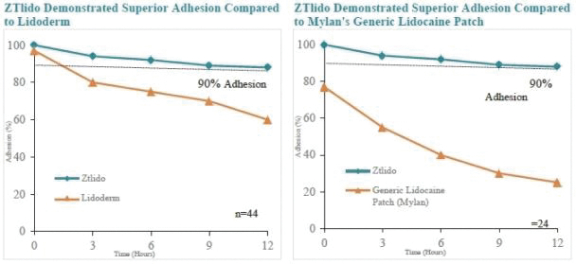
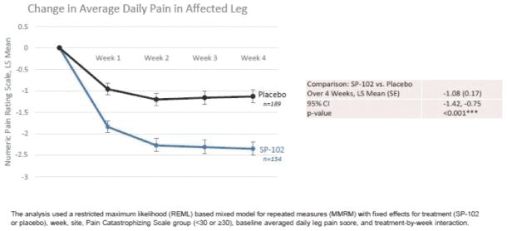
這份初步招股説明書中的信息不完整,可能會被更改。在提交給美國證券交易委員會的註冊聲明生效之前,這些證券不得出售。這份初步招股説明書不是出售這些證券的要約,也不是在任何不允許要約或出售的司法管轄區徵求購買這些證券的要約。
初步-有待完成,日期為2024年3月27日
初步招股説明書
SCILEX控股公司
最多69,738,977股普通股
最多10,958,309股可在行使認股權證時發行的普通股
最多5,402,955份認股權證
本招股説明書涉及吾等發行合共10,958,309股本公司普通股,每股面值0.0001美元(“普通股”),可在行使(I)4,104,000份私募認股權證(“私募認股權證”)後發行,該認股權證最初以私募方式出售,每份認股權證的價格為0.75美元,與Vickers Vantage Corp.I(“Vickers”)的首次公開發行相關(其中一部分隨後轉讓給Sorrento Treeutics,(Ii)原來出售予公眾投資者的6,854,309份公開認股權證(“公開認股權證”),與維克斯的單位(“公開認股權證”及連同私人認股權證,簡稱“認股權證”)的首次公開發售有關,價格為每單位10.00元,每單位由一股維克斯的普通股及一半一份認股權證購買一股維克斯的普通股。正如我們之前在2023年10月6日提交給美國證券交易委員會的招股説明書補充文件中披露的那樣,索倫託隨後出售了(A)60,068,585股普通股;(B)29,057,097股A系列優先股;及(C)可行使4,490,617股普通股的認股權證,在每種情況下,可行使的認股權證均交付給SCLX Stock Acquisition JV LLC、德克薩斯州一家有限責任公司(“SCLX JV”)和我們的間接全資子公司,其中可行使普通股4,000,000股的認股權證隨後由SCLX JV轉讓給特拉華州Oramed製藥公司(“Oramed”)。
每份認股權證的持有人有權以每股11.50美元的價格購買一股我們的普通股。吾等將不會收到本協議項下私募認股權證股份或公開認股權證股份轉售所得的收益,但我們將收取行使私募認股權證及公開認股權證所得的收益。
本招股説明書還涉及通過以下方式不時進行的要約和出售:
(A)本招股説明書所指名的出售股東(包括其獲準受讓人、受讓人、質權人及其他利益繼承人)(統稱為“出售股東”)持有本公司普通股共計69,738,977股(“轉售股份”),包括:
(I)由Vickers Venture Fund VI Pte Ltd、Vickers Venture Fund VI(Plan)Pte Ltd和Suneel Kaji(統稱為“發起人”)持有的最多2,350,227股普通股(“發起人”),包括於2022年11月9日轉換後發行的相同數量的前普通股(發起人在Vickers Vantage Corp.I的單位首次公開發行前以每股普通股0.007美元的收購價收購)以及同樣於11月9日發行的股份,2022年根據債務出資協議,Vickers Venture Fund VI Pte Ltd和Vickers Venture Fund VI(Plan)Pte Ltd以每股10.00美元的出資價值與業務合併相關的某些債務出資;
(Ii)於2022年11月10日就業務合併向索倫託發行最多61,985,795股普通股(“合併股份”),股權代價價值為每股10.00美元,其中約60,068,585股由SCLX合資公司持有,1,917,210股由索倫託暫停持有,以供某些認股權證持有人購買索倫託普通股;
(Iii)在行使私募認股權證時最多可發行4,016,338股私募認股權證,行使價為每股11.50元;及
(Iv)最多1,386,617股可於行使公開認股權證時發行的公共認股權證,行使價為每股11.50元;及
(B)本招股説明書所指名的售賣認股權證持有人(包括其獲準受讓人、受讓人、質權人及其他利益繼承人)(統稱為“賣出認股權證持有人”及“賣出證券持有人”)最多4,016,338份私募認股權證(最初發行價格為每份私募認股權證0.75美元,其中約3,104,000份已由保薦人免費轉讓予索倫託,與業務合併有關),以及1,386,617份公開認股權證(由索倫託在公開市場購買中購入,加權平均收購價為每份公開認股權證0.3078美元)。索倫託隨後將其持有的4,490,617份認股權證轉讓給SCLX合資公司,其中4,000,000份權證隨後由SCLX合資公司轉讓給Oramed。
於2022年11月10日,吾等根據日期為2022年3月17日的若干合併協議及計劃(經不時修訂、重述或補充,包括日期為2022年9月12日的合併協議及計劃第1號修正案)(“合併協議”)完成先前公佈的業務合併(“業務合併”),由吾等、吾等當時的全資附屬公司Vantage Merger Sub Inc.(“合併附屬公司”)及開業前聯合Scilex控股公司(“Legacy Scilex”)。我們正在登記,根據Vickers Vantage Corp.I(現稱Scilex Holding Company)與大陸股票轉讓信託公司(Continental Stock Transfer&Trust Company)之間的認股權證協議(日期為2021年1月6日)的條款,我們在行使公共認股權證時發行最多6,854,309股普通股,作為管理公共認股權證的權證代理。吾等亦登記保薦人股份、合併股份、私募認股權證股份及私募認股權證於2022年11月10日由吾等、保薦人及若干其他股東訂立的若干經修訂及重訂的註冊權協議(“註冊權協議”)所規定的轉售事項。