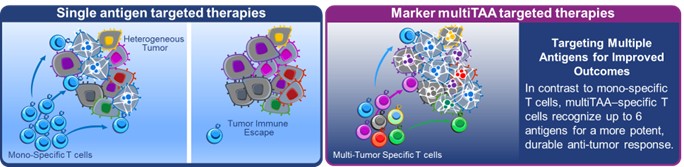
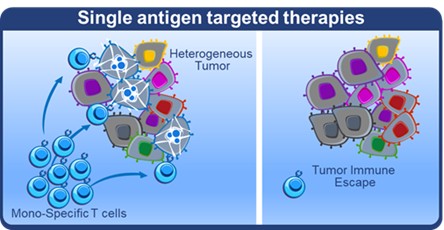
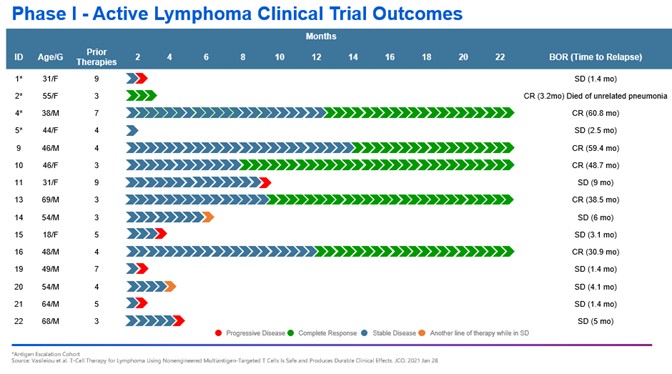
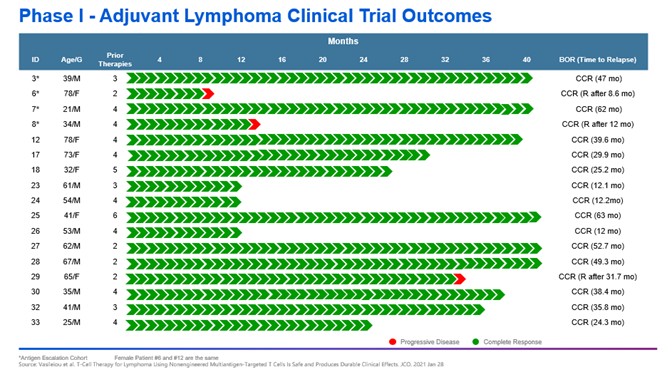
目錄表
美國
美國證券交易委員會
華盛頓特區,20549
表格:
根據1934年《證券交易法》第13或15(D)條提交的年度報告 | |
截至本財政年度止 | |
或 | |
根據1934年《證券交易法》第13或15(D)條提交的過渡報告 | |
從_的過渡期。 | |
委託文件編號:

(註冊人的確切姓名載於其章程)
| ||
(註冊成立的國家或其他司法管轄區) | (税務局僱主身分證號碼) | |
(主要執行辦公室地址) | (郵政編碼) |
(
(電話號碼)
4551 Kennedy Commerce Drive,休斯敦,德克薩斯州,77032 |
(前姓名、前地址和前財政年度,如果自上次報告以來發生變化) |
根據該法第12(B)款登記的證券:
每個班級的標題 |
| 交易代碼 |
| 註冊的每個交易所的名稱 |
這個 |
根據該法第12(G)款登記的證券:無
用複選標記表示註冊人是否為證券法規則第405條所定義的知名經驗豐富的發行人。是☐
如果註冊人不需要根據該法第15(D)節第13節提交報告,請用複選標記表示。是☐
用複選標記表示註冊人(1)是否在過去12個月內(或註冊人被要求提交此類報告的較短期限內)提交了1934年《證券交易法》第13節或15(D)節要求提交的所有報告,以及(2)在過去90天內是否符合此類提交要求。
用複選標記表示註冊人是否已在過去12個月內(或在註冊人被要求提交此類文件的較短時間內)以電子方式提交了根據S-T規則第405條(本章232.405節)要求提交的每個交互數據文件。
通過複選標記來確定註冊人是否是大型加速申報人、加速申報人、非加速申報人、小型申報公司或新興成長型公司。參見《交易法》規則12b—2中的“大型加速申報人”、“加速申報人”、“小型申報公司”和“新興增長公司”的定義。
大型加速文件服務器 | ☐ | 加速文件管理器 | ☐ |
☒ | 規模較小的報告公司 | ||
| 新興成長型公司 |
如果是一家新興的成長型公司,用複選標記表示註冊人是否已選擇不使用延長的過渡期來遵守根據交易所法案第13(A)節提供的任何新的或修訂的財務會計準則。☐
用複選標記表示註冊人是否提交了一份報告,證明其管理層根據《薩班斯-奧克斯利法案》(《美國聯邦法典》第15編,第7262(B)節)第404(B)條對其財務報告的內部控制的有效性進行了評估,該評估是由編制或發佈其審計報告的註冊會計師事務所進行的。
如果證券是根據該法第12(B)條登記的,應用複選標記表示登記人的財務報表是否反映了對以前發佈的財務報表的錯誤更正。☐
用複選標記表示這些錯誤更正中是否有任何重述需要對註冊人的任何執行人員在相關恢復期間根據第240.10D-1(B)條收到的基於激勵的補償進行恢復分析。
檢查註冊人是否為空殼公司(如交易法第12b—2條所定義)。是的
截至2023年6月30日(註冊人最近完成的第二財政季度的最後一天),註冊人的非關聯公司持有的有表決權和無表決權普通股的總市值基於納斯達克資本市場截至該日報告的收盤價3.10美元,約為美元。
註冊人有
關於反向股票分割的注意事項
2023年1月26日,我們向特拉華州務卿提交了對我們的經修訂和重述的公司註冊證書的修訂,以實現我們的授權,已發行和流通普通股的反向拆分,比例為1:10。本報告中反映的所有歷史份額和每股金額均已調整,以反映反向股票分割。
引用成立為法團的文件
註冊人關於註冊人2024年股東年會的委託書的部分(“委託書”)將根據第14A條規定在註冊人財政年度結束後120天內提交給美國證券交易委員會,以引用的方式納入本年度報告第三部分的表格10—K。除本10—K表格年報中以引用方式特別納入的信息外,委託聲明書不視為作為本10—K表格年報的一部分提交。