

STK-001 用於治療 Dravet 綜合症 的分析 Stoke Therapeutics 2023 年 7 月 25 日附錄 99.2

議程簡介投資者關係主管 埃裏克·羅哈斯介紹性發言愛德華·凱耶醫學博士、1/2a期中期分析首席執行官巴里·蒂喬,醫學博士,首席醫學官金伯利·帕克森,醫學博士,神經病學臨牀開發主管 閉幕詞 Edward M. Kaye,醫學博士,首席執行官問答(包括斯托克的其他領導層)Ff,首席監管官

前瞻性陳述本 演示文稿由Stoke Therapeutics, Inc.(“Stoke” 或 “我們”)編寫,僅供參考,不用於其他目的。本演示文稿中的任何內容都不是,也不應解釋為主講人或斯托克或Stoke的任何高級職員、董事、員工、代理人或顧問提出的建議、 承諾或陳述。本演示文稿並不旨在包羅萬象,也不包含您可能想要的所有信息。本演示文稿包含 1995 年《私人證券訴訟改革法》中 “安全港” 條款所指的 前瞻性陳述,包括但不限於 STK-001 治療德拉維特綜合徵 的根本原因、減少癲癇發作或在指定劑量水平下或完全改善非發作合併症的能力,以及臨牀試驗、數據讀取和演示的時間和預期進展。包含 “計劃”、“將”、“繼續”、“預期” 或 “持續” 等詞語的陳述以及未來時態陳述均為前瞻性陳述。這些前瞻性陳述涉及風險和不確定性,如 以及假設,如果事實證明不正確或未完全實現,則可能導致我們的結果與此類前瞻性陳述所表達或暗示的結果存在重大差異,包括但不限於風險和不確定性 ,與以下方面相關的風險和不確定性 :我們推進、獲得監管部門批准並最終將其商業化的能力;臨牀前和臨牀試驗的時機和結果;積極的風險臨牀試驗的結果可能不是 在後續試驗中複製或在早期臨牀試驗中取得的成功可能無法預測後期試驗的結果,正在進行的試驗的初步中期數據可能顯示出結果在這些試驗完成後發生變化; 我們為發展活動提供資金和實現發展目標的能力;我們保護其知識產權的能力;以及我們在截至2022年12月31日的10-K 表年度報告中在 “風險因素” 標題下描述的其他風險和不確定性,我們關於10-Q表的季度報告,以及我們不時向美國證券交易委員會提交的其他文件。這些前瞻性陳述僅代表截至本新聞稿發佈之日,斯托克沒有義務修改或更新任何前瞻性陳述以反映本文發佈之日之後的事件或情況。通過參加或接受本次演講,您承認您被警告不要過分依賴這些前瞻性陳述,這些陳述僅代表此類陳述發表之日;您將對自己對市場和我們的市場狀況的評估承擔全部責任;您將進行自己的分析 ,並全權負責形成自己對斯托克未來潛在表現的看法。

介紹性發言 Edward M. Kaye, 醫學博士首席執行官
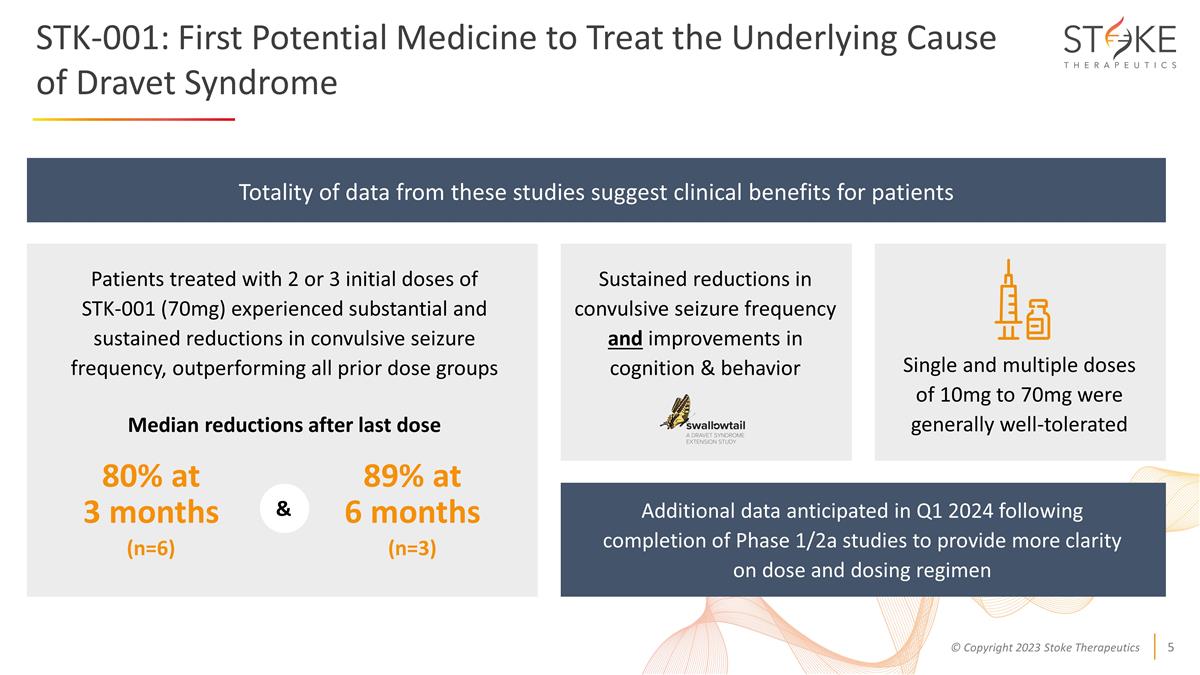
STK-001:第一種 治療 Dravet 綜合徵根本原因的潛在藥物 2 或 3 次 STK-001(70 mg)初始劑量治療的患者驚厥發作頻率大幅持續降低,表現優於之前的所有劑量組 驚厥發作頻率持續降低,認知和行為得到改善這些研究的全部數據表明患者的臨牀益處最後一次劑量和單劑量和多劑量為 10mg 至 70 mg mg 通常 耐受性良好。其他數據預計在2024年第一季度完成1/2a期研究後,將進一步明確劑量和給藥方案,3個月時為80%(n=6),6個月時為89%(n=3)

約 35,000 名 90% 的 Dravet 綜合徵患者的癲癇發作未得到充分控制 85% 的病例中有 85% 的病例由 SCN1A 基因單倍不全引起。在美國、加拿大、日本、德國、法國和英國,受影響的 Dravet 綜合徵兒童和青少年在 成年之前死亡,原因是 SUDEP1、長期發作、發作相關事故或感染 20%。地理區域或族裔羣體 50% 的 Nav1.1 蛋白表達 16,000 名嬰兒中有 1 名出生時患有 Dravet 綜合症,結果是:沒有治療德拉維特綜合徵的疾病改善藥物 1 癲癇突然意外死亡來源:《2018年健康進展報告》;Djémié等人,《分子遺傳學與基因組醫學》,2016年;Lagae等 等,《發育醫學與兒童神經病學》,2017年;Nabbout等人,《孤兒網罕見疾病雜誌》,2013年

我們的目標:綜合徵管理,不是 只是癲癇發作沒有藥物可用於綜合徵管理 STK-001 Dravet 綜合徵臨牀上目前唯一潛在的治療疾病的方法用於控制癲癇的可用藥物:乙酰唑胺苯二氮卓類藥物布里瓦拉西坦 大麻二酚卡馬西平氯巴扎美索昔米非巴酸芬氟拉明拉莫三嗪左旋拉西坦美舒昔米 carbazepine 苯妥英盧非酰胺Stiripentol 丙戊酸託吡酯產品唑尼沙胺多種藥物可用於癲癇發作管理 儘管有這些治療方法,90% 的 Dravet 綜合徵患者的癲癇發作未得到充分控制
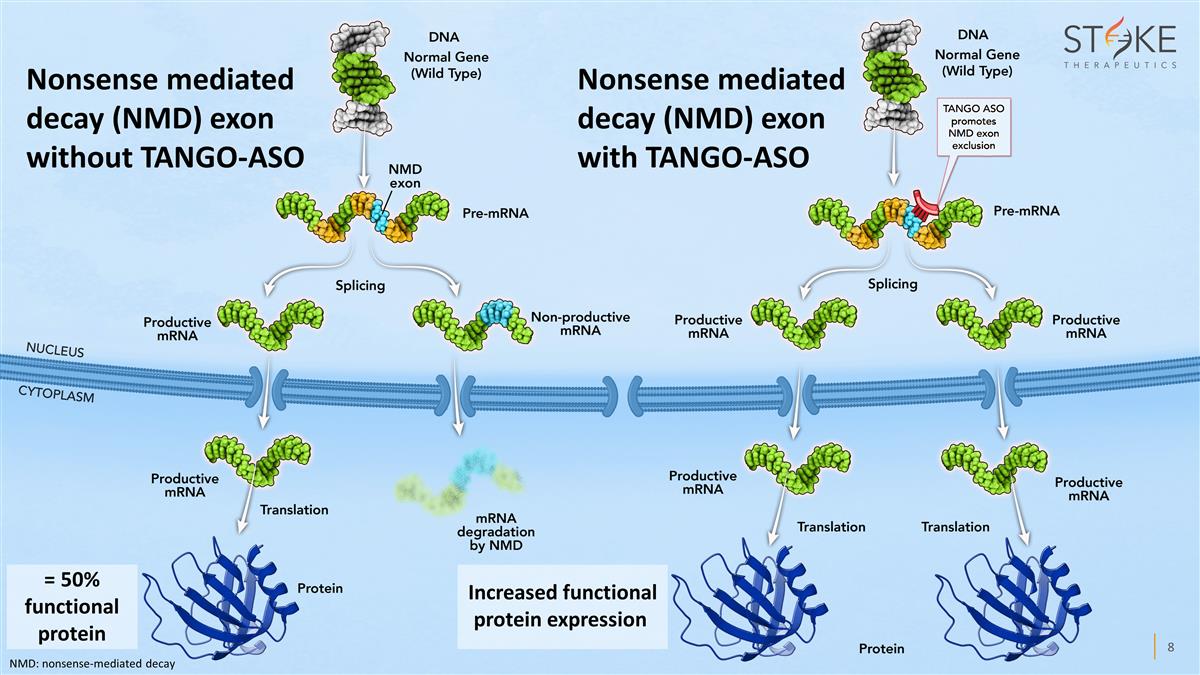
沒有 TANGO-ASO 的廢話介導衰變 (NMD) 外顯子 增加功能蛋白表達含有 TANGO-ASO 的無意義介導衰變 (NMD) 外顯子 = 50% 功能蛋白 NMD:無意義介導的衰變

STK-001 1/2a 期 MONARCH 和 ADMIRAL 研究分析 Barry Ticho,醫學博士,博士首席醫學官

1/2a 階段研究設計:MONARCH (美國)和 ADMIRAL(英國)*對 ADMIRAL 的研究協議進行了修訂,允許研究人員在患者有資格加入 LONGWING OLE 之前,決定在 ADMIRAL 研究中服用兩劑還是三劑 STK-001(70mg)。* SAD MAD

74 名患者 接受 ≥ 1 劑量 STK-001 的患者的人口統計數據截止日期:MONARCH 13APR2023;ADMIRAL 12APR2023 和 21JUN2023 總計,n (%) N 74 在 篩查時的年齡,y 平均值 (SD) 10.2 歲 (5.05) 中位數(2、18)性別女性 39(52.7%)男性 35 (47.7%) 3%) 伴發抗癲癇藥物的數量 ≥3 60 (81.1%) ≥4 37 (50.0%) 伴隨芬氟拉明% 36 (48.6%) 每 28 天的基線驚厥發作頻率中位數(最小、最大)17.5(1,2335)1/2a 階段 MONARCH & ADMIRAL 研究人口統計
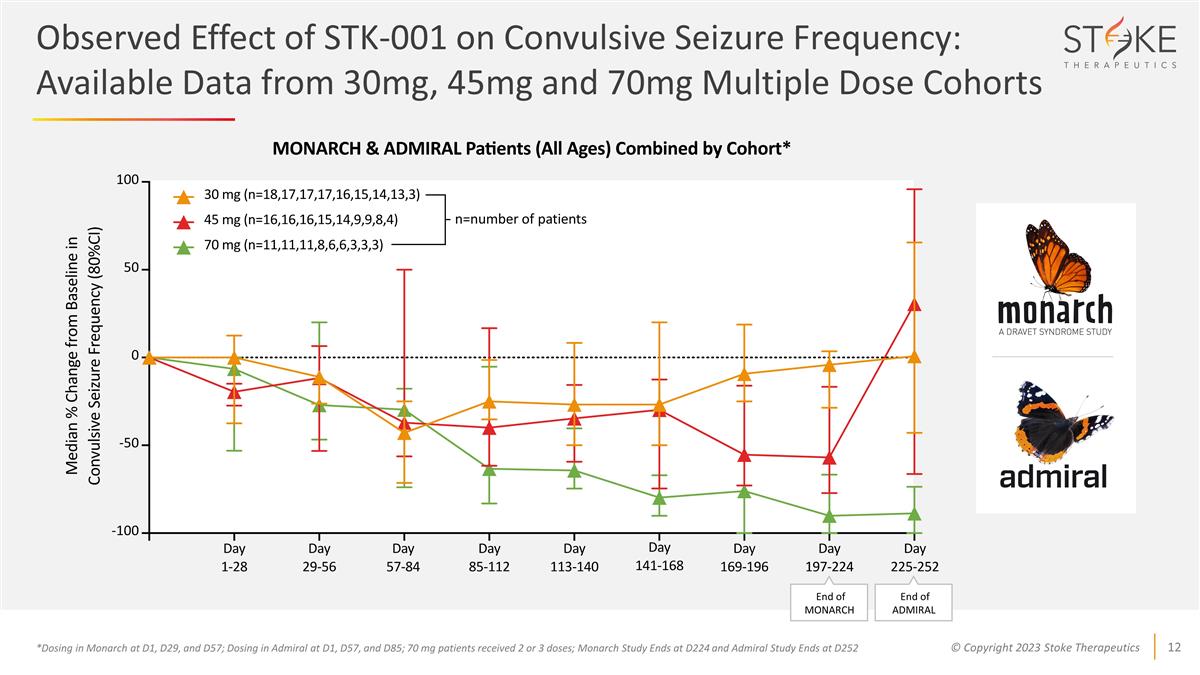
STK-001 對 驚厥發作頻率的觀測影響:來自 30 毫克、45 毫克和 70 毫克多劑量隊列的可用數據 *在 D1、D29 和 D57 時在 Monarch 中給藥;在 D1、D57 和 D85 處給藥;70 mg 患者接受 2 或 3 劑量;Monarch 研究在 D224 結束,Admiral 研究在 D252 n=數量患者君主末日海軍上將的終結
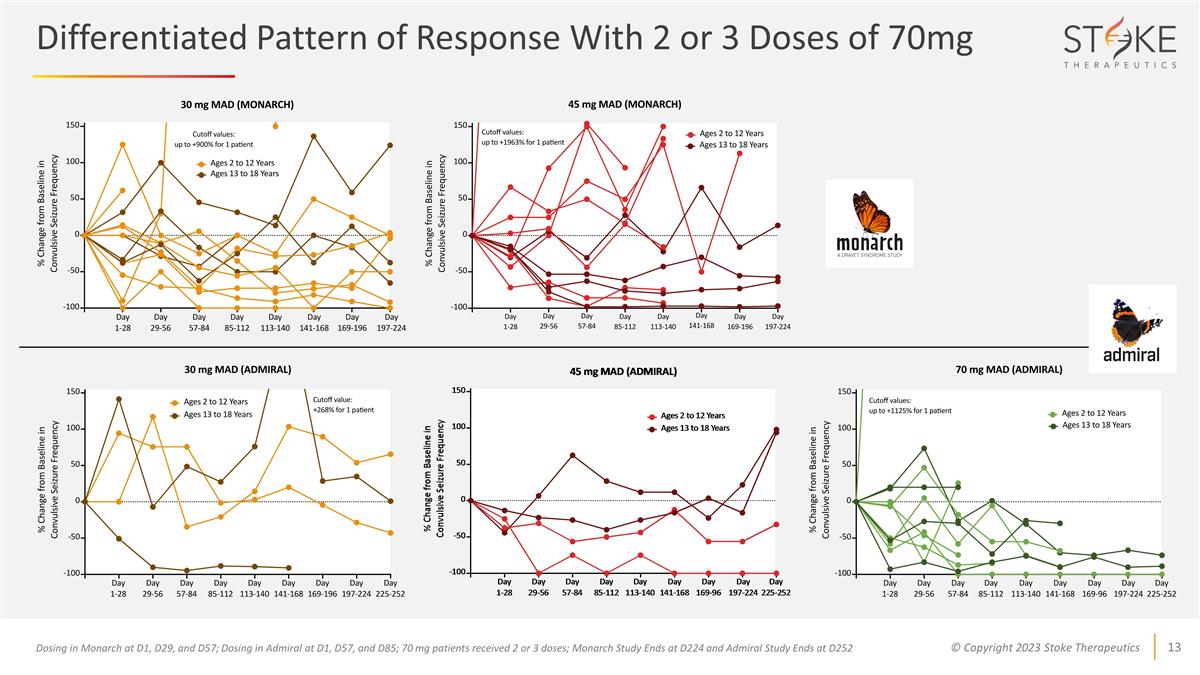
差異化反應模式 在 D1、D29 和 D57 處在 Monarch 中服用 2 或 3 劑量 70 mg;在 D1、D57 和 D85 處給藥 Admiral 給藥;70 mg 患者接受 2 或 3 劑量;Monarch 研究在 D224 結束,Admiral 研究在 D252 結束
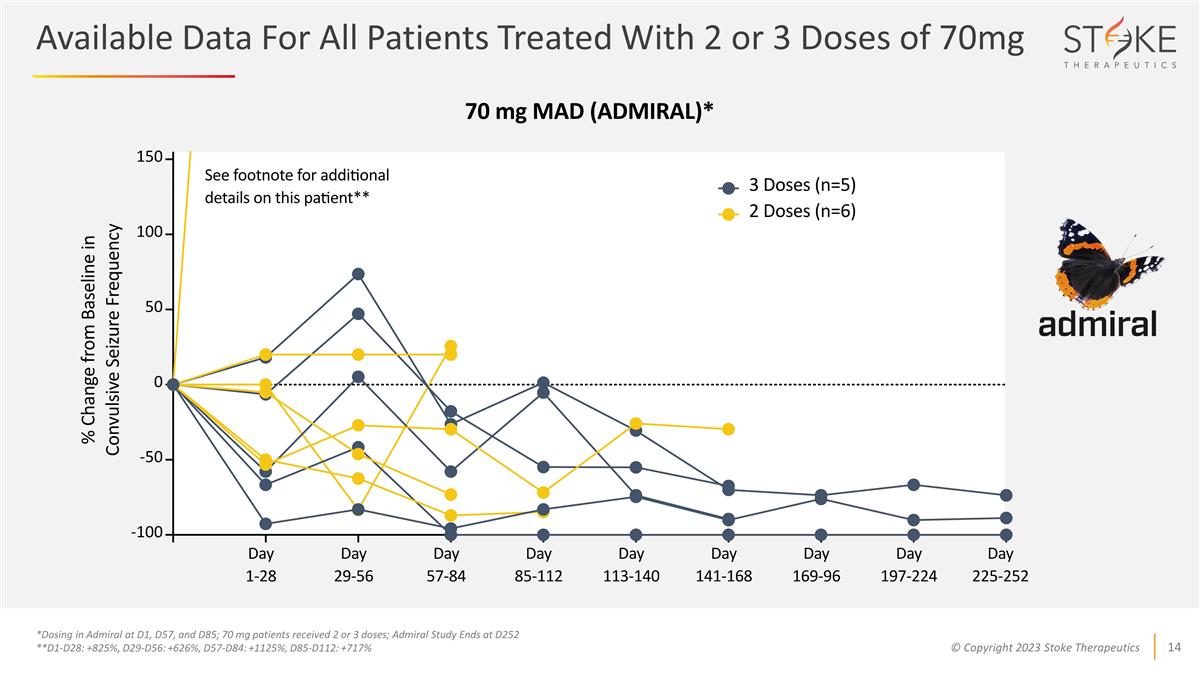
所有患者的可用數據 使用 2 或 3 劑 70 毫克的劑量 *在 D1、D57 和 D85 處在 Admiral 中給藥;70 mg 患者接受 2 或 3 劑;Admiral 研究於 D252 結束 **D1-D28:+825%,D29-D56:+626%,D57-D84:+1125%,D85-D112:+717%
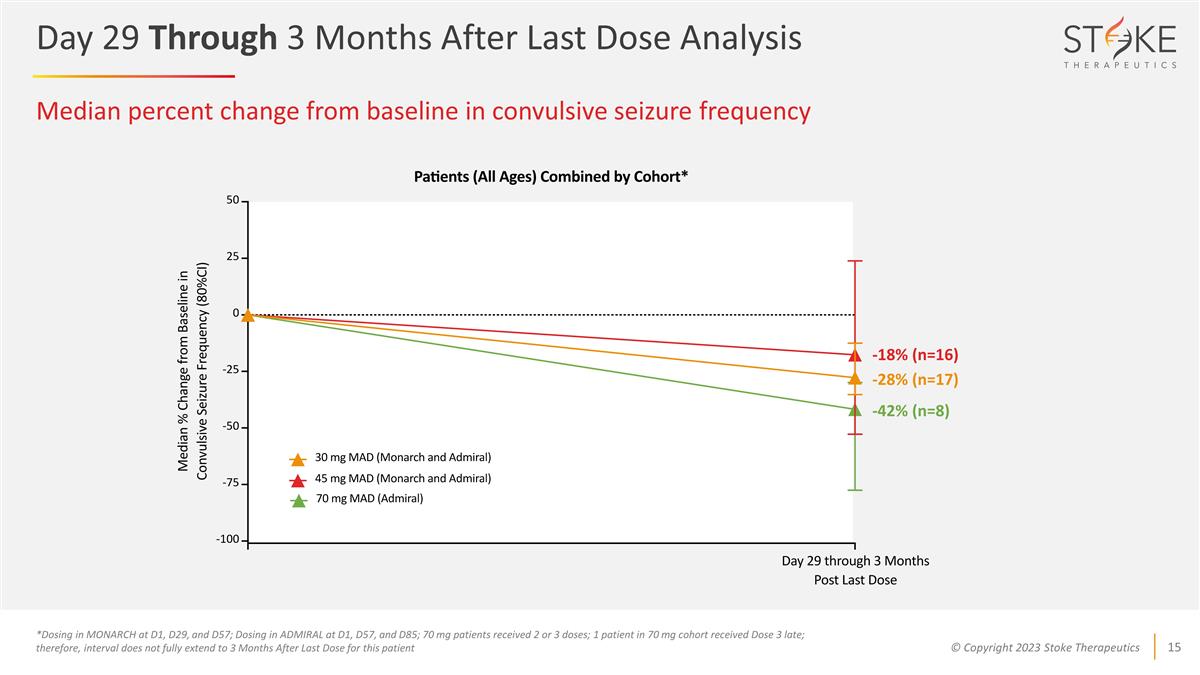
驚厥發作頻率與基線 相比的中位數變化百分比*在D1、D29和D57處給藥MONARCH;在D1、D57和D85時給藥ADMIRAL;70 mg患者接受2或3劑量;70 mg隊列中有1名患者延遲接受劑量3;因此,該患者在最後一次服藥後的3個月內間隔不完全延長 -42% (n=8) -18% (n=16) -28% (n=17) 上次劑量分析後的第 29 天至 3 個月
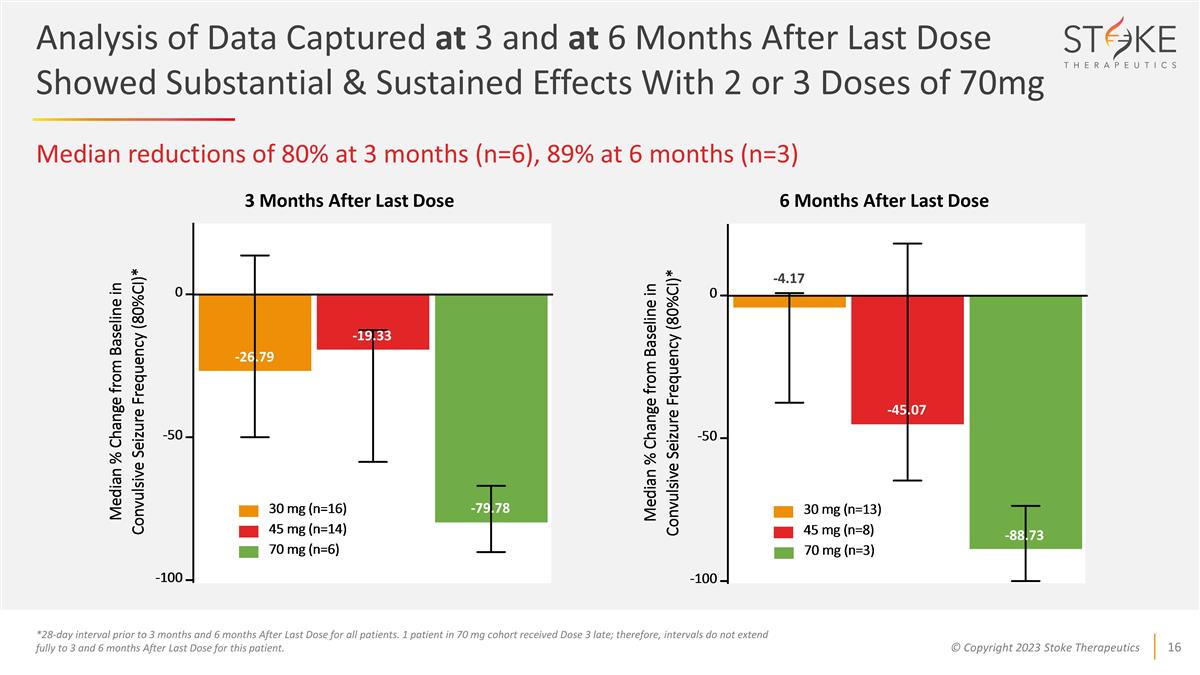
對最後一次給藥後6個月的3和 採集的數據的分析顯示,2或3劑70mg的效果中位數減少了80%(n=6),6個月時減少了89%(n=3)*所有患者在3個月之前和最後一次給藥後6個月的28天間隔。70 mg隊列中有1名患者延遲接受了3劑量;因此,間隔不會完全延長到3個月和6個月後該患者的最後一次劑量。最後一次給藥後 3 個月 -45.07 -4.17 -88.73 -79.78 -19.33 -26.79 最後一次給藥後 6 個月
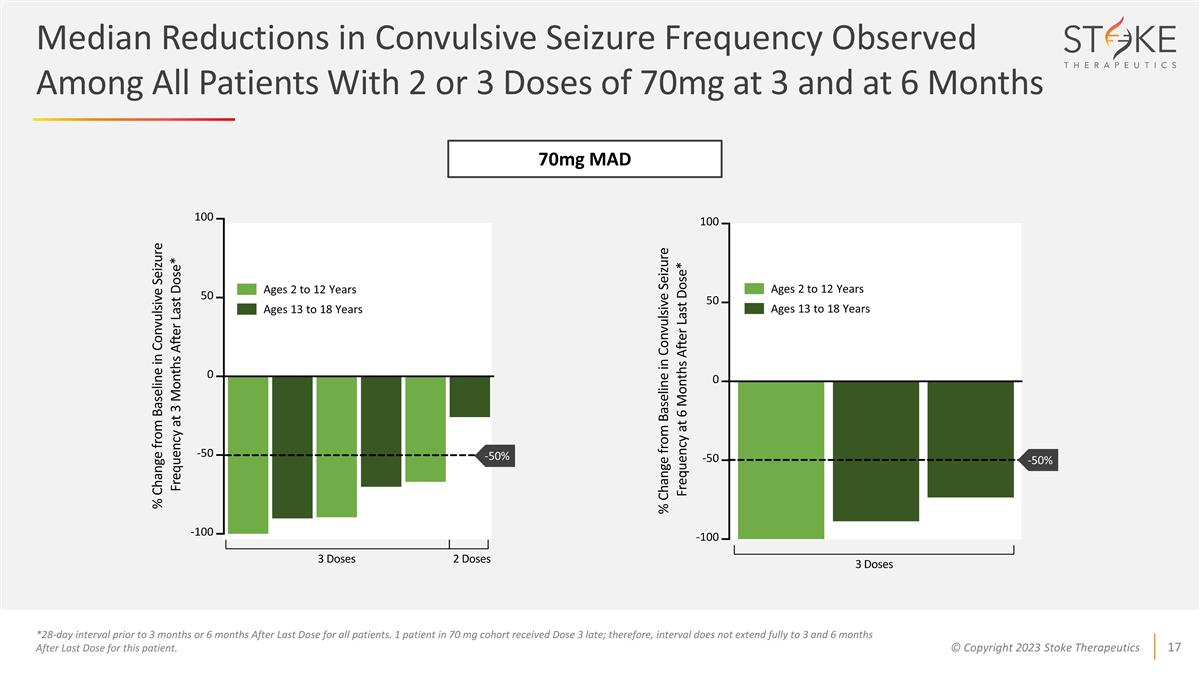
*所有患者在 3 個月前 或 6 個月前的 28 天間隔。70 mg 隊列中有 1 名患者延遲接種 3 劑量;因此,該患者上次服藥後的 3 至 6 個月間隔未完全延長。70 mg MAD 年齡 2 至 12 歲 13 至 18 歲 13 至 18 歲 13 至 18 歲所有服用 2 或 3 劑量 70 mg 的患者中觀察到的驚厥發作頻率中位數降低 3 個月和 6 個月時 -50% -50%

對 SWALLOWTAIL OLE 的分析 Kimberly Parkerson,醫學博士,神經病學臨牀開發主管

一項開放標籤的擴展研究 旨在評估重複劑量 STK-001 的長期安全性和耐受性
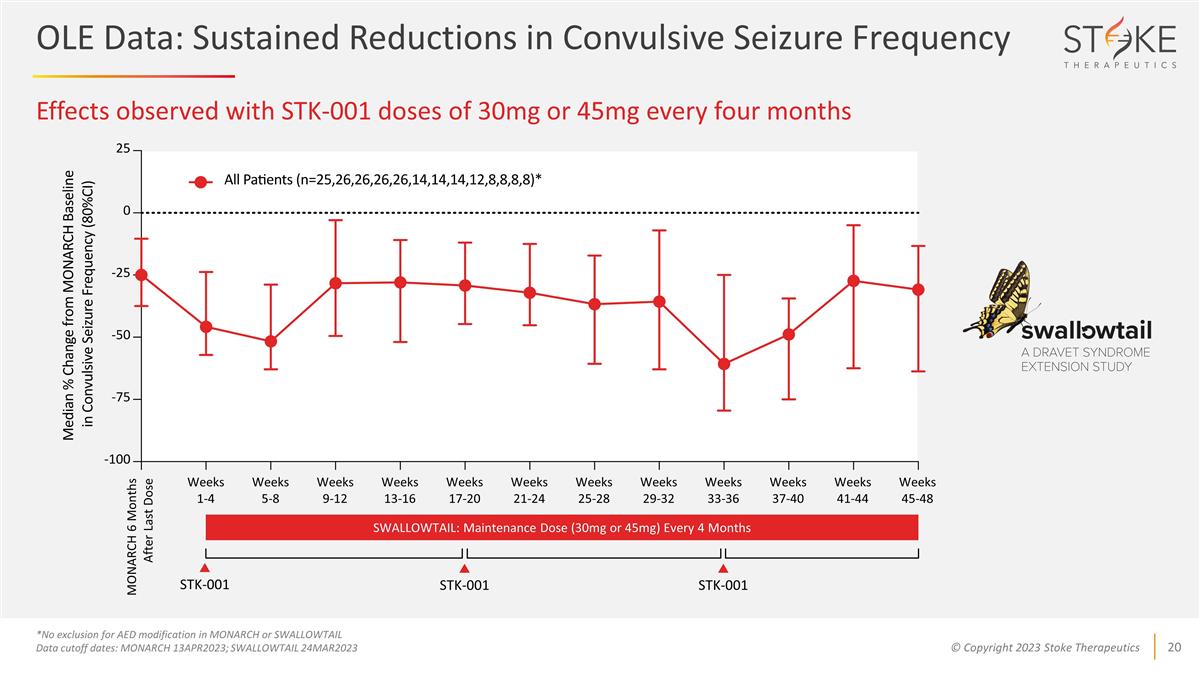
STK-001 劑量 每四個月為 30 毫克或 45 毫克時觀察到的效果 *不排除在 MONARCH 或 SWALLOWTAIL 數據中修改 AED 截止日期:MONARCH 13APR2023;SWALLOWTAIL 24MAR2023 第 1-4 周 5-8 周 9-12 周 13-16 周 17-20 周 21-24 周 25-28 周 33-36 周 41-44 周 45-48 周 STK-001 STK-001 MONARCH 上次服藥後 6 個月 SWALLOWTAIL:每 4 個月維持劑量(30 毫克或 45 毫克)OLE 數據:驚厥發作頻率持續降低 STK-001

德拉維特綜合症不僅僅是 “只是發作” 來源:Dravet 綜合症基金會發布的《患者之聲》報告,2022年5月,智力障礙與發育遲緩 “隨着時間的推移,我們看到從言語、 到活動能力、耐力、能量損失、對刺激的耐受性、耐力等各個領域都緩慢而穩步地下降。”運動與平衡 “我們很失望 [我們兒子的]體育活動受到限制,現在必須將我們計劃與他 祖母一起短途步行或探視改為長時間乘坐輪椅。”語言和言語障礙 “在19歲時, [我們的兒子]停止説話了,似乎在一夜之間失去了説話能力。大多數時候他都保持沉默,儘管他能聽懂簡單的談話,但他基本上無法表達自己的意見。”睡眠異常 “每天晚上,他在睡覺時都會出現癲癇發作。除了 DS 的所有其他合併症外,他還被剝奪了睡個好覺這一基本的人類必需品 。這會影響我們的整個家庭,因為日復一日地睡得這麼少,很難維持正常生活。”

Vineland 自適應行為量表 (VABS-III)衡量一個人在日常生活中的表現的全方位衡量標準,我希望看到他恢復一些言語,這樣他就可以溝通,減少沮喪感。溝通日常生活技能社交運動技能 — Barbara S., 患有德拉維特綜合症的兒子的媽媽 “” 來源:由德拉維特綜合症基金會提供
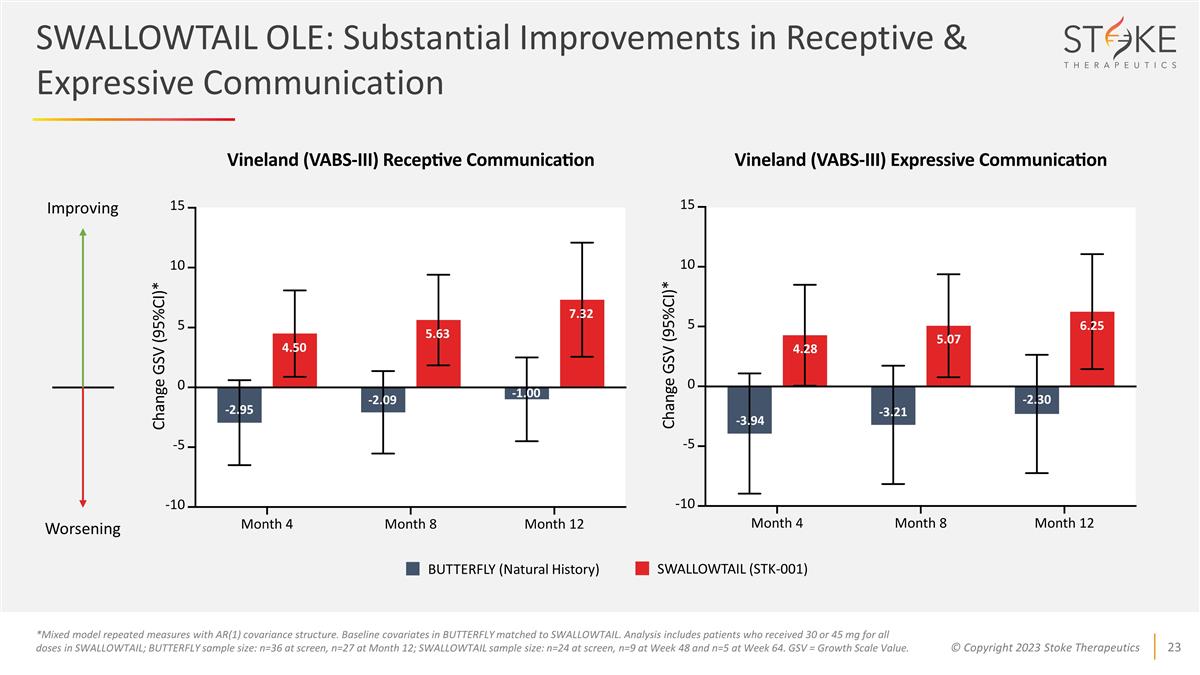
-2.95 -2.09 4.50 5.63 7.32 -1.00 BUTTERFLY(自然歷史)SWALLOWTAIL (STK-001) *採用 AR (1) 協方差結構的混合模型重複測量。蝴蝶中的基線協變量與 SWALLOWTAIL 相匹配。分析包括在 SWALLOWTAIL中所有劑量接受30或45毫克的患者;蝴蝶樣本量:篩查時n=36,第12個月的n=27;SWALLOWTAIL樣本量:篩查時n=24,第48周n=9,第64周n=5。GSV = 增長規模值。改善惡化情況 -3.94 4.28 5.07 6.25 -3.21 -2.30 SWALLOWTAIL OLE: 接受和表達性溝通的實質性改善
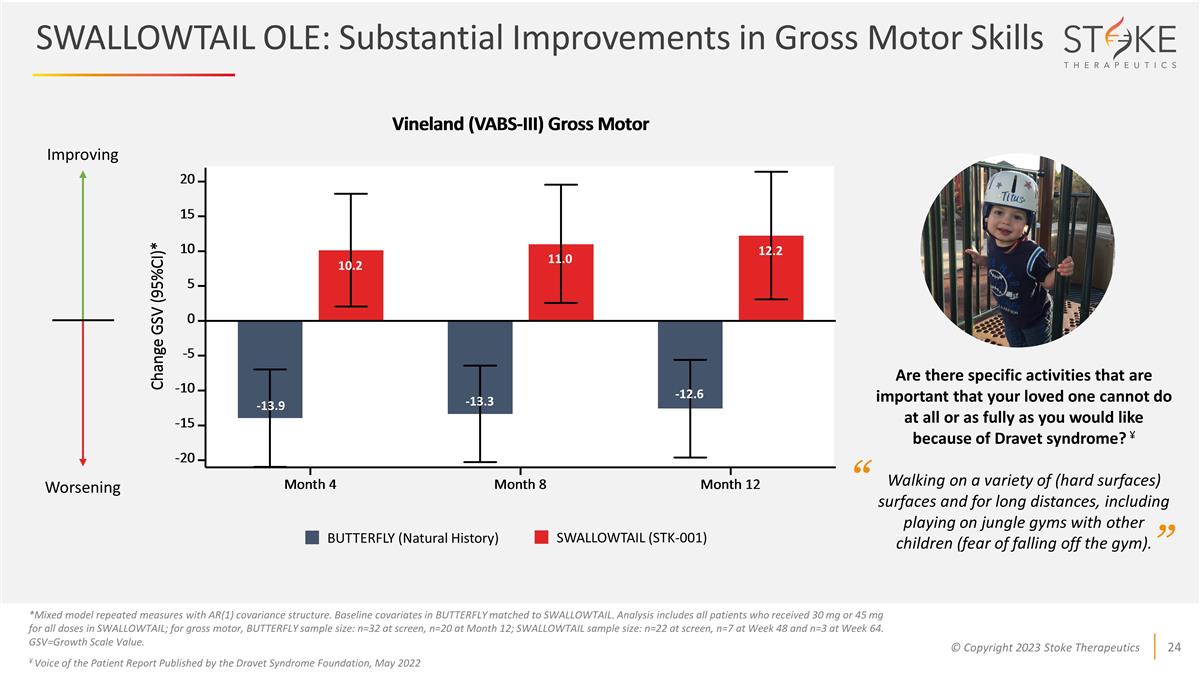
SWALLOWTAIL OLE:大肌肉運動技能大幅改善 *使用 AR (1) 協方差結構混合模型重複測量。蝴蝶中的基線協變量與 SWALLOWTAIL 相匹配。分析包括在SWALLOWTAIL中所有劑量接受30毫克或45毫克的所有患者;對於 粗大運動,BUTTERFLY 樣本量:篩查時為 n=32,第 12 個月為 n=20;SWALLOWTAIL 樣本量:篩查時為 n=22,第 48 周為 n=7,第 64 周為 n=3。gsv=成長量表價值。¥德雷維特綜合症基金會發布的《患者之聲報告》, 2022年5月 -13.9 10.2 11.0 12.2 -13.3 -12.6 改善惡化的蝴蝶(自然史)SWALLOWTAIL(STK-001)是否有因為 Dravet 綜合徵你所愛的人根本無法或完全按照你的意願進行的重要活動?¥在各種(堅硬表面)表面上行走和長途行走,包括和其他孩子一起在叢林體育館玩耍(害怕從健身房掉下來)。“”
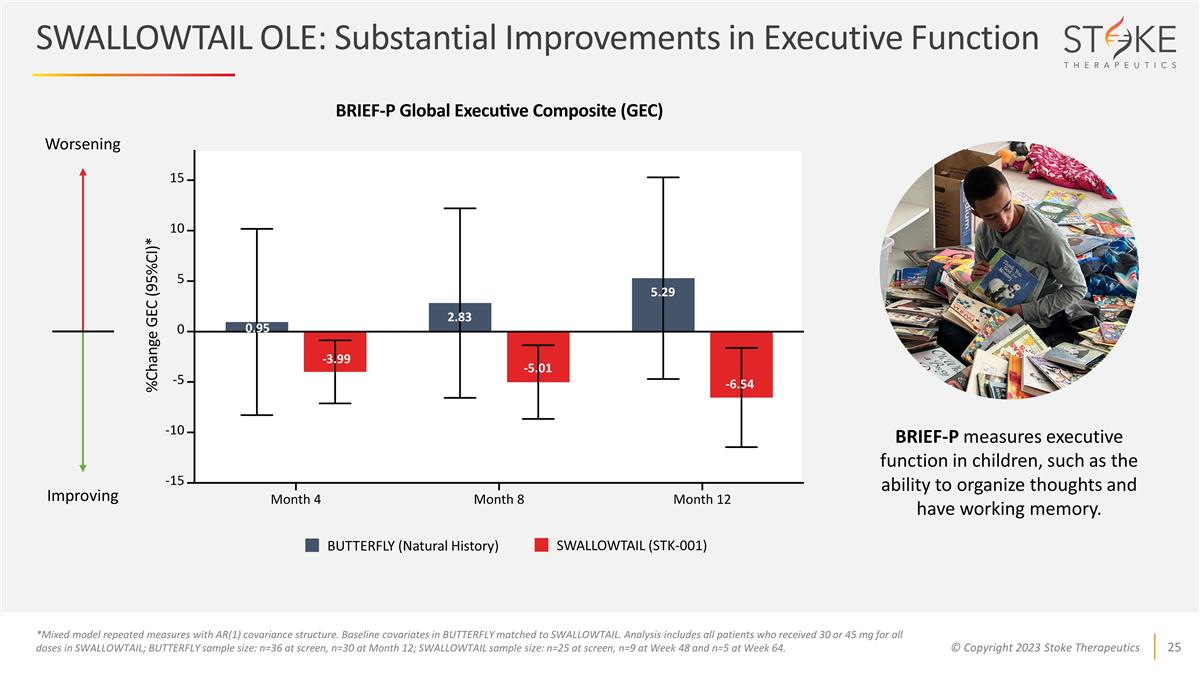
SWALLOWTAIL OLE:執行功能顯著 改善 0.95 -3.99 -5.01 5.29 2.83 -6.54 惡化蝴蝶(自然史)SWALLOWTAIL(STK-001)BRIEF-P 衡量兒童的執行功能,例如組織思想和保持正常記憶的能力。*採用 AR (1) 協方差結構的混合模型重複測量。蝴蝶中的基線協變量與 SWALLOWTAIL 相匹配。分析包括所有在 SWALLOWTAIL 中接受所有劑量為 30 或 45 mg 的患者;BUTTERFLY 樣本量: 篩查時為 n=36,第 12 個月為 n=30;SWALLOWTAIL 樣本量:篩查時為 n=25,第 48 周為 n=9,第 64 周為 n=5。

沒有變化差很多 改善了 BUTTERFLY(自然史)SWALLOWTAIL(STK-001)SWALLOWTAIL OLE:整體狀況的顯著改善臨牀醫生和護理人員的全球變化印象量表衡量患者的整體狀況 *混合模型重複使用 AR (1) 協方差結構進行測量。蝴蝶中的基線協變量與 SWALLOWTAIL 相匹配。分析包括所有服用 SWALLOWTAIL 劑量為 30 或 45 mg 的患者。對於 CGI-C,BUTTERFLY 樣本量:第 3 個月為 n=32,第 12 個月為 n=29;對於 CAGI-C,BUTTERFLY 樣本量:第 3 個月為 n=27,第 12 個月為 n=24。對於 CGI-C 和 CAGI-C,SWALLOWTAIL 樣本量:第 16 周為 n=25,第 48 周為 n=9,第 64 周為 n=5。BUTTERFLY 中的 CGI 和 cAGI 是為認知而改編的。 CGI-c=臨牀全球變化印象和 CAGI-c=Caregiver 全球變革印象。4.40 2.80 4.32 2.68 2.68 4.24 2.50 4.48 2.50 4.48 2.23 4.23 4.23 1.95 3.98 1.53

不超過 70mg 的單劑和多劑量通常耐受性良好 MONARCH 和 ADMIRAL(n=74)32%(24/74)的患者出現了與研究藥物相關的治療緊急不良事件(TEAE)。與研究藥物相關的最常見的 TEAE 是腦脊液蛋白升高、嘔吐、 和 20%(15/74)出現治療緊急嚴重不良事件(TESAE)。15 名患者中有 14 名患者經歷的 teSAE 被認為與研究藥物無關。1 名患者出現疑似意外嚴重不良反應 (SUSAR) ,研究人員將其歸因於 STK-001。患者完成了研究。ADMIRAL 研究方案的修正案允許研究人員決定是否服用 2 或 3 劑 STK-001 (70 mg) SWALLOWTAIL (n=44) 與 MONARCH 和 ADMIRAL 相比,觀察到腦脊液蛋白升高的發生率更高,在給藥後觀察到大於 50 mg/dL 的患者沒有任何相關的臨牀表現 MONARCH 和 ADMIRAL 64% (28/44) 的 SWALLOWTAIL 中的患者:1 名患者停止了研究治療;1 名患者錯過了 1 次劑量

關鍵要點迄今為止的數據支持 STK-001 是德拉維特綜合徵的第一種潛在的疾病改善療法。療效癲癇發作減少以及認知和行為評估的改善表明 2 至 18 歲患者的臨牀益處中位數 在 3 個月時降低 80%(n=6),在最後一次給藥 2 或 3 次 70 毫克初始劑量後 6 個月降低 89%(n=3)安全 STK-001 的耐受性普遍良好與研究藥物有關的最常見的TEAE是腦脊液蛋白升高、嘔吐和煩躁不安 Next Steps 數據將在上公佈國際癲癇大會(9月)和美國癲癇協會(12月)預計將在2024年第一季度提供更多數據MONARCH & ADMIRAL的研究結束其他燕尾和長翼OLE數據

閉幕詞 醫學博士首席執行官愛德華·凱伊

第三階段給藥的後續步驟和路徑美國70mg SAD和英國的70mg MAD 2024年第一季度完成其他數據:來自ADMIRAL和MONARCH的研究結束數據更多來自SWALLOWTAIL(30mg,45mg)和LONGWING(45mg)的OLE數據與監管機構接觸,包括劑量和給藥方案繼續與主要利益相關者就計劃和研究設計進行接觸確定認知和行為第三階段研究的終點預計將在2024年上半年更新第三階段的規劃

問與答
