附錄 99.1
Kiora Pharmicals公佈2023年業績;繼續推進罕見視網膜疾病的治療渠道;最近的戰略夥伴關係和融資預計將在2026年之前為運營提供資金
加利福尼亞州恩西尼塔斯——2024年3月25日——基奧拉制藥公司(納斯達克股票代碼:KPRX)(“Kiora” 或 “公司”)今天公佈了其2023年財務業績,並提供了其視網膜疾病開發項目的最新情況。該公司計劃於 2024 年實施的主要舉措是啟動用於治療遺傳性視網膜疾病的小分子光開關 KIO-301 的二期臨牀開發,首先是色素性視網膜炎 (RP);以及進一步開發 KIO-104,一種用於治療非感染性葡萄膜炎的玻璃體注射消炎藥。Kiora與Théa Open Innovation(TOI)的 KIO-301 開發和商業化合作夥伴關係預付的1,600萬美元預付款,預計將足以在2026年之前為公司提供資金,其中不包括任何潛在的合作里程碑或認股權證行使。
Kiora首席執行官布萊恩·斯特雷姆博士説:“我們今年的首要任務是推進 KIO-301 和 KIO-104 的發展,以評估它們進一步造福患者的潛力。”“這兩款產品都是經過臨牀驗證的候選藥物,其基礎是專有和創新的小分子,這些小分子靶向有大量未滿足需求的罕見視網膜疾病。
“KIO-301 有可能成為遺傳性視網膜退行性疾病(例如 RP)患者的第一種視力恢復選擇。正在進行的開發將由我們的合作伙伴TOI共同指導和全額資助。如果 KIO-301 獲得上市許可,它將為Kiora提供有意義的商業里程碑和特許權使用費,直至20年代的低點,而合作伙伴在眼力領域有良好的領導記錄。我們正在與TOI合作,最終確定RP中隨機、雙重掩碼、對照、劑量遞增的2期試驗的細節,並期待提供有關預期入組和結果時間表的更多細節。
“資產負債表為我們提供了為進一步開發用於治療後部非感染性葡萄膜炎的 KIO-104 提供資金的財務能力。由於非傳染性葡萄膜炎可能危及視力,因此市場對新的類固醇節約治療方法有強烈的興趣。KIO-104 中的活性化合物是一種高效、可改善疾病的抗炎劑,屬於一類藥物,可幫助成千上萬的全身性自身免疫性疾病(包括多發性硬化和類風濕關節炎)患者。我們認為,通過直接向眼睛輸送 KIO-104,我們可以減少視網膜炎症的負面影響,而不會產生全身性消炎藥物或慢性類固醇暴露的潛在副作用。除非感染性葡萄膜炎外,KIO-104 的作用機制還可能適用於其他視網膜疾病,例如增殖性玻璃體視網膜病變 (PVR),這是視網膜脱離修復後的併發症,非臨牀研究仍在進行中。”
財務執行副總裁梅利莎·托斯卡補充説:“孤兒適應症涉及高效、具有成本效益的市場路徑。”“到2024年,我們預計將增加研發支出,KIO-301 的支出將被TOI的季度報銷所抵消。此外,我們預計今年的併購支出將保持相對平穩。我們認為這可以平衡我們
希望加快有意義的發展,同時保持強勁的現金狀況,預計將在2026年之前為運營提供資金。”
已實現和即將到來的里程碑:
Kiora 在 2023 年和 2024 年迄今取得的重要里程碑包括:
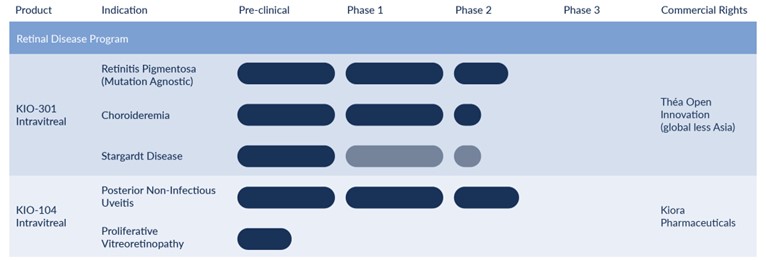
KIO-301
•建立戰略合作伙伴關係,授予TOI在全球範圍內獨家開發和商業化權利,不包括亞洲,用於治療視網膜退行性疾病。KIO-301根據交易條款,Kiora 獲得了 1,600 萬美元的預付款,並有資格額外獲得高達 2.85 億美元的開發、監管和商業里程碑;淨銷售額最高為 20 年代的分級特許權使用費;以及 KIO-301 研發費用報銷。
•已完成註冊並報告了 ABACUS-1 研究的頭條結果。結果表明,KIO-301 是安全且可容忍的,並顯示出在多項衡量標準下的持續改善,包括改善視野、視力和功能視覺(在現實世界模擬中導航)。此外,功能性磁共振成像測量顯示,大腦中負責視覺的特定區域已重新激活。
•與美國食品藥品管理局就Kiora提出的臨牀開發計劃舉行了B型、IND前會議,並收到了有關試驗設計的反饋,包括可批准的終點、對照組的詳細信息以及突出的非臨牀要求,所有這些都與Kiora當前的計劃和時間表一致。
KIO-100 系列(KIO-104、KIO-101)
•在醫學雜誌《藥學》上發表了 KIO-101 的1期雙面研究結果,記錄了為期12天的多劑量局部治療 KIO-101,健康志願者和眼部發炎患者的耐受性良好。與安慰劑組相比,治療組的結膜充血明顯減少。
•獲得 KIO-100 系列非甾體抗炎小分子的局部眼部遞送的美國和歐洲專利。
Kiora預計將實現以下臨牀和監管里程碑:
KIO-301
•報告其他 ABACUS-1 數據,包括定量功能 MRI 測量結果,顯示視覺皮層中的大腦活動以隨時間變化的方式重新激活。
•在 Kiora-TOI 聯合指導委員會的領導下,完成一項針對色素性視網膜炎的 KIO-301 的隨機、對照、多中心、雙面罩、劑量遞增的 2 期研究的全面設計,預計最早在 2024 年第四季度啟動。
•在美國和歐盟尋求針對脈絡膜血癥和斯塔加特病的 KIO-301 孤兒藥認定。
KIO-104
•啟動支持性非臨牀研究,為2024年的2期和註冊研究提供信息並進行優化。
•計劃一項用於治療非感染性葡萄膜炎的 KIO-104 的多中心、隨機、雙重掩碼、劑量遞增的 2 期研究。
•對 KIO-104 在增殖性玻璃體視網膜病變中進行額外的臨牀前概念驗證研究,增殖性玻璃體視網膜病變是一種罕見但嚴重的併發症,從 2024 年開始。
財務業績
Kiora在年底擁有250萬美元的現金和現金等價物以及200萬美元的應收税款。2024年2月,Kiora從TOI額外獲得了1,600萬美元的預付款,並從私募發行中籌集了1,380萬美元的淨收益。截至2024年3月24日,該公司的現金和現金等價物超過3000萬美元,該公司認為這將為2026年的運營提供資金。
2023年,扣除170萬美元的抵消性税收抵免,研發費用為400萬美元,而2022年扣除150萬美元的抵消性税收抵免後,研發費用為350萬美元。2023年第四季度的研發費用為110萬美元,扣除50萬美元的抵消性税收抵免,而扣除2022年第四季度的40萬美元抵消性税收抵免後,為80萬美元。2023 年研發的增長主要是由於增加對 KIO-301 臨牀試驗相關活動的投資以及研發團隊的人事相關費用。Kiora預計,隨着其開始規劃和招募患者參與2期臨牀試驗,研發費用將增加,KIO-301 的試驗相關費用將被TOI的報銷所抵消。
2023年的一般和管理費用為470萬美元,而2022年為830萬美元。2023年第四季度的一般和管理費用為90萬美元,而2022年第四季度為280萬美元。2023年全年和第四季度一般和管理費用的減少主要與外部會計和審計服務減少的推動下,專業服務費的降低有關。基奧拉預計,在不久的將來,一般和管理費用將保持相對穩定。
2023年的淨虧損為1,250萬美元,而2022年為1,360萬美元。2023年第四季度的淨虧損為230萬美元,而2022年第四季度的淨虧損為250萬美元。
關於 Kiora 製藥
Kiora Pharmaceuticals是一家臨牀階段的生物技術公司,正在開發和商業化治療孤兒視網膜疾病的產品。KIO-301 正在開發用於治療色素性視網膜炎、脈絡膜血癥和斯塔加特病。它是一種分子光電開關,有可能恢復遺傳性和/或年齡相關性視網膜變性患者的視力。KIO-104 正在開發用於治療後部非感染性葡萄膜炎。它是二氫乳清酸脱氫酶的下一代非甾體免疫調節小分子抑制劑。除了新聞稿和美國證券交易委員會文件外,我們預計還將在我們的網站www.kiorapharma.com和社交媒體賬户上發佈可能與投資者相關的信息。我們鼓勵投資者在推特和領英上關注我們,訪問我們的網站和/或訂閲電子郵件提醒。
前瞻性陳述
本新聞稿中的一些聲明是 “前瞻性的”,是根據1995年《私人證券訴訟改革法》的安全港條款作出的。這些 “前瞻性” 陳述包括與Kiora執行開發和商業化工作以及與Kiora開發階段產品(包括 KIO-104、KIO-301、KIO-201 和 KIO-101)相關的其他監管或營銷批准工作的能力以及其成功的陳述,此類批准或成功可能無法及時獲得或實現,或根本無法獲得或實現的現有現金足以為特定時期的運營提供資金,及時完成計劃舉措的能力2024 年,包括第 2 階段
KIO-301 和 KIO-104 的臨牀開發,KIO-301 可能成為RP等遺傳性退行性疾病患者的首選治療選擇,Kiora進一步資助KIO-104 開發的計劃,KIO-104 減少炎症的可能性,KIO-104 2b期試驗的關鍵時機,KIO-104 應用於其他視網膜炎性疾病的可能性,以及2024年研發和一般及行政支出的預期趨勢。這些聲明涉及風險和不確定性,可能導致結果與本新聞稿中列出的聲明存在重大差異,包括滿足與發行相關的成交條件的能力、及時進行臨牀試驗的能力、市場和其他條件以及在 “風險因素” 標題下描述的某些風險因素,這些風險因素載於Kiora於2024年3月25日向美國證券交易委員會提交的10-K表年度報告或Kiora's中描述的 “風險因素” 標題下描述的某些風險因素其他公開文件。Kiora的業績還可能受到Kiora目前尚未意識到的因素的影響。本新聞稿中的前瞻性陳述僅代表截至本新聞稿發佈之日。除非法律要求,否則Kiora明確表示不承擔任何義務或承諾公開發布此類聲明的任何更新或修訂,以反映其對該聲明的期望的任何變化或任何此類聲明所依據的事件、條件或情況的任何變化。
聯繫信息:
Investors@kiorapharma.com