

從偶然性到合理設計將分子膠降解劑推向新高度 | 2024 年 1 月

前瞻性陳述這些材料包括明示和默示的 “前瞻性陳述”,包括1995年《私人證券訴訟改革法》所指的前瞻性陳述。前瞻性陳述包括所有非歷史事實的陳述,在某些情況下,可以用 “可能”、“可能”、“將”、“應該”、“期望”、“打算”、“計劃”、“目標”、“預期”、“相信”、“估計”、“預測”、“潛力”、“繼續”、“持續”、“持續” 或否定等術語來識別這些術語或其他旨在識別未來陳述的類似術語。此處包含的前瞻性陳述包括但不限於有關我們產品開發活動的陳述,包括我們對分子膠降解劑(“MGD”)潛力的期望,我們此處詳細的MGD產品線,包括GSPT1、VAV1、NEK7、CDK2以及我們早期未公開的MGD的潛力,我們對產品線進展和時機的期望,包括我們的前進能力我們的候選人通過對候選人的潛在客户進行優化,我們對候選人的期望我們的 MGD 產品線的潛在治療機會,我們對 GSPT1 MGD(即 MRT-2359)持續臨牀開發的期望,包括對某些中期臨牀數據的潛在相關性以及我們對未來任何臨牀數據發佈的性質和時間的預期,我們對 MRT-2359 未來臨牀開發的性質和時機的期望,包括我們對任何潛在的 2 期研究的計劃,我們對 MGD 正在進行的臨牀前和潛在臨牀開發的期望 VAV1,被稱為 MRT-6160,包括我們使用臨牀前數據來預測 MRT-6160 在多種自身免疫適應症(包括與胃腸病學、皮膚病學、風濕病學和神經病學相關的適應症)中的潛在臨牀用途,我們對 MRT-6160 和 MRT-6160 進入臨牀的研究性質和時機的期望,MRT-6160 使多種自身免疫性疾病患者受益的可能性,還有我們的 MRT-6160使用此類適應症獲得VAV1作為靶標的概念驗證的能力,包括其時間,我們對正在進行的NEK7MGD臨牀前開發的期望,包括NEK7開發候選藥物的任何宣佈和發佈時間,以及我們使用臨牀前數據來預測NEK7應用MGD的治療機會,我們對正在進行的CDK2MGD臨牀前開發的期望,包括任何 CDK2開發候選藥物的公告及其時間以及我們對預開發劑的使用用於預測CDK2應用MGD治療機會的臨牀數據,我們對各種MGD(包括 GSPT1、VAV1、NEK7、CDK2)各種適應症的潛在患者羣體規模的預測,以及我們對財務狀況強度的預期,包括對現金跑道的估計等。就其性質而言,這些陳述受許多風險和不確定性的影響,以及我們在2023年3月16日向美國證券交易委員會提交的截至2022年12月31日的第四季度和全年10-K表年度報告以及任何後續文件中規定的風險和不確定性,這些風險和不確定性可能導致實際業績、業績或成就與聲明中的預期或暗示存在重大不利差異。你不應依賴前瞻性陳述作為對未來事件的預測。儘管我們的管理層認為我們的陳述中反映的預期是合理的,但我們不能保證前瞻性陳述中描述的未來業績、業績或事件和情況能夠實現或發生。提醒收件人不要過分依賴這些前瞻性陳述,這些陳述僅代表截至此類陳述發表之日,不應被解釋為事實陳述。除非適用法律要求,否則我們沒有義務公開更新任何前瞻性陳述,無論是由於新信息、任何未來陳述還是其他原因。這些材料中包含的某些信息,以及在介紹這些材料時所作的任何口頭陳述,這些陳述與材料有關或基於從第三方來源獲得的研究、出版物、調查和其他數據以及我們自己的內部估計和研究。儘管我們認為截至這些材料發佈之日這些第三方研究、出版物、調查和其他數據是可靠的,但我們尚未獨立核實,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性作出任何陳述。此外,沒有獨立來源評估過我們的內部估計或研究的合理性或準確性,也不應依賴這些材料中與此類內部估計和研究有關或基於此類內部估計和研究的任何信息或陳述。這些材料仍然是Monte Rosa Therapeutics的專有知識產權,未經蒙特羅莎療法事先書面同意,不得全部或部分分發或複製。

Monte Rosa Therapeutics — 公司概述將分子膠降解劑 (MGD) 推向新高度合理設計的 MGD 庫有可能通過以前所未有的精度降解與治療相關的蛋白質來解決其他模式的許多侷限性高產、行業領先的發現引擎將實驗與人工智能相結合,實現新型 MGD 的合理設計多個披露的全資項目,涵蓋腫瘤、自身免疫和炎症。強勁的財務狀況為2026年上半年及以後的現金流提供了充足的現金流多個預期的臨牀結果,包括 MRT-2359 1/2 期和 VAV1 的 SAD/MAD 以及正在進行的 MRT-2359 針對 MYC 驅動的癌症的 NEK7 1/2 期臨牀研究;中期數據顯示出最佳的藥效學調節和臨牀活動的早期跡象;RP2D 預計將於 2024 年第二季度與羅氏合作開發腫瘤學和神經系統疾病的 MGD — 將平臺覆蓋範圍擴大到神經病學 MRT-6160,高度選擇性的 VAV1 導向 MGD,正在快速推進 IND 預計於 2024 年中期;在自身免疫性疾病中具有廣泛的潛在應用
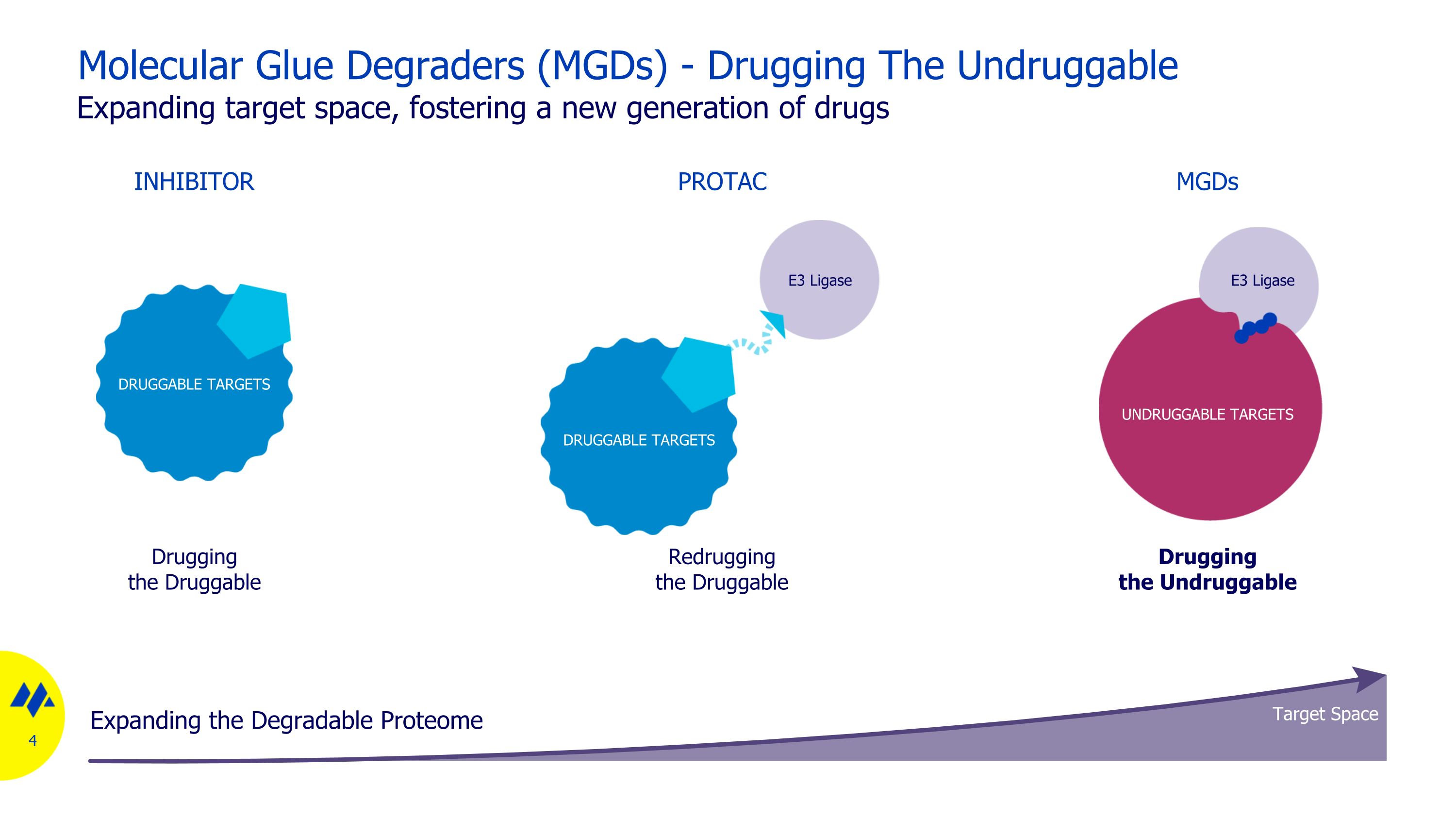
分子膠降解劑 (MGD)-給藥不可上藥的藥物擴大靶標空間,培育新一代藥物給可藥物抑制劑下藥給不可上藥的 mgD 重新給藥可吸毒 PROTAC 不可藥物靶標 E3 Liggase DRUGGABLE 靶標 E3 Liggase DRUGGABLE 靶標 E3 Liggase DRUGGABLE 靶標靶標空間擴大可降解蛋白質組

進入不可藥物治療的空間精湛的選擇性高效口服生物利用度細胞滲透性系統分佈中樞神經系統穿透持久的藥效學效應 Monte Rosa 合理設計的 MGD 解決了第一代蛋白質降解劑的關鍵侷限性,並將潛在應用擴展到免疫學、神經科學和其他治療領域分子膠降解劑 (MGD) — 一種高度差異化的模態效力和選擇性,口服生物利用小分子三元複合物泛素化蛋白酶體介導的新底物泛素鏈降解新底物連接酶新底物 MGD
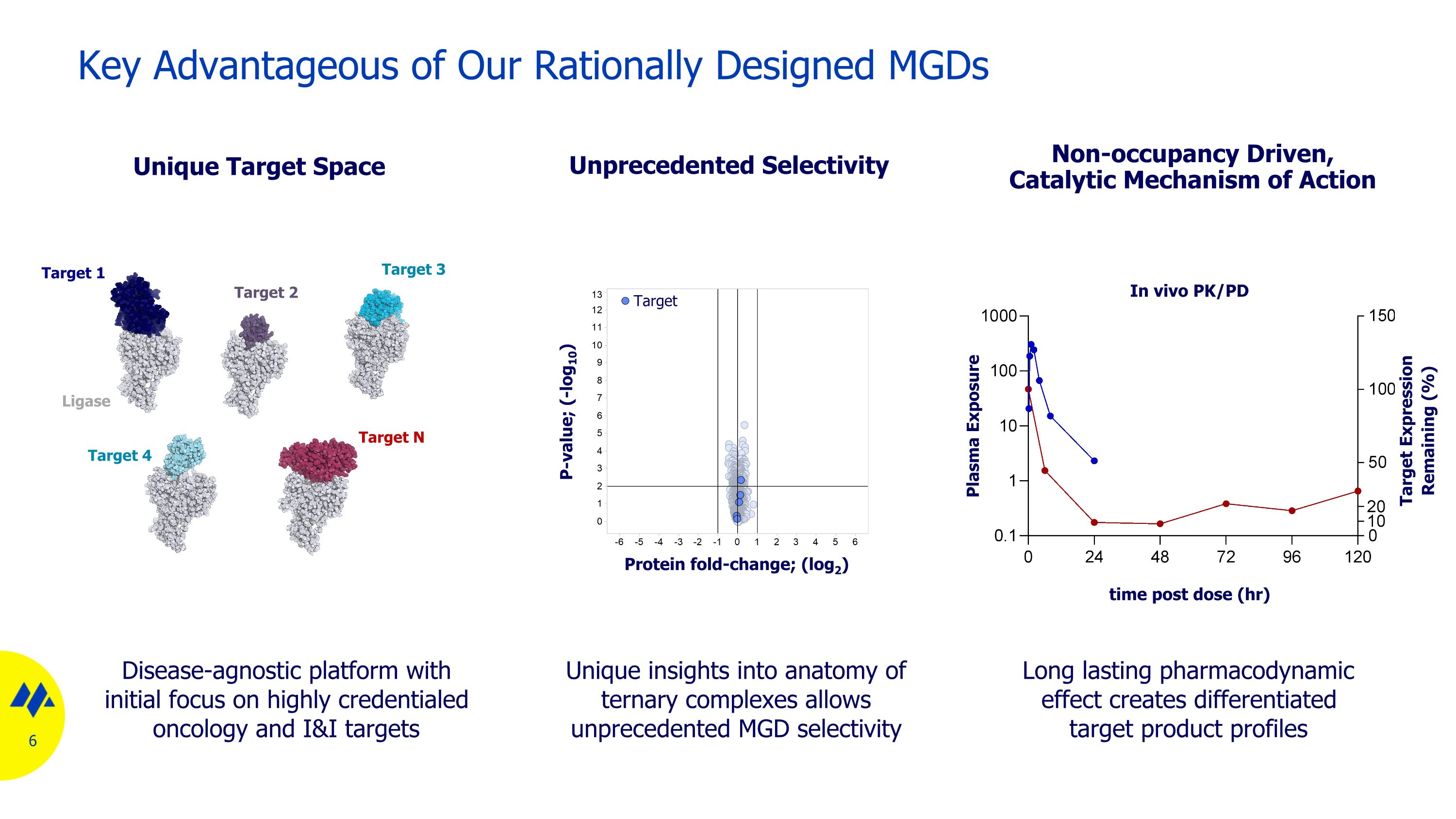
我們合理設計的 MGD 的關鍵優勢對三元複合物解剖結構的獨特見解可實現前所未有的 MGD 選擇性前所未有的選擇性蛋白摺疊變化;(log2)與疾病無關的平臺,最初專注於高度認證的腫瘤學和 I&I 靶標獨特的靶標 1 目標 3 目標 2 目標 4 目標 N 連接酶持久的藥效學效應可創建差異化的目標產品概況非佔用率驅動的催化作用機制 P 值;(-log10) 血漿暴露目標表達剩餘 (%) 體內靶點給藥後 PK/PD 時間(小時)

Monte Rosa Therapeutics — 關鍵的首次和成就從偶然性到合理設計 MGD 建立了以靶標為中心的藥物發現方法,將實驗與人工智能相結合,實現了高效和選擇性的 MGD 的合理設計 VAV1 MGD MRT-6160 進入了支持新藥的研究;MRT-6160 是首個專為非腫瘤學適應症開發的已知 MGD 建立了基於分子膠的專有靶向蛋白降解平臺,開發有選擇地降解致病高級蛋白的突破性療法其他幾個可通過我們的平臺降解的具有高度認證的靶點,包括CDK2、NEK7和多個發現靶點;開始將E3連接酶的方法擴展到Cereblon以外的領域。提交了用於治療MYC驅動腫瘤的GSPT1指導的MGD MRT-2359 1/2期試驗的中期數據;觀察到最佳藥效學*、良好的安全性特徵和初步臨牀活性與羅氏在腫瘤學和神經系統疾病領域建立的驗證發現合作*基於臨牀前研究中的最佳 PD 調製

投資組合
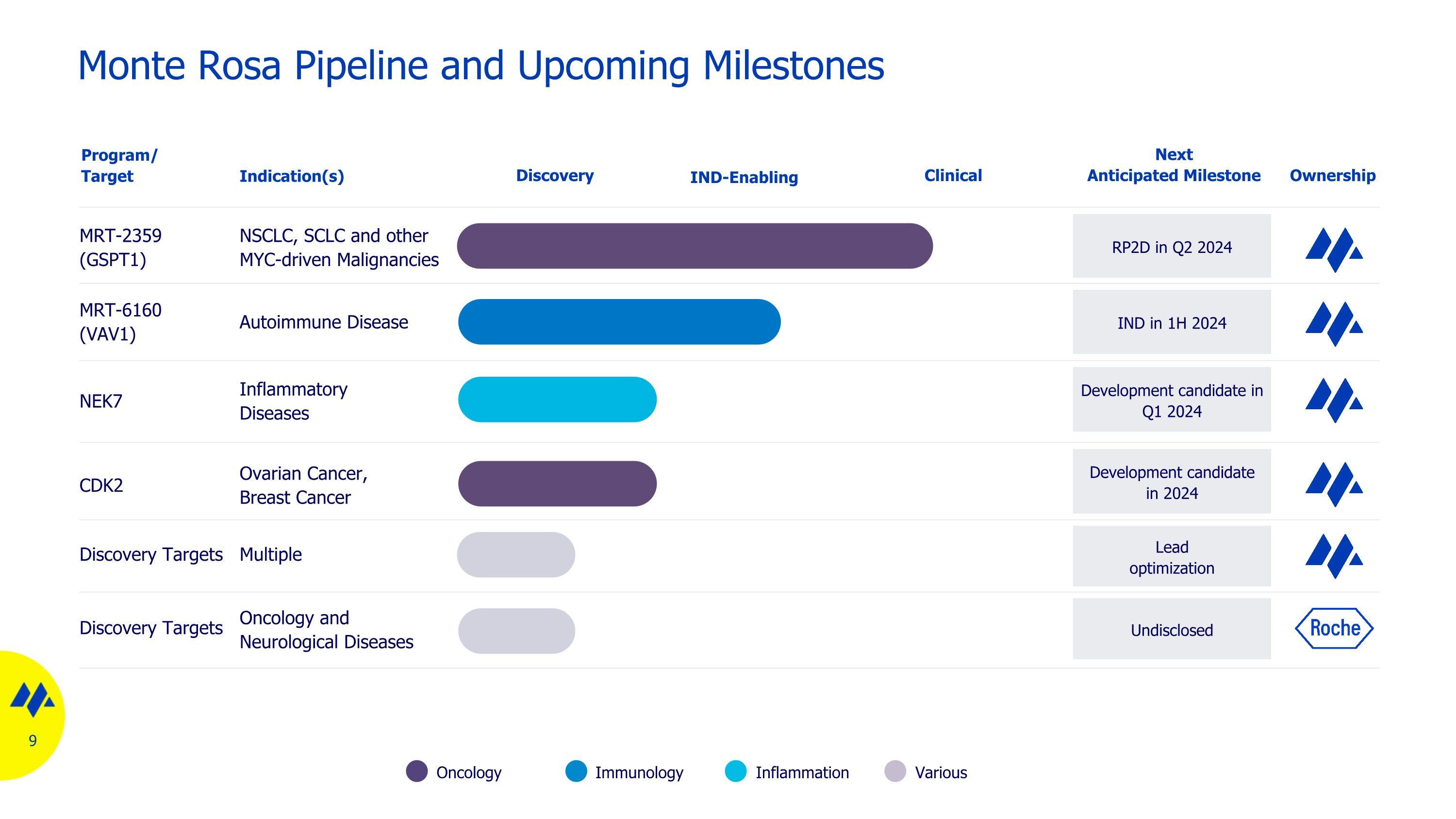
Monte Rosa Pipeline 和即將到來的里程碑腫瘤學炎症免疫學各種 MRT-2359 (GSPT1) NSCLC、SCLC 和其他 MYC 驅動的惡性腫瘤 NEK7 炎性疾病 MRT-6160 (VAV1) 自身免疫性疾病發現計劃/靶向適應症 2024 年第 1 季度的 RP2D 下一個預期里程碑所有權發現目標 2024 年第一季度多個支持 IND 的臨牀先導優化候選藥物 2024 年上半年 CDK2 卵巢癌、乳腺癌 IND 發現靶標和腫瘤學 2024 年未公開的神經系統疾病發展候選人

GSPT1 節目
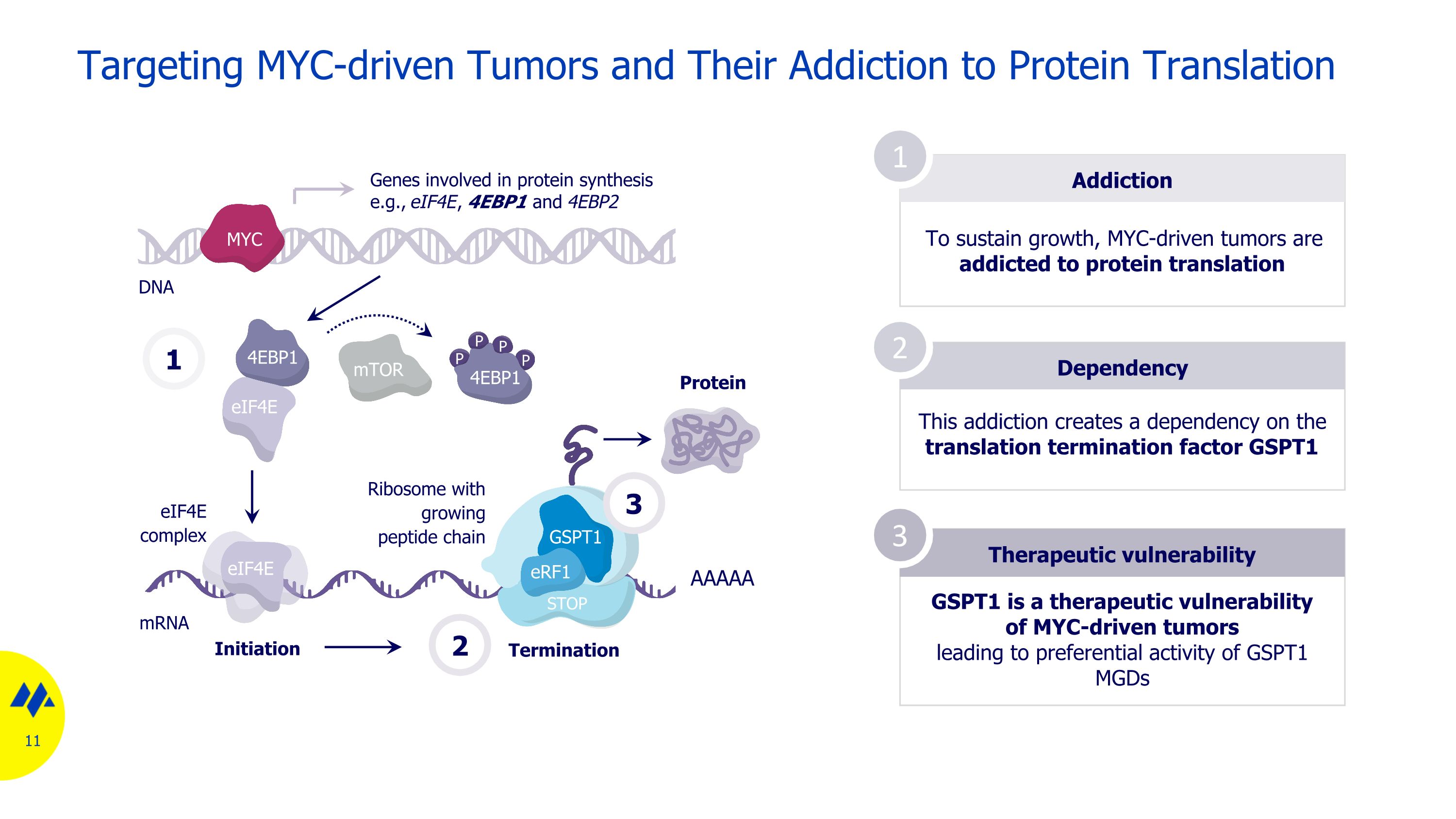
針對 myc 驅動的腫瘤及其對蛋白質翻譯成癮的成癮為了維持生長,myc 驅動的腫瘤沉迷於蛋白質翻譯依賴性治療漏洞 1 2 3 這種成癮會造成對翻譯終止因子的依賴 GSPT1 GSPT1 是 myc 驅動的腫瘤的治療脆弱性,導致 GSPT1 mgds mRNA 1 mTOR eif4E eif4e 的優先活性 4EBP1 P P P 4EBP1 eif4E eif4E 參與蛋白質合成的複合基因,例如 eif4E 4e、4EBP1 和 4EBP2 啟動終止 AAAA Protein 2 MYC STOP GSPT1 erF1具有不斷增長的肽鏈的核糖體 3
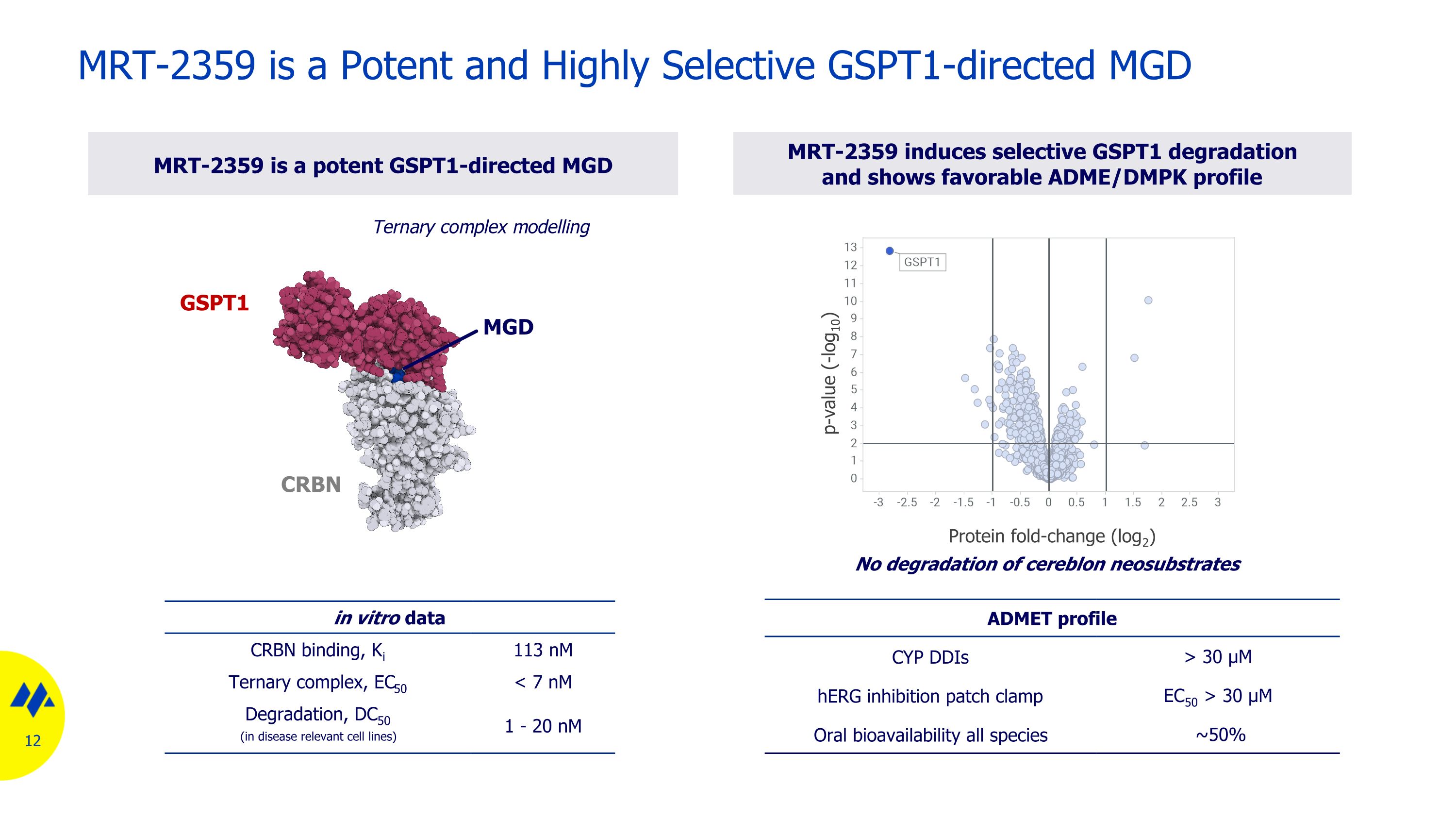
MRT-2359 是一種有效且高度選擇性的 GSPT1 導向 MGD 體外數據 CRBN 結合、Ki 113 nM 三元複合物、EC50 30 µM hERG 抑制貼片鉗 EC50 > 30 µM 口服生物利用度所有物種 ~ 50% 三元複合物建模 GSPT1 CRBN MGD 不降解小腦新底物蛋白摺疊變化 (log2) p 值 (-log10)
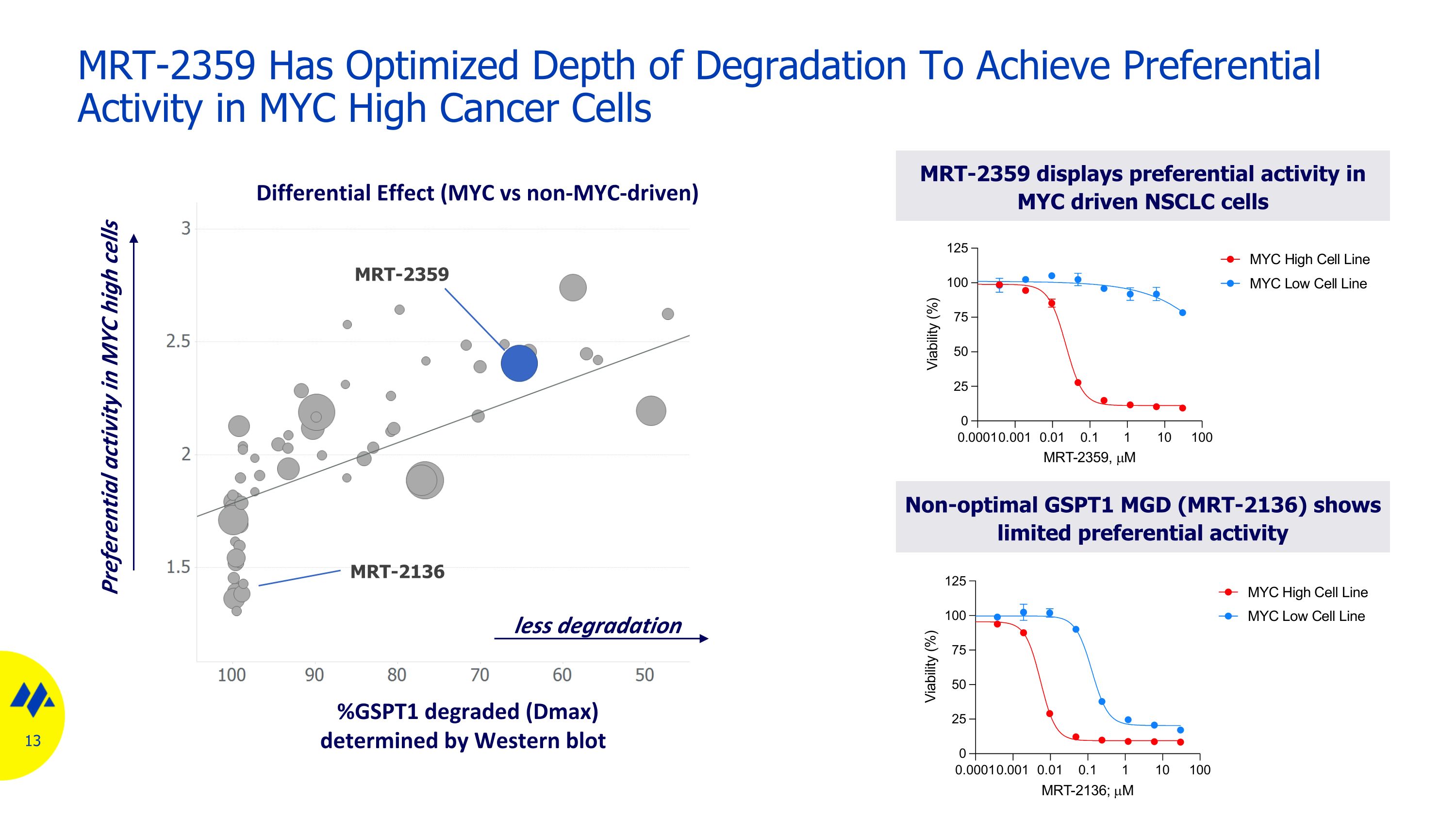
MRT-2359 優化了降解深度,在 MYC 高癌細胞中實現優先活性 %GSPT1 降解 (Dmax) 由 Western blot 差異效應(MYC 與非 MYC 驅動)確定降解較少 MYC 高細胞中的優先活性 MRT-2359 MRT-2136 MRT-2359 在 MYC 驅動的 NSCLC 細胞中顯示優先活性非最佳 GSPT1 MGD (MRT-2136) 顯示有限的優先活性
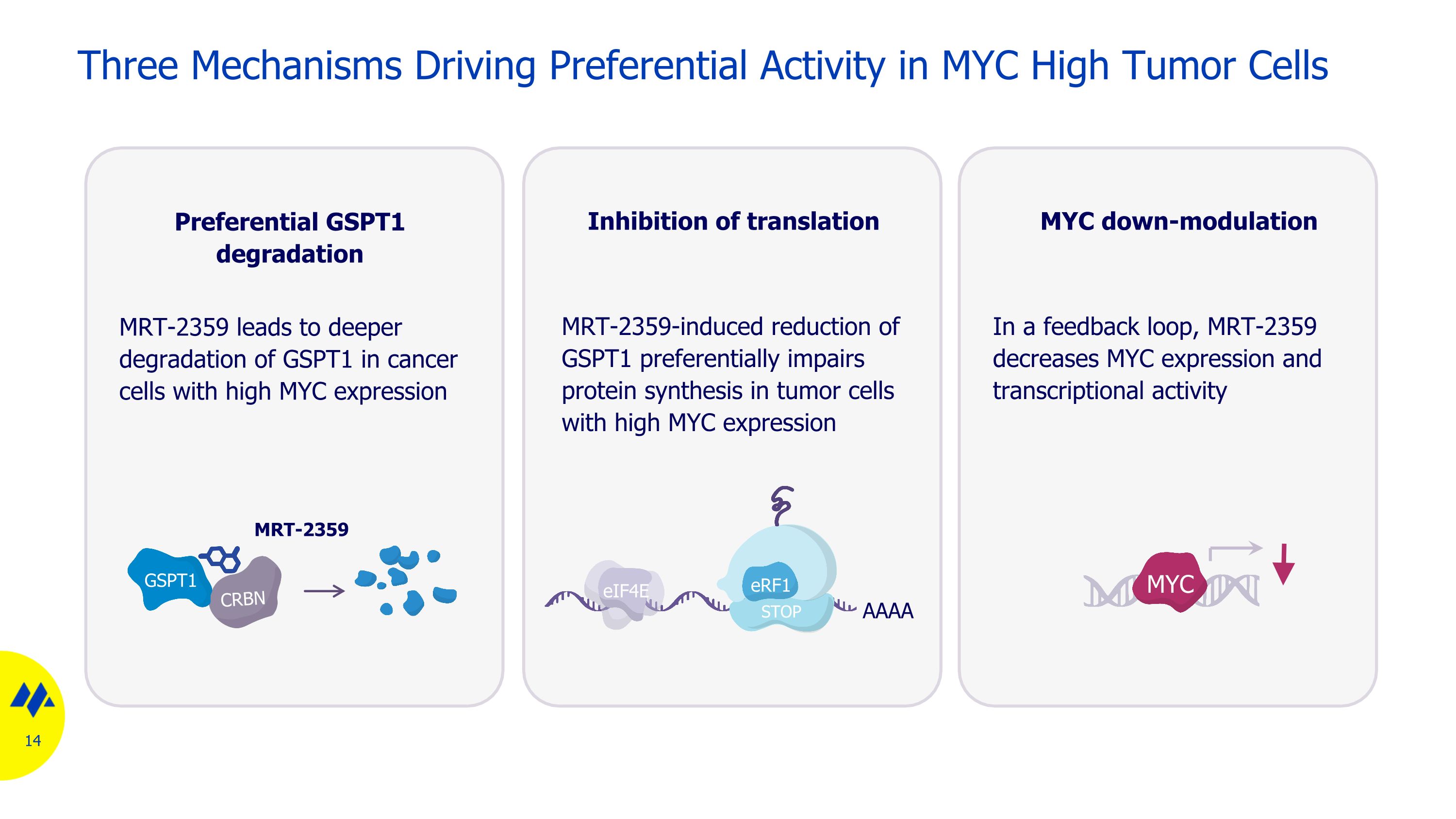
驅動 MYC 高腫瘤細胞優先活性的三種機制 MRT-2359 CRBN GSPT1 優先 GSPT1 降解 MRT-2359 導致高 MYC 表達的癌細胞中 GSPT1 的深度降解 mrt-2359 誘導的 GSPT1 減少優先損害 MYC 表達量高的腫瘤細胞的蛋白質合成 eif4e AAAA STOP erF1 MYC 下調在反饋迴路中,MRT-2359 降低 MYC 表達和轉錄活性 MYC
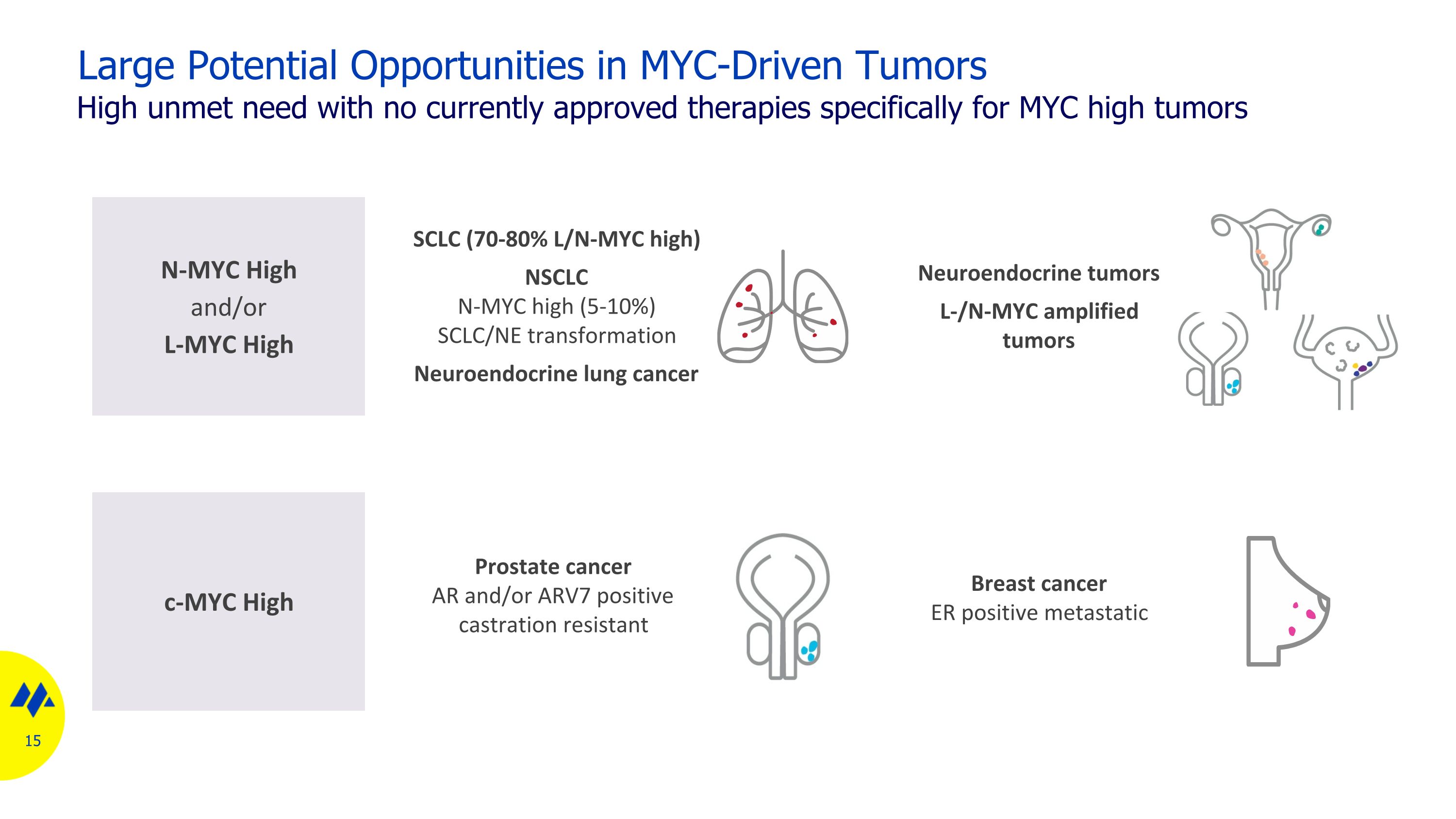
MYC 驅動的腫瘤存在巨大潛在機會由於目前沒有批准專門針對 MYC 高腫瘤的療法 N-MYC 高和/或 L-MYC 高神經內分泌腫瘤 L/N-MYC 擴增腫瘤 c-myc 高血紅素乳腺癌 ER 陽性轉移性小細胞肺癌(70-80% L/N-MYC 高)NSCLC N-MYC 高(5-10%)SCLC/NE 轉化神經內分泌肺癌 AR 和/或 ARVVC 前列腺癌 ARVC 7 抗去勢陽性
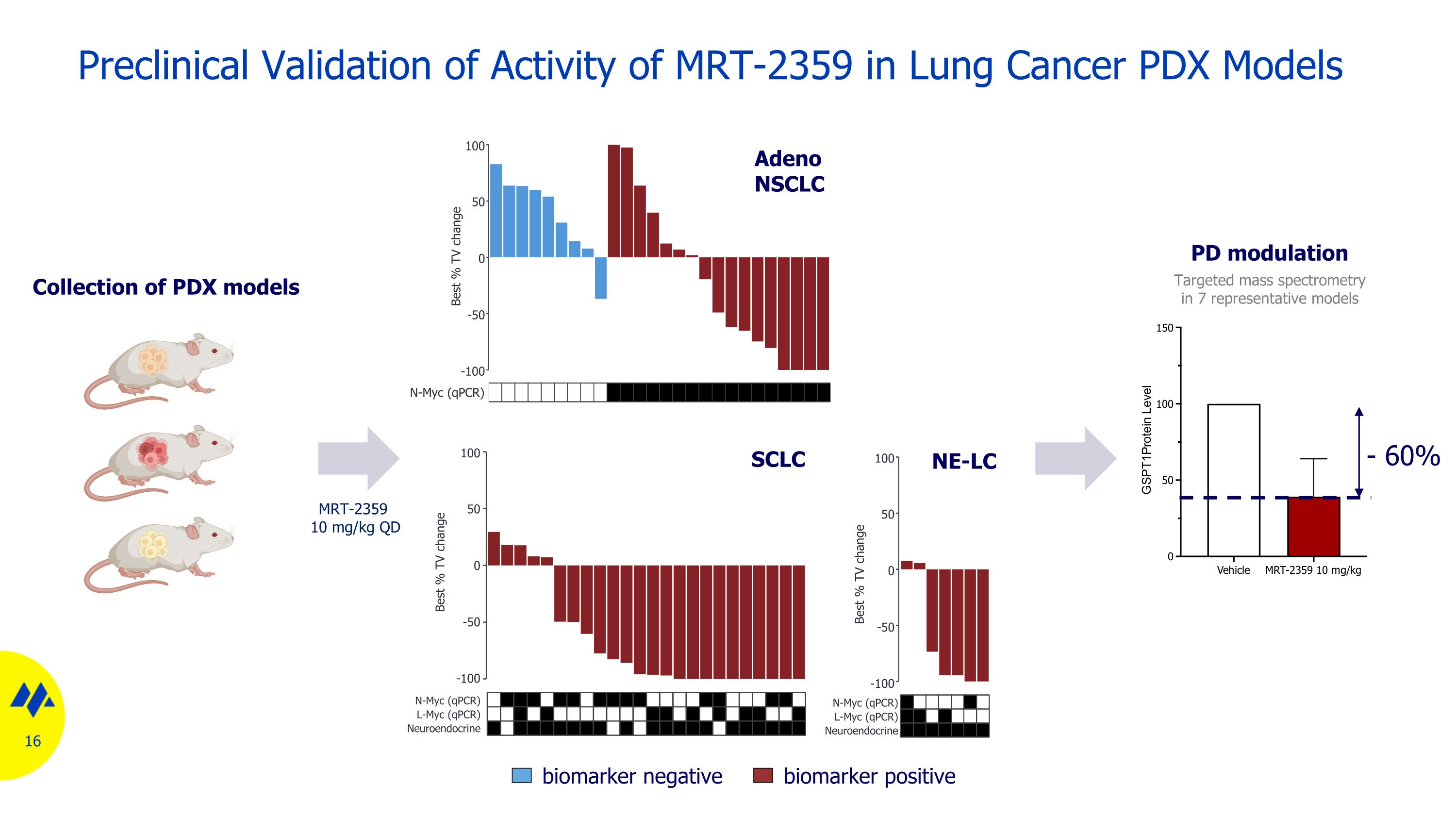
肺癌 MRT-2359 活性的臨牀前驗證 PDX 模型集 16 個 SCLC Adeno NSCLC NE-LC 生物標誌物陰性生物標誌物陽性 7 個代表性模型中的靶向質譜 PD 調製 100 50 0 -50 -100 N-Myc (qPCR) 最佳百分比 TV 變化 100 50 0 -50 -100 N-Myc (qPCR) 最佳百分比 TV 變化 L-Myc (qPCR) 最佳百分比 N-Myc (qPCR) 最佳百分比 TV 變化 NeuroMyc (qPCR) 內分泌 100 50 0 -50 -100 N-Myc (qPCR) 最佳百分比 TV 變化 L-Myc (qPCR) 神經內分泌 MRT-2359 10 mg/kg QD-60%
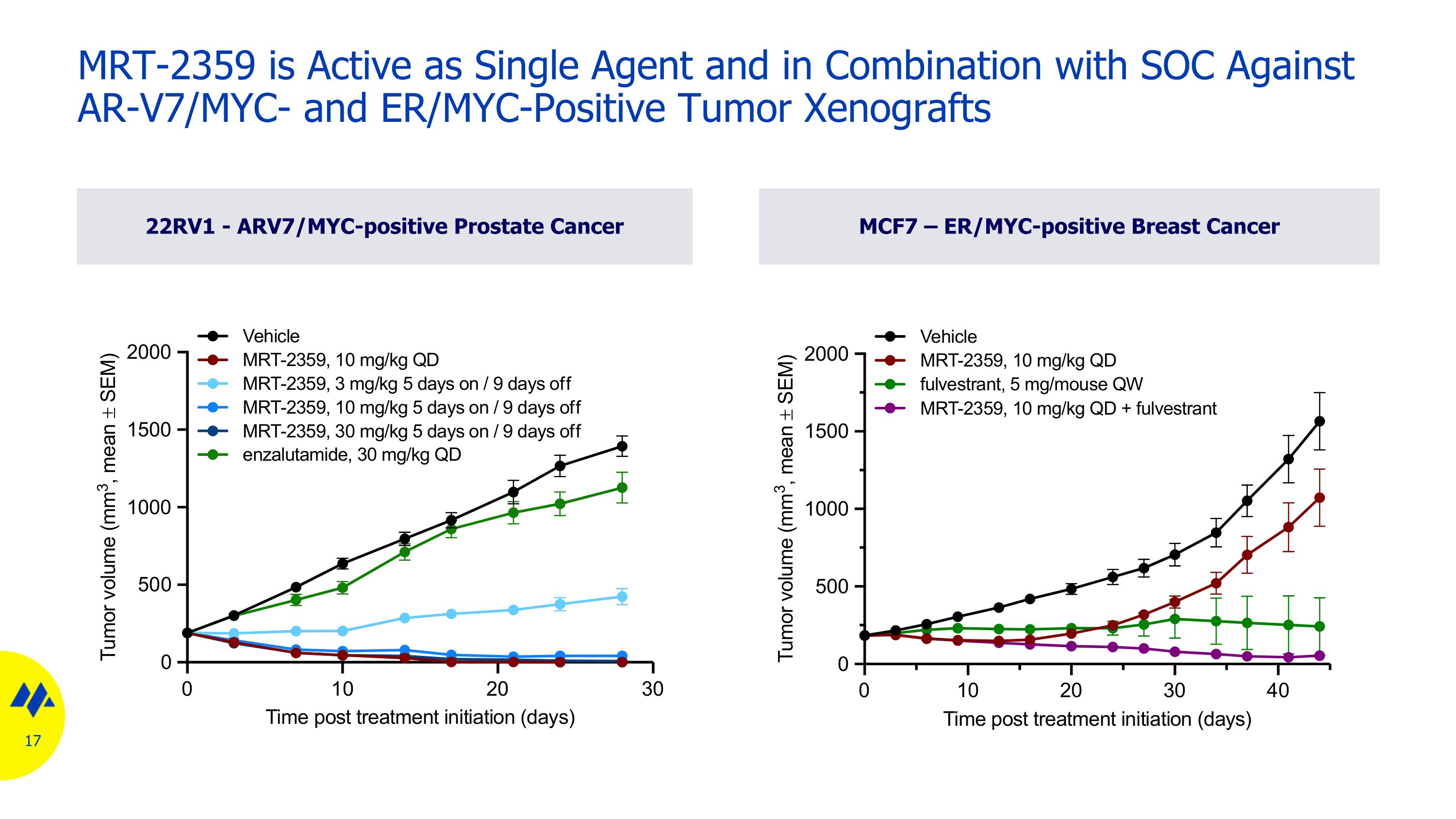
22RV1-ARV7/MYC 陽性前列腺癌 MCF7 — ER/MYC 陽性乳腺癌 MRT-2359 作為單一藥物具有活性,可與 SOC 聯合對抗 AR-V7/MYC 和 ER/MYC 陽性腫瘤異種移植
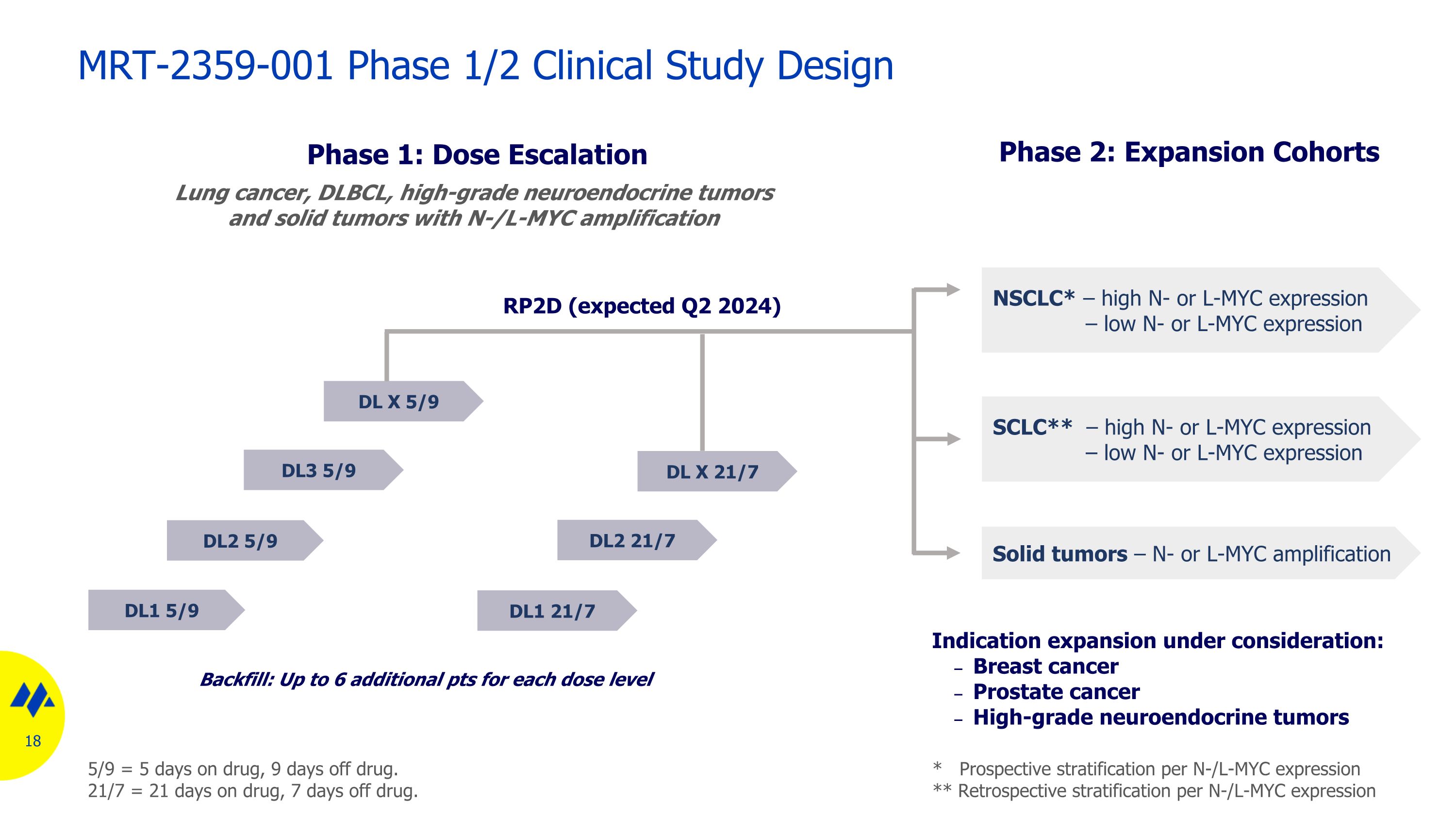
DL1 5/9 第 2 階段:擴展隊列第 1 階段:劑量遞增 DL3 5/9 DL2 5/9 * 每個 N/L-MYC 表達的前瞻性分層 ** 每個 N/L-MYC 表達的回顧性分層 MRT-2359-001 1/2 期臨牀研究設計肺癌、DLBCL、高級神經內分泌腫瘤和實體瘤使用 N/L-MYC 擴增回填:每個劑量水平最多增加 6 分 DL X 21/2 7 DL X 5/9 5/9 = 服藥 5 天,停藥 9 天。21/7 = 服藥 21 天,停藥 7 天。RP2D(預計 2024 年第二季度)DL1 21/7 NSCLC* — 高 N 或 L-MYC 表達 — 低 N 或 L-MYC 表達 SCLC** — 高 N 或 L-MYC 表達 — 低 N 或 L-MYC 表達 — 低 N 或 L-MYC 表達正在考慮擴大適應症:乳腺癌前列腺癌高級神經內分泌腫瘤 18 DL2 21/7

MRT-2359 I 期中期數據-2023 年 10 月 I 期中期分析的目標顯示劑量依賴性 PK 在 PBMC 和組織活檢中顯示 GSPT1 在安全劑量水平下顯著降解(根據臨牀前數據為 60%)分享生物標誌物陽性患者的潛在初步療效信號
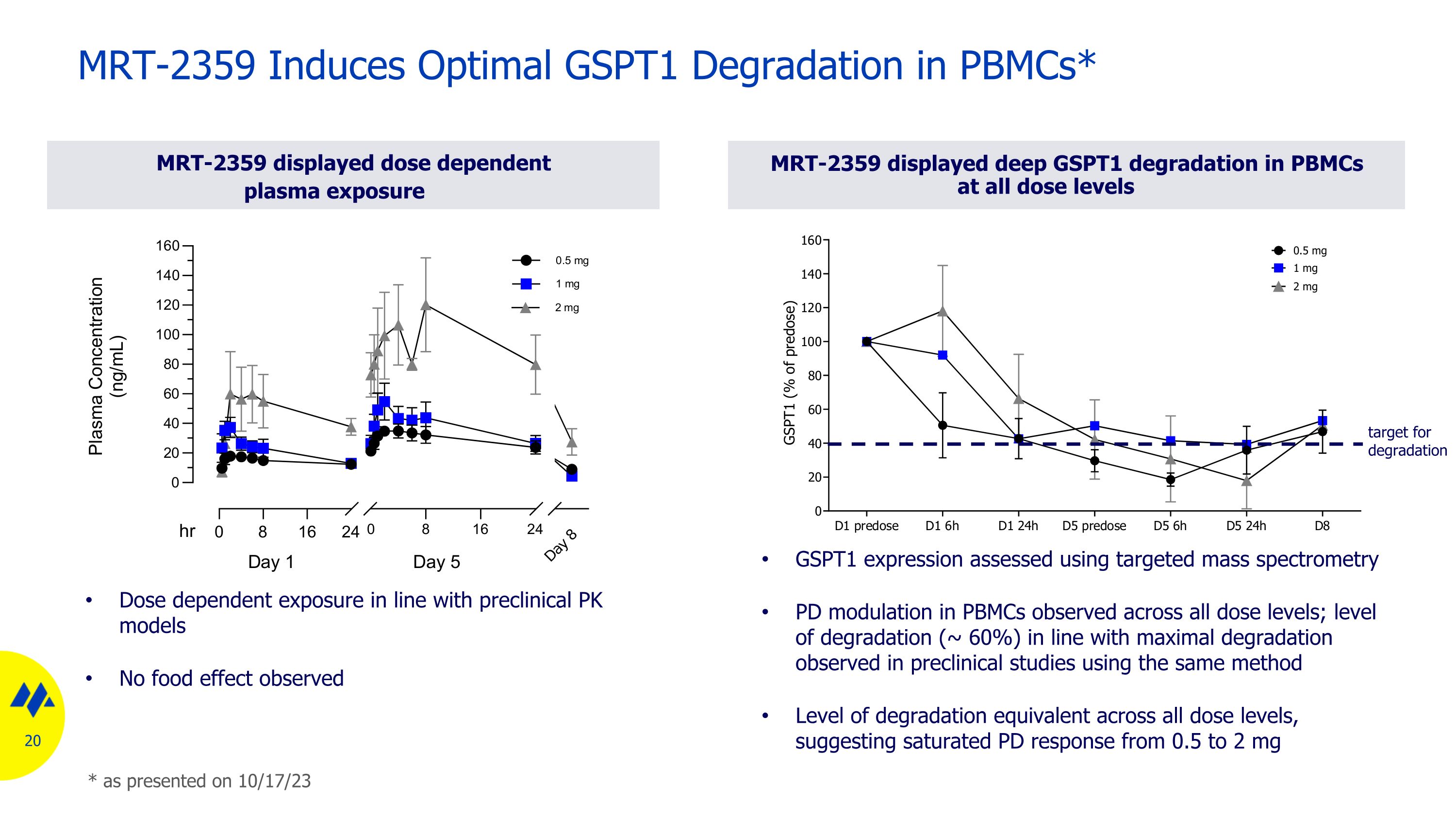
MRT-2359 顯示劑量依賴性血漿暴露 MRT-2359 誘導 pbmcs 最佳 GSPT1 降解* MRT-2359 在所有劑量水平下均顯示 PBMC 的深度 GSPT1 降解 GSPT1 表達使用靶向質譜法評估所有劑量水平下觀察到的 PBMC 的局部調製;降解水平(約 60%)與使用相同方法在臨牀前研究中觀察到的最大降解水平一致,所有劑量水平的降解等效水平,提示飽和 PD 反應介於 0.5 至 2 mg 劑量依賴暴露範圍內使用臨牀前 PK 模型如 23 年 10 月 17 日所述,未觀察到食物效應降解目標*
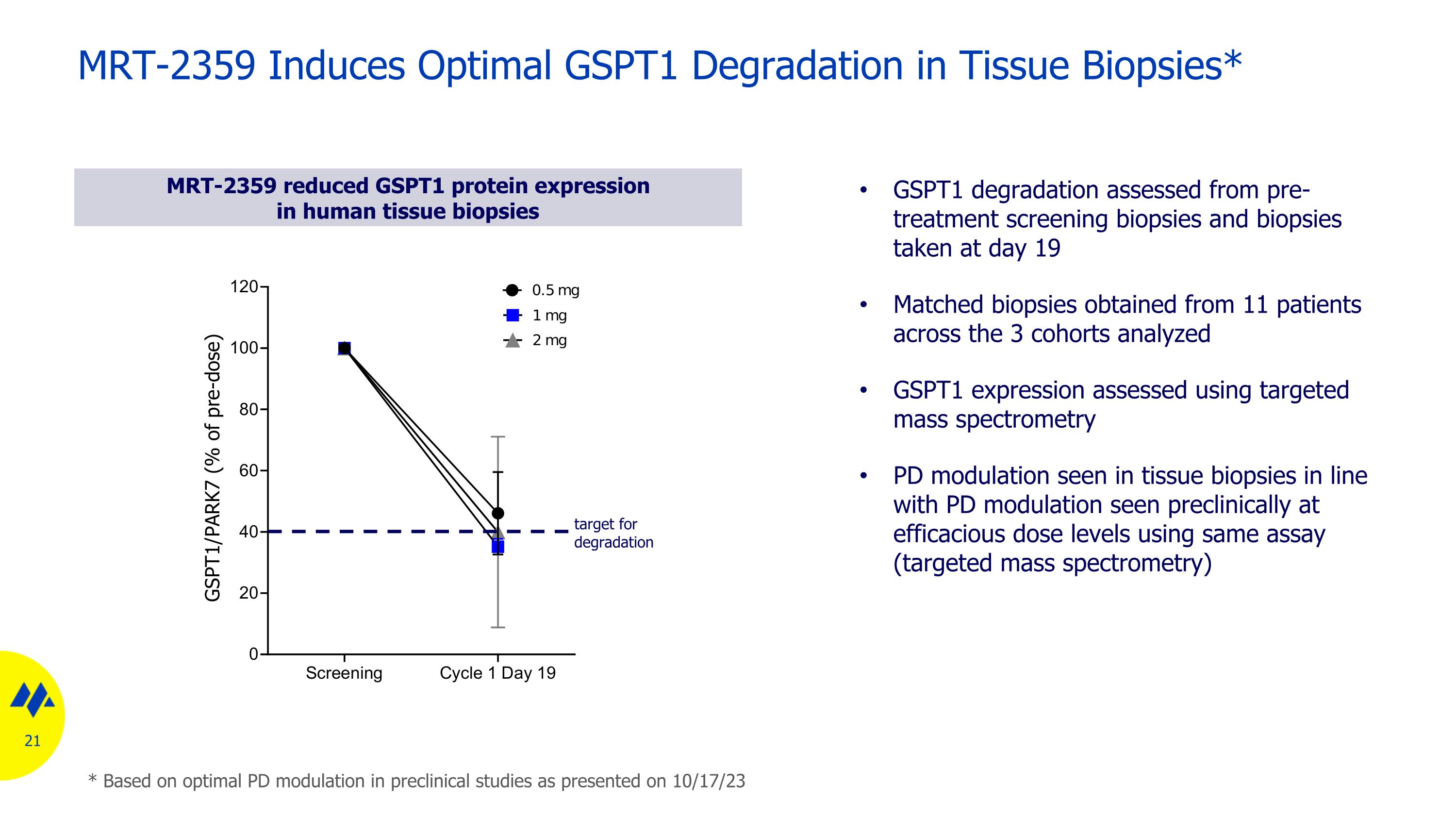
MRT-2359 在組織活檢中誘導最佳 GSPT1 降解* MRT-2359 降低人體組織活檢中的 GSPT1 蛋白表達 GSPT1 降解根據治療前篩查活檢和第 19 天進行的活檢評估。從分析的 3 個隊列中 11 名患者獲得的匹配活檢 GSPT1 表達使用靶向質譜法評估的組織活檢中的 PD 調製與臨牀前使用相同試驗(靶向質譜)靶標在有效劑量水平下看到的 PD 調製一致降級 * 基於最佳 PD 調製在 23 年 10 月 17 日公佈的臨牀前研究中
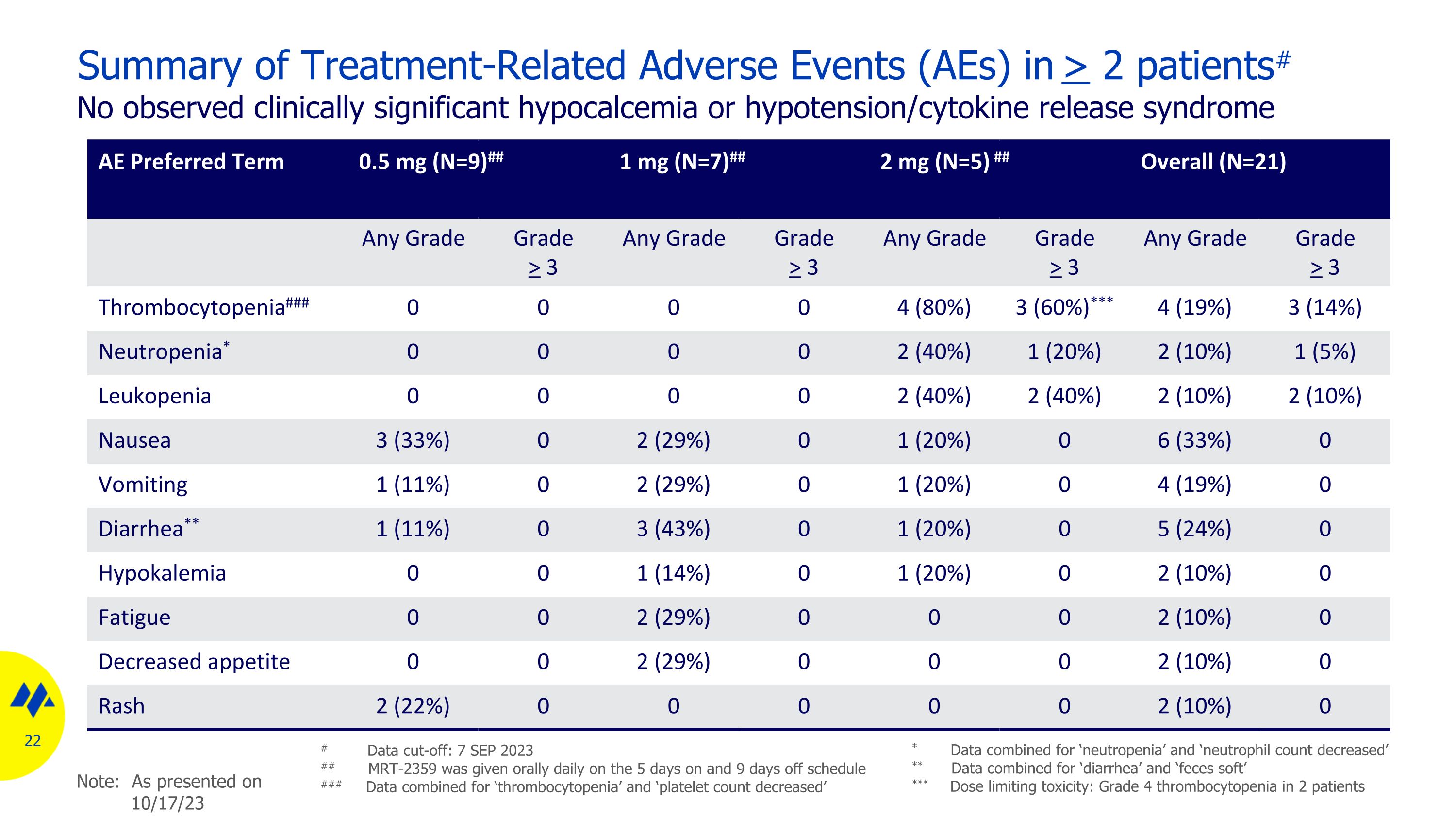
> 2 名患者的治療相關不良事件 (AE) 摘要# 未觀察到臨牀上顯著的低鈣血癥或低血壓/細胞因子釋放綜合徵 AE 首選術語 0.5 mg (N=9) ## 1 mg (N=7) ## 2 mg (N=5) ## 總體 (N=21) 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 > 3 任何等級 topenia### 0 0 0 0 4 (80%) 3 (60%) *** 4 (19%) 3 (14%) 中性粒細胞減少* 0 0 0 0 2 (40%) 1 (20%) 2 (10%) 1 (5%) 1 (5%) 白細胞減少症 0 0 0 0 2 (40%) 2 (40%) 2 (10%) 噁心 3 (33%) 0 2 (29%) 0 1 (20%) 0 6 (33%) 0 嘔吐 1 (11%) 0 2 (29%) 0 1 (20%) 0 4 (19%)0 腹瀉** 1 (11%) 0 3 (43%) 0 1 (20%) 0 5 (24%) 0 低鉀血癥 0 0 1 (14%) 0 1 (20%) 0 2 (10%) 0 疲勞 0 0 2 (29%) 0 0 0 2 (10%) 0 食慾下降 0 0 0 2 (29%) 0 0 0 2 (10%) 0 Rash 2 (22%) 0 0 0 0 2 (2%) 0 10%) 0 # 數據截止日期:2023 年 9 月 7 日 ## MRT-2359 在預期 5 天和 9 天內每天口服 ### “血小板減少症” 和 “血小板數量減少” 的合併數據 * “中性粒細胞減少症” 和 “中性粒細胞數量減少” 的合併數據 ** “腹瀉” 和 “糞便軟化” 的合併數據 *** 劑量限制毒性:4 級血小板減少症 2 年減少症患者注意:如 23 年 10 月 17 日所述
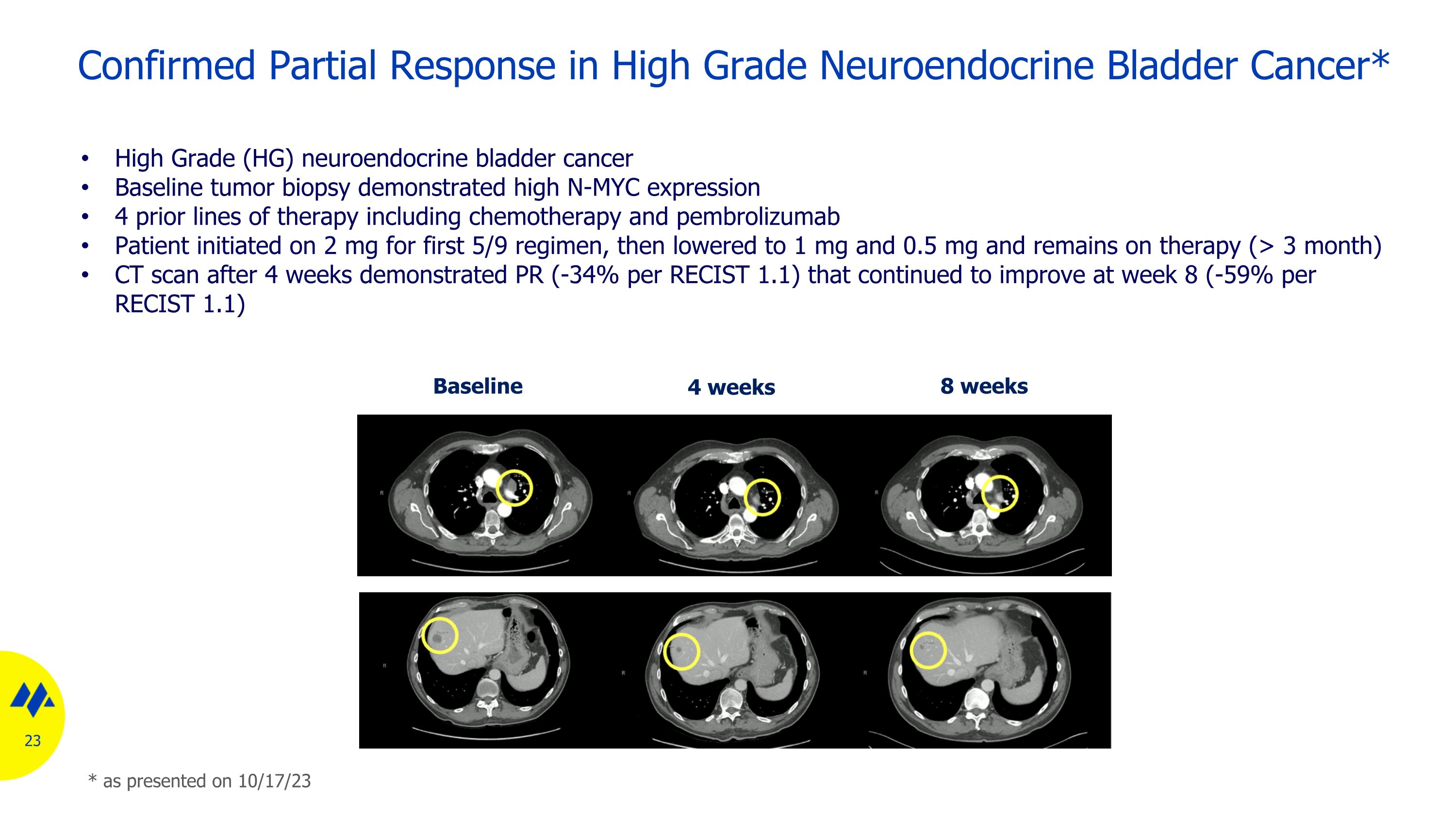
已證實對高級別神經內分泌膀胱癌有部分反應* 基線 8 周 4 周高級 (HG) 神經內分泌膀胱癌基線腫瘤活檢顯示 N-MYC 表達高 4 種先前療法,包括化療和派姆羅利珠單抗患者在最初的 5/9 方案中開始服用 2 mg,然後降至 1 mg 和 0.5 mg,並在 4 周後繼續接受治療(> 3 個月)CT 掃描顯示 PR(每 34%)RECIST 1.1)在第8周繼續改善(根據RECIST 1.1為-59%)*如23年10月17日公佈的那樣
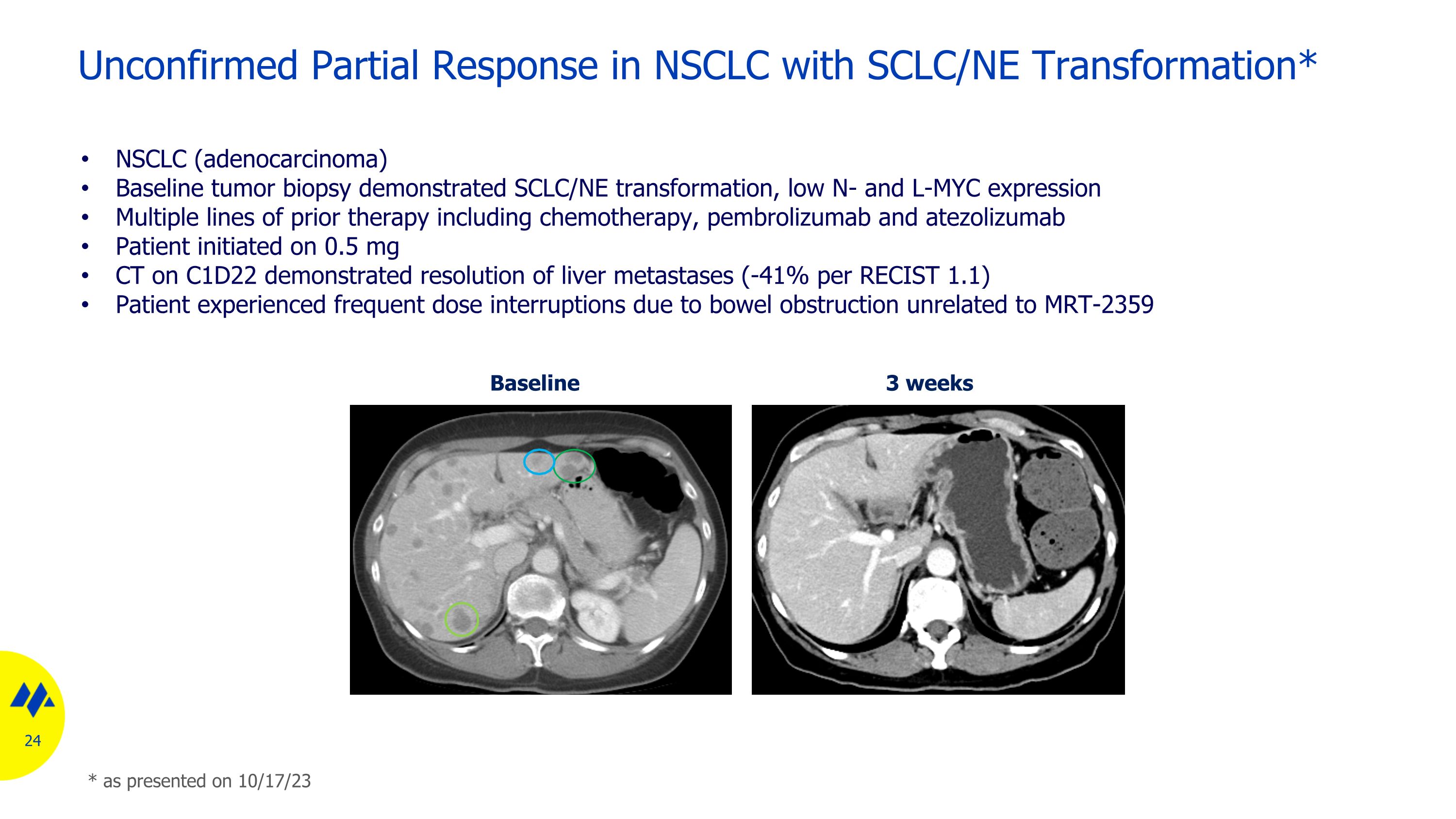
未經證實的 SCLC/NE 轉化對非小細胞肺癌有部分反應* 基線 3 周 NSCLC(腺癌)基線腫瘤活檢顯示 SCLC/NE 轉化、N 和 L-MYC 表達低先前治療包括化療、pembrolizumab 和 atezolizumab 在內的多系先前治療,開始對 C1D22 進行 0.5 mg CT 的患者顯示肝轉移消退(每 RECIST 1.1 患者為 -41%)如 23 年 10 月 17 日所述,由於與 MRT-2359 無關的腸梗阻而頻繁出現劑量中斷
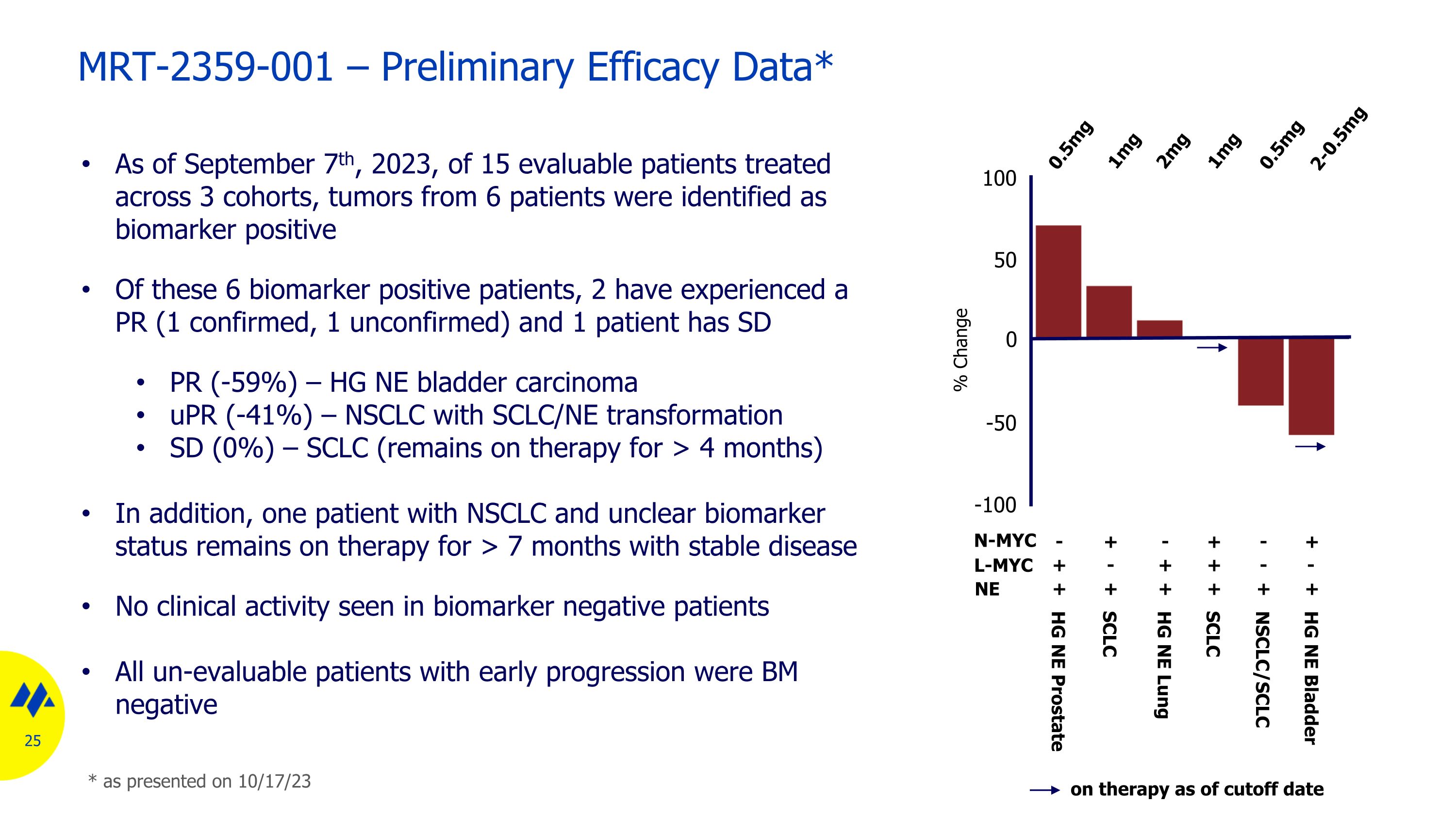
MRT-2359-001 — 初步療效數據* 截至2023年9月7日,在3個隊列治療的15名可評估患者中,來自6名患者的腫瘤被確定為生物標誌物陽性。在這6名生物標誌物陽性患者中,有2名患者經歷了PR(1例確診,1例未經證實),1名患者患有SD PR(-59%)— HG NE 膀胱癌 uPR(-41%)— SCLC/NE轉化為SD(0%)) — SCLC(繼續接受治療超過 4 個月)此外,一名患有非小細胞肺癌且生物標誌物狀態不明的患者仍在接受治療超過 7 個月,病情穩定。沒有臨牀活動在生物標誌物陰性患者中出現所有無法評估的早期進展患者均為 BM 陰性 100 50 0 -50 -100 0.5mg 0.5mg 2mg 1mg 1mg 1mg 1mg HG NE 前列腺小細胞肺小細胞癌 NSCLC/SCLC HG NE Lung HG NE 膀胱自截止日期起治療變化百分比 NMYC + + +--+ + + + + NE L-MYC +---+ + + + + NE L-MYC +----+ + + + + NE L-MYC +----+ + + + + NE L-MYC +----+ + + + + NE L-MYC +-----+ + + + + 如 23 年 10 月 17 日發佈的那樣

臨牀活性劑量具有良好的安全性* 安全性特徵支持進一步發展 GSPT1 在 MYC 高腫瘤細胞中的優先降解速度更快可實現 0.5 和 1 mg 的臨牀活性劑量(AE)——無 ≥3 級 AE,1-2 AE 主要與 GI 相關且可管理未觀察到先前報告的其他 GSPT1 靶向藥物的侷限性在任何劑量下均未觀察到具有臨牀意義的低鈣血癥或低血壓/細胞因子釋放綜合徵 4 級血小板減少症被確定為劑量限制毒性 (DLT) 濃度為 2 mg,安全性良好,缺乏低鈣血癥,這使得人們能夠探索 21/7 的時間表,預計在 2024 年第二季度從 0.5 mg RP2D 起步*,如 23 年 10 月 17 日公佈的

CDK2 節目
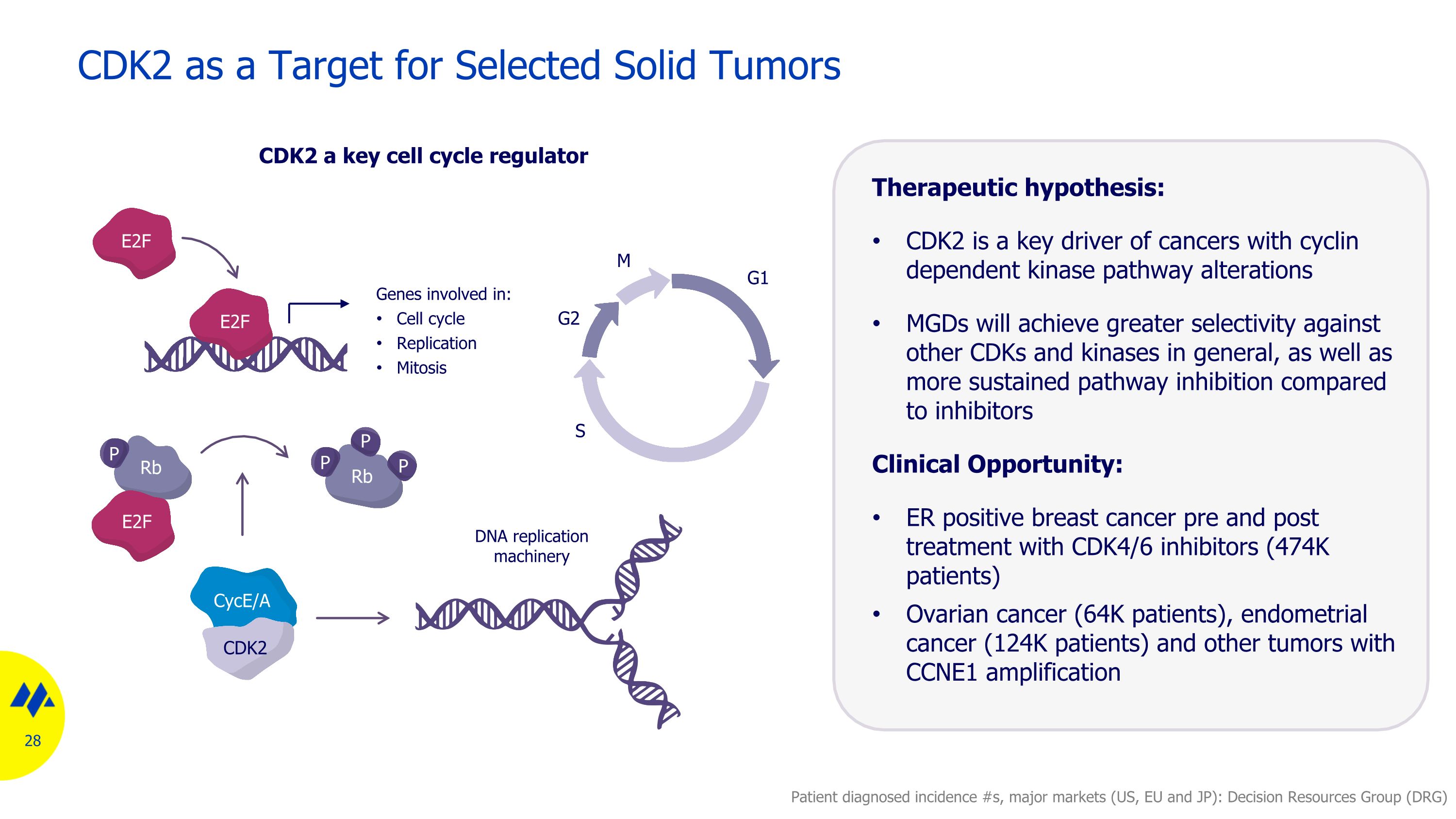
CDK2作為選定實體瘤的靶標治療假設:CDK2是細胞週期蛋白依賴激酶路徑改變的癌症的關鍵驅動因素,與抑制劑相比,MGD將對其他CDK和激酶實現更大的選擇性,以及更持續的路徑抑制作用臨牀機會:使用CDK4/6抑制劑治療前後ER陽性乳腺癌(474K患者)卵巢癌(64K患者),子宮內膜癌(12.4 萬名患者)和其他採用 CCNE1 擴增 CDK2 的腫瘤患者已確診發生率 #s,主要市場(美國、歐盟和日本):決策資源小組(DRG)S G2 M G1 參與的基因:細胞週期複製有絲分裂 P P P 4EBP1 Rb P P P 4EBP1 Rb P E2F E2F E2F E2F E2F E2F DNA 複製機制 cyce/A CDK2
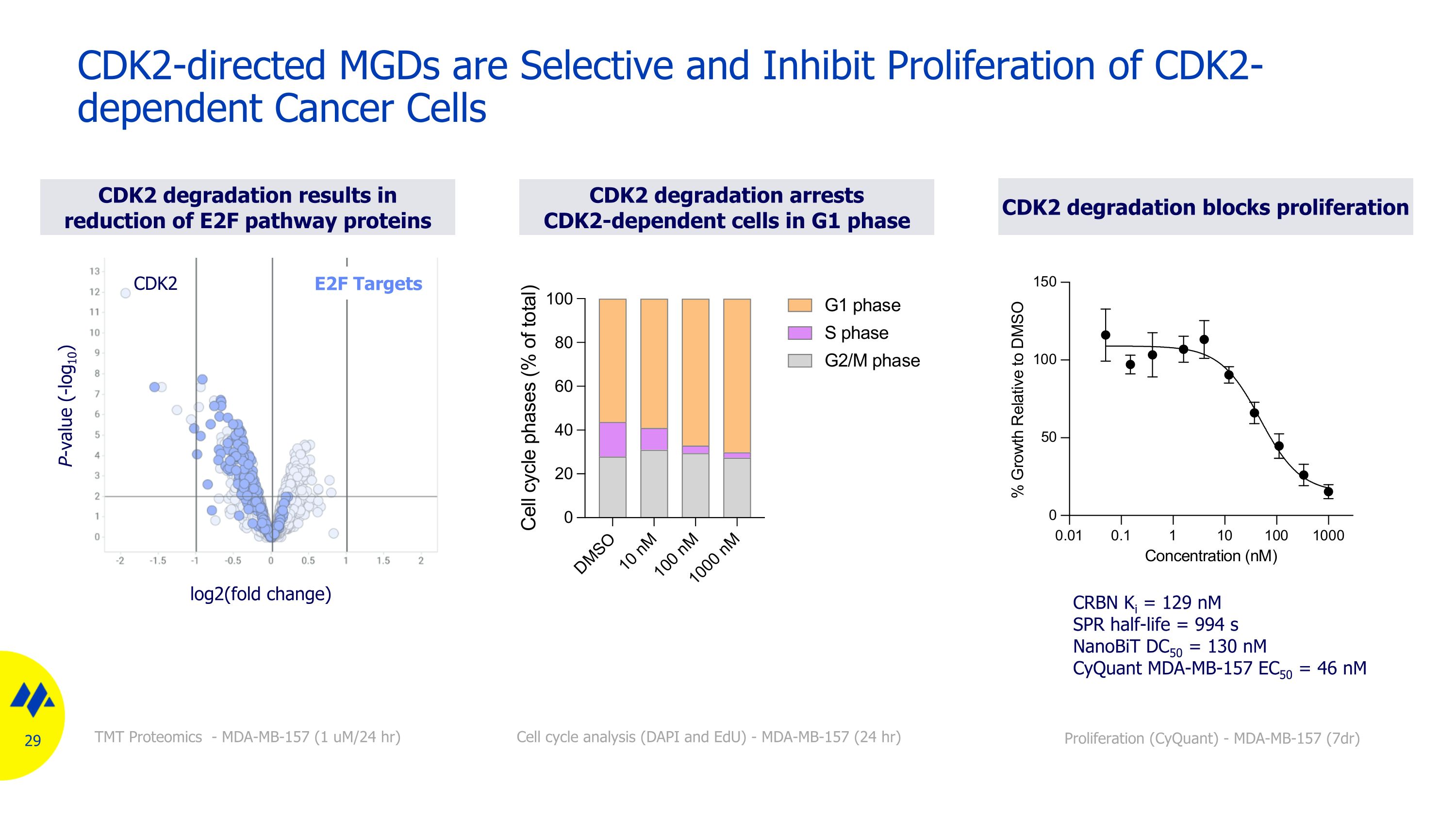
導向 CDK2 的 MGD 具有選擇性,可抑制 CDK2 依賴性癌細胞的增殖 CDK2 降解在 G1 階段阻止 CDK2 依賴細胞 CDK2 降解導致 E2F 途徑蛋白降解減少 E2F 途徑蛋白質細胞週期分析(DAPI 和 edU)-MDA-MB-157(24 小時)TMT 蛋白質組學-MDA-MB-157(1 um/24 小時)log2(摺疊變化)CDK2 E2F 目標 P 值(-log10)CDK2 降解阻斷增殖 CRBN Ki = 129 nM SPR 半衰期 = 994 s nanoBit DC50 = 130 nM cyQuant MDA-MB-157 EC50 = 46 nM 增殖 (cyQuant)-MDA-MB-157 (7dr)
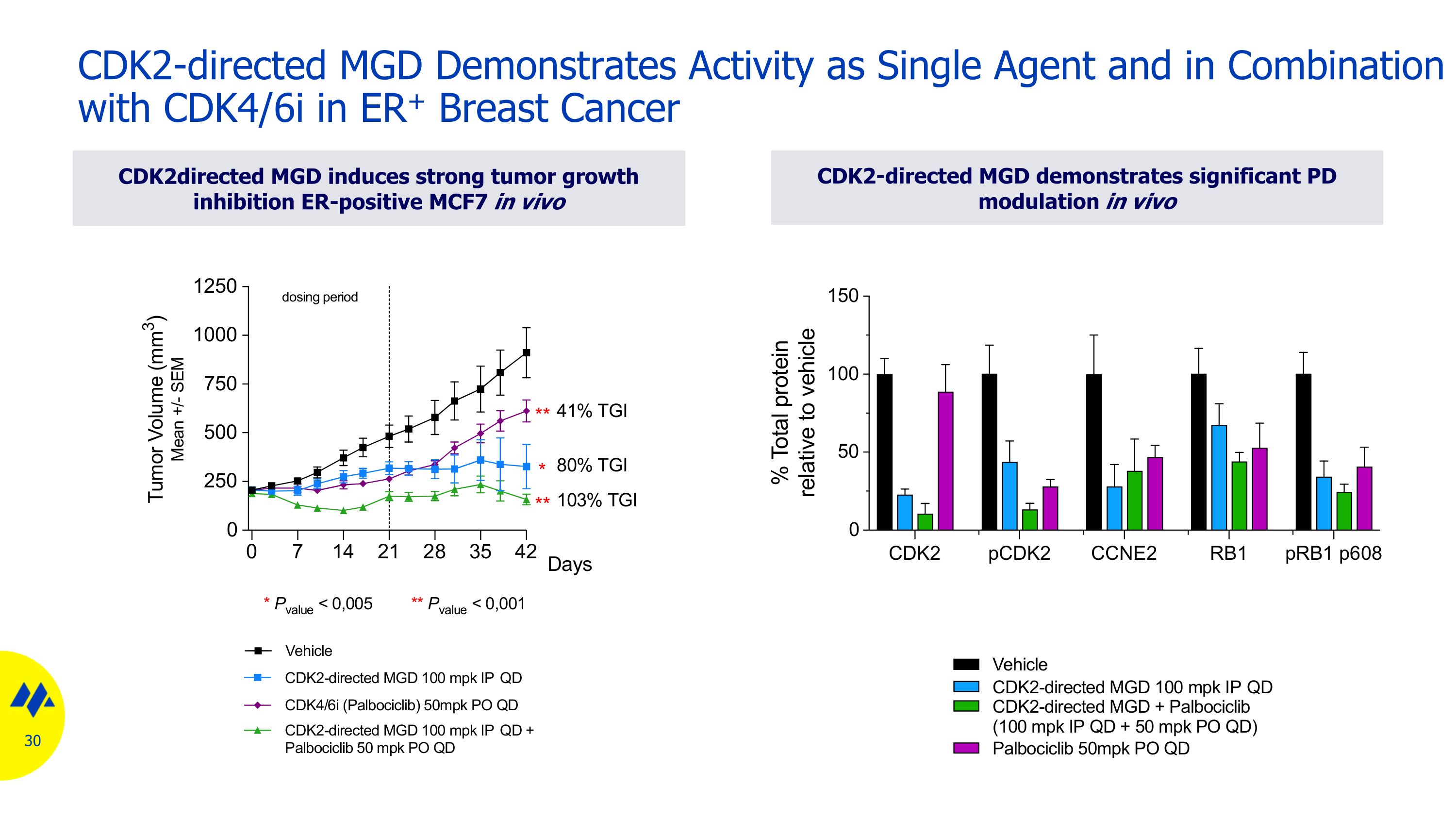
CDK2 導向 MGD 作為單一藥物表現出活性,與 CDK4/6i 聯合應用於ER+ 乳腺癌 CDK2 導向 MGD 可誘導強烈的腫瘤生長抑制 ER陽性 MCF7 體內 CDK2 導向 MGD 在體內表現出顯著的 PD 調節

炎症和免疫學 (I&I) 項目
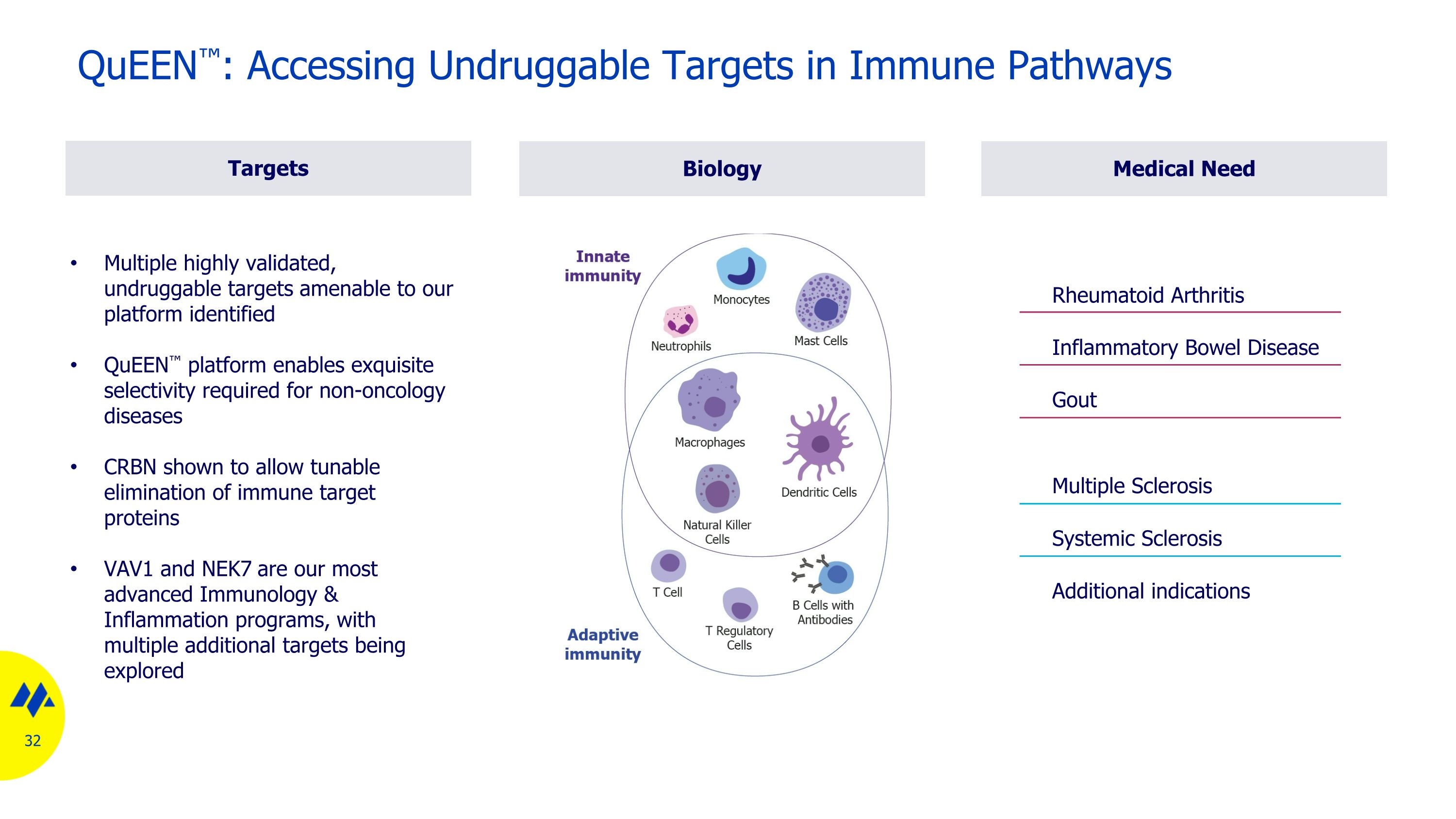
生物學多個經過高度驗證、不可藥物的靶標均適用於我們的平臺 queEN 平臺可實現非腫瘤學疾病所需的精細選擇性 CRBN 被證實允許可調消除免疫靶蛋白 VAV1 和 NEK7 是我們最先進的免疫學和炎症項目,還有多個其他靶點正在探索中 Queen:獲取免疫途徑中不可藥物的靶點醫療需求靶點其他適應症系統性硬化多發性硬化類風濕性關節炎炎性腸病痛風

VAV1 計劃
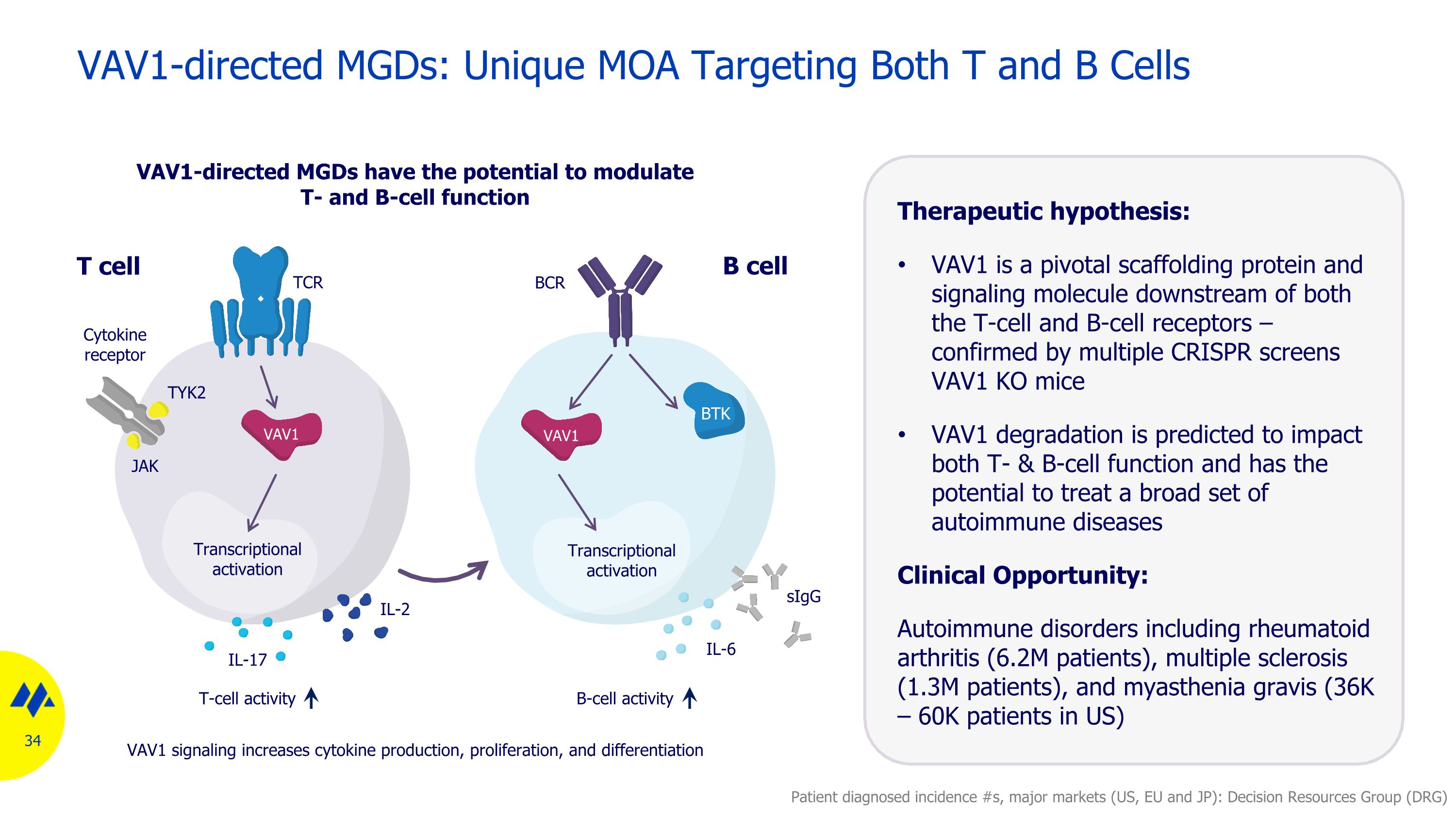
VAV1 導向 MGD:針對 T 和 B 細胞的獨特MOA 治療假設:VAV1 是 T 細胞和 B 細胞受體下游的關鍵支架蛋白和信號分子,經多個 CRISPR 篩查證實 VAV1 KO 小鼠 VAV1 降解預計將影響 T 細胞和 B 細胞功能,並有可能治療多種自身免疫性疾病臨牀機會:包括風濕病在內的自身免疫性疾病類關節炎(620萬名患者)、多發性硬化症(130萬名患者)和重症肌無力(美國有3.6萬至6萬名患者)患者診斷髮病率 #s,主要市場(美國、歐盟和日本):決策資源組(DRG)細胞因子受體 TYK2 JAK TCR T 細胞 B 細胞 BCR BCR IL-2 IL-17 sigG IL-6 T 細胞活性 B 細胞活性轉錄激活 VAV1 信號傳導可增加細胞因子的產生、增殖和分化轉錄激活 VAV1 導向 MGD 有可能調節 T 和 B 細胞功能 VAV1 VAV1
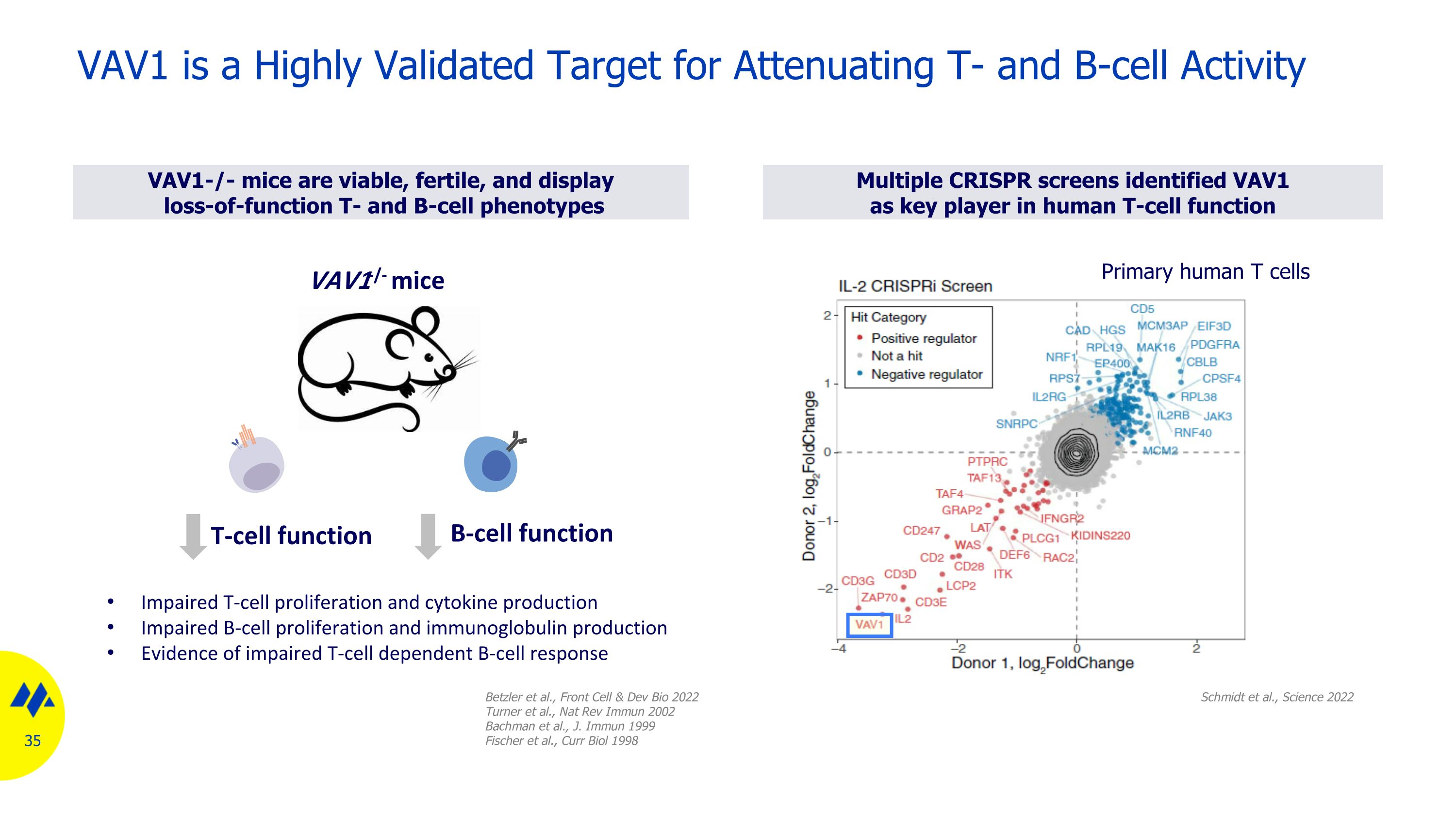
VAV1-/-小鼠是可存活、有生育能力並表現出功能喪失的 T 細胞和 B 細胞表型多個 CRISPR 屏幕將 VAV1 確定為人類 T 細胞功能的關鍵參與者 VAV1 是經過高度驗證的減弱 T 細胞和 B 細胞活性的靶標 Schmidt 等人,《科學》2022年原發人類 T 細胞 Betzler 等人,Front Cell & Dev Bio 2022 Turner 等人,Nat Rev Immun 2002 Bachman 等人,J. Immun 1999 Fischer 等人,Curr Biol 1998 年 T 細胞功能 B 細胞功能 VAV1-/-小鼠 T 細胞增殖和細胞因子產生受損 B 細胞增殖受損和免疫球蛋白產生 T 細胞依賴性 B 細胞反應受損的證據
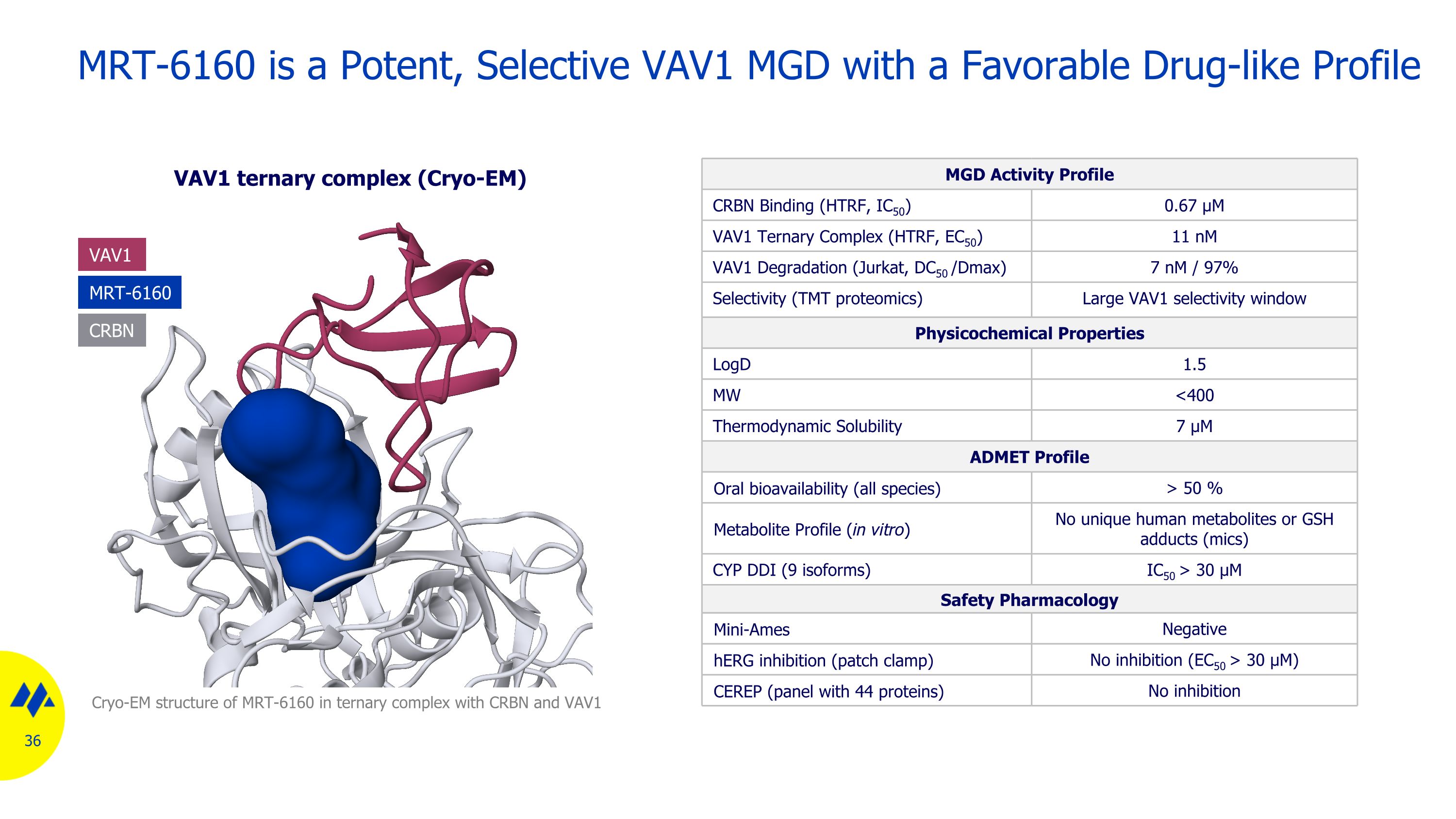
MRT-6160 是一種強效的選擇性 VAV1 MGD,具有良好的藥物樣特徵 VAV1 三元複合物(cryo-em)MGD 活性曲線 CRBN 結合(HTRF、IC50)0.67 µM VAV1 三元複合物(HTRF、EC50)11 nM VAV1 降解(Jurkat、DC50 /dmax)7 nM/97% 選擇性(TMT 蛋白質組學)大 VAV1 選擇性窗口物理化學特性 logD 1.5 MW 50% 代謝物譜(體外)沒有獨特的人類代謝物或谷胱甘肽加合物(mics)CYP DDI(9 種亞型)IC50 > 30 μM 安全藥理學 mini-Ames 陰性 HerG 抑制(補丁鉗)無抑制(EC50 > 30 µM)CEREP(包含 44 種蛋白質的試劑盒)在 CRBN 和 VAV1 的三元複合物中 MRT-6160 沒有抑制 cryo-em 結構 MRT-6160 VAV1 CRBN
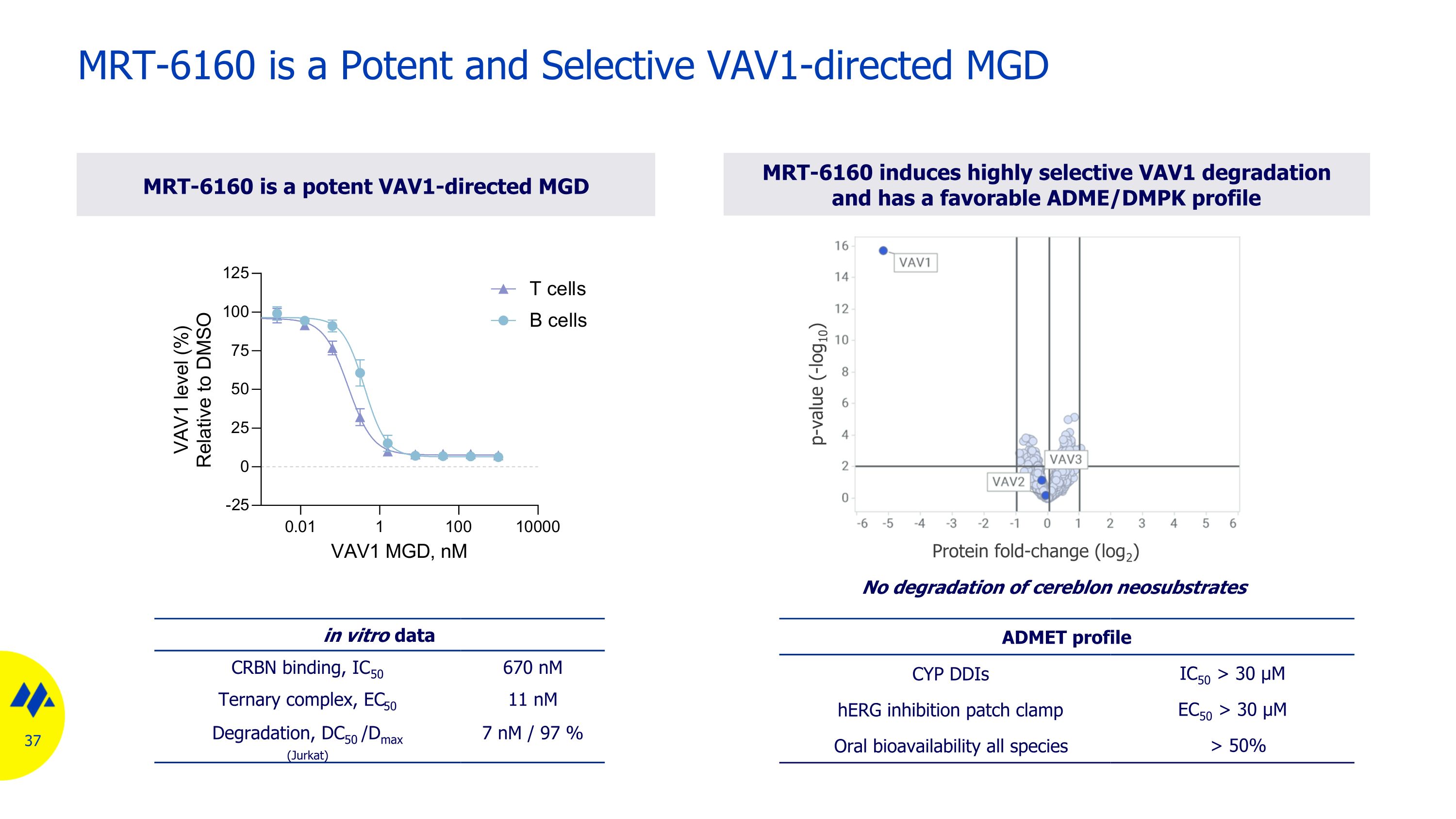
MRT-6160 是一種有效的選擇性 VAV1 導向 MGD 的體外數據 CRBN 結合,IC50 670 nM 三元複合物,EC50 11 nM 降解,DC50 /Dmax (Jurkat) 7 nM/97% MRT-6160 誘導高選擇性 VAV1 降解,具有良好的 ADME/DMK 特徵 MRT-6160 是一種強效的 VAV1 導向 MGD ADMET 特徵 CYP ddIS IC50 > 30 µM hERG ing 抑制貼片鉗 EC50 > 30 µM 口服生物利用度所有物種 > 50% p 值 (-log10) 蛋白質摺疊變化 (log2) 不降解大腦新底物
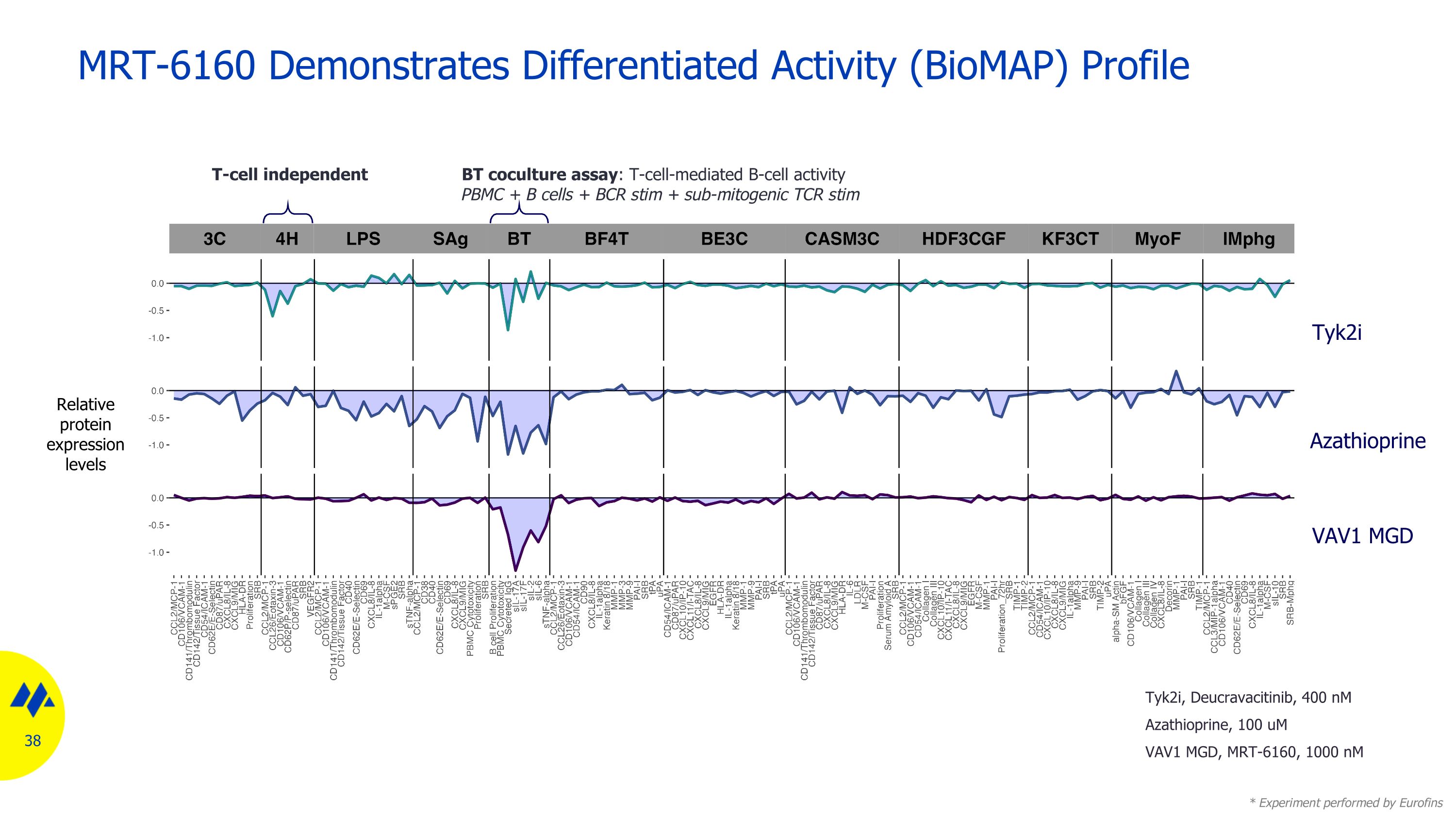
MRT-6160 表現出差異化活性 (BioMap) 分佈相對蛋白表達水平 Azathioprine VAV1 MGD tyk2i BT 共培養試驗:T 細胞介導的 B 細胞活性 PBMC + B 細胞 + BCR stim + 亞絲裂原 TCR stim * 由 Eurofins T 細胞無關 TCR stim 進行的實驗,Deucravacitinib,400 nM 硫唑嘌呤,100 uM VAZATHIOPRINE AV1 MGD,MRT-6160,1000 nM
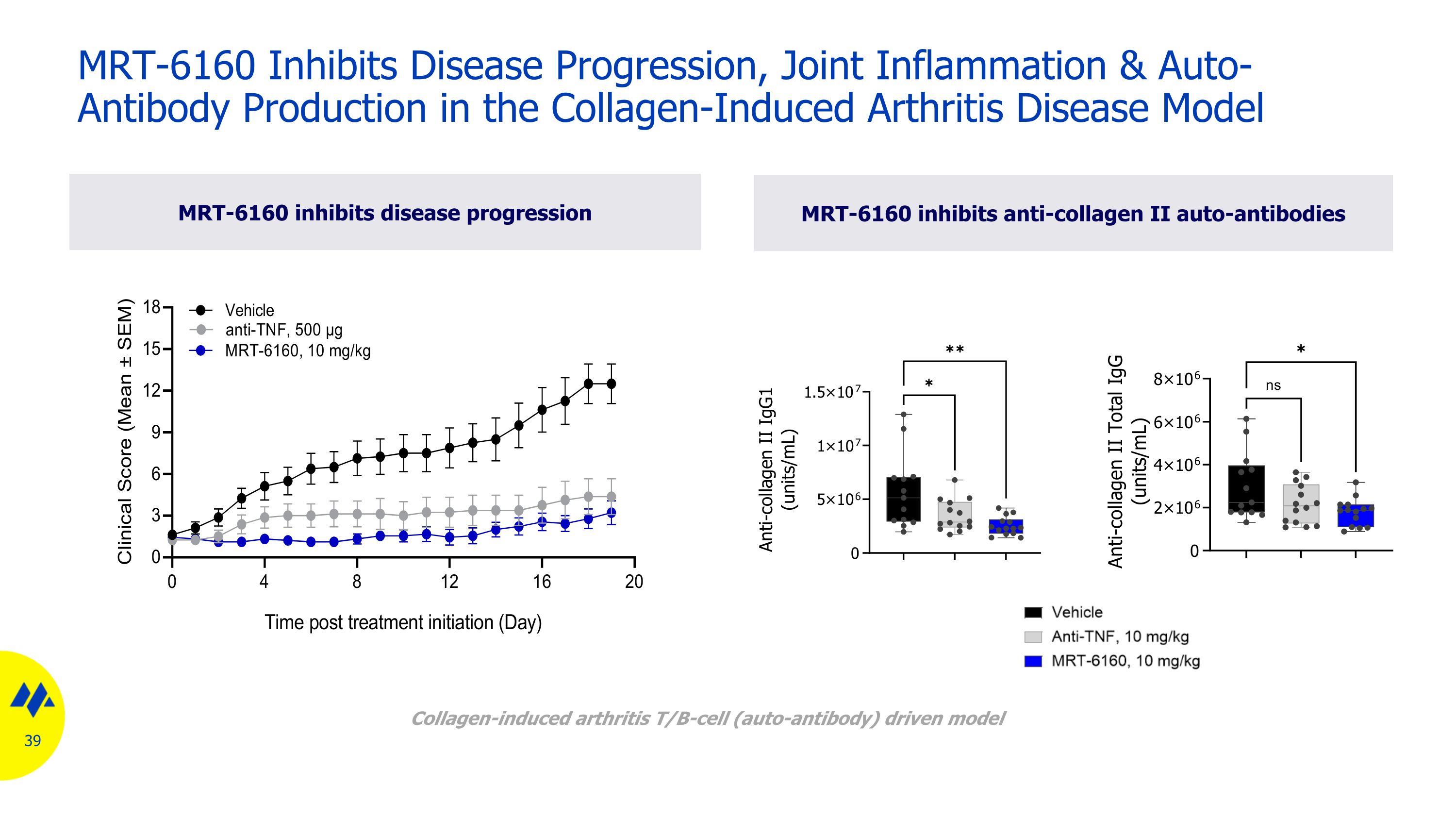
MRT-6160 抑制膠原誘發性關節炎疾病模型中的疾病進展、關節炎和自身抗體產生 MRT-6160 抑制抗膠原蛋白 II 自身抗體 MRT-6160 抑制疾病進展膠原誘導的關節炎 T/B 細胞(自身抗體)驅動模型
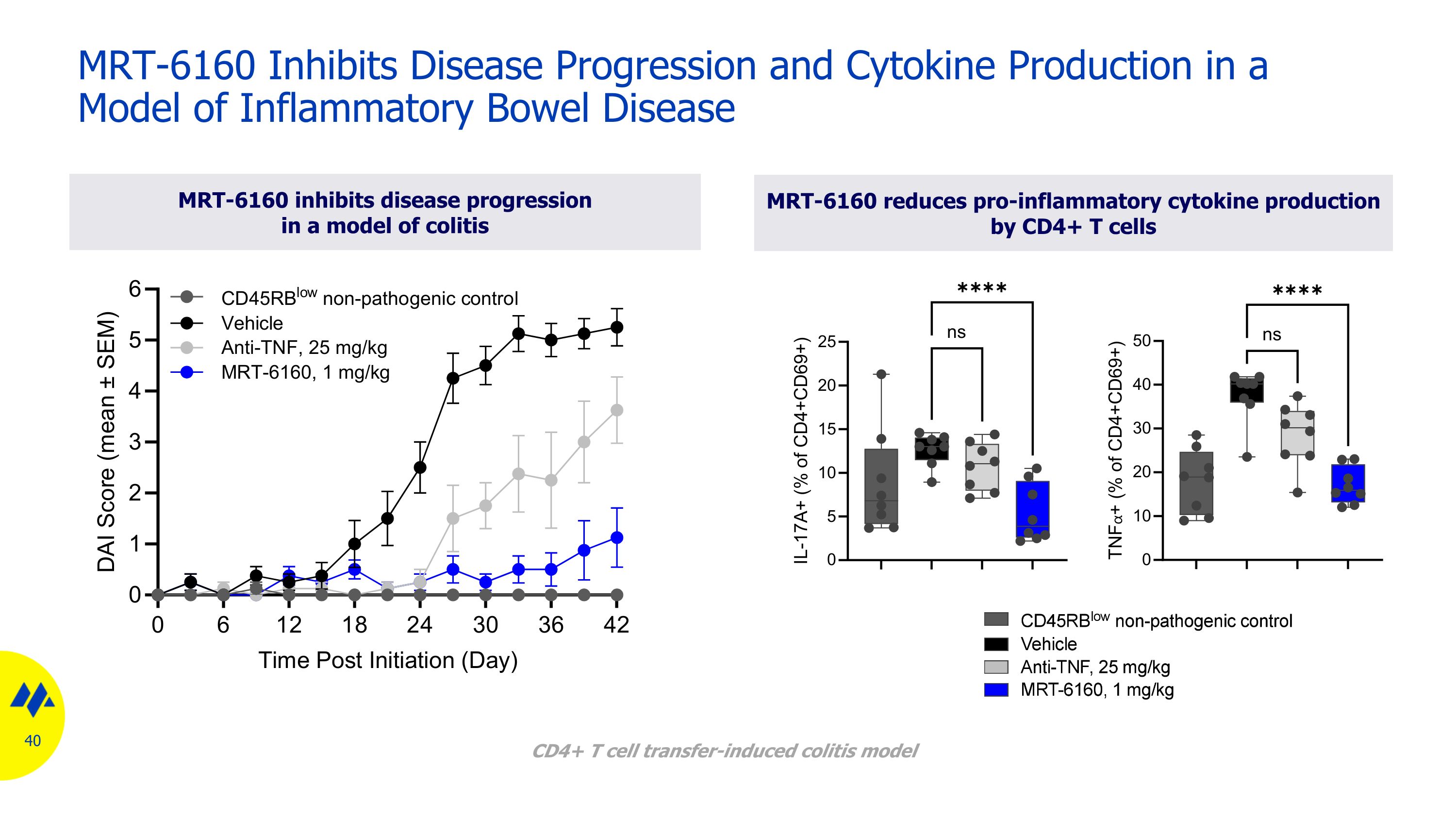
MRT-6160 抑制炎性腸病模型中的疾病進展和細胞因子產生 MRT-6160 可降低 CD4+ T 細胞產生促炎細胞因子 MRT-6160 抑制結腸炎模型中的疾病進展 CD4+ T 細胞轉移誘導的結腸炎模型
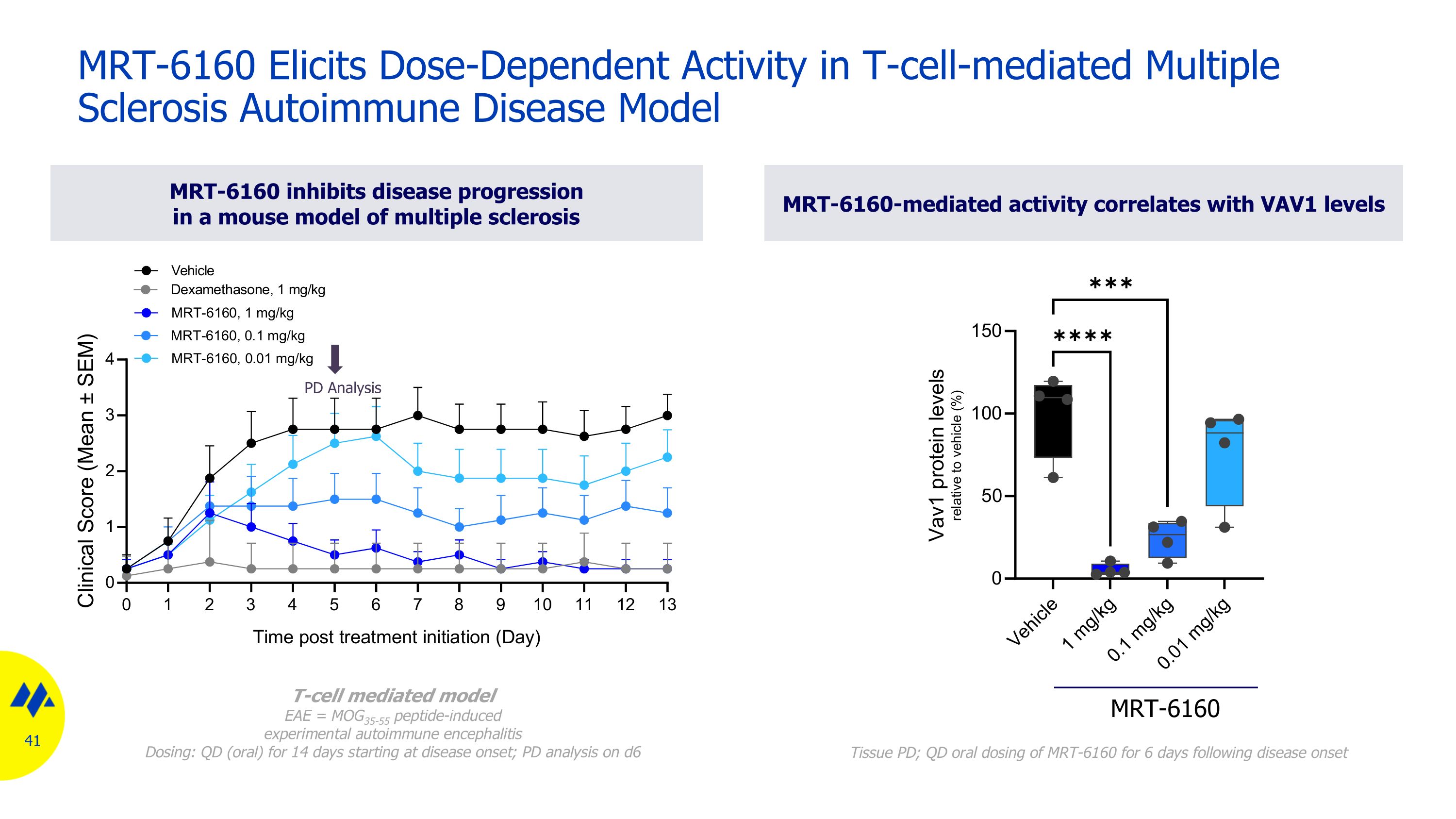
PD 分析 MRT-6160 抑制多發性硬化症小鼠模型中的疾病進展 mrt-6160 介導的活性與 VAV1 水平相關 T 細胞介導模型 EAE = MOG35-55 肽誘導的實驗性自身免疫性腦炎劑量:從發病開始 14 天 QD(口服);d6 MRT-6160 組織 PD 分析;QD 在發病後 6 天內口服 MRT-6160 劑量 MRT-6160 Elicits 劑量 T 細胞介導的多發性硬化症自身免疫性疾病模型中的依賴活性
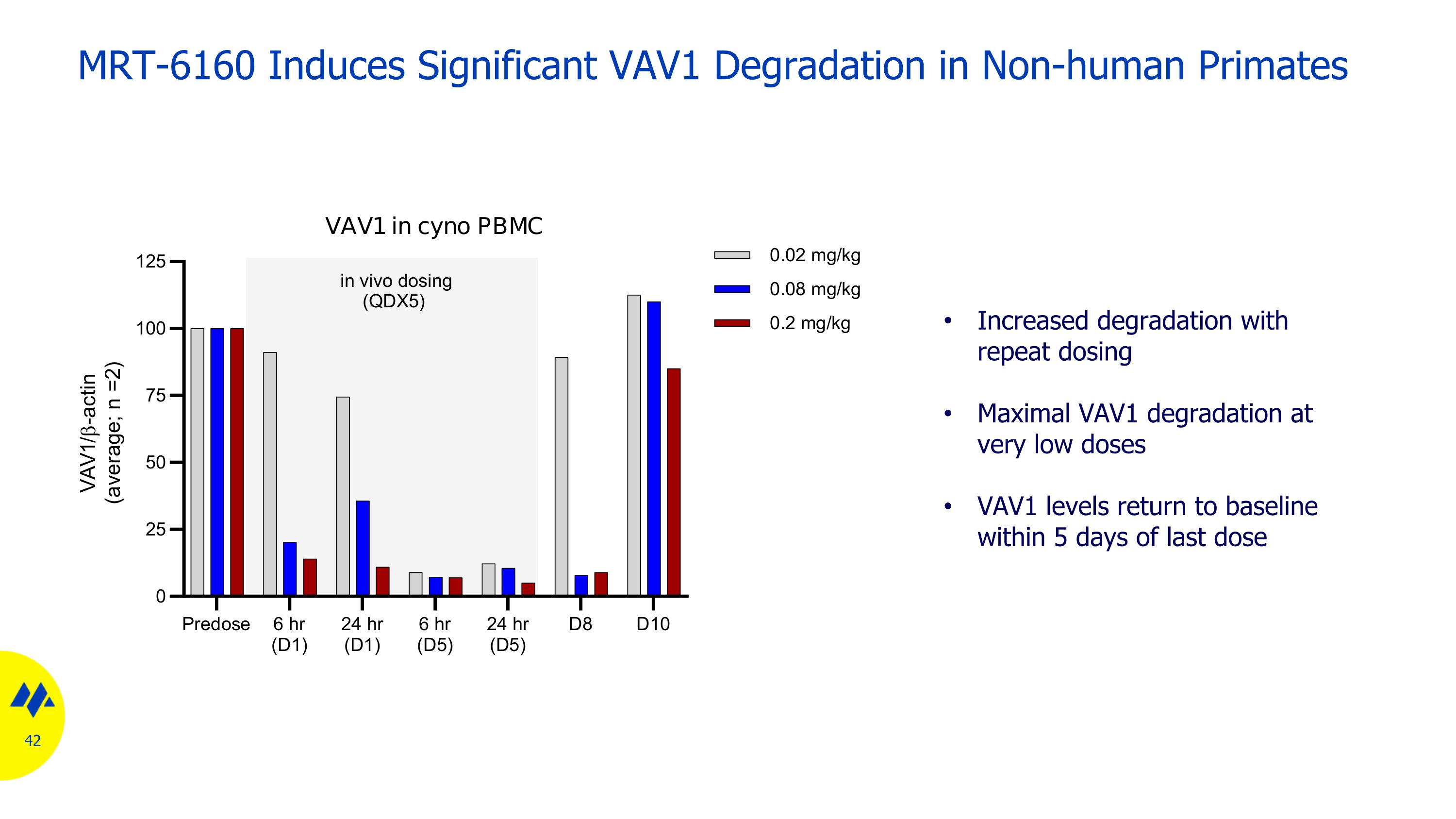
MRT-6160 在非人靈長類動物中誘發顯著 VAV1 降解重複給藥後降解加劇極低劑量下最大 VAV1 降解 VAV1 水平在最後一次給藥後 5 天內恢復到基線
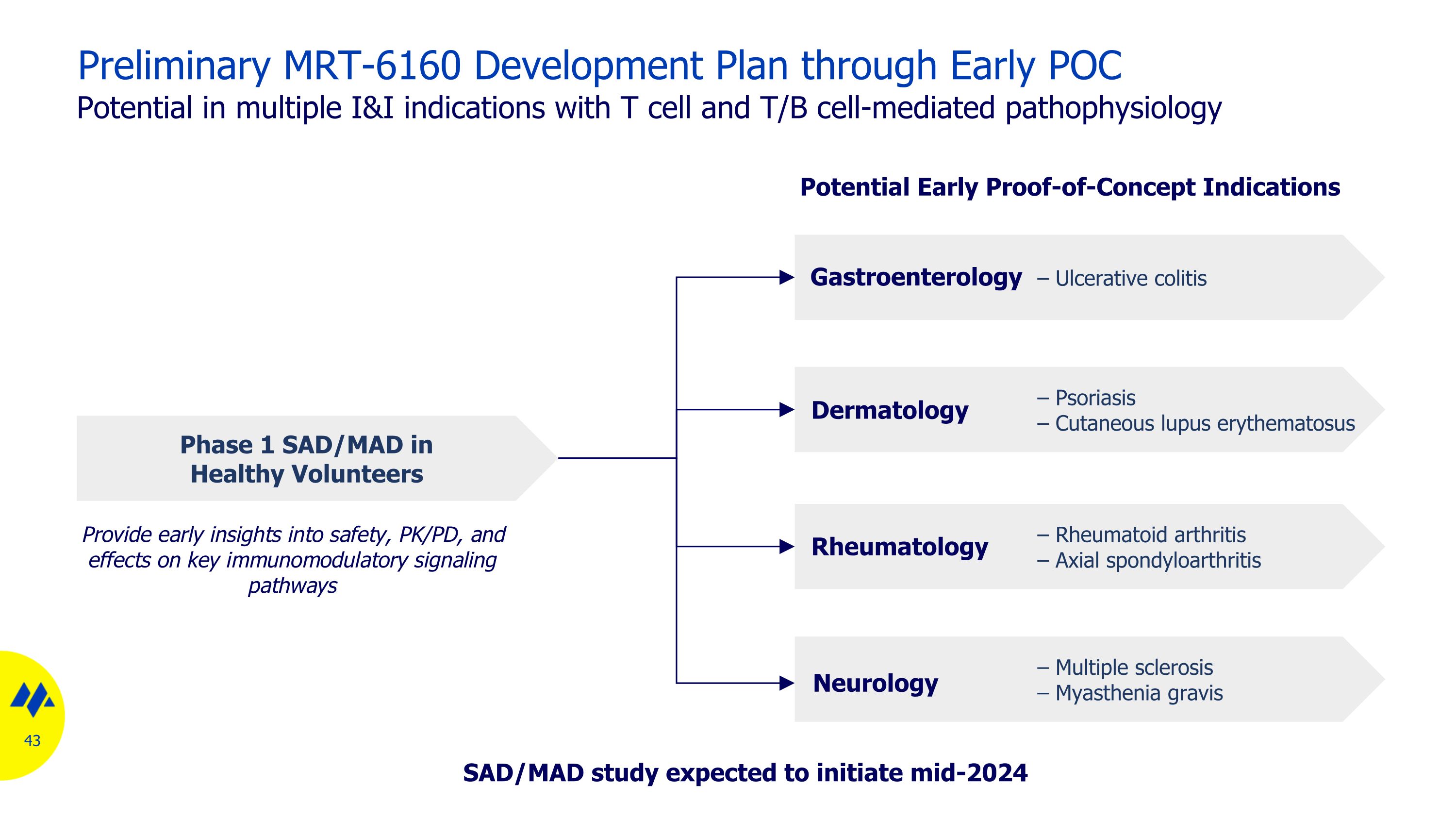
通過多個 I&I 適應症的早期 POC 潛力進行初步的 MRT-6160 開發計劃,具有 T 細胞和 T/B 細胞介導的病理生理學潛在的早期概念驗證適應症,提供對安全性、PK/PD 以及對關鍵免疫調節信號通路的影響的早期見解 — 健康志願者的潰瘍性結腸炎 SAD/MAD — 銀屑病 — 皮膚紅斑狼瘡皮膚科胃腸病學 — 風濕類關節炎 — 軸向脊柱關節炎風濕病學 — 多發性硬化 — 重症肌無力神經病學 SAD/MAD 研究有望在中期啟動-2024

NEK7 計劃
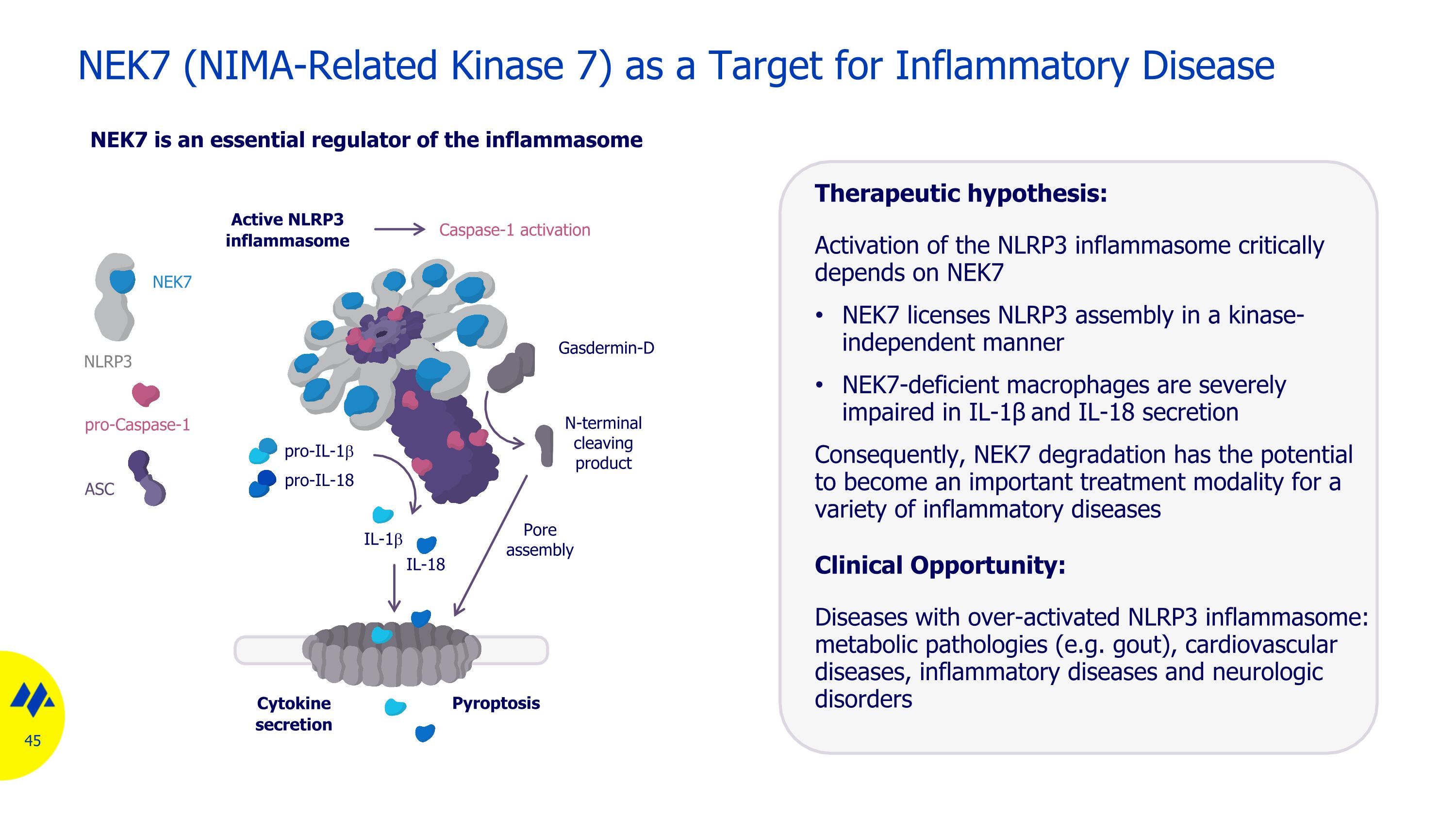
NEK7(與 NIMA 相關的激酶 7)作為炎症性疾病的靶標 NEK7 是炎症體治療假設的重要調節劑:NLRP3 炎性小體的激活關鍵依賴於 NEK7 以與激酶無關的方式組裝 NLRP3 的組裝 NEK7 缺乏 NEK7 的巨噬細胞在 IL-1β 和 IL-18 的分泌中受到嚴重損害。因此,NEK7 降解有可能成為一種重要的治療方式各種炎症性疾病臨牀機會:過度活化的 NLRP3 炎症小體的疾病:代謝病理學(例如痛風)、心血管疾病、炎症性疾病和神經系統疾病 Active NLRP3 炎性小體 pro-IL-1b IL-1b Gasdermin-D N 末端切割產物 Caspase-1 激活 pro-IL-18 細胞因子分泌 Pyroptosis pro-caspase-1 NEK7 NLRP3 ASC IL-18 孔隙組裝
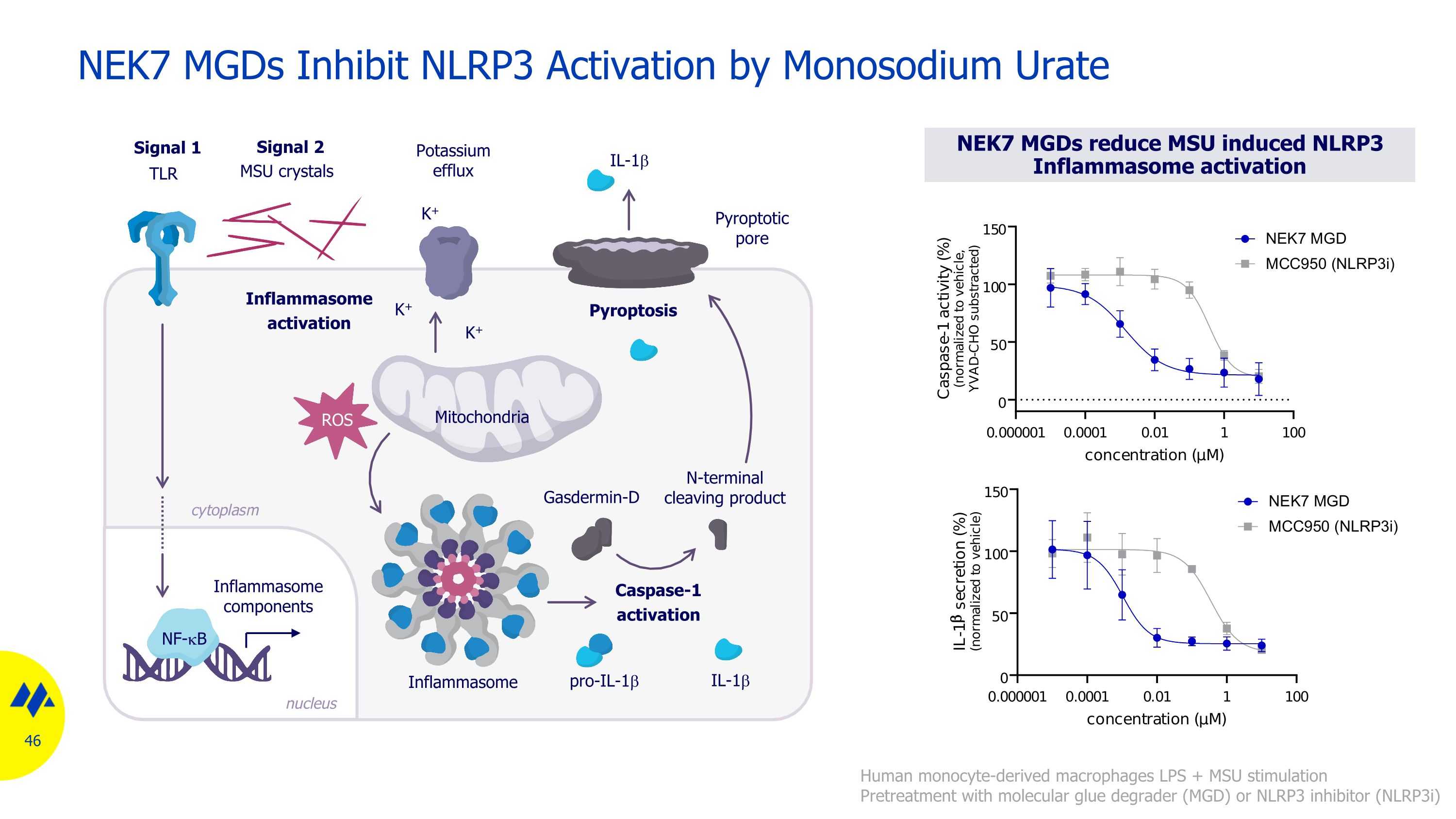
NEK7 MGD 通過尿酸鈉抑制 NLRP3 活化人單核細胞衍生巨噬細胞 LPS + MSU 刺激使用分子膠降解劑 (MGD) 或 NLRP3 抑制劑 (nlrp3i) 進行預處理 Signal 1 信號 2 TLR MSU 晶體鉀外流焦化孔 IL-1b pro-il-1b IL-1b K+ K+ Gasdermin-D N 末端裂解產物組成分線粒體炎性小體 NF-kB ROS Pyroptosis 炎性體激活 Caspase-1 激活核細胞質 NEK7 MGD 降低 MSU 誘導的 NLRP3 炎症體激活

MRT-8102 是一種導向 Nek7 的 MGD,具有良好的藥物樣特性 MGD 活性譜 CRBN 結合(HTRF、IC50)0.2 µM NEK7 降解(CAL51、DC50 /Dmax)10 nM/ 89% 選擇性(TMT 蛋白質組學)在不同細胞系中具有出色的選擇性特性物理化學特性 logD 1.47 MW 30 µM)CEREP(含有 44 種蛋白質的面板)無抑制作用 NEK7 Teryms Nary Complex(晶體結構)MRT-8102 NEK7 CRBN
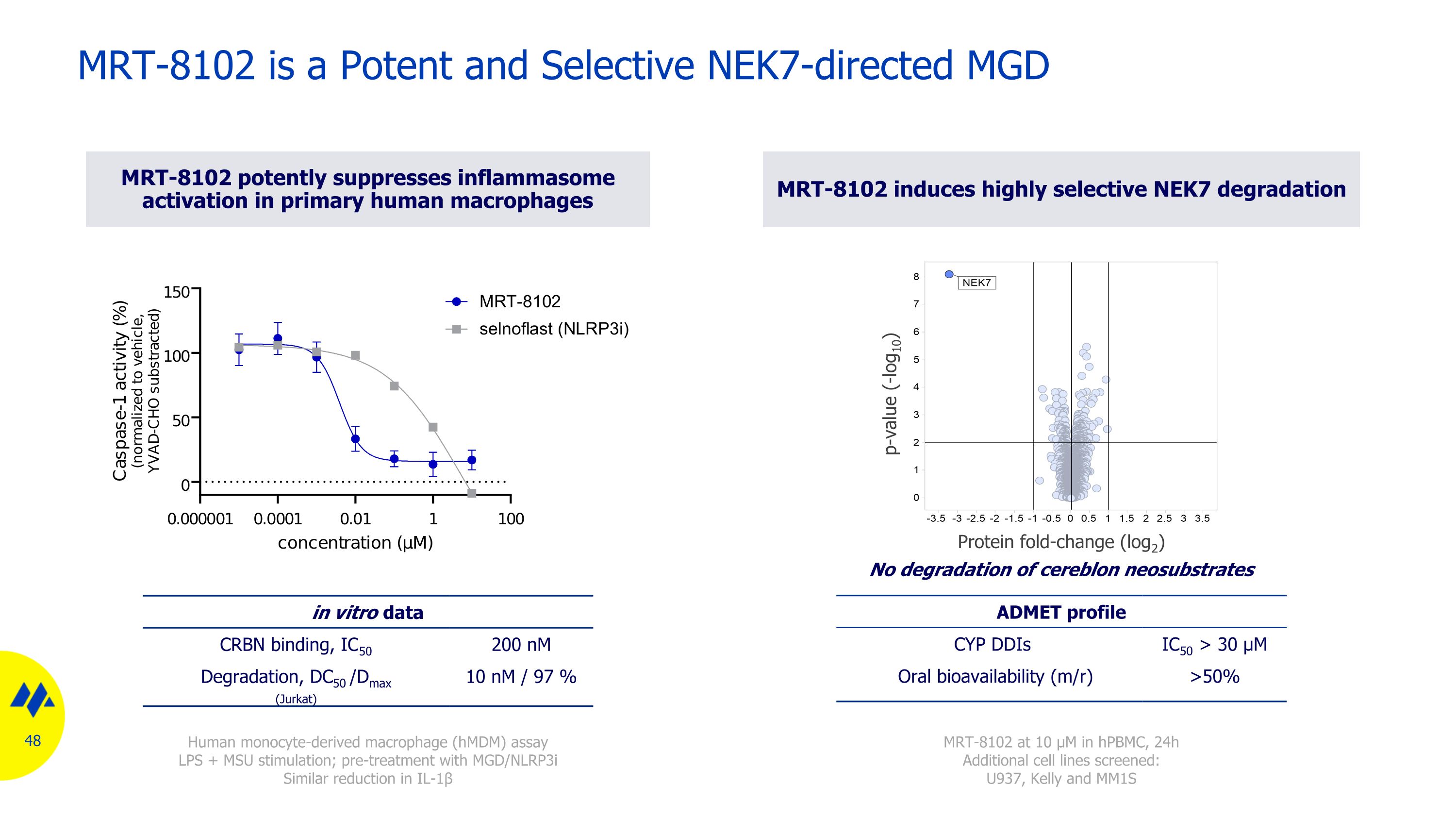
MRT-8102 有效抑制原代人類巨噬細胞中的炎症體激活 MRT-8102 在 hpbMC 中誘導高選擇性 NEK7 降解 p 值 (-log10) 蛋白摺疊變化 (log2) MRT-8102,24 小時篩選的其他細胞系:U937、Kelly 和 MM1S 人類單核細胞衍生巨噬細胞 (HmDM) 試驗 LPS + MSU 刺激;使用 mgd/NLRPS 進行預處理 3i IL-1β MRT-8102 的類似還原是體外數據 CRBN 結合的有效且選擇性的 NEK7 導向 MGD,IC50 200 nM 降解,DC50 /Dmax (Jurkat) 10 nM/97% ADMET 曲線 CYP ddiS IC50 > 30 µM 口服生物利用度 (m/r) > 50% 不降解大腦新底物
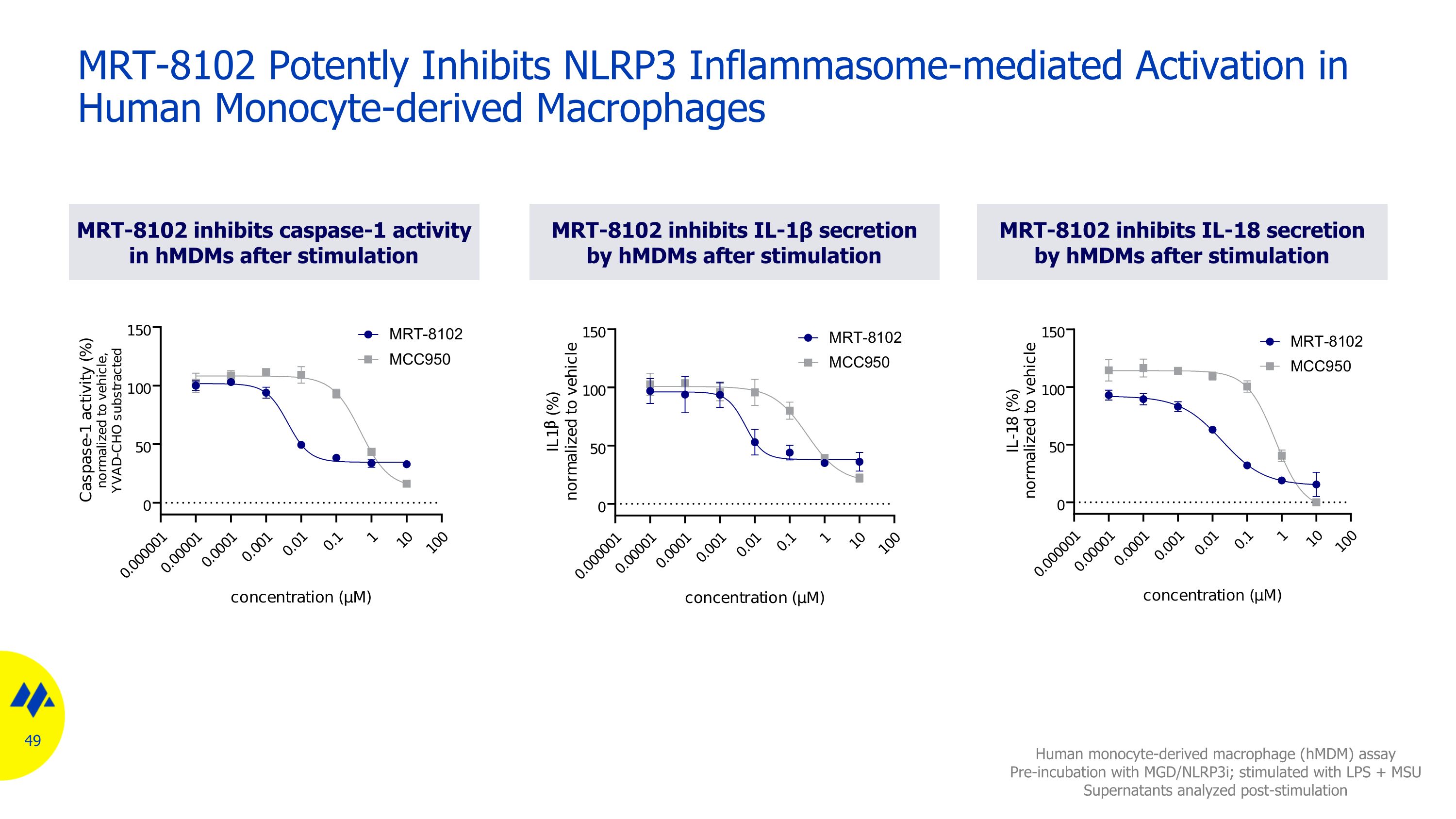
MRT-8102 在刺激後抑制 HMDMS 中 caspase-1 活性人單核細胞衍生巨噬細胞 (HmdM) 試驗 MGD/NLRP3I 預孵育;使用 LPS + MSU 上清刺激刺激後分析 MRT-8102 有效抑制人單核細胞衍生巨噬細胞中 NLRP3 炎症體介導的激活 MRT-8102 在刺激後 HMDMS 抑制 IL-1β 的分泌 MRT-8102 IL-18 刺激後 HMDMS 分泌
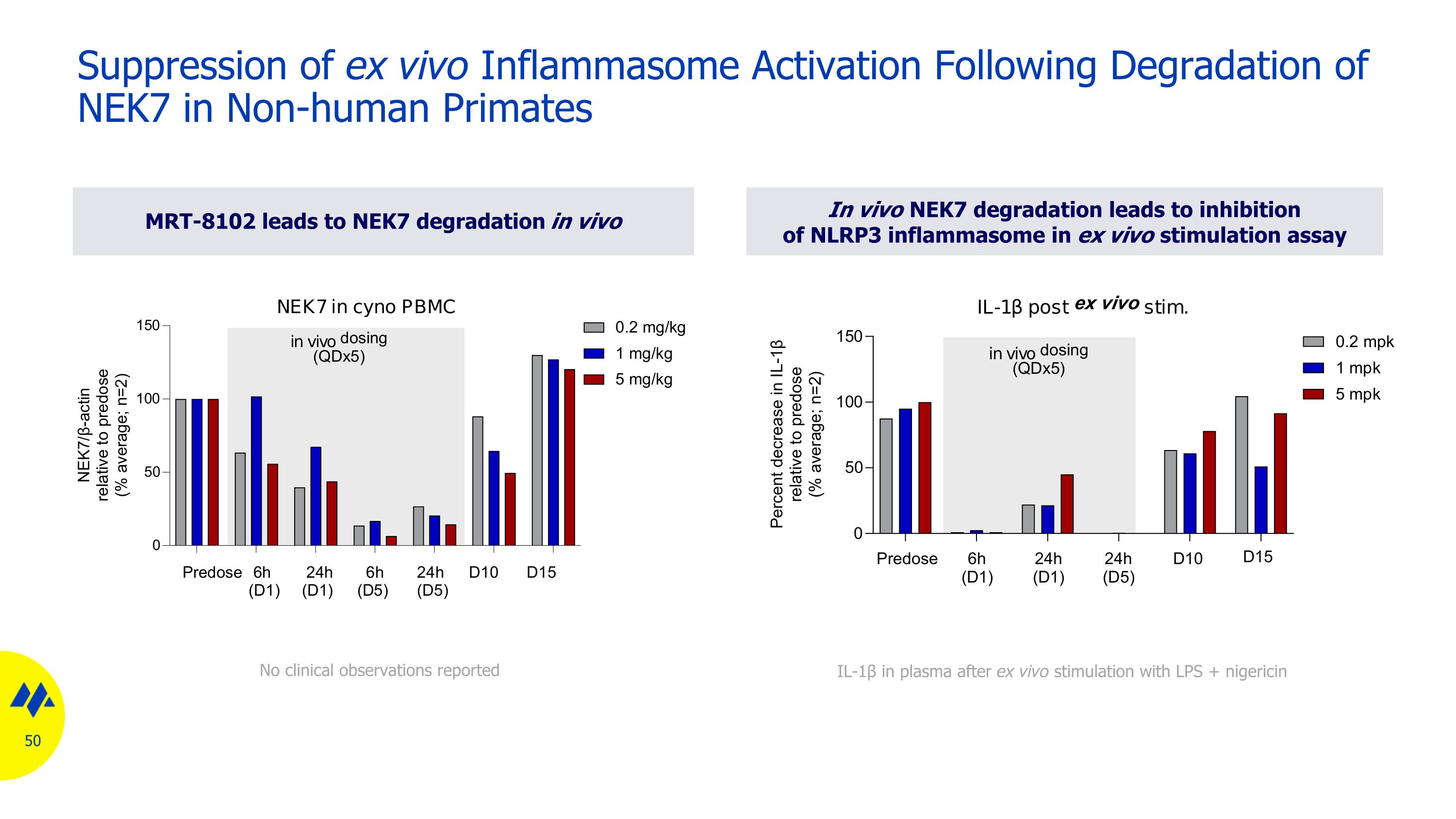
MRT-8102 導致 NEK7 在體內降解體內 NEK7 降解導致體外刺激試驗中抑制 NLRP3 炎性小體的抑制在非人靈長類動物中 NEK7 降解後體外炎性體體的激活沒有臨牀觀察報告在體外使用 LPS + 尼日利亞菌素刺激後血漿中有 IL-1β

球隊

世界一流領導力在分子膠發現、藥物開發和精準醫療方面擁有深厚的專業知識朱利安·瓊斯博士、法學博士、工商管理碩士首席商務官菲利普·詹庫醫學博士首席醫學官馬庫斯·瓦爾默斯醫學博士首席執行官約翰·卡斯爾博士首席數據科學家兼信息官莎倫·湯森博士首席技術官歐文·華萊士博士研究和臨牀前開發總裁菲爾·尼克森,博士,法學博士總法律顧問詹妮弗·尚普首席人事與運營官馬格努斯·沃爾特,博士化學科學高級副總裁和流程開發

謝謝