

第一天:適用於所有年齡段人羣的生物製藥靶向療法(2024年2月)

免責聲明本演示文稿和隨附的口頭評論包含前瞻性陳述,這些陳述基於我們管理層的信念和假設以及管理層目前可獲得的信息。前瞻性陳述本質上受風險和不確定性的影響,其中一些風險和不確定性無法預測或量化。在某些情況下,您可以通過諸如 “可能”、“將”、“應該”、“可能”、“期望”、“計劃”、“預測”、“相信”、“估計”、“預測”、“打算”、“潛在”、“將”、“繼續”、“持續” 或否定這些術語或其他類似術語中的否定詞來識別前瞻性陳述。前瞻性陳述包括除本演示文稿中包含的歷史事實陳述以外的所有陳述,包括有關我們未來財務業績的信息,包括我們的現金、現金等價物和短期投資是否足以為我們的運營提供資金、業務計劃和目標、我們計劃的非臨牀和臨牀開發活動的時機和成功、我們的任何戰略合作的結果,包括可能實現的里程碑以及根據里程碑支付的特許權使用費、時間和非臨牀研究和臨牀試驗的結果,我們的候選產品的療效和安全性概況,託沃拉非尼的2期和3期臨牀試驗以及託伏拉非尼和匹馬舍替布的1b/2期臨牀試驗的執行情況,對完成臨牀試驗和獲得監管部門批准的託沃拉非尼和其他正在開發的候選藥物的安全性、有效性、時機和能力的任何期望,託伐非尼和其他正在開發的候選藥物的能力 enib 用於治療小兒低度神經膠質瘤 (plGG) 或相關適應症、潛在的治療益處以及候選產品的經濟價值、潛在的增長機會、競爭地位、行業環境和潛在的市場機會、我們保護知識產權的能力以及全球商業或宏觀經濟狀況對我們的業務和運營的影響,包括通貨膨脹、利率變化、全球銀行系統的潛在不穩定性、聯邦債務上限和預算的不確定性以及與之相關的潛在政府關閉以及全球地區衝突的影響。前瞻性陳述受已知和未知風險、不確定性、假設和其他因素的影響。我們的管理層無法預測所有風險,也無法評估所有因素對我們業務的影響,也無法評估任何因素或因素組合在多大程度上可能導致實際業績與我們可能做出的任何前瞻性陳述中包含的結果存在重大差異。這些因素,加上我們向美國證券交易委員會(“SEC”)提交的最新10-Q表季度報告以及我們不時向美國證券交易委員會提交的其他文件中在 “風險因素” 標題下描述的因素,可能導致我們的實際業績、業績或成就與我們的前瞻性陳述的預期或暗示存在重大和不利的差異。此外,“我們相信” 的陳述和類似的陳述反映了我們對相關主題的信念和觀點。這些陳述基於截至本演示之日我們獲得的信息,儘管我們認為此類信息構成了此類陳述的合理依據,但此類信息可能有限或不完整,不應將我們的陳述理解為表明我們已經對所有可能可用的相關信息進行了徹底的調查或審查。這些陳述本質上是不確定的,提醒投資者不要過分依賴這些陳述。此外,如果我們的前瞻性陳述被證明不準確,則不準確性可能是實質性的。鑑於這些前瞻性陳述中存在重大不確定性,您不應將這些陳述視為我們或任何其他人對我們將在任何指定時間範圍內實現目標和計劃的陳述或保證,或根本不這樣做。除非法律要求,否則我們沒有義務公開更新任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。本演示文稿還包含獨立方和我們提供的與市場規模和增長相關的估計和其他統計數據,以及有關我們行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。此外,對我們未來表現的預測、假設和估計以及我們經營的市場的未來表現必然受到高度的不確定性和風險的影響。

所有年齡段人羣的癌症療法開發針對基因組定義的癌症的藥物通過快速註冊途徑建立一流的地位擴展到青少年和成人羣體,並以與對兒童相同的承諾來尋求這些機會我們的方法納斯達克:黎明首次公開募股:2021年成立時間:2018年財務狀況:Runway進入2026年
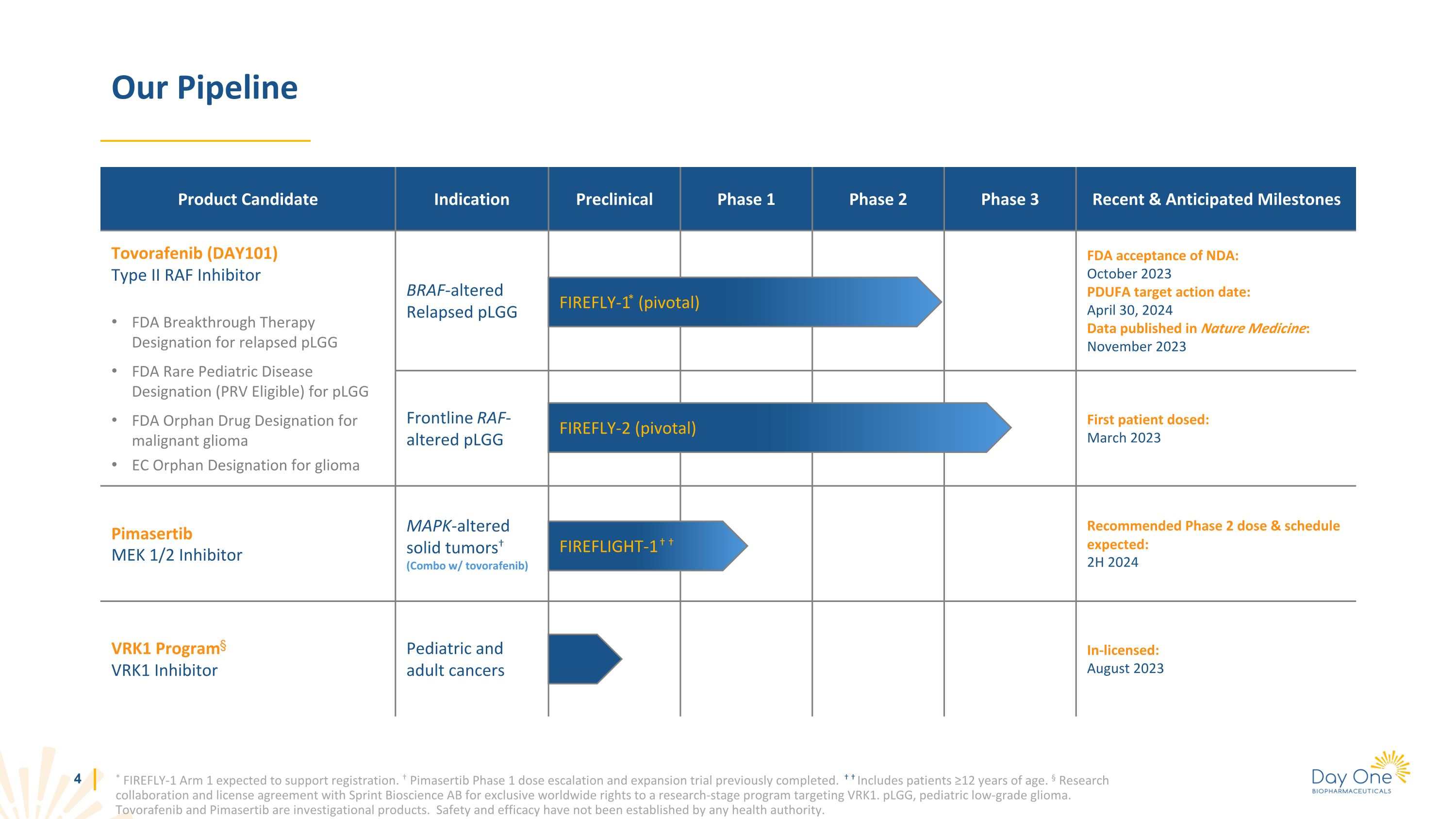
* FIREFLY-1 Arm 1 預計將支持註冊。Pimasertib 1 期劑量遞增和擴展試驗此前已完成。包括 12 歲以上的患者。§ 與 Sprint Bioscience AB 簽訂的研究合作和許可協議,獲得一項針對 VRK1. plGG(兒科低度神經膠質瘤)的研究階段項目的全球獨家權利。Tovorafenib 和 Pimasertib 是研究產品。任何衞生機構尚未確定安全性和有效性。我們的管線產品候選適應症臨牀前 1 期 2 期 3 期近期和預期里程碑託伏拉非尼 (DAY101) II 型 RAF 抑制劑 FDA 復發突破性療法獲得 plGG FDA 罕見兒科疾病認定(符合 PRV 標準)FDA 惡性神經膠質瘤孤兒藥認定 BRAF 改變的復發 plGG FDA 接受保密協議:2023 年 10 月 PDUFA 目標行動 :2024 年 4 月 30 日發表在《自然醫學》上的數據:2023 年 11 月 Frontline Raf 改性 plGG 首位患者給藥時間:2023 年 3 月pimasertibMEK 1/2 抑制劑 MAPK 改變的實體瘤(組合使用託伏拉非尼)預計的第 2 期推薦劑量和時間表:2024 年 2 月 VRK1 項目§ VRK1 抑制劑兒科和成人癌授權中:2023 年 8 月 FIREFLY-1*(關鍵)FIREFLY-2(關鍵)FIREFLIGHT-1

託伏拉非尼 (DAY101) II 型 RAF 抑制劑

索耶,生活在 plGG 中。1 個數字來自 FIREFLY-1 基線患者特徵,數據截止日期為 2023 年 6 月 5 日。參加 FIREFLY-1 試驗第 1 組的患者總數為 77 人。像 Sawyer 這樣的孩子童年的大部分時間都是作為患者而不是孩子度過的 3 (1-9) 51% 先前接受過全身治療的中位數(範圍)1 先前接受過大於或等於 3 線全身治療的患者百分比 1
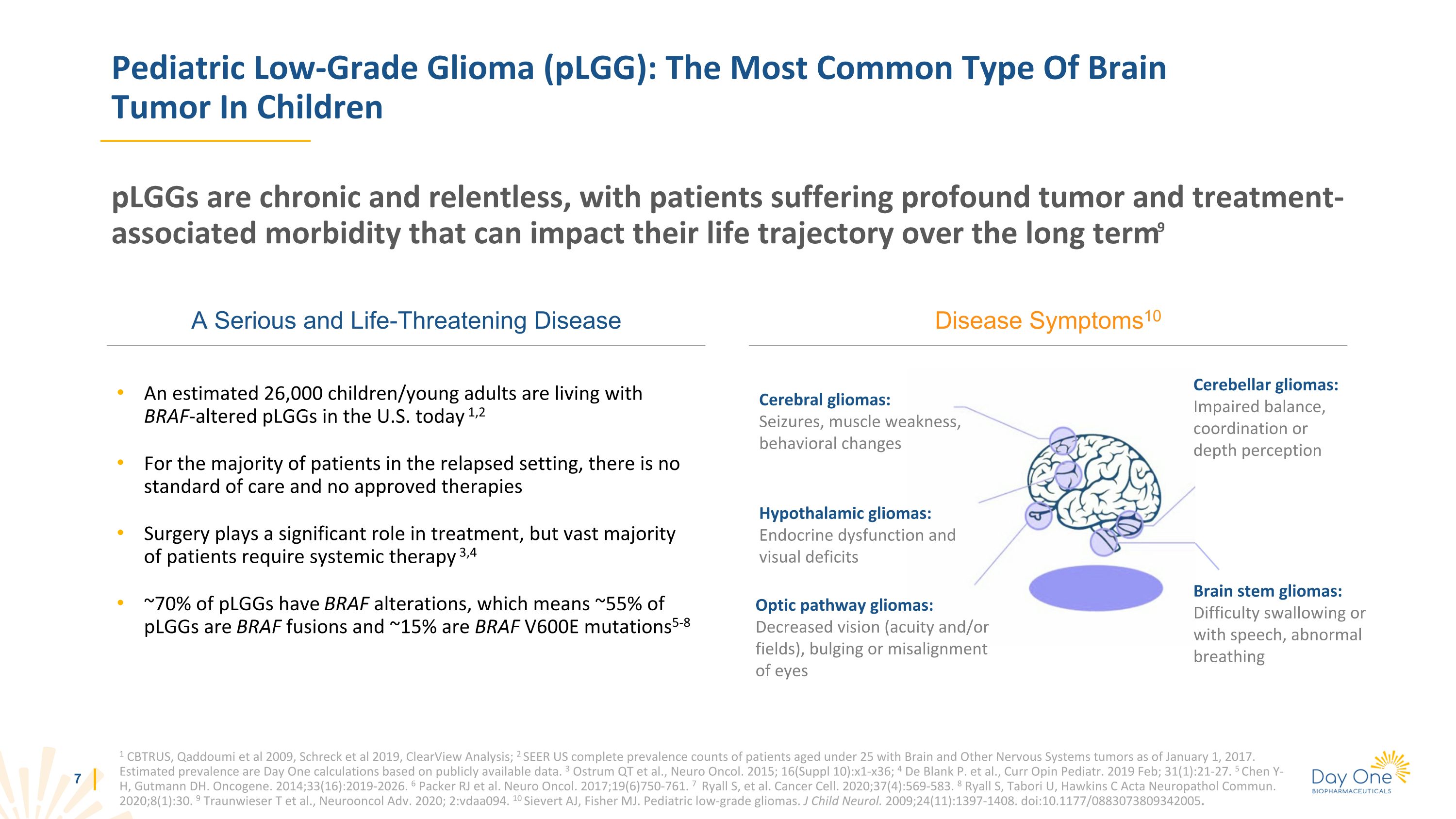
小兒低度神經膠質瘤(plGG):兒童中最常見的腦腫瘤一種嚴重且危及生命的疾病 PLGG 是慢性的,持續性的,患者患有嚴重的腫瘤和治療相關發病率,可能會長期影響他們的生活軌跡9 1 CBTRUS,Qaddoumi等人,2009年,Schreck等人,2019年,ClearView分析;2 SEER美國25歲以下患者的完整腦部患病率以及截至2017年1月1日的其他神經系統腫瘤。估計的患病率是根據公開數據計算得出的第一天。3 Ostrum QT 等人,Neuro Oncol。2015;16(補編 10): x1-x36;4 De Blank P. 等人,Curr Opin Pediatr。2019 年 2 月;31 (1): 21-27。5 Chen Y-H,Gutmann DH。Oncogene。2014;33 (16): 2019-2026。6 Packer RJ 等人。Neuro Oncol. 2017;19 (6) 750-761。7 Ryall S 等人。Cancer Cell. 2020;37 (4): 569-583. 8 Ryall S,Tabori U,Hawkins C Acta Neuropathol Commun。2020;8 (1) 30. 9 Traunwieser T 等人,Neurooncol Adv. 2020;2:vdaa094。10 Sievert AJ,Fisher MJ。小兒低度神經膠質瘤。J Child Neurol. 2009;24 (11): 1397-1408。doi: 10.1177/0883073809342005。疾病症狀10 當今美國估計有26,000名兒童/年輕人患有BRAF改變的PLGG 1,2 對於復發環境中的大多數患者來説,沒有護理標準,也沒有批准的療法手術在治療中起着重要作用,但絕大多數患者需要全身治療 3,4~70% 的PLGG有BRAF變異,這意味着大約55%的PLGG是BRAF融合和約 15% 是 BRAF V600E 突變5-8 腦膠質瘤:癲癇發作、肌肉無力、行為變化下丘腦膠質瘤:內分泌功能障礙和視力缺陷視通路神經膠質瘤:視力下降(敏鋭度和/或視野)、眼睛隆起或錯位小腦膠質瘤:平衡、協調或深度感知受損腦幹膠質瘤:吞嚥困難或説話困難、呼吸異常

資料來源:1.Heitzer AM、Raghubar K、Ris MD 等小兒低度神經膠質瘤手術後的神經心理學功能:一項前瞻性縱向研究。兒科雜誌。2019 年;1-9。doi: 10.3171/2019.9.peds19357。2.Bryant R. 管理兒童癌症治療的副作用。J Pediatr Nurs. 2003;18 (2): 113-125。doi: 10.1053/jpdn.2003.11。3.Zahnreich S、Schmidberger H. 兒童癌症:第二原發性惡性腫瘤的發生、治療和風險。癌症(巴塞爾)。2021;13 (11): 2607. doi: 10.3390/cancers/13112607. 4.國家癌症研究所。患有癌症的女孩和女性的生育問題。http://www.cancer.gov。已於2022年6月13日訪問。5.Alessi I.、Caroleo A.M.、de Palma L.、Mastronuzzi A.、Pro S.、Colafati G.S.、Boni A.、Della Vecchia N.、Velardi M.、Evangelisti M. 等兒科癌症治療的短期和長期毒性:中樞神經系統損傷。癌症。2022;14:1540. doi:10.3390/cancers14061540。傳統治療可能會對兒童造成幹擾,並可能產生重大的長期後果,對於大多數plGG復發或進行性患者來説,顯然需要一種對他們生活的幹擾最小的有效治療。恢復時間長併發症風險切除可能受腫瘤位置的限制根據腫瘤的位置和切除範圍可能出現功能缺陷繼發性惡性腫瘤的風險惡性轉化的風險血管增殖和中風的風險神經認知影響,視腫瘤位置和放射區域的需要留置導管和每週輸液的要求中性粒細胞減少、超敏反應、噁心和嘔吐以及周圍神經病變外科化療放療
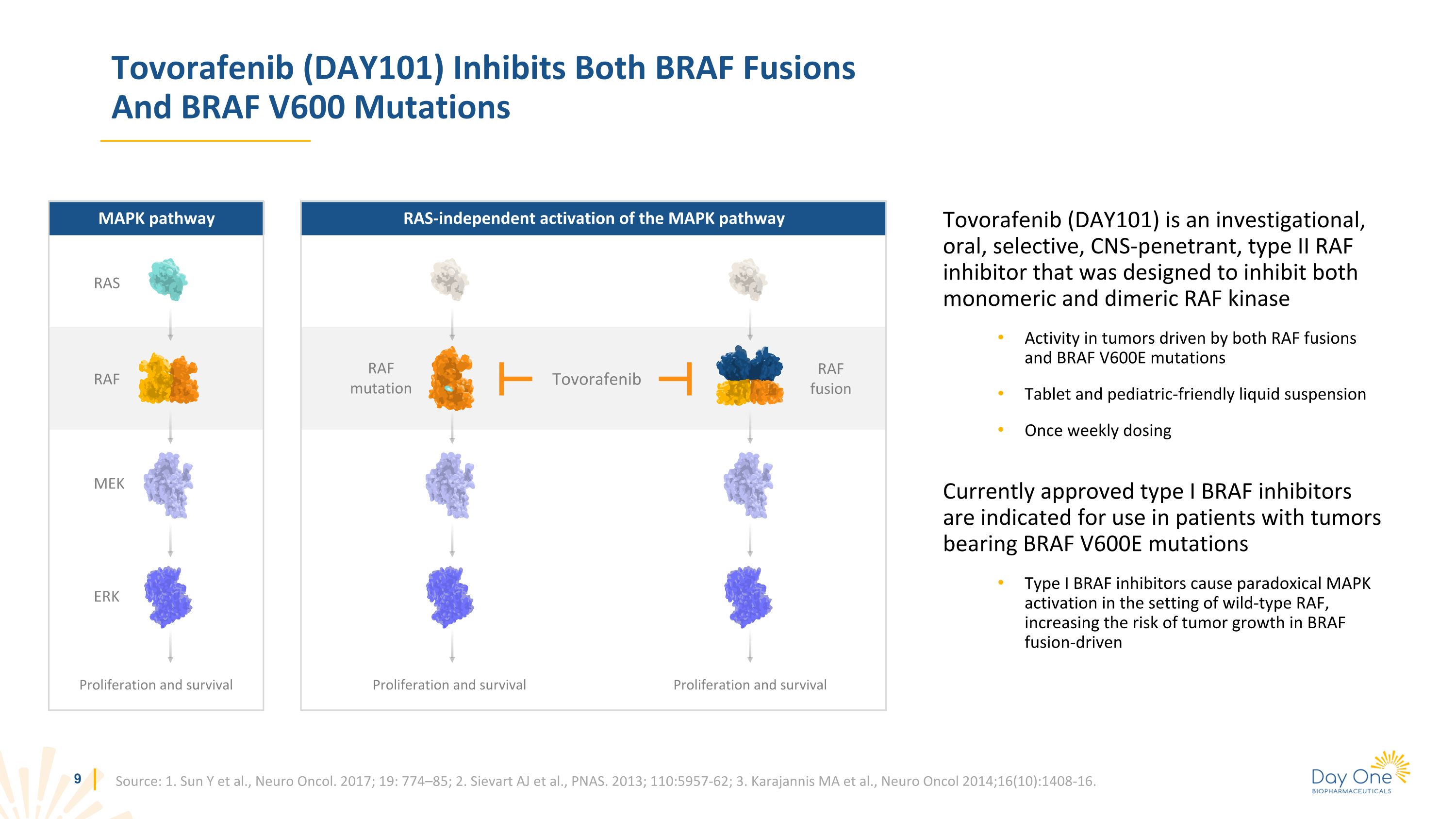
Tovorafenib (DAY101) 可抑制 BRAF 融合和 BRAF V600 突變 Tovorafenib (DAY101) 是一種研究性口服、選擇性、滲透性的 II 型 RAF 抑制劑,旨在抑制由 RAF 融合和 BRAF V600E 突變驅動的腫瘤中的單體和二聚體 RAF 激酶活性。片劑和適合兒科的液體懸浮液每週一次劑量目前批准的 I 型 BRAF 抑制劑適用於帶有 BRAF V600E 突變的腫瘤患者,I 型 BRAF 抑制劑會導致矛盾的 MAPK 激活野生型RAF,在BRAF融合驅動下增加腫瘤生長的風險來源:1.Sun Y 等人,Neuro Oncol. 2017;19:774—85;2.Sievart AJ 等人,PNAS。2013;110:5957-62;3.Karajannis MA 等人,Neuro Oncol 2014;16 (10): 1408-16。獨立於 RAS 激活 MAPK 通路 MAPK 通路 RAS RAF MEK ERK 增殖和存活 RAF 突變 RAF 融合增殖和存活 Tovorafenib 增殖和存活
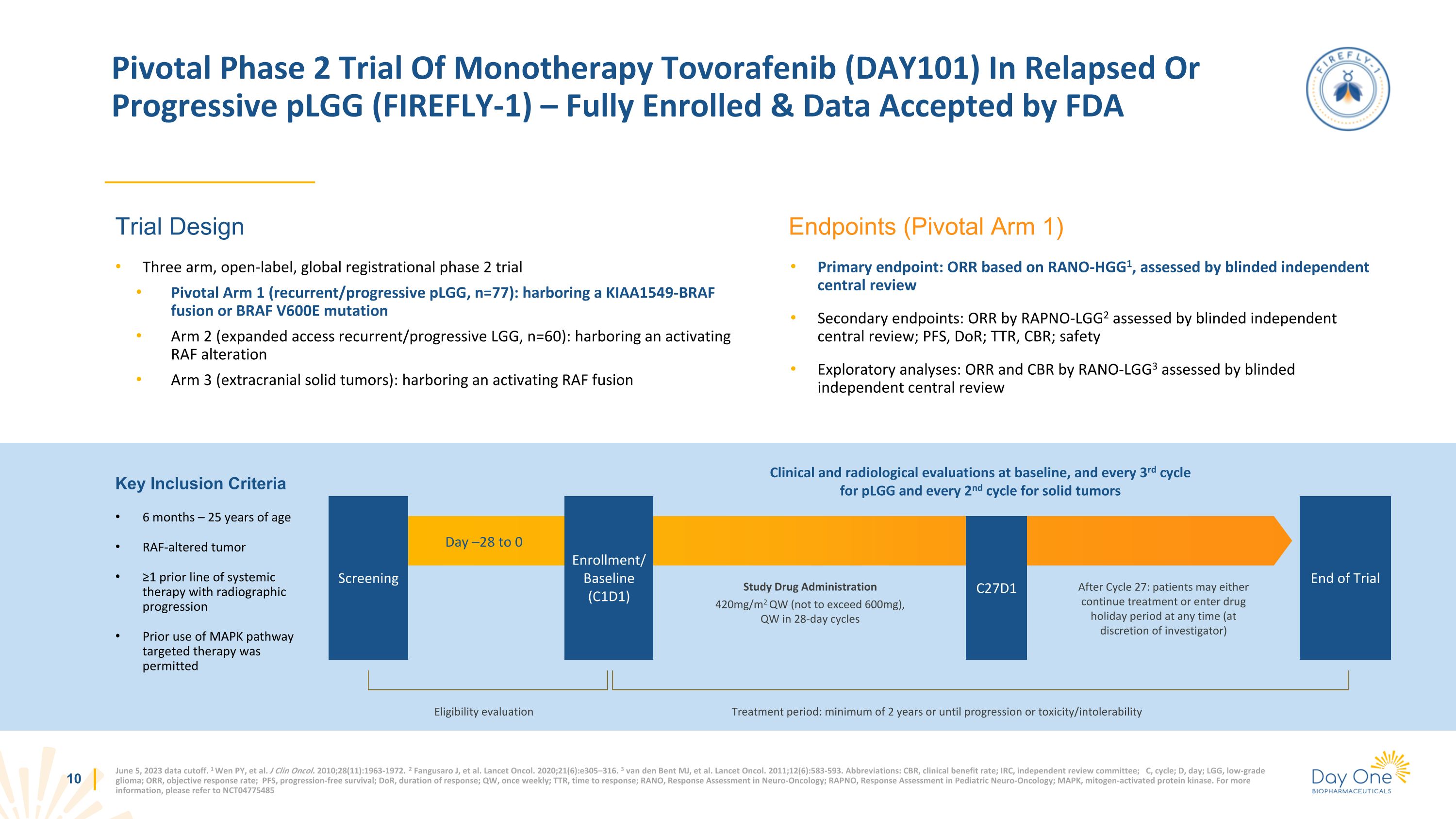
2023 年 6 月 5 日數據截止。1 Wen PY 等人J Clin Oncol. 2010;28 (11): 1963-1972。2 Fangusaro J,等人。Lancet Oncol. 2020;21 (6): e305—316. 3 van den Bent MJ,等人Lancet Oncol. 2011; 12 (6): 583-593。縮寫:CBR,臨牀獲益率;IRC,獨立審查委員會;C,週期;D,天;LGG,低度神經膠質瘤;ORR,客觀緩解率;PFS,無進展存活率;DoR,反應持續時間;QW,每週一次;TTR,神經腫瘤學反應評估;RAPNO,兒科神經腫瘤學反應評估;MAPK,絲裂原激活蛋白激酶。欲瞭解更多信息,請參閲 NCT04775485 復發或進行性 pLGG(FIREFLY-1)單一療法的關鍵二期試驗 — 已完全入組且數據已獲得 FDA 試驗設計終點(Pivotal Arm 1)的三組、開放標籤、全球註冊 2 期試驗 Pivotal Arm 1(復發/進行性 pLGG,n=77):包含 KIAA1549-BRAF 融合或 V600E 突變 Arm 2(擴展訪問權限)急性/漸進性 LGG,n=60):藏有激活的 RAF 改變 Arm 3(顱外實體瘤):藏有激活的 RAF 融合原發性 DAY101終點:基於 RANO-HGG1 的 ORR,由盲人獨立中心審查評估次要終點:RAPNO-LGG2 的 ORR 由盲人獨立中央審查評估;PFS、DoR;TTR、CBR;安全性探索性分析:由 RANO-LGG3 評估的 ORR 和 CBR 由盲人獨立中央審查日 —28 至 0 研究藥物管理局 420mg/m2 QW(不超過 600 mg),週期為 28 天后 QW:患者可以繼續治療或服藥隨時休假(由研究者自行決定)篩選 C27D1 註冊/基線(C1D1)試驗結束基線臨牀和放射學評估,plGG 每三個週期進行一次臨牀和放射學評估,實體瘤每隔兩個週期進行一次資格評估治療週期:至少 2 年或直到進展或毒性/不可耐受性關鍵納入標準 6 個月 — 25 歲 RAF 改變的腫瘤 ≥1 先前有放射學進展的全身療法先前允許使用 MAPK 途徑的靶向治療

來自 Pivotal 2 期 FIREFLY-1 試驗的數據 2023 年 6 月 5 日數據截止
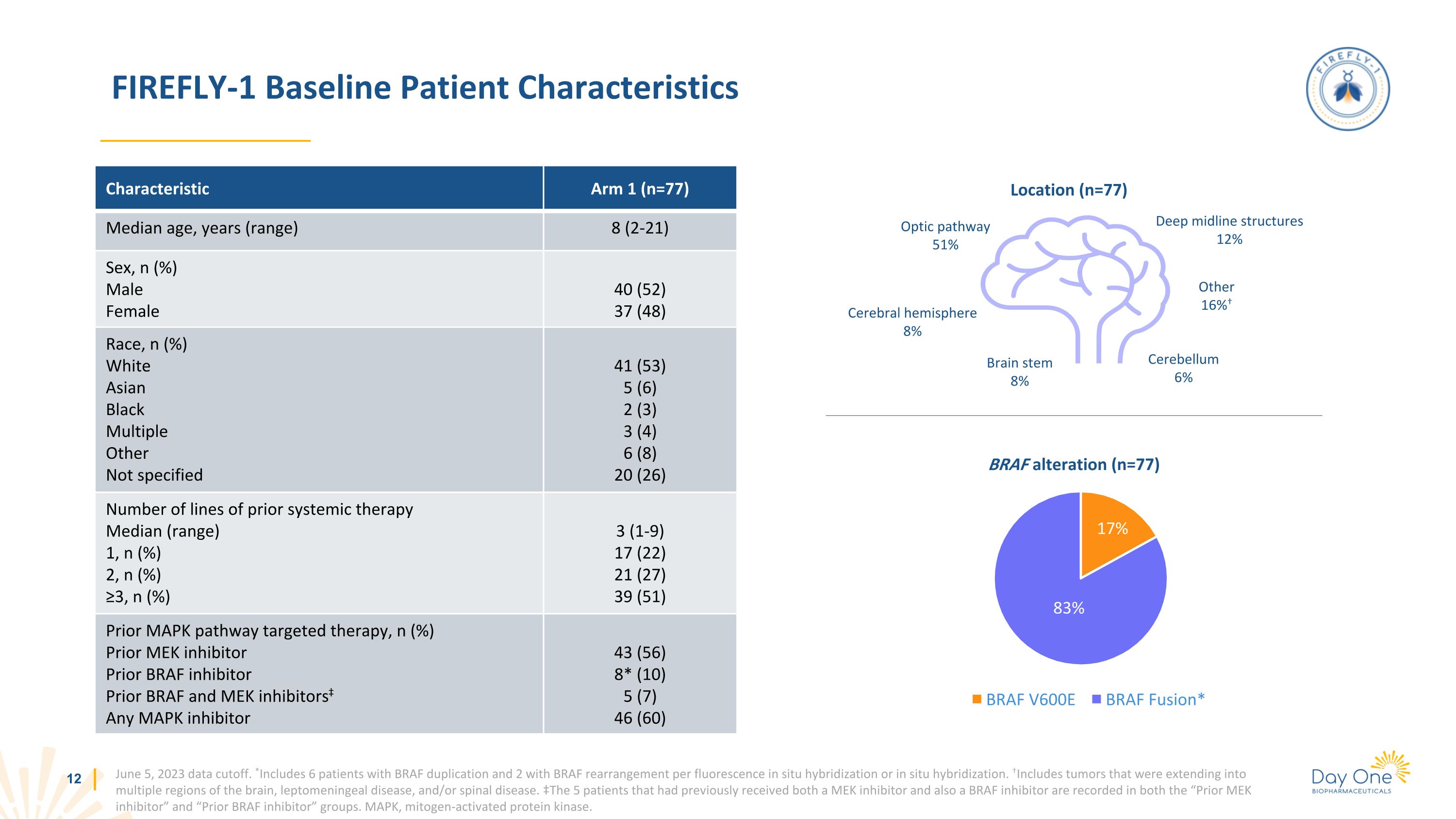
FIREFLY-1 基線患者特徵 2023 年 6 月 5 日數據截止。*通過熒光原位雜交或原位雜交包括6名BRAF重複患者和2名BRAF重排患者。包括延伸到大腦多個區域的腫瘤、輕腦膜病和/或脊柱疾病。在 “Prior MEK抑制劑” 和 “Prior BRAF抑制劑” 組中均記錄了先前同時接受過MEK抑制劑和BRAF抑制劑的5名患者。MAPK,絲裂原活化蛋白激酶。特徵組 1 (n=77) 中位年齡、年齡(範圍)8(2-21)性別,n(%)男性女性 40(52)37(48)種族,n(%)白人亞裔黑人多重未指定 41(53)5(6)2(3)3(4)6(8)20(26)先前全身治療的線路數中位數(範圍)1,n(%)2,n(%)) ≥3, n (%) 3 (1-9) 17 (22) 21 (27) 39 (51) 先前的 MAPK 途徑靶向治療,n (%) 先前的 MEK 抑制劑先前 BRAF 抑制劑先前 BRAF 和 MEK 抑制劑任何 MAPK 抑制劑 43 (56) 8* (10) 5 (7) 46 (60) BRAF 改變 (n=77) 位置 (n=77) 視通路 51% 大腦半球 8% 大腦莖 8% 深中線結構 12% 其他 16% 小腦 6% 17% 83%
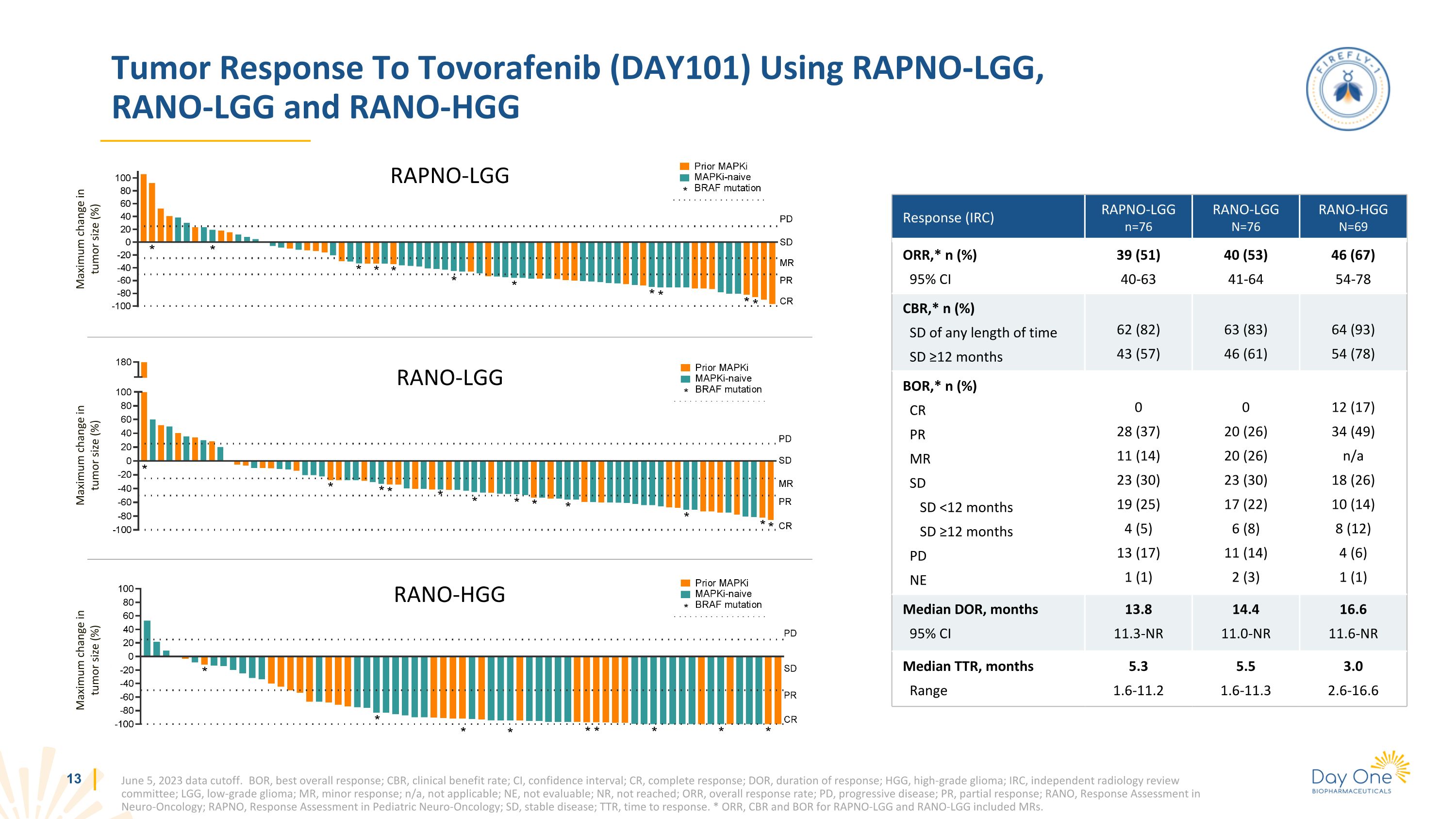
使用 RAPNO-LGG、RANO-LGG 和 RANO-HGG 對託沃拉非尼 (DAY101) 的腫瘤反應腫瘤大小的最大變化 (%) 腫瘤大小的最大變化 (%) RAPNO-LGG RANO-LGG RANO-HGG 2023 年 6 月 5 日數據截止。BOR,最佳總體反應;CBR,臨牀獲益率;CI,置信區間;CR,完全反應;DOR,緩解持續時間;HGG,高級別神經膠質瘤;IRC,獨立放射學審查委員會;LGG,低度神經膠質瘤;MR,輕微反應;n/a,不可評估;NR,總體緩解率;PR,部分反應;RANO,神經腫瘤學反應評估;RAPNO,兒科神經腫瘤學反應評估;SD,穩定疾病;TTR,反應時間。* RAPNO-LGG 和 RANO-LGG 的 ORR、CBR 和 BOR包括 mR。迴應 (IRC) RAPNO-LGG n=76 RANO-LGG N=76 RANO-HGG N=69 ORR,* n (%) 95% 置信區間 39 (51) 40-63 40 (53) 46-64 (67) 54-78 CBR,* n (%) 任意時間長度的 SD ≥12 個月 62 (82) 43 (57) 63 (83) 46 (61) 64 (93) 54 (93) 54 (93) 54 (93) 54 (93) 54 (93) 54 (93) 54 (93) 54 (93) 54 (93) 54 (93) 78) BOR,* n (%) CR PR PR MR SD SD
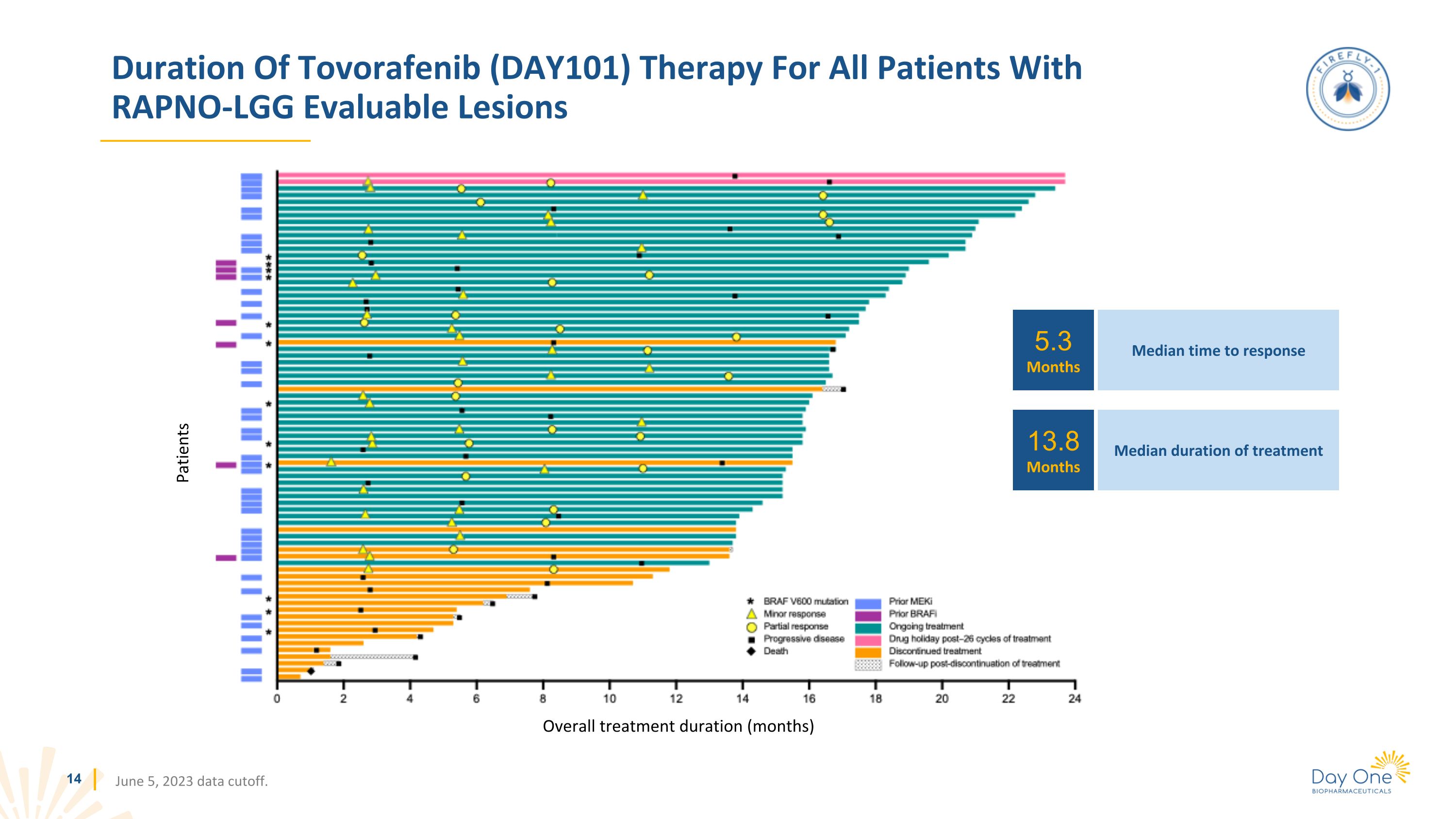
所有患有 rapno-LGG 可評估病變患者的託伏拉非尼(DAY101)治療持續時間 2023 年 6 月 5 日數據截止。患者總治療時間(月)5.3 個月 13.8 個月中位緩解時間中位數治療持續時間
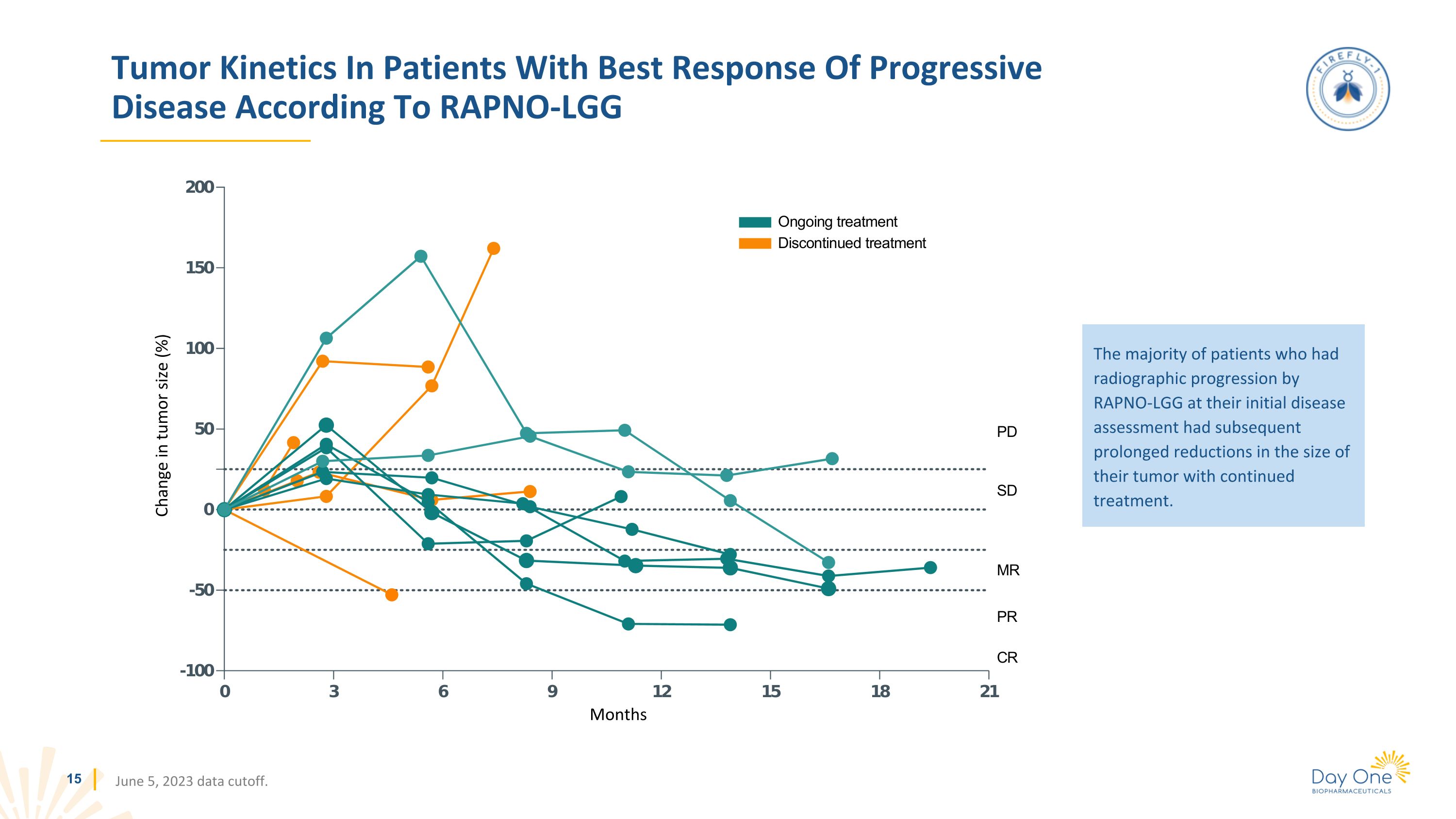
根據RAPNO-LGG,進展性疾病反應最佳患者的腫瘤動力學數據截止日期為2023年6月5日。腫瘤大小變化(%)月份大多數在初始疾病評估時接受RAPNO-LGX射線照相進展的患者,在繼續治療後,腫瘤大小會長期減小。
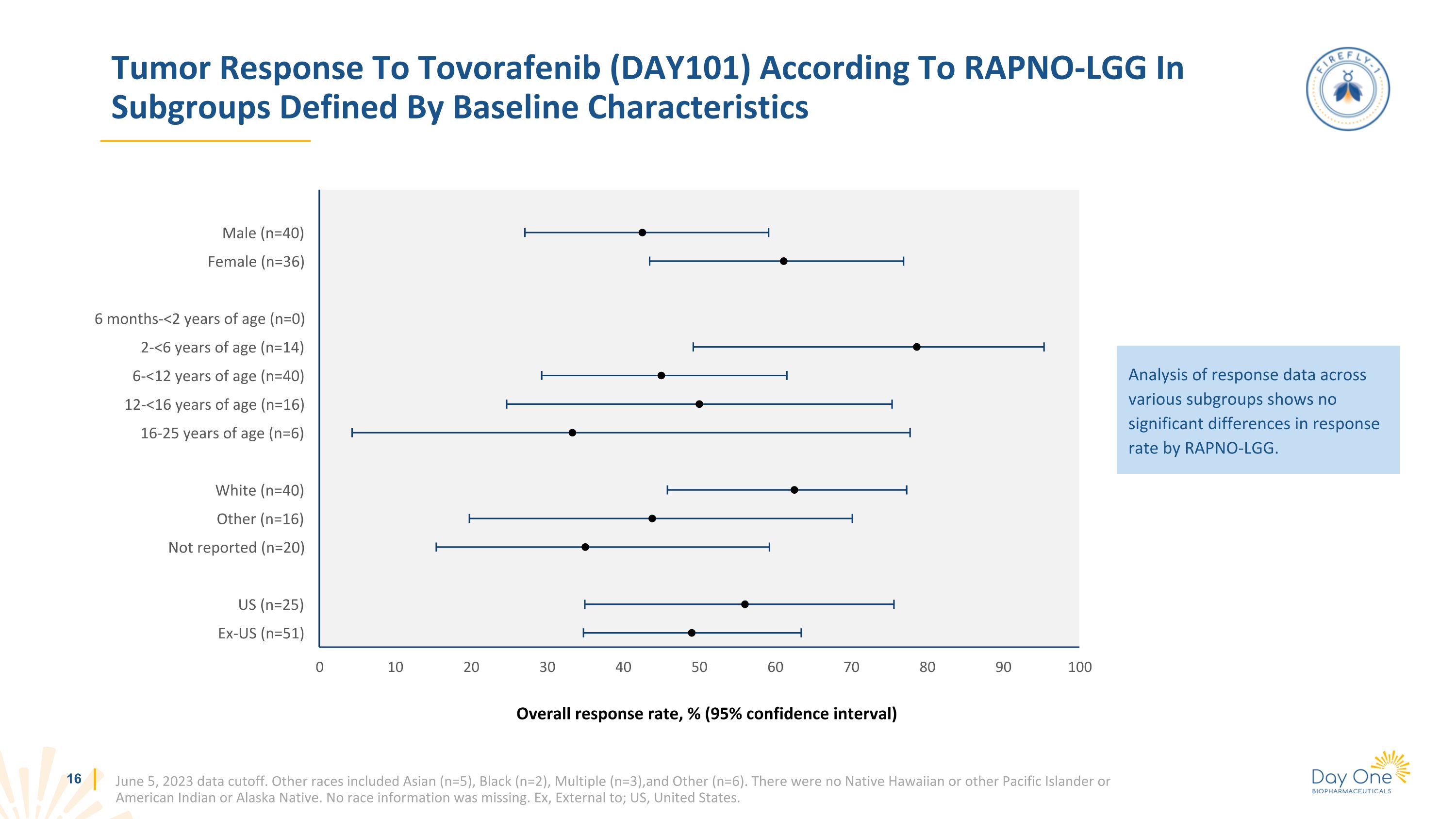
根據RAPNO-LGG的腫瘤對託伏拉非尼(DAY101)的反應,按基線特徵定義的亞組數據截止日期為2023年6月5日。其他種族包括亞洲人(n=5)、黑人(n=2)、多人(n=3)和其他種族(n=6)。沒有夏威夷原住民或其他太平洋島民、美洲印第安人或阿拉斯加原住民。沒有丟失任何比賽信息。例如,外部;美國、美國。對不同子組的反應數據的分析顯示,RAPNO-LGG的反應率沒有顯著差異。總體響應率,%(95% 置信區間)
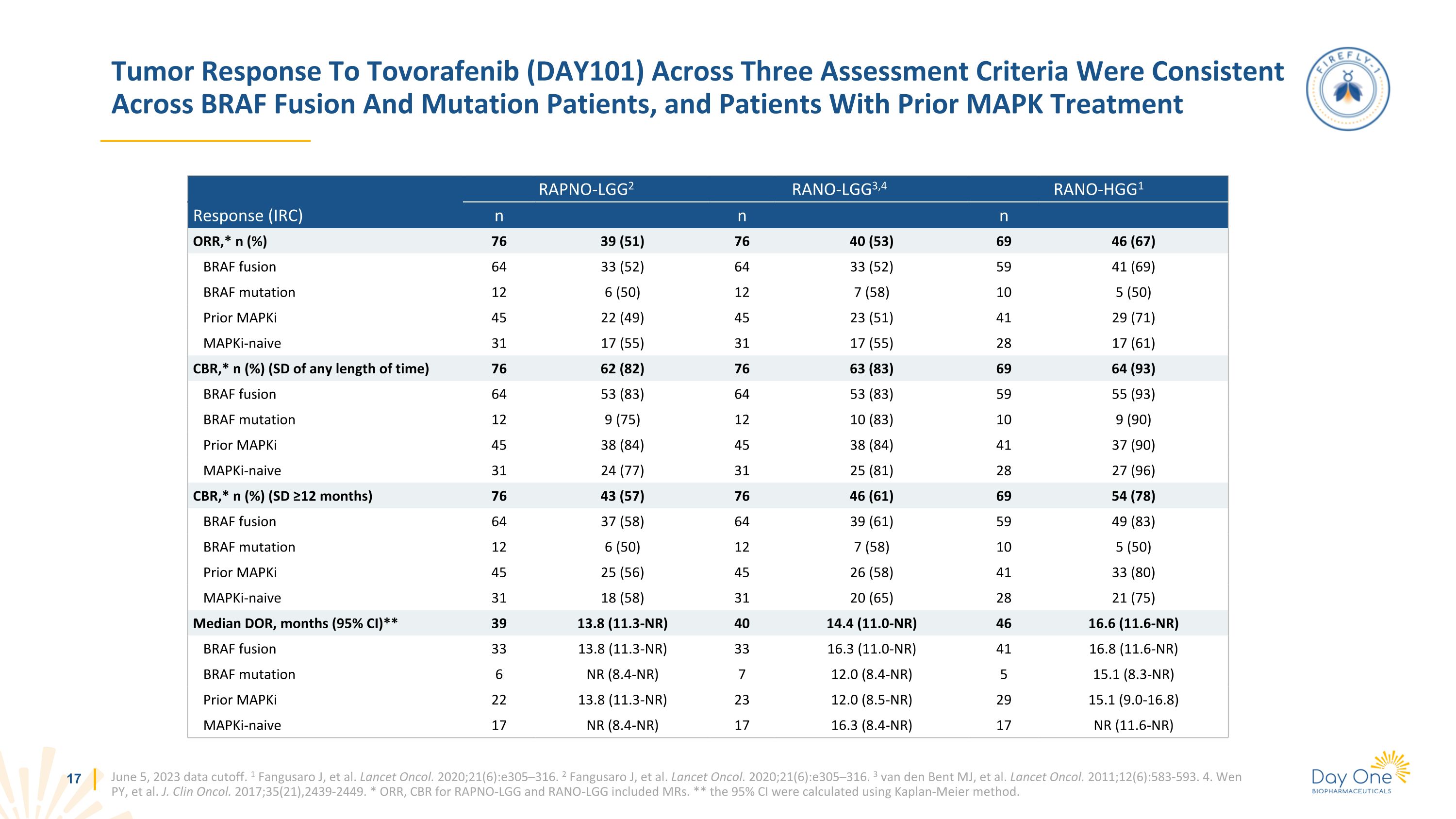
2023 年 6 月 5 日,BRAF 融合和突變患者以及之前接受過 MAPK 治療的患者在三個評估標準中腫瘤對託伏拉非尼(DAY101)的反應一致。1 Fangusaro J 等人。Lancet Oncol. 2020;21 (6): e305—316. 2 Fangusaro J,等人。Lancet Oncol. 2020;21 (6): e305—316. 3 van den Bent MJ,等人。Lancet Oncol. 2011; 12 (6): 583-593. 4.Wen PY 等人。J. clin Oncol. 2017;35 (21) ,2439-2449。* ORR、RAPNO-LGG 的 CBR 和 RANO-LGG 包括 MRS。** 95% 置信區間是使用 Kaplan-Meier 方法計算得出的。RAPNO-LGG2 RANO-LGG3,4 RANO-HGG1 響應 (IRC) n n n n ORR,* n (%) 76 39 (51) 76 40 (53) 69 46 (67) BRAF 融合 64 33 (52) 64 33 (52) 59 41 (69) BRAF 突變 12 6 (50) 12 7 (58) 10 5 (50) Prior mapKI 45 22 (49) 45 23 (51) 41 29 (71)) mapki-naive 31 17 (55) 31 17 (55) 28 17 (61) CBR,* n (%)(任意時間長度的 SD)76 62 (82) 76 63 (83) 69 64 (93) BRAF 融合 64 53 (83) 64 53 (83) 64 (83) 64 53 (83) BRAF 融合 64 53 (83) 64 53 (83) 59 (93) BRAF 突變 12 9 (75) 12 10 (83) 10 9 (90) Prior mapKI 45 38 (84)) 45 38 (84) 41 37 (90) Mapki-naive 31 24 (77) 31 25 (81) 28 27 (96) CBR,* n (%)(SD ≥12 個月)76 43 (57)76 46 (61) 69 54 (78) BRAF 融合 64 37 (58) 64 39 (61) 59 (83) BRAF 突變 12 6 (50) 12 7 (58) 10 5 (50) Prior mapKI 45 25 (56) 45 26 (58) 41 33 (80) mapki-naive 31 18 (58) 31 20 (65) 28 21 (75) DOR,月份(95% 置信區間)** 39 8 (11.3-NR) 40 14.4 (11.6-NR) 46 16.6 (11.6-NR) BRAF fusion 33 13.8 (11.3-NR) 33 16.3 (11.0-NR) 41 16.8 (11.6-NR) BRAF 突變 6 NR (8.4-NR) 7 12.0 (8.4-NR) 5 15.1 (8.3-NR) Prior mapKI 22 13.8 (11.3-NR) BRAF 突變 6 NR (8.4-NR) 7 12.0 (8.4-NR) 5 15.1 (8.3-NR) Prior mapKI 22 13.8 (11.3-NR) NR) 23 12.0 (8.5-NR) 29 15.1 (9.0-16.8) Mapki-naive 17 NR (8.4-NR) 17 16.3 (8.4-NR) 17 16.3 (8.4-NR) 17 NR (11.6-NR) 17 NR (11.6-NR)
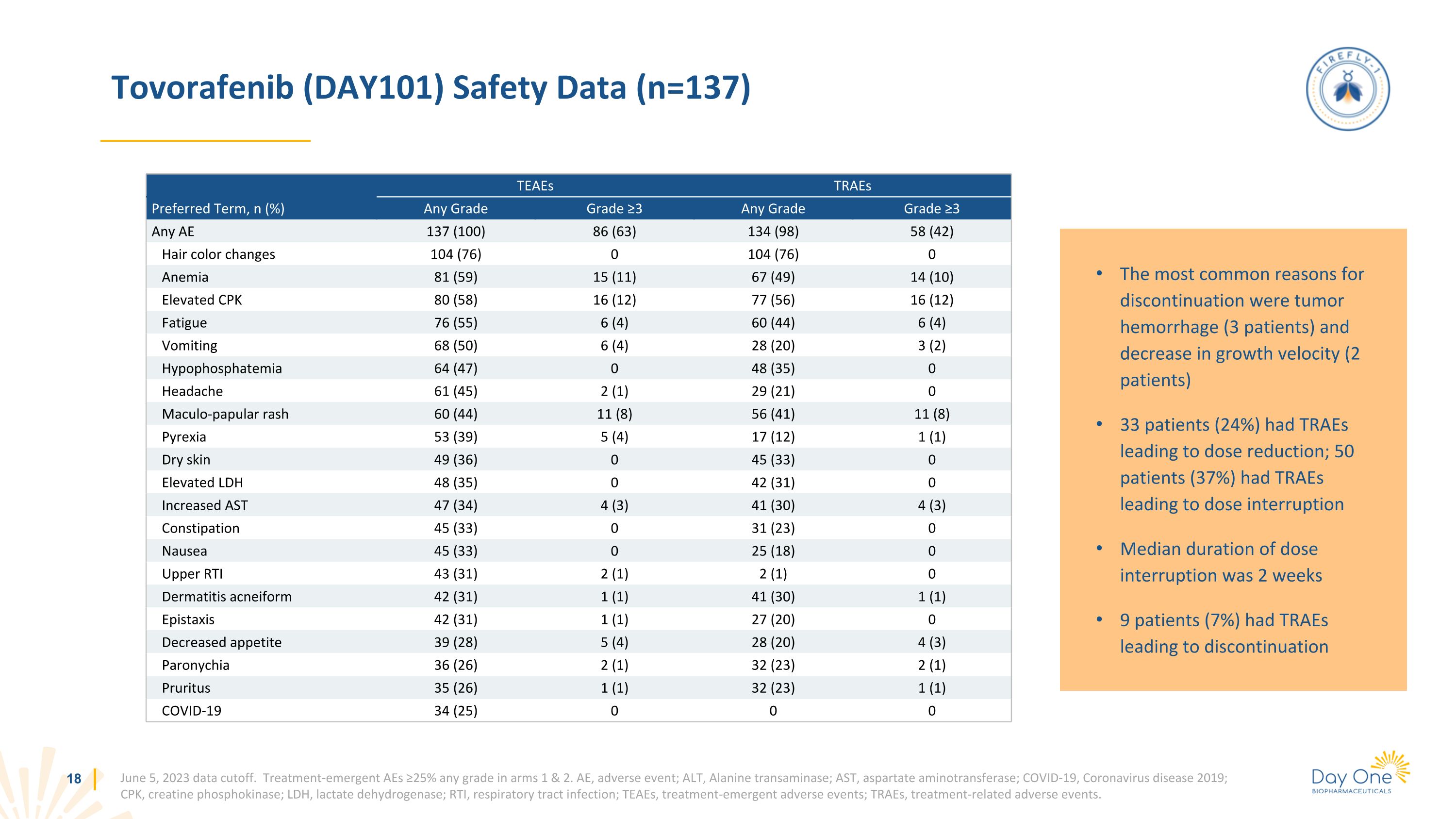
Tovorafenib (DAY101) 安全數據 (n=137) 2023 年 6 月 5 日數據截止。第 1 和第 2 組中任何等級的治療急性 AE ≥ 25%。AE,不良事件;ALT,丙氨酸轉氨酶;AST,天冬氨酸氨基轉移酶;COVID-19,2019年冠狀病毒病;CPK,肌酸磷酸激酶;LDH,乳酸脱氫酶;RTI,呼吸道感染;TEAE,治療緊急不良事件;TRAE,與治療相關的不良事件。TeaES traES 首選術語,n (%) 任何等級 ≥3 任何等級 ≥3 任何 AE 137 (100) 86 (63) 134 (98) 58 (42) 頭髮顏色變化 104 (76) 0 104 (76) 0 貧血 81 (59) 15 (11) 67 (49) 14 (10) CPK 升高 80 (58) 16 (12) 77 (56) 16 (12) 疲勞 76 (55) 6 (12) 4) 60 (44) 6 (4) 嘔吐 68 (50) 6 (4) 28 (20) 3 (2) 低磷血癥 64 (47) 0 48 (35) 0 頭痛 61 (45) 2 (1) 29 (21) 0 斑丘疹 60 (44) 11 (8) 56 (41) 11 (8) 發熱 53 (39) 5 (4) 17 (12) 1 (1) 乾性皮膚 49 (36) 0 45 (33) 0 LDH 升高 48 (35) 0 42 (31) 0 AST 47 (34) 4 (3) 4 (3) 41 (30) 4 (3) 4 (3)) 便祕 45 (33) 0 31 (23) 0 噁心 45 (33) 0 25 (18) 0 上部 RTI 43 (31) 2 (1) 2 (1) 0 痤瘡樣皮炎 42 (31) 1 (1) 41 (1) 41 (30) 1 (1) 鼻出血 42 (31) 1 (1) 27 (20) 0 食慾下降 39 (28) 5 (4) 28 (20) 4 (4) 28 (20) 4 (4) 3) 甲溝炎 36 (26) 2 (1) 32 (23) 2 (1) 瘙癢 35 (26) 1 (1) 32 (23) 1 (1) COVID-19 34 (25) 0 0 0 0 最常見的停藥原因是腫瘤出血(3 名患者)和生長速度降低(2 名患者)33 名患者(24%)的 TRAE 導致劑量減少;50 名患者(37%)有 TRAE 導致劑量中斷中位數劑量中斷持續時間為 2 周 9 名患者 (7%) 有 traE 導致停藥
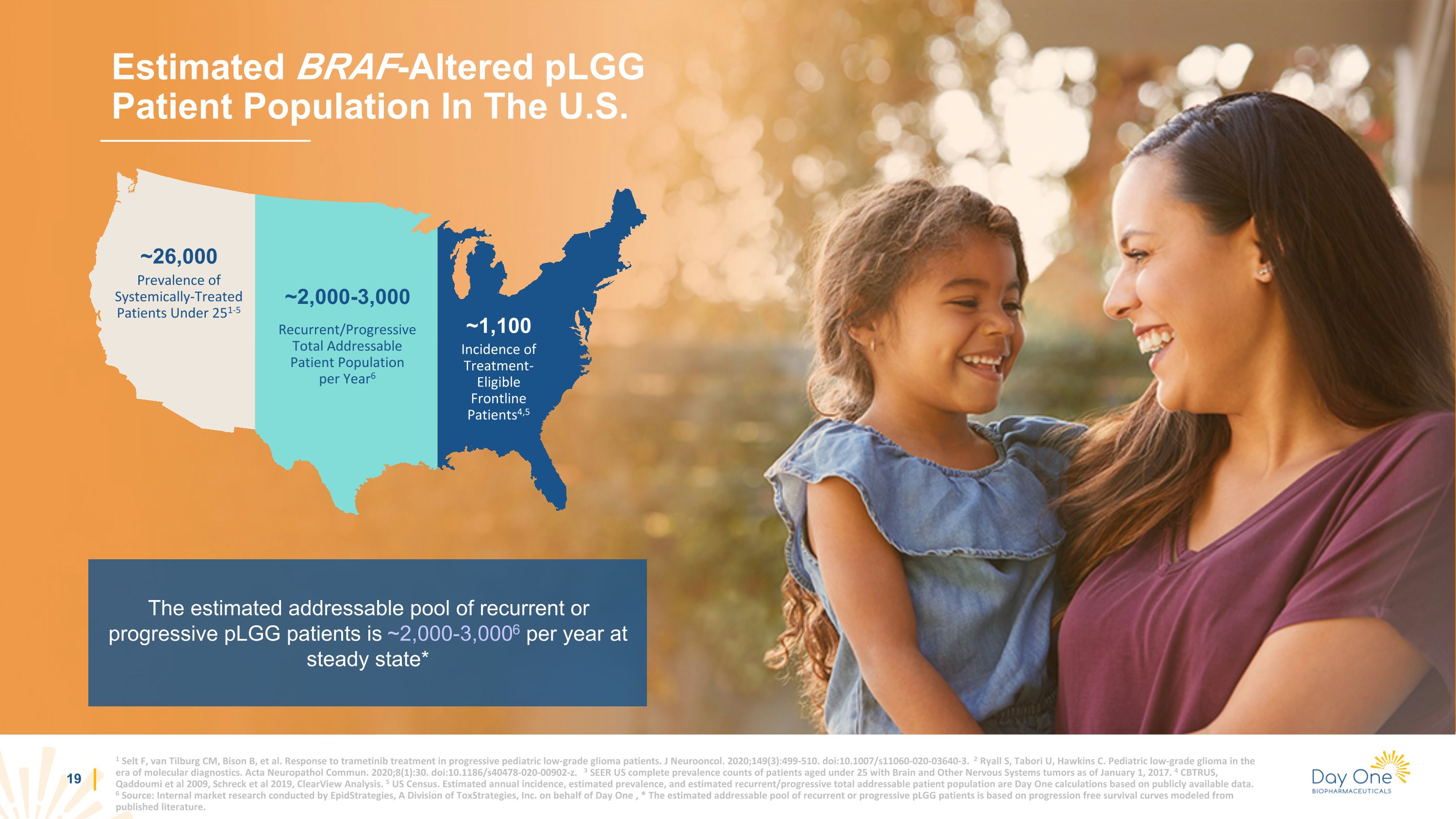
1 Selt F、van Tilburg CM、Bison B 等。進展性兒科低度神經膠質瘤患者對曲美替尼治療的反應。J Neurooncol. 2020;149 (3): 499-510。doi: 10.1007/s11060-020-03640-3。2 Ryall S、Tabori U、Hawkins C. 分子診斷時代的兒科低度神經膠質瘤。Acta Neuropathol Commun。2020;8 (1) :30。doi: 10.1186/s40478-020-00902-z。3 SEER 美國截至2017年1月1日25歲以下大腦和其他神經系統腫瘤患者的完整患病率。4 CBTRUS,Qaddoumi等人 2009年,Schreck等人,ClearView分析。5 美國人口普查。估計的年發病率、估計的患病率和預計的復發/進行性可尋址患者總數是根據公開數據計算得出的第一天得出的。6 來源:ToxStrategies, Inc.旗下EpidStrategies代表第一天進行的內部市場研究,* 復發或進行性plGG患者的估計可尋址庫是基於已發表文獻模型的無進展生存曲線。美國估計的BRAF改變的plGG患者羣體在穩定狀態下,每年復發或進行性plGG患者的可尋址人數約為2,000-3,0006人* 約26,000~2,000-3,000人每年約1,100例復發/漸進性可尋址患者羣體6符合治療條件的一線患者的發病率4,5 251-5歲以下接受全身治療的患者的患病率
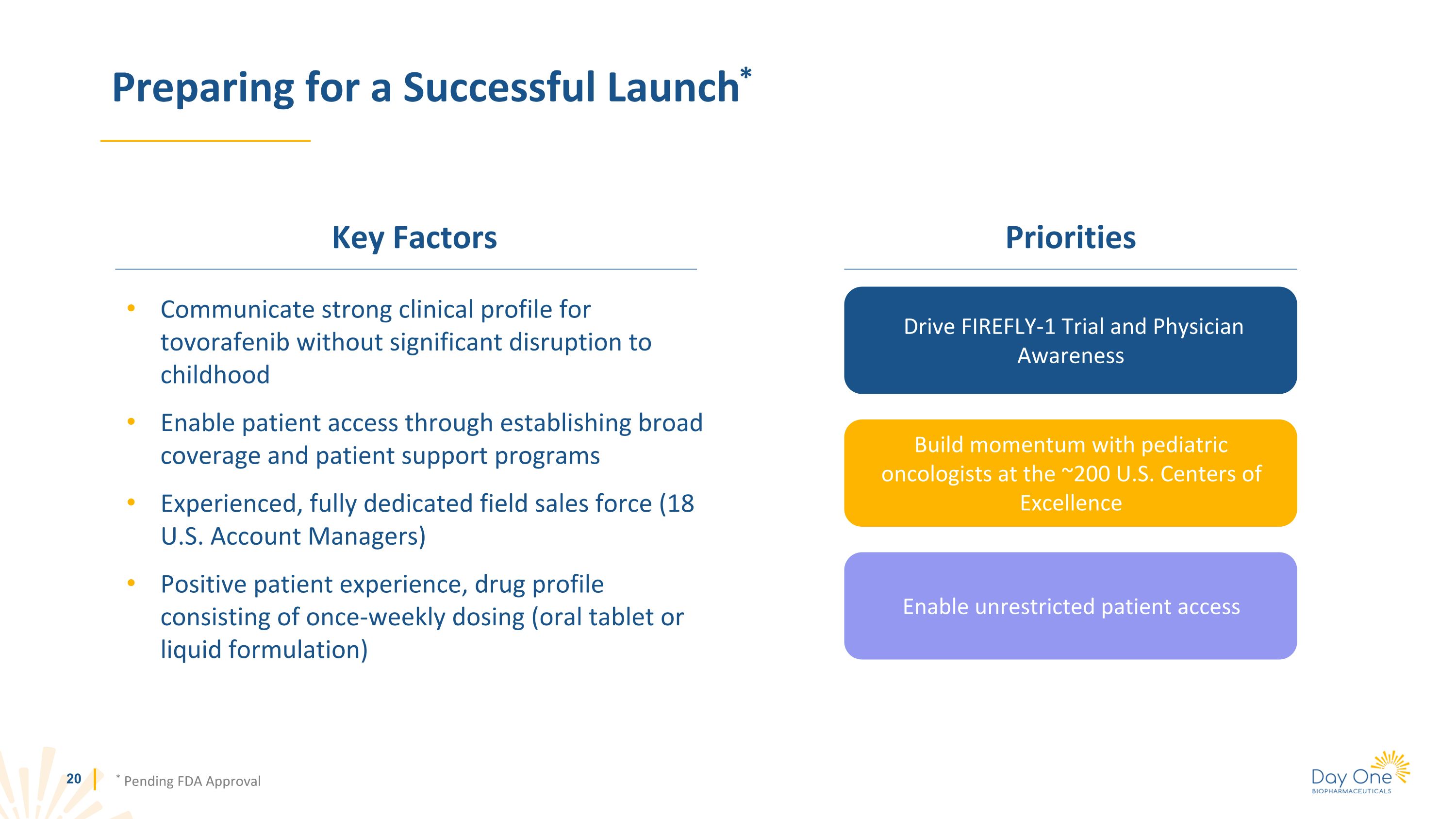
為成功上市做準備* * 待美國食品藥品管理局批准關鍵因素在不對兒童造成重大幹擾的情況下傳達託沃拉非尼的強大臨牀形象通過建立廣泛的覆蓋範圍和患者支持計劃為患者提供准入機會經驗豐富、專職的現場銷售隊伍(18 名美國客户經理)積極的患者體驗、包括每週一次劑量(口服片劑或液體配方)在內的藥物概況優先事項推動 FIREFLY-1 試驗和醫生意識與大約 200 個美國中心的兒科腫瘤學家一起增強勢頭的卓越讓患者可以不受限制地進入

FIREFLY-1 數據和後續步驟的關鍵要點對於複發性或進行性 LGG 含有 BRAF 融合或 BRAF V600E 突變(“BRAF 改變”)的兒科患者 FIREFLY-1 的臨牀意義67% RARNO-HGG 51% RRRNO-LGG 53% ORR RANO-LGG 53% ORR RANO-LGG 加深患者在 2022 年 12 月至 2023 年 6 月期間觀察到的反應所有三個評估標準的數據截止時間有意義的持續時間截至數據截止時的響應(平均時間:RANO-HGG 為 16.6 個月,RAPNO-LGG 為 13.8 個月,RANO-LGG 為 14.4 個月)*在患有 BRAF 融合或 BRAF V600E 突變的患者中觀察到反應在經過大量預處理的人羣中觀察到反應,其中大多數(60%)患者在使用一種或多種 MAPK 抑制劑或之後進展的安全性和耐受性概況表明單一療法託伏拉非尼對plGG的耐受性普遍良好,有資格獲得優先審查券2023年6月5日數據截止日期。* RANO-HGG 95% 置信區間:11.6-NR,RAPNO-LGG 95% 置信區間:11.3-NR,RANO-LGG 95% 置信區間:11.0-NR。下一步:優先審查獲得批准,PDUFA的目標行動日期為2024年4月30日

FIREFLY-2/LOGIC Tovorafenib (DAY101) 在 Frontline plGG 中進行的 3 期關鍵試驗
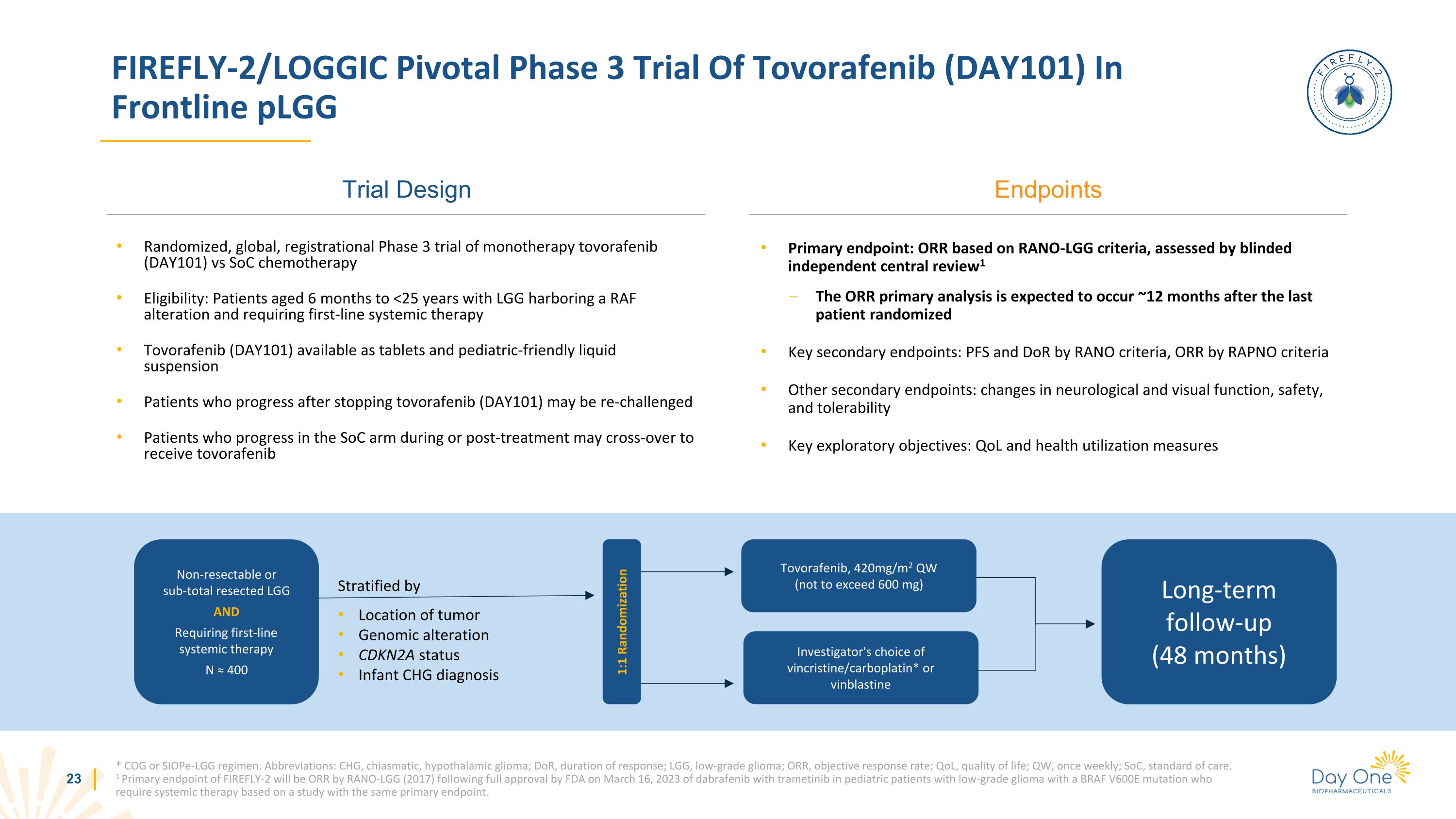
FIREFLY-2/LOGIC Tovorafenib(DAY101)在前線 plGG 試驗設計中進行的 FIREFLY-2/LOGIC 關鍵性三期試驗 * COG 或 SIOPE-LGG 方案。縮寫:CHG,交叉性,下丘腦神經膠質瘤;doR,緩解持續時間;LGG,低度神經膠質瘤;ORR,客觀緩解率;QL,生活質量;QW,每週一次;SoC,護理標準。美國食品藥品管理局於 2023 年 3 月 16 日全面批准達布拉非尼和曲美替尼用於低水平兒科患者後,FIREFLY-2 的主要終點將是 RANO-LGG(2017)的 ORR 根據一項具有相同主要終點的研究,具有 BRAF V600E 突變且需要全身治療的級別神經膠質瘤。終點單一療法 tovorafenib (DAY101) 與 SoC 化療的隨機、全球註冊 3 期試驗資格:6 個月至 的患者

評估託伏拉非尼(DAY101)與匹馬舍替聯合使用的 FIRELIGHT-1 1b/2 期試驗

Pimasertib:正在研究的變構型 MEK1/2 抑制劑,在 MAPK 驅動的實體瘤中表現出活性 Pimasertib 是一種正在研究的口服生物可利用、選擇性、非競爭性的 MEK1/2 抑制劑,已於 2021 年 2 月獲得默沙東 KGaA 的許可,第 2 階段有大量的非臨牀和臨牀開發工作,包括在日本進行的一項實體瘤試驗,以及與所有同類異構體典型的其他 MOA 主要抗體藥物的組合 MEK 抑制劑(胃腸道、CPK 升高、皮疹、視力障礙)中樞神經系統穿透率比其他 meKi 高出近三倍抑制劑(曲美替尼或賽魯美替尼)Pimasertib顯示出單一療法臨牀活性,包括在NRAS突變黑色素瘤中與達卡巴嗪相比,Pifs中位數有所改善,與託伏拉非尼(DAY101)和其他靶向療法聯合使用可能會釋放pimasertib在晚期實體瘤中的全部價值來源:Pimasertib研究者手冊,v12,2019;de Gooijer 等人.,《國際癌症雜誌》,2018年;Shaw等人,AACR LB-456,2012年;Lebbe等人,《癌症》,2020年。
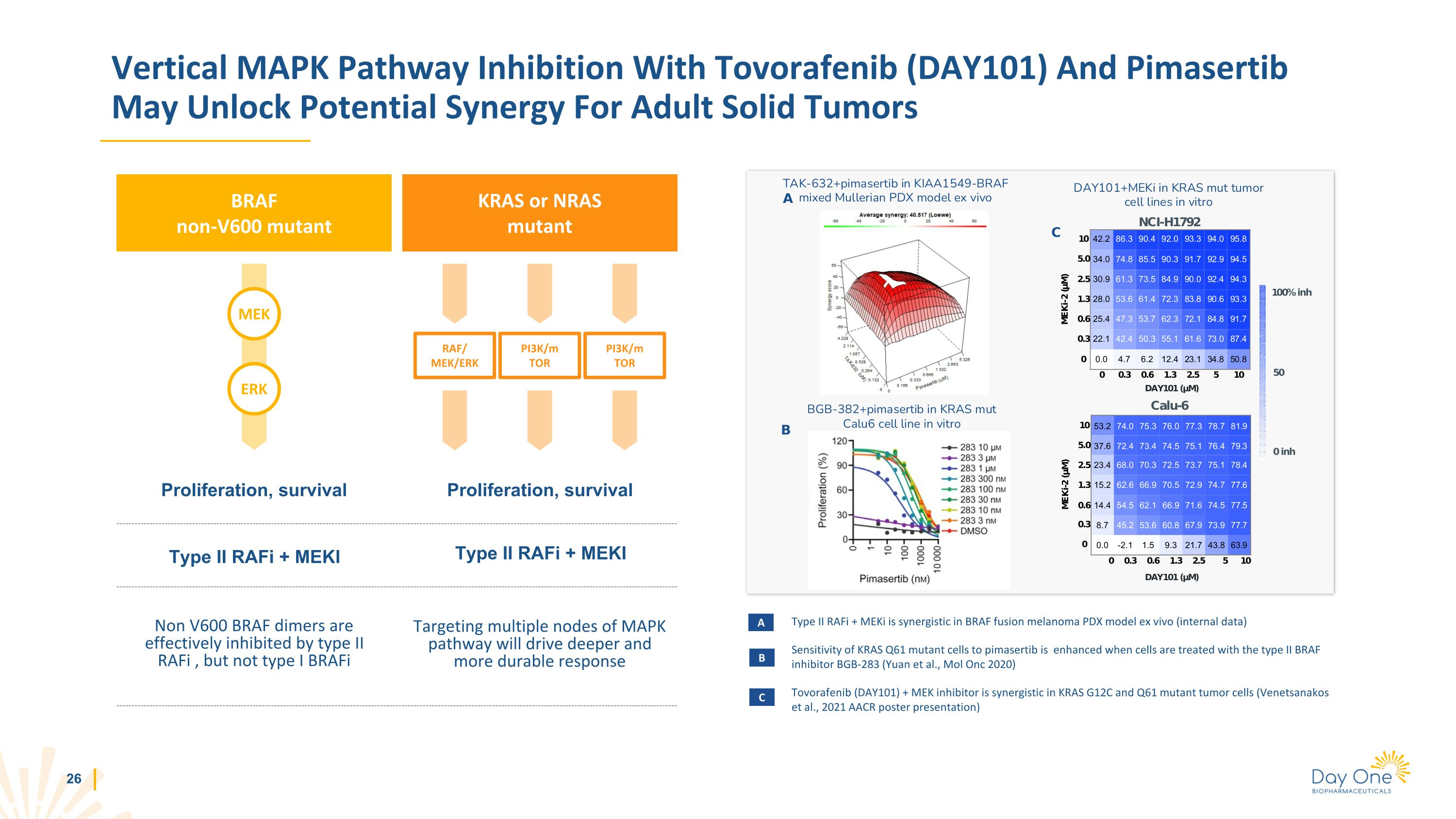
使用託伏拉非尼(DAY101)和匹馬舍替布抑制垂直 MAPK 途徑可能為成人實體瘤 KRAS 或 NRAS 突變體 BRAF 非 v600 突變體 MEK ERK RAF/ MEK/ERK PI3K/M TOR PI3K/M TOR PI3K/M TOR 增殖、存活增殖、存活 II 型 RaFi + MEKI 非 V600 BRAF 二聚體有效抑制 II 型 RaFi,但不是 I 型 braFi 靶向 MAPK 通路的多個節點將推動更深、更持久的反應 II 型 RaFi + meKi 在 BRAF 融合黑色素瘤 PDX 模型體外具有協同作用(內部數據)使用 II 型 BRAF 抑制劑 BGB-283(Yuan 等人,Mol Onc 2020)治療細胞時,KRAS Q61 突變細胞對匹馬舍替布的敏感性會增強 Tovorafenib (DAY101) + MEK 抑制劑在 KRAS G12C 和 Q61 突變腫瘤細胞中具有協同作用(Venetsanakos 等人,2021 年 AACR 海報演示)A B C
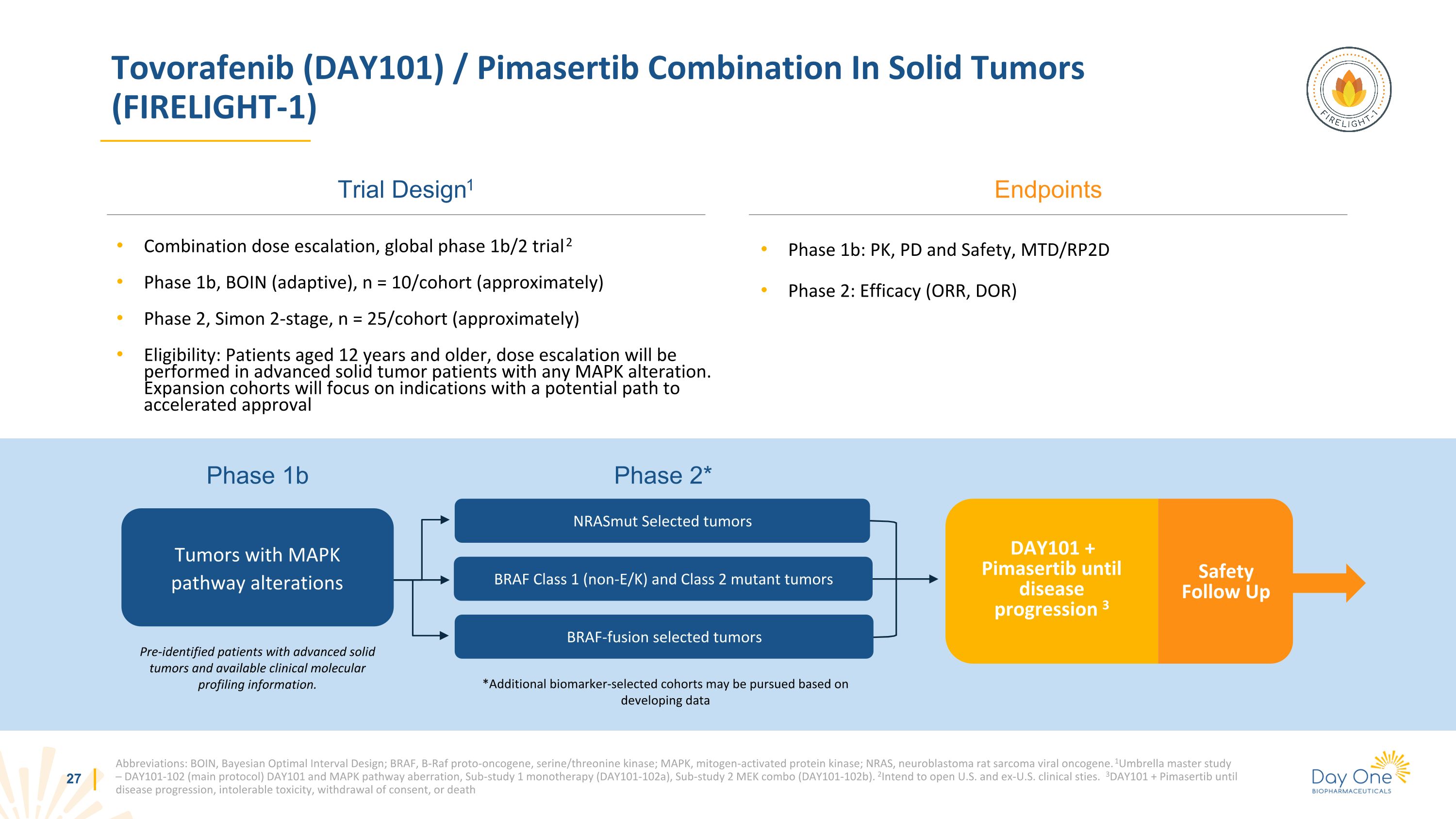
NrasMut 精選腫瘤預先確定了晚期實體瘤患者和可用的臨牀分子譜信息。Tovorafenib (DAY101) /Pimasertib 組合治療實體瘤 (FIRELIGHT-1) 試驗設計1 縮寫:BOIN,貝葉斯最佳間隔設計;BRAF、B-Raf 原癌基因、絲氨酸/蘇氨酸激酶;MAPK,絲裂原活化蛋白激酶;NRAS,神經母細胞瘤大鼠肉瘤病毒癌基因。1Umbralla 主研究 — DAY101-102(主要方案)DAY101 和 MAPK 途徑異常,子研究 1 單一療法(第 101-102a 天),子研究 2 MEK 組合(第 101-102b 天)。2打算開設美國和美國以外的臨牀站點。3DAY101 + Pimasertib 直到疾病進展,毒性不可耐受,撤回同意,或死亡終點組合劑量遞增,全球1b/2期試驗2階段1b,BOIN(適應性),n = 10/隊列(大約)2期,西蒙2階段,n = 25/隊列(大約)資格:12歲及以上的患者,劑量遞增將對任何MAPK改變的晚期實體瘤患者進行。擴展隊列將重點關注有可能加速審批 1b 期的適應症:PK、PD 和安全性,MTD/RP2D 第 2 階段:療效(ORR、DOR)安全性隨訪 DAY101 + Pimasertib 直至疾病進展 3 期 1b BRAF-Fusion 選定腫瘤 2* * 可根據開發數據研究其他生物標記物選擇的隊列 BRAF 1 類(非 E/K)和 2 類突變腫瘤

摘要
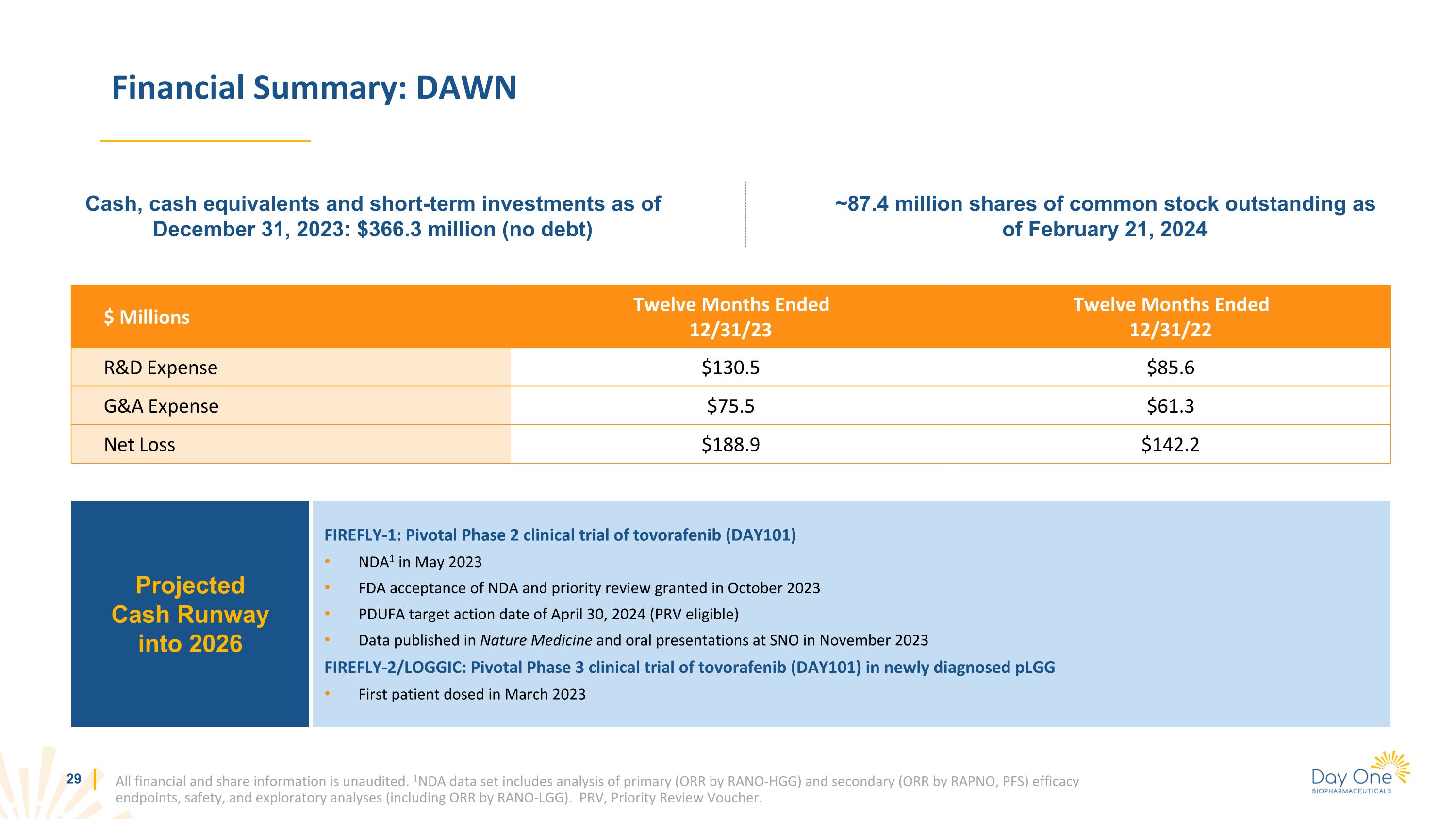
財務摘要:DAWN所有財務和股票信息均未經審計。1NDA數據集包括對初級(RANO-HGG的ORR)和次要(RAPNO的ORR,PFS)療效終點分析、安全性和探索性分析(包括RANO-LG的ORR)。PRV,優先審查憑證。百萬美元截至23年12月31日的十二個月研發費用130.5美元85.6美元併購費用75.6美元淨虧損188.9美元142.2美元截至2023年12月31日的現金、現金等價物和短期投資:截至2024年2月21日的3.663億美元(無債務)約8,740萬股已發行普通股預計到2026年的現金跑道 FIREFLY-1:2023 年 5 月 tovorafenib (DAY101) NDA1 的關鍵性 2 期臨牀試驗 FDA 接受保密協議並於 2023 年 10 月批准優先審查 PDUFA 的目標行動日期為 2024 年 4 月 30 日 (PRV)符合條件)2023 年 11 月發表在《自然醫學》和 SNO 的口頭陳述中的數據 FIREFLY-2/LOGIC:對新診斷的 plGG 進行託伏拉非尼 (DAY101) 的關鍵性 3 期臨牀試驗 2023 年 3 月首次給藥的患者

2023 年關鍵成就 FIREFLY-1:復發或漸進式 plGG 業務發展財務狀況截至2023年12月31日為3.663億美元的現金、現金等價物和短期投資 Cash Runway 2023 年 8 月針對 VRK1 的臨牀前項目的研究合作和許可協議保密協議於 2023 年 5 月啟動 2023 年 6 月在 ASCO 口頭陳述中公佈的臨牀數據 FDA 接受保密協議並於 2023 年 10 月批准優先審查。數據發佈於《自然醫學》和口頭陳述 2023 年 11 月的 SNO PDUFA 目標行動2024 年 4 月 30 日的日期 FIREFLY-2:Frontline plGG 於 2023 年 3 月為第一位患者服藥

在我們向商業階段公司擴張的過程中,我們的優先事項確保首個經美國食品藥品管理局批准的具有已復發或進展的BRAF融合和點突變的plGG靶向療法擴大醫生的認識,擴大覆蓋範圍以使患者獲得治療獲得批准後,將託伏拉非尼確立為復發或進行性plGG的護理標準。第一天成長為領先的生物製藥公司,成為腫瘤藥物開發的首選合作伙伴探索選擇性合作伙伴關係作為資本和風險分擔來源更多投資業務發展活動以擴大我們針對兒童和成人的多元資產組合 FIREFLY-2:研究託伏拉非尼作為未接受治療的 plGG FIRELIGHT-1 患者的前線療法:評估託伏拉非尼與匹馬舍替聯合應用於青少年和成人人羣的早期VRK1項目推進臨牀開發啟動託伏拉非尼高級投資組合擴大產品線

附錄
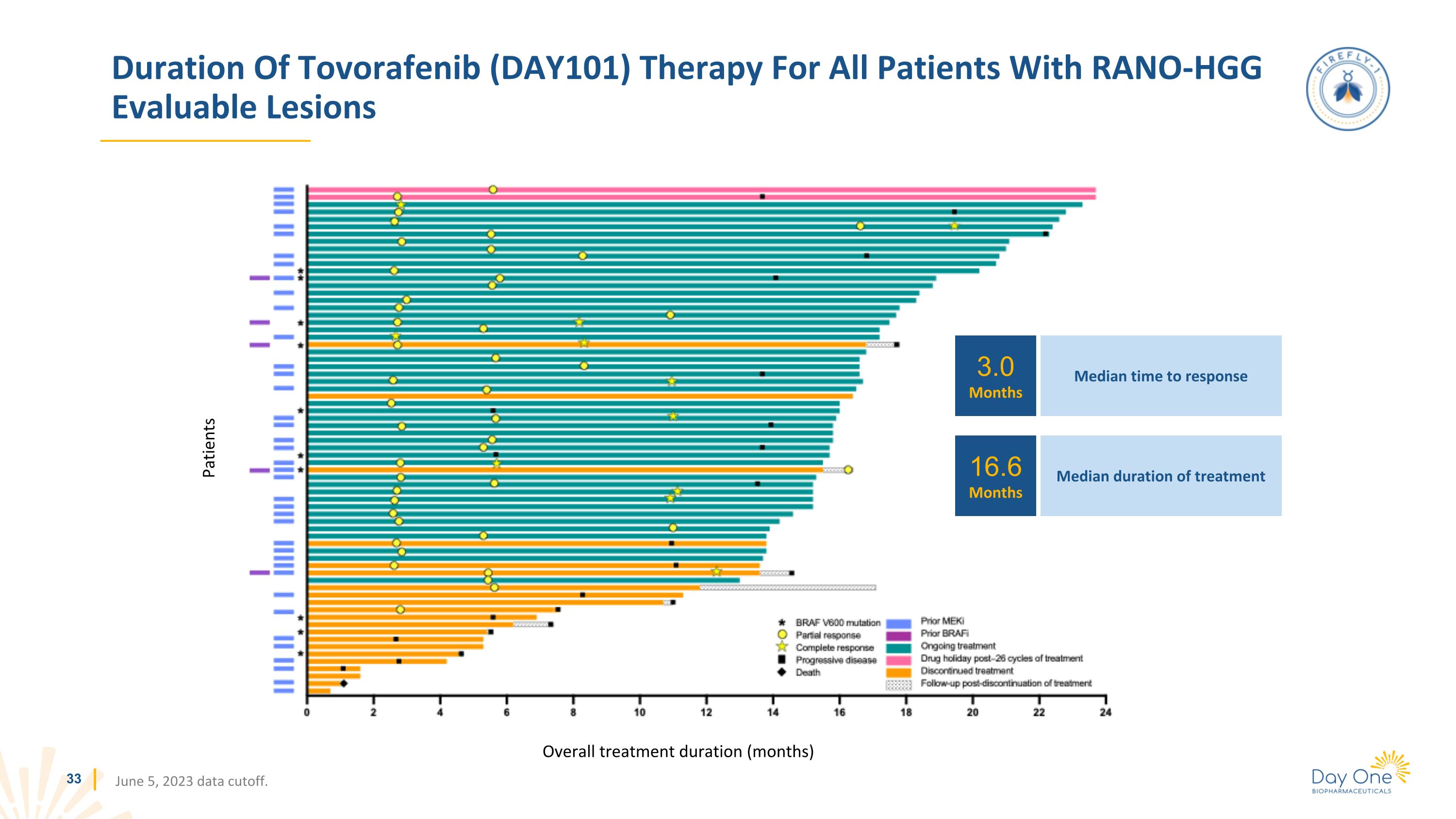
所有患有 RANO-HGG 可評估病變患者的託伏拉非尼 (DAY101) 治療持續時間(月)2023 年 6 月 5 日數據截止日期。3.0 個月 16.6 個月中位緩解時間中位數

所有 RANO-LGG 可評估病變患者的託伏拉非尼 (DAY101) 治療持續時間(月)2023 年 6 月 5 日數據截止日期。5.5 個月 14.4 個月中位緩解時間中位數
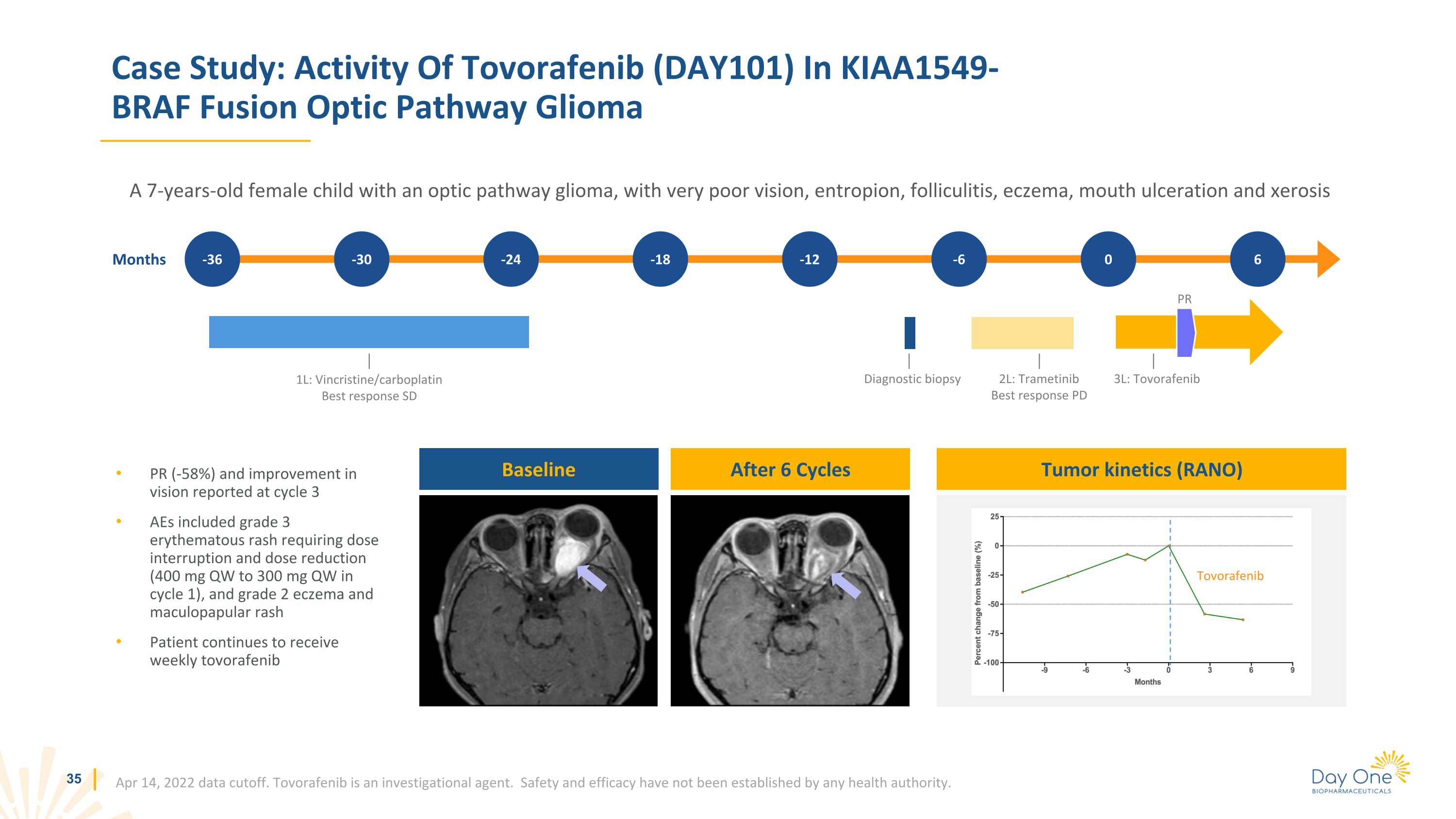
案例研究:託伏拉非尼(DAY101)在 KIAA1549-BRAF 融合視通路神經膠質瘤中的活性一名患有視通路神經膠質瘤的7歲女童,視力極差、熵、毛囊炎、濕疹、口腔潰瘍和乾燥症 2022年4月14日數據截止。託伏拉非尼是一種研究藥物。任何衞生機構尚未確定安全性和有效性。月 -36 -30 -24 -18 -12 -6 0 6 6 6 6 週期後 6 個週期後基線 1L:長春克里斯汀/卡鉑最佳反應 SD 診斷活檢 PR 6 2L:曲美替尼最佳反應 PD 3L:託伏拉非尼腫瘤動力學 (RANO) Tovorafenib PR (-58%) 和第 3 週期報告的視力改善包括需要中斷劑量和減少劑量的 3 級紅斑皮疹(在週期 1 中為 400 mg QW 到 300 mg QW),以及 2 級濕疹和斑丘疹患者繼續每週接受託伏拉非尼治療
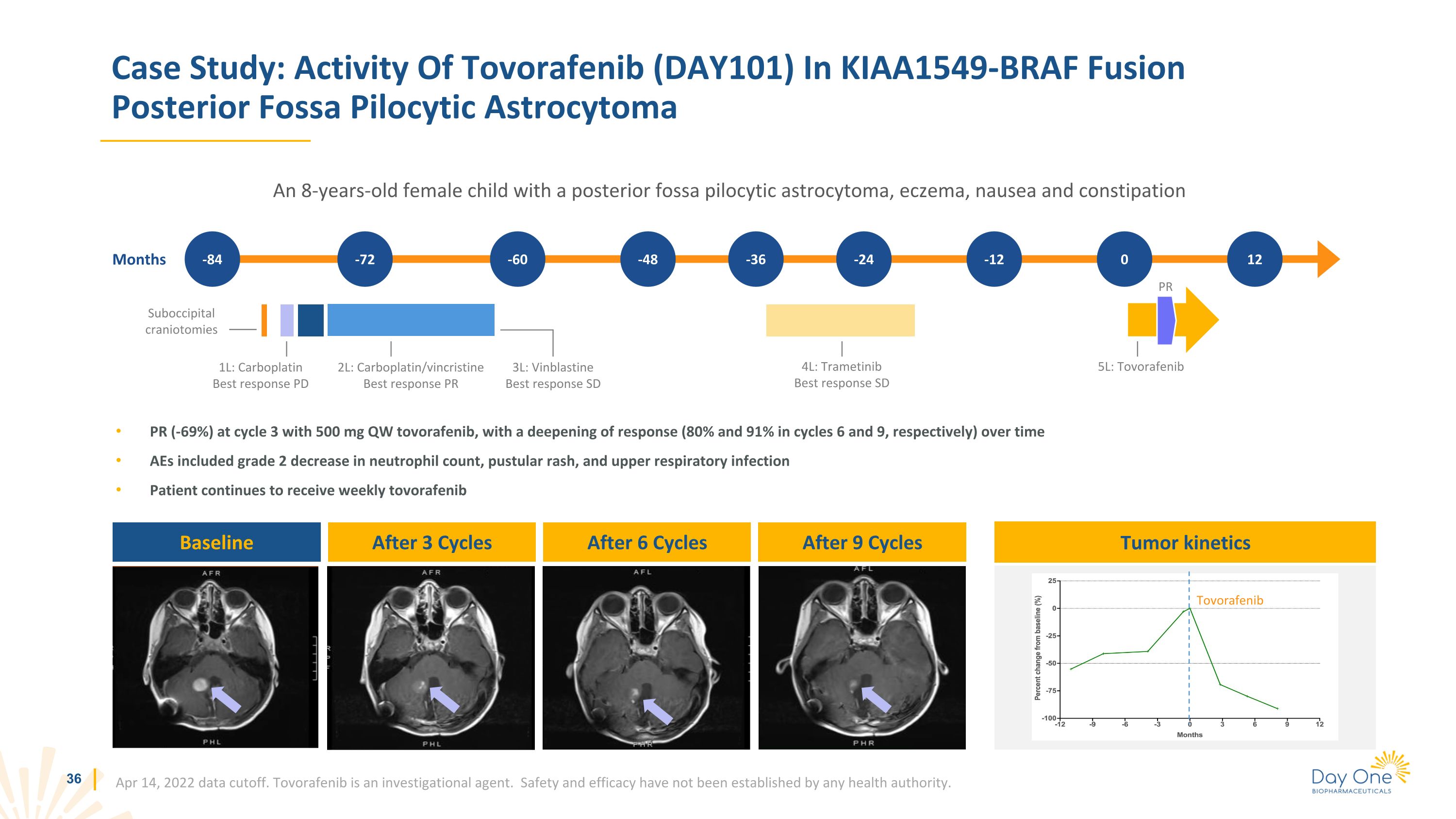
週期 3 時 PR(-69%)使用 500 mg QW tovorafenib,隨着時間的推移,反應加深(第 6 和第 9 週期分別為 80% 和 91%)AE 包括中性粒細胞計數下降 2 級、膿皰皮疹和上呼吸道感染患者繼續每週接受託伏拉非尼託伏拉非尼案例研究:託伏拉非尼 (DAY101) 在 KIAA1549-BRAF 融合後窩中的活性星形細胞瘤一名患有後窩毛細胞星形細胞瘤、濕疹、噁心和便祕的8歲女童,2022年4月14日數據截止。託伏拉非尼是一種研究藥物。任何衞生機構尚未確定安全性和有效性。個月 -84 -72 -60 -48 -36 -24 -12 基線 3L:長春鹼最佳反應 SD PR 0 4L:曲美替尼最佳反應 SD 5L:託伏拉非尼腫瘤動力學 12 2L:卡鉑/長春新鹼最佳反應 PR 1L:卡鉑最佳反應 PD 在 9 個週期後 6 個週期後的枕骨下開顱術
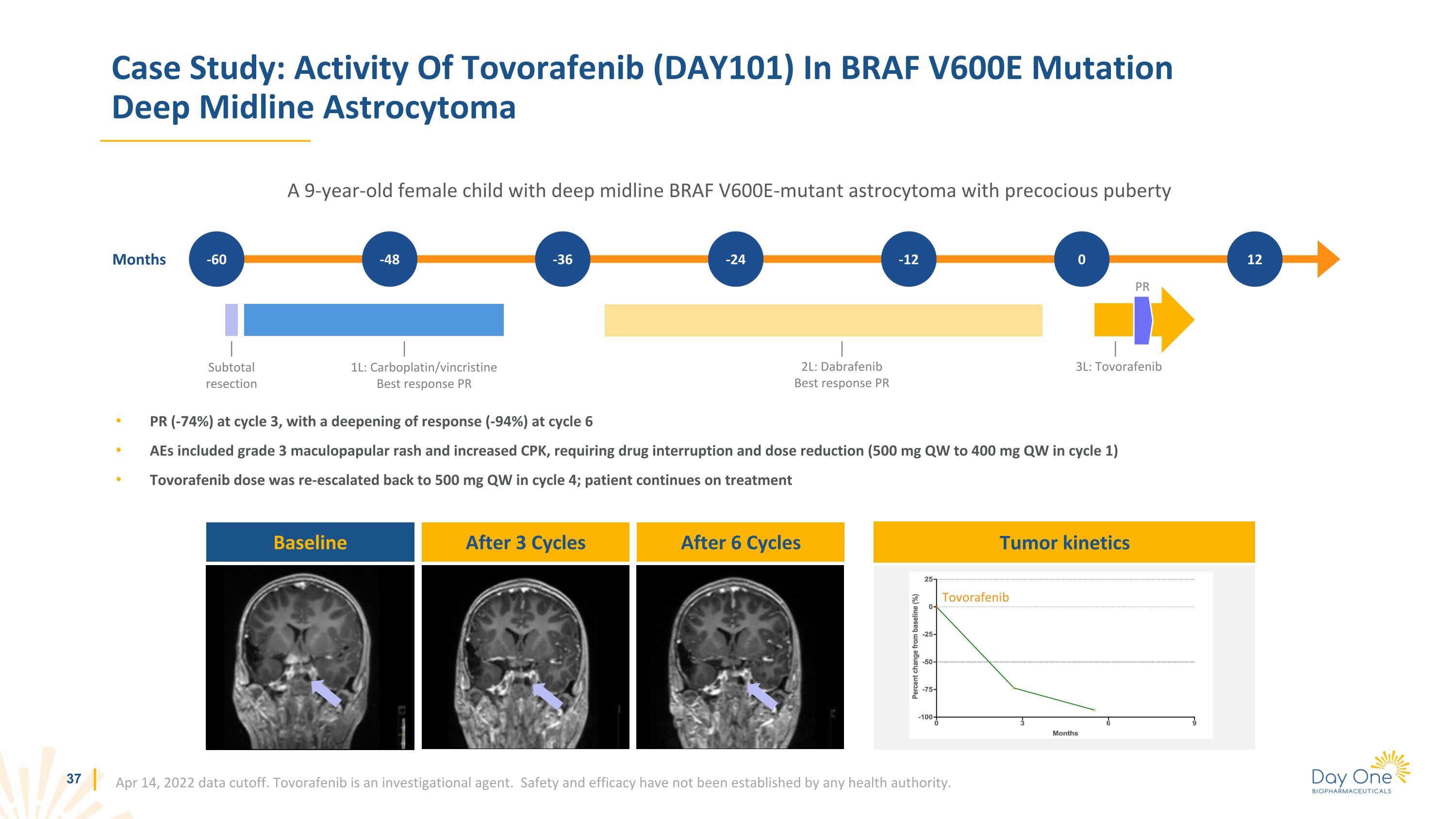
第 3 週期 PR (-74%),第 6 週期反應加深 (-94%) AE 包括 3 級斑丘疹和 CPK 升高,需要中斷藥物和減少劑量(週期 1 中為 500 mg QW 至 400 mg QW),週期 4 中託伏拉非尼的劑量重新增加到 500 mg QW;患者繼續接受治療案例研究:BRAF 中託伏拉非尼 (DAY101) 的活性 V600E 突變深度中線星形細胞瘤一個 9 歲的女孩,患有深中線 BRAF v600E 突變星形細胞瘤,青春期早熟,數據截止。託伏拉非尼是一種研究藥物。任何衞生機構尚未確定安全性和有效性。月 -60 -48 -36 -24 -12 基線 PR 0 2L:達布拉非尼最佳反應 PR 3L:託伏拉非尼腫瘤動力學 12 1L:卡鉑/長春新鹼最佳反應 PR 6 個週期後 3 個週期後的小計切除託沃拉非尼
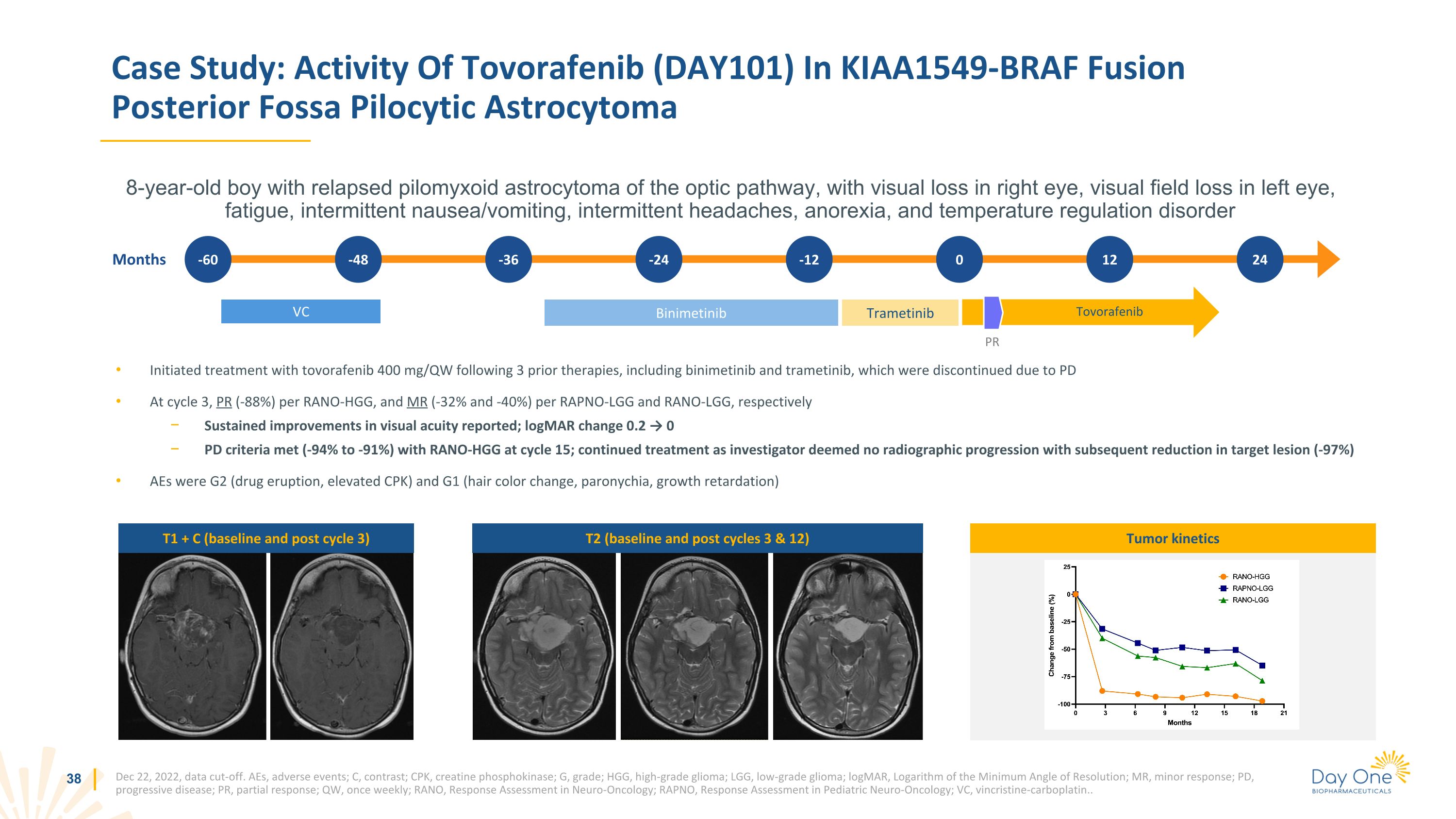
在之前的三種療法之後,開始使用託沃拉非尼400 mg/QW的治療,包括比尼美替尼和曲美替尼,這兩種療法因PD 在週期3中停止,每個RANO-HGG的PR(-88%),RAPNO-LGG和RANO-LGG的磁共振成像(-32%和-40%),報告的視力持續改善;LogMar變化0.2 → 0 PD標準滿足(-94%至-40%)91%) RANO-HGG 處於第 15 週期;繼續治療,因為研究人員認為沒有放射學進展,隨後目標病變減少 (-97%) AE 為 G2(藥物噴發,CPK 升高)和 G1(頭髮顏色變化,甲溝炎、生長遲緩)案例研究:託伏拉非尼(DAY101)在 KIAA1549-BRAF 融合後窩毛細胞星形細胞瘤中的活性 8 歲男孩視通路復發的毛黴素星形細胞瘤,右眼視力喪失,左眼視野喪失,疲勞,間歇性惡心/嘔吐,間歇性頭痛,厭食症和温度調節障礙 2022年12月22日,數據截止。AE,不良事件;C,對比;CPK,肌酸磷酸激酶;G,等級;HGG,高級別神經膠質瘤;LGG,低級別神經膠質瘤;LogMar,最小分辨角對數;MR,輕微反應;PD,進行性疾病;PR,部分反應;QW,每週一次;RANO,神經腫瘤學反應評估;RAPNO,兒科神經腫瘤學反應評估;VC,長春新鹼-卡鉑。。月 -60 -48 -36 -24 -12 VC 曲美替尼 PR 0 Tovorafenib 12 24 Binimetinib T1 + C(基線和後周期 3)T2(基線和後周期 3 和 12)腫瘤動力學
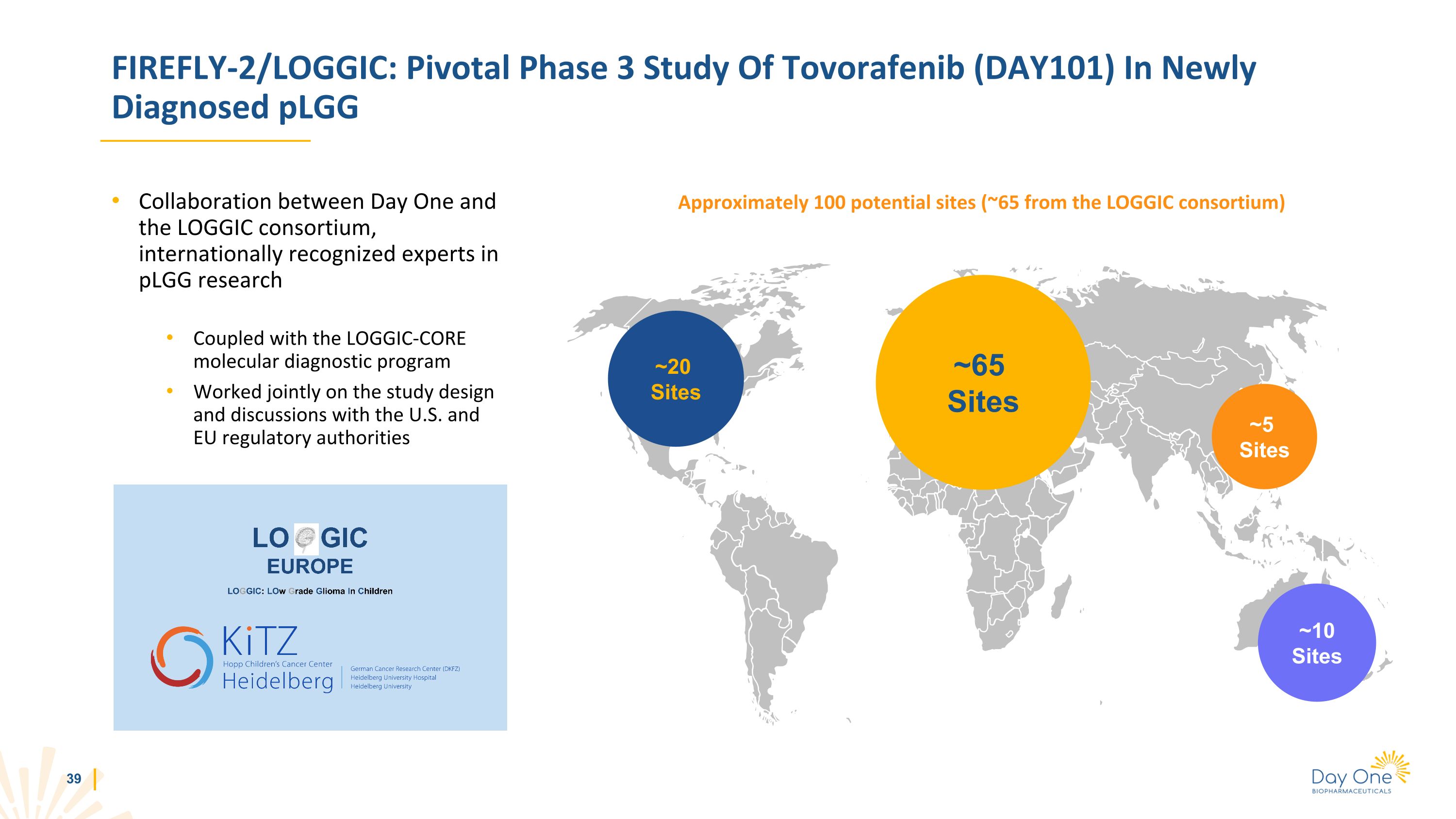
FIREFLY-2/LOGIC:託沃拉非尼(DAY101)的關鍵性三期研究在第一天與LOGGIC聯盟新診斷的plGG合作中,國際公認的plGG研究專家與LOGGIC-CORE分子診斷計劃共同進行了研究設計並與美國和歐盟監管機構進行了討論~20個地點 ~5個站點 ~10個地點大約有100個潛在地點(約65個來自LOGGIC聯盟)