附錄 99.2

SEELOS THERAPEUTICS SLS-005 ALS 熱門數據 2024 年 3 月 “我們是一家專注於實現最有效產品開發的公司,以滿足中樞神經系統疾病和罕見疾病中未得到滿足的重大需求”

前瞻性陳述本公司演示文稿包括經修訂的1934年《證券交易法》第21E條和1995年《私人證券訴訟改革法》所指的某些前瞻性陳述。這些前瞻性陳述包括但不限於關於Seelos Therapeutics, Inc.(“我們”、“我們的”、“公司” 或 “Seelos”)和我們的管理團隊的意圖、信念或當前期望的陳述。這些前瞻性陳述涉及已知和未知的風險、不確定性和其他重要因素,這些因素可能導致該公司的實際業績、業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異。諸如 “預期”、“相信”、“預測”、“潛力”、“目標”、“考慮”、“期望”、“打算”、“或行動”、“希望”、“尋求”、“估計”、“戰略”、“繼續”、“持續”、“機會”、“可能”、“應該”、“可能”、“應該”、“可能”、“應該”、“可能”、“應該”、“很可能”、“將”、“可能”、“應該”、“可能”、“應該”、“很可能”、“將”、“可能”、“應該”、“很可能”、“將”、“可能”、“應該”、“可能” “可能”、“可以”、“設計用於”、“未來”、“面向可預見的未來” 以及類似的表述和變體,以及這些詞的否定詞可識別前瞻性陳述。這些前瞻性陳述基於管理層的預期、估計、預測、信念和假設,這些信息均可能發生變化。寬鬆的前瞻性陳述並不能保證未來的表現,並且存在風險和不確定性,可能導致實際業績與前瞻性陳述所設想的結果存在實質性差異。決定這些結果和價值的許多重要因素超出了我們的控制或預測能力。提醒你不要過分依賴任何前瞻性陳述。除非法律另有要求,否則我們不承擔任何義務更新任何前瞻性陳述。有關可能導致實際業績與戰後陳述中描述的業績存在重大差異的因素的更多信息,請參閲公司向美國證券交易委員會(“SEC”)提交的文件,包括y公司截至2023年12月31日止年度的10-K表年度報告、隨後的10-Q表季度報告以及公司向美國證券交易委員會提交的其他文件中包含的風險因素。本公司簡報僅供參考,既不是購買要約,也不是徵求出售、認購或購買任何證券的費用,也不是根據擬議交易在任何司法管轄區徵集任何投票,也不得在任何司法管轄區進行任何違反適用法律的證券出售、發行或轉讓。除非通過符合經修訂的1933年《證券法》第10條要求的招股説明書,否則不得進行證券要約。2

3 肌萎縮性側索硬化症的患病率和批准的療法艾達拉豐(RADICAVA®)在利用事後分析進行了第二項3期研究後獲得批准 https://pubmed.ncbi.nlm.nih.gov/28522181/ ALS的全球患病率至少為20萬人 • 美國1為3萬人,歐盟和英國為3萬人 2 1. https://www.cdc.gov/als/dashboard/index.html 2.Brown CA 等人神經流行病學。2021;55(5):342-353 批准:2017(IV)2022年(口服)批准:1995 年利魯唑(RILUTEK®)經過兩項測量氣管切開術或死亡時間的3期研究獲得美國食品藥品管理局批准。兩項研究在研究結束時均未顯示死亡率存在統計學上的顯著差異。https: //www.accessdata.fda.gov/drugsatfda_docs/ label/2009/020599s011s012lbl.pdf 最早批准的療法 QALSODY®(tofersen)是一種處方藥,用於治療超氧化物歧化酶1(SOD1)基因發生突變或變化的肌萎縮側索硬化症(ALS)成年人。由於在接受QALSODY治療的患者中觀察到的血液中神經絲輕鏈(nFL)減少,QALSODY獲得了加速批准。https://www.qalsody.com/ 批准:2023年獲得批准:2022年美國食品藥品管理局根據一項針對137名成年肌萎縮性側索硬化症患者的單項臨牀試驗(研究 1)的安全性和有效性數據批准了RELYVRIO®。https://www.fda.gov/drugs/drug-批准-數據庫/藥物-試驗-快照-relyvrio 最近批准的療法 “Definite/probite/2024 年 3 月 8 日,“可能” 肌萎縮性側索硬化症患者 “肯定/可能” 的肌萎縮性側索硬化症患者:未滿足預先指定的主要或次要端點,n=664
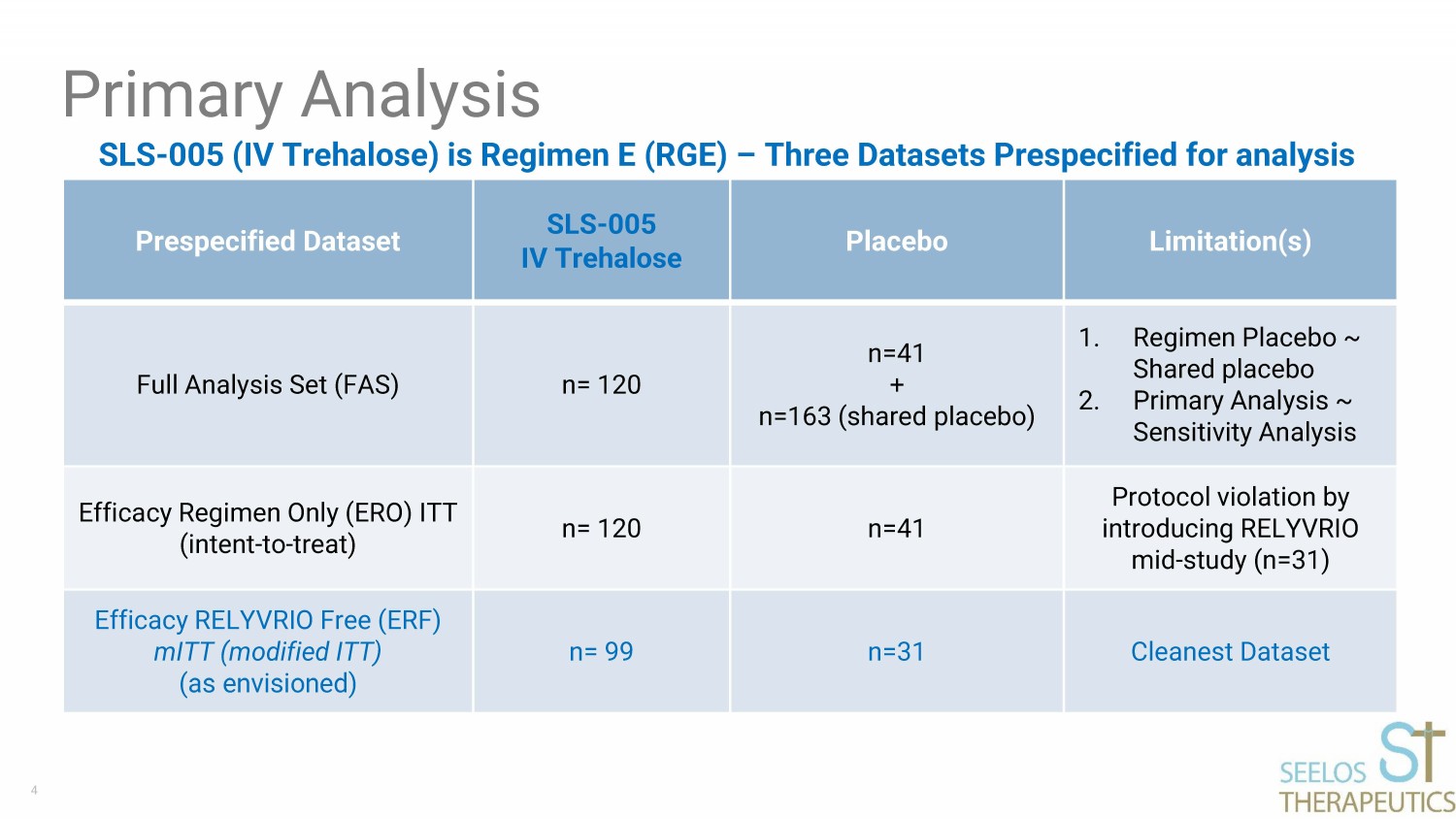
4 SLS-005(IV 海藻糖)是方案 E(RGE)— 三個預先指定的數據集用於分析的主要分析預設數據集 SLS-005 IV 海藻糖安慰劑限制完整分析集(FAS)n= 120 n=41 + n=163(共享安慰劑)1。養生安慰劑 ~ 共享安慰劑 2.初步分析 ~ 僅限靈敏度分析療效方案 (ERO) ITT(意圖——治療)n= 120 n=41 引入 RELYVRIO 中期研究(n=31)功效 RELYVRIO Free (ERF) MiTT(修改版 ITT)(如設想)n= 99 n=31 最乾淨的數據集

5 初級分析結果對方案 E (RGE) SLS-005 IV 海藻糖一致性:初級 ⇒ 靈敏度分析 22% 功能減緩和死亡率初級分析模型完整分析套裝 (FAS) SLS-005 IV 海藻糖(如設想)ERF 套裝 — 靈敏度分析合併安慰劑 n=204 RGE Active n=120 RGE 安慰劑 n=31 RGE Active n=31 RGE Active n=31 RGE Active n=31 RGE Active n=31 RGE Active n=31 RGE Active n=31 RGE Active n=31 RGE Ac99-6.42-4.80 = 1.62 ~ 6 個月 25% 單獨使用功能可獲益 13% 功能減緩和死亡率
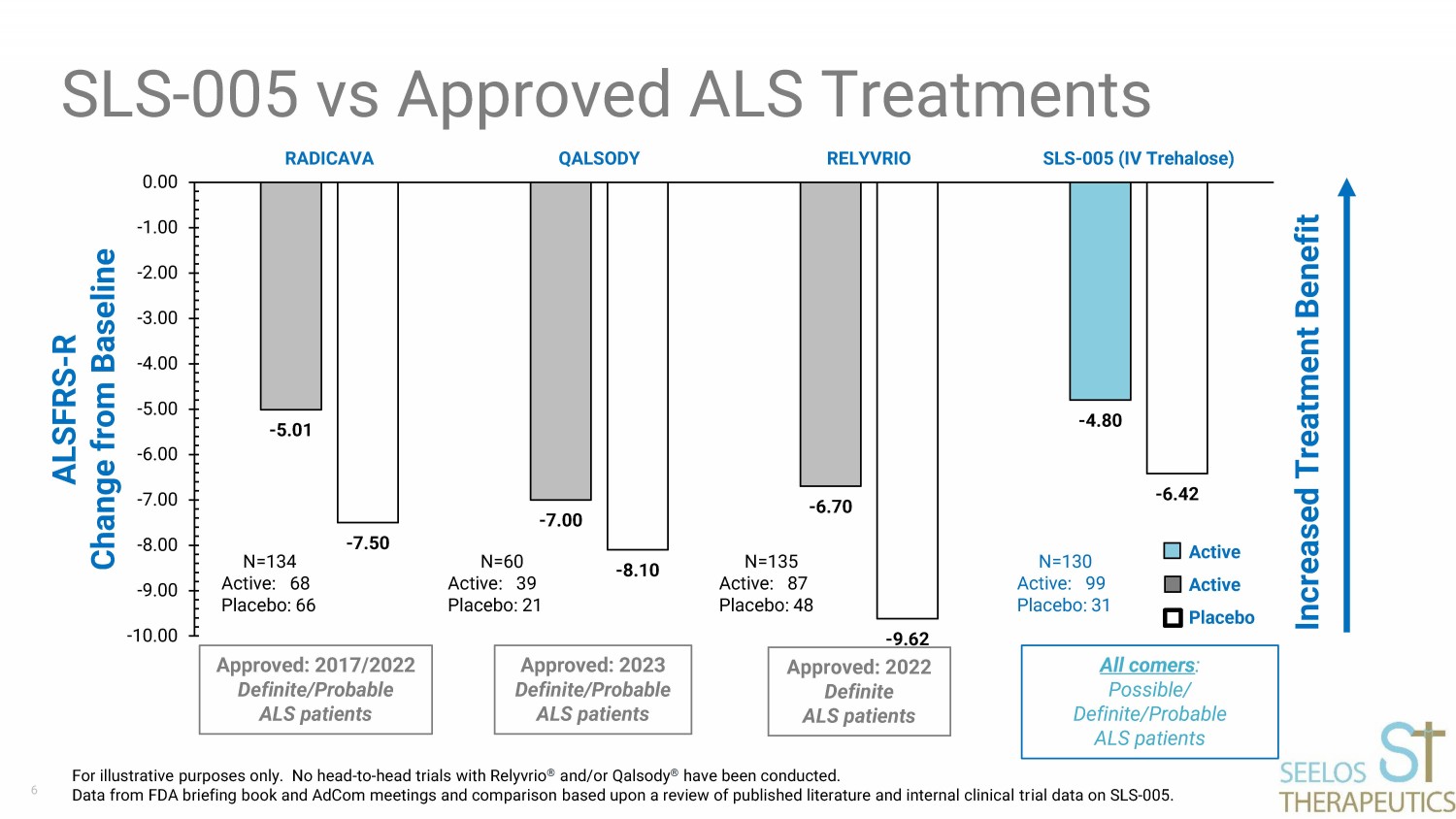
6-5.01-7.00-6.70-4.80-7.50-8.10-9.62-6.42 -10.00 -9.00 -8.00 -7.00 -5.00 -4.00 -3.00 -2.00 -1.00 0.00 0.00 RADICAVA QALSODY RELYVRIO SLS-005(IV 海藻糖)ALSFRS-R 與基線 SLS-005 與批准的 ALS 治療的變化僅用於説明目的。尚未使用Relyvrio® 和/或Qalsody® 進行過對頭試驗。來自美國食品藥品管理局簡報和AdCom會議的數據,並根據對SLS-005的已發表文獻和內部臨牀試驗數據的回顧進行了比較。獲批:2022年確定的肌萎縮性側索硬化症患者獲批:2023 確定/可能的肌萎縮性側索硬化症患者所有來者:可能/明確/可能的肌萎縮性側索硬化症患者 N=135 活性:87 安慰劑:48 N=60 活性:39 安慰劑:21 N=134 活性:31 N=134 活性安慰劑:68 安慰劑:68 活性安慰劑
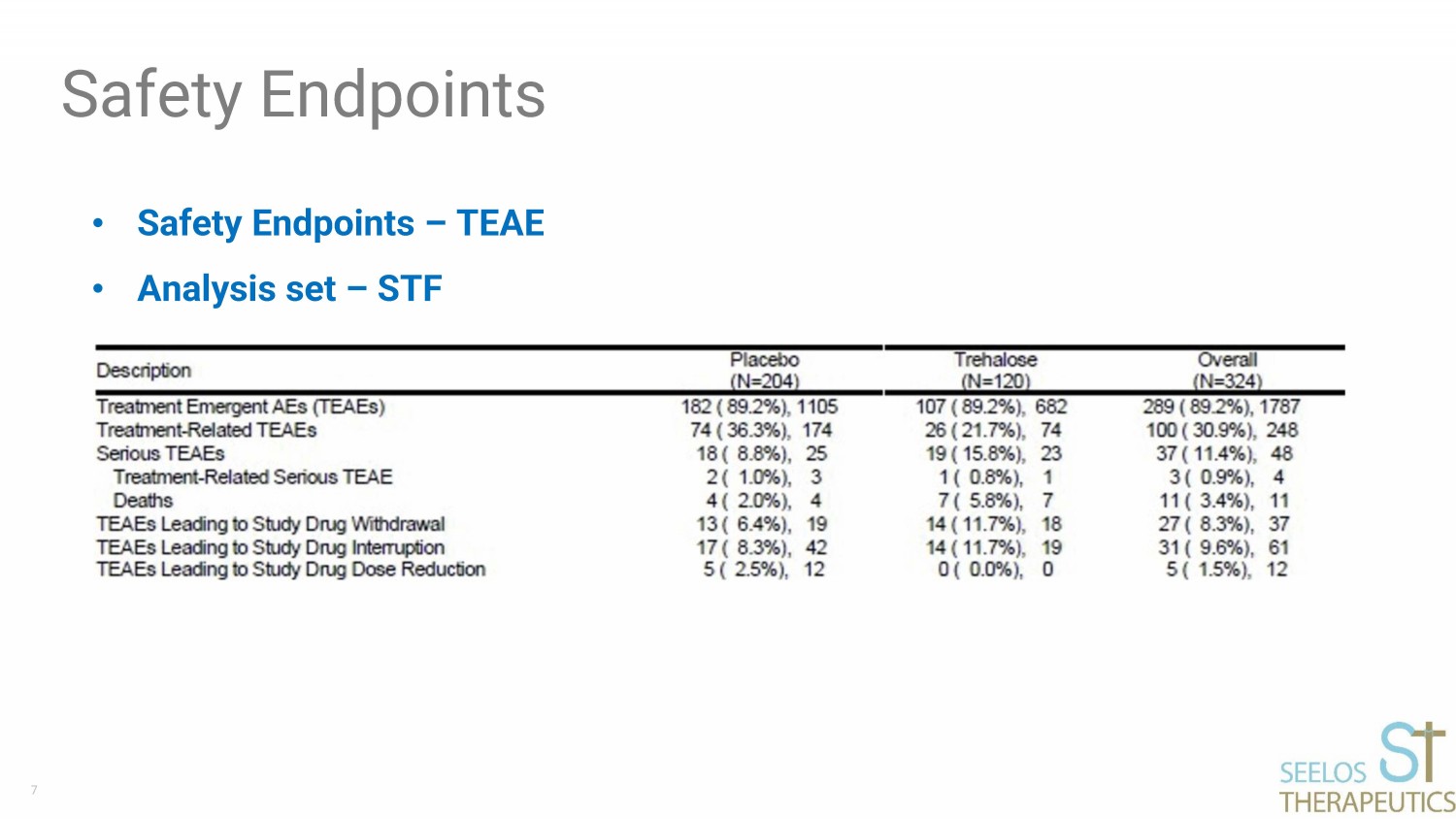
7 個安全終點 • 安全終點 — TEAE • 分析集 — STF
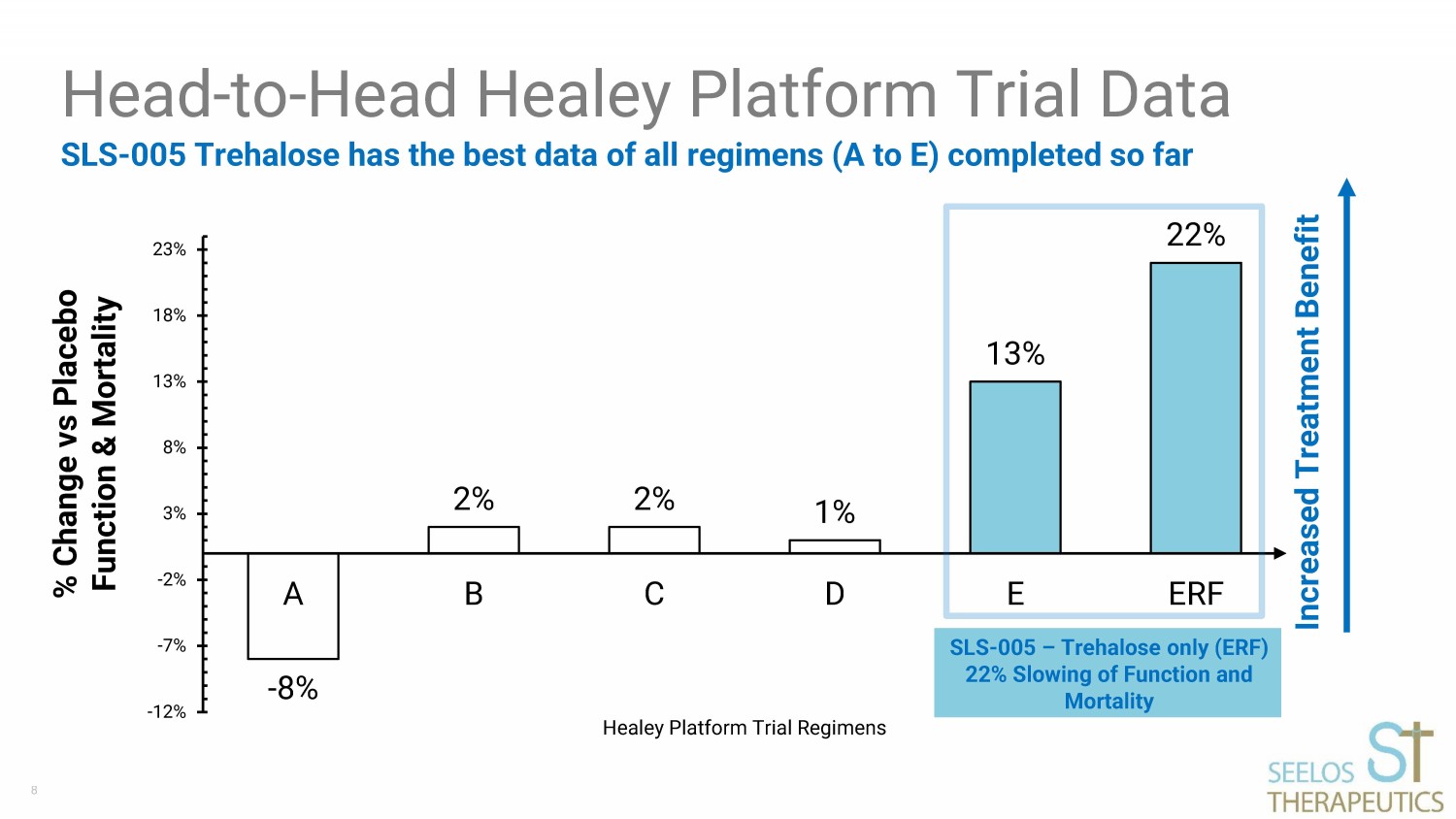
8-8% 2% 2% 1% 13% 22% -12% -7% -2% 3% 8% 13% 18% 23% A B C D E ERF Healey 平臺試驗方案 SLS-005 海藻糖擁有迄今為止完成的所有方案(從A到E)的最佳數據頭對頭Healey平臺試驗數據百分比變化與安慰劑功能和死亡率增加治療益處SLS-005 — 僅限海藻糖(ERF)) 功能和死亡率減慢 22%