
2024年3月18日提交給商業交易委員會
註冊編號333-
美國
證券交易委員會
華盛頓特區 20549
表格
註冊聲明
在……下面
1933年《證券法》
(註冊人的確切姓名在其章程中規定)
| 2834 | 不適用 | |
|
(述明或其他司法管轄權 公司或組織) |
(主要標準工業 分類代碼編號) |
(美國國税局僱主 識別號碼) |
電話:
(註冊人主要執行辦公室的地址,包括郵政編碼和電話號碼,包括區號)
普格利西律師事務所
電話:
(提供服務的代理商的名稱、地址,包括郵政編碼和電話號碼,包括區號)
發送至以下公司的通信副本:
傑森·S·麥卡弗裏
Mintz,Levin,Cohn,Ferris,Glovsky&Popeo,P.C.
One Financial Center
馬薩諸塞州波士頓02111
電話:(617)542-6000
傳真:(617)542-2241
建議開始向公眾銷售的大約日期:在本註冊聲明生效日期後在切實可行的範圍內儘快進行。
如果根據1933年《證券法》第415條的規定,在此 表格上登記的任何證券將以延遲或連續方式發售,請選中以下框。þ
如果根據證券法下的規則462(B)提交此表格是為了註冊發行的額外證券 ,請選中以下框並列出同一發行的較早生效的註冊聲明的證券法註冊聲明 編號。¨
如果此表格是根據證券法下的規則462(C)提交的生效後修訂 ,請選中以下框並列出同一發行的較早生效的註冊聲明的 證券法註冊聲明編號。¨
如果此表格是根據證券法下的規則462(D)提交的生效後修訂 ,請選中以下框並列出同一發行的較早生效的註冊聲明的 證券法註冊聲明編號。¨
用複選標記表示註冊人 是否是1933年證券法第405條所界定的新興成長型公司。
新興成長型公司
如果一家新興成長型公司根據美國公認會計原則編制其 財務報表,請用複選標記表示註冊人是否已選擇不使用延長的過渡期 以遵守證券法第7(A)(2)(B)節提供的任何新的或修訂的財務會計準則。 ¨
註冊人特此在必要的一個或多個日期修改本註冊聲明,以推遲其生效日期,直至註冊人提交進一步的修正案,明確聲明本註冊聲明此後將根據證券法第8(A)節生效,或直至 註冊聲明將於證監會根據第8(A)節決定的日期生效。
此初步招股説明書中的信息不完整,可能會更改。在提交給證券和交易委員會的註冊聲明生效之前,我們不能出售這些證券。本初步招股説明書不是出售這些證券的要約,我們也不是在任何不允許要約或出售的州或司法管轄區 徵求購買這些證券的要約。
初步招股説明書-主題 完成日期為2024年3月18日

1,283,541,200股普通股,相當於3,208,853股美國存托股份
___________________
本招股説明書涉及 本招股説明書中確定的出售股東不時轉售百得剋制藥有限公司或本公司的總計1,283,541,200股普通股(每股面值0.001英鎊)或普通股,代表為3,208,853股美國存托股份或存托股份,包括:(1)373,521,200股普通股,代表於2023年12月在私募交易中發行的933,803股存托股份 ,及(2)代表於2,275,050股存托股份的910,020,000股普通股,代表於該等私募發行的預出資認股權證獲行使時發行。
出售股東 在第148頁開始的表格中列出。每股存托股份代表400股普通股。本公司沒有 登記任何存托股份供我們出售。吾等將不會收取出售股東出售存托股份的任何所得款項。 出售本招股説明書涵蓋的存托股份所代表的普通股的所有淨收益將歸出售 股東所有。然而,如果持有人不以無現金方式行使 認股權證,吾等可能會從任何行使預先供資認股權證中收取最低額收益。參見“收益的使用”。
出售股東可 不時在市場交易中通過我們的存托股份當時交易的任何市場 、以協商交易或其他方式出售存托股份所代表的全部或部分普通股,價格和條款將由當時的市場價格決定,或直接或通過經紀商以協商價格決定,其可以作為代理人或委託人 或通過這些銷售方法的組合。 我們同意,根據我們與出售股東簽訂的登記權協議 , 承擔與登記這些股份有關的所有費用 。出售股東將支付與出售股份有關的任何承銷折扣和銷售佣金和/或類似費用 。參見“分配計劃”。
我們的存托股份 在納斯達克資本市場上市,代碼為"BDRX"。我們的存托股票在納斯達克資本市場的最後一次報告收盤價為2024年3月15日為1.17美元。
投資我們的證券 涉及風險。請參閲本招股説明書第8頁開始的“風險因素”,以瞭解您在決定購買這些證券之前應仔細考慮的因素。
美國證券交易委員會和任何州證券委員會都沒有批准或不批准這些證券,也沒有確定本招股説明書 是否真實或完整。任何相反的陳述都是刑事犯罪。
本招股章程日期為 2024年
目錄
| 頁面 | |
| 關於這份招股説明書 | 1 |
| 財務和其他資料的列報 | 2 |
| 招股説明書摘要 | 3 |
| 風險因素 | 8 |
| 有關前瞻性陳述的警示説明 | 48 |
| 收益的使用 | 50 |
| 股利政策 | 51 |
| 大寫 | 52 |
| 管理層的討論和分析以及運營結果 | 54 |
| 生意場 | 64 |
| 管理 | 94 |
| 某些關係和關聯方交易 | 103 |
| 主要股東 | 105 |
| 股本説明 | 107 |
| 美國存托股份説明 | 127 |
| 課税 | 141 |
| 出售股東 | 148 |
| 配送計劃 | 151 |
| 發售的費用 | 153 |
| 法律事務 | 153 |
| 專家 | 153 |
| 民事責任的強制執行 | 153 |
| 在那裏您可以找到更多信息 | 154 |
| i |
| 《目錄》 |
關於這份招股説明書
本招股説明書是我們向美國證券交易委員會或美國證券交易委員會提交的註冊聲明的一部分。在美國證券交易委員會規則和規則允許的情況下,我們提交的註冊説明書包括本招股説明書中未包含的其他信息。您可以在美國證券交易委員會的網站或辦公室閲讀 註冊聲明和我們向美國證券交易委員會提交的其他報告,如下文所述,標題為 “在哪裏可以找到更多信息”。
您應僅依賴本招股説明書中包含的 信息。我們沒有授權任何人向您提供與本招股説明書中包含的信息不同的信息。本招股説明書不是在任何不允許要約或出售的州出售這些證券的要約,也不是尋求購買這些證券的要約。本招股説明書中的信息僅適用於本招股説明書的日期,除非信息 明確指出另一個日期適用,無論本招股説明書的交付時間或本招股説明書提供的證券的任何出售時間 。自那以後,我們的業務、財務狀況、經營結果和前景可能發生了變化。我們不對本招股説明書中的信息以外的任何信息的可靠性承擔任何責任,也不對其可靠性提供任何保證。 本招股説明書的交付和存托股份的出售都不意味着本招股説明書中包含的信息在本招股説明書日期後是正確的 。您不應將本招股説明書視為與 任何司法管轄區的證券相關的要約或要約,而此類要約或要約與證券相關的要約或要約未經授權。此外,如果提出要約或要約的人沒有資格這樣做,或者如果您收到此類要約或要約是非法的,則您不應將本招股説明書視為與證券有關的要約或要約。
除非上下文另有説明,否則本招股説明書附錄中提及的“Biodexa PharmPharmticals PLC”、“Biodexa”、“The Company”、“We”、“Our”、“Our”、“Us”、“Group”或類似術語均指Biodexa PharmPharmticals PLC及其合併子公司。
對於美國以外的投資者:我們沒有采取任何行動 允許在美國境外公開發行存托股份,或允許在美國境外擁有或分發本招股説明書 。持有本招股説明書的美國境外人士必須告知自己 ,並遵守與發行存托股份和在美國境外分發本招股説明書有關的任何限制。
| 1 |
| 《目錄》 |
財務和其他資料的列報
我們的財務報表 是根據國際會計準則委員會發布的國際財務報告準則編制的。 我們對本招股説明書中的一些數字進行了四捨五入的調整。因此,在 某些表格中顯示為總計的數字可能不是其前面數字的算術聚合。
我們以英鎊編制我們的 合併財務報表。除另有説明外,本招股説明書中的所有金額均以英鎊為單位。
在本招股説明書中,除非另有説明 或文意另有所指外:
| · | “美元”和“美元”分別指美元(或其單位); 和 |
| · | “GB”、“Pence”和“p”分別指的是英鎊(或其單位)。 |
2023年3月27日,在股東 批准後,我們對我們的普通股,每股面值0.02 GB,或普通股進行了20股一股的反向拆分, 我們的普通股開始在AIM交易,AIM是倫敦證券交易所(AIM)在拆分調整的基礎上運營的市場。沒有發行與反向股票拆分相關的零碎股份。2023年3月24日,我們的股東批准取消AIM上我們普通股的認購,這一取消於2023年4月26日生效。
在反向拆分的同時,為了繼續滿足納斯達克股票市場有限責任公司或納斯達克根據規則5550(A)(4)規定的最低500,000股公開持有股份的要求,我們於2023年3月27日將我們的美國存托股份或存托股份代表的普通股數量進行了比率調整,從每股存托股份25股普通股改為每股存托股份5股普通股。
2023年6月14日,我們召開了年度股東大會或6月年度股東大會,我們的股東通過了決議和其他程序事項,批准配發和解除70億股普通股的優先購買權,或股東批准。2023年6月14日,我們還召開了股東大會,或6月GM,我們的股東通過決議,(X)(I)將我們遞延的 股票重新指定為A遞延股份,或重新指定,和(Ii)將我們每股面值為0.02 GB的普通股細分為1股面值為0.001 GB的普通股和19股面值為0.001 GB的B遞延普通股,每股拆分於2023年6月15日生效,(Y)通過新的公司章程,或公司章程。該等條款對本公司現有的組織章程細則作出相應修訂,以反映重新指定及分拆,以及若干 其他修訂,以反映普通股不再獲準在AIM買賣。作為遞延股份的標準,每股B 遞延股份的權利非常有限,實際上是沒有價值的。B遞延股份擁有組織章程細則所載權利及限制,其持有人無權收取本公司任何股東大會的通知,或出席本公司的任何股東大會並於大會上投票,亦無權收取股息或其他分派。
2023年7月5日,為了使我們的存托股票價格符合納斯達克的每股最低出價要求,我們將 我們的存托股份代表的普通股數量從每股存托股份5股更改為每股400股普通股 。沒有發行零星存托股份。
因反向股票拆分而導致的普通股數量的變化,以及因比率變化而導致的存托股份(和相關普通股)數量的變化,包括因不向持有人發行與存托股份比例變化相關的零碎存托股份而導致的任何變化,已在適用範圍內追溯到本招股説明書中提出的所有股份和每股金額。由於將因未向持有人發行零碎存托股份而產生的變動追溯應用於存托股份比率變動 ,因此在先前交易中發行的普通股金額可能不等於該等存托股份目前可行使的存托股份金額 。
市場和行業數據
本招股説明書中使用的市場數據以及某些行業數據和預測均來自我們認為可靠的來源,包括市場研究數據庫、公開的信息、政府機構的報告以及行業出版物和調查。我們依賴來自第三方的特定數據,包括內部調查、行業預測和市場研究,根據我們管理層對行業的 知識,我們認為這些數據是可靠的。雖然我們不知道與本招股説明書中的行業數據有關的任何錯誤陳述,但我們的估計 涉及風險和不確定因素,可能會根據各種因素而發生變化,包括標題下討論的那些因素。風險因素 “以及在本招股説明書的其他地方。
僅為方便起見, 本招股説明書中的商標和商品名稱可能不帶®和™符號,但此類引用不應被解釋為其各自所有者不會根據適用法律在最大程度上主張其權利的任何指示。本招股説明書中的商標、商號和服務標誌均為其各自所有者的財產。
| 2 |
| 《目錄》 |
招股説明書摘要
本摘要重點介紹了本招股説明書中其他部分詳細介紹的精選信息 。此摘要不包含可能對您很重要的所有信息 。在作出投資決定之前,您應仔細閲讀整個招股説明書,包括“風險因素”和“管理層對財務狀況和經營結果的討論和分析”部分,以及我們的合併財務報表和本招股説明書中其他地方包含的相關説明。
我們的業務
我們 是一家臨牀階段生物製藥公司,開發一系列創新產品,用於治療未滿足醫療需求的疾病 ,包括1型糖尿病或T1D以及罕見/孤兒腦癌。我們的主要資產託立酮正在開發用於T1D, 正在研究MTX 110在侵襲性罕見/孤兒腦癌適應症中的應用,包括複發性膠質母細胞瘤、瀰漫性中線膠質瘤或 DMG和髓母細胞瘤。
託咪酮是一種選擇性的 激活劑,可增加胰島素底物—1的磷酸化,從而放大胰島素與其受體結合引發的信號級聯 。Lyn激酶調節關鍵的細胞內功能,如增殖、分化、凋亡、遷移和代謝。在脂肪細胞中,lyn激酶增加了胰島素的利用,從而降低血糖而不影響胰島素的產生 。在胰島中,lyn激酶的激活促進β細胞的存活和增殖,而其抑制 導致細胞死亡,阻止增殖並誘發糖尿病。
MTX 110 正在研究侵襲性罕見/孤兒腦癌適應症,包括複發性膠質母細胞瘤、DMG和髓母細胞瘤, 是組蛋白脱乙酰酶或HDAC抑制劑帕比司他的液體制劑。我們的專利製劑能夠通過對流增強遞送(CED)將產品以潛在化療劑量直接遞送至腫瘤部位,繞過 血腦屏障並避免全身毒性。
我們的 臨牀資產由三種專有藥物輸送技術支持,這些技術專注於通過持續輸送(Q—Sphera)改善 藥物的生物輸送和生物分佈TM),直接交付(MidaSolveTM),或定向交付(MidaCoreTM):
| · | 我們的Q—Sphera平臺:我們的破壞性聚合物微球微技術 用於持續給藥,以延長和控制治療藥物在較長的時間內(從數週到數月)的釋放。 |
| · | 我們的MidaSolve平臺:我們創新的低聚糖納米技術 用於溶解藥物,使其能夠以液體形式直接和局部進入腫瘤。 |
| · | MidaCore平臺:我們的納米金技術 通過使用化療劑或免疫劑來靶向疾病部位。 |
最新財經動態
截至2023年9月30日,我們擁有382萬英鎊的現金和現金等價物。截至2023年9月30日止三個月和九個月,我們在經營中使用的現金淨額分別為137萬英鎊和525萬英鎊。截至2023年9月30日,我們的借款總額為504,000英鎊。
本招股説明書中截至2023年9月30日的財務信息 未經審計,由我們的管理層編制,並由我們的管理層負責。此數據可能會因進一步 審查而更改。此外,我們的獨立註冊會計師事務所尚未審計、審閲、編制或執行任何程序 此未經審計財務信息,且不就此發表意見或任何其他形式的保證。 因此,您不應過分依賴此信息。為了更完整地瞭解我們截至2023年9月30日的財務狀況、流動性和經營成果,將需要更多信息和披露。完整的年度業績 將包含在截至2023年12月31日止年度的表格20—F年度報告中。
最新發展動態
收購Tolimidone
2023年11月22日,我們與Adhera Therapeutics,Inc.簽訂了 轉讓和交換協議,或轉讓和交換協議,特拉華州公司或 Adhera,以及Adhera發行的擔保貸款票據或Adhera擔保票據的某些持有人或擔保票據持有人,據此,Adhera同意將其對化合物託立酮的所有權利轉讓給公司,該公司是一種酶lyn 激酶的選擇性激活劑,可增加胰島素底物—1的磷酸化,從而放大由胰島素 與其受體結合引發的信號級聯。Adhera此前與Melior製藥公司簽訂了獨家許可協議,特拉華州公司 或Melior,用於在除中國、韓國和Melior許可給Bukwang Pharmaceutical Co. Ltd.以外的大多數地區開發和商業化託立酮,總部設在韓國,或者説Bukwang。
| 3 |
| 《目錄》 |
此外,2023年11月22日,我們與Melior簽訂了一份關於託立酮化合物的許可協議,或《許可協議》。根據許可協議, 交易結束時,公司將從Melior獲得獨家的、全球性的、可再許可的權利,開發、製造、 商業化或以其他方式利用含託立酮的產品用於任何領域。2023年11月22日,Melior和Bukwang就許可協議(日期為2013年11月20日)或Bukwang許可協議簽署了修訂案。根據 該修正案,Melior和Bukwang同意,在公司 2024年9月30日前獲得至少400萬美元的新股權融資後,Bukwang許可證將全部終止,Bukwang將向Melior轉讓 某些研究性新藥申請、專有技術和數據以及與託立酮相關的專利的所有權利、所有權和利益。
於2023年12月21日,我們完成了轉讓及交換協議和許可協議中的每一項所擬交易的 ,或該等交易的成交。由於 關閉,(i) Adhera同意轉讓其所有權利的化合物tolimidone, 給我們和(ii)我們收購從Melior, 在任何領域開發、製造、商業化或以其他方式利用含妥立酮產品的獨家、全球性、可轉許可的權利。作為代價,(i)我們根據轉讓 及交換協議向Adhera支付預付款640,000美元,並向若干有抵押票據持有人發行(x)合共224,947股存托股份, 已清償Adhera有抵押票據,及(y)合共2,275,050份預融資認股權證,或2023年12月私募 預融資認股權證,向若干有擔保票據持有人購買存托股份,及(ii)向Melior發行其存托股份354,428 。在許可協議項下的若干義務得到履行後,我們預計將向Bukwang發行354,428股存托股份 。
此外,在交割時, 我們與各有擔保票據持有人和Melior訂立了登記權協議和禁售協議,我們預計 與Bukwang訂立同樣的協議。
此外, 根據每項禁售協議,就根據轉讓及交換協議及 許可協議收到的存托股份而言,持有人同意在(i)本表格F—1的註冊 聲明宣佈生效後90天或轉售生效日期後,及(ii)收市後180天(以較早者為準)之前,不轉售其存托股份。在轉售生效日期後的90天內 ,有擔保票據持有人作為一個團體,以及Melior和Bukwang各自,可分別出售總計 我們在納斯達克資本市場交易的存托股份每日交易量的30%和5.5%,除非存託公司 股價等於或超過3.00美元,在這種情況下,持有人可以出售無限的存托股份,只要市場價格保持 在每股存托股份3.00美元或以上。
甲苯咪唑酮發展
2023年2月7日,我們宣佈 美國專利和商標局已允許美國專利申請No. 16/546,595,標題為“預防胰腺細胞變性” ,該申請由Melior獨家授權給我們,與關閉有關的其他專利。
2023年2月23日,我們宣佈, 代表我們,CRO進行了一項 體外培養 實驗設計用於證明託立酮對β細胞 增殖的潛力,使用重新聚集的胰島。實驗的結果是不確定的,因為它們與 之前在 體外培養和體內 託立酮的研究。我們認為有許多 可能的解釋, 體外培養 研究,並據此,我們計劃着手進行一項 在活體中 具有類似目的的臨牀前研究,同時繼續準備我們計劃在T1D患者中進行的託立酮IIa期開放標籤研究 ,該研究將於2024年晚些時候開始招募。
完成承銷公開發售
於2023年12月21日,我們完成 承銷公開發售或12月公開發售的結束,據此,我們發行並出售(i)1,088,887個A類單位, 或A類單位,公開發售價為每股A類單位2.00美元,每個A類單位包括(a)一股存托股份, (b)一份E系列認股權證,以每股2.20美元的行使價購買一股存托股份,該認股權證將於初始行使日期的五年 週年屆滿,或一份E系列認股權證,以及(c)一份F系列認股權證,以每股2.20美元的行使價購買一股存托股份,或F系列認股權證,及(ii)1,911,176個B類基金單位或B類基金單位,公開發售價為每B類基金單位1.9999美元,每個B類基金單位包括(a)一份預存資金認股權證,或12月公開發售預集資認股權證,連同 2023年12月私募預集資認股權證,(b)一份E系列認股權證,及(c)一份F系列認股權證,其中包括全面行使 超額配售選擇權。本公司所得款項總額約為6,000,000元。
| 4 |
| 《目錄》 |
在12月 公開發行的結束之際,我們向Ladenburg Thalmann & Co.發行,Inc(12月公開發售的承銷商)或承銷商, 購買120,003股我們的存托股份或承銷商認股權證,相當於12月公開發售結束時售出的存托股份總數 (包括12月公開發售中發行的任何預撥資金認股權證相關的存托股份)的4.0%。 承銷商認股權證可按每股行使價 2.50美元行使.承銷商認股權證可於發行後立即隨時及不時全部或部分行使, 自十二月公開發售開始銷售起計的三年期間內行使,其他條款與作為十二月公開發售一部分向投資者發行的E系列認股權證及F系列認股權證大致類似。
此外,根據本公司與承銷商於2021年12月19日簽訂的 承銷協議的條款,我們同意對(其中包括)後續股權出售進行 ,該等出售將持續至2023年12月21日起90日。本公司還同意 在2023年12月21日之後的180天內, 不發行任何價格根據本公司普通股的交易價格或 未來特定或或有事件進行價格重置的證券,或簽署任何協議以未來確定的價格發行證券,但某些例外情況除外。
MTX110開發
2023年1月12日,我們宣佈, 在我們的首例患者完成了為期一個月的MTX 110治療後,我們在複發性膠質母細胞瘤中進行的MTX 110 I期研究(也稱為MAGIC—G1研究)將在研究DSMB的積極建議下繼續進行計劃的劑量遞增。 MAGIC—G1是一項開放標籤、劑量遞增研究,旨在評估CED通過植入的可再灌注泵和導管間歇輸注MTX 110的可行性和安全性。本研究旨在招募兩個隊列(隊列A和隊列B),每個隊列至少 4名患者;第一個隊列在CED系統植入後接受MTX 110,第二個隊列也將接受MTX 110,但治療研究者可選擇在疾病進展時將導管重新放置到新病變區域,目的是 增加腫瘤覆蓋率和生存率。
隊列A中的第一名患者通過直接至腫瘤給藥給予 60 uM MTX 110,並在19周內接受了13次48小時輸注。在此期間,未觀察到患者發生治療相關不良事件。在成功完成第一個月的治療後,DSMB審查了 可用數據,並建議在研究中將劑量遞增至90 uM,我們認為這是最佳劑量。迄今為止, 沒有劑量限制性毒性。
2023年10月3日,我們宣佈完成 隊列A的招募,最少4名患者。隊列B的入組於2023年10月獲得DMSB批准。 我們預計中期無進展生存期結果將於2024年第二季度公佈。
2023年7月10日,我們宣佈 在哥倫比亞 大學歐文醫學中心正在進行的MTX 110 I期研究或'203研究中,完成了9名DMG兒科患者的入組和治療。所有4至17歲的患者均按照醫療機構的標準接受放射治療。每例患者隨後接受了植入 瘤內導管和可編程皮下泵的手術,9例患者中有8例接受了兩次通過CED輸注MTX 110,間隔時間為1周。遞送濃度為30、60或90 µ M,未增加患者內劑量。迄今為止,尚未報告 與研究藥物相關的劑量限制性毒性。該隊列的中位總生存率為26.1個月。我們預計全面業績將於2024年第一季度公佈。
2023年2月7日,我們宣佈了關於複發性GBM的I期研究的更新 。由於在治療開始後的前30天內未觀察到藥物相關不良事件, 隊列A招募了至少4名患者。患者1每週輸注60 µ M MTX 110,自治療開始後存活 12個月(OS = 12)。患者2、3和4分別接受每週90 µ M MTX 110輸注,這是預期的 最佳劑量。留在書房裏GBM普遍復發,根據《神經腫瘤學雜誌》報道的299例患者的回顧性分析 ,一旦復發,中位總生存期為6.5個月。目前,沒有為複發性GBM制定治療標準。
2023年2月23日,我們宣佈了'203研究的頂部 結果。9名患者在研究中接受了治療(30 mM組,n = 3; 60 mM組,n = 4;90 mM組(最佳劑量),n = 2)。 60歲的病人中有一名 mM組發生嚴重不良事件,經研究者 評估為與研究藥物無關,但與輸注和腫瘤解剖結構有關。中位無進展生存期為診斷後10個月 (PFS = 12),中位總生存期為16. 5個月(OS = 16. 5)。
| 5 |
| 《目錄》 |
我們的公司信息
我們的主要行政 辦公室位於1裏海角,裏海路,加的夫,CF10 4DQ,United Kingdom。我們首席執行官辦公室的電話號碼是+44 29 20480 180。我們的公司網站位於www.biodexahpharma.com。我們網站上包含的信息不屬於本招股説明書 的一部分,也不包含在本招股説明書中。我們在美國的授權代表是Puglisi and Associates的Donald J. Puglisi。 我們在美國的服務代理商是Donald J. Puglisi,Puglisi and Associates,地址:850 Library Avenue,Suite 204,Newark,Delaware 19711。我們的存托股份在納斯達克資本市場以“BDRX”交易
成為外國私人發行人的影響
我們在英格蘭和威爾士註冊為上市有限公司 ,根據修訂後的《1934年證券交易法》或《交易法》的報告規則,我們是否被視為“外國私人發行人”。作為外國私人發行人,我們不受《交易法》規定的某些規則的約束,如果我們是在美國註冊成立的公司,這些規則將適用於這些規則,包括:
| · | 要求向美國證券交易委員會提交定期報告和財務報表的頻率和速度與根據《交易法》註冊證券的美國公司一樣頻繁或迅速。 |
| · | 要求按照美國公認的會計原則或美國公認會計原則提交財務報表。 |
| · | 委託書規則,對委託書徵集規定了某些披露和程序要求; 和 |
| · | 遵守FD法規的要求,該法規對選擇性披露重大信息施加了某些限制。 |
此外,我們的高級管理人員、董事和主要股東在購買和出售我們的普通股時,不受《交易所法》第16節的報告和“短期”利潤回收條款以及《交易所法》的規則的約束。因此,投資者收到的有關我們的信息可能會少於在美國註冊的上市公司。
| 6 |
| 《目錄》 |
| 供品 | ||
| 出售股東發行的存托股份 | 本公司合共1,283,541,200股普通股,即3,208,853股存托股份,包括(1)373,521,200股普通股,即於收市時發行的933,803股存托股份,及(2)910,020,000股普通股,即2,275,050股存托股份,可於2023年12月行使於收市時發行的私募預籌資權證時發行。出售股東在第148頁開始的表格中列出。 | |
| 緊接本次發行前已發行的普通股總數 | 普通股1,699,804,122股(包括以存托股份為代表的普通股) | |
| 緊接本次發行後將發行的普通股總數 | 2,609,824,122股普通股(包括以存托股份為代表的普通股),假設所有認股權證已全部行使。 | |
| 存托股份 |
每股存托股份相當於400股普通股。
託管人(通過其託管人)將持有您的存托股份所涉及的普通股。您將享有本公司、摩根大通銀行、北卡羅來納州銀行作為存託機構,以及根據存託協議不時發行的存托股份的所有所有者和持有人之間的存託協議所規定的權利。除其他事項外,您可註銷您的存托股份,並提取相關普通股,並向存託人支付費用(該費用可能由本公司報銷)。在存款協議中描述的某些有限情況下,我們可以修改或終止存款協議而無需 您的同意。如果您繼續持有您的存托股份,您同意受當時有效的存款協議條款的約束。
為更好地瞭解存托股份和存款協議的條款,包括適用的費用和收費,您應仔細閲讀本招股説明書中的“美國存托股份説明” 。你還應該閲讀存款協議,這是包括本招股説明書在內的註冊聲明的證物。 | |
| 託管人 | 摩根大通銀行,N.A. | |
| 收益的使用 | 吾等將不會收取出售股東出售以存托股份為代表的普通股的任何所得款項。出售本招股章程所涵蓋之存托股份所代表之普通股所得款項淨額將予出售股東。然而,倘持有人不以無現金基準行使認股權證,吾等可能收取行使二零二三年十二月私募預集資認股權證的所得款項。請參閲本招股章程標題為“所得款項用途”的章節。 | |
| 風險因素 | 你應該讀一下《風險因素"由本招股章程第8頁開始的一節,討論決定投資於我們的證券前應考慮的因素。 | |
| 股利政策 | 我們從未向股東宣派或派付任何現金股息,且我們目前預期於可見將來不會宣派或派付任何現金股息。參見“股息政策”。 | |
| 上市 | 我們的存托股份在納斯達克資本市場上市,代碼為“BDRX”。 | |
| 7 |
| 《目錄》 |
風險因素
我們的業務存在重大風險。除 本年度報告中包含的其他信息外,包括年度報告 標題為“前瞻性報表的警示性説明”一節以及我們的財務報表和相關附註中所述事項,您 應仔細考慮以下風險。下文所述的風險和不確定性並非我們可能面臨的唯一風險和不確定性 。我們目前未知或我們目前認為不重要的其他風險和不確定性也可能對我們的業務、財務狀況、經營業績、前景、利潤和股價產生負面影響。如果下列風險 實際發生,我們的業務、財務狀況、經營業績、前景、利潤和股價都可能受到重大不利影響 。
風險因素摘要
本節標題為"風險因素"單獨或 與其他事件或情況結合,可能會對我們的業務、財務狀況和經營業績造成重大不利影響。 在這種情況下,我們證券的交易價格可能會下跌,您可能會損失全部或部分投資。此類風險包括, 但不限於:
| • | 自成立以來,我們已經發生了重大損失,預計未來我們將繼續發生 損失; |
| • | 我們對短期內額外融資的要求代表了一種重大的不確定性,這使 對我們繼續作為一家持續經營企業的能力產生了巨大的懷疑。 |
| • | 如果我們要求或尋求籌集額外資金以資助我們的運營,但我們未能獲得必要的 融資,我們可能無法完成候選產品的開發。 |
| • | 我們的運營處於早期開發階段,沒有經常性收入來源, 無法保證我們將成功開發和許可我們的候選產品或實現盈利。 |
| • | 我們面臨與英國退出歐盟有關的政治、監管、社會和經濟風險。 |
| • | 我們過去曾進行過,將來也可能進行戰略性收購。未能整合 收購可能會對我們的價值產生不利影響。 |
| • | 我們未來的成功取決於產品開發以及能否成功地將候選產品 授權給合作伙伴,這些合作伙伴可以尋求監管部門的批准和候選產品的商業化。 |
| • | 我們的發展努力處於早期階段。我們的所有候選產品都處於臨牀開發 或臨牀前開發階段。如果我們無法通過臨牀開發推進候選產品、獲得監管部門 批准並最終將候選產品商業化,或者在這樣做過程中遇到重大延誤,我們的業務將受到嚴重損害 。 |
| • | 臨牀前研究和早期臨牀試驗的結果並不總是預測未來的結果。 我們在臨牀試驗中推進的任何候選產品可能無法在以後的臨牀試驗中取得有利結果(如有),也無法獲得 上市批准。 |
| • | 美國和歐洲的監管審批流程漫長、耗時且固有 不可預測,如果我們最終無法獲得候選產品的監管審批,我們的業務可能會受到嚴重 損害。 |
| • | 我們尋求與潛在的許可合作伙伴和合作者建立協議,如果我們無法 以商業上合理的條款建立協議,我們可能不得不改變我們的開發和商業化計劃。 |
| · | 於2020年,我們與MTX 110產品中的活性藥物成分帕比司他有關的許可協議被Secura Bio,Inc.終止。因此,我們認為相關Secura Bio,Inc.專利可能會延遲MTX110的上市 ,這可能會對我們的業務、財務狀況和經營業績產生重大不利影響。 |
| 8 |
| 《目錄》 |
| • | 如果我們與許可或協作合作伙伴就我們的候選產品的開發和商業化達成協議 ,我們在這些候選產品方面的前景將在很大程度上取決於這些 合作的成功。 |
| • | 我們的任何候選產品都不能保證在商業上取得成功。 |
| • | 製藥和生物技術行業競爭激烈。 |
| • | 醫療保健政策、法律和法規的變化,包括旨在降低醫療保健成本的立法措施,可能會影響 我們獲得批准或商業化我們未來候選產品的能力(如果獲得批准)。 |
| • | 我們的 當前或未來的候選產品可能無法獲得覆蓋範圍和足夠的報銷,這可能會使我們難以在獲得批准的情況下實現盈利銷售。 |
| • | 我們的業務可能會受到經濟狀況及當前經濟疲弱的不利影響。 |
| • | 我們的業務可能會受到政治事件、戰爭、恐怖主義、業務中斷和其他地緣政治 事件和我們無法控制的不確定性的影響。 |
| • | 我們將來可能無法留住和招聘合格的科學家、關鍵管理人員、關鍵員工或關鍵顧問,可能會延誤 我們的開發工作或以其他方式損害我們的業務。 |
| • | 公共衞生危機,如COVID—19大流行,已經並可能在未來對我們的業務產生負面影響。 |
| • | 我們的成功在一定程度上取決於我們保護知識產權的能力,這是 無法保證的。 |
| • | 我們依賴第三方進行臨牀前和臨牀試驗。如果這些第三方未能 成功履行其合同職責或在預期期限內完成,我們可能無法獲得監管部門的批准或將候選產品商業化 ,我們的業務可能會受到嚴重損害。 |
| • | 我們依賴第三方來生產我們的候選產品,並且我們希望繼續依賴第三方 為我們的候選產品和其他未來候選產品的臨牀以及任何未來的商業供應提供。如果任何此類第三方未能向我們提供足夠的臨牀或商業數量的此類候選產品或 產品,未能以可接受的質量水平或價格提供,或未能達到或維持令人滿意的法規合規性,則我們當前和未來候選產品的開發以及任何獲批產品的商業化可能會停止、延遲或降低利潤 。 |
| • | 我們依賴第三方供應商,如果我們遇到與這些第三方中的任何一個出現問題, 我們候選產品的製造可能會被推遲,這可能會損害我們的運營結果。 |
| • | 如果我們不能滿足納斯達克的繼續上市要求,納斯達克可能會將我們的存托股份摘牌, 這可能會對我們存托股份的流動性和市價造成不利影響。 |
| • | 我們的存托股份價格可能波動。 |
| • | 我們的存托股份的流動性可能對股價造成不利影響。 |
| • | 股東在本公司的所有權權益可能因(其中包括)未來 融資和/或額外收購而被稀釋,並可能對我們證券的市價產生重大負面影響。 |
| • | 我們的披露控制和程序可能無法阻止或檢測所有錯誤或欺詐行為。 |
| • | 作為外國私人發行人,我們無需遵守適用於在美國註冊成立的公司的納斯達克公司治理標準 。 |
| • | 您參與未來任何配股發行的權利可能會受到限制,這可能會導致您所持股份的稀釋。 |
| • | 《英國城市收購與合併法典》條款中的保護措施可能會延遲 或阻止收購嘗試,包括可能有利於我們普通股和存托股持有人的嘗試。 |
| 9 |
| 《目錄》 |
與我們的財務運營和資本需求相關的風險
自成立以來,我們已蒙受重大損失 ,預計未來我們將繼續蒙受損失。
我們是一家處於早期階段的生物製藥公司。生物製藥產品開發的投資具有高度的投機性,因為我們需要大量的前期資本支出 ,並且存在候選產品在開發過程中失敗、無法獲得監管部門批准或無法 商業可行性的重大風險。我們繼續產生與我們的持續經營有關的重大發展和其他開支。因此,我們 沒有盈利,自成立以來已經發生了巨大的損失。截至2023年6月30日止六個月,我們淨虧損為357萬英鎊,累計虧損為1.3897億英鎊。截至2022年、2021年和2020年12月31日止年度,我們分別淨虧損766萬英鎊、546萬英鎊和2219萬英鎊。
我們預計在可預見的未來 將繼續遭受損失,並且預計這些損失不會減少,因為我們將繼續開發我們的候選產品,並與任何許可合作伙伴合作 一起尋求監管部門的批准。
我們可能會遇到不可預見的費用、困難、 併發症、延誤和其他可能對我們業務產生不利影響的未知因素。我們未來淨虧損的規模將部分取決於我們未來支出的增長率和我們創造收入的能力。如果我們未能找到許可合作伙伴,如果 我們放棄了任何開發項目,或者如果我們的任何許可候選產品在臨牀試驗中失敗或沒有獲得監管部門的批准, 或者如果獲得批准,無法獲得市場認可,我們可能永遠無法盈利。即使我們在未來實現了盈利, 我們也可能無法在隨後的時期保持盈利。我們以前的虧損和預期的未來虧損已經並將繼續 對我們的股東權益和營運資金產生不利影響。
我們對短期內額外融資的要求 代表了重大的不確定性,對我們作為一家持續經營企業的能力產生了重大的懷疑。
在過去幾年裏,隨着我們開發投資組合,我們經歷了淨虧損和經營活動中使用的現金大量 現金流出。
我們未來的生存能力取決於我們 從融資活動中籌集現金以資助我們的開發計劃直至商業化的能力,從運營活動中獲得現金的能力,以及成功獲得監管批准以允許我們的開發產品營銷的能力。我們未能在需要時籌集資金 可能會對我們的財務狀況和執行業務戰略的能力產生負面影響。
我們的綜合財務報表是在持續經營的基礎上編制的,該報表考慮了正常業務過程中的資產變現和負債清償情況。截至2022年12月31日和2023年6月30日,我們分別擁有284萬GB和523萬GB的現金和現金等價物。
我們已經準備了現金流預測,並考慮了未來三年的現金流需求,包括自財務報表批准之日起12個月的期間 。繼2023年12月的一次承銷公開發行,籌集了600萬美元的毛收入後,我們更新了預測。 更新的預測顯示,2024年第四季度之前將需要進一步融資。如果在此之前未能獲得額外資金 ,可能會導致公司進入破產管理程序。
我們認為,小微市值生物技術公司的融資環境仍然具有挑戰性。雖然這可能會帶來與其他融資渠道有限或沒有融資渠道的 公司的收購和/或合併機會,但任何隨之而來的融資都可能是稀釋的。我們和我們的顧問繼續 評估可能提供給我們的融資選擇,包括與收購和/或合併相關的選擇,包括籌資 以及公司資產和技術的合作。不能保證為 公司融資的任何行動方案都會成功。短期內需要額外融資的這一要求代表着一種重大的不確定性,可能會讓人懷疑我們作為一家持續經營的企業是否有能力繼續下去。如果未來在我們的現金資源耗盡之前,公司沒有可採取行動的現實融資選擇 ,那麼我們將不再是一個持續經營的公司。在這種情況下,我們將不再能夠根據《國際會計準則1》第25段編制財務報表。相反,財務報表將在清算的基礎上編制,資產評估將按可變現淨值列報,所有負債將加速為流動負債。
我們相信有足夠的選擇及 時間為本公司爭取額外融資,並在考慮到不明朗因素後,我們認為在編制財務資料時繼續採用持續經營基準是恰當的。
| 10 |
| 《目錄》 |
我們作為一家持續經營企業繼續經營的能力 取決於我們獲得額外資本和/或處置資產的能力,因此不能保證我們 能夠及時、以優惠條款或根本不能做到這一點。
我們的業務處於早期開發階段,沒有任何經常性收入來源,也不能保證我們將成功開發和許可我們的候選產品或實現盈利。
我們正處於商業開發的相對早期階段。到目前為止,我們從候選產品中獲得的收入微乎其微。我們能否創造收入、實現盈利並保持盈利,在一定程度上取決於我們能否成功地為我們的候選產品、 或我們可能授權或收購的其他候選產品找到許可合作伙伴,並將這些候選產品成功商業化。我們目前的戰略是,在我們的候選產品概念驗證確定後,通過合作伙伴創造收入,從而獲得版税和/或 里程碑收入;然而,這在可預見的將來是不可能實現的,也不能保證我們能夠為我們的候選產品找到許可合作伙伴。即使我們的候選產品成功獲得監管部門的批准, 我們也不知道候選產品何時會產生收入(如果有的話)。我們從候選產品中獲得收入的能力 還取決於許多其他因素,包括我們的能力以及任何許可合作伙伴的能力,以:
| • | 圓滿完成開發活動; |
| • | 完成新藥申請並提交給歐洲藥品管理局或EMA、英國的藥品和保健產品監管機構、或MHRA、FDA和任何其他外國監管機構,並 獲得有商業市場的產品的監管批准; |
| • | 設定一個在商業上可行的價格; |
| • | 以可接受的成本水平獲得產品的商業質量; |
| • | 發展和維持一個能夠在產品銷售市場銷售、營銷和分銷的商業組織 ;以及 |
| • | 從第三方獲得足夠的補償,包括政府、部門和醫療保健支付者。 |
此外,由於與產品開發相關的眾多風險和不確定性,包括我們的候選產品可能無法在開發過程中取得進展或達到適用臨牀試驗的終點,我們無法預測增加費用的時間或金額,或者我們 何時或是否能夠實現或保持盈利。即使我們能夠完成上述流程,我們預計也會產生巨大的 成本。
即使我們能夠從銷售候選產品中獲得版税 和/或里程碑收入,我們也可能無法盈利,可能需要獲得額外資金 才能繼續運營。如果我們未能實現盈利或無法持續保持盈利能力,那麼我們可能無法 繼續按照計劃水平進行運營,並可能被迫停止或減少運營。
我們無法保證我們的運營將盈利,產生合理的投資回報(如果有的話),或保持償付能力。如果我們的策略被證明不成功,股東可能會 損失全部或部分投資。
如果我們需要或尋求籌集額外資金以資助 我們的運營,但我們未能獲得必要的融資,我們可能無法完成候選產品的開發。
我們預計今後將繼續花費大量 現金資源,以推進候選產品的開發。我們相信我們有足夠的 資金繼續運營到2024年第三季度,我們相信我們將需要籌集額外的資本,以資助 我們此後的運營。
在我們能夠從我們許可的候選產品中產生足夠的 收入之前,如果有的話,我們預計我們可以通過(除其他外) 公共或私人股本或債券發行來為未來的現金需求提供資金。此類產品可能在英國、美國或其他外國 國家進行。然而,如果我們無法在需要時或在我們可接受的條件下籌集資金,我們的業務可能會受到嚴重損害。 如果我們通過發行債務或額外股本證券籌集額外資金,此類發行可能導致 現有股東的稀釋和/或增加固定付款責任。此外,這些證券的權利可能高於我們的 普通股的權利,並且可能包含會限制我們的運營並可能損害我們的競爭力的契約,例如對我們產生額外債務的能力的限制,對我們獲取、出售或許可知識產權的能力的限制,以及可能對我們開展業務能力產生不利影響的其他 運營限制。任何這些事件都可能嚴重損害我們 的業務、財務狀況和前景。
| 11 |
| 《目錄》 |
我們對 財政資源將足以支持我們的運營的時間段的預測是一項前瞻性聲明,涉及風險和不確定性, 實際結果可能因多種因素而異,包括本報告其他部分討論的因素。風險因素“ 段。我們的估計是基於可能被證明是錯誤的假設,我們可以比我們目前的預期更快地利用可用資本資源。我們的現金預測是基於可能被證明是錯誤的假設,我們可以比我們目前的預期更快地使用可用的資本資源。不斷變化的環境可能會導致我們消耗資本的速度遠遠超過我們目前 的預期,而且由於情況超出了我們的控制範圍,我們可能需要花費比目前預期更多的資金。我們未來的資金需求(無論是近期還是長期)將取決於許多因素,包括但不限於:
| • | 其他資產的任何收購和商業化,包括許可資產; |
| • | 我們推進臨牀試驗的任何候選產品的臨牀試驗的啟動、進展、時間安排、成本和結果; |
| • | 里程碑的實現以及需要就我們的任何候選產品 或任何其他未來候選產品支付任何版税; |
| • | 我們獲得許可或收購和開發的候選產品的數量和特徵; |
| • | EMA、MHRA、FDA和任何其他可比 外國監管機構的監管批准結果、時間和成本,包括此類監管機構要求我們進行比我們目前預期更多或 成本更高的研究的可能性; |
| • | 提交、起訴、辯護和執行任何專利要求或其他知識產權的費用;以及 |
| • | 競爭的技術和市場發展的影響。 |
此外,我們的預測也沒有反映 由於市場狀況,我們可能無法動用部分現有現金、現金等價物和投資的可能性。 例如,2023年3月10日,美國聯邦存款保險公司接管了公司,並被任命為硅谷銀行的接管人。如果其他銀行和金融機構因影響銀行系統和金融市場的財務狀況而進入接管或在未來破產 ,我們獲取現有現金、現金等價物和投資的能力可能受到威脅 ,並可能對我們的業務和財務狀況造成重大不利影響。
如果缺乏可用資本意味着 我們無法擴大業務或以其他方式利用我們的商業機會,我們的業務、財務狀況和經營業績 可能會受到重大不利影響。
在過去幾年中,我們和我們的獨立註冊公共 會計師事務所發現了我們對財務報告的內部控制存在的重大缺陷。如果我們未能維持 有效的內部控制系統或在未來提供可靠的財務和其他信息,則可能導致投資者對我們的財務報表和SEC文件失去信心 ,我們證券的市場價格可能受到重大不利影響。
2002年的《薩班斯—奧克斯利法案》(Sarbanes—Oxley Act)要求,除其他事項外,我們對財務報告和披露控制和程序保持有效的內部控制。 根據《薩班斯—奧克斯利法案》第404條,我們必須向管理層提交報告,其中包括我們對財務報告的內部控制的有效性 。此評估包括披露管理層 在財務報告內部控制中發現的任何重大弱點。
重大缺陷是指財務報告內部控制中的控制缺陷, 或控制缺陷的組合,導致 年度或中期財務報表的重大錯報無法及時預防或發現的合理可能性以上。《薩班斯—奧克斯利法案》第404條一般還要求我們的獨立註冊會計師事務所就我們對財務報告的內部控制的有效性進行證明 。然而,只要我們仍然是非加速申報人,我們就不需要遵守 獨立註冊會計師事務所的認證要求。
在過去幾年中,我們和我們的獨立 註冊的公共會計師事務所發現了我們對財務報告的內部控制存在的重大缺陷。雖然我們已經 採取了補救措施來解決已發現的重大缺陷,並持續審查和評估我們的內部控制 系統,以允許管理層報告我們對財務報告的內部控制的充分性,但我們不能向您保證,我們 不會發現我們對財務報告的內部控制的其他缺陷。任何此類額外弱點或未能 充分補救任何現有弱點可能會對我們的財務狀況和經營業績以及 我們及時可靠地準確報告財務狀況和經營業績的能力產生重大不利影響。
| 12 |
| 《目錄》 |
此外,先前 識別的重大弱點,或我們將來可能發現的其他重大弱點或重大缺陷,可能導致我們確定 我們的控制和程序在未來期間無效,或可能導致綜合財務報表 出現無法防止或發現的重大錯報。
任何未能保持對財務報告的有效內部 控制的情況都可能嚴重阻礙我們準確報告財務狀況、經營結果 或現金流量的能力。如果我們無法得出結論認為我們對財務報告的內部控制是有效的,或者如果我們的獨立註冊 會計師事務所確定我們對財務報告的內部控制存在重大缺陷或重大缺陷 ,一旦該事務所開始其第404節審查,我們可能會失去投資者對我們財務報表 和報告的準確性和完整性的信心,我們的普通股和/或存托股的市價可能下跌,我們可能會受到納斯達克、SEC或其他監管機構的制裁或調查 。未能糾正我們財務報告內部控制中的任何重大缺陷, 或未能實施或維持上市公司要求的其他有效控制系統,也可能限制我們未來進入 資本市場。
與我們的業務、戰略和行業相關的風險
我們過去進行過、將來也可能進行戰略性收購。未能整合收購可能會對我們的價值造成不利影響。
過去,我們發展 管道和業務的方式之一是通過戰略性收購其他業務、候選產品和技術。我們可能會, 不時評估額外的收購機會,並在未來,當我們認為機會對我們的前景有利時,可能會對業務、化合物、產品和技術進行戰略性的進一步收購、 和投資,例如收購託立酮。我們無法保證將來能夠找到合適的收購或 投資。就這些收購或投資而言,我們可能:
| • | 發行會稀釋股東持股比例的股票; |
| • | 有義務支付里程碑或其他或有或無付款; |
| • | 承擔債務並承擔責任;和/或 |
| • | 產生與無形資產相關的攤銷費用或立即發生大規模核銷。 |
我們也可能無法找到合適的收購對象 ,並且可能無法以優惠條件完成收購(如果有的話),或為此類收購獲得足夠的融資。 如果我們確實完成了一項收購,這可能無法最終加強我們的競爭地位,也無法確保客户、金融市場或投資者不會對我們產生負面看法 。此外,收購亦可能對我們的營運構成多項額外風險,包括:
| • | 整合採購的業務、產品或技術而沒有實質性成本、延遲 或其他問題的問題; |
| • | 增加我們的開支; |
| • | 未能發現所收購資產或公司的未披露負債,而我們可能 對此無法充分説明; |
| • | 轉移管理層的注意力,使其從日常職責和我們的核心業務上轉移; |
| • | 無法執行補償和非競爭協議; |
| • | 未能成功地將收購的產品或技術納入我們的業務; |
| • | 所收購的業務、產品或技術未能如預期那樣發揮作用; |
| • | 未能實現預期的協同增效和成本節約; |
| • | 意外的安全性問題和/或收購產品的臨牀試驗失敗; |
| • | 損害我們的經營業績或財務狀況,特別是在收購完成後的前幾個報告期 ; |
| • | 進入我們以前經驗有限或沒有經驗的市場;以及 |
| • | 主要員工或客户的潛在損失,特別是被收購實體的員工或客户。 |
| 13 |
| 《目錄》 |
我們可能無法完成一項或多項 收購,或有效整合通過任何此類收購獲得的運營、產品或人員,而不會對我們的業務、財務狀況和經營業績造成重大不利影響 。
我們未來的成功取決於產品開發和成功 將我們的候選產品授權給合作伙伴的能力,這些合作伙伴可以尋求我們的候選產品的監管批准和商業化。
我們將繼續為我們的候選產品進行研究和開發 ,並在較小程度上為我們的某些候選產品進行臨牀試驗;然而,無法保證 我們的任何目標開發都將獲得成功。我們必須開發滿足特定市場需求的功能性產品。因此,我們必須 從事新的開發活動,這些活動可能無法及時或根本無法產生創新的、商業上可行的結果。此外,我們可能無法開發新技術或識別可通過我們的技術或現有技術解決的特定市場需求。為了開發適合許可的技術和產品,我們可能會遇到延誤,併產生額外的開發和生產成本和開支,超出預期。如果我們的任何發展計劃被削減, 這可能會對我們的業務和財務狀況產生重大不利影響。
Our business is dependent on our ability to complete the development of product candidates, and license our product candidates to partners who will seek to obtain regulatory approval for and commercialize our product candidates in a timely manner. Any licensing partner cannot commercialize a product without first obtaining regulatory approval from the appropriate regulatory authorities in a country. Before obtaining regulatory approvals for the commercial sale of any product candidate for a target indication, it must be demonstrated with substantial evidence gathered in preclinical and well-controlled clinical studies that the product candidate is safe and effective for use for that target indication and that the manufacturing facilities, processes and controls are adequate. The process of developing, obtaining regulatory approval for and commercializing product candidates is long, complex and costly. Even if a product candidate were to successfully obtain approval from the EMA, the MHRA, the FDA and/or comparable foreign regulatory authorities, any approval might contain significant limitations related to use restrictions for certain age groups, warnings, precautions or contraindications, or may be subject to burdensome post-approval study or risk management requirements. If our product candidates are unable to obtain regulatory approval in one or more jurisdictions, or any approval contains significant limitations, we may not be able to obtain sufficient funding or generate sufficient revenue to continue the development of any other product candidate. Furthermore, even if a product candidate obtains approval from the regulatory authorities, it is likely that, in order to obtain royalty and/or milestone revenue from any of our licensing partners, our licensing partners may need to expand their commercial operations, establish commercially viable pricing and obtain approval for adequate reimbursement from third parties and government departments and healthcare payors for such products. If our product candidates are unable to successfully be commercialized, we may not be able to earn sufficient revenues to continue our business.
我們的發展努力處於早期階段。 我們的所有候選產品都處於臨牀開發或臨牀前開發階段。如果我們無法通過臨牀開發推進候選產品 、獲得監管部門的批准並最終將候選產品商業化,或者在這一過程中遇到 重大延誤,我們的業務將受到重大損害。
臨牀測試費用高昂,可能需要 多年時間才能完成,其結果本質上是不確定的。臨牀試驗過程中的任何時候都可能發生失敗。我們候選產品的任何臨牀前研究和早期臨牀試驗的 結果可能無法預測後期臨牀試驗的結果 ,即使在早期臨牀試驗中看到了令人鼓舞的結果。處於臨牀試驗後期階段的候選產品 可能無法顯示預期的安全性和有效性特徵,儘管已通過臨牀前研究和初步臨牀試驗取得進展。 A生物製藥行業的許多公司,包括許多比我們擁有更多資源和經驗的公司,儘管在早期的 試驗中取得了令人鼓舞的結果,但由於缺乏療效或不良的安全性特徵,在高級臨牀試驗中遭受了嚴重的 挫折。
我們已決定不再在人體中進行額外的 臨牀試驗,除了初步試驗,以確定藥物已批准的適應症以外的適應症的概念證明。我們希望我們的許可合作伙伴將負責未來的臨牀試驗。我們和我們當前或潛在的許可 合作伙伴可能會在正在進行或未來的臨牀試驗中遇到延誤,我們不知道計劃的臨牀試驗是否會按時開始或招募 受試者,是否需要重新設計或按計劃完成(如果有的話)。
| 14 |
| 《目錄》 |
無法保證我們候選產品當前或未來的 臨牀試驗將成功或產生積極的臨牀數據,我們可能無法獲得FDA、歐盟委員會或其他監管機構對我們的任何候選產品的上市批准。我們在 向FDA提交新藥申請或NDA、生物製品許可證申請或BLA和研究性新藥申請或IND, 向EMA提交臨牀試驗申請或CTA或上市許可申請或MAA方面的經驗有限。甲苯咪唑酮 和MTX 110都處於臨牀開發的相對早期階段。託咪酮預計將於2024年年中開始招募IIa期 研究,MTX 110目前正在進行的I期和藥物啟動試驗中進行研究。無法保證 FDA將允許我們未來的任何NDA、BLA或IND(包括託立酮或MTX 110的NDA或 其他候選產品的任何未來IND)及時生效或根本生效。如果候選產品沒有IND或CTA, 將不允許我們分別在美國或歐盟對該候選產品進行臨牀試驗。
藥物或生物 產品開發是一個困難、漫長、耗時、昂貴且不確定的過程,在我們的任何臨牀試驗的任何階段 都可能發生延遲或失敗。如果我們的候選產品未能獲得監管部門的批准,我們將無法對其進行商業化和 營銷。臨牀試驗可能因各種原因而延遲、暫停或提前終止,例如:
| • | 延遲或未能完成臨牀前研究; |
| • | 沒有足夠的財政和其他資源來完成必要的臨牀前研究和臨牀試驗; |
| • | 延遲或未能與適用監管機構就試驗設計達成協議; |
| • | 延遲或未能獲得開始試驗的授權,或無法遵守監管機構關於臨牀試驗範圍或設計的條件 ; |
| • | 延遲或未能與潛在合同研究組織、 或CRO以及臨牀試驗提供商和研究中心就可接受的條款達成協議,這些條款可能需要廣泛協商,並且在不同CRO和研究中心之間可能存在很大差異 ; |
| • | 延遲或未能獲得機構審查委員會或IRB的批准或其他審查 實體(包括外國監管機構)在每個研究中心開展臨牀試驗的批准; |
| • | 由於治療標準的改變或研究中心不符合參加我們臨牀試驗的資格,導致臨牀試驗中心未能招募或隨後退出臨牀試驗; |
| • | 拖延或未能招募合適的受試者參加審判的; |
| • | 延遲或未能讓受試者完成試驗或返回治療後跟進; |
| • | 臨牀研究中心和研究者偏離試驗方案、未能按照 監管要求進行試驗或退出試驗; |
| • | 無法識別和維護足夠數量的試驗中心,其中許多可能已經 參與其他臨牀試驗項目,包括一些可能用於相同適應症的試驗項目; |
| • | 第三方臨牀試驗管理人員或臨牀試驗中心未能履行合同義務或滿足 預期期限; |
| • | 增加新的臨牀試驗地點延遲或失敗; |
| • | 不明確或負面的中期結果,或結果與早期結果不一致; |
| • | 需要根據EMA、MHRA、FDA、 負責IRB、數據安全性監測委員會或其他監管機構的意見,或根據早期或同期臨牀前 和臨牀研究的結果,對臨牀試驗方案進行修改; |
| • | EMA、MHRA、FDA、負責IRB、其他監管機構或我們的決定,或數據安全監測委員會的建議 ,因安全性問題或任何其他原因隨時暫停或終止臨牀試驗; |
| 15 |
| 《目錄》 |
| • | 不可接受的風險受益概況或不可預見的安全問題或不良副作用; |
| • | 未能證明使用我們的候選產品比現有上市產品或已確立的 標準護理治療獲益; |
| • | 生產問題,包括生產或從第三方獲得足夠 數量的原材料、活性藥物成分或API或用於臨牀試驗的候選產品的問題;以及 |
| • | 政府法規或行政措施的變化或缺乏足夠的資金繼續進行臨牀試驗。 |
其中許多因素是我們無法控制的。 如果我們在完成或終止任何正在進行的或未來的臨牀試驗方面出現延誤,我們候選產品的商業前景將受到損害,我們從這些候選產品中獲得產品收入的能力將受到延誤 。此外,完成臨牀試驗的任何延誤都可能減慢我們的候選產品開發和批准過程 ,並危及開始銷售產品和產生收入的能力。任何這些事件都可能嚴重損害我們的業務、財務狀況和前景。此外,導致或導致臨牀試驗開始或完成延遲的許多因素 也可能最終導致我們的候選產品得不到監管批准。即使我們花費了 大量時間和資源尋求此類批准, 我們的候選產品都可能無法成功完成臨牀開發過程並獲得監管部門的批准。
我們的 主要候選產品開發過程中的負面結果也可能妨礙或延遲我們繼續或開展臨牀項目或獲得其他候選產品的監管批准 的能力。例如,雖然我們認為我們的臨牀前研究和託立酮和MTX 110的動物試驗證明瞭可接受的安全性和有效性特徵,但未來的臨牀試驗可能無法證明足夠水平的安全性或有效性 。此外,對於MTX 110,我們計劃在臨牀試驗中評估的每種腫瘤類型的抗腫瘤活性可能不同 。因此,即使我們計劃對多種腫瘤類型進行臨牀開發,但與其他癌症患者相比,某些癌症患者的腫瘤反應可能 較低。因此,由於臨牀獲益不足,我們可能需要停止對患有這些腫瘤類型和/或突變的患者進行MTX 110的開發,同時繼續對更有限的患者人羣進行開發 。因此,為了獲得監管部門的批准,我們可能必須與FDA就定義最佳患者人羣、研究設計和規模達成協議,其中任何一項都可能需要大量額外資源,並延遲我們的臨牀試驗和 最終批准(如果有的話)。
我們可能會遇到一些挫折,這些挫折可能會延遲 或阻止監管部門批准候選產品,或阻止我們將候選產品商業化的能力,包括:
| • | 我們的臨牀前研究或臨牀試驗結果為陰性或不確定性,或其他人 的臨牀試驗結果為陽性,與我們相似的候選產品獲得批准,並演變為決定或要求進行額外的臨牀前 測試或臨牀試驗或放棄項目; |
| • | 患者或受試者在我們的臨牀試驗中或使用我們、FDA、其他監管機構或其他人認為與我們候選產品開發相關的藥物或治療劑的個人經歷的產品相關副作用; |
| • | 延遲提交IND或類似的國外申請,延遲或未能獲得監管機構開始臨牀試驗的必要批准 ,或臨牀試驗一旦開始即暫停或終止; |
| • | FDA或類似的外國機構對我們臨牀試驗的範圍或設計(包括我們的 臨牀終點)施加的條件; |
| • | 不能保持遵守法規要求,包括當前的良好製造規範或cGMP,並有效地遵守其他程序; |
| • | 臨牀試驗所需的候選產品或其他材料的供應或質量不足; |
| • | 臨牀試驗費用高於預期; |
| • | 無法與其他療法競爭; |
| • | 我們的候選產品在臨牀試驗期間療效不佳; |
| • | 試驗結果的時間比預期的要長; |
| 16 |
| 《目錄》 |
| • | 試驗受到欺詐、數據獲取失敗或其他技術故障的影響,導致我們的試驗無效; |
| • | 我們的試驗結果不支持歐盟有條件批准的申請; |
| • | 不利於FDA或其他監管機構對臨牀試驗場地進行檢查和審查; |
| • | 我們的第三方承包商或調查人員未能及時或根本不遵守監管要求或履行其合同義務; |
| • | 監管要求、政策和指南的延遲和變更,包括對一般臨牀開發或特別是我們的技術施加額外的監管監督;或 |
| • | FDA和類似的外國監管機構對數據的不同解釋。 |
此外,由於我們的財務和人力資源有限,並且主要專注於開發我們的領先候選產品,我們可能會放棄或推遲追求其他未來的候選產品,這些候選產品可能被證明具有更大的商業潛力,可能無法利用可行的商業產品或有利可圖的 市場機會。如果我們沒有準確評估未來候選產品的商業潛力或目標市場,我們可能會 通過協作、許可或其他版税安排將寶貴的權利讓給這些未來候選產品,而在這種情況下,我們保留這些未來候選產品的獨家開發權和商業化權利會更有利。
臨牀前研究和早期臨牀試驗的結果並不總是預測未來的結果。我們在臨牀試驗中推進的任何候選產品可能不會在以後的臨牀試驗(如果有)中獲得有利的結果,也可能無法獲得市場批准。
藥物和生物製品的研發費用昂貴,風險極高。進入開發流程的候選產品中只有一小部分獲得了市場批准。在獲得監管部門批准銷售我們的候選產品之前, 我們必須進行廣泛的臨牀試驗,以證明候選產品在人體上的安全性和有效性。臨牀測試的結果還不確定。我們的候選產品開發策略可能面臨不可預見的挑戰,我們不能保證我們的任何臨牀試驗將按計劃進行或如期完成,或者根本不能保證我們最終將在當前和未來的臨牀試驗中取得成功 ,或者我們的候選產品將能夠獲得監管部門的批准。一項或多項臨牀試驗的失敗可能發生在測試的任何階段,這可能是由多種因素導致的,包括研究設計中的缺陷、劑量選擇問題、安慰劑效應、患者登記標準以及未能證明良好的安全性或有效性。臨牀前試驗和早期臨牀試驗的結果可能不能預測後續臨牀試驗的成功,臨牀試驗的初步或中期結果不一定能預測最終結果。例如,候選產品在人體試驗中表現出不可預見的安全性或有效性問題並不少見,儘管在臨牀前動物模型研究中取得了令人振奮的結果 。因此,我們不能向您保證,我們可能進行的任何臨牀試驗將證明一致或足夠的有效性和安全性,以支持上市審批。一般來説,FDA和美國以外的監管機構在批准藥品上市前,要求進行兩項充分的 且控制良好的臨牀試驗,以證明其安全性和有效性,包括第三階段臨牀試驗。
製藥行業的許多公司在後期臨牀試驗中遭遇了重大挫折,即使在臨牀前試驗和早期臨牀試驗中取得了令人振奮的結果 ,我們不能確定我們不會面臨類似的挫折。此外,臨牀前和臨牀數據往往容易受到不同解釋和分析的影響,許多公司認為他們的候選產品在臨牀前研究和臨牀試驗中表現令人滿意,但仍未能獲得其產品的上市批准。此外,我們開發的任何候選產品未能在任何臨牀試驗中證明其安全性和有效性,可能會對我們開發的其他候選產品 產生負面影響,或者導致監管機構在批准我們的任何候選產品之前要求進行額外的測試。
如果要求我們進行額外的 臨牀試驗或其他測試我們的候選產品,如果我們無法成功完成候選產品的臨牀試驗或其他測試,如果這些試驗或測試的結果不是陽性或僅為輕度陽性,如果存在安全問題 或者如果我們確定觀察到的安全性或有效性特徵在市場上不具競爭力,我們可能會:
| • | 招致計劃外費用; |
| • | 延遲獲得我們開發的候選產品的上市批准; |
| • | 根本沒有獲得上市批准; |
| • | 在一些國家獲得上市批准,而在另一些國家則沒有; |
| • | 獲得批准的適應症或患者羣體並不像預期或期望的那樣廣泛; |
| 17 |
| 《目錄》 |
| • | 獲得包括重大使用或分銷限制或安全警告在內的標籤的批准; |
| • | 接受額外的上市後測試要求;或 |
| • | 在獲得上市批准後將該產品從市場上撤下。 |
如果我們在臨牀試驗或獲得上市批准方面遇到延誤,我們的產品開發成本也將 增加。我們不知道我們的任何臨牀試驗 是否將繼續或按計劃開始,是否需要重組,或是否將如期完成,或根本不知道。我們還可能決定改變 我們一個或多個臨牀試驗的設計或方案,包括增加額外的患者或研究組,這可能導致 成本和費用增加或延誤。臨牀試驗的重大延誤還可能縮短我們可能擁有 將候選產品商業化的獨家權利的任何時間,或允許競爭對手在我們之前將產品推向市場,並損害我們成功將候選產品商業化的能力 ,並可能損害我們的業務和運營結果。
我們或我們的合作者可能會在臨牀試驗中招募和/或保留患者時遇到延遲或困難,這可能會延遲或阻止我們獲得必要的監管批准。
成功和及時完成臨牀試驗 需要我們或我們的合作者為候選產品申辦試驗,招募足夠數量的患者。 患者入組是臨牀試驗時間安排的一個重要因素,受許多因素影響,包括患者人羣的規模和 性質,以及與競爭對手爭奪有資格參加我們臨牀試驗的患者,可能正在進行 臨牀試驗的候選產品正在開發中,用於治療與我們的一個或多個候選產品相同的適應症 或批准的產品,以滿足我們開發候選產品的條件。
患者入組時間長於預期或患者退出,可能會導致試驗延遲。如果我們無法按照FDA、EMA或類似的外國監管機構的要求找到並招募足夠數量的合格患者參加臨牀試驗, 我們可能無法啟動或繼續進行候選產品的臨牀試驗。我們無法預測我們或我們的合作者在未來臨牀試驗中招募受試者方面會有多成功。試驗受試者入組受其他因素影響,包括:
| • | 診斷所調查疾病的嚴重程度和困難程度; |
| • | 有關試驗的資格和排除標準; |
| • | 患者人羣的規模和識別患者的過程; |
| • | 我們有能力招聘具有適當能力和經驗的臨牀試驗研究人員; |
| • | 試驗方案的設計; |
| • | 試驗中候選產品相對於其他可用 療法(包括可能獲批用於我們正在研究的適應症的任何新產品)的感知風險和受益; |
| • | 競爭性市售療法的可用性和其他競爭性治療候選人針對正在研究的疾病或病症的臨牀試驗; |
| • | 患者是否願意參加我們的臨牀試驗; |
| • | 入組臨牀試驗的受試者在完成前退出我們的試驗的風險; |
| • | 我們獲得和維護臨牀試驗受試者知情同意的能力 |
| • | 促進及時登記參加臨牀試驗的努力; |
| • | 醫生的病人轉診做法; |
| • | 在治療期間和治療後充分監測患者的能力;以及 |
| • | 臨牀試驗地點的近似性和對潛在患者的可用性。 |
| 18 |
| 《目錄》 |
此外,美國國會最近 修改了FDCA,要求III期臨牀試驗或其他"關鍵性研究"的申辦者為此類臨牀試驗設計並提交多樣性行動計劃,以支持上市許可。行動計劃必須描述合適的 入組多樣性目標,以及目標的理由以及申辦者如何實現這些目標的描述。儘管 我們的候選產品均未達到臨牀開發的III期,但在III期試驗或關鍵研究方案提交給FDA進行審查之前,我們或我們的許可合作伙伴必須向FDA提交多樣性行動計劃 ,除非我們或我們的許可合作伙伴能夠獲得對多樣性行動計劃部分或全部要求的豁免。目前尚不清楚 多樣性行動計劃會如何影響我們候選產品未來III期試驗的計劃和時間安排,或者 FDA在此類計劃中期望獲得哪些具體信息。但是,如果FDA反對為我們候選產品的任何未來III期試驗制定的多樣性行動計劃 ,並且我們或我們的許可合作伙伴可能會遇到困難,招募多樣化的 患者人羣以滿足任何已批准的多樣性行動計劃的要求。
無法招募足夠數量的患者進行臨牀試驗 將導致嚴重延誤,並可能要求我們完全放棄一項或多項臨牀試驗。 這些臨牀試驗的入組延遲可能會導致我們候選產品的開發成本增加,從而導致 公司價值下降,並限制我們獲得額外融資的能力。此外,我們希望依靠CRO和臨牀試驗中心來確保我們的臨牀試驗的正確和及時進行,我們對他們的性能的影響有限。
我們面臨與英國退出歐盟有關的政治、監管、社會和經濟風險。
在 2016年公投結果後,英國於2020年1月31日離開歐盟,通常稱為英國退歐。根據英國與歐盟達成的正式退出安排,英國將經歷一段過渡期,直至2020年12月31日,在此期間,歐盟規則繼續適用。2020年12月,英國和 歐盟簽署了《貿易與合作協定》,該協定概述了英國和歐盟之間未來的貿易關係。新的貿易協定對聯合王國的總體和經濟狀況的影響仍然不確定。例如,可能會 從歐盟採購的材料和設備產生額外成本和/或可能對我們的業務、財務狀況和經營業績產生重大不利影響的延遲。
從監管角度來看,聯合王國退出歐盟可能會帶來巨大的複雜性和風險。 歐盟 法律中有關在歐盟授予藥品上市許可的一項基本要求是申請人在歐盟成立 。英國退出歐盟後, 以前授予在英國成立的申請人的上市許可可能不再有效。 此外,歐盟委員會根據集中程序授予的藥品上市許可的範圍將來可能不包括英國。 在這些情況下,將需要獲得英國主管當局的授權才能將藥品投放到英國市場。
任何這些因素都可能顯著增加我們在歐盟和英國的活動的複雜性,可能抑制我們的經濟活動並限制 我們獲得資本的途徑,這可能對我們的業務、財務狀況和經營業績產生重大不利影響,並降低 我們普通股和存托股的價格。
| 19 |
| 《目錄》 |
美國和歐洲的監管審批流程漫長、 耗時且固有不可預測,如果我們最終無法獲得候選產品的監管審批, 我們的業務可能會受到嚴重損害。
候選產品獲得EMA、MHRA、FDA和其他類似的國外監管機構的批准所需時間是不可預測的,如果獲得批准,通常 在臨牀前研究和臨牀試驗開始後需要花費許多年時間,這取決於 許多因素,包括監管機構的大量自由裁量權。此外,批准政策、法規或 獲得批准所需的臨牀數據類型和數量可能在候選產品臨牀開發過程中發生變化 ,並且可能因司法管轄區而異。我們尚未獲得任何候選產品的監管批准,而且我們可能永遠不會 獲得任何候選產品的監管批准。在我們收到FDA的NDA監管批准之前,我們或任何當前或未來的合作者 都不允許在美國銷售任何候選藥品, 在我們分別收到EMA或 MHRA的上市許可批准之前,我們不能在歐盟或英國銷售任何候選藥品,或在任何其他國家,直至我們根據該國家的法律獲得監管授權。
我們的候選產品可能無法獲得EMA、MHRA、FDA和其他類似外國監管機構的 監管批准,原因包括:
| • | 不同意臨牀試驗的設計或實施; |
| • | 未能證明候選產品對其擬定適應症安全有效; |
| • | 臨牀試驗結果未達到批准所需的統計意義水平; |
| • | 未能證明候選產品的臨牀和其他受益超過其安全性 風險; |
| • | 不同意我們對臨牀前研究或臨牀試驗數據的解釋; |
| • | 從我們的候選產品的臨牀試驗中收集的數據不足,無法支持提交NDA、BLA、MAA或其他提交或獲得監管部門批准; |
| • | 監管機構可能會發現良好的臨牀實踐或GCP遵從性方面的不足,或者可能會發現我們的記錄保存或我們臨牀試驗地點的記錄保存不充分; |
| • | 不批准與我們或任何許可合作伙伴簽訂臨牀和商業用品合同的第三方製造商的製造工藝或設施;或 |
| • | 審批政策或法規的變化,導致臨牀前和臨牀數據不足以進行審批 。 |
在大量開發中的產品中,只有一小部分產品成功完成了FDA、EMA、MHRA或其他類似的監管審批流程並已商業化。 漫長的審批和營銷授權流程以及未來臨牀試驗結果的不可預測性可能會導致我們無法獲得監管部門的批准和營銷授權來營銷我們的候選產品,這將嚴重損害我們的業務、財務狀況、運營結果和前景。
| 20 |
| 《目錄》 |
此外,EMA、MHRA、FDA 和其他類似的外國監管機構可能需要更多信息,包括額外的臨牀前或臨牀數據以支持批准,這可能會推遲或阻止批准和任何商業化計劃,或者我們或任何許可合作伙伴可能決定放棄開發計劃。如果獲得批准,監管機構可能會批准我們的任何候選產品的適應症少於或 多於要求的適應症,可能會根據昂貴的上市後臨牀試驗的表現而批准, 或者可能批准標籤不包括候選產品成功商業化所必需或需要的標籤聲明 。此外,如果我們的候選產品產生不良副作用或安全問題,監管機構 (FDA、MHRA、EMA或類似的外國監管機構)可能會要求建立風險評估和緩解策略或REMS,例如,可能會限制產品的分銷,並對我們或任何許可合作伙伴施加繁重的實施要求。上述任何一種情況都可能對我們的候選產品的商業前景造成實質性損害。
我們的候選產品可能會導致不良的副作用 或具有其他可能延遲或阻止其監管審批並限制已批准標籤的商業形象的特性, 這些副作用或其他特性可能會在任何候選產品獲得上市批准後導致嚴重的負面後果 。
我們的任何候選產品引起的不良副作用可能會導致我們、我們的許可合作伙伴(如果有)或監管機構中斷、推遲或暫停臨牀試驗 ,並可能導致更嚴格的標籤或EMA、MHRA、FDA或其他類似外國監管機構的監管批准延遲或拒絕。臨牀試驗的結果可能會顯示與候選產品使用相關的嚴重程度和流行程度高且不可接受的副作用或風險。在這種情況下,我們的試用可能會暫停或終止, 監管機構可以命令我們停止進一步開發或拒絕批准我們的任何或所有目標候選產品 。與藥物相關的副作用可能會影響我們的候選產品臨牀試驗的患者招募,或登記受試者完成試驗的能力或導致潛在的產品責任索賠。這些情況中的任何一種都可能嚴重損害我們的業務、財務狀況和前景。
此外,如果在批准上市後發現我們產品的不良副作用 ,可能會導致一些潛在的重大負面後果,包括:
| • | 該產品的銷售可能會暫停; |
| • | 產品召回或產品撤回; |
| • | 監管部門可以撤銷對這類產品的批准,或者可能要求在標籤上附加警告; |
| • | 要求為每種產品制定可再生能源管理體系,或在已經制定戰略的情況下,納入可再生能源管理體系下的額外要求,或制定類似的戰略,以滿足可比外國監管機構的要求; |
| • | 要求進行額外的上市後研究;以及 |
| • | 被起訴並被追究對受試者或患者造成的傷害的責任。 |
因此,我們的聲譽和業務運營可能受到影響。
這些事件中的任何一種都可能阻止實現或保持市場對特定產品或候選產品的接受程度(如果獲得批准),並可能嚴重損害我們的業務、 運營結果和前景。
即使我們獲得了任何候選產品的監管批准,我們也將受到持續的監管監督和持續的監管審查,這可能會導致大量額外費用,如果我們未能遵守監管要求或遇到任何候選產品的意外問題,我們可能會 受到處罰 。
我們的候選產品,如果獲得 監管部門批准,將遵守EMA、MHRA、FDA和其他監管機構的持續要求,管理 生產、質量控制、進一步開發、標籤、包裝、儲存、分銷、安全監督、進口、出口、 廣告、促銷、記錄保存和安全性報告以及其他上市後信息。這些要求包括提交 安全性和其他上市後信息和報告、企業註冊和上市,以及持續遵守 產品生產的cGMP和我們在批准後進行的任何臨牀試驗的GCP要求。任何產品的安全性特徵 在批准後均由EMA、MHRA、FDA和其他監管機構密切監測。如果EMA、MHRA、FDA或其他 監管機構在批准我們的任何產品或候選產品後獲悉新的安全性信息,監管機構 可能會要求更改標籤或制定風險緩解策略或類似策略,對產品的指定用途或上市實施重大限制 ,或對可能昂貴的批准後研究或上市後監督實施持續要求。
| 21 |
| 《目錄》 |
此外,藥品和生物製品的製造商及其設施須接受EMA、MHRA、FDA和其他政府監管機構的持續審查和定期檢查,以確保其符合cGMP和其他適用法規。如果發現產品存在以前未知的問題,例如 嚴重度或頻率超出預期的不良事件,或產品生產工廠存在問題, 監管機構可能會對該產品、生產工廠或產品商業化的一方施加限制,包括 要求召回或從市場撤回產品或暫停生產。如果我們的候選產品或候選產品的製造設施 不符合適用的法規要求,監管機構可以:
| • | 出具警告信或者無題信的; |
| • | 強制修改或撤回營銷和宣傳材料,或要求向醫療保健專業人員提供糾正性 信息; |
| • | 要求違約方簽署同意令,其中可以包括施加各種 罰款、報銷檢查費用、規定的具體行動到期日和對不遵守行為的處罰; |
| • | 尋求禁制令或施加民事或刑事處罰或罰款; |
| • | 要求對標籤進行修訂,包括對批准用途的限制或添加額外 警告、禁忌症或其他安全信息,包括盒裝警告; |
| • | 暫停、變更或者撤銷監管審批; |
| • | 要求進行額外的上市後臨牀試驗,以評估產品的安全性; |
| • | 暫停任何正在進行的臨牀研究; |
| • | 拒絕批准我們或任何許可合作伙伴提交的未決申請或申請的補充; |
| • | 暫停或對業務、產品、製造或我們施加限制;或 |
| • | 扣押或扣留產品,拒絕允許產品進口或出口,或要求產品召回。 |
在歐盟,EMA可能需要等同的風險管理 計劃或RMP。不遵守歐盟關於安全性監測或藥物警戒的要求也可能導致嚴重的 經濟處罰。同樣,不遵守歐盟關於保護個人信息的要求 也可能導致重大處罰和制裁。
上述任何事件或 處罰的發生可能會抑制我們從我們的任何許可 合作伙伴商業化的候選產品中賺取收入的能力。
FDA、EMA、MHRA和其他類似的 外國監管機構的政策可能會發生變化,並且可能會頒佈額外的政府法規,這可能會阻止、限制 或延遲我們候選產品的監管批准。如果我們行動緩慢或無法適應現有要求的變化,或 新要求或政策的採用,或者如果我們無法保持法規合規性,我們可能失去 可能獲得的任何營銷批准,這將對我們的業務、前景以及實現或維持盈利能力造成不利影響。
在一個司法管轄區獲得和維持對 我們的任何其他候選產品的監管批准,並不意味着我們將在其他司法管轄區成功獲得對 候選產品的監管批准。
在一個司法管轄區獲得和維持我們的其他候選產品的監管批准 並不保證我們能夠獲得或維持任何其他司法管轄區的監管批准 ,而在一個司法管轄區獲得監管批准的失敗或延遲可能會對 其他司法管轄區的監管批准過程產生負面影響。例如,即使FDA授予候選產品的上市許可,類似的外國 監管機構也必須批准候選產品在這些國家的生產、營銷和推廣。批准 和許可程序因司法管轄區而異,可能涉及的要求和行政審查期限不同於或長於美國的要求和行政審查期限,包括額外的非臨牀研究或臨牀試驗,因為在一個司法管轄區進行的臨牀試驗 可能不被其他司法管轄區的監管機構接受。在美國以外的許多司法管轄區,候選產品 必須先獲得批准以報銷,然後才能批准在該司法管轄區銷售。在某些情況下,我們打算 為我們的產品收取的價格也需要得到批准。
| 22 |
| 《目錄》 |
我們也可能在其他國家提交營銷申請 。美國以外司法管轄區的監管機構對候選產品的批准有要求 ,我們必須在這些司法管轄區上市前遵守這些要求。獲得類似的外國監管批准並遵守 類似的外國監管要求可能會給我們帶來重大的延誤、困難和成本,並可能會延遲或阻止 我們的產品在某些國家的引入。我們目前沒有任何候選產品在任何司法管轄區(包括國際市場)獲得批准銷售,我們也沒有獲得國際市場監管批准的經驗。如果我們未能 遵守國際市場的監管要求和/或獲得適用的上市批准,我們的目標市場將 減少,我們實現候選產品全部市場潛力的能力將受到損害。
我們尋求與潛在的許可合作伙伴和合作者建立協議 ,如果我們無法以商業上合理的條款建立協議,我們可能不得不改變我們的開發和商業化計劃 。
Our current development and commercialization strategy is to deploy our proprietary drug delivery technologies to formulate a compelling portfolio of novel first-in-class sustained release formulations of products with significant commercial potential for licensing to pharmaceutical company partners at proof-of-concept stage, which would potentially result in revenue generation from product royalty and/or milestone deals. We seek to work with licensing or collaboration partners for the development and commercialization of one or more of our product candidates. For example, in January 2019, we entered into that certain Licensing, Collaboration and Distribution Agreement, or the CMS License Agreement, with China Medical System Holdings Limited, or CMS, as guarantor, and two of its wholly owned subsidiaries, CMS Bridging Limited, or CMS Bridging, and CMS Medical Hong Kong Limited, or CMS Medical HK, each a CMS Party, pursuant to which, among other things, we agreed to license certain of our products to the CMS Parties in exchange for, among other things, royalty revenue. In June 2020, we announced a research and development collaboration with Dr. Reddy’s Laboratories Ltd., or Dr. Reddy’s, under which we evaluated the feasibility of applying Q-Sphera technology to molecules nominated by Dr. Reddy’s. The collaboration was subsequently terminated by mutual agreement. In July 2020, we announced a similar collaboration with Janssen Pharmaceutical NV, a subsidiary of Johnson & Johnson, or Janssen. The collaboration with Janssen concluded in September 2023. Future collaborators may include large and mid-size pharmaceutical companies, regional and national pharmaceutical companies and biotechnology companies.
我們在尋求 適當的許可或協作合作伙伴方面面臨着巨大的競爭。我們是否達成最終協議將取決於我們對合作夥伴的資源和專業知識的評估,以及擬議合作的條款和條件,以及擬議合作伙伴 對許多因素的評估。這些因素可能包括我們的候選產品與競爭產品的潛在差異 、臨牀試驗的設計或結果、獲得FDA或類似外國監管機構批准的可能性以及 任何此類批准的監管途徑、候選產品的潛在市場,製造 和將產品交付給患者的成本和複雜性以及競爭產品的潛力。合作伙伴還可以考慮替代產品候選 或可用於協作的類似適應症的技術,以及此類協作是否比與我們就產品候選產品進行的協作更具吸引力 。
這些協議很複雜,而且談判和記錄耗時 。此外,最近大型製藥公司之間進行了大量業務合併 ,導致未來潛在許可和合作夥伴數量減少。
我們可能無法及時、以可接受的條款或根本無法與這些潛在合作伙伴談判協議。如果我們無法做到這一點,我們可能不得不縮減我們尋求合作的候選產品 的開發,減少或推遲其開發計劃或我們的一個或多個其他開發計劃。
如果我們與許可或合作伙伴 就我們的候選產品的開發和商業化達成協議,我們在這些候選產品方面的前景將 在很大程度上取決於這些合作的成功。
我們目前的一些收入來自與其他生物製藥公司、研究機構和大學的許可或合作協議,我們預計 未來我們的收入將有很大一部分來自這些協議和類似協議。我們可能會與許可或協作合作伙伴簽訂其他協議,以開發我們的某些候選產品並將其商業化。如果我們簽訂此類協議,我們將對我們的合作伙伴將用於我們候選產品的開發或商業化的資源的數量和時間進行有限的控制。我們能否從這些安排中獲得收入,將取決於未來任何許可合作伙伴成功履行這些安排中分配給他們的職能的能力。此外,任何未來的許可 或協作合作伙伴可能有權在協議條款到期之前或之後放棄研發項目並終止適用的協議,包括 資金義務。
涉及我們候選產品的協議 會帶來許多風險,包括:
| • | 合作伙伴在確定他們將應用於這些事項的努力和資源方面有很大的自由裁量權。 |
| • | 合夥人可能未按預期履行其義務; |
| 23 |
| 《目錄》 |
| • | 合作伙伴不得對我們的候選產品進行開發和商業化,也可以根據臨牀試驗結果、戰略重點的變化或可獲得的資金或外部因素(如收購),選擇不繼續或續訂開發或商業化計劃; |
| • | 合作伙伴可以推遲臨牀試驗,為臨牀試驗提供資金不足,停止臨牀試驗或放棄候選產品,重複或進行新的臨牀試驗,或要求新配方的候選產品進行臨牀 測試; |
| • | 對一個或多個產品擁有營銷和分銷權利的合作伙伴可能沒有投入足夠的資源 用於此類產品的營銷和分銷; |
| • | 與合作伙伴的分歧,包括在專有權、合同解釋或首選開發過程上的分歧,可能會導致候選產品的研究、開發或商業化的延遲或終止 ,可能會導致我們對候選產品承擔額外的責任,或者可能導致訴訟或仲裁, 其中任何一項都將是耗時和昂貴的; |
| • | 合作伙伴可能無法正確維護或捍衞我們的知識產權,或可能使用我們的專有信息以引發訴訟,從而危及或使我們的知識產權或專有信息無效 或使我們面臨潛在的訴訟; |
| • | 合作伙伴可能侵犯第三方的知識產權,這可能使我們面臨訴訟和潛在的責任;以及 |
| • | 協議可能會終止,如果終止,可能需要額外的資金來進一步開發適用的候選產品或將其商業化。 |
協議可能不會以最有效的方式或根本不會導致候選產品的開發或商業化。如果我們的任何未來合作伙伴參與業務合併,它可能會決定推遲、減少或終止我們向其授權的任何候選產品的開發或商業化。
我們的任何候選產品 都不能保證在商業上取得成功。
無法保證我們目前正在開發的任何 候選產品將成功開發成任何商業可行的產品和/或以可接受的成本以商業數量生產,或成功且有利可圖地銷售。如果我們或我們的合作伙伴在任何階段遇到 延誤,並且未能成功解決此類延誤,則可能會對我們的業務、財務狀況 和前景產生重大不利影響。此外,我們的成功將取決於市場對這些產品的接受程度, 我們無法保證這種接受程度即將到來,也無法保證我們的技術將作為競爭產品的替代品取得成功。如果市場未能 發展或發展速度比預期慢,我們可能無法收回我們在開發特定 產品時可能產生的成本,並且可能永遠無法從該產品中獲得有利可圖的版税或許可收入。
製藥和生物技術行業競爭激烈。
新藥的開發和商業化競爭激烈。我們的業務面臨着來自全球範圍內一系列主要和專業製藥和生物技術公司的競爭,在我們可能尋求開發或商業化的任何候選產品方面,未來也將面臨競爭 。
目前有許多製藥和 生物技術公司在市場和銷售產品,或正在開發可與我們的候選產品競爭的產品。關於託立酮,替普利珠單抗(T1D的首種疾病改善治療)已獲批用於延遲 3期T1D,許多公司正在研究潛在的T1D疾病改善方法,包括Vertex Pharmaceuticals,Inc.的幹細胞療法。CRISPR Therapeutics AG和SAB Biotherapeutics,Inc.正在發展免疫系統此外,JDRF T1D基金還投資了大約30傢俬營公司,致力於各種治療T1D的方法。關於 MTX 110,有許多公司正在研究GBM的潛在治療方法,包括CNS Pharmaceuticals,Inc.。和Plus Therapeutics,Inc. Chimerix Inc.是眾多為DMG開發產品的公司之一。
其中一些競爭產品和療法 基於與我們的方法相同或相似的科學方法,而另一些則基於完全不同的方法。 潛在的競爭者還包括學術機構、政府機構和其他公共和私人研究組織,它們進行研究、尋求專利保護並建立研究、開發、製造和商業化的合作安排。
| 24 |
| 《目錄》 |
我們在生物技術和 製藥行業的競爭對手可能擁有卓越的研發能力、產品、製造能力或銷售和營銷 專業知識。我們的許多競爭對手可能擁有更多的財政和人力資源,並且可能在研發方面有更多的經驗 。
由於這些因素,我們的競爭對手 可能比我們更快地獲得對其產品的監管批准,或者可能獲得其他知識產權的專利保護,從而限制了我們開發或商業化候選產品的能力。我們的競爭對手也可能開發出比我們自己的候選產品更有效、使用更廣泛、成本更低的產品,並且可能在 產品商業化方面更成功。
我們預計,隨着新公司進入我們的市場,以及替代產品和技術的出現, 未來我們將面臨越來越激烈的競爭。 製藥和生物技術行業的合併和收購可能會導致更多的資源集中在少數競爭對手手中。 規模較小的和其他處於早期階段的公司也可能成為重要的競爭對手,特別是通過與大型和成熟的公司的合作安排 。這些第三方在招聘和留住合格的科學、管理和商業人員方面與我們競爭,以及獲取補充或必要的技術,我們的計劃。
醫療保健政策、法律和法規的變化,包括 旨在降低醫療保健成本的立法措施,可能會影響我們獲得批准或商業化我們未來任何 候選產品(如果獲得批准)的能力。
All aspects of our business, including research and development, manufacturing, marketing, pricing, sales, litigation, and intellectual property rights, are subject to extensive legislation and regulation. Changes in applicable U.S. federal and state laws and agency regulation, as well as foreign laws and regulations, could have a materially negative impact on our business. In the United States and in some other jurisdictions, there have been a number of legislative and regulatory changes and proposed changes regarding the healthcare system that could prevent or delay marketing approval of our product candidates or any potential future product candidates of ours, restrict or regulate post-approval activities, or affect our ability to profitably sell any product candidates for which we obtain marketing approval. Increased scrutiny by the U.S. Congress of the FDA’s approval process may significantly delay or prevent marketing approval, as well as subject us to more stringent product labeling and post-marketing testing and other requirements. Congress also must reauthorize the FDA’s user fee programs every five years and often makes changes to those programs in addition to policy or procedural changes that may be negotiated between the FDA and industry stakeholders as part of this periodic reauthorization process. Congress most recently reauthorized the user fee programs in September 2022 without any substantive policy changes.
在美國 和其他地方的決策者和支付者中,有很大興趣促進醫療保健系統的變革,其既定目標是控制醫療保健成本,提高醫療保健質量和/或擴大醫療保健的可獲得性。在美國,製藥行業一直是這些努力的焦點 ,並受到重大立法舉措的重大影響。2010年3月,美國國會通過了ACA,它極大地改變了政府和私人保險公司為醫療保健提供資金的方式,並對美國製藥業產生了重大影響。 我們預計,ACA、醫療保險和醫療補助計劃的變更或增加,以及其他醫療改革措施 (特別是各州的醫療保健准入、融資或其他立法)導致的變更,可能會對美國的醫療保健行業產生重大的不利影響 。
《藥品供應鏈安全法》(DSCSA)將於2024年11月全面生效並適用,該法案對藥品製造商施加了與產品跟蹤和追蹤相關的義務。此外,在2022年2月,FDA發佈了擬議的法規,以修改各州對藥品批發分銷商許可的國家標準 ;為州許可的第三方物流供應商建立新的最低標準;並創建一個聯邦許可系統,以在沒有州計劃的情況下使用,每個計劃都由DSCSA授權。 還提出了其他立法和監管建議,以擴大藥品的批准後要求並限制銷售和促銷活動 。我們不確定是否會頒佈額外的立法變更,或是否會變更現行法規、 指南或解釋,或這些變更是否會對我們的業務產生任何影響。
Additionally, there has been heightened governmental scrutiny in the United States of biopharmaceutical pricing practices considering the rising cost of prescription drugs and biologics. Such scrutiny has resulted in several recent congressional inquiries and proposed and enacted federal and state legislation designed to, among other things, bring more transparency to product pricing, review the relationship between pricing and manufacturer patient programs, and reform government program reimbursement methodologies for products. For example, President Biden's Executive Order 14087, issued October 2022, called for CMS to prepare and submit a report to the White House on potential payment and delivery modes that would complement to IRA, lower drug costs, and promote access to innovative drugs. In February 2023, CMS published its report which described three potential models focusing on affordability, accessibility and feasibility of implementation for further testing by the CMS Innovation Center. As of February 2024, the CMS Innovation Center continues to test the proposed models and has started to roll out plans for access model testing of certain product types (e.g., cell and gene therapies) by states and manufacturers. At the state level, state legislatures are increasingly passing legislation and implementing regulations designed to control pharmaceutical pricing, including price or patient reimbursement constraints, discounts, restrictions on certain product access and marketing cost disclosure and transparency measures, and, in some cases, designed to encourage importation from other countries and bulk purchasing. In December 2020, the U.S. Supreme Court held unanimously that federal law does not preempt the states’ ability to regulate pharmaceutical benefit managers, or PBMs, and other members of the health care and pharmaceutical supply chain, an important decision that may lead to further and more aggressive efforts by states in this area. Then, in mid-2022, the Federal Trade Commission, or FTC, launched sweeping investigations into the practices of the PBM industry that could lead to additional federal and state legislative or regulatory proposals targeting such entities’ operations, pharmacy networks, or financial arrangements. In addition, in the last few years, several states have formed prescription drug affordability boards, or PDABs, with the authority to implement upper payment limits, or UPLs, on drugs sold in their respective jurisdictions. There are several pending federal lawsuits challenging the authority of states to impose UPLs, however.
| 25 |
| 《目錄》 |
最近,在2022年8月,拜登總統簽署了《2022年減少通貨膨脹法案》,或IRA。除其他外,IRA有多項條款,可能 影響銷售到醫療保險計劃和整個美國的藥品價格。從2023年開始,醫療保險B部分或D部分涵蓋的藥物或生物產品的 製造商必須向聯邦政府支付回扣,如果產品的 價格增長速度超過通貨膨脹率。此計算是根據藥品逐一計算的, 欠聯邦政府的回扣金額直接取決於Medicare Part B或 D支付的藥品數量。此外,從2026年付款年度開始,CMS將每年就選定數量的單一來源D部分藥物進行藥物價格談判, 沒有仿製藥或生物仿製藥競爭。CMS還將談判選定數量的B部分藥物的藥品價格,開始支付 2028年。倘CMS選擇藥物產品進行談判,預期該藥物產生的收益將減少。任何 額外的聯邦或州醫療改革措施都可能限制第三方支付者為未來醫療保健產品和服務支付的金額,進而可能大幅降低某些開發項目的預計價值,降低我們的盈利能力。
在美國以外,特別是在歐盟,處方藥和生物製劑的覆蓋狀況和定價受政府控制。 在這些國家/地區,在獲得產品的上市批准後,與政府機構進行定價談判可能需要相當長的時間 。此外,歐盟的要求可能有所不同。會員國。為了在某些國家獲得承保範圍和報銷或定價 批准,我們可能需要進行臨牀試驗,將候選產品 與其他可用療法的成本效益進行比較。如果我們的產品無法報銷,或在範圍或金額上受到限制,或者如果定價設置在不令人滿意的水平 ,我們的業務可能會受到損害。此外,在國家一級,已採取行動制定透明度和反贈與法(類似於美國醫師支付陽光法案),涉及製藥公司和醫療保健專業人員之間的支付。
我們當前或未來的候選產品可能無法獲得覆蓋範圍和充分的 報銷,這可能使我們難以盈利地銷售 (如果獲得批准)。
我們商業化的任何候選產品(如果獲得批准)的市場接受度和銷售將部分取決於第三方支付方(包括政府衞生管理部門、 管理式醫療組織和私人醫療保險公司)為這些產品和相關治療提供的補償 。 我們可能獲得監管部門批准的任何產品的覆蓋範圍和報銷狀態存在重大不確定性。第三方付款人決定他們將支付哪些治療費用,並確定報銷 水平。在美國,第三方支付人通常依賴Medicare保險政策和支付限制來設定自己的 保險和報銷政策。但是,有關 我們開發的任何候選產品的覆蓋範圍和報銷金額的決定將根據付款人的情況作出。 一個付款人決心為一種藥品提供保險並不能保證其他付款人也會為該藥品提供保險。此外, 第三方付款人決定為治療提供保險並不意味着將批准足夠的報銷率。 第三方付款人除了質疑其安全性和有效性外,還越來越多地挑戰價格,檢查醫療必要性,審查醫療產品、治療和服務的成本效益。除了獲得FDA批准所需的費用外,我們進行昂貴的 藥物經濟學研究以證明我們的候選產品的醫療必要性和成本效益可能會產生巨大的成本。我們的候選產品可能不被認為是醫學上必要的或具有成本效益的。
每個 付款人決定是否為治療提供保險,將為治療向製造商支付多少金額,以及 將被放置在其承保藥品清單或處方中的哪一層。支付者處方上的位置通常決定了患者獲得治療所需的最低自付金額,並可能強烈影響患者和醫生採用此類治療 。為其病情開出處方治療的患者和開出此類服務處方的提供者通常依賴第三方付款人來報銷全部或部分相關醫療費用。患者不太可能使用我們的產品, 提供商也不太可能開我們的產品處方,除非提供保險和報銷足以支付我們產品及其管理費用的很大一部分 。因此,承保範圍和足夠的報銷對於新醫療產品的接受度至關重要。
在美國,第三方付款人之間沒有統一的產品承保和報銷政策。因此,我們產品的承保範圍和報銷範圍因付款人而異。因此,從政府或 其他第三方付款人那裏獲得產品的承保和報銷審批是一個既耗時又昂貴的過程,這可能需要我們向每個付款人提供支持科學、臨牀 和成本效益的數據,以便逐個付款人使用我們的產品,但不能保證將獲得承保和充分的報銷 。即使我們獲得了特定產品的保險,由此產生的報銷付款率也可能不足以 我們實現或維持盈利能力,或者可能需要患者認為不可接受的高共付額。此外,第三方付款人 一旦獲得批准,可能不會覆蓋使用候選產品後所需的長期後續評估,也不會為這些評估提供足夠的補償。
| 26 |
| 《目錄》 |
美國醫療保健行業和其他地方的一個主要趨勢是成本控制。第三方付款人試圖通過限制特定藥物的承保範圍和報銷金額來控制成本。我們不能確保我們可能商業化的任何產品都可以獲得保險和報銷,如果可以報銷,報銷級別是多少。即使 如果我們獲得監管部門批准的一個或多個候選產品獲得了有利的承保範圍和報銷狀態,未來可能會實施不太有利的承保政策和報銷費率。承保範圍和報銷不充分可能會影響我們獲得上市批准的任何藥物的需求或價格。如果無法獲得保險和足夠的報銷, 或僅限於有限級別,我們可能無法成功地將我們當前和未來開發的任何候選產品進行商業化 。
我們受管理危險材料和其他廢物產品的使用、儲存、處理和處置的環境法律和法規的約束。
我們受有關使用、儲存、搬運和處置危險材料和其他廢物的環境法律和法規的約束。我們制定了健康和安全政策和程序,以評估與使用危險材料相關的風險,評估包括為員工提供有關如何使用這些物質以避免環境污染和意外暴露於自己及其同事的信息。儘管我們對這些材料的搬運和處置採取了預防措施,但我們不能消除意外污染或傷害的風險。如果發生危險廢物泄漏或其他事故,我們可能會承擔損害賠償、處罰或其他形式的譴責責任。 如果我們不遵守任何法律或法規,或者如果發生事故,我們可能需要支付鉅額罰款,並可能對由此導致的任何損害承擔責任。這一責任可能超出我們的財務資源,並可能損害我們的聲譽。我們還可能需要 為遵守當前或未來的環境法律法規而產生巨大的額外成本。我們未能遵守適用於我們實驗室和實驗室中使用的材料的任何政府法規,可能會對我們開發、生產、營銷或合作我們可能商業化或開發的任何產品的能力產生不利影響。
我們的員工、首席調查人員、顧問和商業合作伙伴可能從事不當行為或其他不當活動,包括不遵守監管標準和要求, 這可能會對我們的業務產生實質性的不利影響。
We are exposed to the risk of employee fraud or other misconduct by our employees, principal investigators, consultants and commercial partners. Misconduct by such parties could include intentional failures to comply with applicable regulations, provide accurate information to regulatory authorities, comply with manufacturing standards, comply with healthcare fraud and abuse laws and regulations, report financial information or data accurately, or disclose unauthorized activities to us. In particular, sales, marketing and business arrangements in the healthcare industry are subject to extensive laws and regulations intended to prevent fraud, kickbacks, self-dealing and other abusive practices. These laws and regulations may restrict or prohibit a wide range of pricing, discounting, marketing and promotion, sales commission, customer incentive programs and other business arrangements. Such misconduct could also involve the improper use of information obtained in the course of clinical trials, which could result in regulatory sanctions and serious harm to our reputation. We have adopted a Code of Business Conduct and Ethics, but it is not always possible to identify and deter employee misconduct, and the precautions we have taken to detect and prevent this activity may not be effective in controlling unknown or unmanaged risks or losses or in protecting us from governmental investigations or other actions or lawsuits stemming from a failure to be in compliance with such laws or regulations. If any such actions are instituted against us and we are not successful in defending ourselves or asserting our rights, those actions could have a significant impact on our business and results of operations, including the imposition of significant fines or other sanctions.
可能會發生意外的設施關閉或系統故障,我們的災難 恢復計劃可能不夠。
我們依賴性能、可靠性 和可用性的物業、機器和實驗室設備和信息技術系統。我們可能無法訪問 我們的設施,因為我們無法控制的事件,例如極端天氣條件、洪水、火災、盜竊、恐怖主義 和天災。
此外,我們 設備和/或系統的任何損壞或故障也可能導致我們的運營中斷。我們的信息技術 系統、或我們依賴的CRO和其他第三方的系統的全部或部分故障,或數據損壞,可能導致我們無法訪問 我們需要的信息,以履行我們對客户的義務,或違反我們或客户的專有信息的機密性。如果發生此類事件並導致我們的運營中斷,則可能會導致我們的藥物開發計劃受到嚴重破壞 。例如,已完成或正在進行的臨牀試驗中的臨牀試驗數據丟失可能導致 我們的監管審批工作延遲,並顯著增加我們恢復或複製數據的成本。我們的災難恢復 計劃可能無法充分解決每一個潛在事件,我們的保險單可能無法覆蓋全部或部分損失(包括 業務中斷導致的損失)或我們遭受的全部或根本損失。發生一個或多個此類事件 可能會對我們的業務、財務狀況、聲譽或前景造成重大不利影響,並可能導致索賠。
| 27 |
| 《目錄》 |
我們的業務可能會受到經濟狀況和當前經濟疲軟的不利影響。
全球、區域性 或我們運營所在的任何國家/地區的任何經濟衰退都可能對我們候選產品的需求產生不利影響。 A更長時間的經濟衰退可能導致我們的銷售額整體下降,限制我們產生利潤和正現金流的能力。我們預期提供產品的市場直接受到許多國家和國際因素 的影響,這些因素超出了我們的控制範圍,例如政治、經濟、貨幣、社交及其他因素。
我們的業務可能會受到政治事件、戰爭、 恐怖主義、業務中斷和其他地緣政治事件以及我們無法控制的不確定性的影響.
戰爭、恐怖主義、地緣政治不確定性 和其他業務中斷可能會造成損害,破壞或取消我們在全球或區域基礎上計劃進行的臨牀試驗 ,這可能會對我們的業務、臨牀研究中心或與我們有業務往來的供應商造成重大不利影響。此類事件還可能 降低患者參加我們臨牀試驗的需求,或使我們難以或不可能向我們的臨牀試驗機構提供產品和服務 。此外,領土入侵可能導致對公司(如我們)的網絡安全攻擊, 位於衝突區之外。如果由於地緣政治事件導致業務持續中斷,我們可能會導致 重大損失,需要大量恢復時間,並經歷重大支出,以恢復我們的業務或臨牀運行 。我們在俄羅斯或烏克蘭沒有業務,但我們不知道這些地緣政治 領域當前的不確定性(這些不確定性正在實時展開)是否會升級,並導致廣泛的經濟和安全狀況或醫療用品配給, 這可能會限制我們進行臨牀試驗的能力或對我們的業務造成重大影響。
我們面臨着在國際上做生意的風險。
我們過去一直在英國以外運營,未來也可能如此。這些國際業務在不同國家/地區運營時會面臨許多固有風險。這些風險包括但不限於以下風險:
| • | 貨幣匯率波動; |
| • | 對匯回收入的限制; |
| • | 在當地司法管轄區有效執行合同條款的困難;‘ |
| • | 國外知識產權(包括機密性)保護不足; |
| • | 公共衞生疫情或暴發,如新冠肺炎; |
| • | 貿易保護措施、進出口許可要求和罰款、處罰或暫停或取消出口特權;以及 |
| • | 特定國家或地區政治或經濟狀況的變化,包括聯合王國退出歐盟的影響。 |
任何此類事件或情況的發生都可能對我們在不同國家/地區增加或維持業務的能力產生不利影響。
我們面臨與貨幣匯率相關的風險。
我們目前在英國以外開展部分業務 。由於我們使用英鎊作為我們的財務報表報告貨幣,當我們的經營業績從 當地貨幣換算為英鎊時,貨幣匯率的變化已經並可能對我們的經營業績產生重大影響。當地貨幣和英鎊之間的匯率波動在幾個方面造成了 風險,包括以下方面:英鎊走弱,例如,在英國退歐公投結果之後,可能會增加海外研發費用的英鎊成本和在英國以外採購產品組件的成本;英鎊走強可能會降低我們以其他貨幣計價的收入 的價值;非英鎊交易和現金存款的匯率可能會扭曲我們的財務業績;商業 定價和利潤率受到貨幣波動的影響。未來貨幣匯率的變化可能會對我們的財務業績產生實質性的不利影響。
| 28 |
| 《目錄》 |
我們面臨網絡安全風險和其他網絡事件,包括我們的信息被盜用和其他可能導致中斷的信息安全漏洞,以及為將這些風險降至最低而產生的 成本。
在開展業務的正常過程中, 我們收集並存儲我們網絡上的敏感數據,包括知識產權、員工的個人信息、我們專有的 業務信息以及我們客户、供應商和業務合作伙伴的信息。儘管我們已採取安全措施,並且 我們未來可能實施的任何額外措施來保護我們的系統並緩解潛在的安全風險,但我們的設施和系統以及我們的第三方服務提供商的設施和系統可能容易受到安全漏洞、計算機病毒、丟失或錯放的數據、編程錯誤、人為錯誤、破壞公物的行為或其他事件。我們為阻止和緩解這些風險而採取的任何措施都可能不會成功 ,並可能導致成本增加。我們系統的任何中斷或安全漏洞或導致盜用、丟失或以其他未經授權的方式泄露機密信息的事件,無論是由我們直接還是由我們的第三方服務提供商造成的,都可能 損害我們的聲譽,導致成本,使我們面臨訴訟和責任的風險,導致監管處罰 根據保護個人信息隱私的法律,擾亂我們的業務或以其他方式影響我們的運營結果。
我們在努力遵守不斷變化的全球數據保護法律和法規的過程中可能會產生鉅額成本,而我們未能或被認為未能遵守此類法律和法規 可能會損害我們的業務和運營。
我們 維護大量敏感信息,包括與進行臨牀試驗相關的機密業務和個人信息以及與我們的員工相關的信息,我們受管理此類信息的隱私和安全的法律法規的約束。在美國,有許多管理個人信息收集、使用、披露和保護的聯邦和州隱私和數據安全法律法規,包括聯邦和州健康信息隱私法、聯邦和州安全違規通知法以及聯邦和州消費者保護法。隱私和數據保護的立法和監管格局 繼續發展,隱私和數據保護問題受到越來越多的關注,包括監管執法和私人訴訟方面的問題,這可能會影響我們的業務,預計會增加我們的合規成本和責任風險。在美國,許多聯邦和州法律法規可能適用於我們的業務或我們合作伙伴的業務,包括州數據泄露通知法、州健康信息隱私法以及聯邦和州消費者保護法律和法規,這些法律和法規管理與健康相關的個人信息和其他個人信息的收集、使用、披露和保護 。此外,我們可能會從受HIPAA隱私和安全要求約束的第三方(包括我們 從其獲得臨牀試驗數據的研究機構)獲取健康信息,HIPAA經HITECH及其頒佈的法規 修訂。根據事實和情況,如果我們以未經HIPAA授權或允許的方式獲取、使用或披露,或者 受到有關個人可識別健康信息的實際或據稱的數據泄露,我們可能會受到重大處罰。
此外,美國多個州已經頒佈了 隱私和安全法律法規,這些法律法規因州而異,不斷演變,並且 會發生重大變化。在某些情況下,此類法律和法規可能會施加比HIPAA和其他美國聯邦法律更嚴格的要求,從而使合規工作複雜化。例如,加利福尼亞州和弗吉尼亞州已經頒佈了重要的隱私法,給予 這些州的居民更多的訪問和刪除其個人信息、選擇退出某些個人信息共享、 以及接收關於如何使用其個人信息的詳細信息的權利。不遵守這些州隱私法可能導致 的處罰並出現未解決的合規問題。此外,還可能制定美國聯邦隱私法。 美國州或聯邦隱私法數量的不斷變化可能會增加我們的合規成本和潛在責任。其他州也在考慮類似的 數據隱私和安全法案,這些法案可能在未來頒佈。除了可能因未能遵守州法律而受到的罰款和處罰外,某些州還規定了濫用或未經授權訪問個人信息的患者的私人訴訟權。
In the European Union, the General Data Protection Regulation (EU) 2016/679, or GDPR, lays down the legal framework for data protection and privacy. The GDPR applies directly in all European Union member states (until December 31, 2020, this included the United Kingdom) and applies to companies with an establishment in the European Economic Area, or EEA, and to certain other companies not in the EEA that offer or provide goods or services to individuals located in the EEA or monitor the behavior of individuals located in the EEA. In the United Kingdom, the GDPR has been converted into United Kingdom domestic law, pursuant to the Data Protection, Privacy and Electronic Communications (Amendments etc.) (EU Exit) Regulations 2019 (as amended), which makes some minor technical amendments to ensure the GDPR is operable in the United Kingdom, or the UK GDPR. The UK GDPR is also supplemented by the Data Protection Act 2018. United Kingdom and European Union data protection law is therefore aligned. The GDPR and UK GDPR implement stringent operational requirements for controllers of personal data, including, for example, expanded disclosures about how personal information is to be used, limitations on retention of information, increased requirements pertaining to health data and pseudonymized (i.e., key-coded) data, increased cyber security requirements, mandatory data breach notification requirements and higher standards for controllers to demonstrate that they have obtained a valid legal basis for certain data processing activities. The GDPR provides that European Union member states may make their own further laws and regulations in relation to the processing of genetic, biometric or health data, which could result in differences between member states, limit our ability to use and share personal data or could cause our costs to increase, and harm our business and financial condition.
| 29 |
| 《目錄》 |
GDPR還規範了將受GDPR約束的個人數據傳輸到所謂的第三國,歐盟委員會尚未發現這些國家提供適當的 數據保護水平。從2020年開始,歐洲的法律發展已經給此類轉讓帶來了複雜性和不確定性。 例如,2020年7月16日,歐洲聯盟法院(CJEU)通過所謂的 施雷姆二世判決,歐盟—美國隱私盾框架(U.S. Privacy Shield Framework)或隱私盾,根據該框架,個人數據可以從 EEA傳輸到已根據隱私盾計劃進行自我認證的美國實體。然而,2023年7月10日,歐盟委員會通過了一項充分性決定,建立一個新的機制,將數據從歐盟轉移到美國—歐盟—美國數據 隱私框架,該框架為歐盟提供個人擁有多項新權利,包括訪問其數據的權利,或獲得 更正或刪除不正確或非法處理的數據的權利,並允許美國公司向美國商務部自我證明其遵守了一套商定的隱私原則,以自由接收歐盟。個人數據.在作出充分性決定之前, 簽署了一項行政命令,引入了新的具有約束力的保障措施,以解決《公約》中提出的問題。 Schrems II判斷值得注意的是, 新的義務旨在確保美國情報機構只能在必要和適當的範圍內訪問數據,並建立一個獨立和公正的補救機制,以處理歐洲人關於出於國家安全目的收集其 數據的投訴。歐盟委員會將繼續審查美國的事態發展及其充分性決定。此外,2021年6月,歐盟委員會發布了一項決定,該決定將於2025年6月27日結束, 沒有采取進一步行動,即英國確保對根據歐盟傳輸的個人數據提供適當的保護。歐盟的GDPR去英國。如果出現影響適用管轄區 保護水平的事態發展,則可以調整或甚至撤銷無國籍決定。
未能 遵守歐盟法律,包括違反GDPR和英國GDPR、2018年數據保護法、電子隱私指令和其他與個人數據安全相關的法律,可能導致高達2000萬歐元的罰款(或英國GDPR下的1750萬英鎊)或 上一個財政年度全球年營業額總額的4%,如果更大,以及其他行政處罰,包括 刑事責任,這些處罰可能是繁重的,並對我們的業務、財務狀況、經營業績和前景造成不利影響。 GDPR還賦予數據主體和消費者協會一項私人訴訟權,可以向監管機構提出投訴,尋求司法救濟,並獲得因違反GDPR而造成的損害賠償。此外,GDPR 還包括對跨境數據傳輸的限制。 不遵守GDPR和相關 法律可能導致數據主體和消費者非營利組織提起私人訴訟的風險增加,包括GDPR下提供的新形式 集體訴訟。 雖然我們不定期處理或處理個人數據,但我們維護員工信息數據庫 ;然而,與GDPR和英國GDPR不合規相關的潛在風險難以預測。
我們將來可能無法留住和招募到合格的 科學家,y高管和董事、關鍵員工或關鍵顧問可能會延誤我們的發展 工作或以其他方式損害我們的業務。
我們的未來發展和前景 在很大程度上取決於我們高級管理團隊(包括我們的董事會成員)的經驗、表現和持續服務。我們已投資於各級管理團隊。我們已與董事和 高級管理團隊訂立合同安排,目的是確保他們每個人的服務。但是,無法保證保留這些服務或確定合適的替代品 。無法保證現任董事和高級管理層 團隊的服務將得到保留,或能夠確定和僱用具有適當技能和合格的人員,這可能會對我們 開發技術和/或在客户要求的時間提供服務的能力或我們營銷服務和技術的能力以及以其他方式發展業務的能力產生不利影響,可能會受損任何董事或高級管理團隊其他成員 的服務損失以及招聘替代人員的成本可能會對我們以及我們的商業和 財務表現產生重大不利影響。
也無法保證繼續吸引和留住具有適當專業知識和技能的 員工的能力。尋找和僱用任何額外的人員和替換人員 可能會花費高昂的費用,並且可能需要我們授予重大的股權獎勵或其他獎勵性補償,這可能會對 我們的財務業績產生不利影響,並且無法保證我們將有足夠的財務資源來這樣做。有效的產品開發 和創新是我們的成功所依賴的,反過來又取決於吸引和留住有才能的技術和科學人才 ,他們是我們的重要資產,是我們技術和產品創新的源泉。如果我們無法 及時僱用、培訓和留住此類人員,我們產品的開發和引進可能會被推遲,我們銷售產品和以其他方式發展業務的能力將受到損害,這種延遲和無能可能會對 我們的業績產生不利影響。
| 30 |
| 《目錄》 |
2020年,Secura Bio終止了與帕比司他有關的許可協議, 是我們MTX110產品中的活性藥物成分。因此,我們認為,相關 Secura Bio專利可能會推遲MTX 110的上市,這可能會對我們的業務、財務狀況和運營結果 產生重大不利影響。
We entered into a License Agreement, executed on or about June 6, 2017, or the License Agreement, by and between Biodexa Ltd (formerly known as Midatech Ltd) and Novartis AG, or Novartis, which Novartis subsequently transferred to Secura Bio, or the Secura License Agreement. Pursuant to the Secura License Agreement, Biodexa Ltd was granted a worldwide, sublicensable license to certain patents of panobinostat, the active pharmaceutical ingredient of our development product MTX110. Biodexa Ltd’s rights are limited to the treatment of brain cancer in humans, administered by convection-enhanced delivery. We received a letter dated June 1, 2020, sent on behalf of Secura Bio purporting to terminate the Secura License Agreement “effective immediately,” the reason specified being that we were proposing to liquidate the Company. Despite our assurances to the contrary, and despite our repeated requests that Secura Bio withdraw its termination, Secura Bio reaffirmed the termination and reasons therefor and the agreement was thus terminated. We received a further letter sent on behalf of Secura Bio dated May 21, 2021 purporting to terminate the Secura License Agreement a second time for alleged material breaches of the agreement, and demanding a non-exclusive, fully paid-up, royalty-free, perpetual license to our MTX110 intellectual property. This demand was refused based upon, among other things, Secura Bio’s previous termination of the License Agreement in 2020.
我們將MTX 110視為一項重要資產, 目前正在進行兩項MTX 110臨牀試驗,並可能會在MTX 110臨牀計劃的一部分開展進一步的臨牀試驗。 雖然我們繼續享有將帕比司他用於研究目的的自由,並且我們計劃繼續開發MTX 110,但 我們認為,如果MTX 110獲得加速 用於DMG患者的批准,相關Secura Bio專利可能會推遲MTX 110在DMG患者中的上市。然而,我們預計這不會對在多發性膠質母細胞瘤患者中使用MTX 110產生任何影響。如果我們在專利到期前無法推出候選產品,則可能會對我們的業務、 財務狀況和運營結果造成重大不利影響。
此外,如果Secura Bio繼續幹擾 我們正在進行的業務,包括質疑終止Secura許可協議的合法性,則不確定性 以及相關時間和資源的轉移可能會對我們的業務、財務狀況和前景產生重大不利影響, 我們無法向您保證我們將成功解決此類爭議。
與全球公共衞生問題有關的風險
公共衞生危機(如COVID—19大流行)已經 並可能在未來對我們的業務產生負面影響。
Pandemics or disease outbreaks, such as the COVID-19 pandemic, have created and may continue to create significant volatility, uncertainty and economic disruption in the markets we operate in and may negatively impact business and healthcare activity globally. In response to the COVID-19 pandemic, governments around the world imposed measures designed to reduce the transmission of COVID-19 and individuals continue to respond to the fear of contracting COVID-19. It is not possible to accurately predict the extent of the adverse effects of the pandemic on our business. However, we have experienced certain impacts and may experience others which, if they continue for an extended period of time, could have material adverse effects on our operations and the execution of our business plans. For example, we experienced some delays in our clinical trials, in particular our Phase I trials of MTX110 in DMG at Columbia University and in medulloblastoma at the University of Texas. Individuals defer seeking treatment, physicians have fewer in-person meetings to recruit and enroll patients, and recruited patients are hindered by restrictions in traveling to and accessing clinical sites. In addition, resources at hospitals have been diverted to dealing with the pandemic, causing delays in scheduling screening evaluations, implant procedures, and follow-up monitoring visits. As a result of the foregoing factors, the expected timeline for data readouts of our clinical trials may be negatively impacted, which would adversely affect our business.
| 31 |
| 《目錄》 |
對暴露於COVID—19、新變種、疾病爆發、流行病或類似廣泛健康問題的恐懼或實際影響 影響我們業務的程度將取決於未來的發展,這些發展高度不確定,無法有信心地預測,例如 疾病的地理傳播速度和範圍、疫情持續時間、旅行限制,疫苗接種 和治療的有效性;對美國、英國和國際醫療體系、美國、英國經濟 和全球經濟的影響;美國、英國和國際政府應對措施的時機、範圍和有效性;以及 對我們員工的健康、福祉和生產力的影響。在COVID—19大流行對我們的業務 和財務業績造成不利影響的情況下,它還可能加劇本"風險因素" 部分中描述的許多其他風險。
與我們的知識產權有關的風險
我們的成功在一定程度上取決於我們保護知識產權的能力,這是無法保證的。
我們的成功和有效競爭的能力 在很大程度上取決於對我們內部開發的或已獲得 或已獲得許可的專有技術和產品的利用。迄今為止,我們一直依賴版權、商標和商業祕密法,以及保密程序、非競爭 和/或僱傭勞動發明轉讓協議和與我們的員工、顧問、承包商、客户 和供應商的許可協議,以建立和保護我們對我們技術的權利,並儘可能控制我們技術、軟件的訪問和分發 ,文檔和其他專有信息,所有這些都只提供有限的保護。在 根據我們的協議我們有權這樣做的情況下,我們通過在美國、 和世界各地提交與我們的新技術和產品有關的專利申請來保護我們的專利地位,這些技術和產品對我們的業務非常重要。生物技術和製藥公司的專利地位 通常是高度不確定的,涉及複雜的法律和事實問題,並且 近年來一直是許多訴訟的主題。因此,我們 專利(包括由第三方授權給我們的專利權)的頒發、範圍、有效性、可轉讓性和商業價值具有高度的不確定性。無法保證:
| • | 我們的專利範圍提供並將為我們提供關於我們的任何或所有 候選產品和技術的排他性,以及通過不同方式解決與我們的技術 和候選產品相同問題的任何其他技術和/或產品,無論其方式是否與我們相同; |
| • | 待決或將來的專利申請將以專利的形式頒發; |
| • | 我們的專利和/或我們獲得許可的那些專利現在並將繼續有效和可執行 ,並且不會受到無效或撤銷程序的約束,並且此類程序不會導致權利的全部或部分喪失 ; |
| • | 我們不時利用專利的權利(包括僅以我們的名義 或我們的附屬公司的名義或以我們或附屬公司和第三方的聯名名義註冊的專利,或授權給我們的專利)足以保護我們的核心知識產權,不受第三方的侵害,我們的商業活動免受競爭 或全面支持我們現在或將來開發和銷售我們擬議產品的能力; |
| • | 缺乏任何特定專利或使用任何特定專利的權利,以及我們專利的範圍, 不會對我們開發和營銷我們擬議候選產品的能力產生重大不利影響,無論是現在還是將來; |
| • | 我們有或將有資源追究任何侵權者:(i)不時以我們的名義註冊的專利(無論 單獨或與第三方聯合註冊);或(ii)授權給我們的專利,而我們或關聯公司有財務責任 根據相關許可協議提起此類侵權訴訟; |
| • | 我們將單獨或與第三方聯合開發可申請專利的技術或產品候選產品; |
| • | 不時以我們名義註冊的任何專利的所有權、範圍或有效性(單獨或共同)不會受到第三方的質疑,包括與我們或任何關聯公司達成合作 項目或共同所有權安排的各方,且任何此類質疑都不會成功; |
| • | 我們單獨或共同擁有的任何專利或專利申請不會因 我們未能識別正確的發明人或我們未能遵守向美國專利商標局或外國司法管轄區任何具有披露要求的同等機構披露的義務而受到質疑; |
| 32 |
| 《目錄》 |
| • | 任何以我們的單獨或聯名名義發佈的專利將不會在一個或多個授予後程序中受到質疑,包括但不限於 各方間審查、派生程序、干涉等;任何 此類質疑不會導致此類已發佈專利的權利的全部或部分喪失; |
| • | 以我們單獨或聯名名義提出的任何專利申請不會受到任何第三方的反對, 包括與我們或其任何成員的合作、共存和任何其他合同關係的各方; |
| • | 我們與第三方之間的許可協議在將來有效並將有效 或直至其到期日,並且我們已遵守了許可協議項下的合同義務; |
| • | 根據我們與第三方之間的合作協議而產生或已經產生的所有能夠商業化的知識產權將被識別或已經被識別; |
| • | 根據合作協議生成的、我們享有合同 權利的或由員工生成的所有知識產權均已合法轉讓給我們的唯一名稱(或我們的子公司); |
| • | 關於根據我們和 第三方之間合作協議(我們和第三方享有共同合同權利)生成的所有知識產權,此類知識產權已被合法 分配為聯名名稱,且我們和第三方之間的權利受到共同所有權協議的適當監管;以及 |
| • | 除合同保證外,知識產權的授權人向我們或我們的關聯公司擁有 相關專利,並且這些專利沒有也不會成為或受到侵權、無效或撤銷 訴訟的對象。 |
我們為保護我們的所有權而採取的步驟 可能不足以防止在英國和美國境內或境外對我們的所有權信息的盜用或對我們知識產權的侵犯。根據我們當前發佈的任何專利已經授予的權利 以及根據未來發布的專利可能授予的權利可能無法為我們提供我們正在尋求的專利保護或競爭優勢 。如果我們無法獲得並維持對我們的技術和產品的專利保護,或者如果所獲得的專利保護的範圍不充分,我們的競爭對手可能會開發和商業化與 類似或優於我們的技術和產品,我們成功商業化技術和產品的能力可能會受到不利影響。
With respect to patent rights, we do not know whether any of the pending patent applications for any of our licensed compounds will result in the issuance of patents that protect our technology or products, or which will effectively prevent others from commercializing competitive technologies and products. Although we have a number of issued patents covering our technology, our pending applications cannot be enforced against third parties practicing the technology claimed in such applications unless and until a patent issues from such applications. Further, the examination process may require us to narrow the claims, which may limit the scope of patent protection that may be obtained. Because the issuance of a patent is not conclusive as to its inventorship, scope, validity or enforceability, issued patents that we own or have licensed from third parties may be challenged in the courts or patent offices in the European Union, United Kingdom, the United States and other foreign jurisdictions. Overall, such challenges may result in the loss of patent protection, the narrowing of claims in such patents, or the invalidity or unenforceability of such patents, which could limit our ability to stop others from using or commercializing similar or identical technology and products, or limit the duration of the patent protection for our technology and products. Protecting against the unauthorized use of our patented technology, trademarks and other intellectual property rights is expensive, difficult and may in some cases not be possible. In some cases, it may be difficult or impossible to detect third party infringement or misappropriation of our intellectual property rights, even in relation to issued patent claims, and proving any such infringement may be even more difficult.
The patent prosecution process is expensive and time-consuming, and we may not be able to file and prosecute all necessary or desirable patent applications at a reasonable cost or in a timely manner. It is also possible that we will fail to identify patentable aspects of inventions made in the course of our development and commercialization activities before it is too late to obtain patent protection on them. Further, given the amount of time required for the development, testing and regulatory review of new product candidates, patents protecting such candidates might expire before or shortly after such candidates are commercialized. We expect to seek extensions of patent terms where they are available in any countries where we are prosecuting patents. However, the applicable authorities, including the FDA in the United States, and any equivalent regulatory authority in other countries, may not agree with our assessment of whether such extensions are available, and may refuse to grant extensions to our patents, or may grant more limited extensions than we request. If this occurs, our competitors may be able to take advantage of our investment in development and clinical trials by referencing our clinical and preclinical data and launch their product earlier than might otherwise be the case. Changes in either the patent laws or interpretation of the patent laws in the European Union, the United Kingdom, the United States and other countries may diminish the value of our patents or narrow the scope of our patent protection. The laws of foreign countries may not protect our rights to the same extent as the laws of the United Kingdom or the United States, and these foreign laws may also be subject to change. Publication of discoveries in the scientific literature often lag behind the actual discoveries, and patent applications typically are not published until 18 months after filing or, in some cases, not at all. Therefore, we cannot be certain that we were the first to make the inventions claimed in our owned or licensed patents or pending patent applications, or that we were the first to file for patent protection of such inventions.
| 33 |
| 《目錄》 |
以前,在美國,假設 滿足專利性的其他要求,第一個發明的人有權獲得專利。在美國以外 ,首先提交專利申請的人有權獲得專利。2013年3月,美國過渡到“先申請”制度,在該制度中,第一個提交專利申請的發明人將有權獲得專利。在以前的 或當前的制度下,第三方將被允許在美國專利和 商標局頒發專利之前提交現有技術,並且可能會捲入對 我們的專利權或他人的專利權提出異議、派生、複審、各方間審查或干涉訴訟。任何此類提交、訴訟或訴訟中的不利決定可能會減少 我們的專利權的範圍或使其無效,這可能會對我們相對於第三方的競爭地位產生不利影響。
我們的商業成功部分取決於我們不侵犯他人擁有的知識產權。
Although we believe that we have proprietary platforms for our technologies and product candidates, we cannot determine with certainty whether any existing third party patents or the issuance of any third party patents in the future would require us to alter our technology, obtain licenses or cease certain activities. We may become subject to claims by third parties that our technology infringes their intellectual property rights, in which case we will have no option other than to defend the allegation, which may be possible to resolve through negotiation or which might result in court proceedings. An adverse outcome in any of these circumstances is that we might be subject to significant liabilities, be required to cease using a technology or to pay license fees (both prospectively and retrospectively); and may be subject to the payment of significant damages. We could incur substantial costs in any litigation or other proceedings relating to patent rights, even if it is resolved in our favor. If the proceedings occur in the United States, it is likely that we will be responsible for our own legal costs, no matter the outcome of the litigation. In contrast, in the United Kingdom, the losing party typically is ordered to pay the winning party’s costs, although it is rare to have a complete recovery of all costs from the losing side. Some of our competitors may be able to sustain the costs of complex litigation more effectively or for a longer time than we can because of their substantially greater resources. In addition, uncertainties or threatened or actual disputes relating to any patent, patent application or other intellectual property right (including confidential information) could have a material adverse effect on our ability to market a product, enter into collaborations in respect of the affected products, or raise additional funds.
對未經授權使用我們的 專利技術和候選產品進行監管既困難又昂貴。我們無法保證我們採取的措施將防止 盜用或防止未經授權的第三方獲得或使用我們所依賴的技術、專門知識和產品。 此外,在某些司法管轄區,有效的保護可能無法提供或受到限制。任何盜用我們的專有技術、 候選產品和知識產權的行為都可能對我們的業務和經營成果產生負面影響。 將來可能需要提起訴訟,以執行或保護我們的權利,或確定他人所有權的有效性或範圍。訴訟 可能導致我們產生大量成本,並分散資源和管理層的注意力,無法保證任何此類訴訟的結果。此外,任何此類訴訟中的被告可能會對我們提出反訴,從而導致 額外的時間和費用來對此類反訴進行抗辯,而抗辯可能不會成功。
我們可能會捲入訴訟以保護或執行我們的知識產權,這可能是昂貴的、耗時的和不成功的。
Competitors may infringe on our patents or misappropriate or otherwise violate our intellectual property rights. To counter infringement or unauthorized use, litigation may be necessary in the future to enforce or defend our intellectual property rights, to protect our trade secrets or to determine the validity and scope of our own intellectual property rights or the proprietary rights of others. This can be expensive and time consuming. Many of our current and potential competitors have the ability to dedicate substantially greater resources to defend our intellectual property rights than we can. Accordingly, despite our efforts, we may not be able to prevent third parties from infringing upon or misappropriating our intellectual property. Litigation could result in substantial costs and diversion of management resources, which could harm our business and financial results. In addition, in an infringement proceeding, a court may decide that a patent owned by or licensed to us is invalid or unenforceable, or may refuse to stop the other party from using the technology at issue on the grounds that our patents do not cover the technology in question. An adverse result in any litigation proceeding could put one or more of our patents at risk of being invalidated, held unenforceable or interpreted narrowly. Furthermore, because of the substantial amount of discovery required in connection with intellectual property litigation, there is a risk that some of our confidential information could be compromised by disclosure during this type of litigation.
第三方可能會提起法律訴訟,聲稱我們侵犯了他們的知識產權,訴訟結果不確定,並可能對我們的業務成功造成重大不利影響 。
Our commercial success depends upon our ability and the ability of our collaborators and licensing partners to develop, manufacture, market and sell our product candidates, and to use our proprietary technologies without infringing the proprietary rights of third parties. We may become party to, or threatened with, future adversarial proceedings or litigation regarding intellectual property rights with respect to our products and technology. Third parties may assert infringement claims against us based on existing patents or patents that may be granted in the future. If we are found to infringe a third party’s intellectual property rights, we could be required to obtain a license from such third party to continue developing and commercializing our products and technology. However, we may not be able to obtain any required license on commercially reasonable terms or at all. Even if we are able to obtain a license, it may be non-exclusive, thereby giving our competitors access to the same technologies licensed to us. We could be forced, including by court order, to cease commercializing the infringing technology or product. In addition, in any such proceeding or litigation, we could be found liable for monetary damages. A finding of infringement could prevent us from commercializing our product candidates or force us to cease some of our business operations, which could materially harm our business. Any claims by third parties that we have misappropriated our confidential information or trade secrets could have a similar negative impact on our business.
| 34 |
| 《目錄》 |
我們可能會被指控員工錯誤地使用或泄露 其前僱主的所謂商業機密。
我們的許多員工,包括我們的高級 管理人員,以前曾受僱於其他生物技術或製藥公司。其中一些員工,包括 我們的高級管理層成員,在之前的僱傭合同中執行了所有權、保密和非競爭協議。 雖然我們努力確保我們的員工不在為我們工作中使用他人的專有信息或專有技術,但我們可能 會受到聲稱我們或這些員工使用或披露任何此類員工前僱主的知識產權(包括商業祕密或其他專有信息)的指控。我們不知道有任何與這些事項有關的威脅或未決索賠 或與我們的高級管理層的協議,但將來可能需要提起訴訟以抗辯此類索賠。 如果我們未能為任何此類索賠辯護,除了支付金錢損失外,我們還可能失去寶貴的知識產權或 人員。即使我們成功地為此類索賠進行了辯護,訴訟也可能導致大量費用,並可能分散管理層的注意力。
如果我們無法保護商業機密的機密性,我們的業務 和競爭地位可能受到損害。
In addition to seeking patents for some of our technology and product candidates, we also rely on trade secrets, including unpatented know-how, technology and other proprietary information, to maintain our competitive position. We seek to protect these trade secrets, in part, by entering into non-disclosure and confidentiality agreements with parties who have access to them, such as our employees, corporate collaborators, outside scientific collaborators, contract manufacturers, consultants, advisors and other third parties. We also enter into confidentiality and invention or patent assignment agreements with our employees and consultants. Despite these efforts, any of these parties may breach the agreements and disclose our proprietary information, including our trade secrets, and we may not be able to obtain adequate remedies for such breaches. In addition, a court may determine that we failed to take adequate steps to protect our trade secrets, in which case it may not be possible to enforce our trade secret rights. Enforcing a claim that a party illegally disclosed or misappropriated a trade secret is difficult, expensive and time-consuming, and the outcome is unpredictable. In addition, some may be less willing or unwilling to protect trade secrets. If any of our trade secrets were to be lawfully obtained or independently developed by a competitor, we would have no right to prevent such competitor from using that technology or information to compete with us, which could harm our competitive position.
我們可能會面臨潛在的產品責任,而且,如果 對我們提出索賠成功,我們可能會承擔大量責任和費用。如果使用我們的候選產品損害了患者或被 認為損害了患者,即使這種損害與我們的候選產品無關,我們的監管批准可能會被撤銷或 受到負面影響,我們可能會面臨代價高昂且損害性較大的產品責任索賠。
在開展我們的活動時,我們可能 面臨合同和法定索賠,或客户、供應商和/或投資者的其他類型索賠。此外,我們還面臨 產品研發、生產和供應過程中固有的潛在產品責任風險。入組 我們臨牀試驗的受試者、消費者、醫療保健提供者或使用或銷售基於我們和我們合作者 技術的產品的其他人員,可能能夠基於使用此類產品向我們提出索賠。如果我們不能成功地為自己辯護 任何商業化的候選產品造成傷害的索賠,我們可能會產生大量的成本和責任。無論其是非曲直或實際結果如何,責任索賠可能導致:
| • | 對我們可能開發的任何候選產品的需求減少; |
| • | 臨牀試驗參與者的退出; |
| • | 終止臨牀試驗; |
| • | 嚴重的負面媒體關注和損害我們的聲譽; |
| • | 相關訴訟的鉅額抗辯費用; |
| • | 對試驗對象或患者給予鉅額金錢獎勵; |
| • | 收入損失; |
| 35 |
| 《目錄》 |
| • | 從我們的業務運營中分流管理和科學資源;以及 |
| • | 無法將我們可能開發的任何產品商業化。 |
雖然我們獲得了產品責任 保險,但我們的保險範圍可能不足以涵蓋我們的全部產品責任相關費用或損失,並且可能無法涵蓋 我們可能遭受的任何費用或損失。此外,保險範圍正變得越來越昂貴,將來,我們可能無法 以合理的成本、足夠的金額或足夠的條款維持保險範圍,以保護我們免受因產品責任而造成的損失 。如果我們確定增加產品責任是謹慎的,我們可能無法獲得這種增加的 產品責任保險,或根本無法獲得商業上合理的條款。在集體訴訟或個人 訴訟中,基於具有意外副作用的藥物(包括可能比我們產品的副作用更輕的副作用)做出了重大判決。 A成功的產品責任索賠或針對我們的一系列索賠可能導致普通股和/或存託 股票的價格下跌,如果判斷超出我們的保險範圍,可能會減少我們的現金,並對我們的業務、 經營業績、財務狀況和前景造成重大不利影響。
與我們與第三方的關係相關的風險
我們依賴第三方進行臨牀前和 臨牀試驗。如果這些第三方未能成功履行其合同職責或在預期期限內完成,我們可能無法 獲得監管部門的批准或將我們的候選產品商業化,我們的業務可能會受到嚴重損害。
We are, and may continue to be, reliant on other parties for the successful development and commercialization of many of our product candidates. We rely upon CROs and clinical investigators for the conduct of our clinical trials and upon contract laboratories for execution of our preclinical studies, and we control only certain aspects of their activities. Nevertheless, we are responsible for ensuring that each of our studies and trials is conducted in accordance with the applicable protocol and legal, regulatory and scientific standards, and our reliance on the CROs or collaboration partners does not relieve us of our regulatory responsibilities. We also rely on third parties to assist in conducting our preclinical studies in accordance with good laboratory practices, or GLP, and requirements with respect to animal welfare. We and our CROs or collaboration or licensing partners are required to comply with GCP, which are regulations and guidelines enforced by the MHRA, the FDA, the EMA and comparable foreign regulatory authorities for all of our products in clinical development. Regulatory authorities enforce GCP regulations, and other regulations applicable to clinical trials and investigational drug or biological products, through periodic inspections of trial sponsors, CROs, principal investigators and trial sites. If we or any of our CROs or partners fail to comply with applicable GCP regulations or other clinical trial regulations, the data generated in our clinical trials may be deemed unreliable and the EMA, the MHPA, the FDA or comparable foreign regulatory authorities may require us to perform additional clinical trials before approving our marketing applications. We cannot be assured that upon inspection by a given regulatory authority, that such regulatory authority will determine that any of our clinical trials comply with GCP requirements or other applicable regulations. In addition, our clinical trials must be conducted with product produced under cGMP requirements. Failure to comply with these regulations may require us to repeat preclinical and clinical trials, which would delay the regulatory approval process.
我們的CRO和其他承包商或協作者 不是我們的員工,除了根據與此類CRO達成的此類協議向我們提供的補救措施外,我們無法控制他們是否將足夠的時間和資源用於我們正在進行的或未來的臨牀或非臨牀項目(視情況而定)。如果CRO未能成功地 履行其合同職責或義務,或未能在預期期限內完成,或者如果他們獲得的臨牀數據的質量或準確性因未能遵守我們的臨牀方案、法規要求或其他原因而受到影響,則我們的臨牀 試驗可能會被延長、推遲或終止,我們可能無法獲得監管機構對我們的候選產品的批准或成功將其商業化。因此,我們的運營結果和候選產品的商業前景將受到損害,我們的成本可能會增加,我們的創收能力可能會被推遲。
如果我們與這些第三方 的任何關係終止,我們可能無法以商業上合理的條款或完全終止與其他第三方達成安排。與其他CRO、臨牀試驗調查員或其他第三方達成安排涉及額外成本,並且需要管理重點和時間,此外還要求新CRO、臨牀試驗調查員或其他第三方開始工作時有一段過渡期。如果第三方未能成功履行其合同職責或義務或未能在預期期限內完成, 如果他們需要更換,或者如果他們獲得的臨牀數據的質量或準確性因未能遵守我們的臨牀方案、法規要求或其他原因而受到影響,則與此類第三方相關的任何臨牀試驗可能會 被延長、推遲或終止,我們可能無法為我們的候選產品獲得市場批准或成功商業化。因此,我們認為我們的財務業績和我們候選產品的商業前景將受到損害,我們的成本可能會增加,我們的創收能力可能會被推遲。
由於我們一直依賴第三方, 我們執行這些功能的內部能力有限。外包這些職能涉及第三方可能無法按照我們的標準執行 、可能無法及時產生結果或根本無法執行的風險。此外,使用第三方服務提供商 要求我們向這些各方披露我們的專有信息,這可能會增加該信息被盜用的風險。我們目前的員工數量很少,這限制了我們可用於識別和 監控第三方供應商的內部資源。如果我們未來無法識別併成功管理第三方服務提供商的績效,我們的業務可能會受到不利影響。儘管我們謹慎地管理與CRO的關係,但不能保證我們在未來不會遇到類似的挑戰或延誤,或者這些延誤或挑戰不會對我們的業務、財務狀況和前景產生實質性的不利影響。
| 36 |
| 《目錄》 |
我們依賴第三方生產我們的候選產品,我們預計將繼續依賴第三方提供我們候選產品的臨牀以及未來的任何商業供應 和其他未來的候選產品。如果任何此類第三方未能向我們提供足夠的臨牀或商業 數量的此類候選產品或產品,未能以可接受的質量水平或價格這樣做,或未能達到或維持令人滿意的法規遵從性,則我們當前和未來候選產品的開發以及任何已獲批准的產品的商業化可能會被停止、延遲或利潤下降。
我們目前沒有,也沒有計劃在內部建立基礎設施或能力來製造當前候選產品或任何未來候選產品 用於進行我們的臨牀試驗或(如果獲得批准)用於商業供應。我們依賴並預計將繼續依賴合同 製造組織或CMO。與我們自己生產候選產品相比,依賴第三方承包商可能會使我們面臨更大的風險。儘管我們與CMO簽訂的協議要求他們按照cGMP要求執行,例如與質量控制、質量保證、生產和測試記錄的維護以及合格人員相關的要求,但我們不控制我們CMO的製造流程,我們依賴這些CMO根據cGMP和其他相關適用法規生產我們的候選產品。
為了遵守FDA和其他類似外國監管機構的製造法規 ,我們和我們的第三方製造商必須在設計和開發、測試、生產、記錄保存和質量控制方面花費大量時間、金錢和精力,以確保候選產品 符合適用的規格和其他法規要求。如果我們或我們的CMO未能遵守這些要求, 我們可能會受到監管執法行動的影響,包括沒收候選產品和停產。
即使我們能夠與第三方製造商建立並維護 協議,依賴第三方製造商也會帶來額外的風險,包括:
| • | 依賴第三方進行監管、合規和質量保證; |
| • | 第三方可能違反制造協議; |
| • | 我們的專有信息可能被盜用,包括我們的商業祕密和專有技術; 和 |
| • | 第三方可能在代價高昂或對我們造成不便的時間終止或不續訂協議。 |
我們或我們的第三方製造商可能會 在生產我們臨牀試驗所需的候選產品所需的原材料或原料藥方面遇到短缺,或者,如果我們的候選產品獲得批准,則會出現足夠的數量用於商業化或滿足需求的增加,原因是 由於產能限制、延遲或市場對原材料或活性藥物配料的市場中斷,包括我們的競爭對手或其他公司購買此類原材料或原料藥造成的短缺。我們或我們的第三方製造商 未能獲得生產足夠數量的我們候選產品所需的原材料或原料藥,可能會對我們的業務產生重大不利影響 。
我們的第三方製造商接受監管機構的檢查和批准,然後才能開始製造和銷售我們的任何候選產品, 之後將不定期接受檢查。我們的第三方製造商可能無法遵守cGMP 法規或美國以外的類似法規要求。我們的失敗或我們的第三方製造商未能遵守適用的法規 可能會導致監管行動,例如發出檢查觀察通知、 警告信或對我們施加的制裁,包括臨牀擱置、罰款、禁令、民事處罰、延遲、暫停或 撤銷批准、吊銷許可證、沒收或召回候選產品或商業產品(如果有)、運營限制 和刑事起訴,其中任何一項都可能對我們的產品供應產生重大不利影響。如果我們的任何第三方供應商 未能遵守cGMP或其他適用的製造法規,我們開發和商業化候選產品的能力可能會受到嚴重影響。
Any disruption, such as a fire, natural hazards or vandalism at our CMOs, or any impacts on our CMOs due to health pandemics, could significantly interrupt our manufacturing capability. We currently do not have alternative production plans in place or disaster-recovery facilities available. In case of a disruption, we will have to establish alternative manufacturing sources. This would require substantial capital on our part, which we may not be able to obtain on commercially acceptable terms or at all. Additionally, we would likely experience months of manufacturing delays as we build facilities or locate alternative suppliers and seek and obtain necessary regulatory approvals. If this occurs, we will be unable to satisfy manufacturing needs on a timely basis, if at all. If changes to CMOs occur, then there also may be changes to manufacturing processes inherent in the setup of new operations for our product candidates and any products that may obtain approval in the future. Any such changes could require the conduct of bridging studies and regulatory approval before we can use any materials produced at new facilities or under new processes in clinical trials or, for any products reaching approval, in our commercial supply. Further, business interruption insurance may not adequately compensate us for any losses that may occur and we would have to bear the additional cost of any disruption. For these reasons, a significant disruptive event of any CMOs could have drastic consequences, including placing our financial stability at risk.
| 37 |
| 《目錄》 |
我們的候選產品和 我們可能開發的任何藥物可能與其他候選產品和藥物競爭,以獲得生產設施的使用權。無法保證我們 能夠以可接受的條款與其他按照cGMP法規運營的製造商達成類似安排,並且 可能有能力為我們生產。我們現有或未來製造商的任何性能故障都可能延遲 臨牀開發或上市批准。
如果我們出現意外 供應中斷,或任何供應商無法滿足我們對任何候選產品的臨牀或商業需求,我們計劃的臨牀研究或商業化可能會延遲 。我們可能無法找到具有可接受質量和經驗的替代供應商,以可接受的成本或優惠的條件生產和供應適當數量。此外,我們的供應商往往 受到嚴格的製造要求和嚴格的測試要求的約束,這可能會限制或延遲生產。必要時,更換製造商和供應商所需的漫長過渡期 ,將大大推遲我們的臨牀試驗,對於獲得批准的候選產品 ,也會推遲我們產品的商業化,這將對我們的業務、財務 狀況和運營結果造成重大不利影響。
我們依賴第三方供應商,如果我們遇到 這些第三方中的任何一個問題,我們的候選產品的製造可能會被推遲,這可能會損害我們的 運營結果。
We are dependent upon certain qualified suppliers, of which there are a limited number, for the supply of raw materials, components, devices and manufacturing equipment, some of which are manufactured or supplied by small companies with limited resources and experience to support commercial pharmaceutical and biologics production. Additionally, these suppliers may also have upstream suppliers who supply materials, components, devices and manufacturing equipment, which may indirectly impact our business operations. Thus, the success of our business may be adversely affected by the underperformance of third parties, exploitation by third parties of our commercial dependence and by unforeseen interruptions to third parties’ businesses. Although the existence of several alternative suppliers for each function mitigates the risks associated with this dependence, as does the availability of commercial insurance in respect of the impact of accidental events, the failure of a third party to properly to carry out their contractual duties or regulatory obligations could be highly disruptive to our business. Supply chain failures can result in significant clinical or commercial supply interruptions which could materially hamper our ability to conduct clinical trials or to supply adequate commercial supplies (if any of our product candidates receive marketing authorization), and efforts to qualify new suppliers can be costly and time consuming. Further, any action taken by a third party that is detrimental to our reputation could have a negative impact on our ability to register our trademarks and/or market and sell our products, if any.
對於這些原材料、組件、 設備和製造設備,我們依賴於,將來也可能依賴於獨家供應商或有限數量的供應商。生產我們的候選產品所需的試劑和其他特殊材料和設備的供應 可以隨時減少或中斷 。在這種情況下,尋找和接洽替代供應商或製造商可能會導致延遲,我們可能無法以可接受的條款找到其他可接受的供應商或製造商,或者根本無法找到。更換供應商或製造商可能涉及鉅額成本,並可能導致我們所需的臨牀和商業時間表的延遲。如果我們的任何候選產品獲得了營銷授權,而我們更換了供應商或製造商以進行商業生產,則適用的監管機構必須批准此類更改 ,並可能要求我們進行額外的研究或試驗。如果失去關鍵供應商或製造商,或者如果材料供應減少或中斷,我們可能無法以及時和具有競爭力的方式開發、製造和營銷我們的候選產品 ,甚至根本無法開發、製造和營銷我們的候選產品。無法繼續從這些供應商中的任何一個採購產品,這可能是由於許多問題,包括影響供應商的監管措施或要求、供應商經歷的不利財務或其他戰略發展、 勞資糾紛或短缺、意外需求或質量問題,可能會對我們滿足產品需求的能力產生不利影響 候選產品,這可能會對我們的產品審批或商業化計劃和運營結果產生不利和實質性的影響,或我們進行臨牀試驗的能力 ,其中任何一項都可能嚴重損害我們的業務。
隨着我們繼續開發我們的候選產品和製造工藝,我們預計我們將需要獲得某些材料和設備的權利和供應,以便在此過程中使用 。我們可能無法以商業上合理的條款獲得此類材料的權利,或者根本無法獲得這些材料的權利,如果我們 無法以商業上可行的方式改變我們的流程以避免使用此類材料或找到合適的替代品,這將對我們的業務產生重大不利影響。即使我們能夠改變我們的過程以使用其他材料或設備,這種改變也可能導致我們的臨牀開發和/或商業化計劃的延遲。如果已處於臨牀測試中的候選產品 發生這種變化,則可能需要我們在進行更高級的臨牀試驗之前進行體外或體內可比性研究,並從患者那裏收集更多數據。這些因素可能會導致研究或試驗的延遲、 法規提交、我們開發的候選產品所需的審批或商業化,導致我們產生更高的成本 並阻止我們成功地將我們的候選產品商業化。
| 38 |
| 《目錄》 |
我們的交易對手可能會破產。
與我們進行貿易或有其他業務關係的各方(包括合作伙伴、合資企業、客户、供應商、分包商和其他方) 可能會破產。這可能是由於一般經濟條件或該公司特有的因素造成的。如果與我們交易的一方破產,這可能會對我們的收入和盈利能力產生不利影響。
我們與客户、醫療保健提供者、醫生、處方者、購買者、第三方付款人、慈善組織和患者的關係受到適用的反回扣、欺詐和濫用以及其他醫療保健法律法規的約束,這可能使我們面臨刑事制裁、民事處罰、合同損害、聲譽損害以及利潤和未來收入減少。
雖然我們目前沒有任何產品 上市,但一旦我們的任何候選產品商業化,如果獲得批准,我們將受到額外的醫療保健法規 以及美國聯邦和州政府以及我們開展業務所在司法管轄區的外國政府的監管要求和監督。美國和其他地方的醫療保健提供者、醫生和第三方付款人在推薦和處方藥品和生物製品方面發揮着主要作用。與第三方付款人和客户的協議 可能使製藥商面臨廣泛適用的欺詐和濫用以及其他醫療法律法規,包括但不限於聯邦反回扣法規(AKS)和虛假索賠法案(FCA),它們可能會限制此類公司銷售、營銷和分銷藥品的業務或財務 安排和關係。特別是,我們任何候選產品的研究,以及醫療保健產品和服務的推廣、銷售和營銷,以及醫療保健行業的某些業務 安排,都受到旨在防止欺詐、回扣、自我交易和其他濫用行為的廣泛法律的約束。這些法律法規可能會限制或禁止廣泛的定價、折扣、營銷和促銷、結構化 和佣金(S)、某些客户激勵計劃和其他業務安排。受這些法律約束的活動還涉及不適當地使用在招募患者進行臨牀試驗的過程中獲得的信息。
可能影響我們的醫療保健法律包括: 聯邦欺詐和濫用法律,包括AKS;虛假索賠和民事罰款法律,包括FCA和民事貨幣懲罰法 ;聯邦數據隱私和安全法律,包括經HITECH修訂的HIPAA;以及與醫生及其直系親屬持有的所有權和投資權益有關的聯邦醫生付款陽光法案,以及向醫生、某些高級非醫生醫療從業者和教學醫院進行的付款和/或其他 價值轉移。此外,許多州都有類似的法律法規,可能在很大程度上不同於其他州和聯邦法律,從而使合規工作複雜化 。此外,幾個州要求製藥公司遵守制藥業的自願合規指南和聯邦政府頒佈的相關合規指南,並可能要求製造商報告與向醫生和其他醫療保健提供者支付和其他價值轉移或營銷支出有關的信息。此外,一些州和地方法律要求在該司法管轄區註冊藥品銷售代表。
這些法律的範圍和執行都是不確定的,在當前的醫療改革環境下,尤其是在缺乏適用的先例和法規的情況下,會受到快速變化的影響。確保業務安排符合適用的醫療保健法,以及應對政府當局可能進行的調查,這可能會耗費時間和資源,並可能分散公司對其業務其他方面的注意力。
It is possible that governmental and enforcement authorities will conclude that our business practices may not comply with current or future statutes, regulations or case law interpreting applicable fraud and abuse or other healthcare laws and regulations. If any such actions are instituted against us, and we are not successful in defending ourselves or asserting our rights, those actions could have a significant impact on our business, including the imposition of significant civil, criminal and administrative penalties, damages, fines, disgorgement, imprisonment, reputational harm, possible exclusion from participation in federal and state funded healthcare programs, contractual damages and the curtailment or restricting of our operations, as well as additional reporting obligations and oversight if we become subject to a corporate integrity agreement or other agreement to resolve allegations of non-compliance with these laws. Further, if any of the physicians or other healthcare providers or entities with whom we expect to do business is found not to be in compliance with applicable laws, they may be subject to significant criminal, civil or administrative sanctions, including exclusions from government funded healthcare programs. Any action for violation of these laws, even if successfully defended, could cause a pharmaceutical manufacturer to incur significant legal expenses and divert management’s attention from the operation of the business. Therefore, even if we are successful in defending against any such actions that may be brought against us, our business may be impaired. Prohibitions or restrictions on sales or withdrawal of future marketed products could materially affect business in an adverse way.
與我們的證券所有權和我們作為美國上市公司的地位有關的風險
如果我們不能滿足納斯達克的持續上市要求, 納斯達克可能會將我們的存托股份摘牌,這可能會對我們存托股份的流動性和市價造成不利影響。
我們的存托股份目前在納斯達克資本市場上市 。我們需要滿足某些定性和財務測試,以維持我們的存託 股票在納斯達克上市。2023年1月31日,我們收到納斯達克的一封信函,稱在過去連續30個營業日, 我們的存托股份的買入價收盤低於根據納斯達克上市規則5550(a)(2)在納斯達克資本市場繼續上市的每股最低買入價。2023年7月20日,我們收到納斯達克的書面通知,通知我們 在過去連續10個營業日,我們存托股份的收盤買入價為1美元或以上。因此, 納斯達克決定我們已重新遵守納斯達克上市規則5550(a)(2)。
| 39 |
| 《目錄》 |
納斯達克進一步通知我們,我們將接受 的強制性小組監督,為期一年,自2023年7月20日起。如果在一年的監控期內,納斯達克上市資格工作人員發現我們不遵守先前例外情況下的規則,上市資格工作人員將發出退市決定函,我們將有機會要求納斯達克聽證會小組舉行聽證會。
雖然我們已重新遵守 繼續在納斯達克資本市場上市的所有適用要求,但我們無法向您保證,我們將繼續遵守 繼續在納斯達克資本市場上市的所有適用要求。如果我們將來未能持續遵守 繼續在納斯達克上市的所有適用要求,包括在一年的監控期內,我們的存托股份可能會 被納斯達克退市。這可能會抑制我們的存托股份持有人在公開 市場交易其股份的能力,從而嚴重限制該等股份的流動性。儘管持有人可能能夠在場外交易市場上交易其存托股份 ,但無法保證會發生這種情況。此外,場外交易市場提供的流動性遠遠低於納斯達克和其他國家證券交易所,交易量少且波動性高,做市商較少,且 分析師不關注。因此,您交易或獲得這些證券報價的能力可能比 它們在納斯達克或其他國家證券交易所報價時受到更大的限制。
我們的存托股份價格可能波動。
我們在美國的存托股份 的交易價格一直波動,並可能繼續波動,主要是由於各種因素(其中部分因素 超出我們的控制範圍,包括交易量有限)。股票市場,特別是製藥和生物技術股票市場,經歷了極端的波動,通常與這些公司的經營業績無關。 由於這種波動,投資者可能無法以或高於為存托股份支付的價格出售其存托股份 。此外,我們的普通股目前沒有市場,我們不希望在可預見的將來將我們的普通股在任何交易所上市 或在任何場外交易系統上報價交易。
除了 中討論的因素之外,"風險因素”一節,可能導致每股存托股份市價波動的因素包括:
| • | 有競爭力的產品或技術的成功; |
| • | 監管行動; |
| • | 相對於競爭對手,我們增長率的實際或預期變化; |
| • | 我們或我們的競爭對手宣佈新產品、重大收購、戰略合作伙伴關係、合資企業、合作或資本承諾; |
| • | 我們或競爭對手的候選產品的臨牀前開發、實驗室測試和臨牀試驗的進展情況。 |
| • | 我們的臨牀計劃和我們未來可能進行的任何試驗的結果; |
| • | 潛在類似競爭產品的臨牀試驗進展; |
| • | EMA、MHRA、FDA或國際法規或法律發展; |
| • | 我們的任何候選產品,如果獲得批准,都未能取得商業成功; |
| • | 與專利申請、已頒發的專利或其他專有知識產權有關的發展或糾紛 |
| • | 關鍵人員的招聘或離職; |
| • | 與我們的任何候選產品或臨牀開發計劃相關的費用水平; |
| • | 訴訟或公眾對我們產品安全的擔憂; |
| 40 |
| 《目錄》 |
| • | 證券分析師對財務結果、發展時間表或建議的估計的實際或預期變化 ; |
| • | 我們經營業績的實際和預期波動; |
| • | 我們的財務業績或那些被認為與我們相似的公司的財務業績差異; |
| • | 股價和成交量波動可歸因於我們股票的成交量水平不一致; |
| • | 宣佈或預期將作出更多融資努力; |
| • | 有關我們或我們的競爭對手的謠言; |
| • | 本公司、本公司內部人士或其他股東出售本公司存托股份; |
| • | 改變醫療保健支付制度的結構; |
| • | 製藥和生物技術行業的市場狀況,或其他因素造成的市場普遍波動 ; |
| • | 第三方補償政策; |
| • | 英國退歐和任何由此產生的經濟或貨幣波動; |
| • | 有關當前或未來合作、戰略聯盟、合資企業或類似 關係的發展;以及 |
| • | 對我們資產的長期價值進行審查,這可能導致減值支出,從而減少我們的 收益。 |
該等及其他市場及行業因素 可能導致我們的存托股份的市價及需求大幅波動,而不論我們的實際經營表現如何, 可能限制或阻止投資者以或高於存托股份的價格出售其存托股份,並可能 對我們普通股及存托股份的流動性產生負面影響。 實現上述任何 風險或任何廣泛的其他風險,包括這些"風險因素,"可能對我們存托股份的市價產生巨大的 和重大的不利影響。
我們存托股份的流動性可能對股價產生不利影響 。
於2023年7月,我們更改了 普通股與存托股份的比率,其影響為存托股份的80分之一反向拆分,並減少了 公開交易的存托股份的數量。市場上可能沒有足夠的流動性來適應 銷售活動或大量出售我們證券的情況。我們的存托股份歷來交易量有限 ,這也可能導致波動。
我們可能會受到證券訴訟的影響,這是昂貴的,而且可能會轉移 管理層的注意力。
我們的存托股份的市價 可能會波動,過去,一些股票市價波動的公司曾受到 證券集體訴訟。 我們作為一方的任何訴訟,無論是否有價值,都可能導致不利的 判決。我們也可能決定以不利條件解決訴訟。
任何此類負面結果都可能導致 支付鉅額損害賠償或罰款、損害我們的聲譽或對我們的業務慣例造成不利變化。為訴訟辯護 既費錢又耗時,而且可能會分散我們管理層的注意力和資源。此外,在訴訟過程中, 聽證、動議或其他臨時程序或事態發展的結果可能會出現負面公告,這可能 對我們存托股份的市場價格產生負面影響。
股東在本公司的所有權權益可能因(其中包括)未來融資和/或額外收購而被稀釋,並可能對我們 證券的市價產生重大負面影響。
我們可能會尋求 不時通過公開或私人發行股本籌集額外資金,此類融資可能在不久的將來或更長期進行。出售 我們通過未來股權發行提供的證券可能會導致我們現有股東的利益大幅稀釋。 向投資者出售大量證券,或預期出售此類證券,可能使我們在未來更難以我們希望實現出售的時間和價格出售 股權或股權相關證券。
| 41 |
| 《目錄》 |
我們還可能不時發行普通股(及該等普通股相關的存託 股份)或其他可轉換為普通股的證券,用於未來收購, 包括收購許可證,例如擬議收購託立酮許可證。 這些工具的相關證券的發行,或認為可能發生發行,將對其他股東產生攤薄影響,並可能對我們存托股份的市價產生重大的 負面影響。
如果股票研究分析師不發表研究報告或發表不準確或 對我們業務不利的研究,我們的股價和交易量可能會下降。
我們證券的交易市場 部分取決於股票研究分析師發佈的關於我們或我們業務的研究和報告。 如果 沒有或很少有股票研究分析師報道我們公司,我們的交易價格 證券會受到負面影響。我們無法控制分析員或其報告中包含的內容和意見。我們的價格 證券如果一個或多個股票研究分析師下調我們的評級, 證券 或發表其他對我們不利的評論或研究。如果一個或多個股票研究分析師 停止對我們的報道或未能定期發佈關於我們的報告, 證券可能 下降,進而可能導致我們的交易價格或交易量 證券 下降。
存托股份持有人的權利與普通股持有人的權利不同 。
我們是一家根據英格蘭和威爾士法律註冊成立的上市有限公司。存托股份指於我們普通股之實益擁有權權益。存托股份持有人的權利 受英國法律、我們的組織章程文件以及 存托股份發行所依據的存託協議的約束。存托股份的權利和條款旨在在合理可行的範圍內複製普通股附帶的權利,而普通股目前在美國沒有活躍的交易市場。然而,由於 英國法律、我們的章程文件和存管協議的條款等方面,存管股票持有人的權利將與普通股持有人的權利不相同,在某些方面,可能不如普通股持有人的權利。
您可能沒有與我們普通股持有人 相同的投票權,並且可能無法及時收到投票材料以行使您的投票權。
我們的存托股份持有人與直接持有我們普通股的股東不擁有 相同的權利,並且只能根據存託協議的規定就 相關普通股行使其投票權。存托股份持有人將任命 存託人或其代名人為其代表,以行使存托股份所代表的普通股附帶的表決權。召開股東大會時,如果您持有存托股份,您可能無法收到足夠的股東大會通知 ,以允許您撤回存托股份相關的普通股,以允許您就任何特定 事項投票。此外,我們無法向存托股份的購買人保證,他們將及時收到投票材料以指示存託人 投票,他們或通過經紀人、交易商或其他第三方持有存托股份的人 可能沒有機會行使投票權。此外,保存人不對任何 未執行表決指示、任何表決的方式或任何此種表決的效力負責。因此,存托股份 的購買人可能無法行使其投票權,且如果其存托股份未按其要求投票,則可能缺乏追索權。
如果向存托股份持有人提供存托股份所代表的普通股或其任何價值,則閣下不得接受存托股份持有人的分派。
存托股份的存託人 已同意就其或託管人收到的普通股或 其他存託證券的現金或其他分派向您支付分派,扣除其商定的費用和開支。您將按照您的存托股份所代表的普通股數量 的比例獲得這些分配。但是,如果存管人認為向任何存管股份持有人進行分配是非法或不切實際的 ,則存管人不承擔責任。我們沒有義務採取任何其他行動,允許向我們的存托股份持有人分發 我們的存托股份、普通股、權利或其他任何東西。因此,如果我們向您提供普通股或其任何價值的分配是非法或不切實際的,您可能無法收到 對您進行的分配。 這些限制可能會對您的存托股份的價值產生重大不利影響。
閣下在轉讓閣下的存托股份時可能會受到限制。
您的存托股份可在存託人的賬簿上轉讓 。然而,保存人可隨時或不時在其認為對履行其職責有利時關閉其賬簿。一般而言,當我們或存管人的賬簿關閉時,或在我們或存管人認為 由於法律或政府或政府機構的任何要求,或根據存管協議的任何條款,或由於任何 其他原因, 認為適當的時候,存管人可拒絕交付、轉讓或登記閣下的存管人股份的轉讓。
| 42 |
| 《目錄》 |
我們目前無意在可預見的將來就我們的普通股支付股息 ,因此,您在此期間獲得投資回報的唯一機會可能 是存托股份價格升值。
我們目前無意在可預見的將來就我們的普通股支付股息 。我們的董事會決定支付股息將取決於許多因素, 包括我們的財務狀況、經營業績、法律要求和其他因素。因此,如果存託 股份的價格在可預見的將來下跌,而您出售存托股份,您的投資將出現虧損,而 該虧損不可能部分或全部被現金股息抵銷。
我們是非加速備案人,適用於非加速備案人的報告義務減少 可能會降低我們的證券對投資者的吸引力。
We are a “non-accelerated filer” under the rules of the SEC. For as long as we remain a “non-accelerated filer,” our independent registered public accounting firm is not required to deliver an annual attestation report on the effectiveness of our internal control over financial reporting. We will cease to be a non-accelerated filer if (a) the aggregate market value of our outstanding Ordinary Shares held by non-affiliates as of the last business day of our most recently completed second fiscal quarter is $75 million or more and we reported annual net revenues of greater than $100 million for our most recently completed fiscal year or (b) the aggregate market value of our outstanding Ordinary Shares held by non-affiliates as of the last business day of our most recently completed second fiscal quarter is $700 million or more, regardless of annual net revenues. If we cease to be a non-accelerated filer, we would be subject to the requirement for an annual attestation report by our independent registered public accounting firm on the effectiveness of our internal control over financial reporting. We cannot predict whether investors will find our securities less attractive if we rely on this exemption. If some investors find our securities less attractive as a result, there may be a less active trading market for our securities and our stock price may be more volatile and may decline.
我們的披露控制和程序可能無法防止 或檢測所有錯誤或欺詐行為。
我們必須遵守《交易法》的某些定期報告 要求。我們設計了披露控制和程序,以合理地確保根據《交易法》提交或提交的報告中要求我們 披露的信息在SEC的規則和表格中規定的時間段內累積並傳達給管理層、記錄、處理、彙總 和報告。我們認為,任何披露控制和程序 或內部控制和程序,無論其構思和操作如何完善,都只能提供合理而非絕對的保證, 控制系統的目標得到實現。這些固有的侷限性包括決策過程中的判斷可能是錯誤的,以及由於簡單的錯誤或錯誤而可能發生故障。此外,某些人的個別 行為、兩個或多個人的勾結、或未經授權的控制超馳,都可能規避控制。因此,由於 我們控制系統的固有侷限性,可能會發生因錯誤或欺詐而導致的錯誤陳述或披露不足,我們可能無法發現 。
任何未能保持有效的內部 控制和財務報告程序的情況都可能嚴重阻礙我們準確報告財務狀況、經營結果 或現金流量的能力。
由於作為上市公司運營, 我們的成本增加,管理層將需要投入大量時間進行新的合規性計劃。
我們是一家上市公司,因此,我們 承擔了大量的法律、會計和其他費用,而我們作為一傢俬營公司沒有承擔。我們目前遵守 《交易法》、《薩班斯—奧克斯利法案》、《多德—弗蘭克華爾街改革和保護法案》以及 SEC和納斯達克通過和將要通過的規則的報告要求。我們的管理層和其他人員將需要花費大量時間 來執行這些合規性計劃。此外,我們預計這些規則和法規將大幅增加我們的法律和財務合規成本,並使某些活動更加耗時和成本更高。例如,我們預計這些規則和條例會使 我們更難獲得董事和高級管理人員責任保險,並且我們可能需要花費大量 成本來維持足夠的保險範圍。我們無法預測或估計我們為響應這些要求而可能產生的額外成本的金額或時間。這些要求的影響還可能使我們更難吸引和留住合格人員 進入我們的董事會、董事委員會或高級管理層成員。
與投資外國私人發行人或英國公司有關的風險
根據美國證券交易委員會的 規則和條例,我們是一家"外國私人發行人",因此,我們不受《交易法》中的多項規則的約束,並且允許向美國證券交易委員會提交 比在美國註冊的公司少的信息。
我們在英格蘭和威爾士註冊成立為一家上市有限公司,根據SEC的規則和法規,我們被視為"外國私人發行人"。作為 外國私人發行人,我們不受《交易法》下的某些規則的約束,如果我們是在美國註冊成立的公司 ,這些規則將適用,包括:
| • | 要求向美國證券交易委員會提交定期報告和財務報表的頻率和速度與根據《交易法》註冊證券的美國公司一樣頻繁或迅速。 |
| 43 |
| 《目錄》 |
| • | 提交根據美國公認會計原則編制的財務報表的要求; |
| • | 委託書規則,其中對委託書或徵求同意書施加了某些披露和程序要求; 和 |
| • | 遵守FD法規的要求,該法規對選擇性披露重大信息施加了某些限制。 |
此外,我們的高級管理人員、董事和 主要股東在購買和出售普通股和存托股時,不受《交易所法》第16條的報告和“短期”利潤回收條款的約束。因此,您收到的 關於我們的信息可能少於您收到的關於在美國註冊成立的上市公司的信息,並且根據美國聯邦證券法,您獲得的保護可能少於我們在美國註冊成立時的保護 。
如果我們失去了作為外國 私人發行人的身份,可能會適用其他報告要求。
作為外國私人發行人,我們不需要 遵守適用於美國國內發行人的《交易法》的所有定期披露和當前報告要求。為維持我們目前作為外國私人發行人的地位,(1)我們的大部分投票證券 必須由非美國居民直接或間接擁有,或(2)(a)我們的大部分執行 或董事不能是美國公民或居民,(b)我們50%以上的資產必須位於美國境外 ,(c)我們的業務必須主要在美國境外管理。
如果我們失去了作為外國私人 發行人的身份,我們將被要求遵守適用於美國國內發行人的《交易法》報告和其他要求,這些要求 比外國私人發行人的要求更加詳細和廣泛。我們還可能需要根據SEC和納斯達克的各種規則對我們的公司治理實踐進行修改。根據美國證券法律 ,如果我們被要求遵守適用於美國國內發行人的報告要求,我們的監管和合規成本可能遠遠高於 我們作為外國私人發行人所承擔的成本。因此,我們預計失去外國私人發行人身份將增加 我們的法律和財務合規成本,並將使某些活動非常耗時和成本高昂。我們還預計,如果我們 被要求遵守適用於美國國內發行人的規則和法規,將使我們 獲得董事和高級管理人員責任保險變得更加困難和昂貴,我們可能需要接受降低的投保額或為獲得投保額支付相當高的 成本。這些規則和條例也可能使我們更難吸引和留住合格的董事會成員 。
作為一家外國私人發行人,我們不需要遵守 適用於在美國註冊成立的公司的納斯達克公司治理標準。
我們的董事會需要維持一個由三名或三名以上董事組成的審計委員會,該委員會符合納斯達克適用於審計委員會成員的獨立性標準 。然而,作為一家外國私人發行人,我們不需要遵守納斯達克的大多數其他公司治理規則,包括保持獨立董事佔多數的要求,以及我們由完全由獨立董事組成的董事會的提名和薪酬委員會。雖然我們遵守的英國公司治理規則也有類似的 要求,但存托股份持有人可能無法獲得適用於在美國註冊成立的公司的相同 程度的納斯達克公司治理標準的好處。
您參與未來任何配股發行的權利可能會受到限制,這可能會導致您所持股份的稀釋。
根據英國法律,在發行新股以換取現金時,股東通常擁有按比例認購的優先購買權。不在英國居住的某些股東行使優先購買權可能受到英國和海外司法管轄區適用法律或慣例的限制。 我們可能會不時向我們的股東分配權利,包括購買我們證券的權利。但是,我們不能將權利 提供給美國的股東,除非我們根據證券 法案註冊與權利相關的權利和證券,或者可以豁免註冊要求。此外,根據存款協議,託管銀行不會向存托股份持有人提供權利,除非這些權利和任何相關證券均已根據《證券法》登記,或向存托股份持有人分發這些權利可免於根據《證券法》登記。我們沒有義務 就任何此類權利或證券提交註冊聲明,或努力使此類註冊聲明 宣佈為有效。此外,我們可能無法根據證券法建立註冊豁免。如果託管機構 不分配權利,則根據存款協議,它可以在可能的情況下出售這些權利,或者允許這些權利失效。因此, 存托股份持有人可能無法參與我們的配股發行,其所持股份可能會被稀釋。根據英國法律,我們也被允許 取消優先購買權(前提是我們的股東通過特別決議批准或在我們的公司章程中加入取消此類權利的權力),從而將某些股東(如海外股東)排除在配股發售之外(通常是為了避免違反當地證券法)。
| 44 |
| 《目錄》 |
您可能很難對我們或我們的董事會成員提起任何訴訟或執行在美國獲得的任何判決,這可能會限制您在其他方面可以獲得的補救措施 。
我們是在英格蘭和威爾士註冊成立的上市有限公司,我們的所有資產都位於美國以外。此外,我們董事會的所有成員都是美國以外的國家(包括英國)的國民和居民。這些個人的大部分或全部資產位於美國以外。因此,投資者可能無法在美國境內向此類人員送達訴訟程序,也無法執行在美國法院獲得的對他們或我們不利的判決,包括基於美國聯邦證券法民事責任條款的判決。
美國和聯合王國目前沒有條約規定相互承認和執行民商事判決(仲裁裁決除外) 。因此,由美國法院作出的最終付款判決,無論是否完全基於美國證券法,在英格蘭和威爾士都不會自動得到承認或強制執行。此外,英格蘭和威爾士法院是否受理在英格蘭和威爾士針對我們或我們的董事或高管根據美國或美國任何州的證券法提起的原始訴訟,也存在不確定性。在美國法院獲得的任何最終和決定性的、對我們不利的金錢判決將被英格蘭和威爾士法院視為訴訟本身的原因,並被作為債務提起訴訟,因此不需要對問題進行重審,前提是符合英國法律和公共政策的某些要求。對於基於美國證券法的民事責任條款的判決,是否滿足這些要求是英國法院做出此類裁決的問題。如果英國法院就根據美國判決應支付的金額作出判決,則英國判決將可通過通常可用於此目的的方法執行。
因此,美國投資者可能無法 針對我們或我們的高管、董事會或本文中提到的居住在英國或美國以外國家/地區的某些專家執行在美國法院獲得的任何民商事判決,包括根據美國聯邦證券法作出的判決。
出於税務目的,我們打算將我們僅視為英國居民,但出於税務目的,相關税務機關可能也會將我們視為另一個司法管轄區的居民 。
根據現行英國法律,英國法院的裁決 和英國税務和海關總署公佈的慣例表明,我們很可能被視為 聯合王國居民,如果我們打算,(i)董事會的所有主要會議以及大多數 例行會議在英國舉行,大多數董事出席該等會議;(ii)在 這些會議上,充分討論影響我們和我們的子公司的關鍵戰略問題,並就這些問題作出決定; (iii)適當記錄這些會議;(iv)我們至少有部分董事,連同支援人員,駐在英國;及(v)我們在英國有足夠的常設辦公場所,以履行我們的職能。
即使我們被英國税務和海關總署視為英國居民,正如預期的那樣,然而,如果(a)我們同時居住在另一個司法管轄區,我們將不會被 視為英國居民(適用該 司法管轄區的税收居住規則)與英國簽訂了雙重徵税條約,以及(b)在該税務條約中有一個打破平局的條款,將專屬居住地分配給該另一個管轄區。由於此分析具有高度的事實性,並且可能取決於我們管理層 和組織結構的未來變化,因此無法保證我們的納税居住地的最終確定。如果我們在英國以外的其他司法管轄區被視為 居民,我們將根據該司法管轄區的法律在該司法管轄區納税 ,這可能會導致額外的成本和開支。
我們股東的權利可能不同於 通常提供給美國公司股東的權利。
我們是根據英國法律成立的。普通股持有人的 權利,以及我們存托股份持有人的某些權利,受英國 法律(包括《公司法》的條款)和我們的組織章程約束。這些權利在某些方面與典型美國公司的股東權利不同。見"公司章程大綱及章程—公司法的差異 "以描述適用於我們的《公司法》條款與有關股東權利和保護的《特拉華州普通公司法》條款之間的主要差異。
英國 《城市收購和合並法》條款中的保護措施可能會延遲或阻止收購嘗試,包括可能有利於 我們普通股和存托股持有人的嘗試。
《英國收購和合並城市法典》(United Kingdom City Code on Takeovers and Mergers)或《城市法典》(City Code)適用於(除其他事項外)對註冊辦事處位於英國且中央管理和控制地點位於英國的公共有限公司的要約,由英國收購和合並委員會(Panel on Takeovers and Mergers) 或該委員會決定。專家小組已確認,我們受《城市守則》約束。
| 45 |
| 《目錄》 |
《城市法典》提供了一個框架, 在該框架內對在英國組織的某些公司的收購進行監管和實施。以下是 《城市法典》一些最重要規則的簡要摘要:
| • | 對於潛在要約,如果遵循潛在投標人或其代表的方法, 公司是"謠言或猜測的對象",或者公司 股價出現"不利變動",則需要潛在投標人就公司的潛在要約作出公開公告,或 公司就其對潛在要約的審查作出公開公告。 |
| • | 當 要約人收購了持有某一類別投票權10%或以上的股份權益時(即,投標人)在報價期間(即,在收購要約所涉及的股份之前)或在之前 12個月內,要約必須以現金形式或隨附該類別所有股東的現金替代品,其價格為要約人或與他們一致行動的任何人在該期間支付的最高價格 。此外,如果要約人或與他們一致行動的任何人 在要約期內獲得任何股份權益,則股份要約必須以現金形式或附有現金替代品 ,其價格至少等於要約期內為該等股份支付的價格。 |
| • | 如果在發佈公告後,要約人或任何與他們一致行動的人獲得了受要約公司股份的權益 (即,目標)的價格高於要約價值,則要約必須相應增加。 |
| • | 受要約公司的董事會必須任命一名合格的獨立顧問,其關於要約財務條款的意見必須連同受要約公司董事會的意見一併告知所有股東。 |
| • | 不允許對選定股東有利的交易,除非在某些情況下,獲得獨立 股東批准,且 受要約人的財務顧問認為該安排公平合理。 |
| • | 必須向所有股東提供相同的信息。 |
| • | 那些出具與收購有關的文件的人必須包括對其內容負責的聲明。 |
| • | 利潤預測、量化財務效益報表和資產估值必須符合指定的 標準,並且必須由專業顧問報告。 |
| • | 在文件中或向媒體發表的誤導性、不準確或未經證實的聲明必須立即予以公開 更正。 |
| • | 受要約公司在要約過程中採取的可能會使要約受挫的行動通常是 禁止的,除非股東批准這些計劃。令人沮喪的行動包括,例如,延長 董事根據其服務合同的通知期,或同意出售目標集團的重要部分。 |
| • | 對要約期間相關證券交易的披露作出了嚴格的規定, 包括要約各方以及 (直接或間接)擁有任何類別相關證券1%或以上權益的任何人士,迅速披露頭寸和進行相關證券交易。 |
| • | 要約人和受要約公司的僱員以及受要約公司的 養老金計劃的受託人必須被告知要約。此外,受要約公司的僱員代表和養老金計劃受託人 有權就受要約董事會通告的附件或網站上公佈的要約對就業的影響發表單獨的意見。 |
如果我們在2024年或之前或之後的任何年度被視為或成為被動外國投資公司或PFIC,就美國聯邦所得税而言,這可能會導致作為我們證券持有人的美國納税人產生不利的美國聯邦所得税後果 。
在任何應納税年度,如果(1)至少75%的總收入為“被動收入”,或(2)平均至少50%的資產價值產生被動收入或持有用於產生被動收入,則我們將被視為美國聯邦所得税的PFIC。 此目的的被動收入一般包括,除其他外,某些股息、利息、特許權使用費、租金和商品和證券交易所得收益,以及從出售或交換財產所得收益。被動收入還包括因臨時投資資金而獲得的金額,包括在公開發行中籌集的資金。在確定非美國公司 是否為PFIC時,應考慮其直接或間接擁有至少25% 權益(按價值計算)的每家公司的收入和資產的比例份額。
| 46 |
| 《目錄》 |
我們不相信我們在2023年是PFIC, 但不能保證我們在2024年或任何其他納税年度不會是PFIC,因為我們在任何這樣的 年的經營業績可能會導致我們成為PFIC。如果在美國股東持有我們證券的任何納税年度內,出於美國聯邦所得税的目的,我們被定性為PFIC,而該美國股東沒有選擇將我們視為“合格選舉基金”或QEF,或進行“按市值計價”的選擇,則“超額分派”給美國股東, 出售或以其他方式處置我們的證券所獲得的任何收益將受到特殊規則的約束。根據這些規則:(1)超額分配或收益將按比例在證券的美國股東持有期內分配;(2)分配給本納税年度和我們作為PFIC的第一個納税年度第一天之前的任何期間的金額將作為普通收入徵税;以及(3)分配給其他每個課税年度的款額將按適用於該年度的適用類別納税人的最高税率 徵税,並將就可歸因於該等其他課税年度的相應税項徵收被視為遞延利益的利息 。此外,如果美國國税局或美國國税局確定我們在某一年是PFIC,而我們已確定我們不是PFIC,那麼對於美國股東來説,及時進行QEF或按市值計價可能已經太晚了 。在我們曾經或現在是PFIC的一段時間內持有或曾經持有我們證券的美國股東將遵守上述規則,即使我們在隨後的幾年中不再是PFIC, 做出及時QEF或按市值計價的美國股東的例外情況除外。但是,由於我們不打算準備或 提供允許進行有效QEF選舉的信息,因此此類選舉將不向美國 持有者開放。
美國和非美國税法的變化可能會對我們的 公司以及我們普通股和存托股份的持有人造成重大不利影響。
美國於2017年12月頒佈了《減税和就業法案》,這是一項對美國現行公司税制進行廣泛改革的立法。減税和就業法案對美國聯邦所得税法進行了重大修改。減税和就業法案的某些條款可能會對公司或我們普通股或存托股份的持有人產生不利影響。美國財政部和美國國税局繼續就如何實施和管理《減税和就業法案》的條款進行解讀和發佈指導意見。 減税和就業法案的許多條款的解釋仍然不清楚。我們無法預測何時或在多大程度上將發佈任何額外的美國聯邦税收 闡明減税和就業法案的法律、法規、解釋或裁決,或任何此類指導 對投資者或公司的影響。敦促普通股和存托股份的持有者就減税和就業法案的影響以及美國聯邦税法的其他潛在變化諮詢他們自己的税務顧問。
我們無法預測未來可能實施的税收變化 或這些變化會對我們的業務產生什麼影響,但此類變化可能會影響我們在有業務的國家/地區的有效税率,並可能對我們未來的整體税收狀況產生不利影響,同時增加税收合規的複雜性、負擔和成本。此外,此類變更可能會影響普通股或存托股份的持有者。
| 47 |
| 《目錄》 |
有關前瞻性陳述的警示説明
This prospectus contains certain forward-looking information about the Company that is intended to be covered by the safe harbor for “forward-looking statements” provided by the Private Securities Litigation Reform Act of 1995. These statements may be made directly in this prospectus or may be incorporated into this prospectus by reference to other documents. Our representatives may also make forward-looking statements. Forward-looking statements are statements that are not historical facts. Words such as “expect,” “believe,” “will,” “may,” “anticipate,” “plan,” “estimate,” “intend,” “should,” “can,” “likely,” “could” and similar expressions are intended to identify forward-looking statements. Forward-looking statements appear in a number of places throughout this prospectus and include statements regarding our intentions, beliefs, assumptions, projections, outlook, analyses or current expectations concerning, among other things, our intellectual property position, success integrating acquisitions, research and development projects, results of operations, cash needs, capital expenditures, financial condition, liquidity, prospects, growth and strategies, regulatory approvals and clearances, the markets and industry in which we operate and the trends and competition that may affect the markets, industry or us.
這些前瞻性聲明基於 當前可用的競爭、財務和經濟數據以及管理層對未來 事件和業務表現的看法和假設,截至發表聲明之時,並受風險和不確定性影響。我們謹提醒 您,有一些已知和未知的因素可能導致實際結果與此類前瞻性陳述中明示或暗示的任何未來結果、業績 或成就存在重大差異,包括但不限於與以下方面相關的風險:
| · | 我們對額外資金的需求以及我們作為持續經營企業的能力; |
| · | 我們對損失、費用、未來收入、資本需求和額外融資需求的估計; |
| · | 我們有能力成功地開發、測試和與被許可方合作,以便在使用我們的技術平臺的條件下製造或商業化 產品; |
| · | 成功商業化和製造我們可能商業化或許可的任何未來產品; |
| · | 我們的臨牀前研究和臨牀試驗的成功和時機; |
| · | 我們的業務和商業戰略的轉變; |
| · | 與我們的任何候選產品相關的監管申報(包括新藥研究申請)的歸檔和時間安排,以及收到任何監管批准; |
| · | 我們候選產品的預期醫療益處; |
| · | 獲得和保持我們候選產品的監管批准的困難,以及我們可能獲得的任何批准下的標籤 ; |
| · | 我們的候選產品和我們未來可能獲得的任何候選產品(包括託咪酮和MTX 110)的潛在商業開發的成功和時機; |
| · | 我們開發和商業化我們的候選產品的計劃和能力,以及我們 未來可能獲得的任何候選產品; |
| · | 在第三方工廠生產產品的能力; |
| · | 我們任何候選產品的市場接受率和程度; |
| · | 成功發展我們的商業化能力,包括我們的內部銷售和營銷能力 ; |
| · | 為我們的候選產品和我們的專有技術獲得並維護知識產權保護; |
| · | 已有或即將推出的競爭療法和產品的成功; |
| · | 任何未來收購或其他戰略交易的成功; |
| · | 將未來收購的業務整合到我們自己的業務中的困難; |
| · | 網絡安全和其他網絡事件; |
| 48 |
| 《目錄》 |
| · | 行業趨勢; |
| · | 政府法律法規的影響; |
| · | 聯合王國、歐洲聯盟、美國和其他國家的監管、經濟和政治動態,包括聯合王國退出歐盟的任何影響; |
| · | 在國際上做生意的困難; |
| · | 本公司普通股和存托股份的所有權; |
| · | 我們有能力繼續滿足繼續在納斯達克資本市場上市所需的上市標準; |
| · | 我們有能力招聘或留住關鍵的科學或管理人員,或留住我們的高級管理層; |
| · | 我們現在或將來可能受到的任何訴訟的影響以及費用和費用; |
| · | 第三方的表現,包括合資合作伙伴、我們現有的銷售人員、我們的合作者、 第三方供應商和我們的許可協議各方;以及 |
| · | 其他風險和不確定因素,包括“風險因素"在這個 招股説明書中。 |
我們在本招股説明書中作出的任何前瞻性陳述 僅限於該等陳述的日期,我們沒有義務更新該等陳述以反映本招股説明書日期之後的事件 或情況,或反映意外事件的發生。本期 和任何前期業績的比較並不旨在表達任何未來趨勢或未來業績的指標,除非如此表述,且 應僅視為歷史數據。但是,您應審查我們在本招股説明書發佈之日後 不時向SEC提交的報告中描述的因素和風險。見"在那裏您可以找到更多信息.”
您還應仔細閲讀"中描述的因素 風險因素"在本招股説明書以及本招股説明書的其他地方,以更好地瞭解我們業務中固有的風險 和不確定性以及任何前瞻性陳述的潛在風險。由於這些因素,我們無法向您保證本招股説明書中的前瞻性陳述將被證明是準確的。此外,如果我們的前瞻性陳述被證明是不準確的,則不準確性可能是重大的。鑑於這些前瞻性陳述中的重大不確定性,您不應 將這些陳述視為我們或任何其他人的陳述或保證,即我們將在 任何指定時間內實現我們的目標和計劃。
| 49 |
| 《目錄》 |
收益的使用
我們將不會收到出售股東出售存托股份所代表的普通股的任何收益。出售 本招股説明書所涵蓋的存托股份代表的普通股及二零二三年十二月私募預集資認股權證的所有所得款項淨額將歸出售股東所有。在行使2023年12月私募預配認股權證以換取現金時, 適用的出售股東將向我們支付每股0.0001美元的行使價。
我們預計,出售股東 將出售其普通股(代表於“分配計劃”中所述的存托股份)。
| 50 |
| 《目錄》 |
股利政策
自成立以來, 我們從未就普通股宣派或派付任何現金股息,且預期在可預見的將來不會就普通股 或存托股份派付任何現金股息。我們打算保留所有可用資金和任何未來收益,為 我們業務的發展和擴展提供資金。因此,普通股和存托股份的投資者只有在普通股和存托股份增值的情況下才會在可預見的未來受益。
未來支付股息的決定 將由我們的董事會酌情決定,並將取決於我們的經營業績、現金 需求、財務狀況、合同限制和任何未來債務協議,並須遵守適用的 法律,包括2006年英國公司法或公司法,這要求英國公司的可分配利潤 等於或大於建議股息的金額。
| 51 |
| 《目錄》 |
大寫
下表列出了我們截至2023年6月30日的資本狀況:
| · | 在實際基礎上;以及 |
| · | 按經調整的備考基準,以實施(i)吾等出售1,088,887個A類單位(每個 A類單位包括一股存托股份、一份購買一股存托股份的E系列認股權證和一份購買 一股存托股份的F系列認股權證),公開發行價為每A類單位2.00美元,扣除估計承銷折扣和佣金 和估計發行費用,以及我們出售的1,911,176個B類基金單位後,(每個B類單位由一份12月公開發售 預籌資金權證組成,一份E系列認股權證以購買一股存托股份,一份F系列認股權證以購買一股存托股份) ,公開發行價為每B類基金單位1.9999美元,在扣除估計承銷折扣和佣金以及估計 發行費用以及沒有行使單位中包含的任何認股權證後,及(ii)就收市而言,(a)向Adhera支付 70萬美元,並向有擔保票據持有人和Melior發行存托股份。 |
以下所示的調整金額未經審計 ,代表管理層的估計。本表中的信息應與本招股説明書中包含的財務報表及其附註以及其他財務信息一併閲讀,並通過參考 加以限定。
| (GB單位:千) | ||||||||
| 截至2023年6月30日 | ||||||||
| 實際 |
調整後的形式 | |||||||
| 現金和現金等價物 | 5,227 | 8,079 | ||||||
| 非流動借款 | 380 | 380 | ||||||
| 總股本 | 5,299 | 11,482 | ||||||
| 總市值 | 5,679 | 11,862 | ||||||
_______________________
| (1) | 收益已按1 GB至1.26615美元的匯率轉換為英鎊。 |
| (2) | 出售該等單位的所有收益已在本表的權益總額內反映。 我們將被要求完成對該等工具的會計及估值評估,這可能會導致部分收益被歸類於權益總額之外,並在每個報告期(如屬負債分類工具)重新計量至公允價值。 此類評估將在編制我們發生銷售的期間的綜合財務報表時完成。 |
就本節而言,截至本招股説明書日期及本次發行後的已發行普通股總數 基於截至2023年6月30日的277,971,722股已發行普通股 2023年12月發售的約3,000,063股,不包括截至2023年6月30日的以下其他證券 :
| · | 121,340股可在行使股票期權時發行的普通股 根據我們的股權激勵計劃,加權平均行權價為每股5.05 GB; |
| · | 134股可在行使與收購Dara有關的股票期權時發行的普通股,加權平均行權價為每股1,903.40美元; |
| · | 以2019年10月私募方式向停戰公司發行的認股權證,可行使375股存托股份(相當於150,000股普通股),行使價為每股存托股份320.00美元; |
| · | 向配售代理髮行的與2019年10月私募有關的認股權證,可按每股存托股份10,000.00美元的行使價行使17股存托股份(相當於6,800股普通股); |
| · | 認股權證是在2020年5月私募發行給停戰公司的,可行使406股存托股份(相當於162,400股普通股),行使價為每股存托股份320.00美元; |
| · | 認股權證是在2020年5月私募發行給不同投資者的,可行使415股存托股份(相當於166,000股普通股),行使價為每股存托股份3,280.00美元; |
| · | 向配售代理髮行的與2020年5月私募有關的認股權證,可按每股存托股份3,300.00美元的行使價行使17股存托股份(相當於6,800股普通股); |
| · | 2020年5月在英國配售發行的認股權證,可行使349,600股普通股,行使價為每股6.80 GB; |
| · | 2022年8月發行的認股權證,可行使16,400股普通股,行使價格為每股普通股2.70 GB; |
| 52 |
| 《目錄》 |
| · | 2023年2月向配售代理髮行的與2022年12月登記的直接發行相關的認股權證,可行使49股存托股份(相當於19,600股普通股),行使價為每股存托股份400.00美元。 |
| · | 於2023年2月向配售代理髮行的與2月私募有關的認股權證,可按每股存托股份232.00美元的行使價行使1,293股存托股份(相當於517,200股普通股); |
| · | 2023年6月發行的C系列認股權證,可行使存托股份256,324股(相當於102,529,600股普通股),行使價為每股存托股份16.00美元(帶有無現金行權選擇權); |
| · | D系列認股權證於2023年6月發行,可行使276,689股存托股份(相當於110,675,600股普通股),行使價為每股存托股份16.00美元; |
| · | 2023年6月向配售代理髮行的與2023年5月登記直接發行相關的認股權證,可行使11,067股存托股份(相當於4,426,800股普通股),行使價為每股存托股份15.00美元 ; |
| · | 與收市及十二月公開發售有關的可發行認股權證。 |
| 53 |
| 《目錄》 |
管理層的討論和分析以及 操作結果
以下有關本公司財務狀況及經營業績的討論及分析 應與本招股章程其他部分所載截至2023年6月30日止六個月的經審核綜合財務報表及其附註及未經審核簡明綜合財務報表及其附註一併閲讀。我們在本招股説明書 中以英鎊編制合併財務報表,並根據國際財務報告準則, a由國際會計準則理事會頒佈的,在重大方面可能與其他司法管轄區的公認會計原則(包括美國的公認會計原則)不同.《國際財務報告準則》在一些重大方面與美國公認會計原則不同。 截至2023年6月30日止六個月的經營業績不一定代表截至2023年12月31日止全年或任何未來期間的業績。
以下討論和分析 包含前瞻性陳述。非歷史事實陳述的陳述,包括管理層信念和期望的表達,在性質上可能是前瞻性的,並基於當前的計劃、估計、預測和信念。前瞻性 聲明僅適用於作出之日,我們不承擔根據新信息或 未來事件更新其中任何聲明的義務。前瞻性陳述涉及固有風險和不確定性。許多重要因素可能導致實際結果 或結果與任何前瞻性陳述中表達的結果有重大差異。這些因素包括在 標題"風險因素"和"前瞻性陳述警示"下確定的因素。
與我們截至2020年12月31日的財政年度有關的信息包含在我們截至2021年12月31日的年度表格20—F年度報告中,從第77頁開始, "項目5.業務和財務回顧及展望”,這是2022年4月26日提交給SEC的。
最新發展動態
有關我們最新發展的信息, 請參閲"業務,其通過引用結合於此。
影響業務結果的主要因素
我們認為, 英鎊、歐元和美元之間的貨幣匯率以及影響不同時期經營業績可比性的某些其他因素 是最有可能影響我們的財務狀況和經營業績的因素。
貨幣匯率
我們以英鎊報告財務結果,我們的現金儲備也大部分以英鎊計價。
在我們的財務報表(以引用方式納入本報告)所載期間,尤其是2021年和2022年,英鎊兑歐元和美元的 波動相當大。 我們不時進行 以功能貨幣以外的貨幣計價的交易,這會導致外匯風險。目前,我們認為 風險敞口不足以利用衍生工具管理遠期外匯風險。
綜合收益表項目的組成部分
收入
我們的收入來源包括來自提供服務、研發合同和贈款收入的收入。收入在截至2022年12月31日的年度的綜合財務報表附註1中按行 確認。
運營費用
我們將我們的運營費用分為兩類:(I)研發和(Ii)管理成本。這些類別對應於公司內不同的 職能領域。
我們的運營費用 主要包括人員成本、合同研發成本、專業服務費和折舊。每類運營費用的人員成本 包括工資、獎金、社會保險、醫療保險、其他員工福利和該類別人員的基於股份的薪酬。我們分攤因期權的公允價值攤銷而產生的基於股份的薪酬支出。中央管理費用,如租金、計算機和其他技術費用,沒有分配給各部門。
| 54 |
| 《目錄》 |
研發成本 。研發成本包括可直接歸因於與本文所述產品相關的研發計劃的成本。這包括第三方合同研究機構、研究專家 專業服務提供商、研究和製造過程中使用的化學品和其他消耗品的成本、與研發職能相關的資產折舊 以及直接分配到研究和製造運營的員工的工資成本。
管理成本 。這主要包括高管、財務、公司發展和行政人員的人事成本,以及法律、會計和其他專業服務費、其他公司費用、併購成本和首次公開募股成本 計入綜合全面收益表。行政成本還包括行政資產的折舊。
財政收入
財務收入 包括現金存款的所有應收利息。
在2023年和2022年,財務收入還包括股權結算衍生金融負債的收益。我們在2023年、2020年和2019年發行了與註冊直接發行相關的認股權證。2015年,我們承擔了收購Dara的完全既得權證和股票期權。於行使認股權證及購股權時將發行的普通股數目是固定的,但行使價格以美元計價,這與本公司的功能貨幣不同。因此,認股權證和購股權在綜合財務狀況表中被歸類為權益結算衍生金融負債,任何損益 在綜合全面收益表中通過財務收入或財務費用確認。
財務費用
財務費用 包括借款和貸款工具的所有應付利息。於2023年及2022年,財務開支主要由租賃負債及其他貸款應付利息 組成。
税收
税項是指集團公司就符合資格的研發成本所產生的應收税項抵免。
經營成果
截至2023年6月30日的6個月與截至2022年6月30日的6個月
下表彙總了截至2023年6月30日和2022年6月30日的六個月的綜合運營結果:
| 截至6月30日的六個月, | ||||||||
| 2023 | 2022 | |||||||
| (千英鎊;未經審計) | ||||||||
| 收入 | 298 | 468 | ||||||
| 其他收入 | - | 16 | ||||||
| 研發成本 | (2,251 | ) | (2,413 | ) | ||||
| 行政費用 | (2,291 | ) | (1,849 | ) | ||||
| 運營虧損 | (4,244 | ) | (3,778 | ) | ||||
| 財政收入 | 410 | 404 | ||||||
| 財務費用 | (22 | ) | (24 | ) | ||||
| 税前虧損 | (3,856 | ) | (3,398 | ) | ||||
| 税收 | 288 | 337 | ||||||
| 母公司所有人應佔本期虧損 | (3,568 | ) | (3,061 | ) | ||||
收入。 截至2023年6月30日止六個月的總收入為30萬英鎊,而2022年首六個月為47萬英鎊,下降36%。 二零二三年上半年及二零二二年上半年的收入全部由與楊森的研發合作收入組成。2023年上半年 收入減少反映與楊森的合作已於2023年9月終止 。於二零二三年或二零二二年並無補助收入。
| 55 |
| 《目錄》 |
研發成本。 截至2023年6月30日止六個月的研發成本減少16萬英鎊,或7%,至225萬英鎊,而截至2022年6月30日止六個月的241萬英鎊。期間,研發成本佔運營成本的百分比 從57%降至50%。截至2023年6月30日止六個月研發成本的減少反映了將公司重新定位為治療公司的決定,而不再繼續投資於我們的內部藥物輸送平臺。2023年3月的成本削減計劃導致7名員工被裁員,一次性成本為88,000英鎊。這些減少部分被MTX 110 I期臨牀試驗費用增加30萬英鎊的支出所抵消。
行政費用。 截至2023年6月30日止六個月的行政開支 由去年同期的185萬英鎊增加24%至229萬英鎊。二零二三年上半年行政成本增加,乃由於與成功融資交易及成功及失敗收購有關的法律及專業費用40萬英鎊。
財政收入。 本期及前期的融資收入 包括與權益結算衍生金融負債有關的收益分別為39萬英鎊 及40萬英鎊。此外,我們賺取現金存款利息。
財務部。 與租賃負債相關的期間內的融資費用 。
截至2022年12月31日的年度與截至2021年12月31日的年度比較
下表概述我們截至二零二二年及二零二一年十二月三十一日止年度的綜合經營業績 :
| 截至十二月三十一日止的年度: | ||||||||
| 2022 | 2021 | |||||||
| (GB單位:千) | ||||||||
| 收入 | 699 | 578 | ||||||
| 總收入 | 699 | 578 | ||||||
| 其他收入 | 22 | 24 | ||||||
| 研發成本 | (5,111 | ) | (4,654 | ) | ||||
| 行政費用 | (4,542 | ) | (2,946 | ) | ||||
| 運營虧損 | (8,932 | ) | (6,998 | ) | ||||
| 財政收入 | 497 | 936 | ||||||
| 財務費用 | (53 | ) | (44 | ) | ||||
| 税前虧損 | (8,488 | ) | (6,106 | ) | ||||
| 税收 | 832 | 646 | ||||||
| 持續經營虧損 | (7,656 | ) | (5,460 | ) | ||||
| 母公司擁有人應佔年內虧損 | (7,656 | ) | (5,460 | ) | ||||
收入。截至2022年12月31日止年度,我們的持續經營收入為70萬GB,而2021年為58萬GB, 包括每年為客户提供的研發合作協議下的Q-Sphera配方服務。
研發成本 。我們在2022年產生了511萬GB的研發成本,而2021年為465萬GB, 增長了10%,主要是由於我們在內部能力上的投資增加了60萬GB的員工成本,以及MTX110的臨牀成本增加了40萬GB。隨着我們對產品組合進行合理化,臨牀前成本減少了20萬GB,專利相關成本減少了20萬GB,抵消了這些增長。
管理成本 。截至2022年12月31日的年度,我們的管理成本為454萬GB,而2021年為295萬GB 。增加的主要原因是與擬議收購BiOASIS有關的費用增加了136萬加元,以及撥備了40萬加元用於支付款項和未來的貸款承諾BiOasis Technologies, Inc.,或BiOASIS,與一項最終終止的擬議交易有關的貸款。這一年保險費用和工作人員費用也發生了補償 非實質性變化。
財政收入。 財務收入指現金結餘所賺取的利息及權益結算財務負債的收益。於2022年,財務收入 50,000 GB計入損益表,而2021年則為94,000 GB,並計入權益結算財務負債的收益 47,000 GB。
財務費用。 2022年財務費用為0.05萬GB,而2021年為0.04萬GB,增加了0.1萬GB。 利息支出主要指租賃負債的利息支出。
| 56 |
| 《目錄》 |
流動性與資本資源
概述
我們發生了嚴重的淨虧損 ,從成立到2023年6月30日的每一段時間內,我們的運營現金流都是負的,截至2023年6月30日,我們的累計赤字為1.3897億GB。截至2023年6月30日和2022年12月31日,我們分別擁有523萬GB和284萬GB的現金和現金等價物。我們還沒有產生利潤,而且,不包括股票發行,現金流從成立之日起就一直是負的。管理層預計,在可預見的未來,運營虧損和負現金流將持續。 我們相信,我們現有的現金和現金等價物餘額將不足以滿足我們未來12個月的營運資金需求和與現有業務相關的其他流動性需求。
我們未來的生存能力 取決於我們是否有能力從融資活動中籌集現金,為我們的開發計劃提供資金,直到商業化,從運營活動中產生現金,併成功獲得監管部門的批准,允許我們的開發產品上市。我們未能在需要時籌集資金,可能會對其財務狀況和實施其業務戰略的能力產生負面影響。
必須獲得額外的資金 ,可能包括公開或私募股權或債券發行。可能無法以合理的 條款獲得額外資本(如果有的話)。如果我們無法以我們可以接受的金額或條款籌集額外資本,我們可能不得不大幅 推遲、縮減或停止我們的候選產品和配方的開發,並考慮其他戰略選擇。
如果我們通過發行債務證券或額外的股權證券籌集額外的 資金,可能會導致對我們現有股東的稀釋, 增加的固定支付義務,這些證券可能擁有優先於我們普通股(包括存托股份)的權利,並可能包含限制我們運營並可能損害我們競爭力的契諾,例如對我們產生額外債務的能力的限制,對我們獲取、銷售或許可知識產權的能力的限制,以及可能對我們開展業務的能力產生不利影響的其他 運營限制。任何此類事件都可能嚴重損害我們的業務、財務狀況和前景。
我們認為,小型股和微型股生物技術公司的融資環境仍然具有挑戰性。雖然這可能會帶來與其他融資渠道有限或沒有融資渠道的公司進行收購和/或合併的機會,但任何隨之而來的融資都可能是稀釋的。我們 繼續評估本集團可能獲得的融資選擇,包括與收購和/或合併相關的融資選擇。 任何替代方案取決於交易對手的同意,因此,不能保證為公司融資的任何替代 行動方案都將成功。這種在短期內進行額外融資的要求代表了一種重大的不確定性,可能會讓人對我們作為一家持續經營的企業繼續下去的能力產生重大懷疑。如果在我們的現金資源耗盡之前,在 未來公司明顯沒有可採取行動的現實融資選擇,那麼我們將不再是一家持續經營的公司,很可能被置於管理部門。在這種情況下,我們將不再能夠根據《國際會計準則1》第25段編制財務報表。相反,財務報表將在清算的基礎上編制 資產將按可變現淨值列報,所有負債將加速轉為流動負債。
我們對 財政資源將足以支持我們的運營的時間段的預測是前瞻性聲明,涉及風險和不確定性, 實際結果可能因多種因素而異,包括臨牀試驗的時間安排。我們的估計 基於可能被證明是錯誤的假設,我們可以比目前預期更快地利用可用資本資源。如果我們 缺乏足夠的資本來擴大我們的業務或以其他方式利用我們的業務機會,我們的業務、財務狀況 和經營業績可能會受到重大不利影響。
現金流
下表呈列截至2023年及2022年6月30日止六個月以及截至2022年及2021年12月31日止年度來自持續經營活動的現金的主要 來源及用途概要:
| 截至6月30日的六個月, | 截至十二月三十一日止的年度: | |||||||||||||||
| 2023 | 2022 | 2022 | 2021 | |||||||||||||
| (千英鎊;未經審計) | (GB單位:千) | |||||||||||||||
| 用於經營活動的現金 | (3,881 | ) | (3,539 | ) | (7,048 | ) | (6,008 | ) | ||||||||
| 投資活動產生/(用於)現金 | 20 | (17 | ) | (220 | ) | (278 | ) | |||||||||
| 融資活動產生/(用於)提供的現金 | 6,252 | (78 | ) | 47 | 8,805 | |||||||||||
| 現金及等價物淨(減少)增加 | 2,391 | (3,634 | ) | (7,221 | ) | 2,519 | ||||||||||
經營活動
下表呈列 截至2023年及2022年6月30日止六個月及截至2022年及2021年12月31日止年度的經營所用現金摘要:
| 57 |
| 《目錄》 |
| 截至6月30日的六個月, | 截至十二月三十一日止的年度: | |||||||||||||||
| 2023 | 2022 | 2022 | 2021 | |||||||||||||
| (千英鎊;未經審計) | (GB單位:千) | |||||||||||||||
| 2004年12月20日之前的業務活動現金流量 營運資金變動 | (4,086 | ) | (3,494 | ) | (8,246 | ) | (6,548 | ) | ||||||||
| 營運資金的變動 | 205 | (45 | ) | 520 | (617 | ) | ||||||||||
| 運營中使用的現金 | (3,881 | ) | (3,539 | ) | (7,726 | ) | (7,165 | ) | ||||||||
營運資金變動前的經營活動現金流量 。二零二三年首六個月,營運資金變動前之經營活動現金流出淨額為409萬英鎊 ,而二零二二年同期則為349萬英鎊。現金流出增加59萬英鎊,或17%,是由本公司擁有人應佔虧損增加51萬英鎊,以及以股份為基礎的付款費用減少08萬英鎊所致。
截至2022年12月31日止年度,營運資金變動前的 經營活動現金流出淨額為825萬英鎊,而2021年同期則為655萬英鎊。現金流出增加170萬英鎊,或26%, 是由公司擁有人應佔虧損增加220萬英鎊和税收抵免增加19萬英鎊, 被股份支付費用增加0000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 二零二二年經營活動現金流量包括20萬英鎊,涉及對Bioasis的貸款減值。
現金用於運營。營運資金於二零二三年首六個月按現金流量計算增加21萬英鎊,而二零二二年同期則減少5萬英鎊。 截至2023年6月30日止六個月的增長主要包括貿易及其他應收賬款增加31萬英鎊,被撥備減少21萬英鎊所抵銷。
截至二零二二年十二月三十一日止年度,營運資金按現金流量計算減少52萬英鎊,而二零二一年則增加62萬英鎊。 2022年的減少主要包括貿易及其他應付款項增加36萬英鎊,以及就提供給Bioasis的貸款的預期虧損計提撥備20萬英鎊。
已付税款。截至2023年及2022年6月30日止六個 個月支付的税項為零英鎊。
2022年獲得的研究和開發税收抵免為68萬英鎊,而2021年為116萬英鎊。這與上一財政年度提交的索賠有關。
投資活動
二零二三年首六個月,物業、廠房及設備的購買額為4,000英鎊,而二零二二年首六個月為33,000英鎊。2022年的資本支出 與購買實驗室設備有關,而2023年的資本支出則包括實驗室和IT設備。
截至2022年12月31日止年度, 購買物業、廠房及設備為06萬英鎊,而2021年為032萬英鎊 。於二零二二年,資本開支主要與為實驗室購置實驗室設備有關。還向Bioasis提供了一筆貸款,涉及2022年12月宣佈的擬議交易,金額為20萬英鎊。
融資活動
租賃負債 支付的金額。 截至2023年6月30日止六個月,我們就租賃負債支付了95,000英鎊,而上一個期間則為73,000英鎊。
於二零二二年,我們就租賃負債支付 18萬英鎊,而二零二一年則為11萬英鎊。我們於二零二一年就加的夫的新公司 辦公室訂立租約,並於二零二一年放棄我們在加的夫的舊設施的租約。
股票發行 包括權證,扣除成本。 截至2023年6月30日止六個月,我們從2023年2月的 私募和2023年5月的註冊直接發售以及認股權證行使籌集了635萬英鎊的淨所得款項,相比之下,截至2022年6月30日止六個月的融資交易沒有 所得款項。
截至2022年12月31日止年度,我們以現金方式從2022年12月的登記直接發售及行使認股權證籌集了24萬英鎊的所得款項淨額。於截至2021年12月31日止年度,我們以現金方式從2021年7月英國配售或2021年英國配售以及行使認股權證籌集了903萬英鎊的所得款項淨額。
| 58 |
| 《目錄》 |
2021年7月,我們通過我們當時的經紀人Turner Pope完成了與英國的若干投資者的2021年英國配售,發行價為每股5.70英鎊。
於 2022年12月,我們完成了以每股存托股份320. 00美元的價格出售492,400股普通股(包括1,231股存托股份)的登記直接發售,所得款項總額約為40萬美元。
截至2022年12月31日止年度,我們發行了1,250股普通股 ,以供員工股份激勵信託公司股份激勵計劃購買。
現金和現金等價物
截至二零二三年六月三十日止六個月的現金增加239萬英鎊,而二零二二年同期則減少363萬英鎊。截至2023年6月30日,我們的現金及現金等價物為523萬英鎊,而於2022年6月30日為642萬英鎊。
截至2022年12月31日止年度,現金減少 722萬英鎊(未計外匯變動影響),而2021年則增加 252萬英鎊。該減少主要是由於持續的貿易虧損所致。截至2022年12月31日,我們的現金及現金等價物為284萬英鎊,而於2021年12月31日則為1006萬英鎊。
現金承諾
截至2023年6月30日,我們的現金資源 預計將為2024年第一季度提供流動性。本公司仍專注於在任何特定時間嚴格控制其現金承諾 。截至2023年6月30日,我們的現金需求主要與以下各項有關:
| · | 與我們的辦公室和研發設施有關的租賃責任,在綜合財務狀況表中確認為 租賃負債; |
| · | 根據我們的商業供應協議和相關活動的採購義務;以及 |
| · | 與我們正在開發的候選產品的臨牀前和臨牀試驗相關的研發活動 。 |
我們的辦公室和研發設施的租約於2021年8月開始,並於2026年8月到期。我們的租賃責任(按貼現 基準)的現金需求分別為17萬英鎊和38萬英鎊,分別為短期(在報告日期後十二個月內支付)和長期(在報告日期後十二個月後支付)。我們的租賃義務包括與公用事業、維護和其他服務有關的附屬合同承諾 。
我們在2021年4月至8月期間在新設施建設了辦公室和實驗室空間 。 二零二一年,我們確認租賃物業改善方面的5萬英鎊,並確認新實驗室設備方面的額外19萬英鎊。我們預計在可預見的未來 只會有適度的資本支出。
截至2023年6月30日,我們相信我們有足夠的現金資源為我們的承諾和運營提供資金,直至2024年第一季度。我們於2023年12月完成了承銷的公開募股 ,共籌集了560萬美元。我們相信,公司有足夠的現金資源為 2024年第三季度的運營提供資金。為了在該日期之後維持運營,將需要額外的資金,其中可能包括公共或私人 股本或債券發行。如有額外資本,則可能無法按合理條款提供。如果我們無法以足夠數量或我們可以接受的條件籌集額外的 資本,我們可能不得不大幅推遲、縮減或停止我們候選產品和配方的開發 ,並考慮其他戰略替代方案。
研發、專利和許可證等。
截至2023年6月30日及2022年6月30日止六個月,我們的研發費用分別為225萬英鎊及241萬英鎊。
截至2022年12月31日及 2021年12月31日止年度,我們的研發費用分別為511萬英鎊及465萬英鎊。
趨勢信息
除本 招股説明書其他部分所披露的情況外,我們並不知悉有任何趨勢、不確定性、需求、承諾或事件合理可能對我們的收入、盈利能力、流動性或資本資源產生重大不利影響,或導致披露的財務信息 不一定能代表未來的經營業績或財務狀況。
| 59 |
| 《目錄》 |
資產負債表外安排
截至2023年6月30日及2022年12月31日,我們沒有 任何資產負債表外安排。
關鍵會計估計
編制我們的綜合財務報表 要求我們作出估計、假設和判斷,這些估計、假設和判斷可能對 財務報表各自日期的資產和負債、收入和支出的報告金額以及或然資產和負債的相關披露產生重大影響。我們的估計、假設和判斷基於歷史經驗和我們認為在當時情況下合理的各種其他因素。在不同的假設 或條件下,實際結果可能與這些估計不同。管理層定期評估估計、假設和判斷,並作出相應的更改,並與董事會討論 關鍵會計估計。
以下是 重要會計政策,因為它們對我們的財務狀況或經營成果的描述非常重要 ,並且它們需要對不確定的事項作出重要的管理估計和判斷。
以下是 被視為關鍵會計判斷:
收入
供應研究和服務開發
確認服務提供收入涉及重大管理判斷 和估計。服務收入於合約 期限內確認,按整體履行履約責任(本集團提供的服務)的進度按比例, 按估計總成本中迄今已產生的成本計量。我們的研發合作協議要求在 12個月內交付服務。
所得税
遞延税項資產會就未動用 税項虧損確認,惟以可能有應課税溢利可供動用虧損為限。需要 管理層作出重大判斷,以確定可根據可能的時間和 未來應課税利潤水平以及未來税務規劃策略確認的遞延税項資產金額。
於二零二二年及二零二一年,未動用税項虧損總額分別為71,100,000英鎊及67,200,000英鎊。由於沒有足夠證據支持其可於未來期間收回,故並無就虧損計提遞延税項資產 。
持續經營的企業
我們面臨着 與其他開發和早期商業階段製藥公司類似的許多風險。這些風險包括 開發組合產生收入,以及與我們管道產品的研究、開發、測試和 相關監管批准相關的風險。最終,盈利運營的實現取決於未來 不確定事件,其中包括獲得足夠的融資以完成我們的商業和開發活動,以及產生足以支持我們成本結構的收入水平 。
在過去幾年裏,隨着我們開發投資組合,我們經歷了 淨虧損和經營活動所用現金的大量現金流出。截至2023年6月30日,我們的總股本為530萬英鎊(2022年12月31日為316萬英鎊), 截至2023年6月30日止六個月的税後淨虧損為357萬英鎊,而2022年同期為306萬英鎊,同期在經營活動中使用現金388萬英鎊(2022年6月30日:354萬英鎊)。
我們未來的生存能力 取決於我們從融資活動中籌集現金以資助我們的開發計劃直至商業化、從經營活動中產生現金以及成功獲得監管部門批准以允許我們的開發產品上市的能力。我們未能 在需要時籌集資金,可能會對我們的財務狀況和執行業務戰略的能力產生負面影響。
我們的綜合 財務報表已按持續經營基準呈列,該基準考慮在正常業務過程中變現資產和清償 負債。
截至2023年6月30日,我們擁有523萬英鎊的現金和現金等價物。2023年12月21日,我們完成了承銷的公開募股,其中我們籌集了560萬美元(約442萬英鎊)的總收益。我們預計,我們目前有足夠的現金為 我們的計劃運營提供資金,直到2024年第三季度。未能在2024年第三季度之前獲得額外資金, 可能導致公司被置於管理層。
| 60 |
| 《目錄》 |
我們已經編制了 現金流量預測,並考慮了未來三年(包括自財務報表批准之日起12個月)的現金流量需求。這些預測表明,在未來12個月期間,將需要進一步的融資,尤其是假設某些開發計劃和其他經營活動按當前計劃繼續進行。
We believe the environment for financing of small and micro-cap biotech companies is as challenging as it has been since the financial crisis of 2008-2010. While this may present acquisition and/or merger opportunities with other companies with limited or no access to financing, any attendant financing is likely to be dilutive. We and our advisors continue to evaluate financing options, including those connected to acquisitions and/or mergers, potentially available to us, including fundraising and the partnering of assets and technologies of the Company. The alternatives being considered are all at an early stage and are contingent upon the agreement of counterparties and accordingly, there can be no assurance that any of the alternative courses of action to finance the Company will be successful. This requirement for additional financing in the short term represents a material uncertainty that may cast significant doubt about our ability to continue as a going concern. Should it become evident in the future that there are no realistic financing options available to the Company which are actionable before our cash resources run out then we will no longer be a going concern. In such circumstances, we would no longer be able to prepare financial statements under paragraph 25 of IAS 1. Instead, the financial statements would be prepared on a liquidation basis and assets would be stated at net realizable value and all liabilities would be accelerated to current liabilities. As a result of the foregoing, our independent registered public accounting firm included an explanatory paragraph in its report on our financial statements as of and for the year ended December 31, 2022 with respect to this uncertainty.
吾等相信,有足夠的選擇和時間可供貴公司獲得額外融資,經考慮不確定因素後,吾等 認為在編制財務資料時繼續採用持續經營基準屬適當。
我們作為一家持續經營企業繼續經營的能力 取決於我們獲得額外資本和/或處置資產的能力,因此不能保證我們 能夠及時、以優惠條款或根本不能做到這一點。
以下是關鍵會計估計:
商譽減值和尚未準備好使用的無形資產
尚未可供使用的商譽和無形資產 在年終時每年在現金產生單位層面進行減值測試,如果發生事件或情況發生變化,很可能導致現金產生單位的公允價值低於 其賬面值,則在年度測試之間進行減值測試。這些事件或情況可能包括商業環境、法律因素、運營 績效指標、競爭或出售或處置報告單位的重要部分的重大變化。
應用 商譽減值測試需要判斷,包括識別現金產生單位、將資產和負債 轉讓給這些單位、將商譽轉讓給這些單位以及確定單位的公允價值,對於尚未準備使用的無形資產, 需要資產的公允價值。每個現金產生單位或資產的公允價值採用收益法,採用 貼現現金流量法進行估計。此分析需要作出重大判斷,包括未來現金流量的估計,這取決於 內部預測,包括收入和開發成本、業務長期增長率的估計、現金流量將出現的可用年期的估計以及加權平均資本成本的確定。於二零二三年及二零二二年六月三十日,我們的商譽賬面值為0英鎊,而於二零二三年及二零二二年六月三十日,尚未可供使用的無形資產為0英鎊。 我們的商譽於2022年及2021年12月31日的賬面值為0英鎊,而於2022年及2021年12月31日尚未可供使用的無形資產為0英鎊。
估計 用於計算現金產生單位的公允價值,根據經營業績和市場狀況逐年變動。該等估計及假設的變動 可能會對釐定各有關單位的公平值及商譽減值產生重大影響。
基於股份的支付
我們根據 國際財務報告準則2,以股份為基礎的支付,要求根據授出日期獎勵的公允價值,計量為換取普通股購股權而獲得的僱員服務的成本 。
我們選擇柏力克—斯科爾斯—默頓期權 定價模式作為在沒有市場條件的情況下確定我們以股份為基礎的獎勵的估計公允價值的最合適方法。 對於包括與我們普通股市場表現相關的歸屬條件的基於表現的期權,我們使用了蒙特卡洛 定價模型,以反映必須滿足作為歸屬條件的價格障礙的估值影響。
| 61 |
| 《目錄》 |
股權激勵 獎勵產生的成本在獎勵的必要服務期(通常為歸屬期)內確認為費用。補償開支 於歸屬期內以直線法確認,並於綜合全面收益表分類。
用於估計以股份為基礎的付款交易的公允價值的假設在我們的年度財務報表中披露,並估計如下:
| · | 波動率是根據生物技術領域一些上市同行公司的平均年化波動率進行估計的; |
| · | 期權的估計壽命估計為第一個行權期,通常為期權授予後的下一個月;以及 |
| · | 股息回報是參考我們的歷史股息支付來估計的。目前,這一數字估計為零,因為前幾個時期沒有支付任何股息。 |
金融負債
損益公允價值(FVTPL)
我們在公司普通股本中有尚未行使的認股權證。行使時將發行的普通股數量是固定的,但行使價以美元(與母公司的功能貨幣不同)計值。因此,認股權證分類為權益結算 衍生金融負債,並於損益賬按公平值確認。
金融負債採用 蒙特卡洛模型或布萊克—斯科爾斯期權定價模型進行估值。按公平值計入損益之金融負債按公平值列賬,重新計量產生之任何收益或虧損於損益確認。在損益中確認的淨收益或虧損包括 就金融負債支付的任何利息,並計入損益表中的"融資收入"或"融資費用"項目 。公平值乃按年度財務報表所述方式釐定。
近期發佈和採納的會計公告
請參閲本報告其他部分的 合併財務報表附註1,瞭解最近採納的會計聲明和最近發佈的 截至本報告所包括的財務狀況表日期尚未採納的會計聲明。
關於市場風險的定量和定性披露
我們面臨各種金融 風險,包括但不限於市場風險(包括外匯和利率風險)、信貸風險和流動性風險。 我們的整體風險管理計劃側重於金融市場的不可預測性,併力求將對其財務表現的潛在不利影響 降至最低。
信用風險
信貸風險是指如果開發合作伙伴或金融工具的交易對手未能履行其合同義務,則對公司造成財務損失的風險。我們主要面臨 來自協作夥伴的應收款項的信貸風險,這些款項被視為較低。
信用風險也來自現金和現金等價物以及銀行和金融機構的存款。對於銀行和金融機構,僅接受獨立評級且信用狀況較高的當事方 。
我們不訂立衍生工具以管理 信貸風險。
我們所承受的信貸風險總額等於 年末持有的金融資產的總值。綜合實體就按攤餘成本或按公允價值計入其他全面收益計量的金融資產的預期信貸虧損確認虧損撥備。 虧損撥備的計量取決於綜合實體於各報告期末對金融工具的 信貸風險自初始確認以來是否顯著增加的評估,該評估基於可用的合理且有支持性的信息, 無需付出不必要的成本或努力。
當信貸風險自初始確認以來沒有顯著增加 ,則估計12個月的預期信貸損失撥備。這代表資產的整個存續期預期信貸損失的 部分,該部分歸因於未來12個月內可能發生的違約事件。 當金融資產出現信貸減值或確定信貸風險顯著增加時,虧損撥備 基於資產的全期預期信貸虧損。已確認的預期信貸損失金額是根據工具使用期限內預期現金短缺的 概率加權現值(按原有效 利率貼現)計量的。就按公平值計入其他全面收益的金融資產而言,虧損撥備於 其他全面收益內確認。於所有其他情況下,虧損撥備於損益確認。
| 62 |
| 《目錄》 |
銀行存款
我們正在不斷審查與在銀行存款相關的信貸風險 ,並試圖通過在信用狀況較高的銀行存款 來降低此風險。
外匯風險
當我們的 個別實體進行以功能貨幣以外的貨幣計值的交易時,也會產生外匯風險。我們的 英國以外地區到歐洲的交易推動了外匯變動,供應商以英鎊以外的貨幣開具發票。這些 交易不進行對衝,因為這樣做的成本與風險不成比例。
利率風險
我們不持有任何使我們面臨重大利率風險的衍生工具、 或其他金融工具。
流動性風險
流動性風險源於我們對營運資金的管理 。它的風險是,我們在履行到期的財政義務時將遇到困難。
我們的目標是在餘額到期時進行結算。
我們已經準備了 現金流預測,並考慮了我們未來三年的現金流需求,包括自財務報表批准之日起12個月的期間。這些預測表明,在未來 12個月期間,將需要進一步融資,前提是某些開發計劃和其他運營活動將按當前計劃繼續進行。 這種對額外融資的要求帶來了重大不確定性,使人對我們持續經營的能力產生了極大的懷疑。因此,我們的獨立註冊會計師事務所在其關於截至2022年12月31日和截至2022年12月31日的年度的財務報表的報告中包含了一段關於這種不確定性的説明性段落。
我們認為,小型和微型生物科技公司的融資環境與2008-2010年金融危機以來的環境一樣具有挑戰性。 雖然這可能會帶來與其他融資渠道有限或沒有融資渠道的公司的收購和/或合併機會,但隨之而來的任何融資都可能是稀釋的。我們和我們的顧問繼續評估融資選擇,包括與收購和/或合併相關的選擇,包括我們可能獲得的融資選擇,包括籌資以及公司資產和技術的合作。現正考慮的替代方案 均處於初期階段,並視乎交易對手的同意而定,因此,不能保證為本公司提供資金的任何替代方案將會成功。考慮到不確定性後,我們認為在編制財務信息時繼續採用持續經營基礎是合適的。如果在我們的現金資源耗盡之前,公司顯然沒有實際可行的融資選擇,那麼我們 將不再是一家持續經營的企業。在這種情況下,我們將不再能夠根據《國際會計準則》第1款編制財務報表。相反,財務報表將在清算的基礎上編制,資產將按可變現淨值列報 ,所有負債將加速轉為流動負債。
我們作為持續經營企業繼續經營的能力取決於我們獲得額外資本和/或處置資產的能力,因此 不能保證我們能夠及時、以有利的條款或根本不能保證我們能夠做到這一點。
有關詳細信息, 請參閲“-關鍵會計估計和判斷-持續關注.”
| 63 |
| 《目錄》 |
生意場
業務概述
我們 是一家臨牀階段的生物製藥公司,正在開發一系列創新產品,用於治療醫療需求未得到滿足的疾病,包括1型糖尿病和罕見/孤兒腦癌。我們的主要資產Tolimidone正在為T1D開發,MTX110正在研究侵襲性罕見/孤兒腦癌的適應症,包括複發性膠質母細胞瘤、瀰漫性中線膠質瘤和髓母細胞瘤。
託利米酮是Lyn激酶的選擇性激活劑,可增加胰島素底物-1的磷酸化,從而放大由胰島素與其受體結合而啟動的信號 下跌。Lyn激酶調節細胞內的重要功能,如增殖、分化、凋亡、遷移和新陳代謝。在脂肪細胞中,Lyn激酶增加了對胰島素的利用,從而降低了血糖,而不會對胰島素的產生產生影響。在胰島中,Lyn激酶的激活促進了β細胞的存活和增殖,而它的抑制則導致細胞死亡,阻止增殖和誘發糖尿病。
MTX110, 正在研究侵襲性罕見/孤兒腦癌的適應症,包括複發性膠質母細胞瘤、DMG和髓母細胞瘤, 是組蛋白脱乙酰酶的液體制劑,泛諾比妥。我們的專利配方使產品能夠通過對流增強的 遞送方式以潛在的化療劑量直接到達腫瘤部位,繞過血腦屏障,避免系統性 毒性。
我們的 臨牀資產由三種專有藥物輸送技術支持,這些技術專注於通過持續輸送(Q—Sphera)改善 藥物的生物輸送和生物分佈TM),直接交付(MidaSolveTM),或定向交付(MidaCoreTM):
| · | 我們的Q—Sphera平臺:我們的破壞性聚合物微球微技術 用於持續給藥,以延長和控制治療藥物在較長的時間內(從數週到數月)的釋放。 |
| · | 我們的MidaSolve平臺:我們創新的低聚糖納米技術 用於溶解藥物,使其能夠以液體形式直接和局部進入腫瘤。 |
| · | MidaCore平臺:我們的納米金技術 通過使用化療劑或免疫劑來靶向疾病部位。 |
收入。本公司整體持續經營及非持續經營的收入如下。
| Year ended December 31, | ||||||||||||
| (GB單位:千) | 2022 | 2021 | 2020 | |||||||||
| 收入(歐洲,包括英國) | 699 | 578 | 118 | |||||||||
| 收入(世界其他地區) | -- | -- | 62 | |||||||||
| 持續經營和非持續經營的總收入 | 699 | 578 | 180 | |||||||||
最新財經動態
如之前披露的,截至2023年9月30日,我們擁有382萬GB的現金和現金等價物。截至2023年9月30日的三個月和九個月,我們在運營中使用的淨現金分別為137萬GB和525萬GB。截至2023年9月30日,我們的總借款為504,000 GB。
本招股説明書中截至2023年9月30日的財務信息未經審核,由我們的管理層編制,並由管理層負責。 此數據可能會因進一步審查而發生變化。此外,我們的獨立註冊會計師事務所沒有對這一未經審計的財務信息進行審計、審查、編制或執行任何程序,也沒有就此發表意見或 作出任何其他形式的保證。因此,您不應過度依賴這些信息。要更全面地瞭解我們的財務狀況、流動性和截至2023年9月30日的運營結果,需要更多信息 和披露。完整的年度業績將包括在我們截至2023年12月31日的Form 20-F年度報告中。
| 64 |
| 《目錄》 |
最新發展動態
收購Tolimidone
2023年11月22日,我們與特拉華州的Adhera治療公司和Adhera發行的擔保貸款票據的某些持有人簽訂了一項 轉讓和交換協議,根據該協議,Adhera同意將其對化合物託利米酮的所有權利轉讓給公司,該化合物是Lyn激酶的選擇性激活劑,可增加胰島素底物-1的磷酸化,從而放大由 胰島素與其受體結合而啟動的信號下跌。Adhera之前與特拉華州的一家公司Melior PharmPharmticals I,Inc.簽訂了獨家許可協議,在除韓國中國和一些較小的亞洲地區以外的大多數地區開發和商業化託利米酮,Melior將這些許可授予總部設在韓國的Bukwang製藥有限公司。
此外,在2023年11月22日,我們與梅利奧爾簽訂了關於託利咪酮化合物的許可協議。根據許可協議,在交易完成時,公司將從梅利奧爾獲得獨家的、全球範圍的、可再許可的權利,以開發、製造、商業化或以其他方式開發任何領域的含有託利米酮的產品。關於許可協議,Melior和Bukwang於2023年11月22日簽訂了日期為2013年11月20日的許可協議修正案。根據這項修訂,Melior和Bukwang同意,在公司在2024年9月30日之前獲得至少400萬美元的新股權融資後,Bukwang許可證將全部終止 ,而Bukwang將把與託利米酮相關的某些研究新藥應用、技術訣竅和數據以及專利的所有權利、所有權和權益轉讓給Melior。
2023年12月21日,我們完成了轉讓與交換協議和許可協議中每一項預期的交易。作為關閉的結果, (I)Adhera同意將其對Tolimidone化合物的所有權利轉讓給我們和(Ii)我們 從Melior獲得的。在任何領域開發、製造、商業化或以其他方式開發含有託利米酮的產品的獨家、全球範圍內可再許可的權利。作為代價,(I)吾等根據轉讓及交換協議 向Adhera預付640,000美元,並(X)向若干有抵押票據持有人發行合共224,947股存托股份以清償Adhera 抵押票據,及(Y)合共2,275,050份預籌資權證或2023年12月私募預籌資權證,以向若干有抵押票據持有人購買 存托股份,及(Ii)向Melior發行其354,428股存托股份。在履行許可協議項下的若干責任後,我們預計將向北旺發行354,428股我們的存托股份。
此外,在交割時, 我們與各有擔保票據持有人和Melior訂立了登記權協議和禁售協議,我們預計 與Bukwang訂立同樣的協議。
此外,根據每份鎖定協議,就根據轉讓及交換協議及 許可協議而收到的存托股份而言,持有人同意不會轉售其存托股份,直至(I)本表格F-1的註冊聲明宣佈生效日期起計90天及(Ii)成交後180天內兩者中較早者為止。在回售生效日期後的90天內,有擔保票據持有人以及美麗華和步旺各自可以分別出售至多相當於我們在納斯達克資本市場上交易的存托股份每日交易量的30%和5.5%,除非存托股價等於或 超過3.00美元,在這種情況下,只要市場價格保持在每股存托股份3.00美元或以上,有擔保債券持有人就可以出售無限制存托股份。
甲苯咪唑酮發展
2023年2月7日,我們宣佈 美國專利和商標局已允許美國專利申請No. 16/546,595,標題為“預防胰腺細胞變性” ,該申請由Melior獨家授權給我們,與關閉有關的其他專利。
2023年2月23日,我們宣佈, 代表我們,CRO進行了一項 體外培養 實驗設計用於證明託立酮對β細胞 增殖的潛力,使用重新聚集的胰島。實驗的結果是不確定的,因為它們與 之前在 體外培養和體內 託立酮的研究。我們認為有許多 可能的解釋, 體外培養 研究,並據此,我們計劃着手進行一項 在活體中 具有類似目的的臨牀前研究,同時繼續準備我們計劃在T1D患者中進行的託立酮IIa期開放標籤研究 ,該研究將於2024年晚些時候開始招募。
完成承銷公開發售
2023年12月21日,我們完成了一項包銷公開發行的結束 ,據此,我們以每股2.00美元的公開發行價發行和出售了(I)1,088,887個A類單位,每個A類單位包括(A)一個存托股份,(B)一個E系列認股權證,以每股2.20美元的行使價購買一股存托股份 ,將於初始行使日的五年週年日到期,以及(C)一個F系列認股權證,以每股2.20美元的行權價購買一股存托股份,(Ii)1,911,176個B類單位,公開發行價為每B類單位1.9999美元,每個B類單位包括(A)一份預資權證、(B)一份E系列認股權證及(C)一份F系列認股權證,其中包括全面行使超額配售選擇權。該公司的總收益總額約為600萬美元。
| 65 |
| 《目錄》 |
在12月 公開發行的結束之際,我們向Ladenburg Thalmann & Co.發行,Inc(12月公開發售的承銷商)購買 120,003股我們的存托股份或承銷商認股權證的認股權證,相當於12月公開發售結束時售出的存托股份總數(包括12月公開發售中發行的任何預撥資金認股權證相關的存托股份)的4.0%。 承銷商認股權證可按每股2.50美元的行使價行使.承銷商認股權證可於發行後立即 於十二月公開發售開始銷售起計的三年期間內隨時及不時全部或部分行使,而其他條款與作為十二月公開發售的一部分向投資者發行的E系列認股權證及F系列認股權證大致相似。
此外,根據本公司與承銷商於2021年12月19日簽訂的 承銷協議的條款,我們同意對(其中包括)後續股權出售進行 ,該等出售將持續至2023年12月21日起90日。本公司還同意 在2023年12月21日之後的180天內, 不發行任何價格根據本公司普通股的交易價格或 未來特定或或有事件進行價格重置的證券,或簽署任何協議以未來確定的價格發行證券,但某些例外情況除外。
MTX110開發
2023年1月12日,我們宣佈, 在我們的首例患者完成了為期一個月的MTX 110治療後,我們在複發性膠質母細胞瘤中進行的MTX 110 I期研究(也稱為MAGIC—G1研究)將在研究DSMB的積極建議下繼續進行計劃的劑量遞增。 MAGIC—G1是一項開放標籤、劑量遞增研究,旨在評估CED通過植入的可再灌注泵和導管間歇輸注MTX 110的可行性和安全性。本研究旨在招募兩個隊列(隊列A和隊列B),每個隊列至少 4名患者;第一個隊列在CED系統植入後接受MTX 110,第二個隊列也將接受MTX 110,但治療研究者可選擇在疾病進展時將導管重新放置到新病變區域,目的是 增加腫瘤覆蓋率和生存率。
隊列A中的第一名患者通過直接至腫瘤給藥給予 60 uM MTX 110,並在19周內接受了13次48小時輸注。在此期間,未觀察到患者發生治療相關不良事件。在成功完成第一個月的治療後,DSMB審查了 可用數據,並建議在研究中將劑量遞增至90 uM,我們認為這是最佳劑量。迄今為止, 沒有劑量限制性毒性。
2023年10月3日,我們宣佈完成 隊列A的招募,最少4名患者。隊列B的入組於2023年10月獲得DMSB批准。 我們預計中期無進展生存期結果將於2024年第二季度公佈。
2023年7月10日,我們宣佈完成 哥倫比亞大學歐文醫療中心正在進行的MTX 110 I期研究的9名兒童DMG患者的入組和治療。所有4至17歲的患者均按照醫療機構的護理標準接受放射治療。每例患者隨後接受了植入瘤內導管和可編程皮下泵的手術, 9例患者中有8例接受了兩次通過CED輸注MTX 110,間隔一週。輸送濃度為30、60或90 µ M ,未增加患者內劑量。迄今為止,尚未報告與研究藥物相關的劑量限制性毒性。 該隊列的中位總生存率為26.1個月。我們預計全面業績將於2024年第一季度公佈。
2023年2月7日,我們宣佈了關於複發性GBM的I期研究的更新 。由於在治療開始後的前30天內未觀察到藥物相關不良事件, 隊列A招募了至少4名患者。患者1每週輸注60 µ M MTX 110,自治療開始後存活 12個月(OS = 12)。患者2、3和4分別接受每週90 µ M MTX 110輸注,這是預期的 最佳劑量。留在書房裏GBM普遍復發,根據《神經腫瘤學雜誌》報道的299例患者的回顧性分析 ,一旦復發,中位總生存期為6.5個月。目前,沒有為複發性GBM制定治療標準。
2023年2月23日,我們宣佈了由哥倫比亞大學歐文醫學中心進行的MTX110在DMG患者中的I期研究結果。研究中有9名患者接受了治療(30 mM組,n = 3;60 mM組, n = 4;90 mM組(最佳劑量),n = 2)。由於這是首次通過CED對腦橋重複輸注 的研究,該研究的主要目的是安全性和耐受性,因此,輸注次數限制為 兩次,每次48小時,間隔7天。60名患者中有一名 mM組發生了重度 不良事件,經研究者評估為與研究藥物無關,但與輸注和腫瘤解剖結構有關。儘管本研究沒有可靠性證明療效,但中位無進展生存期為診斷後10個月(PFS = 12),而中位 總生存期為16. 5個月(OS = 16. 5)。
我們的戰略
2023年初,我們決定將 公司重新定位為治療(而不是藥物輸送)公司,我們開始尋找額外的資產來補充我們的MTX 110項目。提供概念驗證臨牀數據是我們未來業務模式的主要重點。
我們的專利藥物輸送技術 不再是公司的關鍵優先事項。
| 66 |
| 《目錄》 |
發展
我們的目的是建立一個平衡的臨牀階段開發資產組合 ,理想情況下,重點關注罕見/孤兒適應症。Tolimidone於2023年12月獲得許可,是我們打算為T1D開發的第二階段準備好的資產。MTX 110目前正處於三種罕見/孤兒腦癌的I期開發階段。
我們的目標是將臨牀資產 開發到概念驗證階段,然後再爭取合作伙伴進行最昂貴的後期開發。
我們的研發計劃可能會像MTX 110一樣, 基於我們的一種或多種支持技術。
製造業
我們不打算建立自己的製造能力 。對於臨牀試驗材料,我們使用GMP認證的合同製造商。
商業化
一旦概念驗證建立, 我們打算尋求將我們的產品授權給合作伙伴,該合作伙伴將在商定的許可區域內完成產品的開發,並隨後進行營銷和銷售 。除了償還開發成本外,合作伙伴還應根據銷售目標和版税支付里程碑式的 付款。
管道
我們正在積極 開發T1D和MTX 110中的託咪酮,用於三種適應症。我們的發展管道如下:
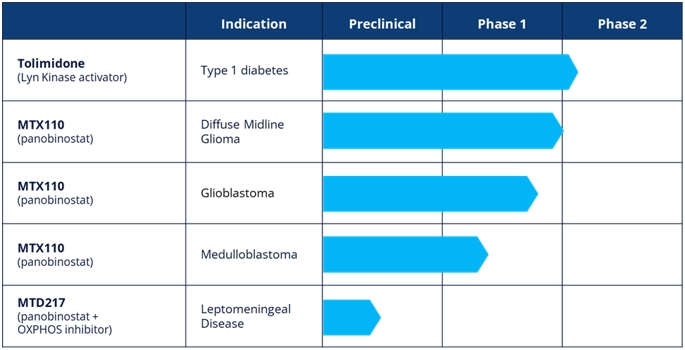
當前臨牀階段資產
託利咪酮. 甲苯咪酮最初由輝瑞公司發現,或輝瑞,並通過II期開發用於治療胃潰瘍。 輝瑞開展了廣泛的臨牀前項目,以表徵託立酮的藥理學、藥代動力學、代謝和毒理學。 輝瑞在II期由於缺乏該適應症的療效而停止了該藥物的開發。甲苯咪唑酮是Lyn激酶的選擇性激活劑 ,可增加胰島素底物—1的磷酸化,從而放大由 胰島素與其受體結合引發的信號級聯反應。
我們打算開發用於治療T1D的託咪酮。作為一種lyn激酶激活劑,託立酮在臨牀前實驗中已被證明在β細胞存活和增殖中發揮作用。如果在臨牀研究中重複,託立酮可能具有改善疾病的潛力,並 改變T1D的治療模式。T1D影響全球約840萬人,每年約有50萬例新診斷。
| 67 |
| 《目錄》 |
作為計劃中的託立酮持續臨牀開發的第一步 ,我們打算啟動IIa期劑量確認研究,以確定託立酮在T1D患者中的最佳劑量。IIa期研究將在約15名接受治療的T1D患者中進行, 為期三個月,終點為C肽水平、HbA1c和高血糖事件數量的變化。
有關託咪酮的其他 信息,請參見"—近期發展—甲苯咪唑酮發展".
MTX110. 使用 我們的MidaSolve技術與帕比司他(一種不溶的藥物,我們認為是最有效的 藥物之一)聯合使用,MTX 110設計用於對難治性腦癌的直接腫瘤治療。帕比司他目前以品牌 Farbenak ®上市銷售,該產品用於治療多發性骨髓瘤的聯合治療。我們目前正在研究MTX110在概念驗證階段的應用 :
多形膠質母細胞瘤(GBM): GBM是成人中最常見和最具侵襲性的腦癌形式,通常發生在大腦白質。治療方法包括放療、手術切除和化療,儘管幾乎所有病例腫瘤都會復發。 根據美國神經外科醫生協會的可用數據,每年約有2—3/100,000人診斷為GBM 。標準護理治療的生存期為未甲基化MGMT基因啟動子患者的約13個月 至高度甲基化MGMT基因啟動子患者的約30個月。研究顯示,2022年全球GBM治療市場的價值約為24.6億美元,預計到2030年將每年增長9.7%。
在2021年12月獲得IND批准 後,我們正在進行一項I期研究招募患者,以評估MTX 110在複發性GBM中的效用。 I期研究是一項開放標籤、劑量遞增研究,旨在評估CED通過植入的可再灌注泵和導管間歇輸注MTX 110的可行性和安全性。本研究旨在招募兩個隊列,每個隊列至少4名患者; 第一個隊列將僅接受MTX 110,第二個隊列將接受MTX 110,但治療研究者可選擇 在進展時將導管重新放置到新病變區域,目的是增加腫瘤覆蓋率和生存率。
瀰漫性中線神經膠質瘤(DMG): DMG,以前稱為瀰漫性內源性腦橋膠質瘤(DIPG),腫瘤位於腦幹的腦橋(中間) ,呈瀰漫性浸潤。該病主要發生在兒童中,每年全球約有1,100名患者和美國約有300名患者被診斷為DMG,中位生存期約為10個月。沒有有效的治療方法,因為手術 切除是不可能的。治療的標準是放射治療,它短暫地改善症狀和生存。化療不能 提高生存率,一個可能的原因是許多抗癌藥物不能穿過血腦屏障進入腫瘤。
2020年10月, 我們報道了加州大學舊金山分校首次使用CED系統在DMG中使用MTX110的人體研究。I期研究 確定了II期的推薦劑量範圍,具有良好的安全性和耐受性特徵,但在7名接受治療的患者中也獲得了令人鼓舞的生存數據。
2024年2月,我們宣佈了哥倫比亞大學歐文醫學中心開展的MTX110在兒童DMG患者中的研究結果。9名患者在研究中接受了治療(30 mM組,n = 3;60 mM 組,n = 4;90 mM組(最佳劑量),n = 2)。60名患者中有一名 mM 組發生嚴重不良事件,經研究者評估為與研究藥物無關,但與輸注和腫瘤解剖相關 。中位無進展生存期為診斷後10個月(PFS = 12),中位總生存期為16.5個月(OS = 16.5)。
成神經: 髓母細胞瘤 是一種惡性胚胎腫瘤,始於小腦。它們是侵入性的,與大多數腦腫瘤不同,它們通過腦脊液或CSF擴散,並且經常轉移到大腦和脊髓的不同位置。治療包括切除、放療和化療。在美國,每年約有350名患者被診斷為髓母細胞瘤,3800人患有該疾病 。5年、10年和20年的累積生存率分別約為60%、52%和47%; 然而,在沒有建立治療標準的情況下,復發幾乎總是致命的。
德克薩斯大學 正在對複發性髓母細胞瘤患者進行I期探索性研究,將MTX 110直接注射到 第四腦室,使其能夠在CSF中循環。
2020年,Secura Bio終止了我們對帕比司他某些專利的全球非獨家 可轉授權。我們將MTX 110視為一項重要資產 ,目前正在進行兩項MTX 110臨牀試驗,並打算啟動兩項臨牀試驗,作為我們的MTX 110臨牀項目的一部分 。我們繼續享有將帕比司他用於研究目的的自由,我們計劃繼續開發MTX 110。 我們認為,如果MTX110獲得加速 批准,相關Secura Bio專利可能會推遲MTX110在DMG患者中的上市,但我們預計這不會對MTX110在GBM患者中的上市產生任何影響。如果我們在專利到期前無法 推出候選產品,則可能會對我們的業務、財務狀況和 運營結果造成重大不利影響。
| 68 |
| 《目錄》 |
有關MTX110的其他 信息,請參見-最新發展-MTX110發展.
當前臨牀前資產
MTD217.我們的項目圍繞着 一種水溶性藥物製劑,可以輕鬆地同時或順序地直接輸注或注射到癌症微環境中, 以高度局部化的方式破壞代謝功能並限制脱靶毒性。我們最初的目標是治療軟腦膜疾病,或LMD,這是一種致命的併發症,其中轉移癌細胞侵入腦脊液和中樞神經系統。所有癌症患者中約有 5%會發展為LMD,並且由於目前沒有有效的治療方法,中位總生存期僅為診斷後三至 六個月。
商業協議、戰略夥伴關係和協作:
我們目前正在與生物製藥公司、合同研究組織和大學就我們的幾個開發項目進行合作。
2020年7月21日,我們宣佈與一家全球製藥公司的歐洲分公司合作,將我們的內部專業知識和專有藥物輸送平臺部署到合作公司提名的候選產品中。2022年1月17日,我們宣佈延長合作 ,並披露合作者為強生的關聯公司揚森。2022年3月9日,我們宣佈,我們已經擴展了這一合作,包括另一個大分子。最終交付成果提供給Janssen,合作於2023年9月結束。
梅里奧爾執照。2023年11月22日, 我們與梅利奧爾簽訂了關於託利咪酮化合物的許可協議。根據許可協議,我們從 梅利奧爾獲得了在全球範圍內開發、製造、商業化或以其他方式開發任何領域含有託利米酮的產品的獨家、全球範圍內可再許可的權利。
根據許可協議的條款,吾等以預付代價向Melior發行354,428股存托股份,並同意向北光發行該等股份。此外,我們有義務 根據建議的特許權使用費協議,向梅利奧爾支付託利米酮淨銷售額的個位數分級特許權使用費,梅利奧爾同意向北光支付此類特許權使用費的50%。
根據許可協議,我們有權自費控制託利米酮專利的起訴、維護和強制執行,而如果我們選擇不起訴和維護此類託利咪酮專利,Melior則有一定的插手權利。如果我們未能履行各種開發盡職調查義務,則許可協議可能會被梅利奧爾終止。
關於許可協議, 於2023年11月22日,Melior和Bukwang簽署了對Bukwang許可的修訂。根據《Bukwang修正案》,Melior和Bukwang 同意,在我們在融資日期前獲得至少400萬美元的新股權融資後,Bukwang許可證應全部終止,而Bukwang應將與託利米酮相關的某些IND、技術訣竅和數據以及專利的所有權利、所有權和利益轉讓給Melior。
根據《Bukwang修正案》,自融資之日起,Melior和Bukwang將簽訂擬議的特許權使用費協議,根據該協議,Bukwang將有權獲得根據Tolimidone許可收到的所有款項的50%,包括:(I)我們根據Tolimidone許可發行的股權的50%,以及(Ii)我們將向Melior支付的特許權使用費的50%。此外,根據建議的特許權使用費協議,北王將向梅利奧爾支付100,000美元作為代價 ,以換取梅利奧爾免除北王根據北王許可證支付專利費用的義務,而梅里奧爾將承擔所有託利米酮專利訴訟和維護費用。
CMS許可協議。2019年1月29日,我們與作為擔保人的CMS和被許可方簽訂了CMS許可協議。CMS許可協議自2019年2月26日起生效 。根據CMS許可協議的條款,吾等同意許可被許可人 獨家使用我們的技術和我們的知識產權以及與我們的某些臨牀和臨牀前 產品(即MTD201、MTX110、MTX102、MTR103和MTD119)有關的信息和數據,以及在CMS許可協議生效後第一個三年內進入臨牀前或臨牀前開發的任何其他流水線或生產線延伸產品,連同 這些產品,以便在中國(包括澳門、香港和臺灣)開發和商業化產品。在東南亞的某些國家/地區擁有相同的權利,被許可人通知我們,在FDA、EMA或英國、法國、德國或瑞士的監管當局批准任何產品後,該被許可人想要獲得許可。 總體而言,被許可人(S)和CMS的附屬公司以及當地合作伙伴作為被許可子被許可人進行此類活動。 被許可人擁有進口、獲得市場批准以及註冊、營銷、分銷、由被許可方自行決定在區域內推廣和銷售產品,如果我們在某些情況下選擇不履行或未能滿足被許可方具有約束力的產品訂單,我們將被授予自行製造產品的權利。被許可人將被限制向區域外的任何客户提供產品,而我們將被限制向區域內供應產品 ,但通過被許可人除外。
| 69 |
| 《目錄》 |
我們將為 被許可人及其子被許可人制造產品,這些產品將受與該地區的被許可人的獨家採購和供應安排的約束。
此外,我們同意允許許可證持有人確定其 自己的產品和產品線擴展目標,如果我們同意,我們將進行初步的開發,然後,技術轉讓費 的數額將取決於具體情況,傳輸特定的程序知識和數據以啟用 持牌人繼續使用我們的平臺技術進行開發,然後在該地區進行商業化。我們將在該區域內獲得一個較低的 位數的淨銷售額(根據CMS許可協議中的定義)的使用費。被許可人將擁有其創建的任何知識產權和他們在開發過程中收集的任何數據,並將這些權利和數據許可給我們,用於 製造所述產品以及在區域外商業化產品,為此,我們將向被許可人支付 較低的兩位數使用費。
許可證持有人應按產品向我們支付一次性付款 (美元)在獲得某些監管批准後(六個或可能七個數字 金額)和銷售業績里程碑(七位數,或可能八位數),以及淨銷售額的版税(作為 對於MTX110以外的產品,其使用費將為個位數百分比)。
CMS許可協議 可由任何一方因特定重大違約或破產而終止。特別是,我們的終止權僅限於違反某些 非競爭限制、未能支付里程碑或特許權使用費、破產或在獲得FDA或EMA監管批准後未能在特定國家開發和/或商業化特定 產品。此外,如果被許可人直接或間接侵犯我們的知識產權或對其有效性提出質疑,或者 在任何時候與特定產品和特定地區有關,因為被許可人已決定 不再希望在該地區的該國家開發和/或商業化產品,我們有權終止 協議。CMS許可協議還包括對此類交易的慣例賠償 。
銷售和市場營銷
我們目前沒有任何內部銷售 和市場營銷組織或分銷能力。
研究與開發
我們在威爾士的卡迪夫租賃了一個實驗室,在那裏我們能夠進行基本的配方和分析工作。
知識產權
我們的成功在很大程度上取決於我們 能否獲得和維護我們的候選產品(以及由此衍生的產品)、技術和專門知識的專有保護, 在不侵犯他人所有權的情況下進行運營,並防止他人侵犯我們的所有權。我們努力 保護我們認為對我們的業務很重要的專有技術,方法包括尋求和維護專利(如果有的話),這些專利旨在涵蓋我們的候選產品(及其衍生產品)、成分和配方、其 使用方法和製造工藝以及對我們 業務發展具有商業意義的任何其他發明。我們還依賴商業祕密、專業知識、持續的技術創新和許可證內的機會來發展和保持 我們的專有和競爭地位。
我們在全球範圍內建立了強大的知識產權基礎,包括專利、技術訣竅和商業祕密。目前,我們有101項授權專利,23項申請正在處理中, 每項申請均覆蓋全球所有主要市場,14項獨立專利系列覆蓋所有主要地區。我們繼續加強我們的 專利組合,根據我們積極的研發活動,戰略性地提交新專利和分案專利申請。我們業務的核心是我們的三項知識產權技術,這些技術旨在實現現有治療藥物的靶向給藥(即正確的地點)和受控緩釋(即正確的時間)。這些技術在多個治療領域有着廣泛的應用 ,並提供了創造多種收入機會的潛力。
專利權已在所有 世界主要市場(包括歐洲、美國和日本)或主要市場授予。我們專利系列中的已授予專利和待審專利申請 由我們單獨擁有、與其他方共同擁有或授權給我們。這些專利包括與託立酮和MTX 110的使用方法相關的專利,以及涵蓋緩釋藥物遞送、納米包合技術和納米顆粒技術的專利。
單個專利的期限取決於 專利在獲得它們的國家的法律期限。在大多數國家,包括美國,專利有效期為自非臨時專利申請的申請日起20年。在美國,專利期限在某些情況下可能會因專利期限調整而延長 ,這對專利權人因美國專利商標局在審查和授予專利時的行政延誤進行補償,或者如果專利被終止放棄,則可能會縮短專利期限。
| 70 |
| 《目錄》 |
The term of a United States patent that covers a drug, biological product or medical device approved pursuant to a pre-market approval may also be eligible for patent term extension when FDA approval is granted, provided that certain statutory and regulatory requirements are met. The length of the patent term extension is related to the length of time the drug is under regulatory review while the patent is in force. The Drug Price Competition and Patent Term Restoration Act of 1984 permits a patent term extension of up to five years beyond the expiration date set for the patent. Patent extension cannot extend the remaining term of a patent beyond a total of 14 years from the date of product approval, only one patent applicable to each regulatory review period may be granted an extension and only those claims reading on the approved drug may be extended. Similar provisions are available in Europe and certain other foreign jurisdictions to extend the term of a patent that covers an approved drug, provided that statutory and regulatory requirements are met. Thus, in the future, if and when our product candidates receive approval by the FDA or foreign regulatory authorities, we expect to apply for patent term extensions on issued patents covering those products, depending upon the length of the clinical trials for each drug and other factors. The expiration dates of our patents and patent applications referred to above are without regard to potential patent term extension or other market exclusivity that may be available to us.
除專利外,在某些情況下,我們可能會依賴商業祕密來保護我們的技術並保持我們的競爭地位。但是,商業祕密可能很難 保護。我們通過與員工、企業 和科學合作者、顧問、科學顧問、承包商和其他第三方簽訂的保密協議,部分地保護我們的專有技術和工藝。我們還尋求通過維護我們場所的物理安全以及我們信息技術系統的物理和電子安全 來維護我們數據和商業祕密的完整性和機密性。
政府規章
美國、 聯邦、州和地方一級以及其他國家和司法管轄區(包括歐盟和英國)的政府當局廣泛監管研究、開發、測試、製造、質量控制、批准、包裝、儲存、 記錄保存、標籤、廣告、促銷、分銷、營銷、批准後監測和報告,醫藥產品進出口 。在美國、外國和司法管轄區獲得監管批准的過程, 以及隨後遵守適用的法規和法規以及其他監管機構,需要花費 大量的時間和財政資源。正如我們在此披露的,我們正在尋求將我們的候選產品和其他配方授權給許可合作伙伴 。雖然此處規定的許多規則和法規適用於我們,但有些規則和法規更適用於尋求對我們的任何候選產品進行臨牀試驗、獲得監管部門批准和商業化的任何 許可合作伙伴, 這可能會對我們獲得的任何許可收入產生影響。
美國的藥品審查和審批
在美國,FDA根據《聯邦食品、藥品和化粧品法案》(FDCA)和實施條例對 藥物進行監管。在產品開發過程、批准過程或批准後的任何時候,如果申請人 和/或申辦者未能遵守適用的美國要求,可能會受到各種行政或司法制裁,包括FDA拒絕批准待決申請、撤回批准 、實施臨牀暫停、發出警告信和其他類型的執行信,產品召回、產品 扣押、全部或部分暫停生產或分銷、禁令、罰款、拒絕政府合同、歸還、挪用利潤、禁止參與政府贊助的醫療保健項目(如醫療保險),或FDA和司法部、司法部或其他政府實體提起的民事或刑事調查和處罰。
申請人尋求批准在美國上市和分銷新 藥品通常必須執行以下操作:
| • | 按照FDA的 藥物非臨牀研究質量管理規範或GLP法規完成臨牀前(或非臨牀)實驗室試驗、動物研究和製劑研究; |
| • | 向FDA提交IND申請,該申請必須在人體臨牀試驗開始前生效; |
| • | 在各臨牀試驗機構入組受試者之前,由獨立機構審查委員會或IRB或代表各臨牀試驗機構的倫理委員會批准臨牀方案; |
| • | 可能啟動和完成建立安全劑量範圍的連續臨牀試驗; |
| • | 根據藥物臨牀試驗質量管理規範或GCP以及其他臨牀試驗相關法規進行充分且控制良好的人體臨牀試驗 ,以確定擬定製劑在每種適應症中的安全性和有效性; |
| • | 準備並向FDA提交新藥申請,或NDA,或生物製品許可證申請,或BLA; |
| 71 |
| 《目錄》 |
| • | 在適當或適用的情況下,由FDA諮詢委員會對提交的材料進行審查; |
| • | 滿意地完成FDA對生產產品或其組件的一個或多個製造設施的一次或多次檢查,以評估符合cGMP要求,並確保設施、方法和控制足夠 以保持產品的特性、強度、質量和純度; |
| • | 令人滿意地完成FDA對臨牀試驗地點的審計,以確保符合GCP和臨牀數據的完整性; |
| • | 支付使用費,並確保FDA批准NDA或BLA; |
| • | 同意遵守FDA要求的任何批准後要求,包括風險評估和緩解策略或REMS,以及批准後研究。 |
| • | FDA審查和批准《食品和藥物管理局》的保密協議或許可證。 |
臨牀前研究
臨牀前研究包括對原料藥或原料藥和配方成品或藥品的純度和穩定性進行實驗室評估,以及在試管中和動物研究,以評估該藥物的安全性和活性,用於在人類身上進行初步測試,並建立用於治療的理論基礎。臨牀前研究的實施須遵守聯邦和州的法規和要求,包括GLP法規。 臨牀前測試的結果與生產信息、分析數據、任何可用的臨牀數據或文獻以及臨牀試驗計劃等一起,作為IND的一部分提交給FDA。IND是FDA授權給人類使用研究產品的請求,必須在人體臨牀試驗開始之前生效。一些長期的非臨牀測試,如生殖不良事件和致癌性的動物測試,可能會在IND提交後繼續進行。
2022年12月29日簽署成為法律的2023年綜合撥款法案(P.L.117-328)修訂了FDCA和公共衞生服務法,規定藥物和生物製品的非臨牀測試可以包括,但不是必需的體內動物實驗。根據修改後的語言, 贊助商可以通過完成各種體外培養化驗(例如基於細胞的化驗、器官芯片或微生理系統),硅片研究(例如,計算機建模)、其他基於人類或非人類生物學的測試(例如,生物打印),或者體內動物實驗。
支持NDA的人體臨牀試驗
Clinical trials involve the administration of the investigational product to human subjects under the supervision of qualified investigators in accordance with GCP requirements, which include, among other things, the requirement that all research subjects provide their informed consent in writing before their participation in any clinical trial. Clinical trials are conducted under written study protocols detailing, among other things, the inclusion and exclusion criteria, the objectives of the study, the parameters to be used in monitoring safety and the effectiveness criteria to be evaluated. A protocol for each clinical trial and any subsequent protocol amendments must be submitted to the FDA as part of the IND. An IND automatically becomes effective 30 days after receipt by the FDA, unless before that time the FDA raises concerns or questions related to a proposed clinical trial and places the clinical trial on clinical hold. In such a case, the IND sponsor and the FDA must resolve any outstanding concerns before the clinical trial can begin. Accordingly, submission of an IND may not result in the FDA allowing clinical trials to commence. A separate submission to an existing IND must also be made for each successive clinical trial conducted during development of a product candidate, and the FDA must grant permission, either explicitly in writing or implicitly by not objecting, before each clinical trial can begin.
臨牀試驗開始後,FDA也可以 對該試驗實施臨牀暫停或部分臨牀暫停。臨牀暫停是FDA向申辦者發出的推遲 擬議臨牀研究或暫停正在進行的研究的命令。部分臨牀暫停是指延遲或暫停IND要求的僅部分臨牀工作 。在實施臨牀暫停或部分臨牀暫停後不超過30天,FDA 將向申辦者提供暫停依據的書面解釋。在發佈臨牀暫停或部分臨牀暫停後, 只有在FDA通知申辦者調查可以繼續後,才能恢復調查。
| 72 |
| 《目錄》 |
此外,代表參加臨牀試驗的每個機構的IRB 必須在該機構開始任何臨牀試驗之前審查和批准該計劃,並且 IRB必須至少每年進行一次持續審查和重新批准研究。IRB必須審查和批准(除其他事項外)研究方案和向研究受試者提供的知情同意書信息。IRB必須遵守FDA的規定。
有些試驗由試驗申辦方組織的獨立 合格專家組(稱為數據安全監測委員會或委員會,簡稱DSMB)監督。該小組根據只有該小組保留的 研究可用數據的訪問權限,授權是否可以在指定檢查點推進試驗。
有關某些臨牀試驗的信息, 包括方案和最終研究結果的詳細信息,必須在特定時間範圍內提交給美國國立衞生研究院 ,以在其www.example.com網站上公開發布。與產品、患者人羣、 研究階段、研究中心和研究者以及臨牀試驗的其他方面相關的信息作為臨牀試驗註冊的一部分而公開 。申辦者也有義務在完成臨牀試驗後披露其結果。 這些審判結果的披露在某些情況下可能會延遲至審判結束之日後的兩年。未按照法律規定及時註冊受保臨牀研究或提交研究結果,可能會導致民事罰款,並且 也會阻止違規方從聯邦政府獲得未來的補助金。美國衞生和人類服務部的最終規則和NIH關於www.example.com註冊和報告要求的補充政策於2017年生效,NIH和FDA都對不符合要求的臨牀試驗申辦者採取了執法行動。
人體臨牀試驗通常分三個連續的 階段進行,即I期、II期和III期,這些階段可能重疊或合併:
| • | 第一階段.候選產品最初引入健康人類受試者,並進行安全性、劑量耐受性、 吸收、代謝、分佈和排泄測試。對於某些用於嚴重或危及生命的疾病的候選產品,特別是 當候選產品本身毒性太大,無法在倫理上給予健康志願者時,通常 在患者中進行初始人體試驗。 |
| • | 第二階段.在有限的患者人羣中評價候選產品,以確定可能的不良反應和 安全性風險,初步評價候選產品對特定目標疾病的療效,並確定劑量耐受性、 最佳劑量和給藥方案。 |
| • | 第三階段.在地理上分散的臨牀試驗中心開展臨牀試驗,以進一步評估擴大的 患者人羣中的劑量、臨牀療效、效價和安全性。這些臨牀試驗旨在確定候選產品的總體風險/受益 比,並在適當時為批准和產品標籤提供充分的依據。這些試驗可能包括 與安慰劑和/或其他對照治療的比較。治療持續時間通常會延長,以模擬產品在上市期間的實際使用情況。 |
批准後臨牀試驗,有時稱為第四階段臨牀試驗,可在初步上市批准後進行。這些臨牀試驗用於從預期治療適應症患者的治療中獲得更多經驗,特別是用於長期安全隨訪。在某些情況下,FDA可能會強制執行IV期臨牀試驗,作為批准NDA或BLA的條件。
在2023年綜合撥款法案中,國會修訂了FDCA,要求第三階段臨牀試驗的贊助商或新藥的其他“關鍵研究”支持上市授權, 提交此類臨牀試驗的多樣性行動計劃。行動計劃必須包括贊助商的註冊多樣性目標, 以及這些目標的基本原理和贊助商將如何實現這些目標的描述。贊助商必須在贊助商將試驗方案提交給FDA審查之前向FDA提交多樣性行動計劃。FDA可能會對多樣性行動計劃的部分或全部要求給予豁免。目前尚不清楚多樣性行動計劃如何影響第三階段試驗計劃 以及FDA將在此類計劃中預期的時間或具體信息,但如果FDA反對贊助商的多樣性行動計劃,並要求贊助商修改計劃或採取其他行動,它可能會推遲試驗啟動。
詳細説明臨牀試驗結果的進度報告必須至少每年提交給FDA,如果發生嚴重不良事件,則更頻繁地提交。此外,對於下列任何一種情況,必須向FDA提交IND 安全報告:嚴重的和意外的可疑不良反應;其他研究或動物或體外培養試驗表明暴露於該藥物中的人存在重大風險;以及在嚴重疑似不良反應的情況下,與方案或研究人員手冊中列出的情況相比,是否存在臨牀上重要的 增加。第一階段、第二階段和第三階段臨牀試驗可能不會在任何指定的時間內成功完成,或者根本不會成功完成。此外,FDA或贊助商可隨時以各種理由暫停或終止臨牀試驗,包括髮現研究對象暴露在不可接受的健康風險中。同樣,如果臨牀試驗不是按照IRB的要求進行的,或者如果藥物 與患者受到意外的嚴重傷害有關,IRB可以暫停或終止對其機構或其所代表機構的臨牀試驗的批准。FDA通常會檢查一個或多個臨牀站點,以確保符合GCP,並確保與NDA或BLA一起提交的臨牀數據的完整性。
| 73 |
| 《目錄》 |
向FDA提交NDA或BLA
Assuming successful completion of required clinical testing and other requirements, the results of the preclinical studies and clinical trials, together with detailed information relating to the product’s chemistry, manufacture, controls and proposed labeling, among other things, are submitted to the FDA as part of an NDA or BLA requesting approval to market the product candidate for one or more indications. Data may come from company-sponsored clinical trials intended to test the safety and effectiveness of a use of a product, or from a number of alternative sources, including studies initiated by investigators. To support marketing approval, the data submitted must be sufficient in quality and quantity to establish the safety and effectiveness of the investigational drug product to the satisfaction of the FDA. In particular, a BLA must contain proof of the biological product candidate’s safety, purity, potency and efficacy for its proposed indication or indications. Under federal law, the submission of most NDAs is additionally subject to a substantial application user fee, and the sponsor of an approved NDA is also subject to an annual program user fee. These fees are typically increased annually. Certain exceptions and waivers are available for some of these fees, such as an exception from the application fee for products with orphan designation and a waiver of the application fee for the first application filed by a qualifying small business.
FDA在收到NDA的60天內對其進行初步審查,並在FDA收到申請後的第74天內通知申辦者, 申請是否足夠完整,可以進行實質性審查。FDA可以要求提供更多信息,而不是接受NDA 進行備案。在這種情況下,申請必須與附加信息一起重新提交。重新提交的申請在FDA接受申請之前也要經過 的審查。一旦申請被接受備案,FDA將開始進行深入的實質性審查。 FDA已同意在NDA和BLA的審查過程中指定性能目標。大多數此類申請將在提交之日起的十個月內進行審查 ,大多數"優先審查"產品的申請將在提交之日起的六個月內進行審查 。儘管有這些審查目標,FDA對NDA或BLA的審查超出目標日期並不罕見。例如,FDA可能會將審查過程延長三個月,以考慮申請人提供的新信息或澄清 ,以解決FDA在原始提交後發現的未決缺陷。
FDA可以將新的 藥物或生物製品或存在安全性或有效性難題的藥物或生物製品的申請提交給諮詢委員會, 通常是一個由獨立臨牀醫生和其他專家組成的小組,以供審查、評估和建議是否批准 申請以及在何種條件下批准。FDA不受諮詢委員會建議的約束,但 在做出決定時會仔細考慮這些建議,通常會遵循諮詢委員會的建議。
在批准NDA之前,FDA通常 將檢查正在或將要生產產品的工廠。這些批准前檢查涵蓋與NDA或BLA提交相關的所有設施 ,包括藥物或生物組分生產(如API)、成品生產、 和控制檢測實驗室。FDA將不會批准申請,除非其確定生產工藝和設施 符合cGMP要求,並足以確保產品在要求的質量標準範圍內一致生產。此外, 在批准NDA之前,FDA通常會檢查一個或多個臨牀研究中心,以確保符合GCP。
快速通道、突破性治療和優先審查指定
FDA有權指定某些產品進行加速 審查,如果這些產品旨在解決在治療嚴重或危及生命的疾病或病症時未滿足的醫療需求。這些 項目是快速通道指定、突破性治療指定和優先審查指定。
具體而言,FDA可指定產品 進行快速通道審查,如果該產品預期單獨或與一種或多種其他藥物聯合用於治療嚴重 或危及生命的疾病或病症,並且該產品證明瞭通過提供 不存在的治療或根據療效或安全性因素可能優於現有治療的治療,解決未滿足的醫療需求的潛力。對於快速通道產品, 申辦者可能會與FDA進行更頻繁的互動,FDA可能會在申請完成前啟動對快速通道產品 NDA或BLA的部分的審查。如果FDA在對申辦者提交的臨牀數據進行初步評估 後確定快速通道產品可能有效,則可以進行滾動審查。申辦者還必須提供提交剩餘信息的時間表,且必須得到FDA的批准,並且申辦者必須在提交NDA或BLA的第一部分時支付適用的用户費用。但是,FDA審查快速通道申請的時間段目標在 NDA的最後一部分提交後才開始。此外,如果FDA認為 快速通道指定不再得到臨牀試驗過程中出現的數據的支持,FDA可能會撤銷該指定。
| 74 |
| 《目錄》 |
FDA可根據IND申辦方的要求,授予符合某些法定標準的藥物或生物製劑突破性治療指定 。如果產品單獨或與一種或多種其他藥物聯合使用,用於治療嚴重或危及生命的疾病 或病症,並且初步臨牀證據表明該產品在一個或多個具有臨牀意義的終點(例如在臨牀開發早期觀察到的實質性治療效果)上顯示出比現有療法 的實質性改善,則該產品可被指定為突破性 療法。FDA 可能會針對突破性治療採取某些措施,包括在整個開發過程中與申辦者舉行會議 ;及時向產品申辦者提供有關開發和批准的建議;讓更多高級人員參與審評 流程;為審評團隊指定跨學科項目負責人;以及採取其他措施以高效的方式設計臨牀試驗 。此外,突破性療法有資格獲得各自上市申請的加速批准。
FDA可以指定一種產品進行優先審查,如果它是一種治療嚴重疾病的藥物,如果獲得批准,將提供顯著改善安全性或有效性。FDA在提交上市申請時, 根據具體情況確定,與其他可用療法相比,擬定藥物是否具有顯著改善 。顯著改善可通過以下證據來説明: 某種疾病治療的有效性增加、治療限制性藥物反應的消除或顯著減少、患者 依從性的增加(可能導致嚴重結局改善),或在新亞羣中有安全性和有效性的證據。優先 指定旨在將整體注意力和資源引導到此類申請的評估上,並將FDA對原始BLA或NME NDA的上市申請採取行動的 目標從 申請之日起從10個月縮短到6個月。
即使產品符合上述一個或多個 項目的資格,FDA也可能在稍後決定該產品不再符合資格條件,或者決定FDA審查或批准的時間 不會縮短。此外,快速通道指定、突破性治療指定和優先 審查不會改變批准的科學或醫學標準或支持批准所需的證據質量,並且 最終不會加快開發或審查過程。
加速審批途徑
FDA可加速批准 用於治療嚴重或危及生命的疾病的藥物或生物製劑,該疾病比現有 治療方法更能為患者提供有意義的治療優勢,基於嚴格對照的臨牀試驗確定該藥物對 合理可能預測臨牀獲益的替代終點有影響。當產品 對中間臨牀終點的影響可以早於對不可逆發病率或死亡率 或IMM的影響進行測量,並且考慮到嚴重性、罕見性, 或疾病的流行程度以及替代治療的可用性或缺乏。獲得加速批准的藥物和生物製品 必須符合與獲得傳統批准的藥物和生物製品相同的法定安全性和有效性標準。
為了加速批准, 替代終點是一種標誌物,例如實驗室測量值、放射學圖像、體徵或其他被認為 可預測臨牀獲益但本身不是臨牀獲益的指標。替代終點通常比臨牀終點更容易或 更快地測量。中間臨牀終點是治療效果的測量,被合理地認為 可能預測藥物或生物製劑的臨牀獲益,例如對IMM的影響。FDA在基於中間臨牀終點的加速批准方面經驗有限,但已指出,如果有依據 得出結論認為治療效果合理可能預測藥物或生物製劑的最終臨牀受益,則此類終點通常可支持加速批准, 由終點測量的治療效果本身不是臨牀獲益和傳統批准的基礎。
加速批准途徑 最常用於疾病病程較長且需要較長時間來測量藥物預期臨牀獲益 的情況,即使對替代或中間臨牀終點的影響迅速發生。例如,加速批准 已廣泛用於各種癌症治療藥物的開發和批准,其中治療的目標 通常是提高生存率或降低發病率,而典型病程的持續時間需要長時間,有時是大型 臨牀試驗來證明臨牀或生存益處。
The accelerated approval pathway is usually contingent on a sponsor’s agreement to conduct, in a diligent manner, additional post-approval confirmatory studies to verify and describe the drug’s clinical benefit. As a result, a drug candidate approved on this basis is subject to rigorous post-marketing compliance requirements, including the completion of Phase IV or post-approval clinical trials to confirm the effect on the clinical endpoint. Failure to conduct required post-approval studies, or confirm a clinical benefit during post-marketing studies, would allow the FDA to withdraw the drug from the market on an expedited basis. All promotional materials for drug candidates approved under accelerated regulations are subject to prior review by the FDA. As part of the Consolidated Appropriations Act for 2023, Congress provided FDA additional statutory authority to mitigate potential risks to patients from continued marketing of ineffective drugs previously granted accelerated approval. Under the act’s amendments to the FDCA, FDA may require the sponsor of a product granted accelerated approval to have a confirmatory trial underway prior to approval. The sponsor must also submit progress reports on a confirmatory trial every six months until the trial is complete, and such reports are published on FDA’s website. The amendments also give FDA the option of using expedited procedures to withdraw product approval if the sponsor’s confirmatory trial fails to verify the claimed clinical benefits of the product.
| 75 |
| 《目錄》 |
FDA關於NDA或BLA的決定
The FDA reviews an NDA to determine, among other things, whether a product is safe and effective for its intended use and whether its manufacturing is cGMP-compliant to assure and preserve the product’s identity, strength, quality and purity. The FDA reviews a BLA to determine, among other things whether the product is safe, pure and potent and the facility in which it is manufactured, processed, packed or held meets standards designed to assure the product’s continued safety, purity and potency. The approval process is lengthy and often difficult, and the FDA may refuse to approve an NDA or BLA if the applicable regulatory criteria are not satisfied or may require additional clinical or other data and information. On the basis of the FDA’s evaluation of the NDA and accompanying information, including the results of the inspection of the manufacturing facilities, the FDA may issue an approval letter or a complete response letter. An approval letter authorizes commercial marketing of the product with specific prescribing information for specific indications. A complete response letter indicates that the review cycle of the application is complete and the application will not be approved in its present form. A complete response letter generally outlines the deficiencies in the submission and may require substantial additional testing or information in order for the FDA to reconsider the application. If and when those deficiencies have been addressed to the FDA’s satisfaction in a resubmission of the NDA or BLA, the FDA will issue an approval letter. The FDA has committed to reviewing such resubmissions in two or six months depending on the type of information included. Even with submission of this additional information, the FDA ultimately may decide that the application does not satisfy the regulatory criteria for approval.
If the FDA approves a product, it may limit the approved indications for use for the product, require that contraindications, warnings or precautions be included in the product labeling, require that post-approval studies, including Phase IV clinical trials, be conducted to further assess the drug’s safety after approval, require testing and surveillance programs to monitor the product after commercialization, or impose other conditions, including distribution restrictions or other risk management mechanisms, such as REMS, which can materially affect the potential market and profitability of the product. The FDA may prevent or limit further marketing of a product based on the results of post-market studies or surveillance programs. The FDA may also require an applicant to develop a REMS as a condition of approval to ensure that the benefits of the product outweigh its risks and to assure its safe use. REMS use risk minimization strategies beyond the professional labeling to ensure that the benefits of the product outweigh the potential risks. To determine whether a REMS is needed, the FDA will consider the size of the population likely to use the product, seriousness of the disease, expected benefit of the product, expected duration of treatment, seriousness of known or potential adverse events, and whether the product is a new molecular entity. REMS can include medication guides, physician communication plans for healthcare professionals, and elements to assure safe use, or ETASU. ETASU may include, but are not limited to, special training or certification for prescribing or dispensing, dispensing only under certain circumstances, special monitoring, and the use of patient registries. The FDA may require a REMS before approval or post-approval if it becomes aware of a serious risk associated with use of the product. If the FDA concludes a REMS is needed as a condition of approval, the sponsor must submit a proposed REMS during the application review process; the FDA will not approve the NDA without an approved REMS, if required. The requirement for a REMS can materially affect the potential market and profitability of a product. After approval, many types of changes to the approved product, such as adding new indications, manufacturing changes and additional labeling claims, are subject to further testing requirements and FDA review and approval.
審批後要求
根據FDA批准生產或分銷的藥物或生物製品 受FDA普遍和持續的監管,其中包括 有關記錄保存、定期報告、產品抽樣和分銷、廣告和促銷以及產品不良反應報告 的要求。批准後,對已批准產品的大多數變更(如增加新適應症或其他標籤聲明)均需 事先經過FDA審查和批准。對於任何上市產品,還存在持續的年度項目費用要求,以及對臨牀數據補充申請的 新申請費用。
此外,藥品和生物製品製造商 以及參與生產和分銷獲批藥品或生物製品的其他實體必須向FDA和州政府機構註冊其機構 ,並接受FDA和相關州政府 機構的定期預先或突擊檢查,以符合cGMP和其他監管要求。製造工藝的變更受到嚴格監管,通常 在實施前需要事先獲得FDA批准。FDA法規還要求調查和糾正與 cGMP的任何偏差,並對申辦者和申辦者可能決定使用的任何第三方製造商實施報告和文件要求。因此,製造商必須繼續在生產和質量控制領域花費時間、金錢和精力,以保持 cGMP合規性。
一旦獲得批准,如果未能保持對監管要求和標準的遵守,或者產品上市後出現問題,FDA可以 撤回批准。後來發現產品以前未知的問題,包括嚴重度或頻率超出預期的不良事件,或製造工藝,或不符合監管要求,可能導致修訂已批准的標籤以增加新的安全性信息;強制進行上市後研究或臨牀試驗以評估新的安全性風險;或實施REMS項目下的分銷或其他限制。其他潛在後果包括:
| • | 限制產品的銷售或生產、完全從市場上撤出產品或產品召回; |
| 76 |
| 《目錄》 |
| • | 對批准後的臨牀試驗處以罰款、警告信或暫停; |
| • | FDA拒絕批准待決的NDA或已批准NDA的補充,或暫停或撤銷產品許可證批准 ; |
| • | 扣押、扣留產品,或者拒絕允許產品進出口的; |
| • | 禁制令或施加民事或刑事處罰。 |
FDA嚴格規範投放市場的產品的營銷、標籤、廣告和 促銷,我們必須遵守FDA的廣告和促銷要求,例如 與直接面向消費者的廣告、行業贊助的科學和教育活動以及涉及互聯網的促銷活動有關的要求 ,以及禁止將產品用於 產品批准標籤中未描述的用途或用於患者人羣(稱為"標籤外使用")。藥品和生物製品僅可用於批准的 適應症並根據批准的標籤規定進行促銷。雖然醫生可以處方合法可用的產品 用於標籤外用途,但製造商不得銷售或推廣此類用途。FDA和其他機構積極執行禁止推廣標籤外使用的法律法規, 被發現不當推廣標籤外使用的公司可能會承擔 重大責任。
In addition, the distribution of prescription pharmaceutical products is subject to the Prescription Drug Marketing Act, or PDMA, which regulates the distribution of drugs and drug samples at the federal level, and sets minimum standards for the registration and regulation of drug distributors by the states. Both the PDMA and state laws limit the distribution of prescription pharmaceutical product samples and impose requirements to ensure accountability in distribution. Furthermore, the Drug Supply Chain Security Act, or DSCSA, was enacted with the aim of building an electronic system to identify and trace certain prescription drugs distributed in the United States, including most biological products. The DSCSA mandates phased-in and resource-intensive obligations for pharmaceutical manufacturers, wholesale distributors, and dispensers over a 10-year period, which culminated in November 2023. Most recently, the FDA announced a one-year stabilization period to November 2024, giving entities subject to the DSCSA additional time to finalize interoperable tracking systems and to ensure supply chain continuity. From time to time, new legislation and regulations may be implemented that could significantly change the statutory provisions governing the approval, manufacturing and marketing of products regulated by the FDA. It is impossible to predict whether further legislative or regulatory changes will be enacted, or FDA regulations, guidance or interpretations changed or what the impact of such changes, if any, may be.
仿製藥的縮寫新藥申請
1984年,隨着Hatch—Waxman FDCA修正案的通過,國會授權FDA批准與FDA 先前根據法規的NDA條款批准的藥物相同的仿製藥,並頒佈了FDCA第505(b)(2)條。要獲得仿製藥的批准,申請人 必須向FDA提交簡化的新藥申請或ANDA。為支持此類申請,仿製藥生產商可依賴 對先前根據NDA批准的藥品(稱為參考 上市藥物或RLD)進行的臨牀前和臨牀試驗。
具體地説,為了使ANDA獲得批准,FDA必須發現仿製藥在有效成分、給藥途徑、劑型和藥物強度方面與RLD相同。同時,FDA還必須確定仿製藥與創新藥具有生物等效性。根據該法規,如果仿製藥的吸收速度和程度與上市藥物的吸收速度和程度沒有顯示出顯著差異,則仿製藥在生物上等同於RLD。
在ANDA獲得批准後,FDA會在其出版物《經過治療等效性評估的已批准藥物產品》(也稱為《橙色手冊》)中指出該仿製藥是否與RLD在治療方面具有等效性。醫生和藥劑師認為治療性的等同仿製藥完全可以替代RLD。此外,通過某些州法律和眾多醫療保險計劃的實施,FDA指定的治療等效性通常會導致在處方醫生或患者不知情或未經其同意的情況下替代仿製藥。
相比之下,第505(B)(2)節允許在至少部分批准所需的信息來自不是由申請人或為申請人進行的研究且申請人沒有獲得參考權的情況下提交保密協議。第505(B)(2)節的申請人可以消除進行某些臨牀前或臨牀研究的需要,如果它可以確定依賴對以前批准的產品進行的研究在科學上是合適的 。與創新藥物生物等效版的開發商使用的ANDA途徑不同,ANDA途徑不允許申請者 提交除生物利用度或生物等效性數據以外的新臨牀數據,505(B)(2)監管途徑不排除後續申請者需要進行額外的臨牀試驗或非臨牀研究的可能性;例如,他們可能 正在尋求批准將先前批准的藥物用於新的適應症或用於需要新的臨牀 數據來證明安全性或有效性的新患者羣體。然後,FDA可以批准RLD已獲批准的所有或部分標籤適應症的新產品,或適用於第505(B)(2)節申請人尋求的任何新適應症。
| 77 |
| 《目錄》 |
此外,根據Hatch-Waxman修正案,在RLD的任何適用的非專利專有期到期之前,FDA不得批准ANDA或505(B)(2)NDA。FDCA下的這些市場排他性條款還會推遲某些申請的提交或批准。FDCA為含有新化學實體的新藥提供了為期五年的非專利數據獨佔期。藥物是一種新的化學實體 如果FDA以前沒有批准過任何其他含有相同活性部分的新藥,這是負責藥物物質作用的分子或離子 。在授予這種專有權的情況下,ANDA或505(B)(2)NDA在五年期滿之前不得向FDA提交,除非提交的文件附有第四款證明(如下所述),在這種情況下,申請人可以在原始產品批准後四年提交申請。
FDCA還規定,如果FDA認為由申請人或為申請人進行的一項或多項新的臨牀研究(生物利用度或生物等效性研究)對批准申請至關重要,則NDA、505(B)(2)NDA或其補充項的數據排他期為三年。這三年的專營期通常保護以前批准的藥物產品的變更,例如新的劑型、給藥途徑、組合 或適應症。這項為期三年的專營權僅涵蓋與新的臨牀研究相關的使用條件,並不禁止FDA批准含有原始活性物質的藥物的後續申請。五年和三年的排他性也不會延遲提交或批准根據FDCA第505(B)(1)條提交的傳統保密協議。然而,提交傳統保密協議的申請人將被要求進行或獲得所有臨牀前研究和充分且受控良好的臨牀試驗的參照權,以證明安全性和有效性。
Hatch-Waxman專利認證和30個月的逗留
在NDA或其補充文件 獲得批准後,NDA申辦者必須向FDA列出每項專利,其中包括涵蓋申請人產品或已批准的產品使用方法的權利要求。NDA贊助商列出的每一項專利都在橘書中公佈。當ANDA申請人向FDA提交 申請時,申請人必須向FDA證明關於橘書中列出的參考產品 的任何專利,但涉及ANDA申請人不尋求批准的使用方法的專利除外。如果 第505(b)(2)節NDA申請人依賴於對已獲批准產品進行的研究,則申請人必須向FDA證明 關於橘書中所列已獲批准產品的任何專利,其程度與ANDA申請人相同。
具體而言,申請人必須就每項專利證明 :
| I. | 原申請人未提交所需專利資料的; |
| 二、 | 上市專利已經到期的; |
三.所列專利尚未 到期,但將在特定日期到期,並在專利到期後尋求批准;或
四.所列專利無效, 不能執行或不會因製造,使用或銷售新產品而受到侵犯。
如果 提交了第I段或第II段認證,FDA可在完成審核後立即批准申請。如果提交了第三段證明 ,則批准可以在申請中指定的專利到期日生效,但臨時批准 可以在該時間之前發佈。如果申請包含第IV段認證,將觸發一系列事件,其結果 將決定ANDA或505(b)(2)申請的批准生效日期。
證明新產品不會 侵犯已批准產品列出的專利,或證明這些專利無效或不可執行,稱為第 IV段證明。如果後續申請人已向FDA提供第IV段認證,則一旦FDA受理相關後續申請並提交 ,申請人還必須向NDA和專利持有人發送第IV段認證通知 。專利法和專利權人可以根據第四段證明的通知提起專利侵權訴訟。 在收到第IV段認證後45天內提出專利侵權訴訟, FDA將自動阻止其批准ANDA或505(b)(2)NDA,直至收到第IV段通知後30個月、 專利到期或侵權案件中對ANDA或505(b)(2)申請人有利的決定後(以較早者為準)。或者,如果所列專利 持有人未在規定的45天期限內提起專利侵權訴訟,則後續申請人的ANDA或 505(b)(2)NDA將不受30個月延期的約束。
生物製品的參考產品排他性
2010年3月,美國頒佈了《患者保護和平價醫療法案》(ACA),其中包括2009年《生物製品價格競爭和創新法案》(BPCIA)。BPCIA修訂了PHSA,為FDA許可的參比生物製品生物仿製藥或可互換 的生物製品創建了簡化的批准途徑。到目前為止,FDA已經批准了許多生物類似藥,並且許多生物類似藥 在歐洲獲得了批准。FDA還發布了幾份指導文件,概述了其審查和批准生物仿製藥 和可互換生物仿製藥的方法,並創建了一個公共數據庫,其中包含FDA許可的所有生物製品(包括生物仿製藥)的信息,稱為Purple Book。
| 78 |
| 《目錄》 |
生物仿製藥產品定義為 與參比產品高度相似,儘管臨牀非活性組分存在微小差異,且生物製品與參比產品之間在產品安全性、純度和效價方面不存在 具有臨牀意義的差異 。可互換產品是一種生物仿製藥產品,預期在任何給定患者中產生與參比產品相同的臨牀結果,對於個體多次給藥的產品,產品和參比產品 可以在先前給藥後交替或互換,而不會增加安全性風險或降低療效的風險 相對於對照品的專用使用,沒有進行上述變更或切換。在獲得FDA許可後,可以使用可互換的 生物仿製藥替代參比產品,而無需處方參比產品的醫療保健提供者的幹預。
生物仿製藥申請人必須根據以下數據證明產品為 生物仿製藥:(1)分析研究表明生物仿製藥產品與參比產品高度相似; (2)動物研究(包括毒性);以及(3)一項或多項臨牀研究,以證明在參比產品獲批的一個或多個適當使用條件下的安全性、純度和效力。此外,申請人必須證明生物仿製藥 和參比產品在標籤、給藥途徑、劑量和規格上的使用條件方面具有相同的作用機制, 生產設施必須符合旨在確保產品安全性、純度和效價的標準。
A reference biological product is granted 12 years of data exclusivity from the time of first licensure of the product, and the first approved interchangeable biologic product will be granted an exclusivity period of up to one year after it is first commercially marketed. As part of the Consolidated Appropriations Act for 2023, Congress amended the PHSA in order to permit multiple interchangeable products approved on the same day to receive and benefit from this one-year exclusivity period. If pediatric studies are performed and accepted by the FDA as responsive to a Written Request, the 12-year exclusivity period will be extended for an additional six months. In addition, the FDA will not accept an application for a biosimilar or interchangeable product based on the reference biological product until four years after the date of first licensure of the reference product. “First licensure” typically means the initial date the particular product at issue was licensed in the United States. Date of first licensure does not include the date of licensure of (and a new period of exclusivity is not available for) a supplement for the reference product for a subsequent application filed by the same sponsor or manufacturer of the reference product (or licensor, predecessor in interest or other related entity) for a change (not including a modification to the structure of the biological product) that results in a new indication, route of administration, dosing schedule, dosage form, delivery system, delivery device or strength or for a modification to the structure of the biological product that does not result in a change in safety, purity or potency. Therefore, one must determine whether a new product includes a modification to the structure of a previously licensed product that results in a change in safety, purity or potency to assess whether the licensure of the new product is a first licensure that triggers its own period of exclusivity. Whether a subsequent application, if approved, warrants exclusivity as the “first licensure” of a biological product is determined on a case-by-case basis with data submitted by the sponsor.
BPCIA很複雜,FDA仍在解釋和實施。此外,最近的政府提案試圖縮短12年參考產品獨佔期 。BPCIA的其他方面,其中一些可能影響BPCIA的排他性條款,也成為訴訟的主題。 因此,BPCIA的最終影響、實施和意義存在重大不確定性。
兒科研究和排他性
Under the Pediatric Research Equity Act, or PREA, amendments to the FDCA, an NDA, BLA or supplement thereto must contain data that are adequate to assess the safety and effectiveness of the drug product for the claimed indications in all relevant pediatric subpopulations, and to support dosing and administration for each pediatric subpopulation for which the product is safe and effective. With enactment of the FDASIA in 2012, PREA was made permanent and sponsors are required submit pediatric study plans to FDA prior to the assessment data. In particular, a sponsor that is planning to submit a marketing application for a product that includes a new active ingredient, new indication, new dosage form, new dosing regimen or new route of administration submit an initial Pediatric Study Plan, or PSP, within 60 days of an end-of-Phase II meeting or, if there is no such meeting, as early as practicable before the initiation of the Phase III or Phase II/III study. The initial PSP must contain an outline of the proposed pediatric study or studies the applicant plans to conduct, including study objectives and design, age groups, relevant endpoints and statistical approach, or a justification for not including such detailed information and any request for a deferral of pediatric assessments or a full or partial waiver of the requirement to provide data from pediatric studies along with supporting information. The FDA and the sponsor must reach an agreement on the PSP. A sponsor can submit amendments to an agreed-upon initial PSP at any time if changes to the pediatric plan need to be considered based on data collected from preclinical studies, early phase clinical trials and/or other clinical development programs.
| 79 |
| 《目錄》 |
FDA可主動或應申請人的要求,批准部分或所有兒科數據的提交,直至產品批准用於成人, 或完全或部分豁免兒科數據要求。法律現在要求FDA向未能提交PREA要求的兒科評估、未能尋求或獲得延期 或延期延期或未能申請批准所需兒科製劑的申辦者發送PREA不符合 函。它進一步要求FDA公開 發佈PREA不符合函和申辦者的回覆。除非法規另有要求,否則兒科數據要求 不適用於具有孤兒藥指定的產品,儘管FDA已採取措施限制其認為在PREA中濫用該法定豁免 ,宣佈不打算授予任何額外的孤兒藥指定給罕見的兒科亞羣( 否則為常見疾病)。
此外,兒科排他性是美國的另一種 非專利營銷排他性,如果獲得批准,將在任何現有監管排他性或上市專利的期限內附加額外的六個月的營銷保護 。如果NDA申辦者提交的兒科數據對FDA的此類數據的書面請求做出了公正的迴應,則可以授予此六個月的排他性。數據不需要 表明產品在研究的兒科人羣中有效;相反,如果臨牀試驗被認為公平地響應 FDA的要求,則授予額外保護。如果在法定時限內向FDA提交併接受所需兒科研究的報告,則無論產品的任何法定或監管期限或專利保護期限 都將延長六個月,包括孤兒藥的排他性。這不是專利期限的延長,但它有效地延長了FDA無法批准另一項申請的監管期限。FDA發出的書面申請並不要求申辦方 進行所述研究。
孤兒藥物的指定和排他性
根據孤兒藥法案,如果用於治療罕見疾病或病症,FDA可以指定 藥品為"孤兒藥"(通常意味着它影響不到20萬人在美國,如果沒有合理預期開發成本 並且在美國製造用於治療疾病或病症的藥品將從產品的銷售中回收)。公司必須在提交保密協議之前申請孤兒產品名稱。如果申請被批准,FDA將披露治療劑的身份及其潛在用途。孤兒產品指定並不會在監管審查和批准過程中傳遞任何優勢或縮短 的持續時間。
如果具有孤兒指定的產品隨後 獲得FDA首次批准,用於其具有此類指定的疾病或病症,或用於其指定的罕見疾病或病症中的特定適應症或用途,則該產品通常將獲得孤兒產品的排他性。孤兒產品的排他性 是指FDA在七年內不得批准同一產品用於相同適應症的任何其他申請,除非 在某些有限的情況下,例如通過更高的 有效性、更高的安全性或為患者護理提供重大貢獻或在藥物供應問題的情況下,顯示出優於孤兒產品的臨牀優越性。但是,競爭對手 可能獲得批准,用於相同適應症的不同產品,而孤立產品具有排他性,或用於相同 產品,但用於不同適應症(然後可在孤立適應症中標籤外使用)。如果指定 為孤兒產品的藥物或製劑最終獲得上市批准,其適應症範圍超出其孤兒產品申請中指定的範圍, 可能無權享有排他性。
專利期限的恢復和延長
如果符合某些法定和法規要求, 涵蓋根據PMA批准的藥物、生物製品或醫療器械的美國專利的期限也有資格在獲得FDA批准時獲得專利期限延長。專利有效期延長的長度 與產品在專利有效期間接受監管審查的時間長度有關。Hatch—Waxman法案允許專利期限 在為專利設定的到期日之後最多延長五年。但是,專利延期不能將專利的剩餘期限 延長至自產品批准之日起總共14年。只有一項專利可適用於已批准的藥物, 才可獲得延期,且必須在專利到期前申請延期。美國專利貿易局與FDA協商,審查 並批准任何專利期限延長或恢復的申請。歐洲和某些其他外國司法管轄區也有類似的條款 ,以延長涵蓋已批准藥物的專利期限,前提是滿足法定 和監管要求。
美國以外的監管
為了在 美國以外地區銷售任何產品,公司還必須遵守其他國家和司法管轄區關於 質量、安全性和有效性以及管理(除其他外)藥品的臨牀試驗、上市許可、商業銷售和分銷 的眾多和不同的監管要求。無論產品是否獲得FDA批准,該公司都需要獲得 類似外國監管機構的必要批准,然後才能在這些國家或司法管轄區開始產品的臨牀試驗或上市銷售。 批准流程最終因國家和司法管轄區而異,可能涉及額外的產品測試和額外的行政 審查期。在其他國家和司法管轄區獲得批准所需的時間可能與獲得FDA批准所需的時間不同,而且比獲得FDA批准所需的時間更長。一個國家或司法管轄區的監管批准並不確保另一個國家或司法管轄區的監管批准,但未能 或延遲在一個國家或司法管轄區獲得監管批准可能會對其他國家或司法管轄區的監管過程產生負面影響。
| 80 |
| 《目錄》 |
歐盟的監管和營銷授權
歐盟 藥品批准的流程基本上遵循與美國相同的路線,同樣,通常涉及滿意地完成以下每一項 :
| • | 臨牀前實驗室試驗、動物研究和製劑研究均按照適用的歐盟藥物非臨牀研究質量管理規範進行; |
| • | 向相關國家主管部門提交臨牀試驗申請或CTA,必須在人類臨牀試驗開始前獲得批准; |
| • | 進行充分且受控良好的臨牀試驗,以確定產品對每種擬定適應症的安全性和有效性; |
| • | 向相關主管部門提交上市許可申請或MAA,其中包括支持 安全性和有效性的數據,以及臨牀開發中產品的生產和成分的詳細信息以及擬定 標籤; |
| • | 相關國家主管部門滿意地完成了對生產產品的生產設施(包括 第三方的設施)的檢查,以評估產品是否符合嚴格執行的現行cGMP; |
| • | 可能對產生支持MAA的數據的非臨牀和臨牀試驗地點進行審計;以及 |
| • | 在對產品進行任何商業營銷、銷售或發貨之前,應由MAA的相關主管當局進行審查和批准。 |
臨牀前研究
臨牀前試驗包括產品化學、配方和穩定性的實驗室評價 ,以及動物研究中評價毒性的研究,以評估產品的潛在安全性和有效性。臨牀前試驗的實施和試驗用化合物的配製必須符合 相關的歐盟法規和要求。臨牀前試驗結果以及相關生產信息 和分析數據作為CTA的一部分提交。
臨牀試驗批准
新的臨牀試驗法規(EU) No 536/2014於2022年1月31日生效,旨在簡化和簡化歐盟臨牀試驗的批准。 該法規的主要特點包括:通過單一入口點、臨牀試驗 信息系統或CTIS簡化的申請程序;為申請準備和提交的單一文件集以及簡化的臨牀試驗申辦者報告程序 ;以及用於評估臨牀試驗申請的協調程序,該程序分為 兩個部分。第I部分由指定的報告成員國進行評估,其評估報告提交給申辦者 和已提交臨牀試驗授權申請的所有歐盟成員國 的所有其他主管當局(相關成員國)進行審查。第二部分由每個有關會員國單獨評估。已為臨牀試驗申請的評估制定了嚴格的期限 。相關倫理委員會在評估程序中的作用 將繼續受相關成員國的國家法律管轄。但是,總體相關時間表將由 臨牀試驗法規定義。
與美國一樣,歐盟(EudraCT)網站www.example.com和其他國家/地區也有發佈臨牀試驗信息的類似要求 。
歐盟的頂級稱謂
2016年3月,EMA啟動了一項計劃 ,以促進適應症(通常罕見)的候選產品開發,目前很少或沒有治療方法。優先 藥物(或PRIME)計劃旨在鼓勵在未滿足醫療需求的領域進行藥物開發,並提供對代表根據集中程序審查的重大創新的產品的加速評估 。中小企業( 或中小企業)的產品可能比大型公司更早地進入PRIME計劃。具有PRIME指定的候選產品的申辦者獲得了許多好處 ,包括但不限於,與EMA進行早期和主動的監管對話,頻繁討論臨牀 試驗設計和其他開發項目元素,以及在提交申報資料後 加速上市許可申請評估。重要的是,在PRIME計劃的早期,從人用藥品委員會(CHMP)或高級治療委員會(CAT)任命了一名專門的FDA聯繫人和特別報告員,以促進EMA 委員會層面對產品的瞭解。啟動會議啟動了這些關係,幷包括EMA的一個多學科專家團隊,為總體開發和監管戰略提供 指導。
| 81 |
| 《目錄》 |
營銷授權
為獲得歐盟監管體系下的 產品的上市許可,申請人必須根據 EMA管理的集中程序或歐盟成員國主管當局管理的程序之一(分散程序、 國家程序或相互承認程序)提交MAA。上市許可只能授予在 歐盟成立的申請人。法規(EC)No 1901/2006規定,在獲得歐盟上市許可之前,申請人 必須證明符合EMA批准的兒科研究計劃(PIP)中包含的所有措施,涵蓋兒科人羣的所有亞組 ,除非EMA已批准(1)產品特定豁免,(2)集體放棄或(3)推遲一項或 包括在PIP中的一項或多項措施。
集中程序規定,歐盟委員會授予單一 上市許可,該許可在整個歐洲經濟區內有效(即,歐洲聯盟以及冰島、列支敦士登和挪威)。根據法規(EC)第726/2004號,集中程序對於特定產品是強制性的, 包括通過某些生物技術工藝生產的藥物、指定為孤兒藥產品的產品、高級治療 藥品和含有新活性物質的產品,用於治療某些疾病,包括 癌症治療產品。對於含有新活性物質的產品,適用於治療其他疾病,以及具有高度創新性的產品,或者集中過程符合患者利益的產品,集中過程可能是可選的。集中 程序也可應申請人的要求用於某些其他情況。
在集中化程序下,CHMP 還負責幾項授權後和維護活動,例如評估對現有營銷授權的修改或擴展。根據歐洲聯盟的中央程序,評估一項重大影響評估的最長時限為210天,不包括計時器停頓,但申請人應提供補充信息或書面或口頭解釋,以回答CHMP的問題。在特殊情況下,如果從公共衞生的角度,特別是從治療創新的角度來看,一種藥用產品具有重大的價值,CHMP可能會給予加速評估。如果中國藥品監督管理局接受這一請求,210天的期限將縮短為150天,但如果中國藥品監督管理局認為不再適合進行加速評估,可以恢復到 集中程序的標準時限。 在這一期限結束時,中國藥品監督管理局就是否應該批准與 有關的醫藥產品的上市授權提出科學意見。在收到CHMP的最終意見後15個歷日內,歐盟委員會必須準備一份關於銷售授權申請的決定草案。該決定草案必須考慮到該意見和歐盟法律的任何相關規定。在對醫藥產品的集中授權申請作出最後決定之前,歐盟委員會必須與人用藥品常設委員會協商。常設委員會由歐洲聯盟成員國的代表組成,由一名無投票權的歐盟委員會代表擔任主席。歐洲議會也有一個相關的“權利”。歐洲議會的作用是確保歐盟委員會在決定批准或拒絕批准營銷授權方面沒有越權。
歐盟委員會可能會授予所謂的 “在特殊情況下的營銷授權”。此類授權適用於申請人 能夠證明其在正常使用條件下無法提供有關有效性和安全性的全面數據的產品,因為相關產品的適應症非常罕見,因此無法合理地期望申請人提供全面的證據,或者在目前的科學知識狀態下,無法提供全面的信息,或者收集此類信息將 違反公認的醫學道德原則。因此,在 特殊情況下,可根據特定義務授予營銷授權,這些義務可能包括:
| • | 申請人必須在主管當局規定的時間內完成確定的學習計劃,其結果構成重新評估收益/風險概況的基礎; |
| • | 有關醫藥產品只能根據醫療處方供應,在某些情況下,只能在嚴格的醫療監督下使用,可能是在醫院,如果是放射性藥物,則由授權的人員使用;以及 |
| • | 包裝傳單和任何醫療信息必須提請醫生注意 有關所涉藥品的現有細節在某些具體方面尚不充分。 |
在特殊情況下的營銷授權須接受年度審查,以在年度重新評估程序中重新評估風險與收益的平衡。繼續 授權與年度重新評估相關,負面評估可能會導致 營銷授權被暫停或撤銷。然而,在特殊情況下,醫藥產品的上市授權的續簽遵循與“正常”銷售授權相同的規則。因此,在特殊情況下授予的營銷授權最初為五年,之後授權將無限期生效,除非EMA決定安全理由值得 再續簽一次五年。
| 82 |
| 《目錄》 |
歐盟委員會還可以在獲得申請獲得全面營銷授權所需的全面臨牀數據之前,批准所謂的“有條件營銷授權”。如果(I)候選產品的風險-收益平衡為正,(Ii)申請人很可能能夠提供所需的全面臨牀試驗數據,(Iii)產品滿足未得到滿足的醫療需求,以及(Iv)相關醫藥產品立即上市對公眾健康的益處,則可對候選產品(包括被指定為孤兒藥品的藥品)授予此類有條件的營銷授權,條件是:(I)候選產品的風險-效益平衡為正,(Ii)申請人很可能能夠提供所需的全面臨牀試驗數據,(Iii)產品滿足未得到滿足的醫療需求,以及(Iv)相關藥品在市場上立即上市對公眾健康的益處超過了仍需要額外數據的情況下所固有的風險。有條件的營銷授權可包含營銷授權持有人必須履行的具體義務,包括完成正在進行的或新的研究的義務,以及收集藥物警戒數據的義務。有條件營銷授權的有效期為一年,如果風險-收益平衡保持為正,並且在評估了附加或修改條件和/或特定義務的必要性後,可每年續簽一次。上述集中程序的時間表也適用於CHMP對有條件營銷授權申請的審查。
歐盟藥品規則明確 允許歐盟成員國通過國家立法,禁止或限制銷售、供應或使用含有特定類型的人類或動物細胞(如胚胎幹細胞)、由其組成或衍生的任何醫療產品。雖然我們正在開發的產品 不使用胚胎幹細胞,但某些歐盟成員國 的國家法律可能會禁止或限制我們將產品商業化,即使這些產品已獲得歐盟上市許可。
與集中式授權程序不同, 分散式上市授權程序需要向產品上市的每個歐盟成員國的主管當局單獨申請,並獲得其單獨批准。本申請與通過集中程序提交給EMA進行授權的申請 相同。參考歐盟成員國在收到有效申請後120天內準備 評估草案和相關材料草案。生成的評估 報告將提交給相關歐盟成員國,歐盟成員國必須在收到後90天內決定是否批准評估 報告和相關材料。如果相關歐盟成員國因擔心可能對公共健康造成嚴重風險而無法批准評估報告和相關材料,則有爭議的內容可提交歐盟委員會,其決定對所有歐盟成員國具有約束力。
同樣,互認程序的基礎是歐洲聯盟成員國主管當局接受歐洲聯盟其他成員國主管當局對醫藥產品的銷售授權。國家營銷授權的持有者可以向歐盟成員國的主管部門提交申請,要求該主管部門承認另一個歐盟成員國的主管部門提供的營銷授權。
2023年4月,歐盟委員會發布了一項提案,將修訂和取代現有的一般藥品立法。如果按照目前的提議通過和實施,這些修訂將極大地改變歐盟藥品開發和審批的幾個方面。
歐盟的監管數據保護
在歐盟,根據2001/83/EC指令,根據完整的獨立數據包獲得批准的創新醫藥產品有資格獲得八年的數據獨佔權 和另外兩年的市場獨佔權。第(EC)726/2004號條例對按照集中授權程序授權的藥品重複了這一權利。數據排他性使這些創新產品的仿製藥授權申請者 無法參考創新者的數據來評估仿製藥(簡化)申請,期限為 8年。在額外的兩年市場獨佔期內,可以 提交和授權仿製藥營銷授權申請,並可以參考創新者的數據,但在市場獨家經營權到期之前,任何仿製藥都不能投放到歐洲 聯盟市場。如果在這十年中的前八年中,營銷授權持有人獲得了一個或多個新的治療適應症的授權,那麼整個十年的期限將延長到最多11年。 在授權之前的科學評估中,這些適應症被認為與現有療法相比能夠帶來顯著的臨牀益處。即使一種化合物被認為是一種新的化學實體,從而創新者獲得了規定的 數據獨佔期,如果另一家公司獲得了基於MAA的營銷 授權,該公司也可以銷售該產品的另一個版本,該MAA具有完整的獨立數據包,包括藥物測試、臨牀前測試和臨牀試驗。
| 83 |
| 《目錄》 |
授權期和續期
營銷授權的初始有效期原則上為五年。營銷授權可在歐洲市場管理局或歐盟成員國主管當局重新評估風險-收益平衡的基礎上在五年後續簽。為此,營銷授權持有人 必須向EMA或主管當局提供關於質量、安全和有效性的文件的合併版本,包括自授予營銷授權以來引入的所有變化,至少在營銷授權失效前 六個月。歐盟委員會或歐盟成員國主管當局可在與藥物警戒有關的正當理由下決定繼續進行為期五年的上市授權期。一旦隨後最終續簽, 營銷授權的有效期為無限期。任何授權之後,如果沒有在授權失效後三年內將藥品實際投放到歐盟市場(如果是集中程序)或授權的歐盟成員國的市場(所謂的日落條款)。
兒科研究
在歐盟獲得營銷授權之前,申請者必須證明符合EMA批准的兒科調查計劃(PIP)中包括的所有措施,涵蓋兒科人口的所有子集,除非EMA已批准特定產品豁免、類別豁免 或推遲PIP中包括的一項或多項措施。所有銷售授權程序的各自要求 載於(EC)第1901/2006號條例,稱為《兒科條例》。當 公司想要為已獲授權的藥物添加新的適應症、藥物形式或給藥途徑時,此要求也適用。EMA的兒科委員會,或PDCO,可能會批准某些藥物的延期,允許公司推遲兒童藥物的開發 ,直到有足夠的信息證明其對成人的有效性和安全性。當不需要或不適合在兒童中開發藥物時,PDCO也可以給予豁免,例如隻影響老年人口的疾病。
在提交營銷授權申請或修改現有營銷授權之前,EMA確定公司確實遵守了每個相關PIP中列出的商定研究和措施 。
獲得營銷授權後的監管要求
如果在歐盟獲得醫藥產品的授權,則營銷授權的持有者必須遵守適用於醫藥產品的製造、營銷、推廣和銷售的一系列要求。這些措施包括:
| • | 必須確保遵守歐盟嚴格的藥物警戒或安全報告規則。這些規則可以規定授權後的研究和額外的監測義務。 |
| • | 授權藥品的生產(其必須單獨獲得生產商許可證)也必須嚴格遵守適用的歐盟法律、法規和指南,包括 指令2001/83/EC、指令2003/94/EC、法規(EC)No 726/2004和歐盟委員會藥品生產質量管理規範指南 。這些要求包括在生產醫藥產品和活性藥物成分時遵守歐盟cGMP標準,包括在歐盟以外生產活性藥物成分並打算將活性藥物成分進口到歐盟。 |
| • | 授權藥物的營銷和推廣,包括行業贊助的繼續醫學教育 和針對藥物處方者和/或公眾的廣告,在歐盟受到嚴格的監管,特別是 指令2001/83 EC(經修訂)和歐盟成員國法律的約束。歐盟禁止直接面向消費者的處方藥廣告 。 |
孤兒藥物的指定和排他性
在EMA孤兒藥品委員會的評估 之後,歐盟委員會將MTX 110設計為孤兒藥品。根據法規 (EC)第141/2000號和法規(EC)第847/2000號,歐盟委員會可授予孤兒藥產品名稱, 申辦者可確定其預期用於診斷、預防或治療危及生命或慢性衰弱疾病的產品,且在歐盟每10,000人中影響不超過5人,或在歐盟存在危及生命、嚴重衰弱 或嚴重慢性疾病,如果沒有激勵措施,在歐盟銷售該藥物 不太可能產生足夠的回報來證明必要的投資是合理的。此外,申辦者必須確定,在歐盟沒有 其他令人滿意的診斷、預防或治療疾病的方法,或者如果存在此類方法, 擬定的孤兒藥將對患者有顯著的益處。
| 84 |
| 《目錄》 |
Orphan drug designation is not a marketing authorization. It is a designation that provides a number of benefits, including fee reductions, regulatory assistance, and the possibility to apply for a centralized European Union marketing authorization, as well as ten years of market exclusivity following a marketing authorization. During this market exclusivity period, neither the EMA, the European Commission nor the member states can accept an application or grant a marketing authorization for a similar medicinal product. A “similar medicinal product” is defined as a medicinal product containing a similar active substance or substances as those contained in an authorized orphan medicinal product and that is intended for the same therapeutic indication. The market exclusivity period for the authorized therapeutic indication may be reduced to six years if, at the end of the fifth year, it is established that the orphan designation criteria are no longer met, including where it is shown that the product is sufficiently profitable not to justify maintenance of market exclusivity. In addition, a competing similar medicinal product may in limited circumstances be authorized prior to the expiration of the market exclusivity period, including if it is shown to be safer, more effective or otherwise clinically superior to the already approved orphan drug. Furthermore, a product can lose orphan designation, and the related benefits, prior to us obtaining a marketing authorization if it is demonstrated that the orphan designation criteria are no longer met.
一般資料保障規例
收集、使用、披露、轉移、或以其他方式處理有關歐盟內個人的個人數據,包括個人健康數據,受2018年5月25日生效的歐盟《一般數據保護條例》(簡稱GDPR)的約束。GDPR的範圍很廣, 對處理個人數據的公司提出了許多要求,包括與處理健康和其他敏感數據有關的要求、徵得與個人數據相關的個人的同意、向個人提供有關數據處理活動的信息、實施保障措施以保護個人數據的安全和機密性、在數據泄露時提供通知 ,以及在使用第三方處理器時採取某些措施。GDPR還對將個人數據轉移到歐盟以外的國家(包括美國)實施了嚴格的規則,並允許數據保護當局對違反GDPR的行為處以鉅額 罰款,包括可能高達2000萬歐元或全球年收入的4%的罰款,以金額較大者為準。GDPR還賦予數據主體和消費者協會一項私人訴訟權利,可以向監管當局提出投訴,尋求司法補救,並就違反GDPR造成的損害獲得賠償。遵守GDPR將是一個嚴格且耗時的過程,可能會增加開展業務的成本或要求公司改變其業務做法以確保完全合規。
2023年7月,歐盟委員會通過了一項關於將數據從歐盟傳輸到美國的新機制的充分性決定-歐盟-美國數據隱私框架 ,該框架為歐盟中的個人提供了幾項新的權利,包括訪問其 數據,或更正或刪除不正確或非法處理的數據的權利。充分性決定是在簽署了一項行政命令後做出的,該命令引入了新的具有約束力的保障措施,以解決歐洲聯盟法院在其對一起被稱為Schrems II,這使之前的歐盟-美國隱私盾牌無效。值得注意的是,新的義務旨在 確保美國情報機構只能在必要和相稱的範圍內訪問數據,並建立獨立的 公正的補救機制來處理歐洲人關於出於國家安全目的收集他們的數據的投訴。 歐盟委員會將在其充分性決定的同時不斷審查美國的發展。如果事態發展影響到適用法域的保護水平,則可以調整甚至撤回充分性決定。歐盟數據保護機構未來的行動很難預測。一些客户或其他服務提供商可能會對這些不斷變化的法律法規做出迴應,要求我們做出無法 或不願做出的某些隱私或數據相關的合同承諾。這可能會導致失去現有或潛在客户或其他業務關係。
在聯合王國退出歐盟之後,聯合王國(作為聯合王國的GDPR)實施了GDPR。英國GDPR與英國《2018年數據保護法》並駕齊驅,該法案將歐盟GDPR中的某些克減措施納入英國法律。根據英國GDPR,未在英國設立但在英國處理與向個人提供商品或服務有關的個人數據或監控其行為的公司將受到英國GDPR的約束-英國GDPR的要求(目前)與歐盟GDPR下的要求基本一致,因此可能導致類似的合規和運營成本,潛在罰款最高可達1,750萬GB或全球營業額的4%。2021年6月28日,歐盟委員會發布了一項決定,即聯合王國確保對根據歐盟GDPR從歐盟轉移到英國的個人數據提供足夠的保護。2022年,英國政府提出並辯論了數據保護和數字信息法案,以在一個立法框架下協調2018年數據保護法、英國GDPR以及隱私和電子通信法規。然而,隨着政府繼續評估數據保護改革的最優方法,該法案的進展停滯不前。2021年6月,歐盟委員會發布了一項決定,將在2025年6月27日日落時不採取進一步行動,即聯合王國確保對根據GDPR從歐盟轉移到英國的個人數據提供足夠的保護。英國議會目前正在審議數據保護和數字信息法案,以在一個立法框架下協調2018年數據保護法、英國GDPR以及隱私和電子通信法規 。
此外,截至2024年1月,英國議會正在審議數據保護和數字信息法案,以將2018年數據保護法、英國GDPR以及隱私和電子通信法規統一在一個立法框架下。
| 85 |
| 《目錄》 |
批准產品的定價決策
In the European Union, pricing and reimbursement schemes vary widely from country to country. Some countries provide that products may be marketed only after a reimbursement price has been agreed. Some countries may require the completion of additional studies that compare the cost-effectiveness of a particular product candidate to currently available therapies or so-called health technology assessments, in order to obtain reimbursement or pricing approval. For example, the European Union provides options for its Member States to restrict the range of products for which their national health insurance systems provide reimbursement and to control the prices of medicinal products for human use. Member States may approve a specific price for a product or it may instead adopt a system of direct or indirect controls on the profitability of the company placing the product on the market. Other Member States allow companies to fix their own prices for products, but monitor and control prescription volumes and issue guidance to physicians to limit prescriptions. Recently, many countries in the European Union have increased the amount of discounts required on pharmaceuticals and these efforts could continue as countries attempt to manage health care expenditures, especially in light of the severe fiscal and debt crises experienced by many countries in the European Union. The downward pressure on health care costs in general, particularly prescription products, has become intense. As a result, increasingly high barriers are being erected to the entry of new products. Political, economic and regulatory developments may further complicate pricing negotiations, and pricing negotiations may continue after reimbursement has been obtained. Reference pricing used by various Member States, and parallel trade, i.e., arbitrage between low-priced and high-priced Member States, can further reduce prices. There can be no assurance that any country that has price controls or reimbursement limitations for pharmaceutical products will allow favorable reimbursement and pricing arrangements for any products, if approved in those countries.
專利期延長
為了補償專利權人 在獲得專利產品上市許可方面的延誤,可以授予補充證書或SPC,以將該特定產品的獨佔期延長最多五年。SPC的申請必須向 每個歐盟成員國的相關專利局提出,並且授予證書僅在授予成員國有效。專利所有人必須 在歐盟首次授予上市許可後的六個月內(假設 中的專利未過期、失效或被撤銷)或在專利授予後的六個月內(如果首次授予上市許可, )提出申請。在SPC的上下文中,術語"產品"是指 醫藥產品的活性成分或活性成分的組合,術語"專利"是指保護此類產品或其新生產工藝或申請的專利 。SPC的持續時間計算為專利申請日期與首次上市許可日期之間的差值 減去五年,最長任期為五年。
如果專利權人已執行商定的兒科研究計劃,授權產品信息包括 研究結果信息,且產品在歐盟所有成員國獲得授權,則可獲得SPC的6個月兒科延期。
英國法規
從2021年1月1日起,歐盟法律 不再直接適用於英國。英國已採用現行歐盟藥品法規作為獨立的 英國立法,並進行了一些修訂,以反映有關上市許可的程序和其他要求 和其他監管條款。
藥品和保健產品監管局(MHRA)負責監管英國藥品市場(大不列顛及北愛爾蘭)。為了 在英國銷售藥品,製造商必須持有英國授權。2021年1月1日,所有歐盟 上市許可均轉換為英國上市許可,但製造商可選擇退出。英國 已針對監管申報和藥品MA引入了單獨的英國特定流程,MHRA指南指出, 英國將有權考慮根據歐盟分散和相互 認可程序進行的上市許可。2024年1月1日,MHRA啟動了國際認可程序(IRP),該程序為已從受信任的合作機構(如EMA或FDA)獲得積極上市授權決定的產品提供了加速 授權程序。根據獨立專家小組,有兩條可供評估及認可的途徑:
| · | 認可途徑A—自提交文件生效後60天 |
| o | 申請必須在前兩年內基於參考監管或RR MA |
| o | 與RR批准的質量申報資料的任何顯著差異都需要根據認可進行評估 途徑B |
| o | 提交材料時應提供生產地點符合GMP要求的證據 |
| o | 不符合任何認可途徑B標準 |
| · | 認可途徑B—自提交文件生效之日起110天,計劃在第70天停止一次(最多 60天),以便申請人對審查期間發現的問題作出迴應 |
| o | 申請必須基於前十年內的RR上市許可。 |
| 86 |
| 《目錄》 |
| o | 要求認可途徑B的標準除其他外包括: |
| § | RR授予有條件或特殊情況的上市許可 |
| § | 申請中包含的其他生產地點未經RR評估,或某個生產地點 未經GMP認證 |
| § | 與RR批准的工藝相比,生產工藝有實質性變更 |
| § | 某些產品類型(例如,高級治療藥品、孤兒藥、非處方藥) |
| § | 風險管理計劃未經駐地代表評估 |
| § | RR要求對產品進行一項或多項上市後安全性研究 |
| § | 正確使用產品需要伴隨診斷 |
英國藥品立法 根據《2021年藥品和醫療器械法案》,未來將發生監管變化。該法案為通過 藥品法規制定了一個新的框架。
在北愛爾蘭實施《北愛爾蘭議定書》後,不同的規則適用於北愛爾蘭 ,根據該議定書,歐盟集中營銷申請將繼續適用 。然而,2023年3月,英國政府和歐盟委員會就取代《北愛爾蘭議定書》的監管框架達成協議,稱為《温莎框架》。温莎框架預計將於2025年1月1日起實施,並將改變北愛爾蘭議定書下的現有制度,包括 英國對醫藥產品的監管。具體而言,MHRA將負責批准所有擬在英國上市的藥物(即,英國和北愛爾蘭),而EMA將不再參與批准打算在北愛爾蘭銷售的藥物。
《貿易與合作協定》規定了歐盟與英國之間的夥伴關係框架,於2021年1月1日生效。歐洲聯盟和聯合王國之間的貿易與合作協定 包含一個與藥品有關的附件,目的是 促進藥品的供應、促進公眾健康和消費者保護藥品。附件 規定了藥品生產質量管理規範(GMP)檢查和證書的相互認可,這意味着生產設施 無需在兩個市場接受重複檢查。該附件設立了一個醫藥產品工作組, 處理貿易和合作協定項下的事項,促進合作並進行技術討論。 預計將繼續就《貿易與合作協定》 以外的監管領域(包括藥物警戒)進行進一步雙邊討論。《貿易與合作協定》也不包括承認批測試認證的互惠安排 。然而,英國列出了批准的國家,包括歐洲經濟區,這將使英國進口商 和批發商能夠認可某些認證和監管標準。歐洲聯盟委員會沒有采用這種承認程序。
預計建立一個單獨的聯合王國授權系統,儘管聯合王國有過渡性的承認程序,但將導致額外的監管費用。 此外,由於批檢測和相關監管措施缺乏相互承認,可能會產生額外的監管成本 。
醫療保健法律法規
醫療保健提供者、醫生和第三方 支付方在獲得上市批准的藥品的推薦和處方中發揮着主要作用。與 第三方付款人和客户的協議受廣泛適用的欺詐和濫用以及其他醫療保健法律法規的約束。適用的聯邦和州醫療保健法律和法規下的此類限制 包括以下內容:
| • | 除其他外,聯邦反回扣法規禁止任何人故意和故意 直接或間接以現金或實物形式尋求、提供、接受或提供報酬,以誘導或獎勵 將個人轉介,或購買、訂購或推薦任何商品或服務, 可全部或部分付款 ,根據聯邦醫療保健計劃(如Medicare和Medicaid);個人或實體不需要實際瞭解 反回扣法規或違反該法規的具體意圖即可實施違法行為; |
| 87 |
| 《目錄》 |
| • | 聯邦民事和刑事虛假索賠法和民事罰款法,包括聯邦 虛假索賠法,其中禁止個人或實體故意提交或導致提交虛假 或欺詐性索賠,以支付醫療保險、醫療補助或其他聯邦醫療保健計劃或獲得其批准,故意作出,使用 或導致作出或使用虛假記錄或聲明,以證明虛假或欺詐性索賠或支付或轉移 給聯邦政府的義務,或故意隱瞞或故意和不正當地避免或減少或隱瞞向聯邦政府支付款項的義務。根據FCA,即使製造商不直接向 政府付款人提交索賠,如果他們被視為"導致"提交虛假或欺詐索賠,也可能被追究責任。《FCA》還允許個人 個人作為"舉報人"代表聯邦政府提起訴訟,指控違反《FCA》 ,並分享任何金錢回收; |
| • | 《民事貨幣處罰法》,其中禁止提供或給予報酬, 其中包括但不限於無償或低於公平市場價值的任何項目或服務轉讓(除少數例外), 該人知道或應該知道的醫療保險或醫療補助受益人可能會影響受益人選擇 由聯邦或州政府計劃報銷的物品或服務的特定供應商; |
| • | 《1996年聯邦健康保險流通和責任法案》,或HIPAA,對執行欺詐任何醫療福利計劃的計劃或作出與醫療保健事項有關的虛假陳述規定了刑事和 民事責任; |
| • | 經《經濟和臨牀健康衞生信息技術法》及其實施 條例修訂的HIPAA還規定了有關保護個人可識別健康信息的隱私、安全和傳輸 的義務,包括強制性合同條款; |
| • | 《聯邦虛假陳述法》禁止故意和故意偽造、隱瞞或掩蓋重大事實或作出與醫療福利、項目或服務的交付或支付有關的任何重大虛假陳述; |
| • | 《醫師支付陽光法案》的聯邦透明度要求,該法案要求醫療保險、醫療補助或CHIP下的州計劃涵蓋的藥物、設備、生物製品和醫療用品的製造商 向醫療補助服務中心(CMS)報告與向醫生、某些非醫師高級醫療保健從業人員支付和其他價值轉移相關的信息,和教學醫院,或應醫生和教學醫院的要求或代表醫生和教學醫院指定的實體或個人,以及醫生及其直系親屬持有的某些所有權和投資權益;以及 |
| • | 類似的州和外國法律法規,例如州反回扣和虛假索賠法, 可能適用於涉及由非政府第三方 支付方(包括私人保險公司)報銷的醫療保健項目或服務的銷售或營銷安排和索賠。 |
此外,歐盟、英國和其他司法管轄區的類似醫療保健法律和 法規,包括詳細説明與 的互動和向醫療保健提供者付款的報告要求,以及管理某些受保護信息隱私和安全的法律,如GDPR和英國 GDPR,其中規定了收集和使用與位於歐盟的個人有關的個人數據(包括健康數據)的義務和限制。
最後,大多數州也有 與上述聯邦法律類似的法規或條例,其中一些法規或條例的範圍更廣,適用於醫療補助計劃和其他州計劃下報銷的項目和服務,或者在幾個州,無論付款人是誰,都適用。某些州法律要求製藥公司遵守制藥行業的自願合規性指南和聯邦政府頒佈的相關合規性指南 ,此外還要求藥品製造商報告與向臨牀醫生和其他 醫療保健提供者付款或營銷支出相關的信息。一些州和地方司法管轄區要求藥品銷售代表註冊。 在某些情況下,州和外國法律也對健康信息的隱私和安全進行管理,其中許多法律在很大方面 彼此不同,並且通常不會被HIPAA搶先,從而使合規工作複雜化.
由於 這些法律的廣度及其例外和安全港的狹窄性,商業活動可能會受到 根據一項或多項此類法律的質疑。這些法律的範圍和執行都不確定,在當前醫療改革的環境下,特別是在缺乏適用的先例和法規的情況下, 會發生迅速變化。聯邦和 州執法機構最近加強了對醫療保健公司和醫療保健提供者之間互動的審查, 這導致了醫療保健行業的多項調查、起訴、定罪和和解。
確保 與第三方的業務安排符合適用的醫療保健法律和法規不僅成本高昂而且耗時。如果 業務運營被發現違反了上述任何法律或任何其他適用的政府法規, 藥品製造商可能會受到處罰,包括民事、刑事和行政處罰、損害賠償、罰款、剝奪財產、 個人監禁、排除在政府資助的醫療保健計劃(如Medicare和Medicaid)之外、合同損害、名譽 損害,利潤和未來收益減少、額外的報告義務和監督(如果遵守企業誠信協議 或其他協議以解決不遵守這些法律的指控),以及業務縮減或重組,其中任何一種情況 都可能對製藥商經營其業務的能力及其經營結果產生不利影響。
| 88 |
| 《目錄》 |
承保和報銷
The future commercial success of our product candidate or any of our collaborators' ability to commercialize any approved product candidate successfully will depend in part on the extent to which governmental payor programs at the federal and state levels, including Medicare and Medicaid, private health insurers and other third-party payors provide coverage for and establish adequate reimbursement levels for our product candidate. Government health administration authorities, private health insurers and other organizations generally decide which drugs they will pay for and establish reimbursement levels for healthcare. In particular, in the United States, private health insurers and other third-party payors often provide reimbursement for products and services based on the level at which the government, through the Medicare or Medicaid programs, provides reimbursement for such treatments. In the United States, the United Kingdom, the European Union, and other potentially significant markets for our product candidate, government authorities and third-party payors are increasingly attempting to limit or regulate the price of medical products and services, particularly for new and innovative products and therapies, which often has resulted in average selling prices lower than they would otherwise be. Further, the increased emphasis on managed healthcare in the United States and on country and regional pricing and reimbursement controls in the United Kingdom and European Union will put additional pressure on product pricing, reimbursement and usage, which may adversely affect our future product sales and results of operations. These pressures can arise from rules and practices of managed care groups, judicial decisions and laws and regulations related to Medicare, Medicaid and healthcare reform, pharmaceutical coverage and reimbursement policies and pricing in general.
Third-party payors are increasingly imposing additional requirements and restrictions on coverage and limiting reimbursement levels for medical products. For example, federal and state governments reimburse covered prescription drugs at varying rates generally below average wholesale price. These restrictions and limitations influence the purchase of healthcare services and products. Third-party payors may limit coverage to specific drug products on an approved list, or formulary, which might not include all of the FDA-approved drug products for a particular indication. Third-party payors are increasingly challenging the price and examining the medical necessity and cost-effectiveness of medical products and services, in addition to their safety and efficacy. We may need to conduct expensive pharmacoeconomic studies in order to demonstrate the medical necessity and cost-effectiveness of our products, in addition to the costs required to obtain the FDA approvals. Our product candidate may not be considered medically necessary or cost-effective. A payor's decision to provide coverage for a drug product does not imply that an adequate reimbursement rate will be approved. Further, one payor’s determination to provide coverage for a drug product does not assure that other payors will also provide coverage for the drug product. Adequate third-party reimbursement may not be available to enable us to maintain price levels sufficient to realize an appropriate return on our investment in drug development. Legislative proposals to reform healthcare or reduce costs under government insurance programs may result in lower reimbursement for our products and product candidate or exclusion of our product candidate from coverage. The cost containment measures that healthcare payors and providers are instituting and any healthcare reform could significantly reduce our revenues from the sale of any approved product candidates. We cannot provide any assurances that we will be able to obtain and maintain third-party coverage or adequate reimbursement for our product candidate in whole or in part.
醫療改革
在美國和一些外國司法管轄區, 已經並將繼續存在若干關於醫療保健系統的立法和監管變更以及擬議變更, 這些變更可能會阻止或延遲產品和治療候選產品的上市批准,限制或監管批准後活動,並影響 獲得上市批准的產品和治療候選產品的盈利性銷售能力。FDA和其他監管機構 的政策可能會發生變化,並且可能會頒佈其他政府法規,這可能會阻止、限制或延遲對我們產品和治療候選藥物的監管批准。如果我們行動緩慢或無法適應現有要求的變化,或 新要求或政策的採用,或如果我們無法維持監管合規性,我們可能失去 本來可能獲得的任何營銷批准,我們可能無法實現或維持盈利能力,這將對我們的業務、前景、財務狀況 和經營業績造成不利影響。
In addition, the containment of healthcare costs has become a priority of federal and state governments and the prices of therapeutics have been a focus in this effort. The U.S. government, state legislatures and foreign governments have shown significant interest in implementing cost-containment programs to limit the growth of government-paid healthcare costs, including price controls, restrictions on reimbursement, and requirements for substitution of generic and biosimilar products for branded prescription medicines and biologics, respectively. In recent years, the U.S. Congress has considered reductions in Medicare reimbursement levels for medicines administered by physicians. CMS, the agency that administers the Medicare and Medicaid programs, also has authority to revise reimbursement rates and to implement coverage restrictions for most drugs and biologics. Cost reduction initiatives and changes in coverage implemented through legislation or regulation could decrease utilization of and reimbursement for any approved products we may market in the future. While Medicare regulations apply only to pharmaceutical benefits for Medicare beneficiaries, private payors often follow Medicare coverage policy and payment limitations in setting their own reimbursement rates. Therefore, any reduction in reimbursement that results from federal legislation or regulation may result in a similar reduction in payments from private payors.
| 89 |
| 《目錄》 |
The ACA, as amended by the Health Care and Education Affordability Reconciliation Act, was enacted in 2010 and substantially changed the way healthcare is financed by both governmental and private insurers in the United States, and significantly impacted the pharmaceutical industry. The ACA was intended to broaden access to health insurance, reduce or constrain the growth of healthcare spending, enhance remedies against healthcare fraud and abuse, add new transparency requirements for healthcare and health insurance industries, impose new taxes and fees on pharmaceutical manufacturers, and impose additional health policy reforms. With regard to biopharmaceutical products, the ACA, among other things, addressed a new methodology by which rebates owed by manufacturers under the Medicaid Drug Rebate Program are calculated for therapeutics that are inhaled, infused, instilled, implanted or injected, increased the minimum Medicaid rebates owed by manufacturers under the Medicaid Drug Rebate Program and extended the rebate program to individuals enrolled in Medicaid managed care organizations, established annual fees on manufacturers of certain branded prescription medicines, created a new Medicare Part D coverage gap discount program, and expanded the 340B drug discount program. As another example, the 2021 Consolidated Appropriations Act signed into law on December 27, 2020 incorporated extensive healthcare provisions and amendments to existing laws, including a requirement that all manufacturers of medicines and biological products covered under Medicare Part B report the product’s average sales price, to the U.S. Department of Health and Human Services beginning on January 1, 2022, subject to enforcement via civil money penalties.
ACA下的立法和監管變更仍然是可能的,但目前尚不清楚任何此類變更或任何法律將採取何種形式,以及如何或是否會影響整個生物製藥行業或我們未來的業務。我們預計,ACA、Medicare和Medicaid計劃的變更或增加 以及其他醫療改革措施(特別是在個別州的醫療保健准入、融資或其他立法方面)的變更或增加,可能會對美國的醫療保健行業產生重大不利影響。
In addition, there has been heightened governmental scrutiny over the manner in which biopharmaceutical manufacturers set prices for their marketed products. Such scrutiny has resulted in several recent U.S. Congressional inquiries and proposed and enacted federal and state legislation designed to, among other things, bring more transparency to medicine pricing, review the relationship between pricing and manufacturer patient programs, reduce the cost of medicines under Medicare, and reform government program reimbursement methodologies for pharmaceutical products. Notably, on December 20, 2019, the Further Consolidated Appropriations Act for 2020 became law (P.L. 116-94) and included a piece of bipartisan legislation called the Creating and Restoring Equal Access to Equivalent Samples Act of 2019, or the CREATES Act. The CREATES Act aims to address the concern articulated by both the FDA and others in the industry that some brand manufacturers have improperly restricted the distribution of their products, including by invoking the existence of a REMS for certain products, to deny generic and biosimilar product developers access to samples of brand products. Because generic and biosimilar product developers need samples to conduct certain comparative testing required by the FDA, some have attributed the inability to timely obtain samples as a cause of delay in the entry of generic and biosimilar products. To remedy this concern, the CREATES Act establishes a private cause of action that permits a generic or biosimilar product developer to sue the brand manufacturer to compel it to furnish the necessary samples on “commercially reasonable, market-based terms.” Whether and how generic and biosimilar product developments will use this new pathway, as well as the likely outcome of any legal challenges to provisions of the CREATES Act, remain highly uncertain and its potential effects on our future commercial products are unknown.
More recently, in August 2022, President Biden signed into the law the Inflation Reduction Act of 2022, or the IRA. Among other things, the IRA has multiple provisions that may impact the prices of drug products that are both sold into the Medicare program and throughout the United States. Starting in 2023, a manufacturer of a drug or biological product covered by Medicare Parts B or D must pay a rebate to the federal government if the drug product’s price increases faster than the rate of inflation. This calculation is made on a drug product by drug product basis and the amount of the rebate owed to the federal government is directly dependent on the volume of a drug product that is paid for by Medicare Parts B or D. Additionally, starting in payment year 2026, CMS will negotiate drug prices annually for a select number of single-source Part D drugs without generic or biosimilar competition. CMS will also negotiate drug prices for a select number of Part B drugs starting for payment year 2028. If a drug product is selected by CMS for negotiation, it is expected that the revenue generated from such drug will decrease. CMS has begun to implement these new authorities and entered into the first set of agreements with pharmaceutical manufacturers to conduct price negotiations in October 2023. However, the IRA’s impact on the pharmaceutical industry in the United States remains uncertain, in part because multiple large pharmaceutical companies and other stakeholders (e.g., the U.S. Chamber of Commerce) have initiated federal lawsuits against CMS arguing the program is unconstitutional for a variety of reasons, among other complaints. Those lawsuits are currently ongoing.
在美國的州一級,立法機構也越來越多地通過立法並實施旨在控制藥品定價的法規,包括價格或患者報銷限制、折扣、對某些產品准入的限制、營銷成本披露 和透明度措施,在某些情況下,旨在鼓勵從其他國家進口和批量購買。例如, 近年來,幾個州成立了PDAB。與****的藥品價格談判計劃非常相似,這些PDAB試圖在公共和商業醫療計劃中對各自州銷售的藥品實施UPL。2023年8月,科羅拉多州的PDAB宣佈了一份包含五種處方藥的清單,這些藥物將接受負擔能力審查。這些努力的效果仍然不確定 等待幾起挑戰州政府監管處方藥支付限額的權力的聯邦訴訟的結果。此外, 2020年12月,美國最高法院一致認為,聯邦法律不妨礙各州監管藥品福利經理和醫療保健和藥品供應鏈的其他成員的能力,這一重要決定可能會導致各州在這一領域做出進一步和 更積極的努力。2022年年中,聯邦貿易委員會還對PBM行業的做法展開了全面調查,這可能導致針對此類實體的 運營、藥房網絡或財務安排的額外聯邦和州立法或監管提案。改變目前在美國存在的PBM行業的重大努力可能會影響整個藥品供應鏈和其他利益相關者的業務,包括我們這樣的生物製藥開發商 。此外,地區醫療當局和個別醫院越來越多地使用招標程序來確定他們的處方藥和其他醫療保健計劃將包括哪些藥品和供應商。這些措施 一旦獲得批准,可能會降低對我們產品的最終需求,或者給我們的產品定價帶來壓力。
| 90 |
| 《目錄》 |
我們無法預測美國或國外未來的立法或行政或行政行動可能產生的政府監管的可能性、性質或程度。我們預計未來將採取更多的聯邦、州和外國醫療改革措施,其中任何一項都可能限制聯邦和州政府為醫療產品和服務支付的金額,這可能導致 一旦獲得批准,醫療產品和服務的覆蓋範圍和報銷範圍有限,對我們產品的需求減少,或額外的定價壓力。
競爭
我們還面臨來自眾多來源的競爭,包括商業製藥和生物技術企業、學術機構、政府機構以及私營和公共研究機構。我們的許多競爭對手可能擁有明顯更強的研究能力,以及財務、產品開發、製造和營銷資源。
可用於治療T1D的產品相對較少。外源性胰島素的各種形式被用來彌補所有T1D患者普遍缺乏的內源性胰島素。最近,T1D的第一種疾病修改療法teplizumab已被批准用於延遲第三階段T1D。 許多公司正在研究潛在的T1D疾病修改方法,包括Vertex PharmPharmticals公司的幹細胞療法,CRISPR Treeutics AG和SAB BioTreateutics,Inc.正在開發一種免疫療法。JDRF T1D基金已經投資了大約30傢俬營公司,致力於各種治療T1D的方法。根據Clinicaltrials.gov網站,有400多項研究被列為T1D中的招聘 。
目前批准用於治療GBM的產品數量有限,目前的護理標準是手術切除,然後放射治療並聯合替莫唑胺。 對於復發的GBM或DMG的治療,沒有正式的護理標準。有許多公司正在研究潛在的GBM治療方法,包括CNS PharmPharmticals,Inc.和Plus Treateutics,Inc.。Chimerix Inc.是為DMG開發產品的多家公司之一。根據Clinicaltrials.gov網站,大約有340項研究被列為在GBM中招聘,約70項研究在DMG中招聘。
製造業
我們沒有自己的生產設施 ,我們依賴GMP認證的合同製造商提供我們的臨牀試驗材料。
環境問題和季節性
我們可能會不時受到各種環境、健康和安全法律法規的約束,包括空氣排放、水和廢水排放、噪音排放、危險、放射性和生物材料及廢物的使用、管理和處置,以及受污染場地的清理。我們相信,我們的業務、運營和設施在所有實質性方面都符合適用的環境、健康和安全法律法規。根據我們目前掌握的信息,我們預計環境成本和意外情況不會對其產生重大不利影響。然而,我們實驗室規模的製造設施的運營在這些領域存在風險。如果要求這些設施遵守新的或更嚴格的環境或健康和安全法律、法規或要求,未來可能需要大量支出。
我們目前的業務通常不反映任何顯著的季節性。
法律訴訟
我們可能不時受到 在日常業務過程中產生的各種索賠或法律訴訟。除本年報所披露者外, 我們目前並無任何法律訴訟的一方,管理層認為該等訴訟可能或可能合理 對我們的業務、財務狀況或經營業績造成重大不利影響。
物業、廠房及設備
我們目前的總部位於1裏海角,裏海路,加的夫,威爾士,在那裏我們也有我們的實驗室和中試規模的生產設施。我們於2021年4月簽訂了 該等場所的租約。新物業面積為754平方米(約8,118平方英尺)。租約將於2026年8月到期 。我們相信,這一設施將足以滿足我們目前的需要。
| 91 |
| 《目錄》 |
員工
截至截至2022年、2021年和2020財年12月31日的財年結束時,我們按地理位置和職能劃分的員工人數如下:
| 截至12月31日, | ||||||||||||
| 2022 | 2021 | 2020 | ||||||||||
| 業務功能區: | ||||||||||||
| 研發 | 22 | 15 | 13 | |||||||||
| 一般事務及行政事務 | 5 | 5 | 5 | |||||||||
| 總計 | 27 | 20 | 18 | |||||||||
| 截至12月31日, | ||||||||||||
| 2022 | 2021 | 2023 | ||||||||||
| 地理位置: | ||||||||||||
| 英國 | 25 | 19 | 18 | |||||||||
| 德國 | 1 | 1 | -- | |||||||||
| 愛爾蘭共和國 | 1 | -- | -- | |||||||||
| 總計 | 27 | 20 | 18 | |||||||||
據我們所知,我們的員工 目前沒有工會代表或集體談判協議涵蓋的員工。我們認為與員工的關係很好 。
歷史背景與公司結構
我們最初於2000年根據英格蘭和威爾士法律成立為有限責任公司,名稱為Midatech Ltd,通過轉讓位於西班牙馬德里的Consejo Superior de Investigacy Cientifias或CSIC的全球商業化權利和專利權的共同所有權,獲得了其基礎納米顆粒技術。Midatech Ltd是一家專注於研發的生物技術公司,該公司隨後先進和開發了這一黃金納米藥物輸送平臺技術,以增強對臨牀治療選擇有限的主要治療適應症的藥物輸送,特別是針對某些癌症,如肝癌和腦癌。
為了更好地繼續進行Midatech有限公司研發項目的商業開發,Midatech Pharma PLC於2014年9月12日根據英格蘭和威爾士法律註冊成立,成為Midatech有限公司和Midatech Pharma(Wales)Limited的公開控股公司,註冊號為 09216368。2014年12月8日,我們在英國完成了普通股的首次公開募股。
2020年3月31日,我們宣佈,在資本市場普遍狀況的背景下,我們預計無法籌集資金繼續開發MTD201,包括擴大我們畢爾巴鄂工廠的MTD201製造規模。我們決定對我們的業務進行戰略評估, 停止對MTD201的進一步投資,並關閉我們在西班牙畢爾巴鄂的業務,包括裁員我們在畢爾巴鄂的所有員工。
2020年4月20日,我們宣佈了運營戰略評估的更新 ,包括任命Noble Capital Markets,Inc.就從我們的技術中提取 價值的選項向我們提供建議,包括與我們的臨牀階段資產合作、與現有和即將推出的概念驗證配方合作、 合作或出售我們的一項或多項技術或出售整個公司。
2021年1月26日,我們宣佈,戰略審查已完成,我們現在正專注於執行我們調整後的戰略,即部署我們的技術來開發更多早期產品,並在概念驗證階段尋找許可合作伙伴。
2023年3月24日,我們召開了股東大會,股東們批准從2023年4月26日起將我們的名稱更改為“Biodexa PharmPharmticals PLC”,並取消我們的普通股在AIM交易的資格。此外,Midatech Ltd和Midatech Pharma(Wales)Limited後來分別更名為Biodexa Ltd和Biodexa PharmPharmtiucals(Wales)Ltd。
| 92 |
| 《目錄》 |
我們的主要執行辦事處和註冊 辦事處位於1裏海角,裏海路卡迪夫,英國CF 10 4DQ,我們的電話號碼是+44 29 2048 0180。我們在美國的 授權代表是Puglisi and Associates的Donald J. Puglisi。我們在美國的服務代理 是Donald J. Puglisi,Puglisi and Associates,地址:850 Library Avenue,Suite 204,Newark,Delaware 19711。我們的存托股份 在納斯達克資本市場交易,代碼為"BDRX"。
我們向SEC提交報告和其他信息。SEC維護一個互聯網網站,其中包含報告、委託書和信息聲明,以及有關 發行人(包括我們)的其他信息,這些信息以電子方式提交給SEC。我們向SEC提交的文件可通過SEC 網站向公眾提供,網址為 http://www.sec.gov本公司網站 所載信息不屬於本招股説明書的一部分,也不包含在本招股説明書中。
我們有三個全資子公司, 以及幾個間接子公司和合資企業。下表載列本集團的描述。
| 附屬公司 | 註冊國家/地區 | 有表決權的權益 |
| Biodexa Pharmaceuticals PLC的子公司 | ||
| Biodexa Pharmaceuticals(Wales)Limited | 英格蘭和威爾士 | 100% |
| Biodexa有限公司 | 英格蘭和威爾士 | 100% |
| Haaland UK Limited(3) | 英格蘭和威爾士 | 100% |
| 與Biodexa Ltd的合資企業 | ||
| MidaSol治療GP(1)(3) | 開曼羣島 | 50% |
| (2)(3) | 美國(特拉華州) | 50% |
| Biodexa Ltd | ||
| Pharmida AG(3) | 瑞士 | 100% |
_______________
| (1) | Biodexa Ltd和Aquesive Therapeutics的合資企業,前身為MonoSol RX。 |
| (2) | Biodexa Ltd和Immunotope Inc.的合資企業。實體的所有權百分比 參考合夥協議確定,並視承諾的資本而不時有所不同。雖然50%是經濟利益 ,但Biodexa有限公司目前可以直接49%的投票權。 |
| (3) | 休眠實體。 |
資本支出
截至2023年及2022年6月30日止六個月,我們的資本開支分別為4,000英鎊及33,000英鎊,截至2022年及2021年12月31日止年度的資本開支分別為6萬英鎊及32萬英鎊。
截至2023年6月30日及 2022年6月30日止六個月,我們的主要資本支出主要與實驗室設備有關。
截至2022年12月31日及 2021年12月31日止年度,我們的主要資本支出主要與我們在威爾士加的夫的實驗室和中試規模生產設施的投資有關。
| 93 |
| 《目錄》 |
管理
董事和高級管理人員
下表載列了有關我們現任董事和高級管理層的某些信息 。每位董事和管理人員的專業地址為Biodexa Pharmaceuticals PLC,地址為:裏海角,1裏海路,加的夫,CF10 4DQ,英國。
| 姓名(1) |
年齡: 12/31/2023 |
職位/頭銜 | ||
| 董事: | ||||
| 斯蒂芬·斯坦普 | 62 | 首席執行官兼首席財務官、董事 | ||
| 斯蒂芬·帕克(3)(4) | 65 | 董事會非執行主席 | ||
| 西蒙·特頓博士(2)(3)(4) | 56 | 董事高級獨立非執行董事 | ||
| 西門(Simon)de Vries,M.D.(2)(4) | 64 | 非執行董事董事 | ||
| 安·莫錢特(2)(3) | 58 | 非執行董事董事 | ||
| 高級管理人員(5) | ||||
| Dmitry Zamoryakhin,醫學博士 | 43 | 首席科學官 |
__________________________
| (1) | 董事會的任期將在斯坦普先生、帕克博士和梅錢特女士於2026年、德弗里斯博士和特頓博士分別於2024年和2025年舉行的年度股東大會之後立即屆滿。 |
| (2) | 薪酬委員會委員 |
| (3) | 審計委員會委員 |
| (4) | 提名委員會委員 |
| (5) | 除身兼高級管理層成員的董事外。 |
董事
斯蒂芬·斯坦普自2020年3月31日起擔任我們的首席執行官,並自2019年9月起擔任我們的首席財務官和董事會成員。在加入本公司之前,Stamp先生曾於2017年12月至2019年1月擔任Ergmed plc(AIM:ERGO)首席執行官,並於2016年1月至2018年7月擔任首席財務官。2013年3月至2015年7月,Stamp先生擔任Assurex Health,Inc.首席財務官 。2010年11月至2012年10月以及2010年3月至2010年6月,Stamp先生分別擔任EZCORP Inc.(納斯達克代碼:EZPW)和KV PharmPharmticals Co.的首席財務官。斯坦普先生還曾擔任過Xanodyne製藥公司的首席運營官,以及雷格斯公司(現為IWG公司)和夏爾公司(後來被武田製藥有限公司收購)的集團財務董事公司的首席運營官。斯坦普先生是一名特許會計師,擁有畢馬威會計師事務所的資格。斯坦普先生擁有曼徹斯特大學的經濟學學士學位。
斯蒂芬·帕克has served as our Non-Executive Chairman of the Board of Directors and a director since June 2022.Dr. Parker has a career in the healthcare and pharma sector that spans over 30 years, including 10 years in advisory roles. Dr. Parker has served as Managing Director of sp2 Consulting Limited since 2002, as well as an advisor to Opus Corporate Finance LLP since 2019. Dr. Parker has also served as Chairman of Sareum Holdings plc (AIM: SAR) since May 2016 and Drishti Discoveries Limited since January 2021, as Senior Independent Director of MGC Pharmaceuticals Limited (ASX, LSE:MXC) since March 2019, and as a director of Eternans Limited since July 2019 and sp2 Asset Management Limited since September 2018. Previously, Dr. Parker served as a director of Albucasis Limited from September 2013 to September 2019, as Chairman of Liverpool Chirochem Limited from July 2017 to July 2018, and as a director and Chairman of Silence Therapeutics plc (LSE: SLN) from November 2013 to April 2019. Dr. Parker also has corporate finance experience having been an investment banker focusing on pharma and biotechnology with Barings Brothers Limited, SBC Warburg Dillon Read, and Apax Partners LLP, and previously served as a director at subsidiaries of Celtic Pharma GP Limited and Chief Financial Officer of Oxford GlycoSciences. Dr. Parker received his D.Phil in Biochemistry from the University of Oxford, MBA in Business Administration from City University, London, and B.Sc. in Chemical Sciences from the University of East Anglia.
Simon Turton博士.自2014年12月以來一直擔任我們董事會的非執行成員。Turton博士自2014年3月起擔任Q Chip和OpsiRx Pharmaceuticals 的董事長,直至2014年12月被我們收購。自2015年1月起,他擔任Gensmile Limited的董事總經理。2002年,Turton博士加入Warburg Pincus,最近擔任歐洲醫療保健投資活動負責人,直到 2011年6月。Turton博士曾在Archimedes Pharma、Eurand、ProStrakan Group plc和Tornier,Inc.的董事會任職。Turton博士擁有歐洲工商管理學院工商管理碩士學位和博士學位倫敦大學的藥劑學博士
Sijmen de Vries,醫學博士.自2004年10月以來, 一直擔任我們董事會的非執行成員(包括他為我們的前身實體服務)。自2008年11月以來,de Vries博士一直擔任Pharming Group NV(Euronext:PHARM)的首席執行官。在此之前,de Vries博士曾擔任4—Antibody and Morphochem AG的首席執行官。在此之前,他曾在諾華製藥公司、諾華眼科公司和SmithKline Beecham Pharmaceuticals Plc工作,在那裏他曾擔任高級業務和商業職務。德·弗里斯醫生擁有醫學博士學位阿姆斯特丹大學 學位,英國阿什裏奇管理學院工商管理綜合管理碩士學位。
| 94 |
| 《目錄》 |
安·麥錢特自2023年12月以來一直擔任我們董事會的非執行成員。Merchant女士自2018年起擔任MorphoSys AG(NASDAQ:MOR)副總裁,該公司是一家總部位於德國慕尼黑的商業 階段生物製藥公司,並自2019年1月起擔任全球供應鏈和外部運營主管 。從2011年9月到2018年8月,Merchant女士擔任Schreimer Group Dilh & Co. KG的業務部門Schreiner Medipharm的總裁。1994年至2011年期間,Merchant女士在安進公司擔任多個職務。(NASDAQ:AMGN), 包括2007年至2011年期間的副總裁、國際供應鏈主管和現場主管。Merchant女士目前在Alvotech S.A. 董事會任職。(納斯達克股票代碼:ALVO),一家生物仿製藥公司。Merchant女士擁有亨利商學院的MBA學位 和喬治敦大學的語言理學士學位。
高級管理層
Dmitry Zamoryakhin醫學博士自2021年7月以來, 一直擔任我們的首席科學官。在此之前,Zamoryakhin博士於2021年2月至2021年7月為基因和細胞治療、生物製劑和小分子領域的生物技術和製藥公司提供獨立諮詢服務。2018年9月至2021年1月,Zamoryakhin博士擔任Oxford Biosedica plc(LON:OXB)的首席醫療官。從2016年10月到2018年8月,他在Grunenthal GmbH擔任的職務越來越多,最近擔任副總裁、開發和戰略主管 。Zamoryahkin博士還曾在Daiichi Sankyo Company Limited(TYO:4568),Ono Pharmaceutical Co.,Limited (TYO:4528)和葛蘭素史克(LON:GSK,NYSE:GSK)。 DR. Zamoryakhin在藥物和醫療器械開發的各個階段擁有豐富的經驗, 與監管機構合作,包括EMA、FDA、PMDA和NMPA 他在俄羅斯彼爾姆州立醫學院獲得醫學博士資格,之後在PHARMED、 Universite Libre de Bruxelles獲得藥學文憑,並在華威商學院獲得MBA學位。
有關我們的首席執行官兼首席財務官Stephen Stamp的個人資料,請參閲"—董事和高級管理層董事.”
非執行董事的薪酬
我們的非執行董事會就其作為董事的服務收取費用 ,該費用由我們的董事會批准,並適當考慮其角色的時間投入和責任 以及類似組織和任命的當前市場費率。根據我們的費用政策,非執行董事可報銷差旅費 及其他因我們業務而產生的雜費。
下表概述了2023年支付給非僱員董事的薪酬 。
| 名字 | 賺取的費用 以現金支付 (£)(1) | 所有其他 補償 (£) | 總計 £ | |||||||||
| 錫門德弗里斯 | 31,920 | - | 31,920 | |||||||||
| 西蒙·特頓 | 31,920 | - | 31,920 | |||||||||
| 斯蒂芬·帕克 | 82,000 | - | 82,000 | |||||||||
| 安·梅爾特(2) | - | - | - | |||||||||
______________
| (1) | 包括年費、委員會主席費和會議費。 |
| (2) | Merchant女士於2023年12月31日被任命為董事會成員,截至2023年12月31日止年度未收取任何費用。 |
| 95 |
| 《目錄》 |
下表載列截至二零二三年十二月三十一日,於二零二三年擔任非執行董事的該等人士持有的購股權獎勵總數:
| 名字 | 選項數量 | 格蘭特 日期 | 行權價格 每股 (£) | 期滿 日期 | |||||||||
| Sijmen de Vries(1) | 25 | (1) | 6/30/2014 | 30.00 | 6/30/2024 | ||||||||
___________
| (1) | 購股權分以下分期歸屬:(i)50%的購股權在我們的股價為每股2,124.00英鎊時歸屬,(ii)25%的購股權在我們的股價為每股5,488.00英鎊時歸屬,以及(iii) 剩餘25%的購股權在我們的股價為每股7,544.00英鎊時歸屬。 |
所有購股權的行使價 等於或高於授出日期的市價。
彌償契據
根據本公司於2015年8月5日宣佈的投票契據 或彌償契據,董事會和我們的公司祕書應承擔與其職務有關的費用和責任 ,但該人員對本公司本身的任何責任除外(或其任何關聯 實體),以及某些情況下的責任賠償除外,這些賠償是公司法所禁止的。 彌償契約規定,董事亦可獲貸款,以資助任何相關辯護費用,但如果 此類訴訟程序涉及刑事或民事事項,且該人被定罪或被判敗訴,則該 貸款必須償還。
任用書
根據委任書,每位非執行董事( Parker博士除外)均獲委任為董事會成員。每位董事的初始任期 為三年,除非任何一方提前一個月通知或根據 委任書的條款提前終止。該委任受本公司的組織章程細則所規限,並須在 公司任何股東周年大會上確認。
各非執行董事(除帕克博士外)在2023年支付了31920英鎊的年費(2024年該金額隨後提高至40,000英鎊),涵蓋 所有職責,包括委員會服務或Biodexa子公司董事會服務,委員會主席職位 和某些額外職責除外,比如擔任高級獨立董事。此金額可能會因時間而更改 。此外,我們向每位董事償還履行其職責所產生的合理及適當記錄的開支。 如上所述,在公司法允許的範圍內,我們還授予每位董事一份彌償契據,以補償因其服務 而可能產生的某些負債。
此外,未經我們事先書面同意, 在董事終止服務後六個月內,該董事將不會,無論是作為委託人或代理人 ,也無論是單獨或聯合,或作為任何其他人的董事、經理、合夥人、股東、僱員顧問,繼續 或被聘用,與Biodexa或任何子公司(如適用)經營的任何業務類似或正在(或打算)競爭的任何業務有關或有利害關係的任何業務。
帕克博士任命書
根據日期為 2022年6月20日的任命條款或任命協議,帕克博士被任命為董事會非執行主席,自 任命之日起生效。帕克博士的初步任期於2023年6月19日屆滿,其後獲續期一年。 此外,他的任命可能被終止:
| • | 任何一方至少提前三個月發出書面通知; |
| • | 董事會合理確定帕克博士接受任何其他僱用、 聘用、任命、利益或參與任何業務或個人與其任命相競爭或衝突,並將導致 嚴重利益衝突,或帕克博士合理確定此類利益將導致嚴重利益衝突,且 帕克博士接受此類僱用、聘用、任命,興趣或參與; |
| • | 根據我們的公司章程或適用法律;或 |
| • | 他沒有連任董事會成員。 |
根據任命 協議的條款,帕克博士將獲得82,000英鎊的年費,加上工作超過16天的每一天額外支付1,750英鎊的費用。
| 96 |
| 《目錄》 |
我們還同意償還帕克博士在履行職責過程中產生的合理和有記錄的費用,併為他提供高達7,500英鎊的與履行職責有關的專業建議。《委任協議》包括與不披露信息 和轉讓發明有關的條款。除其他事項外,這些條款規定帕克博士不得披露我們在僱傭期間收到的任何專有和機密信息,並將在其僱傭期間構思或開發的任何發明轉讓給我們。
如果我們根據公司章程或適用法律的規定隨時終止 與Parker博士的協議,Parker博士在下列情況下 無權要求損害賠償或賠償:
| • | 被認定犯有任何不當行為、重大過失或不誠實行為,或以嚴重損害我們利益的方式 的行為; |
| • | 嚴重或多次違反或不履行其對公司的義務; |
| • | 破產,根據1986年英國破產法作出針對他的臨時命令,或 在任何其他司法管轄區與他的債權人或任何類似的債權人達成任何債務重整或達成任何安排; |
| • | 精神不健全,根據任何與精神健康有關的法規成為患者,或因任何事故、疾病或傷害而不能連續六個月以上為公司履行職責; |
| • | 被判犯有刑事犯罪(不包括被判處非監禁刑罰的駕車犯罪); |
| • | 被法律或具有司法管轄權的法院命令取消擔任公職的資格;或 |
| • | 於根據委任協議條款被要求時,彼並無向本公司非執行主席及董事提交辭呈 。 |
如果我們在任何時間終止協議,並立即生效(不是根據上一段的規定),我們將向Parker博士支付他在接下來12個月內應支付的所有費用。
若本公司(I)犯有影響他的任何重大疏忽或對他或有關他的任何不誠實行為,或(Ii) 破產、與債權人或同等債權人訂立任何債務重整協議或訂立任何安排,派克博士可隨時辭去其職位 。如果Parker博士因這些原因辭職,我們將向Parker博士支付在接下來的12個月內到期的所有費用。此外,如果派克博士因意外、疾病或受傷而連續六個月以上不能根據《斯塔赫爾任命協議》的條款為本公司履行職責,他可隨時辭職,但無權獲得任何損害賠償 或賠償。Parker博士也因董事會認定他接受任何其他僱用、聘用、委任、利益或與任何企業或個人的參與與他的任命 競爭或衝突,並將導致嚴重的利益衝突,或Parker博士合理地確定此類利益將導致嚴重的利益衝突而辭職,Parker博士接受該僱用、聘用、任命、利益或參與,但沒有任何獲得損害賠償或 補償的權利。如果帕克博士因任何其他原因辭職,他必須提供12個月的書面通知。
高級管理人員的薪酬
下表彙總了我們的高級管理層在2023年(包括在我們任何子公司的任何服務)獲得的薪酬 ,其中包括一名前高管。
| 名字 | 薪金 (£) | 獎金 (£)(1) | 所有其他 補償 (2)(£) | 總計 (£) | ||||||||||||
| 斯蒂芬·斯坦普 | ||||||||||||||||
| 首席執行官兼首席財務官 | 249,991 | - | 2,012 | 252,003 | ||||||||||||
| Dmitry Zamoryakhin,醫學博士 | ||||||||||||||||
| 首席科學官 | 215,000 | 1,000 | 22,358 | 238,358 | ||||||||||||
| 所有高級管理人員作為一個小組(2人) | 464,991 | 1,000 | 24,370 | 490,361 | ||||||||||||
_____________
| (1) | Stamp先生和Zamoryakhin博士的獎金目標分別為其年基本工資的33%和30%, 該獎金將在實現董事會或其委員會 主觀判斷確定的目標時支付,並考慮了各種因素,沒有任何預先分配的權重。Stamp先生沒有收到2023財年的獎金。博士 Zamoryakhin在2023財年獲得的獎金已於2024年1月支付。 |
| (2) | 這些數額反映了醫療福利的應付福利價值(Stamp先生和Zamoryakhin博士分別為2,012英鎊和858英鎊)以及Zamoryakhin博士根據養卹金計劃支付的21,500英鎊。 |
| 97 |
| 《目錄》 |
下表載列截至2023年12月31日,高級管理層持有的購股權獎勵總數。
| 名字 | 數量 選項 |
授予日期 | 鍛鍊 價格 分享 | 期滿 日期 | |||||||||||||
| 斯蒂芬·斯坦普 | 1,500 | (1) | 9/9/2019 | 21.00 | 9/9/2029 | ||||||||||||
| 15,000 | (2) | 6/17/2020 | 4.04 | 1/17/2030 | |||||||||||||
| 25,000 | (2) | 7/15/2021 | 5.55 | 7/14/2031 | |||||||||||||
| Dmitry Zamoryakhin,醫學博士 | 12,500 | (2) | 7/15/2021 | 5.55 | 7/14/2031 | ||||||||||||
| 所有高級管理人員作為一個小組(3人) | 54,000 | (3) | (4 | ) | (5 | ) | (6 | ) | |||||||||
_________
| (1) | 在這些期權中,375項先前於2020年9月9日歸屬,其餘1,125項期權隨後 已歸屬或將在隨後的三年期間內以12個季度相等的方式歸屬。 |
| (2) | 其中,25%的購股權於授出日期後12個月歸屬,其餘購股權其後已 或將於其後三年期間內分12個季度等額歸屬。 |
| (3) | 35,719份購股權全部歸屬。 |
| (4) | 授出日期介乎二零一九年九月九日至二零二一年七月十五日。 |
| (5) | 購股權之行使價介乎4.04英鎊至5.55英鎊。 |
| (6) | 股票期權將於2029年9月9日至2031年7月14日期間到期。 |
與高級管理層的協議
斯蒂芬·斯坦普. 2019年9月9日, 我們與Stamp先生簽訂了服務協議或服務協議。《服務協議》規定了基本工資、獎勵 補償福利,以及在某些情況下的離職福利。本服務協議可在提前六個月通知的情況下終止,但某些 例外情況除外。
《服務協議》規定初始 基本工資為160,000英鎊。Stamp先生的基本工資每年4月1日按英國國家統計局公佈的"零售價格所有項目指數"中的百分比(如有)增加。 應每年對Stamp先生的基本工資進行審查,以考慮工資的任何增加。Stamp先生的基本工資自2022年4月1日起增加至23萬英鎊。
服務協議還包括Stamp先生的獎金 目標為年基本工資的33%,該獎金將在實現董事會或其委員會的主觀判斷中確定的目標時支付,並考慮了各種因素,而沒有任何預先分配的權重。除基本工資和獎金外,服務協議還規定了額外福利,如10%的養老金繳款、人壽保險、醫療保險、休假福利以及董事會不時確定的任何其他額外福利。 2021年8月,我們同意將他的公司養老金繳款10%折算為工資。
根據服務協議的條款, Stamp先生還同意,在其終止後的六個月內,他將不會直接或間接與 公司競爭。《服務協議》包括與不披露信息和轉讓發明有關的條款。除其他事項外,這些條款禁止Stamp先生披露在工作期間收到的任何我們的專有和機密信息,並規定他有義務將在其工作期間構思或開發的任何發明轉讓給公司。 本服務協議還包括慣例保密、非招攬、非偷獵和非貶低條款。
服務協議亦規定先生。 在某些終止僱傭時,加蓋某些付款和/或福利。如果他因疾病或其他喪失工作能力而無法履行其職責而被終止,連續三個月,或在任何12個月期間內累計超過100個工作日 ,則無論服務協議中有任何其他規定,我們均可在提前六個月書面通知後終止Stamp先生的僱傭 。在此期間,Stamp先生將無權領取其工資或任何獎金, 但有權享受服務協議項下的任何福利。此外,儘管服務協議中有任何終止通知要求 ,我們可隨時全權酌情終止服務協議,並向李先生提供。 加蓋款項以代替任何要求的通知。該款項將包括他的基本工資,但不包括任何獎金或其他 福利,並應扣除任何税款或保險費。儘管有上述規定,如果Stamp先生:
| • | 犯有嚴重不當行為或任何其他不當行為,影響或可能損害我們的利益; |
| 98 |
| 《目錄》 |
| • | 未能或忽略有效及勤勉地履行其職責,或嚴重或反覆 違反或不遵守服務協議或我們採納的任何股份交易守則的任何條文; |
| • | 有針對他的臨時接管令,破產或作出任何債務重整或與他的債權人訂立任何債務安排契據; |
| • | 被指控犯有可追究刑事罪(在英國或其他地方被處以罰款或非監禁處罰的道路交通罪除外); |
| • | 因具司法管轄權的法院的命令而喪失在任何公司任職的資格; |
| • | 根據任何與精神健康有關的法規,精神不健全或成為病人; |
| • | 根據英國《1993年刑事司法法》(Criminal Justice Act 1993)與內幕交易有關,或根據任何其他現行或未來與內幕交易有關的法令或法規,被定罪; |
| • | 違反了倫敦證券交易所發佈的關於董事買賣上市證券(包括AIM證券交易)的標準守則(標準守則隨後被MAR中的條款取代,但 僱傭協議尚未更新以反映這一點);或 |
| • | 根據普通法實施任何其他行為,包括但不限於任何 根據我們的一般適用紀律規則,不經通知而解僱。 |
德米特里·扎莫里亞金 我們與Zamoryakhin博士簽訂了僱傭合同或僱傭合同。 僱傭合同於2021年7月12日生效,並規定Zamoryakhin博士的基本工資、獎勵性補償福利以及終止僱傭的補償。 Zamoryakhin博士或公司可提前 六個月通知終止僱傭合同。
《僱傭合同》規定了 205,000英鎊的初始基本工資,這可能會進行調整,還包括Zamoryakhin博士 年基本工資的30%的初始獎金目標。 Zamoryakhin博士的基本工資從2022年4月1日起增加到21.5萬英鎊。除 基本工資和獎金外,僱傭合同還規定了額外福利,如10%的養老金繳款、醫療保險、 假期福利和董事會不時確定的任何其他額外福利。
Zamoryakhin博士還同意,在他被解僱後的六個月(減少任何“花園假”期間),他將不會直接或間接地與公司競爭,或招攬任何客户,潛在客户或關鍵員工。 《僱傭合同》包括 與保密、不披露信息和轉讓發明有關的條款。 除其他事項外, 這些條款禁止Zamoryakhin博士披露我們在僱傭過程中收到的任何專有和機密信息,並要求Zamoryakhin博士將在其僱傭過程中構思或開發的任何發明轉讓給我們。
僱傭合同規定, 我們將在終止合同前的任何通知期內支付Zamoryakhin博士的正常工資。 如果Zamoryakhin博士被發現犯有任何根本性 或否認性違約或違反適用於Zamoryakhin博士的紀律規則,我們也可以立即終止 Zamoryakhin博士的僱傭,無需通知或付款。
董事會
我們的董事會目前由 五名董事組成,其中一名為執行董事,四名為非執行董事,反映了不同 經驗和背景的混合。董事會主席(非執行職位)和首席執行官 的角色已分開,兩個職位之間有明確的職責分工。為維持董事會的獨立性 ,主席或非執行董事均不以股份形式支付酬金。
自2018年9月28日起,所有 AIM上市公司均須正式應用公認的公司治理守則。雖然我們不再在AIM上交易,但我們 選擇採用《上市公司聯盟中小型上市公司企業治理守則》或《QCA守則》的原則。QCA準則確定了公司實現長期股東價值增長所需遵循的十項原則,包括高效、有效和動態的管理框架,輔之以良好的溝通,以促進信心 和信任。
| 99 |
| 《目錄》 |
董事會負責 除其他外, 批准中期和年度財務報表,制定和監控我們的策略,批准財務計劃和審查業績, 以及遵守法律、監管和企業管治事宜。 董事會有一個保留事項的時間表。
董事會定期開會, 審議戰略、業績和內部控制框架。為使董事會能夠履行其職責,所有董事 都收到適當和及時的信息。簡介文件於董事會會議前分發予全體董事。
董事會委員會
我們已設立董事會審計、提名和 薪酬委員會,並正式授權其職責和責任。董事會可不時設立獨立委員會 ,以在需要時考慮特定問題。
審計委員會
審計委員會由三名成員組成: Turton先生(主席)、Parker博士和Merchant女士。於二零二三年,de Vries先生曾擔任審核委員會成員,直至獲委任陳女士為止。 商人於2024年1月22日。董事會已確定Turton先生、Parker博士和Merchant女士根據《交易法》第10A—3條和納斯達克適用規則是獨立的,並且Turton先生符合表格20—F第16A項所定義的"審計委員會財務專家"的資格。
董事會審計委員會 協助董事會履行其在財務報告、外部和內部審計以及 控制方面的職責,包括審查和監控公司年度和中期財務報表的完整性,就 外部審計師的任命提供諮詢意見,審查和監控外部審計師所從事的非審計工作的範圍,監督 我們與外部審計師的關係,審查外部審計過程的有效性,並審查內部控制審查職能的有效性 。審核和批准年度報告和賬目以及半年度報告的最終責任仍由董事會承擔。
此外,審計委員會在商定的職權範圍內,負責確保遵守美國證券交易委員會頒佈的規章制度和納斯達克規則, 並確保信息披露。
審核委員會每年舉行不少於 兩次會議,並視需要舉行其他會議。
提名委員會
提名委員會由博士擔任主席。 帕克,目前由帕克博士、德弗里斯先生和特頓先生組成。提名委員會協助董事會 履行其與董事會和 董事會任何委員會的組成和組成有關的職責。它負責定期審查董事會的結構,並在需要時確定 被任命為董事或委員會成員的潛在候選人。提名委員會負責評估 技能、知識和經驗的平衡以及董事會和董事會委員會的規模、結構和組成, 退休以及新增和替換董事和委員會成員的任命,並就這些事項向 董事會提出適當的建議。
提名委員會每年舉行不少於一次會議, 視需要舉行其他會議。
薪酬委員會
薪酬委員會由三名 成員組成:de Vries先生(主席)、Turton先生和Merchant女士。2023年期間,帕克博士在薪酬委員會任職,直到 Merchant女士於2024年1月22日被任命。董事會已確定de Vries先生和Turton先生以及Merchant女士 根據納斯達克適用規則是獨立的。
董事會薪酬委員會 負責在商定的職權範圍內,建立正式和透明的程序,以制定行政人員薪酬政策 ,並制定個別董事的薪酬待遇。這包括與董事會就執行董事、公司祕書和指定考慮的其他執行管理層成員的薪酬框架 達成協議。董事會亦負責釐定每位董事的個人薪酬待遇總額,包括(如適用)花紅、獎勵金及購股權。任何董事不得參與有關其本身薪酬的任何決定。 薪酬委員會在可能的情況下確保遵守與薪酬有關的QCA守則。
薪酬委員會每年舉行不少於兩次會議, 視需要舉行其他會議。
| 100 |
| 《目錄》 |
服務合同
除此處所述外,我們沒有 與董事會或高級管理層的任何成員簽訂服務合同。
股權福利計劃
Biodexa Pharmaceuticals PLC 2014年企業管理 獎勵計劃
董事會已建立 Biodexa Pharmaceuticals PLC 2014年企業管理獎勵計劃,或2014年計劃,允許我們向合資格的員工和公司董事或計劃參與者授予購買普通股的期權,以吸引、獎勵和留住這些人員。
行政管理. 2014年計劃的運營和管理由董事會承擔 的全面責任。
資格.為了有資格 作為計劃參與者參與2014年計劃,一名人員必須是公司或其任何子公司的僱員或董事 ,其"承諾時間"至少為每週25小時,或(如果少於)其"工作時間"的75%,"這些術語中的每一個 都根據英國《2003年所得税(收入和 養老金)法案》附表5或附表5所載的英國税務和海關規則所定義。董事會可行使其酌情權,選擇根據2014年計劃將授予的股票期權的計劃參與者 。
授予期權.董事會可不時 授出購股權,但適用法律不允許授出或 普通股有其他限制的情況除外。授出購股權將不會支付任何款項。
期權形式.根據2014年計劃授出 的購股權的行使價可高於或等於授出日期 普通股市值,但在任何情況下不得低於該等股份面值的價格授出。股票期權可以是用於認購 新普通股的股票期權。
參與者在能夠行使股票期權並獲得普通股之前,將沒有股東 權利。
期權授予額和計劃限額. 股票期權應根據並遵守附表5授予。這在一定的門檻上為股票期權提供了税收優惠。 該門檻目前是這樣的:當員工收到並持有授予價值為250,000英鎊或 以上的股票期權時,他或她可能在三年內沒有任何進一步授予的期權。如果超過此門檻或本公司 不再滿足合資格條件,則可根據2014年計劃的條款授出未經批准的購股權。受未行使購股權約束的股份總價值 在任何時候不得超過300萬英鎊。所有購股權必須在自授出日期起10年內 ,如2014年計劃的規則或適用的購股權協議所述。
董事會可不時 指定可授出購股權所涉及的普通股的最大數量。
期權的歸屬.在正常過程中 ,股票期權將有資格在時間和財務業績目標的滿足下歸屬。
如果計劃參與者因任何原因離職 公司或其子公司,其股票期權通常將失效,除非董事會行使其酌情權 允許股票期權行使。
績效目標.根據2014年計劃授出的所有股票期權 將受董事會確定的適當業績目標的約束,其中可能包括 股價目標,股票期權部分歸屬於每個業績目標的實現。
附於普通股的權利. 因行使股票期權而發行的普通股將與當時已發行的所有其他普通股享有同等地位 (普通股所附帶的任何權利除外,這些權利是指股票在 股東名冊上登記之前的記錄日期)。
調整.如果我們的已發行股本有任何調整 ,則附帶購股權的普通股將作適當調整。董事會 可以適當的方式調整股票期權。
| 101 |
| 《目錄》 |
Biodexa Pharmaceuticals PLC員工股份獎勵計劃
2017年,我們設立了Biodexa Pharmaceuticals 股票激勵計劃(原名Midatech Pharma PLC股票激勵計劃),簡稱SIP。根據SIP,我們的員工和董事 可以通過薪酬犧牲安排獲得我們的普通股。我們為根據SIP購買的每一股股份授予配對股份。為保留這些股份,計劃參與者必須自收購之日起三年內繼續受僱於本集團。SIP購買的所有 股票均由不受我們控制的員工福利信託持有。股份必須在計劃中保留五年 才有資格獲得全額所得税減免。
2023年4月,就我們從AIM退市而言,我們終止了SIP,隨後清算了股份並向持有人分發現金。
| 102 |
| 《目錄》 |
某些關係和關聯方交易
與Chesyl Pharma Limited的協議
2014年4月,Biodexa Ltd(前稱 Midatech Ltd)與Chesyl Pharma Limited或Chesyl簽訂了諮詢協議或諮詢協議。Chesyl由Rolf Stahel先生全資擁有,他是我們的前董事會非執行主席兼董事。顧問協議的有效期自2014年3月1日開始 ,初步有效期為12個月,其後繼續有效,直至根據其條款終止。Chesyl 受聘提供管理諮詢服務,包括就 運營問題向Biodexa有限公司董事會提供支持和協助,以及就公司戰略、公司活動、資金籌集和合並以及 收購機會提供諮詢,統稱為服務。
根據諮詢協議 的條款,Stahel先生(或經Biodexa有限公司批准的類似合格替代方)有義務在 合理必要的時間和地點採購服務,每年10個完整工作日。Biodexa Ltd同意每年向Chesyl支付40,000英鎊,以支付Stahel先生的服務(從2017年10月1日起生效的50,000英鎊減少),如果僱用任何額外 天,則每個完整工作日將支付2,000英鎊的費率。截至2022年12月31日的財政年度,Biodexa Ltd向Chesyl支付了13,333英鎊。
顧問協議因Stahel先生於2022年6月20日辭去董事會職務而終止。
與CMS締約方的協議
CMS許可協議
有關CMS許可協議的信息,請參見商業—商業協議、戰略夥伴關係和合作—CMS許可協議.”
關係協議
2019年1月29日,公司,Panmure Gordon(UK)Limited(我們的前提名顧問)、CMS股東和CMS股東的某些關聯公司簽訂了關係 協議或關係協議,以規範我們與CMS及其關聯實體(統稱為 CMS各方)的關係,並限制他們對我們的企業行動和活動以及與公司有關的一般事項的結果的影響力。關係協議自二零一九年二月二十六日起生效。關係協議隨後於2020年5月12日和2022年4月15日修訂。
根據關係協議 的條款,CMS各方已同意(其中包括):
| • | 在正常商業基礎上與我們進行所有交易,包括根據目標規則中的 關聯方規則以及任何其他適用法律、法規和證券交易所規則,並且必須事先得到大多數獨立董事的批准; |
| • | 行使其投票權或其他權利和權力,以確保其各自集團的每個成員都能夠獨立於每個CMS締約方(及其任何集團公司和聯營公司)開展其業務並作出決策; 和 |
| • | 放棄就與各CMS方(或其任何聯繫人)的關聯方的任何合同、安排或交易有關的任何決議案進行表決。 |
我們進一步同意與CMS各方(及其任何集團公司和聯營公司) 在正常商業基礎上,並根據AIM規則中規定的關聯方規則,在公平交易條款下進行所有交易、 協議和關係(無論是合同或其他)。
《關係協議》規定, 公司與CMS各方和/或其各自的任何聯繫人之間就CMS各方(或其任何聯繫人)與本公司之間的任何現有或擬議的 交易、安排或協議產生的任何爭議,應由 多數獨立董事決定解決。
雙方在 關係協議下的義務應在下列情況下自動終止:
| • | CMS方(或其任何聯繫人)不再實益持有合共10%的已發行普通股;或 |
| • | 普通股不再被AIM接納。 |
| 103 |
| 《目錄》 |
就於2023年2月15日完成的私募 配售而言,CMS方實益擁有合共少於10%的已發行普通股,因此, 關係協議根據其條款終止。
彌償契據
我們已為董事會和公司祕書的利益簽訂了彌償契約 。有關詳細信息,請參閲"管理層— 非執行董事的補償—彌償契據.”
與董事及高級管理層的協議
我們之前已與董事和高級管理層就其在董事會的服務或在公司的僱傭事宜簽訂了若干 協議。 有關詳細信息,請參閲"管理.”
| 104 |
| 《目錄》 |
主要股東
下表列出了截至2024年3月1日,據我們所知, 有關普通股實益擁有權的信息,包括:
| · | 我們所知為5%或5%以上普通股實益擁有人的每位人士 (基於我們的股份登記冊中的信息以及該等人士提供的信息); |
| · | 我們的董事會成員; |
| · | 我們的每一位高級管理人員;以及 |
| · | 董事會全體成員和高級管理層,作為一個整體。 |
股份的實益所有權根據SEC的規則確定 ,通常包括個人行使單獨或共同投票權或投資權的任何股份。除 腳註所述外,並受適用的共同體財產法的約束,根據向我們提供的信息, 我們相信,下表中所列的個人和實體對 所示為由他們實益擁有的所有普通股擁有唯一的投票權和投資權。實益擁有權百分比乃根據截至二零二四年三月一日的1,699,804,122股已發行普通股計算。受目前可行使或可在2024年3月1日起60天內行使的購股權或認股權證約束的普通股被視為 尚未行使並由持有購股權的人實益擁有,以計算該人及其成員的任何團體的 實益擁有的百分比,但在計算 其他人的實際所有權百分比時,不被視為未完成。除非另有説明,否則以下列出的每個持有人的地址為Biodexa Pharmaceuticals PLC,Kapian Point,1 Kapian Way,Cardiff,CF10 4DQ,United Kingdom。所有普通股持有人,包括下列 股東,對這些股份擁有相同的投票權。
| 實益擁有人姓名或名稱 |
金額和 自然界 |
百分比 類 |
||||||
| 大股東 | ||||||||
| Bigger Capital Fund,LP(1) | 188,657,296 | 9.9 | % | |||||
| Brio Capital Master Fund Ltd.(2) | 188,657,296 | 9.9% | ||||||
| 北京市百光製藥有限公司(3) | 141,771,200 | 8.3 | % | |||||
| 與騎兵基金有關聯的實體(4) | 179,729,182 | 9.9 | % | |||||
| 第2區資本基金LP(5) | 188,657,296 | 9.9% | ||||||
| GS Capital Partners LLC(6) | 143,852,800 | 8.1 | % | |||||
| Melior Pharmaceuticals I,Inc.(七) | 141,771,200 | 8.3 | % | |||||
| 美世街全球機遇基金有限責任公司(8) | 187,702,082 | 9.9 | % | |||||
| 董事和高級管理人員: | ||||||||
| 安·麥錢特 | -- | -- | ||||||
| 斯蒂芬·帕克 | -- | -- | ||||||
| 斯蒂芬·斯坦普(9) | 35,250 | * | ||||||
| 西蒙·特頓 | 2,766 | * | ||||||
| 錫門德弗里斯 | 1,312 | * | ||||||
| Dmitry Zamoryakhin(10) | 8,594 | * | ||||||
| 董事及高級管理人員(6人)(11) | 47,922 | * | ||||||
__________________
| * | 低於流通普通股的百分之一。 |
| (1) | Based primarily on the Schedule 13G filed by Bigger Capital Fund, LP, Bigger Capital Fund GP, LLC, District 2 Capital Fund LP, District 2 Capital LP, District 2 GP LLC, District 2 Holdings LLC and Michael Bigger with the SEC on February 12, 2023, and our information and belief. Consists of (i) warrants to purchase an aggregate of 361,483,200 Ordinary Shares (in the form of Depositary Shares) beneficially owned by Bigger Capital Fund, LP and (ii) warrants to purchase an aggregate of 392,650,800 Ordinary Shares (in the form of Depositary Shares) beneficially owned by beneficially owned by District 2 Capital Fund LP. Bigger Capital Fund GP, LLC is the general partner of, and may be deemed to beneficially own the securities owned by, Bigger Capital Fund, LP. Each of (i) District 2 Capital LP, as the investment manager of District 2 Capital Fund LP, (ii) District 2 GP LLC, as the general partner of District 2 Capital Fund LP, and (iii) District 2 Holdings LLC, as the managing member of District 2 GP LLC, may be deemed to beneficially own securities owned by District 2 Capital Fund LP. Mr. Bigger is the managing member of Bigger Capital Fund GP, LLC and is the managing member of District 2 Holdings LLC and may be deemed to beneficially own the securities held by Bigger Capital Fund, LP and District 2 Capital Fund LP. The percentage in this table reflects that the reporting persons may not exercise the warrants to the extent such exercise would cause the reporting persons to beneficially own a number of Ordinary Shares that would exceed 9.99% of our then outstanding share capital following such exercise. The principal business address of the reporting person is 11700 West Charleston Blvd, #170-659, Las Vegas, NV 89135. |
| (2) | 基於我們的信息和信念。包括購買總計236,867,000股普通股 (以存托股份形式)的認股權證。Brio Capital Management LLC是Brio Capital Master Fund Ltd.的投資經理, 以Brio Capital Management LLC管理成員的身份,對Brio Capital Master Fund Ltd. Shaye Hirsch持有的證券擁有投票權和投資權,代表Brio Capital做出投票和投資決策 Management LLC作為Brio Capital Master Fund Ltd.的投資經理。此表中的百分比反映了 報告人不得行使認股權證,但行使將導致報告人實益擁有數量超過9.99%的普通股我們當時已發行的股本。Brio Capital Management LLC的主要業務地址是Merrick路100號,401W套房,羅克維爾中心,紐約11570。 |
| (3) | 由Bukwang Pharmaceuticals Co. Ltd.擁有的141,771,200股普通股(以存托股份的形式)組成,或者説布旺 Bukwang的主要營業地址為7,Sangdo—ro,Dongjak—gu,Seoul 06955,大韓民國。 |
| 105 |
| 《目錄》 |
| (4) | 主要基於騎兵基金 I LP於2023年2月13日提交的附表13G/A以及我們的信息和信念。(i)(x) 80,442,400股普通股(以存託 股形式),及(y) 購買由Cavalry Investment Fund I,LP實益擁有的合共1,060,675,200股普通股(以存托股份形式)的認股權證及(ii)(x) 8,938,000股普通股( 存托股份形式)及(y) 購買由Cavalry Investment Fund LP實益擁有的合共177,726,400股普通股( 以存托股份的形式)的認股權證。Cavalry Fund I Management LLC是Cavalry Fund I LP和Cavalry Investment Fund LP的投資經理,對這些證券擁有投票權和投資權。Thomas Walsh是 Cavalry Fund I Management LLC的管理成員,該公司是Cavalry Fund I LP和Cavalry Investment Fund LP的普通合夥人。Thomas Walsh否認對這些證券的實益所有權。 本表中的百分比反映了 報告人不得行使認股權證,但行使將導致報告人實益擁有 若干普通股,而該等普通股數量將超過該等行使後我們當時已發行股本的9. 99%。 報告人的 主要營業地址為82 E。阿倫代爾路,Ste 5B,Saddle River,NJ 07458. |
| (5) | Based primarily on the Schedule 13G filed by Bigger Capital Fund, LP, Bigger Capital Fund GP, LLC, District 2 Capital Fund LP, District 2 Capital LP, District 2 GP LLC, District 2 Holdings LLC and Michael Bigger with the SEC on February 12, 2023, and our information and belief. Consists of (i) warrants to purchase an aggregate of 361,483,200 Ordinary Shares (in the form of Depositary Shares) beneficially owned by Bigger Capital Fund, LP and (ii) warrants to purchase an aggregate of 392,650,800 Ordinary Shares (in the form of Depositary Shares) beneficially owned by beneficially owned by District 2 Capital Fund LP. Bigger Capital Fund GP, LLC is the general partner of, and may be deemed to beneficially own the securities owned by, Bigger Capital Fund, LP. Each of (i) District 2 Capital LP, as the investment manager of District 2 Capital Fund LP, (ii) District 2 GP LLC, as the general partner of District 2 Capital Fund LP, and (iii) District 2 Holdings LLC, as the managing member of District 2 GP LLC, may be deemed to beneficially own securities owned by District 2 Capital Fund LP. Mr. Bigger is the managing member of Bigger Capital Fund GP, LLC and is the managing member of District 2 Holdings LLC and may be deemed to beneficially own the securities held by Bigger Capital Fund, LP and District 2 Capital Fund LP. The percentage in this table reflects that the reporting persons may not exercise the warrants to the extent such exercise would cause the reporting persons to beneficially own a number of Ordinary Shares that would exceed 9.99% of our then outstanding share capital following such exercise. The principal business address of the reporting person is 14 Wall Street, 2發送郵編:11743,紐約州亨廷頓。 |
| (6) | 基於我們的信息和信念。包括(i)購買合共80,768,800股普通股(以存托股份形式)之認股權證;及(ii)合共63,084,000股普通股(以存托股份形式)。GS Capital Partners LLC總裁Gabe Sayegh對此處報告的GS Capital持有的 證券擁有投票控制權和投資自由裁量權。GS Capital的主要營業地址是1 East Liberty Street,Suite 600,Reno,NV 89501。 |
| (7) | 由本公司擁有的141,771,200股普通股(以存托股份形式)組成, Melior Pharmaceuticals I,Inc. Melior Pharmaceuticals I,Inc.的主要營業地址。地址是860 Springdale Drive,Suite 500,Exton,PA 19341。 |
| (8) | 基於我們的信息和信念。包括(i)購買合共468,479,600股普通股(以存托股份形式)的認股權證,及(ii)合共141,771,200股普通股(以存托股份形式)。本表中的百分比反映,如果行使將導致申報人實益擁有的普通股數量超過行使後我們當時已發行股本的9. 99%,則申報人不得行使認股權證。Jonathan Juchno是美世街全球機會基金有限責任公司(“美世”)的管理合夥人,對美世持有的證券擁有投票控制權和投資自由裁量權。 報告人的主要營業地址為1111 Brickell Ave,Ste 2920,Miami,FL 33131。 |
| (9) | Stamp先生擁有的股份包括32,750股普通股,但須受可於2024年3月1日起行使或將於該日期後60天內行使的已行使購股權所規限。 |
| (10) | Zamoryakhin博士擁有的股票是8,594股普通股,受流通股期權的約束,可於2024年3月1日行使,或將在該日期後60天內行使。 |
| (11) | 所有董事及高級管理人員作為一個整體欠下的股份包括41,344股受 流通股期權約束的普通股,每股可於2024年3月1日行使,或將在該日期後60天內行使。 |
截至2024年3月1日,我們的已發行普通股約有0.03% 由地址在英國的登記股東持有(不包括根據我們與摩根大通銀行的託管協議由託管人持有的股份),我們在英國有189名登記持有人。 截至2024年3月1日,摩根大通銀行作為託管股份的託管機構,持有1,699,284,027股普通股,佔當日已發行股本的99.97%。截至2024年3月1日,我們有七個註冊地址在美國。 美國或英國的記錄持有人或註冊持有人的數量不能代表受益持有人的數量或受益持有人的居住地。
根據我們的股份登記冊,我們相信 我們不受另一家公司或政府或任何其他自然人或法人直接或間接控制。 沒有任何可能導致控制權變更的安排。我們的主要股東與我們普通股的其他持有人沒有不同的投票權 。
據我們所知,除因本公司股東持有的未行使認股權證到期或本招股説明書其他地方披露外,在過去三年內,上述主要股東持有本公司普通股的百分比並無重大變動 。
| 106 |
| 《目錄》 |
股本説明
下面介紹我們的已發行股本,總結我們的公司章程的重要條款,並重點介紹英國和美國公司法的某些差異。我們的股本説明和公司章程摘要並不完整, 僅限於參考我們的公司章程。您應該閲讀我們的公司章程,這些章程作為本招股説明書的一部分作為註冊説明書的證物 存檔,以瞭解對您重要的條款。
下面介紹了我們的已發行股本,總結了我們公司章程的主要規定,並重點介紹了英國和美國公司法的某些差異。請注意,本摘要並不是要詳盡無遺。欲瞭解更多信息,請參閲本招股説明書所附註冊説明書的完整版本 。
一般信息
我們是根據英格蘭和威爾士法律成立的上市有限公司,註冊號為09216368。我們的註冊辦事處是英國加的夫裏海大道1號,郵編:CF10 4DQ。我們運作和發行股票所依據的主要法律是2006年的英國公司法,或公司法。
已發行股本
我們截至2024年3月1日和2023年6月30日的已發行股本分別為1,699,804,122股和277,971,722股普通股。每股普通股的面值為每股0.001 GB。已發行的每股普通股均已全額支付。我們目前在已發行股本中有1,000,001股A遞延股份、4,063,321,420股B遞延股份和 無優先股。
我們被授權發行的普通股或優先股的數量沒有限制,因為根據公司法的條款 ,授權資本的概念不再適用。沒有關於任何普通股的轉換權、贖回條款或償債基金條款。
根據英國法律,我們不允許持有自己的普通股,除非我們回購普通股並以國庫形式持有。我們目前沒有持有任何我們自己的普通股 。
股本發展史
自2021年1月1日起,我們的已發行股份 資本發生變化,如下所示。
2021年2月19日,我們在2020年5月的發售中向配售代理的某些關聯公司發行了15,200股普通股,相當於38股存托股份, 行使了於2020年5月發行的認股權證,行使價為每股3,300.00美元。
2021年7月6日,我們以每股5.70 GB的價格向某些非美國投資者發行了1,754,386股普通股,在英國配售,總收益為1,000萬GB。
於2022年3月22日,我們於2019年2月向某機構投資者發行的一份認股權證獲行使後按每股200英鎊的行使價發行一股普通股。
2022年5月3日, 我們向股份激勵計劃信託發行了1,250股普通股,以每股0.02英鎊的價格購買。
2022年8月3日,我們向某機構投資者發行認股權證,以每股2.70英鎊的行使價購買16,666股普通股。
2022年9月26日,我們對存托股份進行了比率變動,據此,普通股與存托股份的比率已變動 ,使一股存托股份代表25股普通股。我們的普通股不受此變動影響,且未發行零碎 存托股份。
2022年12月16日,我們以每股存托股份320.00美元的價格向一名機構投資者出售了492,400股普通股,其中1,231股存托股份代表。
| 107 |
| 《目錄》 |
On February 15, 2023, we completed the closing of the February Private Placement pursuant to which we sold to certain institutional investors (1) 3,250,000 Ordinary Shares represented by 8,125 Depositary Shares at $185.60 per Depositary Share, (2) 12,931,020 Ordinary Shares represented by 32,328 Depositary Shares, issuable upon the exercise of Series A Warrants issued in the February Private Placement at an exercise price of $214.40 per warrant, (3) 19,396,400 Ordinary Shares represented by 48,491 Depositary Shares, issuable upon the exercise of Series B Warrants issued in the February Private Placement at an exercise price of $214.40 per warrant, and (4) 62,184,525 Ordinary Shares represented by 155,461 Depositary Shares, issuable upon the exercise of pre-funded warrants issued in the February Private Placement at an exercise price of $0.032 per warrant, for aggregate gross proceeds of approximately $6.0 million. We also issued unregistered February Placement Agent Warrants to purchase a total of 536,800 Ordinary Shares represented by 1,342 Depositary Shares to the Placement Agent at an exercise price of $400.00 per warrant for 49 warrants and an exercise price of $232.00 per warrant for 1,293 warrants, and Series A Warrants to purchase 625,000 Ordinary Shares represented by 1,562 Depositary Shares at an exercise price of $214.40 per warrant to an investor pursuant to the Waiver.
2023年3月27日, 在股東批准後,我們對普通股進行了一比20的反向拆分,我們的普通股於該日開始在 AIM交易,並按拆分調整的基準進行交易。並無發行與反向股份拆股有關的零碎股份。
與 反向拆股同時,為努力使存托股份價格符合納斯達克對500,000股上市存托股份的最低要求,我們於2023年3月27日將存托股份所代表的普通股數量的比率由每股存托股份25股普通股改為每股存托股份5股普通股。未發行 零碎存托股份。
自2023年3月27日 至本報告日期,我們已於2月私募發行的237,841份預配權證、A系列權證 和B系列權證獲行使後發行了95,137,075股普通股。
於2023年5月26日, 我們完成了2023年5月登記直接發售的完成,機構投資者為(1)166,017,700股普通股, 以415,044股存托股份代表,可於C系列認股權證獲行使時按每份認股權證16.00美元的行使價發行,(2)110,675股,600股普通股,即276,689股於D系列認股權證獲行使時按每份認股權證16.00元之行使價發行之存托股份;及(3)4,426,800股普通股,即11股,067 2023年5月配售 代理認股權證行使時可發行的存托股份,行使價為每份認股權證15.00美元。
於2023年6月20日,我們向投資者和配售代理髮行了C系列權證、D系列權證和2023年5月配售代理權證, 在收到所需股東批准分配和取消根據C系列權證將發行的普通股的優先購買權後, ,D系列認股權證及2023年5月配售代理認股權證於我們的6月總經理舉行。
自2023年6月20日 至本報告日期,我們已於2023年5月 登記直接發售中發行的415,044份C系列權證獲行使後發行了166,017,700股普通股。
於2023年7月5日, 我們對存托股份進行了比率變動,據此,普通股與存托股份的比率已變動, 一股存托股份代表400股普通股。我們的普通股不受此變動影響,亦無發行零碎存托股份 。
於2023年12月21日,我們完成了12月公開發售的結束 ,據此,我們發行並出售(i)1,088,887個A類單位,公開發售價為每 A類單位2.00美元,每個A類單位包括(a)一股存托股份,(b)一份E系列權證,及(c)一份F系列權證,及 (ii)1,911,176個B類單位,公開發售價為每B類單位1.9999美元,每個B類單位包括(a)一份12月 公開發售預集資認股權證,可就一股存托股份行使,(b)一份E系列認股權證,及(c)一份F系列認股權證。 公司的總收益約為600萬美元。此外,我們發行了承銷商認股權證,以購買 120,003股我們與12月公開發行有關的存托股份。
自2023年12月21日至本報告日期, 我們已於12月公開發售中發行的12月公開發售預集資認股權證及F系列認股權證獲行使後發行了510,226,400股普通股。
此外,於2023年12月21日, 就收市而言,我們(i)向若干有抵押票據持有人發行合共224,947股存托股份,以清償 Adhera有抵押票據,及(y)合共2,275,050股二零二三年十二月私募預配權證,以向若干有抵押票據持有人購買存托股份,及(ii)向Melior發行354,428股我們的存托股份。在許可協議項下的若干 義務得到履行後,我們預計將向Bukwang發行354,428股存托股份。
| 108 |
| 《目錄》 |
選項
我們已經建立了Biodexa Pharmaceuticals PLC 2014年企業管理激勵計劃,根據該計劃,我們向員工和 董事發行了購買普通股的期權。截至2023年6月30日,有購股權可購買121,340股普通股。購股權自授出之日起十年後失效 。截至2023年6月30日,購股權的加權平均剩餘年期為7. 9年。
關於我們在2015年12月收購DARA ,我們承擔了DARA所有未行使的期權,或DARA期權。截至2023年6月30日,有未行使的DARA 購股權購買134股普通股,加權平均剩餘壽命為2年。
認股權證
2019年10月和2020年5月的認股權證
In October 2019, we completed a private placement with certain institutional investors, or the October Private Placement, where we issued warrants to certain investors, or the October Private Placement Warrants, and the placement agent, Wainwright, or the Wainwright October Warrants. In May 2020, we completed a private placement with certain institutional investors, or the May Private Placement, where we issued warrants to certain investors, or the May Private Placement Warrants, the placement agent, Wainwright, or the Wainwright May Warrants and Armistice, or the May Armistice Warrants. The following is a brief summary of the October Private Placement Warrants, Wainwright October Warrants, May Private Placement Warrants, Wainwright May Warrants and the May Armistice Warrants issued in connection with the October Private Placement and May Private Placement, as applicable, and is subject in all respects to the provisions contained in the applicable warrants, which, with respect to the October Private Placement Warrants and Wainwright October Warrants, are filed as exhibits to our Report on Form 6-K dated October 24, 2019, and for the May Private Placement Warrants, May Armistice Warrants and Wainwright May Warrants, are filed as exhibits to our Report on Form 6-K dated May 20, 2020. In December 13, 2022, the exercise price of the October Private Placement Warrants granted to Armistice and the May Private Placement Warrants was reduced to $320.00. Unless otherwise stated, references to warrants in this section include the October Private Placement Warrants, May Private Placement Warrants, Wainwright October Warrants and Wainwright May Warrants.
可運動性。 10月份的私募認股權證和Wainwright 10月份的認股權證於2019年12月23日開始可行使。五月私人配售認股權證、五月停戰認股權證及温賴特五月認股權證一經發行即可行使。10月份的私募認股權證、5月份的私募認股權證和5月份的停戰權證將於最初行使日起五年半到期,而温賴特10月份的權證和温賴特的5月份的權證將分別於2024年10月22日和2025年5月18日到期。持有人須於行權日期後兩個交易日內交付行權通知所指明的存托股份的行權總價(受制於下文所述的“無現金行權”安排)。
無現金鍛鍊。關於10月份的私募認股權證和Wainwright 10月份的認股權證,如果在該等認股權證的發行日期 超過六個月後,沒有有效的登記聲明登記該等認股權證的存托股份,或沒有現行招股章程可供轉售該等認股權證,則持有人可在無現金基礎上全部或部分行使認股權證。關於5月份的私募認股權證和Wainwright May認股權證,如果沒有有效的登記聲明登記該等認股權證相關的存托股份的轉售,或沒有當前的招股説明書可供轉售,則持有人可在無現金的基礎上全部或部分行使該認股權證。
行權價格。 (i)每份10月私募認股權證和Wainwright十月認股權證分別為每股存托股份320.00美元和10,000.00美元, 及(ii)每份5月私募認股權證、5月停戰認股權證和Wainwright五月認股權證分別為每股存托股份3,280.00美元、320.00美元和3,300.00美元,每項交易均須遵守上述"無現金行使"安排,並須按下文所述作出調整 。
受益所有權 限制。 持有人無權行使認股權證的任何部分,但在此行使生效後,該持有人連同該持有人的關聯公司,以及任何與該持有人或任何 該關聯公司作為一個集團行事的任何人,根據持有人的最初選擇,將實益擁有超過4.99%或9.99%(視適用而定)的股份,在行使該等行使後,立即發行存管股份相關的普通股 已發行在外的普通股數量。認股權證持有人在通知我們後,可增加或減少實益擁有權限制 至不超過9.99%的百分比,但實益擁有權限制的任何增加應在通知我們後61天內生效。持有人及其關聯公司的受益所有權將根據《交易法》第13(d) 條及其頒佈的規則和條例確定。
股票股息 和股票分割。 倘吾等以存托股份或普通股、 或任何其他股本或同等證券支付股票股息或以其他方式作出應付分派,分拆或合併已發行存托股份或普通股,或重新分類存托股份、普通股或吾等股本中的任何股份,則每份認股權證的行使價將通過將當時 行使價乘以分數而調整,其分子應為緊接該事件發生前已發行的存托股份(不包括庫存股份,如有)數量,其分母應為緊接該事件發生後已發行的存托股份數量。
| 109 |
| 《目錄》 |
權利供應; 按比例分配.如果我們按比例向存托股份持有人發行普通股等價物或購買股份、認股權證、證券或其他財產的權利 ,認股權證持有人將有權收購,但受限於上述實益所有權限制 ,如果持有人持有數量的存托股份,則持有人本可獲得的證券或財產 在緊接發出記錄的日期之前,認股權證完全行使時可發出。如果我們向存托股份或普通股持有人宣佈或作出 任何股息或其他資產分配或收購資產的權利,則認股權證持有人 將有權參與,但受實益所有權限制的限制,在該等分配中, 如果持有人持有在充分行使 後可發行的存托股份數量,則持有人將參與分配的程度相同。搜查令
基本交易 .如果我們進行了一項基本交易,其中包括合併、出售我們幾乎所有的資產、 要約收購、交換收購和其他業務合併交易,則在隨後行使任何認股權證時,其持有人 應有權獲得,對於由存托股份代表的每股普通股,在此期間本應發行 在發生這種基本交易之前,繼承人或收購公司的證券的股份數量,如果它是倖存的公司,及任何額外代價,該等基本交易 可立即行使認股權證的存托股份所代表的普通股數目的持有人, 在這種基本交易之前。
可轉讓性。 每份 認股權證及其項下的所有權利可在交出認股權證時全部或部分轉讓,連同認股權證的書面轉讓 ,受適用證券法的約束;但是,Wainwright十月認股權證和Wainwright五月認股權證 須遵守FINRA的某些轉讓限制。吾等不擬申請權證於任何證券交易所或 其他交易系統上市。
在行使之前,沒有 股東的權利。 除認股權證中規定的情況外,認股權證持有人在行使認股權證之前,作為本公司股本持有人沒有任何投票權、股息 或其他權利。
2020年5月英國配售認股權證
於2020年5月22日,我們發行了333,333個單位,每個單位包括 一股新普通股和一份英國認股權證。英國認股權證的行使價為每股6. 80英鎊,自發行日期起五年零 六個月內到期。我們亦發行英國認股權證,以購買合共16,400股普通股予配售代理Turner Pope,以配合該發售的完成,其條款及條件與發售的其他投資者相同。
2022年8月認股權證
於2022年8月3日,我們向Strand Hanson Limited發行認股權證以購買16,400股普通股,以支付所提供的服務。該等認股權證的行使價為每股2.70英鎊, 自發行日起三年內到期。
二月份的配售代理認股權證
以下為 就2月份私募發行的2月份配售代理權證的簡要摘要,且在所有方面 均受權證所載條款的約束,權證作為本表格F—1的登記聲明的附件存檔。所有與二月私募有關的預充 認股權證、A系列認股權證及B系列認股權證均已行使。
可運動性。 2月配售代理認股權證可予行使,自最初行使日期起計滿三年。持有人應在行權日後兩個交易日內交付行權通知中指定的存托股份的行權總價(受制於下文所述的“無現金行權”安排)。
無現金鍛鍊。 二月配售代理權證僅可在無現金基礎上行使,前提是,在行使時,在現行招股説明書中沒有有效的登記聲明,可用於 二月配售代理權證相關的存托股份的轉售。
行權價格。部分二月配售代理認股權證的 行使價分別為每股存托股份400.00美元,另一部分為每股存托股份232.00美元,各受上述"無現金行使"安排及 本文所述調整所限。
受益所有權 限制。 持有人無權行使2月配售代理權證的任何部分,但在 行使該等行使生效後,該持有人連同該持有人的關聯公司,以及與該持有人或任何該等關聯公司作為一個團體行事的任何人士,將實益擁有超過當前發行在外普通股數量的4.99% 於行使該等行使時發行存托股份相關普通股後生效。該認股權證持有人 在通知我們後,可以增加或減少實益所有權限制至不超過9. 99%的百分比,但實際所有權限制 的任何增加應在通知我們後61天內生效。 持有人及其關聯公司的受益所有權將根據《交易法》第13(d)條以及據此頒佈的規則和條例 確定。
| 110 |
| 《目錄》 |
股票股息 和股票分割。 如果我們以存托股份或普通股、 或任何其他股本或同等證券支付股票股息或以其他方式作出應付分派,分割或合併已發行的存托股份或普通股,或重新分類存托股份、普通股或我們的任何股本,則每份2月配售代理權證的行使價將通過將當時的行使價乘以分數來調整 ,其分子應為緊接該事件發生前已發行的存托股份(不包括庫存 股份,如有)的數量,其分母應為緊接該事件發生後已發行的存托股份數量 。
權利供應; 按比例分配.如果我們按比例向存托股份持有人發行普通股等價物或購買股份、認股權證、證券或其他財產的權利 ,則2月份配售代理認股權證的持有人將有權收購,受上述受益 所有權限制的限制,如果持有人持有號碼,則持有人本可獲得的證券或財產 在緊接有關發行的記錄 日期之前,於2月配售代理權證完全行使後可發行的存托股份。如果我們向 存托股或普通股持有人宣佈或作出任何股息或其他資產分配或收購資產的權利,則2月配售代理權證持有人將有權參與,但須遵守 所有權限制,在這種分配中,持有人將參與其中,如果持有人持有,於二月配售代理認股權證獲全面行使時可予發行之存托股份數目。
基本交易 . If we effect a fundamental transaction, including, among other things, a merger, sale of substantially all of our assets, tender offer, exchange offer and other business combination transactions, then upon any subsequent exercise of a February Placement Agent Warrant, the holder thereof shall have the right to receive, for each Ordinary Share represented by the Depositary Shares that would have been issuable upon such exercise immediately prior to the occurrence of such fundamental transaction, the number of shares of the successor’s or acquiring corporation’s securities, if it is the surviving corporation, and any additional consideration receivable as a result of such fundamental transaction by a holder of the number of Ordinary Shares represented by the Depositary Shares for which the February Placement Agent Warrant is exercisable immediately prior to such fundamental transaction. In addition, in the event of a fundamental transaction that is (i) an all cash or substantially all cash transaction, (ii) a “Rule 13e-3 transaction” as defined in Rule 13e-3 under the Exchange Act, or (iii) with certain limited exceptions, a fundamental transaction involving a person or entity not traded on a national securities exchange or other established trading market, including, but not limited to, the London Stock Exchange, AIM, The New York Stock Exchange, Inc., The NYSE MKT, The NASDAQ Global Select Market, The NASDAQ Global Market, The NASDAQ Capital Market, the OTC QX, the OTC QB or the Over-the-Counter Bulletin Board, then the Company or any successor entity will pay at the holder’s option, exercisable at any time concurrently with or within 30 days after the consummation of the fundamental transaction, an amount of cash equal to the value of the February Placement Agent Warrant as determined in accordance with the Black Scholes option pricing model.
可轉讓性。 每份 配售代理權證及其項下的所有權利可在配售代理權證交出後全部或部分轉讓, 連同權證的書面轉讓,但前提是配售代理權證 須遵守FINRA的某些轉讓限制。吾等不擬申請配售代理權證於任何證券交易所或其他交易系統上市。
在行使之前,沒有 股東的權利。 除配售代理認股權證中規定的情況外,配售代理認股權證持有人 在行使配售代理認股權證之前,作為本公司股本持有人沒有任何投票權、股息或其他權利。
D系列認股權證及二零二三年五月配售代理認股權證
以下為與二零二三年五月發售有關而發行的D系列權證及二零二三年五月配售代理權證的簡要摘要,並在各方面受適用權證所載條文規限,該等權證已作為本 表格F—1的登記聲明的證物存檔。除非另有説明,否則本小節中提及的權證包括D系列權證和 2023年5月配售代理權證。於二零二三年五月發售中發行的所有C系列認股權證均已獲行使。
可運動性. 認股權證於2023年6月14日開始可行使。D系列認股權證及二零二三年五月配售代理認股權證分別自初始行使日期起計五年及三年 年屆滿。持有人應在行使日期後兩個交易日內交付行使通知中指定 的存托股份的總行使價(受限於下文所述的"無現金行使"安排 )。
無現金鍛鍊。 系列D認股權證及二零二三年五月配售代理認股權證可無現金基準行使,前提是且僅前提是,吾等未於初始行使日期起計六個月內提交登記 登記有關認股權證相關存托股份的登記聲明。
| 111 |
| 《目錄》 |
行權價格。每份D系列認股權證的 行使價為每股存托股份16.00美元,每份二零二三年五月配售代理認股權證的行使價為每股存托股份15.00美元。
受益所有權 限制。 持有人無權行使認股權證的任何部分,但在行使該行使生效後,該持有人連同該持有人的關聯公司,以及與該持有人或任何 該關聯公司作為一個集團行事的任何人,將實益擁有超過9.99%的股份(或就二零二三年五月配售代理認股權證而言,為4. 99%),緊隨有關行使後發行存托股份相關普通股 已發行普通股數目 。認股權證持有人在收到通知後,可將實益擁有權限制增加或減少至不超過9.99%的百分比 ,但實益擁有權限制的任何增加應在收到通知後 61天內生效。持有人及其關聯公司的受益所有權將根據交易所法第13(d)節以及據此頒佈的規則和條例確定。
股票股息 和股票分割。 倘吾等以存托股份或普通股、 或任何其他股本或同等證券支付股票股息或以其他方式作出應付分派,分拆或合併已發行存托股份或普通股,或重新分類存托股份、普通股或吾等股本中的任何股份,則每份認股權證的行使價將通過將當時 行使價乘以分數而調整,其分子應為緊接該事件發生前已發行的存托股份(不包括庫存股份,如有)數量,其分母應為緊接該事件發生後已發行的存托股份數量。
權利供應; 按比例分配.如果我們按比例向存托股份持有人發行普通股等價物或購買股份、認股權證、證券或其他財產的權利 ,認股權證持有人將有權收購,但受限於上述實益所有權限制 ,如果持有人持有數量的存托股份,則持有人本可獲得的證券或財產 在緊接發出記錄的日期之前,認股權證完全行使時可發出。如果我們向存托股份或普通股持有人宣佈或作出 任何股息或其他資產分配或收購資產的權利,則認股權證持有人 將有權參與,但受實益所有權限制的限制,在該等分配中, 如果持有人持有在充分行使 後可發行的存托股份數量,則持有人將參與分配的程度相同。搜查令
基本交易 . If we effect a fundamental transaction, including, among other things, a merger, sale of substantially all of our assets, tender offer, exchange offer and other business combination transactions, then upon any subsequent exercise of a warrant, the holder thereof shall have the right to receive, for each Ordinary Share represented by the Depositary Shares that would have been issuable upon such exercise immediately prior to the occurrence of such fundamental transaction, the number of shares of the successor’s or acquiring corporation’s securities, if it is the surviving corporation, and any additional consideration receivable as a result of such fundamental transaction by a holder of the number of Ordinary Shares represented by the Depositary Shares for which the warrant is exercisable immediately prior to such fundamental transaction. In addition, with respect to the Series C Warrants, Series D Warrants and the May 2023 Placement Agent Warrants, in the event of a fundamental transaction that is (i) an all cash or substantially all cash transaction, (ii) a “Rule 13e-3 transaction” as defined in Rule 13e-3 under the Exchange Act, or (iii) with certain limited exceptions, a fundamental transaction involving a person or entity not traded on a national securities exchange or other established trading market, including, but not limited to, the London Stock Exchange, AIM, The New York Stock Exchange, Inc., The NYSE MKT, The NASDAQ Global Select Market, The NASDAQ Global Market, The NASDAQ Capital Market, the OTC QX, the OTC QB or the Over-the-Counter Bulletin Board, then the Company or any successor entity will pay at the holder’s option, exercisable at any time concurrently with or within 30 days after the consummation of the fundamental transaction, an amount of cash equal to the value of the warrant as determined in accordance with the Black Scholes option pricing model.
可轉讓性。 每份 認股權證及其項下的所有權利可在交出認股權證時全部或部分轉讓,連同認股權證的書面轉讓 ,但須遵守適用證券法;但2023年5月配售代理認股權證須遵守某些 FINRA轉讓限制。吾等無意申請認股權證於任何證券交易所或其他交易系統上市。
在行使之前,沒有 作為股東的權利。 除認股權證中規定的情況外,認股權證持有人在行使認股權證之前,作為本公司股本持有人沒有任何投票權、股息或其他權利。
E系列權證、F系列權證、 2023年12月私募預募權證、12月公募預募權證及承銷商權證
以下為E系列權證、F系列權證、2023年12月私募預配權證、12月 公開發售預配權證以及就12月私募及12月公開發售發行的承銷商權證的簡要摘要,並在各方面受適用權證所載條文的規限,其中,作為 本登記聲明的證物存檔於表格F—1。除非另有説明,否則本小節中提及的權證包括E系列權證、 系列F系列權證、2023年12月私募預配權證、12月公開發售預配權證和承銷商 權證。
| 112 |
| 《目錄》 |
可運動性. 認股權證於2023年12月21日開始可行使。E系列認股權證、F系列認股權證及承銷商認股權證分別自初始行使日期起五年、一年及三年屆滿。的 2023年12月私人 安置預先供資認股權證及 12月公開發行預充認股權證 可隨時行使且不會過期。持有人應於行使日期後兩個交易日內交付 行使通知中指定的存托股份的總行使價(受限於下文所述的“無現金行使”安排 )。
無現金鍛鍊。 如果 在持有人行使其E系列權證或F系列權證時,根據《證券法》登記發行E系列權證或F系列權證相關證券的 登記聲明當時無效或可用,且 根據《證券法》不適用於發行此類股票,則代替支付現金 支付在行使總行使價時預期向我們支付的現金,持有人可以選擇 在此行使時接收(全部或部分)根據E系列認股權證及F系列認股權證所載公式 釐定的存托股份淨額。
在持有人行使其權利時 2023年12月私募預先出資的認股權證或12月 公開發行預融資權證,持有人可選擇在行使時收取(全部或部分)根據下列公式釐定的存托股份淨額,以代替預期在行使時向吾等支付的現金支付 以支付總行使價。2023年12月私募預先出資的認股權證或12月公開發行預融資權證, 視情況而定.
行權價格。每一份E系列、F系列、承銷商、2023年12月私人 安置預先出資的認股權證和12月公開發行預充認股權證存托股份分別為2.2美元、2.2美元、2.5美元、0.0001美元和0.0001美元。
受益所有權 限制。*持有人無權行使認股權證的任何部分,條件是在行使該權利後,該持有人連同該持有人的關聯公司,以及任何作為一個團體連同該持有人或任何該關聯公司行事的人士,將實益擁有超過9.99%(或就承銷商認股權證而言,則為4.99%)的普通股數目,而該普通股在該行使後立即生效發行該存托股份。 該認股權證持有人在通知我們後,可將實益所有權限額增加或降低至不超過 9.99%的百分比,但實益所有權限額的任何增加將在通知我們後61天內生效。 持有人及其關聯公司的實益所有權將根據《交易法》第13(D)節及其下發布的規則和條例確定。
股票股息 和股票分割。 倘吾等以存托股份或普通股、 或任何其他股本或同等證券支付股票股息或以其他方式作出應付分派,分拆或合併已發行存托股份或普通股,或重新分類存托股份、普通股或吾等股本中的任何股份,則每份認股權證的行使價將通過將當時 行使價乘以分數而調整,其分子應為緊接該事件發生前已發行的存托股份(不包括庫存股份,如有)數量,其分母應為緊接該事件發生後已發行的存托股份數量。
權利供應; 按比例分配.如果我們按比例向存托股份持有人發行普通股等價物或購買股份、認股權證、證券或其他財產的權利 ,認股權證持有人將有權收購,但受限於上述實益所有權限制 ,如果持有人持有數量的存托股份,則持有人本可獲得的證券或財產 在緊接發出記錄的日期之前,認股權證完全行使時可發出。如果我們向存托股份或普通股持有人宣佈或作出 任何股息或其他資產分配或收購資產的權利,則認股權證持有人 將有權參與,但受實益所有權限制的限制,在該等分配中, 如果持有人持有在充分行使 後可發行的存托股份數量,則持有人將參與分配的程度相同。搜查令
基本交易 . If we effect a fundamental transaction, including, among other things, a merger, sale of substantially all of our assets, tender offer, exchange offer and other business combination transactions, then upon any subsequent exercise of a warrant, the holder thereof shall have the right to receive, for each Ordinary Share represented by the Depositary Shares that would have been issuable upon such exercise immediately prior to the occurrence of such fundamental transaction, the number of shares of the successor’s or acquiring corporation’s securities, if it is the surviving corporation, and any additional consideration receivable as a result of such fundamental transaction by a holder of the number of Ordinary Shares represented by the Depositary Shares for which the warrant is exercisable immediately prior to such fundamental transaction. In addition, with respect to the Series E Warrants, Series F Warrants and the Underwriter Representative Warrants, in the event of a fundamental transaction that is (i) an all cash or substantially all cash transaction, (ii) a “Rule 13e-3 transaction” as defined in Rule 13e-3 under the Exchange Act, or (iii) with certain limited exceptions, a fundamental transaction involving a person or entity not traded on a national securities exchange or other established trading market, including, but not limited to, the London Stock Exchange, AIM, The New York Stock Exchange, Inc., The NYSE MKT, The NASDAQ Global Select Market, The NASDAQ Global Market, The NASDAQ Capital Market, the OTC QX, the OTC QB or the Over-the-Counter Bulletin Board, then the Company or any successor entity will pay at the holder’s option, exercisable at any time concurrently with or within 30 days after the consummation of the fundamental transaction, an amount of cash equal to the value of the warrant as determined in accordance with the Black Scholes option pricing model.
| 113 |
| 《目錄》 |
可轉讓性。 每份 認股權證及其項下的所有權利可在交出認股權證時全部或部分轉讓,連同認股權證的書面轉讓 ,但前提是承銷商認股權證須遵守FINRA的某些轉讓 限制。吾等無意申請認股權證於任何證券交易所或其他交易系統上市。
在行使之前,沒有 作為股東的權利。 除認股權證中規定的情況外,認股權證持有人在行使認股權證之前,作為本公司股本持有人沒有任何投票權、股息或其他權利。
《公司章程》
以下 是我們公司章程中某些條款的摘要。請注意,這只是一個摘要,並非詳盡無遺。 有關更多信息,請參閲我們公司章程的完整版本,該章程作為本註冊的附件 表格F—1聲明.
相關的股份和權利
客體
我們公司的宗旨是不受限制的。
股份權利
在已發行股份附帶 的任何特別權利的前提下,我們的股份可能附帶或附帶任何優先、遞延或其他特別權利或 特權,或受我們可能通過股東普通決議或董事會決定決議所決定的限制。
投票權
在不影響任何權利或限制 的情況下,股份所附帶的投票權 如下:
| · | 舉手錶決時,每一位親身出席的股東和每一位正式授權的代表應有一票表決權; |
| · | 在舉手錶決時,如果 代理人已由一名以上股東正式委任,且一名或多名股東指示該代理人投票贊成該決議,一名或多名股東指示該代理人投票反對該決議,則每位親自出席的代理人有權投票反對該決議; |
| · | 在舉手錶決的情況下,如果 代理人已由一名以上有權就決議投票的股東正式委任,則每位親自出席的代理人均有一票贊成和一票反對:(1)代理人已被一名或多名該等股東指示 投票贊成該決議案,並已被一名或多名該等股東授予任何酌情權 投票,而代理人行使該酌情權投反對票;或(2)代理人已被一名或多名該等股東指示投票反對該決議案,並已被一名或多名該等股東授予任何酌情權投票,而代理人行使該酌情權投票贊成該決議案;及 |
| · | 在投票表決中,每名親身或委派代表出席的股東對其持有的每股 股份有一票投票權。 |
在任何股東大會上,交大會表決的決議應以舉手錶決的方式決定,除非要求以投票方式表決。根據《公司法》的規定, 公司法中的差異--表決權“在本招股説明書中,以下人士可要求以投票方式表決:
| · | 會議主席; |
| · | 五名以上有投票權的親臨或委派代表出席的股東; |
| · | 親自出席或委派代表出席,且代表所有有權就決議投票的股東的總投票權合計不少於10%的股東;或 |
| · | 任何親身或委派代表出席並持有賦予對 決議案表決權利的股份的股東,而就該決議案已繳足的款項合計不少於賦予該權利的所有股份已繳足股款總額的10%。 |
對投票的限制
任何股東均無權在任何股東大會或任何單獨的股東大會上就其持有的任何股份投票,除非 其就該股份應付的所有催繳股款或其他款項已支付。
| 114 |
| 《目錄》 |
董事會可不時 就任何未繳股款向股東催繳股款,而各股東須(在至少14天通知的規限下,指明付款時間及地點)於指定時間或多個時間支付催繳股款。 如催繳股款到期及應付後仍未繳款,而董事會提供的14天通知仍未獲遵守,則發出通知的任何股份可由董事會決議予以沒收。
股東出席本公司股東大會或股東大會或就其股份投票的權利,如未能遵守披露有關股份權益的適當要求,可由董事會根據本公司的組織章程細則暫停。請參閲“其他英國法律考慮因素-披露股份權益“在這份招股説明書中。
分紅
吾等可通過普通決議案宣佈根據股東各自的利潤權益向股東支付股息,並可確定支付股息的時間 。宣佈的股息不得超過董事建議的數額。董事會可不時 宣佈並向我們的股東支付董事認為根據我們可供分配的利潤而合理的中期股息 。我們的普通股沒有固定的分紅權利產生的日期。
根據董事的建議,股東可通過普通決議案,指示所有或任何部分股息須以分派特定資產的方式支付,尤其是任何其他法人團體的已繳足股份或債券。我們的公司章程還允許,在股東普通決議的事先授權下,允許股票所有者有機會選擇獲得全額支付的普通股,而不是現金,或股票和現金的組合,以支付未來的股息。
通過行使留置權的方式,如果股東以任何方式欠我們與股份有關的任何款項,董事會可以從股東持有的任何股份的任何股息中扣除任何這筆錢,或從我們就該股份應支付的其他款項中扣除任何款項。以這種方式扣除的錢可能會被用來支付欠我們的金額。
未認領的股息和與股份有關的其他應付款項 可由董事投資或以其他方式用於我們的利益,直至它們被認領為止。股息或其他款項在最初到期支付12年後仍無人認領,將被沒收並歸還給本公司。
股東獲得股息的權利 如果佔該類別已發行股份的0.25%以上,如果他未能 遵守適當的披露股份權益的要求,董事可能會暫停其股息。請參閲“其他英國法律考慮事項-披露股份權益 “在這份招股説明書中。
控制權的變更
本公司的組織章程中沒有任何會導致延遲、推遲或阻止控制權變更的具體條款。然而,我們須遵守《城市守則》的條款 ,該條款載有詳細條款,規範對授予投票權的公司 股份的任何收購要約的時機和方式。見"英國其他法律考慮事項—《城市收購與合併守則》“ 在本招股説明書中。
權利的變更
每當我們的股本被分成 不同類別的股份時,任何類別所附的所有或任何權利可以以這些權利所規定的方式(如有)變更或廢除,(在沒有任何該等條款的情況下)經持有人書面同意至少75% 該類別已發行股份或經該類別股份持有人單獨股東大會上通過的特別決議案授權。
股本變更及購回
在遵守《公司法》條款的前提下,且在不損害任何類別股份附帶的任何相關特別權利的情況下,我們可不時:
| · | 根據本公司的組織章程及任何相關股東決議案,通過配發及發行新股增加本公司的股本; |
| · | 將我們的全部或任何股本合併為更大面值的股份(即,(面值)比 現有股份; |
| · | 將我們的任何股份細分為面值較小的股份(即,面值)高於我們現有 股份;或 |
| · | 重新命名我們的股本或任何類別的股本。 |
| 115 |
| 《目錄》 |
優先購買權與新股發行
根據《公司法》, 全部以現金支付的股本證券(根據僱員股份計劃持有的股份除外)的發行必須首先 按各自名義金額的比例(即,以 相同或更優惠的條款持有其持有的股份,除非已通過相反的特別決議案或公司章程另有規定 不受此要求的限制(該限制最長可達五年,其後將需要我們的股東批准, 才能延長該限制)。在此背景下,"股本證券"是指普通股(並不包括就股息或資本而言,附帶僅在指定數額範圍內參與分配的權利的股份),以及認購或轉換證券為此類普通股的任何和 權利。這與美國法律不同,根據美國法律,股東通常 沒有優先購買權,除非在公司註冊證書或其他方面明確授予。
董事會尋求在每次年度股東大會上以非優先股方式配發股份的一般授權。本公司於2023年6月14日舉行的股東周年大會上通過決議案,授權董事一般配發本公司股份,或授予認購、轉換或交換任何證券為本公司股份的權利,總面值最高為140,000,000 GB,直至本公司將於2026年舉行的股東周年大會結束為止。《公司法》規定的優先購買權不適用於根據該授權進行的現金配售。
股份轉讓
任何憑證式股東可以以通常的普通格式或公司法允許並經董事會批准的任何其他方式通過轉讓文書轉讓 其全部或部分股份。任何書面轉讓文書應由轉讓人或其代表簽署,以及(如果是部分繳足股份)受讓人。
所有無證書股份的轉讓應 按照並遵守《2001年無證書證券條例》的規定及其相關制度的設施和要求 進行。《2001年無證書證券條例》允許以無證書形式發行和持有股票,並 通過計算機系統進行轉讓。
董事會可拒絕登記 任何股份的轉讓,除非:
| · | 全部繳足股份; |
| · | 公司沒有留置權的股份; |
| · | 只就一種股份類別; |
| · | 一個受讓人或不超過四個受讓人; |
| · | 已加蓋適當印章或正式證明或以其他方式表明董事會滿意 豁免任何所需印花税;或 |
| · | 在本公司的註冊辦事處或 董事會可能決定的其他地點進行登記,並附上相關股份的證書(非證書股份除外)和董事會可能合理要求的任何其他 證據,以提供轉讓人的該等股份的所有權。 |
如果董事會拒絕登記 轉讓,則應在實際可行的情況下儘快,無論如何在提交轉讓之日後兩個月內,向 受讓人發送拒絕通知,連同拒絕理由。
波峯
CREST是一個計算機化的無紙股份轉讓和結算系統,允許證券通過電子方式轉讓,而無需書面轉讓文書 。公司章程與CREST成員資格一致,除其他外,允許持有和轉讓非證書形式的股份。
股東大會
股東周年大會
根據《公司法》,我們 除該年度的任何其他股東大會外,每年還需舉行一次股東周年大會,並在召開股東周年大會的通知中指明該股東周年大會。股東周年大會應在董事會認為合適的時間和地點召開,但 的規定如下:公司法的差異—股東周年大會"和 "公司法的差異—股東大會通知“在這份招股説明書中。
股東大會的通知
召開全體 會議的安排見"公司法上的差異-股東大會通告“在這份招股説明書中。
| 116 |
| 《目錄》 |
在符合某些條件的情況下,根據與存托股份有關的存託協議條款, 存托股份持有人有權收到通知。請參閲“説明 美國存托股份-投票權“在這份招股説明書中。
大會的法定人數
除非有法定人數出席,否則不得在任何股東大會上處理任何事務,但未達到法定人數並不妨礙委任、挑選或選舉主席,而 不得被視為會議事務的一部分。至少有兩名親身或委派代表出席並有權投票的股東應構成所有目的的法定人數。
班級會議
《公司章程》中有關股東大會的規定適用於某類股份持有人的每一次單獨的股東大會,但下列情況除外:
| · | 除董事會成員外,任何成員均無權知會或出席該會議,除非他是該類別股份的持有人; |
| · | 該類別會議的法定人數為兩名親自或委託代表不少於該類別已發行股份面值三分之一的持有人; |
| · | 在類別會議上,親身或委派代表出席的類別股票持有人可要求以投票方式表決,並在投票時有權就他所持有的每一類別股票投一票;及 |
| · | 如在該等持有人的任何延會上,出席會議的法定人數不足,則一名親身或委派代表出席延會的該類別股份 的持有人構成法定人數。 |
董事
董事人數
我們的董事會中不能少於兩名董事 。我們沒有董事的最高人數,但我們可以通過股東的普通決議來確定最高人數。 我們可以通過股東的普通決議,不時改變董事的最低人數和任何最高人數。
董事的委任
在組織章程細則 條文的規限下,吾等可透過股東普通決議案推選任何人士出任董事成員,以填補臨時空缺 或加入現有董事會。
在不影響通過股東決議委任任何人士為董事的權力的情況下,董事會有權委任任何人士為董事,以填補臨時空缺或作為現有董事會的新增成員。任何由董事會委任的董事將任職至下一屆股東周年大會及在該次股東周年大會上獲委任替代其職務的人士 較早者為止。該董事有資格在該會議上連任,但在確定董事 或在該會議上輪流退任的董事人數時不應被考慮在內。
董事輪換
在每屆股東周年大會上,三分之一的董事 須退任,或如董事人數並非三的倍數,則最接近但不超過三分之一的董事人數須退任 ,而每名董事必須至少每三年退任一次。如董事人數少於三人,應由一名董事 連任。
每次卸任的董事 應為自上次當選以來任期最長的須輪值退任的董事,但在 同一天成為或再次當選董事的人士之間,應通過抽籤決定(除非他們之間另有協議) 。
於股東周年大會上退任的董事有資格連選連任。
股東可以在 董事退休的會議上選舉一人填補空缺的職位,如果辭職的董事願意繼續 行事,則應被視為已連任,除非在該會議上明確決議不填補該空缺職位,或除非 決議重新—該董事的選舉應在會議上提出而失敗,或該董事已向我們發出書面通知 他不願連任,或該董事已達到根據 公司法適用於他作為董事的退休年齡。
| 117 |
| 《目錄》 |
董事的利益
在法律允許的最大範圍內,董事會可授權向其提出的任何事項,否則會導致董事違反其避免 其擁有或可能擁有與本公司利益相沖突或可能相沖突的直接或間接利益,且 合理地被視為可能會引起利益衝突的情況。除非董事另有協議,否則董事 不得就其(或與其有關的人士)從董事授權的任何事項中獲得的任何利益向我們負責, 與此相關的任何合同、交易或安排不得因任何該等利益而被撤銷。
根據《公司法》第175、177和182節的要求(要求董事避免出現其擁有或可能擁有與本公司利益相沖突或可能相沖突的直接或間接 利益的情況,並申報其在與本公司的擬議或現有交易或安排中直接或間接 擁有的任何利益),且只要他已根據《公司法》和《公司章程》向董事會披露其任何利益的性質 和範圍,董事不論其職務 :
| · | 可能是與我們的任何交易或安排的一方,或以其他方式感興趣,或在其中我們 以其他方式感興趣; |
| · | 可能是由我們推動的或我們有其他利益的任何法人團體的董事或其他高級人員,或受僱於任何與任何法人團體的交易或安排的一方,或以其他方式與該等法人團體有利害關係;及 |
| · | 不會因其職位而就其從任何該等職位或僱傭、任何該等交易或安排或任何該等法人團體的任何權益中獲得的任何利益向吾等負責,且不得因任何該等權益或利益而避免任何該等交易或安排。 |
如果 董事以任何方式直接或間接地在(a)與我們的擬議交易或安排中或(b)我們已達成的交易或安排中擁有權益,則除非公司章程另有規定,在董事會或董事會委員會的會議上,該董事不得就有關其 的事項的任何決議進行表決。擁有重大權益(但由於其在或通過本公司的股份、債權證或其他證券中的權益除外),除非其權益或責任僅因情況屬於以下一段或多段而產生:
| · | 該決議涉及就借給吾等或吾等任何附屬公司的款項,或因吾等或吾等任何附屬公司的要求或為吾等或我們的任何附屬公司的利益而招致的債務,向其本人或與其有關連的人士提供擔保、保證或賠償; |
| · | 該決議涉及對董事或我們的任何子公司的債務或義務提供擔保、擔保或賠償,而董事或與其有關的人已根據擔保或賠償或提供擔保對該債務或義務承擔全部或部分責任; |
| · | 該決議以任何方式與他直接或間接擁有權益的任何其他公司有關 ,不論是作為高級管理人員或股東或以其他方式,條件是,據他所知,他和任何與他有關聯的人 並不持有佔該公司任何類別股本或投票權的百分之一或以上的股份權益 該公司股東享有的權利; |
| · | 該決議以任何方式涉及為我們的僱員或我們的子公司的任何僱員的利益作出的安排,而該安排並不授予他一般不授予與該安排有關的僱員的任何特權或利益; |
| · | 該決議在任何方面與為董事購買或維持保險有關;或 |
| · | 該決議是針對任何不能合理地認為與董事的利益相沖突的事項。 |
董事不應計入出席會議的法定人數 中,就其無權表決的決議。
如果在 董事會或董事會委員會的會議上出現關於董事表決權或被計入法定人數的問題,並且 該問題未通過其自願同意放棄表決權或不被計入法定人數的方式解決,該問題可以 在會議結束前,提交會議主席,其對 本人以外的任何董事的裁決應為最終和決定性的,除非有關董事的利益性質或程度沒有 公平披露。
與 董事有關聯的人的利益應視為董事的利益,《公司法》第252條應確定一個人是否與董事有關聯。
董事酬金及薪酬
每位董事應按董事會(或為免生疑問,任何正式授權的董事會委員會)不時釐定的費率向每位董事支付費用 ,但支付予董事的所有該等費用的總和不得超過每年600,000 GB, 或股東不時以普通決議釐定的較高金額。
| 118 |
| 《目錄》 |
每位董事可獲支付其出席董事會或其委員會會議或股東大會或個別持有人類別股份或債權證會議的合理旅費、住宿費及其他往返費用,並支付其在處理本公司業務或履行董事職責時適當及合理地產生的所有開支。任何董事應我們的要求為我們所要求的任何目的出國或居住,或者提供董事會認為超出董事一般職責的服務,都可以獲得董事會決定的額外報酬。
董事高管應獲得董事會確定的薪酬,作為董事薪酬的補充或替代,詳情見上文 。
年齡限制和股份所有權
我們對我們的 董事沒有任何年齡限制,也沒有因為達到一定年齡而強制退休。我們的董事不需要持有公司的任何股份 。
借款權
我們的董事可以行使公司的所有權力 借入或籌集資金,並將我們的全部或任何部分業務、財產和資產(現在和未來)、 和未催繳資本抵押或抵押。在公司法的規限下,董事亦可為本公司或任何第三方的任何債務、責任或義務設立及發行債權證、其他貸款股票及其他證券,作為直接擔保或作為附屬擔保。我們的董事被要求限制本公司的借款,以確保在任何時候未償還的借款本金總額 及其所有附屬業務(集團內借款除外)在任何時候都不得超過本公司及其子公司資產總值的兩倍,除非事先獲得本公司普通決議的批准。
Biodexa及其董事和高級職員的法律責任
根據《公司法》中關於賠償的規定,每個董事、替代董事或前董事(以及任何關聯公司)有權從我們的資產中獲得賠償,以支付其因任何訴訟或任何監管調查或行動而招致的所有費用和債務,這些費用和責任與其作為董事的所作所為或不作為或被指控的所作所為或不作為有關,只要賠償不包括對公司的違約責任或任何罰款,與董事違約訴訟有關的費用或相關費用。合法賠償延伸到公司向他或她提供資金,以支付他在任何訴訟(無論是民事或刑事訴訟)中或在申請法定救濟或監管當局的調查中為自己辯護而發生或將發生的支出,但如果該等訴訟、申請、調查或行動與任何據稱的疏忽、過失、他或她對公司(或我們的任何關聯公司)的失職或失信行為 ,他或她因此而被定罪或被判失信。 根據英國法律,任何旨在免除公司的董事人員(在任何程度上)因與公司有關的任何疏忽、失責、失職或失信行為而承擔的責任的條款均無效。
根據吾等於2015年8月5日宣佈的契據或彌償契據,吾等董事會及吾等公司祕書將獲賠償與其職務有關的費用及責任,但不包括該等人士欠本公司本身(或吾等任何相聯實體)的任何債務 ,亦不包括因公司法所禁止的某些情況下的賠償責任。賠償契約 規定,董事也可以借出款項來支付任何相關的辯護費用,前提是 如果此類訴訟涉及刑事或民事案件,當事人被判有罪或被判敗訴,則必須償還此類貸款。 我們在賠償契約項下的總負債為500萬GB。
鑑於根據憲章條款、合同、安排、法規或其他規定,我們的董事、高級管理人員和控制人可能可以對證券法下產生的責任進行賠償,我們承認美國證券交易委員會認為此類賠償違反證券法中所表達的公共政策,因此不能強制執行。
英國法律的其他考慮因素
強制採購和收購
根據《公司法》第979條至第991條,如果已向我們提出收購要約,且要約人已收購或無條件簽約收購價值不低於 的股份,以及這些股份所攜帶的不低於90%的投票權,要約人可以 向要約人尚未收購或無條件合同收購的與要約有關的任何股份的持有人發出通知,説明他希望收購,並有權如此收購,以與公開要約相同的條款出售這些股份。要約人將 向傑出的少數股東發送通知,告知他們將強制收購他們的股份。此類通知 必須在以規定方式接受要約的最後一天起三個月內發送。少數 股東的擠出可在發出通知之日起六週內完成,此後要約人可執行 已發行股份的轉讓,並向我方支付對價,我方將以信託方式為 已發行少數股東持有對價。根據《公司法》強制收購其股份的未上市少數股東 的對價一般而言必須與收購要約下可獲得的對價相同。
| 119 |
| 《目錄》 |
銷售一空
《公司法》還賦予我們的少數 股東在某些情況下有權被要約人收購我們所有股份。與要約有關的股份的 持有人,且未以其他方式接受要約的,可以要求要約人收購其股份 ,如果在該要約的接受期屆滿前,(i)要約人已收購或同意收購價值不低於 的有表決權股份的90%,以及(ii)這些股份所附帶的投票權的不低於90%。要約人可以對少數股東被收購的權利設定期限 ,該期限不少於接受期限結束後三個月。如果 股東行使其被收購的權利,則要約人必須按照本要約的條款或 可能商定的其他條款收購這些股份。
股份權益的披露
根據《公司法》第22部分, 吾等有權發出書面通知,通知吾等知悉或有合理理由相信擁有吾等股份權益的任何人士,或 於緊接發出通知日期前三年內的任何時間,要求該 人員在合理時間內向我們披露該人員利益的詳情,(就其所知而言) 存在或存在於該等股份中的任何其他權益的詳情。公司章程規定,在任何此類通知送達後14天內,該人士須作出迴應 。
根據公司章程,如果 個人在向我們提供有關股份或違約股份的所需詳情時違約,董事 可發出通知指示:
| · | 就違約股份而言,相關股東無權出席任何股東大會或某類別股份持有人大會或在任何投票表決時投票( 親自或委派代表),或行使 違約股份賦予的任何權利;及/或 |
| · | 如果違約股份至少佔其類別的0.25%,(A)就違約股份支付的任何股息(或股息的任何部分) 應由我們保留,不承擔支付利息的責任,(B)股東可能無權 選擇接受股份而不是股息,以及(C)任何違約股份的相關成員不得登記轉讓 (除非該成員本人沒有違約,且轉讓與違約股份無關,轉讓是豁免的或轉讓 根據2001年英國無證書證券法規允許轉讓)。 |
購買自己的股份
根據英國法律,有限公司 只能從公司的可分配利潤或為購買融資而發行的新股份的收益中購買或贖回自己的股份,條件是他們這樣做不受其章程的限制。有限公司不得 購買或贖回自己的股份,如果由於購買, 公司將不再有任何已發行股份,但可贖回股份或作為庫存股份持有的股份除外。股份必須全部支付,才能回購。
在遵守上述規定的前提下,我們可以按照以下規定的方式購買 自己的股份。我們可以根據股東的普通決議案 在市場上購買我們自己的繳足股份。授權購買的決議必須:
| · | 具體説明授權收購的最大股份數量; |
| · | 確定可能為股份支付的最高和最低價格;以及 |
| · | 指定不遲於決議通過後五年的日期,購買授權書將在該日期失效。 |
我們可以在 購買發生前,根據股東決議授權的購買合同,在認可的投資交易所以外的地方購買我們自己的繳足股份 。如果我們擬向其購買股份的任何股東就決議案投票 ,且如果他沒有這樣做,決議案將不會獲得通過,則任何授權將無效。授權購買的決議必須指定購買授權到期的日期, 不得遲於決議通過後五年。
| 120 |
| 《目錄》 |
分配和分配
根據《公司法》,公司 在合法進行分配或股息之前,必須確保其擁有足夠的可分配儲備(非合併基礎上)。 基本規則是,公司可用於進行分配的利潤是其累計的、已實現的利潤, 只要以前未用於分配或資本化,減去其累計的、已實現的損失,只要以前未在適當進行的資本削減或重組中註銷 。在可支付分派 或股息之前,須有足夠的可分派儲備金的要求適用於我們以及我們根據英國法律註冊成立的各附屬公司。
我們作為一家上市 公司,僅為進行分配而獲得可分配利潤是不夠的。 對我們施加了額外的資本維持要求,以確保公司的淨值至少等於其資本額。上市公司只能進行分銷:
| · | 如果在作出分派時,其淨資產數額(即資產超過負債的總額 )不少於其已繳股本和不可分派儲備的總額;及 |
| · | 如果在作出分配時,分配本身並未將淨資產的數額減少到少於該總額,則在此範圍內。 |
關於收購和合並的城市法規
公司是一家在英國註冊成立的上市有限公司,其註冊辦事處位於英國,但其證券不被 允許在英國受監管的市場或多邊交易設施(或海峽羣島 或馬恩島的證券交易所)上交易。只有當專家組認為公司的中央管理和控制地點位於英國(或海峽羣島或馬恩島)時,《城市守則》才適用於公司。這就是所謂的“居住測試”。為《城市法典》目的, 集中管理和控制測試的應用方式可能與 英國税務機關HMRC的應用方式不同。根據《城市法典》,委員會通常考慮公司大多數 董事的居住地以及其他因素,以確定公司在哪裏 集中管理和控制的地方。本公司四名董事中有三名目前居住在英國,且本公司的中央管理和控制地點 目前打算留在英國,這意味着本公司 及其股東將享有《城市法典》提供的保護,包括但不限於《城市法典》第9條規定的保護,如下所述。
城市代碼由專家組發佈和管理。《城市法典》提供了一個框架,在該框架內對受其約束的公司進行收購 。特別是,《城市法典》載有關於強制性要約的若干規則。根據《城市法典》第9條,如果 個人:
| · | 獲得我們股份中的權益,該權益與他或 與其一致行動的人擁有權益的股份一併計算,擁有我們股份30%或以上的投票權;或 |
| · | 與與其一致行動的人一起,在總計持有不少於 30%且不超過50%的本公司投票權的股份中擁有權益,獲得額外的股份權益,從而增加了該人擁有權益的附帶投票權的股份的百分比 , |
收購方及視乎情況而定,其協議方將被要求(除非獲得小組同意)以不低於收購方或其協議方在過去12個月內為股份權益支付的最高價格的現金要約收購吾等的已發行股份。
儘管有上述規定,如果發生任何變更導致公司 被視為不再在英國、海峽羣島或馬恩島擁有其中央管理和控制地點,則公司將來可能不再受《城市守則》的約束。
外匯管制
除預扣税要求外,英國沒有任何政府法律、法令、 法規或其他立法可能影響資本的進出口,包括 現金和現金等價物供我們使用,或可能影響我們向普通股或存托股的非居民 持有人匯款股息、利息或其他付款。英國 法律或公司章程沒有對非居民持有股份或投票權的權利施加限制。
| 121 |
| 《目錄》 |
公司法中的差異
《公司法》的適用條款不同於適用於美國公司及其股東的法律。以下是 適用於我們的《公司法》條款與《特拉華州總公司法》(特拉華州總公司法)在股東權利和保護方面的某些差異的摘要。本摘要並不打算對各自的 權利進行完整的討論,而是參照英國法律和特拉華州法律對其進行了限定。
| 英格蘭和威爾士 | 特拉華州 | |||
| 董事人數 | 根據《公司法》,上市有限公司必須至少有兩名董事,董事人數可由公司章程規定或按公司章程規定的方式確定。 | 根據特拉華州法律,一家公司必須至少有一家董事,董事人數應由章程或按章程規定的方式確定。 | ||
| 董事的免職 | 根據《公司法》,股東可通過普通決議案(該決議案須於股東大會上以親身或委派代表投票者的簡單多數票通過)無正當理由罷免董事,而不論董事與本公司訂立的任何服務合約的任何條款,但須提前28整天通知本公司及其股東。在收到關於罷免董事的擬決議的通知後,公司必須立即將通知的副本送交有關董事。還必須遵守《公司法》下的某些其他程序要求,例如允許董事在會議上或以書面形式提出反對罷免其職務的陳述。 | 根據特拉華州法律,當時有權在董事選舉中投票的多數股份的持有者可以在無理由或有理由的情況下罷免任何董事或整個董事會,但以下情況除外:(A)除非公司章程另有規定,否則對於董事會屬於機密的公司,股東只有在有理由的情況下才能罷免,或(B)對於具有累積投票權的公司,如果要罷免的董事會人數少於整個董事會,任何董事,如果所投的反對罷免的票數足以選舉他當選,則不得無故罷免他,如果在整個董事會選舉中累計投票,或者如果存在董事類別,則在他所屬類別的董事選舉中投票。 | ||
| 董事會的職位空缺 導演 |
根據英國法律,除公司最初董事外的董事的任命程序一般載於公司的組織章程,但如果兩名或兩名以上的人通過股東決議被任命為有限公司的董事,則任命每名董事的決議必須單獨表決。 | 根據特拉華州法律,空缺和新設立的董事職位可由當時在任的大多數董事(即使不足法定人數)或唯一剩餘的董事填補,除非(A)公司註冊證書或公司章程另有規定,或(B)公司註冊證書指示特定類別的股票將選舉該董事,在此情況下,由該類別選舉的其他董事的大多數或由該類別選舉的唯一剩餘董事將填補空缺。 | ||
| 股東周年大會 | 根據《公司法》,上市有限公司必須在公司年度會計參考日期之後的每六個月期間舉行年度股東大會。 | 根據特拉華州法律,股東年會應在董事會不時指定的地點、日期和時間舉行,或在公司註冊證書或章程規定的時間舉行。 |
| 122 |
| 《目錄》 |
| 英格蘭和威爾士 | 特拉華州 | |||
|
股東大會
|
根據《公司法》,上市有限公司的股東大會可由董事召集。
持有在股東大會上有投票權的公司實收資本至少5%的股東可以要求董事召開股東大會,如果董事在一定期限內沒有召開股東大會,則可以自行召開股東大會。 |
根據特拉華州法律,股東特別會議可由董事會召開,或由公司註冊證書或章程授權的一人或多人召開。 | ||
| 有關一般事宜的通知 個會議 |
根據《公司法》,召開年度股東大會和在會上提出任何決議,必須提前21整天發出通知。除公司章程規定的較長期限外,任何其他股東大會均須提前至少14整天發出通知。此外,某些事項,如罷免董事或審計師,需要特別通知,即28整天的通知。在任何情況下,公司股東均可同意較短的通知期,就股東周年大會而言,所需的股東同意比例為有權出席及表決的股東的100%,而就任何其他股東大會而言,股東同意的比例為有權出席大會並於會上投票的過半數成員,即合共持有不少於95%股份面值並有權出席大會並於會上投票的過半數成員。 | 根據特拉華州法律,除非公司註冊證書或章程另有規定,任何股東會議的書面通知必須在會議日期不少於10天或超過60天之前發給每位有權在會議上投票的股東,並應明確會議的地點、日期、時間和目的。 | ||
| 代理 | 根據《公司法》,在任何股東大會上,股東可以委派另一人代表他們出席會議、發言和投票。 | 根據特拉華州的法律,在任何股東會議上,股東可以指定另一人通過委託代理該股東,但這種委託不得在自其日期起三年後投票或代理,除非委託規定了更長的期限。特拉華州公司的董事不得出具代表董事作為董事投票權的委託書。 | ||
| 優先購買權 | 根據《公司法》,“股權證券”是指:(1)公司的股份(股息和資本方面的股份除外),只有權參與指定數額的分配(“普通股”),或(2)認購證券或將證券轉換為普通股的權利,建議以現金分配,必須首先按其所持股份的面值按比例提供給公司現有的股權股東,除非有例外情況或股東在股東大會上通過了與之相反的特別決議,或者公司章程根據《公司法》的規定另有規定。 | 根據特拉華州法律,股東沒有優先認購額外發行的股票或任何可轉換為此類股票的證券的權利,除非公司註冊證書明確規定了此類權利。 |
| 123 |
| 《目錄》 |
| 英格蘭和威爾士 | 特拉華州 | |||
| 分配的權限 | 根據《公司法》,公司董事不得分配股份或授予認購或將任何證券轉換為股份的權利,除非有例外情況或股東在股東大會上通過了與之相反的普通決議,或公司章程根據《公司法》的規定另行規定。 | 根據特拉華州的法律,如果公司的章程或公司註冊證書有此規定,董事會有權授權發行股票。它可以授權發行以現金、任何有形或無形財產或公司的任何利益或其任何組合為對價的股本。它可以通過核準一個公式來確定這種對價的數額。在交易中沒有實際舞弊的情況下,董事對這種對價的價值的判斷是決定性的。 | ||
| 高級船員的法律責任及 導演 |
根據《公司法》,任何條款,無論是包含在 公司章程、任何合同或其他內容中,如果聲稱在任何程度上免除公司的董事人員因與公司有關的任何疏忽、過失、失職或背信行為而承擔的任何責任,均屬無效。
公司直接或間接在任何程度上為公司或關聯公司的董事人員提供賠償的任何條款也是無效的,因為他所在的公司因疏忽、過失、失職或違反信託而承擔與他有關的任何責任 ,但《公司法》允許的例外情況除外,《公司法》規定該公司可以:(A)購買和維護針對此類責任的保險; (B)提供“合資格第三方彌償”(即就董事向公司或相聯公司以外的人承擔的法律責任或在他未被定罪的刑事訴訟中招致的法律責任而作出的彌償);及(C)提供“合資格退休金計劃彌償”(即就因公司作為職業退休金計劃受託人而招致的法律責任而招致的法律責任作出彌償)。 |
根據特拉華州法律,公司的公司註冊證書可包括一項條款,取消或限制董事因違反作為董事的受信責任而對公司及其股東造成的損害的個人責任。然而,任何條款都不能限制董事在以下方面的責任:
·禁止 違反董事對公司或其股東的忠誠義務;
·不誠實信用的行為或不作為,或涉及故意不當行為或明知違法的行為;
·*故意或疏忽支付非法股息或股票購買或贖回;或
·禁止任何 董事謀取不正當個人利益的交易。 |
| 124 |
| 《目錄》 |
| 英格蘭和威爾士 | 特拉華州 | |||
| 投票權 |
根據英國法律,除非公司股東要求 或會議主席或公司章程要求進行投票,否則股東應以舉手方式對所有決議進行表決。根據《公司法》,以下情況可要求投票表決:(A)不少於五名有權就決議投票的股東;(B)代表所有有權就決議投票的股東 總投票權不少於10%的任何股東(S);或(C)持有有權就決議案投票的公司股份的任何股東(S),而該等股份的已繳足股款總額不少於賦予該項權利的所有股份已繳足股款總額的10% 。一家公司的公司章程可能會為股東提供更廣泛的投票權利,在我們的案例中,上文(A)款中的數量從五個減少到三個。
根據英國法律,普通決議案如獲出席(親自或受委代表)及有權投票的股東以簡單多數(超過50%)通過,則以舉手方式通過。如要求以投票方式表決,普通決議案如獲代表出席股東(親身或受委代表)總投票權的簡單多數 的持有人批准,而該等股東有權就決議案投票。特殊的 決議需要親自或委派代表出席 會議的股東投不少於75%的贊成票。 |
特拉華州法律規定,除非公司註冊證書另有規定,否則每個股東持有的每股股本有權投一票。 | ||
| 股東投票表決 確定 交易 |
《公司法》規定了安排方案,即公司與任何類別的股東或債權人之間的安排或妥協,用於某些類型的重組、合併、資本重組或收購。這些安排需要:
· 在根據法院命令召開的股東或債權人會議上批准多數股東 或債權人佔該類別股東或債權人或其類別持有的資本或所欠債務價值75%的債權人 親自出席或委派代表出席並參加表決;及
· 法院的批准。 |
一般而言,根據特拉華州法律,除非公司註冊證書規定 大部分股票的投票,完成合並、合併、出售、租賃或交換全部或幾乎全部 公司的資產或解散要求:
· 董事會批准;及
· 批准 由多數已發行股票持有人的投票,或如果公司註冊證書規定多於或少於 每股一票,即有權就該事項投票的公司發行在外股票的多數票。 |
| 125 |
| 《目錄》 |
| 英格蘭和威爾士 | 特拉華州 | |||
| 行為標準 對於董事 |
根據英國法律,董事應承擔各種法定和受託責任 對公司的職責,包括:
· 到 以他認為最有可能促進公司成功的方式行事,使其成員受益 整體而言,
· 到 避免他擁有或可能擁有與利益相沖突或可能相沖突的直接或間接利益的情況 公司;
· 到 按照公司章程行事,並只為授予該等權力的目的而行使其權力;
· 到 獨立判斷;
· 到 採取合理的謹慎、技巧和勤勉;
· 不是 接受第三者因其身為董事或以董事身份行事或不行事而授予的利益;及
· 到 申報他在與公司進行的建議或現有的交易或安排中直接或間接擁有的任何利益。 |
特拉華州法律不包含關於 董事的行為標準。董事受託責任的範圍一般由國家法院確定 特拉華州。一般而言,董事有義務在充分知情的基礎上,以合理的方式行事, 相信這符合股東的最佳利益。
特拉華州公司的董事應履行 對公司及其股東的關心和忠誠。注意義務一般要求董事以誠信行事, 一個通常謹慎的人在類似情況下會採取的謹慎態度。根據這一職責,董事必須告知自己 有關一項重大交易的所有合理可得的重大資料。忠誠義務要求董事 以他合理地相信符合法團的最佳利益的方式進行。他不得利用公司職位從事個人事務 獲得或優勢。一般情況下,除某些例外情況外,董事的行為被推定為在知情的情況下作出 (c)根據本公司的法律規定,並真誠地相信所採取的行動符合公司的最佳利益。然而,這個假設 可以被違反其中一項受信責任的證據推翻。特拉華州法院還強制實施了更高的行為標準 特拉華州公司的董事採取任何旨在挫敗公司控制權威脅變動的行動。
此外,根據特拉華州法律,當董事會 在特拉華州公司批准出售或解散公司時,在某些情況下,董事會可以有 有義務獲得股東合理可得的最高價值。 | ||
| 股東訴訟 | 根據英國法律,一般而言,公司(而非股東)是就公司所犯錯誤或公司內部管理出現不當行為而提起的訴訟的適當申索人。儘管有這一一般性立場,《公司法》規定(i)法院可允許股東提出衍生索賠,(即就公司及代表公司的訴訟)就因董事的疏忽、失責、(ii)股東可以向法院提出申索,公司的事務一直或正在以不公平的方式處理,損害了部分股東。 |
根據特拉華州的法律,如果公司本身未能強制執行權利,股東可以發起派生訴訟以強制執行公司的權利。投訴必須:
· 狀態 原告在原告投訴的交易發生時是股東,或者原告在此後分享了股份 借法律的實施而轉授原告人;及
· 斷言 特別是原告為從董事處獲得原告希望的訴訟所做的努力以及原因 原告人未能取得訴訟;或
· 狀態 不努力的原因。
此外,原告必須在衍生品訴訟期間一直是股東。沒有特拉華州衡平法院的批准,這一行動不會被駁回或妥協。 |
| 126 |
| 《目錄》 |
美國存托股份説明
我們的存托股份乃根據 於2023年12月18日簽署的第二份經修訂及重列存款協議存放,由本公司、摩根大通銀行,N.A.,作為存託人, 和美國存託憑證的持有人和受益所有人,或存託協議。存託人登記並交付 存托股份。每份存托股份代表400股普通股的所有權,我們將根據《存託協議》將這些普通股存入作為存託代理的託管人 。
保存人辦公室位於383 Madison Avenue,Floor 11,New York,NY 10179。
存托股比 受美國存託憑證(ADR)形式規定的修改(這可能會產生 ADR形式的費用)。將來,每一份存托股份還將代表任何證券、現金或其他財產存放在存託機構,但 他們沒有直接分配給閣下。
實益擁有人是指在存托股份中擁有實益所有權權益的任何個人或實體 。受益所有人不必是證明此類存托股份的ADR持有人。如果受益所有人不是ADR持有人,則其必須依賴ADR持有人證明該存托股份,以 主張根據存款協議行使任何權利或獲得任何利益。受益所有人僅能通過證明該受益所有人擁有的存托股份的ADR持有人行使或獲得存託協議項下的任何權利 或任何利益。受益所有人與相應ADR持有人之間的安排可能會影響受益所有人 行使其可能擁有的任何權利的能力。
ADR持有人應被視為具有 必要的權力代表任何及所有存托股份的實益擁有人行事,該等 ADR持有人在存託協議和ADR項下的所有目的上登記在該 ADR持有人名下的ADR證明。根據交存協議 和ADR,交存人的唯一通知義務是向已登記的ADR持有人。就存管協議 和ADR的所有目的而言,向ADR持有人發出的通知應被視為向由ADR持有人的ADR證明的任何及所有存管股份實益所有人發出的通知。
除非特別要求 憑證式美國存託憑證,所有存托股份將以簿記形式在我們的存託機構賬簿上發行,並將 向您郵寄反映您在該存托股份中的所有權權益的定期報表。在我們的説明中,提及美國存託憑證 或美國存託憑證應包括您將收到的反映您存托股份所有權的報表。
您可以直接 或通過您的經紀人或其他金融機構間接持有存托股份。如果您直接持有存托股份,則通過在存託人賬簿上以您的名義登記存托股份 ,您即為ADR持有人。本説明假定您直接持有存托股份 。如果您通過您的經紀人或金融機構代理人持有存托股份,您必須依賴該 經紀人或金融機構的程序來維護本節所述ADR持有人的權利。您應諮詢您的經紀人或 金融機構,瞭解這些程序是什麼。
作為ADR持有人或受益所有人,我們 不會將您視為我們的股東,您將不享有任何股東權利。英格蘭和威爾士的法律管轄股東權利。由於存託人或其代名人將是所有流通 存托股份所代表的普通股的記錄股東,股東權利屬於該記錄持有人。您的權利是ADR持有人或受益所有人的權利。此類 權利源自我們、存託人以及根據存託協議發行的ADR的所有持有人和受益所有人 之間訂立的存託協議的條款,如果是受益所有人,則源自 受益所有人與相應ADR持有人之間的安排。本公司與託管人及其代理人的義務也在託管協議中列明 。由於託管人或其代名人實際上是普通股的登記所有人,您 必須依賴其代表您行使股東的權利。
存款協議、美國存託憑證和 存托股份受紐約州的內部法律管轄,但不影響 法律衝突原則的適用。根據存款協議,作為ADR持有人或存托股份的實益擁有人,您同意,因或基於存託協議、存託 股票、ADR或據此擬進行的交易而針對或涉及我們或存託的任何 法律訴訟、訴訟或程序只能在美國紐約南部 地區法院提起(或在某些情況下,紐約州紐約州紐約縣的州法院),且您無可爭議地放棄 您可能對任何此類訴訟的地點的設置提出的任何異議,並無可爭議地服從此類法院在任何 此類訴訟、訴訟或程序中的專屬管轄權。
以下是我們認為 是存款協議的重要條款的摘要。儘管如此,由於它是一個摘要,所以它可能不包含您可能認為重要的所有信息 。有關更完整的信息,您應閲讀存款協議的完整格式和包含您的存托股份條款的ADR格式 。您可以閲讀存款協議表格的副本,該表格作為本註冊聲明的附件 ,該表格F—1(或其修訂)提交給SEC,本招股説明書是其中的一部分。您還可以 在SEC公共參考室(目前位於華盛頓州東北部100 F Street,NE,Washington, DC 20549)獲取存款協議的副本。您可以致電美國證券交易委員會1—800—732—0330獲取有關公共資料室運作的信息。您還可以 在SEC網站www.example.com上找到註冊聲明和隨附的存款協議。
| 127 |
| 《目錄》 |
存款證券的分派,銷售
我將如何獲得 存托股份相關普通股的股息和其他分配?
我們可能會就我們的證券進行各種類型的分發 。託管人已同意,在實際可行的範圍內,它將在將收到的任何現金兑換成美元(如果它確定這種轉換可以在合理的基礎上進行)之後,向您支付它或託管人從普通股或其他存款證券上收到的現金股息或其他 分派,並在任何情況下都對存款協議中規定的任何必要扣減進行 。託管銀行可利用摩根大通銀行的分支機構、分行或附屬公司,根據《存款協議》指導、管理和/或執行任何公開和/或私下出售證券和/或財產。該分部、分支機構和/或關聯公司可向託管機構收取與此類銷售相關的費用,該費用被視為應向託管股份持有人收取的託管費用。所有證券銷售將由存託機構按照其當時的現行政策處理。 您將按照您的存托股份所代表的標的證券數量按比例獲得這些分配。在所有 《存款協議》或《美國存託憑證》提及證券或財產的“出售”(或類似含義的詞語)的情況下,除非擬出售的證券在證券交易所上市並公開交易,或者待出售的財產有公開市場,否則託管人可能但沒有義務進行任何此類出售。如果證券不是這樣上市和公開交易的,或者我們如此分配的財產沒有公開市場:(I)如果存款協議終止,託管人持有在存款協議終止日期後沒有上市和公開交易的已存放證券,應按照存款協議的終止條款和此類證券和財產的ADR形式行事;以及(Ii)如果託管人或其託管人收到現金、我們的普通股和/或收購我們普通股的權利以外的分派,且該分派包括非由託管人分派的證券或財產,則託管人將被視為以面值出售瞭如此收到的證券和/或財產的總數,並且 沒有義務向美國存託憑證持有人分派該等證券或其視為出售所得的任何收益。此外,在託管人試圖出售普通股、其他證券或財產的情況下,這些證券和/或財產可以 以大宗出售或單筆交易的形式出售。
除下文所述外,託管機構將按照美國存託憑證持有人的權益比例,以下列方式將此類分配交付給他們:
| · | 現金。託管人將以平均或其他可行的基礎,分配現金股利或其他現金分配或任何其他分配或其部分的銷售淨收益(在適用範圍內)所產生的任何可用美元,條件是:(I)適當調整預扣税款,(Ii)此類分配對於某些登記的ADR持有人是允許的或可行的,以及(Iii)扣除託管人和/或其代理人的手續費和開支:(1)將任何外幣兑換成美元,但前提是託管人確定這種兑換可以在合理的基礎上進行;(2)通過託管人確定的方式將外幣或美元轉移到美國,以確定這種轉移可以在合理的基礎上進行;(3)獲得此類轉換或轉移所需的任何政府當局的批准或許可。(4)以任何商業上合理的方式,以公共或私人方式進行任何銷售。如果任何已交存證券因其發行日期或其他原因而不是或不應 有權獲得此類現金股息、分配或銷售淨收益的全部金額,則託管機構應對就此類已交存證券分配給美國存託憑證持有人的金額進行適當調整。如果我們或託管人必須從任何存款證券的任何現金股息、分派或銷售淨收益中扣留税款,則就該等存款證券發行的存托股份的分派金額應相應減少。 |
如果託管銀行認為適用的法律、規則或法規不允許將外幣兑換成美元並將其分發給部分或所有有權獲得美元的美國存託憑證持有人,則託管銀行可酌情將託管銀行收到的部分或全部外幣按其認為允許和可行的方式分發,或保留和持有未投資的外幣,並對有權獲得這些外幣的美國存託憑證持有人的相應賬户不承擔利息責任。如果保管人按照《保證金協議》的規定保留和持有任何現金、外幣、證券或其他財產 ,與持有該等現金、外幣、證券或其他財產有關或由此產生的任何及所有費用、收費和開支應從該等現金、外幣、證券或其他財產或其出售所得的淨收益中支付,從而減少所持有的金額。 如果在保管人不能兑換外幣期間匯率波動,您可能會損失分配的部分或全部價值。
| · | 股份。在普通股分派的情況下,託管人將額外發行 份美國存託憑證,以證明代表該等普通股的存托股份數量。只會發行全盤存托股份。任何將產生零星存托股份的普通股將被出售,公開或私下出售此類股票的淨收益將 以與現金相同的方式分配給有權獲得該股的美國存託憑證持有人。 |
| 128 |
| 《目錄》 |
| · | 獲得額外普通股的權利。在分配權利以認購額外普通股或其他權利的情況下,如果我們及時提供令託管人滿意的證據,表明其可以合法地分配此類權利,託管人將酌情分配代表此類權利的權證或其他票據。 但是,如果我們不及時提供此類證據,託管人可能: |
(I)在可行的情況下,美國政府將出售此類權利,並以與現金相同的方式將出售此類權利的公共或私人銷售的淨收益分配給有權享有該權利的美國存託憑證持有人;或
(Ii)如果因權利不可轉讓、市場有限、期限短或其他原因而出售該等權利並不可行,則不採取任何行動並允許該等權利失效,在這種情況下,美國存託憑證持有人將不會獲得任何東西,權利可能會失效。
我們沒有義務根據證券法提交註冊聲明 以向ADR持有人提供任何權利。
| · | 其他分發。對於非上述證券或財產的分配,保管人可以(1)以其認為公平和可行的任何方式分配此類證券或財產,或(2)在保管人認為此類證券或財產的分配不公平和可行的情況下,出售此類證券或財產,並以其分配現金的方式分配公共或私人銷售的任何淨收益。 |
| · | 可選分配。在股東選擇以現金或額外普通股支付股息的情況下,我們將在建議分派前至少30天通知託管人,説明我們是否希望向ADR持有人提供此類選擇性分派。託管機構應在下列情況下向ADR持有人提供此類選擇性分配:(I)我們應及時要求ADR持有人可獲得選擇性分配,(Ii)託管機構應已確定此類分配是合理可行的,以及(Iii)託管機構應已收到符合《託管協議》條款的令人滿意的文件,包括託管機構以其合理的酌情決定權可能要求的任何法律意見。如不符合上述條件,託管銀行應在法律許可的範圍內,根據與當地市場就未作出選擇的普通股作出的相同釐定,向美國存託憑證持有人分配(X)現金或(Y)代表該等額外普通股的額外存托股份。如果滿足上述條件, 託管機構應建立程序,使美國存託憑證持有人能夠選擇以現金或額外的存托股份形式收取擬議股息。不能保證存托股份的普通美國存託憑證持有人或實益擁有人,或任何美國存託憑證持有人或存托股份實益擁有人將有機會按與普通股持有人相同的條款和條件獲得選擇性分派。 |
如果託管人自行決定上述任何分配對於任何或所有ADR持有人而言都不可行,則託管人可選擇其認為對該ADR持有人可行的任何分配方法,包括分配部分或全部現金、外幣、證券或其他財產(或證明有權接受部分或全部此類現金、外幣、證券或其他財產的適當文件),和/或可保留部分或全部此類物品,而無需支付利息或將其作為已存入證券進行投資。在這種情況下,存托股份也將代表保留的物品。如果託管人不合理地認為適用法律、規則或法規將允許其將外幣兑換成美元並將這些美元分配給部分或全部ADR持有人,則託管人可以酌情將託管人收到的外幣分配給有權獲得該外幣的ADR持有人各自的賬户,或持有未投資的外幣,並且不承擔利息責任。在保管人持有這種外幣的範圍內,與持有這種外幣有關的或由此產生的任何和所有成本和費用應從這種外幣中支付,從而減少所持有的金額。
任何美元都將通過電匯支付和/或以美國銀行開出的整美元和美分的支票分發。零碎的美分將被扣留,不承擔任何責任,並由保管人根據其當時的現行做法進行處理。
如果 保管人未能確定任何分發或行動合法或合理可行,則保管人不負責任。
不能保證託管人 能夠以指定的匯率兑換任何貨幣或以指定的價格出售任何財產、權利、股票或其他證券,也不能保證任何此類交易能夠在指定的時間段內完成。所有證券的買賣將由託管機構按照其當時的現行政策處理,這些政策目前在www.adr.com的“披露”頁面(或後續頁面)(由託管機構不時更新,“ADR.com”)上有規定。
| 129 |
| 《目錄》 |
存取款及註銷
存託機構如何發行存托股份?
如果您或您的經紀人向託管人存放普通股或收取普通股的權利的證據,並向託管人支付與此類發行相關的費用和費用,則託管人將發行存托股票。對於將根據本招股説明書發行的存托股份,我們將與此處指定的承銷商安排存放該等股份。
關於普通 股的存管,存管人或其保管人可要求以其滿意的形式提供以下內容:(i)書面命令,指示存管人 向該命令中指定的一名或多名人士發行代表該存管 股的存管股份;(ii)就該等存置股份作出適當背書或正式籤立的轉讓文書;(iii)轉讓 予存管人、其保管人或代名人就該等存管股份或就該等存管股份作出任何分派或就此作出的彌償的文書; 及(iv)授權保管人對該等已存股份進行表決的代理。存放的普通股和任何此類附加項目 稱為"存放證券"。在託管人收到根據 任何該等存款或根據影響已存證券的分配或變更的已存證券後,在切實可行的範圍內,託管人應儘快將該等已存證券 提交至託管人、其託管人或其中之一的代名人的名下,以進行轉讓登記,在每種情況下均為ADR 持有人的利益,費用及開支由作出該項存款的人(或為該人的利益而作出該項存款的人)承擔,並須取得令其信納的有關該項註冊的證據。
託管人將在法律不禁止的範圍內,為賬户 並按照託管人的指示持有所有已存證券 (包括由我們或代表我們就本招股説明書所涉及的發行所存證券),在每種情況下均為ADR持有人的利益。ADR持有人和 實益擁有人因此在普通股中沒有直接的所有權權益,僅擁有存款協議 中所載的權利。託管人還將持有任何額外的證券、財產和現金,在存放的證券上收到或替代的證券、財產和現金。
存置證券不擬 也不應構成存管人、託管人或其指定人的專有資產。已存證券的實益所有權 擬歸屬並應在存款協議期限內始終歸屬於 代表該等已存證券的存托股份的實益所有人。儘管本協議另有規定,但在存管協議中, 以ADR和/或任何未發行存管股份的形式,存管人、託管人及其各自的代名人應 且在存管協議期限內的任何時候都僅為存管股份代表的存管證券的記錄持有人,以利於ADR持有人。託管人代表其自身以及託管人及其 各自的代名人,放棄代表ADR持有人持有的已存證券的任何實益所有權權益。
每次交存普通股,收到 相關交付文件並遵守交存協議的其他條款,包括支付保管人的費用 和費用以及任何税款或其他費用或費用,託管人將以其名義或在 有權持有的人的指示,證明該人有權持有的存托股份數目。除非有相反的特別要求,否則所有已發行的存託 股票將成為存託人直接登記系統的一部分,且已登記的 持有人將收到存託人的定期報表,其中將顯示以該ADR持有人 名義登記的存托股票數量。ADR持有人可以要求不通過存託人的直接登記系統持有存托股份,並要求發行 證書ADR。
ADR持有人如何註銷存托股份並獲得 存託證券?
當您在 託管辦公室上交您的ADR證書時,或者當您在直接登記存托股份的情況下提供適當的説明和文件時, 在遵守或管轄我們普通股的規定(包括但不限於我們的管轄文件和所有適用的法律、規則和法規)的情況下,託管機構將在支付某些適用的費用、收費和税款後,將相關的 普通股交付給您或您的書面訂單。將在託管人的辦公室(或託管人以非物質化的程度由託管人交付)以證書形式交付已存放的證券。根據您的風險、費用和要求,託管機構可以在您要求的其他地點交付已存放的證券 (包括任何相關憑證)。
託管人只能在下列情況下限制已交存證券的提取:
| · | 因股東大會表決或支付股息而關閉本公司或託管人的轉讓賬簿或存放普通股而造成的暫時性延誤; |
| · | 支付費用、税款和類似費用;或 |
| · | 遵守任何與美國或外國法律或政府法規有關的美國存託憑證或已存入證券的提取。 |
這項提款權利不受存款協議任何其他條款的限制。
| 130 |
| 《目錄》 |
記錄日期
如果可行,託管機構可在與我們協商後確定記錄日期(在適用的範圍內,應儘可能接近我們確定的任何相應記錄日期),以確定將有權(或有義務,視情況而定)的已登記ADR持有人:
| · | 接受關於或與存款證券有關的任何分發, |
| · | 就投票權的行使作出指示, |
| · | 支付由管理ADR項目的託管機構評估或欠其的任何費用以及ADR中規定的任何費用,或 |
| · | 接受任何通知,或就其他事項採取行動或承擔義務, |
所有條款均受制於《存款協議》的規定。
投票權
我該怎麼投票?
如果您是美國存託憑證持有人,而託管機構 要求您向其提供投票指示,您可以指示託管機構如何行使作為您的託管股份基礎的普通股的投票權。在收到吾等通知普通股持有人有權參加的任何會議,或吾等徵求普通股持有人同意或委託書的通知後,託管人應根據《存託協議》的規定儘快確定存托股份登記日期,但如果託管人及時收到吾等的書面請求,且至少在投票或會議日期前三十(30)天,託管人應支付吾等的費用。向已登記的美國存託憑證持有人分發一份“投票通知”,説明(I)此類表決和會議的最終信息和任何徵集材料,(Ii)聲明在託管機構確定的記錄日期內的每名美國存託憑證持有人,在英格蘭和威爾士法律的任何適用條款的規限下,有權指示託管機構行使與存托股份所代表的存託證券有關的投票權, 由該存托股份持有人的美國存託憑證證明,以及(Iii)發出此類指示的方式。包括向我們指定的人提供酌情委託書的指示。 每個ADR持有人應單獨負責向以該ADR持有人的名義登記的存托股份的實益擁有人轉發投票通知。不能保證一般的美國存託憑證持有人和實益所有人或任何特定的持有人或實益所有人會在足夠的時間內收到上述通知,使該等美國存託憑證持有人或實益所有人能夠及時將任何表決指示退還給託管機構。
在負責代理和表決美國存託憑證持有人指示(包括但不限於代表存託信託公司或DTC代名人行事的任何一個或多個實體的指示)的美國存託憑證部門 實際收到後,託管機構應在託管機構為此目的而設立的 時間或之前,儘可能按照該等美國存託憑證持有人的美國存託憑證所證明的託管 股份所代表的存託證券進行表決或促使其表決,以符合實際情況,並根據託管證券的條款所允許的此類指示進行表決。
ADR holders are strongly encouraged to forward their voting instructions to the depositary as soon as possible. For instructions to be valid, the ADR department of the depositary that is responsible for proxies and voting must receive them in the manner and on or before the time specified, notwithstanding that such instructions may have been physically received by the depositary prior to such time. The depositary will not itself exercise any voting discretion in respect of deposited securities. The depositary and its agents will not be responsible for any failure to carry out any instructions to vote any of the deposited securities, for the manner in which any voting instructions are given, including instructions to give a discretionary proxy to a person designated by us, for the manner in which any vote is cast, including, without limitation, any vote cast by a person to whom the depositary is instructed to grant a discretionary proxy pursuant to the terms of the Deposit Agreement, or for the effect of any such vote. Notwithstanding anything contained in the Deposit Agreement or any ADR, the depositary may, to the extent not prohibited by any law, rule or regulation, or by the rules, regulations or requirements of any stock exchange on which the Depositary Shares are listed, in lieu of distribution of the materials provided to the depositary in connection with any meeting of or solicitation of consents or proxies from holders of deposited securities, distribute to the registered holders of ADRs a notice that provides such ADR holders with or otherwise publicizes to such ADR holders instructions on how to retrieve such materials or receive such materials upon request (即,通過參考包含用於檢索的材料的網站或用於請求材料副本的聯繫人)。
我們無法保證您將及時收到 投票材料以指示託管人投票,並且您或通過 經紀人、交易商或其他第三方持有其託管股份的人可能沒有機會行使投票權。
| 131 |
| 《目錄》 |
報告和其他通信
美國存託憑證持有人是否可以查看我們的報告?
存管協議、 或管轄存管證券的條款,以及託管人或其代名人作為存管證券的 持有人收到並提供給存管證券持有人的任何書面通信,可供ADR 持有人在美國的存管辦事處查閲,在美國證券交易委員會的互聯網網站上或根據向託管人提出的請求(託管人可自行決定拒絕該請求)。
此外,如果我們向普通股持有人提供任何書面通信 ,且我們向存管人提供其副本(或英文翻譯或摘要), 存管人將向登記ADR持有人分發該等書面通信。
費用及開支
我將負責支付哪些費用和開支?
存託人可向 發行存托股份的每個人收取費用,包括但不限於針對普通股存款的發行、關於 股份分配、權利和其他分配的發行、根據我們宣佈的股票股息或股票分割的發行或根據合併的發行,證券交換或影響存托股份或存託證券的任何其他交易或事件, 及每一位為撤回已存證券而交出存托股份或其存托股份因任何其他原因被註銷或減少 的人士,每100股已發行、交付、減持、註銷 或交還的存托股份(或其任何部分),或已作出或要約進行股份分派或選擇性分派(視情況而定),收取最高5美元的費用。存管人可 出售(通過公開或私下出售)就股份分配、權利和/或其他分配收到的足夠證券和財產 ,以支付該等費用。
ADR持有人、受益所有人、任何一方存入或撤回普通股 或任何一方交出存托股份和/或發行存托股份的人也應產生下列額外 費用、收費和開支(包括但不限於,根據我們宣佈的股票股息或股票分割發行 ,或有關存托股份或存託證券的股票交換 或分派存托股份),以適用者為準:
| · | 費用最高為美元0.05根據存款協議,為進行任何現金分派或提供的任何選擇性現金/股票股息而持有的每份存托股份; |
| · | 每個歷年的總費用為每股存托股份0.05美元(或其部分),用於託管人在管理ADR時執行的服務 (該費用可在每個日曆年度內定期收取,並應 在每個日曆年度內由保管人設定的記錄日期起對ADR持有人進行評估,並應 以下一條規定的方式支付); |
| · | 償付託管人和/或 其任何代理人發生的費用、收費和開支的金額(包括但不限於託管人,以及代表ADR持有人發生的與遵守外匯管制條例或任何法律有關的費用和開支,與外國投資有關的規則或法規) 與普通股或其他存置證券的還本付息有關,證券的銷售(包括但不限於 已存證券)、已存證券的交付或與託管人或其託管人遵守適用法律有關的其他事項,規則或規例(這些費用和收費應根據ADR持有人的比例評估,自 由託管人設定的記錄日期或日期,並應由託管人全權酌情通過向該等ADR持有人開具賬單或 從一項或多項現金股息或其他現金分配中扣除該等費用支付); |
| · | 就直接或間接分銷證券而持有的每份存托股份收取最多0.05美元的費用( 不包括存托股份或購買額外存托股份的權利)或公開或私下出售 此類證券的現金收益淨額,無論任何此類分配和/或出售是否由、為或收取,或(在每種情況下)代表託管人、我們和/或任何第三方的 (該費用可在託管人設定的記錄日期向ADR持有人評估); |
| · | 股票轉讓或其他税費及其他政府收費; |
| · | 在www.example.com 的"披露"頁面(或後續頁面)上披露的每個取消請求(包括通過SWIFT、傳真 傳輸或任何其他通信方式提出的任何取消請求)的交易費(由託管人不時更新,"www.example.com")以及任何適用的交付費用(由此類 人員或ADR持有人支付); |
| · | 在任何適用的 登記冊上登記與存放證券的存放或提取有關的存放證券的轉讓或登記費; |
| · | 託管人用於指導、管理 和/或執行任何公開和/或私人出售證券的任何分支機構、分支機構或關聯機構的費用。 |
| 132 |
| 《目錄》 |
為便於管理各種 存託憑證交易,包括支付股息或其他現金分配以及其他公司行為,存託人 可聘請摩根大通銀行(N.A.)銀行部門內的外匯服務枱,或銀行和/或其關聯機構,以便 進行即期外匯交易,將外幣兑換為美元。對於某些貨幣,外匯 交易是與銀行或附屬機構(視情況而定)以委託人身份進行的。對於其他貨幣, 外匯交易直接發送給非關聯本地託管人(或其他第三方本地流動性 提供商)並由其管理,並且本行及其任何關聯機構都不是此類外匯交易的一方。
適用於外匯 交易的外匯匯率將是(a)公佈的基準匯率,或(b)由第三方本地流動性提供者確定的匯率, 在每種情況下加上或減去利差(如適用)。託管人將在ADR.com的“披露”頁面(或後續頁面)上披露適用於此類貨幣的外匯匯率和利差(如有) 。此類適用的外匯匯率和利差 可(也不是保存人,銀行或其任何關聯機構均無任何義務確保該利率不會 不同於與其他客户進行可比交易時的利率和利差或外匯匯率範圍,且 本行或其任何附屬機構在外匯交易當日以相關貨幣對進行外匯交易時的點差 。此外,外匯交易的執行時間根據當地 市場動態而異,其中可能包括監管要求、外匯市場的交易時間和流動性或其他因素。 此外,本行及其關聯公司可以以其認為適當的方式管理其市場頭寸的相關風險 ,而不考慮此類活動對託管人、我們、ADR持有人或受益所有人的影響。 所應用的利差不 反映本行及其關聯公司因風險管理或其他對衝 相關活動而可能賺取或發生的任何收益或損失。
儘管有上述規定, 在我們向存管人提供美元的情況下,本行或其任何關聯機構均不會執行 此處所述的外匯交易。在這種情況下,保管人將分發從我們收到的美元。
有關適用的 外匯匯率、適用的利差和外匯交易執行的詳細信息將由託管人在 ADR.com上提供。每位持有人和受益所有人通過持有或擁有ADR或存托股份或其中的權益,我們確認 並同意,適用於www.example.com上不時披露的外匯交易的條款將適用於根據存託協議執行的任何外匯 交易。
我們將根據我們 與託管人之間不時達成的協議,支付託管人和託管人的任何代理人(託管人除外)的所有其他費用、收費和 開支。
保管人收取費用和 收取費用、收費和開支的權利在保管協議終止後仍然有效,並應擴展到保管人辭職或免職生效前發生的費用、收費和開支。
上述費用和收費 可不時通過我方和保管人的協議進行修改。
The depositary anticipates reimbursing us for certain expenses incurred by us that are related to the establishment and maintenance of the ADR program upon such terms and conditions as we and the depositary may agree from time to time. The depositary may make available to us a set amount or a portion of the depositary fees charged in respect of the ADR program or otherwise upon such terms and conditions as we and the depositary may agree from time to time. The depositary may also agree to reduce or waive certain fees that would normally be charged on Depositary Shares issued to or at the direction of, or otherwise held by, us and/or certain holders and beneficial owners and holders and beneficial owners of Ordinary Shares of ours. The depositary collects its fees for issuance and cancellation of Depositary Shares directly from investors depositing Ordinary Shares or surrendering Depositary Shares for the purpose of withdrawal or from intermediaries acting for them. The depositary collects fees for making distributions to investors by deducting those fees from the amounts distributed or by selling a portion of distributable property to pay the fees. The depositary may collect its annual fee for depositary services by deduction from cash distributions, or by directly billing investors, or by charging the book-entry system accounts of participants acting for them. The depositary will generally set off the amounts owing from distributions made to holders of Depositary Shares. If, however, no distribution exists and payment owing is not timely received by the depositary, the depositary may refuse to provide any further services to ADR holders that have not paid those fees and expenses owing until such fees and expenses have been paid. At the discretion of the depositary, all fees and charges owing under the Deposit Agreement are due in advance and/or when declared owing by the depositary.
| 133 |
| 《目錄》 |
繳税
ADR holders and/or beneficial owners must pay any tax or other governmental charge payable by the custodian or the depositary on any Depositary Share or ADR, deposited security or distribution. If any taxes or other governmental charges (including any penalties and/or interest) shall become payable by or on behalf of the custodian or the depositary with respect to any ADR, any deposited securities represented by the Depositary Shares evidenced thereby or any distribution thereon such tax or other governmental charge shall be paid by the ADR holder thereof to the depositary and by holding or owning, or having held or owned, an ADR or any Depositary Shares evidenced thereby, the ADR holder and all beneficial owners thereof, and all prior ADR holders and beneficial owners thereof, jointly and severally, agree to indemnify, defend and save harmless each of the depositary and its agents in respect of such tax or other governmental charge. Notwithstanding the depositary’s right to seek payment from current or former ADR holders and beneficial owners, each ADR holder and beneficial owner, and each prior ADR holder and beneficial owner, by holding or owning, or having held or owned, an ADR or an interest in Depositary Shares acknowledges and agrees that the depositary has no obligation to seek payment of amounts owing from any current or prior beneficial owner. If an ADR holder owes any tax or other governmental charge, the depositary may (i) deduct the amount thereof from any cash distributions, or (ii) sell deposited securities (by public or private sale) and deduct the amount owing from the net proceeds of such sale. In either case, the ADR holder remains liable for any shortfall. If any tax or governmental charge is unpaid, the depositary may also refuse to effect any registration, registration of transfer, split-up or combination of ADRs or withdrawal of deposited securities until such payment is made. If any tax or governmental charge is required to be withheld on any cash distribution, the depositary may deduct the amount required to be withheld from any cash distribution or, in the case of a non-cash distribution, sell the distributed property or securities (by public or private sale) in such amounts and in such manner as the depositary deems necessary and practicable to pay such taxes and distribute any remaining net proceeds or the balance of any such property after deduction of such taxes to the ADR holders entitled thereto. Neither we nor the depositary nor any of our or its respective agents, shall be liable to ADR holders or beneficial owners of the Depositary Shares for failure of any of them to comply with applicable tax laws, rules and/or regulations.
作為ADR持有人或受益所有人,您 將同意賠償我們、託管人、其託管人以及我們或其各自的任何管理人員、董事、僱員、代理人 和關聯公司,並使他們免受任何政府機構就税款、税款增加 、罰款或任何退税引起的利息提出的索賠,降低的來源預扣税率或獲得的其他税務優惠, 在任何轉讓或退回存托股份或終止存託協議時,這些義務將繼續存在。
重新分類、資本重組和合並
如果我們採取了某些影響 已存證券的行動,包括(i)已存證券的面值、拆分、合併、註銷或其他重新分類的任何變更,或(ii)未向美國存託憑證持有人進行的普通股或其他財產的任何分配,或(iii)任何資本重組、重組、 合併、合併、清算、接管,破產或出售我們的全部或幾乎全部資產,則託管人可以 選擇,並應在我們合理要求時:
| · | 修改藥品不良反應的格式; |
| · | 分發新的或修訂的美國存託憑證; |
| · | 分配因此類行動而獲得的現金、證券或其他財產; |
| · | 以公開或私下出售的方式出售所收到的任何證券或財產,並以現金形式分發收益; 或 |
| · | 以上都不是。 |
如果存託人不選擇上述任何選項, 其收到的任何現金、證券或其他財產將構成存託證券的一部分,而每份存托股份將 代表該等財產的比例權益。
修訂及終止
如何修改《存款協議》?
吾等可與 存託人同意修改存託協議及存托股份,而無需閣下以任何理由同意。ADR持有人必須提前 至少提前三十(30)天通知任何修訂,以每份存托股份為基準徵收或增加任何費用、費用或開支 (股票轉讓或其他税費以及其他政府收費、轉讓或註冊費、每次取消請求的交易費 (包括通過SWIFT、傳真傳輸或任何其他通信方式提出的任何取消請求)除外,適用的 交付費用或其他此類費用、收費或開支),或以其他方式損害ADR持有人或受益 所有人的任何實質性現有權利。此類通知無需詳細描述由此生效的具體修訂,但必須向ADR持有人和受益所有人確定訪問此類修訂文本的方法。如果ADR持有人或受益所有人在收到通知後繼續持有ADR或其中的權益 ,則該ADR持有人和任何受益所有人被視為同意該修訂,並受如此修訂的 存款協議約束。然而,任何修訂均不會損害您交出存托股份和接收相關 證券的權利,除非為遵守適用法律的強制性規定。
| 134 |
| 《目錄》 |
(i)合理必要的任何修訂 或補充(經我們和存託人同意),以便(a)存托股份根據證券法以表格F—6登記 ,或(b)存托股份或普通股僅以電子簿記形式交易 ,且(ii)在上述兩種情況下均不徵收或增加ADR持有人應承擔的任何費用或收費,應被視為不損害ADR持有人或受益所有人的任何實質性權利。儘管有上述規定,如果任何政府機構或監管機構 採用了新的法律、規則或法規,需要修改或補充存管協議或ADR格式以 確保遵守,則我們和存管人可根據該等修改後的法律、規則或法規隨時修改或補充存管協議和ADR格式(以及所有未完成的 ADR)。在此情況下, 存款協議的此類修訂或補充可在向ADR持有人發出此類修訂或補充通知之前或在遵守規定所需的任何其他時間 內生效。
關於存款協議的任何修訂通知 或ADR形式的任何形式不需要詳細描述由此生效的特定修訂,並且未在任何此類通知中描述特定 修訂不應導致此類通知無效,但前提是,在每種此類情況下,向 ADR持有人發出的通知確定了ADR持有人和受益所有人檢索或接收此類修訂文本的方法(即從美國證券交易委員會、託管人或我們的網站檢索,或應託管人的要求)。
如何終止《存款協議》?
The depositary may at any time, and shall at our written direction, terminate the Deposit Agreement and the ADRs by mailing notice of such termination to the registered holders of ADRs at least thirty (30) days prior to the date fixed in such notice for such termination; provided, however, if the depositary shall have (i) resigned as depositary under the Deposit Agreement, notice of such termination by the depositary shall not be provided to registered ADR holders unless a successor depositary shall not be operating under the Deposit Agreement within sixty (60) days of the date of such resignation, and (ii) been removed as depositary under the Deposit Agreement, notice of such termination by the depositary shall not be provided to registered holders of ADRs unless a successor depositary shall not be operating under the Deposit Agreement on the 60th day after our notice of removal was first provided to the depositary. Notwithstanding anything to the contrary in the Deposit Agreement, the depositary may terminate the Deposit Agreement (a) without notifying us, but subject to giving thirty (30) days' notice to the ADR holders, under the following circumstances: (i) in the event of our bankruptcy, liquidation proceedings or insolvency, (ii) if our Depositary Shares are delisted from a “national securities exchange” (that has registered with the Commission under Section 6 of the Securities Exchange Act of 1934, as amended), (iii) if we effect (or will effect) a redemption of all or substantially all of the deposited securities, or a cash or share distribution representing a return of all or substantially all of the value of the deposited securities, (iv) there are no deposited securities with respect to Depositary Shares remaining, including if the deposited securities are cancelled, or the deposit securities have been deemed to have no value, or (v) there occurs a merger, consolidation, sale of assets or other transaction as a result of which securities or other property are delivered in exchange for or in lieu of deposited securities, and (b) immediately without prior notice to the Company, any ADR holder or beneficial owner or any other person if (i) required by any law, rule or regulation relating to sanctions by any governmental authority or body, (ii) the depositary would be subject to liability under or pursuant to any law, rule or regulation, or (iii) required by any governmental authority or body, in each case under (b) as determined by the depositary in its reasonable discretion.
If our Ordinary Shares are not listed and publicly traded on a stock exchange or in a securities market as of the date so fixed for termination or if, for any reason, the depositary does not sell the deposited securities, then after such date fixed for termination, the depositary shall use its reasonable efforts to ensure that the Depositary Shares cease to be eligible for settlement within DTC and that neither DTC nor any of its nominees shall thereafter be an ADR holder. At such time as the Depositary Shares cease to be DTC eligible and/or neither DTC nor any of its nominees is an ADR holder, to the extent we are not, to the depositary’s knowledge, insolvent or in bankruptcy or liquidation, the depositary shall (A) cancel all outstanding ADRs; (B) request DTC to provide the depositary with information on those holding Depositary Shares through DTC and, upon receipt thereof, revise the ADR register to reflect the information provided by DTC; (C) instruct its custodian to deliver all deposited securities to us, a subsidiary or affiliate of ours (the company representative) or an independent trust company engaged by us (the trustee) to hold those deposited securities in trust for the beneficial owners of the ADRs if we are not permitted to hold any of the deposited securities under applicable law and/or we have directed the depositary to deliver such deposited securities to the company representative or trustee along with a stock transfer form and/or such other instruments of transfer covering such deposited securities as are needed under applicable law, in either case referring to the names set forth on the ADR register and (D) provide us with a copy of the ADR register.
在收到涵蓋該等存置證券和ADR登記冊的任何轉讓文書 後,吾等同意,吾等將根據當地 法律的要求,向該等ADR登記冊上反映的每個人交付適當的文件,以將 先前由其ADR證明的存置證券轉讓給該等人,批准將先前由其ADR代表的已存 證券轉讓給ADR登記冊上列出的人員(如適用),促使公司股東登記冊進行相關更新 ,以反映將先前由其ADR代表的已存證券轉移給 ADR登記冊上列出的人員(如適用)並向保管人提供經核證的 最新股東登記冊副本。
| 135 |
| 《目錄》 |
To the extent the depositary reasonably believes that we are insolvent, or if we are in receivership, have filed for bankruptcy and/or are otherwise in restructuring, administration or liquidation, and in any such case the deposited securities are not listed and publicly traded on a securities exchange after the termination date, or if, for any reason, the depositary believes it is not able to or cannot practicably sell the deposited securities promptly and without undue effort, the deposited securities shall be deemed to have no value (and such holder shall be deemed to have instructed the depositary that the deposited securities have no value). The depositary may (and, by holding an ADR or an interest therein, all holders irrevocably consent and agree that the depositary may) instruct its custodian to deliver all deposited securities to us (acting, as applicable by an administrator, receiver, administrative receiver, liquidator, provisional liquidator, restructuring officer, interim restructuring officer, trustee, controller or other entity overseeing the bankruptcy, insolvency, administration, restructuring or liquidation process) and notify us that the deposited securities are surrendered for no consideration. The Deposit Agreement requires us, subject to applicable law, to promptly accept the surrender of the deposited securities for no consideration and deliver to the depositary a written notice confirming (A) the acceptance of the surrender of the deposited securities for no consideration and (B) the cancellation of such deposited securities. Promptly after notifying us that the deposited securities are surrendered for no consideration and irrespective of whether we haves complied with the immediately preceding sentence, the depositary shall notify ADR holders that their Depositary Shares have been cancelled with no consideration being payable to such ADR holders.
在保管人遵守以上三款中任何一款的 規定後,保管人及其代理人應被解除並停止履行《保管協議》和《美國存託憑證》項下的所有義務 。
如果我們的普通股在證券交易所上市和公開 交易,且託管人認為能夠、允許且可行地出售託管證券 ,則託管人可以努力公開或私下出售(只要它可以合法地這樣做)存放的 證券,該出售可以在大宗銷售/單手交易中實現,在此銷售結算後,在法律允許和切實可行的範圍內,分配或持有賬户(可為獨立或非獨立帳户)該等出售所得淨額 ,減去欠保管人的任何款項(包括但不限於取消費),連同當時根據存款協議持有的任何其他 現金,以信託方式,不承擔利息責任,為享有此權利的持有人按比例受益。在進行此類出售後,託管人應解除與《存款協議》和《美國存託憑證》有關的所有義務, 除外,對該淨收益和其他現金進行核算。
對義務和法律責任的限制
對我們的義務和託管人的義務的限制; 對ADR持有人、受益人和其他人的責任限制
在發行、登記、登記 轉讓、拆分、合併或註銷任何美國存託憑證之前,或在交付相關的任何分發之前,以及 在出示下述證明的情況下,我們或存託人或其保管人可能要求:
| · | 與此相關的支付(i)任何股票轉讓或其他税務或其他政府收費,(ii) 在 任何適用登記冊上登記普通股或其他存置證券的轉讓而有效的任何股票轉讓或登記費,以及(iii)存置協議中所述的任何適用費用和開支; |
| · | 出示令其滿意的證明,證明(i)任何簽字人的身份和任何 簽字的合法性,以及(ii)此類其他信息,包括但不限於有關公民身份、居住地、外匯管制批准、 任何證券的受益或其他所有權或權益的信息,遵守適用法律、法規,(視乎其認為必要或適當的)已存證券的規定或管轄 以及已存協議和美國存託憑證的條款;以及 |
| · | 遵守保管人根據《保管協議》或保管人認為為遵守適用法律、規則和法規所必需、必要或可取的法規。 |
美國存託憑證的發行、接受 普通股存款、登記、轉讓、拆分或合併ADR或撤回普通股,在一般或特定情況下,當美國存託憑證登記冊或任何存託證券登記冊關閉時,或當認為需要採取任何此類行動時,託管人出於任何原因需要或建議的,但撤回 普通股的能力僅在以下情況下受到限制:(i)因關閉託管人或我們的轉讓簿或因股東大會表決而交存普通股而造成的暫時延遲,或支付 股息,(ii)支付費用、税款和類似費用,以及(iii)遵守與美國存託憑證或撤回已存證券有關的任何法律或政府法規。託管人可隨時關閉ADR登記冊(和/或其任何部分) 或在其認為合適的時候不時關閉。
| 136 |
| 《目錄》 |
存款協議明確限制了託管人、託管人的託管人或我們以及我們各自的董事、管理人員、僱員、代理人和關聯公司的 義務和責任,但條件是,存款協議的任何條款均不構成 在適用的範圍內,放棄或限制ADR持有人或受益所有人根據《證券法》或《1934年證券交易法》可能擁有的任何權利。存管協議規定,我們、存管人以及各自的董事、高級職員、 僱員、代理人和關聯公司將:
| · | 承擔或不承擔任何責任(包括但不限於ADR持有人或受益所有人)如果美國、英格蘭、威爾士或任何其他國家或司法管轄區, 或任何政府或監管機構或任何證券交易所或市場或自動報價系統的 現行或未來的法律、規則、法規、法令、命令或法令,或 管轄任何託管證券的條款,本公司章程的任何當前或將來的規定、任何天災、戰爭、恐怖主義、流行病、 大流行病、國有化、徵用、貨幣限制、異常市場狀況、停工、罷工、內亂、革命、叛亂、爆炸、網絡、勒索軟件或惡意軟件攻擊、計算機故障或情況本公司、託管人或本公司 各自董事、管理人員,代理人、代理人或關聯公司的直接和即時控制應防止 或延遲,或應使他們中的任何人因任何此類一方作出或履行存款協議 或ADR規定的任何行為(包括但不限於投票)而受到任何民事或刑事處罰; |
| · | 承擔或不承擔任何責任(包括但不限於ADR持有人或受益所有人)由於 在執行根據存款協議條款規定的任何行為或事項時,如上述原因導致 或ADR項下的任何不履行或延遲,或根據存款協議 或ADR項下行使或未行使酌情權,包括但不限於,未能確定任何分發或行動可能是合法或合理切實可行的; |
| · | 如果其在沒有重大過失或故意不當行為的情況下履行 存款協議和ADR中明確規定的義務,則不承擔或承擔任何責任(包括但不限於對持有人或受益所有人); |
| · | 對於託管人及其代理人,沒有義務出庭、起訴或辯護 有關任何已存證券、託管股份或美國存託憑證的任何訴訟、訴訟或其他程序; |
| · | 對於我們和我們的代理人,沒有義務出庭、起訴或辯護任何訴訟、 訴訟或其他程序,我們或我們的代理人認為, (視情況而定)可能涉及我們的費用或責任,除非我們或我們的代理人滿意的賠償,視情況而定, 所有費用(包括律師費用和支出)和責任應儘可能要求提供; |
| · | 無需承擔任何責任(包括但不限於ADR持有人或受益所有人) 其依賴於任何法律顧問、任何會計師、任何提交普通股供 存的任何人士、任何ADR登記持有人或其認為有能力提供此類建議或信息的任何其他人士的意見或信息而採取的任何行動或不作為,和/或, 對於託管人,從我們;或 |
| · | 可依賴並在根據其相信為真實並已由適當一方或多方簽署、出示或給予的任何書面通知、請求、指示、指示或文件行事時受到保護。 |
託管人不應是受託人 或對ADR持有人或受益所有人負有任何受託責任。
The depositary and its agents may fully respond to any and all demands or requests for information maintained by or on its behalf in connection with the Deposit Agreement, any registered holder or holders of ADRs, any ADRs or otherwise related to the Deposit Agreement or ADRs to the extent such information is requested or required by or pursuant to any lawful authority, including without limitation laws, rules, regulations, administrative or judicial process, banking, securities or other regulators. The depositary shall not be liable for the acts or omissions made by, or the insolvency of, any securities depository, clearing agency or settlement system. Furthermore, the depositary shall not be responsible for, and shall incur no liability in connection with or arising from, the insolvency of any custodian that is not a branch or affiliate of JP Morgan. Notwithstanding anything to the contrary contained in the Deposit Agreement or any ADRs, the depositary shall not be responsible for, and shall incur no liability in connection with or arising from, any act or omission to act on the part of the custodian except to the extent that any registered ADR holder has incurred liability directly as a result of the custodian having (i) committed fraud or willful misconduct in the provision of custodial services to the depositary or (ii) failed to use reasonable care in the provision of custodial services to the depositary as determined in accordance with the standards prevailing in the jurisdiction in which the custodian is located. The depositary and the custodian(s) may use third party delivery services and providers of information regarding matters such as, but not limited to, pricing, proxy voting, corporate actions, class action litigation and other services in connection with the ADRs and the Deposit Agreement, and use local agents to provide services such as, but not limited to, attendance at any meetings of security holders of issuers. Although the depositary and the custodian will use reasonable care (and cause their agents to use reasonable care) in the selection and retention of such third-party providers and local agents, they will not be responsible for any errors or omissions made by them in providing the relevant information or services.
| 137 |
| 《目錄》 |
託管人 沒有義務通知ADR持有人或受益所有人有關英格蘭、威爾士、美國或任何其他國家或司法管轄區或任何政府或監管機構或 任何證券交易所或市場或自動報價系統的法律、規則或法規的要求或其任何變更 。
此外,託管人、託管人或我們,或其或我們各自的任何董事、高級管理人員、僱員、代理人或關聯公司均不 對任何登記的ADR持有人或受益所有人未能獲得信貸或非美國税款退款的利益 承擔責任。託管人沒有義務向ADR持有人 和受益所有人或他們中的任何人提供有關我們税務狀況的任何信息。我們、託管人、託管人或 我們或其各自的任何董事、高級管理人員、僱員、代理人或關聯公司均不對註冊ADR持有人或受益所有人因其擁有或處置ADR或存託 股份而可能產生的任何税務或税務後果承擔任何責任。
Neither the depositary nor its agents will be responsible for any failure to carry out any instructions to vote any of the deposited securities, for the manner in which any voting instructions are given, including instructions to give a discretionary proxy to a person designated by us, for the manner in which any vote is cast, including, without limitation, any vote cast by a person to whom the depositary is instructed to grant a discretionary proxy pursuant to the terms of the Deposit Agreement, or for the effect of any such vote. The depositary shall endeavor to effect any sale of securities or other property and any conversion of currency, securities or other property, in each case as is referred to or contemplated in the Deposit Agreement or the form of ADR, in accordance with the depositary's normal practices and procedures under the circumstances applicable to such sale or conversion, but shall have no liability (in the absence of its own willful default or gross negligence or that of its agents, officers, directors or employees) with respect to the terms of any such sale or conversion, including the price at which such sale or conversion is effected, or if such sale or conversion shall not be practicable, or shall not be believed, deemed or determined to be practicable by the depositary. Specifically, the depositary shall not have any liability for the price received in connection with any public or private sale of securities (including, without limitation, for any sale made at a nominal price), the timing thereof or any delay in action or omission to act nor shall it be responsible for any error or delay in action, omission to act, default or negligence on the part of the party so retained in connection with any such sale or proposed sale. The depositary shall not incur any liability in connection with or arising from any failure, inability or refusal by us or any other party, including any share registrar, transfer agent or other agent appointed by us, the depositary or any other party, to process any transfer, delivery or distribution of cash, shares, other securities or other property, including without limitation upon the termination of the Deposit Agreement, or otherwise to comply with any provisions of the Deposit Agreement that are applicable to it. The depositary may rely upon instructions from us or our counsel in respect of any approval or license required for any currency conversion, transfer or distribution. The depositary shall not incur any liability for the content of any information submitted to it by us or on our behalf for distribution to ADR holders or for any inaccuracy of any translation thereof, for any investment risk associated with acquiring an interest in the deposited securities, for the validity or worth of the deposited securities, for the credit-worthiness of any third party, for allowing any rights to lapse upon the terms of the Deposit Agreement or for the failure or timeliness of any notice from us. The depositary shall not be liable for any acts or omissions made by a successor depositary whether in connection with a previous act or omission of the depositary or in connection with any matter arising wholly after the removal or resignation of the depositary.
我們同意在某些情況下賠償保管人 ,保管人也同意在某些情況下賠償我們。
儘管《存款協議》或《美國存託憑證》有任何其他相反的規定,吾等或其各自的代理人均不對 其他任何一方或任何其他個人或實體(包括但不限於持有人和實益所有人)以任何形式招致的任何間接、特殊、懲罰性或後果性損害或利潤損失承擔責任,無論是否可預見,也不論可提起此類索賠的訴訟類型。除非(I)該等特別損害賠償 是因被要求賠償的一方的嚴重疏忽或故意行為所致,或(Ii)特別損害賠償是由第三方(包括但不限於持有人和實益所有人)針對根據《存款協議》行事的 託管人或其代理人提出的索賠而引起的,但如該等特別損害賠償是由於根據本協議要求賠償的一方的嚴重疏忽或故意不當行為而引起的,則屬例外。
在存託協議中,協議各方(為免生疑問,包括每一位美國存託憑證持有人和實益擁有人)在適用法律允許的最大範圍內,不可撤銷地放棄因普通股或其他存託證券、存托股份或美國存託憑證的任何交易或違反(不論基於合同、侵權行為、普通法或任何其他理論)所產生或與之相關的任何訴訟、訴訟或法律程序而可能擁有的任何由陪審團進行審判的權利。
《存款協議》或《美國存託憑證》的任何規定均不打算在適用範圍內放棄或限制美國存託憑證持有人或任何實益所有人根據《證券法》或《1934年證券交易法》(經修訂)可能享有的任何權利。
託管人及其代理人可以擁有和買賣本公司及其關聯公司的任何類別的證券和存托股份。
| 138 |
| 《目錄》 |
披露存托股份的權益
如果或管理任何已存放證券的條款可能要求披露或對已存放證券、其他普通股和其他證券的實益或其他所有權或權益施加限制,並可能規定阻止轉讓、投票權或其他權利以強制執行此類披露或限制,則作為美國存託憑證持有人或實益所有人,您同意遵守所有此類披露要求和所有權限制,並 遵守我們可能就此提供的任何合理指示。吾等保留權利指示存托股份持有人(及透過任何該等存托股份持有人,由登記於該存托股份持有人名下的存托股份證明的存托股份實益擁有人)交付其存托股份以註銷及提取存託證券,以便吾等可作為股份持有人直接與存托股份持有人及/或存托股份實益擁有人交易,並透過持有存托股份或其權益,美國存托股份持有人及存托股份實益擁有人將同意遵守該等指示。
每位美國存託憑證持有人同意提供本公司根據公司法或公司組織章程 發出的披露通知或披露通知所要求的信息。每名美國存託憑證持有人承認,其理解為不遵守披露通知可能會導致對相關普通股持有人施加 制裁,而不合規人士根據公司法及組織章程細則的規定,目前可能包括撤回該等普通股的投票權及對收取股息及轉讓該等普通股的權利施加限制 。此外,每名美國存托股份持有人同意遵守英國金融市場行為監管局公佈的《披露指引及透明度規則》(不時修訂至 次)中有關通知本公司普通股、存托股份及某些金融工具的權益的條款,該等條款目前規定:除其他外,美國存託憑證持有人必須通知本公司他作為股東持有的投票權的百分比,或通過他直接或間接持有的某些金融工具(或該等持有量的組合),如果該等投票權的百分比達到、超過或低於指定的門檻,則該等投票權的百分比必須通知本公司。
存託之書
託管人或其代理人將保存一份登記、轉讓登記、合併和拆分美國存託憑證的登記冊,其中應包括託管人的直接登記系統。美國存託憑證的登記持有人可以在任何合理時間到託管機構的辦公室查閲該等記錄,但僅限於為了與其他美國存託憑證持有人就本公司的業務或與存款協議有關的事項進行溝通的目的。託管人認為合宜時,可隨時或不時關閉這種登記冊(和/或其任何部分)。
託管人將維護美國存託憑證的交付和接收設施。
委任
在《存託協議》中,根據《存託協議》的條款和條件發行的任何存托股份或美國存託憑證(或其中任何一項的任何權益)一經接受,每一美國存託憑證登記持有人和每一實益所有人在任何情況下都將被視為:
| · | 成為存款協議和適用ADR條款的一方並受其約束, |
| · | 指定保管人為其實際代理人,全權委託、代表保管人行事,並 採取保管協議和適用ADR中設想的任何及所有行動,採取任何和所有必要的程序 以遵守適用的法律,並採取保存人全權酌情認為必要或適當的行動 説明存款協議和適用的ADR和ADR的目的,採取此類行動是決定其必要性和適當性的決定因素 ;以及 |
| · | acknowledge and agree that (i) nothing in the Deposit Agreement or any ADR shall give rise to a partnership or joint venture among the parties thereto, nor establish a fiduciary or similar relationship among such parties, (ii) the depositary, its divisions, branches and affiliates, and their respective agents, may from time to time be in the possession of non-public information about us, ADR holders, beneficial owners and/or their respective affiliates, (iii) the depositary and its divisions, branches and affiliates may at any time have multiple banking relationships with us, ADR holders, beneficial owners and/or the affiliates of any of them, (iv) the depositary and its divisions, branches and affiliates may, from time to time, be engaged in transactions in which parties adverse to us, ADR holders, or beneficial owners may have interests, (v) nothing contained in the Deposit Agreement or any ADR(s) shall (A) preclude the depositary or any of its divisions, branches or affiliates from engaging in any such transactions or establishing or maintaining any such relationships, or (B) obligate the depositary or any of its divisions, branches or affiliates to disclose any such transactions or relationships or to account for any profit made or payment received in any such transactions or relationships, (vi) the depositary shall not be deemed to have knowledge of any information held by any branch, division or affiliate of the depositary and (vii) notice to an ADR holder shall be deemed, for all purposes of the Deposit Agreement and the ADRs, to constitute notice to any and all beneficial owners of the Depositary Shares evidenced by such ADR holder's ADRs. For all purposes under the Deposit Agreement and the ADRs, the ADR holders thereof shall be deemed to have all requisite authority to act on behalf of any and all beneficial owners of the Depositary Shares evidenced by such ADRs. |
| 139 |
| 《目錄》 |
對司法管轄權的同意
在《存款協議》中,我們已向紐約州和聯邦法院提交 的非專屬管轄權,並代表我們指定了一名代理人進行程序送達 。託管人還可以在英格蘭和/或威爾士、美國的任何管轄法院和/或任何 其他管轄法院對我們提起任何基於存款協議、存托股份、美國美國存託憑證或其中擬進行的交易或 由此產生的任何訴訟。
Under the Deposit Agreement, by holding or owning an ADR or Depositary Share or an interest therein, holders and beneficial owners each irrevocably agree that (i) any legal suit, action or proceeding against or involving holders or beneficial owners brought by us or the depositary, arising out of or based upon the Deposit Agreement, the Depositary Shares, the ADRs or the transactions contemplated therein or thereby, may be instituted in a state or federal court in New York, New York, and by holding or owning an ADR or Depositary Share or an interest therein each irrevocably waives any objection that it may now or hereafter have to the laying of venue of any such proceeding, and irrevocably submits to the non-exclusive jurisdiction of such courts in any such suit, action or proceeding and (ii) any legal suit, action or proceeding against or involving us and/or the depositary brought by holders or beneficial owners, arising out of or based upon the Deposit Agreement, the Depositary Shares, the ADRs or the transactions contemplated therein or thereby, including, without limitation, claims under the Securities Act may be instituted only in the United States District Court for the Southern District of New York (or in the state courts of New York County in New York if either (a) the United States District Court for the Southern District of New York lacks subject matter jurisdiction over a particular dispute or (b) the designation of the United States District Court for the Southern District of New York as the exclusive forum for any particular dispute is, or becomes, invalid, illegal or unenforceable). In the Deposit Agreement each holder and beneficial owner irrevocably waives any objection which it may at any time have to the laying of venue of any such proceeding, and irrevocably submits to the jurisdiction of such courts in any such suit, action or proceeding.
陪審團的審判豁免
在《存款協議》中,雙方 (為免生疑問,包括存托股份或美國存託憑證的每位持有人和實益擁有人和/或權益持有人) 在適用法律允許的最大範圍內,在直接或間接引起的針對存託人和/或我們的任何訴訟、訴訟或訴訟中,基於或以任何方式與普通股 或其他存置證券、存置股份或美國存託憑證、存置協議或其中預期的任何交易有關,或 違約(無論基於合同、侵權行為、普通法或任何其他理論),包括根據美國聯邦證券法 提出的任何索賠。
如果我們或保管人反對基於此類放棄的 陪審團審判要求,法院將根據適用的州和聯邦法律,確定該放棄是否在 本案的事實和情況下可執行,包括當事人是否故意、明智和自願放棄 陪審團審判的權利。存款協議中對陪審團審判權利的放棄不應被視為我們或託管人的任何持有人 或受益所有人對美國聯邦證券法以及據此頒佈的規則和法規的放棄。
| 140 |
| 《目錄》 |
課税
以下 摘要描述了普通股和存托股的收購、所有權 和處置的重大美國聯邦所得税和英國税務後果,但其並非全面描述了可能與購買普通股或存托股決策相關的所有税務考慮 。本摘要基於 美國税法及其相關法規和英國税法及其相關法規, 截至本報告日期,這些法規可能會發生變化。
英國的某些税務考慮
以下為 與擁有和出售我們普通股或存托股份有關的若干英國税務考慮的一般摘要,但不涉及 與投資我們普通股或存托股份有關的所有可能税務後果。它基於英國税法 ,並於本招股説明書發佈之日普遍公佈的英國税務及海關(HMRC)慣例,兩者 均可能會更改,可能具有追溯效力。英國的納税年度從任何一年的4月6日到次年的4月5日。
除另有規定外,本摘要 僅適用於以下人士:我們普通股或存托股份的絕對實益所有人、出於税務目的在英國居住(在個人的情況下為居籍)、在任何其他司法管轄區居住 且在與我們普通股或存托股份的持有相關的任何其他司法管轄區沒有常設機構或固定基地的人或英國持有人。建議不是英國持有人的人,包括(A)不是英國居民(或如果是居民,則 不是以英國為户籍)納税的人,包括通過普通股或存托股份所屬的英國分支機構、代理或常設機構在英國進行交易的個人和公司,或(B)在英國以外的司法管轄區居住或以其他方式納税的人,就其納税義務尋求專業 顧問的建議。
本摘要僅供一般信息 ,不打算也不應被視為對任何特定投資者的法律或税務建議。它沒有解決 根據特定情況可能與特定投資者或根據英國税法受到特殊待遇的投資者有關的所有税務考慮事項。尤其是這一摘要:
| · | 僅適用於普通股或存托股份的絕對實益擁有人以及就該普通股支付的任何股息,而在英國税收方面,股息被視為該人自己的收入(而不是其他人的收入);以及 |
| · | (A)它只涉及將普通股或存托股份作為資本資產持有的投資者在英國的主要税收後果,(B)它沒有解決可能與某些特殊類別的投資者相關的税收後果,例如股票或證券的交易商、經紀商或交易商,以及任何其他持有普通股或存托股份而不是作為投資的人,(C)它沒有解決金融機構、保險公司、集體投資計劃、養老金計劃、慈善機構或免税組織的持有人的税收後果,(D)假定持有人並非該公司(亦非任何關連公司)的高級人員或僱員,亦沒有(亦不被當作已)憑藉職務或受僱工作而取得普通股或存托股份,及(E)假定持有人並不單獨或連同一名或多名有聯繫或關連的人直接或間接(包括透過持有存托股份)控制或持有(亦不當作控制或持有)該等股份,在已發行股本(或任何類別的股本)、投票權、利潤權或公司資本中擁有10%或以上的權益,且與公司沒有其他聯繫。 |
本摘要進一步假設,就英國直接税而言,存托股份持有人為相關普通股的實益擁有人。
存托股份的潛在投資者在投資前應諮詢他們自己的税務顧問,以確定其在自己的特殊情況下的整體税務後果,特別是根據英國税法和英國税務委員會慣例收購、擁有和處置普通股或存托股份的後果。
股息的課税
預繳税金。 不是英國持有人的普通股或存托股份個人持有人將不會就本公司支付的股息徵收英國所得税 ,除非該持有人通過普通股或存托股份所屬的英國分支機構或代理在英國進行(無論單獨或合夥)貿易、專業或職業。 在此情況下,該持有人可根據其個人情況就從本公司收取的股息徵收英國所得税 。
| 141 |
| 《目錄》 |
個別英國人收到的股息。持有人將繳納 英國所得税。就個別英國人於二零二二╱二零二三税年度或二零二三╱二零二四税年度收取之股息應徵收之英國所得税税率。持有人是(i)額外税率納税人為39.35%,(ii)較高税率 納税人為33.75%,(iii)基本税率納税人為8.75%。一個英國人持有人可享有2022/2023納税年度2,000英鎊和2023/2024納税年度1,000英鎊的免税股息免税額(除個人免税額外),即相關個人在繳納英國所得税前可獲得的股息收入金額。但是, 股息備抵內的股息仍將計入相關個人的基本、較高或額外利率範圍。個人的 股息收入被視為其總收入的最高部分,應繳納英國所得税。 個人所得税免税額所涵蓋的股息不計入股息免税額,且在股息免税額中被忽略。
公司税。 一家英國在英國公司税徵收 範圍內的持有人,可能有權就 普通股的股息支付獲得英國公司税豁免。如果不滿足豁免條件或此類英國。持有人選擇豁免 股息應課税,則將對股息徵收英國公司税。從2023年4月1日起,25%的公司税主要税率將適用於利潤超過25萬英鎊的公司。19%的較低税率將適用於利潤不超過5萬英鎊的公司,19%至25%的邊際税率將適用於利潤在5萬英鎊至25萬英鎊之間的公司。如果潛在投資者對自己的立場有任何疑問,他們應該諮詢自己的專業顧問。
非英國普通股或 存托股的法人持有人。持有人從公司收到的股息無需繳納英國公司税, 除非持有人通過普通股或存托股歸屬的常設機構在英國進行交易 。在這些情況下,根據其個人情況,如果上文討論的 英國公司税豁免不適用,則該持有人可以就從 公司收到的股息徵收英國公司税。
英國持有者. A出售或視為出售普通股或存托股份。持有人可根據其個人情況 ,產生應課税收益或允許損失,以供英國資本利得税之用。決定出售普通股或存托股份的資本利得税狀況的主要 因素是 持有人在進行出售的納税年度實現任何其他資本利得的程度,持有人在該納税年度或任何較早納税年度發生資本損失的程度,以及英國資本利得税年度免税額的水平("年度免税額")由英國政府為該納税年度設定。2022/2023納税年度的年度免税額為12,300英鎊,2023/2024納税年度為6,000英鎊。如果,在所有允許的扣除之後,一個英國人。持有人 相關納税年度的總應課税收入超過基本税率所得税限額,出售普通股或存托股份時應計的應課税資本收益按20%的税率徵税。在其他情況下,因出售我們的普通股或存托股份而產生的應課税資本收益 ,可能會按10%或20%的税率或兩者的合併税率徵税。
一個英國人 不再是英國居民的持有人(或為避免雙重徵税而未被視為英國境外領土居民的人士)居住少於五個日曆年,且在該臨時非英國居住期間處置普通股或存托股的人士,可能須就應徵收的 繳納英國資本利得税在返回聯合王國時(或為避免雙重徵税而不再被視為聯合王國境外居民時),因上述處置而產生的收益(受現有豁免或減免的限制)。
英國公司出售(或視為出售)普通股或存托股份。持有人可能會為該持有人產生應課税收益或允許的 損失,就英國公司税而言。
在持有普通股或存托股期間,有關貨幣波動的任何收益或損失 也在 出售時計入。
非英國持有人. 非英國人的個人持有人。持有人無需就出售普通股或存托股而實現的資本收益繳納英國資本收益税,除非持有人在英國從事(無論單獨或合夥)貿易、專業 或職業。透過普通股或存托股份應佔之英國分行或代理。 在這些情況下,根據其個人情況,該持有人可能需要就出售其普通股或存托股產生的應課税收益向英國徵收資本利得税 。
非英國普通股或存托股的法人持有人 。持有人無需就出售普通股或存托股份實現的應課税收益繳納英國公司税,除非持有人通過普通股或存托股份歸屬的永久性 機構在英國進行交易。在這些情況下,該持有人出售(或視為出售)普通股或存托股 可能會產生英國公司税的可徵收收益或允許損失。
| 142 |
| 《目錄》 |
遺產税
如果 就雙重徵税寬免而言,(對死者遺產和禮物徵税)條約美利堅合眾國法令 1979年(SI 1979/1454)美國和英國之間的個人持有人在其死亡或在其生前進行的轉讓時居住在美國,並且不是英國國民,該持有人實益擁有的任何普通股或存託 股份一般不應繳納英國遺產税,但須支付任何適用的 美國聯邦贈與或遺產税,除非(i)普通股或存托股是 聯合王國常設機構的商業財產或屬於聯合王國固定基地,用於執行獨立個人服務;或(ii)普通股或存托股份包含在和解協議中,除非 和解協議達成時,授予人在美國註冊,而不是英國國民(在這種情況下, 不應適用英國遺產税的費用)。
印花税及印花税儲備税
英國印花税(或印花 税)和英國印花税儲備税(或SDRT),在存託憑證系統或清算服務之外發行和轉讓普通 股票的協議的處理方式,在以下段落中討論一般信息"下面。 關於此類系統的此類交易的印花税和SDRT處理,請參見"存管 收據系統和清關服務“下面。
一般信息
轉讓普通股的協議通常會向SDRT收取轉讓代價金額或價值的0.5%的費用。一般情況下,特別提款權由買方支付。
轉讓普通股將按轉讓對價的0.5%徵收印花税(四捨五入至下一個 GB 5)。買方須向英國税務及期貨事務監察委員會繳付印花税(如有)。根據英國税務及海關總署現行指引,轉讓存托股份的書面文書或轉讓存托股份的書面協議不應 繳交印花税,理由是該存托股份不被視為“股票”或“有價證券”(就英國印花税而言) 。
如果完成轉讓協議的加蓋適當印花的轉讓在協議簽訂之日起六年內出具(或者,如果協議是有條件的,則協議成為無條件的日期),已支付的任何SDRT通常連同利息一起償還 ,任何尚未支付的SDRT費用將被取消,以避免由於印花税已支付而產生的雙重收費。
對於獲準在“認可成長型市場”交易但未在任何“認可證券交易所”或AIM豁免上市的股票,無需徵收特別提款税或印花税。只要普通股獲準在AIM(該市場符合“認可成長型市場”的資格)交易,而不是在符合“認可證券交易所”資格的市場上市,則AIM豁免將適用,普通股轉讓或普通股轉讓協議將豁免AIM豁免下的印花税及/或特別印花税(視情況而定)。AIM取消認購普通股後,AIM豁免不再適用。
存託憑證系統和結算服務
歐洲聯盟法院,載於C-569/07。滙豐控股,維達科斯提名有限公司訴女王陛下税務專員和海關專員和第一級税務法庭在2018年的裁決滙豐控股和紐約梅隆銀行起訴女王陛下税務和海關專員審議了歐洲聯盟理事會第69/335/EEC號指令的規定,該指令後來被歐洲聯盟理事會第2008/7/EEC號指令或歐盟指令所取代。在作出這些決定後,英國税務及期貨事務監察委員會已公開確認,向結算服務機構(如DTC)或存託憑證系統發行或轉讓我們等英國註冊公司的股票,將不會向英國SDRT收取1.5%的費用,如果該發行或轉讓是籌集新資本不可或缺的一部分。
英國政府宣佈 作為2017年英國預算的一部分,英國退歐後,將不對英國註冊公司發行股票(以及轉讓此類股票作為新資本籌集不可或缺的一部分)不執行1.5%的印花税和SDRT費用。然而,英國政府可能會 引入新的英國法律,使我們未來發行或轉讓普通股到清算服務或存託憑證系統(即使此類發行或轉讓是公司籌集新資本的組成部分)可能 可能被徵收1.5%的印花税或SDRT。
| 143 |
| 《目錄》 |
如普通股轉讓(I)轉讓予業務為提供結算服務或包括提供結算服務的人士或其代名人,或(Ii)轉讓予業務為發行存託憑證或包括髮行存託憑證的人士,而該項轉讓並非公司籌集新資本的組成部分,則印花税或特別提款權一般將按給予代價金額或價值的1.5%或在某些情況下股份價值的1.5%徵收印花税或特別印花税。如果轉讓發生在普通股獲準在AIM上交易,從而適用AIM豁免的時間,則將產生該印花税或SDRT費用。然而,在取消AIM的普通股認購後,AIM的豁免不再有效。
如果清算服務機構已根據1986年《金融法》第97A(1)條做出並維持選擇,則向清算服務機構或被指定人轉賬收取1.5%的手續費是個例外 ,該法案已獲英國税務及海關總署批准。如該等選擇由結算服務公司作出,則於普通股轉讓入結算服務及其後在結算服務內轉讓有關股份時,將按轉讓應付代價金額或價值的0.5%按SDRT 計算。據我們瞭解,DTC迄今尚未根據1986年《金融法》第97A(1)條作出選擇。
對於向結算服務或存託憑證系統的轉賬,或與此類服務內的轉賬有關的印花税或特別提款税的任何責任,如確實發生,將由清算服務或存託憑證系統運營商或其指定人(視具體情況而定)嚴格向HMRC負責,但在實踐中將由清算服務或存託憑證系統的參與者支付。
美國的某些税務問題
以下是美國持有者持有和處置存托股份(定義如下)對美國聯邦所得税產生的重大影響的摘要。 本摘要僅供參考,並不代表税務建議。每位投資者應就證券所有權和處置的税收後果諮詢其税務顧問。
本摘要基於 1986年《國內税收法典》(經修訂)的條款,或根據該法典頒佈的美國財政部條例(無論是最終的、臨時的、 還是提議的)、行政裁決及其司法解釋聯合王國政府間公約 2001年大不列顛及北愛爾蘭和美利堅合眾國政府關於避免雙重徵税和防止逃税的《關於所得税和資本收益税的協定》,經修訂(以下簡稱美國—英國)條約),所有這些條款均於本協議之日生效,且所有條款均可更改,可能具有追溯效力。
在本討論中,術語 “美國持有者”是指我們普通股或存托股份的持有者,也就是美國聯邦所得税的持有者。
| · | 是美國公民或居民的個人; |
| · | 在美國或根據美國或其任何州或哥倫比亞特區的法律設立或組織的公司或其他應納税的實體; |
| · | 其收入應繳納美國聯邦所得税的遺產,無論其來源如何; 或 |
| · | 如果(A)美國境內的法院能夠對信託的管理進行主要監督,並且一名或多名美國人有權控制信託的所有實質性決定,或者(B)根據適用的美國財政部法規,此類信託 具有有效的選擇權,將被視為美國人。 |
本摘要僅針對收購併持有存托股份作為守則第1221節所指的資本資產(一般指為投資而持有的財產)的美國持有人的美國聯邦所得税考慮事項。本討論不涉及美國聯邦所得税的所有方面,這些方面可能與持有人的特定情況有關,或者可能適用於根據美國聯邦所得税法受到特殊待遇的持有人(例如,包括銀行、金融機構、承銷商、保險公司、證券或外幣交易商、為其證券選擇按市值計價會計方法的證券交易員、繳納替代最低税額的人、使用美元以外的功能貨幣的人、免税組織(包括私人基金會)、共同基金、S分部、公司、合夥企業或其他為繳納美國聯邦所得税而轉賬的實體、某些外籍人士、為逃避美國聯邦所得税而積累收益的公司 、作為對衝、跨境、推定出售、轉換或其他綜合交易一部分而持有存托股份的人、通過行使期權或其他補償安排獲得存托股份的人、擁有(或被視為擁有)我們已發行有表決權股票10%或以上的人,或非美國持有人)。此外,本討論不涉及州、當地、外國、遺產法、贈與法或其他適用於存托股份持有人的税法的任何方面。
合夥企業(包括為美國聯邦所得税目的而被視為合夥企業的任何實體或安排)中的合夥人的美國聯邦所得税待遇 通常取決於合夥人的地位和合夥企業的活動。此類合夥企業的合夥人應就相關税務後果諮詢其税務顧問。
| 144 |
| 《目錄》 |
與存托股份所有權和處置有關的後果
論存托股份的所有權。就美國聯邦所得税而言,存托股份持有人一般會被視為直接擁有該等存托股份所代表的普通股。
論存托股份的分配。 取決於下面的討論“—被動型外國投資公司規則,“從我們的當前或累計收益和利潤(根據美國聯邦所得税目的而確定的)進行的任何存托股份分配(包括預扣税,如果有)的總額一般將在實際或建設性地收到此類分配的 日期作為股息收入向美國持有人徵税。支付給美國公司持有者的任何此類股息通常不符合獲得的股息扣除資格,否則根據本準則可能允許扣除股息。超過我們當前 和累計收益和利潤的分配通常首先被視為美國 持有人在存托股份中的基礎範圍內的免税資本回報,然後被視為資本收益。然而,由於我們不根據美國聯邦所得税原則計算我們的收益和利潤 ,因此預計存托股份的任何分配都將報告為股息 ,即使該分配否則將被視為免税資本回報或根據上述規則被視為資本收益。
以美元以外的貨幣支付的股息,如果有,一般應作為普通股息收入向美國持有者徵税,其金額等於實際或建設性收到這種分配之日收到的貨幣的美元價值。必須使用該日期的即期匯率來確定該美元的價值,無論該非美國貨幣在該日期是否實際兑換成美元。如果收到的貨幣在實際收到或建設性收到之日之後兑換成美元,美國持有者可能實現匯兑收益或損失。一般而言,任何此類 損益都將是普通的,並將被視為來自美國境內的來源,用於美國的外國税收抵免。
以下面的討論為前提“—3.8% 對淨投資收入徵收的醫療保險税,“某些非法人美國持有者(包括個人)從”合格外國公司“獲得的股息 有資格享受降低的税率,目前最高税率為20%,條件是滿足某些持有期要求和其他條件。出於這些目的,外國公司通常將被視為合格的外國公司,因為該公司支付的股息可隨時在美國成熟的證券市場上交易。美國財政部的指導意見指出,在納斯達克資本市場上市的存托股份將被視為在美國成熟的證券市場上隨時可以交易。然而,不能保證存托股份在未來幾年將被視為在成熟的證券市場上隨時可以交易。外國公司也被視為合格的外國公司,如果它有資格享受美國與美國簽訂的綜合所得税條約的好處,而美國財政部認為該條約就本規則而言是令人滿意的 ,並且包括信息交換條款。美國財政部已確定 美英條約符合這些要求。就本規則而言,如果我們在支付股息的課税年度或上一課税年度是被動外國投資公司,就不會構成合格外國公司。 如下所述:-被動型外國投資公司規則.”
根據某些條件和限制, 對公司支付的股息預扣的非美國税款(如有)可被視為符合根據美國外國税收抵免規則對 美國持有人的美國聯邦所得税負債進行抵免的外國税款。管理美國外國税收抵免的規則 非常複雜,美國持有人應諮詢其税務顧問,瞭解 在其特定情況下是否可獲得美國外國税收抵免。
出售存托股份
美國持有人通常將確認存托股份的任何出售、交換、贖回或其他應納税處置的 收益或損失,金額等於處置所實現的金額與該等證券的持有人的税收基準之間的差額 。根據以下 中的討論"-被動型外國投資公司規則,"美國持有人就應納税 處置存托股份確認的任何收益或損失一般為資本收益或損失,如果持有人在處置時持有該股份的 期限超過一年,則為長期資本收益或損失。資本損失的扣除受到限制。
對於現金制納税人,收到的外幣 單位通常將按銷售結算日的即期匯率換算為美元。在這種情況下, ,交易日和結算日之間的貨幣波動不會導致外匯匯兑收益或損失 。應計制納税人可以選擇適用於現金制納税人的與銷售 在已建立的證券市場上交易的ADR相同的規則,條件是該選擇必須每年一致適用 ,並且未經國税局同意不得更改。對於不進行此類選擇的權責發生制納税人,收到的外幣 單位通常將按銷售交易日的即期匯率換算為美元。此類應計 納税人可以根據交易日和交易結算 之間的貨幣波動確認外匯匯兑損益。一般而言,任何此類收益或損失將是普通的,並將被視為來自美國境內的來源,以 美國外國税收抵免的目的。
| 145 |
| 《目錄》 |
被動型外國投資公司規則
如果外國公司 (1)其納税年度總收入的75%或以上為被動收入,或(2)該公司在納税年度持有的產生被動收入或為產生被動收入而持有的資產的平均百分比至少為50%,則該外國公司為PFIC。為了應用前句中的測試,外國公司被視為擁有其按比例份額的資產,並直接獲得其按比例份額的收入,外國公司直接或間接擁有的任何其他公司, 按股票價值至少25%。
根據對其收入、資產和運營的估計 ,預計我們在本應納税年度不會成為PFIC。然而,由於 必須在應納税年度結束後每年確定一次PFIC地位,並將取決於收入和資產的構成 以及我們和我們附屬公司不時開展的活動的性質, 無法保證我們在任何應納税年度都不會被視為PFIC。
If we were to be classified as a PFIC for any taxable year in which a United States holder held the Depositary Shares, various adverse United States tax consequences could result to such United States holders, including taxation of gain on a sale or other disposition of the shares of the corporation, Depositary Shares at ordinary income rates and imposition of an interest charge on gain or on distributions with respect to the shares, Depositary Shares. Unless a United States holder of PFIC shares elects, in either case if eligible, to be taxed annually on a mark-to-market basis or makes a QEF election and certain other requirements are met, gain realized on the sale or other disposition of PFIC shares would generally not be treated as capital gain. Instead, the United States holder would be treated as if the United States holder had realized such gain ratably over the holder’s holding period for such securities. The amounts allocated to the taxable year of sale or other disposition and to any year before the foreign corporation became a PFIC would be taxed as ordinary income. The amount allocated to each other taxable year would be subject to tax at the highest rate in effect for such year, together with an interest charge in respect of the tax attributable to each such year. Similar rules apply to the extent any distribution in respect of PFIC shares exceeds 125% of the average annual distribution on such PFIC securities received by the shareholder during the preceding three years or holding period, whichever is shorter. With certain exceptions, a foreign corporation is treated as a PFIC with respect to a shareholder (or warrant holder, as applicable) if the corporation was a PFIC with respect to such holder at any time during the holder’s holding period of the foreign corporation’s stock or warrants. Dividends paid to with respect to shares of a PFIC are not eligible for the special tax rates applicable to qualified dividend income of certain non-corporate holders. Instead, such dividend income is taxable at rates applicable to ordinary income.
If we were to be treated as a PFIC, the tax consequences described above could be avoided by a “mark-to-market” election with respect to the Depositary Shares. A United States holder making a “mark-to-market” election (assuming the requirements for such an election are satisfied) generally would (i) be required to include as ordinary income the excess of the fair market value of the Depositary Shares on the last day of the United States holder’s taxable year over the United States holder’s adjusted tax basis in such Depositary Shares and (ii) be allowed a deduction in an amount equal to the lesser of (A) the excess, if any, of the United States holder’s adjusted tax basis in the Depositary Shares over the fair market value of such Depositary Shares on the last day of the United States holder’s taxable year or (B) the excess, if any, of the amount included in income because of the election for prior taxable years over the amount allowed as a deduction because of the election for prior taxable years. In addition, upon a sale or other taxable disposition of Depositary Shares, a United States holder would recognize ordinary income or loss (which loss could not be in excess of the amount included in income because of the election for prior taxable years over the amount allowed as a deduction because of the election for prior taxable years). If we were to be treated as a PFIC, different rules would apply to a United States holder making a QEF election with respect to Depositary Shares. However, we do not intend to prepare or provide the information necessary for United States shareholders to make a QEF election.
建議美國持有人 就PFIC規則諮詢其税務顧問,包括"按市價計價"選舉的可用性。
對“淨投資收入”徵收3.8%的醫療保險税
對全部或部分"淨投資收入"徵收3.8%的税或"醫療保險税",其中可能包括(i)美國持有人(其為修改後的經調整總收入超過某些 門檻的個人)和(ii)某些遺產和信託收到的關於 存托股份的任何實現收益或收到的金額。美國持有人應就因持有或處置存托股份而產生的醫療保險税的適用性諮詢自己的税務顧問。
信息報告和備份扣繳
美國持有人可能須遵守 信息報告要求,並可能須就存托股份的股息和 出售、交換或處置存托股份所得款項進行後備預扣税,目前税率為24%,除非美國持有人提供 準確的納税人識別號並符合某些認證程序或以其他方式確立 後備預扣税豁免。後備預扣税不是一種額外的税款,預扣税的金額可以作為美國 持有人的美國聯邦所得税債務的抵免,並且可以使美國持有人有權獲得退款,前提是必須及時向IRS提供某些 所需的信息。
| 146 |
| 《目錄》 |
出售存托股份、認股權證或預備認股權證
美國持有人通常將確認存托股份的任何出售、交換、贖回或其他應課税處置的 收益或損失,金額等於處置所實現的金額與該等證券的持有人的税收基準之間的差額 。根據以下 中的討論"-被動型外國投資公司規則,"美國持有人就應納税 處置存托股份確認的任何收益或損失一般為資本收益或損失,如果持有人在處置時持有該股份的 期限超過一年,則為長期資本收益或損失。資本損失的扣除受到限制。
對於現金制納税人,收到的外幣 單位通常將按銷售結算日的即期匯率換算為美元。在這種情況下, ,交易日和結算日之間的貨幣波動不會導致外匯匯兑收益或損失 。應計制納税人可以選擇適用於現金制納税人的與銷售 在已建立的證券市場上交易的ADR相同的規則,條件是該選擇必須每年一致適用 ,並且未經國税局同意不得更改。對於不進行此類選擇的權責發生制納税人,收到的外幣 單位通常將按銷售交易日的即期匯率換算為美元。此類應計 納税人可以根據交易日和交易結算 之間的貨幣波動確認外匯匯兑損益。一般而言,任何此類收益或損失將是普通的,並將被視為來自美國境內的來源,以 美國外國税收抵免的目的。
| 147 |
| 《目錄》 |
出售股東
本招股説明書涵蓋下表中確定的出售股東不時可能轉售 以存托股份代表的普通股,包括 以行使2023年12月私募預配認股權證 (在本節中統稱和單獨稱為“認股權證”)時發行的存托股份代表的普通股。出售股東可出售部分、全部 或不出售其以存托股份為代表的普通股。我們不知道出售股東將持有認股權證多長時間, 是否有任何人將行使認股權證,以及在行使該等行使時,該等出售股東將在出售前持有存托股份所代表的普通股多長時間,我們目前沒有與出售股東達成任何股份的協議、安排或諒解 。
下表列出了出售股東 以及各出售 股東持有存托股份所代表的普通股實益所有權的其他信息。第二欄列出了每個出售 股東實益擁有的存托股份所代表的普通股數量,基於其對存托股份的所有權和購買存托股份的認股權證,假設行使 出售股東在該日持有的認股權證,而不考慮轉換或行使的任何限制。第三列 列出了出售股東在本招股説明書中發售的以存托股份為代表的普通股的最大數量。 第四欄和第五欄列出了發行後持有的存托股份所代表的普通股數量,按 存托股份所代表的普通股數量和已發行普通股的百分比列出了發行後持有的存托股份所代表的普通股數量,在這兩種情況下,均假設出售股東根據本招股説明書出售的全部 存托股份所代表的普通股,並且不考慮 轉換或練習的任何限制。
根據與出售股東簽訂的登記 權利協議的條款,本招股説明書一般涵蓋以下各項之總和的轉售:(i)12月私人配售中向出售股東發行的普通股數量 ,以及在12月私人配售中發行的認股權證獲行使時向出售股東發行的普通股數量 ,以及(ii)行使相關認股權證時的最大普通股數量(如未行使認股權證在緊接本登記聲明最初提交給SEC之日之前的交易日已全部行使),每一個截止於緊接適用 確定日期之前的交易日,且所有這些都將按照登記權協議的規定進行調整,而不考慮任何限制 的行使。
根據認股權證的 條款,出售股東不得行使認股權證,但該行使將導致該出售股東連同其關聯公司和歸屬方實益擁有的普通股數量超過該行使後我們當時已發行普通股的4.99%或9.99%(如適用),就該等決定而言,不包括因行使該等認股權證而發行的普通股,但尚未行使。受益所有權限制可以增加或 增加或減少,但在任何情況下不得超過9.99%,在通知我們後,受益所有權限制 的任何增加應在我們收到該通知後61天內生效。下表中的股份數量 未反映此限制。見"配送計劃."出售股東可以出售全部、部分或不出售其 普通股。見"配送計劃.”
| 出售股東名稱(1) | 前擁有的普通股數量 供奉 | 最大數量 出售的普通股 根據本招股章程 * | 普通數量 之後擁有的股份 產品(2) | |||||||||
| Bigger Capital Fund,LP(3)* | 361,483,200 | 135,310,800 | 226,172,400 | |||||||||
| 北京市百光製藥有限公司(4) | 141,771,200 | 141,771,200 | -- | |||||||||
| 騎兵基金I LP(5)* | 1,141,117,600 | 318,918,400 | 822,199,200 | |||||||||
| 騎兵投資基金LP(6)* | 186,664,400 | 85,641,200 | 101,023,200 | |||||||||
| 第二區資本基金LP(7)* | 482,359,600 | 151,016,400 | 331,343,200 | |||||||||
| GS Capital Partners LLC(8)* | 143,852,800 | 50,479,200 | 93,373,600 | |||||||||
| Keystone Capital Partners,LLC(9) | 148,970,000 | 55,438,800 | 93,531,200 | |||||||||
| Melior Pharmaceuticals I,Inc.(10) | 141,771,200 | 141,771,200 | -- | |||||||||
| 美世街全球機遇基金有限責任公司(11)* | 477,079,600 | 153,322,800 | 323,756,800 | |||||||||
| Oasis Capital LLC(12)** | 97,642,000 | 36,247,200 | 61,394,800 | |||||||||
| Pinz Capital特殊機會基金LP(13)** | 35,433,600 | 13,628,000 | 21,805,600 | |||||||||
__________________
* 受9.99%的實益所有權限制。
* * 受4.99%的實益擁有權限制。
| (1) | 所有信息截至2024年3月1日。 |
| (2) | 假設根據本招股説明書構成一部分的註冊 聲明登記的所有普通股均在本次發行中出售,且在本招股説明書日期之後和本次發行完成之前,沒有任何出售股東獲得額外的 普通股。 |
| 148 |
| 《目錄》 |
| (3) | 出售股東持有(i)我們在先前交易(包括12月 公開發售)中發行的認股權證,出售股東有權購買總計226,172,400股普通股(以存託 股份的形式),以及(ii)我們在2023年12月的私人配售中發行的認股權證,該認股權證賦予出售股東購買 總計135,310,800股普通股(以存托股份的形式),我們特此登記。認股權證受 9.99%的實益所有權限制的約束,該限制不允許出售股東行使認股權證的部分 ,從而導致出售股東及其關聯公司在行使後擁有超過 實益所有權限制的若干本公司普通股。表中的金額和百分比不適用於9.99%實益所有權限制, 如果適用。Bigger Capital Fund,LP的主要營業地址為11700 West Charleston Blvd,#170—659,Las Vegas,NV 89135。 |
| (4) | 出售股東持有我們就2023年12月私人配售發行的總計141,771,200股普通股(以存托股份形式) ,我們特此登記。 出售股東的 主要營業地址為7,Sangdo—ro,Dongjak—gu,Seoul 06955,大韓民國。 |
| (5) | 出售股東持有(i)80,442,400股普通股(以存托股份的形式),(ii)我們於12月公開發售中發行的 認股權證,該認股權證賦予出售股東購買合共741,756,800股普通股 (以存托股份的形式),及(iii)我們在2023年12月的私人配售中發行的認股權證,該認股權證賦予出售股東購買總計318,918,400股普通股(以存托股份的形式),我們特此登記 .認股權證受9. 99%的實益所有權限制,這不允許 出售股東行使認股權證的部分,從而導致出售股東及其關聯公司在行使後擁有超過實益所有權限制的若干本公司普通股。表 中的金額和百分比不適用於9.99%實益所有權限制(如適用)。Cavalry Fund I LP的主要營業地址為 82 E.阿倫代爾路,套房5B,馬鞍河,新澤西州07458。 |
| (6) | 出售股東持有(i)8,938,000股普通股(以存托股份的形式),(ii)我們在先前交易中發行的認股權證 ,包括12月的公開發行,該認股權證賦予出售股東購買總計 92,085,200股普通股的權利(以存托股份的形式),及(iii)我們在2023年12月的私人配售中發行的認股權證, 賦予出售股東購買總計85,641,200股普通股(以存托股份的形式), 我們特此登記.認股權證受9.99%的實益所有權限制, 該限制不允許出售股東行使認股權證的部分,從而導致出售股東及其關聯公司在行使後擁有超出實益所有權限制的若干本公司普通股。表中的金額和 百分比不適用於9.99%實益所有權限制(如適用)。騎兵的主要業務地址 investment fund LP 是82 E阿倫代爾路,套房5B,馬鞍河,新澤西州07458。 |
| (7) | 出售股東持有(i)我們在12月公開發售中發行的認股權證, 出售股東有權購買總計241,634,400股普通股(以存托股份的形式),及(ii)我們於二零二三年十二月私人配售中發行的認股權證 ,該認股權證賦予出售股東購買合共151,016,400股普通股(以存托股份的形式),我們在此登記。認股權證受9.99%的實益所有權限制 ,該限制不允許出售股東行使認股權證的部分,從而導致出售股東 及其關聯公司在行使後擁有超出實益所有權限制的若干普通股。表中的金額 和百分比不適用於9.99%實益所有權限制(如適用)。District 2 Capital Fund LP的主要營業地址 為華爾街14號,發送郵編:11743,紐約州亨廷頓。 |
| (8) | 出售股東持有(i)我們在12月公開發售中發行的認股權證, 出售股東有權購買總計80,768,800股普通股(以存托股份形式),及(ii)合共 63,084,000股普通股(以存托股份的形式),其中50,479,200股普通股(以存托股份的形式) 由我們在2023年12月的私人配售股份中發行),我們特此登記. 主要營業地址 GS Capital Partners LLC 地址是1325 Airmotive Way,Suite 202,Reno,NV 89502。 |
| (9) | 出售股東持有 (i)我們在 之前的交易(包括12月公開發行)中發行的認股權證,該認股權證賦予出售股東購買總計93,531,200股普通股的權利(以存托股份的形式),及(ii)我們在2023年12月私人配售中發行的認股權證,該認股權證賦予出售股東購買總計55,438股股份的權利,800股普通股(以存托股份的形式),我們特此登記 .認股權證受9. 99%的實益所有權限制,這不允許 出售股東行使認股權證的部分,從而導致出售股東及其關聯公司在行使後擁有超過實益所有權限制的若干本公司普通股。表 中的金額和百分比不適用於9.99%實益所有權限制(如適用)。Keystone Capital Partners LLC的主要營業地址為139 Fulton Street,Suite 412,New York,NY 10038。 |
| (10) | 出售股東持有我們在2023年12月私人配售中發行的總計141,771,200股普通股(以存托股份的形式) ,我們特此登記。 銷售股東的主要 營業地址為Melior Pharmaceuticals I,Inc.,860 Springdale Drive,Suite 500,Exton,PA 19341。 |
| (11) | 售股股東 (i)8,600,000股普通股(以 存托股份的形式),(ii)我們在先前交易中發行的認股權證,包括12月的公開發售,該認股權證賦予銷售股東購買總計315,156,800股普通股的權利(以存托股份形式),及(iii)我們於二零二三年十二月私人配售中發行的認股權證 ,該認股權證賦予出售股東購買合共153,322,800股普通 (以存托股份的形式),我們在此登記。該等認股權證受9.99%的實益擁有權限制,不允許出售股東行使該部分認股權證,而該部分認股權證會導致出售股東及其聯屬公司在行使權證後所持有的普通股數目超過實益擁有權限制。表中的金額和百分比不適用於9.99%受益所有權的限制, 如果適用。美世全球機會基金有限責任公司的主要業務地址是邁阿密佈裏克爾大道1111Brickell Avenue,Suite2920,FL 33131。 |
| 149 |
| 《目錄》 |
| (12) | 出售股東持有 (I)吾等於 十二月公開發售時發行的認股權證,使出售股東有權購買合共57,996,800股普通股(以存托股份形式),(Ii)吾等於十二月公開發售時發行的3,398,000股普通股(以存托股份形式), (Iii)吾等於2023年12月定向增發中發行的25,871,600股普通股(以存托股份形式), 及(Iii)吾等於2023年12月定向增發中發行的認股權證,這使出售股東有權購買總計10,375,600股普通股(以存托股份的形式),我們在此登記。 認股權證受4.99%的實益所有權限制,這不允許出售股東行使該部分認股權證,從而導致出售股東及其關聯公司在行使後擁有超過實益所有權限制的數量的普通股 。如果適用,表中的金額和百分比不適用於9.99%的受益 所有權限制。綠洲資本有限責任公司的主要營業地址是紐約美洲大道1001號,郵編:10018。 |
| (13) | 出售股份的股東持有(I)我們在12月份的公開發行中發行的認股權證,使出售股東有權 購買總計21,805,600股普通股(以存托股份的形式),以及(Ii)我們在2023年12月的私募中發行的總計13,628,000股普通股(以存托股份的形式),我們在此登記。 這些認股權證的實益所有權限制為4.99%,這不允許出售股東行使將導致出售股東及其關聯公司在行使後擁有的該部分認股權證,我們的一些普通股 超過實益所有權限制。表中的金額和百分比不適用於4.99%的受益 所有權限制(如果適用)。Pinz Capital Special Opportunity Fund LP的主要業務地址是East 150 52發送 街道,29號這是Floor,New York,NY 10022。 |
| 150 |
| 《目錄》 |
配送計劃
每名出售股東及其任何質權人、受讓人和權益繼承人可不時在主要交易市場或任何其他證券交易所、市場或交易設施或以私下交易的方式出售本招股説明書所涵蓋的存托股份所代表的任何或全部普通股。這些銷售可能是固定價格,也可能是協商價格。賣出股東在賣出證券時,可以使用下列任何一種或多種方法:
| · | 普通經紀交易和經紀自營商招攬買受人的交易; |
| · | 大宗交易,經紀交易商將試圖以代理身份出售證券,但可能以委託人的身份持有和轉售部分大宗證券,以促進交易; |
| · | 經紀自營商作為本金買入,並由經紀自營商代為轉售; |
| · | 根據適用交易所的規則進行的交易所分配; |
| · | 私下協商的交易; |
| · | 賣空結算; |
| · | 通過經紀自營商進行的交易,與出售股東約定以每種證券規定的價格出售一定數量的此類證券; |
| · | 通過買入或結算期權或其他套期保值交易,無論是通過期權交易所還是其他方式; |
| · | 任何該等銷售方法的組合;或 |
| · | 依照適用法律允許的任何其他方法。 |
出售股東也可以根據規則144或根據《證券法》登記的任何其他豁免(如有)出售證券 ,而不是根據本招股説明書。
銷售股東聘用的經紀商 可安排其他經紀商參與銷售。經紀商可以從銷售股東那裏獲得佣金或折****r}(或者,如果任何經紀—交易商作為證券購買者的代理,則從購買者處),但除 本招股説明書的補充説明書中規定的情況下,代理交易不超過根據FINRA規則2440的慣例經紀佣金 ;在主交易的情況下,按照FINRA IM—2440的規定進行加價或降價。
在出售證券或其權益時,賣出股東可與經紀自營商或其他金融機構進行套期保值交易,而經紀自營商或其他金融機構可在套期保值過程中賣空證券。出售股票的股東 也可以賣空證券並交割這些證券以平倉,或將證券借給或質押給經紀自營商,經紀自營商可能會出售這些證券。出售股東亦可與經紀自營商或其他金融機構訂立期權或其他交易,或創造一種或多項衍生證券,要求向該經紀自營商或其他金融機構交付本招股説明書所提供的證券,而該經紀自營商或其他金融機構可根據本招股説明書轉售該證券(經補充或修訂以反映該等交易)。
出售股東和參與出售證券的任何經紀—交易商 或代理人可被視為與此類出售有關的《證券法》 含義內的"承銷商"。在這種情況下,此類經紀商或代理商收到的任何佣金以及他們購買的證券的轉售利潤 可被視為《證券法》規定的承銷佣金或折扣。各出售股東 已通知公司,其與任何人士 沒有直接或間接的任何書面或口頭協議或諒解。
本公司須支付本公司因註冊證券而產生的某些費用 和費用。公司已同意賠償出售股東 的某些損失、索賠、損害和責任,包括證券法規定的責任。
| 151 |
| 《目錄》 |
我們同意保持本招股説明書的有效期 ,直至(i)證券可由出售股東轉售之日(不經登記,且 因規則144而受任何數量或銷售方式限制,不要求公司遵守 根據《證券法》第144條或任何其他具有類似效力的規則,或(ii)所有證券均已 根據本招股説明書或證券法第144條或任何其他類似效力的規則出售。轉售證券 將僅通過註冊或持牌經紀商或交易商出售,如果適用的州證券法有要求。此外,在 某些州,此處涵蓋的轉售證券不得出售,除非它們已在適用的 州註冊或有資格出售,或者有註冊或資格要求的豁免並得到遵守。
根據 《交易法》的適用規則和法規,任何從事轉售證券分銷的人不得在 分銷開始前的適用限制期內同時從事有關存托股份的做市活動 。此外,出售股東將遵守交易法的適用條款及其相關規則和條例 ,包括條例M,這些條款可能限制出售股東 或任何其他人購買和出售存托股份的時間。我們將向出售股東提供本招股説明書的副本,並告知他們需要 在出售時或之前向每個購買者交付本招股説明書的副本(包括遵守 證券法第172條)。
| 152 |
| 《目錄》 |
發售的費用
下表列出了我們因出售和分銷在此登記的證券而應支付的費用。除美國證券交易委員會註冊費外,顯示的所有金額均為估計值:
| 美國證券交易委員會註冊費 | $ | 566 |
| 印刷和雕刻 | 5,000 | |
| 會計服務 | 15,000 | |
| 律師費及開支 | 40,000 | |
| 雜類 | 5,000 | |
| 總計 | $ | 65,566 |
法律事務
與本公司提供的證券有效性有關的某些法律事項 將由英國倫敦Brown Rudnick LLP代我們處理。
專家
Biodexa Pharmaceuticals PLC截至2022年12月31日以及截至該日止期間三年各年的財務報表,包含在本招股説明書和註冊 聲明中,是基於Mazars LLP(一家獨立註冊公共會計師事務所)根據上述事務所作為審計和會計專家授權 出具的報告。報告 截至2022年12月31日止年度的財務報表中,附註2中載有關於我們持續經營能力的解釋段落。
瑪澤律師事務所(Mazars LLP),英國倫敦,是英格蘭和威爾士特許會計師協會的會員。
民事責任的強制執行
我們是根據英格蘭和威爾士的法律成立的。我們的所有董事和高級管理人員都是美國以外司法管轄區的居民。我們的公司 總部位於英國,我們的全部或大部分資產,以及我們董事和管理人員的全部或大部分資產位於美國境外。因此,您可能難以向我們或我們的董事提起法律訴訟,或讓他們中的任何人出庭受審。
我們 已委任Puglisi & Associates的Donald J. Puglisi為我們的授權代理人,在任何美國聯邦或州法院提起的訴訟中 , 對本招股説明書提供的證券產生或基於本招股説明書提供的證券具有標的管轄權。
我們 理解,在英國,可能無法僅根據美國聯邦證券法就民事責任提起訴訟或執行美國法院的判決。此外,在美國或其他地方提起訴訟的懲罰性賠償金裁決在英國可能無法執行。賠償金的裁決通常被認為是懲罰性的,如果它不尋求賠償 索賠人遭受的損失或損害,而是旨在懲罰被告。除了執行的公共政策方面, 如上述,在英格蘭,任何判決的可執行性將取決於案件的特定事實和相關 情況,例如(明確但不限於),是否存在可能影響 執行判決的能力的任何相關破產程序。此外,美國和聯合王國目前尚未締結條約(或公約)規定相互承認和執行判決(儘管兩國都是《承認及執行外國仲裁裁決紐約公約》的締約國)。
| 153 |
| 《目錄》 |
在那裏您可以找到更多信息
我們必須遵守《1934年證券交易法》(經修訂)或《交易法》(適用於外國私人發行人)的定期 報告和其他信息要求。因此,我們需要向SEC提交報告,包括表格20—F的年度報告和其他信息 。作為一家外國私人發行人,我們不受《交易法》的規則的約束,這些規則規定了根據《交易法》第14(a)、(b)和(c)節中所載的聯邦委託書規則向股東提供 委託書及其內容, 我們的"內部人士"不受《交易法》第16節中所載的報告和短期利潤回收條款的約束。SEC在www.example.com上維護一個互聯網網站,其中包含報告、委託書、信息聲明和有關 發行人的其他信息。我們向SEC提交的某些信息的副本也可在我們的網站www.example.com上查閲。 我們的網站不屬於本招股章程的一部分,也不以引用的方式納入本招股章程。
本招股説明書是 我們向SEC提交的註冊聲明的一部分。本招股説明書根據美國證券交易委員會的規則和規定,省略了註冊聲明中包含的某些信息。您應查看註冊聲明中的信息和附件,以瞭解 有關我們及其合併子公司以及我們提供的證券的更多信息。本招股説明書中關於我們作為註冊聲明的附件提交的任何文件或我們以其他方式向SEC提交的文件的聲明,並不旨在全面,且 通過參考這些文件而具有資格。您應該查看完整的文檔來評估這些聲明。您可以通過上述地址從SEC或SEC網站獲得註冊 聲明的副本。
| 154 |
| 《目錄》 |
BIODEXA PHARMACEUTICALS PLC
截至2023年及2022年6月30日止六個月期間的未經審核簡明綜合財務報表索引
| 頁面 | |
| 截至二零二三年及二零二二年六月三十日止六個月期間的簡明綜合未經審核全面收益表 | F-1 |
| 截至2023年6月30日和2022年12月31日的簡明綜合未經審計財務狀況報表 | F-2 |
| 截至2023年6月30日和2022年6月30日終了的六個月期間的簡明合併未經審計現金流量表 | F-3 |
| 截至2022年6月30日和2022年6月30日止六個月期間的簡明綜合未經審計權益變動表 | F-5 |
| 構成截至2023年6月30日止六個月期間的簡明綜合未經審核中期財務資料的部分附註 | F-6 |
| 155 |
| 《目錄》 |
BIODEXA PHARMACEUTICALS PLC
合併財務報表索引
| 頁面 | |
| 獨立註冊會計師事務所報告(Mazars LLP,英國倫敦,PCAOB ID 1401) | F-18 |
| 2022年、2021年和2020年12月31日終了年度綜合全面收益表 | F-20 |
| 截至2022年、2021年和2020年12月31日的合併財務狀況報表 | F-21 |
| 2022年、2021年和2020年12月31日終了年度合併現金流量表 | F-23 |
| 截至2022年、2021年和2020年12月31日止年度的合併權益變動表 | F-25 |
| 構成綜合財務報表一部分的附註 | F-28 |
| 156 |
| 《目錄》 |
綜合全面收益表
截至6月30日止年度 六個月期間
| 注意事項 | 2023 未經審計 £’000 | 2022 未經審計 £’000 | ||||||||||
| 收入 | ||||||||||||
| 其他收入 | ||||||||||||
| 研發成本 | ( | ) | ( | ) | ||||||||
| 行政費用 | ( | ) | ( | ) | ||||||||
| 運營虧損 | ( | ) | ( | ) | ||||||||
| 財政收入 | 2 | |||||||||||
| 財務費用 | 2 | ( | ) | ( | ) | |||||||
| 税前虧損 | ( | ) | ( | ) | ||||||||
| 税收 | 3 | |||||||||||
| 損失)可歸因於母公司所有者的期間 | ( | ) | ( | ) | ||||||||
| 其他全面收入: | ||||||||||||
| 將會或可能會在隨後重新分類為損益的項目: | ||||||||||||
| 扣除税項的其他綜合收益合計 | ||||||||||||
| 可歸因於母公司所有者的全面損失總額 | ( | ) | ( | ) | ||||||||
| 每股虧損 | ||||||||||||
| 每股普通股基本及攤薄虧損-便士 | 4 | )p | )p | |||||||||
附註 構成這些財務報表的一部分
分銷成本、銷售和營銷在2023年和2022年無關緊要,已計入行政成本。
| F-1 |
| 《目錄》 |
合併財務狀況表
| 注意事項 | 截至
£’000 | 截至 2022年12月31日 £’000 | ||||||||||
| 資產 | ||||||||||||
| 非流動資產 | ||||||||||||
| 財產、廠房和設備 | ||||||||||||
| 無形資產 | ||||||||||||
| 流動資產 | ||||||||||||
| 貿易和其他應收款 | ||||||||||||
| 税收 | ||||||||||||
| 現金和現金等價物 | ||||||||||||
| 總資產 | ||||||||||||
| 負債 | ||||||||||||
| 非流動負債 | ||||||||||||
| 借款 | 5 | |||||||||||
| 流動負債 | ||||||||||||
| 貿易和其他應付款 | ||||||||||||
| 借款 | 5 | |||||||||||
| 條文 | 6 | |||||||||||
| 衍生金融負債 | 7 | |||||||||||
| 總負債 | ||||||||||||
| 母公司擁有人應佔已發行股本及儲備 | ||||||||||||
| 股本 | 8 | |||||||||||
| 股票溢價 | ||||||||||||
| 合併準備金 | ||||||||||||
| 認股權證儲備 | ||||||||||||
| 累計赤字 | ( | ) | ( | ) | ||||||||
| 總股本 | ||||||||||||
| 權益和負債總額 | ||||||||||||
附註 構成這些財務報表的一部分
| F-2 |
| 《目錄》 |
合併的現金流量表
對於t 截至6月30日的六個月期間
| 注意事項 | 2023 未經審計 £’000 | 2022 未經審計 £’000 | ||||||||||
| 經營活動的現金流 | ||||||||||||
| 當期虧損 | ( | ) | ( | ) | ||||||||
| 對以下各項進行調整: | ||||||||||||
| 財產、廠房和設備折舊 | ||||||||||||
| 使用權資產折舊 | ||||||||||||
| 無形固定資產攤銷 | ||||||||||||
| 固定資產處置損失 | ||||||||||||
| 財政收入 | 2 | ( | ) | ( | ) | |||||||
| 財務費用 | 2 | |||||||||||
| 基於股份的支付費用 | ||||||||||||
| 税收 | 3 | ( | ) | ( | ) | |||||||
| 變動前的經營活動現金流量 營運資金 | ( | ) | ( | ) | ||||||||
| 貿易和其他應收款的減少/(增加) | ( | ) | ||||||||||
| 貿易和其他應付款項的增加 | ||||||||||||
| 撥備減少 | ( | ) | ( | ) | ||||||||
| 運營中使用的現金 | ( | ) | ( | ) | ||||||||
| 税款支付 | ||||||||||||
| 經營活動使用的現金淨額 | ( | ) | ( | ) | ||||||||
| F-3 |
| 《目錄》 |
合併 現金流量表(續)
截至6月30日的六個月期間
| 注意事項 | 2023 未經審計 £’000 | 2022 未經審計 £’000 | ||||||||||
| 投資活動 | ||||||||||||
| 購買房產、廠房和設備 | ( | ) | ( | ) | ||||||||
| 處置固定資產所得款項 | ||||||||||||
| 收到的利息 | ||||||||||||
| 投資活動產生/用於投資活動的淨現金 | ( | ) | ||||||||||
| 融資活動 | ||||||||||||
| 支付的利息 | ( | ) | ( | ) | ||||||||
| 租賃負債已付金額 | ( | ) | ( | ) | ||||||||
| 股份發行,包括認股權證,扣除成本 | 8 | |||||||||||
| 融資活動產生的(用於)現金淨額 | ( | ) | ||||||||||
| 現金和現金等價物淨增加/(減少) | ( | ) | ||||||||||
| 期初現金及現金等價物 | ||||||||||||
| 現金和現金等價物的匯兑(損失)/收益 | ||||||||||||
| 期末現金和現金等價物 | ||||||||||||
附註構成這些財務報表的一部分
| F-4 |
| 《目錄》 |
合併的權益變動表 (未經審計)
| 注意事項 | 分享 資本 £’000 | 分享 補價 £’000 | 合併 保留 £’000 | 搜查令 保留 £’000 | 累計 赤字 £’000 | 總計 股權 £’000 | ||||||||||||||||||||
| 2023年1月1日 | ( | ) | ||||||||||||||||||||||||
| 本期虧損 | ( | ) | ( | |||||||||||||||||||||||
| 合計 綜合損失 | ( | ) | ( | |||||||||||||||||||||||
| 交易 與業主: | ||||||||||||||||||||||||||
| 已發行股份 2023年2月15日 | ||||||||||||||||||||||||||
| 與股份發行相關的成本 2023年2月15日 | ( | ) | ( | ) | ( | |||||||||||||||||||||
| 於二零二三年五月二十六日發行之股份 | ( | ) | ||||||||||||||||||||||||
| 與股份發行相關的成本 2023年5月26日 | ( | ) | ( | ) | ( | |||||||||||||||||||||
| 行使預存資金認股權證 在時段 | ( | ) | ||||||||||||||||||||||||
| 期間行使認股權證 | ( | ) | ||||||||||||||||||||||||
| 基於共享 支付計費 | ||||||||||||||||||||||||||
| 合計 所有人的貢獻和分配 | ( | ) | ||||||||||||||||||||||||
| 在 2023年6月30日 | ( | ) | ||||||||||||||||||||||||
| 注意事項 | 分享 資本 £’000 | 分享 補價 £’000 | 合併 儲備 £’000 | 權證
儲備 | 累計 赤字 £’000 | 總計 股權 £’000 | ||||||||||||||||||||
| 2022年1月1日 | ( | ) | ||||||||||||||||||||||||
| 本期虧損 | ( | ) | ( | |||||||||||||||||||||||
| 合計 綜合損失 | ( | ) | ( | |||||||||||||||||||||||
| 交易 與業主: | ||||||||||||||||||||||||||
| 於2022年3月22日行使認股權證 | ||||||||||||||||||||||||||
| 於2022年5月3日發行的股份 | ||||||||||||||||||||||||||
| 基於共享 支付計費 | ||||||||||||||||||||||||||
| 合計 所有人的貢獻和分配 | ||||||||||||||||||||||||||
| 2022年6月30日 | ( | ) | ||||||||||||||||||||||||
附註構成這些財務報表的一部分
| F-5 |
| 《目錄》 |
構成綜合未經審核中期財務資料 部分的附註
截至2023年6月30日的六個月期間
| 1. | 準備的基礎 |
截至2023年6月30日止六個月的未經審核中期綜合財務資料乃根據國際會計準則理事會(IASB)根據國際會計準則第34號中期財務報告 (‘IAS 34’)發佈的國際財務報告準則、國際會計準則及解釋(統稱IFRS)的確認及計量原則 編制。中期綜合財務信息不包括年度財務信息中要求的所有信息和披露,應與截至2022年12月31日的年度經審計財務報表一併閲讀。
精簡的中期財務信息 未經審計。本中期財務資料所載截至2022年6月30日止六個月及截至2022年12月31日止年度的比較財務資料並不構成該年度的法定賬目。2022年12月31日的法定帳目已送交英國公司註冊處。審計師關於這些賬户的報告是無保留的, 沒有根據2006年《公司法》第498(2)或498(3)條的規定發表聲明。審計師的報告確實提請人們注意 與持續經營有關的重大不確定性,以及截至報告日期,公司要求在2023年第四季度之前籌集額外資金的要求 。
持續經營的企業
在過去幾年裏,隨着我們開發投資組合,我們經歷了
淨虧損和經營活動所用現金的大量現金流出。
截至2023年6月30日的六個月,我們的經營綜合虧損為£
我們的未來生存能力 取決於我們從融資活動中籌集現金以資助我們的開發計劃直至商業化、從經營活動中產生現金以及成功獲得監管部門批准以允許我們的開發產品銷售的能力。我們未能 在需要時籌集資金,可能會對我們的財務狀況和執行業務戰略的能力產生負面影響。
我們的綜合 財務報表已按持續經營基準呈列,該基準考慮在正常業務過程中變現資產和清償 負債。
截至2023年6月30日,我們的現金和現金等價物為英鎊
我們已編制 現金流量預測,並考慮了未來三年(包括自 批准本中期財務資料之日起12個月期間)的現金流量要求。這些預測表明,在2024年第一季度之前,將需要進一步的融資,前提是(除其他外)某些開發項目和其他運營活動按當前計劃繼續進行。如果我們通過發行債務證券或額外股本證券籌集 額外資金,可能會導致我們現有 股東的稀釋,增加固定付款義務,這些證券可能擁有優先於我們普通股的權利(包括 美國存託憑證),並可能包含會限制我們的運營並可能損害我們的競爭力的契約,例如對我們承擔額外債務的能力的限制 ,對我們獲取、出售或許可知識產權的能力的限制,以及可能對我們開展業務能力產生不利影響的其他 運營限制。任何這些事件都可能嚴重損害我們 的業務、財務狀況和前景。
| F-6 |
| 《目錄》 |
我們認為, 小型和微型生物技術公司的融資環境與 2008—10年金融危機以來一樣具有挑戰性。雖然這可能會帶來與其他有限或無法獲得融資的公司的收購和/或合併機會, 如上所述,但Biodexa的任何伴隨融資都可能會產生稀釋作用。我們將繼續評估融資方案,包括與收購和/或合併相關的融資方案。所考慮的任何替代方案取決於交易對手的同意 ,因此,無法保證為公司提供資金的任何替代方案都將成功。 這一短期內額外融資的要求代表了一種重大的不確定性,可能會對我們 繼續作為一家持續經營企業的能力產生重大懷疑。如果將來我們顯然沒有可行的融資選擇 在我們的現金資源耗盡之前採取行動,那麼我們將不再是一家持續經營的企業。在這種情況下,我們將無法 再根據國際會計準則第1號第25段編制財務報表。相反,財務報表將在清算基礎上編制,資產將按可變現淨值列報,所有負債將加速為流動負債。
吾等相信 有足夠的選擇和時間為貴公司爭取額外融資,經考慮不確定因素後,吾等認為 在編制該等財務報表時繼續採用持續經營基準是適當的。
我們對 我們的財務資源將足以支持我們的運營的時間段的預測是一項前瞻性聲明, 涉及風險和不確定性,實際結果可能因多種因素而異,包括臨牀試驗的時間安排。 我們基於可能被證明是錯誤的假設作出了這一估計,我們可以比 目前預期更快地利用可用資本資源。如果我們缺乏足夠的資本來擴大我們的業務或以其他方式利用我們的業務機會,我們的 業務、財務狀況和經營業績可能會受到重大不利影響。
| 2. | 財務收支 |
六個月 未經審計 £’000 | 六個月 未經審計 £’000 | |||||||
| 財政收入 | ||||||||
| 銀行存款利息 | ||||||||
| 權益結算衍生金融負債收益 | ||||||||
| 財政總收入 | ||||||||
23年上半年及22年上半年 權益結算衍生金融負債之收益乃由於Biodexa股價下跌所致。
六個月 未經審計 £’000 | 六個月 未經審計 £’000 | |||||||
| 財務費用 | ||||||||
| 租賃負債利息支出 | ||||||||
| 其他貸款 | ||||||||
| 財務費用總額 | ||||||||
| F-7 |
| 《目錄》 |
| 3. | 税收 |
所得税按預期收回或支付的金額確認 或撥備,使用於集團財務狀況表日期已頒佈或實質上已頒佈的税率及税法 。研發税項抵免按應計費用基準確認, 計入流動資產項下的所得税抵免。確認的研發税收抵免是基於管理層對期內預期税務申索的 估計,並記錄在中小型企業計劃項下的税項內。
六個月 未經審計 £’000 | 六個月 未經審計 £’000 | |||||||
| 所得税抵免 | ||||||||
| 4. | 每股虧損 |
每股基本虧損金額乃按母公司普通股持有人應佔期內持續經營業務淨虧損除以期內已發行普通股加權平均數計算。由於本集團於本期間錄得虧損,故每股攤薄虧損等於每股基本虧損。
六個月 未經審計 £’000 | 六個月 未經審計 £’000 | |||||||
| 分子 | ||||||||
| 基本每股收益及攤薄每股收益所用虧損: | ( | ) | ( | ) | ||||
| 分母 | ||||||||
| 基本每股收益所用普通股加權平均數 | ||||||||
| 每股基本虧損和攤薄虧損: | ( | )p | ( | )p | ||||
於2023年3月24日舉行的股東大會上,股東批准將本公司普通股按1比20的基準合併。因此,普通股的面值從每股0.001英鎊變為每股計算分母 以反映本期和前期的股份合併。
於二零二三年六月十四日舉行的股東大會上,股東批准本公司已發行普通股的拆細及重新指定, 每一股每股面值0.001英鎊的普通股和19股每股面值0.001英鎊的'B'遞延股。'B' 遞延股份的權利有限,實際上沒有價值。由於已發行普通股數量沒有變化,股份細分和重新指定不會影響分母的計算 。
2023年2月15日,
| F-8 |
| 《目錄》 |
此外, 關於2月份的私募,本公司與停戰資本主基金有限公司(“停戰”)於2022年12月13日簽署了一份《證券購買協議》(“SPA”)豁免,並於2022年12月16日修訂 ,規定永久豁免SPA項下的某些股權發行禁令和參與權。本公司同意 ,在2023年3月24日的股東大會上收到股東批准後,向停戰公司發出 A系列ADS認股權證 可行使, 普通股(“投資者認股權證”)。
A系列和B系列認股權證可在“替代無現金基礎”上行使,有效地允許持有人以零對價行使。
所有決議案均於2023年3月24日於股東大會上通過。
2023年5月26日
C系列認股權證 可在“替代無現金基礎”上行使,有效地允許持有人以零對價行使。
所有決議案均於2023年6月14日於股東大會上通過。
本公司在發行A系列、B系列、C系列預籌資金權證及投資者認股權證時,已考慮《國際會計準則》第33號所載的指引以計算分母。管理層在計算分母時已確認認股權證由授出日期起計,而非相應普通股的發行日期起計。
本集團於本期及過往期間錄得虧損,因此該等期權及認股權證為反攤薄性質。因此,稀釋後每股收益 按與基本每股收益相同的基準列報。
*以上美國存托股份數字 反映了2023年7月5日生效的美國存托股份比率變化。
| F-9 |
| 《目錄》 |
| 5. | 借款 |
截至30歲 £’000 | 截至31歲 £’000 | |||||||
| 當前 | ||||||||
| 租賃負債 | ||||||||
| 總計 | ||||||||
| 非當前 | ||||||||
| 租賃負債 | ||||||||
| 總計 | ||||||||
賬面價值在2023年6月30日和2022年12月31日接近公允價值。
融資租賃項下的債務以相關固定資產的固定押記作抵押。在此期間,融資租賃得到了滿足。
| 6. | 規定 |
截至30歲 £’000 | 截至31歲 £’000 | |||||||
| 1月1日的期初準備金 | ||||||||
| 糧食的使用情況 | ( | ) | ( | ) | ||||
| 期內確認的撥備 | ||||||||
2022年12月19日,本公司與BiOasis簽訂了一份期票和擔保協議,以在短期內協助BiOasis滿足其營運資金需求。根據協議,該公司同意向BiOasis提供最高達美元的貸款
該公司預付了
美元
管理層認為債務的收回尚不確定,並於2022年確認減值撥備
2023年2月3日,Biaasis宣佈,他們正在“緊急探索和評估所有可能用於解決其流動性需求的融資和戰略替代方案”,這引發了違約事件。因此,未支付協議項下的第三筆付款 。於二零二三年三月五日,Bioasis獲送達違約事件通知。2023年6月20日,Biasis宣佈暫停運營 。
2023年,撥備 已用於抵銷2023年1月向Bioasis支付的預付款。
| F-10 |
| 《目錄》 |
| 7. | 衍生金融負債—流動 |
截至30歲 £’000 | 截至31歲 £’000 | |||||||
| 在1月1日 | ||||||||
| 已發行的認股權證 | ||||||||
| 於綜合全面收益表內於財務收入確認之收益 | ( | ) | ( | ) | ||||
權益結算 衍生金融負債是不以現金結算的負債。
在此期間 行使了下列認股權證:
於二零二三年或二零二二年,並無確認 為權益結算衍生工具之認股權證獲行使。
作為在美國註冊的直接發行和私募的一部分,公司在公司的美國存託憑證中發行了 認股權證。行權時將發行的美國存託憑證數量是固定的,但行權價格以美元計價,與公司的功能貨幣不同。因此,該等認股權證被分類為按公允價值於損益表(“FVTPL”)確認的權益結算衍生金融負債。2023年使用Black-Scholes模型對金融負債進行估值,在之前的 期間使用蒙特卡羅模型。計算方法的改變是由於本公司於2023年從AIM退市,因此在計算公允價值時不再需要考慮外匯變動。FVTPL的財務負債按公允價值列報,因重新計量而產生的任何損益均在損益中確認。於損益確認的淨收益或虧損包括就財務負債支付的任何利息,並計入損益表的“財務收入”或“財務支出”項目 。該工具估值的一個關鍵因素是該公司的股價。
認股權證詳情如下:
下面的美國存托股份數字 反映了2023年7月5日生效的美國存托股份比率變化。
2023年5月認股權證
2023年6月,該公司發佈了
2020年5月認股權證
2020年5月,該公司發佈了
2019年10月認股權證
2019年10月,公司發佈
2020年5月和2019年10月保證重新定價
於2022年12月13日,本公司與停戰資本主基金有限公司(“停戰”)訂立證券購買協議,將先前發行的美國存托股份認股權證重新定價至$
| F-11 |
| 《目錄》 |
| ADS認股權證 編號 * |
原價 根據ADS * |
新價格 ADS |
等效普通 數 | |
| 2019年10月認股權證 | $ |
$ |
||
| 2020年5月認股權證 | $ |
$ |
| * |
DARA認股權證 和股票期權
本集團亦 就收購DARA Biosciences,Inc.而承擔全部歸屬認股權證及購股權。(2015年)。行使時將發行的 普通股數量是固定的,但行使價以美元計值。認股權證分類為 權益結算衍生金融負債,並以與上文詳述者相同的方式入賬。金融負債的估值採用布萊克—斯科爾斯期權定價模型。未行使購股權之行使價為1,903. 40美元。
下表 詳列於二零二三年六月三十日、二零二二年十二月三十一日確認為權益結算衍生金融負債的尚未行使認股權證及購股權,以及期內變動:
| 在
1 一月 2022 |
已失效 | 31歲 2022 |
授與 | 已失效 | 已鍛鍊 | 6月30日
2023 | |
| 美國存託憑證 | |||||||
| 2023年5月授予‘D’認股權證 | |||||||
| 2020年5月撥款 | |||||||
| 2019年10月 贈款 | |||||||
| 普通股 股 | |||||||
| Dara 授權書 | ( |
||||||
| Dara 選項 | ( |
公允價值層次結構
本集團採用以下層級按估值技術釐定及披露金融工具的公允價值:
第一級:相同資產和負債在活躍市場上的報價(未調整);
第2級:可直接或間接觀察到對所記錄公允價值有重大影響的所有投入的其他技術 和
第3級:使用對記錄的公允價值有重大影響但不基於可觀察市場數據的投入的技術 。
| F-12 |
| 《目錄》 |
本集團衍生金融負債的公允價值 按公允價值按經常性基礎計量。下表提供了有關如何確定該金融負債公允價值的信息 。
| 金融 負債 |
公平值 6月30日 2023 |
公允價值為 2022 |
公允價值
|
估值 技術 和按鍵輸入 |
重大不可觀察 輸入
|
的關係
| |
| 以權益結算的金融衍生負債—2023年6月 | £ |
3級 | |||||
| 以權益結算的金融衍生負債—二零二零年五月認股權證 | £ |
3級 |
|
||||
公允價值越高。 | |||||||
| 以權益結算的金融衍生工具負債—二零一九年十月認股權證 | £ |
3級 |
|
||||
公允價值越高。 | |||||||
| 總計 | £ |
£ |
在所有其他變量保持不變的情況下,將無法觀察到的 無風險率輸入更改為估值模型10%,不會影響股票的賬面價值 (2022:零)。
| F-13 |
| 《目錄》 |
在此期間,級別1和級別2之間沒有任何轉移 。
按第3級公允價值計量的公允價值計量的財務負債是指與2023年6月、2020年5月和2019年10月作為私募配售和登記直接發售的一部分發行的權證有關的對價。
| 8. | 股本和儲備金 |
| 已授權、已分配和完全 已支付--歸類為股權 | 截至6月30日 數 | 截至6月30日 £ | 截至31歲 數 | 截至31歲 £ | ||||||||||||
| 每股0.001英鎊的普通股 | ||||||||||||||||
| 'A'遞延股份每股1英鎊 | ||||||||||||||||
| 'B'遞延股份0.001英鎊 | ||||||||||||||||
| 總計 | ||||||||||||||||
於2023年3月24日舉行的股東大會上,股東批准將本公司普通股按1比20的基準合併。因此,普通股的面值從每股0. 001英鎊改為每股0. 02英鎊。上表反映了比較數字中的份額 合併。
在2023年6月14日的股東大會上,股東批准將本公司每股面值0.02英鎊的已發行普通股拆細及重新指定為一股每股面值0.001英鎊的普通股及19股每股面值0.001英鎊的“B”遞延股份。'B' 遞延股份的權利有限,實際上沒有價值。先前發行的遞延股份被重新指定為'A' 遞延股份。
於2023年5月26日, 本公司按附註4所載進行私募。由於並無就該項交易確認股份溢價,分配至首次發行股份的交易成本已計入保留盈利。
期內 本公司進行了兩次私人配售,詳情見附註4。預撥資金、系列A、系列B、系列C及投資者認股權證 已入賬列作股本認股權證,確認時的公平值已扣除交易成本後分配至認股權證儲備。 認股權證行使時,公允值已轉撥至股本及股份溢價。
普通股和遞延 股記錄為權益。
Biodexa Pharmaceuticals PLC股份附帶的權利
分類為股權的股份
本公司股本中 普通股持有人擁有以下權利:
(A) 接收本公司所有股東大會的通知、出席及投票,在此情況下,股東可就其持有的每股股份 投一票;及
(B) 收取董事會就所持每股股份宣派的股息 。
本公司股本中遞延股份的持有者:
(A) 無權接收本公司任何股東大會的通知、出席本公司任何股東大會或在本公司任何股東大會上發言或就將於本公司任何股東大會上提出的任何決議案進行表決。
(B) 無權從本公司的利潤中收取任何股息或其他分派。
| F-14 |
| 《目錄》 |
如發生資產分派,遞延股東應於每股普通股持有人收到該等普通股已繳足或入賬列作繳足的款項(以現金或實物)後,收取有關股份的面值,以及額外的 每股100 GB付款。本公司有權購買遞延股份,並可要求遞延股份持有人以不超過1便士的價格出售遞延股份。
| 2023 | 普通 數 | ‘A’ 數 | “B”延期股份 數 | 分享 £ | 總計 £’000 | |||||||||||||||||
| 在2023年1月1日 | ||||||||||||||||||||||
| 2023年2月15日 | 私募 | |||||||||||||||||||||
| 2023年5月26日 | 註冊的直銷產品 | |||||||||||||||||||||
| 2023年4月至6月 | 行使2023年2月預備認股權證 | |||||||||||||||||||||
| 2023年3月 | 行使'A'系列認股權證 | |||||||||||||||||||||
| 2023年3月 | 行使'B'系列認股權證 | |||||||||||||||||||||
| 2023年6月15日 | 行使投資者認股權證 | |||||||||||||||||||||
| 2023年6月14日 | 股份分拆和重新指定 | 不適用 | 不適用 | |||||||||||||||||||
| 2023年6月30日 | 行使'C'認股權證 | |||||||||||||||||||||
| 於二零二三年六月三十日(未經審核)。 | ||||||||||||||||||||||
| 2022 | ||||||||||||||||||||||
| 在2022年1月1日 | ||||||||||||||||||||||
| 2022年3月22日 | 認股權證的行使 | |||||||||||||||||||||
| 2022年5月3日 | 向SIPP受託人發行股份 * | |||||||||||||||||||||
| 2022年12月19日 | 註冊的直銷產品 | |||||||||||||||||||||
| 在2022年12月31日 | ||||||||||||||||||||||
* 股份 發給Biodexa Pharmaceuticals PLC員工福利信託
| 9. | 關聯交易 |
董事認為, 於報告期間內,除董事薪酬外,並無任何關聯方交易。
| 10. | 或有負債 |
本公司於2022年12月13日與Bioasis訂立
安排協議,並於2022年12月18日修訂。根據該協議,公司同意
收購Bioasis的全部已發行股本,總代價約為740萬加元(440萬加元)。
該協議須經股東批准。根據協議,公司同意償還Bioasis美元,
| F-15 |
| 《目錄》 |
2023年1月23日,在批准安排協議的股東大會上,沒有通過任何特別決議案,因此,收購Bioasis的
沒有進行。1月23日,Bioasis終止了《安排協定》,並要求償還美元
| 11. | 報告日期之後的事件 |
2023年7月5日, 為了努力使美國存託憑證價格符合納斯達克的每股最低買入價要求,我們對美國存託憑證所代表的普通股數量進行了 的比率從每股美國存託憑證五股普通股改為 每股ADS普通股。
| F-16 |
| 《目錄》 |
BIODEXA PHARMACEUTICALS PLC
合併財務報表索引
| 頁面 | |
| 獨立註冊會計師事務所報告(Mazars LLP,英國倫敦,PCAOB ID 1401) | F-18 |
| 2022年、2021年和2020年12月31日終了年度綜合全面收益表 | F-20 |
| 截至2022年、2021年和2020年12月31日的合併財務狀況報表 | F-21 |
| 2022年、2021年和2020年12月31日終了年度合併現金流量表 | F-23 |
| 截至2022年、2021年和2020年12月31日止年度的合併權益變動表 | F-25 |
| 構成綜合財務報表一部分的附註 | F-28 |
| F-17 |
| 《目錄》 |
獨立註冊會計師事務所報告
Biodexa Pharmaceuticals plc(原名Midatech Pharma plc)董事會和股東
對合並財務報表的幾點看法
我們審計了隨附的Biodexa Pharmaceuticals plc的合併財務狀況表 (原名Midatech Pharma plc)及其子公司(“本集團”)於二零二二年及二零二一年十二月三十一日止三年期間各 年度的相關綜合全面收益表、權益變動表及現金流量表,包括相關附註(統稱“綜合財務報表”)。 我們認為,綜合財務報表在所有重大方面公允列報了貴集團 於二零二二年及二零二一年十二月三十一日的財務狀況,以及截至二零二二年十二月三十一日止三年期間各年度的綜合經營業績及現金流量,符合國際會計準則理事會頒佈的國際財務報告準則。
持續經營的不確定性
隨附綜合財務報表已 假設貴集團將繼續持續經營而編制。如綜合財務報表附註1所述, 本集團因經營活動而遭受經常性虧損,且存在淨資本不足,令人對其 持續經營能力產生重大疑問。管理層關於這些事項的計劃也載於附註1。合併財務報表 不包括可能因此不確定性結果而導致的任何調整。
意見基礎
這些合併財務報表由 集團管理層負責。我們的責任是根據我們的審計對該等綜合財務報表發表意見。 我們是一家在上市公司會計監督委員會(美國)(“PCAOB”)註冊的公共會計師事務所, 根據美國聯邦證券法以及美國證券交易委員會和PCAOB的適用規則 和條例,我們必須獨立於本集團。
我們按照PCAOB的標準進行審計。 這些準則要求我們規劃和執行審計,以合理確定綜合財務報表 是否不存在由於錯誤或欺詐而導致的重大錯誤陳述。貴集團無需進行(亦未聘用我們執行)對其財務報告內部控制進行 審計。作為審計工作的一部分,我們需要了解 對財務報告的內部控制,但並非為了就集團對 財務報告的內部控制的有效性發表意見。因此,我們不表達這種意見。
我們的審計包括執行程序以評估 合併財務報表因錯誤或欺詐而存在重大錯報風險,以及執行程序 應對這些風險。此類程序包括在測試基礎上審查有關 合併財務報表中金額和披露的證據。我們的審計還包括評估管理層使用的會計原則和作出的重大估計,以及評估綜合財務報表的整體列報方式。我們相信我們的審計為我們的意見提供了 合理的基礎。
關鍵審計事項
以下溝通的關鍵審計事項 是指已溝通或需要溝通 至審核委員會的本期綜合財務報表審計所產生的事項,且:(1)與對綜合財務報表而言屬重大的賬目或披露有關,以及 (2)涉及我們特別具挑戰性、主觀或複雜的判斷。傳達關鍵審計事項不會以任何方式改變 吾等對綜合財務報表整體的意見,且吾等不會透過傳達以下關鍵審計 事項,就關鍵審計事項或與之相關的賬目或披露提供單獨意見。
| F-18 |
| 《目錄》 |
我們確定了一個關鍵審計事項,作為持續經營 準備的基礎。關鍵審計事項的性質連同我們的結論載於上文 持續經營 不確定性 段落. 鑑於所述情況,董事須 在評估按持續經營基準編制綜合財務報表 是否適當時作出重大判斷,以及在編制其相關解釋披露時。由於要求董事作出 重大判斷(其中大部分判斷屬於定性性質),加上持續經營編制基準的普遍影響 以及相關解釋性披露在提供綜合財務報表背景方面的重要性,我們得出結論 ,持續經營編制基準為關鍵審計事項。
吾等對董事就編制該等綜合財務報表的持續經營基準的適當性所作評估的評估包括但不限於:
| · | 在審計的規劃階段進行初步評估,以確定可能對集團持續經營能力產生重大疑問的事件或條件 ; |
| · | 瞭解有關 董事持續經營評估的相關控制; |
| · | 審閲董事的正式持續經營評估,包括 截至2025年12月31日的現金流量預測; |
| · | 評估董事 在就持續經營作出結論時所使用的關鍵假設及應用的判斷;及 |
| · | 檢討董事於綜合財務報表所作披露之適當性。 |
自 2020年以來,我們一直擔任集團的審計師。
/s/Mazars LLP
Mazars LLP
英國倫敦
2023年4月28日
| F-19 |
| 《目錄》 |
綜合收益表
截至十二月三十一日止的年度
| 注意事項 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||||
| 收入 | 3 | |||||||||||||
| 助學金收入 | ||||||||||||||
| 總收入 | ||||||||||||||
| 其他收入 | ||||||||||||||
| 研發成本 | ( | ) | ( | ) | ( | ) | ||||||||
| 行政費用 | ( | ) | ( | ) | ( | ) | ||||||||
| 無形資產減值準備 | 11,12 | ( | ) | |||||||||||
| 運營虧損 | 4 | ( | ) | ( | ) | ( | ) | |||||||
| 財政收入 | 6 | |||||||||||||
| 財務費用 | 6 | ( | ) | ( | ) | ( | ) | |||||||
| 税前虧損 | ( | ) | ( | ) | ( | ) | ||||||||
| 税收 | 7 | |||||||||||||
| 母公司擁有人應佔年內虧損 | ( | ) | ( | ) | ( | ) | ||||||||
| 其他全面收入: | ||||||||||||||
| 將會或可能會在隨後重新分類為損益的項目: | ||||||||||||||
| 對外業務折算產生的匯兑收益 | ||||||||||||||
| 其他全面收益(扣除税項)合計 | ||||||||||||||
| 可歸因於母公司所有者的全面損失總額 | ( | ) | ( | ) | ( | ) | ||||||||
| 每股虧損 | ||||||||||||||
| 持續運營 | ||||||||||||||
| 每股普通股基本及攤薄虧損—英鎊 | 8 | ( | ) | ( | ) | ( | ) | |||||||
該等附註構成該等綜合財務報表的組成部分。
| F-20 |
| 《目錄》 |
綜合財務狀況報表
12月31日
| 公司編號09216368 | 注意事項 | 2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 資產 | ||||||||||||||
| 非流動資產 | ||||||||||||||
| 財產、廠房和設備 | 9 | |||||||||||||
| 無形資產 | 11 | |||||||||||||
| 非流動資產總額 | ||||||||||||||
| 流動資產 | ||||||||||||||
| 貿易和其他應收款 | 14 | |||||||||||||
| 税收 | ||||||||||||||
| 現金和現金等價物 | 15 | |||||||||||||
| *流動資產總額 | ||||||||||||||
| 總資產 | ||||||||||||||
| 負債 | ||||||||||||||
| 非流動負債 | ||||||||||||||
| 借款 | 17 | |||||||||||||
| 條文 | 18 | |||||||||||||
| *非流動負債總額 | ||||||||||||||
| 流動負債 | ||||||||||||||
| 貿易和其他應付款 | 16 | |||||||||||||
| 借款 | 17 | |||||||||||||
| 條文 | 18 | |||||||||||||
| 衍生金融負債 | 19 | |||||||||||||
| *流動負債總額 | ||||||||||||||
| 總負債 | ||||||||||||||
| F-21 |
| 《目錄》 |
合併財務狀況表(續)
12月31日
| 注意事項 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||||
| 母公司擁有人應佔已發行股本及儲備 | ||||||||||||||
| 股本 | 22 | |||||||||||||
| 股票溢價 | 23 | |||||||||||||
| 合併準備金 | 23 | |||||||||||||
| 認股權證儲備 | 23 | |||||||||||||
| 累計赤字 | 23 | ( | ) | ( | ) | ( | ) | |||||||
| 總股本 | ||||||||||||||
| 權益和負債總額 | ||||||||||||||
該等附註構成該等綜合財務報表的組成部分。
| F-22 |
| 《目錄》 |
現金流量合併報表
截至十二月三十一日止的年度
| 注意事項 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||||
| 經營活動的現金流 | ||||||||||||||
| 本年度虧損 | ( | ) | ( | ) | ( | ) | ||||||||
| 對以下各項進行調整: | ||||||||||||||
| 財產、廠房和設備折舊 | 9 | |||||||||||||
| 使用權資產折舊 | 9 | |||||||||||||
| 無形固定資產攤銷 | 11 | |||||||||||||
| 處置固定資產損失/(利潤) | ( | ) | ( | ) | ||||||||||
| 無形資產減值準備 | 11,12 | |||||||||||||
| 貸款減值準備 | 4,14 | |||||||||||||
| 財政收入 | 6 | ( | ) | ( | ) | ( | ) | |||||||
| 財務費用 | 6 | |||||||||||||
| 基於股份的支付費用/(信用) | 4 | ( | ) | |||||||||||
| 税收 | 7 | ( | ) | ( | ) | ( | ) | |||||||
| 外匯(收益)/損失 | ( | ) | ( | ) | ||||||||||
| 營運資本變動前的經營活動現金流 | ( | ) | ( | ) | ( | ) | ||||||||
| 貿易和其他應收款的減少/(增加) | ( | ) | ||||||||||||
| 增加/(減少)貿易和其他應付款項 | ( | ) | ( | ) | ||||||||||
| 增加/(減少)撥備 | ( | ) | ( | ) | ||||||||||
| 運營中使用的現金 | ( | ) | ( | ) | ( | ) | ||||||||
| 收到的税金 | ||||||||||||||
| 用於經營活動的現金淨額 | ( | ) | ( | ) | ( | ) | ||||||||
| F-23 |
| 《目錄》 |
現金流量合併報表 (續)
截至十二月三十一日止的年度
| 注意事項 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||||
| 投資活動 | ||||||||||||||
| 購買房產、廠房和設備 | 9 | ( | ) | ( | ) | ( | ) | |||||||
| 處置固定資產所得款項 | ||||||||||||||
| 政府貸款擔保的長期存款 | ||||||||||||||
| 已授出之貸款 | 14 | ( | ) | |||||||||||
| 收到的利息 | ||||||||||||||
| 淨現金(用於投資活動)/產生於投資活動 | ( | ) | ( | ) | ||||||||||
| 融資活動 | ||||||||||||||
| 支付的利息 | ( | ) | ( | ) | ( | ) | ||||||||
| 從分租承租人收取的有償租賃款 | ||||||||||||||
| 租賃負債已付金額 | ( | ) | ( | ) | ( | ) | ||||||||
| 償還西班牙業務結束後的政府補助金 | ( | ) | ||||||||||||
| (償還)/政府貸款收益 | 17 | ( | ) | ( | ) | |||||||||
| 股份發行,包括認股權證,扣除成本 | 15 | |||||||||||||
| 融資活動產生的現金淨額 | ||||||||||||||
| 現金和現金等價物淨增加/(減少) | ( | ) | ( | ) | ||||||||||
| 年初現金及現金等價物 | ||||||||||||||
| 現金和現金等價物的匯兑(損失)/收益 | ( | ) | ||||||||||||
| 年終現金及現金等價物 | 15 | |||||||||||||
該等附註構成該等綜合財務報表的組成部分。
| F-24 |
| 《目錄》 |
合併權益變動表
截至十二月三十一日止的年度
注意事項 | 分享 資本 £’000 | 分享 補價 £’000 | 合併 £’000 | 認股權證
保留 £’000 | 外國 兑換 保留 £’000 | 累計 赤字 £’000 | 總計 股權 £’000 | |||||||||||||||||||||||
| 在2022年1月1日 | ( | ) | ||||||||||||||||||||||||||||
| 本年度虧損 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 外匯兑換翻譯 | ||||||||||||||||||||||||||||||
| 全面損失總額 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 與業主的交易 | ||||||||||||||||||||||||||||||
| 於二零二二年三月二十二日行使認股權證 | 15, 22 | |||||||||||||||||||||||||||||
| 於二零二二年十二月十九日發行的股份 | 15, 22 | |||||||||||||||||||||||||||||
| 於二零二二年十二月十九日與股份發行有關的成本 | 15, 22 | ( | ) | ( | ) | |||||||||||||||||||||||||
| 股份支付費用 | ||||||||||||||||||||||||||||||
| 所有人的繳款和分配共計 | ||||||||||||||||||||||||||||||
| 在2022年12月31日 | ( | ) | ||||||||||||||||||||||||||||
| F-25 |
| 《目錄》 |
合併權益變動表 (續)
注意事項 | 分享 資本 £’000 | 分享 補價 £’000 | 合併 保留 £’000 | 搜查令 保留 £’000 | 外國 兑換 保留 £’000 | 累計 赤字 £’000 | 總計 股權 £’000 | |||||||||||||||||||||||
| 在2021年1月1日 | ( | ) | ||||||||||||||||||||||||||||
| 本年度虧損 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 外匯兑換翻譯 | ||||||||||||||||||||||||||||||
| 全面損失總額 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 與業主的交易 | ||||||||||||||||||||||||||||||
| 於二零二一年二月十九日發行的股份 | 15, 22 | |||||||||||||||||||||||||||||
| 於二零二一年二月十九日與股份發行有關的成本 | 15, 22 | ( | ) | ( | ) | |||||||||||||||||||||||||
| 於二零二一年七月六日發行的股份 | 15, 22 | |||||||||||||||||||||||||||||
| 於二零二一年七月六日與股份發行有關的成本 | 15, 22 | ( | ) | ( | ) | |||||||||||||||||||||||||
| 股份支付信貸 | ||||||||||||||||||||||||||||||
| 所有人的繳款和分配共計 | ||||||||||||||||||||||||||||||
| 在2021年12月31日 | ( | ) | ||||||||||||||||||||||||||||
| F-26 |
| 《目錄》 |
合併權益變動表 (cCONTINUED)
注意事項 | 分享 資本 £’000 | 分享 補價 £’000 | 合併準備金 £’000 | 認股權證
保留 £’000 | 外國 兑換 保留 £’000 | 累計 赤字 £’000 | 總計 股權 £’000 | |||||||||||||||||||||||
| 在2020年1月1日 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 本年度虧損 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 外匯兑換翻譯 | ||||||||||||||||||||||||||||||
| 全面損失總額 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 與業主的交易 | ||||||||||||||||||||||||||||||
| 於2020年5月18日發行的認股權證股份-附註16,23 | 15, 22 | |||||||||||||||||||||||||||||
| 與2020年5月18日發行的認股權證股份有關的費用 | 15, 22 | ( | ) | ( | ) | |||||||||||||||||||||||||
| 於2020年7月27日發行的股份 | 15, 22 | |||||||||||||||||||||||||||||
| 與2020年7月27日發行股票有關的費用 | 15, 22 | ( | ) | ( | ) | |||||||||||||||||||||||||
| 於二零二零年八月十九日發行的股份 | 15, 22 | |||||||||||||||||||||||||||||
| 於二零二零年八月十九日與股份發行有關的成本 | 15, 22 | ( | ) | ( | ) | |||||||||||||||||||||||||
| 股份支付信貸 | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 所有人的繳款和分配共計 | ( | ) | ||||||||||||||||||||||||||||
| 2020年12月31日 | ( | ) | ||||||||||||||||||||||||||||
| F-27 |
| 《目錄》 |
構成 財務報表一部分的附註
截至2022年、2021年及2020年12月31日止年度
| 1 | 會計政策 |
一般信息
Biodexa Pharmaceuticals plc(“公司”)是一家在英格蘭和威爾士註冊和註冊的公司。本公司於二零一四年九月十二日註冊成立。
本公司是一家公眾有限公司,其普通股自2014年12月8日起已獲準 在AIM(“AIM”)交易,該公司的普通股於2023年4月26日被取消。
此外,自2015年12月4日起,公司擁有在美國證券交易委員會(“SEC”)註冊的美國存託憑證(“ADR”),並在納斯達克 資本市場上市。
財務報表已於二零二三年四月二十八日獲董事會批准及授權刊發。
2023年3月27日,公司將名稱從Midatech Pharma plc變更為Biodexa Pharmaceuticals plc。
準備的基礎
本集團於2014年10月31日成立,當時本公司於2014年11月13日訂立 一項協議,透過發行相當於本公司 股份收購Midatech Limited及其全資附屬公司的全部股本。
財務報表是根據國際會計準則理事會(IASB)頒佈的國際財務報告準則編制的。
編制財務報表時採用的主要會計政策載列如下。該等政策已於所有呈列期間貫徹應用。
綜合財務報表乃按歷史 成本基準編制,惟以下項目除外(詳情請參閲個別會計政策):
- 某些金融工具—按公允價值計入損益。
採用新的和修訂的標準
自2022年1月1日起生效的新準則、詮釋及修訂
本集團已審閲自二零二二年一月一日起生效的新準則、詮釋及修訂 ,並認為概無適用於截至二零二二年十二月三十一日止年度的年度財務報表。
尚未生效的新準則、詮釋和修訂
國際會計準則理事會已頒佈的若干準則、準則修訂和詮釋 在未來會計期間生效,集團決定不提前採納。
本集團已審閲自二零二三年一月一日及二零二四年一月一日起生效的新訂準則、詮釋及修訂 ,並認為並無對本集團造成影響。
| F-28 |
| 《目錄》 |
| 1 | 會計政策(續) |
合併的基礎
本集團財務報表合併母公司 及其所有子公司的財務報表。如果母公司有權對被投資方進行重大指導活動、 風險敞口或從參與被投資方獲得可變回報的權利,並且有能力對被投資方行使其權力來 影響投資方的回報金額,則母公司控制子公司。所有附屬公司的報告日期為12月31日。
集團公司之間的所有交易和結餘均於合併時對銷 ,包括集團公司之間交易的未變現收益和虧損。倘集團內 資產銷售未變現虧損於綜合賬目時撥回,則相關資產亦會從集團角度進行減值測試。附屬公司財務報表中報告的金額 已在必要時作出調整,以確保與本集團採納的會計政策 一致。
綜合財務報表包括 以下實體的業績:
| 實體 | 概要描述 |
持續經營的企業
本集團和公司面臨許多類似於其他開發和早期商業階段製藥公司的風險。這些風險包括 開發組合產生的收入,以及與我們的管道產品的研究、開發、測試和獲得相關監管批准相關的風險 。最終,盈利運營的實現取決於未來的不確定事件,包括獲得足夠的 融資以完成我們的商業和開發活動,以及產生足以支持我們的成本結構的收入水平。
過去幾年,隨着我們開發投資組合,我們經歷了淨虧損和經營活動中使用的現金 的大量現金流出。截至二零二二年十二月三十一日止年度,本集團錄得綜合經營虧損7,700,000英鎊及經營活動負現金流量7,000,000英鎊。於二零二二年十二月三十一日,本集團的累計虧損為135. 3百萬英鎊。
我們未來的生存能力取決於我們從 融資活動中籌集現金以資助我們的開發計劃直至商業化、從經營活動中產生現金以及成功 獲得監管部門批准以允許我們的開發產品上市的能力。我們未能在需要時籌集資金, 可能對我們的財務狀況和執行其業務戰略的能力產生負面影響。
| F-29 |
| 《目錄》 |
| 1 | 會計政策(續) |
我們的綜合財務報表已按持續經營基準呈列,預期於正常業務過程中變現資產及清償負債。
於二零二二年十二月三十一日,我們擁有現金及現金等價物2. 8百萬英鎊。2023年2月9日,該公司完成了私募,扣除配售代理的費用和其他預計費用後,籌集了520萬美元(約430萬英鎊)。我們預計,集團目前有足夠的現金來 為其計劃運營提供資金,直至2023年第四季度。我們相信,我們目前有足夠的現金為我們的計劃運營提供資金,直到2023年第四季度。未能在2023年第四季度之前獲得額外資金可能導致公司被 置於管理層。
我們已編制現金流量預測,並考慮了貴集團未來三年(包括自批准綜合財務報表之日起十二個月期間)的現金流量要求。 這些預測表明,在未來12個月期間,將需要進一步的融資,尤其是假設某些 發展方案和其他業務活動按當前計劃繼續進行。
In our opinion, the environment for financing of small and micro-cap biotech companies is as challenging as it has been since the financial crisis of 2008-2010. While this may present acquisition and/or merger opportunities with other companies with limited or no access to financing, any attendant financings by Biodexa are likely to be dilutive. We and our advisors continue to evaluate financing options, including those connected to acquisitions and/or mergers, potentially available to the Group, including fundraising and the partnering of assets and technologies of the Company. The alternatives being considered are all at an early stage and are contingent upon the agreement of counterparties and accordingly, there can be no assurance that any of the alternative courses of action to finance the Company will be successful. This requirement for additional financing in the short term represents a material uncertainty that may cast significant doubt about our ability to continue as a going concern. Should it become evident in the future that there are no realistic financing options available to the Company which are actionable before its cash resources run out then the Company will no longer be a going concern. In such circumstances, we would no longer be able to prepare financial statements under paragraph 25 of IAS 1. Instead, the financial statements would be prepared on a liquidation basis and assets would be stated at net realizable value and all liabilities would be accelerated to current liabilities. As a result of the foregoing, our independent registered public accounting firm included an explanatory paragraph in its report on our financial statements as of and for the year ended 31 December 2022 with respect to this uncertainty.
吾等相信有足夠的選擇和時間為貴公司爭取 額外融資,經考慮不確定因素後,吾等認為在編制該等財務資料時繼續採用 持續經營基準是適當的。
我們作為一家持續經營企業的能力取決於我們獲得額外資本和/或處置資產的能力,我們無法保證我們能夠及時、以 優惠條件或根本無法做到這一點。
| F-30 |
| 《目錄》 |
| 1 | 會計政策(續) |
收入
收入按照國際財務報告準則第15號“來自客户合同的收入”的原則入賬。
提供研究和開發服務
提供服務之收入須經特定協議方可作實。 此乃於合約期內確認,並按整體履行履約責任(本集團提供的服務 )的進度按比例確認,並按成本估計總額中迄今已產生的成本計量。根據這些安排執行的幾乎所有工作 的主要投入都是人工。通常,發生的成本與 迄今為止已執行的合同比例之間存在直接關係。
當本集團向客户提供服務時,一般在任何工作開始前按 約定的百分比開具賬單,並在完工時開具餘額。向客户支付的費用按正常 商業條款支付。
助學金收入
當收到補助收入(並非直接償還相關成本)時,收入在滿足條件的時間點確認,並在補助收入內確認。 如果補助金是作為直接相關費用的償還而收到的,則在其擬供款支出的同一時期內,將其記入研究和開發費用。
本集團以前收到利率低於市場利率的政府貸款。該等貸款乃根據國際財務報告準則第9號確認及計量。低於市場利率的收益 按按市場利率貼現的貸款初始賬面值與已收所得款項 之間的差額計量。
該差額作為政府補助在遞延收入中持有, ,並根據其相關支出作為補助收入或研發費用的抵免發放。在 所得款項投資於廠房和設備的情況下,遞延收入在 損益表內根據所收購資產的折舊計入研發。
企業合併和外部收購無形資產
業務合併於收購日期(即本集團取得實體控制權之日期)採用收購法入賬。收購成本按轉讓給賣方的代價金額(按收購日期公允價值計量)和被收購方的任何非控股權益金額 計量。本集團於收購日期初步按成本計量商譽,即:
| · | 轉讓給賣方的對價的公允價值,加上; |
| · | 被收購方的任何非控股權益的金額,加上; |
| · | 如果業務合併是分階段實現的,則在 收購日重新計量的被收購方現有股權的公允價值減去; |
| · | 所收購可識別淨資產及所承擔負債的公允價值。 |
產生的購置成本記作開支並計入行政 成本。收購方將予轉讓之任何或然代價按收購日期之公平值確認。其後 或然代價(無論是資產還是負債)公允價值的變動將通過綜合 全面收益表確認。倘或然代價分類為權益,則不會重新計量。
| F-31 |
| 《目錄》 |
| 1 | 會計政策(續) |
業務合併及外部收購無形資產 (續)
無形資產(為不具實質性的可識別非貨幣資產)於資產應佔的預期未來經濟利益 有可能流入本集團且其成本能可靠計量時予以確認。當資產可分離或 產生於合同或其他法定權利時,資產被視為可識別。
外部收購之無形資產(商譽除外)初步 按成本確認,其後按其使用經濟年期以直線法攤銷。商譽 按成本減任何累計減值虧損列賬。
於業務合併時確認之無形資產應佔金額 乃採用適當估值技術達致。
在業務合併中獲得的在製品研發(“IPRD”)項目 確認為資產,即使後續支出因不符合下文開發成本政策中指定的標準而被撇銷。IPRD每年都要接受減值測試,直到相關項目完成或放棄 。除非符合下文所述的研發標準 ,否則不會就該IPRD進行資本化。
根據國際財務報告準則第3號,一旦完成每個界定項目的研究及開發 ,所收購知識產權開發的賬面值將重新分類為有限年期資產,並於其可使用年期內攤銷。
本集團確認的重大無形資產及其可使用 經濟年期如下:
| 商譽 | – |
| IPRD | – |
| 信息技術和網站費用 | – |
IPRD的使用經濟壽命將在進行中 研究項目完成時確定。
| F-32 |
| 《目錄》 |
| 1 | 會計政策(續) |
內部產生的無形資產(開發成本)
內部項目研究階段的支出在發生期間確認為支出 。當滿足以下所有條件時,特定項目發生的開發成本將計入資本化:
| · | 完成資產在技術上是可行的,以便可以使用或出售; |
| · | 集團打算完成該資產並使用或出售該資產; |
| · | 本集團有能力使用或出售該資產,並且該資產將產生未來可能產生的經濟利益(超出成本); |
| · | 有足夠的技術、財政和其他資源來完成開發和使用或出售資產;以及 |
| · | 資產在開發過程中的支出可以可靠地計量。 |
所有與新項目研發相關的內部活動均由董事持續監督。董事認為,在產品獲得至少一個國家的監管批准之前,該產品不符合將開發支出資本化的標準 。
不符合上述標準的開發支出和內部項目研究階段的支出 計入已產生的綜合全面收益表中確認的研發成本。目前還沒有任何項目達到資本化的程度。
非金融資產減值準備
具有無限使用年限的資產,例如商譽,或尚未準備好使用的無形資產,例如IPRD,不受攤銷影響,並每年進行減值測試。當事件或環境變化顯示賬面金額 可能無法收回時,應攤銷的資產將進行減值審核。減值虧損確認為資產的賬面金額超過其可收回金額的金額。可收回的金額是資產的公允價值減去出售成本和使用價值兩者中較高的一個。
為評估減值,資產按有單獨可識別現金流量(現金產生單位)的最低水平進行分組。本集團於2022年12月31日只有一個現金產生單位(2021:1,2020:1),如附註12所述。除商譽外的非金融資產會於每個報告日期進行審核,以確定是否有可能撥回減值。
減值費用計入損益,除非(如適用)將以前在其他全面收益中確認的收益轉回。確認為商譽的減值損失不能沖銷。
專利和商標
建立專利和商標所產生的成本要麼按照與專利和商標相關的產品的開發支出的相應處理進行支出,要麼在與專利和商標相關的開發支出達到作為無形資產資本化的程度的情況下將其資本化。
| F-33 |
| 《目錄》 |
| 1 | 會計政策(續) |
外幣
附屬公司以業務所在主要經濟環境貨幣以外的貨幣進行的交易,按交易發生時的匯率記錄。 外幣貨幣資產和負債按報告日期的匯率折算。因重新換算未結算貨幣資產及負債而產生的匯兑差額 立即在損益中確認。
該集團的象徵性貨幣是英鎊。外國 子公司使用運營所在國家/地區的當地貨幣。在合併時,海外業務的結果將按與交易發生時的匯率大致相同的匯率轉換為英鎊。海外業務的所有資產及負債,包括因收購該等業務而產生的商譽,均按報告日期的規定匯率折算。按期初匯率折算期初淨資產與按實際匯率折算海外業務結果產生的匯兑差額 在其他綜合收益中確認,並累計在外匯儲備中。
在構成本集團於有關海外業務的投資淨額的長期貨幣項目的換算上,於集團實體損益中確認的匯兑差額 重新分類至其他全面收益,並於合併時累積於外匯儲備內。
於出售海外業務時,截至出售日期,於外匯儲備確認與該業務有關的累計匯兑差額 轉撥至綜合全面收益表 ,作為出售收益或虧損的一部分。
金融資產負債
按攤銷成本
本集團並無任何可分類為 按公平值計入損益之金融資產。因此,所有金融資產分類為按攤銷成本計量的資產,定義如下。
這些資產是具有固定或可確定 付款且在活躍市場上沒有報價的非衍生金融資產。其主要透過向客户提供貨品及服務(例如: 貿易應收款),但也包括其他類型的合同貨幣資產。其初步按公平值加收購或發行直接應佔之交易成本確認,其後採用實際利率法按攤銷成本減減值撥備列賬。
就減值撥備而言,本集團應用國際財務報告準則第9號簡化 方法,使用貿易應收款項的全期預期信貸虧損撥備,以集體基準計量預期信貸 虧損。應收貿易賬款乃根據類似信貸風險及賬齡分類
預期損失率基於本集團在期末前三年期間經歷的歷史信貸損失。然後根據當前和前瞻性的宏觀經濟因素信息 調整歷史損失率。
按攤銷成本計量之資產(續)
本集團按攤銷成本列賬的資產包括綜合財務狀況表中的貿易及其他 應收款項以及現金及現金等價物。
現金及現金等價物包括庫存現金、原到期日為三個月或以下的通知存款 。
| F-34 |
| 《目錄》 |
| 1 | 會計政策(續) |
金融負債
本集團將其金融負債分類為兩類之一,視乎收購負債的目的而定。
按公平值計入損益(“按公平值計入損益”)。
本集團在 公司普通股股本中有尚未行使的認股權證。行使時將發行的普通股數量是固定的,但行使價以美元計值, 與母公司的功能貨幣不同。因此,認股權證分類為權益結算衍生工具 金融負債,並按公平值計入損益表確認。
金融負債採用蒙特卡洛 模型或布萊克—斯科爾斯期權定價模型估值。按公平值計入損益之金融負債按公平值列賬,重新計量產生之任何收益或虧損 於損益確認。於損益中確認的收益或虧損淨額包括就 金融負債支付的任何利息,並計入收益表中的“融資收入”或“融資支出”項目。 公平值按附註19所述方式釐定。
其他金融負債包括以下項目:
| · | 借貸初步按公平值扣除發行工具直接應佔之任何交易成本確認。 該等計息負債其後使用實際利率法按攤銷成本計量,以確保 至償還期間的任何利息開支均按綜合 財務狀況表中所列負債結餘的固定利率計算。在此背景下,利息支出包括初始交易成本和贖回時應付的溢價, 以及負債未償還時應付的任何利息或息票。 |
| · | 以低於市場利率的優惠條款收取的政府貸款按市場利率貼現。 貸款現值與所得款項之間的差額在遞延收入中作為政府補助金持有,並按照資產或支出在收益表中確認的時間,撥入研發支出或補助金收入。 |
| · | 貿易應付款項及其他短期貨幣負債初步按公平值確認,其後採用實際利率法按攤銷 成本列賬。 |
股本
本集團發行的金融工具僅在不符合金融負債或金融資產定義的情況下分類為權益 。集團現有兩類股份 :
| · | 英鎊普通股各分類為權益工具; |
| · | 每股面值1英鎊的遞延股份分類為權益工具。 |
| F-35 |
| 《目錄》 |
| 1 | 會計政策(續) |
退休福利:定額繳款計劃
定額供款退休金計劃之供款於相關年度於 綜合全面收益表扣除。
條文
當本集團因過往事件而承擔現有責任(法定 或推定);履行該責任可能需要 體現經濟利益的資源流出,且能夠可靠估計該責任的金額時,則會確認撥備。
本集團設有多項以權益結算、以股份為基礎的薪酬 計劃,根據該計劃,實體從僱員處獲得服務,作為本集團權益工具(購股權)的代價。為換取授出購股權而獲得的僱員服務的公平值確認為開支。將支銷的總額 乃參考已授出購股權的公平值釐定:
| · | 包括任何市場表現條件(包括股價); |
| · | 不包括任何服務和非市場績效歸屬條件的影響(例如,在指定時間段內仍為實體的僱員 );以及 |
| · | 包括任何非歸屬條件的影響(例如要求僱員儲蓄)。 |
非市場表現和服務條件包含在 關於預期歸屬購股權數量的假設中。總開支於歸屬期內確認,歸屬期為 所有指定歸屬條件將獲達成的期間。如果歸屬條件因 特定事件(如控制權變更或首次公開發行)的發生而加速,則該剩餘未歸屬費用 加速計入損益表。
| F-36 |
| 《目錄》 |
| 1 | 會計政策(續) |
以股份為基礎的付款(續)
此外,在某些情況下,僱員可能在授出日期之前 提供服務,因此,為確認服務開始期至授出日期之間的 期間內的開支,估計授出日期的公允價值。
於各報告期末,本集團根據非市場歸屬條件修訂其對預期歸屬購股權數目的估計 。其於收益表確認修訂 對原估計(如有)的影響,並對權益作出相應調整。當期權被行使時, 公司發行新股。已收所得款項扣除任何直接應佔交易成本後計入股本(面值 )及股份溢價。
租契
識別租賃
當本集團在一段時間內轉讓使用資產的權利以換取代價時,將合約或合約的一部分入賬為 租賃。租賃是指滿足 以下標準的合同:
(a)有一項已確定的資產;
(b)本集團從 使用該資產中獲得幾乎所有的經濟利益;以及
(c)本集團有權直接使用該資產。
本集團考慮供應商是否擁有實質性替代權 。如果供應商確實享有該等權利,則該合同不被認定為產生租賃。
在確定本集團是否從使用該資產中獲得幾乎所有的經濟利益時,本集團僅考慮使用該資產產生的經濟利益,而不考慮附帶的法律所有權或其他潛在利益。
在確定本集團是否有權直接使用該資產時,本集團會考慮其是否在整個使用期間內指示該資產的使用方式及用途。如果由於資產的性質而預先確定,因此沒有 重大決策需要作出,則本集團考慮其是否以預先確定資產在整個使用期間的使用方式和用途的方式參與了資產的設計。如果 合同或合同的一部分不符合這些標準,本集團應用其他適用的國際財務報告準則而非國際財務報告準則第16號。
| F-37 |
| 《目錄》 |
| 1 | 會計政策(續) |
所有租賃均通過確認使用權資產及 租賃負債入賬,惟下列情況除外:
| · | 低價值資產租賃;以及 |
| · | 租期為12個月或以下的租賃。 |
租賃負債按租賃期內應付出租人的合同 付款現值計量,貼現率參考本集團於租賃開始時的增量借款 利率釐定。
使用權資產初始按租賃負債金額計量,並就已收到的任何租賃優惠作出扣減,並就租賃開始時或之前作出的租賃付款增加。 集團已利用實際權宜方法忽略了將非租賃部分分開的要求,而是將 整個合同作為單個租賃入賬。
初始計量後,租賃負債因 按固定利率對未償還餘額收取利息而增加,並因租賃付款而減少。使用權資產按直線法在剩餘租賃期內攤銷 。
當本集團修訂其對任何租賃年期的估計(例如,因為 重新評估承租人延期或終止選擇權被行使的可能性)時,本集團調整租賃負債的賬面值 ,以反映在修訂年期內將作出的付款,並使用修訂貼現率貼現。對使用權資產的賬面值進行等同 調整,經修訂的賬面值在剩餘 (經修訂)租賃期內攤銷。倘使用權資產之賬面值調整至零,則任何進一步減少將於損益確認。
租賃活動的性質(以承租人身份)
於2022年12月31日,本集團於英國有一份物業租賃。
| F-38 |
| 《目錄》 |
| 1 | 會計政策(續) |
税收
税項於全面收益表確認,惟 確認為其他全面收益之收入及開支項目或直接於權益確認 之項目所應佔費用亦分別於其他全面收益或直接於權益確認。
本期所得税抵免是根據税率 以及報告日期前本公司經營和產生 收入所在國家已頒佈或實質頒佈的法律計算的。
遞延納税
倘綜合財務狀況表內資產或負債的賬面值 與其税基不同,則會確認遞延税項資產及負債,惟因下列原因產生的差異 除外:
| · | 商譽的初始確認; |
| · | 在不屬於企業合併的交易中對資產或負債的初始確認,且在交易發生時 不影響會計利潤或應納税利潤;以及 |
| · | 於附屬公司及共同控制實體之投資,而本集團可控制差額撥回之時間 且差額在可見將來可能不會撥回。 |
遞延税項資產的確認僅限於 可能有應課税溢利以抵銷差額的情況。
資產或負債的金額採用報告日期前已頒佈或實質頒佈的税率 釐定,且預期在遞延税項資產或負債 收回或清償時適用。
財產、廠房和設備
物業、廠房及設備按成本值列賬,扣除累計 折舊及累計減值虧損。
所有物業、廠房及設備項目均會計提折舊 ,以於其預期可使用經濟年期內撇銷其賬面值。按以下費率提供:
| 固定裝置及配件 | – |
| 租賃權改進 | – |
| 計算機設備 | – |
| 實驗室設備 | – |
| 使用權資產 | – |
| F-39 |
| 《目錄》 |
| 2 | 關鍵會計估計和判斷 |
編制該等綜合財務報表需要 本集團作出估計、假設及判斷,而該等估計、假設及判斷會對本集團於各自財務報表日期的資產及負債額、收入及開支及或有資產及負債的相關披露產生重大影響。 本集團根據過往經驗及我們認為在當時情況下屬合理的其他各種因素作出估計、假設及判斷。在不同的假設或條件下,實際結果可能與這些估計值不同。管理層定期評估估計、假設和判斷,並做出相應更改,並與董事會討論關鍵會計估計。
以下是被認為是關鍵會計估計:
商譽和尚未投入使用的無形資產的減值
尚未準備使用的商譽及無形資產於年終在現金產生單位層面進行減值測試 若發生事件或情況變化,則於年度測試之間進行減值測試 現金產生單位的公允價值極有可能低於其賬面價值。這些事件或情況 可能包括業務環境、法律因素、經營業績指標、競爭或報告單位相當一部分的出售或處置的重大變化 。
每項現金產生單位或資產的公允價值均採用損益法、折現現金流量法進行估計。這一分析需要做出重大判斷,包括對未來 現金流的估計,這取決於內部預測,包括收入和開發成本,對業務的長期增長率的估計,對現金流發生的使用年限的估計,以及對我們的加權平均資本成本的確定。
截至2022年12月31日,商譽的賬面價值為GB Nil(2021:GB Nil;2020: GB Nil),尚未準備使用的無形資產為GB Nil(2021:GB Nil;2020:GB Nil)(附註11)。
用於計算現金產生單位的公允價值的估計值根據經營業績和市場狀況每年發生變化。該等估計及假設的變動可能會對每個該等單位的公允價值及商譽減值的釐定產生重大影響。
2020年3月,專家組進行了一次戰略審查,以根據現有資源重新評估其優先事項。董事會的結論是,本公司不太可能完成許可交易或籌集足夠資金以及時繼續對MTD201進行所需的剩餘投資。因此,董事會決定立即終止MTD201計劃的進一步內部開發,並根據該決定關閉公司在畢爾巴鄂的MTD201專用製造工廠,併為所有42名員工提供裁員。由於決定終止此計劃,本集團於截至2020年12月31日止年度確認商譽減值費用230萬英磅,以及計入Midatech Pharma(Wales)Ltd現金產生單位國際財務報告減值費用 930萬英磅。見附註12。
於2020年6月,本集團收到本集團MTX110開發計劃的有效成分Panobinostat的許可方Secura Bio Inc.的函件,聲稱終止本公司的牌照。 由於此項聲稱終止,本集團於截至2020年12月31日的年度就收購的與MTX110有關的IPRD確認減值費用80萬英磅。見附註11。
| F-40 |
| 《目錄》 |
| 2 | 主要會計估計及判斷(續) |
基於股份的支付
本集團根據國際財務報告準則第2號以股份為基礎的付款對僱員的以股份為基礎的付款交易進行會計處理,該準則要求根據授出日期獎勵的公允價值,計量為換取 普通股購股權而獲得的僱員服務成本。
董事選擇柏力克—舒爾斯—默頓期權定價模式 作為在不存在市場條件的情況下釐定股份獎勵的估計公平值的最合適方法。對於包括與我們普通股市場表現相關的歸屬條件的基於表現的 期權,使用了蒙特卡洛定價模型 ,以反映必須滿足作為歸屬條件的價格障礙的估值影響。
股權激勵獎勵產生的成本在獎勵的必要服務期(通常為歸屬期)內確認為開支 。補償開支於歸屬期間 以直線法確認,並於綜合全面收益表分類。
估計以股份為基礎的付款交易的公平值所用的假設於綜合財務報表附註25披露,估計如下:
| · | 波動率是根據生物科技行業若干上市同業公司的平均年化波動率估計的; |
| · | 期權的估計壽命估計為至第一個行使期,通常為期權 歸屬後的一個月;及 |
| · | 股息回報是參考我們過往的股息支付而估計的。目前,由於前期沒有支付股息 ,因此估計為零。 |
| F-41 |
| 《目錄》 |
| 2 | 主要會計估計及判斷(續) |
金融負債
按公平值計入損益(“按公平值計入損益”)。
本集團在本公司普通股股本中有尚未行使的認股權證。行使時將發行的普通股數量是固定的,但行使價以美元計值, 與母公司的功能貨幣不同。因此,認股權證分類為權益結算衍生工具 金融負債,並按公平值計入損益表確認。
金融負債採用蒙特卡洛 模型或布萊克—斯科爾斯期權定價模型估值。按公平值計入損益之金融負債按公平值列賬,重新計量產生之任何收益或虧損 於損益確認。於損益中確認的收益或虧損淨額包括就 金融負債支付的任何利息,並計入收益表中的“融資收入”或“融資支出”項目。 公平值按附註19所述方式釐定。
以下被視為關鍵會計判斷:
收入
提供研究和開發服務
確認服務提供收入時涉及重大管理層判斷和估計 。服務收入於合約期內按 整體履行履約責任(本集團提供的服務)的進度按比例確認,並按 至今已產生的成本(總估計成本)計算。公司的研發合作協議要求在12個月內交付服務。
所得税
遞延税項資產確認未使用税項虧損的範圍為: 有可能有應課税溢利可用來抵銷虧損。須作出判斷,以根據可能的時間及未來應課税溢利的水平,連同未來的税務籌劃策略,釐定可確認的遞延税項資產金額。
在2022年,大約有1 GB
| F-42 |
| 《目錄》 |
| 2 | 主要會計估計及判斷(續) |
持續經營的企業
在過去幾年中,隨着其投資組合的發展,我們在經營活動中使用的現金出現了淨虧損和大量現金外流。截至2022年12月31日止年度,本集團於GB
我們未來的生存能力取決於我們是否有能力從融資活動中籌集現金,為我們的開發計劃提供資金,直到商業化,從運營活動中產生現金,併成功 獲得監管部門的批准,允許我們的開發產品營銷。我們未能在需要時籌集資金,可能會對我們的財務狀況和執行業務戰略的能力產生負面影響。
我們的綜合財務報表已按持續經營基準呈列,預期於正常業務過程中變現資產及清償負債。
截至2022年12月31日,我們的現金和現金等價物為
GB
我們已經準備了現金流預測,並考慮了公司未來三年的現金流需求 ,包括自財務報表批准之日起的12個月期間。 這些預測表明,假設某些開發計劃和其他經營活動繼續按當前計劃進行,未來12個月將需要進一步融資。
在我們看來,小微市值生物科技公司的融資環境與2008-2010年金融危機以來的環境一樣具有挑戰性。雖然這可能帶來與其他融資渠道有限或沒有融資渠道的公司的收購和/或合併機會,但Biodexa的任何隨之而來的融資可能會稀釋 。我們和我們的顧問繼續評估融資選擇,包括與收購和/或合併相關的融資選擇,包括融資以及與本公司的資產和技術合作。正在考慮的替代方案 均處於早期階段,並取決於交易對手的同意,因此,不能保證任何為本公司融資的替代方案 將會成功。短期內需要額外融資的這一要求代表着一種重大的不確定性,可能會讓人對我們作為一家持續經營的企業繼續下去的能力產生重大懷疑。如果在現金資源 耗盡之前,公司在未來明顯沒有可採取行動的現實融資選擇,則公司將不再是一家持續經營的公司。在這種情況下,我們將不再能夠根據《國際會計準則1》第25段編制財務報表 。相反,財務報表將在清算的基礎上編制,資產將按可變現淨值列報,所有負債將加速轉為流動負債。由於上述原因,我們的獨立註冊會計師事務所在其截至2022年12月31日及截至2022年12月31日的年度的財務報表報告中就這一不確定性作出了一段説明。
吾等相信有足夠的選擇和時間為貴公司爭取 額外融資,經考慮不確定因素後,吾等認為在編制該等財務資料時繼續採用 持續經營基準是適當的。
我們作為一家持續經營企業的能力取決於我們獲得額外資本和/或處置資產的能力,我們無法保證我們能夠及時、以 優惠條件或根本無法做到這一點。
| F-43 |
| 《目錄》 |
| 3 | 收入 |
與客户簽訂合同的收入
按客户目的地劃分的收入地域分析
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 收入: | ||||||||||||
| 英國 | ||||||||||||
| 比利時 | ||||||||||||
| 世界其他地區 | ||||||||||||
於二零二二年、二零二一年及二零二零年,所有收益均來自銷售服務。 這完全源自公司的研發合作協議。其在合同期內按 整體履行履約義務的進度按比例確認。
| 合同資產 | 合同債務 | |||||||||||||||||||||||
2022 £’000 | 2021 £’000 | 2020 £’000 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||||||||||||
| 在1月1日 | ( | ) | ||||||||||||||||||||||
| 期內從合同資產轉入應收賬款 | ( | ) | ||||||||||||||||||||||
| 期內確認為收益的合約負債所包括的金額 | ( | ) | ||||||||||||||||||||||
| 確認收入超過現金的部分 | ||||||||||||||||||||||||
| 期內未確認為收入的現金 | ( | ) | ( | ) | ||||||||||||||||||||
| 12月31日 | ( | ) | ( | ) | ||||||||||||||||||||
本公司的研發合作協議是為了在未來12個月內交付 服務,IFRS15第121(a)段中的實際權宜之計適用。
於二零二二年,所有收益均來自1名客户(二零二一年:1名客户;二零二零年: 3名客户)。
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 客户A | % | % | % | |||||||||
| 客户B | % | |||||||||||
| 客户C | % | |||||||||||
本集團包含一個可報告經營分部,管道研發(“管道研發”)。該部門尋求使用集團的納米醫學和持續釋放 技術平臺開發產品。分類報告所需的所有對賬均載於主要報表。
可報告分部的會計政策與 附註1所述的本集團會計政策一致。
| F-44 |
| 《目錄》 |
| 4 | 運營虧損 |
注意事項 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||||||
| 經營虧損已扣除╱(計入): | ||||||||||||||||
| 財產、廠房和設備折舊 | ||||||||||||||||
| - 研發成本 | 9 | |||||||||||||||
| - 行政費用 | 9 | |||||||||||||||
| 使用權資產折舊 | ||||||||||||||||
| - 研發成本 | 9 | |||||||||||||||
| - 行政費用 | 9 | |||||||||||||||
| 無形資產攤銷—軟件 | ||||||||||||||||
| - 研發成本 | 11 | |||||||||||||||
| - 行政費用 | 11 | |||||||||||||||
| 無形資產減值準備 | 11 | |||||||||||||||
| 金融資產減值 | 14 | |||||||||||||||
| 貸款協議未來損失準備金 | 18 | |||||||||||||||
| 應付公司審計師審計母公司財務報表的費用 | ||||||||||||||||
| 應付本公司核數師審計附屬財務報表的費用 | ||||||||||||||||
| 應付本公司核數師的費用: | ||||||||||||||||
| —與審計有關的服務 | ||||||||||||||||
| 應支付給本公司前任審計師的母公司財務報表審計費用 | ||||||||||||||||
| 應支付給本公司前任審計師的費用: | ||||||||||||||||
| — 核數相關服務 | ||||||||||||||||
| 匯兑損失 | ||||||||||||||||
| 出售物業、廠房及設備之溢利╱(虧損) | ( | ) | ( | ) | ||||||||||||
| 以權益結算以股份為基礎的付款 * | ( | ) | ||||||||||||||
| * |
| F-45 |
| 《目錄》 |
| 5 | 員工成本 |
員工成本(包括董事)包括:
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 工資和薪金 | ||||||||||||
| 固定繳款退休金成本(附註24) | ||||||||||||
| 社會保障繳費和類似税種 | ||||||||||||
| 基於股份的支付費用/(信用) | ( | ) | ||||||||||
| 員工成本毛利 | ||||||||||||
員工數量
集團在本財政年度僱用的平均員工人數為:
| 2022 | 2021 | 2020 | ||||||||||
| 研發 | ||||||||||||
| 一般事務及行政事務 | ||||||||||||
關鍵管理人員薪酬
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 短期員工福利 | ||||||||||||
| 離職後福利 | ||||||||||||
| 離職福利 | ||||||||||||
| 股份支付 | ( | ) | ||||||||||
| *總計 | ||||||||||||
於本年度內,概無董事行使購股權(2021年:無,2020年:無)。
於本年度內,並無董事(2021:1;2020:2)參與固定繳款退休金計劃。上述説明中的養卹金繳款包括首席科學幹事的繳款。
| F-46 |
| 《目錄》 |
| 6 | 財務收支 |
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 財政收入 | ||||||||||||
| 銀行存款利息 | ||||||||||||
| 權益結算衍生金融負債收益 | ||||||||||||
| 財政總收入 | ||||||||||||
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 財務費用 | ||||||||||||
| 租賃負債利息支出 | ||||||||||||
| 其他貸款 | ||||||||||||
| 以權益結算的衍生金融負債虧損 | ||||||||||||
| 財務費用總額 | ||||||||||||
於二零二二年、二零二一年及二零二零年,以權益結算衍生金融負債 之收益╱(虧損)乃由於股價變動而產生(附註19)。
| F-47 |
| 《目錄》 |
| 7 | 税收 |
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 當期税收抵免 | ||||||||||||
| 計入損益表的當期税款 | ||||||||||||
| 有關外國附屬公司的應付税項 | ( | ) | ||||||||||
| 上一年度調整數 | ||||||||||||
| 當期税收抵免 | ||||||||||||
| 遞延税額抵免 | ||||||||||||
| 撥回暫時性差額人民 | ||||||||||||
| 税收抵免共計 | ||||||||||||
年度實際税款支出與英國公司税率(適用於年度虧損)之間差異的原因如下:
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 税前虧損 | ( | ) | ( | ) | ( | ) | ||||||
| 預期税項抵免按英國企業税標準税率19%(二零二一年:19%;二零二零年:19%)計算。 | ( | ) | ( | ) | ( | ) | ||||||
| 為税務目的不能扣除的費用 | ||||||||||||
| 不應納税的收入 | ( | ) | ( | ) | ( | ) | ||||||
| 前期調整數 | ( | ) | ( | ) | ||||||||
| 退還研發退税的税務損失 | ( | ) | ( | ) | ( | ) | ||||||
| 未確認遞延税項 | ||||||||||||
| 計入損益表的税款總額 | ( | ) | ( | ) | ( | ) | ||||||
税收抵免產生於相應期間的強化研發 税收抵免。
已於二零二二年就前期 確認調整7,000英鎊(二零二一年:零英鎊;二零二零年:158,000英鎊),這是由於 向HMRC提交報税表前對成本分類進行了更詳細的審查。
| F-48 |
| 《目錄》 |
| 8 | 每股虧損 |
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 分子 | ||||||||||||
| 基本每股收益及攤薄每股收益所用虧損: | ||||||||||||
| 持續運營 | ( | ) | ( | ) | ( | ) | ||||||
| 分母 | ||||||||||||
| 基本每股收益所用普通股加權平均數: | ||||||||||||
| 每股基本虧損和攤薄虧損: | ||||||||||||
| 持續經營—£ | ( | ) | ( | ) | ( | ) | ||||||
在2023年3月24日的股東大會上,股東批准了
公司
本集團於本年度及過往年度均錄得虧損,因此 購股權及認股權證具反攤薄作用。因此,每股攤薄盈利於所有所示期間按相同基準呈列。
| F-49 |
| 《目錄》 |
| 9 | 財產、廠房和設備 |
固定裝置 和配件 £’000 | 租賃權 改進 £’000 | 電腦 裝備 £’000 | 實驗室 裝備 £’000 | 使用權 資產 £’000 |
總計 £’000 | |||||||||||||||||||
| 成本 | ||||||||||||||||||||||||
| 在2020年1月1日 | ||||||||||||||||||||||||
| 加法 | ||||||||||||||||||||||||
| 修改租約條款的效果 | ( | ) | ( | ) | ||||||||||||||||||||
| 處置 | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||
| 匯兑差異 | ||||||||||||||||||||||||
| 2020年12月31日 | ||||||||||||||||||||||||
| 加法 | ||||||||||||||||||||||||
| 轉接 | ( | ) | ||||||||||||||||||||||
| 修改租約條款的效果 | ( | ) | ( | ) | ||||||||||||||||||||
| 處置 | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||
| 在2021年12月31日 | ||||||||||||||||||||||||
| 加法 | ||||||||||||||||||||||||
| 轉移到無形資產 | ( | ) | ( | ) | ||||||||||||||||||||
| 處置 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||||||
| 在2022年12月31日 | ||||||||||||||||||||||||
固定裝置 和配件 £’000 | 租賃權 改進 £’000 | 電腦 裝備 £’000 | 實驗室 裝備 £’000 | 使用權 資產 £’000 |
總計 £’000 | |||||||||||||||||||
| 累計折舊 | ||||||||||||||||||||||||
| 在2020年1月1日 | ||||||||||||||||||||||||
| 按年收費 | ||||||||||||||||||||||||
| 處置 | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||
| 匯兑差異 | ||||||||||||||||||||||||
| 2020年12月31日 | ||||||||||||||||||||||||
| 轉接 | ( | ) | ||||||||||||||||||||||
| 按年收費 | ||||||||||||||||||||||||
| 處置 | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||
| 在2021年12月31日 | ||||||||||||||||||||||||
| 轉移到無形資產 | ( | ) | ( | ) | ||||||||||||||||||||
| 按年收費 | ||||||||||||||||||||||||
| 處置 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||||||
| 在2022年12月31日 | ||||||||||||||||||||||||
| 賬面淨值 | ||||||||||||||||||||||||
| 在2022年12月31日 | ||||||||||||||||||||||||
| 在2021年12月31日 | ||||||||||||||||||||||||
| 2020年12月31日 | ||||||||||||||||||||||||
於12月31日,使用權資產包括租賃物業裝修485,000英鎊(二零二一年:619,000英鎊;二零二零年:76,000英鎊)及實驗室設備2,000英鎊(二零二一年:44,000英鎊;二零二零年:零英鎊)。
2022年1月1日,先前在計算機設備中披露的軟件被轉移 至無形資產。
| F-50 |
| 《目錄》 |
| 10 | 租契 |
| 租賃負債 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||
| 在1月1日 | ||||||||||||
| 加法 | ||||||||||||
| 轉接 | ||||||||||||
| 修改租約條款的效果 | ( | ) | ( | ) | ||||||||
| 利息支出 | ||||||||||||
| 租賃費 | ( | ) | ( | ) | ( | ) | ||||||
| 匯兑差異 | ||||||||||||
| 12月31日 | ||||||||||||
使用權資產在附註9中披露。
2021年4月,該集團簽署了一項協議,租賃位於威爾士加的夫的新辦公場所作為其公司辦公室和實驗室的辦公場所。租賃協議允許本集團於二零二一年八月租約完成及入夥前進行甲類工程及裝修。達成的租約期限為5年,沒有任何中斷條款。租賃 於2021年被確認為使用權資產。於2021年確認使用權資產及相應的租賃負債為非現金投融資交易。
2021年5月,本集團發出通知終止其位於加的夫的歷史建築的物業租賃。租約需要提前6個月通知。
於2020年,由於本集團在西班牙的業務關閉,兩份物業租賃提前終止,這對使用權資產和租賃負債都產生了影響。
低價租賃費用(年):
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 耗用的低價值租賃 | ||||||||||||
2022年租賃現金流出總額為GB 181k(2021年:GB 114k;2020年:GB 115k)。
| F-51 |
| 《目錄》 |
| 11 | 無形資產 |
正在進行中 £’000 | 商譽 £’000 | IT/網站 £’000 | 總計 £’000 | |||||||||||||
| 成本 | ||||||||||||||||
| 在2020年1月1日 | ||||||||||||||||
| 處置 | ( | ) | ( | ) | ||||||||||||
| 外匯 | ||||||||||||||||
| 2020年12月31日 | ||||||||||||||||
| 在2021年12月31日 | ||||||||||||||||
| 從財產、廠房和設備轉移 | ||||||||||||||||
| 處置 | ( | ) | ( | ) | ||||||||||||
| 在2022年12月31日 | ||||||||||||||||
正在進行中 研究和 發展 £’000 | 商譽 £’000 | IT/網站 費用 £’000 | 總計 £’000 | |||||||||||||
| 累計攤銷和減值 | ||||||||||||||||
| 在2020年1月1日 | ||||||||||||||||
| 本年度攤銷費用 | ||||||||||||||||
| 處置 | ( | ) | ( | ) | ||||||||||||
| 減損 | ||||||||||||||||
| 外匯 | ||||||||||||||||
| 2020年12月31日 | ||||||||||||||||
| 在2021年12月31日 | ||||||||||||||||
| 本年度攤銷費用 | ||||||||||||||||
| 從財產、廠房和設備轉移 | ||||||||||||||||
| 處置 | ( | ) | ( | ) | ||||||||||||
| 在2022年12月31日 | ||||||||||||||||
| 賬面淨值 | ||||||||||||||||
| 在2022年12月31日 | ||||||||||||||||
| 在2021年12月31日 | ||||||||||||||||
| 2020年12月31日 | ||||||||||||||||
| F-52 |
| 《目錄》 |
| 11 | 無形資產(續) |
2020年,就MTX110上的收購 IPRD記錄了80萬英鎊的減值支出。該減值乃由於本公司與Secura Bio Inc.(“Secura Bio Inc.”)終止一項許可協議所致。根據 許可協議,Midatech Limited獲得了帕比司他(公司開發產品MTX 110的活性藥物成分)的某些專利的非獨家全球性、可分許可的許可。
| 12 | 減損測試 |
由於董事會決定於2020年3月終止其MTD201計劃
,
| 13 | 附屬公司 |
於二零二二年十二月三十一日,本公司之附屬公司(全部為直接或透過附屬公司(如所示)擁有100%權益),並已根據編制基準及綜合附註1所載之詳情 計入本財務報表,詳情如下:
| 名字 | 已註冊 辦公室 | 性質: 業務 | 備註 | |||
| (A)(B) | ||||||
CF10 4DQ | ||||||
CF10 4DQ |
備註:
| (a) |
| (b) |
| F-53 |
| 《目錄》 |
| 14 | 貿易和其他應收款 |
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 應收貿易賬款 | ||||||||||||
| 提前還款 | ||||||||||||
| 其他應收賬款 | ||||||||||||
| 貿易和其他應收賬款總額 | ||||||||||||
| 減:非當前部分 | ||||||||||||
| 當前部分 | ||||||||||||
本集團已應用國際財務報告準則第15號允許的可行權宜方法,不披露 分配至截至報告期末未履行(或部分未履行)履約責任的交易價格 ,因為合約的原始預期期限通常為一年或以下。
於二零二二年、二零二一年及二零二零年十二月三十一日,賬面值與公允值相若。
預期信用損失
鑑於本集團的貿易應收賬款和應計收入( 主要應收大型國內或跨國公司)的短期性質,本集團對預期信貸損失的評估包括為特定客户和合同現金流被視為存在風險的應收賬款準備 。考慮因素包括當前的經濟環境 以及歷史和前瞻性信息。考慮該等事項時並無應用任何假設或估計技術。 額外的準備金是根據對超過一年的賬齡應收款的可收回性的評估(如果沒有足夠的可收回性證據)作出的。
貿易及其他應收款項於二零二二年包含一項減值資產,詳情見下文。於二零二一年及二零二零年,貿易及其他應收款項並無包含減值資產。誠如上文詳述,本集團於二零二二年持有一項資產的抵押品,於二零二一年及二零二零年並無持有任何抵押品作為抵押品。於 綜合財務狀況表日期的最大信貸風險為各類應收款項的公允價值。
當交易對手宣佈 他們有有限的資源來償還債務時,本公司確認金融資產的違約。
| F-54 |
| 《目錄》 |
| 14 | 應收賬款及其他應收款項(續) |
Bioasis貸款
於二零二二年十二月十三日,本公司與Bioasis Technologies Inc(“Bioasis”)訂立安排協議,據此,本公司將收購Bioasis全部已發行股本,所訂立的協議 須經股東批准方可作實。除此之外,於2022年12月19日,本公司與Biasis訂立了一份承兑票據 及擔保協議,以在短期內協助解決Biasis的營運資金需求。根據該協議 ,本公司同意分三批預付Bioasis最多750,000美元,分別於二零二二年十二月十九日、二零二三年一月三日及二零二三年二月六日支付。 貸款應於下列日期中最早者償還:
| a) | 違約事件的發生; |
| b) | 截止日期(定義見 擬議收購Bioasis的安排協議);或 |
| c) | 2023年6月30日 |
承兑票據須按相等於每月2%的利率計息,或自Bioasis到期日起及之後按每年15%的違約利率計息。根據擔保協議,本公司成為有擔保債權人。
截至二零二二年十二月三十一日止年度,本公司向Bioasis墊款250,000美元。2023年1月3日,又向Biasis預付了25萬美元。管理層認為收回債務並不確定,因此 已於年內就2022年12月向Bioasis作出的墊款確認減值撥備207,000英鎊。
2023年2月3日,Bioasis宣佈,他們正在“緊急探索 和評估所有可能用於解決其流動性需求的融資和戰略替代方案”,這引發了 違約事件。因此,該協議項下的第三筆付款並未於年末期間支付。於二零二三年三月五日,Bioasis獲送達違約事件通知。
| F-55 |
| 《目錄》 |
| 15 | 現金及現金等價物及現金流量證明 |
就綜合現金流量表而言,現金及現金等價物 包括:
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 銀行存款可隨時取用 | ||||||||||||
於二零二二年、二零二一年及二零二零年,股權融資交易產生現金流入, 計入現金流量表中的融資活動。作為二零二二年十二月股權交易的一部分,已發行價值為零英鎊(二零二一年七月:零英鎊;二零二零年五月:100萬英鎊)的認股權證,詳情見附註19。
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 總收益 | ||||||||||||
| 交易成本 | ( | ) | ( | ) | ( | ) | ||||||
| 發行股份所得款項 | ||||||||||||
年內,貸款及借款因融資活動而產生以下變動 :
非當前 £’000 | 當前 £’000 | 總計 £’000 | ||||||||||
| 在2022年1月1日 | ||||||||||||
| 現金流 | ( | ) | ( | ) | ||||||||
| 非現金流量: | – | – | – | |||||||||
| 分類為非流動貸款及借貸於二零二一年十二月三十一日變為流動 | ( | ) | ||||||||||
| 綜合全面收益表內之財務收入收益╱(虧損) | ( | ) | ( | ) | ||||||||
| 期間應計利息 | ||||||||||||
| 在2022年12月31日 | ||||||||||||
| F-56 |
| 《目錄》 |
| 15 | 現金及現金等價物及現金流量附註(續) |
非當前 £’000 | 當前 £’000 | 總計 £’000 | ||||||||||
| 在2021年1月1日 | ||||||||||||
| 現金流 | ( | ) | ( | ) | ||||||||
| 非現金流量: | ||||||||||||
| 外匯交易 | ( | ) | ( | ) | ||||||||
| 新租約 | ||||||||||||
| 租賃期修改的影響—IFRS 16 | ( | ) | ( | ) | ||||||||
| 分類為非流動貸款及借貸於二零二零年十二月三十一日成為流動 | ( | ) | ||||||||||
| 認股權證行使時轉撥至股份溢價 | ( | ) | ( | ) | ||||||||
| 於綜合全面收益表內於財務收入確認之收益╱(虧損) | ( | ) | ( | ) | ||||||||
| 期間應計利息 | ||||||||||||
| 在2021年12月31日 | ||||||||||||
非當前 £’000 | 當前 £’000 | 總計 £’000 | ||||||||||
| 在2020年1月1日 | ||||||||||||
| 現金流 | ( | ) | ( | ) | ( | ) | ||||||
| 非現金流量: | ||||||||||||
| 外匯交易 | ||||||||||||
| 公允價值變動 | ||||||||||||
| 租賃期修改的影響—IFRS 16 | ( | ) | ( | ) | ||||||||
| 將部分政府貸款重新分類為非流動貸款 | ( | ) | ||||||||||
| 已發行的認股權證 | ||||||||||||
| 認股權證行使時轉撥至股份溢價 | ( | ) | ( | ) | ||||||||
| 於綜合全面收益表內於財務收入確認之收益╱(虧損) | ||||||||||||
| 期間應計利息 | ( | ) | ( | ) | ( | ) | ||||||
| 2020年12月31日 | ||||||||||||
| F-57 |
| 《目錄》 |
| 16 | 貿易和其他應付款 |
| 當前 | 2022 £’000 | 2021 £’000 | 2020 £’000 | |||||||||
| 貿易應付款 | ||||||||||||
| 其他應付款 | ||||||||||||
| 應計項目 | ||||||||||||
| 金融負債總額,不包括貸款和借款,歸類為按攤銷成本計量的金融負債 | ||||||||||||
| 税收和社會保障 | ||||||||||||
| 遞延收入 | ||||||||||||
| 貿易和其他應付款項總額 | ||||||||||||
於二零二二年、二零二一年及二零二零年十二月三十一日,賬面值與公允值相若。
所有當前貿易及其他應付款均須在上述期末 日期後3個月內支付。
| F-58 |
| 《目錄》 |
| 17 | 借款 |
2020 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 當前 | ||||||||||||
| 租賃負債 | ||||||||||||
| 政府和研究貸款 | ||||||||||||
| 總計 | ||||||||||||
| 非當前 | ||||||||||||
| 租賃負債 | ||||||||||||
| 總計 | ||||||||||||
2021年,償還了10.3萬英鎊(2020年:620萬英鎊)的歐元計價政府和研究貸款。此金額包括零英鎊(二零二零年:120萬英鎊)的政府補助,其已計入附註16披露的金額 。該金額按年終匯率換算為107,000英鎊(二零二零年:480萬英鎊)。
於二零二二年、二零二一年及二零二零年十二月三十一日,賬面值與公允值相若。
融資租賃項下的債務由與其相關的固定資產的固定押記作為擔保 。
西班牙政府貸款
MPE此前有四筆西班牙政府貸款,其中三筆已於2020年償還, 最後一筆貸款於2021年2月償還,然後於MPE清盤前償還。
其中三筆貸款用於資助研究、技術創新和實驗室建設。該等貸款為利率低於市場利率的定期貸款,且須於截至二零二四年的期間內償還 。由於本集團於2020年3月31日決定終止 MTD201的進一步內部開發以及隨後關閉其在畢爾巴鄂的專用生產設施,其中兩筆貸款已於2020年償還,最後一筆貸款已於2021年償還。
MPE於2019年9月收到的第四筆貸款為歐元
如果無法按計劃償還貸款,貸款將帶有違約利率 。在初步確認時,貸款按市場利率貼現,信貸在 遞延收入內歸類為贈款。遞延贈款收入在確認支出的期間在研究和開發成本內計入綜合全面收益表。
政府貸款的遞延收入部分在附註16中指定為遞延收入和政府贈款,貸款的合同償還總額在附註20中披露。由於償還了貸款 ,這些貸款已於2020年全額攤銷。
| F-59 |
| 《目錄》 |
| 18 | 條文 |
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 1月1日的期初準備金 | ||||||||||||
| 糧食的使用情況 | ( | ) | ( | ) | ||||||||
| 本年度確認的撥備 | ||||||||||||
| 12月31日 | ||||||||||||
| 減:非當前部分 | ( | ) | ||||||||||
| 當前部分 | ||||||||||||
截至2021年12月31日和2020年12月31日的撥備是管理層對2021年第四季度騰出的加的夫辦事處的最佳 估計。這筆債務 已於2022年結清。
Bioasis貸款
於2022年12月19日,本公司與BiOasis訂立本票及擔保協議,以在短期內協助BiOasis滿足營運資金需求。根據協議,公司同意向BiOASS提供高達750,000美元的貸款,分三批於2022年12月19日、2023年1月3日和2023年2月6日支付。 協議條款載於附註14。
在截至2022年12月31日的一年中,該公司向BiOASS預付了250,000美元。2023年1月3日,BiOASIS獲得了250,000美元的進一步預付款。
管理層認為收回債務並不確定,因此已於本年度確認一項減值準備207,000英磅以抵銷於2022年12月向BiOasis預提的減值準備,見附註 14.另一項撥備207,000英磅以抵銷本票所產生的未來信貸損失。
2023年2月3日,BiOASIS宣佈,他們正在緊急探索 ,並評估可能可用於滿足其流動性需求的所有融資和戰略替代方案,這引發了 違約事件。因此,協議規定的第三筆付款沒有在年終後期間支付。2023年3月5日,BiOASIS收到了違約事件的通知。
| F-60 |
| 《目錄》 |
| 19 | 衍生金融負債—流動 |
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 股權結算衍生金融負債 | ||||||||||||
| 在1月1日 | ||||||||||||
| 已發行的認股權證 | ||||||||||||
| 認股權證行使時轉撥至股份溢價 | ( | ) | ( | ) | ||||||||
| (損益)/在綜合全面收益表內確認的財務(收入)/費用 | ( | ) | ( | ) | ||||||||
| 12月31日 | ||||||||||||
股權結算衍生金融負債是指不以現金結算的負債。
2020年5月認股權證
2020年5月,作為在美國註冊直接發售的一部分,本公司發行了477,255份認股權證作為本公司普通股的一部分。行權時將發行的普通股數量是固定的,但行權價格以美元計價,與公司的功能貨幣不同。因此,認股權證被歸類為通過損益表(‘FVTPL’)按公允價值確認的權益結算衍生金融負債。 金融負債採用蒙特卡羅模型進行估值。FVTPL的財務負債按公允價值列報,任何因重新計量而產生的收益或虧損均在損益中確認。在損益中確認的淨收益或虧損包括就財務負債支付的任何利息,並計入 損益表的“財務收入”或“財務費用”項目。公允價值按附註20所述方式釐定。該工具估值的一項關鍵資料是本公司的股價。
2019年10月認股權證
2019年10月,公司發行了157,495份普通股認股權證 ,作為在美國註冊直接發售的一部分。行權時發行的普通股數量是固定的,但行權價格是以美元計價的。該等認股權證分類為權益結算衍生金融負債,其入賬方式與2020年5月發行的權證相同。利用蒙特卡羅模型對財務負債進行估值。
認股權證重新定價
於2022年12月13日,本公司與停戰資本主基金有限公司(“停戰”)訂立證券購買協議,將先前發行予停戰資本主基金有限公司(“停戰基金”)的先前發行的美國存託憑證重新定價至每份美國存託憑證4美元。 重新定價的影響見下表:其餘認股權證的每份美國存託憑證的行使價維持不變 如下:2019年10月的權證按每份美國存託憑證125.00元重新定價;2020年5月的權證按每份美國存託憑證每股41.00元及41.25元重新定價。
| ADR認股權證 | 等值普通股(25股普通股 每股美國存託憑證) | |||||||||||||||
| 數字* | 原價 根據ADS * | 新價格 adr | 數 | |||||||||||||
| 2019年10月ADR認股權證 | $ | $ | ||||||||||||||
| 2020年5月ADR認股權證 | $ | $ | ||||||||||||||
| F-61 |
| 《目錄》 |
| 19 | 衍生金融負債—流動(續) |
認股權證的數目及原價已作出調整,以反映於二零二零年三月二日發生的股份合併 及ADR與普通股比率變動、於二零二二年九月二十六日發生的ADR與普通股比率變動以及於二零二三年三月二十四日發生的股份合併及ADR與普通股比率變動。
DARA認股權證和股票期權
本集團亦就收購DARA Biosciences,Inc. 時承擔全部歸屬認股權證及購股權。(2015年)。行使時將發行的普通股數量是固定的,但 行使價以美元計值。認股權證分類為權益結算衍生金融負債,並以與上文詳述者相同的方式入賬。金融負債採用柏力克—舒爾斯期權定價模式估值。認股權證和期權的行使價分別為61.03美元和95.17美元。於二零二二年,所有剩餘認股權證均已到期。
下表詳列於十二月三十一日尚未行使之普通股認股權證及年內變動:
| 年1月1日 2020 | 授與 | 已鍛鍊 | 31歲 十二月 2020 | 已失效 | 已鍛鍊 | 31歲 十二月 2021 | 已失效 | 31歲 十二月 2022 | ||||||||||||||||||||||||||||
| 2020年5月撥款 | ( | ) | – | ( | ) | – | ||||||||||||||||||||||||||||||
| 10月19日撥款 | – | – | – | – | – | |||||||||||||||||||||||||||||||
| DARA認股權證 | – | – | ( | ) | – | ( | ) | |||||||||||||||||||||||||||||
| DARA選項 | – | – | – | – | – | |||||||||||||||||||||||||||||||
認股權證數目已作出調整,以反映於二零二零年三月二日發生的股份合併及ADR與普通股比率 變動、二零二二年九月二十六日發生的ADR與普通股比率變動 以及二零二三年三月二十四日發生的股份合併及ADR與普通股比率變動。
| F-62 |
| 《目錄》 |
| 20 | 金融工具—風險管理 |
本集團透過其營運面臨以下財務風險:
| · | 信用風險 |
| · | 外匯風險 |
| · | 流動性風險 |
本附註説明本集團管理該等風險的政策及程序。 管理這些風險的政策已由董事會審閲並與之達成一致,但董事會已授權設計和操作 確保有效管理風險的流程。.
主要金融工具
本集團使用的主要金融工具(產生金融工具風險)如下:
| · | 貿易和其他應收款 |
| · | 現金和現金等價物 |
| · | 貿易和其他應付款 |
| · | 應計項目 |
| · | 貸款和借款 |
| · | 衍生金融負債 |
按類別分列的金融工具摘要如下:
金融資產--攤銷成本
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 現金和現金等價物 | ||||||||||||
| 應收貿易賬款 | ||||||||||||
| 其他應收賬款 | ||||||||||||
| 金融資產總額 | ||||||||||||
財務負債--攤銷成本
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 貿易應付款 | ||||||||||||
| 其他應付款 | ||||||||||||
| 應計項目 | ||||||||||||
| 借款 | ||||||||||||
| 財務負債總額--攤銷成本 | ||||||||||||
金融負債-損益公允價值-流動
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 股權結算衍生金融負債 | ||||||||||||
| F-63 |
| 《目錄》 |
| 20 | 金融工具--風險管理(續) |
公允價值層次結構
本集團採用以下層次結構按估值技術確定和披露金融工具的公允價值:
| · | 第1級:相同資產和負債在活躍市場的報價(未調整)價格; |
| · | 第2級:對記錄的公允價值有重大影響的所有投入均可直接或間接觀察到的其他技術;以及 |
| · | 第3級:使用對記錄的公允價值有重大影響但不是基於可觀察市場數據的投入的技術。 |
本集團衍生金融負債的公允價值按 公允價值按經常性基礎計量。下表提供了關於如何確定這一金融負債公允價值的信息, 附註19提供了補充披露:
| 金融負債 | 公允價值 截至 31/12/2022 | 公平 價值 層次結構 | 估值 技術(S) 和密鑰 輸入 | 重大不可察覺 輸入 | 關係 不可觀測的輸入 按公允價值計算 | |||||||
| 權益結算金融衍生負債 | £ | 3級 | ||||||||||
公允價值越高。 | ||||||||||||
| 權益結算金融衍生負債 | £ | 3級 | ||||||||||
公允價值越高。 | ||||||||||||
| 總計 | £ | |||||||||||
| F-64 |
| 《目錄》 |
| 20 | 金融工具--風險管理(續) |
| 金融負債 | 公允價值 截至 31/12/2021 | 公平 價值 層次結構 | 估值 技術(S) 和密鑰 輸入 | 重大不可察覺 輸入 | 關係 不可觀測的輸入 按公允價值計算 | |||||||
| 權益結算金融衍生負債 | £ | 3級 | ||||||||||
| 權益結算金融衍生負債 | £ | 3級 | ||||||||||
| 權益結算金融衍生負債 | – | 3級 | ||||||||||
| 總計 | £ | |||||||||||
| F-65 |
| 《目錄》 |
| 20 | 金融工具--風險管理(續) |
| 金融負債 | 公允價值 截至 31/12/2020 | 公平 價值 層次結構 | 估值 技術(S) 和密鑰 輸入 | 重大不可察覺 輸入 | 關係 不可觀測的輸入 按公允價值計算 | |||||||
| 權益結算金融衍生負債 | £ | 3級 | ||||||||||
| 權益結算金融衍生負債 | £ | 3級 | ||||||||||
| 權益結算金融衍生負債 | – | 3級 | ||||||||||
| 總計 | £ | |||||||||||
在所有其他變量保持不變的情況下,將估值模型的不可觀察無風險利率輸入值增加10% 不會影響股份的賬面值(二零二一年:無;二零二零年:無)。
期內,第一級與第二級之間並無轉撥。
按第三級公平值計量之公平值計量之金融負債 指與於二零二零年五月及二零一九年十月發行之認股權證有關之代價,作為登記直接發售之一部分,亦為業務合併 。
信用風險
本集團面臨來自合作伙伴應付款項、現金及現金等價物以及銀行及金融機構存款的信貸風險。來自協作合作伙伴的風險被認為是低風險。對於銀行和金融機構,只接受信用狀況較高的獨立評級方。本集團並無 訂立衍生工具以管理信貸風險。金融資產的賬面總額被註銷(部分或全部),如果沒有現實的復甦前景。
如上所述,本集團的信用風險敞口總額等於於每個年末持有的金融資產的總價值。
| F-66 |
| 《目錄》 |
| 20 | 金融工具--風險管理(續) |
外匯風險
匯兑風險是由於集團在西班牙畢爾巴鄂有一項重要業務。鑑於重要性水平,本集團並無對衝其於海外業務的淨投資,因為這樣做的成本與風險敞口不成比例。
下表按貨幣顯示了年終現金的英鎊等值 和現金等值餘額的分析:
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 現金和現金等價物: | ||||||||||||
| 英鎊/英鎊 | ||||||||||||
| 美元 | ||||||||||||
| 歐元 | ||||||||||||
| 總計 | ||||||||||||
下表顯示了產生在綜合全面收益表中確認的淨貨幣損益的外幣風險。截至12月31日,這些風險敞口如下:
2022 £’000 | 2021 £’000 | 2020 £’000 | ||||||||||
| 外幣淨資產/(負債): | ||||||||||||
| 美元 | ||||||||||||
| 歐元 | ||||||||||||
| 其他 | ||||||||||||
| 總計 | ||||||||||||
當個別集團實體以其職能貨幣以外的貨幣進行交易時,也會產生外匯風險;集團在英國以外地區至美國和歐洲的交易推動了外匯變動,供應商以英鎊以外的貨幣開具發票。這些交易沒有進行對衝,因為這樣做的成本與風險不成比例。
| F-67 |
| 《目錄》 |
| 20 | 金融工具--風險管理(續) |
外匯敏感度分析
除英鎊外,本集團交易的最重要貨幣為美元和歐元。本集團亦按需要以其他貨幣進行小額交易。
下表詳細説明瞭本集團對年終匯率 變動10%的敏感度,本集團認為這是主要外幣 兑英鎊匯率根據近期貨幣變動的最大可能變動:
| 截至2022年12月31日的年度 | 美元 £’000 | 歐元 £’000 | 其他 £’000 | |||||||||
| 税前虧損 | ( | ) | ||||||||||
| 總股本 | ( | ) | ||||||||||
| 截至2021年12月31日止年度 | 美元 £’000 | 歐元 £’000 | 其他 £’000 | |||||||||
| 税前虧損 | ||||||||||||
| 總股本 | ||||||||||||
| 截至2020年12月31日止年度 | 美元 £’000 | 歐元 £’000 | 其他 £’000 | |||||||||
| 税前虧損 | ( | ) | ( | ) | ||||||||
| 總股本 | ( | ) | ( | ) | ||||||||
流動性風險
流動資金風險源於本集團對營運資金的管理。本集團在履行到期財務責任時會遇到困難的風險。本集團的目標是在餘額到期時進行結算。
2022年12月,該公司完成了在美國的註冊直接發行 ,在扣除費用前籌集了30萬GB。
於2021年2月,公司行使先前發出的認股權證,因此本公司在扣除開支前獲得13萬英磅的收益。2021年7月,該公司完成了在英國的配售,在扣除費用前籌集了1000萬英磅。
董事已編制現金流預測,並考慮了本公司未來三年的現金流需求 ,包括自批准合併財務報表之日起計的十二個月期間。 這些預測顯示,假設某些發展計劃和其他經營活動繼續按目前計劃進行,2023年第四季度將需要進一步融資。這項短期內額外融資的要求 存在重大不確定性,可能令人對本集團及母公司作為持續經營企業的持續經營能力產生重大懷疑。
在我們看來,小微市值生物科技公司的融資環境與2008-2010年金融危機以來的環境一樣具有挑戰性。雖然這可能帶來與其他融資渠道有限或沒有融資渠道的公司的收購和/或合併機會,但Biodexa的任何隨之而來的融資可能會稀釋 。我們和我們的顧問繼續評估融資選擇,包括與收購和/或合併相關的融資選擇,包括融資以及與本公司的資產和技術合作。正在考慮的替代方案 均處於早期階段,並取決於交易對手的同意,因此,不能保證任何為本公司融資的替代方案 將會成功。短期內需要額外融資的這一要求代表着一種重大的不確定性,可能會讓人對我們作為一家持續經營的企業繼續下去的能力產生重大懷疑。如果在現金資源 耗盡之前,公司在未來明顯沒有可採取行動的現實融資選擇,則公司將不再是一家持續經營的公司。在這種情況下,我們將不再能夠根據《國際會計準則1》第25段編制財務報表 。相反,財務報表將在清算的基礎上編制,資產將按可變現淨值列報,所有負債將加速轉為流動負債。由於上述原因,我們的獨立註冊會計師事務所在其截至2022年12月31日及截至2022年12月31日的年度的財務報表報告中就這一不確定性作出了一段説明。
吾等相信有足夠的選擇和時間為貴公司爭取 額外融資,經考慮不確定因素後,吾等認為在編制該等財務資料時繼續採用 持續經營基準是適當的。
| F-68 |
| 《目錄》 |
| 20 | 金融工具--風險管理(續) |
下表列出了金融資產負債的合同到期日(代表未貼現的 合同現金流):
| 2022 | 最多3個 £’000 | 介於 3和12 月份 £’000 | 介於 年份 £’000 | 介於 £’000 | 完畢 £’000 | |||||||||||||||
| 貿易和其他應付款 | ||||||||||||||||||||
| 租賃負債 | ||||||||||||||||||||
| 總計 | ||||||||||||||||||||
| 2021 | 最多3個 £’000 | 介於 3和12 月份 £’000 | 介於 年份 £’000 | 介於 £’000 | 完畢 £’000 | |||||||||||||||
| 貿易和其他應付款 | ||||||||||||||||||||
| 租賃負債 | ||||||||||||||||||||
| 總計 | ||||||||||||||||||||
| 2020 | 最多3個 £’000 | 介於 3和12 月份 £’000 | 介於 年份 £’000 | 介於 £’000 | 完畢 £’000 | |||||||||||||||
| 貿易和其他應付款 | ||||||||||||||||||||
| 租賃負債 | ||||||||||||||||||||
| 政府研究貸款 | ||||||||||||||||||||
| 總計 | ||||||||||||||||||||
有關上述項目的更多詳情載於相關附註:
應付賬款及其他應付款—附註16
借款—附註17
由於於二零二零年三月進行的策略檢討,本集團於二零二零年及二零二一年償還所有 政府研究貸款。
| F-69 |
| 《目錄》 |
| 20 | 金融工具--風險管理(續) |
資本風險管理
本集團監控資本,包括所有權益組成部分(即股本、 股份溢價、外匯儲備及累計虧損)。
本集團維持資本的目標為:
| · | 保障該實體作為持續經營企業繼續經營的能力;及 |
| · | 有足夠資源推動發展項目走向商品化。 |
本集團繼續產生重大經營開支。在本集團產品商業化產生 正淨現金流入之前,本集團仍依賴於通過注入股本和政府資金獲得的額外資金。本集團可能無法在未來產生正淨現金流入,或根本無法吸引 此類額外所需資金,或以適當條款提供。在這種情況下,開發計劃可能會被推遲或取消, 和業務活動減少。
本集團通過嚴格控制支出、避免 長期供應商合同(臨牀試驗除外)、優先考慮最接近潛在創收的產品的開發支出、 獲得政府補助金(如適用)、保持集中開發中的產品組合以及向股東通報進展情況,尋求降低此風險。
自上一年以來,本集團管理資本風險的流程沒有變化 。
| 21 | 遞延税金 |
遞延税項乃根據負債法 按產生税項資產或負債的税務司法管轄區適用的税率全額計算。
遞延税項賬於二零二二年之變動為零英鎊(二零二一年:零英鎊, 二零二零年:零英鎊),乃由於無形資產攤銷及其他時間差異產生之淨信貸已與 就抵銷剩餘負債之虧損確認之遞延税項資產減少相匹配。
未使用的結轉税務虧損(須與當地税務機關達成協議)如下:
總損失 £’000 | 潛力 £’000 | |||||||
| 2022年12月31日 | ||||||||
| 2021年12月31日 | ||||||||
| 2020年12月31日 | ||||||||
於二零二零年,Midatech Pharma(Wales)Ltd業務合併產生的剩餘遞延税項資產及負債
(二零一九年:
餘下的潛在遞延税項資產1,790萬英鎊(二零二一年:1,690萬英鎊,二零二零年:1,310萬英鎊)由於資產是否會被收回而未在該等賬目中計提撥備。損失 是由累積交易損失造成的。
| F-70 |
| 《目錄》 |
| 22 | 股本 |
| 授權、配發和繳足—分類為股權 | 2022 數 | 2022 £ | 2021 數 | 2021 £ | 2020 數 | 2020 £ | ||||||||||||||||||
| 12月31日 | ||||||||||||||||||||||||
| 每股0.001英鎊的普通股 | ||||||||||||||||||||||||
| 每股1英鎊的遞延股份 | ||||||||||||||||||||||||
| 總計 | ||||||||||||||||||||||||
於2023年3月24日舉行的股東大會上,股東批准將 公司普通股按1比20的基準合併。因此,普通股之面值由每股0. 001英鎊改為每股0. 02英鎊。與此同時,公司普通股與美國存託憑證的比率從每股美國存託憑證代表25股普通股變更為每股美國存託憑證代表5股普通股。上表反映股份合併。
根據本公司於2014年11月13日採納的組織章程細則 ,本公司的股本由無限數量的每股面值0. 001英鎊的普通股組成。普通股 和遞延股記錄為權益。
Biodexa Pharmaceuticals註冊成立後股份附帶的權利 plc
分類為權益的股份
本公司股本中普通股持有人擁有以下權利:
(a) 接收所有 公司股東大會的通知、出席和投票,在這種情況下,股東應就其持有的每一股股份擁有一票表決權;以及,
(b) 收取董事會就所持每股股份宣派的股息。
本公司股本中遞延股份持有人:
(a) 無權接收本公司任何股東大會的通知或出席或發言,也無權就本公司任何股東大會提出的任何決議案進行表決;及
(b) 無權從公司利潤中獲得任何股息或其他分配。
在分配資產的情況下,遞延股東應在每股普通股持有人收到(現金或實物)已繳足或入賬列作已繳足的金額以及每股100英鎊的額外付款後,收到 該股已繳足的面值。公司有權 購買遞延股份,並可要求遞延股份持有人以不超過 所有遞延股份1便士的價格出售遞延股份。
| F-71 |
| 《目錄》 |
| 22 | 股本(續) |
普通 數 | 延期 數 | 分享 £ | 總計 £’000 | |||||||||||||||
| 在2020年1月1日 | ||||||||||||||||||
| 2020 | ||||||||||||||||||
| 2020年5月18日 | 配售及登記直接發售 | |||||||||||||||||
| 2020年7月27 | 放置 | |||||||||||||||||
| 2020年8月19日 | 認股權證的行使 | |||||||||||||||||
| 2020年9月30日 | 向SIPP受託人發行股份(見附註25) | |||||||||||||||||
| 2020年12月31日 | ||||||||||||||||||
| 2021年2月19 | 認股權證的行使 | |||||||||||||||||
| 2021年7月6日 | 放置 | |||||||||||||||||
| 在2021年12月31日 | ||||||||||||||||||
| 2022年3月22日 | 認股權證的行使 | |||||||||||||||||
| 2022年5月3日 | 向SIPP受託人發行股份(見附註25) | |||||||||||||||||
| 十九歲?2022年12月 | 註冊的直銷產品 | |||||||||||||||||
| 在2022年12月31日 | ||||||||||||||||||
| F-72 |
| 《目錄》 |
| 23 | 儲量 |
以下説明權益內各項儲備之性質及用途:
| 儲備 | 説明和目的 | |
| 股本 | ||
| 股票溢價 | ||
| 合併準備金 | ||
| 外匯存底 | ||
| 認股權證儲備 | ||
| 累計赤字 |
| F-73 |
| 《目錄》 |
| 24 | 退休福利 |
本集團為僱員之利益設立界定供款退休金計劃。
該計劃的資產由信託人管理,其基金獨立於本集團的基金。當年的年費是
£
| 25 | 基於股份的支付 |
股票期權
本集團已根據2014年Biodexa Pharmaceuticals plc企業管理激勵計劃、Biodexa Pharmaceuticals plc 2016年美國期權計劃(該計劃為已批准 英國計劃的子計劃)以及授予非英國或非美國員工的未經批准的購股權發行普通股期權。此外,根據Midatech Limited 2008年未經批准的購股權計劃或Midatech Limited 2013年批准的企業激勵 計劃,最初就Midatech Limited的股份發行的某些購股權已於2015年根據2014年Biodexa Pharmaceuticals plc企業管理 激勵計劃重新發行。選擇權的行使須繼續受僱。
於2023年3月24日舉行的股東大會上,股東批准將 公司普通股按1比20的基準合併。因此,普通股之面值由每股0. 001英鎊改為每股0. 02英鎊。下表反映股份合併。
2022年授出的購股權是根據2014年Biodexa Pharmaceuticals plc 企業管理獎勵計劃作出的。
根據該等計劃授出的所有購股權詳情載列如下:
| 批出日期 | 在2022年1月1日 | 授予於 2022 | 失落在 2022 | 被沒收在 2022 | 在… 12月31日 | 鍛鍊 價格 | ||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| 2020年4月17日 | £ | |||||||||||||||||||||||
| ( | ) | ( | ) | £ | ||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| ( | ) | ( | ) | |||||||||||||||||||||
| 於二零二二年十二月三十一日可行使的購股權 | ||||||||||||||||||||||||
| 於二零二二年十二月三十一日尚未行使購股權的加權平均行使價 | £ | |||||||||||||||||||||||
| 2022年行使的購股權加權平均行使價 | 不適用 | |||||||||||||||||||||||
| 於二零二二年失效之購股權加權平均行使價 | £ | |||||||||||||||||||||||
| 二零二二年沒收購股權加權平均行使價 | £ | |||||||||||||||||||||||
| 2022年授出購股權加權平均行使價 | £ | |||||||||||||||||||||||
| 於2022年12月31日尚未行使購股權的加權平均剩餘合約年期 | 年份 | |||||||||||||||||||||||
| F-74 |
| 《目錄》 |
| 25 | 以股份為基礎的付款(續) |
| 批出日期 | 2021年1月1日 | 授予於 2021 | 失落在 2021 | 被沒收在 2021 | 在… 12月31日 | 鍛鍊 價格 | ||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| ( | ) | ( | ) | |||||||||||||||||||||
| 在2021年12月31日可行使的期權 | ||||
| 截至2021年12月31日未償還期權的加權平均行權價 | £ | |||
| 2021年行使期權的加權平均行權價 | 不適用 | |||
| 2021年期權加權平均行權價失效 | £ | |||
| 2021年喪失的期權的加權平均行權價 | £ | |||
| 2021年授予期權的加權平均行權價 | £ | |||
| 截至2021年12月31日未平倉期權的加權平均剩餘合同期限 | 年份 |
| F-75 |
| 《目錄》 |
| 25 | 以股份為基礎的付款(續) |
| 批出日期 | 在2020年1月1日 | 授予於 2020 | 失落在 2020 | 被沒收在 2020 | 在… 12月31日 | 鍛鍊 價格 | ||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | ( | ) | £ | ||||||||||||||||||||
| ( | ) | ( | ) | £ | ||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | ( | ) | £ | ||||||||||||||||||||
| ( | ) | ( | ) | £ | ||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| £ | ||||||||||||||||||||||||
| ( | ) | £ | ||||||||||||||||||||||
| ( | ) | ( | ) | |||||||||||||||||||||
| 購股權可於二零二零年十二月三十一日行使 | ||||
| 於二零二零年十二月三十一日尚未行使購股權的加權平均行使價 | £ | |||
| 2020年行使期權的加權平均行權價 | 不適用 | |||
| 期權的加權平均行權價在2020年失效 | £ | |||
| 2020年喪失的期權的加權平均行權價 | £ | |||
| 2020年授予期權的加權平均行權價 | £ | |||
| 截至2020年12月31日未償還期權的加權平均剩餘合同期限 | 年份 |
| F-76 |
| 《目錄》 |
| 25 | 以股份為基礎的付款(續) |
以下資料與釐定本集團經營的以股權為基礎的酬金計劃下於2022年授出的期權的公允價值有關。
| 2022年2月 | 2022年8月 | 2022年8月 | ||||||||||
| 選項數量 | ||||||||||||
| 使用的期權定價模型 | ||||||||||||
| 股價 | £ | £ | £ | |||||||||
| 年內發行的購股權行使價 | £ | £ | £ | |||||||||
| 合同期限 | ||||||||||||
| 預期壽命 | ||||||||||||
| 波動率 | %** | %** | %** | |||||||||
| 預期股息收益率 | % | % | % | |||||||||
| 無風險利率 | % | % | % | |||||||||
釐定二零二二年授出購股權公平值所用之股價為授出日期之股價。
| ** |
以下資料與釐定二零二一年根據本集團運作之股權股份薪酬計劃授出之購股權之公平值有關。
| 2021年7月 | 2021年8月 | 2021年9月 | ||||||||||
| 選項數量 | ||||||||||||
| 使用的期權定價模型 | 布萊克-斯科爾斯 | 布萊克-斯科爾斯 | 布萊克-斯科爾斯 | |||||||||
| 股價 | £ | * | £ | * | £ | * | ||||||
| 年內發行的購股權行使價 | £ | £ | £ | |||||||||
| 合同期限 | ||||||||||||
| 預期壽命 | ||||||||||||
| 波動率 | %** | %** | %** | |||||||||
| 預期股息收益率 | % | % | % | |||||||||
| 無風險利率 | % | % | % | |||||||||
| * |
| ** |
| F-77 |
| 《目錄》 |
| 25 | 以股份為基礎的付款(續) |
以下資料與釐定根據本集團經營的股權薪酬計劃於二零二零年授予的購股權的公允價值有關。
| 2020年4月 | 2020年6月 | |||||||
| 選項數量 | ||||||||
| 使用的期權定價模型 | 布萊克-斯科爾斯 | 布萊克-斯科爾斯 | ||||||
| 股價 | £ | * | £ | * | ||||
| 年內發行的購股權行使價 | £ | £ | ||||||
| 合同期限 | ||||||||
| 預期壽命 | ||||||||
| 波動率 | %** | %** | ||||||
| 預期股息收益率 | % | % | ||||||
| 無風險利率 | % | % | ||||||
| * |
| ** |
所有其他購股權與Midatech Limited 2008年未經批准的購股權計劃有關。
股票激勵計劃
2017年4月,集團設立了Biodexa Pharmaceuticals股票激勵計劃(MPSIP)。根據BPSIP,本集團僱員及董事可透過薪酬犧牲安排收購本公司普通股。 Biodexa為購買的每一份股份授予相應的股份。為保留這些股份,計劃參與者必須自收購之日起三年內繼續受僱於 集團。BPSIP購買的所有股份均由不受Biodexa 控制的員工福利信託持有。股票必須在計劃中保留5年,才有資格獲得全額所得税和NIC減免。
| 26 | 資本承諾 |
於二零二二年十二月三十一日、二零二一年十二月三十一日及二零二零年十二月三十一日,本集團並無資本承擔。
| F-78 |
| 《目錄》 |
| 27 | 關聯方交易 |
買賣交易
董事認為BioConnection BV為關聯方,原因是 與本公司有共同董事,且該董事被識別為對實體具有重大影響力。2019年是這種關係存在的第一年。
年內,集團公司與非集團成員公司的關聯方進行了以下交易。
| 購買商品 | 關聯方欠款 | |||||||||||||||||||||||
2022 €’000 | 2021 €’000 | 2020 €’000 | 2022 €’000 | 2021 €£’000 | 2020 €’000 | |||||||||||||||||||
| BioConnection BV | ||||||||||||||||||||||||
2019年,Midatech Pharma(Espana)SL與BioConnection BV就集團的MTD201項目簽訂了一份商業合同,該合同隨後因該項目終止 而於2020年終止。
於二零二二年、二零二一年或二零二零年,本集團並無就關聯方應收賬款計提任何呆壞賬撥備,亦無就關聯方交易作出或收取任何擔保。
| 28 | 或有負債 |
本公司於二零二二年十二月十三日與Bioasis訂立一份安排協議(於二零二二年十二月十八日修訂)。根據該協議,本公司同意收購Bioasis的全部已發行股本,總代價為
,
2023年1月23日,在批准安排協議的股東大會上,沒有 任何特別決議案獲得通過,因此,收購Bioasis沒有進行。1月23日,Bioasis終止了 《安排協議》,並要求償還與交易有關的225,000美元費用,但迄今為止,這些費用 尚未支付。
於二零二一年十二月三十一日及二零二零年十二月三十一日,本集團並無或然負債。
| 29 | 最終控制方 |
董事認為並無最終控制方。
| F-79 |
| 《目錄》 |
| 30 | Midatech Pharma(España)SL |
截至2020年12月31日止年度的集團綜合全面收益表包括於2020年6月3日關閉的集團西班牙業務的業績。集團任命了一名 清算人,於2021年2月向西班牙當局提交文件,對公司進行清算。
管理層評估了Midatech Pharma(España)SL是否應根據IFRS 5作為已終止經營業務入賬,並得出結論認為,由於其不符合現金產生單位的定義,因此不符合標準。
Midatech Pharma(España)SL截至12月31日止年度的未經審計業績 如下:
截至31年底止年度 £’000 | ||||
| 助學金收入 | ||||
| 總收入 | ||||
| 研發成本 | ( | ) | ||
| 行政費用 | ( | ) | ||
| 運營虧損 | ( | ) | ||
| 財務費用 | ( | ) | ||
| 税前虧損 | ( | ) | ||
| 税收 | ( | ) | ||
| 税後運營虧損 | ( | ) | ||
| 31 | 資產負債表後事件 |
2023年1月3日,公司根據其於2022年12月19日簽訂的本票和擔保協議,向BiOASIS提供了進一步的預付款,金額為美元
本公司於2023年1月5日發出通函,載列本公司擬收購BiOasis的詳情,集資#美元
| F-80 |
| 《目錄》 |
| 31 | 資產負債表後事件(續) |
2023年2月9日,該公司宣佈已與美國機構投資者達成具有最終約束力的協議,以籌集總計#美元的總收益。
本公司於2023年3月8日宣佈,已向股東發出通函 召開股東大會,以20股為基準進行股份合併,授權董事配發股份、撤銷優先認購權、採納新章程、取消本公司普通股於AIM市場買賣,並將本公司名稱 更改為Biodexa PharmPharmticals PLC。本公司還通知股東,普通股與美國存托股份的比例將從每股美國存托股份25股普通股改為每股美國存托股份5股普通股。在2023年3月24日的股東大會上,所有決議均獲正式通過。
股份合併將對普通股、任何員工 股票期權計劃以及認股權證產生影響。作為股份合併的結果:
| 預拆分 | 拆分後 | |
| 加權平均流通股數量--基本和稀釋 | ||
| 已發行普通股 | ||
| 尚未行使的普通股僱員購股權 | ||
| 未行使的DARRA普通股期權 | ||
| 尚未行使的普通股認股權證 |
財務報表反映了所有呈列期間的反向股票分割(股份合併) 的影響。
於2023年4月26日,本公司普通股獲準在AIM交易 被取消。
| F-81 |
| 《目錄》 |
第二部分
招股説明書不需要的資料
| 第6項。 | 對董事和高級職員的賠償。 |
註冊人的組織章程規定,在遵守《2006年英國公司法》的情況下,每一個現在或曾經是 註冊人或其任何子公司的董事、替任董事或前任董事的人,都可以從註冊人的資產中扣除 ,以抵消所有成本、收費、開支、損失,他或她在履行其職責或行使其權力或與該公司有關的其他方面所產生的損害賠償和責任。一般來説,根據英國《2006年公司法》,公司不得就其董事的個人責任向其賠償:在公司解僱董事的情況下(即,只有對第三方的責任才可作為彌償的主題);刑事行為罰款的責任 或監管機構施加的罰款;或在董事被定罪的刑事案件中,或在公司提起的民事案件中,最終判決不利於董事的訴訟費等其他責任。
註冊人已與其每一位董事和高級管理人員簽訂了賠償契約。除適用法律禁止外,這些 賠償契約可要求註冊人賠償其董事和高級管理人員的某些費用,包括 律師費、判決、罰款和和解金額,這些董事和高級管理人員因其作為註冊人或其子公司的董事或高級管理人員的服務而產生的任何訴訟或訴訟中 的賠償金額,或因應註冊人的要求向其他公司或企業提供的服務而引起的。
根據上述規定,可以允許董事、高級管理人員或控制我們的人員 根據《1933年證券法》(經修訂)下產生的責任賠償 ,我們已獲悉,根據證券交易委員會 ,此類賠償違反了《證券法》中所述的公共政策,因此不可強制執行。
| 第7項。 | 最近出售的未註冊證券 |
以下信息 是關於登記人在過去三年內發行的所有證券,但未根據經修訂的1933年證券法 進行登記。除非下文另有説明,此類股票的發行被視為豁免 經修訂的1933年證券法的註冊要求,因為根據條例S,此類證券是在美國境外向 既不是美國公民也不是美國居民的人提供和出售的,或此類銷售根據經修訂的1933年證券法第4(2)節和據此頒佈的條例D第506條免於登記。
2021年7月6日,我們以每股5.70 GB的價格向某些非美國投資者發行了1,754,386股普通股,在英國配售,總收益為1,000萬GB。
於2022年3月22日,我們於2019年2月發行的一份認股權證獲行使後,以每股200英鎊的行使價發行 一股普通股。
2022年5月3日,我們以每股0.02 GB的價格向 股票激勵計劃信託發行了1,250股普通股,將根據股票激勵計劃購買。
於 2023年2月15日,我們完成了私募配售的完成,據此,我們向某些機構投資者出售了(1)3,250,000股普通股,由8,125股存托股份以每股185.60美元的價格表示,(2)12,931,020股普通股,由32,328股存托股份表示,在行使私募發行的A系列權證時可發行,行使價為每份權證214.40美元,(3)19,396,400股普通股,代表48,491股存托股份,在私人配售中發行的B系列權證以每份權證214.40美元的行使價行使時可發行,及(4)62,184,525股普通股代表 155,461股存托股份,可在行使在私募中發行的預出資認股權證時發行,行使價為 每份認股權證0.032美元,總收益約為600萬美元。我們還發行了未註冊配售代理權證 以購買總計536,800股普通股,其中包括1,342股存托股份, 拉登堡·塔爾曼公司 根據豁免,49份認股權證的行使價為每份認股權證400.00美元,1,293份認股權證的行使價為每份認股權證232.00美元,以及A系列認股權證以每份214.40美元的行使價購買1,562股存托股份代表的625,000股普通股。
2023年5月26日,我們完成了2023年5月的登記直接發行,機構投資者(1)166,017,700股普通股,相當於415,044股存托股份,可在C系列權證行使時發行,行使價為每股16.00美元 ,(2)110,675,600股普通股,相當於276,689股存托股份,可在行使D系列權證時發行 ,行使價為每權證16.00美元,以及,(3)4,426,800股普通股,相當於11,067股存托股份,可於行使2023年5月配售代理權證時發行,行使價為每份認股權證15.00美元。
| II-1 |
| 《目錄》 |
我們於2023年6月14日舉行的股東大會上,收到股東對根據C系列認股權證、D系列認股權證及配售代理認股權證發行的普通股的配發及解除優先認購權所需的批准後,於2023年6月20日向投資者及配售代理髮行C系列認股權證、D系列認股權證及配售代理認股權證。
2023年12月21日,在兩筆私募交易中,我們(I)向某些有擔保票據持有人發行了總計224,947股存托股份,以滿足Adhera Treateutics,Inc.的要求,以及(Y)向某些有擔保票據持有人發行了總計2,275,050份預融資認股權證,以購買存托股份給某些 有擔保票據持有人,以及(Ii)向Melior PharmPharmticals I,Inc.發行了354,428股我們的存托股份。
| 第8項。 | 展品和財務報表附表 |
| (a) | 在此引用作為參考的展品索引。 |
見本註冊説明書所附的證據索引,該説明書以引用的方式併入本文。
| (b) | 財務報表明細表。 |
以上未列出的附表 已被省略,因為其中要求列出的信息不適用或已在財務報表或其附註中顯示。
| 第9項。 | 承諾 |
以下籤署的註冊人特此承諾:
| (1) | 在提供報價或銷售的任何時間段內,提交本註冊聲明的生效後修正案: |
| (i) | 包括證券法第10(A)(3)節要求的任何招股説明書; |
| (Ii) | 在招股説明書中反映在登記聲明生效日期(或最近生效後的修訂)之後產生的、個別地或總體上代表登記聲明所載信息發生根本變化的任何事實或事件 。儘管有上述規定,發行證券數量的任何增加或減少(如果發行證券的總美元價值不超過登記的)以及與估計最高發行範圍的低端或高端的任何偏離,可在根據規則 424(B)提交給證監會的招股説明書中反映,前提是總量和價格的變化合計不超過有效註冊説明書“註冊費計算”表中規定的最高發行價格的20%;以及 |
| (Iii) | 在登記聲明中包含先前未披露的有關分銷計劃的任何重要信息 ,或在登記聲明中對此類信息的任何重大變更; |
| (2) | 就確定《證券法》下的任何責任而言,每次該等生效後的修訂應被視為與其中所提供的證券有關的新的登記聲明,屆時該等證券的發售 應被視為其首次真誠發售。 |
| (3) | 通過生效後的修訂將終止發行時仍未售出的任何已登記證券從登記中刪除。 |
| (4) | 提交註冊聲明生效後的修訂,以包括第8.A項要求 的任何財務報表。在任何延遲發售開始或整個連續發售期間,無需提供本法第10(a)(3)條要求的財務報表和信息, 提供 註冊人在招股説明書中通過生效後的修訂,包括根據本(a)(4)段要求的財務報表和其他必要的信息 ,以確保招股説明書中的所有其他信息至少與這些財務報表的日期一樣及時。 |
| II-2 |
| 《目錄》 |
| (5) | 為根據1933年《證券法》確定對任何買方的法律責任: |
| (i) | 註冊人根據規則424(b)(3)提交的每份招股説明書應被視為註冊 聲明的一部分,自提交的招股説明書被視為註冊聲明的一部分幷包含在註冊聲明中之日起;並且 |
| (Ii) | Each prospectus required to be filed pursuant to Rule 424(b)(2), (b)(5), or (b)(7) as part of a registration statement in reliance on Rule 430B relating to an offering made pursuant to Rule 415(a)(1)(i), (vii), or (x) for the purpose of providing the information required by section 10(a) of the Securities Act of 1933 shall be deemed to be part of and included in the registration statement as of the earlier of the date such form of prospectus is first used after effectiveness or the date of the first contract of sale of securities in the offering described in the prospectus. As provided in Rule 430B, for liability purposes of the issuer and any person that is at that date an underwriter, such date shall be deemed to be a new effective date of the registration statement relating to the securities in the registration statement to which that prospectus relates, and the offering of such securities at that time shall be deemed to be the initial bona fide offering thereof. Provided, however, that no statement made in a registration statement or prospectus that is part of the registration statement or made in a document incorporated or deemed incorporated by reference into the registration statement or prospectus that is part of the registration statement will, as to a purchaser with a time of contract of sale prior to such effective date, supersede or modify any statement that was made in the registration statement or prospectus that was part of the registration statement or made in any such document immediately prior to such effective date. |
根據 上述規定或其他規定,可允許對註冊人的董事、高級管理人員和控制人員就《證券法》下產生的責任進行賠償 ,註冊人已被告知,根據證券交易委員會 ,此類賠償違反了《證券法》中所述的公共政策,因此,不可強制執行。如果針對此類責任的 賠償要求(註冊人支付註冊人的董事、高級管理人員或控制人員在成功抗辯任何訴訟、訴訟或程序時所招致或支付的費用除外),該董事、高級管理人員或控制人員就被註冊的證券提出異議,註冊人將,除非其律師認為 問題已通過控制先例得到解決,否則將向具有適當管轄權的法院提出這樣的賠償 是否違反《法案》中所述的公共政策,並將受該問題的最終裁決的管轄。
以下籤署的註冊人特此承諾:
| (1) | 為了確定1933年證券法規定的任何責任,根據規則430A作為本註冊説明書的一部分提交的招股説明書表格中遺漏的信息,以及註冊人根據證券法第424(B)(1)或(4)或497(H)條提交的招股説明書表格 中包含的信息,在宣佈生效時應被視為本註冊説明書的一部分。 |
| (2) | 為了確定1933年《證券法》下的任何責任,包含招股説明書格式的每一個生效後的修正案 應被視為與其中所提供的證券有關的新登記聲明, 當時所提供的此類證券應被視為首次善意提供。 |
| II-3 |
| 《目錄》 |
簽名
根據1933年證券法(經修訂)的要求 ,註冊人證明其有合理理由相信其符合 表格F—1備案的所有要求,並已於2024年3月18日在威爾士加的夫正式促成下列簽署人 在本註冊聲明書上正式簽署。
| 博德薩藥業有限公司 | ||
| 發信人: | /s/Stephen Stamp | |
| 斯蒂芬·斯坦普 | ||
| 首席執行官 | ||
我們, 以下簽名人,特此分別任命Stephen Stamp和Stephen Parker,各自以各自的身份,作為我們的 真實合法的代理人和代理人,並具有完全的替換和重新替換權, 以任何和所有身份執行任何和所有修訂(包括生效後的修訂)本登記聲明, 簽署根據經修訂的1933年證券法第462(b)條提交的任何登記聲明,並促使其連同所有附件一起提交,以及與此相關的所有文件,與證券交易委員會,授予上述 事實上的律師和代理人充分的權力和授權,以儘可能充分地和所有意圖和目的在處所內和周圍進行和執行每一項必要和可取的行動和事情,特此批准和確認上述事實律師和代理人,或其替代者可以合法地做或安排做的所有事實和事情。
根據經修訂的1933年《證券法》的要求, 本表格F—1的登記聲明已由下列人員以所示的身份和日期簽署。
| 姓名和簽名 | 標題 | 日期: | ||
| /s/Stephen Stamp | 首席執行官,董事, | 2024年3月18日 | ||
| 斯蒂芬·斯坦普 | 首席執行官、首席財務官和首席會計官 | |||
| /s/Stephen Parker | 董事會非執行主席 | 2024年3月18日 | ||
| 斯蒂芬·帕克 | ||||
| /s/Simon Turton博士 | 董事高級獨立非執行董事 | 2024年3月18日 | ||
| Simon Turton博士 | ||||
| /s/Sijmen de Vries,醫學博士 | 非執行董事董事 | 2024年3月18日 | ||
| Sijmen de Vries,醫學博士 | ||||
| /s/Ann Merchant | 非執行董事董事 | 2024年3月18日 | ||
| 安·麥錢特 |
| II-4 |
| 《目錄》 |
授權代表
根據1933年證券法(經修訂)的要求,本表格F—1的註冊聲明已於2024年3月18日由以下籤署人簽署。
| 發信人: | /s/Donald J.Puglisi | |
| 姓名: | 唐納德·J·普格利西 | |
| 標題: | 在美國的授權代表 |
| II-5 |
| 《目錄》 |
展品索引
|
展品 數 |
標題 |
| 3.1 | Biodexa Pharmaceuticals PLC的公司章程,於2023年6月14日通過(通過引用本公司於2023年6月16日向SEC提交的F—1表格註冊聲明(文件編號333—272693)的附件3.1)。 |
| 4.1* | 根據《交易法》第12條登記的證券説明。 |
| 4.2 | 代表Biodexa Pharmaceuticals PLC普通股的證書樣本(通過引用2023年6月16日向SEC提交的公司F—1表格(文件號333—272693)的註冊聲明的附件4.2)。 |
| 4.3 | Biodexa Pharmaceuticals PLC,JPMorgan Chase Bank,N.A.,作為存託人,以及其下的美國存托股份的所有人和持有人(通過引用本公司於2023年12月6日向SEC提交的F—6表格(文件號333—275909)的登記聲明的附件(a)納入)。 |
| 4.4 | JPMorgan Chase Bank,N.A.美國存託憑證(包括在附件4.5中作為附件A)。 |
| 4.5 | 2019年10月25日發佈的權證表格(通過引用公司於2019年10月24日向SEC提交的6—K表格報告的附件4.1納入)。 |
| 4.6 | 2019年10月25日發佈的配售代理權證表格(通過引用本公司於2019年10月24日向SEC提交的6—K表格報告的附件4.2)。 |
| 4.7 | 2020年5月20日發佈的認股權證表格(通過引用公司於2020年5月20日向SEC提交的6—K表格報告的附件4.1納入)。 |
| 4.8 | 2020年5月20日發佈的配售代理權證表格(通過引用本公司於2020年5月20日向SEC提交的6—K表格報告的附件4.2)。 |
| 4.9 | 2020年5月22日發佈的權證文件格式(通過引用公司於2020年5月20日向SEC提交的6—K表格報告的附件4.3納入)。 |
| 4.11 | 配售代理權證的形式(通過引用本公司於2023年2月9日向SEC提交的6—K表格報告的附件4.4)。 |
| 4.15 | D系列權證的形式(通過引用公司於2023年5月24日向SEC提交的6—K表格報告的附件4.2)。 |
| 4.16 | 配售代理權證的形式(通過引用本公司於2023年5月24日向SEC提交的6—K表格報告的附件4.3)。 |
| 4.17 | E系列權證的形式(通過引用公司於2023年12月21日向SEC提交的6—K表格報告的附件4.1而納入)。 |
| 4.18 | 預融資認股權證表格(通過引用公司於2023年12月21日向SEC提交的6—K表格報告的附件4.2)。 |
| 4.19 | 代表權證表格(通過引用公司於2023年12月21日向SEC提交的6—K表格報告的附件4.3)。 |
| 4.20 | F系列權證的形式(通過引用公司於2023年12月21日向SEC提交的6—K表格報告的附件4.4)。 |
| II-6 |
| 《目錄》 |
| 5.1* | 作者:Brown Rudnick LLP |
| 10.1# | Biodexa Pharmaceuticals PLC 2014年企業管理激勵計劃(通過引用本公司F—4表格註冊聲明的附件10.3(文件編號333—206305),最初於2015年8月11日提交給SEC,經修訂)。 |
| 10.2# | 期權協議的格式(見附件10.1)。 |
| 10.3# | 諮詢協議,日期為2014年4月15日,由Biodexa Ltd和Chesyl Pharma Limited簽署(通過引用公司表格F—4(文件編號333—206305)的註冊聲明附件10.17合併,最初於2015年8月11日提交給SEC,經修訂)。 |
| 10.4# | Biodexa Pharmaceuticals PLC與Biodexa Pharmaceuticals PLC的某些董事之間的任命書(通過引用本公司表格F—4註冊聲明的附件10.22(文件編號333—206305),最初於2015年8月11日提交給SEC,經修訂)。 |
| 10.5# | 日期為2015年8月5日的賠償契據(通過引用本公司表格F—4(文件編號333—206305)的註冊聲明的附件10.23,最初於2015年8月11日提交給SEC,經修訂)。 |
| 10.6† | 由Biodexa Pharmaceuticals PLC、CMS Bridging Limited、CMS Medical Hong Kong Limited和中國醫療系統控股有限公司簽署的許可、合作和分銷協議,日期為2019年1月29日(通過引用本公司截至2018年12月31日止年度20—F表格年度報告的附件4.17,經修訂,於5月28日向SEC提交,2019年)。 |
| 10.7# | 股票激勵計劃(通過引用本公司2018年4月24日向SEC提交的截至2018年12月31日的年度20—F表格的年度報告的附件4.27納入)。 |
| 10.8†# | Bodexa Pharmaceuticals PLC和Stephen Stamp之間日期為2019年9月9日的服務協議(通過引用公司於2019年9月19日向SEC提交的表格6—K報告的附件10.1合併)。 |
| 10.9# | Bodexa Pharmaceuticals PLC和Dmitry Zamoryakhin之間的服務協議,日期為2021年7月12日(通過引用公司截至2021年12月31日止年度的表格20—F年度報告的附件4.15,於2022年4月26日向SEC提交)。 |
| 10.10# | 董事任命條款,日期為2022年6月20日,由Biodexa Pharmaceuticals PLC和Stephen Barry Parker(通過引用公司於2022年6月21日向SEC提交的表格6—K報告的附件10.1合併)。 |
| 10.11 | 轉讓和交換協議,日期為2023年11月22日,由Biodexa Pharmaceuticals PLC、Adhera Therapeutics,Inc.以及有擔保票據持有人(通過引用公司於2023年11月27日向SEC提交的6—K表格報告的附件10.1而合併)。 |
| 10.12† | Biodexa Pharmaceuticals PLC和Melior Pharmaceuticals I,Inc.簽署的許可協議,日期為2023年11月22日。(通過引用公司於2023年11月27日向SEC提交的6—K表格報告的附件10.4)。 |
| 10.13 | Biodexa Pharmaceuticals PLC和有擔保票據持有人之間的註冊權協議格式(通過引用公司於2023年11月27日向SEC提交的6—K表格報告的附件10.2合併)。 |
| 10.14 | Biodexa Pharmaceuticals PLC和有擔保票據持有人之間的鎖定協議形式(通過引用公司於2023年11月27日向SEC提交的6—K表報告的附件10.3)。 |
| 10.15 | Biodexa Pharmaceuticals PLC、Melior Pharmaceuticals,Inc.簽署的註冊權協議格式和Bukwang Pharmaceutical Co. Ltd.(通過引用本公司於2023年11月27日向SEC提交的6—K表格報告的附件10.5)。 |
| 10.16 | Biodexa Pharmaceuticals PLC和Melior Pharmaceuticals,Inc.之間的鎖定協議格式。和Bukwang Pharmaceutical Co. Ltd.(通過引用公司於2023年11月27日向SEC提交的6—K表報告的附件10.6)。 |
| 21.1* | Biodexa Pharmaceuticals PLC的子公司。 |
| 23.1* | 獨立註冊會計師事務所Mazars LLP的同意。 |
| 23.2* | Brown Rudnick LLP的同意書(見附件5.1)。 |
| 24.1* | 授權書(包括在簽名頁上)。 |
| 107* | 備案費表。 |
__
*現送交存檔。
| # | 管理合同或補償計劃或安排。 |
| † | 省略了本附件的某些部分(如圖所示),因為它們不重要 ,如果公開披露,可能會對Biodexa Pharmaceuticals PLC造成競爭損害。 |
II-7