目錄表
美國
美國證券交易委員會
華盛頓特區,20549
表格
(標記一)
截至本財政年度止
或
在過渡時期, 到 .
佣金文件編號
(註冊人的確切姓名載於其章程)
|
|
|
|
(註冊成立或組織的國家或其他司法管轄區) |
(國際税務局僱主身分證號碼) |
|
|
|
|
(主要執行辦公室地址) |
(郵政編碼) |
註冊人的電話號碼,包括區號
根據該法第12(B)節登記的證券:
|
每個班級的標題 |
交易符號 |
註冊所在的交易所名稱 |
|
|
|
這個 |
根據該法第12(G)節登記的證券:無
用複選標記表示註冊人是否為證券法第405條規定的知名經驗豐富的發行人。
如果註冊人不需要根據該法案的第13節或第15(D)節提交報告,請用複選標記表示。如果是:☐不需要提交報告。
用複選標記表示註冊人(1)是否在過去12個月內(或在要求註冊人提交此類報告的較短期限內)提交了1934年《證券交易法》第13條或15(D)節要求提交的所有報告,以及(2)在過去90天內一直遵守此類提交要求。
用複選標記表示註冊人是否在過去12個月內(或在註冊人被要求提交此類文件的較短時間內)以電子方式提交了根據S-T規則第405條(本章232.405節)要求提交的每個交互數據文件。
通過複選標記來確定註冊人是否是大型加速申報人、加速申報人、非加速申報人、小型申報公司或新興成長型公司。參見《交易法》第12b—2條中"大型加速申報人"、"加速申報人"、"小型申報公司"和"新興增長公司"的定義。
規模較小的報告公司:
如果是一家新興的成長型公司,用複選標記表示註冊人是否已選擇不使用延長的過渡期來遵守根據《交易所法》第13(A)節提供的任何新的或修訂的財務會計準則。*☐
通過複選標記檢查註冊人是否已提交報告並證明其管理層根據《薩班斯—奧克斯利法案》第404(b)條對財務報告內部控制有效性的評估(15 U.S.C. 7262(b))編制或出具審計報告的註冊公共會計表。
如果證券是根據該法第12(B)條登記的,應用複選標記表示登記人的財務報表是否反映了對以前發佈的財務報表的錯誤更正。
用複選標記表示這些錯誤更正中是否有任何重述需要對註冊人的任何執行人員在相關恢復期間根據第240.10D-1(B)條收到的基於激勵的補償進行恢復分析。☐
檢查註冊人是否為空殼公司(如法案第12b—2條所定義)。 是的:
註冊人的非關聯公司持有的有表決權和無表決權普通股的總市值約為美元,
截至2024年2月27日,註冊人已
以引用方式併入的文件
本表格10—K的第三部分通過引用從註冊人的最終委託書中獲得的信息,該聲明將在本年報所涵蓋的財政年度結束後120天內提交給美國證券交易委員會。
LEMAITRE血管
表格10-K的2023年年報
目錄
|
第一部分 |
4 | |
|
第1項。 |
業務 |
4 |
|
項目1A. |
風險因素 |
17 |
|
項目1B。 |
未解決的員工意見 |
28 |
|
項目1C。 |
網絡安全 |
28 |
|
第二項。 |
屬性 |
29 |
|
第三項。 |
法律訴訟 |
30 |
|
第四項。 |
煤礦安全信息披露 |
30 |
|
第II部 |
31 | |
|
第5項。 |
註冊商的市場’普通股、相關股東事項與發行人購買股權證券 |
31 |
|
第6項。 |
已保留 |
33 |
|
第7項。 |
管理’關於財務狀況和經營成果的討論與分析 |
33 |
|
項目7A。 |
關於市場風險的定量和定性披露 |
46 |
|
第8項。 |
財務報表和補充數據 |
46 |
|
第9項。 |
會計和財務披露方面的變化和與會計師的分歧 |
46 |
|
項目9A。 |
控制和程序 |
46 |
|
項目9B。 |
其他信息 |
49 |
|
項目9C。 |
關於妨礙檢查的外國司法管轄區的披露 |
49 |
|
部分 (三) |
49 | |
|
第10項。 |
董事、高管與公司治理 |
49 |
|
第11項。 |
高管薪酬 |
49 |
|
第12項。 |
某些實益擁有人的擔保所有權以及管理層和相關股東的事項 |
49 |
|
第13項。 |
某些關係和相關交易,以及董事的獨立性 |
50 |
|
第14項。 |
首席會計費及服務 |
50 |
|
部分 IV |
51 | |
|
第15項。 |
展品和財務報表明細表 |
51 |
|
第16項。 |
表格10-K摘要 |
55 |
|
簽名 |
56 | |
第一部分
關於前瞻性陳述的特別説明
本Form 10-K年度報告包含前瞻性聲明(定義見美國1995年“私人證券訴訟改革法”),涉及大量風險和不確定性,尤其是與監管環境、我們的普通股、我們的季度和年度業績的波動、我們成功地將收購整合到我們的業務中的能力以及與我們的業務和行業相關的風險,例如在開發和商業化在外圍血管疾病市場使用的安全和有效的產品和服務的過程中所固有的風險。除有關歷史事實的陳述外,本報告中包含的有關我們的戰略、未來業務、未來財務狀況、未來淨銷售額、毛利率預期、預計成本、預計開支、前景和計劃以及管理目標的所有陳述均為前瞻性陳述。“預期”、“相信”、“估計”、“預期”、“打算”、“可能”、“計劃”、“項目”、“將”、“將”等類似表述旨在識別前瞻性表述,儘管並不是所有前瞻性表述都包含這些識別詞語。這些前瞻性陳述是基於我們目前對未來事件的預期和預測。儘管我們認為我們任何前瞻性陳述背後的預期都是合理的,但這些預期可能被證明是不正確的,所有這些陳述都受到風險和不確定因素的影響。如果這些風險和不確定性中的一個或多個成為現實,或者潛在的假設、預測或預期被證明是不正確的,我們的實際結果、業績或財務狀況可能與預期、估計或預期的結果、業績或財務狀況大不相同。任何前瞻性陳述都不能得到保證,實際結果可能與前瞻性陳述中預測的結果大相徑庭。我們打算利用1995年《私人證券訴訟改革法》中關於我們前瞻性陳述的安全港條款,並明確包括這一句話,以使我們能夠在所有前瞻性陳述中使用安全港保護。這些風險和不確定因素包括但不限於:我們的全球監管批准狀況以及對我們產品在美國和美國以外市場和銷售的監管要求的遵守情況;實施新的企業資源規劃系統的風險;來自其他公司競爭的風險;由於眾多因素導致我們的季度和年度業績大幅波動的風險;對公司產品市場以及公司直銷隊伍和分銷商生產率的假設可能不正確的風險;我們可能無法維持最近的盈利水平的風險;公司可能無法實現其戰略活動的預期效益的風險;與收購目標的整合有關的風險;產品增長率的加速或減速;與產品需求和市場對公司產品和定價的接受度有關的風險;召回我們的產品可能導致重大成本或負面宣傳的風險;以及該公司未能成功地在新地區過渡到直銷模式的風險。
以下討論應與我們的綜合財務報表及本年報其他部分所載的相關附註一併閲讀, 10—K和我們的其他證券交易委員會文件。
除非上下文另有説明, “勒邁特血管,” “勒邁特,” “我們,” “我們的,”和“我們”在本年度報告中,表格10—K指LeMaitre Vascular,Inc.及其子公司。
LeMaitre,AlboGraft,Anasto卡箍,Anasto卡箍GC,Artegraft,Cardial,Eze—Sit,Glow ‘N Tell、LeverEdge、LifeSpan、ProCol、Pruitt、Pruitt F3、RestoreFlow、TufTex、VascuCel、VascuTape和XenoSure是LeMaitre Vascular或其子公司的註冊商標,Chevalier、DuraSure、Flexcel、Omniflow、PerVu和Syntel是LeMaitre Vascular的商標。本年報表格10—K還包括其他人的註冊和未註冊商標,這些商標是其各自擁有人的財產。僅為方便起見,本報告中提及的商標和商品名稱可能在沒有 ®或TM符號。
|
第1項。 |
業務 |
概述
LeMaitre Vascular是一家全球性的醫療器械和人體組織冷凍保存服務供應商,主要用於治療外周血管疾病、終末期腎病和較小程度的心血管疾病。我們開發、製造和銷售器械,以滿足血管外科醫生的需求,在較小程度上滿足心臟外科醫生、普通外科醫生和神經外科醫生等其他專業的需求。我們多樣化的器械組合包括用於動脈和靜脈的品牌產品,這些產品為血管外科醫生所熟知。我們的主要產品在全球銷售,主要在美國、歐洲、加拿大和亞太地區。我們估計,全球每年的外周血管器械市場超過50億美元,其中我們的產品市場約為8億美元。
我們主要通過直接銷售隊伍銷售我們的產品和服務。截至2023年12月31日,我們的銷售隊伍由136名銷售代表組成,分佈於北美、歐洲及亞太地區,其中包括三名出口經理。我們的全球總部位於馬薩諸塞州伯靈頓,在亞利桑那州錢德勒和加拿大沃恩也設有北美銷售辦事處。我們的歐洲總部位於德國的蘇爾茨巴赫,在意大利米蘭、西班牙馬德里、英國赫裏福德和愛爾蘭都柏林都設有歐洲銷售辦事處。我們的亞太區總部位於新加坡,在日本東京、中國上海、澳大利亞肯辛頓、韓國首爾和泰國曼谷設有亞太區銷售辦事處。截至2023年12月31日止年度,約96%的淨銷售額來自我們聘用直銷代表的地區。我們還通過分銷商在其他國家銷售我們的產品。
外周血管疾病市場
根據行業統計,我們估計外周血管疾病影響全球超過2億人,所有外周血管器械的全球年市場超過50億美元。該疾病包括許多條件,其中輸送血液到或從腿,手臂或器官,心臟以外的動脈或靜脈變得狹窄,阻塞,削弱,或以其他方式受損。在許多情況下,外周血管疾病未被發現,有時會導致危及生命的事件(包括中風、動脈瘤破裂和肺栓塞)或死亡。臨牀研究已經確定了幾個增加外周血管疾病風險的因素,包括吸煙,糖尿病,肥胖,高血壓,缺乏運動,冠狀動脈疾病,高膽固醇和超過65歲。人口統計學趨勢表明外周血管疾病的患病率隨着時間的推移而增加,主要是由肥胖和糖尿病水平的上升以及人口老齡化所驅動。我們相信,我們強大的品牌、已建立的銷售隊伍、一系列的外周血管器械產品以及廣泛的血管外科客户網絡使我們能夠在這個市場中佔據越來越大的份額。
血管外科醫生治療外周血管疾病,並執行與其他疾病(如終末期腎病)相關的血管手術。我們估計,全世界有超過22,000名血管外科醫生。與其他專家(如介入心臟病學家和介入放射科醫生)相比,血管外科醫生同時進行開放性血管手術和血管內手術。開放性血管手術包括打開身體,切割血管和血管。血管內手術通常是微創的、基於導管的,並且使用實時成像從內部治療血管。我們估計,於二零二三年,超過95%的淨銷售額來自開放手術中使用的器械。
我們的業務策略
我們通過三管齊下的戰略來發展業務:1)追求專注的呼叫點;2)競爭低競爭對手的利基產品的銷售;3)擴大我們的全球直銷隊伍,同時收購補充設備。我們已將收購作為進一步滲透外周血管器械市場的主要手段,我們預計未來將繼續這一戰略。我們目前在馬薩諸塞州伯靈頓的總部生產我們的大部分產品。
|
• |
集中呼叫點。 我們一直將產品提供和銷售努力指向血管外科醫生,並估計2023年我們約80%的銷售額來自血管外科醫生使用的器械和冷凍保存組織。由於血管外科醫生通常同時進行開放性血管手術和血管內手術,我們在開放性和血管內市場向同一終端用户銷售器械。最近,我們開始關注鄰近的市場終端用户,如心臟外科醫生,他們可以使用我們的設備和組織處理能力。 |
|
• |
低競爭利基細分市場。 我們尋求在利基市場建立和保持領先地位,我們定義為全球年收入低於2.5億美元。我們相信,較大的競爭對手對這些細分市場的關注相對不足,以及我們產品的差異化功能和一致的質量,使銷售價格更高,市場份額增加。 |
|
• |
擴大直銷隊伍,增加配套產品。 我們主要通過在北美、歐洲和亞太地區的直銷隊伍銷售我們的產品。截至2023年,我們擁有136名直銷代表,包括3名出口經理。我們相信,直接到醫院銷售可建立更緊密的客户關係,可獲得更高的售價及毛利率,且毋須承受與分銷商營業額有關的客户流失風險。在我們沒有直接銷售隊伍的國家,我們通過分銷商銷售我們的產品。截至2023年12月31日止年度,我們約96%的淨銷售額來自直接到醫院的銷售隊伍,並無單一醫院客户佔我們淨銷售額的2%以上。我們打算進一步擴大和多樣化我們的產品種類,並增加新的技術平臺,主要是通過收購。我們相信,我們在收購和整合產品線和業務方面的經驗是我們的競爭優勢之一。我們不斷評估收購可能與我們的產品供應互補的額外產品線和業務,完善我們現有的產品線或為我們現有的技術開發新的應用程序。我們還在新的細分市場和地區獲得監管部門的批准,以進一步進入更廣泛的外周血管器械市場並選擇其他市場。 |
獲取歷史
我們於1983年由George D. LeMaitre醫學博士,他是一位血管外科醫生,設計並開發了LeMaitre瓣膜刀。通過24項互補收購以及研發,我們已擴展到16條產品線,其中包括13種不同的產品類型:
|
年 |
採辦 |
主要產品和服務 |
||
|
1998 |
VascuTape |
不透射線膠帶製造操作 |
||
|
1999 |
TufTex |
栓子切除導液管 |
||
|
2001 |
Pruitt F3分流器 |
頸動脈分流管、球囊導管和腹腔鏡膽囊切除術器械 |
||
|
2003 |
credent |
聚碳酸酯接枝物 |
||
|
2004 |
Anasto夾子 |
容器封閉系統 |
||
|
2005 |
恩多梅德 |
支架移植物 |
||
|
2007 |
LeverEdge |
造影劑注射器 |
||
|
2007 |
MollRing切割機 |
遠端動脈內膜切除術器械 |
||
|
2007 |
UnBalloon |
覆膜支架建模導管 |
||
|
2007 |
AlboGraft |
聚酯移植物和補片 |
||
|
2010 |
壽命 |
eptfe移植物 |
||
|
2012 |
XenoSure |
生物補片 |
||
|
2013 |
Pruitt F3—S分流管 |
頸動脈分流管和取栓導管 |
||
|
2013 |
Trivex |
動力靜脈切除系統 |
||
|
2014 |
Omniflow II |
生物合成移植物 |
||
|
2014 |
佩裏武 |
血管鏡 |
||
|
2015 |
Eze—Sit OUS |
閥門切割器 |
||
|
2016 |
Procol |
生物移植物 |
||
|
2016 |
RestoreFlow |
人體組織冷凍保存服務 |
||
|
2018 |
Syntel |
栓子切除導液管 |
||
|
2018 |
賁門 |
聚酯移植物、瓣膜切割器、外科膠 |
||
|
2019 |
Eze—Sit US |
閥門切割器 |
||
|
2019 |
cardiocel |
生物補片 |
||
|
2020 |
阿特移植 |
生物移植物 |
我們的大部分設備都是在內部製造的,24項收購中有21項的製造業務完全搬遷到馬薩諸塞州伯靈頓的總部。與RestoreFlow同種異體移植物相關的人體組織處理和冷凍保存操作發生在我們伊利諾伊州福克斯河格羅夫工廠。Artegraft生物移植生產發生在我們的北布倫瑞克,新澤西州的工廠。在有限的基礎上,我們使用第三方製造商,目前我們從澳大利亞馬拉加的Anteris Technologies Ltd(Anteris,前身為Admedus Ltd)購買我們的VascuCel和VascuCel補丁。2022年,我們開始將AmsterCel及VascuCel貼片的生產搬遷至Burlington。
我們的產品和服務
我們的產品線主要用於治療血管疾病,其中大部分用於開放性血管手術和透析通路。我們還提供人體血管和心臟組織冷凍保存服務。於二零二三年、二零二二年或二零二一年,並無單一產品線佔我們收入的20%以上。
我們的產品包括一套生物產品。這些產品包括我們為Elutia Inc銷售的XenoSure補片(牛心包)、EschoCel和VascuCel補片(牛心包)、Artegrag(牛頸動脈)、Omniflow II生物合成補片(羊組織和合成補片)、RestoreFlow同種異體移植物冷凍保存服務(人屍體組織)和心血管補片(豬細胞外基質)。(Elutia,前身為Aziyo Biologics,Inc.)。這些生物產品佔我們2023年銷售額的51%,2022年銷售額的49%,2021年銷售額的48%。
移植
通過我們的RestoreFlow同種異體移植業務,我們提供人體屍體組織冷凍保存服務,特別是靜脈、動脈和心臟瓣膜管道的處理和冷凍保存。我們的RestoreFlow同種異體移植物是冷凍保存的人體組織移植物,包括隱靜脈、股靜脈和動脈、主動脈和髂動脈、主動脈和肺動脈帶瓣導管和肺補片。這些同種異體移植物用於各種血管重建,如外周旁路、血液透析通路和主動脈感染,以及心臟修復和重建。
血管鏡
我們的PerVu一次性血管內窺鏡是一種用於觀察血管內腔的光纖導管。PeriVu還可在原位旁路手術期間直接顯示瓣膜。
用於栓塞和血栓切除術的球囊導管
我們的TufTex和Syntel系列栓子切除導管用於清除動脈中的血栓。我們銷售單腔乳膠和無乳膠栓子切除導管,以及雙腔乳膠和無乳膠栓子切除導管。雙腔取栓導管可清除凝塊,同時沖洗或導絲可跟蹤。我們的Syntel血栓切除術導管具有硅膠球囊,用於清除靜脈系統中的血栓。
用於封堵和灌注的球囊導管
我們的封堵導管暫時封堵血流,讓外科醫生有時間和空間完成手術。灌注導管將血液和其他流體灌注到脈管系統中。我們的Pruitt系列封堵和灌注導管通過使用內部球囊固定而不是傳統的外部夾持來減少血管創傷。
牛移植物
我們的Artegraft生物移植物是用於透析通路的牛頸動脈。其生物纖維基質經過處理以增強長期通暢性,並提供緊密編織、交聯的導管,具有柔性和順應性。人工關節也適用於下肢旁路手術。
血管和心臟貼片
我們的XenoSure生物補片由牛心包製成,主要用於手術幹預後的血管閉合。
我們的VascuCel和VascuCel生物補片是無細胞膠原生物支架,具有優化的生物相容性和零醛毒性。這些牛心包補片用於血管修復以及心臟修復和重建,包括新生兒修復。
我們為Elutia分發的心血管貼劑由細胞外基質製成,旨在減少炎症並刺激健康組織的形成。這些豬補片用於心臟修復以及血管修復和重建,包括新生兒修復。
頸動脈分流管
我們的Pruitt F3和Flexcel頸動脈分流器用於在頸動脈內膜切除術期間暫時將血液分流至大腦,同時外科醫生在頸動脈內膜切除術期間去除斑塊。我們的Pruitt F3分流器具有球囊內固定功能。我們的Flexcel分流器是一種非球囊分流器,專為喜歡外固定的外科醫生提供。
密閉系統
我們的Anasto卡箍AC和Anasto卡箍GC閉合系統使用鈦夾代替縫線將血管彼此連接。這些閉合系統產生了間斷的吻合,隨着血管脈動而擴張和收縮,一些外科醫生認為這提高了吻合的耐久性。Anasto卡箍AC和Anasto卡箍GC閉合系統也可用於神經應用中的硬腦膜閉合。
綿羊血管移植物
我們的Omniflow II生物合成血管移植物是一種交聯羊膠原蛋白與聚酯網內骨架的複合物。適用於下肢旁路和透析通路。
聚酯血管移植物
我們的AlboGraft和Cardial血管移植物是膠原浸漬聚酯編織和編織移植物,用於旁路或置換病變動脈。這些假體有直管和分叉版本。
ePTFE血管移植物
我們的LifeSpan血管移植物是一種膨脹聚四氟乙烯(ePTFE)移植物,用於旁路或置換病變動脈並創建透析通路部位。LifeSpan有普通和薄壁兩種選擇,可選擇全部或部分外部螺旋支撐。我們的階梯式和錐形LifeSpan移植物旨在降低盜血綜合徵和高心輸出量的風險,這些併發症有時會出現在透析通路移植物中。
不透射線膠帶
我們的VascuTape不透射線膠帶是一種柔性的醫用級膠帶,上面印有釐米或毫米標記,用專有的不透射線油墨印刷,眼睛和X光機或熒光鏡都能看到。VascuTape應用於皮膚,為外科醫生和介入醫生提供了一種簡單的方法來交叉參考患者身體的內部和外部,使他們能夠定位皮膚下的分支或病變。
瓣刀
我們的瓣膜刀切割或破壞隱靜脈中的瓣膜,隱靜脈是一種從足部到腹股溝的靜脈,因此靜脈可以被改造為動脈,將血液通過病變動脈輸送到小腿或足部。我們相信,我們的瓣膜刀可以通過幾個小切口而不是一個連續的腳踝至腹股溝切口來進行下肢搭橋手術,從而減少住院時間和傷口併發症的可能性,從而降低醫院的成本。
銷售和市場營銷
截至2023年12月31日,我們僱用了136名銷售代表,其中包括3名出口經理。我們相信,擴大銷售隊伍是成功的關鍵因素,並仍是我們的主要長期策略之一。2023年約96%的淨銷售額發生在我們聘用銷售代表的地區。在我們的直接市場之外,我們通常通過特定國家的分銷商銷售我們的產品。
我們的營銷工作包括直郵、數字營銷和醫學大會展覽,我們相信這些對我們的品牌發展非常重要。我們相信,市場營銷使我們能夠與我們直接銷售人員無法接觸的血管外科醫生建立聯繫,同時也增強了我們的品牌知名度和產品供應給現有客户。
我們還為我們的血管外科醫生提供特定手術的培訓,包括原位旁路手術、頸動脈內膜切除術和中斷吻合術,以及針對經驗不足的醫生的一般手術技能培訓計劃,以向他們介紹我們的產品。
研究與開發
我們的研發工作包括監管和臨牀工作、工藝工程、生產轉移和產品開發。最近,我們的研發工作集中在心臟同種異體移植和下一代動力靜脈切除術項目,以及旨在提高毛利率的生產轉移和重大工藝工程變更。於二零二二年,我們完成了Omniflow II產品線的搬遷工作,並獲批准在歐盟(EU)銷售在伯靈頓生產的設備。該產品線的轉移活動於2023年結束。目前,我們已申請CE認證。此外,我們將開始銷售在美國伯靈頓製造的E—Cel和VascuCel設備,2024年上半年加拿大和亞太部分地區。
我們經常使用從獨立醫生那裏收到的反饋來演示產品功能,然後再開始全面營銷任何產品。為此,我們將於2024年上半年在美國啟動下一代動力靜脈切除術設備PhasTIPP的有限市場發佈(LMR)。
此外,我們於2022年開始審查和更新Artegraft產品線的生產工藝,以申請其歐洲醫療器械法規(2017/745)(MDR)CE標誌。“Artegraft MDR就緒”項目於二零二三年被視為高優先項目,並於二零二三年十二月申請CE標誌。我們預計在2025年下半年之前不會批准在歐盟上市。我們將於2024年和2025年在其他歐洲市場尋求同種異體移植保存服務的批准。例如,我們於2023年向愛爾蘭和德國衞生當局提出申請,尋求批准在這些地區進口和銷售我們的同種異體移植保存服務。
我們的監管和臨牀工作一直專注於獲得和維護不同地區的監管批准。過去,我們通常不會進行臨牀試驗,因為我們通常購買的產品線已獲得監管部門批准。此外,我們更願意避免與啟動臨牀試驗相關的時間、費用和風險。然而,許多地區越來越多的監管要求導致需要更多的臨牀測試。 因此,近年來,我們研發開支的這一部分有所增加。2017年,我們啟動了臨牀試驗,努力獲得XenoSure貼片在中國的心臟和血管適應症的批准。我們已完成試驗入組,並於2022年6月提交心臟執照申請。我們預計將於2024年向中國國家藥品監督管理局(NMPA)提交血管申報。於二零二一年,我們亦與Anteris訂立協議,承擔我們的VascuCel及VascuCel產品上市後臨牀隨訪研究的主要責任。
2017年,歐盟通過了MDR,取代了歐洲醫療器械指令(93/42/EC,經2007/47/EC修訂)(MDD),並於2021年5月26日生效。在此日期之後,我們的MDD證書有效期至其有效期,有效期為2023年8月至2024年5月。歐盟委員會隨後延長了MDR的全面適用期,允許我們的產品證書根據其分類有效期至2027年和2028年。我們的產品最終將受到MDR的約束,該MDR要求我們所有的產品,無論分類如何,都必須根據新的、更嚴格的標準獲得新的CE標誌。展望未來,我們預計將有很大一部分監管和臨牀時間和費用用於這一過渡。2023年,我們的Pruitt F3分流管、Flexcel分流管和XenoSure心包補片獲得MDR CE認證。有關MDD證書狀態的更多信息,請參見下面的“政府法規”。
製造和加工
我們的主要生產設施位於馬薩諸塞州伯靈頓。我們還在新澤西州北布倫瑞克(North Brunswick)生產Artegraft,伊利諾伊州福克斯河格羅夫(Fox River Grove)加工RestoreFlow同種異體移植物。
我們的戰略是將大部分收購產品線的生產轉移到伯靈頓的業務。2019年,我們擴大了生物潔淨室,2020年,我們開始在這個新的潔淨室進行Omniflow II的生產轉移。2019年,我們租賃了第五座伯靈頓大樓,並將我們的行政職能全部搬遷到這座大樓,以便擴大我們的生產足跡。於二零二零年,我們完成將Syntel取栓業務轉移至Burlington。於二零二一年,我們完成了額外的生物潔淨室的建設,以生產EscuCel及VascuCel。2022年,我們將伯靈頓主要潔淨室及原材料倉庫的佔地面積擴大約40%,以適應產量增加及2021年及2022年直接僱傭勞動力的激增。於2023年,我們大致完成轉讓我們生產的Auscel及VascuCel。我們相信,這些潔淨室擴建和產品轉移將提高我們運營人員的工作效率。
我們生產某些專有組件,自行組裝大部分設備,並檢查、測試和包裝所有成品。通過使用原材料製造產品,並儘可能多地組裝和測試我們的產品,我們相信我們可以保持更好的質量控制,確保遵守適用的監管標準,限制外部接觸我們的專有技術,確保充足的產品供應,並快速進行設計修改。我們擁有定製設計的專有製造和加工設備,併為現有的生產機械開發了專有增強功能。我們的產品是按庫存生產的。
我們處理和冷凍保存由合格的美國組織採購組織提供給我們的人體組織。捐贈的人體組織是由這些組織從已故捐贈者那裏獲得的。我們對組織和捐贈者的身體狀況和特徵以及捐贈者的病史有嚴格的規範。
我們的管理信息系統為我們提供了評估業績、收集商業情報和做出更好的戰略決策的能力。這些系統包括客户關係管理、訂單輸入、發票、在線庫存管理、批次跟蹤、採購、車間控制、裝運和分銷分析以及各種面向會計的功能。這些系統使我們能夠跟蹤我們的產品從訂單開始到生產,然後再到交付給客户。
我們從第三方購買某些組件,並擁有由第三方生產的某些產品線。我們的大部分組件都可以從多個供應商處輕鬆獲得,但我們確實依賴單一和有限來源供應商來提供幾個關鍵組件或產品,最值得注意的是從澳大利亞馬拉加的Anteris購買了E—Cel和VascuCel設備。雖然我們確實與Anteris有合同安排,但我們沒有與許多供應商和製造商簽訂合同安排,我們根據需要訂購供應品和產品。有些供應品、產品或組件的替代性、經驗證的來源相對較少,或在某些情況下沒有。在任何時候,我們的供應商都可能停止或無法以可接受的條款生產這些材料。如有需要,確定和確定額外或替代供應商的資格可能無法迅速完成或根本無法完成,而且可能涉及大量費用。到目前為止,我們尚未經歷任何重大供應中斷。
質量保證
我們的伯靈頓和北布倫瑞克的生產設施已通過ISO 13485標準認證,這使我們能夠提供高質量的產品,並滿足歐盟、加拿大和其他外國司法管轄區的監管要求。我們位於伊利諾伊州福克斯河格羅夫的工廠已獲得美國組織庫協會的認可,用於處理、儲存和分配心臟和血管組織移植。我們的所有生產和加工設施均接受不同監管機構和公告機構的定期檢查,以確保符合監管要求。更多信息見"政府條例"。於二零二三年,我們進行了七項監管審核及十八項內部審核。沒有任何重大發現。在同一時期,我們在歐洲有一次與製造過程有關的II級召回,在美國有一次與供應過程有關的III級召回。兩次召回都沒有涉及患者受傷。
競爭
我們競爭的領域具有技術進步和科學發現導致的週期性變化的特點。沒有一家公司與我們所有的產品線競爭;相反,我們與一系列公司競爭。值得注意的較大競爭對手包括雅培,百特國際公司,Artivion、Becton、Dickinson and Company、Edwards Lifesciences Corporation、Getinge、LifeNet Health、Silk Road Medical、Terumo Medical Corporation和W. L.戈爾公司
我們的許多競爭對手擁有比我們更多的資金、技術、研發、監管、營銷、銷售和人力資源。某些競爭對手能夠以較低的成本生產,因此可能以較低的價格提供產品,特別是聚酯和ePTFE血管移植物等產品。某些競爭對手在開發和改進產品、獲得監管部門批准以及製造和銷售此類產品方面也可能擁有更豐富的經驗。在同種異體移植的情況下,某些競爭者可能在組織來源方面具有優勢。此外,我們的一些競爭對手可能會在我們之前獲得專利保護或監管部門的批准或許可,或實現產品商業化,這可能會對我們的業務造成不利影響。
我們產品的成功依賴於有效的現場支持以及卓越的技術、質量、可用性、可靠性、易用性、成本效益、醫生熟悉度和品牌認可度。雖然我們也以價格為基礎進行競爭,但我們技術先進的產品往往以更高的價格出售。我們的持續成功可能取決於我們是否有能力擴大和優化我們的直接銷售渠道,收購補充性血管器械,獲得監管和報銷批准,保持充足的庫存,並留住熟練的人才。
我們還根據程序類型進行競爭。外周血管疾病的治療經歷了從開放血管手術向微創血管內手術的轉變,我們的大多數產品主要用於開放血管手術。因此,我們的有效競爭能力依賴於與血管器械市場以及微創血管內市場的產品供應保持同步。
我們的產品用於治療心血管疾病、腎臟疾病、糖尿病和其他相關疾病。我們產品和服務的市場競爭激烈,並受到新產品引入和其他行業參與者活動的影響,包括新產品和療法的引入。最近推出的胰高血糖素樣肽1(GLP—1)藥物等療法表明,這類藥物可能會導致長期體重減輕。這可能會縮小我們可尋址市場的規模並減少我們的銷售額。儘管成本高、給藥方法(注射)不方便和潛在的副作用,但不能保證GLP—1不會對我們的業務產生不利影響。
知識產權
我們相信,我們的成功在一定程度上取決於我們對專有技術的開發和維護。我們依靠商業祕密法、專利法、商標法和保密法的結合來保護我們的知識產權。
我們在美國擁有有限的專利組合,我們的專利將在2031年到期
我們相信,我們的品牌也是我們成功的重要因素。我們依靠普通法和註冊商標來保護我們的品牌。我們的一些註冊商標包括LeMaitre、Artegraft、XenoSure、Pruitt、VascuTape、Glow 'N Tell和RestoreFlow,每個商標都在美國註冊,歐盟,或兩者,以及在某些情況下在其他國家。
我們的大多數產品不受專利保護。當我們獲得未獲得專利的商業化產品時,如Artegraft生物移植物,則無法獲得專利保護。過去,其他公司已獨立開發或以其他方式收購可比較或實質上等同的專有信息和技術,且無法保證其他公司將來不會這樣做。我們要求員工和顧問簽署保密協議。這些保密協議要求員工將其在受僱於我們期間所做或構思的任何發明的所有權利轉讓給我們。我們通常還要求我們的顧問將其聘用期間所做的任何發明轉讓給我們。然而,不能保證這些協定將提供有意義的保護或適當的補救。
外國的法律通常不像美國法律那樣保護我們的所有權,我們在某些外國司法管轄區執行我們的所有權時可能會遇到更大的困難。
見"項目1A。風險因素"用於描述與我們的知識產權相關的某些風險。
政府監管
醫療器械和人體組織受美國FDA和其他聯邦和州當局以及外國政府的監管。
美國醫療器械法規
我們的大多數產品是受FDA根據21 U.S. Code第9章《聯邦食品、藥品和化粧品法案》(FDCA)廣泛監管的醫療器械。FDA法規管理產品開發、測試、製造、包裝、標籤、儲存、許可或批准、廣告和促銷、銷售和分銷以及進出口。
上市前途徑
大多數醫療器械在商業分銷前必須獲得FDA的510(k)批准或上市前申請批准(PMA批准)。被認為風險相對較小的器械分為I類或II類,這要求製造商提交上市前通知,要求允許商業分銷;這稱為510(k)許可。一些低風險器械不受此要求的限制。II類器械可能受到特殊控制,例如性能標準和FDA指南,但不適用於I類器械。FDA認為構成最大風險的器械,例如生命維持、生命支持或植入式器械,或被認為與之前獲得510(k)批准的器械或修正案前III類器械實質等同的器械(即(1976年5月28日之前處於商業分銷中),未要求PMA申請的)被歸入III類,這通常需要PMA批准。在所有情況下,510(K)提交和PMA申請都需要繳納使用費。
510(k)許可。為了獲得510(K)許可,製造商必須提交投放市場前的通知,證明建議的設備在預期用途和性能方面與“預測設備”(即,之前通過510(K)許可的第I類或第II類設備或修改前的第III類設備)。FDA的510(K)清除途徑通常需要3到12個月的時間。在審查510(K)批准時,FDA可能會要求提供更多信息,包括臨牀數據。我們在美國銷售的幾乎所有設備都獲得了510(K)許可,除了我們的ARTERGET生物血管移植物。
在設備獲得510(K)許可後,任何可能顯著影響其安全性或有效性的修改,或將構成FDA指南指定的重大變化的任何修改,都需要新的510(K)許可。FDA要求每個製造商做出這一決定,但FDA可以審查任何這樣的決定。如果FDA不同意製造商不尋求新的510(K)許可的決定,該機構可能會要求新的510(K)許可。FDA還可以要求製造商停止銷售和/或召回修改後的設備,直到獲得510(K)許可。
PMA批准。PMA批准途徑需要FDA滿意的擬議設備的安全性和有效性的證據,這使得這一途徑更加昂貴、漫長和不確定。PMA申請必須提供臨牀前和臨牀試驗數據,以及與設備設計、製造和標籤有關的設備及其組件的信息。作為PMA審查的一部分,FDA將經常檢查製造商的設施是否符合質量體系法規(QSR)。
如果FDA批准了PMA,批准的適應症或聲稱可能比尋求的更有限。PMA可以包括批准後的條件,以確保設備的安全和有效性,其中包括對標籤、促銷、銷售和分銷的限制。FDA還可能對上市後研究或註冊提出要求。不遵守批准條件可能會導致重大的不利執法行動,包括喪失或撤回批准。即使在PMA獲得批准後,如果設備或其標籤或製造工藝被修改,也可能需要新的PMA或PMA補充。補充PMA可要求提交原始PMA所需的相同類型的信息,儘管補充一般僅限於支持擬議更改所需的信息。
臨牀試驗。臨牀試驗通常需要支持PMA申請,有時還需要支持510(K)批准。在某些情況下,較小的可行性研究可能會先於更全面、關鍵的研究設備豁免(IDE)臨牀試驗。所有研究設備的臨牀研究都必須符合FDA的要求。如果研究設備可能對患者構成重大風險,FDA必須批准IDE申請。非重大風險設備不需要提交IDE。重大風險和非重大風險調查設備都需要獲得研究中心機構審查委員會(IRBs)的批准。FDA和IRB可以隨時暫停臨牀試驗。在研究期間,研究人員必須獲得患者的知情同意,遵循研究計劃和研究方案,控制研究設備的處置,並遵守所有報告和記錄保存要求。
儘管QSR並不完全適用於調查設備,但對設計和開發控制的要求確實適用。贊助商還必須按照IDE申請中描述的質量控制和FDA可能對製造施加的任何IDE批准條件來製造研究設備。
從歷史上看,我們的設備是通過510(K)計劃進入美國市場的。我們目前在美國營銷或銷售的任何產品都沒有使用PMA流程,除了我們的ArteMigrate血管移植物,這些產品在收購時獲得了PMA批准。
售後監管
設備投放市場後,無論其分類或上市前途徑如何,均適用重要的監管要求,包括:
|
• |
每年向美國食品和藥物管理局註冊生產設施和設備清單; |
|
• |
QSR合規性,要求成品設備製造商和合同製造商遵循設計、測試、控制、文檔和其他質量保證程序; |
|
• |
標籤法規和FDA禁止推廣用於未經批准、未經批准或非標籤用途的產品,以及與促銷活動相關的其他要求; |
|
• |
醫療設備報告條例,要求製造商在其設備可能導致或導致死亡或嚴重傷害時向FDA報告;以及 |
|
• |
糾正和移除報告條例,要求製造商向FDA報告任何現場糾正和產品召回或移除,如果採取措施以降低器械對健康造成的風險。 |
我們接受FDA的檢查和營銷監督,以確定我們是否符合監管要求。FDA最近一次對伯靈頓工廠的檢查是在2023年5月,結果發現了一個觀察結果,隨後得到了解決。不遵守FDA要求可能導致,除其他外,公開警告信、罰款、禁令、民事處罰、召回或扣押產品、全部或部分暫停生產、FDA未能批准上市許可、撤回上市許可和刑事起訴。倘我們的其中一家供應商未能遵守上文所述的我們的質量要求,我們可能需要對新供應商進行資格認證,並可能出現生產延誤。
我們參與了醫療器械單一審核計劃(MDSAP),該計劃允許製造商接受在美國接受的通用質量體系審核,日本、澳大利亞、加拿大和巴西,取代每個監管機構的單獨審計。維護此認證是在某些地區(包括加拿大)維持銷售的要求。未能保持該認證的良好信譽可能導致我們在加拿大或其他地區的銷售工作暫停。我們的最後一次MDSAP審核於2023年7月進行,審核結果被我們的公告機構SGS視為令人滿意。
未經FDA批准或許可的美國生產醫療器械的國際銷售受FDA出口要求的約束。在向外國出口未經批准的產品之前,我們必須遵守FDA的出口程序。
醫療器械的國際監管
在許多國家,醫療器械的銷售均受監管要求的約束。監管審查程序可能因國家而異。歐盟已經通過了許多與醫療器械相關的指令和標準,規範其設計、製造、臨牀試驗、標籤和不良事件報告,包括MDD和最近的MDR。符合MDD或MDR要求的器械有權帶有CE標誌,並可在歐盟國家、英國(UK)、冰島、列支敦士登、挪威、土耳其和瑞士分銷。歐盟的每個成員國都設立了一個"主管當局",在其領土上執行指令/法規。
2017年4月,歐盟通過了新的醫療器械MDR法規,取代了MDD,並於2021年5月26日生效,大多數II類和III類器械的過渡期分別於2027年和2028年結束。我們的產品受MDR的約束,其中要求我們的所有產品,無論分類如何,都必須根據MDR下的新的、更嚴格的標準獲得新的CE標誌。作為CE標誌批准的一個條件,III類和植入式器械將需要臨牀研究的臨牀證據。隨着我們的公告機構繼續從MDD過渡到MDR,他們已經開始對我們執行這些更嚴格的要求,以保持我們的某些產品的CE標誌。如果我們未能及時或根本未能在MDR項下為我們的任何其他產品獲得新的CE標誌,我們產品未來在歐盟的銷售可能會受到不利影響。2023年1月,我們的Pruitt F3分流管獲得了MDR下的首個CE認證,2023年11月,我們獲得了XenoSure和Flexcel器械的認證。本公司的AmsterCel及VascuCel產品的MDD CE標誌將於2023年8月到期,但其後已延長至2028年5月。我們目前與Anteris簽訂了供應協議,將繼續供應產品至2025年1月,屆時我們預計將過渡到伯靈頓工廠供應產品。我們已於2023年6月提交了針對這些產品的伯靈頓製造版本的MDR申請,預計在18—24個月內獲得批准。如果我們未能獲得MDR CE標誌或經歷重大延誤,我們在歐洲的E—Cel和VascuCel銷售可能會受到不利影響。
MDD和MDR定義了器械上市前必須滿足的基本要求,制定了器械批准程序,併為主管部門制定了指令。基本要求包括製造、設計、性能、標籤和安全要求,可能包括提供某些臨牀數據。
低風險器械製造商通常可以根據自我聲明證明符合性。歐洲標準化委員會已經針對特定類型的醫療器械採用了許多統一標準。遵守相關標準確立了符合基本要求的推定。高風險器械的製造商通常必須使用一個“公告機構”——一個指定的獨立第三方——來評估符合性。該第三方評估可能包括對製造商質量體系的審核和對製造商設備的測試。通常需要由歐盟內一個國家的公告機構進行評估,以進行產品的商業分銷。我們的大多數器械被認為是需要公告機構評估的高風險器械。
MDD和MDR還涉及醫療器械的廣告和推廣、臨牀研究以及處理不良事件的要求。醫療器械的上市後監督通常在國家的基礎上進行;但是,MDD和MDR規定了報告不良事件的某些要求。醫療器械警戒系統是歐盟管理和監測不良事件報告的機制。
英國於2020年1月31日離開歐盟,通常被稱為“脱歐”。我們於2019年在英國赫裏福德開設辦事處,主要是為了應對英國退歐。根據英國與歐盟協定的正式退出安排,英國將受過渡期限制,直至二零二零年十二月三十一日。在2020年12月31日之後,希望將其設備進口到英國的醫療器械製造商獲得了一個註冊至2021年底的過渡期。我們遵守了這一期限,我們所有的CE標誌繼續在英國得到認可。英國藥品和保健產品監管局(“MHRA”)隨後宣佈,CE標誌將繼續在英國獲得認可,歐盟認可的認證機構頒發的證書將在英國市場繼續有效,直至2027年和2028年,以配合MDR過渡。此後,所有在英國銷售的器械都將需要獲得英國認可機構認證的英國合格評定(“UKCA”)標誌。如果我們未能獲得UKCA的一致性,我們在英國的銷售可能會受到負面影響。2023年1月,我們獲得了Pruitt F3分流器的首個UKCA標誌,2023年11月,我們獲得了XenoSure和Flexcel的第二個和第三個UKCA標誌。
如果我們的產品被證明存在缺陷,我們可以自願召回,或者FDA或國際等同機構可以要求我們召回。如果有人因故障或產品缺陷而受到傷害,我們可能會遇到產品責任索賠。任何糾正行動,無論是自願的還是非自願的,以及在訴訟中為自己辯護,都需要我們投入時間和資本。未來的召回或索賠也可能導致巨大的成本和不利的宣傳。
在某些情況下,我們依賴國際分銷商或第三方代理商獲得上市前批准和完成產品註冊。未來,我們預期將繼續以這種方式依賴分銷商及代理商(如適用)。
加拿大通過加拿大衞生部(HC)監管醫療器械。HC將醫療器械分為四個類別,其中I類風險最低。I類和II類設備通常在獲得CE標誌或列入公司ISO認證並通過傳真申請提交後方可銷售。高風險器械(III類和IV類)需要與美國510(k)申請類似的申報資料。作為加拿大器械許可證的持有者,我們在加拿大沃恩辦事處接受HC的檢查,並且我們必須保存有效的MDSAP證書。我們的加拿大沃恩辦事處最近一次檢查是在2017年8月,結果令人滿意。伯靈頓辦事處最近一次於二零二三年七月根據MDSAP進行審核,結果令人滿意。
在日本,厚生勞動省(MHLW)通過《藥事法》監管醫療器械。作為日本器械許可證持有者,我們還接受多個日本當局的檢查,包括日本製藥和醫療器械管理局(PMDA)、東京都政府(TMG)以及日本電氣安全和環境技術實驗室(JET)等第三方。我們的東京辦事處最近一次於二零二三年三月接受JET視察,結果令人滿意。
澳大利亞通過治療用品管理局(TGA)監管醫療器械的進口和銷售。TGA圍繞着與歐洲類似的要求建立了監管框架。因此,低風險醫療器械可使用其現有的歐盟頒發的CE標誌獲得上市許可。風險較高的器械必須經過設計審查,這可能是昂貴的,需要更長的時間。頒發的醫療器械許可證不需要續期,但確實需要年費以保持有效。作為澳大利亞器械許可證的持有者,我們還在澳大利亞和美國接受TGA的檢查。我們之前生產Omniflow II移植物的北墨爾本工廠於2018年12月接受了TGA的檢查,伯靈頓工廠於2023年7月接受了MDSAP的檢查,兩次檢查的結果均令人滿意。澳大利亞要求所有外國製造商都必須有一個國內的“贊助商”,該贊助商必須在澳大利亞境內擁有許可證業務。我們的許可證由我們的贊助商Emergo Group管理。
在中國,國家藥品監督管理局(NMPA)監管和批准所有醫療器械。中國有三級風險分類體系,其中一級風險最低。作為先決條件,需要母國批准,例如510(k)或PMA批准。此外,NMPA經常在自己的測試實驗室測試設備。審批過程漫長,通常需要臨牀試驗。NMPA許可證有效期為五年,需要更新。作為中國器械許可證持有人,我們在中國和美國均接受NMPA的檢查。NMPA於2018年8月對我們的上海辦事處進行了檢查,結果令人滿意。國家藥品監督管理局要求所有位於中國境外的公司指定一個在中國境內註冊業務的法人作為許可證持有人。2015年成立中國子公司後,我們將第三方許可證持有人的許可證轉讓給我們的子公司。
美國對人體組織的監管
林業局
我們的同種異體移植物受FDA根據聯邦法規第21篇第1271部分(人體細胞、組織和細胞和組織產品)的廣泛監管。這些法規是根據《公共衞生服務法》第361條頒佈的,該條授權FDA發佈法規,以防止傳染病的傳播。根據這些法規,FDA要求加工人體細胞、組織以及細胞和組織產品的機構進行註冊。FDA的這些法規還建立了捐贈者資格標準、當前的良好組織規範和其他程序,以防止此類產品引入、傳播和傳播傳染病,包括通過捐贈者篩查和檢測。我們位於伊利諾伊州福克斯河格羅夫的工廠和亞利桑那州錢德勒的工廠均在FDA生物製品評估和研究中心註冊。該條例還規定食品和藥物管理局對組織機構進行檢查。FDA最近於2023年4月對我們伊利諾伊州福克斯河格羅夫工廠進行了檢查,結果令人滿意。
AATB
我們自願遵守組織庫行業認證組織美國組織庫協會(AATB)的標準。AATB已經建立了組織庫的標準,並管理一個認證計劃。認證必須每三年更新一次。我們的福克斯河格羅夫,伊利諾伊州的工廠已獲得AATB認證,用於處理,儲存和分配心臟和血管組織移植至2024年5月13日。AATB有權隨時檢查會員。AATB最近於2023年11月視察了伊利諾伊州福克斯河格羅夫工廠,結果令人滿意。
nota
根據《國家器官移植法》(NOTA),任何人或實體故意獲取、接收或以其他方式轉移任何人體器官以用於人體移植,如果轉移影響到州際商業,則屬非法。然而,“有價對價”不包括與人體器官的切除、運輸、植入、加工、保存、質量控制和儲存相關的合理支付。我們認為,我們收到的關於我們的同種異體移植物的賠償屬於這一法定例外。
國家法規
某些州對人體組織的加工、儲存和分配進行了管理。我們在加利福尼亞州、特拉華州、佛羅裏達州、伊利諾伊州、馬裏蘭州、紐約州和俄勒岡州註冊。這些州的監管機構可能會不時檢查我們的福克斯河格羅夫,伊利諾伊州的設施,以監測其法規的遵守情況。
其他美國法規
我們的產品和服務受銷售或分銷我們產品和服務所在司法管轄區的各種州和地方法律的約束。有聯邦、州和地方法律與安全工作條件、生產實踐、環境保護、火災危險控制和危險物質的處置等事項有關。我們受各種聯邦和州法律約束,管理我們與醫生和其他購買或推薦我們產品的人的關係。例如,聯邦法律禁止任何形式的付款,以誘導根據醫療保險,醫療補助或任何其他聯邦醫療保健計劃支付的任何項目的轉診。許多州都有類似的法律。我們無法保證我們現時或將來不會因遵守該等法律及法規而產生重大成本,或該等法律或法規不會對我們的業務造成不利影響。
我們遵守聯邦、州和地方法律、規則、法規和政策,管理與我們的運營有關的某些有害和潛在有害物質的使用、生成、製造、儲存、氣體排放、污水排放、處理和處置。儘管我們相信我們已遵守該等法律及法規,且從未被要求糾正任何不合規情況,但不能保證我們日後不會被要求遵守環境法規。
國際人體組織管制
在美國境外銷售人體組織服務需遵守各國不同的國際監管要求。與醫療器械類似,在歐盟銷售組織首先獲得允許組織進入歐洲市場的成員國的批准。隨後分發給其他成員國,根據該國的州和地方當局的不同註冊要求。在加拿大,我們的同種異體移植保存服務受加拿大衞生部生物製品和遺傳療法理事會、保健產品和食品部門監管。我們於2017年獲得批准,在加拿大銷售我們的同種異體移植保存服務。在英國,我們受人類組織管理局(HTA)監管,並於2022年獲得批准提供同種異體移植保存服務。向英國和歐洲國家的申請也可能需要在批准前對我們的設施和供應商進行檢查。2023年,我們向愛爾蘭和德國衞生部門提出申請,尋求批准進口和銷售我們的同種異體移植保存服務在歐洲市場。由於我們的申請,德國當局已經檢查了我們的福克斯河格羅夫設施和我們的兩個組織恢復合作伙伴。
第三方報銷
美國
購買醫療器械的醫療保健提供者通常依賴第三方支付者,包括醫療保險和醫療補助計劃以及私人支付者(如賠償保險公司、僱主團體醫療保險計劃和管理式醫療計劃)來報銷這些產品的全部或部分成本。因此,對我們產品的需求現在並將繼續部分取決於這些付款人的覆蓋範圍和償還政策。尋求和獲得補償的方式根據所涉付款人的類型以及產品提供和使用的環境而有所不同。例如,醫療保險報銷政策有利於門診治療。此外,醫療保險、醫療補助和其他第三方支付機構的支付受到立法和監管變化的影響,並容易受到預算壓力的影響。
在美國,第三方付款人通常直接向醫療保健提供者支付醫療服務,在某些情況下,直接向醫療保健提供者支付醫療服務。我們的銷售量取決於第三方付款人支付我們產品的程度以及使用這些產品的程序。一般而言,第三方支付人僅在計劃管理人確信該產品或程序在醫療上是必要的,因為該產品或程序以安全且具成本效益的方式改善健康結果,包括生活質量或功能能力。即使器械已獲得FDA的上市許可或批准,也不能保證第三方支付者將支付器械和器械使用的相關程序的費用。
在許多情況下,第三方支付方使用價格費用表支付使用我們的產品執行的程序,該價格費用表不改變報銷,以反映執行這些程序中使用的產品和設備的成本。在其他情況下,除了程序本身的付款或償還外,還可單獨支付所用產品和設備的付款或償還。即使有保險,第三方支付人可能會對他們提供保險的情況進行限制,或可能提供不足以支付我們產品成本的補償。
此外,許多第三方支付者正在轉向管理式醫療系統,在該系統中,提供者簽訂合同,以每人固定的成本提供全面的醫療服務,而不是傳統的收費服務模式。管理式醫療服務提供者通常試圖通過授權較少的選擇性外科手術來控制醫療保健的成本。在當前的前瞻性支付系統下,如診斷相關組系統和醫院門診前瞻性支付系統,這兩個系統都被醫療保險使用,在許多私人第三方支付者使用的管理式醫療系統中,我們產品的報銷被納入一個程序的整體報銷中,我們的產品沒有單獨的報銷。
國際
我們在國際市場的成功將部分取決於第三方付款人的償還,醫療保健提供者通過這些付款人在這些市場獲得付款。非美國市場的報銷和醫療支付系統因國家而異。醫療支付系統的主要類型是政府贊助的醫療保健和私人保險。和美國一樣,償還費用會受到立法和監管的改變以及預算壓力的影響。必須在每個國家單獨獲得報銷批准。在美國以外,我們可能會在我們直接向醫院銷售的國家尋求報銷批准。在其他市場,我們一般依賴分銷商獲得報銷批准。
美國欺詐和濫用法律
我們可能會直接或間接地受到與醫療欺詐和濫用有關的各種美國聯邦和州法律的約束,包括反回扣法。特別是,美國聯邦醫療保健計劃反回扣法規禁止任何人故意和故意直接或間接地索取、提供、接受或提供報酬,以換取或誘使個人轉介,或提供、安排或推薦可全部或部分根據聯邦醫療保健計劃支付的商品或服務。例如醫療保險和醫療補助計劃。對違規行為的處罰包括刑事處罰和民事制裁,如罰款、監禁,以及可能被排除在醫療保險、醫療補助和其他聯邦醫療保健計劃之外。《反回扣法》是廣泛的,禁止許多在醫療保健行業以外的企業中合法的安排和做法。在執行該法令時,監察長辦公室(OIG)發佈了一系列被稱為"安全港"的條例。安全港規定,如果所有適用要求都得到滿足,安全港將向醫療保健提供者和其他各方保證,他們不會根據《反回扣法》被起訴。一項交易或安排未能準確地放置在一個或多個安全港內,並不一定意味着它是非法的,也不一定意味着會進行起訴。然而,不能完全滿足安全港要求的行為和業務安排可能導致政府執法當局加強審查。
美國患者保護和平價醫療法案
2010年3月,美國醫療體系改革以《患者保護和平價醫療法案》(PPACA)的形式獲得通過。根據PPACA,我們必須遵守《開放支付法》,該法案要求詳細公開披露我們向醫療保健專業人員的某些付款和“價值轉移”,例如支付特許權使用費、提供服務的補償以及報銷差旅費和餐費。某些州還要求我們披露類似的信息,甚至禁止某些形式的此類付款。
員工與人力資本管理
截至2023年12月31日,我們有630名員工,包括614名全職員工。我們的全職員工的職能組成如下:332名製造和運營,183名銷售和營銷,57名一般和行政,以及42名研發。我們每月審查(1)招聘需求,(2)新員工人數,(3)我們的自願離職率。於2023年,我們增加了23名全職員工,全球自願離職率為7. 1%。
多樣性和包容性
我們的目標是通過強調團隊合作和分散決策,為員工提供激勵和回報的工作環境。我們致力於為所有個人提供平等的就業和晉升機會。我們不會基於種族、膚色、宗教、性別、國籍、年齡、殘疾、性取向、性別認同、母乳餵養或相關醫療條件、宗教着裝、軍人或退伍軍人身份或受法律保護的任何其他特徵進行歧視。這項政策涉及就業的所有方面。截至2023年12月31日,我們的全球員工約50%為女性員工,執行委員會約38%為女性。我們在美國的員工約有62%的員工被認定為非白人,包括以下族裔/種族:亞裔(48.4%)、西班牙裔或拉丁裔(8.2%)、黑人或非裔美國人(4.8%)、兩個或更多種族(非西班牙裔或拉丁裔)(0.6%)、夏威夷原住民或其他太平洋島民(0.2%)。
薪酬和福利
我們相信提供有競爭力的薪酬和福利。我們使用第三方基準來幫助確定工資。我們的薪酬旨在吸引、留住和激勵員工,在平衡公司短期和長期績效的同時,取得業績。我們偶爾會與外部福利顧問合作,以評估我們每年向所有員工提供的福利的質量、競爭力和成本。於2023年,我們將美國受薪僱員的僱主醫療福利供款由60%增加至70%,而美國小時工於2022年亦有類似增幅。
顧客
我們的銷售不依賴於任何單一客户或分銷商,我們繼續通過直銷代表和獨立分銷商擴大我們的全球分銷渠道。於二零二三年,並無單一客户佔我們淨銷售額的2%以上。
企業信息
2006年10月19日,我們執行了首次公開募股,我們的普通股在納斯達克全球市場交易代碼為“LMAT”。於二零二一年一月,我們將品牌名稱由“LeMaitre Vascular”更改為“LeMaitre”。我們的主要行政辦公室位於63 Second Avenue,Burlington,Massachusetts 01803,我們的電話號碼是(781)221—2266。我們的網站地址是www.lemaitre.com。
在那裏您可以找到更多信息
我們的表格10—K年度報告,表格10—Q季度報告,表格8—K當前報告,以及根據1934年證券交易法第13(a)或15(d)節提交或提供的這些報告的修訂,可在我們以電子方式提交此類材料後,在合理可行的範圍內儘快通過我們網站(www.example.com)的投資者關係部分免費獲取,www.lemaitre.com SEC網站的地址為www.sec.gov。我們的投資者關係頁面和我們網站上的信息不屬於本10—K表格年度報告或我們任何其他證券文件的一部分,除非在本10—K表格年度報告中明確納入本10—K表格年度報告或其中,並且您不應將我們網站中包含的或可通過我們網站訪問的任何信息視為本10—K表格年度報告的一部分。SEC維護一個包含報告、代理和信息聲明以及其他信息的互聯網網站。我們在任何證券文件中作出的所有聲明,包括所有前瞻性聲明或信息,均在包含聲明的文件日期作出,除非法律要求這樣做,否則我們不承擔或承擔更新任何這些聲明或文件的義務。此外,我們的企業管治指引、商業行為及道德準則以及審計、薪酬及提名委員會及企業管治委員會章程可在我們的網站上查閲,並提供印刷版供任何要求有關資料的股東查閲。
|
第1A項。 |
風險因素 |
投資我們的證券涉及高度風險。閣下在評估我們的業務時,應考慮以下有關下文所述風險的資料,連同本報告及我們其他公開文件中所載的其他資料。以下因素(其中包括)可能導致我們的實際經營業績與本報告中所作前瞻性陳述或管理層在其他地方呈列的業績有重大差異。投資者在作出投資決定前應考慮以下風險。以下所述的風險並不是我們面臨的唯一風險。我們目前未知或我們目前認為不重大的額外風險亦可能損害我們的業務營運。我們的業務可能會受到任何這些風險的損害。我們普通股的交易價格可能會因任何這些風險而下跌,投資者可能會失去全部或部分投資。
與我們的業務相關的風險
我們面臨來自其他公司的外部競爭,如GLP—1等技術’和替代醫療程序,我們可能無法有效地競爭。
可能不被視為外周血管器械領域競爭對手的公司可能開發可能影響我們產品和服務使用的技術、產品或服務。例如,某些治療性治療,如用於治療糖尿病或體重減輕的藥物,如GLP—1,可增強患者健康並降低血管疾病的發生率和嚴重程度。倘我們不及時推出新產品、服務及增強功能,我們若干產品及服務的使用量可能會減少,在此情況下,我們的經營業績可能會受到影響。
我們主要經營的分部亦具競爭力,易受變動,並受新產品推出影響。雖然沒有任何公司在我們的所有產品上與我們競爭,但許多設備製造商擁有大量的資本資源、更大的客户基礎、更廣泛的產品線、更大的銷售隊伍、更大的研發或監管人員;與我們的目標客户建立了聲譽;並開發了比我們更大的分銷渠道。我們的競爭對手可以選擇將額外資源投入到我們經營的特定細分市場。此外,雖然我們目前在部分產品的細分市場中處於領先地位,但並非所有產品都如此。
某些競爭者能夠以較低的成本更有效地製造和分銷產品,並可能以較低的價格提供類似產品。某些競爭對手在開發和改進產品、獲得監管批准、獲得優惠補償以及生產和營銷產品方面也可能擁有更豐富的經驗。例如,血管外科醫生可能會選擇使用我們競爭對手的新產品或增強產品進行頸動脈支架植入,而不是我們的頸動脈內膜切除產品。此外,某些競爭對手可能在我們之前獲得專利保護或監管部門的批准或許可,或實現產品商業化。此外,如果血管內手術相對於開放血管手術的趨勢持續或加速,這可能會損害我們的結果。血管疾病市場的特點是廣泛的研究努力和技術進步。競爭對手可能會開發出比我們更安全、更有效、更容易使用或更便宜的技術和產品。此外,我們的許多產品面臨替代程序的競爭。競爭加劇也可能導致價格下降或市場份額的喪失。
如果我們不遵守國際監管要求,在美國境外銷售我們的產品,或由於這些要求而被要求修改我們的業務或產品,我們的業務將受到損害。
在美國境外銷售醫療器械需遵守各國不同的國際監管要求。這些要求和時間可能與我們在美國FDA的經驗不同。在某些國家,我們依靠我們的國際分銷商獲得上市前批准,完成產品註冊,並遵守臨牀試驗要求。未能滿足外國法規可能會影響我們在這些國家銷售產品的能力。我們無法保證我們將能夠獲得或維持所需的國際監管批准。
我們的器械目前在歐盟和英國受MDD和MDR的監管。為了在歐盟銷售我們的醫療器械,我們需要獲得CE標誌,這表明符合MDD或MDR的基本要求,並且高風險器械的製造商通常必須使用“公告機構”—指定的獨立第三方來評估符合性。我們目前使用三個公告機構。我們在MDD下獲得了CE標誌,銷售了我們的大部分產品,最近在MDR下獲得了Pruitt F3分流管、Flexcel分流管和XenoSure Biologic補片的前三個CE標誌。
歐盟通過了新的醫療器械法規MDR,取代了MDD,並於2021年5月26日生效。最終符合MDR的截止日期修訂為2027年12月31日和2028年12月31日。我們的產品最終將完全受MDR的約束,該MDR要求我們所有的產品根據MDR獲得新的CE標誌。我們的一些公告機構已經開始對我們施加這些更嚴格的要求。我們幾乎所有的產品都已提交給我們的公告機構,以供根據MDR進行審查。如果我們未能根據MDR獲得新的CE標誌,我們產品未來在歐盟的銷售可能會受到不利影響。
由於英國退出歐盟,英國藥品和保健產品監管局(“MHRA”)宣佈,CE標誌將在英國繼續得到認可,歐盟認可的公告機構頒發的證書將在英國市場繼續有效,直到2024年7月1日。這一最後期限隨後被修改,以配合2027年和2028年歐盟延期。在這些日期之後,所有在英國上市的器械都將需要英國合格評定(“UKCA”)標誌。如果我們未能在這些截止日期前獲得UKCA標誌,或根本無法獲得UKCA標誌,我們在英國的銷售可能會受到負面影響。
我們的設施受到眾多監管機構(包括政府機構和公告機構)的定期檢查,我們必須證明符合適用的醫療器械法規。如果我們未能遵守監管要求,我們可能會採取糾正措施,例如修改我們的政策和程序。此外,我們可能被要求停止全部或部分業務一段時間,直至我們能夠證明已採取適當步驟。無法保證我們在未來的審計中會遵守這些標準。
我們還在其他直接銷售設備的司法管轄區(如日本和中國)尋求註冊。2015年,國家食品藥品監督管理局(NMPA)大幅提高了產品註冊申請費,並對獲得產品批准提出了額外要求,其中包括進行臨牀試驗以支持中國新引進產品的註冊申請流程。因此,我們可能不會為某些費用不合理的產品尋求註冊。產品註冊的任何延遲都可能對我們的經營業績產生負面影響。
如果我們無法擴大產品和服務範圍,我們可能無法實現增長目標,我們的經營業績可能會受到影響。
外周血管和心血管疾病的治療包括開放性血管手術和微創血管內手術,我們的大多數產品主要或專門用於開放性手術。我們主要向血管外科醫生推銷和銷售我們的產品。我們估計,在2023年,超過95%的銷售額來自開放式外科手術中使用的器械。
我們增長戰略的核心組成部分是收購補充產品線,主要是開放性血管手術。開放性血管手術中適當規模的目標數量可能有限,如果我們無法執行收購策略,我們的銷售增長可能會受到抑制。
除非我們能夠跟上血管器械市場,特別是微創血管內手術領域現有或新產品、服務和技術的步伐,否則我們可能無法有效競爭。我們在開發和商業化新產品和現有產品和服務的新版本,或獲得新產品方面的成功,受到我們以下能力的影響:
|
• |
及時發現新的市場趨勢和客户需求; |
|
• |
識別滿足這些趨勢或需求的產品或服務; |
|
• |
確定並執行合適的收購目標; |
|
• |
獲得監管許可或批准; |
|
• |
為這些產品開發具有成本效益的製造工藝;以及 |
|
• |
引進這些產品、服務和技術。 |
倘我們無法透過內部發展或收購擴大產品或服務,我們可能無法增加銷售額,而我們的經營業績及股價亦可能受到影響。
倘我們未能提高銷售價格,或須作出價格優惠,則銷售增長可能會減少,經營業績亦可能受損。
截至2023年、2022年及2021年12月31日止年度,我們銷售增長的主要部分由較高的平均售價推動,尤其是瓣膜刀及頸動脈分流器銷售。過去,我們一直能夠依靠我們的知名品牌和建立的聲譽來提高價格。此外,我們可能無法進一步提高價格:
|
• |
如果醫療支出減少,特別是在美國,為應對政府頒佈的醫療改革、總體經濟狀況或負責任的護理組織的影響; |
|
• |
使用我們產品的醫療程序的補償率是否降低或限制; |
|
• |
如果競爭對手推出安全性和有效性相當的低價產品;或 |
|
• |
客户是否參與有關醫療器械競爭性定價的信息共享。 |
市場的變化也可能對定價造成壓力,因為醫院加入了團購組織,綜合交付網絡和管理式醫療組織。由於價格壓力,外科醫生甚至可能進行替代手術。如果我們無法提高價格,可能會降低我們的淨銷售增長率,並損害我們的經營業績。
我們正在實施新的企業資源規劃系統,實施該系統所面臨的挑戰可能會影響我們的業務和運營。
我們正在實施一個新的企業資源規劃系統。ERP的實施是複雜的、耗時的、勞動密集型的,並且涉及大量的支出。新的ERP對我們收集重要信息、獲取和交付產品、發送發票、履行合同義務、維護賬簿和記錄、提供準確、及時和可靠的財務和經營業績報告以及以其他方式經營業務的能力至關重要。實施企業資源規劃還需要內部流程的轉變。任何此類實施都涉及風險,包括信息丟失和業務可能中斷。新的企業資源規劃系統的實施和維護可能會出現延誤和費用超支。
新ERP系統實施過程中的任何中斷、延誤或缺陷都可能影響我們處理訂單、發貨產品、發送發票、履行合同義務、準確維護賬簿和記錄、提供準確、及時和可靠的財務和經營業績報告的能力,包括SEC要求的報告,例如根據2002年《薩班斯—奧克斯利法案》第404條對我們財務報告內部控制的評估,並經營我們的業務。此外,如果我們不按計劃實施新的企業資源規劃,我們對財務報告的內部控制的有效性可能受到不利影響。
我們的季度和年度業績可能會出現重大波動。
我們季度和年度財務業績的波動已經並將繼續受到多種因素的影響,包括:
|
• |
對我們銷售的產品和服務的需求變化; |
|
• |
由於市場狀況、監管環境或其他因素,產品和價格競爭加劇; |
|
• |
我們針對不同產品線和服務的定價策略; |
|
|
• |
我們銷售隊伍的生產力; |
|
• |
收購業務或產品,或剝離或停產產品; |
|
• |
國內外經濟和政治條件以及匯率的影響; |
|
• |
生產或加工業務的搬遷和整合; |
|
• |
可能需要召回我們的產品或警告信的監管行動; |
|
• |
改變我們產品的監管狀態; |
|
• |
支付或停止支付季度現金股利,和/或增加現金股利的數額和頻率; |
|
• |
我們因終止合同和其他關係而產生的費用,包括分銷商/代理商的關係; |
|
|
• |
我們沒有把重點放在集團採購組織(GPO)合同上,這可能會減少單位銷售額; |
|
• |
我們在美國以外的選定國家收取應收賬款的能力; |
|
• |
在我們開展業務的司法管轄區內的法律變化; |
|
• |
營業淨虧損結轉等遞延税項資產的到期、抵銷或利用; |
|
• |
任何重要客户的流失,特別是在客户基礎有限的任何產品或服務方面。 |
這些因素,其中一些不在我們的控制範圍內,可能會導致我們普通股的價格波動。如果我們的季度經營業績未能達到或超過證券分析師或投資者的預期,我們的股價可能會下跌。我們認為,我們財務業績的季度比較並不總是有意義的,不應依賴於作為我們業績的唯一指標。
我們可能無法保持利潤增長的歷史水平。
二零二三年的年度經營收入較二零二二年增長37%。部分原因是我們於二零二二年及二零二三年為增長銷售隊伍及直接勞動力資源作出了大量投資。無法保證我們將能夠在二零二四年或未來幾年達到此水平的溢利增長。倘我們未能有效管理營運開支,我們可能需要實施削減成本措施以維持盈利能力。投資水平的下降可能會抑制未來的增長。
此外,我們維持和提高盈利能力的能力將受到許多因素的影響,包括:
|
• |
未來銷售、製造成本和運營費用的水平和時間; |
|
• |
控制或減少運營費用的能力; |
|
• |
我們直銷隊伍的生產力; |
|
• |
外幣匯率波動; |
|
• |
市場接受我們的新產品和服務; |
|
• |
在新市場成功建立直銷機構的能力; |
|
• |
我們成功獲取和開發有競爭力的產品的能力 |
|
• |
我們成功整合收購企業的能力; |
|
• |
競爭產品、技術和程序對我們業務的影響; |
|
• |
我們的產品獲得或保持監管批准的能力; |
|
• |
醫療產品和程序的補償率; |
|
• |
訴訟費用(如有的話);及 |
|
• |
税法的變化。 |
我們對獨家及有限來源供應商的依賴可能會阻礙我們向客户提供產品及服務的能力,並可能損害營運業績。
我們的許多重要組件和某些產品依賴獨家和有限來源供應商。例如,我們依靠獨家供應商提供Omniflow II移植物中使用的綿羊材料。關於我們的RestoreFlow同種異體移植物,我們依靠組織採購組織向我們提供捐贈組織。雖然我們與多個組織採購組織建立了合作關係,但我們無法確定是否有足夠的合適人體組織供應,在這種情況下,我們的同種異體移植保存服務收入可能會受到不利影響。
當我們收購一條產品線時,我們通常會與賣方簽訂協議,在確定的期限內供應所收購產品,直至我們可以將生產轉移到我們的工廠。這些安排始終是唯一來源供應安排。供應商可能沒有分配足夠的資源來生產我們的產品。此外,如果供應商沒有資金繼續供應產品,則存在風險。例如,在我們2019年收購的AmsterCel和VascuCel生物貼片的情況下,Anteris同意繼續供應這些產品,直到2025年1月。如果Anteris未能履行其在供應協議下的義務,那麼我們的供應可能會中斷。如果我們的收購產品供應不足,這可能導致銷售損失,我們的經營業績可能受到損害。
這些材料和產品的替代供應來源相對較少,或在某些情況下沒有。我們並不總是與供應商訂立供應協議,而是根據需要下訂單。在任何時候,這些供應商可能會停止或變得無法生產或供應這些材料或產品。我們通常不會對這些材料和產品進行大量庫存。如有需要,確定和確定額外或替代供應商的資格可能無法迅速完成或根本無法完成,而且可能涉及大量額外費用。供應商的任何供應中斷或未能獲得替代供應商將影響我們生產產品的能力,導致生產延遲及成本增加。這可能導致銷售和客户的損失,我們的經營業績可能受到損害。在某些情況下,原材料供應商的變更或替代原材料的使用可能需要進行重大測試和隨後的監管批准。
信息技術系統的重大中斷或信息安全系統的漏洞可能會對我們的業務產生不利影響。
我們依靠信息技術系統和傳統記錄保存相結合來運營我們的業務。在日常業務過程中,我們收集、存儲和傳輸機密信息(包括但不限於有關我們業務的信息、財務信息、個人數據、知識產權,以及在某些非常有限的情況下,患者數據)。我們的信息技術和信息安全系統和記錄可能容易受到安全漏洞、服務中斷、數據丟失或由我們的員工、供應商或其他第三方的無意或故意行為造成的惡意攻擊。此外,由於我們的國際業務和移動銷售隊伍,我們為某些員工實施了遠程工作安排,這些員工可能使用易受安全漏洞、服務中斷、數據丟失或惡意攻擊(包括第三方)攻擊的外部技術和系統。
雖然我們已經並將繼續投資於我們的信息技術和信息安全系統以及員工信息安全培訓,但我們無法保證我們的努力將防止所有安全漏洞、網絡釣魚/欺詐企圖、服務中斷或數據丟失。雖然我們並不知道之前曾經歷過任何重大數據泄露、監管違規事件或網絡安全事件,但我們將來可能會受到此類事件的影響,使我們的客户和我們面臨以下風險:有人訪問我們的信息、我們的客户或其客户的信息或我們的知識產權、禁用或降級服務,或破壞系統或信息。任何此類安全漏洞都可能導致對我們服務安全性失去信心,損害我們的聲譽,擾亂我們的業務,要求我們承擔大量調查、補救和/或支付贖金的費用,導致法律責任,對我們未來的銷售產生負面影響,並導致重大財務損失。
我們可能會在採購、收購及整合業務及產品至我們的業務中遇到困難,或我們可能無法實現該等收購的預期利益。
為了擴大我們的產品範圍,我們已經完成了24項收購,我們戰略的一個關鍵部分是收購更多的業務、產品或技術。自二零二零年以來,我們尚未完成收購。如果我們無法以令人滿意的條件或根本無法完成收購,我們的增長目標和銷售額可能會受到負面影響。
即使我們完成收購,我們也可能會經歷:
|
• |
將任何收購的業務、人員和產品整合到我們現有業務中的困難; |
|
• |
在將製造業務整合到現有業務中或在新的製造設施中成功複製製造流程方面遇到困難或延誤; |
|
• |
由於與我們收購的設備相關的利潤率下降,我們的企業毛利率下降; |
|
• |
主要客户的銷售量突然減少,特別是在被收購公司銷售集中的情況下; |
|
• |
從其他業務上轉移管理層的時間; |
|
• |
整合成本高於預期; |
|
• |
作為收購一部分的意外負債; |
|
• |
與前業主就或有付款、承擔的債務或其他事項發生爭議或訴訟; |
|
• |
在遵守監管要求方面遇到的挑戰,而我們以前並不受約束; |
|
• |
加強監管審查; |
|
• |
在轉讓、維護或獲得所收購產品的監管批准方面的挑戰; |
|
• |
在留住被收購企業的關鍵員工方面存在困難; |
|
• |
如果被收購的公司離我們馬薩諸塞州伯靈頓總部很遠,則會遇到困難; |
|
• |
臨牀研究的過渡困難或延遲,或此類臨牀研究的不利結果; |
|
• |
主要供應商的損失或從原所有者處繼續供應所收購產品的問題; |
|
• |
與收購進行中的研究和開發有關的費用; |
|
• |
由於需要為收購成本提供資金的股權融資而導致的稀釋;或 |
|
• |
債務,因為融資收購將優先於我們的普通股,將需要支付利息給我們的貸款人,並可能限制我們向股東支付股息的能力。 |
我們還可能發現因欺詐或在盡職調查中未發現的缺陷,包括內部控制、數據充足性和完整性、產品質量和監管合規性方面的缺陷,以及未披露的合同或其他責任和產品責任,其中任何一項都可能導致我們受到處罰或其他責任。任何這些困難都可能對我們從收購或未來收購中實現預期和預期利益的能力產生負面影響。
我們的呼叫點集中於血管外科醫生,其產品組合主要用於開放性血管外科手術,可能過於狹窄,這可能會對我們未來的銷售產生不利影響。
外周血管疾病的治療繼續從開放血管手術轉向微創血管內手術。例如,一些血管外科醫生已經開始使用經頸動脈血運重建術(一種新的微創手術)來治療頸動脈疾病,而不是使用頸動脈分流器和血管補片的手術。我們主要向血管外科醫生推銷和銷售我們的產品,我們的大部分營銷工作和銷售與開放性血管手術而非血管內手術中使用的產品有關。我們估計,於二零二三年,超過95%的淨銷售額來自開放手術中使用的器械。
人口統計學趨勢和其他因素,如補償率,正在推動血管外科醫生越來越專注於某些類型的手術,如創建和維護透析通路和血管內治療。血管外科醫生培訓計劃可能側重於那些治療,排除開放性血管手術。如果血管外科醫生在開放性血管手術方面的培訓減少,轉而支持微創血管內手術的培訓,則由於缺乏開放性血管技能,可能會限制使用我們產品的血管外科醫生數量。如果這種趨勢持續下去,可能會導致我們的客户羣分散,從而減少交叉銷售機會,從而對我們的業務產生負面影響。
我們的一些設備銷售到與我們大多數產品線不同的呼叫點,我們可能無法成功銷售到該呼叫點。
我們的一些產品銷售到與我們主要的呼叫點不同的呼叫點。例如,從歷史上看,我們的ESCel銷售額中有很大一部分是針對兒科心臟外科醫生,而我們的大部分營銷工作和銷售額與血管外科醫生使用的產品有關。因此,我們的銷售代表主要聘請血管外科醫生,其次是心臟和神經外科醫生。我們在心臟領域成功銷售像EschCel這樣的產品,部分取決於我們的銷售代表投入部分時間,並與兒科心臟外科醫生建立關係。如果他們不進行這些活動或沒有成功地這樣做,那麼這可能會導致ESTA Cel銷售損失。兒童心臟外科醫生的交叉銷售機會有限。相反,如果我們的銷售代表在血管外科醫生身上花費的時間減少,我們血管產品的銷售量可能會下降。
我們的組織處理和保存服務面臨各種風險,包括與人體組織採購和監管要求有關的風險。
我們成功提供RestoreFlow同種異體移植物處理、保存和分銷服務的能力可能受到以下因素的影響:
|
• |
維持質量標準和控制措施,以降低處理過的組織無法滅菌的風險; |
|
• |
符合特定於人體組織的法規和法律要求或這些要求的變更; |
|
• |
維護我們的AATB認證、FDA機構註冊和州許可證; |
|
• |
我們的組織在成功取得捐贈組織的禮物方面的程度; |
|
• |
從組織採購組織採購足夠數量的人體組織,其類型和質量符合我們的規範; |
|
• |
以具有成本效益的方式處理人體組織; |
|
• |
控制組織處理和冷凍保存技術人員的更替;以及 |
|
• |
我們的組織採購組織遵守現行的組織良好規範。 |
我們在上述任何一個或多個領域的失敗可能會對我們提供與同種異體移植物相關的加工、保存和分銷服務的能力產生不利影響,從而影響我們的業務和運營。
我們生產設施的任何中斷都可能損害我們的經營業績。
我們的全球主要執行、分銷和製造業務位於馬薩諸塞州伯靈頓的五個租賃設施。我們還在新澤西州北布倫瑞克有一個生產基地,以及在伊利諾斯州福克斯河格羅夫有一個紙巾加工,保存和分銷設施。我們用於生產產品和服務的這些設施和設備將難以更換,並且在發生自然或人為災難時可能需要大量的準備時間進行維修或更換。在此情況下,我們無法將生產或加工轉移至其他製造設施,我們將被迫依賴第三方製造商(如有)。雖然我們為我們的財產損失和我們的業務中斷購買保險,但該保險可能不足以涵蓋我們的所有潛在損失,包括對我們的聲譽的潛在損害,並且我們可能無法繼續以可接受的條款提供,或根本無法獲得。我們持有大量的成品,這也有助於緩解這些問題。
我們的某些產品含有來自動物源的材料,可能會受到額外法規的約束。
我們的AlboGraft血管移植物、Artegrat生物補片、XenoSure生物補片、VascuCel和VascuCel補片產品含有牛組織或牛源材料,我們的Omniflow II Biosynthetic血管移植物含有羊組織。含有動物來源材料的產品越來越受到媒體和監管機構的審查。監管機構關注疾病從動物傳播給人類的可能性。在日本和西歐,公眾對動物源性產品的審查非常嚴格,因為擔心感染了導致牛海綿狀腦病(又稱瘋牛病或瘋牛病)的病原體的牛材料,如果攝入或植入,可能導致人類克雅氏病的變異,這是一種最終致命的疾病,目前尚無治癒方法。在加拿大和美國發現的牛中BSE病例也提高了北美對這一問題的認識。某些地區或國家已經頒佈法規,要求產品必須使用來自澳大利亞或新西蘭等國家的牛組織進行加工,這些國家沒有發生牛海綿狀腦病病例。含有動物源材料的產品,包括我們的產品,可能會受到額外監管,甚至在某些國家被禁止。重大的新法規或對我們產品的禁令可能會損害我們目前的業務。
國際經營所固有的風險以及銷售和運輸我們的產品以及在國際採購我們的零部件和產品的風險可能會對我們的淨銷售額、經營業績和財務狀況造成不利影響。
截至2023年12月31日止年度,39%的淨銷售額來自美國境外。我們的國際銷售業務使我們及其代表、代理商和分銷商面臨在外國司法管轄區經營的固有風險。這些風險包括:
|
• |
外幣匯率波動; |
|
• |
美國和外國政府實施額外的控制或法規,包括出口許可證要求、關税和關税以及其他貿易限制; |
|
• |
我們的人員、分銷商和其他代理商不遵守《反海外腐敗法》或其他反腐敗法律的風險; |
|
• |
變更醫療器械法規,可能妨礙我們在司法管轄區註冊我們的產品; |
|
• |
對與我們有業務往來的國家或方實施美國和/或國際制裁; |
|
• |
第三方補償政策的變化; |
|
|
• |
收回外國政府用於醫療保健的資金超過預算數額; |
|
• |
對外國代理商、代表和分銷商的活動施加限制; |
|
• |
審查外國税務機關,這可能導致罰款,罰款和額外税收; |
|
• |
定價壓力大; |
|
• |
有利於當地公司的法律和商業慣例; |
|
• |
付款週期較長; |
|
• |
執行協議和收取應收款方面的困難; |
|
• |
在執行或捍衞知識產權方面的困難; |
|
• |
暴露於不同的法律、數據隱私和政治標準;以及 |
|
• |
政治、經濟和/或社會不穩定。 |
我們無法向您保證其中一個或多個因素不會損害我們的業務。我們的國際銷售額的任何重大下降將對經營業績造成不利影響。
全球經濟狀況的重大不利發展,或某些其他世界性事件的發生,可能會影響對我們產品的需求,增加我們的運營成本並損害我們的業務。
全球宏觀環境依然充滿挑戰。例如,俄羅斯對烏克蘭的入侵引發了美國和歐洲的重大制裁,這對我們的業務產生了負面影響。以色列和巴勒斯坦、中國和臺灣以及其他地方也存在類似的衝突或緊張局勢。這些制裁措施或不遵守制裁措施,可能導致運營延誤、成本或罰款增加,或導致我們的國際銷售大幅下降,所有這些都可能對我們的業務產生不利影響。
使用或誤用我們的產品和我們分銷的紙巾可能會導致傷害,導致產品責任訴訟,這可能會給我們的業務帶來高昂的成本。
如果我們的產品或我們處理的組織設計、製造、加工或標籤存在缺陷,包含缺陷成分,或被濫用,或發現導致或促成了傷害或死亡,我們可能會面臨昂貴的訴訟。雖然我們為醫生提供培訓,但我們不要求醫生接受使用我們產品的培訓,醫生可能會錯誤地使用我們的產品或在我們未考慮的程序中使用。我們不時涉及產品責任索賠。產品責任索賠可能會轉移管理層對我們核心業務的注意力,損害我們的聲譽,辯護費用昂貴,並導致我們面臨鉅額損失賠償。
我們不能向您保證我們的產品責任保險範圍足以滿足對我們提出的索賠。此外,我們可能無法維持相同的覆蓋水平,並且我們可能無法以合理的成本和合理的條款獲得足夠的覆蓋(如果有的話)。此外,如果任何此類產品責任索賠或一系列索賠因未投保的責任而向我們提出,或超出我們的保險範圍,我們的業務可能會受到損害。
我們不時涉及結果不確定且可能涉及重大開支的訴訟。
我們不時會受到法律訴訟和訴訟,包括但不限於與產品責任、僱傭事宜、知識產權、合同糾紛和其他商業事宜有關的訴訟。由於訴訟的結果本身就難以預測,訴訟的結果,甚至只是訴訟的辯護,可能會給我們帶來巨大的成本,轉移管理層的注意力,並對我們的聲譽造成不利影響。我們在國際市場經營的事實也增加了我們可能面臨法律風險的風險,因為我們尋求遵守大量不同的法律和監管要求。倘任何該等程序導致不利結果,則可能對我們的經營業績造成不利影響。
有關監管環境的風險
對醫療器械行業的監督可能會影響我們銷售醫療器械和在市場上競爭的方式。
有法律和法規來規範醫療保健公司如何向醫療保健專業人員推銷其產品和服務,包括例如,聯邦反回扣法令,聯邦虛假索賠法,聯邦健康保險攜帶和責任法案的1996年,州法律等同於這些聯邦法律,旨在防止欺詐和濫用以及外國類似法律。違反這些法律將受到刑事和民事制裁,並禁止州或聯邦醫療計劃。雖然我們努力遵守這些法律和法規,但我們不能保證政府官員不會聲稱我們違反了這些法律或法規。聯邦法律和州法律有時也是開放的解釋,如果我們的解釋與競爭對手不同,我們有時會發現自己處於競爭劣勢。
我們的業務受到複雜、昂貴和繁重的法規的約束。如果我們未能遵守,我們可能會受到重大處罰。
我們產品和服務的生產和營銷以及我們正在進行的研究和開發受到美國和海外眾多政府機構的廣泛監管和審查。美國和外國適用於醫療器械和人體組織的法規範圍廣泛,除其他外,除規範生產和加工實踐、報告、促銷和廣告、進出口、標籤和記錄保存程序外,還規範與人體組織相關的新醫療器械和服務的測試、營銷和上市前許可或批准。
近年來,在我們開展業務的司法管轄區內,數據隱私法的範圍和執法力度有所增加。歐洲議會通過了《一般數據保護條例》(GDPR),2018年5月生效。2020年1月生效的加州消費者隱私法(CCPA)要求覆蓋的公司向消費者提供有關此類公司數據收集以及新的使用和共享做法的新披露等。在CCPA通過後,美國其他幾個州也通過了類似的數據隱私法,其中大部分於2023年生效或2024年生效。2023年,歐洲敲定了有史以來第一個全面的人工智能使用治理法律框架--歐盟人工智能法案,預計將於2026年生效。遵守這些不同的制度已經並將導致我們產生額外的成本,包括任何不遵守或聲稱不遵守可能導致的成本。
我們未能遵守適用的監管要求可能導致政府機構或法院採取行動,包括以下任何行動:
|
• |
向我們發出公開警告信; |
|
• |
對我們施加罰款和懲罰; |
|
• |
發佈禁止令,禁止我們銷售或分銷我們的產品; |
|
• |
對我們提出民事或刑事指控; |
|
• |
命令召回、扣留或扣押我們的產品或冷凍保存的人體組織;或 |
|
• |
撤回或拒絕對我們產品的批准或許可。 |
倘發生上述任何或全部情況,我們的業務、經營業績及品牌可能受到重大不利影響。
如果我們不能成功地獲得政府機構對我們的醫療器械的額外許可和批准,我們可能無法銷售我們的產品,我們的未來增長可能會受到阻礙。
我們希望在美國上市的每個醫療器械通常必須獲得510(k)批准或上市前申請(PMA)批准。任何一種過程都可能漫長而昂貴。FDA的510(k)審批程序通常需要三到十二個月。儘管我們目前幾乎所有需要此類許可的產品都獲得了510(k)許可,但如果器械出現安全性或有效性問題,FDA可能會限制、限制或禁止我們銷售這些產品。我們的新產品或重大改進的現有產品可能會被拒絕510(k)批准。
PMA的審批過程成本更高,時間更長,而且不確定。一般需要六個月到三年。獲得上市前批准通常需要廣泛的臨牀試驗,並可能需要提交大量的修正案。我們在獲得PMA批准或對我們的產品進行這些研究方面沒有豐富的經驗。
FDA此前曾提出過變更,FDA批准上市可能需要臨牀數據、更廣泛的生產信息和上市後數據。作為510(k)改革的一部分,FDA提議發佈法規,界定撤銷先前已獲準上市的510(k)申請的理由和程序。FDA還可能要求對某些產品進行更廣泛的PMA程序。我們在美國以外地區銷售產品的能力也需要得到監管部門的批准,包括我們在臨牀環境中證明產品的安全性和有效性的能力。即使產品獲得了監管部門的批准或許可,該批准或許可也可能限制產品的用途或聲明,這可能會限制我們產品的市場。如果我們沒有獲得並保持外國監管機構或FDA對我們產品的批准(如適用),我們將無法銷售我們的產品,我們的未來增長可能會受到影響。
如果我們或我們的供應商未能遵守FDA的規定,’我們的質量體系法規和其他適用要求,我們的生產或加工操作可能會中斷,我們可能會受到各種FDA執法行動的影響。
我們接受FDA的檢查和營銷監督,以確定我們是否符合所有監管要求。如果FDA發現我們未能遵守任何監管要求,它可以採取各種執法行動,包括但不限於警告信、罰款和處罰、禁令、民事或刑事指控、強制召回和撤銷銷售產品的許可。
我們和我們的一些供應商必須遵守FDA的質量體系法規,該法規規範了醫療器械的設計、測試、製造、控制、質量保證、安裝、服務、標籤、包裝、儲存和運輸所使用的方法、設施和控制。我們的Fox River Grove業務必須符合FDA現行的組織質量管理規範。FDA通過事先宣佈和未經宣佈的檢查來執行其規定。我們接受FDA和其他監管機構的此類檢查。今後審計的時間未知,審計可能導致一個或多個不令人滿意的結果。如果我們或我們的一個供應商未能通過檢查,或者如果我們或我們的一個供應商採取的糾正行動計劃不充分,FDA可能會對我們採取執法行動。
我們參加了MDSAP,該計劃允許製造商接受在美國接受的通用質量體系審核,日本、澳大利亞、加拿大和巴西,取代每個監管機構的個別例行審計。維護此認證是在某些地區(包括加拿大)維持銷售的要求。未能保持該認證的良好信譽可能導致我們在加拿大或其他地區的銷售工作暫停。
我們還受FDA一般禁止將我們的產品用於未經批准或標籤外用途的推廣,以及醫療器械報告法規的約束,該法規要求我們向FDA報告,如果我們的產品可能導致或促成死亡或嚴重傷害,或者如果我們的器械故障和故障復發可能導致死亡或嚴重傷害。我們還必須向FDA提交一些器械糾正和移除的報告,並且我們必須遵守FDA關於標籤和促銷的規定。如果我們未能遵守這些或其他FDA要求,或未能採取足夠的糾正措施來應對FDA提出的任何重大合規問題,FDA可以採取重大執法行動,這可能會損害我們的業務、運營結果和聲譽。
此外,大多數其他國家(如日本)要求我們在銷售和銷售我們的產品之前,遵守與美國相似的醫療器械的製造和質量保證標準。
即使在我們的產品獲得上市批准或許可後,我們的產品和我們加工的紙巾也可能被召回。許可證、註冊、批准和許可可能會因未能遵守監管標準或在最初批准後發生不可預見的問題而被撤回或暫停。
我們的產品、服務、營銷、銷售和開發活動以及製造過程都受到FDA、外國類似機構以及其他監管機構和管理機構的廣泛和嚴格的監管。如果這些監管機構認為我們未能遵守監管標準,則不能保證任何批准、許可或註冊不會隨後被撤回、暫停或以廣泛的上市後研究要求為條件,即使在獲得營銷批准或許可或許可證和註冊之後也是如此。此外,由於各監管機構的相互聯繫,特別是在歐盟內部,也不能保證任何單一監管機構撤回或暫停我們的任何批准、許可證或註冊不會導致一個或多個其他監管機構也撤回或暫停其批准、許可證或註冊。
如果我們的任何產品被證明存在缺陷,我們可以自願召回我們的任何產品,或者FDA或外國同等機構可能要求我們實施召回。在歐盟和英國,不良事件報告要求要求我們報告導致或可能導致死亡或健康嚴重惡化的事件。召回,無論是自願的還是強制的,都可能給我們帶來巨大的成本和嚴重的負面宣傳。在嚴重情況下,FDA還可以發出警告信和/或銷燬缺陷產品和/或命令暫停或停止生產缺陷產品。此外,如果某人因故障或產品缺陷而受到損害,我們可能會因此類缺陷而面臨產品責任索賠。任何糾正行動,無論是自願的還是非自願的,以及在訴訟中為自己辯護,都需要我們投入時間和資金,並可能損害我們的財務業績。未來的召回或索賠還可能給我們帶來鉅額成本和嚴重的負面宣傳,這可能會損害我們未來營銷產品的能力。
國內外立法或行政改革導致第三方付款人的限制性補償做法,以及成本控制措施可能會降低對我們產品的需求或價格。
我們的產品和同種異體移植物保存服務主要由醫院或醫生購買,他們通常向各種第三方付款人收費,如政府計劃(例如,Medicare、Medicaid和類似的外國計劃)、私人保險計劃和管理式護理計劃。我們的客户能夠從第三方付款人那裏獲得產品和服務的適當報銷,這對我們的產品和服務的成功起到了重要作用,因為。報銷因國家/地區而異,可能會影響對新技術的接受。在美國以及德國、日本和法國等主要海外市場實施醫療改革可能會限制、減少或取消對我們產品和服務的報銷。
美國和海外醫院服務的主要第三方付款人繼續努力控制醫療成本。例如,為了降低成本,某些醫院和其他客户可能會對我們打算一次性使用的產品進行重新消毒,或者從第三方再加工者那裏購買再加工產品。
進一步對美國和國外的報銷制度進行立法或行政改革,或這些系統的管理人在承保或報銷方面與我們的產品相關的不利決定,可能會減少使用我們醫療器械的程序的報銷,或導致這些程序被拒絕承保。這些改革或不利決定的例子包括價格監管、競爭性定價、覆蓋和支付政策、治療的相對有效性、技術評估和管理保健安排。任何這樣的改革或不利的決定都可能對我們的客户願意為我們的產品支付的價格產生不利影響。
有關知識產權的風險
如果我們不能充分保護我們的知識產權,或防止第三方使用我們的知識產權,我們可能會失去顯著的競爭優勢,我們的業務可能會受到影響。
我們的成功在一定程度上有賴於維護和執行我們的知識產權。我們採取預防措施來保護我們的技術優勢和知識產權。我們依靠專利、商業祕密、版權、專有技術和商標法以及許可協議和合同條款來建立我們的知識產權並保護我們的產品。這些措施可能只能提供有限的保護。
我們的技術幾乎沒有專利。即使在我們確實擁有專利的地方,專利的頒發也不總是對其有效性或可執行性具有決定性的。我們的專利可能被第三方規避或設計。此外,專利在一段時間後到期,這取決於頒發專利的司法管轄區。如果任何製造商成功挑戰我們的專利,或者他們在我們的專利到期後進入市場,這可能會對我們的業務產生不利影響。
我們可能無法有效地保護我們在非專利技術、商業祕密和機密信息方面的權利。我們有一項政策,要求關鍵員工、顧問和企業合作伙伴接觸商業機密或其他機密信息,以執行保密協議。我們的保密協議還要求我們的員工將其在受僱期間所做或構思的任何發明的所有權利轉讓給我們。我們通常還要求顧問將他們在與我們合作期間所做的任何發明轉讓給我們。但是,我們不能保證,這些協議將為我們提供有意義的保護或充分的補救措施,以防止未經授權的使用、轉讓或披露機密信息或發明。
此外,外國法律可能無法有效地保護我們的知識產權,或保護程度與美國法律相同。如果我們的知識產權沒有得到充分保護,我們可能無法將我們的技術、產品或服務商業化,而我們的競爭對手可能會將類似的技術商業化,這可能導致我們的銷售額和市場份額下降。
如果第三方聲稱我們侵犯了他們的知識產權,我們可能會承擔責任和成本,我們可能不得不重新設計或停止銷售受影響的產品。
在我們的行業中運營的公司經常為他們新穎的產品設計尋求專利保護,我們的許多主要競爭對手都擁有大量的專利組合。醫療器械行業的公司利用知識產權訴訟來獲得競爭優勢。我們面臨着侵犯第三方知識產權的索賠風險,我們無法向您保證我們的產品或方法不會侵犯第三方的專利或其他知識產權。我們在識別和避免侵犯第三方知識產權方面的努力未必總能成功。任何侵犯專利權或其他知識產權的索賠,即使是沒有法律依據的索賠,都可能:
|
• |
辯護既昂貴又耗時; |
|
|
• |
導致我們被要求支付重大損失; |
|
• |
損害我們的聲譽; |
|
• |
使我們停止生產或銷售產品; |
|
• |
要求我們重新設計、重新設計或重新品牌我們的產品,這可能是不可能的; |
|
• |
要求我們簽訂版税或許可協議,以獲得使用第三方知識產權的權利,這些協議可能無法以我們可接受的條款提供,或根本無法獲得; |
|
• |
轉移我們管理層和關鍵人員的注意力,使其從對我們業務成功至關重要的其他任務上轉移;或 |
|
• |
導致我們的客户或潛在客户推遲或限制他們購買或使用受影響產品,直到訴訟解決。 |
第三方也可能聲稱我們的製造過程侵犯了現有專利或其他知識產權。如果我們未能為該索賠辯護,我們可能被迫停止一個或多個生產設施的生產。此外,我們的競爭對手獲得的新專利可能威脅到產品在市場上的持續壽命,即使產品已經推出。如果我們的業務成功,其他人可能會對我們提出侵權索賠。
如果我們認為我們的產品是或可能是第三方專利或其他知識產權的主體,我們可能試圖與他們達成許可協議,以製造、營銷和銷售這些產品。如果我們未能達成協議,我們可能會被要求就過去使用聲稱的知識產權向第三方支付重大損害賠償金,並可能被迫停止生產或銷售包含受質疑知識產權的產品。
此外,我們可能會受到美國專利局進行的干涉程序或在外國專利局進行的反對程序,質疑發明的優先權或我們專利的有效性。
與我們普通股相關的風險
我們的股票價格可能會波動,對我們普通股的投資可能會遭受價值下跌。
股本證券之市價及成交量可能有重大波動,而與發行證券之公司之財務表現無關。這些廣泛的市場波動可能會對我們普通股的市場價格產生負面影響。可能對我們的普通股市場價格產生重大影響的一些因素包括:
|
• |
經營業績或未來前景的實際或預期波動; |
|
|
• |
增長率的變化; |
|
• |
我們的公告或競爭對手的新產品公告; |
|
• |
公眾對我們的新聞稿、我們的其他公告以及我們向SEC提交的文件的反應; |
|
• |
我們決定是否繼續派發季度現金股息; |
|
• |
我們決定是否進行或繼續進行股份回購計劃; |
|
• |
我們或我們的競爭對手的戰略行動,例如收購、剝離或重組; |
|
• |
發行額外證券的攤薄效應; |
|
• |
適用於本公司業務的新法律法規或對現有法律法規的新解釋; |
|
• |
產品線或其他創收活動的中斷; |
|
• |
可能導致召回我們的產品或服務的不利監管行動,或對我們產品或服務市場產生負面影響的警告信; |
|
• |
我們或我們的董事、高級職員或主要股東出售普通股; |
|
• |
我們的關聯公司和內部人士控制我們普通股的很大一部分; |
|
• |
減少或減少我們普通股的交易量;以及 |
|
• |
我們納入或刪除股票市場指數,如標準普爾600或羅素2000。 |
股票市場經歷了價格和成交量的波動,這些波動往往與個別公司的經營業績無關或不相稱。我們的普通股的市價也可能由於與我們的財務業績無關的各種因素而大幅波動,包括政治不穩定、自然災害、流行病、戰爭和/或恐怖主義事件;證券分析師的評論;以及我們行業或整個經濟的一般市場狀況。廣泛的市場和行業因素可能會影響公司(包括我們)股票的市場價格,而不管實際經營業績如何。過去,在整體市場及特定公司證券的市場價格出現波動後,往往會對這些公司提起證券集體訴訟。如果對我們提起訴訟,可能會導致鉅額成本,並轉移我們管理層的注意力和資源。
我們的首席執行官擁有重大投票權,並可能採取可能與我們其他股東利益不一致的行動。
截至2023年12月31日,我們的首席執行官控制着我們約11%的已發行普通股。因此,彼可能對需要股東批准的事宜(包括選舉董事及批准重大公司交易)有重大影響力。這種所有權的集中可能會延遲或阻止控制權的變更,可能會對我們普通股的市場價格產生不利影響,並且可能無法完全符合其他股東的利益。
我們沒有為普通股股東設立最低股息支付水平,也沒有保證我們將來有能力向普通股股東支付股息。
2011年2月,我們的董事會通過了季度股息計劃,目的是向我們的股東返還資本。然而,我們尚未為普通股股東設立最低股息支付水平,我們支付股息的能力可能會受到本年度報告10—K表格以及我們不時向SEC提交的其他文件中所述的風險和不確定性的損害。未來股息(如有)將由我們的董事會授權。此外,我們的信貸安排中的財務契約可能會限制我們支付未來季度股息的能力。我們無法保證我們將來有能力支付股息。
|
項目1B。 |
未解決的員工意見 |
沒有。
|
項目1C。 |
網絡安全 |
風險管理和戰略
LeMaitre Vascular認識到開發、實施和維護強大的網絡安全措施對保護我們的信息系統和保護我們數據的機密性、完整性和可用性至關重要。
重大風險管理與綜合全面風險管理
我們已將網絡安全風險管理戰略性地納入我們更廣泛的風險管理框架,以促進全公司的網絡安全風險管理文化,目標是確保網絡安全考慮因素成為我們決策過程的一個組成部分。我們的IT部門在風險評估過程中持續評估及處理網絡安全風險,以配合我們的業務目標及營運需要。
讓第三方參與風險管理
我們認識到網絡安全威脅的複雜性和不斷演變的性質,與外部專家(包括網絡安全評估員和顧問)合作,以評估和測試我們的風險管理系統。我們與第三方的合作包括定期審計、威脅評估和安全增強諮詢。
第三方風險監管
使用基於風險的方法,我們審查第三方服務提供商,作為我們IT一般控制的一部分,特別關注金融風險和第三方應用程序和圍繞該風險的控制。
網絡安全威脅帶來的風險
雖然我們並不知道之前曾經歷過任何重大數據泄露、監管違規事件或網絡安全事件,但我們將來可能會受到此類事件的影響,使我們的客户和我們面臨以下風險:有人訪問我們的信息、我們的客户或其客户的信息或我們的知識產權、禁用或降級服務,或破壞系統或信息。任何此類安全漏洞都可能導致對我們服務安全性失去信心,損害我們的聲譽,擾亂我們的業務,要求我們承擔大量調查、補救和/或支付贖金的費用,導致法律責任,對我們未來的銷售產生負面影響,並導致重大財務損失。
治理
董事會意識到管理與網絡安全威脅相關的風險的關鍵性質。董事會已建立健全的監督機制,以確保有效管治管理與網絡安全威脅有關的風險,因為我們認識到這些威脅對我們的營運誠信及持份者信心的重要性。
董事會監督
審計委員會是董事會監督網絡安全風險的核心,並對該領域承擔主要責任。審核委員會定期檢討電腦系統監控、網絡安全風險管理以及相關管治及事故披露的充足性。
管理’管理風險的角色
我們的信息技術副總裁和首席財務官(CFO)在向審計委員會通報網絡安全風險方面發揮着關鍵作用。彼等定期向審核委員會提供全面簡報,最少每年一次。這些簡報涵蓋廣泛的議題,包括:
|
● |
當前的網絡安全格局和新出現的威脅; |
|
|
● |
現行網絡安全舉措和戰略的現狀; |
|
|
● |
事件報告和從任何網絡安全事件中吸取的教訓;以及 |
|
|
● |
符合法規要求和行業標準。 |
除我們預定的會議外,審核委員會、我們的信息技術副總裁和我們的首席財務官就新出現或潛在的網絡安全風險保持持續對話。
風險管理人員
評估、監控和管理我們的網絡安全風險的主要責任在於我們的信息技術副總裁,他在該領域擁有超過25年的經驗。由於每一項都與網絡安全有關,我們的信息技術副總裁負責測試我們的標準合規性、已知風險的補救以及我們的員工培訓計劃。
監控網絡安全事件
我們的信息技術副總裁領導我們對信息系統的定期監控流程的實施和監督。我們制定了網絡安全事件應對計劃,由我們的副總裁(信息技術)監督,其中包括減輕影響的立即行動以及補救和預防未來事件的長期策略。
向董事會彙報工作
我們的信息技術副總裁定期向首席財務官通報與網絡安全風險和事件有關的事宜。我們的副總裁,信息技術和首席財務官,然後向審計委員會和董事會通報重要的網絡安全問題和戰略風險管理。
|
第二項。 |
屬性 |
我們在全球的主要執行、分銷和製造業務位於馬薩諸塞州伯靈頓的五個租賃設施,總面積為109,354平方英尺。伯靈頓的五份租約中有四份將於2034年12月到期,第五份租約將於2030年12月到期。本公司並無選擇權將該四份租約延長或續期至二零三四年十二月後。在收購Artegrant生物移植業務時,我們在新澤西州北布倫瑞克(North Brunswick)擁有16,732平方英尺的租約,該租約將於2029年10月到期。此外,我們的歐洲業務總部位於德國Sulzbach的21,410平方英尺租賃設施,租約將於2031年6月到期。我們還在美國其他地區租用額外的製造、加工、分銷和銷售辦事處,歐洲、英國和亞太地區。根據我們目前的運營計劃,我們相信我們現有的設施足以滿足我們的需要。
|
第三項。 |
法律訴訟 |
在日常業務過程中,我們不時涉及訴訟、索賠、調查、訴訟和訴訟威脅,包括知識產權、合同、商業、僱傭和其他事項。雖然無法確切預測該等訴訟及索償的結果,但管理層認為,截至2023年12月31日,概無合理預期會對我們的財務狀況、經營業績或現金流量造成重大不利影響的事項。
|
第四項。 |
煤礦安全信息披露 |
不適用。
第II部
|
第五項。 |
註冊人普通股市場、相關股東事項與發行人購買股權證券 |
市場信息
我們的普通股在納斯達克全球市場公開交易,代碼為“LMAT”。在我們於2006年10月19日首次公開發行之前,我們的普通股沒有公開交易市場。
紀錄持有人
2024年2月20日,根據納斯達克全球市場的報告,我們普通股的每股收盤價為62.49美元,我們有大約144名記錄在案的股東。此外,我們相信,我們普通股的大量實益擁有人以街道名稱持有他們的股份。
分紅
2011年2月,我們的董事會批准了一項政策,以支付我們的普通股的季度現金股息。於二零二三年,我們派發季度現金股息每股0. 140美元,於二零二二年,我們派發季度現金股息每股0. 125美元。2024年2月21日,我們的董事會批准了於2024年3月28日向2024年3月14日營業結束時記錄在案的股東支付每股0.160美元的季度現金股息,總額約為360萬美元。未來宣派季度股息及建立未來記錄及付款日期須經董事會按季度批准。
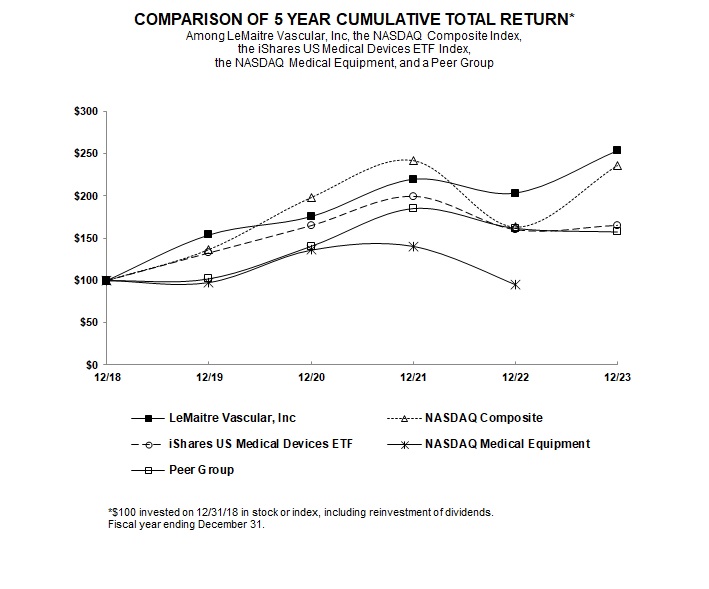
股價表現圖表
以下是一個圖表,比較了LeMaitre普通股與納斯達克綜合指數,iShares美國醫療器械ETF指數和同行集團的累計總股東回報,涵蓋期間從2018年12月31日到LeMaitre截至2023年12月31日的財年結束。我們今年採用iShares美國醫療器械ETF指數作為比較,取代納斯達克醫療器械指數,因為納斯達克醫療器械指數在2023年不再作為已發佈的指數存在。因此,雖然我們已在下圖中參考截至2022年12月31日的納斯達克醫療設備指數,但我們無法就截至2023年12月31日的年度呈列該指數,且不打算將其納入未來年度。該圖假設在2018年12月31日投資100.00美元,投資於(i)LeMaitre的普通股,(ii)構成納斯達克綜合指數的股票,(iii)構成iShares美國醫療ETF指數的股票,(iv)構成我們同行集團的股票,以及(v)構成納斯達克醫療設備指數的股票。以下內容不應被視為通過引用納入我們根據《1934年證券交易法》(經修訂)或《1933年證券法》(經修訂)提交的任何其他文件中,除非我們特別通過引用將其納入此類文件中。
以下圖表中的比較是基於歷史數據,並不指示也不打算預測我們普通股的未來表現。

|
12/18 |
12/19 |
12/20 |
12/21 |
12/22 |
12/23 |
|||||||||||||||||||
|
LeMaitre Vascular,Inc |
100.00 | 153.77 | 175.43 | 219.49 | 203.27 | 253.28 | ||||||||||||||||||
|
納斯達克複合體 |
100.00 | 136.69 | 198.10 | 242.03 | 163.28 | 236.17 | ||||||||||||||||||
|
iShares美國醫療器械ETF |
100.00 | 132.72 | 164.81 | 199.47 | 160.14 | 165.28 | ||||||||||||||||||
|
納斯達克醫療設備 |
100.00 | 97.52 | 136.07 | 140.62 | 94.93 | - | ||||||||||||||||||
|
同級組 |
100.00 | 102.10 | 140.38 | 184.86 | 161.55 | 157.36 | ||||||||||||||||||
LeMaitre的財政年度於每年12月的最後一天結束;上表中的數據反映了我們的股票、納斯達克和同行集團指數截至該年度最後一個交易日收盤時的市值。同行組包括以下公司:AngioDynamics,Inc.,Artivion公司,阿特里庫爾公司,Inari Medical,Inc.,Merit Medical Systems,Inc.,Penumbra公司,Shockwave Medical,Inc.,Silk Road Medical,Inc.
最近出售的未註冊證券
不適用。
發行人購買股票證券
|
發行人購買股票證券 |
||||||||||||||||
|
最大數量 |
||||||||||||||||
|
(或近似 |
||||||||||||||||
|
總人數 |
美元價值) |
|||||||||||||||
|
股份(或單位) |
股份(或單位) |
|||||||||||||||
|
總計 |
平均值 |
購買方式為 |
這可能還是可能的 |
|||||||||||||
|
數量 |
價格 |
公開的一部分 |
買入 |
|||||||||||||
|
|
股份(或單位) |
付費單位 |
已宣佈的計劃 |
這些計劃或 |
||||||||||||
| 期間: |
已購買(1) |
共享(或單位) |
或計劃 |
計劃 |
||||||||||||
|
2023年10月1日至2023年10月31日 |
- | $ | - | 不適用 | 不適用 | |||||||||||
|
2023年11月1日至2023年11月30日 |
- | $ | - | 不適用 | 不適用 | |||||||||||
|
2023年12月1日至2023年12月31日 |
12,077 | $ | 55.28 | 不適用 | 不適用 | |||||||||||
|
總計 |
12,077 | $ | 55.28 | 不適用 | 不適用 | |||||||||||
|
(1) |
截至2023年12月31日止三個月,我們回購了12,077股普通股,以滿足員工在與受限制股票單位歸屬有關的最低法定預扣税方面的義務。 |
|
第六項。 |
已保留 |
|
第7項。 |
管理層對財務狀況和經營成果的探討與分析 |
以下討論應與我們的綜合財務報表及本年報其他部分所載的相關附註一併閲讀, 10—K和我們的其他證券交易委員會文件。以下討論可能包含預測、估計和其他涉及許多風險和不確定性的前瞻性陳述,包括下文中討論的風險和不確定性。 “風險因素”以及本年報其他地方的表格10—K。這些風險可能導致我們的實際業績與下文建議的任何未來業績有重大差異。
本管理層對財務狀況及經營業績的討論及分析的主要目的是通過提供對管理層認為的公司財務業績及狀況的解釋及分析,加強我們的整體財務披露。
概述
我們是醫療器械和人體組織冷凍保存服務的全球供應商,主要用於治療外周血管疾病、終末期腎病和較小程度的心血管疾病。我們開發、生產和銷售血管器械,以滿足血管外科醫生的需求,以及其他專業如心臟外科醫生、普通外科醫生和神經外科醫生的需求。我們多樣化的器械組合包括用於動脈和靜脈的品牌產品,這些產品為血管外科醫生所熟知。我們的主要產品在全球銷售,主要在美國、歐洲、加拿大和亞太地區。我們估計,全球每年的外周血管器械市場超過50億美元,其中我們的產品市場約為8億美元。我們採用簡單的三管齊下的戰略來發展業務:1)追求專注的呼叫點;2)競爭低競爭對手的利基產品的銷售;3)擴大我們的全球直銷隊伍,同時收購補充設備。我們已將收購作為進一步滲透外周血管器械市場的主要手段,我們預計未來將繼續這一戰略。我們目前在馬薩諸塞州伯靈頓的總部生產我們的大部分產品。
我們的產品和服務主要用於通過開放手術方法和血管內技術治療外周血管疾病的血管外科醫生。與介入心臟科醫生和介入放射科醫生相比,血管外科醫生可以進行開放手術和微創血管內手術,因此可以為患者提供更廣泛的治療選擇。然而,最近,我們開始探索鄰近市場客户,或非血管外科醫生客户,他們可以使用我們的血管器械技術,如心臟外科醫生和神經外科醫生。
我們的主要產品線包括:吻合夾、生物血管和透析移植物、生物血管和心臟補片、頸動脈分流器、栓子切除導管、閉塞導管、不透射線標記帶、合成血管和透析移植物以及瓣膜刀。通過我們的RestoreFlow同種異體移植業務,我們還提供與人體血管和心臟組織的處理和冷凍保存相關的服務。
我們的主要生物產品包括血管和心臟補片以及血管和透析移植物。2023年,生物製品佔我們全球銷售額的51%。我們看好我們的生物器械產品,因為我們相信它們代表了差異化的產品,在某些情況下,還代表了不斷增長的產品細分。
為了幫助我們評估我們的業務策略,我們監測外周血管器械市場的長期技術趨勢。此外,我們考慮了與醫療界就我們產品需求(包括潛在的新產品發佈)進行討論所獲得的信息。我們還使用這些信息來幫助確定我們在外周血管器械市場的競爭地位以及我們的生產能力要求。
我們的業務機會包括:
|
• |
擴大我們在北美、歐洲、英國和亞太地區的直銷隊伍,包括用我們的直銷人員取代分銷商; |
|
|
• |
提高我們設備的平均售價; |
|
|
• |
收購互補產品; |
|
|
• |
在獲得監管批准或註冊後,將我們的產品引入新的地區; |
|
|
• |
鞏固我們馬薩諸塞州伯靈頓工廠的產品製造, |
|
|
• |
通過研發更新現有產品和推出新產品。 |
我們主要通過直接銷售隊伍銷售我們的產品和服務。截至2023年12月31日,我們的銷售團隊由136名銷售代表組成,分佈在北美、歐洲、英國和亞太地區,其中包括三名出口經理。我們的全球總部位於馬薩諸塞州伯靈頓,在亞利桑那州錢德勒和加拿大沃恩也設有北美銷售辦事處。我們的歐洲總部位於德國的蘇爾茨巴赫,在意大利米蘭、西班牙馬德里、英國赫裏福德和愛爾蘭都柏林都設有歐洲銷售辦事處。我們的亞太區總部位於新加坡,在日本東京、中國上海、澳大利亞肯辛頓、韓國首爾和泰國曼谷設有亞太區銷售辦事處。截至2023年12月31日止年度,約96%的淨銷售額來自我們聘用直銷代表的地區。我們還通過分銷商在其他國家銷售我們的產品。
從歷史上看,我們在競爭較低的利基市場上取得了成功。例如,在瓣膜刀市場,我們高度差異化的設備歷史上使我們能夠在保持單位份額的同時提高銷售價格。相比之下,我們在競爭激烈的市場(如聚酯血管移植市場)中取得的成功較少,在那裏,我們面臨着來自擁有更多資源和更低單位成本的大公司的競爭。
我們在歐洲等國際市場也取得了成功,我們在歐洲擁有一支強大的銷售隊伍,有時提供的平均售價比北美低。如果我們繼續在北美以外地區尋求增長機會,我們的毛利率可能會面臨下行壓力。
我們的業務增長策略包括收購互補的產品線和公司,這些產品線和公司可能難以識別、談判和購買,並且無法保證我們將來能夠這樣做。
|
• |
於二零二零年六月,我們與Artegraft訂立協議,以72,500,000美元購買其牛移植業務的資產,外加最多17,500,000美元的額外付款(視乎二零二一年至二零二三年單位銷售情況而定)。 |
有時,我們停止或剝離不再與我們業務互補或商業上不可行的產品。
|
• |
於二零二一年,我們決定停止或停止使用TRIVEX電動靜脈切除系統、遠程動脈內膜切除裝置及手術膠。這些產品線於二零二一年的總收入約為220萬美元。 |
|
• |
2022年,我們決定停止ProCol覆膜支架、AlboSure聚酯貼片、LeverEdge和Latis覆膜支架清潔導管產品線。這些產品在2022年的總收入約為70萬美元。 |
|
• |
2023年,我們決定停止在美國銷售AlboGraft和LifeSpan合成移植產品線,這些產品在2023年的收入中分別為約30萬美元和不到10萬美元。 |
我們可能會不時減少銷售量,並將銷售轉移至其他SKU或具有類似功能的產品。例如,於2022年,我們開始將Syntel彈簧頭端導管的銷售過渡至Syntel常規頭端導管。任何該等行動均可能導致存貨撇銷,並對我們的銷售、毛利率及客户關係造成暫時或永久的負面影響。
由於我們相信直接向醫院銷售可產生更緊密的客户關係,並可提高銷售價格和毛利率,我們定期與分銷商進行交易,以將其銷售我們的醫療器械轉移至我們的直接銷售組織:
|
• |
於二零二二年五月,我們與韓國分銷商訂立分銷過渡協議,以直接在韓國銷售產品,並解散現有分銷安排。我們自2022年12月起一直在韓國銷售直達醫院。分銷終止費總額約為50萬美元。 |
|
|
|
||
|
• |
於二零二三年三月,我們與泰國分銷商訂立分銷過渡協議,以直接在泰國銷售產品,並解散現有分銷安排。自2023年8月起,我們一直在泰國銷售直達醫院。分銷終止費總額約為70萬美元。 |
我們還從內部產品開發努力中受益,以將差異化技術和下一代產品推向市場:
|
• |
2020年,我們推出RestoreFlow同種異體心臟移植物,用於心臟修復和恢復。 |
|
• |
2022年3月,我們獲得美國FDA批准上市PhasTIPP,這是一種用於移除腿部靜脈曲張的便攜式電動靜脈切除術設備。我們預計將在2024年或2025年推出該產品。 |
除了我們的銷售增長戰略,我們還執行了多項旨在將生產整合到伯靈頓工廠的運營計劃。我們預計這些工廠合併和生產轉移將改善對生產質量的控制並降低成本。我們最近的生產轉移包括:
|
• |
2018年10月,我們從Becton Dickinson手中收購Cardial業務。Cardial在法國聖艾蒂安工廠生產聚酯血管移植物、瓣膜刀和外科膠。2022年6月,我們關閉了聖艾蒂安工廠,以簡化生產運作及減少開支。我們正在將心臟移植物銷售過渡到我們的伯靈頓製造的聚酯移植物產品(AlboGraft),以節省額外的成本和提高利潤率。 |
|
• |
2019年10月,我們從Anteris收購了AmsterCel和VascuCel生物貼片業務。於二零二零年七月,我們啟動了一項將生產轉移至伯靈頓工廠的項目。轉移至Burlington已於二零二三年大致完成。2023年6月,這些伯靈頓生產的器械提交了MDR CE標誌申請,我們預計這一申請過程需要18—30個月。 |
最後,我們可能不時訂立補充產品線的分銷協議,並可選擇於未來收購該產品線:
|
• |
2023年4月,我們與Elutia達成協議,成為其心血管豬貼片的美國獨家分銷商。根據協議,我們可以在三年內分銷產品,並在協議的第二年和第三年內選擇收購Elutia的全球心血管貼片業務。截至2023年12月31日止九個月,LeMaitre Vascular的銷售額為410萬美元。 |
我們執行該等措施可能會影響財務業績的可比性,並可能導致期間間波動,因為我們產生相關開支(如工藝工程及其他費用)。
2024年2月,我們開始實施新的ERP系統,以取代我們的軟件報告和規劃系統。我們預計,新的ERP系統將在多個領域受益,包括庫存管理、定價方案、財務運作和實時報告。雖然我們自2022年以來一直在為這一過渡做準備,並聘請了一個經驗豐富的諮詢團隊來協助這一過渡,但無法保證實施將成功或及時執行。截至2023年12月31日,我們已將與該ERP系統相關的成本資本化約360萬美元。
美元與外幣(主要是歐元)之間的匯率波動影響我們的財務業績。截至2023年12月31日止年度,我們約39%的銷售額發生在美國以外地區,主要是美元以外的貨幣。我們預計外幣將佔未來銷售額的很大比例。與該等銷售有關的銷售、市場推廣及行政成本亦以外幣計值,從而部分減輕我們的匯率波動風險。但是,如果外幣兑換美元的匯率上升,那麼就需要比匯率上升前更多的外幣來兑換一定數額的美元。在這種情況下,我們記錄的美元收入將比匯率變動前減少。就二零二三年而言,我們估計匯率變動的影響使我們報告的銷售額較二零二二年的匯率增加約20萬美元。
淨銷售額和銷售額
以下為我們淨銷售額及開支的主要組成部分:
淨銷售額。我們的淨銷售額來自銷售我們的產品和服務,減去折扣和退貨。淨銷售額包括我們客户支付的運費和手續費。我們的大部分銷售額是由我們的直接銷售團隊產生的,並被運送到世界各地的醫院或診所並開具賬單。在我們沒有直接銷售隊伍的國家,主要銷售給分銷商,而分銷商又銷售給醫院和診所。在某些情況下,我們的產品在購買前在醫院或診所以託運方式存放;在這些情況下,我們在產品用於手術時而非發貨時確認收入。
銷售成本。我們生產我們銷售的大部分產品。我們的銷售成本主要包括製造人員、原材料及組件、物業及設備折舊、其他分配的製造費用,以及我們為向客户運送產品而支付的運費。
銷售和市場營銷。我們的銷售和市場營銷費用主要包括工資、佣金、基於股票的薪酬、差旅和娛樂、銷售會議、出席血管和心臟會議、培訓計劃、廣告和產品促銷、直郵和其他市場營銷費用。
一般的和行政的。一般及行政開支主要包括行政人員、財務及人力資源薪金、股票薪酬、法律及會計費用、資訊科技開支、無形資產攤銷開支及保險開支。
研究和開發。研發費用主要包括與獲得和維持我們產品的監管批准有關的成本、工資、實驗室測試和供應成本。它還包括與臨牀研究的設計和執行相關的成本,註冊、維護和保護我們的知識產權的成本,以及將收購的產品線的生產轉移到我們的伯靈頓工廠的成本。還包括與新產品或現有產品的設計、開發、測試和改進有關的費用。
其他收入(費用)。其他收入(支出)主要包括利息收入和支出、外幣收益(損失)和其他雜項收益(損失)。
所得税支出。我們在美國產生的收益要繳納聯邦和州所得税,其中包括根據税收選擇而在某些外國司法管轄區特定年份的營業虧損或利潤,以及對我們全資擁有的外國子公司的收益徵收的外國税。我們的綜合税費支出受到我們在美國和海外子公司的應税收入(虧損)、永久項目、離散項目、未確認的税收優惠以及用於美國納税報告的商譽攤銷的組合的影響。
經營成果
截至去年十二月底的年度比較 截至2023年12月31日止的年度 31, 2022
下表列出了所示期間按地理位置劃分的我們的淨銷售額,以及以百分比增加或減少表示的指定期間之間的變化:
|
百分比 |
||||||||||||||||
|
2023 |
2022 |
$Change |
變化 |
|||||||||||||
|
(千美元) |
||||||||||||||||
|
淨銷售額 |
$ | 193,484 | $ | 161,651 | $ | 31,833 | 20 | % | ||||||||
|
按地理位置劃分的淨銷售額: |
||||||||||||||||
|
美洲 |
$ | 130,308 | $ | 109,439 | $ | 20,869 | 19 | % | ||||||||
|
歐洲、中東和非洲 |
51,099 | 41,854 | 9,245 | 22 | % | |||||||||||
|
亞太地區 |
12,077 | 10,358 | 1,719 | 17 | % | |||||||||||
|
總計 |
$ | 193,484 | $ | 161,651 | $ | 31,833 | 20 | % | ||||||||
淨銷售額。截至2023年12月31日的財年,淨銷售額增加了3,180萬美元,增幅為20%,達到193.5美元,而截至2022年12月31日的財年,淨銷售額為161.7美元。這一增長主要是由於平均銷售價格上升、醫院程序量增加、額外的銷售代表以及與我們新的豬補丁產品線相關的410萬美元的銷售額。Valverotome的銷售額增加了630萬美元,牛血管補片的銷售額增加了460萬美元,牛移植物的銷售額增加了420萬美元,同種異體移植物保存服務增加了370萬美元,頸動脈分流術的銷售額增加了310萬美元。我們估計,在截至2023年12月31日的一年中,美元走弱使淨銷售額比截至2022年12月31日的年度增加了20萬美元。
截至2023年12月31日和2022年12月31日的年度,直接到醫院的淨銷售額分別佔我們總淨銷售額的96%和95%。
按地域劃分的淨銷售額。截至2023年12月31日止年度,美洲銷售淨額較截至2022年12月31日止年度增加20. 9百萬美元或19%。這一增長主要是由於瓣膜刀的銷售額增加了520萬美元,牛移植物的銷售額增加了420萬美元,豬補片的銷售額增加了410萬美元,同種異體移植物保存服務的銷售額增加了280萬美元,牛血管補片的銷售額增加了200萬美元。
截至2023年12月31日止年度,EMEA淨銷售額較截至2022年12月31日止年度增加9. 2百萬美元或22%。這一增長主要是由於牛血管補片210萬美元、頸動脈分流器190萬美元、牛心臟補片120萬美元、瓣膜刀110萬美元和羊移植物100萬美元的銷售額增加所致。
截至2023年12月31日止年度,亞太區銷售淨額較截至2022年12月31日止年度增加1,700,000元或17%。這一增長主要是由於閉塞導管的銷售額增加了70萬美元,牛血管補片的銷售額增加了50萬美元,ePTFE血管移植物和頸動脈分流器的銷售額增加了20萬美元。
毛利。下表載列我們於所示期間的毛利及毛利率變動:
|
百分比 |
||||||||||||||||
|
2023 |
2022 |
變化 |
變化 |
|||||||||||||
|
(千美元) |
||||||||||||||||
|
毛利 |
$ | 127,049 | $ | 104,896 | $ | 22,153 | 21 | % | ||||||||
|
毛利率 |
65.7 | % | 64.9 | % | 0.8 | % | * | |||||||||
|
*不適用 |
截至2023年12月31日止年度,毛利增加2,220萬元或21%至127,000,000元,期內毛利率增加80個基點至65. 7%。毛利的增長主要是由於銷售額的增加,特別是瓣膜刀、牛血管補片、牛移植片和豬補片。毛利率的增加主要由有利的產品組合帶動,包括銷售利潤相對較高的瓣膜刀,以及生產效率,但部分被廢料增加以及超額及過時費用所抵銷。
運營費用。下表載列我們於所示期間的經營開支變動及指定期間之間的變動,以增加或減少百分比表示:
|
百分比 |
2023年% |
2022年% |
||||||||||||||||||||||
|
2023 |
2022 |
$Change |
變化 |
淨銷售額的 |
淨銷售額的 |
|||||||||||||||||||
|
(千美元) |
||||||||||||||||||||||||
|
銷售和市場營銷 |
$ | 41,054 | $ | 32,921 | $ | 8,133 | 25 | % | 21 | % | 20 | % | ||||||||||||
|
一般和行政 |
31,832 | 28,745 | 3,087 | 11 | % | 16 | % | 18 | % | |||||||||||||||
|
研發 |
16,966 | 13,294 | 3,672 | 28 | % | 9 | % | 8 | % | |||||||||||||||
|
重組 |
485 | 3,107 | (2,622 | ) | (84 | %) | 0 | % | 2 | % | ||||||||||||||
| $ | 90,337 | $ | 78,067 | $ | 12,270 | 16 | % | 47 | % | 48 | % | |||||||||||||
銷售和市場營銷.在截至2023年12月31日的一年中,銷售和營銷費用增長了25%,達到4110萬美元。這一增長主要是由於銷售和相關佣金、競賽和獎金支出、銷售代表和營銷人員增加以及工資和工資的增加所推動的。薪酬及相關支出增加610萬美元,差旅和培訓支出增加80萬美元,銷售會議和貿易展覽支出增加70萬美元。截至2023年12月31日,銷售代表人數為136人,比2022年12月31日增加了4%。在截至2023年12月31日的一年中,銷售和營銷費用佔淨銷售額的百分比從上一季度的20%上升到21%。
一般的和行政的。在截至2023年12月31日的一年中,一般和行政費用增長了11%,達到3180萬美元。增加的主要原因是由於人員增加而增加了170萬美元的報酬和相關費用。此外,專業費用和外部服務費用增加了140萬美元。在截至2023年12月31日的一年中,一般和行政費用佔銷售額的百分比從上一季度的18%下降到16%。
研究和開發。在截至2023年12月31日的一年中,研發支出增長了28%,達到1710萬美元。這一增長主要是由於外部服務和測試費用增加了200萬美元,這是因為諮詢和第三方成本增加,這主要與歐洲監管機構的批准有關。我們的產品目前在歐盟和英國受到歐洲MDD和MDR的監管。此外,由於人員增加,報酬和相關費用增加了140萬美元。在截至2023年12月31日的一年中,總研發費用佔銷售額的比例從上一季度的8%上升到9%。
重組。在截至2023年12月31日的一年中,重組費用為50萬美元。2022年6月30日,我們在法國聖艾蒂安的工廠停止運營。關閉導致截至2022年12月31日的年度的重組費用為310萬美元。這些費用主要包括僱傭終止費用、固定資產和存貨減值以及第三方費用。在截至2023年12月31日的一年中,我們記錄了與法國聖埃蒂安工廠關閉相關的額外重組費用50萬美元。額外費用主要包括解僱、和解、法律和其他第三方費用。在截至2023年12月31日的一年中,重組費用佔銷售額的百分比不到1%。
所得税費用。截至2023年12月31日的12個月,我們的税前收入為3950萬美元,而截至2022年12月31日的12個月,我們的税前收入為2750萬美元,税前收入為690萬美元。
在截至2023年12月31日的三個月和十二個月期間,我們的有效所得税税率分別為25.3%和23.7%。我們2023年的税費是基於26.1%的估計年度有效税率,在適用的季度期間進行調整,用於離散股票期權行使和其他離散項目。我們2023年的所得税支出與法定税率不同,主要是由於聯邦和州税收抵免、永久項目、與我們外國實體不同的法定税率以及股票期權行使的離散項目。
在截至2022年12月31日的三個月和十二個月期間,我們的有效所得税税率分別為27.8%和24.9%。我們的2022年撥備是基於26.0%的估計年度有效税率,在適用的季度期間針對離散股票期權行使和其他離散項目進行了調整。我們2022年的所得税支出與法定税率存在差異,主要原因是永久性項目、我們外國實體的不同法定税率以及股票期權行使的離散項目。
我們按税務管轄區監控盈利能力組合,並按需要按季度調整年度預期利率。雖然通常難以預測任何特定税務事項的最終結果或決議時間,但我們相信,我們的税項儲備反映了已知或然事項的可能結果。
我們評估遞延税項資產將透過未來應課税收入變現的可能性,並記錄估值撥備,以將遞延税項資產總額減至我們認為較有可能變現的金額。截至2023年12月31日,我們已就遞延税項資產計提170萬美元的估值撥備,主要涉及預期不會實現的澳大利亞淨經營虧損和資本虧損結轉以及馬薩諸塞州税收抵免結轉。
從2022年開始,2017年的《減税和就業法案》取消了在發生年度立即扣除研發支出的選項,並要求納税人出於税收目的在五年內攤銷此類支出。該撥備導致二零二三課税年度的現金税項負債約為70萬美元。因此,我們的遞延税項資產淨額於二零二三年亦增加約80萬元。該撥備預計亦會增加我們2024年的現金税項負債。對二零二四年現金税項負債的實際影響將取決於二零二四年已付或產生的研發費用金額(其中包括其他因素)。雖然該撥備的最大影響將是對二零二二年及二零二三年現金税項負債,但影響將在五年攤銷期內持續,但將於期內按比例減少。
《通貨膨脹削減法》(IRA)於2022年8月16日頒佈成為法律。IRA包括一項條款,即對適用公司的“調整後財務報表收入”徵收15%的企業替代最低税,對回購股票徵收1%的消費税。該等條文於二零二二年十二月三十一日之後開始的課税年度生效。我們已經評估了IRA的條款,我們目前認為IRA不會對我們報告的業績、現金流或財務狀況產生重大影響。
截至去年十二月底的年度比較 2022年31月至截至12月止年度 31, 2021
下表載列於所示期間,我們按地區劃分的銷售淨額,以及指定期間之間的變動,以增加或減少百分比表示:
|
百分比 |
||||||||||||||||
|
2022 |
2021 |
$Change |
變化 |
|||||||||||||
|
(千美元) |
||||||||||||||||
|
淨銷售額 |
$ | 161,651 | $ | 154,424 | $ | 7,227 | 5 | % | ||||||||
|
按地理位置劃分的淨銷售額: |
||||||||||||||||
|
美洲 |
$ | 109,439 | $ | 102,265 | $ | 7,174 | 7 | % | ||||||||
|
歐洲、中東和非洲 |
41,854 | 42,132 | (278 | ) | (1 | %) | ||||||||||
|
亞太地區 |
10,358 | 10,027 | 331 | 3 | % | |||||||||||
|
總計 |
$ | 161,651 | $ | 154,424 | $ | 7,227 | 5 | % | ||||||||
淨銷售額。截至2022年12月31日止年度,淨銷售額增加7. 2百萬元或5%至161. 7百萬元,而截至2021年12月31日止年度則為154. 4百萬元。這一增長主要由牛移植物銷售額增加290萬美元,頸動脈貼片銷售額增加240萬美元,分流器銷售額增加240萬美元,同種異體移植物保存服務增加170萬美元。增加的銷售額部分被綿羊移植物銷售額減少150萬美元(主要是由於監管和生產相關的積壓訂單,年底總計約100萬美元)和外科膠水銷售額減少70萬美元所抵消。我們估計,美元走強導致截至二零二二年十二月三十一日止年度的淨銷售額較截至二零二一年十二月三十一日止年度減少6. 1百萬美元。
截至2022年12月31日和2021年12月31日的年度,直接到醫院的淨銷售額分別佔我們總淨銷售額的95%和94%。
按地域劃分的淨銷售額。截至2022年12月31日的一年,美洲的淨銷售額比截至2021年12月31日的一年增加了720萬美元,增幅為7%。這一增長主要是由於牛移植物銷售額增加了290萬美元,同種異體移植物保存服務增加了130萬美元,分流術銷售額增加了110萬美元,瓣膜切除術銷售額增加了90萬美元,頸動脈補片銷售額增加了60萬美元。
與截至2021年12月31日的年度相比,截至2022年12月31日的年度,歐洲、中東和非洲地區的淨銷售額減少了30萬美元,降幅為1%。這一下降主要是由於2022年美元相對走強,以及羊移植物銷售額減少150萬美元(主要是由於監管和生產相關的延交訂單,年末訂單總額約為100萬美元),以及外科手術膠銷售額為70萬美元。銷售額的下降被140萬美元的分流銷售額和110萬美元的頸動脈補片銷售額的增加部分抵消了。
截至2022年12月31日的年度,亞太地區的淨銷售額比截至2021年12月31日的年度增加了30萬美元,增幅為3%。這一增長主要是由於頸動脈補片銷售額增加了70萬美元和血栓切除導管銷售額增加了30萬美元。2022年美元相對走強,以及閉塞導管、瓣膜環、分流管和夾子銷售額分別下降10萬美元,部分抵消了銷售額的增長。
毛利。下表載列我們於所示期間的毛利及毛利率變動:
|
百分比 |
||||||||||||||||
|
2022 |
2021 |
變化 |
變化 |
|||||||||||||
|
(千美元) |
||||||||||||||||
|
毛利 |
$ | 104,896 | $ | 101,382 | $ | 3,514 | 3 | % | ||||||||
|
毛利率 |
64.9 | % | 65.7 | % | (0.8% | ) | * | |||||||||
|
*不適用 |
截至2022年12月31日止年度的毛利增加350萬美元,或3%,至104.9,000,000美元;期內毛利率下降80個基點,至64.9%。毛利潤的增長主要是由於牛移植物、頸動脈補片和分流術銷售額的增加。毛利率下降的主要原因是外匯匯率的不利變化、製造效率低下主要與直接人工和質量成本增加有關,以及不利的產品組合,包括利潤率相對較低的取栓導管和聚酯移植物的銷售增加,以及利潤率相對較高的瓣膜切開術的銷售減少。
運營費用。下表載列我們於所示期間的經營開支變動及指定期間之間的變動,以增加或減少百分比表示:
|
百分比 |
2022年% |
2021年作為百分比 |
||||||||||||||||||||||
|
2022 |
2021 |
$Change |
變化 |
淨銷售額的 |
淨銷售額的 |
|||||||||||||||||||
|
(千美元) |
||||||||||||||||||||||||
|
銷售和市場營銷 |
$ | 32,921 | $ | 27,655 | $ | 5,266 | 19 | % | 20 | % | 18 | % | ||||||||||||
|
一般和行政 |
28,745 | 25,501 | 3,244 | 13 | % | 18 | % | 17 | % | |||||||||||||||
|
研發 |
13,294 | 11,801 | 1,493 | 13 | % | 8 | % | 8 | % | |||||||||||||||
|
重組 |
3,107 | - | 3,107 | * | 2 | % | 0 | % | ||||||||||||||||
| $ | 78,067 | $ | 64,957 | $ | 13,110 | 20 | % | 48 | % | 42 | % | |||||||||||||
*不是一個有意義的百分比。
銷售和市場營銷.在截至2022年12月31日的一年中,銷售和營銷費用增長了19%,達到3290萬美元。這一增長主要是由於工資增加和410萬美元的相關費用,包括140萬美元的更高銷售佣金。從2021年12月31日到2022年12月31日,我們的銷售代表人數從103人增加到131人。在此期間,我們還增加了兩名區域銷售經理。差旅及相關支出也增加了80萬美元。為應對新冠肺炎,在2020年至2021年期間實施的開支削減計劃,包括減少銷售隊伍,降低了截至2021年12月31日的年度開支。自那以後,我們在許多領域重新招聘,包括我們的銷售隊伍。在截至2022年12月31日的一年中,銷售和營銷費用佔淨銷售額的百分比從上一季度的18%增加到20%。
一般的和行政的。在截至2022年12月31日的一年中,一般和行政費用增長了13%,達到2870萬美元。增加的主要原因是,由於人員增加,薪金和相關費用增加270萬美元。此外,2021年,我們確認了與修訂與我們2019年Anteris生物貼片收購相關的或有購買義務相關的50萬美元的收益,從而降低了一般和行政費用。在截至2022年12月31日的一年中,一般和行政費用佔銷售額的百分比從上一季度的17%增加到18%。
研究和開發。在截至2022年12月31日的一年中,研發費用增長了13%,達到1330萬美元。增加的主要原因是,由於人員增加,薪金和相關費用增加了110萬美元。外部服務和測試也增加了50萬美元,主要是因為與歐洲監管機構批准相關的第三方成本上升。我們的產品目前在歐盟和英國受到MDD和MDR的監管。2022年和2021年的總研發費用佔銷售額的百分比均為8%。
重組。在截至2022年12月31日的一年中,重組費用為310萬美元。2022年6月30日,我們在法國聖艾蒂安的工廠停止運營。關閉導致截至2022年12月31日的年度的重組費用為310萬美元。費用主要包括僱傭終止費用、固定資產和存貨減值以及第三方成本。
所得税支出。截至2022年12月31日止十二個月,我們就税前收入27,500,000元作出税項撥備6,900,000元,而截至2021年12月31日止十二個月的税前收入34,300,000元則為7,400,000元。
截至二零二二年十二月三十一日止三個月及十二個月期間,我們的實際所得税率分別為27. 8%及24. 9%。二零二二年的税項開支乃根據估計年度實際税率26. 0%計算,並於適用季度期間就離散股票期權行使及其他離散項目作出調整。二零二二年的所得税開支與法定税率不同,主要由於永久項目、海外實體不同的法定税率以及股票期權行使的獨立項目所致。
截至二零二一年十二月三十一日止三個月及十二個月期間,我們的實際所得税率分別為21. 9%及21. 5%。我們的二零二一年撥備乃根據估計年度實際税率24. 7%計算,並於適用季度期間就離散購股權行使及其他離散項目作出調整。二零二一年的所得税開支與法定税率有所不同,主要由於聯邦及州税務抵免、永久項目、海外實體不同的法定税率以及股票期權行使的獨立項目所致。
截至2022年12月31日,我們已就遞延税項資產計提160萬美元的估值撥備,主要涉及預期不會實現的澳大利亞淨經營虧損及資本虧損結轉以及馬薩諸塞州税收抵免結轉。
從2022年開始,2017年的《減税和就業法案》取消了在發生年度立即扣除研發支出的選項,並要求納税人出於税收目的在五年內攤銷此類支出。該撥備導致二零二二課税年度的現金税項負債約為70萬美元。因此,我們的遞延税項資產淨額於二零二二年亦增加約70萬元。
流動性與資本資源
2024年2月21日,我們的董事會授權通過公開市場交易、私下協商購買或其他方式回購高達5000萬美元的公司普通股,直到2025年2月21日。回購計劃可隨時暫停或終止。到目前為止,我們還沒有根據該計劃進行任何回購。
截至2023年12月31日,我們的現金及現金等價物為2430萬美元,而截至2022年12月31日則為1910萬美元。截至2023年12月31日,我們擁有8080萬美元的短期有價證券,截至2022年12月31日,我們擁有6360萬美元的短期有價證券。我們的現金及現金等價物為高流動性投資,於購買當日到期日為90天或以下,主要由營運銀行賬户組成。我們的短期有價證券包括一個管理收益共同基金,主要投資於短期投資級別,美國—截至2023年12月31日,我們的短期有價證券因市場利率上升而錄得120萬美元未實現虧損。
於2021年7月16日,我們完成了以每股54. 50美元扣除承銷折扣的價格向公眾發行1,000,000股普通股,每股面值0. 01美元。扣除承銷折扣及其他發行開支後,所得款項淨額約為5100萬美元。我們用發行所得的一部分來償還未償債務。於二零二一年八月四日,承銷商根據就上述發售向彼等授出的購股權額外購買150,000股股份。扣除承銷折扣及其他發行費用後,本公司所得款項淨額約為760萬美元。
於二零二零年六月,就收購Artegraft,我們產生債務6,500萬元,包括5年期循環信貸額度2,500萬元及4,000萬元五年期定期貸款。該等貸款按協議所界定的基本利率加適用利率1. 25%至1. 75%(視乎我們的綜合槓桿比率)或歐洲美元利率加適用利率2. 25%至2. 75%(視乎我們的綜合槓桿比率)計息。於二零二一年七月,我們悉數償還定期貸款餘額,加應計利息。於二零二一年十一月,我們終止了原協議所允許的信貸協議,包括循環信貸額度。
營運及資本開支規定
我們需要現金來支付運營費用、資本支出和支付長期負債。自成立以來,我們一直透過公開發售及私募股權證券、短期及長期借貸以及營運所產生的資金為我們的營運提供資金。
我們確認截至2023年12月31日止年度的營業收入為3670萬美元,截至2022年12月31日止年度的營業收入為2680萬美元,以及截至2021年12月31日止年度的營業收入為3640萬美元。我們預計從現有現金及現金等價物中為任何增加的成本及開支提供資金,儘管我們未來的資本需求取決於眾多因素。這些因素包括但不限於:
|
• |
銷售我們的產品和服務所產生的收入; |
|
• |
向普通股股東支付與未來潛在季度現金股息有關的款項; |
|
• |
未來與收購有關的付款; |
|
• |
與所得税和其他税有關的付款; |
|
• |
與擴大我們的製造、營銷、銷售和分銷工作相關的成本; |
|
• |
與我們在新國家直接向醫院銷售相關的成本; |
|
• |
獲得和維持美國FDA和其他監管許可的費用; |
|
• |
與獲得歐洲MDR許可相關的費用; |
|
• |
收購、資產剝離和其他戰略交易的數量、時間和性質; |
|
• |
未來的股票回購。 |
我們的現金餘額可能會減少,因為我們繼續使用現金為我們的運營提供資金,進行收購,支付股息,回購我們的普通股股份,並作出與先前收購有關的遞延付款。我們相信,我們的現金、現金等價物、投資以及我們從這些結餘中賺取的利息將足以滿足我們至少未來12個月的預期現金需求,並滿足我們已知的長期現金需求。倘該等現金來源不足以滿足未來十二個月後的流動資金需求,我們可能尋求出售額外股本或債務證券或取得貸款。出售額外股本及債務證券可能導致股東攤薄,二零二一年七月股本發售即屬如此。如果我們通過發行債務證券籌集額外資金,這些證券的權利可能高於我們的普通股,並可能包含限制我們的運營和可能我們支付股息的能力的契約。我們可能需要額外的資本,超出我們目前的預測金額。任何該等所需額外資本可能無法按合理條款提供(如有)。
現金流
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(千美元) |
||||||||||||
|
現金和現金等價物 |
$ | 24,269 | $ | 19,134 | $ | 13,855 | ||||||
|
現金流由(用於): |
||||||||||||
|
經營活動 |
$ | 36,751 | $ | 25,378 | $ | 35,102 | ||||||
|
投資活動 |
(24,715 | ) | (10,371 | ) | (61,076 | ) | ||||||
|
融資活動 |
(7,131 | ) | (9,234 | ) | 13,702 | |||||||
經營活動提供的淨現金。截至2023年12月31日止年度,經營活動提供的現金淨額為3680萬美元,包括3010萬美元淨收入,調整後的非現金項目為1790萬美元(主要包括折舊和攤銷950萬美元、基於庫存的補償530萬美元、庫存核銷準備金和信貸損失260萬美元,遞延所得税撥備80萬美元,資產剝離損失50萬美元,被外匯交易對收入的影響70萬美元和收購或有對價債務的公允價值調整10萬美元所抵消),以及用作週轉資金的現金1 130萬美元。用於週轉金的現金淨額是由於存貨和其他遞延費用增加980萬美元、應收賬款增加310萬美元、預付費用和其他資產增加290萬美元,但應付賬款和其他負債增加460萬美元抵消。
截至2022年12月31日止年度,經營活動提供的現金淨額為2540萬美元,包括2060萬美元淨收入,調整非現金項目1810萬美元(主要包括折舊和攤銷940萬美元、基於庫存的補償420萬美元、庫存核銷準備金和信貸損失320萬美元,資產剝離損失200萬美元,固定資產處置損失10萬美元,由外幣交易對收入的影響30萬美元、遞延所得税收益20萬美元、出售建築物收益10萬美元以及收購或有對價債務的公允價值調整10萬美元所抵消),以及用於週轉資金的現金1 340萬美元。用於週轉金的現金淨額是由於庫存和其他遞延費用增加740萬美元、應收賬款增加350萬美元、預付費用和其他資產增加310萬美元,但應付賬款和其他負債增加60萬美元抵消。
截至2021年12月31日止年度,經營活動提供的現金淨額為3510萬美元,包括2690萬美元的淨收入,調整非現金項目1820萬美元(主要包括折舊和攤銷1 110萬美元、基於庫存的補償350萬美元、庫存核銷準備金和信貸損失400萬美元,外幣交易對收入的影響為20萬美元,遞延所得税撥備為10萬美元,被收購或有代價債務的公允價值調整額70萬美元所抵銷),以及用作週轉資金的現金1 000萬美元。用於週轉金的現金淨額是由於庫存和其他遞延費用增加550萬美元、預付費用和其他資產增加190萬美元、應付賬款和其他負債減少170萬美元以及應收賬款增加80萬美元。
用於投資活動的淨現金。截至2023年12月31日止年度,用於投資活動的現金淨額為2470萬美元,包括購買有價證券1660萬美元,購買物業和設備730萬美元,以及收購相關付款90萬美元。
截至2022年12月31日止年度,用於投資活動的現金淨額為1040萬美元,包括購買有價證券800萬美元以及購買物業和設備320萬美元,被出售法國聖艾蒂安大樓的收益90萬美元所抵消。
截至2021年12月31日止年度,投資活動所用現金淨額為6110萬美元,包括購買有價證券淨額5620萬美元及購買物業及設備淨額490萬美元。
由融資活動提供(用於)的現金淨額。截至2023年12月31日止年度,融資活動所用現金淨額為710萬美元。現金使用包括股息支付1240萬美元。這筆現金的使用被股票期權行使所得的收益530萬美元(扣除為支付僱員工資税而回購的股票)所抵消。
截至2022年12月31日止年度,融資活動所用現金淨額為920萬美元。現金使用包括股息支付1 100萬美元和收購遞延付款110萬美元。這些現金的使用被股票期權行使所得280萬美元(扣除為支付僱員工資税而回購的股票)所抵消。
截至二零二一年十二月三十一日止年度,融資活動提供的現金淨額為13. 7百萬美元。現金來源主要包括股權發行所得淨額5 870萬美元和股票期權行使所得款項370萬美元,扣除為支付僱員工資税而購回的股份。這些現金來源被我們支付的長期債務3900萬美元、支付的股息930萬美元和延遲支付的收購款項40萬美元所抵消。
分紅
2011年2月,我們的董事會批准了一項政策,以支付我們的普通股的季度現金股息。未來宣派季度股息及建立未來記錄及付款日期須經董事會按季度批准。於呈列期間之股息活動如下:
|
記錄日期 |
付款日期 |
每股金額 |
股息支付 |
|||||||
|
(單位:千) |
||||||||||
|
2023財年 |
||||||||||
|
2023年3月9日 |
2023年3月23日 |
$ | 0.140 | $ | 3,099 | |||||
|
2023年5月17日 |
2023年6月1日 |
$ | 0.140 | $ | 3,116 | |||||
|
2023年8月17日 |
2023年8月31日 |
$ | 0.140 | $ | 3,117 | |||||
|
2023年11月16日 |
2023年11月30日 |
$ | 0.140 | $ | 3,117 | |||||
|
2022財年 |
||||||||||
|
2022年3月8日 |
2022年3月24日 |
$ | 0.125 | $ | 2,743 | |||||
|
2022年5月17日 |
2022年6月2日 |
$ | 0.125 | $ | 2,745 | |||||
|
2022年8月25日 |
2022年9月8日 |
$ | 0.125 | $ | 2,750 | |||||
|
2022年11月17日 |
2022年12月1日 |
$ | 0.125 | $ | 2,750 | |||||
2024年2月21日,我們的董事會批准了於2024年3月28日向2024年3月14日營業結束時記錄在案的股東支付每股0.160美元的季度現金股息,總額約為360萬美元。
關鍵會計政策和估算
我們已根據美國公認會計原則(GAAP)採納多項會計政策編制綜合財務報表。我們最重要的會計政策載於本年報表格10—K其他地方的綜合財務報表附註1。根據公認會計原則編制我們的綜合財務報表要求我們作出影響綜合財務報表和隨附附註中報告的金額的估計和假設。我們的估計及假設(包括與收入確認、存貨估值、無形資產及商譽估值、或然代價及所得税有關的估計及假設)會持續審閲,並於適當時更新。實際結果可能與該等估計不同。
我們的若干較關鍵的會計政策要求管理層在選擇適當假設時應用判斷以計算財務估計。就其性質而言,這些判斷具有固有的不確定性。這些判斷是基於我們的歷史經驗、現有合同的條款以及對行業趨勢的遵守(如適用)。本期本可採用不同的合理估計數。此外,會計估計變動合理可能於不同期間發生。這兩個因素可能對我們財務狀況、財務狀況變動或經營業績的呈列產生重大影響。
我們相信,以下財務估計及相關會計政策對反映我們的財務狀況及經營業績均很重要,並需要作出主觀或複雜的判斷。此外,吾等相信下文所討論的項目已於吾等所有呈列期間之綜合財務報表妥善記錄。管理層已與董事會審核委員會及獨立註冊會計師事務所討論制定、選擇及披露最關鍵財務估計。有關該等財務估計之判斷乃基於於我們綜合財務報表日期可得之資料。這些財務估計數和相關政策包括:
收入確認
我們的收入主要來自銷售血管手術期間使用的一次性或植入式器械。我們主要直接銷售予醫院,少量銷售予分銷商,詳情如下所述,並於綜合財務報表呈列期間,與醫院或分銷商訂立有限委託存貨安排。我們還從人體組織的加工和冷凍保存中獲得收入,用於植入患者體內。這些收入在提供服務和紙巾已發運給客户時確認,但須符合下文所述的所有其他收入確認標準。
我們根據ASU 2014-09的規定記錄收入,與客户簽訂合同的收入(主題606)。專題606的核心原則是,實體應確認向客户轉讓貨物或服務的收入,其數額應反映該實體預期有權以這些貨物或服務換取的對價。該標準解釋説,為了實現核心原則,實體應採取以下行動:
步驟1:確定與客户的合同
第二步:確定合同中的履約義務
第三步:確定交易價格
第四步:分配成交價
第5步:在實體履行業績義務時或在履行義務時確認收入
當公司通過將承諾的商品或服務轉讓給客户來履行履行義務時(即當客户獲得該商品或服務的控制權時),收入就被確認。如果運輸和搬運活動是在客户控制貨物之後執行的(例如,從我們的碼頭裝運時所有權轉移),我們已經做出了主題606允許的政策選擇,以將這些活動作為履行成本而不是作為履行義務來考慮。
我們通常參考客户採購訂單來確定合同是否存在。沒有附帶採購訂單的訂單將以書面或口頭形式與客户確認。採購訂單或類似的函件一旦被接受,就確定了履約義務以及交易價格,並以其他方式概述了各方的權利和義務。我們根據採購訂單上指定的每個項目的定價在履行義務之間分配每個合同的交易價格,而採購訂單上指定的每個項目的定價又基於我們公佈的價目表中的獨立銷售價格。在我們為產品打折或免費提供某些物品的情況下,我們按比例將折扣分配給所有履約義務,除非可以證明折扣應完全分配給一個或多個但不是所有履約義務。
我們記錄收入,扣除退貨和折扣津貼,支付給集團採購組織的費用,以及任何需要開具發票的銷售和增值税,我們選擇在發貨時(考慮合同發貨條款)或在寄售庫存消耗時,從標準允許的交易價格測量中排除這些收入和增值税。發貨是指產品和所有權的控制權轉移到我們的客户手中,Lemaitre現在有權收到貨款。
我們不承擔任何合同資產或合同負債,因為根據我們已部分履行履約義務的合同,我們一般不會向客户支付未開賬單的金額,或者我們從客户那裏收到的金額沒有履行履約義務。我們在收到訂單後的短時間內履行收入合同規定的履約義務,客户的付款通常在訂單完成後30至60天內收到,但意大利、西班牙和法國等某些地區的付款週期通常較長。因此,我們的收入合同中沒有重要的融資部分。此外,我們選擇的政策是,由於合同的短期性質,為獲得合同而產生的增量成本(如佣金)應作為已發生的費用計入費用。
退貨客户可根據退貨條件和退貨時間享受全部或部分積分。要被接受,退回的產品必須是未打開(如果無菌)、未摻雜和未損壞的,必須在有效期之前至少還有18個月,或者對於我們在歐洲的醫院客户來説,必須有12個月的剩餘時間,並且通常在發貨後30天內退回。這些退貨政策適用於對醫院和分銷商的銷售。退還給我們的產品數量,無論是換貨還是賒購,都不是實質性的。然而,我們根據歷史退貨經驗為未來的銷售退貨撥備了準備金,這需要做出判斷。我們更換有缺陷產品的成本並不是實質性的,在更換時已計入。
庫存和其他遞延成本
庫存和其他遞延成本包括成品、在製品、原材料和與RestoreFlow同種異體移植業務的人體組織冷凍保存服務相關的遞延成本。我們以成本或市場價值較低的價格對庫存和其他遞延成本進行估值。成本包括材料、人工和製造費用,並使用先進先出(FIFO)方法確定。我們每季度審查現有庫存量,並主要根據產品到期日期和我們基於銷售歷史和預期未來需求的估計銷售預測來分析過剩和過時庫存的撥備。我們對未來產品需求的估計可能不準確,我們可能會低估或誇大過剩和過時庫存所需的撥備。因此,需求的任何重大意外變化都可能對我們的庫存價值和運營結果產生重大影響。
無形資產與商譽的計價
無形資產主要包括購買的已開發技術、專利、客户關係及商標,並按其估計可使用年期(介乎2至16年)攤銷。商譽指就業務收購所付代價超出所收購資產及所承擔負債之公平值。我們一般使用經風險調整貼現率計算無形資產的公平值為我們預期從該資產產生的估計未來現金流量的現值。在釐定與無形資產相關的估計未來現金流量時,我們使用有關資產的未來收入貢獻、成本結構及剩餘可使用年期的估計及假設。該等估計及假設須作出重大判斷,而實際結果可能與假設或估計金額不同。截至2023年12月31日,其他無形資產(扣除累計攤銷)為4170萬美元,截至2022年12月31日為4650萬美元。於2023年12月31日及2022年12月31日,商譽均為65. 9百萬元。
或有事件
在正常業務過程中,我們面臨與(其中包括)業務收購、僱傭、商業事宜、知識產權事宜、產品責任及產品召回相關的訴訟、訴訟及其他申索及評估。我們評估對該等事項作出任何不利判斷或結果的可能性,以及可能虧損的潛在範圍。該等或然事項所需儲備金額(如有)乃經仔細分析每項個別事項後釐定。所需準備金將來可能會因每一事項的新發展或處理這些事項的方法的改變而有所改變,例如處理這些事項的解決策略的改變。當我們確定可能出現損失,並且我們可以合理估計該等成本時,我們會記錄我們預期就針對我們的訴訟和索賠產生的成本的費用。截至二零二三年、二零二二年及二零二一年十二月三十一日止年度,我們並無任何重大訴訟、申索或評估。
就我們的若干收購事項而言,我們可能會訂立協議,於達成若干協定條件後支付額外未來代價。我們按估計公允價值記錄該等安排的負債,反映管理層對完成交易時達到指定標準的可能性的假設,這可能需要作出重大判斷。該等金額於各報告期間重新計量,任何調整均計入經營收入。
所得税
我們根據所得税會計的資產負債法核算所得税。根據資產及負債法,遞延税項乃根據資產及負債之財務申報與税基之間之差異釐定,而該等差異預期可撥回之年度生效之已頒佈税率。所得税撥備包括當期應付税項及因財務報表與資產及負債税基之間暫時性差異之税務影響而產生之遞延税項。倘遞延税項資產的全部或部分很可能無法變現,我們會保留估值撥備。估值撥備之變動計入變動期間之税項撥備。在釐定估值撥備是否合理時,吾等會評估過往盈利記錄、預期未來盈利、結轉及結轉期及税務策略等因素,以提高遞延税項資產變現的可能性。
我們在財務報表中確認、計量、呈列和披露我們已採取或預期在報税表中採取的不確定税務狀況。我們在財務報表中確認符合“較有可能”門檻的税務狀況的影響,基於該狀況的技術優勢。在財務報表中確認的税務利益乃根據最終結算時實現的可能性超過百分之五十的最大利益計量。
我們的政策是將與未確認税務優惠有關的利息和罰款分類為所得税開支。
近期會計公告
有關近期會計公告的其他資料,包括各自的預計採納日期以及對我們綜合財務報表的估計影響(如有),請參閲綜合財務報表附註第8項“財務報表及補充數據”中的附註1“主要會計政策及相關事項”。
|
項目7A。 |
關於市場風險的定量和定性披露 |
在日常業務過程中,我們面臨與市況潛在變動有關的若干風險。該等市場風險包括可能影響經營業績、財務狀況及現金流量的貨幣匯率及利率變動。
外幣風險
於二零二三及二零二二財政年度,我們總收益的39%來自美國以外的客户。此外,我們於美國以外的大部分經營成本以美元以外的貨幣計值。我們在全球範圍內開展業務,因此,我們的一部分收入、收益、淨資產和在海外附屬公司的淨投資面臨外匯匯率變動的風險。我們計量現金結餘頭寸及現金流入及流出的淨風險,以評估降低外匯風險的需要。我們可能會訂立外幣遠期合約,以儘量減低不利匯率變動的影響,儘管我們於二零二三年或二零二二年並無訂立該合約。我們的最大外匯匯率風險主要來自歐元、英鎊、加拿大元、澳元及日圓。
截至2023年及2022年12月31日止年度,我們分別錄得外匯匯兑虧損淨額300萬美元及400萬美元,有關結算及重新計量以營運附屬公司功能貨幣以外的貨幣計值的交易。我們對以多種外幣交易的經營業績的分析顯示,假設外幣匯率變動10%,可能會使二零二三年的綜合經營業績增加或減少約1,600,000元。
利率風險
截至2023年12月31日,我們持有2430萬美元現金及現金等價物,以及8080萬美元短期管理收益共同基金投資。我們相信,假設利率上升或下降10%可能對我們的現金結餘及財務狀況、經營業績或現金流量產生重大影響。截至2023年12月31日,由於市場利率上升,我們的短期有價證券反映了120萬美元的未實現虧損。
|
第8項。 |
財務報表和補充數據 |
請參閲以下第15項下列出的作為本年報一部分的表格10—K提交的綜合財務報表,該等報表以引用方式併入本文。
|
第9項。 |
會計與財務信息披露的變更與分歧 |
不適用。
|
項目9A。 |
控制和程序 |
信息披露控制和程序的評估
我們的管理層在首席執行官和首席財務官的參與和監督下,根據《交易所法案》規則13a-15(E)和15d-15(E)負責我們的信息披露控制和程序。披露控制和程序是控制和其他程序,旨在確保我們根據交易所法案提交或提交的報告中要求披露的信息在美國證券交易委員會規則和表格指定的時間段內得到記錄、處理、彙總和報告。披露控制和程序包括控制和程序,旨在確保我們根據交易所法案提交的報告中要求披露的信息得到積累,並酌情傳達給我們的主要高管和我們的主要財務官,以便及時做出關於要求披露的決定。我們設計我們的披露控制和程序,以確保在合理的保證水平下,該等信息被及時記錄、處理、彙總和報告,然後適當地積累和傳達。
根據對我們截至2023年12月31日的披露控制和程序的評估,我們的首席執行官和首席財務官得出結論,截至該日期,我們的披露控制和程序在合理的保證水平下是有效的。
管理層關於財務報告內部控制的報告
我們的管理層負責建立和維持對財務報告的充分內部控制(如交易法第13a-15(F)和15d-15(F)規則所定義),以提供關於我們財務報告的可靠性和根據公認會計原則編制外部財務報表的合理保證。
管理層評估了截至2023年12月31日我們對財務報告的內部控制的有效性。管理層的評估是基於內部控制 —集成框架特雷德韋委員會贊助組織委員會發布(2013年框架)。管理層的評估包括對關鍵財務報告控制的設計和操作有效性、流程文件、會計政策和我們的整體控制環境等要素的評估。
根據以下標準進行評估內部控制 —集成框架,管理層得出結論,我們對財務報告的內部控制自2023年12月31日起生效。
我們截至2023年12月31日的財務報告內部控制已由獨立註冊會計師事務所Grant Thornton LLP審計,如本報告所述。
財務報告內部控制的變化
如前所述,我們正在完成新的企業資源規劃系統的實施工作。企業資源規劃的實施需要將新的企業資源規劃系統與多個新的和現有的信息系統和業務流程相結合。新的ERP旨在準確維護我們的賬簿和記錄,並向我們的管理團隊提供對業務運營至關重要的信息。隨着新的企業資源規劃系統的分階段實施,我們預計將繼續改變某些流程和程序,這反過來預計將導致我們對財務報告的內部控制發生變化。當發生該等變動時,我們將每季度評估該等變動是否對我們對財務報告的內部控制造成重大影響。截至2023年12月31日,新的ERP系統尚未投入使用,因此並未影響我們對財務報告的內部監控。
於截至2023年12月31日止財政年度,我們對財務報告的內部控制並無發生對或合理可能對我們對財務報告的內部控制造成重大影響的其他變動。
內部控制的內在侷限性
儘管如此,我們的管理層(包括首席執行官及首席財務官)並不期望我們的披露控制及程序或內部控制能防止所有錯誤及所有欺詐行為。一個控制系統,無論設計和操作多麼好,只能提供合理的,而不是絕對的保證,以達到控制系統的目標。由於所有控制系統固有的侷限性,任何控制措施的評估都不能絕對保證公司內部的所有控制問題和欺詐事件(如果有的話)都已被發現。這些固有的侷限性包括決策過程中的判斷可能是錯誤的,以及由於一個簡單的錯誤或錯誤而可能發生故障。此外,某些人的個人行為、兩個或多個人的勾結或管理層對控制的超越,都可能規避控制。任何控制系統的設計也部分基於對未來事件可能性的某些假設,無法保證任何設計在所有潛在未來條件下都能成功實現其既定目標。隨着時間的推移,控制可能會因情況的變化而變得不足,或遵守政策或程序的程度可能會惡化。由於成本效益高的控制制度固有的侷限性,可能會發生因錯誤或欺詐而導致的錯報,而未被發現。
獨立註冊會計師事務所報告
董事會和股東
Lemaitre血管公司
對財務報告內部控制的幾點看法
我們已審核LeMaitre Vascular,Inc.財務報告的內部控制。(特拉華州公司)及其子公司(“公司”)截至2023年12月31日,根據2013年確立的標準, 內部控制—集成框架由Treadway委員會贊助組織委員會(“COSO”)發佈。我們認為,截至2023年12月31日,公司在所有重大方面均按照2013年制定的標準對財務報告進行了有效的內部控制。 內部控制—集成框架由COSO發佈。
我們亦已按照美國上市公司會計監督委員會(“PCAOB”)的標準,審核本公司截至2023年12月31日及截至該年度的綜合財務報表,而我們於2024年2月29日的報告對該等財務報表表達了無保留意見。
意見基礎
本公司管理層負責維持有效的財務報告內部控制,並負責評估財務報告內部控制的有效性,包括在隨附的《管理層財務報告內部控制報告》中。我們的責任是根據我們的審計,對公司財務報告的內部控制發表意見。我們是一家在PCAOB註冊的公共會計師事務所,根據美國聯邦證券法以及美國證券交易委員會和PCAOB的適用規則和法規,我們必須與公司保持獨立。
我們是按照PCAOB的標準進行審計的。這些標準要求我們計劃和執行審計,以獲得合理的保證,以確定財務報告的有效內部控制是否在所有重要方面都得到了維護。我們的審計包括瞭解財務報告的內部控制,評估存在重大弱點的風險,根據評估的風險測試和評估內部控制的設計和運作有效性,以及執行我們認為在情況下必要的其他程序。我們相信,我們的審計為我們的觀點提供了合理的基礎。
財務報告內部控制的定義及侷限性
公司對財務報告的內部控制是一個程序,旨在根據公認的會計原則,為財務報告的可靠性和為外部目的編制財務報表提供合理保證。公司對財務報告的內部控制包括下列政策和程序:(1)關於保存合理詳細、準確和公平地反映公司資產的交易和處置的記錄;(2)提供合理的保證,即交易被記錄為必要的,以便按照公認的會計原則編制財務報表,公司的收入和支出僅根據公司管理層和董事的授權進行;(三)提供合理保證,防止或及時發現可能對財務報表產生重大影響的未經授權收購、使用或處置公司資產。
由於其固有的侷限性,財務報告的內部控制可能無法防止或發現錯誤陳述。此外,對未來期間進行任何有效性評估的預測都有可能因條件的變化而出現控制不足的風險,或者政策或程序的遵守程度可能會惡化。
/s/均富律師事務所
波士頓,馬薩諸塞州 2024年2月29日
|
項目9B。 |
其他信息 |
在截至2023年12月31日的財季中,我們的董事或高級職員採納、修改或終止規則10b5—1交易安排或非規則10b5—1交易安排,這些條款在規則S—K第408項中定義。
|
項目9C。 |
關於妨礙檢查的外國司法管轄區的披露 |
不適用因
第三部分
|
第10項。 |
董事、高管與公司治理 |
迴應本項目的信息以引用的方式併入本文,內容來自標題為"董事、執行官和主要僱員"、"公司治理,”和“董事會會議和委員會”在我們的2024年最終委託書2024年度股東大會將於截至2023年12月31日的財政年度後120天內向美國證券交易委員會提交2024年度股東大會。
本項目所要求的有關遵守交易法第16(a)條的信息通過引用納入本公司2024年委託書中標題為“違約條款16(a)報告”的章節中所載的信息,在需要包括的範圍內。
道德守則
有關我們企業管治的若干文件,包括適用於我們董事、高級職員和僱員的商業行為和道德準則,以及我們董事會的審核委員會、薪酬委員會以及企業管治和提名委員會的章程,可在我們的網站上查閲,網址為: http://www.lemaitre.com.本公司擬披露對適用於本公司首席執行官、首席財務官、首席會計官或控權人或履行類似職能的人士的商業行為及道德準則任何條文的實質性修訂或豁免(包括隱含豁免),方式是在本公司的網站上公佈該等資料,網址為: http://www.lemaitre.com.
|
第11項。 |
高管薪酬 |
迴應此項目的資料載於本公司2024年授權委託書中標題為“行政人員及董事的薪酬”一節的資料,以引用方式納入本報告。
|
第12項。 |
某些實益擁有人的擔保所有權以及管理層和相關股東的事項 |
迴應此項目的資料以引用方式納入本公司2024年授權委託書中標題為“若干實益擁有人及管理層的證券擁有權”一節所載的資料。
股權薪酬計劃信息
下表載列有關我們於2023年12月31日生效的股權補償計劃的資料。我們的每個股權補償計劃均為“僱員福利計劃”,定義見1933年證券法(經修訂)第C條第405條。
|
計劃類別 |
證券數量 將在以下日期發出 演練 未完成的選項, 認股權證及權利 |
加權平均 行權價格 未完成的選項, 認股權證及權利 |
證券數量 保持可用 用於未來的發行 在權益下 薪酬計劃, 不包括證券 反映在列中 (a) |
|||||||||
|
(a) |
(b) |
(c) |
||||||||||
|
證券持有人批准的股權補償計劃 |
961,282 | $ | 43.95 | 273,588 | ||||||||
|
未經證券持有人批准的股權補償計劃 |
- | - | - | |||||||||
|
總計 |
961,282 | $ | 43.95 | 273,588 | ||||||||
|
第13項。 |
某些關係和相關交易,以及董事的獨立性 |
迴應此項目所需資料載於二零二四年授權委託書中標題為“若干關係及相關交易”及“企業管治”章節的資料,以引用方式納入本報告。
|
第14項。 |
首席會計師費用及服務 |
迴應此項目的資料以引用方式納入本公司2024年授權委託書中標題為“獨立註冊會計師事務所的批准”及“關於我們獨立註冊會計師事務所的額外資料”章節中的資料。
第四部分
|
第15項。 |
展品和財務報表附表 |
|
a) |
作為本報告的一部分提交的文件。 |
|
(1) |
以下綜合財務報表載於上文第二部分第8項。 |
|
(i) |
獨立註冊會計師事務所報告 |
|
(Ii) |
合併資產負債表 |
|
(Iii) |
合併業務報表 |
|
(Iv) |
合併股東權益變動表 |
|
(v) |
綜合全面收益表 |
|
(Vi) |
合併現金流量表 |
|
(Vii) |
合併財務報表附註 |
|
(2) |
所有財務報表附表均被省略,因為這些附表不適用,或所需資料載於財務報表或附註。 |
|
(3) |
陳列品 |
|
通過引用併入 |
||||||||||
|
展品 數 |
展品説明 |
表格: |
日期: |
SEC文件 數 |
已提交 特此聲明: |
|||||
|
2.1 |
2019年10月11日,註冊人與Admedus Ltd及其子公司簽署的資產購買協議 |
10-K |
3/12/20 |
001-33092 |
||||||
|
2.2 |
2019年10月11日,註冊人與Admedus Ltd(現稱為Anteris Technologies Ltd)及其子公司之間的資產購買協議第1號修訂案。 |
8-K |
9/1/21 |
001-33092 |
||||||
|
2.3^ |
資產購買協議,日期為2020年6月22日,本公司和Artegraft,Inc. |
8-K |
6/24/20 |
001-33092 |
||||||
|
3.1 |
經修訂及重訂的註冊人章程細則 |
S-1/A |
5/26/06 |
001-33092 |
||||||
|
3.2 |
二次修訂和重新註冊的註冊人註冊證書 |
10-K |
3/29/10 |
001-33092 |
||||||
|
3.3 |
第二次修訂及重述的註冊人法團證書的修訂 |
8-K |
6/15/12 |
001-33092 |
||||||
|
4.1 |
證明普通股股份的樣本 |
S-1/A |
6/22/06 |
333-133532 |
||||||
|
通過引用併入 |
||||||||||
|
展品 數 |
展品説明 |
表格: |
日期: |
SEC文件 數 |
已提交 特此聲明: |
|||||
|
4.2 |
根據《1934年證券交易法》第12條註冊的證券説明,經修訂 |
10-K |
3/12/20 |
001-33092 |
||||||
|
10.1 |
董事薪酬政策 |
10-Q |
8/5/21 |
001-33092 |
||||||
|
10.2† |
註冊人與喬治·W Lemaitre |
S-1/A |
5/26/06 |
333-133532 |
||||||
|
10.3† |
2008年12月23日,註冊人和George W. Lemaitre |
10-K |
3/31/09 |
001-33092 |
||||||
|
10.4† |
2006年6月20日,註冊人與David Roberts簽訂的僱傭協議 |
S-1/A |
6/22/06 |
333-133532 |
||||||
|
10.5† |
2008年12月19日,註冊人和David Roberts簽署的僱傭協議第一次修正案 |
10-K |
3/31/09 |
001-33092 |
||||||
|
10.6† |
4月僱傭協議 2006年20日,由註冊人和Joseph P. Pellegrino |
S-1/A |
6/22/06 |
333-133532 |
||||||
|
10.7† |
《僱傭協議》第一修正案,日期為12月 2008年19日,由註冊人和Joseph P. Pellegrino |
10-K |
3/31/09 |
001-33092 |
||||||
|
10.8† |
註冊人與其董事及行政人員之間的賠償協議格式 |
S-1/A |
5/26/06 |
333-133532 |
||||||
|
10.9 |
西北公園租約日期為3月 2003年31日,由註冊人和Roger P. Nordblom和Peter C. Nordblom作為Northwest Associates的受託人,經修訂 |
S-1 |
4/25/06 |
333-133532 |
||||||
|
10.10 |
第二次修訂租約日期為5月 2007年21日,羅傑 P. Nordblom和Peter C. Nordblom,作為Northwest Associates的受託人和註冊人 |
8-K |
6/15/07 |
001-33092 |
||||||
|
10.11 |
2008年2月26日的第三次租賃修正案,由羅傑和 P. Nordblom和Peter C. Nordblom,作為Northwest Associates的受託人和註冊人 |
8-K |
4/10/08 |
001-33092 |
||||||
|
10.12 |
2008年10月31日的第四次租賃修正案,由羅傑和 P. Nordblom和Peter C. Nordblom,作為Northwest Associates的受託人和註冊人 |
10-K |
3/31/09 |
001-33092 |
||||||
|
10.13 |
2010年3月23日的第五次租賃修正案,由羅傑和 P. Nordblom和Peter C. Nordblom,作為Northwest Associates的受託人和註冊人 |
10-K |
3/29/10 |
001-33092 |
||||||
|
10.14 |
2013年12月20日,由NWP Building 5 LLC作為Northwest Associates受託人的利益繼承人和註冊人之間的第六次租賃修訂案 |
8-K |
12/23/13 |
001-33092 |
||||||
|
10.15 |
NWP BUILDING 5 LLC和註冊人之間日期為2019年10月29日的租賃第七次修訂 |
8-K |
11/1/19 |
001-33092 |
||||||
|
10.16 |
2023年10月18日NWP Building 5 LLC和註冊人之間的租賃第八次修訂 |
10-Q |
11/7/23 |
001-33092 |
||||||
|
通過引用併入 |
||||||||||
|
展品 數 |
展品説明 |
表格: |
日期: |
SEC文件 數 |
已提交 特此聲明: |
|||||
|
10.17 |
西北公園租約日期為2010年3月23日,由羅傑 P. Nordblom和Peter C. Nordblom,作為Northwest Associates的受託人和註冊人 |
10-K |
3/29/10 |
001-33092 |
||||||
|
10.18 |
2010年9月14日,由羅傑簽署的西北公園租約第一修正案 P. Nordblom和Peter C. Nordblom,作為Northwest Associates的受託人和註冊人 |
10-K |
3/27/12 |
001-33092 |
||||||
|
10.19 |
2011年10月31日,由NWP Building 4 LLC(作為Northwest Associates受託人的利益繼承人)和註冊人簽署的西北公園租約第二次修正案 |
10-K |
3/27/12 |
001-33092 |
||||||
|
10.20 |
西北公園租約第三次修訂日期為8月 2012年31日,由NWP Building 4 LLC,作為西北協會受託人的利益繼承人,和註冊人之間 |
10-K |
3/27/13 |
001-33092 |
||||||
|
10.21 |
第四次修訂租約日期為12月 2013年20日,由NWP Building 4 LLC,作為西北協會受託人的利益繼承人,和註冊人之間的NWP Building 4 LLC, |
8-K |
12/23/13 |
001-33092 |
||||||
|
10.22 |
NWP BUILDING 4 LLC和註冊人之間日期為2019年10月29日的租賃第五次修訂 |
8-K |
11/1/19 |
001-33092 |
||||||
|
10.23 |
NWP Building 4 LLC和註冊人之間日期為2023年10月18日的租賃第六次修訂 |
10-Q |
11/7/23 |
001-33092 |
||||||
|
10.24 |
2013年12月20日,由N.W. Building 3 Trust和註冊人簽訂的租約 |
8-K |
12/23/13 |
001-33092 |
||||||
|
10.25 |
2019年10月29日NWP BUILDING 3 LLC與註冊人之間的租賃第一次修訂 |
8-K |
11/1/19 |
001-33092 |
||||||
|
10.26 |
2023年10月18日NWP Building 3 LLC和註冊人之間的租賃第二次修訂 |
10-Q |
11/7/23 |
001-33092 |
||||||
|
10.27 |
2019年11月26日,NWP Retail 18 LLC和註冊人之間的租約。 |
8-K |
12/3/19 |
001-33092 |
||||||
|
10.28 |
2023年10月18日NWP Retail 18 LLC和註冊人之間的租賃第一次修訂 |
10-Q |
11/7/23 |
001-33092 |
||||||
|
10.29† |
修訂和重述的管理獎勵計劃 |
8-K |
2/25/14 |
001-33092 |
||||||
|
10.30† |
2006年第三次修訂及重述股票期權及激勵計劃 |
8-K |
6/8/15 |
001-33092 |
||||||
|
10.31† |
LeMaitre Vascular,Inc.下限制性股票單位獎勵協議的格式。2006年股票期權及獎勵計劃 |
8-K |
3/9/18 |
001-33092 |
||||||
|
10.32† |
LeMaitre Vascular,Inc.下的激勵股票期權協議的形式。2006年股票期權及獎勵計劃 |
10-K |
3/9/18 |
001-33092 |
||||||
|
10.33† |
LeMaitre Vascular,Inc.下的非合格股票期權協議(僱員)的格式。2006年股票期權及獎勵計劃 |
10-K |
3/9/18 |
001-33092 |
||||||
|
10.34 |
LeMaitre Vascular,Inc.下的非合格股票期權協議(非僱員董事)格式。2006年股票期權及獎勵計劃 |
10-K |
3/9/18 |
001-33092 |
||||||
|
10.35^ |
註冊人與Admedus Ltd及其子公司於2019年10月11日簽署的許可協議 |
10-K |
3/12/20 |
001-33092 |
||||||
|
通過引用併入 |
||||||||||
|
展品 數 |
展品説明 |
表格: |
日期: |
SEC文件 數 |
已提交 特此聲明: |
|||||
|
10.36† |
第八次修訂和重述的股權獎勵授予政策 |
8-K |
7/9/21 |
001-33092 |
||||||
|
10.37† |
受限制股票單位獎勵協議的格式— LeMaitre Vascular,Inc. 2006年股票期權及獎勵計劃 |
10-K |
2/28/22 |
001-33092 |
||||||
|
21.1 |
附屬公司名單 |
X | ||||||||
|
|
||||||||||
|
23.1 |
均富律師事務所同意 |
X | ||||||||
|
|
||||||||||
|
24.1 |
授權書(包括在本年報10-K表格的簽署頁上) |
X | ||||||||
|
|
||||||||||
|
31.1 |
首席執行官的認證,根據《規則》的要求 13a—14(a)或規則 15D-14(A) |
X | ||||||||
|
|
||||||||||
|
31.2 |
財務主任按照《細則》的要求認證 13a—14(a)或規則 15D-14(A) |
X | ||||||||
|
|
||||||||||
|
32.1* |
首席執行官的認證,根據《規則》的要求 第13A-14(B)條或規則 15D-14(B)和節 第1350章 36%的頭銜 《美國法典》第18條(18 南卡羅來納州§1350) |
X | ||||||||
|
|
||||||||||
|
32.2* |
財務主任按照《細則》的要求認證 第13A-14(B)條或規則 15D-14(B)和節 第1350章 36%的頭銜 《美國法典》第18條(18 南卡羅來納州§1350) |
X | ||||||||
|
97.1 |
Lemaitre血管公司補償恢復計劃 |
X |
||||||||
|
101.INS |
內聯XBRL實例文檔。 |
X | ||||||||
|
|
||||||||||
|
101.SCH |
內聯XBRL分類擴展架構文檔。 |
X | ||||||||
|
|
||||||||||
|
101.CAL |
內聯XBRL分類擴展計算鏈接庫文檔。 |
X | ||||||||
|
|
||||||||||
|
101.DEF |
內聯XBRL分類擴展定義Linkbase文檔。 |
X | ||||||||
|
|
||||||||||
|
101.LAB |
內聯XBRL分類擴展標籤Linkbase文檔。 |
X | ||||||||
|
|
||||||||||
|
101.PRE |
內聯XRBL分類擴展演示鏈接庫文檔。 |
X | ||||||||
|
|
||||||||||
|
104 |
封面交互數據文件(格式為內聯XBRL,包含在附件101中)。 |
|||||||||
|
† |
表示管理合同或任何補償計劃、合同或安排。 |
|
* |
本年度報告10—K表格隨附的附件32.1和32.2證明不視為已提交給美國證券交易委員會,也不以引用的方式納入LeMaitre Vascular,Inc.的任何文件中。根據經修訂的1933年證券法,或經修訂的1934年證券交易法,無論是在本表格10—K日期之前還是之後作出,無論該等文件中包含的任何一般註冊語言。 |
|
^ |
展品的部分(以"[***]")被省略,因為它們不是材料,並且是LeMaitre Vascular,Inc.作為私人和機密。 |
|
第16項。 |
表格10—K摘要 |
不適用。
簽名
根據1934年《證券交易法》第13條或第15條(d)的要求,註冊人已於2024年2月29日正式促使以下簽名人代表其簽署本報告,並經正式授權。
|
LEMAITRE VASCULAR,INC. |
||
|
發信人: |
/S/首席執行官喬治·W·勒梅特 |
|
|
喬治·W·勒梅特, 首席執行官兼董事長 董事會 |
||
授權委託書
我知道,以下簽名的每個人構成並任命George W.Lemaitre和Joseph P.Pellegrino,Jr.,以及他們中的每一個人,他真正合法的事實律師和代理人,有充分的替代和再代理的權力,以他的名義,地點和代理,以任何和所有的身份,簽署對本報告的任何和所有修正案(包括生效後的修正案),並將其連同所有證物和與此相關的其他文件,提交給證券交易委員會,授予上述事實律師和代理人,以及他們每個人,完全有權作出和執行與此相關的每一項必要和必要的作為和事情,盡其可能或可以親自作出的所有意圖和目的,在此批准並確認所有上述事實律師和代理人,或他們中的任何一人,或他們或他們的替代者或替代者,可以合法地作出或導致作出憑藉本條例而作出的一切事情。
根據1934年《證券交易法》的要求,本報告已由以下人員以登記人的身份在指定日期簽署。
|
簽名 |
標題 |
日期 |
||
|
/S/首席執行官喬治·W·勒梅特雷擔任首席執行官。 |
首席執行官和 |
2024年2月29日 |
||
|
喬治·W·萊梅特 |
董事會主席 (首席行政主任) |
|||
|
/S/首席執行官約瑟夫·P·佩萊格里諾,小約瑟夫·P·佩萊格里諾,他的父親。 |
首席財務官(本金 |
2024年2月29日 |
||
|
約瑟夫·P·佩萊格里諾,Jr. |
財務與會計 (海關人員)阿里巴巴和董事 |
|||
|
/S/美國總統勞倫斯·J·賈辛斯基(Lawrence J.Jasinski)將他帶到美國。 |
董事 |
2024年2月29日 |
||
|
勞倫斯·J·賈辛斯基 |
||||
|
/S/首席執行官約翰·J·奧康納擔任首席執行官。 |
董事 |
2024年2月29日 |
||
|
約翰·J·奧康納 |
||||
|
/S/首席執行官David·B·羅伯茨擔任首席執行官。 |
總裁與董事 |
2024年2月29日 |
||
|
David·B·羅伯茨 |
||||
|
/S/首席執行官約翰·A·魯什將他帶到美國。 |
董事 |
2024年2月29日 |
||
|
John a. Roush |
||||
|
/s/ 布里奇特A.羅斯 |
董事 |
2024年2月29日 |
||
|
布里奇特·A.羅斯 |
|
/s/ 瑪莎M.沙丹 |
董事 |
2024年2月29日 |
||
|
瑪莎M.沙丹 |
財務報表索引
|
第頁: |
|
|
Lemaitre血管公司 |
|
|
合併財務報表 |
|
|
獨立註冊會計師事務所報告(PCAOB ID號 |
58 |
|
截至12月的合併資產負債表 31、2023年和2022年 |
59 |
|
截至十二月止年度的綜合經營報表 31、2023、2022和2021 |
60 |
|
截至十二月止年度的綜合全面收益表 31、2023、2022和2021 |
61 |
|
股東合併報表’ 截至12月止年度股權 31、2023、2022和2021 |
62 |
|
截至十二月止年度的合併現金流量表 31、2023、2022和2021 |
63 |
|
合併財務報表附註 |
64 |
獨立註冊會計師事務所報告
董事會和股東
Lemaitre血管公司
對財務報表的幾點看法
我們已審核隨附LeMaitre Vascular,Inc.的合併資產負債表。本公司於二零二三年及二零二二年十二月三十一日止三年各年之相關綜合經營報表、全面收益表、股東權益變動表及現金流量表及相關附註(統稱“財務報表”)。我們認為,財務報表在所有重大方面公允列報了貴公司於2023年及2022年12月31日的財務狀況,以及截至2023年12月31日止三個年度各年的經營成果和現金流量,符合美利堅合眾國公認的會計原則。
我們還根據美國上市公司會計監督委員會(PCAOB)的標準,根據2013年建立的標準,審計了公司截至2023年12月31日的財務報告內部控制內部控制—集成框架由特雷德韋委員會贊助組織委員會(“COSO”)發佈的聲明,我們於2024年2月29日的報告表達了無保留意見。
意見基礎
這些財務報表由公司管理層負責。我們的責任是根據我們的審計對公司的財務報表發表意見。我們是一家在PCAOB註冊的公共會計師事務所,根據美國聯邦證券法以及美國證券交易委員會和PCAOB的適用規則和法規,我們必須與公司保持獨立。
我們是按照PCAOB的標準進行審計的。這些標準要求我們計劃和執行審計,以獲得關於財務報表是否沒有重大錯報的合理保證,無論是由於錯誤還是舞弊。我們的審計包括執行評估財務報表重大錯報風險的程序,無論是由於錯誤還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查與財務報表中的數額和披露有關的證據。我們的審計還包括評價管理層使用的會計原則和作出的重大估計,以及評價財務報表的整體列報。我們相信,我們的審計為我們的觀點提供了合理的基礎。
關鍵審計事項
關鍵審計事項是指當期對財務報表進行審計而產生的、已傳達或要求傳達給審計委員會的事項:(1)涉及對財務報表具有重大意義的賬目或披露;(2)涉及我們特別具有挑戰性的、主觀的或複雜的判斷。我們確定不存在關鍵的審計事項。
/s/
自2015年以來,我們一直擔任本公司的審計師。
LeMaitre Vascular,Inc. 合併資產負債表
|
十二月三十一日, |
十二月三十一日, |
|||||||
|
2023 |
2022 |
|||||||
|
(單位:千,共享數據除外) |
||||||||
| 資產 | ||||||||
|
流動資產: |
||||||||
|
現金和現金等價物 |
$ | $ | ||||||
|
短期有價證券 |
||||||||
|
應收賬款,扣除準備金淨額#美元 |
||||||||
|
庫存和其他遞延費用 |
||||||||
|
預付費用和其他流動資產 |
||||||||
|
流動資產總額 |
||||||||
|
財產和設備,淨額 |
||||||||
|
使用權租賃資產 |
||||||||
|
商譽 |
||||||||
|
其他無形資產,淨額 |
||||||||
|
遞延税項資產 |
||||||||
|
其他資產 |
||||||||
|
總資產 |
$ | $ | ||||||
| 負債和股東權益 | ||||||||
|
流動負債: |
||||||||
|
應付帳款 |
$ | $ | ||||||
|
應計費用 |
||||||||
|
與收購有關的債務 |
||||||||
|
租賃負債--短期 |
||||||||
|
流動負債總額 |
||||||||
|
租賃負債--長期 |
||||||||
|
遞延税項負債 |
||||||||
|
其他長期負債 |
||||||||
|
總負債 |
||||||||
| 承付款和或有事項(附註8) | ||||||||
|
股東權益: |
||||||||
|
優先股,$ |
||||||||
|
普通股,$ |
||||||||
|
額外實收資本 |
||||||||
|
留存收益 |
||||||||
|
累計其他綜合損失 |
( |
) | ( |
) | ||||
|
庫存股,按成本計算; |
( |
) | ( |
) | ||||
|
股東權益總額 |
||||||||
|
總負債和股東權益 |
$ | $ | ||||||
見合併財務報表附註。
LeMaitre Vascular,Inc.
合併業務報表
|
截至十二月三十一日止的年度: |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位為千,每股數據除外) |
||||||||||||
|
淨銷售額 |
$ | $ | $ | |||||||||
|
銷售成本 |
||||||||||||
|
毛利 |
||||||||||||
|
銷售和市場營銷 |
||||||||||||
|
一般和行政 |
||||||||||||
|
研發 |
||||||||||||
|
重組 |
||||||||||||
|
總運營費用 |
||||||||||||
|
營業收入 |
||||||||||||
|
其他收入(支出): |
||||||||||||
|
利息收入 |
||||||||||||
|
利息支出 |
( |
) | ||||||||||
|
其他收入(虧損),淨額 |
( |
) | ( |
) | ( |
) | ||||||
|
所得税前收入 |
||||||||||||
|
所得税撥備 |
||||||||||||
|
淨收入 |
$ | $ | $ | |||||||||
|
普通股每股收益: |
||||||||||||
|
基本信息 |
$ | $ | $ | |||||||||
|
稀釋 |
$ | $ | $ | |||||||||
|
加權平均流通股: |
||||||||||||
|
基本信息 |
||||||||||||
|
稀釋 |
||||||||||||
|
宣佈的每股普通股現金股息 |
$ | $ | $ | |||||||||
見合併財務報表附註。
LeMaitre Vascular,Inc.
綜合全面收益表
|
截至十二月三十一日止的年度: |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
淨收入 |
$ | $ | $ | |||||||||
|
其他全面收益(虧損): |
||||||||||||
|
外幣折算調整,淨額 |
( |
) | ( |
) | ||||||||
|
短期有價證券未實現收益(損失) |
( |
) | ( |
) | ||||||||
|
其他全面收益(虧損)合計 |
( |
) | ( |
) | ||||||||
|
綜合收益 |
$ | $ | $ | |||||||||
見合併財務報表附註。
Lemaitre血管公司
股東權益合併報表
(單位:千,共享數據除外)
|
累計 |
||||||||||||||||||||||||||||||||
|
其他內容 |
其他 |
總計 |
||||||||||||||||||||||||||||||
|
普通股 |
已繳費 |
保留 |
全面 |
庫存股 |
股東的 |
|||||||||||||||||||||||||||
|
股票 |
金額 |
資本 |
收益 |
收入(虧損) |
股票 |
金額 |
權益 |
|||||||||||||||||||||||||
|
2020年12月31日餘額 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
淨收入 |
||||||||||||||||||||||||||||||||
|
其他全面收益(虧損) |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
普通股發行,扣除發行成本 |
||||||||||||||||||||||||||||||||
|
發行普通股以行使股票期權 |
||||||||||||||||||||||||||||||||
|
既得限制性股票單位 |
||||||||||||||||||||||||||||||||
|
基於股票的薪酬費用 |
||||||||||||||||||||||||||||||||
|
回購普通股,用於股權獎勵的淨結算 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
普通股現金股利派發 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
2021年12月31日的餘額 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
淨收入 |
||||||||||||||||||||||||||||||||
|
其他全面收益(虧損) |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
發行普通股以行使股票期權 |
||||||||||||||||||||||||||||||||
|
既得限制性股票單位 |
||||||||||||||||||||||||||||||||
|
基於股票的薪酬費用 |
||||||||||||||||||||||||||||||||
|
回購普通股,用於股權獎勵的淨結算 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
普通股現金股利派發 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
2022年12月31日的餘額 |
$ | $ | $ | $ | ( |
) | $ | ( |
) | $ | ||||||||||||||||||||||
|
淨收入 |
||||||||||||||||||||||||||||||||
|
其他全面收益(虧損) |
||||||||||||||||||||||||||||||||
|
發行普通股以行使股票期權 |
||||||||||||||||||||||||||||||||
|
既得限制性股票單位 |
||||||||||||||||||||||||||||||||
|
基於股票的薪酬費用 |
||||||||||||||||||||||||||||||||
|
回購普通股,用於股權獎勵的淨結算 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
普通股現金股利派發 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
2023年12月31日的餘額 |
$ | $ | $ | $ | ( |
) | $ | ( |
) | $ | ||||||||||||||||||||||
見合併財務報表附註。
Lemaitre血管公司
合併現金流量表
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
| 經營活動 | ||||||||||||
|
淨收入 |
$ | $ | $ | |||||||||
|
將淨收入與經營活動提供的現金淨額進行調整: |
||||||||||||
|
折舊及攤銷 |
||||||||||||
|
基於股票的薪酬 |
||||||||||||
|
存貨減記準備 |
||||||||||||
|
遞延所得税準備(利益) |
( |
) | ||||||||||
|
資產剝離損失 |
||||||||||||
|
信貸損失準備金 |
||||||||||||
|
對或有對價債務的公允價值調整 |
( |
) | ( |
) | ( |
) | ||||||
|
出售建築物所得收益 |
( |
) | ||||||||||
|
出售PP及E的虧損 |
||||||||||||
|
外幣交易對收入的影響 |
( |
) | ( |
) | ||||||||
|
經營性資產和負債變動情況: |
||||||||||||
|
應收賬款 |
( |
) | ( |
) | ( |
) | ||||||
|
庫存和其他遞延費用 |
( |
) | ( |
) | ( |
) | ||||||
|
預付費用和其他資產 |
( |
) | ( |
) | ( |
) | ||||||
|
應付帳款和其他負債 |
( |
) | ||||||||||
|
經營活動提供的淨現金 |
||||||||||||
| 投資活動 | ||||||||||||
|
購買短期有價證券 |
( |
) | ( |
) | ( |
) | ||||||
|
購置財產和設備 |
( |
) | ( |
) | ( |
) | ||||||
|
與收購相關的付款 |
( |
) | ||||||||||
|
出售建築物所得款項 |
||||||||||||
|
出售有價證券所得收益 |
||||||||||||
|
用於投資活動的現金淨額 |
( |
) | ( |
) | ( |
) | ||||||
|
融資活動 |
||||||||||||
| 普通股現金股利派發 | ( |
) | ( |
) | ( |
) | ||||||
|
發行普通股所得款項 |
||||||||||||
|
購買庫存股票以淨額結算股權獎勵 |
( |
) | ( |
) | ( |
) | ||||||
|
支付遞延收購對價 |
( |
) | ( |
) | ||||||||
|
償還長期債務 |
( |
) | ||||||||||
|
融資活動提供(用於)的現金淨額 |
( |
) | ( |
) | ||||||||
|
匯率變動對現金及現金等價物的影響 |
( |
) | ( |
) | ||||||||
|
現金及現金等價物淨增(減) |
( |
) | ||||||||||
|
年初現金及現金等價物 |
||||||||||||
|
年終現金及現金等價物 |
$ | $ | $ | |||||||||
|
現金流量資料的補充披露(見附註6及9)。 |
||||||||||||
見合併財務報表附註。
Lemaitre血管公司
合併財務報表附註
2023年12月31日
1.重大會計政策及相關事項
業務説明
除文意另有所指外,凡提及Lemaitre、Lemaitre血管公司、我們、我們和我們指的是Lemaitre血管公司和我們的子公司。我們開發、製造和銷售主要用於血管外科領域的醫療設備和植入物。我們還從人體組織的加工和冷凍保存中獲得收入,以便植入患者體內。我們在一個我們的主要產品線包括:吻合夾、生物血管和透析移植物、生物血管和心臟補片、頸動脈分流管、取栓術導管、閉塞導管、不透射線標記膠帶、人造血管移植物和瓣膜切開術。我們的辦事處和生產設施位於馬薩諸塞州伯靈頓、伊利諾伊州福克斯河格羅夫、新澤西州北布倫瑞克、亞利桑那州錢德勒、加拿大沃恩、德國蘇茲巴赫、意大利米蘭、西班牙馬德里、英國赫裏福德、愛爾蘭都柏林、澳大利亞肯辛頓、日本東京、上海、中國、新加坡、韓國首爾和泰國曼谷。
總結和陳述的依據
我們的綜合財務報表包括Lemaitre Vial的賬户和我們全資子公司Lemaitre Vial GMBH,Lemaitre Vial GK,Vascutech收購有限公司,Lemaitre Acquisition LLC,Lemaitre Vial SAS,Lemaitre Vial S.r.l,Lemaitre Vial西班牙S.L.,Lemaitre Vial Swiss GmbH,Lemaitre VasualAS,Lemaitre VculasPty Ltd,Bio Nova International Pty Ltd,Bio Nova Holdings Pty,Lemaitre Vial,Ltd.,Lemaitre Medical Technology(Shanghai),Lemaitre Carial,Lemaitre Pty Pty Ltd,Lemaitre Ltd,Lemaitre Co.,所有重大公司賬户和交易已在合併中取消。
外幣折算
境外子公司的資產負債表按年終匯率換算成美元。經營賬户按每年的平均匯率換算。淨折算收益或虧損直接調整為股東權益內其他全面收益(虧損)的單獨組成部分。外匯交易收益(虧損),基本上全部與我們和我們的海外子公司之間的公司間活動有關,在隨附的綜合經營報表中計入其他收入(費用)。
估計數
按照美國公認會計原則(GAAP)編制財務報表要求管理層作出估計和假設,這些估計和假設會影響我們的合併財務報表和附註中報告的金額。本公司並不知悉有任何特定事件或情況需要更新其會計估計或調整其資產及負債的賬面價值。我們的估計和假設,包括與壞賬、庫存、無形資產、銷售退貨和折扣、基於股份的薪酬和所得税有關的估計和假設,將持續審查並適當更新。實際結果可能與這些估計不同。
收入確認
我們的收入主要來自血管手術中使用的一次性或可植入設備的銷售。我們主要直接向醫院銷售,其次向國際分銷商銷售,如下所述,在我們的合併財務報表中列報的期間,我們與醫院或分銷商達成了有限的寄售庫存安排。我們還從人體組織的加工和冷凍保存中獲得收入,以便植入患者體內。這些收入在提供了服務並將紙巾運送給客户時確認,前提是滿足了下一段討論的所有其他收入確認標準。
我們根據ASU 2014-09的規定記錄收入,與客户簽訂合同的收入(主題606)。專題606的核心原則是,實體應確認向客户轉讓貨物或服務的收入,其數額應反映該實體預期有權以這些貨物或服務換取的對價。該標準解釋説,為了實現核心原則,實體應採取以下行動:
步驟1:確定與客户的合同
第二步:確定合同中的履約義務
第三步:確定交易價格
第四步:將交易價格分配給履約義務
第5步:在實體履行業績義務時或在履行義務時確認收入
當公司通過將承諾的商品或服務轉讓給客户來履行履行義務時(即當客户獲得該商品或服務的控制權時),收入就被確認。如果運輸和搬運活動是在客户控制貨物之後執行的(例如,從我們的碼頭裝運時所有權轉移),我們已經做出了主題606允許的政策選擇,以將這些活動作為履行成本而不是作為履行義務來考慮。
我們通常參考客户採購訂單來確定合同是否存在。沒有附帶採購訂單的訂單將以書面或口頭形式與客户確認。採購訂單或類似的函件一旦被接受,就確定了履約義務以及交易價格,並以其他方式概述了各方的權利和義務。我們根據採購訂單上指定的每個項目的定價在履行義務之間分配每個合同的交易價格,而採購訂單上指定的每個項目的定價又基於我們公佈的價目表中的獨立銷售價格。在我們為產品打折或免費提供某些物品的情況下,我們按比例將折扣分配給所有履約義務,除非可以證明折扣應完全分配給一個或多個但不是所有履約義務。
我們記錄收入,扣除退貨和折扣津貼,支付給集團採購組織的費用,以及任何需要開具發票的銷售和增值税,我們選擇在發貨時(考慮合同發貨條款)或在寄售庫存消耗時,從標準允許的交易價格測量中排除這些收入和增值税。發貨是指產品和所有權的控制權轉移到我們的客户手中,Lemaitre現在有權收到貨款。
以下是按主要地理區域對我們的收入進行的細分,這是管理層在評估財務業績時使用的主要分類之一,以千為單位:
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 | ||||||||||
|
美洲 |
$ | $ | $ | |||||||||
|
歐洲、中東和非洲 |
||||||||||||
|
亞太地區 |
||||||||||||
|
總計 |
$ | $ | $ | |||||||||
我們不承擔任何合同資產或合同負債,因為根據我們已部分履行履約義務的合同,我們一般不會向客户支付未開賬單的金額,或者我們從客户那裏收到的金額沒有履行履約義務。我們在收到訂單後很短的時間內履行了收入合同下的履約義務,客户的付款通常在
退貨客户可根據退貨條件和退貨時間享受全部或部分積分。要被接受,退回的產品必須是未打開(如果無菌)、未摻雜和未損壞的,必須在有效期之前至少還有18個月,或者對於我們在歐洲的醫院客户來説,必須有12個月的剩餘時間,並且通常在發貨後30天內退回。這些退貨政策適用於對醫院和分銷商的銷售。退還給我們的產品數量,無論是換貨還是賒購,都不是實質性的。然而,我們根據歷史退貨經驗為未來的銷售退貨撥備了準備金,這需要判斷。我們更換有缺陷產品的成本並不是實質性的,在更換時已計入。
研發費用
研究和開發成本,主要是工資、實驗室測試和用品,在發生時計入費用,還包括與許可和獲得的知識產權相關的使用費支付。
運費和搬運費
客户支付的運費和手續費計入淨銷售額,相關費用計入銷售成本。
廣告費
廣告成本在產生時計入費用,並作為銷售和營銷費用的組成部分計入隨附的綜合經營報表。廣告費用如下:
|
截至十二月三十一日止的年度: |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
廣告費 |
$ | $ | $ | |||||||||
現金和現金等價物
我們認為所有購買到期日為90天或更短的高流動性工具均為現金等價物。現金和現金等價物主要投資於貨幣市場基金。該等金額按成本列報,與公允價值大致相同。
短期有價證券s
我們的短期有價證券是按公允價值列賬的可供出售證券,未實現收益和虧損記錄在其他全面收益中。它們包括一隻主要投資於短期投資級債券的管理收益共同基金,以美元計價的固定利率和浮動利率債券,以及一隻短期債券基金。
信用風險的集中度
我們面臨集中信用風險的金融工具主要包括現金和現金等價物以及應收賬款。現金等價物是指在購買之日到期日為90天或更短的高流動性投資。根據持有這些資金的金融機構的信譽,與現金和現金等價物有關的信用風險是有限的。我們在幾家銀行都有現金餘額。位於美國的賬户由聯邦存款保險公司(FDIC)承保,最高可達25萬美元。我們的某些賬户餘額超過了FDIC的限額。在美國境外持有的現金餘額總計約為#美元
我們的應收賬款來自美國和國際的客户。應收賬款一般應在發票開出後30至60天內到期,並按扣除信貸損失和銷售退貨準備後的客户應收金額列報,但在某些付款週期通常較長的歐洲市場除外。我們對客户的財務狀況進行持續的信用評估,並根據支付歷史和客户的當前信用狀況調整信用額度,這是通過審查客户當前的信用信息確定的。我們持續監控客户的賬齡報告、催收和付款,並根據歷史經驗和我們發現的任何特定客户催收問題維護估計的信用損失準備金。
我們密切關注未償還應收賬款的潛在催收風險,包括美國和國際經濟環境中可能出現的風險。我們向政府擁有或支持的客户(如醫院、分銷商和代理商)在歐洲的銷售,特別是在意大利、西班牙和法國,可能會因為政府的緊縮措施影響資金和支付實踐而受到嚴重的付款延遲。截至2023年12月31日,我們在意大利、西班牙和法國的應收賬款總額為$
當應收賬款無法收回時,我們將其註銷。從歷史上看,這樣的信貸損失在我們的預期和允許範圍之內。信用損失準備是我們對現有應收賬款中可能發生的信用損失金額的最佳估計。我們每月審查我們的信貸損失準備金,並逐一審查所有逾期餘額是否可收回。信貸損失準備金記入一般費用和行政費用。以下是我們的信貸損失和銷售退貨準備的摘要:
|
餘額為 |
加法 |
扣除額 |
餘額為 |
|||||||||||||
|
起頭 |
(收回) |
從… |
結束 |
|||||||||||||
|
週期的 |
到收入 |
儲量 |
期間 |
|||||||||||||
|
(單位:千) |
||||||||||||||||
|
信貸虧損撥備及銷售退貨: |
||||||||||||||||
|
截至2023年12月31日的年度 |
$ | $ | $ | $ | ||||||||||||
|
截至2022年12月31日的年度 |
||||||||||||||||
|
截至2021年12月31日的年度 |
||||||||||||||||
金融工具的公允價值
我們的金融工具包括現金及現金等價物、短期有價證券、應收賬款及應付貿易賬款。該等工具之公平值與其賬面值相若,乃基於其短期性質或浮動利率。短期有價證券的未實現收益及虧損計入其他全面收益。截至2023年和2022年12月31日,我們的短期有價證券反映了未實現虧損美元,
庫存和其他遞延成本
庫存和其他遞延成本包括成品、在製品、原材料和與RestoreFlow同種異體移植業務的人體組織冷凍保存服務相關的遞延成本。我們以成本或市場價值較低的價格對庫存和其他遞延成本進行估值。成本包括材料、人工和製造費用,並使用先進先出(FIFO)方法確定。我們每季度審查現有庫存量,並主要根據產品到期日期和我們基於銷售歷史和預期未來需求的估計銷售預測來分析過剩和過時庫存的撥備。我們對未來產品需求的估計可能不準確,我們可能會低估或誇大過剩和過時庫存所需的撥備。因此,需求的任何重大意外變化都可能對我們的庫存價值和運營結果產生重大影響。
雲計算安排
本公司將與本公司雲計算安排相關的合格設置和實施成本資本化。遞延成本於相關雲計算安排的年期內以直線法攤銷,該直線法代表本公司預期從接入雲計算安排中受益的模式。
已資本化的雲計算實施成本於綜合資產負債表於預付開支及其他流動資產及其他資產中呈列。截至2023年12月31日,該公司的淨資本化雲計算實施成本為美元,
財產和設備
財產和設備按成本入賬。折舊乃按相關資產之估計可使用年期以直線法計提,詳情如下:
|
描述 |
使用壽命(以年為單位) |
|||
|
計算機硬件 |
|
– |
|
|
|
機器和設備 |
|
– |
|
|
|
建築和租賃的改進 |
其使用年限或租賃期中較短者 |
|||
保養和維修支出在發生時記作業務支出,而添置和改良則記作資本。當資產報廢或處置時,資產的原始成本和相關的累計折舊從賬目中沖銷,任何收益或損失反映在業務報表中。
企業合併的估值
吾等根據收購日期之公平值,將收購業務所轉讓代價之價值分配至所收購有形資產及可識別無形資產及所承擔負債。我們使用多種方法評估資產(包括無形資產)的公允價值,通常由獨立評估師從市場參與者的角度計量公允價值進行。
收購乃採用收購法入賬,而被收購公司之業績已自其各自收購日期起計入隨附之綜合財務報表。收購交易成本已計入一般及行政開支,並於產生時支銷。收購之購買價分配乃根據所收購資產淨值之估計公平值作出,並可於最終確定購買價分配時作出調整。
我們的收購歷來以高於所收購資產公平值的價格進行,由於預期合併業務產生協同效應,產生商譽。該等協同效應包括利用我們現有的商業基礎設施擴大所收購業務產品的銷售、利用所收購業務的商業基礎設施以具有成本效益的方式擴大產品的銷售,以及消除多餘的設施、職能和員工。
或有對價
收購或有代價於收購日期根據該日的公平值確認,然後通過調整淨收入定期重新計量。
長期資產減值準備
我們每季度審閲須攤銷的長期資產(主要是物業及設備以及無形資產),以確定是否存在任何不利條件或情況發生變化,從而顯示減值或剩餘可使用年期的變化。可能顯示減值的條件包括但不限於法律因素或商業環境的重大不利變化,可能影響資產價值、產品召回或監管機構的不利行動或評估。倘存在減值跡象,我們會測試無形資產的可收回性。倘有事件及情況顯示經營中使用的長期資產可能出現減值,且估計該等資產產生的未貼現現金流量低於該等資產的賬面值,我們會記錄該等資產的減值虧損。減值乃按受影響資產之公平市價以貼現現金流量計量。
商譽
商譽指就業務收購所付代價超出所收購資產及所承擔負債之公平值。商譽每年評估減值,或倘出現減值跡象或情況變動顯示可能存在減值,則更頻密地評估商譽減值。我們每年根據單一報告單位評估商譽賬面值的12月31日結餘。我們評估定性因素,以確定報告單位的公平值是否“極有可能”低於其賬面值,作為釐定是否需要進行量化商譽減值測試的基準。“更有可能”閾值定義為具有超過50%的可能性。量化商譽減值測試將報告單位之公平值與其賬面值(包括商譽)進行比較。倘報告單位之公平值超過其賬面值,則報告單位之商譽被視為並無減值。倘報告單位之賬面值超過其公平值,則按相等於該超出部分之金額確認減值虧損,惟以分配至該報告單位之商譽總額為限。我們已經確定 截至2023年、2022年或2021年12月31日止年度的商譽減值支出。
其他無形資產
其他無形資產主要包括與業務收購和資產收購有關而收購的專利、商標、技術許可證和客户關係,並按其估計可使用年期攤銷,範圍為:
基於股票的薪酬
我們將使用柏力克—舒爾斯期權定價模式釐定的授予僱員的股票期權的估計公平值確認為開支。以股份為基礎的薪酬支出根據承授人的主要職能在綜合經營報表中記錄。我們已選擇於獎勵歸屬期內以直線法確認所有以股份為基礎的獎勵的補償成本。於我們授出購股權期間,公平值假設乃基於波動率、利息、股息率及購股權尚未行使的預期年期。預期波動率的計算基於公司股票的歷史波動率。授出合約期內各期間之利率乃根據授出時有效之美國財政部無風險利率計算。行使模式之歷史數據乃估計購股權預期年期之基準。預期年度股息率乃根據最新季度股息率將年度股息除以授出日期的收市股價計算。
根據股東批准的2006年計劃,我們還發行限制性股票單位(RSU)和基於業績的限制性股票單位(PSU),作為額外形式的股權補償,我們的員工,管理人員和董事,根據我們的股東批准的2006年計劃。受限制股份單位賦予承授人免費發行股份的權利,並一般在董事會於授出時釐定的期間內歸屬。於二零二二年十二月授出的優先認股單位乃根據二零二三年的經營收入與董事會批准的預算經營收入的實現而歸屬。獎勵之公平市值乃根據授出受限制股份單位及PSU數目及本公司普通股於授出日期之市值釐定,並於歸屬期內攤銷至開支。未歸屬的RSU和PSU將於僱傭或服務終止之日沒收和取消。受限制股份單位及PSU於歸屬時以普通股股份結算。我們一般於僱員歸屬受限制股份單位及PSU時購回普通股,以支付因獎勵歸屬而產生的任何最低預扣税責任。於二零二二年十二月根據二零二三年的經營收入與董事會批准的預算經營收入的實現而授出的購股權單位已實現,並因此授予收件人。
承付款和或有事項
在正常業務過程中,我們會因專利侵權、商業收購、僱傭、商業事務和產品召回等事項而受到訴訟、訴訟和其他索賠和評估。我們評估對這些事項作出任何不利判斷或結果的可能性,以及潛在的可能損失範圍。對每個問題進行仔細分析後,才能確定這些或有事項所需的準備金數額。所需準備金今後可能會因新的事態發展或做法的變化而變化,例如在處理每一事項時改變解決戰略。當我們斷定可能發生損失並且我們可以合理地估計損失時,我們記錄與訴訟和索賠有關的預期損失的費用。與或有損失相關的法律費用在發生時計入費用。在截至2023年、2022年和2021年12月31日的年度內,我們沒有受到任何重大訴訟或索賠和評估的影響。
醫療器械在美國以外的銷售受到國際監管要求的約束,這些要求因國家而異。這些要求和批准所需的時間可能與我們與美國FDA的經驗不同。在歐盟,我們要求我們的產品獲得CE標誌,這表明我們符合高風險設備製造商的基本要求。如果不能獲得、保留或保持這些CE標誌,將影響我們在某些歐洲國家銷售產品的能力,並可能導致我們的業務受到影響。
所得税
我們是按照資產負債法核算所得税的。在資產負債法下,遞延税項是根據資產及負債的財務報告及税基之間的差額,採用預期差額將被撥回的年度的現行税率釐定。所得税準備金包括因財務報表與資產和負債的計税基礎之間的暫時性差異而產生的税收影響所產生的當前應繳税款和遞延税款。在遞延税項資產的全部或部分很可能無法變現的情況下,我們維持估值免税額。估值免税額的變動計入我們於變動期間的税項撥備。在決定是否需要估值撥備時,我們會評估一些因素,例如過往盈利歷史、預期未來盈利、結轉及結轉期,以及可能提高變現遞延税項資產的可能性的税務策略。
我們在財務報表中確認、計量、呈列和披露我們已採取或預期在報税表中採取的不確定税務狀況。我們在財務報表中確認符合“較有可能”門檻的税務狀況的影響,基於該狀況的技術優勢。在財務報表中確認的税務利益乃根據最終結算時實現的可能性超過百分之五十的最大利益計量。
我們的政策是將與未確認税務優惠有關的利息和罰款分類為所得税開支。
綜合收益
全面收益定義為企業於一段期間內因非擁有人來源之交易及其他事件及情況而產生之權益變動。除呈報淨收益外,全面收益包括外幣換算調整及有價證券的未實現收益及虧損,並於隨附的綜合全面收益表中披露。有 截至2023年、2022年或2021年12月31日止年度的全面收益重新分類。
累計其他全面虧損包括外幣換算調整虧損
重組
我們記錄與業務合併或搬遷、退出業務線、削減效力或終止分銷商有關的重組費用。這些重組費用反映了我們對終止或退出計劃的承諾,是基於對與工廠關閉、法律事項、合同終止、遣散費或與重組直接相關的其他成本的估計。如果實際發生的成本超過估計成本,則將產生額外的收入扣除。倘實際成本低於估計成本,則確認收益貸記。
每股收益
我們計算每股基本收益的方法是將普通股股東可獲得的淨收益除以年內發行在外的加權平均股數。除結果對每股淨收入有反攤薄作用外,每股攤薄盈利乃採用庫存股法計算,反映受限制普通股的潛在歸屬及購股權的潛在行使,以及其相關所得税影響。
每股基本淨收益和稀釋後淨收益的計算如下:
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位為千,每股數據除外) |
||||||||||||
|
基本信息: |
||||||||||||
|
普通股股東可獲得的淨收入 |
$ | $ | $ | |||||||||
|
加權平均流通股 |
||||||||||||
|
基本每股收益 |
$ | $ | $ | |||||||||
|
稀釋: |
||||||||||||
|
普通股股東可獲得的淨收入 |
$ | $ | $ | |||||||||
|
加權平均流通股 |
||||||||||||
|
普通股等價物,如果稀釋的話 |
||||||||||||
|
用於計算稀釋後每股普通股收益的股票 |
||||||||||||
|
稀釋後每股收益 |
$ | $ | $ | |||||||||
|
不包括在計算稀釋後每股收益中的股票,因為這些股票將是反稀釋的 |
||||||||||||
近期會計公告
新的會計聲明不時由財務會計準則委員會(FASB)或其他準則制定機構發佈,並自指定生效日期起被公司普遍採用。
尚未生效
2023年12月,FASB發佈了ASU 2023-09,所得税主題740-改進所得税披露。這項修正案預計將提高所得税披露的透明度和決策有用性,要求公共企業實體每年披露税率調節中的特定類別、符合量化門檻的調節項目的額外信息以及有關已支付所得税的某些信息。修訂後的指導意見適用於2024年12月15日之後發佈的財務報表。我們目前正在評估新標準的影響。
2023年11月,FASB發佈了ASU 2023-07,分部報告主題280--改進可報告分部披露。這項修訂要求在年度和中期基礎上披露增量分部信息。本ASU適用於2023年12月15日之後的會計年度,以及2024年12月15日之後的會計年度內的中期,並要求追溯適用於財務報表中列報的所有先前期間。我們目前正在評估新標準的影響。
2.資產剝離
2022年4月26日,我們承諾計劃關閉支持我們Lemaitre Carial SAS(Carial)業務的法國聖埃蒂安工廠,以簡化製造運營並降低費用。卡迪爾的業務包括製造聚酯血管移植物、瓣膜切除器、外科膠水和選定的OEM設備。我們於2018年收購了Carial業務。
2022年6月30日,我們停止了法國聖艾蒂安工廠的運營。關閉導致了#美元的重組費用。
2022年10月10日,我們以美元的價格出售了法國聖艾蒂安大樓、建築改造和土地
在截至2023年12月31日的一年中,由於法國聖埃蒂安工廠的關閉,我們記錄了50萬美元的額外重組費用。額外費用主要包括解僱、和解、法律和其他第三方費用。
3.庫存和其他遞延成本
庫存和其他遞延成本包括以下內容:
|
2023年12月31日 |
2022年12月31日 |
|||||||
|
(單位:千) |
||||||||
|
原料 |
$ | $ | ||||||
|
在製品 |
||||||||
|
成品 |
||||||||
|
其他遞延成本 |
||||||||
|
總庫存和其他遞延成本 |
$ | $ | ||||||
我們在客户地點的寄售庫存為$
與我們的RestoreFlow同種異體移植業務相關,其他遞延成本包括保存可供運輸的人體組織、目前處於活躍處理中的組織以及處於隔離狀態等待釋放到可植入狀態的組織所產生的成本。根據聯邦法律,人體組織不能買賣。因此,我們保存的組織不是作為庫存持有的,而是我們購買和處理血管組織所產生的成本被累積和推遲。這些成本包括與冷凍保存過程相關的固定和可變間接管理成本,主要包括直接人工成本、組織回收費用、入境運費、間接材料和設施成本。與提供該等服務有關的一般及行政開支及銷售開支於產生時計提。
4.財產和設備
財產和設備包括以下內容:
|
截至12月31日, |
||||||||
|
2023 |
2022 |
|||||||
|
(單位:千) |
||||||||
|
計算機硬件 |
$ | $ | ||||||
|
機器和設備 |
||||||||
|
建築和租賃的改進 |
||||||||
|
總財產和設備 |
||||||||
|
減去累計折舊 |
( |
) | ( |
) | ||||
|
財產和設備,淨額 |
$ | $ | ||||||
在截至2023年、2022年和2021年12月31日的年度內,我們註銷了全部折舊資產,總價值為#美元。
折舊開支如下:
|
截至十二月三十一日止的年度: |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
折舊費用 |
$ | $ | $ | |||||||||
5.商譽和其他無形資產
商譽包括以下內容:
|
截至12月31日, |
||||||||
|
2023 |
2022 |
|||||||
|
年初餘額 |
$ | $ | ||||||
|
用於收購的附加內容 |
||||||||
|
採購會計調整 |
||||||||
|
貨幣兑換的影響 |
||||||||
|
年終餘額 |
$ | $ | ||||||
其他無形資產包括:
|
2023年12月31日 |
2022年12月31日 |
|||||||||||||||||||||||
|
毛收入 |
網絡 |
毛收入 |
網絡 |
|||||||||||||||||||||
|
攜帶 |
累計 |
攜帶 |
攜帶 |
累計 |
攜帶 |
|||||||||||||||||||
|
價值 |
攤銷 |
價值 |
價值 |
攤銷 |
價值 |
|||||||||||||||||||
|
(單位:千) |
||||||||||||||||||||||||
|
產品技術與知識產權 |
$ | $ | $ | $ | $ | $ | ||||||||||||||||||
|
商標、商號和許可證 |
||||||||||||||||||||||||
|
客户關係 |
||||||||||||||||||||||||
|
其他無形資產 |
||||||||||||||||||||||||
|
可確認無形資產總額 |
$ | $ | $ | $ | $ | $ | ||||||||||||||||||
這些資產在使用年限內攤銷,範圍從
|
截至十二月三十一日止的年度: |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
攤銷費用 |
$ | $ | $ | |||||||||
根據截至2023年12月31日的無形資產,未來五個財政年度每年的估計攤銷費用如下:
|
截至十二月三十一日止的年度: |
||||||||||||||||||||
|
2024 |
2025 |
2026 |
2027 |
2028 |
||||||||||||||||
|
(單位:千) |
||||||||||||||||||||
|
攤銷費用 |
$ | $ | $ | $ | $ | |||||||||||||||
6.循環信貸額度和長期債務
關於收購Artegrant生物移植業務,我們產生了金額為美元的債務,
根據協議條款,貸款按年利率計息(按吾等選擇):(i)基本利率加適用息差,
我們就此信貸安排產生的債務發行成本約為美元
於二零二一年十一月,我們終止了原協議所允許的信貸協議,包括循環信貸額度。
7.應計費用及其他長期負債
應計費用包括以下內容:
|
2023年12月31日 |
2022年12月31日 |
|||||||
|
(單位:千) |
||||||||
|
薪酬及相關税項 |
$ | $ | ||||||
| 應計購貨 | ||||||||
| 應計費用 | ||||||||
|
所得税和其他税 |
||||||||
|
專業費用 |
||||||||
|
其他 |
||||||||
|
總計 |
$ | $ | ||||||
其他長期負債包括:
|
2023年12月31日 |
2022年12月31日 |
|||||||
|
(單位:千) |
||||||||
|
與收購有關的負債 |
$ | $ | ||||||
|
所得税 |
||||||||
|
其他 |
||||||||
|
總計 |
$ | $ | ||||||
8.承付款和或有事項
租契
本公司於合約開始時釐定安排是否為租賃。本公司擁有建築物的經營租賃,主要用於辦公空間、製造和分銷以及汽車和印刷設備。截至2023年12月31日,本公司有下列於資產負債表資本化的樓宇及設施租賃:
|
地點(租賃) |
目的 |
約平方英尺 |
期滿 |
||||
|
美洲 |
|||||||
|
Burlington,MA(4) |
公司總部和製造業 |
|
2034年12月 |
||||
|
新澤西州北布倫瑞克(1) |
Artegraft生物業務 |
|
2029年10月 |
||||
|
Burlington,MA(1) |
美國分銷 |
|
2030年12月 |
||||
|
伊利諾伊州福克斯河格羅夫(3) |
RestoreFlow同種異體移植業務 |
|
2025年11月 |
||||
|
沃恩,加拿大 |
加拿大銷售辦事處和經銷部門 |
|
2026年2月 |
||||
|
錢德勒,亞利桑那州 |
美國銷售辦事處 |
|
2025年8月 |
||||
|
歐洲、中東和非洲 |
|||||||
|
蘇茲巴赫,德國 |
歐洲總部和分銷中心 |
|
2031年6月 |
||||
|
意大利米蘭 |
意大利銷售辦事處和經銷部門 |
|
2027年7月 |
||||
|
赫裏福德,英國 |
英國銷售辦事處和經銷 |
|
2029年10月 |
||||
|
西班牙馬德里 |
西班牙銷售辦事處 |
|
2029年6月 |
||||
|
亞太地區 |
|||||||
|
新加坡 |
亞太區總部和分銷 |
|
2024年6月 |
||||
|
日本東京 |
日本銷售辦事處和分銷 |
|
2025年7月 |
||||
|
泰國曼谷 |
泰國銷售辦事處和分銷 |
|
2026年8月 |
||||
|
韓國首爾 |
韓國銷售辦事處和分銷 |
|
2027年4月 |
||||
|
上海,中國 |
中國銷售辦事處和分銷 |
|
2024年8月 |
||||
|
澳大利亞巴拉拉特 |
供給設施 |
|
2030年12月 |
||||
經營租賃使用權(ROU)資產及經營租賃負債乃根據租賃期開始日期的未來租賃最低付款額現值確認。許多租賃協議載有續期或終止條款,倘合理確定該等選擇權將獲行使,則該等條款將計入租賃期的釐定。本公司於租期內以直線法確認該等租賃的租賃開支。
我們的不可撤銷租賃付款概不包括非租賃部分,如維護合同;我們一般向業主償還與租賃空間相關的直接運營成本。我們並無分租,亦無任何與我們的任何租約有關的剩餘價值擔保或任何租約所施加的限制性契諾。於二零二三年十二月三十一日,概無根據資本租賃持有資產。我們選擇了一套可行的權宜方案,使我們可以從資產負債表中剔除初步租期為12個月或以下的租賃,該等租賃在租賃年期內以直線法支銷。
租賃協議隱含的利率通常不易釐定,因此,本公司在釐定未來付款現值時使用基於開始日期可得資料的增量借款利率。增量借款利率定義為本公司將支付以抵押基準借款的利息。
有關我們租賃的其他資料如下:
|
截至的年度 |
截至的年度 |
|||||||
|
十二月三十一日, |
十二月三十一日, |
|||||||
|
2023 |
2022 |
|||||||
|
(單位:千) |
(單位:千) |
|||||||
|
租賃費 |
||||||||
|
經營租賃成本 |
$ | $ | ||||||
|
短期租賃成本 |
||||||||
|
總租賃成本 |
$ | $ | ||||||
|
其他信息 |
||||||||
|
為計入經營租賃負債的金額支付的現金 |
$ | $ | ||||||
|
以新的經營租賃負債換取的使用權資產 |
$ | $ | ||||||
|
加權平均剩餘租賃期限--經營租賃(年) |
||||||||
|
加權平均貼現率--經營租賃 |
% | % | ||||||
於2023年12月31日,初始或剩餘租期超過一年的最低不可取消經營租賃租金承擔如下:
|
截至十二月三十一日止的年度: |
||||
|
2024 |
$ | |||
|
2025 |
||||
|
2026 |
||||
|
2027 |
||||
|
2028 |
||||
|
此後 |
||||
|
2023年12月31日淨現值調整 |
( |
) | ||
|
最低不可註銷租賃負債 |
$ |
購買承諾
作為我們正常業務過程的一部分,我們承諾購買約美元
9.所得税
所得税前收入(虧損)如下:
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
美國 |
$ | $ | $ | |||||||||
|
外國 |
||||||||||||
|
總計 |
$ | $ | $ | |||||||||
我們的若干海外子公司作為分支機構列入美國納税申報表,但就上表而言,這些子公司被列為海外子公司。
所得税準備金(福利)如下:
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
當前: |
||||||||||||
|
聯邦制 |
$ | $ | $ | |||||||||
|
狀態 |
||||||||||||
|
外國 |
||||||||||||
|
延期: |
||||||||||||
|
聯邦制 |
( |
) | ||||||||||
|
狀態 |
( |
) | ( |
) | ||||||||
|
外國 |
||||||||||||
| ( |
) | |||||||||||
|
所得税撥備 |
$ | $ | $ | |||||||||
我們已審閲了目前由税務機關審查的所有納税年度的納税申報表中已採取或將採取的税務立場。截至2023年12月31日,不包括利息和罰款的未確認税收優惠總額為美元,
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
年初未確認的税收優惠 |
$ | $ | $ | |||||||||
|
本年度税務狀況的增加/調整 |
||||||||||||
|
以往年度税務狀況的增加/調整 |
( |
) | ( |
) | ( |
) | ||||||
|
與税務機關達成和解的減幅 |
||||||||||||
|
因適用的時效法規失效而減少的費用 |
( |
) | ||||||||||
|
年底未確認的税收優惠 |
$ | $ | $ | |||||||||
遞延税項乃由下列暫時性差異所致:
|
截至12月31日, |
||||||||
|
2023 |
2022 |
|||||||
|
(單位:千) |
||||||||
|
遞延税項資產: |
||||||||
|
庫存 |
$ | $ | ||||||
|
淨營業虧損結轉 |
||||||||
|
税收抵免結轉 |
||||||||
|
資本損失結轉 |
||||||||
|
準備金和應計項目 |
||||||||
|
經營租賃負債 |
||||||||
|
無形資產 |
||||||||
|
股票期權 |
||||||||
|
其他 |
||||||||
|
遞延税項資產總額 |
||||||||
|
遞延税項負債: |
||||||||
|
財產和設備 |
( |
) | ( |
) | ||||
|
商譽 |
( |
) | ( |
) | ||||
|
經營性租賃使用權資產 |
( |
) | ( |
) | ||||
|
國外分支機構遞延抵銷 |
( |
) | ( |
) | ||||
|
其他 |
( |
) | ( |
) | ||||
|
遞延税項負債總額 |
( |
) | ( |
) | ||||
|
減值前遞延税項資產淨值 |
||||||||
|
估值免税額 |
( |
) | ( |
) | ||||
|
遞延税項負債淨額 |
$ | $ | ||||||
|
遞延税項分類 |
||||||||
|
長期遞延税項資產 |
$ | $ | ||||||
|
長期遞延税項負債 |
( |
) | ( |
) | ||||
|
長期遞延所得税資產淨額 |
$ | $ | ||||||
於2022年,我們減少估值撥備$
截至2023年12月31日,我們已提供估值撥備$,
我們的遞延税項資產的變現取決於我們在未來期間產生足夠的應課税收入。雖然吾等相信未來應課税收入較有可能足以讓吾等收回於吾等應用估值撥備後剩餘遞延税項資產的絕大部分價值,但無法保證變現,且未來事件可能導致吾等改變判斷。倘實際結果與我們的估計不同,或我們於未來期間調整該等估計,則可能會對我們的估值撥備作進一步調整,這可能會對調整期間的財務狀況及淨收入(虧損)造成重大影響。
截至2023年12月31日,我們在澳大利亞的淨經營虧損結轉為$
2018年12月,我們重新評估了我們的國際業務,因此,我們不再無限期地再投資於我們德國和澳大利亞子公司的未分配收益。沒有記錄與這些未分配收益的未來匯款相關的外國和州税收成本的重大遞延税項支出。對於來自其他海外子公司的未分配收益,我們仍將進行永久性再投資。估計這些永久性再投資未分配收益的遞延税項負債額(如果有的話)是不可行的。
美國聯邦法定税率與我們的有效税率的對賬如下:
|
2023 |
2022 |
2021 |
||||||||||
|
聯邦法定利率 |
% | % | % | |||||||||
|
扣除聯邦福利後的州税 |
% | % | % | |||||||||
|
外國税收的影響 |
% | % | % | |||||||||
|
對外國所得徵收的聯邦税 |
% | % | % | |||||||||
|
估值免税額 |
% | ( |
%) | ( |
%) | |||||||
|
國外遞延税項負債抵銷 |
( |
%) | ( |
%) | ( |
%) | ||||||
|
研發税收抵免 |
( |
%) | % | ( |
%) | |||||||
|
股票期權 |
( |
%) | % | ( |
%) | |||||||
|
不確定的税收狀況 |
% | ( |
%) | % | ||||||||
|
其他永久性差異 |
% | ( |
%) | ( |
%) | |||||||
|
其他 |
( |
%) | ( |
%) | ( |
%) | ||||||
|
實際税率 |
% | % | % | |||||||||
我們目前沒有在任何税務管轄區接受所得税審計。
截至2023年12月31日,我們最主要的税務司法管轄區仍需審查的税務年度摘要如下:
|
美國 |
2020年及未來 |
|
外國 |
2016年及未來 |
現金流量信息的補充披露如下:
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
繳納所得税的現金,淨額 |
$ | $ | $ | |||||||||
10.股東權益
授權股份
我們的公司註冊證書,經不時修訂和重申,授權簽發最多
根據我們的註冊證書的條款,我們的董事會被授權發行一個或多個系列的優先股,而無需股東批准。我們的董事會有權酌情決定每一系列優先股的權利、優先權、特權和限制,包括投票權、股息權、轉換權、贖回特權和清算優先權。目前已經 發行在外的優先股。
股本發售
於二零二一年七月十六日,我們完成了一項發售,
2021年8月4日,承銷商購買了額外的
股票獎勵計劃
2006年5月,我們批准了2006年股票期權及激勵計劃(其後修訂為2006年計劃),該計劃於我們首次公開發售時生效。2006年計劃允許提供一筆總額,
我們已使用以下加權平均假設計算每年授出的僱員購股權的公平值:
|
2023 |
2022 |
2021 |
||||||||||
|
股息率 |
% | % | % | |||||||||
|
波動率 |
% | % | % | |||||||||
|
無風險利率 |
% | % | % | |||||||||
|
加權平均預期購股權年期(年) |
||||||||||||
|
已授予期權的加權平均每股公允價值 |
$ | $ | $ | |||||||||
於二零二三年十二月三十一日及截至該日止三個年度之購股權活動概要呈列如下:
|
加權 |
加權平均 |
集料 |
||||||||||||||
|
數 |
平均值 |
剩餘 |
固有的 |
|||||||||||||
|
的股份 |
行權價格 |
合同條款 |
價值 |
|||||||||||||
|
(單位:年) |
(單位:千) |
|||||||||||||||
|
2020年12月31日的未償還餘額 |
$ | $ | ||||||||||||||
|
授與 |
$ | |||||||||||||||
|
已鍛鍊 |
( |
) | $ | $ | ||||||||||||
|
取消/過期 |
( |
) | $ | |||||||||||||
|
截至2021年12月31日的未償還餘額 |
$ | $ | ||||||||||||||
|
授與 |
$ | |||||||||||||||
|
已鍛鍊 |
( |
) | $ | $ | ||||||||||||
|
取消/過期 |
( |
) | $ | |||||||||||||
|
截至2022年12月31日的未償還餘額 |
$ | $ | ||||||||||||||
|
授與 |
$ | |||||||||||||||
|
已鍛鍊 |
( |
) | $ | $ | ||||||||||||
|
取消/過期 |
( |
) | $ | |||||||||||||
|
於2023年12月31日的未償還結餘 |
$ | $ | ||||||||||||||
| 可在以下地點登記: | ||||||||||||||||
|
2021年12月31日 |
$ | $ | ||||||||||||||
|
2022年12月31日 |
$ | $ | ||||||||||||||
|
2023年12月31日 |
$ | $ | ||||||||||||||
| 預期歸屬於: | ||||||||||||||||
|
2021年12月31日 |
$ | |||||||||||||||
|
2022年12月31日 |
$ | |||||||||||||||
|
2023年12月31日 |
$ | |||||||||||||||
在截至2023年12月31日、2022年和2021年12月31日止年度內,行使股票期權所收到的現金為#美元
限制性股票單位和基於業績的限制性股票單位
基於時間歸屬的限制性股票單位獎勵的公允價值以授予之日獎勵的內在價值為基礎。
我們還根據業績條件發放具有歸屬的限制性股票單位獎勵。基於業績的限制性股票單位根據我們的營業收入相對於我們的目標營業收入的實現情況授予vest。對於包括根據業績條件進行歸屬的限制性股票單位獎勵,公允價值基於授予之日獎勵的內在價值。
截至2023年12月31日以及截至那時的三年,我們的限制性股票單位活動摘要如下:
|
加權 |
||||||||
|
平均值 |
||||||||
|
數 |
授予日期 |
|||||||
|
的股份 |
公允價值 |
|||||||
|
2020年12月31日的未償還餘額 |
$ | |||||||
|
授與 |
$ | |||||||
|
既得 |
( |
) | $ | |||||
|
取消 |
( |
) | $ | |||||
|
截至2021年12月31日的未償還餘額 |
$ | |||||||
|
授與 |
$ | |||||||
|
既得 |
( |
) | $ | |||||
|
取消 |
( |
) | $ | |||||
|
截至2022年12月31日的未償還餘額 |
$ | |||||||
|
授與 |
$ | |||||||
|
既得 |
( |
) | $ | |||||
|
取消 |
( |
) | $ | |||||
|
於2023年12月31日的未償還結餘 |
$ | |||||||
授予的RSU數量包括我們代表員工扣繳的股份,以滿足最低法定預扣税額要求。在2023年、2022年和2021年期間歸屬的RSU的公允價值為$
我們回購普通股股份,以支付與RSU投資相關的任何最低預扣税款責任。我們的回購摘要如下:
|
2023 |
2022 |
2021 |
||||||||||
|
為股權獎勵淨額結算而回購的普通股股份 |
||||||||||||
|
每股回購平均價格 |
$ | $ | $ | |||||||||
|
購買總價(千) |
$ | $ | $ | |||||||||
截至2023年12月31日和截至那時的三年,我們基於業績的限制性股票單位活動摘要如下:
|
加權 |
||||||||
|
平均值 |
||||||||
|
數 |
授予日期 |
|||||||
|
的股份 |
公允價值 |
|||||||
|
2020年12月31日的未償還餘額 |
$ | |||||||
|
授與 |
$ | |||||||
|
既得 |
$ | |||||||
|
取消 |
$ | |||||||
|
截至2021年12月31日的未償還餘額 |
$ | |||||||
|
授與 |
$ | |||||||
|
既得 |
$ | |||||||
|
取消 |
( |
) | $ | |||||
|
截至2022年12月31日的未償還餘額 |
$ | |||||||
|
授與 |
$ | |||||||
|
既得 |
$ | |||||||
|
取消 |
( |
) | $ | |||||
|
於2023年12月31日的未償還結餘 |
$ | |||||||
基於股票的薪酬
計入綜合經營報表的以股票為基礎的補償開支的組成部分如下:
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
股票期權獎勵 |
$ | $ | $ | |||||||||
|
限制性股票單位 |
||||||||||||
|
基於業績的限制性股票單位 |
||||||||||||
|
基於股票的薪酬總額 |
$ | $ | $ | |||||||||
以股票為基礎的補償包括在我們的經營報表中如下:
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
銷售成本 |
$ | $ | $ | |||||||||
|
銷售和市場營銷 |
||||||||||||
|
一般和行政 |
||||||||||||
|
研發 |
||||||||||||
|
基於股票的薪酬總額 |
$ | $ | $ | |||||||||
我們預計將記錄以股份為基礎的薪酬支出的未攤銷部分,
股票回購計劃
2024年2月21日,我們的董事會授權回購最多$
分紅
2011年2月,我們的董事會批准了一項政策,以支付我們的普通股的季度現金股息。未來宣派季度股息及建立未來記錄及付款日期須經董事會按季度批准。於呈列期間之股息活動如下:
|
記錄日期 |
付款日期 |
每股金額 |
股息支付 |
|||||||
|
(單位:千) |
||||||||||
| 2023財年 | ||||||||||
|
2023年3月9日 |
|
$ | $ | |||||||
|
2023年5月17日 |
|
$ | $ | |||||||
|
2023年8月17日 |
|
$ | $ | |||||||
|
2023年11月16日 |
|
$ | $ | |||||||
| 2022財年 | ||||||||||
|
2022年3月8日 |
|
$ | $ | |||||||
|
2022年5月17日 |
|
$ | $ | |||||||
|
2022年8月25日 |
|
$ | $ | |||||||
|
2022年11月17日 |
|
$ | $ | |||||||
2024年2月21日,我們的董事會批准了我們普通股的季度現金股息,
11.利潤分享計劃
我們提供401(k)利潤分享計劃(以下簡稱“計劃”),涵蓋符合條件的美國僱員作出遞延税項供款,其中一部分由我們匹配。我們亦可能向該計劃作出酌情利潤分享供款,金額由我們的董事會釐定。我們的貢獻被分配給 就業年,金額約為美元
12.部門和全部門披露
財務會計準則委員會制定了在財務報表中報告有關經營部門的信息的標準。經營分部被確認為從事業務活動的企業的組成部分,可獲得單獨的、離散的財務信息,並由首席經營決策者在就如何分配資源和評估業績作出決定時定期審查。我們將我們的運營和業務管理視為運營部門。除按產品線分類的銷售情況和按當地目的按法人實體的經營情況外,我們不準備任何離散的經營信息。
我們的大部分收入來自美國、德國、英國和其他歐洲國家和加拿大。我們幾乎所有的資產都位於美國和德國。按國家分列的對非附屬客户的淨銷售額如下:
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
美國 |
$ | $ | $ | |||||||||
|
德國 |
||||||||||||
|
加拿大 |
||||||||||||
|
英國 |
||||||||||||
|
其他國家 |
||||||||||||
|
淨銷售額 |
$ | $ | $ | |||||||||
按國家分列的長期資產,包括財產和設備、租賃淨資產和使用權如下:
|
截至12月31日, |
||||||||
|
2023 |
2022 |
|||||||
|
(單位:千) |
||||||||
|
美國 |
$ | $ | ||||||
|
德國 |
||||||||
|
其他國家 |
||||||||
|
長期資產總額 |
$ | $ | ||||||
13.公允價值計量
公平值會計指引要求按公平值列賬的資產及負債分類及披露為以下三個類別之一:
|
• |
第1級-相同資產或負債在活躍市場的報價。 |
|
• |
第2級--第1級中包括的報價以外的可觀察投入,例如活躍市場中類似資產和負債的報價;非活躍市場中相同或類似資產和負債的報價;或可觀測到或可由可觀測市場數據證實的其他投入。 |
|
• |
第三級-市場活動很少或沒有市場活動支持的不可觀察的投入,並且對資產或負債的公允價值具有重大意義。這包括某些定價模型、貼現現金流方法和使用重大不可觀察投入的類似技術。 |
於2023年12月31日,按經常性基準按公允價值計量的第一級資產包括我們的短期投資及短期債券共同基金賬户。
於2023年12月31日,我們並無按經常性基準按公平值計量的第二級資產。
我們的若干收購相關資產及負債已使用第三級技術計量。於二零二零年,我們錄得與收購Artegrant牛頸動脈移植業務有關的或然負債。該協議要求我們向Artegraft支付最高達美元的潛在額外款項
於二零一九年,我們錄得與收購Anteris生物貼片業務有關的或然負債。該協議包括我們可能支付最多美元,
於二零二三年九月,該協議進一步修訂,以(i)為LeMaitre根據MDR法規取得CE標誌所產生的成本總額設定上限,該金額可用作扣除美元,
下表提供該等負債的公平值的結轉,該等負債的公平值乃按第三級不可觀察輸入數據釐定,包括管理層對所收購業務未來收益的預測,以及管理層對達到其他指定標準的可能性的估計:
|
Year ended December 31, |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
期初餘額 |
$ | $ | $ | |||||||||
|
加法 |
||||||||||||
|
付款 |
||||||||||||
|
計入收益的公允價值變動 |
( |
) | ( |
) | ( |
) | ||||||
|
期末餘額 |
$ | $ | $ | |||||||||
14.累計其他綜合收益(虧損)
|
截至十二月三十一日止的年度: |
||||||||||||
|
2023 |
2022 |
2021 |
||||||||||
|
(單位:千) |
||||||||||||
|
期初餘額 |
$ | ( |
) | $ | (3,435 | ) | $ | ( |
) | |||
|
重新分類前的其他綜合收益(虧損) |
(2,596 | ) | ( |
) | ||||||||
|
從累計其他全面虧損中重新分類的金額 |
||||||||||||
|
期末餘額 |
$ | ( |
) | $ | (6,031 | ) | $ | ( |
) | |||
截至二零二三年、二零二二年及二零二一年十二月三十一日止年度,累計其他全面虧損的變動主要包括外幣換算及短期有價證券的未變現虧損。
15.季度財務數據(未經審計)
|
截至三個月 |
||||||||||||||||
|
2023 |
3月31日 |
6月30日 |
9月30日 |
12月31日 |
||||||||||||
|
(單位為千,每股數據除外) |
||||||||||||||||
|
總淨銷售額 |
$ | $ | $ | $ | ||||||||||||
|
毛利 |
||||||||||||||||
|
營業收入 |
||||||||||||||||
|
淨收入 |
||||||||||||||||
|
每股收益 |
||||||||||||||||
|
基本信息 |
$ | $ | $ | $ | ||||||||||||
|
稀釋 |
$ | $ | $ | $ | ||||||||||||
|
截至三個月 |
||||||||||||||||
|
2022 |
3月31日 |
6月30日 |
9月30日 |
12月31日 |
||||||||||||
|
(單位為千,每股數據除外) |
||||||||||||||||
|
總淨銷售額 |
$ | $ | $ | $ | ||||||||||||
|
毛利 |
||||||||||||||||
|
營業收入 |
||||||||||||||||
|
淨收入 |
||||||||||||||||
|
每股收益 |
||||||||||||||||
|
基本信息 |
$ | $ | $ | $ | ||||||||||||
|
稀釋 |
$ | $ | $ | $ | ||||||||||||