| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) Zunsemetinib (ATI-450) 2b 期 類風濕關節炎試驗頂線 結果 2023 年 11 月 13 日通過 激素組創新賦能 患者 |
| © 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 關於前瞻性陳述的警示説明 2 本演示文稿中任何未描述歷史事實的陳述均可能構成前瞻性陳述,該術語在 1995 年《私人證券訴訟改革法》中定義。這些 陳述可以用 “相信”、“期望”、“打算”、“預期”、“可能”、“計劃”、 “潛力”、“意願” 等詞語來識別,並基於阿克拉里斯當前的信念和期望。這些 前瞻性陳述包括對Aclaris候選藥物 未來發展的預期,包括報告其候選藥物試驗結果的時間安排。這些陳述 涉及風險和不確定性,可能導致實際結果與這類 陳述中反映的結果存在重大差異。可能導致實際結果出現重大差異的風險和不確定性包括臨牀試驗中固有的不確定性 、Aclaris對第三方的依賴(可能並不總是 )、Aclaris在商業上合理的條件下建立戰略夥伴關係的能力、宏觀經濟環境的 不確定性以及Aclaris年度報告風險因素部分描述的其他風險和不確定性 截至2022年12月31日的年度為10-K, 和其他申報文件 Aclaris不時與美國證券交易委員會簽約。這些 文件可在Aclaris網站 www.aclaristx.com “投資者” 部分的 “美國證券交易委員會申報” 頁面下找到。任何前瞻性陳述僅代表截至本演示之日, 基於截至本演示文稿之日Aclaris獲得的信息,Aclaris認為 沒有義務也無意更新任何前瞻性陳述,無論是由於新的 信息、未來事件還是其他原因。 |
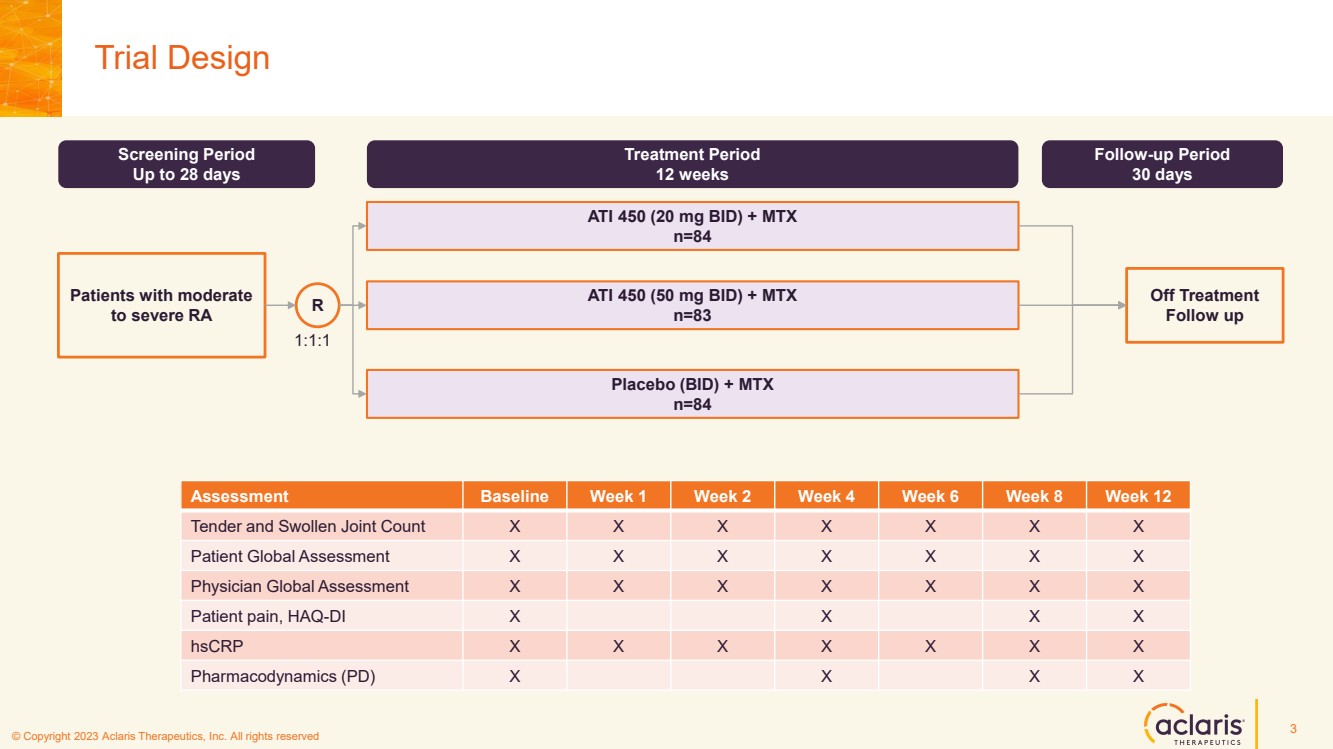
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 試驗設計 3 篩選期 最長 28 天 治療期 12 周 30 天 ATI 450 (20 mg BID) + MTX n=84 ATI 450 (50 mg BID) + MTX n=83 安慰劑 (BID) + MTX n=84 R 停止治療 隨訪 中度 患者 1:1:1 評估基準周 1 周第 2 周第 4 周第 6 周 8 周 12 關節刺痛和腫脹數 X X X X X X 患者全球評估X X X X X X X X 醫生全球評估 X X X X X X 患者疼痛,HAQ-DI X X X X X X X hscRP X X X X X X X X X X X X X X 藥效學 (PD) X X X X X X X |
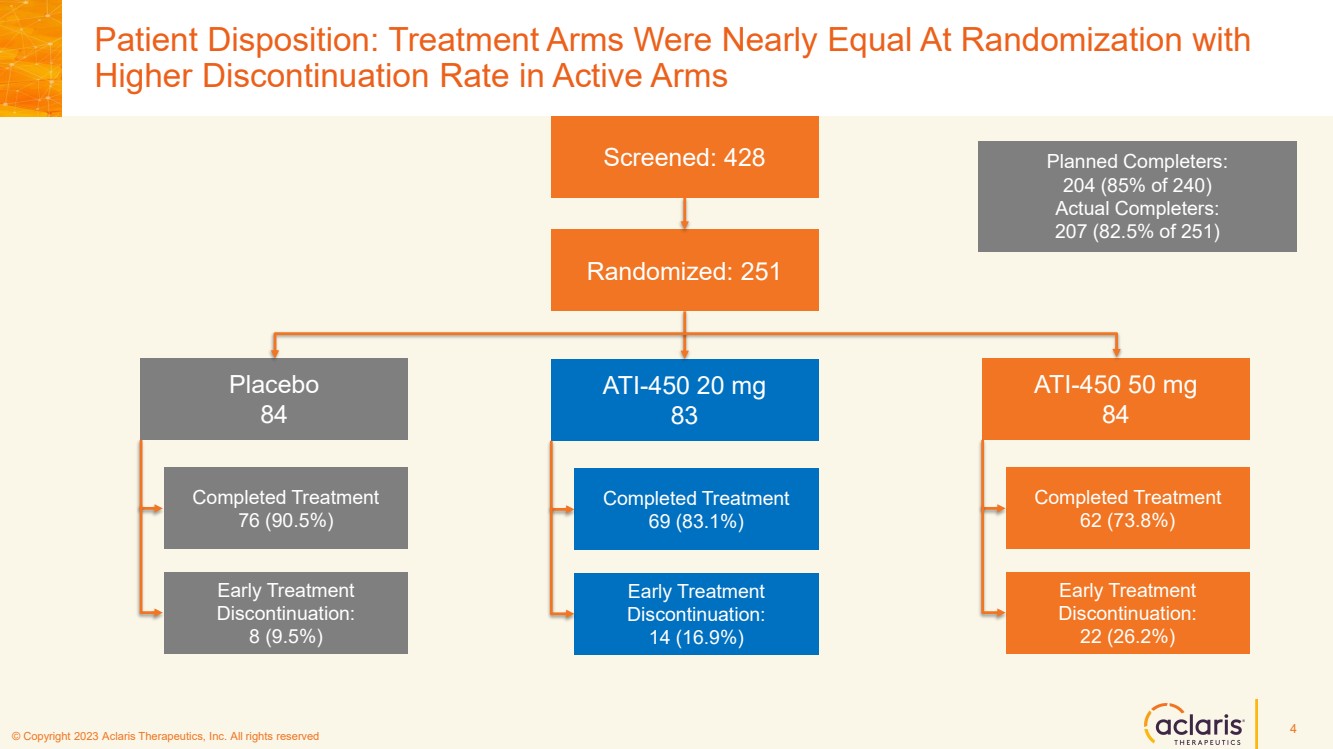
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 患者配置:治療組在隨機分組時幾乎相等, 4 篩選:428 隨機篩選:251 安慰劑 84 20 mg 83 ATI-450 50 mg 84 已完成治療 84 90.5%) 已完成治療 69 (83.1%) 已完成治療 62 (73.8%) 早期治療 停藥: 8 (9.5%) 早期治療 停藥: 14 (16.9%) 提前 ATI-450治療 中止: 22 (26.2%) 計劃完成者: 204(240 人中的 85%) 實際完成者: 207(251 人中的 82.5%) |
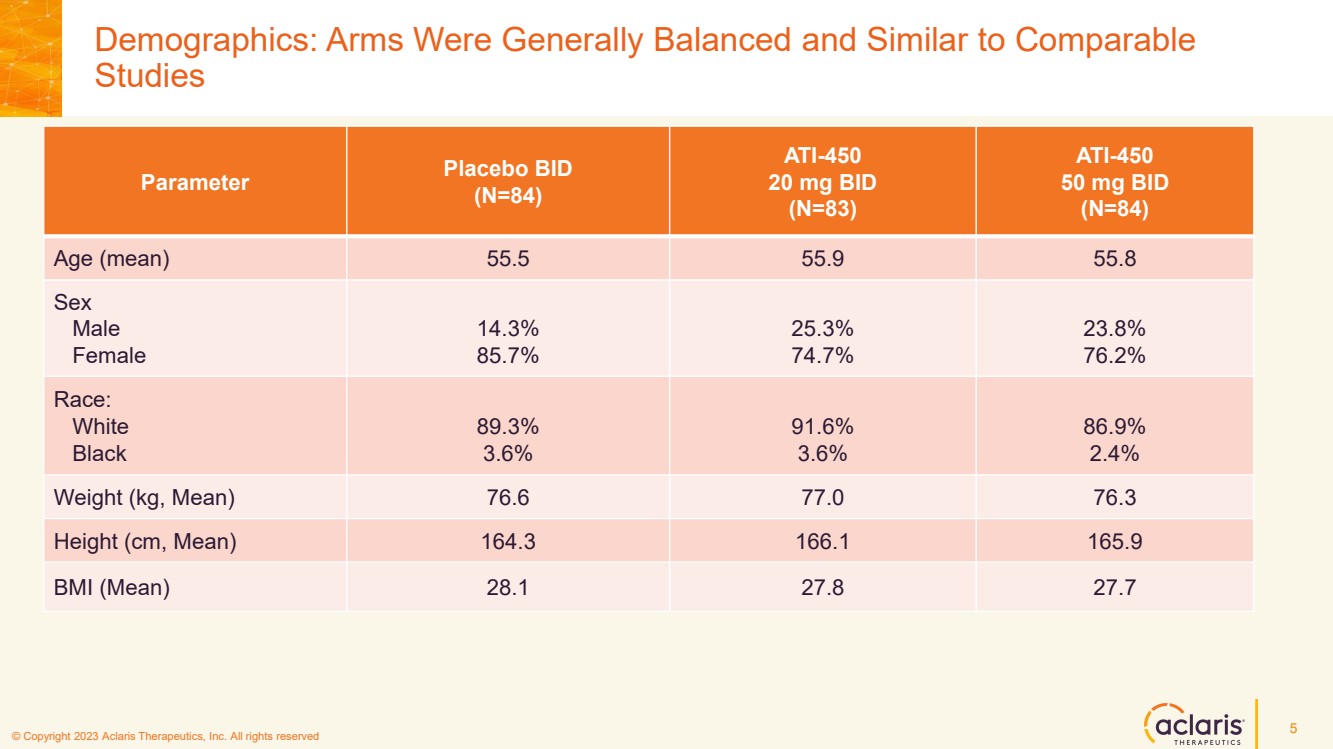
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 人口統計:手臂總體上是平衡的,類似於 5 參數安慰劑 BID (N=84) (N=84) 年齡(平均值)55.5 55.9 55.8 性別 男 14.3% 85.7% 25.3% 74.7% 23.8% 76.2% 76.2% 76.2% 86.6% 3.6% 86.6% 3.6% 86.6% 3.6% 86.6% 3.6% 86.6% 3.6% 86.6% 3.6% 86.6% 9% 2.4% 體重(kg,平均值)76.6 77.0 76.3 身高(cm,平均值)164.3 166.1 165.9 ATI-450 ATI-450體重指數(平均值)28.1 27.8 27.7 |
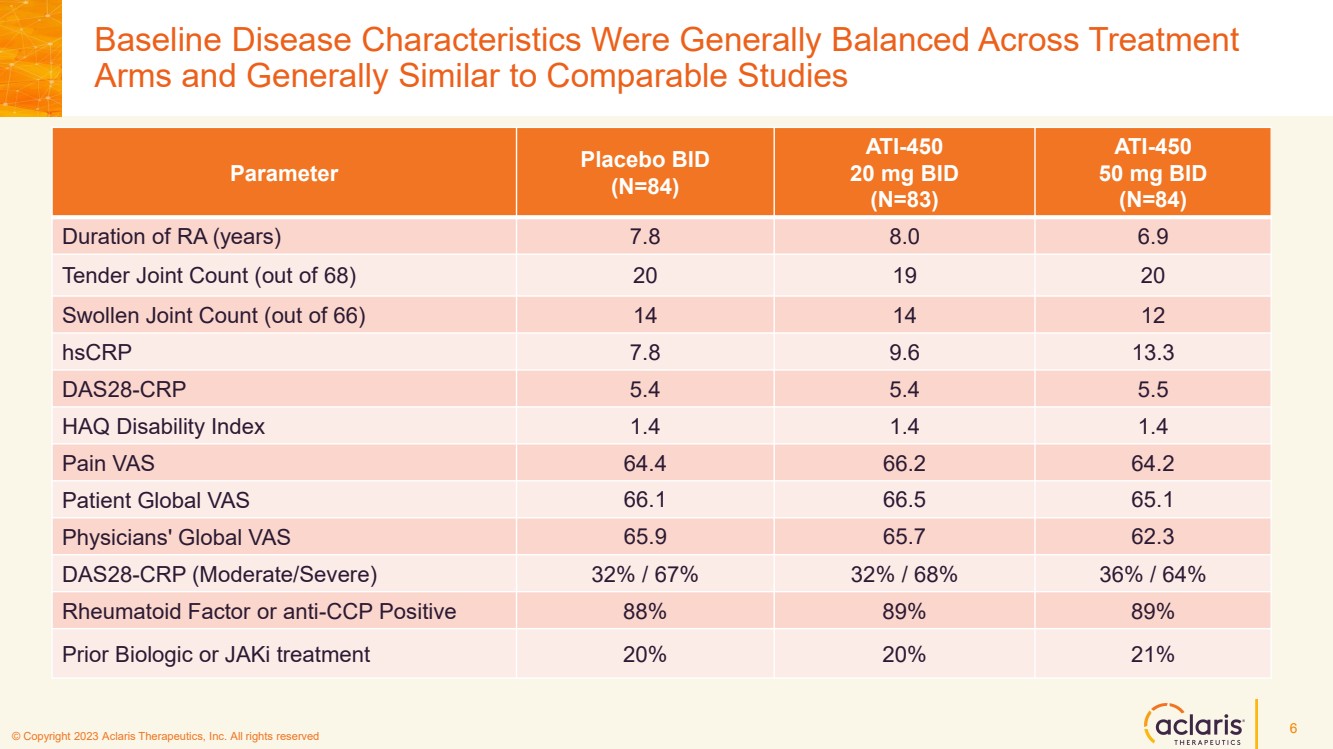
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 治療組的基線疾病特徵總體上與同類研究相似 6 參數安慰劑 BID (N=84) (N=83) ATI-450 50 mg BID (N=83) =84) 關節炎持續時間(年)7.8 8.0 6.9 投標關節數(共 68 個)20 19 20 關節腫脹數(共 66 個)14 14 12 hsCRP 7.8 9.6 13.3 DAS28-CRP 5.4 5.4 5.5 HAQ 殘疾指數 1.4 1.4 疼痛 VAS 64.4 66 ATI-450.2 64.2 患者全球 VAS 66.1 66.5 65.1 醫生全球 VAS 65.9 65.7 62.3 DAS28-CRP(中度/重度)32%/67% 32%/68% 36%/64% 類風濕因子或抗 CCP 陽性 88% 89% 89% 先前的生物學或 JaKi 治療 20% 20% 21% |
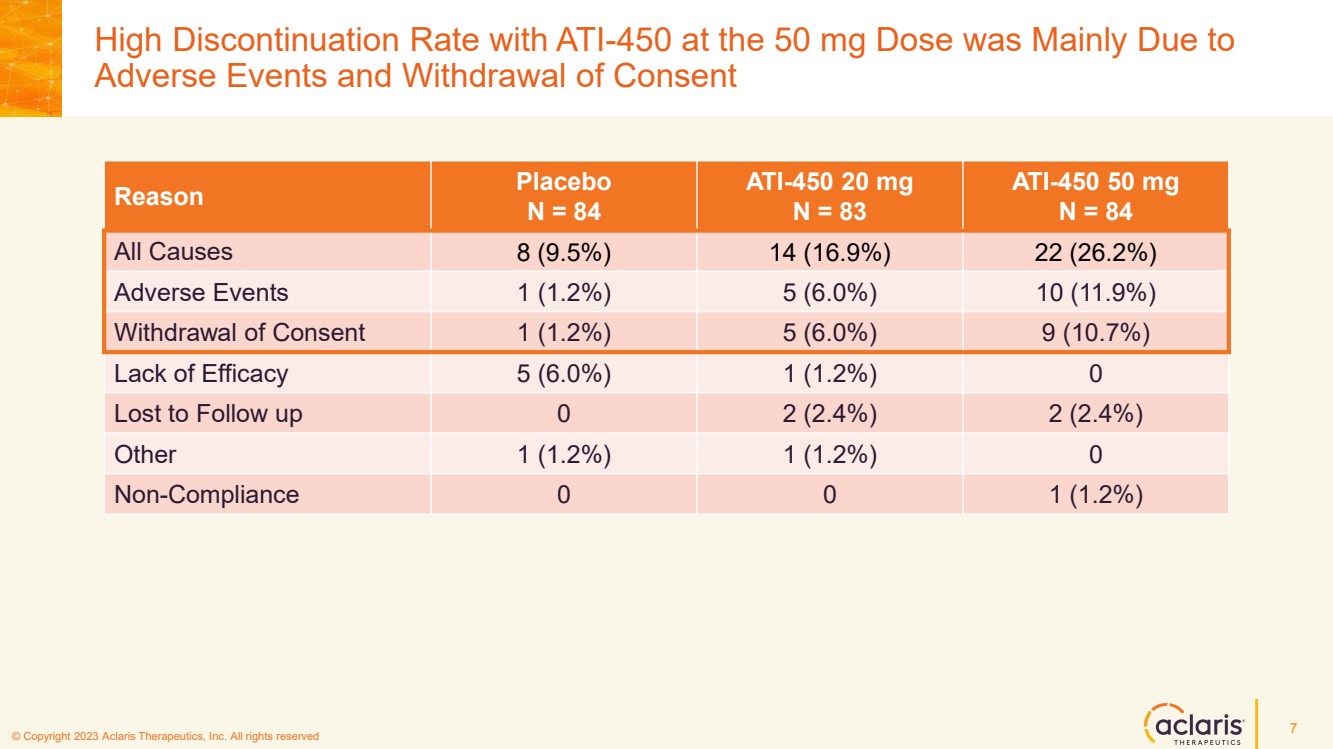
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 50 mg 劑量的 ATI-450 停藥率高主要是由於 不良事件和撤回同意 7 原因安慰劑 N = 84 ATI-450 20 mg N = 83 ATI-450 50 mg N = 84 所有原因 8 (9.5%)) 14 (16.9%) 22 (26.2%) 不良事件 1 (1.2%) 5 (6.0%) 10 (11.9%) 撤回同意 1 (1.2%) 5 (6.0%) 9 (10.7%) 缺乏療效 5 (6.0%) 1 (1.2%) 0 輸給隨訪 0 2 (2.4%) 2 (2.4%) 其他 1 (1.2%)1 (1.2%) 0 違規 0 0 1 (1.2%) |
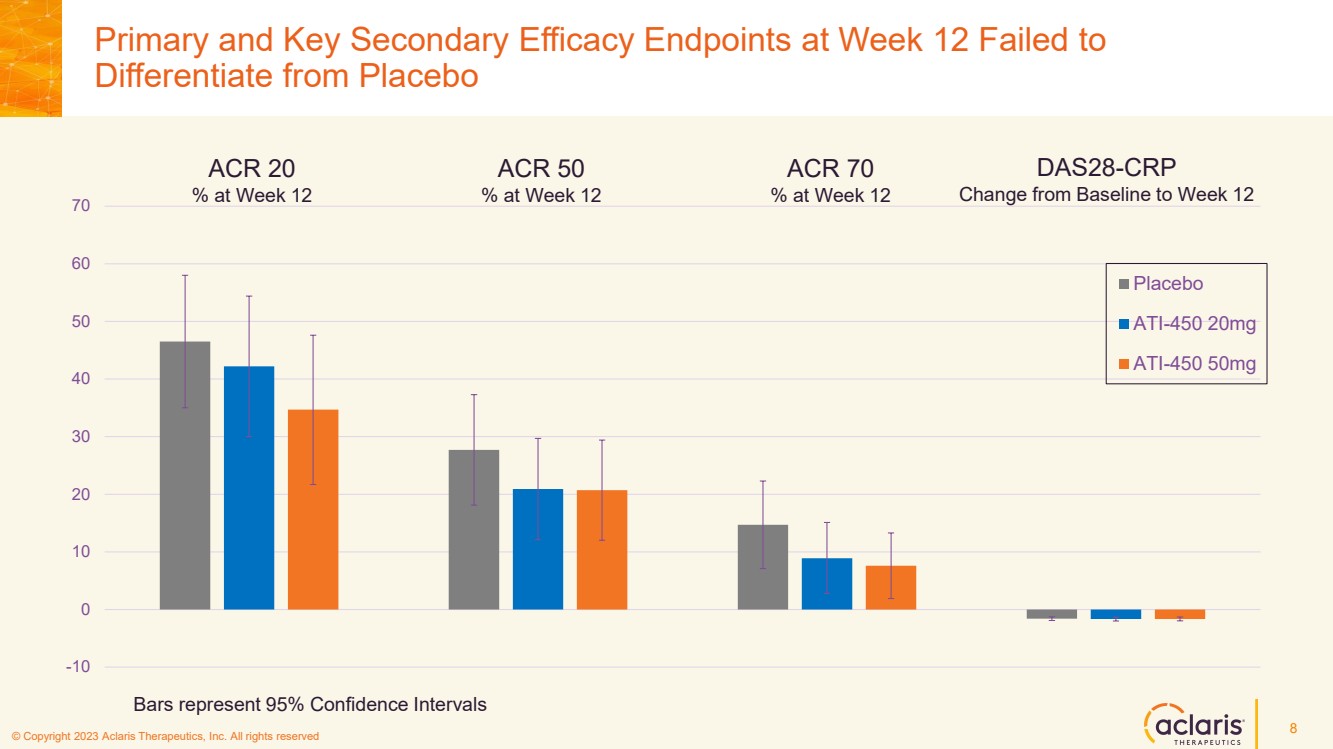
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 第 12 周的主要和關鍵次要療效終點沒有 與安慰劑 -10 0 10 20 30 40 50 60 70 安慰劑 ATI-450 20mg ATI-450 50mg ACR 第 12 周與基線的變化 DAS28-CRP 至第 12 周的 ACR 第 12 周為 70% ACR 第 12 周的 50% 8 個柱形代表 95% 的置信區間 |
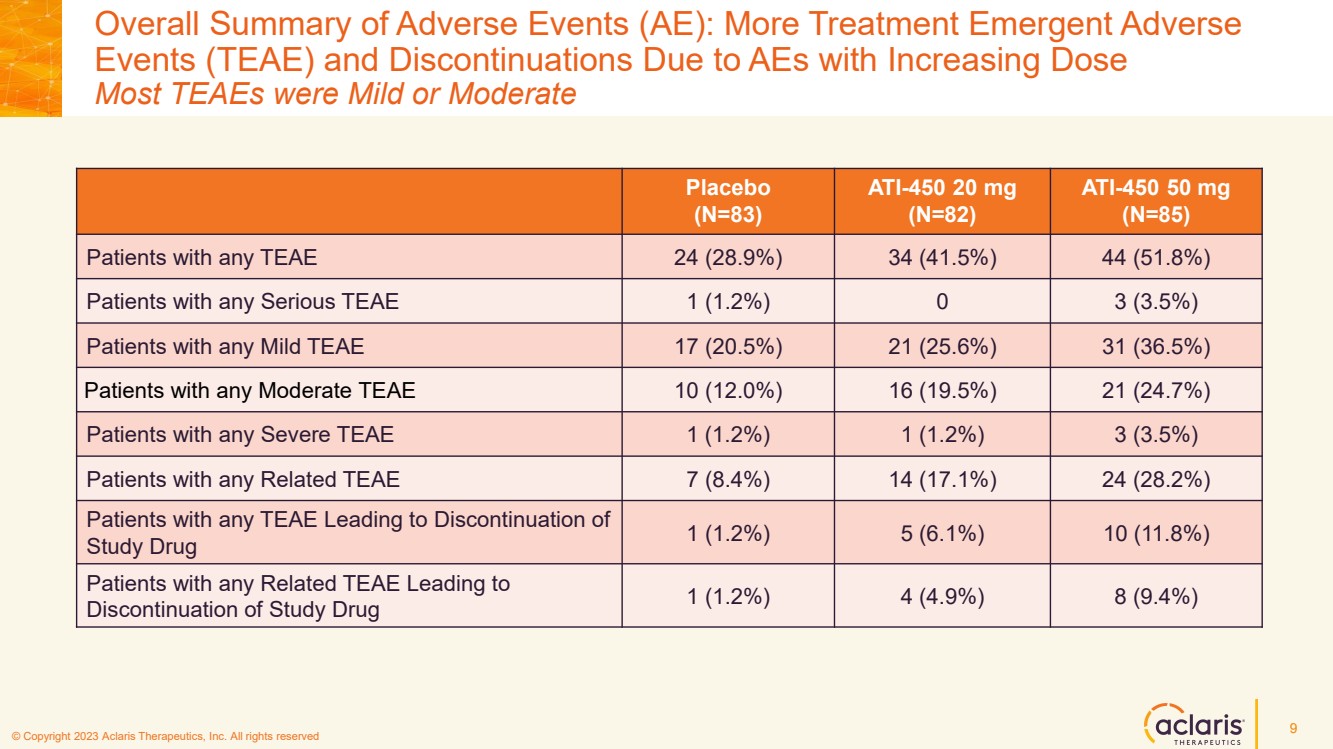
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 不良事件總體摘要 (AE):更多治療緊急不良事件 (TEAE) 和因不良反應劑量增加而停藥 大多數 TEAE 為輕度或中度 9 安慰劑 (N=83) ATI-450 20 mg (N=82) ATI-450 50 mg (N=85) 任何 TEAE 24 (28.9%) 34 (41.5%) 44 (51.8%) 任何重度 TEAE 的患者 1 (1.2%) 0 (3.5%) 任何輕度 TEAE 17 (20.5%) 21 (25.6%) 31 (36.5%) 任何輕度 TEAE 17 (20.5%) 21 (25.6%) 31 (36.5%) } 任何中度 TEAE 10 (12.0%) 16 (19.5%) 21 (24.7%) 任何重度 TEAE 1 (1.2%) 1 (1.2%) 3 (3.5%) 任何相關 TEAE 7 (8.4%) 14 (17.1%) 24 (28.2%) 任何 TEAE 的患者導致 研究藥物 1 (1.2%) 5 (6.1%) 10 (11.8%) 患有任何相關 TEAE 的患者導致 停用研究藥物 1 (1.2%) 4 (4.9%) 8 (9.4%) |
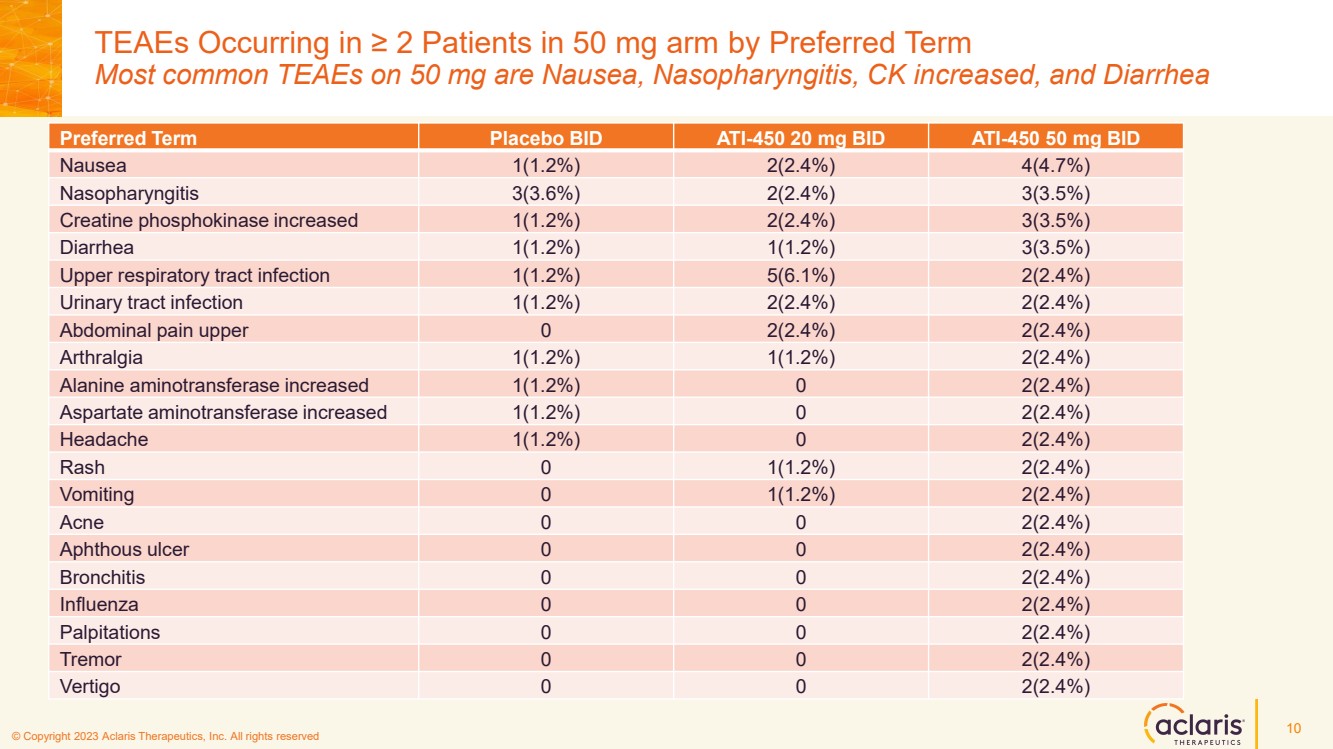
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 按首選術語計算 50 mg 手臂中 ≥ 2 名患者中出現的 TEAE 是噁心、鼻咽炎、CK 增多和腹瀉 10 首選術語安慰劑 BID ATI-450 20 mg BID ATI-450 50 mg BID 1 噁心 (1.2%) 2 (2.4%) 4 (4.7%) 鼻咽炎 3 (3.6%) 2 (2.4%) 3 (3.5%) 肌酸磷酸激酶增加 1 (1.2%) 2 (2.4%) 3 (3.5%) 腹瀉 1 (1.2%) 1 (1.2%) 3 (3.5%) 上呼吸道感染 1 (1.2%)) 5 (6.1%) 2 (2.4%) 尿路感染 1 (1.2%) 2 (2.4%) 2 (2.4%) 上腹痛 0 2 (2.4%) 2 (2.4%) 關節痛 1 (1.2%) 1 (1.2%) 2 (1.2%) 2 (2.4%) 天冬氨酸氨基轉移酶增加 1 (1.2%) 0 2 (2.4%) 頭痛 1 (1.2%) 0 2 (2.4%) 皮疹 0 1 (1.2%) 2 (2.4%) 嘔吐 0 1 (1.2%) 2 (2.4%) 痤瘡 0 0 2 (2.4%) 支氣管 tis 0 0 2 (2.4%) 流感 0 0 2 (2.4%) 心悸 0 0 2 (2.4%) 震顫 0 0 2 (2.4%) 震顫 0 0 2 (2.4%) Vertigo 0 0 2 (2.4%) |
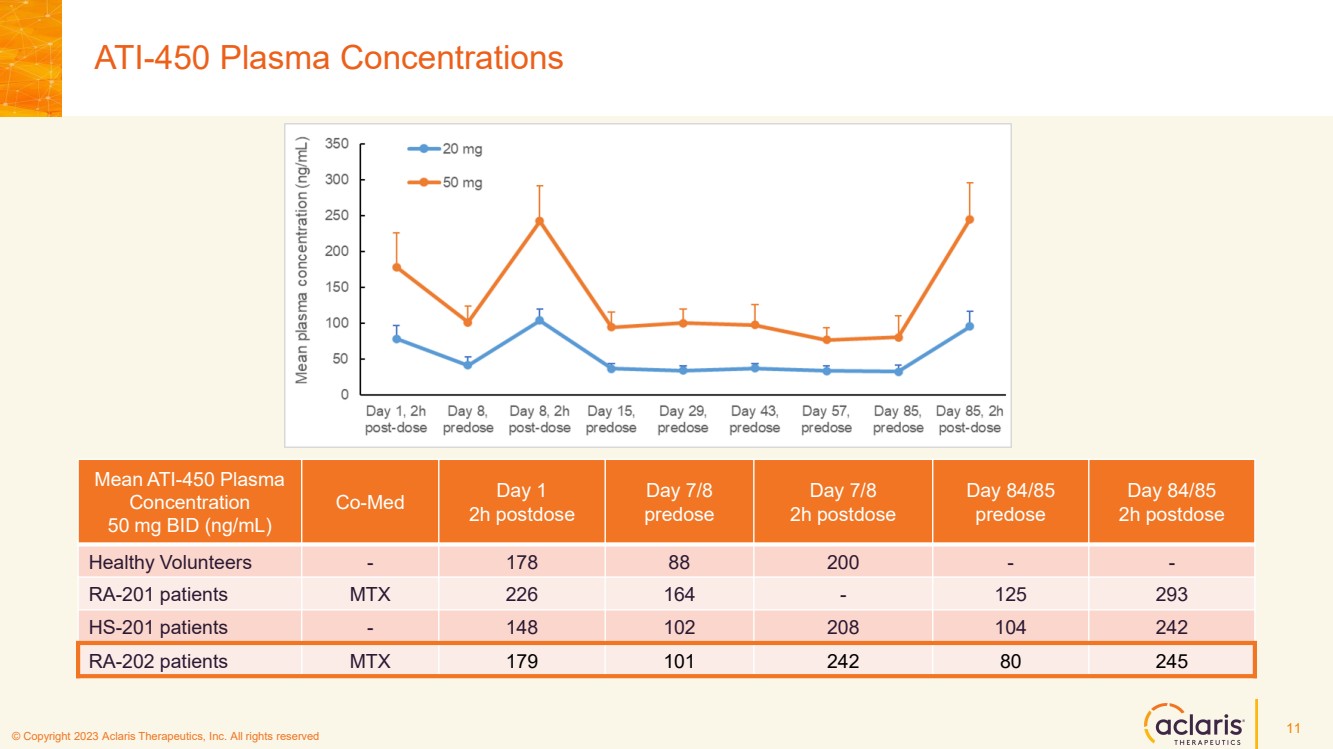
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) ATI-450 血漿濃度 11 平均值 ATI-450 血漿 50 mg BID (ng/mL) 第 1 天 2h 劑量後 第 7 天 84/85 天 predose 第 84/85 天 2 小時服藥後 健康志願者-178 88 200-- RA-201 患者 MTX 226 164-125 293 HS-201 患者-148 102 208 104 242 RA-202 患者 MTX 179 101 242 80 245 |
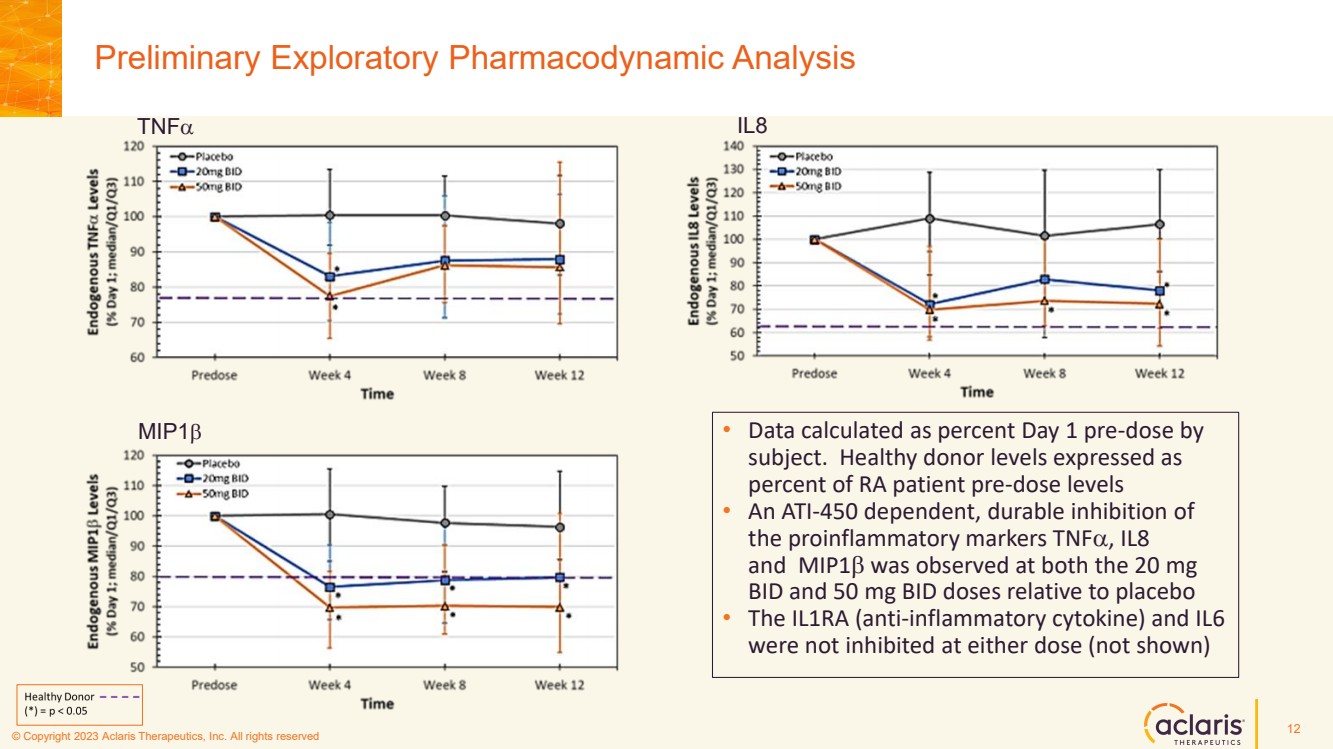
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) 初步探索性藥效學分析 12 tnFa • 數據按 受試者第 1 天預劑量的百分比計算。健康捐贈者水平以 RA 患者服藥前水平的 百分比表示 • 相對於安慰劑 ,在 20 mg BID 和 50 mg BID 劑量下,均觀察到對 促炎標誌物 tnfa、IL8 和 MIP1b 具有 ATI-450 依賴性、持久抑制 。• 兩種劑量,IL1RA(抗炎細胞因子)和 IL6 均未受到抑制(未顯示) IL8 mip1b |
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) • 功效:ATI-450 20 mg BID 和 50 mg BID 在 ACR20 和其他指標中與安慰劑沒有區別 o 安慰劑在 12 周的療效總體上非常相似 o 安慰劑反應較高已超出預期範圍 • 安全性:沒有有意義的安全性發現 o 儘管 原因是 ATI-450(特別是 50 mg BID)的 AE 停藥比安慰劑多 ATI-450不同的 • PK 和 PD o PK 劑量與暴露量成正比,類似於 HS-201 和健康志願者研究,而 略低於 RA-201 o 促炎 PD 生物標誌物(TNFα、IL8 和 MIP1b)與安慰劑相比,在 20 和 50 mg BID 下表現均符合預期,而 IL6 和抗炎細胞因子 IL1RA 在任何劑量下均未受到抑制 結果和結論 13 |
| © 版權所有 2023 Aclaris Therapeutics, Inc. 版權所有 © 2020 Aclaris Therapeutics, Inc. 版權所有 (XX) ATI-1777 治療特應性皮炎的 2b 期試驗預計在年內結果 14 主要終點:EASI 次要項目從基線到第 4 周的變化百分比包括: • EASI-50、-75、-90 • 實現 IGA-TS 的百分比 •% 變化 BSA • ViGA 的變化 • PP-NRS • PGIC • POEM • DLQI 和 CDLQI 溶液上的獨特噴霧 • ATI-1777:0.5% BID,2% BID,2% 每日一次 • 車輛:出價和每日一次武器 2b 期多中心、隨機、雙盲、車輛控制、平行組研究,旨在確定 ATI-1777 在 12-65 歲輕度重度 AD 患者中的安全性、耐受性、PK 和療效 |
| © Copyright 2023 Aclaris Therapeutics, Inc. All rights reserved © Copyright 2020 Aclaris Therapeutics, Inc. All rights reserved (XX) Drug Development Pipeline Fueled by the KINect® Platform Discovery Engine 15 * This is an investigator-initiated Phase 1a trial in patients with advanced solid tumor malignancies sponsored by Washington University. As of September 30, 2023, Aclaris had aggregate cash, cash equivalents and marketable securities of $187.0 million Drug Candidate / Program Target Route of Administration Indication Development Phase Immuno-Inflammatory Diseases ATI-1777 “Soft” JAK 1/3 inhibitor Topical Atopic dermatitis (mild to severe) Phase 2b ATI-2138 ITK/JAK3 inhibitor Oral T cell-mediated autoimmune diseases Phase 2 Ready Oncology ATI-2231 MK2 inhibitor Oral Metastatic breast cancer Phase 1a* Pancreatic cancer |