
美國 美國
證券交易委員會
華盛頓特區,20549
表格
對於
截止的財政年度
或
對於 ,過渡期從_
佣金
文件編號:

(註冊人的確切名稱與其章程中規定的名稱相同)
| (州或 公司或組織的其他管轄權) | (I.R.S.僱主 識別碼) |
(主要執行辦公室地址 )
(註冊人的電話號碼,包括區號)
根據該法第12(B)條登記的證券:
| 每個班級的標題 | 交易 個符號 | 註冊的每個交易所的名稱 | ||
根據該法第12(G)條登記的證券:
無
如果註冊人是證券法規則405中定義的知名經驗豐富的發行人,請用複選標記表示
。是的☐
如果註冊人根據《交易法》第13或15(d)條無需提交報告,請使用複選標記進行標記。是的,
用複選標記檢查
註冊人是否(1)在過去12個月內(或註冊人被要求提交此類報告的較短時間內)提交了1934年證券交易法
第13條或第15(d)條要求提交的所有報告,以及(2)在過去90天內是否
遵守此類提交要求。
用複選標記表示註冊人是否在過去12個月內(或在註冊人被要求提交和張貼此類文件的較短時間內)以電子方式提交了根據S-T規則(本章232.405節)第405條要求提交的每個交互數據文件。
用複選標記表示註冊人是大型加速申報公司、加速申報公司、非加速申報公司、較小的申報公司或新興成長型公司。請參閲《交易法》第12b-2條規則中“大型加速申報公司”、“加速申報公司”、“較小報告公司”和“新興成長型公司”的定義。
| 大型 加速文件服務器 | ☐ | 加速的 文件管理器 | ☐ |
| ☒ | 較小的報告公司 | ||
| 新興的 成長型公司 |
如果
是一家新興成長型公司,請用複選標記表示註冊人是否已選擇不使用延長的過渡期來遵守根據《交易法》第13(A)節提供的任何新的或修訂的財務會計準則。
用複選標記表示註冊人是否提交了一份報告,並證明其管理層根據《薩班斯-奧克斯利法案》(《美國法典》第15編第7262(B)節)第404(B)條對其財務報告內部控制的有效性進行了評估
編制或發佈其審計報告的註冊會計師事務所。
如果證券是根據該法第12(B)條登記的,請用複選標記表示備案文件中包括的註冊人的財務報表是否反映了對以前發佈的財務報表的錯誤更正。
用複選標記表示這些錯誤更正中是否有任何重述需要根據§240.10D-1(B)對註冊人的任何高管在相關恢復期間收到的基於激勵的薪酬進行恢復分析。☐
用複選標記表示註冊人是否是空殼公司(如該法第12b-2條所界定)。是,☐不是
説明
非關聯公司持有的有表決權和無表決權普通股的總市值,該市值參考
普通股最後一次出售的價格,或該普通股的平均出價和要價,截至註冊人
最近完成的第二財政季度的最後一個營業日:$
截至2024年3月15日,註冊人普通股的流通股數量為 .
通過引用併入的文檔
目錄表
| 第一部分 | 1 | |
| 第 項1. | 業務 | 1 |
| 第 1a項。 | 風險因素 | 38 |
| 項目 1B。 | 未解決的員工意見 | 62 |
| 項目 1C。 | 網絡安全 | 62 |
| 第 項2. | 屬性 | 63 |
| 第 項3. | 法律訴訟 | 63 |
| 第 項。 | 煤礦安全信息披露 | 63 |
| 第II部 | 64 | |
| 第 項5. | 註冊人普通股市場、相關股東事項與股權證券發行人回購 | 64 |
| 第 項6. | 已保留 | 65 |
| 第 項7. | 管理層對財務狀況和經營成果的探討與分析 | 66 |
| 第 7A項。 | 關於市場風險的定量和定性披露 | 75 |
| 第 項8. | 財務報表和補充數據 | 76 |
| 第 項9. | 會計與財務信息披露的變更與分歧 | 77 |
| 第 9A項。 | 控制和程序 | 77 |
| 第 9B項。 | 其他信息 | 77 |
| 第 9C項。 | 關於妨礙檢查的外國司法管轄區的披露 | 77 |
| 第三部分 | 78 | |
| 第 項10. | 董事、高管與公司治理 | 78 |
| 第 項11. | 高管薪酬 | 78 |
| 第 項12. | 某些實益擁有人的擔保所有權以及管理層和相關股東的事項 | 78 |
| 第 項13. | 某些關係和相關交易,以及董事的獨立性 | 78 |
| 第 項14. | 首席會計師費用及服務 | 78 |
| 第四部分 | 78 | |
| 第 項15. | 展品和財務報表附表 | 78 |
| 第 項16. | 表格10-K摘要 | 79 |
| 簽名 | 80 | |
| i |
注意事項 注意事項
本 表格10—K的年度報告包含1933年《證券法》第27A條(經修訂)和1934年《證券交易法》第21E條(經修訂)定義的前瞻性陳述。這些前瞻性陳述包括我們對未來的期望、信念、意圖和策略。
These and other factors that may affect our financial results are discussed more fully in “Risk Factors” and “Management’s Discussion and Analysis of Financial Condition and Results of Operations” included in this report. Moreover, we operate in a very competitive and rapidly changing environment, and new risks emerge from time to time. It is not possible for us to predict all risks, nor can we assess the impact of all factors on our business or the extent to which any factor, or combination of factors, may cause actual results to differ materially from those contained in any forward-looking statements we may make. In light of these risks, uncertainties and assumptions, the forward-looking events and circumstances discussed in this report may not occur and actual results could differ materially and adversely from those anticipated or implied in our forward-looking statements. Although we believe that the expectations reflected in our forward-looking statements are reasonable, we cannot guarantee that the future results, levels of activity, performance or events and circumstances described in the forward-looking statements will be achieved or occur. Moreover, neither we nor any other person assumes responsibility for the accuracy and completeness of the forward-looking statements. We caution readers not to place undue reliance on any forward-looking statements. We do not undertake, and specifically disclaim any obligation, to update or revise such statements to reflect new circumstances or unanticipated events as they occur, and we urge readers to review and consider disclosures we make in this and other reports that discuss factors germane to our business. See in particular our reports on Forms 10-K, 10-Q, and 8-K subsequently filed from time to time with the Securities and Exchange Commission.
除 另有説明外,本報告中的所有股份和股價均適用於2023年5月17日以 一比一的比率實施的遠期股票分割。
行業和市場數據
本 報告,特別是“業務”部分,包含基於獨立行業、政府和非政府組織出版物或其他公開可用信息的觀察、統計數據、估計和預測,以及 基於我們內部來源的其他信息。雖然我們認為本報告中提到的第三方來源是可靠的,但 與預測有關的估計涉及許多假設,受到風險和不確定性的影響,並且 可能會根據各種因素(包括在標題為“”的章節中討論的因素)而發生變化風險因素"以及本報告的其他地方。這些和其他因素可能導致結果與獨立 方和我們所作估計中所表達的結果有重大差異。
本報告文本中的某些 信息載於獨立行業政府和非政府組織出版物中。 這些出版物的來源如下:
| ● | Stacy 和Belkaid研究, 阿波羅·斯泰西和亞斯明Belkaid,皮膚健康的微生物守護者。 Science,2019年1月18日;363(6424):227—228。Doi:10.1126/science.aat4326。PMID:30655428 | |
| ● | 哦 研究,Zhou W,Spoto M,Hardy R,Guan C,Fleming E,Larson PJ,Brown JS,Oh J.主機特定 進化和傳播動力學塑造葡萄球菌的功能多樣性 表皮在人體皮膚中。cell. 2020年2月6日;180(3):454—470.e18. doi:10.1016/j.cell.2020.01.006。 Epub 2020 Jan 30. PMID:32004459;PMCID | |
| ● | 佐藤 研究,Satoh TK,Mellett M,Meier—Schiesser B,Fenini G,Otsuka A,Beer HD,Rordorf T,Maul JT,Hafner J,Navarini AA,Contassot E,French LE. IL—36 γ引起皮膚毒性 EGFR/MEK抑制作用和痤瘡角質桿菌。J臨牀投資2020年3月2日;130(3):1417—1430. doi:10.1172/JCI128678。PMID:31805013;PMCID:PMC7269569 | |
| ● | Barbati 研究,兒童內瑟頓綜合徵:管理和未來展望,Federica Barbati, Mattia Giovannini Teresa Oranges,Lorenzo Lodi,Simona Barni,Elio Novembre,Ermanno Baldo, Mario Cristofolini、Stefano Stagi、Silvia Ricci、Francesca Mori、Cesare Filippeschi、Chiara Azzari和Giuseppe Indol;兒科前沿,2021年5月 | |
| ● | 日 Netherton綜合徵研究:病例報告和文獻回顧,Joannie D. Sun,MD, Kenneth G. Linden,博士,醫學博士,國際皮膚病學雜誌2006 | |
| ● | 孤兒網, Netherton綜合徵,Orphanet:Netherton綜合徵 |
| II |
風險 因素彙總
我們的 業務受到許多風險和不確定性的影響,包括本年度報告 表格10—K中的“風險因素”中所述的風險和不確定性。這些風險包括但不限於以下:
| ● | 我們 是一家經營歷史有限的早期臨牀生物製藥公司; | |
| ● | 我們 有重大經營虧損的歷史,並預計將持續經營虧損 在可預見的將來; | |
| ● | 我們 預計我們將需要額外的資金來執行我們的業務計劃和資金運營, 可能無法以合理條件或根本無法獲得額外融資; | |
| ● | 我們的微生物文庫和基因工程平臺的臨牀和商業用途 是不確定的,可能永遠不會實現; | |
| ● | 我們的 候選產品處於早期開發階段,因此需要大量 額外的臨牀前和臨牀試驗; | |
| ● | 我們 將需要擴大我們的組織規模,並且我們可能會在管理方面遇到困難 這種增長; | |
| ● | 我們 目前沒有銷售和營銷機構; | |
| ● | 我們 在可預見的未來,將完全依賴第三方來製造我們的 用於商業銷售的候選產品; | |
| ● | 我們的 商業模式包括我們專有微生物菌株的潛在外授權 庫或我們的候選產品到其他製藥公司;但是,技術 製藥行業的許可證是一個漫長的過程,並存在多種風險 以及我們無法控制的因素; | |
| ● | 我們的 企業可能因失去關鍵人員而受到影響; | |
| ● | 如果 產品責任訴訟針對我們,我們可能會承擔重大責任, 可能要求限制我們候選產品的商業化; | |
| ● | 我們的 如果信息技術系統出現故障,業務運營可能會受到影響 或安全漏洞; | |
| ● | 我們 面臨來自其他生物技術和製藥公司的激烈競爭,目標是 醫學皮膚病學指徵; | |
| ● | 我們的 成功完全取決於我們獲得產品市場批准的能力 FDA和外國司法管轄區的監管機構的候選人,我們 打算推銷我們的候選產品,但不能保證; | |
| ● | 我們的 臨牀試驗可能無法證明安全性和有效性的實質性證據 我們的候選產品或任何未來的候選產品; | |
| ● | 結果 我們候選產品的臨牀前研究可能無法預測 未來的臨牀前研究或臨牀試驗; | |
| ● | 甚至 如果我們的任何候選產品獲得了監管部門的批准,我們可能無法 成功地將產品和我們從其銷售中獲得的收入商業化,如果 任何,可能是有限的; | |
| ● | 當前 未來的立法可能會增加我們獲得上市許可的難度和成本 我們的候選產品並將其商業化,並影響我們可能獲得的價格; | |
| ● | 它 保護我們的知識產權既困難又昂貴,而且我們無法確保 保護這些權利; | |
| ● | 我們的 候選產品可能會侵犯他人的知識產權,這可能會增加 我們的成本和延遲或阻礙我們的開發和商業化努力; | |
| ● | 安 我們的股票可能無法發展活躍,流動性和有序的交易市場; | |
| ● | 未來 融資可能會稀釋您的所有權,並對我們的運營造成其他不利影響; | |
| ● | 本公司股份的市價可能會波動及波動; | |
| ● | 我們的 未能滿足紐約美國證券交易所的持續上市要求可能導致 我們的普通股退市; | |
| ● | 如果 我們未能維持一個有效的財務報告內部控制系統,我們 可能無法準確報告我們的財務業績或防止欺詐; | |
| ● | 我們 根據特拉華州總公司法第204條批准了某些公司行動 法律,或DGCL;但是,不能保證不會提出質疑的索賠 批准書或相關公司行動的有效性;以及 | |
| ● | 我們的章程文件和特拉華州法律可能會阻止股東認為有利的收購。 |
| 三、 |
第 部分I
第 項1.業務
背景
Azitra, Inc.成立於2014年1月2日,是一家特拉華州公司,目的是使用工程蛋白質和局部活性生物製劑產品開發精準皮膚病學的創新療法 。自我們成立以來,我們已經建立了一個專有平臺,其中包括 一個微生物庫,由大約1500種獨特的細菌菌株組成,可以篩選獨特的治療特性。 該平臺由人工智能和機器學習技術增強,可分析、預測並幫助篩選我們的 菌株庫中的藥物類分子。該平臺還利用了一種獲得許可的基因工程技術,能夠 轉化以前遺傳上難以處理的菌株。我們尚未開始商業運營。除非另有説明, 術語“Azitra”、“公司”、“我們”和“我們的”指Azitra,Inc.及其全資子公司。
概述
我們 是一家早期臨牀生物製藥公司,專注於使用工程 蛋白質和局部活性生物治療產品開發精準皮膚病的創新療法。我們已經建立了一個專利平臺,其中包括一個微生物文庫,該文庫由大約1,500個獨特的細菌菌株組成,可以篩選出獨特的治療特徵。該平臺得到了 人工智能和機器學習技術的增強,該技術可以分析、預測和幫助篩選我們的菌株庫中類似藥物的 分子。該平臺還利用了一項獲得許可的基因工程技術,可以轉化以前在基因上難以處理的菌株。我們最初的重點是開發基因工程菌株。表皮葡萄球菌, 或 表皮葡萄球菌,我們認為這是皮膚病治療工程的最佳治療候選種。 特定物種在皮膚中表現出許多描述良好的特性。截至本報告的日期,我們已經在微生物庫中確定了超過60種不同的細菌物種,我們認為這些細菌能夠被改造以創造具有顯著治療效果的活的生物體 或工程蛋白質。
我們是基因工程細菌用於皮膚病治療的先驅。我們的目標是利用我們的平臺和內部微生物庫細菌菌株來創造新的療法,這些療法要麼是工程生物,要麼是工程蛋白質或多肽,用於治療皮膚病。我們最初的重點是開發我們目前的候選產品,包括:
| ● | ATR-12, 一個轉基因菌株表皮葡萄球菌為了治療孤兒病,Netherton 綜合徵,一種慢性且有時致命的皮膚疾病,估計影響大約 每100,000人中有1至9人,但其患病率可能因誤診而被低估 與其他皮膚病的相似性引起的我們獲得了兒科罕見病稱號 美國食品藥品監督管理局(FDA)於2019年發佈了ATR—12。12月 2022年,我們提交了一份1b期臨牀試驗新藥申請(IND) 在Netherton綜合徵患者中進行ATR—12試驗,並於2023年1月27日收到通知 FDA關於擬定階段的"研究可以繼續進行" 1b臨牀試驗提交IND後生產報告後,我們已開始運行 2023年12月,我們的1b期臨牀試驗。我們希望報告初始 2024年下半年的安全性。 |
| ● | ATR-04, 一株轉基因菌株表皮葡萄球菌用於治療接受表皮生長因子受體抑制劑或EGFRi靶向治療的癌症患者出現的丘疹丘疹。我們打算在2024年年中之前將IND提交給正在接受EGFRi靶向治療的某些癌症患者進行1b期臨牀試驗。如果FDA批准我們的IND,我們預計將於2024年第四季度開始我們的1b期臨牀試驗。 |
| ● | ATR-01,一種用於治療尋常型魚鱗病的工程重組人細絲蛋白,這是一種慢性、乾燥(異常乾燥)、鱗片狀皮膚病,估計在250人中的發病率和患病率為1。這表明美國的患者總數為130萬。 我們計劃在2024年完成Lead優化和IND啟用研究,以支持計劃於2025年下半年提交的IND申請。 |
| 1 |
| ● | 我們和拜耳的消費品部門拜耳或國際生命科學公司拜耳正在研究和開發兩種不同的細菌微生物菌株。我們於2019年12月與拜耳簽訂了聯合開發協議(JDA)。根據JDA的條款,我們負責測試我們的細菌菌株及其天然產物庫中的關鍵臨牀前特性。在從數百個菌株中進行篩選後,我們和拜耳選擇了兩個特定的菌株進行進一步的開發。拜耳擁有授予這些菌株專利權的獨家選擇權。2020年12月,拜耳購買了800萬美元的B系列優先股, 這些優先股轉換為我們普通股的1,449,743股,約佔我們普通股流通股的12.0% 。 |
我們 還與卡內基梅隆大學和弗雷德·哈欽森癌症中心或弗雷德·哈奇的團隊建立了合作伙伴關係,這兩個中心是美國兩個主要的學術中心。我們與卡內基梅隆大學團隊的合作利用了全基因組測序的力量。這一合作伙伴關係正在挖掘我們專有的細菌菌株庫,以尋找新的、類似藥物的多肽和蛋白質。該團隊開發的人工智能/機器學習技術根據微生物的基因序列預測微生物製造的分子。然後,該系統將預測結果與通過串聯質譜學和/或核磁共振成像實際做出的產品進行比較,以完善未來的預測。這些預測可以與公開可用的2D和3D蛋白質數據庫進行比較,以選擇類似藥物的結構。
我們 持有Fred Hutch的全球獨家許可,允許將其獲得專利的SyMPL技術用於基因工程的所有領域,包括髮現、開發和商業化皮膚疾病的工程微生物療法和微生物衍生的多肽和蛋白質 。我們正在利用我們許可的專利權來構建質粒,以便進行以前從未實現過的基因轉化。我們與Fred Hutch的合作是由微生物工程專家Christopher Johnston博士領導的,他也是SyMPL技術的創新者。
除了我們的三個主要候選產品和與拜耳的合作之外,我們的目標是開發廣泛的候選產品組合, 專注於擴展我們的精確皮膚病平臺的應用。我們相信,我們已經在推動精準皮膚病生物製劑的開發方面確立了獨特的地位。

| 2 |
我們的 業務戰略
我們 打算通過開發從我們的專利微生物庫中挑選的約1,500種獨特細菌菌株中挑選出來的基因工程 蛋白質,為精密皮膚病創造廣泛的候選產品組合。我們的策略如下:
| ● | 打造一家可持續發展的精準皮膚病公司。我們的目標是打造一家領先的精準皮膚病公司,擁有可持續的候選產品流水線。為此,我們 專注於快速推進我們目前的生物治療候選產品線,同時 積極開發其他候選產品。我們目前的每個候選產品 都是專有產品,正在申請專利。我們預計,我們開發的大多數(如果不是全部)基因工程產品候選產品將有資格獲得專利保護。 |
| ● | 推動我們的主要候選產品ATR-12和ATR-04通過臨牀試驗。我們預計 將在2024年下半年報告我們的ATR-12在Netherton綜合徵患者中的1b期臨牀試驗的初步安全性結果,目前正計劃在某些情況下開始我們的ATR-04的1b期試驗2024年第四季度接受EGFRi治療的癌症患者。我們已經批准了ATR-12的IND,預計將在2024年年中提交ATR-04的IND。 |
| ● | 通過有選擇地探索戰略合作伙伴關係,最大限度地發揮我們精準皮膚科項目的潛力, 拓寬我們的平臺。我們打算保留對我們所有核心技術和候選產品的重要權利。但是,我們將繼續評估 戰略合作伙伴可以幫助我們加快技術和候選產品開發的合作機會,提供獲得協同組合的途徑,或者 提供專業知識,使我們能夠擴展到不同類型皮膚病的治療 。我們還可以通過選擇性地許可技術或候選產品來擴大我們平臺的覆蓋範圍。此外,我們還將考慮將我們的某些專有技術授權給我們自己並不追求的適應症和行業 。我們相信,我們的基因工程技術和技術在醫藥領域之外具有適用性,包括化粧品,以及清潔燃料的生成和生物修復。 |
| ● | 利用我們的學術合作伙伴關係。我們目前與弗雷德·哈欽森癌症中心、耶魯大學、傑克遜基因組醫學實驗室和卡內基梅隆大學的研究人員建立了合作伙伴關係。我們擁有弗雷德·哈欽森癌症中心的獨家許可證,其中包括DNA技術,這些技術可以對以前在遺傳上難以解決的菌株進行基因轉化。我們與卡內基·梅隆大學的研究人員合作,建立在人工智能和機器學習技術的基礎上, 預測由我們圖書館的微生物製造的類似藥物的分子。我們與傑克遜實驗室的朱莉婭·吳博士簽訂了持續的科學顧問委員會合同,並通過贊助小鼠實驗的研究協議與傑克遜實驗室進行了合作。 我們希望利用這些合作伙伴關係,並有可能擴大它們或形成其他形式學術合作伙伴關係,以支持我們的工程平臺並擴展我們的研發管道 。 |
| ● | 經驗豐富的管理團隊和董事會. We are led by Francisco D. Salva, our chief executive officer, and Travis Whitfill, our co-founder and chief operating officer, who have more than 35 years of combined experience in the management of biotechnology companies and healthcare investing. Mr. Salva was previously a co-founder of Acerta Pharma, which was sold to AstraZeneca for approximately $6.3 billion in a staged acquisition beginning in 2016. He also worked on the turnaround of Pharmacyclics, which subsequently sold to Abbvie for approximately $21 billion in 2015. Before that, Mr. Salva spent almost a decade in life sciences venture capital. Mr. Whitfill served as associate research scientist and currently serves as assistant professor adjunct at Yale University with appointments in the Departments of Pediatrics and Emergency Medicine. He spent nearly a decade in venture capital as a partner in a biotech-focused venture capital fund, Bios Partners. He has led numerous grant-funded projects, holds nearly a dozen patents and has co-authored over 60 publications. Our board of directors, or Board, is comprised of renowned group of senior executives, scientists and investors in the biotechnology industry. |
| 3 |
我們的微生物文庫和微生物藥物傳遞平臺
共生微生物存在於人體表面或粘膜中,不會損害人類健康。它們作用於宿主的免疫系統,以誘導保護性反應,防止感染病原體的侵襲和侵襲,從而在維持人類許多器官系統的健康方面發揮關鍵作用,特別是在皮膚中。皮膚上分佈着各種各樣的微生物羣落,一平方釐米可以容納多達十億個微生物。這些不同的細菌、真菌、蟎蟲和病毒羣落可以提供對疾病的保護,並在皮膚上形成動態而獨特的生態位。它們共同構成了皮膚微生物羣。
許多由基因驅動的人類疾病在系統上或部分上與特定蛋白質的功能障礙有關,這些蛋白質因突變而缺失或功能惰性。自大約1982年以來,生物製藥行業一直在對細菌微生物中的重組蛋白進行基因工程 ,目的是提供模仿或支持人體正常功能的蛋白質和多肽的療法。幾十年來,絕大多數基因工程一直侷限於初級大腸桿菌以及少數其他細菌 物種,其中許多可以致病,導致感染。相比之下,我們選擇將重點放在表皮葡萄球菌因為它作為一種在皮膚上自然存在的共生微生物具有有益的作用。我們的目標是利用我們的平臺和60多種細菌的內部微生物庫來設計並通過皮膚角質層將共生皮膚細菌直接輸送到目標皮膚。在皮膚的這些更深層次,工程微生物可以產生缺失或惰性的蛋白質,從而解決潛在的疾病原因。
S.和我們的專有微生物文庫
表皮葡萄球菌是一種強有力的治療候選物種,因為皮膚中有許多描述良好的特性。表皮葡萄球菌 是一種革蘭氏陽性細菌,普遍存在於人類皮膚和粘膜菌羣中。作為最早的皮膚殖民者之一, 表皮葡萄球菌在皮膚免疫和維持微生物羣落動態平衡方面起着重要作用。表皮葡萄球菌 已知與宿主有一種有益的皮膚共生關係。該物種對致病菌株 顯示出抑制作用,金黃色葡萄球菌,或金黃色葡萄球菌,以及壓力痤瘡丙酸桿菌,或痤瘡假單胞菌. 表皮葡萄球菌 誘導角質形成細胞產生抗菌肽,並通過免疫細胞信號產生CD4+和CD8+T細胞的非炎性T細胞積聚。T細胞反應誘導損傷後皮膚重新上皮化,加速修復和傷口閉合。基於這些原因,我們認為表皮葡萄球菌作為局部遞送治療性蛋白質的載體提供了幾個優點。
在他們2019年的研究中,世界領先的皮膚微生物組專家Stacy和Belkaid描述了表皮葡萄球菌作為“皮膚微生物區系的‘海報孩子’,它展示了微生物對皮膚生理和健康所能起到的不同功能。”表皮葡萄球菌具有巨大的菌株多樣性,可用於治療目的。在2020年的ONG研究中,朱莉婭·吳的實驗室報告稱,1,482株獨特的表皮葡萄球菌只出現在五個個體身上。這些菌株不僅具有顯著的遺傳多樣性,而且具有較大的表型多樣性。我們相信這種巨大的菌株間差異表皮葡萄球菌可以被利用。為此,我們收集了健康志願者的樣本,以開發和鑑定我們自己的菌株 庫表皮葡萄球菌其中包括900多個獨特的表皮葡萄球菌具有治療用途潛力的菌株。我們已經使用這個微生物文庫對選定的特性進行了篩選,包括抗菌肽分泌,金黃色葡萄球菌殺傷力、抗生素敏感性和其他與治療相關的特徵。我們還收集了圖書館中的其他物種,其中包括大約60種不同的皮膚共生物種,也可以出於治療目的進行篩選。
| 4 |
圖1.Azitra微生物文庫中的代表性物種

我們的微生物文庫的預測性分析
生物製藥行業在鑑定和分離數千種細菌方面取得了成功。然而,只有相對較少的幾個這樣的物種,據信不到20個,已經被改造成生產具有治療潛力的蛋白質或多肽。我們已經與卡內基梅隆大學的研究和開發集團Chia Biosciences,Inc.建立了合作伙伴關係。通過我們與中國生物科學公司的合作,我們能夠使用他們專有的基因組和多肽人工智能和機器學習系統NRPMiner, 來開發和確認我們專有的 菌庫產生的蛋白質、多肽和小分子的天然產物預測。這些預測通過串聯質譜學或核磁共振得到證實。然後將信息反饋給機器學習算法以改進預測。它還可以與現有的2D和3D蛋白質數據庫進行比較 ,以查找我們的產品與現有蛋白質和多肽藥物的結構同源性。我們相信,我們與卡內基 梅隆大學團隊的合作為我們提供了一種可擴展和容忍修改的方法,以加速我們微生物 庫中的治療發現。
我們微生物生產的藥物的交付
將基因工程蛋白運送到皮下靶點的過程受到天然屏障和角質層防禦的阻礙。這是皮膚最外面的一層,它起到了屏障的作用,防止不需要的物質進入身體。為了應對這一挑戰,我們開發了一種專利工藝,能夠以一種繞過通常無法穿透的角質層的方式促進蛋白質的輸送。該策略利用特定微生物滲透到皮膚更深層的能力。在那裏,轉基因微生物充當微型工廠,在需要的地方生產治療性蛋白質或分子。
我們治療皮膚病的蛋白質輸送能力是基於工程技術表皮葡萄球菌和其他微生物分泌蛋白質,將藥物輸送到皮膚。我們相信,任何數量的蛋白質都可以由我們的細菌進行工程和編碼,產生 並輸送到皮膚上,以治療各種皮膚疾病。我們還在其平臺中添加了關鍵的專有功能,以促進蛋白質的交付。該系統的一個關鍵特徵是它繞過了通常無法穿透的皮膚屏障,這是一個局部蛋白質輸送的問題。皮膚屏障由角質層組成,由去核的角質形成細胞封閉,並由許多結構、物理和生化特性形成。其他經皮給藥挑戰是由於蛋白質對酶消化的敏感性,以及疏水錶面和組成角質層的相連角質細胞層造成的溶解和擴散障礙。我們通過利用自然歸位的表皮葡萄球菌角質層以下的層。 在臨牀前研究中,我們表明表皮葡萄球菌棲息在角質層下面的幾層,將蛋白質輸送到更深的表皮。
為了擴展我們的重組蛋白質構建能力,我們獲得了專有技術的獨家許可,該技術可以偽裝我們的基因工程DNA序列,使其能夠在以前難以處理的細菌物種中生產蛋白質。弗雷德·哈欽森癌症中心或弗雷德·哈奇的這項技術擴大了可以轉基因的細菌物種的範圍。它 基於限制修改系統-靜默SyMPL工具集。SyMPL技術平臺使人造DNA對細菌的防禦系統不可見。從理論上講,這種方法可以應用於任何類型的細菌。我們當前的候選產品未採用SyMPL技術平臺,但我們預計未來的部分或全部候選產品將採用此技術平臺。
| 5 |
事實上,所有自然產生的細菌菌株都有稱為限制修飾系統的防禦機制。四種類型的限制修飾系統識別和防禦用於編碼重組蛋白質的外來DNA的插入。S的功能基因工程。表皮炎(以及金黃色葡萄球菌)以前受到限制,因為在這些細菌物種的幾乎所有菌株中都存在I型和IV型限制系統 。這些限制系統識別來自標準克隆擴增系統(例如(E.Coli)並阻礙外來DNA在微生物中的結合。表皮葡萄球菌由於其遺傳上的頑固性,曾被認為是一種“不可轉化”的菌株。然而,我們已經能夠克服S. 表皮‘防禦。
目前的基因工程流程添加了特定的修飾來偽裝人造DNA,以欺騙細菌認為入侵者 是其自身DNA的一部分。此方法通常需要花費相當多的時間和資源來嘗試將正確的偽裝與每個特定的識別主題相匹配。相比之下,Fred Hutch的SyMPL技術平臺是一種系統化的“工程隱身”方法 ,以克服限制修改防禦系統。這些限制修飾防禦系統保護微生物免受外來DNA的影響,並阻礙絕大多數基因工程方法。SyMPL技術平臺基於構建微環DNA質粒的能力,這些DNA質粒缺乏任何目標識別基序,供微生物的防禦系統識別。該技術使用目標細菌基因組序列中的基因組和甲基組來識別限制酶修飾的目標基序。然後將它們從遺傳工具的核苷酸序列中消除硅片。生成的序列用於構建限制 修改、SyMPL工具。這些基因被繁殖,然後用於基因轉化。“通過工程進行隱形” 方法不僅能夠在遺傳上難以處理的細菌菌株中進行轉化,而且它還被證明能夠顯著提高轉化效率。原則性實驗證明,轉基因菌落的產量提高了10,000倍以上。
2022年1月,Fred Hutch向我們授予了SyMPL技術平臺在所有使用領域的全球獨家專利權和非獨家全球專利權使用費許可。有關根據弗雷德·哈奇許可協議獲得的知識產權的更多信息,請參閲標題為“營業執照和知識產權.”
我們的 候選產品
ATR-12治療Netherton綜合徵
ATR-12是我們的專利和正在申請專利的候選藥物,它包含一種新的菌株表皮葡萄球菌該基因經過基因修飾,可以表達和分泌全長蛋白質的活性片段,稱為淋巴上皮型Kazal相關抑制物,或Lekti。它還被設計成營養缺陷型,這意味着它需要配方中的D-丙氨酸營養才能存活和繁殖。這提供了額外的安全級別,防止潛在的系統性感染。ATR-12是一種局部應用,旨在通過用人重組lekti的活性片段 或rhLEKTI-D6替換缺陷的lekti來解決Netherton綜合徵的根本原因,以對抗在Netherton綜合徵患者中觀察到的皮膚絲氨酸蛋白酶活性失調。絲氨酸蛋白酶活性失控導致嚴重的皮膚屏障缺陷,並導致角質形成細胞和免疫細胞釋放促炎和促過敏介質。截至本報告發表之日,還沒有治癒或有效治療Netherton綜合徵的已知療法。 我們相信ATR-12有可能成為有效治療這種皮膚病的第一種療法。根據Barbati和Sun的研究,我們認為ATR-12代表着到2030年年中潛在的2.5億美元的全球銷售機會。
Netherton 綜合徵概述
Netherton綜合徵是一種罕見的常染色體隱性遺傳病,估計每200,000人中就有一人患病,但由於誤診,其患病率可能被低估了。這是一種慢性皮膚疾病,以嚴重的炎症、瘙癢、鱗屑、紅腫和脱水為特徵。出生時患有Netherton綜合徵的嬰兒可能會遭受發育不良的痛苦,據報道,大約十分之一的Netherton綜合徵嬰兒在出生後的第一年死亡。那些倖存下來的人一生都面臨着皮膚病的挑戰,包括紅色、鱗片狀皮膚、頭髮缺陷以及持續高於正常水平的感染和過敏風險。
| 6 |
Netherton綜合徵是由基因突變引起的Spink5基因,它編碼淋巴上皮型Kazal相關抑制物,或lekti。LEKTI的功能是抑制表皮中的酶,如激肽釋放酶5、7和14,或KLK5、KLK7和KLK14,它們促進皮膚細胞在一個稱為脱皮的過程中脱落。當Lekti缺失或活動減少時,會導致皮膚過度脱皮,皮膚敏感、開放,並出現紅色和鱗片。伴隨而來的是角質層的脱離,導致嚴重的屏障功能障礙、脱水和潛在的環境因素,如化學物質。與健康志願者相比,Netherton綜合徵患者的皮膚組織病理學和免疫熒光染色顯示皮膚中沒有Lekti和異常,如角化過度、表皮增厚和嗜鹼性角化透明質顆粒減少。

圖2:Netherton綜合徵的病理生理學和LETKI缺乏症
Netherton綜合症的嚴重程度從輕微的皮膚紅斑到危及生命不等。疾病的嚴重程度與皮膚上LEKTI功能喪失的程度直接相關。Netherton綜合徵在出生後不久出現,在嬰兒出生的第一年最為嚴重。在大多數情況下,第一年以上的存活是常見的,但這種疾病的影響是一個終生的挑戰。
截至本報告之日 ,內瑟頓綜合徵尚無已知的治癒方法,治療選擇有限。治療Netherton綜合徵嚴重皮膚表現的皮膚病學幹預措施 包括保濕劑、局部皮質類固醇和鈣調磷酸酶抑制劑, 所有這些措施都受到限制,因為它們不能提供持續的治療。考慮到新生兒階段疾病的嚴重程度,除了治療這些患者經常出現的感染外,還需要體液/電解質 和飲食支持。雖然免疫球蛋白治療治療與Netherton綜合徵相關的免疫缺陷的成功率有限,但目前無法持續修復由LEKTI失調引起的皮膚屏障缺陷。
我們的解決方案-ATR-12用於治療Netherton綜合徵
ATR-12是一種外用軟膏,含有表皮葡萄球菌菌株SE351,已經經過基因改造,表達了來自 染色體的lekti。SE351菌株還被設計成對D-丙氨酸具有營養缺陷性,這意味着如果沒有配方中提供的外源D-丙氨酸營養,它就不能生存。ATR-12旨在通過將缺乏/功能失調的lekti替換為具有活性的重組人全長蛋白片段rhLEKTI-D6來解決Netherton綜合徵的根本原因。治療包括將ATR-12應用於受影響的地區。由SE351生產的rhLEKTI-D6將對抗Netherton綜合徵患者觀察到的皮膚絲氨酸蛋白酶活性失調,恢復皮膚屏障功能,減少炎症。我們認為,這種方法的重要優點之一是,隨着時間的推移,有可能將rhLEKTI-D6輸送到角質層和表皮的下層,這是Netherton綜合徵患者調節失調的主要部位。
| 7 |
表皮葡萄球菌SE351是從我們的專利菌株庫中挑選出來的將重組人LEKTI-D6運送到皮膚上的菌株。 該菌株的特點是毒力低,是一種不形成生物膜的宿主菌株。為了進一步提高ATR-12的安全性,我們已經對D-丙氨酸的微生物進行了改造,使其具有營養缺陷性。工程營養缺陷症的關鍵優勢是能夠控制生長和阻止潛在的感染。全長人類LETKI是一種15個結構域的蛋白質(145 KDa),太大了,無法可靠地在細菌中表達和分泌。有證據表明,全長蛋白片段足以對抗Netherton綜合徵患者觀察到的失調的皮膚絲氨酸蛋白酶活性,我們選擇D6在表皮葡萄球菌.
在2020年5月,我們從FDA獲得了ATR-12的罕見兒科疾病稱號。因此,如果我們能夠在兒科方面獲得FDA對ATR-12的批准,我們將有資格收到優先審查憑證,我們可以使用該憑證在六個月的加速期內獲得FDA對此或其他候選藥物的新藥申請或生物製品許可證申請的審查 。這些 代金券通常可以轉讓,有些代金券的售價已超過1億美元。
ATR-12的臨牀前 數據
截至本報告之日 ,我們已經進行了幾次 體內和離體這些實驗共同支持ATR—12作為內瑟頓綜合徵患者的疾病改善療法的潛在療效。轉基因菌株S.配製的ATR—12製劑中使用的表皮被稱為SE351。於二零二一年,我們進行了 體外培養評估外源應用SE351在無菌重建人類表皮中的能力的研究。SE351成功地在重建的人類表皮上殖民化, 此外, 表皮葡萄球菌在沒有D—丙氨酸存在的情況下發生了定殖,證實了必須為 SE351在皮膚上生長提供D—丙氨酸。這些數據表明,SE351能夠在人體皮膚上定殖,並且可以通過補充 D—丙氨酸來控制定殖。
此外, 體外培養使用添加了KLK5的健康志願者的膠帶剝離皮膚來模擬Netherton綜合徵的研究表明,稀釋的SE351培養上清液可劑量依賴性地抑制胰蛋白酶樣活性(KLK5活性)。當加入含有≥0.5%的SE351培養上清液時,Netherton綜合徵代謝物中的胰酶樣活性恢復到正常健康水平。

圖 3:離體人皮帶提取液輔以病級KLK5活性建立Netherton綜合徵模型
在 此外,來自離體豬皮膚模型顯示,單次局部注射3個劑量水平的ATR-12可導致活性rhLEKTI-D6分泌 。最後,來自離體健康人體皮膚模型顯示,單次局部劑量的ATR-12最大預期劑量為109Cfu/g可將足夠活性的rhLEKTI-D6送入角質層的下層,有效地抑制激肽釋放酶5(KLK5),達到Netherton綜合徵患者的典型水平。
| 8 |
具體地説,來自離體健康的人體皮膚模型顯示,單次局部注射ATR-12的最大預期劑量為109每克集落形成單位(CFU/g)可將足夠活性的rhLEKTI-D6送入角質層的下層 ,有效抑制KLK5,達到Netherton綜合徵患者的典型水平。提取層中Lekti 活度的量來自於離體用安慰劑和ATR—12處理的人皮膚。採集 在皮膚貼敷後立即進行(T = 0小時,白色條)或在30 ℃下孵育8小時後(T = 8小時,黑色條)。通過將pmol量加入安慰劑(灰色條)或ATR—12(黑色條)樣品的第1—30層,獲得總 LEKTI活性水平。 數據為3個獨立樣本(N = 3)的平均值±標準差(SD)。使用 雙因素方差分析進行統計分析,**代表p

圖 4:安慰劑和ATR-12處理的皮膚樣品在孵育0和8小時後的LETKI活性
此外,單次治療劑量的ATR-12在24小時的孵育中產生的LEKTI活性是8小時孵育的~2倍。 這表明隨着時間的推移,ATR-12持續產生功能性的重組人LEKTI-D6。
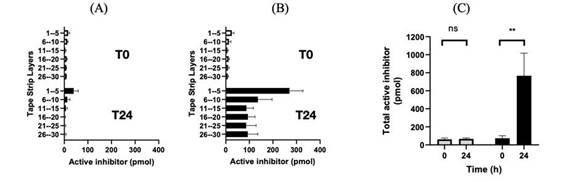
圖5:24小時孵育後安慰劑和ATR-12處理的皮膚樣本中的LETKI活性
在試管中Azitra進行的化學計量學研究表明,KLK5需要在rhLEKTI-D6蛋白上有2個摩爾當量的抑制 (IC測量50)。歷史研究表明,Netherton綜合徵患者的KLK5含量是正常皮膚的~6倍。這相當於每一特定區域60 pmoL的KLK5。以上研究表明,SE351在8小時內釋放了350 pmol的重組人LEKTI-D6,在24小時內釋放了700 pmol的重組人LEKTI-D6。這比預計的活動所需金額高出5至11倍。
| 9 |

圖 6:離體抑制KLK5的LEKTI-D6的化學計量比
在2022年,我們獲得了與FDA的IND前通信,目的是討論我們建議的ATR-12監管途徑,並從FDA獲得導致提交和接受ATR-12的IND申請的臨牀前計劃指導。2022年12月,我們提交了一份IND申請,對Netherton綜合徵患者進行ATR-12的首次人體試驗。我們IND建議對Netherton綜合徵患者的ATR-12進行1b期多中心、隨機、雙盲、單劑量水平的安慰劑對照臨牀研究。主要終點 是安全性,次要終點將包括療效和藥代動力學信號。探索性終點包括免疫和炎症機制生物標記物。2023年1月27日,我們收到FDA的通知,關於擬議的1b期臨牀試驗的研究可能會繼續進行,初步安全結果預計在2024年下半年。
ATR-04用於治療EGFRi相關性皮疹
ATR-04是我們的專利和正在申請專利的候選藥物,它包含一種新的菌株表皮葡萄球菌,SE484,經基因改造為營養缺陷型D-丙氨酸。ATR-04是一種局部應用,旨在解決接受表皮生長因子受體抑制劑(EGFRi)靶向治療的癌症患者所經歷的丘疹/丘疹。我們相信,這款候選產品 代表着2030年前10億美元的潛在全球銷售機會。
EGFRi-關聯的 皮疹概述
靶向癌症療法為診斷為各種腫瘤類型的患者帶來了顯著的治療進展,但它們也與獨特的皮膚病毒性有關,這些毒性可能會阻礙治療努力,並給患者造成嚴重的身體和心理不適 。預防和處理這些毒性可能會使患者更好地耐受治療,延長治療時間,從而有可能從藥物中獲得最大的臨牀益處。其中一類靶向癌症治療包括EGFR抑制劑。EGFR是細胞表面的一種蛋白質,有助於細胞生長和分裂。它也是某些惡性腫瘤的關鍵因素,它的活性促進了腫瘤的生長、侵襲和轉移。全身暴露於EGFRi製劑會抑制靶腫瘤部位的EGFR,同時也會抑制全身的EGFR。在皮膚中,EGFR調節多種角質形成細胞的功能,包括增殖、黏附、遷移、存活和分化。因此,抑制皮膚中的EGFR會導致不良皮膚反應,這使得患者很難堅持這些有效的治療方法。
皮膚病毒性是EGFRi靶向治療中最常見的副作用之一。丘疹是EGFRi治療中最早也是最常見的皮膚科不良事件,通常發生在50%-80%的患者中,具體取決於藥物、正在治療的癌症和治療方案。丘疹皮疹的出現是一種劑量依賴的皮膚藥物反應,通常在最初的一到兩週內出現,在治療後三到四周達到高峯。皮疹的強度可能在兩週後開始減輕,但可以在EGFRi治療的整個過程中持續。皮疹的臨牀特徵是細嫩的紅斑丘疹,幾天後演變為膿皰疹,然後在面部、頭皮、胸部和上背部形成結痂。皮疹通常伴有嚴重的乾燥症,有時還會出現嚴重的皮膚細菌感染,主要是金黃色葡萄球菌。雖然大多數皮疹被認為是輕度到中度,但也有一些是嚴重的。在許多情況下,皮疹會導致嚴重的生活質量問題,甚至可能導致EGFRi治療中斷或停止.
| 10 |
目前接受EGFRi治療的患者的皮疹治療標準因皮疹的嚴重程度而異。通常,皮膚保濕劑、局部類固醇和多西環素從EGFRi治療開始就預防性使用,並在整個治療期內持續使用。如果皮疹繼續發展,就需要口服類固醇和/或抗生素。然而,已知有與這些輔助療法相關的全身不良反應,我們認為醫生和患者試圖 限制其使用。此外,研究表明,口服抗生素會導致腸道微生物羣的破壞,進而導致靶向治療的有效性降低,包括EGFRi。鑑於這些患者持續出現皮疹的高發病率,以及與抗生素對這些治療的潛在影響相關的擔憂,我們認為顯然存在着對額外安全有效的輔助治療的醫療需求,以解決丘疹-丘疹皮疹。
基於佐藤和利希滕貝格進行的研究,細胞因子,白介素36伽馬,或白介素36γ,以及金黃色葡萄球菌與接受EGFR治療的患者所經歷的皮疹相關,並在其中發揮重要作用。IL-36γ在接受EGFR i治療的患者皮膚中升高。2020年,Satoh使用基因表達譜確定IL-36γ是EGFRi/MEKi皮膚毒性的候選驅動因素。它由EGFR抑制誘導, 痤瘡皮膚桿菌協同誘導皮膚中的IL-36γ,隨後誘導IL-8和NF-κB,導致皮膚嗜中性粒細胞。IL-36γ可能是治療EGFRi誘導的皮疹的關鍵治療靶點。2013年,Lichtenberger注意到EGFRi治療患者(n=107)的細菌感染率較高(70%),並提出了EGFR消融導致 金黃色葡萄球菌-在小鼠中誘導感染。該研究指出,大多數患者的 金黃色葡萄球菌(54%).從機制上講,作者注意到EGFRi治療損害宿主防禦:抗微生物肽的表達受損,特別是抗 金黃色葡萄球菌以及緊密連接的表達降低。此外,該研究顯示EGFR消融導致皮膚屏障缺陷以及受損的皮膚免疫應答和細胞因子表達。
我們的解決方案-ATR-04用於治療EGFRi相關性皮疹
ATR-04是我們用於治療EGFRi相關皮疹的配方候選藥物產品。它包括一種新的營養缺陷型菌株表皮葡萄球菌從我們的微生物菌種庫中選擇的菌株,基於所需的IL-36γ還原特性和抑制金黃色葡萄球菌以及它的生物膜。目前的鉛菌株被稱為SE484。然後,我們將SE484進行基因工程,使其成為營養缺乏型D-丙氨酸,並創造出我們的候選藥物產品ATR-04。
從我們的微生物文庫中選擇SE484是基於關鍵特性,如對IL-36γ的抑制以及對S 金色。總之,我們預計這些作用機制將顯著降低接受EGFRi治療的患者的皮疹嚴重程度。
我們 相信ATR-04有可能解決目前治療EGFRi相關皮疹的侷限性:
| ● | 減少了抗生素的使用。從我們對臨牀醫生和主要意見領袖的調查來看,從業者不願給接受EGFRi治療的患者開全身抗生素。這些 患者通常可以服用抗生素超過12個月,並遭受與抗生素相關的不良事件。我們相信ATR-04將減少這些患者對抗生素的需求,並導致較少的不良事件,因為EGFRi和抗生素的使用。 |
| ● | 改善了 EGFRi合規性。高達20%的接受EGFRi治療的患者因不良事件(主要是皮疹)而停止治療。我們相信,我們可以降低接受EGFRi治療的患者的停用率,從而提高依從性。 |
| ● | 更高的生活質量。許多接受EGFRi治療的患者報告説,由於不良事件和丘疹結節皮疹,生活質量較差。目前的治療方案不能充分減少這些不良事件。我們相信,在接受EGFRi治療的患者中使用ATR-04將會減輕皮疹的嚴重程度,從而提高生活質量。 |
| 11 |
ATR-04的臨牀前數據
我們根據安全性(例如,缺乏抗生素耐藥性)和生物活性(例如,IL-36γ抑制和活性與金黃色葡萄球菌),並指定SE484為我們的主要候選菌株。在將該菌株設計為D-丙氨酸的營養缺陷型菌株後,我們提名該候選菌株作為ATR-04藥物產品配方中的活性微生物。
EGFR相關皮疹是一種以皮膚髮紅、瘙癢和刺激為特徵的疾病,由某些癌症治療引起。 基因表達譜(Satoh Et Al 2020)顯示,與健康捐贈者的皮膚相比,EGFR相關皮疹患者的皮膚活檢樣本中細胞因子IL-36γ(IL-36γ)和IL-8水平升高。這些是促炎細胞因子,是免疫系統的信號分子,可增加免疫反應的強度,並可能導致組織損傷。 除了細胞因子水平升高外,接受EGFRi治療的患者還會損害皮膚屏障功能。感染致病菌株 金黃色葡萄球菌加重EGFRi誘導的皮膚病。
我們的工作重點是確定一個表皮葡萄球菌菌株,一種皮膚共生體,可降低IL-36γ水平,從而減少與EGFRi相關的皮疹。我們推測,許多生活在人類皮膚上的細菌物種可能在那裏生存下來,因為它們已經進化出減少人類免疫系統對它們存在的反應的方法,我們或許能夠識別出一種存活下來的人類皮膚共生細菌,從而特別地降低IL-36γ的活性。
要 確定這樣的表皮葡萄球菌菌株,我們開發了一種體外培養檢測培養的人皮膚細胞產生IL-36、γ和IL-8的水平。我們使用的細胞系被稱為HaCaT,它來自人類角質形成細胞,角質形成細胞是表皮中的一種細胞類型。為了模擬表皮生長因子受體相關疾病皮膚的炎症表型,用免疫刺激劑多肌苷:多胞苷或多聚I:C刺激HaCaT細胞,使其分泌高水平的IL-36γ和IL-8。本試驗用來鑑定和評價不同菌株的能力。表皮葡萄球菌可降低IL-36γ和IL-8水平。
我們根據安全性(例如,缺乏抗生素耐藥性)和生物活性(IL-36γ抑制和抗病毒活性)篩選了100多個菌株金黃色葡萄球菌),並指定SE484為我們的主要候選菌株。在將該菌株改造成對D-丙氨酸具有營養缺陷型 ,以便只有在提供D-丙氨酸的情況下才能生長之後,我們還消除了一個抗生物質抗性基因。然後,我們提名該候選微生物作為ATR-04藥品配方中的活性微生物。
為了在類皮膚模型上測試SE484降低IL-36γ的能力,使用厄洛替尼誘導重建的人表皮分泌IL-36γ。同時應用SE484和厄洛替尼可將IL-36γ降低到與未用厄洛替尼治療的相似的水平,這表明SE484作用於皮膚模型以減少這種促炎細胞因子。圖7顯示了兩個測試SE484降低IL-36γ的實驗結果。在圖7A中,將來自SE484培養物的無細胞上清液(CFs)應用於RHE,而在圖7B中,將SE484的活細胞(1x108CFU或1x109CFU),檢測SE484降低IL-36γ的能力。在這兩種情況下,無細胞培養上清液或SE484細胞,厄洛替尼誘導的IL-36γ 水平均降低。
| 12 |
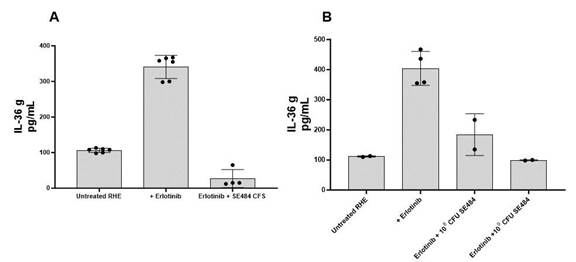
圖7.SE484對RHE的抗IL-36G活性將重建的人表皮或RHE單獨用1 mM厄洛替尼處理72小時,或用來自SE484培養(A)的無細胞培養上清(CFs)處理,或用約10 mM厄洛替尼處理72小時。8或109SE484(B)的CFU。用酶聯免疫吸附試驗檢測培養上清液中IL-36γ水平。

圖8.Poly I:C誘導的IL-8被SE484的CS降低。來自SE484的培養基可阻止聚I:C(紅色箭頭)對IL-8的刺激和釋放。使用Poly I:C的抑制劑作為對照(藍色箭頭)。數據代表兩個獨立的 實驗。CS=培養上清液。
圖8顯示了SE484培養上清對PolyI:C誘導的IL-8的抑制作用,與IL-36γ相似,當PolyI:C 加入HaCaT細胞時,IL-8也被分泌,比本底高出數倍(如未處理的HaCaT和經SE484處理的HaCaT所見)。然而,在SE484存在的情況下,檢測到較低水平的IL-8,從而進一步證明瞭SE484抑制參與EGFRi相關皮疹的促炎 途徑的有效性。
| 13 |
我們的 結果顯示表皮葡萄球菌菌株從健康人志願者中分離得到的SE484可以降低HaCaT細胞產生的IL-36γ和IL-8的水平(分別見圖7和圖8),從而有助於治療EGFRi-相關皮疹。除了抗IL-36γ特性外,SE484對不同的甲氧西林耐藥株也具有廣泛的活性S 金色,或MRSA,菌株類型以及對甲氧西林敏感金黃色葡萄球菌,或MSSA。SE484降低IL-36γ/IL-8水平及其抗腫瘤活性的研究金黃色葡萄球菌經過改造的D-丙氨酸營養缺陷症使我們能夠提名菌株SE484作為ATR-04藥物產品配方中的活性微生物,以形成治療的基礎並降低EGFRi皮疹的嚴重程度。
我們 還表明,SE484可幫助體外培養抑制對甲氧西林耐藥的已知毒力菌株USA300和對甲氧西林敏感的MSSA。以下數據表明,ATR-04降低了致病能力金黃色葡萄球菌細菌 種,用於生長和引發EGFRi皮疹患者的感染。

圖9.表達Epidermin的SE484殺死金黃色葡萄球菌在體外瓊脂平板上具有與莫匹羅星相似的活性。
我們 正在提議在患者中對ATR—04製劑中的SE 484進行初步研究。預期這是一項在開始EGFRi治療的結直腸癌或頭頸癌患者中進行的Ib期多中心、隨機、雙盲、單劑量、安慰劑對照試驗。 主要終點是安全性,次要終點將包括療效和生活質量或QoL我們計劃在2024年年中提交 IND。待FDA批准IND後,我們預計將於2024年第四季度開始1b期臨牀試驗。
ATR-01治療尋常型魚鱗病
ATR-01是我們用於治療尋常型魚鱗病的候選藥物。該項目目前正在研究人類微絲蛋白的專利和正在申請專利的新型工程片段。ATR-01正在開發為一種局部應用,旨在治療尋常型魚鱗病,這是一種慢性鱗狀皮膚病,估計發病率和患病率為1/250,使美國的患者總數達到130萬人。尋常型魚鱗病是由編碼微絲蛋白的基因功能缺失突變引起的。利用蛋白質工程的合成生物學工具,我們在微絲蛋白上附加了一種細胞穿透肽,這有助於更深層次地將微絲蛋白輸送到皮膚。這是為了克服皮膚屏障的不可穿透性,否則會限制局部蛋白質的傳遞。
尋常型魚鱗病概述
尋常型魚鱗病,或IV,是一種慢性、乾燥性、鱗片狀皮膚病,估計發病率和患病率為1/250,這使得美國的患者總數達到130萬人。IV的臨牀特徵通常出現在2個月左右,包括全身乾燥和腹部、胸部和四肢伸肌表面突出的細小、白色到灰色的鱗片。 雖然罕見,但一些IV患者也會出現汗量減少和熱耐受。長期以來,IV的發病機制一直被認為是表皮角質透明質顆粒的減少或數量減少,甚至完全不存在。此外,IV患者患特應性皮炎、哮喘和過敏的風險增加。
| 14 |
尋常型魚鱗病是一種常染色體半顯性遺傳病,由編碼微絲蛋白的基因功能缺失突變引起。微絲蛋白是一種必需的結構蛋白,來源於蛋白原蛋白,它在角質層分解成單獨的微絲蛋白單位。這些 通過與角質形成細胞細胞骨架中的角蛋白和其他中間絲蛋白結合來增強皮膚屏障。許多研究 已經發現了功能喪失突變外掛在IV患者中,這些突變與角蛋白細絲紊亂、皮膚屏障缺陷和角質層微骨折相關,從而導致經皮變應原增敏。此外,絲狀蛋白及其分解產物在皮膚中還具有顯著的附加功能,包括滋潤皮膚(通過吸濕性氨基酸或“天然保濕因子”),影響抗菌分子的產生(特別是針對S 金色)和保持有益的脂類分佈和皮膚的PH值。
治療IV幾乎沒有有效的療法。目前IV的治療選擇主要包括局部水分蒸發抑制劑 (例如氯化鈉、尿素、乳酸、水楊酸),以及少量的保濕劑(例如甘油、丙二醇)。也可以使用局部維甲酸來減緩人體皮膚細胞的產生。然而,長期使用維甲酸並不理想。特別令人擔憂的是所有維甲酸的致畸作用,這限制了它們在有生育潛力的婦女中的使用。長期使用維甲酸治療的慢性毒性可能會導致骨骼異常。此外,兒童長期使用維甲酸可能會抑制他們的生長。值得注意的是,許多IV患者由於自我意識和社交尷尬而顯著降低了生活質量,並對家庭生活、教育/職業生活甚至休閒/體育活動產生了負面影響。
我們治療尋常型魚鱗病的解決方案-ATR-01
現已知,IV是由編碼微絲蛋白的基因功能喪失突變引起的,導致角蛋白細絲組織紊亂、皮膚屏障缺陷和角質層微骨折,以及細菌和病毒皮膚感染導致經皮變應原增敏。我們正在開發ATR-01作為IV的一種新的治療方式,直接針對這種疾病的病理生理學。ATR-01由人Flg蛋白的Flg9-10功能單位和一個附着的細胞穿透肽組成。目標 是通過局部塗抹和通過細胞穿透肽更深入地滲透皮膚來補充hFlg的穩定釋放。
ATR-01的臨牀前 數據
人類Flg單位(結構域9-10)在人體皮膚外植體(來自整形手術)上進行了評估離體。外植體的皮膚屏障被反覆剝離膠帶破壞,導致經皮水分損失或TEWL值較正常皮膚顯著增加。如下例所示,每天局部應用含有細胞穿透肽的人微絲蛋白單元5天后,TEWL迅速改善,呈劑量依賴性(未顯示),提示皮膚屏障得到改善。因此,局部注射重組hFLG單位和細胞穿透肽可以改善/加速受損的人皮膚屏障的修復。

| 15 |
圖 10:剝離的磁帶上的局部微絲膠合應用離體使用人類微絲凝聚蛋白後的人體皮膚。
最後, 我們已經證明,外用微絲蛋白可以改善微絲蛋白缺陷小鼠模型的皮膚屏障缺陷。將重組小鼠微絲蛋白,或mFlg,應用於片狀尾巴或FT小鼠的尾部(一種在細絲研磨基因),每天一次,持續2周(50微克總蛋白質/尾部或15.2微克總蛋白質/釐米2)。與賦形劑(“基線”組)相比,每日服用mFlg顯著改善了FT小鼠在治療時的經皮水分損失(FT+Flg組)。X軸上的第三個 組是正常、對照、野生型組(WT),它沒有細絲研磨吉恩被擊倒了。重組mFlg聯合細胞穿透肽處理受損小鼠皮膚可改善受損小鼠皮膚屏障(見下圖A)。此外,對小鼠尾部切片的表皮的組織學分析顯示,使用mFlg處理有改善角質層厚度的趨勢(見下圖B)。在這張圖中,Y軸表示角質層增厚,角質層在超過正常厚度後開始分裂或結垢。用mFlg治療後,6個樣本中有4個樣本的厚度有所改善。

其他 個潛在候選產品
除了我們的三個主要候選產品外,我們的目標是開發廣泛的候選產品組合,專注於擴大我們的精確皮膚病平臺的應用 。我們擁有發現和開發精準皮膚病治療產品的專有平臺。我們的平臺圍繞由大約1,500個獨特的細菌菌株組成的微生物文庫構建,以篩選獨特的治療特性,並利用微生物基因技術來分析、預測和設計皮膚微生物產生的蛋白質、多肽和分子。通過SyMPL技術的獨家許可,我們對難處理的微生物物種進行基因工程的能力得到了獨一無二的利用。
拜耳 聯合開發協議
2019年12月,我們與拜耳簽訂了聯合開發協議(JDA),根據該協議,我們同意聯合開發從我們的專有微生物文庫中挑選出來的某些菌株。我們和拜耳已經同意在身份識別和在試管中和離體用於外用製劑的微生物菌株的特性。拜耳在簽署聯合開發協議時向我們一次性支付了150,000美元 ,並同意償還我們的開發費用。2021年10月,拜耳擴大了期權協議 ,並支付了375,000美元用於額外的表徵工作。我們已授予拜耳獲得JDA項下開發活動的最多六個品種的獨家版税許可的選擇權,包括任何相關專利權的獨家版税許可 。在對數百個菌株進行篩選後,我們和拜耳選擇了兩個特定的菌株進行進一步研究在試管中和離體表徵,我們打算開發作為潛在的非處方化粧品產品。我們在2023年第四季度完成了 表徵工作並將數據交付給拜耳,屆時拜耳有12個月的時間來行使 其許可菌株和相關專利的選擇權。表徵研究結束並將數據 交付給拜耳後,JDA將結束,但拜耳可選擇許可菌株和相關專利。截至本報告日期,我們 尚未與拜耳談判商業許可協議,我們將不會這樣做,直到拜耳行使其選擇權 以獲得獨家附帶使用費的許可。
| 16 |
2020年9月,拜耳的風險投資集團Leaps by Bayer購買了我們B系列優先股800萬美元。
銷售 和市場營銷
鑑於我們所處的發展階段,我們尚未建立商業組織或分銷能力。我們計劃在美國建立有重點的 能力,將我們的開發計劃商業化,重點是用於皮膚病治療的活生物治療產品和重組蛋白 ,我們相信,在美國,患者羣體和針對我們目標適應症的醫學專家足夠集中,使我們能夠通過有針對性的銷售團隊有效地推廣我們的產品,如果批准進行商業銷售的話。在商業化可能對我們來説資本效率較低的其他市場,我們可能會有選擇地尋求與第三方的戰略合作 ,以最大限度地發揮我們候選產品的商業潛力。
製造業
我們 不擁有或運營用於生產當前候選產品的製造設施。我們目前依賴第三方合同製造商提供我們所需的所有原材料、製造設備和活性藥物成分,以及我們的 臨牀前研究和臨牀試驗。雖然我們能夠在我們的康涅狄格州格羅頓工廠為我們的臨牀試驗 生產成品,但我們將依賴第三方生產我們用於商業銷售的成品。我們與這些第三方中的任何一方都沒有長期的 協議。我們目前也沒有關於製造3期臨牀試驗或商業用品的任何合同關係。我們打算與第三方合同製造商和一個或多個備份製造商簽訂協議,以用於未來的生產。我們正在分析為未來的開發和我們開發的任何產品的商業 量建立製造能力的可行性。此類產品將需要在符合FDA和我們正在尋求批准的其他司法管轄區監管機構的要求的設施和工藝中進行生產。
競爭
生物製藥行業的特點是技術快速進步、競爭激烈以及對專利藥物的高度重視。雖然我們相信我們的知識、經驗和科學資源為我們提供了競爭優勢,但我們面臨着來自許多不同來源的潛在競爭,包括其他生物製藥公司、學術機構和政府機構 以及公共和私人研究機構。我們成功開發和商業化的任何候選藥物都將與現有療法和未來可能出現的新療法展開競爭。
Netherton綜合徵
關於Netherton綜合徵,到目前為止還沒有藥物被FDA批准,特別是針對Netherton綜合徵。標準護理包括使用温和/柔軟的非洗滌劑液體潔面油清潔皮膚,最好是酸性(5)。由於Netherton綜合徵患者的皮膚最常見的是乾燥、鱗屑和脱皮,因此也經常使用潤膚劑和保濕霜。水楊酸、尿素或α-羥基酸等角質溶解藥物通常具有刺激性,Netherton綜合徵患者對其耐受性不佳。Netherton綜合徵患者的皮膚易受細菌感染。有限的感染用局部抗生素治療,治療時間很短,最長可達2周。口服抗生素也可以用來治療病原體金黃色葡萄球菌和鏈球菌可以導致更極端感染的菌株。漂白劑也被推薦每週洗兩到三次,因為它們有抗菌作用。外用皮質類固醇通常用於治療與非感染性Netherton綜合徵皮損相關的炎症和過度增殖,但由於其不良反應,必須加以限制。這些不良事件包括氨基酸尿症、庫欣綜合徵、皮膚萎縮、腎上腺功能不全、生長遲緩、高血壓和虛弱。過度使用局部類固醇甚至會導致角質層的喪失,從而加劇皮膚屏障的缺陷。全身性維甲酸對Netherton綜合徵顯示出不同程度的療效,但也具有骨毒性和致畸作用。局部的鈣調神經磷酸酶抑制劑已被用於減少紅斑(紅腫),但患者 已表現出快速反應,並隨着治療時間的延長而降低療效。這些免疫調節劑還存在嚴重不良影響的風險,包括增加感染、腫脹、灼熱感和刺痛感的風險。光療法(窄帶UVB(NB-UVB)和補骨脂素-UVA(PUVA))也已被研究用於Netherton綜合徵患者,但由於其可能導致紅斑和皮膚癌風險增加而受到限制。
| 17 |
我們 還意識到Sixera Pharma於2021年12月在歐洲啟動了一項臨牀試驗,使用SXR—1096(一種局部小分子KLK抑制劑) 治療Netherton綜合徵。此外,Quoin Pharmaceuticals於2022年12月和2023年3月啟動了兩項使用局部小分子廣譜 絲氨酸蛋白酶抑制劑QRX 003的臨牀試驗。勃林格殷格翰還在招募一項使用spesolimab(一種IL—36抑制劑)治療Netherton綜合徵的II/III期臨牀試驗。Krystal Biotech、MatriSys和BridgeBio報告説,他們正在開發處於臨牀前階段的Netherton綜合徵項目。
如果我們的競爭對手開發和商業化比ATR-12或我們可能開發的任何其他藥物更安全、更有效、副作用更少或更少、更方便或更便宜的藥物,我們的商業機會可能會減少或消失。 我們的競爭對手也可能比我們更快地獲得FDA或其他監管機構對其藥物的批准, 這可能會使我們的競爭對手在我們能夠進入市場之前建立強大的市場地位。與我們相比,我們正在競爭或未來可能競爭的許多公司在研發、製造、臨牀前試驗、進行臨牀試驗、獲得監管批准和營銷 藥品方面擁有更多的財務資源和專業知識。製藥和生物技術行業的合併和收購可能會導致更多的資源集中在我們數量較少的競爭對手中。規模較小或處於早期階段的公司也可能成為重要的競爭對手,尤其是通過與大公司和成熟公司的合作安排。這些競爭對手還在招聘和留住合格的科學和管理人員、為臨牀 試驗建立臨牀試驗站點和受試者註冊以及在獲取與我們的計劃互補或可能需要的技術方面與我們展開競爭。
EGFRi相關 皮疹
迄今為止,FDA尚未專門批准任何藥物用於治療EGFRi相關皮疹。大多數持續接受抗EGFR治療的患者(估計高達90%)發生皮膚病不良事件,尤其是丘疹膿皰性皮疹、 瘙癢(瘙癢)、乾燥症(乾燥)和甲溝炎(指甲感染)。丘疹膿皰或痤瘡樣皮疹是EGFR在皮膚上最常見的不良 事件。這種皮疹在許多患者中對EGFRi治療的依從性產生負面影響。嚴重病例需調整劑量或停止 治療。由於循證對照試驗仍然非常稀少,EGFRi皮膚毒性的治療主要 依賴於醫師經驗和專家共識會議的建議。因此,在EGFRi皮疹的臨牀治療中存在地理差異 甚至不一致。對於痤瘡樣皮疹,在歐洲避免使用局部皮質類固醇,但在美國經常使用。此外,局部治療經常根據個體患者定製 ,並可能根據具體情況進行更改。沒有任何局部治療方案普遍適用於所有患者。
我們 瞭解到以下第二階段計劃正在開發針對EGFRi相關皮疹的候選研究藥物。Lutris Pharma正在美國和以色列開發外用B-Raf抑制劑LUT014。大同藥業正在韓國開發DWP708。
知識產權
概述
我們 積極尋求通過各種方式保護我們的專有技術、發明、發明改進和其他對我們的業務發展具有重要商業意義的知識產權,例如尋求、維護和捍衞專利權,無論是內部開發還是從第三方獲得許可。我們還可以依靠與我們的專有技術平臺相關的商業祕密和技術訣竅,依靠持續的技術創新和未來的許可機會來發展、加強和保持我們在基因治療領域的地位,這可能對我們的業務發展至關重要。還可以通過數據獨佔性、市場獨佔性和專利期延長提供額外的監管保護 。
| 18 |
截至本報告之日,我們擁有或獨家許可了3項已頒發的美國專利、12項未決的美國專利申請、3項未決的PCT申請以及57項對我們的業務發展至關重要的其他外國專利和專利申請。
我們的 政策是提交專利申請,以保護專有技術、發明和對發明的改進以及可能對我們業務發展具有重要商業意義的其他知識 產權。我們還打算尋求額外的專利保護或 依靠專有技術或商業祕密權利來保護可能用於生產和開發我們的活體生物 產品的其他技術。如下所述,我們是獨家許可協議的一方,該協議授予我們在我們的 活體生物產品以及我們產品的製造和開發中使用特定技術的權利。
我們的 專利組合
我們的專利組合廣泛涵蓋治療細菌的藥物組合物,這些藥物組合物含有用於治療異常皮膚狀況的治療細菌,以及製造和使用這些重組細菌的方法。在我們最廣泛的申請中,我們獲得了一項美國專利 ,該專利保護了使用一種細菌菌株治療異常皮膚狀況的藥物組合物,該細菌菌株表達了具有治療效果的重組多肽。這項專利將於2035年5月到期。具體地説,本專利涉及含有一種或多種以下細菌菌株的藥物組合物:雙歧桿菌、短桿菌、丙酸桿菌、乳球菌、鏈球菌、葡萄球菌、乳桿菌、腸球菌、小球菌屬、明串珠菌或葡萄球菌,其中該細菌菌株經過改造可生產用於治療異常皮膚狀況的治療性多肽。我們相信,這項專利為我們使用重組細菌治療皮膚病和疾病提供了廣泛的保護。到2035年5月到期。
針對我們最先進項目的專利申請摘要如下。
ATR-12
我們的 ATR-12候選產品擁有3項已頒發的美國專利、7項未決的美國專利和31項未決的外國專利 和專利申請。這些專利和專利申請代表了十個權利要求家族,其中包括表皮葡萄球菌重組治療性多肽的表達--營養缺陷型表皮葡萄球菌、 和重組表皮葡萄球菌表達治療性lekti蛋白的菌株,以及ATR-12的配方。發佈的其中一項美國專利涉及一種含有治療異常皮膚疾病的治療性多肽的重組細菌菌株,將於2035年到期。第二項頒發的美國專利涵蓋了一種營養缺乏症表皮葡萄球菌2039年到期如果要 從未決專利申請中授予額外專利,它們將在2035年至2044年之間到期。
ATR-04
我們的 ATR-12候選產品受一項已頒發的美國專利、兩項待決的美國專利申請和17項待決的外國申請的約束。 這些專利和專利申請代表了針對營養缺陷型細菌及其治療疾病用途的兩類權利要求。我們有一項已頒發的美國專利,涵蓋ATR-04。如果授予更多專利,它們也將在2039年到期 。
| 19 |
專利期限和期限延長
個別專利有不同的期限,具體期限取決於專利申請的提交日期或專利頒發日期以及獲得專利的國家/地區的專利的法律期限。通常,為在美國提交的申請頒發的實用新型專利的有效期為自非臨時專利申請的最早有效申請之日起20年。此外,在 某些情況下,美國專利的有效期可以延長,以重新獲得美國專利商標局或USPTO的一部分,延遲發佈專利,以及因FDA監管審查期間而實際失去的一部分期限 。但是,對於FDA的組件,恢復期限不能超過5年,恢復期限不能從FDA批准之日起延長 14年以上。此外,只有一項適用於批准的藥物的專利有資格延期, 並且只有那些涉及批准的藥物、其使用方法或製造方法的權利要求才能延長。外國專利的有效期根據適用的當地法律規定有所不同,但通常也是自最早生效日期起計的20年。根據美國專利商標局和各個外國司法管轄區的要求,專利的所有税金、年金或維護費都必須及時支付,以便專利在這段時間內保持有效。
專利提供的實際保護可能因國家/地區的不同產品而有所不同,並可能取決於許多因素,包括專利的類型、其覆蓋範圍、與監管相關的延期的可用性、特定國家/地區的法律 補救措施的可用性以及專利的有效性和可執行性。
我們的專利和專利申請可能會受到其他人的程序或法律挑戰。我們可能無法獲得、維護和 保護開展業務所需的知識產權,並且我們可能會受到侵犯或以其他方式侵犯他人知識產權的索賠,這可能會對我們的業務造成實質性損害。有關更多信息,請參閲標題為 “風險因素-與我們的知識產權有關的風險.”
交易祕密和訣竅
我們 還可能依靠商業祕密、技術訣竅、持續的技術創新和機密信息來發展和維護我們的 專有地位,並保護我們業務中不受專利 保護或我們認為不適合專利保護的方面,包括我們生產活性生物治療產品的專有工藝。我們尋求通過與我們的員工、顧問、科學顧問、承包商和其他可能可以訪問專有信息的人簽訂保密協議和發明轉讓協議來保護我們的專有技術和流程,根據這些協議,他們有義務將他們在受僱期間或服務期限內做出的發明轉讓給我們。這些協議可能會被違反,我們可能沒有足夠的 任何違反的補救措施。此外,我們的商業祕密可能會被競爭對手知曉或獨立發現。對於我們的承包商、商業合作伙伴、合作者、員工和顧問在為我們工作時使用他人擁有的知識產權的程度,可能會就相關或由此產生的專有技術和發明的權利產生爭議。有關更多信息,請參閲 標題為“風險因素-與我們的知識產權有關的風險.”
我們 還試圖通過維護我們場所的物理安全以及我們信息技術系統的物理和電子安全來保護我們的數據和商業祕密的完整性和機密性。
與弗雷德·哈奇森癌症中心簽訂獨家許可協議
2022年1月,我們與弗雷德·哈欽森癌症中心或弗雷德·哈奇簽訂了獨家許可協議。根據我們與Fred Hutch的協議,我們在由Fred Hutch開發和擁有的與SyMPL技術相關的某些專利下獲得了全球獨家許可,可以開發、製造、分銷、分銷、使用、研究、改進、進口、提供銷售、銷售和以其他方式商業化此類專利涵蓋的產品。此類獨家許可受Fred Hutch和美國政府保留的某些權利的約束。弗雷德·哈奇授予我們的專利權包括兩個專利申請系列 ,這些專利申請針對的是繞過限制修飾系統的方法,以便更容易地將異種DNA引入工程微生物。 這些專利申請以及這些申請頒發的任何專利將使我們能夠生產更多用於疾病治療的改良微生物。我們當前的候選產品未採用SyMPL技術平臺,但我們預計部分或全部未來候選產品將採用SyMPL技術平臺。如果發行,這兩個家族將分別於2037年和2040年到期。
考慮到根據Fred Hutch許可協議授予我們的許可,我們象徵性地向Fred Hutch支付了預付款。此外, 我們需要向Fred Hutch支付某些開發和商業里程碑付款,並按許可產品的淨銷售額支付個位數版税 。弗雷德·哈奇協議還要求我們向弗雷德·哈奇報銷許可專利的起訴和維護費用。
| 20 |
根據弗雷德·哈奇許可協議,我們必須以商業上合理的努力,通過一個積極而勤奮的計劃,將許可產品推向市場,以利用許可的專利權。Fred Hutch許可協議的期限將持續 ,直至(I)許可專利到期或(Ii)自許可產品首次銷售之日起十年內。如事先書面通知Fred Hutch,我們可隨時終止Fred Hutch許可協議。如果我們嚴重違反協議並且未能在指定的治癒期限內糾正此類違規行為,或者如果 我們破產或資不抵債,則Fred Hutch有權終止該許可協議。有關根據弗雷德·哈奇許可協議獲得的知識產權的更多信息,請參閲標題為“營業執照和知識產權.”
我們 還在美國和七個國家/地區擁有我們公司名稱和設計的註冊商標。
政府法規
製藥公司受到外國、聯邦、州和當地機構的廣泛監管,如美國FDA,以及全球大多數國家和地區的各種類似機構。藥品的研究、開發、測試、製造、分銷、包裝、標籤、儲存、記錄保存、營銷和銷售在美國和其他國家均受政府監管。此外, 在美國,我們必須遵守FDA制定的規章制度,要求提交數據,表明我們的候選產品 是安全有效的,並根據cGMP規定生產。如果我們不遵守適用的要求, 我們可能會被罰款,政府可能會拒絕批准我們的營銷申請,或者允許我們製造或營銷我們的候選產品, 我們可能會受到刑事起訴。我們、我們的製造商和臨牀研究組織也可能受到其他外國、聯邦、州和當地法律的監管,包括但不限於美國《職業安全與健康法》、《資源保護和回收法》、《清潔空氣法》、進出口和海關法規以及其他 國家的法律法規。美國政府加強了針對國內和國際非法營銷行為的執法活動。 因此,製藥公司必須確保其遵守《反海外腐敗法》和聯邦醫療欺詐 以及包括《虛假索賠法》在內的濫用法律。
這些 監管要求會影響我們的運營,並且因國家/地區的不同而有所不同,因此確保一個國家/地區獲得適用的監管批准並不意味着另一個國家/地區的批准。審批程序成本高,人力密集, 通常持續多年,需要高技能和專業資源。
FDA 上市審批流程
在美國,我們的候選產品根據聯邦食品、藥物和化粧品法案(FDCA)、公共衞生服務法案(PHSA)和FDA頒佈的法規作為生物製品受到FDA的監管。在產品開發流程(包括臨牀前測試、臨牀測試、審批流程或審批後流程)期間的任何時間未能遵守適用要求 可能會使申請人在進行臨牀試驗、監管審查和批准和/或行政或司法制裁方面受到延誤。這些制裁可能包括但不限於FDA拒絕允許申請人繼續進行臨牀測試、拒絕批准未決申請、吊銷或吊銷執照、撤回批准、警告信、不良宣傳、客户通知、產品召回、產品扣押、拒絕批准出口或進口批准、完全或部分暫停生產或分銷、同意法令、禁令、罰款,以及由FDA或美國司法部或其他政府實體提起的民事或刑事調查和處罰。
新生物在美國上市前通常需要採取的步驟通常包括:
| ● | 完成臨牀前實驗室測試和根據FDA現行良好實驗室操作規程進行的動物研究; |
| 21 |
| ● | 向FDA提交IND,該IND必須在臨牀試驗開始之前生效,並且必須 每年更新或發生重大變化; |
| ● | 在試驗開始前,每個治療地點的獨立機構審查委員會或倫理委員會批准 ; |
| ● | 執行充分和良好控制的人體臨牀試驗,以確定擬議生物產品候選的安全性、純度和效力,以確定其擬議的使用適應症; |
| ● | 提交支持安全性和有效性的數據,以及關於臨牀開發和擬議標籤中產品的製造和成分的詳細信息。 |
| ● | 在所有關鍵臨牀試驗完成後,準備並向FDA提交BLA; |
| ● | 令人滿意的 完成FDA諮詢委員會的審查,如果適用; |
| ● | FDA在收到BLA後60天內作出的提交審查申請的決定; |
| ● | 令人滿意的 完成FDA對生產建議產品的一個或多個製造設施的批准前檢查,以評估是否符合cGMP標準,並確保這些設施:方法和控制足以保持生物製品的持續安全性、純度和效力,以及選定的臨牀調查地點,以評估對良好臨牀實踐或GCP的遵從性; |
| ● | 令人滿意的 完成FDA對非臨牀和臨牀試驗地點的任何審計,以確保符合CGP要求和支持BLA的臨牀數據的完整性; |
| ● | 支付使用費,並確保FDA批准擬議的使用適應症的BLA; |
| ● | FDA審查和批准BLA,以允許在美國使用的特定適應症的產品進行商業營銷;以及 |
| ● | 遵守任何審批後要求,包括REMS和FDA要求的任何審批後研究 。 |
臨牀前研究和探索性新藥應用
臨牀前試驗包括對產品的化學成分、配方和穩定性進行實驗室評估,以及對動物進行動物研究以評估其潛在的療效和毒性。進行臨牀前試驗和用於試驗的化合物配方必須符合聯邦法規和要求。臨牀前試驗的結果連同生產信息和分析數據一起作為IND申請的一部分提交給FDA。即使在提交IND申請後,某些臨牀前試驗仍可能繼續。 IND在FDA收到後30天自動生效,除非在此之前FDA對擬議的臨牀試驗的產品或進行提出擔憂或問題,包括擔心人類研究志願者將面臨不合理的健康風險 。在這種情況下,IND贊助商和FDA必須在臨牀試驗開始之前解決FDA的任何懸而未決的問題。
因此,提交IND可能導致FDA不允許臨牀試驗開始,或允許臨牀試驗按發起人最初在IND中指定的條款開始。如果FDA在最初的30天期間或在IND過程中的任何時候提出擔憂或問題,它可以選擇實施部分或全部臨牀擱置。FDA發佈的這一命令將推遲擬議的臨牀試驗或導致正在進行的臨牀試驗的一個階段的啟動延遲,直到所有懸而未決的問題得到充分解決,FDA已通知該公司可能會繼續進行調查。這可能會導致在及時完成計劃的臨牀試驗方面出現重大延誤或困難。
| 22 |
臨牀試驗
臨牀 試驗涉及根據良好臨牀實踐或GCP要求,在合格的首席研究人員的監督下,將研究產品候選給健康志願者或要接受治療的疾病患者 。臨牀 研究是在詳細説明研究目標、哪些類型的患者可以參加研究、測試和程序的時間表、藥物、劑量和研究時間、以及用於監測安全性的參數和要評估的療效標準的方案下進行的。作為IND過程的一部分,每項臨牀研究的方案和任何後續方案修改都必須提交給FDA。
希望在美國境外進行臨牀試驗的贊助商可以(但不需要)獲得FDA的授權,根據IND進行臨牀試驗。如果在美國境外的臨牀試驗不是根據IND進行的,只要臨牀試驗的進行符合GCP的精神,並符合國際臨牀研究道德行為指南《赫爾辛基宣言》和/或進行臨牀試驗的一個或多個國家的法律法規,贊助商可以將臨牀試驗的數據提交給FDA以支持BLA,以為臨牀試驗的參與者提供更大保護的 。
IRB還必須集中或單獨審查將進行臨牀試驗的每個機構的每項臨牀試驗。IRB將考慮臨牀試驗設計、患者知情同意、倫理因素、人類受試者的安全、該機構可能的責任,以及在適當情況下保護人類受試者的隱私。IRB必須按照FDA的規定進行操作。FDA、IRB或臨牀試驗贊助商或首席研究人員可因各種原因在任何時間暫停或中止臨牀試驗,包括髮現臨牀試驗未按照FDA要求進行,或受試者或患者面臨不可接受的健康風險。臨牀測試還必須滿足廣泛的GCP規則和知情同意的要求。此外,一些臨牀研究由臨牀研究贊助商組織的一個獨立的合格專家小組監督,稱為數據安全監測委員會或委員會。根據對研究中某些數據的訪問,該小組建議是否可以在指定的檢查點進行試驗。臨牀研究贊助商 還可以根據不斷變化的業務目標和/或競爭環境暫停或終止臨牀試驗。
臨牀試驗通常分三個連續階段進行,但這些階段可能會重疊或合併。詳細説明臨牀試驗階段結果的年度進度必須提交給FDA。
| ● | 階段 1臨牀試驗通常在健康志願者的小組中進行,以評估 各種給藥方案和藥代動力學的安全性和耐受性。對於某些產品 用於孤兒、嚴重或危及生命的疾病,特別是當產品毒性過大時 為了給健康人施用,可以在個體中進行初始臨牀試驗 患有特定疾病,該疾病指示使用測試產品。這些審判 患者通常被稱為1b期試驗。如果它們包含一個設計,以建立 在特定劑量下,它們通常被稱為Ib/2a期臨牀試驗。不過, 通常需要額外的II期(有時稱為2b期)臨牀試驗來完善 選擇用於關鍵的III期臨牀試驗的最終劑量。 |
| ● | 階段 2臨牀試驗通常在有限的患者人羣中進行,以確定 可能的不良反應和安全風險,評估候選產品的有效性 針對特定的目標適應症,並確定耐受性和最佳劑量。多個 申辦者可進行II期臨牀試驗,以在開始前獲取相關信息 更大、更昂貴的III期臨牀試驗。 |
| ● | 階段 3如果II期臨牀試驗證明劑量範圍 候選產品的潛在有效性和可接受的安全性特徵。階段 進行了3項臨牀試驗,以進一步評估更多患者的劑量, 提供臨牀療效的實質性證據,並進一步測試擴展的安全性 在多個地理上分散的臨牀試驗中心和不同的患者人羣。 可以設計一項控制良好、統計學穩健的III期試驗來提供數據 監管機構將用來決定是否批准,如果批准, 如何適當地給藥物貼標籤:此類III期研究被稱為“關鍵”。 |
| 23 |
如果FDA認為臨牀研究沒有按照FDA的要求進行,或者參與者面臨不可接受的健康風險,FDA可以在任何時候下令暫時或永久停止臨牀研究或施加其他制裁。在某些情況下,FDA可能會批准候選產品的BLA,但要求贊助商進行額外的臨牀試驗,以在BLA批准後進一步評估該藥物的安全性和有效性。此類批准後試驗通常被稱為4期臨牀試驗。這些研究用於從預期治療適應症患者的治療中獲得其他經驗數據,並在根據加速審批法規批准的藥物或生物製品的情況下記錄臨牀益處。 如果FDA批准了產品,而公司正在進行不需要批准的臨牀試驗,則公司可以 使用這些臨牀試驗的數據來滿足任何第四階段臨牀試驗的全部或部分要求,或請求更改 產品標籤。未能對進行4期臨牀試驗進行盡職調查可能會導致撤回對產品的批准 。
符合cGMP要求
當候選產品通過臨牀測試階段時,生產流程將進一步定義、細化、控制和驗證。 FDA要求的控制和驗證級別隨着臨牀研究的進展而提高。FDA通常不會批准BLA申請,除非它確定製造工藝和設施完全符合cGMP要求,並且 能夠確保產品在所要求的規格內一致生產。PHSA強調了對屬性無法精確定義的生物製品等產品進行生產控制的重要性。
我們 和我們賴以生產我們的候選產品及其各自成分(包括活性藥物成分或原料藥)的第三方製造商必須遵守藥品的製造、包裝和標籤符合cGMP的要求。為了符合cGMP要求,製造商必須繼續花費時間、金錢和精力來滿足與人員、設施、設備、生產和工藝、標籤和包裝、質量控制、記錄保存和其他要求有關的要求。
製造商和其他涉及產品製造和分銷的企業也必須向FDA和某些州監管機構註冊。美國和非美國製造企業在首次參與制造過程時,必須註冊並向FDA提供附加信息。由未經註冊的工廠製造或進口的任何產品,無論是在美國還是非美國,都被視為在FDCA下有錯誤的品牌。機構可能會受到政府當局的定期突擊檢查,以確保遵守cGMP和其他法律。檢查必須遵循“基於風險的時間表” ,這可能會導致某些機構更頻繁地被檢查。製造商可能還必須應要求提供有關其工廠的電子或實物記錄。推遲、拒絕、限制或拒絕FDA的檢查可能會導致產品被視為摻假。
BLA 提交和審查
假設 根據所有適用的法規要求完成了所有要求的測試,則將以BLA的形式向FDA提交有關候選產品的詳細信息,請求批准針對一個或多個適應症銷售該產品,並支付 使用費,除非放棄。BLA包括從相關的非臨牀和臨牀研究中獲得的所有相關數據,包括陰性或不明確的結果以及陽性結果,以及有關化學、製造、對照和建議的 標籤等的詳細信息。為支持上市審批,提交的數據必須在質量和數量上足以確定候選產品的安全性和有效性,使FDA滿意。FDA還在批准BLA之前對製造商和實驗室進行預批准 檢查。
如果BLA提交的申請被接受,FDA將開始對BLA進行深入審查。根據《處方藥使用費法案》(PDUFA),FDA的目標是在提交後十個月內完成初步審查並對申請人做出迴應,除非申請 涉及未滿足的醫療需求,或涉及嚴重或危及生命的適應症,在這種情況下,目標可能是在提交BLA後六個月內 。但是,PDUFA目標日期不是法定要求,FDA的迴應通常比最初的PDUFA目標日期晚幾個月。此外,如果FDA要求或BLA發起人以其他方式提供關於BLA中已經提供的信息的補充信息或澄清,則PDUFA項下的審查過程和目標答覆日期可被延長。因此,BLA審查 過程可能非常漫長。在審查BLA期間,FDA可以將申請提交給諮詢委員會進行審查、評估和建議,以確定是否應該批准申請。FDA不受諮詢委員會的建議的約束,但它通常遵循這樣的建議。來自臨牀研究的數據並不總是決定性的,FDA和/或其任命的任何諮詢委員會可能會以不同於申請者的方式解釋數據。
| 24 |
在 FDA評估BLA並檢查將生產和測試藥品和/或其原料藥的製造設施後,它 將批准藥物產品的商業銷售,並提供特定適應症的處方信息,或發佈完整的 回覆信,表明申請尚未準備好批准,並説明為確保BLA獲得批准必須滿足的條件。如果完整的回覆信需要額外的數據,而申請人隨後提交了該數據,FDA仍可能最終判定BLA不符合其批准標準。FDA還可以通過風險評估和緩解策略或REMS計劃來批准BLA以降低風險,其中可能包括藥物指南、醫生溝通計劃或確保安全使用的要素,如受限分發方法、患者登記和其他風險最小化工具。 FDA還可能以更改建議的標籤、制定適當的控制和規範或承諾進行上市後測試為條件進行批准。此類上市後測試可能包括第四階段臨牀試驗和監測,以便 在批准後進一步評估和監測產品的安全性和有效性。對嚴重或危及生命的適應症的產品的監管批准可能需要對臨牀研究的參與者進行長期跟蹤,以確定該藥物的總體生存益處 。
如果FDA批准了我們的候選產品之一,我們將被要求遵守批准後的一些監管要求。 我們將被要求向FDA報告某些不良反應和生產問題,提供最新的安全性和有效性信息,並遵守有關我們任何候選產品的廣告和促銷標籤的要求。此外,質量控制和製造程序在批准後必須繼續符合cGMP,FDA定期檢查 製造設施以評估是否符合cGMP,這規定了廣泛的程序性,實質性和記錄保存要求。 如果我們尋求對批准的產品進行某些更改,例如某些製造更改,我們可能需要FDA審查和批准 才能實施更改。
雖然 醫生可以將產品用於未經FDA批准的適應症,但我們不能將產品用於未經批准的適應症 。確保FDA批准新適應症類似於批准原始適應症的流程 ,除其他事項外,還需要提交充分且受控的研究數據,以證明該產品在新適應症中的安全性和有效性。即使進行了這樣的研究,FDA也可能不會及時批准任何變化,或者根本不批准。
FDA還可能要求進行上市後測試或第四階段測試,以及風險最小化行動計劃和監督,以監控可能限制產品分銷或使用的批准產品或場所條件或批准的影響。
快速跟蹤、突破性治療和優先審查指定
FDA有權指定某些產品進行快速審查,如果這些產品旨在滿足在治療嚴重或危及生命的疾病或狀況或在緊急情況下未得到滿足的醫療需求。這些計劃是快速通道指定、突破性治療指定和優先審查指定。
具體而言,如果一種產品是用於治療嚴重或危及生命的疾病或病症,並且有可能滿足此類疾病或病症的未得到滿足的醫療需求,則FDA可指定該產品進行快速通道審查,無論該產品是單獨使用還是與一種或多種其他產品聯合使用。對於Fast Track產品,贊助商可能會與FDA有更多的互動,FDA可能會在申請完成之前對Fast Track產品申請的部分進行審查。如果FDA在對贊助商提交的臨牀數據進行初步評估後確定快速通道產品可能有效,則可以進行滾動審查。 贊助商還必須提供提交剩餘信息的時間表,並且贊助商必須 支付適用的用户費用。然而,FDA審查快速通道申請的時間段目標直到申請的最後 部分提交後才開始。此外,如果FDA認為快速通道指定不再得到臨牀試驗過程中出現的數據的支持,則FDA可能會撤回該指定。
| 25 |
此外,2012年,國會頒佈了《食品和藥物管理局安全與創新法案》,簡稱FDASIA。這項法律建立了一個新的監管方案,允許加快對被指定為“突破性療法”的產品的審查。如果一種產品旨在單獨或與一個或多個其他產品聯合用於治療嚴重或危及生命的疾病或狀況,並且初步臨牀證據表明該產品可能在一個或多個臨牀重要終點顯示出比現有 療法顯著改善的效果,例如在臨牀開發早期觀察到顯著的治療效果,則該產品可被指定為 突破性療法。 FDA可能會針對突破性療法採取某些行動,包括在整個開發過程中與贊助商舉行會議;及時向產品贊助商提供有關開發和批准的建議;讓更多的高級人員參與評審流程;為評審團隊指派一名跨學科的項目負責人;以及採取其他步驟以高效的方式設計臨牀試驗。
此外,如果一種產品治療嚴重疾病,並且如果獲得批准,將在安全性或有效性方面有顯著改善,則FDA可指定該產品進行優先審查。FDA根據具體情況確定,與其他可用的療法相比,建議的產品是否有顯著改善。顯著的改善可能表現為:有證據表明在治療某種疾病方面提高了 有效性,消除或大幅減少了限制治療的產物反應,有記錄的 患者依從性的提高可能導致嚴重結果的改善,以及新的 亞羣的安全性和有效性的證據。優先指定的目的是將整體注意力和資源引導到對此類申請的評估上,並將FDA對營銷申請採取行動的目標從10個月縮短到6個月。
此外,如果美國政府已指定實際或潛在的緊急情況,衞生與公眾服務部部長可授權銷售未經批准的藥品和生物製品。在指定緊急情況後,FDA可以根據FDCA建立的標準,為特定產品的使用頒發緊急使用授權。EUA是特定於產品的,並受特定的 條件和限制。一旦作為EUA基礎的緊急情況結束,那麼EUA就會終止。
兒科 罕見病指定和優先審查憑證
根據修訂後的FDCA,FDA鼓勵開發符合“罕見兒科疾病”定義的藥物和生物製品。“定義為一種嚴重的或危及生命的疾病,其嚴重的危及生命的表現主要影響從出生到18歲的個人,該疾病在美國影響不到200,000人,或者在美國影響到200,000人或更多人,並且沒有合理的預期在美國開發和製造治療此類疾病或疾病的藥物或生物製劑的成本將從在美國銷售此類藥物或生物製劑中獲得。罕見兒科疾病候選產品的 贊助商可能有資格獲得優惠券,該優惠券可用於在罕見兒科疾病藥物產品批准之日後獲得後續人類藥物或生物應用的優先審查 ,稱為優先審查優惠券,或PRV。贊助商可以在提交其保密協議或BLA之前向FDA申請罕見兒科疾病的指定。一種罕見的兒科疾病指定並不保證贊助商在其NDA或BLA獲得批准後會收到PRV。此外,選擇不提交罕見兒科疾病指定請求的贊助商,如果他們請求原始憑證,則在其營銷申請獲得批准 後仍可收到PRV。市場推廣申請,並滿足所有資格條件 。如果收到PRV,它可能會被出售或轉讓不限次數。國會已將PRV計劃延長至2024年9月30日,並有可能批准PRV至2026年。
審批後條例
一旦獲得監管機構批准的產品上市或現有產品的新適應症,贊助商將被要求 遵守批准後的監管要求,包括FDA可能作為批准條件 強加的任何批准後要求。贊助商將被要求向FDA報告某些不良反應和生產問題,提供最新的安全性和有效性信息,並遵守有關廣告和促銷標籤要求的要求。製造商及其某些分包商必須向FDA和某些州機構註冊其機構,並接受FDA和某些州機構的定期突擊檢查,以瞭解是否符合持續的法規要求,包括對藥品製造商施加某些程序和文件要求的cGMP法規。因此,贊助商及其第三方製造商必須繼續在生產和質量控制方面投入時間、金錢和精力,以保持 遵守cGMP法規和其他法規要求。
| 26 |
產品也可能需要正式批次發佈,這意味着製造商需要對 產品的每個批次進行某些測試,然後才能發佈分銷。如果產品需要正式發佈,製造商必須向FDA提交每個批次的樣品,以及顯示該批次生產歷史摘要和製造商對該批次進行的所有測試結果的發佈協議。此外,FDA可能還會對一些 產品的批次進行某些驗證性測試,然後再放行批次進行分銷。最後,FDA將進行與藥品的安全性、純度、效力和有效性有關的實驗室研究。
批准後,如果沒有遵守監管要求和標準,或者產品上市後出現問題,FDA可能會撤回批准。如果後來發現產品存在以前未知的問題,包括未預料到的嚴重程度或頻率的不良事件,或生產工藝,或未能遵守法規要求,可能會 導致修訂批准的標籤以添加新的安全信息;實施上市後研究或臨牀試驗以評估新的安全風險;或根據REMS計劃實施分銷或其他限制。除其他事項外,其他潛在後果包括:
| ● | 限制 在產品的銷售或生產過程中,完全從 市場或產品召回; |
| ● | 罰款, 批准後臨牀試驗的警告信或擱置; |
| ● | 拒絕 FDA批准待決的BLA或已批准BLA的補充,或暫停或撤銷 產品許可證批准; |
| ● | 產品 扣押、扣留或拒絕準許進口或出口產品;或 |
| ● | 禁令或施加民事或刑事處罰。 |
FDA對投放市場的產品的營銷、標籤、廣告和促銷進行嚴格管理。藥品和生物製品 只能針對批准的適應症並根據批准的標籤的規定進行推廣。FDA和其他機構 積極執行禁止推廣非標籤用途的法律和法規,被發現以不正當方式推廣非標籤用途的公司可能會承擔重大責任。
孤兒 藥品名稱
根據《孤兒藥品法》,FDA可以授予一種藥物孤兒稱號,該藥物旨在治療在美國影響少於200,000人的罕見疾病或疾病,或在其他有限的情況下。孤兒藥物指定(ODD)向擁有將特定產品推向市場的ODD的公司規定了七年的市場排他性,獨立於專利保護。此外,開發孤兒藥物的公司有資格享受某些激勵措施,包括對合格的臨牀測試給予税收抵免。此外,已獲得孤兒藥物指定的產品的BLA 不受處方藥使用費的限制,除非申請包括 藥物指定用於治療罕見疾病或病症以外的其他適應症。
| 27 |
為了獲得排他性,如果具有孤兒藥物指定的產品隨後獲得了FDA對其具有此類指定的疾病或情況的第一次批准 ,該產品有權獲得孤兒藥物排他性,這意味着FDA在七年內不得批准任何其他申請在同一適應症內銷售相同的活性部分,除非在有限的情況下,例如 另一種藥物顯示出優於具有孤兒排他性的藥物的臨牀優勢。此外,醫生可能會開出用於非標籤用途的產品 ,從而破壞我們的排他性。如果競爭對手先於我們獲得了對相同適應症的相同活性部分的批准,則孤立藥物獨佔可能會在 七年內阻止我們的某個候選產品獲得批准,除非我們能夠證明我們的產品在臨牀上是優越的。
贊助商可以為以前未獲批准的產品申請孤兒藥物指定,或為已上市的產品申請新的孤兒藥物指定。 此外,如果贊助商能夠提出其 產品可能在臨牀上優於第一個批准的產品的合理假設,則該產品與已批准的孤兒藥物相同的產品可以申請並獲得針對相同罕見疾病或疾病的後續產品的孤兒藥物指定。多個贊助商可以因相同的罕見疾病或疾病獲得同一產品的孤兒藥物指定,但每個尋求孤兒藥物指定的贊助商必須提交完整的孤兒藥物指定申請,並且只有第一個獲得該藥物的孤兒適應症批准的贊助商才能獲得市場排他性, 有效地阻止了FDA批准同一藥物和相同適應症的競爭對手正在開發的產品,除非 競爭對手能夠證明正在開發的產品在臨牀上優於批准的產品,或者批准的 產品供應不足。為了允許FDA結束另一家制造商的孤兒排他期,FDA必須確定該製造商已經通過證明後一種藥物更安全、更有效,或者 在其他方面對患者護理做出了重大貢獻,從而證明瞭該製造商的臨牀優勢。
專營期從FDA批准上市申請之日開始,僅適用於該產品已被指定的 適應症。FDA可能會批准同一產品用於不同用途的第二次申請,或隨後針對同一適應症的不同藥物的 申請。指定孤兒藥物既不會縮短藥物的開發時間或監管審查時間,也不會在監管審查或批准過程中給藥物帶來任何優勢。
我們 可能計劃在美國、歐盟和其他特定產品感興趣的地區為我們的一些候選產品申請孤兒藥物指定和獨家經營權。我們不能保證我們在任何司法管轄區的任何產品都會獲得孤兒藥物稱號 。即使我們能夠獲得產品的孤兒藥物稱號,我們也不能確保該產品將獲得 批准,我們是否能夠在獲得批准後獲得孤兒藥物獨家經營權(如果有的話),或者我們是否能夠保持授予的任何獨家專利權 。
生物仿製藥和排他性
2010年3月23日簽署成為法律的《患者保護和平價醫療法案》(ACA)包括一個副標題,名為《2009年價格競爭和創新法案》(BPCIA)。BPCIA建立了一個管理方案,授權FDA批准生物仿製藥和可互換的生物仿製藥。FDA已經發布了幾份指導文件草案,概述了審查和批准生物仿製藥的方法。與生物製品更大且往往更復雜的結構相關的複雜性,以及製造此類產品的工藝 ,對實施構成了重大障礙,FDA仍在制定這些障礙。
根據《生物產品檢驗法》,製造商可以提交一份生物製品的許可申請,該生物製品與先前批准的生物製品或參比產品具有生物相似性或互換性。為了讓FDA批准生物相似產品,必須發現參考產品和建議的生物相似產品在安全性、純度和效力方面沒有臨牀上有意義的差異。為使FDA批准生物相似產品可與參考產品互換,該機構必須發現該生物相似產品可預期產生與參考產品相同的臨牀結果,並且(對於多次給藥的產品)生物製劑和參考生物製劑可在先前給藥後 在不增加安全風險或相對於單獨使用參考生物製劑而降低療效的情況下進行切換。
根據BPCIA,生物相似產品的申請必須在參考產品獲得批准之日起4年後才能提交給FDA。FDA可能在參考產品獲得批准之日起12年後才會批准生物相似產品。 即使一種產品被認為是有資格獨家銷售的參考產品,如果FDA批准該產品的完整BLA,該產品包含贊助商自己的臨牀前數據和來自充分的臨牀試驗和良好控制的臨牀試驗的數據,以證明其產品的安全性、純度和有效性,則另一家公司可以銷售該產品的競爭版本 。BPCIA還為被批准為可互換產品的生物仿製藥設立了某些排他性期限。
| 28 |
美國以外的法規
為了在美國境外銷售任何產品,公司還必須遵守其他國家/地區和司法管轄區關於質量、安全性和有效性的眾多且各不相同的監管要求,其中包括臨牀試驗、營銷授權、商業銷售和藥品分銷。無論產品是否獲得FDA批准,該公司 都需要獲得類似非美國監管機構的必要批准,然後才能在這些國家或司法管轄區開始臨牀試驗或產品營銷。審批流程最終因國家和司法管轄區而異 ,可能涉及額外的產品測試和額外的行政審查期。在其他國家和司法管轄區獲得批准所需的時間可能與獲得FDA批准所需的時間不同,甚至可能更長。在一個國家/地區或司法管轄區獲得監管批准並不能確保在另一個國家/地區獲得監管批准,但在一個國家/地區 或司法管轄區未能或延遲獲得監管批准可能會對其他國家/地區的監管流程產生負面影響。
歐盟的法規和銷售授權
歐洲藥品管理局(簡稱EMA)是歐盟或歐盟的科學機構,負責協調對藥品和生物製品等新的和批准的醫藥產品進行評估和監測。它負責對歐盟營銷授權申請進行科學評估,並制定技術指導並向贊助商提供科學建議。
歐盟的醫藥產品審批流程與美國的流程大致相同,通常也包括圓滿完成以下各項:
| ● | 臨牀前 實驗室試驗、動物研究和製劑研究均按照 適用的歐盟藥物非臨牀研究質量管理規範法規; |
| ● | 提交 歐盟成員國的相關監管機構或國家監管機構,臨牀試驗 每個臨牀試驗的試驗申請或CTA,必須在人類臨牀試驗之前獲得批准 審判可以開始; |
| ● | 性能 充分且控制良好的臨牀試驗,以確定該藥物的安全性和有效性 每個建議適應症的產品; |
| ● | 提交 上市許可申請或MAA的相關國家主管部門,其中 包括支持安全性和有效性的數據以及生產的詳細信息 臨牀開發中產品的成分和擬定標籤; |
| ● | 滿意 相關國家主管部門完成對生產設施的檢查 或設施,包括第三方的設施,在那裏生產產品,以評估 符合cGMP; |
| ● | 潛力 對生成數據的非臨牀和臨牀試驗中心進行稽查,以支持 MAA;及 |
| ● | 審核 並在進行任何商業營銷之前獲得MAA相關國家機構的批准, 產品的銷售或發貨。 |
| 29 |
臨牀前研究
臨牀前試驗包括對產品化學成分、配方和穩定性的實驗室評估,以及對動物潛在療效和毒性的評估研究。進行臨牀前試驗和用於試驗的化合物配方必須符合歐盟相關法規和要求。臨牀前試驗的結果,連同相關的生產信息和分析數據,在尋求批准開始臨牀試驗時作為CTA的一部分提交,在尋求營銷授權時與MAA一起提交。
臨牀試驗批准
在歐盟進行臨牀試驗(包括CGCP)的要求 在當前的臨牀試驗指令2001/20/EC和 GCP指令2005/28/EC中執行。根據修訂後的2001/20/EC號指令和2005/28/EC號指令,歐盟已通過成員國的國家立法實施了臨牀試驗審批制度。根據這一制度,必須獲得計劃進行試驗的國家主管部門的批准,如果要在多個成員國進行臨牀試驗,則必須在多個成員國獲得批准。為此,必須提交CTA,該文件必須有調查藥品檔案或IMPD,以及指令2001/20/EC和指令2005/28/EC以及其他適用的指南文件所規定的進一步支持信息。此外,只有在主管倫理委員會對該國的臨牀試驗申請發表了積極的意見後,才能開始臨牀試驗。
2022年1月31日,《臨牀試驗條例》(EU)第536/2014號取代了現行的《臨牀試驗指令2001/20/EC》。為確保臨牀試驗規則在整個歐盟範圍內保持一致,通過了《臨牀試驗條例》(EU)第536/2014號,作為一項直接適用於所有歐盟成員國的條例。然而,《臨牀試驗指令2001/20/EC》仍將在《臨牀試驗條例》生效之日起三年內適用於(I)在申請前提交的臨牀試驗申請,以及(Ii)如果發起人選擇舊系統,在申請後一年內提交的臨牀試驗申請。
第(Br)(EU)2014號法規旨在簡化歐盟臨牀試驗的審批流程。該條例的主要特點包括:
| ● | A 通過單個入口點簡化申請程序,稱為臨牀試驗 信息系統; |
| ● | A 為申請準備和提交的一套文件以及簡化文件 報告程序可避免贊助商提交大致相同的信息 分別向不同的國家主管部門通報; |
| ● | A 臨牀試驗申請評估協調程序,分為 分兩部分; |
| ● | 嚴格來説 確定臨牀試驗申請評估的截止日期;以及 |
| ● | 倫理委員會根據國家《國家標準》參與評估程序 相關成員國的法律,但在法規規定的總體時間內 (EU)第536/2014號。 |
營銷 授權
在歐盟成員國銷售產品的授權是按照以下四種程序之一進行的:集中程序、相互承認程序、分散程序或國家程序。
| 30 |
集中式 流程
通過 集中程序,申請者可以根據單個 申請獲得在所有歐盟成員國都有效的營銷授權。某些醫藥產品,包括通過生物技術方法開發的產品,必須經過集中的上市授權程序,如果根據EMA的意見,如果得到歐盟委員會的批准,則 自動在所有歐盟成員國有效。贊助商可以選擇通過其他類別的 產品的集中程序提交MAA。
集中程序對於某些類型的產品是強制性的,例如來自生物技術過程的藥物,如基因工程 ,高級治療藥物,如基因療法或組織工程藥物,孤兒藥物,以及含有用於治療艾滋病毒、艾滋病、癌症、糖尿病、神經退行性疾病、自身免疫和其他免疫功能障礙以及病毒疾病的含有新活性物質的醫藥產品。
如果其他醫藥產品含有新的活性物質、申請人 證明相關醫藥產品構成了重大的治療、科學或技術創新,或者批准的批准符合歐盟的公共利益,則可選擇採用 集中授權程序。
管理 程序
根據集中程序,EMA的人類醫藥產品委員會,或CHMP作為科學委員會,代表EMA就人類使用的醫藥產品的安全性、有效性和質量提出意見。CHMP由每個成員國的國家藥品主管部門提名的專家組成,其中一人被任命為評估協調工作的報告員,可能的話還會有另一名委員會成員擔任聯合報告員。批准後,報告員(S)繼續對產品的整個生命週期進行監測。CHMP有210個有效天數來採納關於是否應授予營銷授權的意見 。在請求額外信息的情況下,該過程通常需要更長的時間,這會觸發程序時間表中的時鐘停止。這一過程很複雜,需要與成員國的監管當局和一些專家進行廣泛的磋商。如果從公共衞生的角度,特別是從治療創新的角度,就一種具有重大意義的藥物提出上市許可申請,則申請人可根據第14(9)條(EC)第726/2004號條例,請求加快評估程序。如果CHMP接受這樣的請求,210天的時限將減少到150天,但如果CHMP認為不再適合進行加速評估,也可以恢復到集中程序的標準時限 。一旦程序 完成,就會生成一份歐洲公共評估報告,簡稱EPAR。如果意見是否定的,則提供關於得出這一結論的理由的信息。CHMP意見通過後,關於MAA的決定必須由歐盟委員會在諮詢歐盟成員國後 通過,總共可能需要60多天的時間。藥品獲得授權並投放市場後,必須對與其質量、安全性和有效性有關的所有方面進行 審查,這是維持上市授權的條件。
有條件的 審批
在特定情況下,歐盟立法(第14(7)條條例(EC)第726/2004號和第(EC)507/2006號條例)允許申請者在獲得申請全面營銷授權所需的全面臨牀數據之前獲得有條件營銷授權。如果 (1)產品的風險-效益平衡為正,(2)申請人很可能能夠提供所需的全面臨牀試驗數據,(3)產品滿足未得到滿足的醫療需求,以及(4)相關藥物產品立即上市對公共健康的益處大於仍需要額外數據這一事實所固有的風險,則可對產品(包括被指定為孤兒藥品的藥品)授予此類有條件批准。有條件的營銷授權 可能包含營銷授權持有人必須履行的具體義務,包括完成正在進行的或新的研究的義務,以及收集藥物警戒數據的義務。有條件營銷授權的有效期為一年,如果風險-收益平衡保持為正,並且在評估是否需要額外的 或修改的條件和/或特定義務後,可以每年續簽。上述集中程序的時間表也適用於CHMP對有條件營銷授權申請的審查。
| 31 |
營銷 特殊情況下的授權
根據第(Br)條第(8)款(EC)第726/2004號條例,在特殊情況下,申請人能夠證明無法提供(由於立法中預見的特定原因)綜合數據(符合經修訂的2001/83/EC指令附件I中的要求)的產品可能有資格獲得上市許可。此類授權每年都會進行審查 以重新評估風險與收益的平衡。在特殊情況下履行作為營銷授權的一部分而施加的任何特定程序/義務旨在提供有關產品安全有效使用的信息,通常不會導致完成完整的檔案/批准。
兒科研究
在歐盟獲得營銷授權之前,申請人必須證明符合EMA批准的涵蓋所有兒科人羣的兒科調查計劃(PIP)中包括的所有措施,除非EMA已批准(1)特定產品的豁免、(2)類別豁免或(3)推遲PIP中包括的一項或多項措施。所有銷售授權程序的各自要求在(EC)第1901/2006號條例,即所謂的兒科條例中規定。當公司希望為已獲授權的藥物添加新的適應症、藥物形式或給藥途徑時,此要求 也適用。EMA的兒科委員會,或PDCO,可能會批准某些藥物的延期,允許公司推遲兒童藥物的開發,直到有足夠的信息證明其對成人的有效性和安全性。當不需要或不適合在兒童中開發藥物時,PDCO也可以批准豁免,例如隻影響老年人口的疾病。
在提交營銷授權申請或修改現有營銷授權之前,EMA確定公司 確實遵守了每個相關PIP中列出的商定研究和措施。
授權和續訂期限
營銷授權原則上有效期為五年,營銷授權可在五年後根據EMA或國家當局重新評估風險-收益平衡的基礎續簽。為此,營銷授權書持有人必須在營銷授權書失效前至少九個月向EMA或主管當局提供關於質量、安全性和有效性的文件的合併版本,包括自營銷授權書頒發以來引入的所有變化。一旦續簽,上市授權將在無限期內有效,除非歐盟委員會或 國家當局基於與藥物警戒相關的正當理由決定繼續進行一次為期五年的續簽。 任何授權之後,如果沒有在授權後三年內將藥品實際投放到歐盟市場(如果是集中式程序)或授權成員國的 市場,則將不再有效,即所謂的“日落條款”。
孤兒 藥品名稱和排他性
歐盟委員會可以對贊助商可以確定用於診斷、預防或治療 (1)危及生命或慢性衰弱的疾病,或(2)威脅生命、嚴重衰弱或嚴重慢性疾病的產品授予孤兒藥品稱號,如果沒有激勵措施,該藥物在歐盟的銷售不太可能產生足夠的回報,以證明必要的投資是合理的。此外,贊助商必須證明歐盟沒有批准的其他令人滿意的診斷、預防或治療這種疾病的方法,或者如果存在這樣的方法,建議的孤兒藥物將對患者有重大好處。
孤兒 藥物指定提供許多好處,包括費用減免、監管協助和申請集中的歐盟營銷授權(請參閲“-政府法規和產品審批-美國境外的監管-集中的授權程序”),以及在獲得營銷授權後10年的市場排他性。在此市場獨佔期內,EMA、歐盟委員會或成員國均不能接受申請或授予銷售授權 含有與授權孤兒藥品相似的一種或多種活性物質的藥品,以及用於相同治療適應症的藥品。如果在第五年結束時確定不再符合孤兒藥物指定標準,則授權治療適應症的市場專營期可縮短至六年,包括證明該產品具有足夠的利潤而不足以證明維持市場專有性是合理的。此外,在市場獨佔期結束之前,競爭對手的類似藥品可以獲得授權,包括如果 被證明比已經批准的孤兒藥物更安全、更有效或在臨牀上更好,或者如果已經批准的孤兒藥物的上市授權持有人無法供應足夠數量的產品。
| 32 |
如果被指定為孤兒藥物的醫藥產品的MAA包括按照商定的PIP進行的所有研究的結果,並且隨後在授予的上市授權中包含相應的聲明,則十年的市場專營期將延長至十二年。
監管數據保護
歐盟立法還規定了監管數據和市場排他性制度。在獲得營銷授權後,基於完整獨立數據包獲得批准的新化學品 實體將受益於八年的數據獨佔權和額外的兩年市場獨佔權。數據排他性使歐盟的監管機構無法參考創新者的數據來評估通用或生物相似(縮寫)應用。在額外的兩年市場獨佔期內,可以提交仿製藥或生物相似藥的上市授權,並可以參考創新者的數據,但在市場獨家經營權到期之前,不能銷售仿製藥或生物相似藥 。如果在這十年的前八年中,營銷授權持有人或MAH獲得了一個或多個新的治療適應症的授權,那麼整個十年的期限將延長到最多11年 ,在授權之前的科學評估中,這些適應症被認為與現有療法相比可以帶來顯著的臨牀 益處。即使一種化合物被認為是一種新的化學實體,創新者能夠 獲得數據獨佔期,但另一家公司也可以銷售該藥物的另一版本,前提是該公司基於具有藥物試驗、臨牀前試驗和臨牀試驗的完整獨立數據包的MAA獲得 營銷授權。但是,被指定為孤兒藥品的產品在獲得上市許可後,享有10年的孤兒市場專營權(另見“項目4.B--政府法規和產品審批--歐盟的法規和營銷--孤兒藥品的指定和專營權”)。根據歐盟營銷授權流程的時間和持續時間,產品可能有資格獲得最多五年的補充保護證書,或 SPC。這種SPC延長了該藥物基本專利下的權利。
獲得營銷授權後的監管要求
如果 我們在歐盟獲得醫藥產品的授權,我們將被要求遵守適用於醫藥產品的製造、營銷、促銷和銷售的一系列要求:
藥物警戒
例如,我們 將必須遵守歐盟嚴格的藥物警戒或安全報告規則,根據這些規則,可以實施授權後研究和額外的監測義務。
其他 要求涉及,例如,按照良好製造規範標準制造產品和原料藥。 歐盟監管機構可能會進行檢查,以驗證我們是否符合適用的要求,我們將不得不繼續花費時間、金錢和精力來保持合規性。不遵守歐盟關於安全監測或藥物警戒的要求,以及與為兒科人羣開發產品相關的要求,也可能導致歐盟的重大經濟處罰 。同樣,不遵守歐盟關於保護個人數據的要求也可能導致重大處罰和制裁。如果我們不遵守當地適用的要求,個別歐盟成員國也可能實施各種制裁和處罰。
| 33 |
製造業
必須持有單獨的製造商許可證的授權藥品的生產必須遵守EMA的cGMP要求和其他國家主管部門的類似要求,這些要求規定了藥品生產、加工和包裝過程中使用的方法、設施和控制措施,以確保其安全性和身份。EMA通過強制登記設施和檢查這些設施來執行其cGMP要求。EMA可能對這些檢查起到協調作用 ,而執行這些檢查的責任則由製造商所屬的成員國主管當局負責。不遵守這些要求可能會中斷供應並導致延誤、意外成本和收入損失, 並可能使申請者面臨潛在的法律或監管行動,包括但不限於警告信、暫停生產、扣押產品、禁令行動或可能的民事和刑事處罰。
營銷 和促銷
歐盟嚴格監管授權藥品的營銷和推廣,包括行業贊助的繼續醫學教育和麪向藥品處方者和/或普通公眾的廣告。適用法規旨在確保營銷授權持有者提供的有關其產品的信息 真實、平衡,並準確反映EMA或授權成員國的國家當局授權的安全性和功效聲明。不遵守這些要求 可能會導致負面宣傳、警告信、改正廣告以及潛在的民事和刑事處罰。
其他美國醫保法和合規性要求
對於在美國分銷的產品,我們還將接受聯邦 政府和我們開展業務的州的額外醫療法規和執法。適用的聯邦和州醫療法律法規包括 以下內容:
| ● | 聯邦醫療保健反回扣法規禁止,除其他外,個人故意 並故意直接或間接索取、提供、接受或提供報酬, 以現金或實物,誘導或獎勵個人轉介,或 購買、訂購或推薦任何商品或服務,並可付款 根據聯邦醫療保健計劃,如醫療保險,醫療補助或其他政府計劃。 個人或實體無需實際瞭解聯邦反回扣法規 或有特定意圖違反,即已違反;此外,物品或服務 因違反聯邦反回扣法規而導致的,可能構成虛假或 為《虛假索賠法》的目的而進行的欺詐性索賠; |
| ● | 《患者轉診倫理法案》,通常稱為《斯塔克法》及其相應的法規,禁止醫生將根據Medicare或Medicaid計劃報銷的指定醫療服務(包括門診藥物)轉介給醫生或其直系親屬與其有經濟關係或所有權利益的實體,但狹隘的監管例外情況除外,並禁止這些實體就向轉介受益人提供的物品或服務付款向Medicare或Medicaid提出索賠 ; |
| ● | 聯邦虛假索賠法案對故意提供或導致提交的個人或實體施加刑事和民事處罰,包括民事舉報人或準訴訟,向聯邦政府提出虛假或欺詐性的付款要求,或作出虛假陳述以逃避、減少或隱瞞向聯邦政府付款的義務 ; |
| ● | 健康 《1996年保險流通和責任法》規定了刑事和民事責任 執行欺詐任何醫療福利計劃的計劃,並施加義務, 包括關於保護隱私、安全性的強制性合同條款 以及個人可識別健康信息的傳輸。該法規還禁止 故意偽造、隱瞞或掩蓋重要事實或作出任何 與醫療福利的交付或支付有關的重大虛假陳述, 項目或服務; |
| 34 |
| ● | 聯邦虛假陳述法規禁止故意偽造、隱瞞 或掩蓋重要事實或作出任何重大虛假陳述 提供或支付醫療福利、物品或服務; |
| ● | 根據ACA制定的《醫師支付陽光法案》及其實施條例, 要求指定的藥品、器械、生物製品和醫療用品製造商 可根據Medicare、Medicaid或兒童健康保險支付 計劃,除特定例外情況外,每年向醫療保險和醫療補助中心報告 服務或CMS,與付款或其他"價值轉移"相關的信息 給醫生做的。所有這類報告的資料均公開; |
| ● | 類似的州法律法規,如州反回扣和虛假索賠法,可能適用於涉及非政府第三方付款人(包括私營保險公司)報銷的醫療項目或服務的銷售或營銷安排和索賠。一些州法律要求製藥公司遵守制藥行業的自願合規指南和聯邦政府頒佈的相關合規指南。 |
由於這些法律的廣度以及法定例外和可用避風港的狹隘,我們 未來的一些商業活動可能會受到一項或多項此類法律的挑戰。努力確保我們與第三方的業務安排符合適用的法律和法規,這將涉及大量成本。政府 當局可能會得出結論,我們的業務實踐可能不符合當前或未來涉及 適用的欺詐和濫用或其他醫療保健法律和法規的法律、法規或判例法。如果我們的運營被發現違反了這些 法律或任何其他可能適用於我們的政府法規,我們可能會受到重大的民事、刑事和行政 處罰、損害賠償、罰款、被排除在政府資助的醫療保健計劃(如Medicare和Medicaid)之外,以及削減或 重組我們的運營。如果我們預期與之開展業務的任何醫生或其他提供者或實體被發現 不符合適用法律,他們可能會受到刑事、民事或行政制裁,包括將 排除在政府資助的醫療保健計劃之外。
報銷
我們候選產品在美國的銷售額 可能在一定程度上取決於第三方付款人支付候選產品成本的程度,如政府醫療計劃、商業保險和管理的醫療保健組織。這些第三方付款人對醫療產品和服務的收費提出了越來越多的挑戰。此外,控制醫療成本已成為聯邦和州政府的優先事項,藥品價格一直是這一努力的重點。美國政府、州立法機構和外國政府對實施成本控制計劃表現出了極大的興趣,包括價格控制、限制報銷和非專利產品的替代要求。採用 價格控制和成本控制措施,以及在現有控制和措施的司法管轄區採用更嚴格的政策, 可能會進一步限制我們的淨收入和業績。如果這些第三方付款人不認為我們的候選產品與其他可用的療法相比具有成本效益 ,他們可能不會在批准後將我們的候選產品作為其計劃下的一項福利覆蓋,或者,如果他們這樣認為,付款水平可能不足以讓我們在有利可圖的基礎上銷售我們的候選產品。
為了確保可能被批准銷售的任何產品的承保範圍和報銷,我們可能需要進行昂貴的藥物經濟學研究,以證明該產品的醫療必要性和成本效益,以及獲得FDA、EMA或其他類似監管批准所需的成本。我們的候選產品可能不被視為具有醫療必要性或成本效益。 付款人決定為藥品提供保險並不意味着將批准適當的報銷率。 第三方報銷可能不足以使我們能夠將價格保持在足夠高的水平,以實現產品開發投資的適當回報。
| 35 |
定價 和報銷方案因國家/地區而異。一些國家規定,只有在商定了報銷價格之後,才能銷售藥品。一些國家可能要求完成額外的研究,將特定候選產品的成本效益與目前可用的療法進行比較。進行此類研究的成本可能很高,並導致我們的商業化工作延遲 。歐盟為其成員國提供了多種選擇,以限制其國家醫療保險制度提供報銷的藥品範圍,並控制供人使用的醫療產品的價格。歐盟成員國 可以批准藥品的具體價格,或者轉而對將藥品投放市場的公司的盈利能力採取直接或間接控制制度。其他成員國允許公司自行確定藥品價格,但監督和控制公司利潤。總體上,醫療成本,特別是處方藥的下行壓力變得非常大。因此,對新產品的進入設置了越來越高的壁壘。此外,在某些國家/地區,來自低價市場的跨境進口產品會帶來競爭壓力,可能會降低一國國內的定價水平。不能保證 任何對藥品實行價格控制或報銷限制的國家/地區都會允許對我們的任何產品進行優惠的報銷和定價安排。
如果政府和第三方付款人未能提供足夠的保險和報銷,我們獲得監管部門批准用於商業銷售的任何產品的適銷性可能會受到影響。此外,美國對管理式醫療的重視程度也有所提高 ,我們預計這將繼續增加藥品定價的壓力。承保政策、第三方報銷費率和藥品定價規則可能隨時更改。 即使我們獲得監管部門批准的一個或多個產品獲得了有利的承保範圍和報銷狀態,未來也可能會實施不太有利的承保政策和報銷費率。
醫療保健 改革
在美國,已經並將繼續有許多重要的立法舉措來控制醫療成本。ACA於2010年3月在美國頒佈,其中包含的條款可能會降低藥品的盈利能力,包括 例如,增加受Medicaid藥品返點計劃約束的藥品的返點、將Medicaid返點擴大到Medicaid管理的護理計劃、對某些Medicare Part D受益人強制折扣,以及根據製藥公司在聯邦醫療保健計劃的銷售中所佔份額 計算的年費。
此外,自《ACA》頒佈以來,還提出並通過了其他立法修改。這些變化包括從2013年4月1日起將向提供商支付的醫療保險總金額削減 每財年2%,由於隨後對法規進行的立法修訂,這些削減將持續到2027年,除非國會採取額外行動;然而,根據CARE法案和隨後的 立法,由於新冠肺炎疫情,這些削減將從2020年5月1日起暫停至2022年3月31日。2013年1月,《2012年美國納税人救濟法》簽署成為法律,其中包括減少了對幾家醫療服務提供者的醫療保險支付, 並將政府向提供者追回多付款項的訴訟時效期限從三年延長至五年。這些 新法律可能會導致醫療保險和其他醫療保健資金的進一步減少,如果獲得批准,這可能會對我們藥品的 客户以及我們的財務運營產生實質性的不利影響。
此外, 最近,政府加強了對製造商為其商業產品定價的方式的審查。 美國國會最近進行了幾次調查,提出並頒佈了聯邦和州立法,旨在提高藥品定價的透明度,審查定價與製造商患者計劃之間的關係,降低醫療保險下的藥品成本,並改革政府計劃的藥品報銷方法。FDA於2020年9月24日發佈了最終規則,自2020年11月30日起生效,為各州制定和提交來自加拿大的藥品進口計劃提供了指導。此外,2020年11月20日,美國衞生與公眾服務部(HHS)敲定了一項法規,將藥品製造商對D部分下的計劃贊助商的降價安全港保護 直接或通過藥房福利經理刪除,除非法律要求降價。該規則還為反映在銷售點的降價創造了新的安全港,併為藥房福利經理和製造商之間的某些固定費用安排創造了安全港。 在州一級,立法機構越來越多地通過立法並實施旨在控制藥品和生物製品定價的法規,包括價格或患者報銷限制、折扣、對某些產品准入的限制 以及營銷成本披露和透明度措施,在某些情況下,旨在鼓勵從其他國家進口和 批量購買。
| 36 |
最近,2022年8月16日,2022年《降低通貨膨脹率法案》或《****》簽署成為法律。除其他事項外,****指示 衞生與公眾服務部或HHS協商醫療保險覆蓋的某些高支出、單一來源的藥物和生物製品的價格 。談判價格將於2026年首次生效,將以法定最高價格為上限 ,這意味着相對於批發商和直接購買者的平均價格有很大折扣。從2023年開始,該法律還將懲罰那些以高於通貨膨脹率的速度提高聯邦醫療保險B部分和D部分藥品價格的藥品製造商。此外,從2025年開始,IRA通過顯著降低受益人的最大自付成本並創建新的製造商折扣計劃,消除了Medicare Part D計劃下的“甜甜圈漏洞”。****允許衞生和公眾服務部部長在最初幾年通過指導而不是監管來實施許多這些規定。HHS已經並將繼續在這些計劃實施時發佈和更新指導,儘管****可能會受到法律挑戰。目前尚不清楚IRA 將如何實施,但可能會對製藥行業產生重大影響此外,為了迴應拜登政府2022年10月的行政命令,HHS於2023年2月14日發佈了一份報告,概述了醫療保險和醫療補助創新中心 測試的三種新模型,這些模型將根據它們降低藥品成本、促進可獲得性和提高醫療質量的能力進行評估 。目前還不清楚這些模型是否會在未來的任何醫療改革措施中使用。
儘管其中許多措施以及其他擬議的措施可能需要通過額外的立法授權才能生效,但國會 已表示將繼續尋求新的立法措施來控制藥品成本。
CMS 發佈了一項最終規則,於2019年7月9日生效,該規則要求處方藥和生物 產品的直接面向消費者的廣告(可通過或根據聯邦醫療保險或醫療補助付款)在廣告中包括該藥物或生物製品的批發採購成本或標價,如果該藥物或生物製品每月供應或通常療程的成本等於或大於35美元。違反這些要求的處方藥和生物製品將被列入公開名單。
任何 醫療改革措施如果獲得批准,都可能減少對我們產品的最終需求,或給我們的產品定價帶來壓力。 美國各州也越來越積極地通過立法和實施旨在控制藥品定價的法規,包括價格或患者報銷限制、折扣、對某些產品的限制 准入和營銷成本披露和透明度措施,在某些情況下,旨在鼓勵從其他國家/地區進口和批量購買。此外,地區醫療當局和個別醫院越來越多地使用招標程序 來確定哪些藥品和供應商將被納入其處方藥和其他醫療保健計劃。 我們預計未來將採取更多的州和聯邦醫療改革措施。
我們 預計未來將採取更多的州和聯邦醫療改革措施,以及外國政府的法律改革,其中任何一項都可能限制政府為醫療保健產品和服務支付的金額,這可能導致對我們候選產品的需求減少或額外的定價壓力。
員工
截至本報告之日 ,我們有10名員工和全職顧問,包括我們的執行官,提供管理和 財務服務,並承擔一般行政責任。我們相信,我們與 員工保持着令人滿意的工作關係,我們沒有遇到任何重大的勞資糾紛或在招聘員工方面遇到任何困難。 我們的員工都沒有工會代表。
人力資源 資本資源
我們的人力資本資源目標包括識別、招聘、留住、激勵和整合我們現有的 和新員工、顧問和顧問。我們的股權和現金激勵計劃的主要目的是通過授予基於股票和現金的薪酬獎勵來吸引、留住和獎勵人員,以通過激勵這些人員盡其所能並實現我們的目標來增加股東價值和公司的成功。
| 37 |
可用信息
我們的 網站位於www.azitrainc.com。我們網站上的信息或通過我們網站訪問的信息不屬於本年度報告表格 10—K的一部分。本年度報告的表格10—K的副本位於美國證券交易委員會公共參考室,地址為100 F Street,NE,Washington,D.C. 20549。有關公共資料室運作的信息可致電SEC 1—800—SEC—0330獲得。SEC還 在www.sec.gov上維護了一個網站,其中包含有關我們提交文件的報告和其他信息。
第 1a項。風險因素
投資我們的普通股涉及很高的風險。在購買我們的普通股之前,您應該仔細閲讀和考慮以下風險因素以及本報告中包含的所有其他信息,包括我們的財務報表和相關説明。這些風險因素中的每一個,無論是單獨存在還是合併在一起,都可能對我們的業務、經營業績和財務狀況產生不利影響, 也會對我們普通股的投資價值產生不利影響。可能還有我們目前不知道的或我們目前認為不重要的額外風險,這也可能損害我們的業務和財務狀況。如果發生下面所述的任何事件,我們的財務狀況、我們獲得資本資源的能力、我們的經營業績和/或我們未來的增長前景可能會受到重大和不利的影響 我們的普通股市場價格可能會下跌。因此,您可能會損失您對我們普通股的部分或全部投資。
與我們的業務相關的風險
我們是一家處於早期階段的臨牀生物製藥公司,運營歷史有限.
我們 是一家成立於2014年1月2日的早期臨牀生物製藥公司,運營歷史有限。除了有限的贈款和服務收入外,我們尚未 開始創收業務。到目前為止,我們的業務包括開發我們的專有微生物文庫,鑑定、表徵、基因工程和某些細菌種類的測試 以提供治療效果,以及我們最初的候選產品的開發。我們有限的運營歷史使潛在投資者很難評估我們的技術或未來的運營。作為一家早期臨牀生物製藥公司,我們 面臨與新業務相關的組織、融資、支出、併發症和延誤所固有的所有風險。因此,您應該根據 公司在發展早期經常遇到的成本、不確定性、延誤和困難來考慮我們的前景,特別是像我們這樣的早期臨牀生物製藥公司。潛在投資者應仔細考慮一家經營歷史有限的公司將面臨的風險和不確定性。尤其是, 潛在投資者應考慮到我們可能無法:
| ● | 成功 實施或執行我們的業務計劃,或我們的業務計劃是健全的; | |
| ● | 成功 完成臨牀前和臨牀試驗並獲得監管部門的上市批准 我們的候選產品; | |
| ● | 成功地 展示了我們的精準皮膚病候選產品 與市場上當前的產品之間的良好差異化; | |
| ● | 成功 簽約生產我們的臨牀藥物產品並建立商業藥物供應 ; | |
| ● | 確保我們的候選產品獲得市場排他性或足夠的知識產權保護; | |
| ● | 吸引並保留一支經驗豐富的管理和諮詢團隊;以及 | |
| ● | 在資本市場籌集足夠的資金來實施我們的業務計劃,包括我們的候選產品的臨牀開發、監管批准和商業化。 |
投資者 應根據發展中公司在競爭環境中遇到的不確定性來評估對我們的投資。 不能保證我們的努力會成功,也不能保證我們最終能夠實現盈利。如果我們不能成功 執行上述任何一項,我們的業務可能不會成功,您的投資將受到不利影響。您必須準備好 失去所有投資。
| 38 |
我們 有重大運營虧損的歷史,並預計在可預見的未來將繼續運營虧損.
截至2023年12月31日和2022年12月31日的財年,我們分別產生了1260萬美元和1340萬美元的淨虧損。截至2023年12月31日,我們的累計赤字為4860萬美元。我們預計,在沒有任何有意義的 收入的情況下,我們將繼續產生大量開支,除非我們能夠獲得監管部門的批准,併成功地將我們的至少一個候選產品商業化。 我們還認為,自本報告之日起,我們至少需要4到6年時間才能獲得第一個候選藥物的監管批准 ,前提是我們能夠獲得監管批准。即使我們能夠將我們的候選產品商業化 ,也不能保證我們將產生可觀的收入或實現盈利。
我們 預計在推進候選產品向商業化方向發展的過程中,將有大量的研究、監管和開發費用。 因此,我們預計在可預見的將來將產生重大損失,而且這些損失將不斷增加。我們不確定 何時或是否能夠實現或維持盈利能力。如果我們在未來實現盈利,我們可能無法維持 在以後的時期的盈利。未能實現並保持盈利可能會削弱我們維持運營的能力,並 對我們的業務和籌集資金的能力造成不利影響。如果我們無法在合理的時間內產生正現金流, 我們將無法進一步推進我們的業務計劃或繼續運營,在這種情況下,您可能會失去全部投資。
我們的獨立註冊會計師事務所 截至2023年12月31日止年度的報告指出,由於我們的累計赤字、 經常性和來自運營的負現金流,我們的持續經營能力存在重大疑問。
我們 預計我們將需要額外的資金來執行我們的業務計劃和為運營提供資金,而這些額外的資金可能無法以合理的條款或根本無法獲得。
截至2023年12月31日,我們的總資產為510萬美元,營運資金為932,384美元。2024年2月16日,我們完成了16,667,000股普通股的公開發行,發行價為每股0.30美元,扣除承銷商折扣和發行費用後,我們收到了約440萬美元的淨收益。我們認為,截至本報告日期,我們的手頭現金 將不足以支付我們未來12個月的擬議運營計劃。我們打算通過各種 融資來源尋求額外資金,包括出售我們的股權、技術的許可費以及與行業合作伙伴的合資企業。 此外,我們還將考慮現有業務計劃的替代方案,以使我們能夠以較少的資金實現創收業務和 有意義的商業成功。但是,無法保證此類資金 將以商業上合理的條款提供(如果有的話)。如果無法以令人滿意的條件獲得此類融資,我們可能無法進一步執行 我們的業務計劃,我們可能無法繼續運營,在這種情況下,您可能會失去全部投資。
我們的微生物文庫和基因工程平臺的臨牀和商業用途是不確定的,而且可能永遠不會實現。
我們 構建了一個專有平臺,其中包括一個微生物文庫,該文庫由大約1,500個獨特的細菌菌株組成,可以 篩選獨特的治療特徵。該平臺通過人工智能、機器學習和遺傳工程技術進行了擴展。到目前為止,我們的重點是開發基因工程菌株表皮葡萄球菌,我們認為它是皮膚病治療工程的最佳治療候選物種。然而,我們認為,基因工程表皮葡萄球菌是一種新的、未經證實的治療模式我們最近啟動了ATR—12的Ib期臨牀試驗,預計在2024年上半年入組第一名患者,並預計在 2024年年中之前為ATR—04的Ib期臨牀試驗提交IND。然而,截至本報告之日,我們已經檢測和評估了我們的專利菌株, 表皮葡萄球菌在臨牀前 研究中,尚未進行任何旨在評估安全性、耐受性或療效的臨牀試驗。此外,早期臨牀試驗的成功並不能保證大規模臨牀試驗的成功,也不能預測最終結果。即使 我們擬定的1b期臨牀試驗完成後,我們的初始候選產品也只能在少數患者中進行測試。 這些臨牀試驗的結果可能不一定表明我們候選產品的安全性、耐受性或療效 或我們擴展到更大的臨牀試驗。在此之前(如果有的話),由於我們能夠向FDA提供大量臨牀證據,以支持安全性、有效性、純度和效價的聲明,足以使FDA批准我們的專利候選產品 用於任何適應症,我們的專利微生物庫和基因工程平臺仍將未經證實。
| 39 |
我們的候選產品處於早期臨牀試驗或臨牀前開發的早期階段,因此它們將需要廣泛的臨牀前和臨牀測試。臨牀前研究或早期臨牀試驗的成功可能不代表未來臨牀試驗的結果 ,我們不能向您保證任何正在進行的、計劃中的或未來的臨牀試驗將導致足夠的結果 以獲得必要的監管批准。
Because our product candidates are in early stages clinical trials or of preclinical development, they will require extensive preclinical and clinical testing. We recently initiated our Phase 1b clinical trial for ATR-12 and expect to enroll our first patient in the first half of 2024, and expect to file an IND for a Phase 1b clinical trial of ATR-04 by mid-2024. However, we have not conducted meaningful preclinical studies for any of our other product candidates. Success in preclinical testing and early-stage clinical trials does not ensure that later clinical trials will generate the same results or otherwise provide adequate data to demonstrate the efficacy and safety of a product candidate. Preclinical studies and Phase 1b clinical trials are primarily designed to test safety, to study pharmacokinetics and pharmacodynamics and to understand the side effects of product candidates at various doses and schedules. Phase 1b clinical trials also test how well a certain disease responds to a new treatment. Success in preclinical studies and earlier clinical trials does not ensure that later efficacy trials will be successful, nor does it predict final results. Our product candidates may fail to show the desired safety and efficacy in clinical development despite positive results in preclinical studies or even if they successfully advance through earlier clinical trials.
此外,臨牀試驗的設計可以確定其結果是否支持產品的批准,而臨牀試驗設計中的缺陷可能在臨牀試驗進展良好之前不會變得明顯。作為一個組織,我們在設計臨牀試驗方面的經驗有限,可能無法設計和執行臨牀試驗來支持監管部門的批准。製藥和生物技術行業的許多公司都遭遇了重大挫折,包括在臨牀前測試和早期臨牀試驗取得了令人振奮的結果後,仍未能在後期臨牀試驗中取得成功。從臨牀前和臨牀活動中獲得的數據可能會受到不同的解釋,這可能會推遲、限制或阻止監管部門的批准。
此外, 我們無法確定是否或何時可能為我們的任何候選產品提交生物製品許可證申請或BLA以供監管部門批准,或任何此類BLA是否會被FDA接受審查,或任何BLA是否會在 審查後獲得批准。即使我們的臨牀試驗按計劃完成,我們也不能確定他們的結果是否支持我們建議的適應症。 臨牀前試驗和早期臨牀試驗的成功並不能確保以後的臨牀試驗也會成功,我們也不能 確保以後的臨牀試驗的結果將複製以前的臨牀試驗和臨牀前試驗的結果。臨牀 試驗過程可能無法證明我們的候選產品對於其建議的用途是安全有效的。此失敗可能會 導致我們放棄某個候選產品,並可能延遲其他候選產品的開發。我們臨牀試驗的任何延遲或終止都將延遲並可能阻止向FDA提交任何BLAS,並最終影響我們將候選產品商業化並創造產品收入的能力。
我們 將需要擴大我們組織的規模,我們在管理這種增長時可能會遇到困難.
隨着我們的開發和商業化計劃和戰略的發展,我們將需要擴大員工和顧問/承包商的規模 。未來的增長將使管理層成員承擔更多的責任,包括需要確定、招聘、維持、激勵和整合更多的員工。此外,我們的管理層可能不得不將不成比例的 注意力從我們的日常活動中轉移出來,並投入大量時間來管理這些增長活動。我們未來的財務業績、我們將我們的候選產品和任何其他候選產品商業化的能力以及我們有效競爭的能力 在一定程度上將取決於我們有效管理未來增長的能力。
| 40 |
如果我們不能成功地吸引和留住高素質的人才,我們就可能無法成功地實施我們的業務 戰略。此外,失去高級管理層的服務將對我們的業務前景造成不利影響.
我們的管理團隊在藥物開發和商業化的許多不同方面擁有專業知識。然而,我們在競爭激烈的製藥行業中的競爭能力在很大程度上取決於我們能否吸引和留住高素質的管理、科學和醫療人員。當我們進一步開發我們的候選產品時,我們將需要招聘更多的人員。我們市場對技術人員的競爭非常激烈,而對經驗豐富的科學家的競爭可能會限制我們以可接受的條件聘用和留住高素質人員的能力。儘管我們努力留住有價值的員工,但我們的管理、科學和醫療團隊的成員可能會在短時間內終止與我們的僱傭關係。失去任何首席執行官或其他關鍵員工的服務,或我們無法聘用目標高管,可能會潛在地損害我們的業務、經營業績或財務狀況。 我們尤其認為,失去首席執行官的服務將對我們的業務產生實質性的不利影響。
與我們競爭人才的其他生物製藥公司比我們擁有更多的財務和其他資源,不同的風險 概況,以及更長的行業歷史。它們還可以提供更多樣化的機會和更好的職業晉升機會 。這些特點中的一些可能比我們所提供的更吸引高素質的應聘者。如果我們不能 繼續吸引和留住高素質的人才,我們開發和商業化候選產品的速度和成功將受到限制。
我們 目前沒有銷售和營銷組織。如果我們無法建立令人滿意的銷售和營銷能力,或無法獲得第三方銷售和營銷關係,我們可能無法成功地將我們的任何候選產品商業化.
目前,我們沒有銷售或營銷人員。在我們的一個或多個藥物產品初步獲得必要的監管批准後,我們計劃在美國建立專注於將我們的開發計劃商業化的能力, 我們的開發計劃側重於用於治療皮膚病的活性生物治療產品和重組蛋白,我們相信,在那裏,我們目標適應症的患者羣體 和醫學專家足夠集中,使我們能夠通過有針對性的銷售團隊有效地推廣我們的產品 。在商業化可能對我們來説資本效率較低的其他市場,我們可能會有選擇地尋求與第三方的戰略合作,以最大限度地發揮我們候選產品的商業潛力。在某些情況下,我們 可能會尋求我們的微生物文庫或專利權的許可,或者達成聯合開發安排。如果我們在招聘銷售和營銷人員、建立銷售和營銷基礎設施或與第三方達成適當的合作安排方面不成功 ,我們將很難成功地將我們的候選產品商業化,這將對我們的業務、運營業績和財務狀況產生不利影響。
即使我們簽訂了第三方營銷和分銷安排,我們對這些第三方的銷售、營銷和分銷活動的控制也可能是有限的,甚至沒有控制權。我們未來的收入可能在很大程度上取決於這些第三方努力的成功。 在建立銷售和營銷基礎設施方面,我們將不得不與資金雄厚的老牌製藥公司和生物技術公司競爭,以招聘、聘用、培訓和留住銷售和營銷人員。可能阻礙我們 建立內部銷售組織或與第三方達成協作安排的因素包括:
| ● | 我們無法招聘和留住足夠數量的有效銷售和營銷人員; | |
| ● | 銷售人員無法接觸或説服足夠數量的醫生開出我們的任何候選產品; | |
| ● | 銷售人員缺乏可供補充的產品,這可能使我們相對於擁有更廣泛產品線的公司處於競爭劣勢;以及 | |
| ● | 與創建內部銷售和營銷組織相關的不可預見的成本和費用。 |
| 41 |
在可預見的將來,我們 將完全依賴第三方生產我們的候選產品用於商業銷售, 如果這些第三方無法獲得FDA或類似的外國監管機構的生產批准、無法向我們提供足夠數量的候選產品或無法以可接受的質量水平或價格進行商業化,我們候選產品的商業化可能會被暫停、推遲或利潤下降.
我們 不擁有或運營用於商業生產當前候選產品的製造設施。我們目前依賴 第三方合同製造商提供我們臨牀前研究和臨牀試驗所需的所有原材料、製造設備和活性藥物成分 。儘管我們能夠在我們的康涅狄格州格羅頓工廠為我們的臨牀試驗 生產成品,但我們將依賴第三方生產我們用於商業銷售的成品。我們沒有與這些第三方中的任何一方簽訂長期協議。我們目前也沒有任何商業用品的合同關係。 我們打算與第三方合同製造商和一個或多個備份製造商達成協議,以供未來生產。 我們正在分析為我們開發的任何產品的未來開發和商業批量建立製造能力的可行性 。此類產品將需要在符合FDA和我們正在尋求批准的其他司法管轄區監管機構的要求的設施和工藝中生產。同時,如果我們的任何候選產品被批准商業化,我們將有義務依賴合同製造商進行臨牀前研究、臨牀試驗和商業生產。
The facilities used by us or any contract manufacturer to manufacture our raw materials, manufacturing devices, active pharmaceutical ingredients and finished products must be approved by the FDA or comparable foreign regulatory authorities. Such approvals are subject to inspections that will be conducted after we submit a BLA to the FDA or their equivalents to other relevant regulatory authorities. Until such time, if ever, as we establish our own manufacturing facilities, we will not control the manufacturing process of our product candidates and will be completely dependent on our contract manufacturing partners for compliance with Current Good Manufacturing Practices, or cGMPs, for manufacture of our raw materials, manufacturing devices, active pharmaceutical ingredients and finished products. These cGMP regulations cover all aspects of the manufacturing, testing, quality control, storage, distribution and record keeping relating to our product candidates. If our contract manufacturers do not successfully manufacture material that conforms to our specifications and the strict regulatory requirements of the FDA or others, we will not be able to secure or maintain regulatory approval for product made at their manufacturing facilities. If the FDA or a comparable foreign regulatory authority does not approve these facilities for the manufacture of our product candidates or if it withdraws any such approval in the future, we may need to find alternative manufacturing facilities, which could significantly delay our clinical trials and impact our ability to develop, manufacture, obtain regulatory approval for or market our product candidates, if approved. Likewise, we could be negatively impacted if any of our contract manufacturers elect to discontinue their business relationship with us.
我們的合同製造商將接受FDA以及相應的州和外國機構的持續定期突擊檢查,以瞭解是否符合cGMP和類似的法規要求。我們無法控制我們的合同製造商遵守這些法規和標準的情況。如果我們的任何合同製造商未能遵守適用的法規,可能會導致對我們實施制裁,包括罰款、禁令、民事處罰、未能批准我們的任何產品上市 候選產品、延遲、暫停或撤回批准、無法提供產品、運營限制和刑事起訴, 任何這些都可能對我們的業務產生重大不利影響。此外,我們將無法控制我們的合同製造商保持足夠的質量控制、質量保證和合格人員的能力。如果我們的合同製造商未能遵守或保持這些標準中的任何一項,可能會對我們開發、製造、獲得監管機構批准或營銷我們的任何候選產品的能力產生不利影響。
如果, 由於任何原因,這些第三方不能或不願意履行我們的職責,我們可能無法找到替代製造商或配方商,也無法與他們達成有利的協議,我們不能確定任何此類第三方是否具有滿足未來要求的製造能力 。如果這些製造商或任何成品藥品替代製造商在各自的生產流程中遇到我們所需的原材料、製造設備、活性藥物成分或成品的任何重大 困難,或者因任何原因而停止與我們的業務往來,我們的臨牀試驗可能會出現重大延誤 ,我們的任何候選產品的供應可能會出現重大中斷,或者可能根本無法提供我們的候選產品 。
| 42 |
任何製造問題或失去一家代工製造商都可能對我們的運營造成中斷,並導致開發和臨牀試驗延遲和銷售損失。此外,我們將依賴第三方提供生產我們的產品所需的原材料 候選產品。任何這種對供應商的依賴都可能涉及幾個風險,包括可能無法獲得關鍵材料,以及對生產成本、交付時間表、可靠性和質量的控制減少。供應商問題對我們的合同製造商之一的運營造成的任何意外中斷都可能延遲我們的任何候選產品的發貨,增加我們銷售商品的成本,並導致臨牀試驗延遲或銷售損失。
我們的 業務模式包括可能將我們專有微生物文庫或我們的候選產品的菌株授予其他 生物製藥公司,然而生物製藥行業的技術許可是一個漫長的過程,並受到幾個我們無法控制的 風險和因素的影響,我們無法預測我們能否成功地超越我們的技術許可或建立新的許可關係所需的時間 。
我們的商業模式包括將我們的專有微生物文庫或我們的候選產品 中的菌株潛在地外包或聯合開發給其他生物製藥公司。任何此類安排通常都會從我們的潛在合作伙伴或被許可方進行初步可行性測試和評估開始。假設可行性測試成功,我們將成功的測試轉換為商業許可或聯合開發協議的能力取決於許多風險和因素,其中許多風險和因素不在我們的控制範圍之內,包括:
| ● | 製藥行業成員普遍採用和採用新技術的速度; | |
| ● | 我們的 潛在被許可人對銷售皮膚科產品的經濟效益的內部評估 可能與目前正在開發或商用的其他產品競爭的產品 由我們的潛在合作伙伴或被許可人進行銷售,而不管他們認為的好處或優勢如何 我們的技術或產品; | |
| ● | 我們潛在合作伙伴/被許可方的內部預算和產品開發問題,包括他們將資本和人力資源投入到我們的技術或產品的開發和商業化的能力;以及 | |
| ● | 我們的潛在合作伙伴/被許可方是否願意接受我們對預付費用和持續版税的要求。 |
此外,我們認為,在許多情況下,我們的潛在合作伙伴或被許可方可能會與我們一起進行早期可行性測試,作為他們評估多種藥物和藥物輸送方案的一部分,並在做出任何決定或承諾開發新藥產品之前 。因此,即使我們的平臺在早期可行性研究中成功,我們的潛在合作伙伴/被許可人 可能會出於與我們的技術性能無關的原因而決定不與我們簽訂許可協議。因此,我們 無法預測我們提議的許可模式將在多大程度上成功。
如果對我們提起產品責任訴訟,我們可能會承擔大量責任,並可能被要求限制我們候選產品的商業化 .
由於我們候選產品的臨牀測試,我們 將面臨潛在的產品責任風險,如果我們將任何候選產品商業化,我們還將面臨更大的此類責任風險。例如,如果我們開發的任何產品(包括我們的任何候選產品)或我們在候選產品中使用的任何材料涉嫌造成傷害或在產品測試、製造、營銷或銷售過程中被發現 不適合,我們可能會被起訴。任何此類產品責任索賠可能包括對製造缺陷、設計缺陷、未能就產品固有危險發出警告、疏忽、嚴格責任和違反保修的指控。在美國,根據州消費者保護法,也可以對我們提出索賠。如果我們不能成功地針對產品責任索賠進行辯護,我們可能會承擔鉅額責任或被要求限制我們的候選產品的商業化 。即使成功地對這些索賠進行辯護,也需要我們使用大量的財務和管理資源。 無論案情如何或最終結果如何,責任索賠可能會導致:
| ● | 減少了對我們的任何候選產品或我們可能開發的任何未來產品的需求; |
| 43 |
| ● | 損害我們的聲譽。 | |
| ● | 未能獲得監管部門對我們的候選產品的批准; | |
| ● | 退出我們臨牀試驗的參與者 ; | |
| ● | 與我方相關訴訟辯護相關的費用 ; | |
| ● | 轉移我們管理層的時間和資源; | |
| ● | 向試驗參與者或患者發放鉅額 金錢獎勵; | |
| ● | 產品 召回、撤回或貼標籤、營銷或促銷限制; | |
| ● | 無法將我們的部分或全部候選產品商業化;以及 | |
| ● | 我們股票的價值下跌了。 |
截至本報告發布之日,我們投保的產品責任保險足以滿足我們目前的臨牀測試和開發水平 。但是,在我們開始商業銷售我們的初始產品時,我們將需要額外的產品責任保險。 我們無法以可接受的成本獲得並保留足夠的產品責任保險,以防範潛在的產品責任索賠。 我們開發的產品可能會阻止或阻礙其商業化。儘管我們將努力獲得並維持我們認為足夠的此類保險金額,但任何針對我們提出的索賠都可能導致法院判決或和解的金額不在我們的保險範圍內,或者超出我們的保險範圍。 我們的保險單也將有各種排除,我們可能會受到我們沒有保險範圍的產品責任索賠的影響。 因此,我們可能需要支付超出我們的承保範圍限制或 不在我們的保險範圍內的任何由法院裁決或在和解協議中協商的任何金額,並且我們可能沒有或能夠獲得足夠的資本來支付這些金額。
我們的內部計算機系統,或我們的協作者或其他承包商或顧問的系統,可能會出現故障或遭遇安全漏洞,這 可能會導致我們的產品開發計劃發生實質性中斷。
我們的內部計算機系統以及我們當前和未來的任何合作者和其他承包商或顧問的計算機系統容易受到計算機病毒、未經授權的訪問、自然災害、恐怖主義、戰爭以及電信和電氣故障的破壞。雖然我們迄今尚未經歷任何此類重大系統故障、事故或安全漏洞,但如果發生此類事件並導致我們的運營中斷,則可能導致我們的開發計劃和業務運營中斷,無論是由於我們的商業機密或其他專有信息的丟失,還是由於其他類似的中斷。例如,臨牀試驗數據的丟失可能會導致我們的監管審批工作延遲,並顯著增加我們恢復或複製數據的成本。如果任何中斷或安全漏洞 導致我們的數據或應用程序丟失或損壞,或不適當地披露機密或專有信息,我們可能會承擔責任,我們的競爭地位可能會受到損害,我們候選產品的進一步開發和商業化可能會推遲 。
我們 可能會因公司和供應商的信息系統和網絡中維護的信息(包括員工和研究對象的個人信息以及公司和供應商的機密數據)被盜用、誤用、泄露、篡改或故意或意外泄露或丟失而面臨風險。此外,外部各方可能試圖侵入我們的系統或我們供應商的系統,或欺詐性地誘使我們的人員或我們供應商的人員披露敏感信息,以便 訪問我們的數據和/或系統。我們的數據和系統可能會受到威脅,包括惡意代碼和病毒、網絡釣魚和其他網絡攻擊。隨着時間的推移,這些威脅的數量和複雜性不斷增加。如果我們的信息技術系統或供應商的信息技術系統發生重大破壞或數據意外或故意丟失,可能會損害市場對我們安全措施有效性的看法 並可能損害我們的聲譽和信譽。我們可能需要 花費大量資金和其他資源來修復或更換信息系統或網絡。此外,我們可能會 受到個人和團體在涉及隱私問題的私人訴訟中採取的監管行動和/或索賠,這些訴訟涉及與數據收集和使用實踐和其他數據隱私法律法規相關的隱私問題,包括對數據的濫用或不當披露的索賠,以及不公平或欺騙性的做法。
儘管 我們開發和維護旨在防止這些事件發生的系統和控制,並且我們有識別和緩解威脅的流程 ,但這些系統、控制和流程的開發和維護成本高昂,並且需要持續監控和更新 ,因為技術變化和克服安全措施的努力變得越來越複雜。此外,儘管我們做出了努力,但這些事件發生的可能性無法完全消除。隨着我們將更多的信息系統外包給供應商,與付款人和患者進行更多的電子交易,以及更多地依賴基於雲的信息系統,相關的安全風險 將會增加,我們將需要花費更多的資源來保護我們的技術和信息系統。此外, 不能保證我們的內部信息技術系統或我們第三方承包商的系統,或我們的顧問為實施足夠的安全和控制措施所做的努力 是否足以在系統故障時保護我們免受故障、服務中斷、數據惡化或丟失,或者在發生網絡攻擊、安全漏洞、工業間諜攻擊或可能導致財務、法律、商業或聲譽損害的內部威脅攻擊時防止數據被盜或損壞。
| 44 |
我們 面臨其他生物技術和製藥公司針對醫用皮膚病適應症的激烈競爭,如果我們不能有效競爭,我們的經營業績將受到影響。
皮膚病治療市場競爭激烈,並受到重大技術發展的引領。我們預計,如果我們 成功獲得監管部門對我們的候選藥物的批准,我們將面臨來自我們行業將推出的其他批准療法或 藥物的激烈競爭。即使其他品牌、仿製藥或非處方藥的效果較差,但基於成本或便利性,它可能會比我們的產品更快地被醫生和患者採用。
與產品監管相關的風險
我們的成功完全取決於我們能否獲得FDA和外國司法管轄區監管機構對我們候選產品的上市批准,我們打算在這些司法管轄區營銷我們的候選產品,這一點無法得到保證。
我們 在獲得FDA批准 BLA之前,不允許在美國將候選產品作為處方藥產品銷售,也不允許在任何外國國家銷售,直到我們獲得這些國家的必要批准。在美國, FDA通常要求完成每種生物製品的臨牀試驗,以確定其安全性和有效性,以及廣泛的藥物開發 ,以確保BLA獲得批准之前的質量。在大量正在開發的生物製劑中,只有一小部分 導致向FDA提交BLA,最終獲得商業化批准的產品甚至更少。截至本報告之日, 我們尚未向FDA提交BLA或向其他監管機構提交任何候選產品的類似申請。
我們的 成功取決於我們是否獲得上述監管批准,而此類監管批准的發放是不確定的 ,並受到許多風險的影響,包括:
| ● | 此類 當局可能不同意我們的臨牀試驗或任何合作者的臨牀試驗的數量、設計、規模、實施或實施; | |
| ● | 此類 當局可能不同意我們對臨牀前研究或臨牀 試驗數據的解釋,或使用研究結果作為我們當前或未來候選產品的前兆 ; | |
| ● | 毒理學研究結果可能不支持為我們的候選產品提交研究新藥申請、 或IND或BLA; | |
| ● | FDA或類似的外國監管機構或機構審查委員會 可能不同意我們臨牀試驗的設計或實施; | |
| ● | 我們 可能無法為我們的候選產品的安全性和 有效性提供可接受的證據; | |
| ● | 我們臨牀試驗的 結果可能不令人滿意,或者可能不符合FDA、歐洲藥品管理局或EMA或其他監管機構為我們的任何候選產品獲得上市批准所要求的統計 水平或臨牀意義; | |
| ● | 我們的候選產品在特定臨牀試驗中的劑量可能不是最佳的 水平; | |
| ● | 我們臨牀試驗中的患者 可能會出現不良反應,原因可能與我們的候選產品有關,也可能不相關。 | |
| ● | 從臨牀試驗收集的數據可能不足以支持提交BLA或其他提交或獲得美國或其他地方的監管批准; | |
| ● | FDA可能要求制定風險評估和緩解策略,或REMS,作為批准的條件; |
| 45 |
| ● | FDA或類似的外國監管機構可能無法批准與我們簽訂臨牀和商業用品合同的第三方製造商的製造工藝或設施 ;以及 | |
| ● | FDA或類似的外國監管機構的批准政策或法規 可能會發生重大變化,導致我們的臨牀數據不足以批准我們的候選產品 。 |
獲得監管部門批准的過程非常昂貴,通常需要多年時間(如果最終獲得批准的話),而且可能會根據涉及的候選產品的類型、複雜性和新穎性、尋求監管部門批准的司法管轄區以及監管機構的重大自由裁量權等因素而有很大差異。開發期間監管審批政策的變化、附加法規或法規的變更或提交的產品申請的監管審查的變更 可能會導致申請審批或拒絕的延遲。在一個司法管轄區獲得監管批准並不一定意味着候選產品將在我們可能尋求批准的所有司法管轄區獲得監管批准,但在一個司法管轄區未能獲得批准可能會對我們在不同司法管轄區尋求批准的能力產生負面影響。由於上述原因或任何其他原因,如果我們的候選產品未能獲得監管部門的批准,我們將無法將我們的候選產品 商業化,我們的創收能力將受到嚴重影響。
此外,FDA、EMA或其他監管機構還可能批准的候選產品的適應症少於或超過我們的要求,可能會對某些年齡段的使用限制、警告、預防措施或禁忌症施加重大限制,或者可能會根據昂貴的上市後臨牀試驗或風險緩解要求的表現而批准。FDA、EMA或其他監管機構也可能不接受我們認為對於我們的候選產品成功商業化是必要或可取的標籤聲明。
2022年12月,美國國會頒佈了一項新法律,即《2022年化粧品現代化監管法案》,簡稱MOCRA。MOCRA將要求化粧品製造商或進口商:確保其手頭有其產品和成分的安全性證明;滿足 增加的註冊、記錄保存和報告要求;在其標籤上包括香料和過敏原信息;並準備滿足FDA將頒佈的良好製造規範要求。這些額外要求可能會影響預算 和時間表。
我們的臨牀試驗可能無法證明我們的候選產品或任何未來候選產品的安全性和有效性的實質性證據 ,這將阻止、推遲或限制監管批准和商業化的範圍.
Our business model depends entirely on the successful development, regulatory approval and commercialization of our product candidates, which may never occur. We recently initiated our Phase 1b clinical trial for ATR-12 and expect to enroll our first patient in the first half of 2024 and expect to file an IND for a Phase 1b clinical trial of ATR-04 by mid-2024. However, all of our other product candidates are in the early stages of development and as of the date of this report we have not progressed any of our product candidates, other than ATR-12 and ATR-04, beyond performance characterization and animal testing We may not be successful in obtaining approval from the FDA or comparable foreign regulatory authorities to start clinical trials for ATR-04 or any of our other product candidates. If we do not obtain such approvals as presently planned, the time in which we expect to commence clinical programs for any product candidate will be extended and such extension will increase our expenses, delay our potential receipt of any revenues and increase our need for additional capital. Moreover, there is no guarantee that we will receive approval to commence human clinical trials or, if we do receive approval, that our clinical trials will be successful or that we will continue clinical development in support of an approval from the FDA or comparable foreign regulatory authorities for any indication. We note that most product candidates never reach the clinical development stage and even those that do commence clinical development have only a small chance of successfully completing clinical development and gaining regulatory approval. Success in early phases of preclinical and clinical trials does not ensure that later clinical trials will be successful, and interim results of a clinical trial do not necessarily predict final results. A failure of one or more of our clinical trials can occur at any stage of testing. We may experience numerous unforeseen events during, or as a result of, the clinical trial process that could delay or prevent our ability to receive regulatory approval or commercialize our product candidates. Therefore, our business currently depends entirely on the successful development, regulatory approval and commercialization of our product candidates, which may never occur.
| 46 |
我們候選產品的臨牀前研究的結果可能不能預測未來的臨牀前研究或臨牀試驗的結果。
要獲得上市和銷售我們的任何候選產品所需的監管批准,我們必須通過廣泛的臨牀前研究和臨牀試驗證明我們的候選產品在人體內是安全、純淨和有效的。IND必須經過廣泛的臨牀前研究(包括臨牀前實驗室測試、動物實驗和符合良好實驗室規範的配方研究)才能提交FDA 並生效,這是在美國進行人體臨牀試驗的先決條件。臨牀前研究的成功並不能確保以後的臨牀前研究或臨牀試驗也會成功。生物技術和製藥行業的一些公司在臨牀試驗中遭遇了重大挫折,即使在早期的臨牀前研究中取得了積極的結果。這些挫折是由臨牀試驗進行期間的臨牀前發現以及在臨牀試驗中進行的安全性或有效性觀察(包括以前未報告的不良事件)等原因造成的。臨牀試驗的設計可以決定其結果是否支持產品的批准, 在臨牀試驗進展良好之前,臨牀試驗設計中的缺陷可能不會變得明顯。此外,我們或我們的研究人員可能無法控制受試者是否遵守臨牀試驗方案的重要方面。此外,臨牀前和臨牀數據往往容易受到不同解釋和分析的影響。儘管在早期的研究中有任何潛在的有希望的結果,但我們不能確定我們不會面臨類似的挫折。此外,我們的臨牀前動物研究結果可能不能預測後續人體臨牀試驗的結果。臨牀試驗中的候選產品可能無法顯示出所需的藥理特性或安全性和有效性特性,儘管已通過臨牀前研究取得進展。
如果我們在候選產品的臨牀前研究或臨牀試驗中未能收到積極的結果,我們最先進的候選產品的開發時間表和監管批准以及商業化前景將相應地受到負面影響,我們的業務和 財務前景將受到負面影響。
對我們的任何候選產品進行任何針對任何適應症的必要研究的任何 終止或暫停,或開始或完成的任何延誤都可能導致我們的成本增加,延遲或限制我們的創收能力,並對我們的商業前景產生不利影響 .
臨牀研究的開始和完成可能會因多種原因而推遲,包括與以下方面有關的延遲:
| ● | FDA或類似的外國監管機構未能批准繼續進行, 擱置了臨牀研究; | |
| ● | 臨牀試驗受試者 未能以我們預期的速度登記或繼續登記參加我們的試驗; | |
| ● | 生產我們的任何候選產品的工廠因違反cGMP要求或其他適用要求而被FDA或其他政府或監管機構責令暫時或永久關閉,或製造過程中候選產品的交叉污染 ; | |
| ● | 可能需要或希望對我們的製造流程進行的任何 更改; | |
| ● | 受試者 為我們正在開發的產品的適應症選擇替代療法 候選對象,或參與競爭性臨牀研究; | |
| ● | 出現嚴重或意想不到的藥物不良反應的受試者; | |
| ● | 類似技術和產品的臨牀測試報告 引發了安全性和/或有效性問題 ; | |
| ● | 第三方 臨牀研究人員被吊銷進行臨牀試驗所需的執照或許可 ,未按預期時間表進行臨牀試驗或採用符合臨牀試驗規程、cGMP要求的方法,或者其他未及時、準確地進行數據收集和分析的第三方; |
| 47 |
| ● | FDA、類似的外國監管機構或IRBs對臨牀研究地點進行檢查,發現 違反規定的行為,要求我們採取糾正措施,導致暫停或終止一個或多個地點,或對整個研究實施臨牀暫停, 或禁止我們使用部分或全部數據來支持我們的營銷應用程序; | |
| ● | 第三方承包商因違反監管要求而被FDA或其他政府或監管機構禁止或暫停或以其他方式處罰,在這種情況下,我們可能需要 尋找替代承包商,我們可能無法使用此類承包商提供的部分或任何數據來支持我們的營銷應用程序; | |
| ● | 一個或多個研究所拒絕批准、暫停或終止研究地點的研究,禁止招收更多的受試者,或撤回對試驗的批准; 與潛在合同研究機構、或CRO和臨牀試驗地點就可接受的條款達成協議,條款可進行廣泛談判 ,不同CRO和試驗地點的條款可能存在較大差異; | |
| ● | 臨牀站點偏離試驗方案或退出試驗; | |
| ● | 增加 個新的臨牀試驗地點; | |
| ● | CRO因任何原因不能進行任何臨牀試驗;以及 | |
| ● | 政府 或監管延遲或需要暫停或終止試驗的“臨牀擱置” 。 |
產品 如果我們在測試或審批方面有延誤,或者如果我們需要執行比計劃更多的 或更大的臨牀研究,我們任何候選產品的開發成本都將增加。此外,法規要求和政策可能會發生變化,我們可能需要修改 研究方案以反映這些變化。修正案可能要求我們向FDA、類似的外國監管機構和IRBs重新提交我們的研究方案進行重新審查,這可能會影響該研究的成本、時間或成功完成。如果我們遇到 延遲完成,或者如果我們、FDA或其他監管機構、IRB或其他審查實體,或我們的任何臨牀研究站點暫停或終止我們對任何候選產品的任何臨牀研究,其商業前景可能會受到實質性的 損害,我們創造產品收入的能力將被推遲。完成臨牀試驗的任何延誤都將增加我們的成本, 減慢我們的開發和審批流程,並危及我們開始產品銷售和創造收入的能力。任何此類 事件都可能嚴重損害我們的業務、財務狀況和前景。此外,許多導致或導致臨牀研究終止或暫停,或臨牀研究開始或完成延遲的因素,最終也可能導致我們的候選產品被監管部門拒絕批准。此外,如果一項或多項臨牀研究被推遲,我們的競爭對手可能會 先於我們將競爭產品推向市場,而我們任何受影響的候選產品的商業可行性可能會顯著 降低。
即使 如果我們的任何候選產品獲得監管部門的批准,我們也可能無法成功地將該產品商業化。 我們從其銷售中獲得的收入(如果有)可能是有限的。
如果 被批准上市,我們候選產品的商業成功將取決於醫療 社區(包括醫生、患者和醫療保健付款人)對每種產品的接受程度。市場對我們的任何候選產品的接受程度將 取決於許多因素,包括:
| ● | 展示臨牀安全性和有效性; | |
| ● | 相對 方便、給藥負擔和易於管理; | |
| ● | 任何不良影響的流行率和嚴重程度; | |
| ● | 醫生為我們的候選產品開處方的意願,以及目標患者羣體嘗試新療法的意願。 | |
| ● | 我們的候選產品與競爭產品相比的功效 ; | |
| ● | 針對我們的候選產品可能獲得批准的適應症 推出未來可能出現的任何新產品; | |
| ● | 新的 程序或療法,可減少我們的候選產品可能顯示實用的任何適應症的發生率; | |
| ● | 定價 和成本效益; | |
| ● | 在適用的治療和疫苗指南中包括或省略我們的候選產品; | |
| ● | 我們自己或任何未來合作伙伴的銷售和營銷策略的有效性; | |
| ● | 監管部門批准的標籤中包含的限制或警告; |
| 48 |
| ● | 我們 能夠從政府醫療保健計劃(包括Medicare和Medicaid)獲得並維持足夠的第三方保險或報銷,私人健康保險公司和其他第三方付款人,或從管理治療藥物定價和使用的政府機構獲得必要的定價批准;和 | |
| ● | 患者在沒有第三方保險或報銷或政府定價審批的情況下自付費用的意願 。 |
如果我們的任何候選產品獲得批准,但沒有獲得醫生、醫療保健付款人和患者的足夠程度的接受,我們可能無法產生足夠的收入,我們可能無法實現或維持盈利。我們努力讓醫療界和第三方付款人瞭解我們的候選產品的好處,這可能需要大量資源,而且可能永遠不會成功。
此外,即使我們獲得了監管部門的批准,任何批准的時間或範圍也可能會禁止或降低我們將候選產品成功商業化的能力。 例如,如果審批過程太長,我們可能會錯過預期的市場機會,並使其他 公司有能力開發競爭產品或建立市場主導地位。我們最終獲得的任何監管批准都可能是有限的,或者受到限制或審批後承諾的限制,從而使我們的候選產品在商業上不可行。例如, 監管機構可能會批准我們的任何候選產品的適應症少於或超過我們要求的範圍,可能不會批准我們打算對任何候選產品收取的價格,可能會批准取決於昂貴的上市後臨牀試驗的表現,或者可能批准我們的任何候選產品的標籤不包括該適應症成功商業化所必需或需要的標籤聲明 。此外,FDA或類似的外國監管機構可以在批准上附加條件,或要求風險管理計劃或風險評估和緩解戰略(REMS),以確保藥物的安全使用。 此外,如果產品不符合監管標準或在產品首次上市後出現問題,可能會撤回產品批准。上述任何一種情況都可能對我們的候選產品的商業成功造成實質性損害。
即使 如果我們的任何候選產品獲得了市場批准,我們也將受到持續的義務和持續的監管 審查,這可能會導致大量的額外費用。此外,我們的候選產品可能受到標籤和其他 限制並退出市場,如果我們未能遵守監管要求或 我們的候選產品遇到意想不到的問題,我們可能會受到處罰。
即使 如果我們的任何候選產品獲得了監管部門的批准,FDA或外國同等機構仍可能對其指示用途或營銷或批准條件施加 重大限制,或對可能 昂貴且耗時的審批後研究(包括4期臨牀試驗)和上市後監測以監測安全性和 療效施加持續要求。我們的候選產品還將遵守有關製造、標籤、包裝、存儲、分銷、安全監控、廣告、促銷、記錄和報告不良事件及其他上市後信息的持續法規要求 。這些要求包括向FDA註冊,以及對於我們在批准後進行的任何臨牀試驗,繼續遵守當前的良好臨牀實踐法規或CCP。此外,藥品製造商及其設施 要接受FDA和其他監管機構的持續審查和定期檢查,以確保符合當前的cGMP、與質量控制、質量保證和相應的記錄和文件維護相關的要求。
FDA有權要求將REMS作為BLA的一部分或在批准後進行,這可能會對批准的藥物的分發或使用施加進一步的要求或限制,例如將處方限制在經過 專門培訓的特定醫生或醫療中心,將治療限制為滿足某些安全使用標準的患者,或要求患者測試、監測和/或在登記中登記。
對於與我們的候選產品相關的銷售和營銷活動,廣告和促銷材料除了遵守美國其他適用的聯邦、州和地方法律以及其他國家/地區的類似法律要求外,還必須符合FDA的 規則。 在美國,向醫生分發產品樣本必須符合美國處方藥 營銷法的要求。根據更改的性質,申請持有人必須獲得FDA批准才能更改產品和製造。 我們還可能通過我們的客户和合作夥伴直接或間接地受到各種欺詐和濫用法律的約束,包括但不限於美國反回扣法規、美國虛假索賠法案和類似的州法律,這些法律除其他外,還會影響我們擬議的銷售、營銷和科學/教育資助計劃。如果我們參加了美國醫療補助藥品回扣計劃、美國退伍軍人事務部的聯邦供應時間表或其他政府藥品計劃,我們將受到有關報告和付款義務的複雜法律和 法規的約束。所有這些活動還可能受到美國聯邦和州 消費者保護和不正當競爭法律的約束。在其他國家的許多這樣的領域也存在類似的要求。
| 49 |
此外,如果我們的任何候選產品被批准用於特定用途,我們的產品標籤、廣告和促銷 將受到監管要求和持續的監管審查。FDA嚴格監管關於處方藥的促銷聲明。特別是,產品不得用於未經FDA批准的用途,如產品批准的標籤中所反映的那樣。如果我們的候選產品獲得了市場批准,醫生仍然可以合法地 以與批准的標籤不一致的方式向他們的患者開出我們的產品。如果我們被發現推廣此類 標籤外使用,我們可能會面臨重大責任和政府罰款。FDA和其他機構積極執行禁止推廣標籤外使用的法律和法規,被發現不當推廣標籤外使用的公司可能會受到重大制裁。聯邦政府已對涉嫌不當促銷的公司處以鉅額民事和刑事罰款,並禁止幾家公司從事標籤外促銷。FDA還要求公司 簽訂永久禁令的同意法令,根據這些法令,特定的促銷行為將被改變或減少。
如果我們或監管機構發現候選產品存在以前未知的問題,例如未預料到的嚴重程度或頻率的不良事件、生產產品的設施存在問題,或者我們或我們的製造商未能遵守適用的 監管要求,我們可能會受到以下行政或司法制裁:
| ● | 限制產品的銷售或製造、從市場上召回產品、或自願或強制召回產品; | |
| ● | 發出警告信或無標題信; | |
| ● | 臨牀 堅持; | |
| ● | 禁制令或施加民事或刑事處罰或罰款; | |
| ● | 暫停或撤回監管審批; | |
| ● | 暫停任何正在進行的臨牀試驗; | |
| ● | 拒絕批准我們提交的待決申請或已批准申請的補充申請,或暫停或撤銷產品許可批准; | |
| ● | 暫停 或對運營施加限制,包括代價高昂的新制造要求; 或 | |
| ● | 產品 扣押、扣押或拒絕允許進口或出口產品。 |
發生上述任何事件或處罰可能會抑制我們將候選產品商業化並創造收入的能力。 無論是在審批前還是審批後,不利的監管行動也可能導致產品責任索賠並增加我們的產品責任風險。
我們 也無法預測美國或國外未來的立法或行政 行動可能產生的政府監管的可能性、性質或程度,遵守此類監管可能代價高昂,並消耗大量財務 和管理資源。如果我們或任何未來的營銷協作者或合同製造商緩慢或無法適應現有要求的變化或新要求或政策的採用,或者無法保持合規性,則可能會 延遲或阻止我們產品的推廣、營銷或銷售,這將對我們的業務和運營結果產生不利影響。
| 50 |
在一個司法管轄區獲得並保持對我們候選產品的監管批准並不意味着我們將在其他司法管轄區成功獲得 我們候選產品的監管批准。
在一個司法管轄區獲得並保持對我們的候選產品的監管批准並不能保證我們能夠在任何其他司法管轄區獲得或 維持監管批准,但在一個司法管轄區未能或延遲獲得監管批准可能會對其他司法管轄區的監管審批流程產生負面影響。例如,即使FDA批准了候選產品的上市 ,外國司法管轄區的可比監管機構也必須批准該候選產品在這些國家/地區的製造、營銷和推廣。審批程序因司法管轄區而異,可能涉及與美國不同的要求和行政審查期限,包括額外的臨牀前研究或臨牀試驗,因為在一個司法管轄區進行的臨牀研究 可能不會被其他司法管轄區的監管機構接受。在美國以外的許多司法管轄區,候選產品必須先獲得報銷批准,然後才能在該司法管轄區批准銷售。在某些情況下,我們打算對產品收取的價格也需要審批。
獲得外國監管批准並遵守外國監管要求可能會給我們帶來重大延誤、困難和 成本,並可能推遲或阻止我們的候選產品在某些國家/地區推出。如果我們未能遵守國際市場的監管要求和/或獲得相應的營銷批准,我們的目標市場將會減少 ,我們充分發揮候選產品市場潛力的能力將受到損害。
即使 雖然我們可以為候選產品申請孤兒藥物指定,但我們可能無法獲得孤兒藥物營銷排他性。
我們 認為,在某些情況下,我們的候選產品可能有資格獲得FDA的孤立藥物地位。不能保證FDA將批准我們的任何候選產品未來的任何孤兒藥物指定申請,這將使我們沒有資格獲得 孤兒藥物指定的額外排他性和其他好處。
根據《孤兒藥品法》,FDA可以將用於治療罕見疾病或疾病的藥物授予孤兒藥物稱號,這種疾病或疾病通常是指在美國影響不到200,000人的疾病或疾病,因此沒有合理的預期 在美國開發和提供治療此類疾病或疾病的藥物的成本將從產品的銷售中收回 。在提交BLA之前,必須申請指定孤兒藥物。在FDA批准孤兒藥物指定後, FDA將公開披露治療劑的身份及其潛在的孤兒用途。孤立產品命名不會 在監管審批過程中傳達任何優勢或縮短持續時間。除了可能的獨佔期 外,孤兒指定還使公司有資格在四年內每年獲得高達650,000美元的贈款資金,以支付臨牀試驗費用、臨牀研究費用的税收抵免,以及可能免除FDA申請用户費用。
如果具有孤兒稱號的產品隨後獲得FDA對其具有孤兒稱號的疾病或病症的第一次批准,則該產品有權獲得孤兒藥品排他性,這意味着FDA在七年內不得批准同一藥物在同一適應症下銷售的任何其他申請,除非在有限情況下,例如:(I)該藥物的孤兒稱號被撤銷;(Ii)其上市批准被撤回;(Iii)孤兒排他性持有者同意批准另一申請人的 產品;(Iv)孤兒排他性持有者不能保證獲得足夠數量的藥物;或(V)競爭對手的產品顯示出相對於具有孤兒排他性的產品的臨牀優勢。如果被指定為孤兒產品的藥物獲得了 比指定範圍更廣的適應症的上市批准,則該藥物可能沒有資格獲得孤兒藥物獨家經營權。如果我們選擇尋求此類申請,不能保證我們的任何候選產品在我們認為 可能符合條件的適應症中將獲得孤兒藥物指定。
當前的 和未來的立法可能會增加我們獲得候選產品的上市批准並將其商業化的難度和成本 ,並影響我們可能獲得的價格。
在 美國和一些外國司法管轄區,有關醫療保健系統的立法和法規更改以及擬議的更改 可能會阻止或推遲我們候選產品的上市審批,限制或規範審批後活動 ,並影響我們銷售候選產品的盈利能力。已經提出了立法和監管建議,以擴大批准後的要求,並限制藥品的銷售和促銷活動。我們不知道是否會頒佈額外的立法變更,或FDA的法規、指南或解釋是否會更改,或此類變更對我們候選產品的上市審批(如果有)可能產生什麼影響。此外,美國國會對FDA審批過程的更嚴格審查可能會顯著推遲或阻止上市審批,並使我們受到更嚴格的產品標籤和上市後測試及其他要求的約束。
| 51 |
在美國,《聯邦醫療保險現代化法案》(Medicare Modinization Act,簡稱MMA)改變了聯邦醫療保險覆蓋和支付藥品的方式。立法擴大了老年人購買藥品的醫療保險覆蓋範圍,並引入了基於藥品平均銷售價格的新報銷方法。此外,這項立法授權Medicare Part D處方藥計劃使用處方,在這些處方中, 可以限制任何治療類別涵蓋的藥物數量。由於這項立法和聯邦藥品覆蓋範圍的擴大,我們預計將會有更多的壓力來控制和降低成本。這些降低成本的舉措 以及該立法的其他條款可能會降低我們為候選產品提供的覆蓋範圍和價格,並可能嚴重 損害我們的業務。雖然MMA僅適用於Medicare受益人的藥品福利,但私人付款人在設置自己的報銷費率時通常遵循Medicare承保政策和支付限制,而MMA導致的任何報銷減少 可能會導致私人付款人的付款減少類似的情況。
《患者保護和平價醫療法案》經2010年《醫療保健和教育負擔能力協調法案》(或統稱為ACA)修訂,是一部全面的法律,旨在擴大醫療保險的可及性,減少或限制醫療支出的增長,加強針對欺詐和濫用的補救措施,為醫療保健和醫療保險行業增加新的透明度要求, 對醫療行業徵收新的税費,並實施額外的醫療政策改革。出於報告目的,ACA修改了“製造商平均價格”的定義,這可能會增加對各州的醫療補助藥品退税金額。該法律還對生產或進口品牌處方藥產品的公司徵收了一筆可觀的年費。此外,2022年8月16日,總裁·拜登簽署了2022年通脹削減法案,將個人在ACA市場購買醫療保險的增強補貼延長至2025年。從2025年開始,IRA還通過顯著降低受益人的最大自付成本和創建新的製造商折扣計劃來消除Medicare Part D計劃下的“甜甜圈洞” 。目前尚不清楚這些挑戰以及拜登政府的醫療改革措施將如何影響ACA和我們的業務。
此外,自ACA頒佈以來,美國還提出並通過了其他立法修改。2011年,美國 國會頒佈了《2011年預算控制法》或《預算控制法》,其中包括旨在減少聯邦赤字的條款。預算控制法案導致從2013年開始對醫療保險提供者的支付減少2%, 由於隨後對該法規的立法修訂,該法案將在沒有國會額外行動的情況下一直有效到2027年。然而, 根據CARE法案和後續立法,由於新冠肺炎大流行,這些削減將從2020年5月1日至2022年3月31日暫停。2013年1月,2012年《美國納税人救濟法》簽署成為法律,其中包括減少向多家醫療服務提供者支付的醫療保險費用,並將政府向服務提供者追回多付款項的訴訟時效期限從三年延長至五年。這些新法律可能會導致聯邦醫療保險和其他醫療保健資金的進一步減少,如果獲得批准,這可能會對我們藥品的客户以及我們的財務運營產生實質性的不利影響。如果政府支出進一步削減,預計的預算缺口也可能影響FDA等相關機構繼續以當前水平運作的能力,這可能會影響相關機構及時審查和批准研發、製造和營銷活動的能力,這可能會推遲我們開發、營銷和銷售任何候選產品的能力。 此外,任何影響Medicare、Medicaid或其他可能實施的公共資助或補貼醫療計劃的重大支出削減,或可能對我們徵收的任何重大税收或費用,作為任何更廣泛的赤字削減努力的一部分 或對《預算控制法案》的立法替代,可能會對我們預期的產品收入產生不利影響。
| 52 |
此外, 最近,政府加強了對製造商為其商業產品定價的方式的審查。 美國國會最近進行了幾次調查,提出並頒佈了聯邦和州立法,旨在提高藥品定價的透明度,審查定價與製造商患者計劃之間的關係,降低醫療保險下的藥品成本,並改革政府計劃的藥品報銷方法。2020年9月24日,FDA 發佈了一項最終規則,為各州制定和提交來自加拿大的藥物進口計劃提供指導。此外,2020年11月20日,美國衞生與公眾服務部(HHS)敲定了一項法規,取消了藥品製造商對D部分下計劃贊助商降價的安全港保護 直接或通過藥房福利經理,除非 法律要求降價。該規則還為反映在銷售點的降價創造了新的安全港, 也為藥房福利經理和製造商之間的某些固定費用安排創造了安全港。2022年8月16日, 國會頒佈了《2022年通脹削減法案》,其中包含多項與處方藥成本有關的條款,包括對聯邦政府價格談判的要求、返點要求,以及對Medicare Part D投保人的自付支出上限。 在州一級,立法機構越來越多地通過立法並實施旨在控制藥品和生物製品定價的法規,包括價格或患者報銷限制、折扣、對某些產品准入的限制 以及營銷成本披露和透明度措施,在某些情況下,旨在鼓勵從其他國家進口和 批量購買。
2020年11月20日,衞生和公眾服務部監察長辦公室敲定了對聯邦反回扣法規的進一步修改。根據《最終規則》,衞生與公眾服務部監察長辦公室根據《反回扣法規》為臨牀醫生、提供者和其他人之間的某些協調護理和基於價值的安排增加了安全港保護,但取消了 製藥商直接或通過藥房福利經理對D部分下的計劃贊助商降價的安全港保護,除非法律要求降價 。該規則還為反映在銷售點的降價創造了新的安全港,以及為藥房福利經理和製造商之間的某些固定費用安排創造了安全港。此規則(有例外情況)於2021年1月19日生效。我們將繼續評估這些規則將對我們的業務產生什麼影響(如果有的話)。CMS於2019年7月9日發佈了最終規則, 要求處方藥和生物製品的直接面向消費者的廣告(可通過或根據Medicare或Medicaid付款)在廣告中包括該藥物或生物製品的批發採購成本或標價,如果該藥品或生物製品的每月供應或通常療程的批發價等於或大於35美元。違反這些要求的處方藥和生物製品將被列入公共名單。任何採用的醫療改革措施 如果獲得批准,可能會降低對我們產品的最終需求,或者給我們的產品定價帶來壓力。美國各個州也越來越積極地通過立法和實施法規來控制藥品定價,包括價格或患者報銷限制、折扣、對某些產品准入和營銷成本披露的限制 以及透明度措施,在某些情況下,旨在鼓勵從其他國家進口和批量採購。此外,地區醫療當局和個別醫院越來越多地使用招標程序來確定哪些藥品 以及哪些供應商將包括在其處方藥和其他醫療保健計劃中。我們預計未來將採取更多的州和聯邦醫療改革措施。
在歐洲聯盟或歐盟提供醫療保健,包括醫療服務的建立和運營以及藥品的定價和報銷,幾乎完全是國家法律和政策的問題,而不是歐盟的法律和政策。各國政府和衞生服務提供者在提供衞生保健以及產品定價和報銷方面有不同的優先事項和方法 。然而,總的來説,大多數歐盟成員國的醫療預算限制導致相關醫療服務提供商對藥品的定價和報銷進行了限制。再加上希望開發和營銷產品的歐盟和國家監管機構的負擔不斷增加,這可能會阻止或推遲我們的候選產品的上市審批,限制 或監管審批後的活動,並影響我們將任何獲得上市審批的產品商業化的能力。在美國和歐盟,都提出了立法和監管建議,以擴大審批後的要求,並限制 藥品的銷售和促銷活動。我們不知道是否會頒佈額外的法律變更, 或法規、指南或解釋是否會更改,或此類更改對我們的候選產品的上市審批 可能會產生什麼影響。
| 53 |
第三方保險和報銷、醫療成本控制計劃和治療指導方針可能會限制我們未來的收入。
我們 能否成功營銷我們的候選產品,部分取決於政府衞生行政部門、私人健康保險公司和其他組織為我們候選產品和相關治療提供的報銷水平。 我們的任何候選產品經常通過國家醫療保險計劃下的報銷計劃銷售的國家/地區 要求藥品製造商和銷售商在初始價格和任何後續價格上漲時獲得政府批准。在某些國家,包括美國,政府資助和私人醫療保健計劃可能會對價格施加巨大的間接壓力。如果未批准足夠的價格或覆蓋範圍 且無法獲得報銷或報銷範圍有限,我們可能無法銷售我們的候選產品以盈利。越來越多的第三方付款人試圖通過 可能影響我們產品開發的方式來控制醫療成本,包括:
| ● | 未能批准或者對保健品價格提出異議的; | |
| ● | 從價格較低的司法管轄區引入 再進口計劃; | |
| ● | 限制新治療產品的覆蓋範圍和報銷金額; | |
| ● | 拒絕 或限制監管機構批准但被第三方付款人視為試驗性或調查性產品的承保範圍;以及 | |
| ● | 當批准的產品用於未獲得監管部門 市場批准的方式時,拒絕提供保險。 |
我們與客户和付款人的關係受到適用的反回扣、欺詐和濫用以及其他醫療法律法規的約束, 如果違反這些法律法規,我們可能面臨刑事制裁、民事處罰、被排除在政府醫療保健計劃之外、合同損害、聲譽損害以及利潤和未來收入減少。
醫療保健 提供者、醫生和其他人將在推薦和處方我們獲得市場批准的任何產品時發揮主要作用。我們未來與第三方付款人和客户的協議可能使我們面臨廣泛適用的欺詐和濫用 和其他醫療法律法規,主要是在美國,這可能會限制我們營銷、銷售和分銷我們獲得營銷批准的產品的業務或財務安排 和關係。根據 適用的醫療法律法規的限制,包括:
| ● | 聯邦反回扣法規禁止明知和故意提供、支付、招攬或收取任何形式的報酬,以換取或引誘 (I)轉介某人,(Ii)提供或安排提供根據Medicare、Medicaid或其他政府計劃可報銷的物品或服務,或 (Iii)購買、租賃或訂購或安排或推薦購買、租賃或訂購根據Medicare可報銷的任何物品或服務。醫療補助或其他政府計劃。 個人或實體不需要實際瞭解法規或具體意圖即可違反法規 即可實施違規。此外,政府可主張 根據《虛假索賠法》,包括因違反聯邦《反回扣條例》而產生的物品或服務的索賠構成虛假或欺詐性索賠; | |
| ● | 聯邦虛假索賠法案對故意向聯邦政府提交或導致提交的個人或實體施加民事處罰,並規定民事舉報人或準訴訟。虛假或欺詐性的付款要求,或者為逃避、減少或隱瞞向聯邦政府付款的義務而做出虛假陳述的; | |
| ● | HIPAA 對執行詐騙任何醫療福利計劃的計劃或做出與醫療保健事項相關的虛假陳述的行為追究刑事和民事責任。與聯邦《反回扣法規》類似,個人或實體不需要實際瞭解法規或違反法規的具體意圖即可實施違規; | |
| ● | 聯邦虛假陳述法禁止明知和故意偽造、隱瞞、掩蓋重大事實或作出任何與醫療保健福利、項目或服務的交付或付款有關的重大虛假陳述。 | |
| ● | 根據ACA創建的《醫生支付陽光法案》及其實施條例, 該法案要求藥品、器械、生物製品和醫療用品的指定製造商 可根據聯邦醫療保險獲得付款,醫療補助或兒童健康保險計劃,除特定的例外情況外,每年向CMS報告與支付 或向醫生進行的其他“價值轉移”有關的信息。所有此類報告信息 均可公開獲取; |
| 54 |
| ● | 類似的州和非美國的法律法規,例如某些州的反回扣和虛假索賠 法律可能適用於任何第三方付款人報銷的項目或服務,包括商業保險公司 ;州法律要求製藥公司遵守 行業的自願合規指南和聯邦政府頒佈的適用合規指南,或以其他方式限制可能向醫療保健提供者和其他潛在轉介來源支付的款項;州法律,要求藥品製造商報告與向醫生和其他醫療保健提供者支付或以其他方式轉移價值或營銷支出有關的信息。以及在某些情況下管理健康信息隱私和安全的州法律,其中許多法律在許多方面存在重大差異,可能不會產生相同的效果,從而使合規工作複雜化;以及 | |
| ● | 由CMS監管和HHS監察長辦公室或美國司法部執行。 |
由於這些法律的廣度以及法定例外和可用避風港的狹隘,我們 未來的一些商業活動可能會受到一項或多項此類法律的挑戰。
確保我們與第三方的業務安排符合適用的醫療法律法規的努力將涉及 鉅額成本。政府當局可能會得出結論,我們的業務實踐可能不符合當前或未來涉及適用欺詐和濫用或其他醫療保健法律和法規的法規、法規或判例法。如果我們的業務 被發現違反了任何這些法律或任何其他可能適用於我們的政府法規,我們可能會受到重大的民事、刑事和行政處罰、損害賠償、罰款、被排除在美國政府資助的醫療保健計劃之外,如Medicare 和Medicaid,以及削減或重組我們的業務。如果我們希望與之開展業務的任何醫生或其他提供者或實體被發現不符合適用法律,他們可能會受到刑事、民事或行政 制裁,包括排除在政府資助的醫療保健計劃之外。
與我們知識產權有關的風險
保護我們的知識產權是困難和昂貴的,我們無法確保這些權利的保護。
我們的商業成功將在一定程度上取決於我們是否有能力在必要時針對第三方 挑戰起訴和捍衞我們的專利權,併成功地針對第三方競爭對手實施這些專利權。生物技術公司的專利地位可能高度不確定,涉及複雜的法律、科學和事實問題,其中重要的法律原則仍未解決。 專利法或專利法解釋的變化可能會降低我們知識產權的價值。因此, 我們無法預測在我們或我們的專利權許可人提交的任何專利申請中可能允許或可強制執行的索賠的廣度 。我們持有或許可的與我們的微生物平臺和相關技術相關的專利和專利申請 可能會受到第三方的挑戰、無效或規避,並且可能無法保護我們免受具有類似產品或技術的競爭對手的影響。
由我們持有或授權給我們的專利權提供的未來保護程度是不確定的,因為法律手段只能提供有限的 保護,而可能無法充分保護我們的權利,使我們能夠獲得或保持我們的競爭優勢,或為我們提供任何競爭優勢。我們不能確定第三方擁有的任何專利申請不會優先於我們提交或我們持有許可權的專利申請,也不能確定我們不會捲入美國或外國專利局的幹擾、反對或無效訴訟 。
此外, 如果我們對第三方提起法律訴訟,以強制執行涵蓋我們任何候選產品的專利,被告 可以反訴該專利無效和/或不可強制執行。在美國的專利訴訟中,被告聲稱無效和/或不可執行的反訴是司空見慣的。質疑有效性的理由包括據稱未能滿足 幾項法定要求中的任何一項,包括缺乏新穎性、明顯或無法實施。不可執行性斷言的理由包括 與專利起訴有關的人在起訴期間向美國專利商標局或USPTO隱瞞相關信息或做出誤導性陳述的指控。第三方也可以向美國或國外的行政機構提出類似的索賠,即使在訴訟範圍之外也是如此。這類機制包括複審、贈款後審查和外國司法管轄區的同等程序,例如反對程序。此類訴訟可能導致撤銷或修改由我們持有或授權給我們的專利,使其不再涵蓋我們的候選產品或競爭產品。在法律上斷言無效和不可執行之後的結果 是不可預測的。例如,關於有效性,我們不能確定 沒有無效的先前技術,而我們、我們專利權的任何許可人或專利審查員在起訴期間並不知道這一點。 如果被告勝訴,無效和/或不可強制執行的法律主張成立,我們將失去對我們任何候選產品的至少部分,甚至全部 專利保護。這種專利保護的喪失將對我們的業務產生實質性的不利影響。
| 55 |
我們 依靠專有技術和商業祕密來保護技術,特別是在我們認為專利保護不合適或 可以獲得的情況下。然而,專有技術和商業祕密很難保護。雖然我們要求員工、學術合作者、顧問和其他承包商簽訂保密協議,但我們可能無法充分保護我們的商業祕密或其他專有或許可信息。通常,研究合作者和科學顧問有權發佈數據和信息,而我們可能有權發佈這些數據和信息。強制執行第三方非法獲取和使用我們的任何商業祕密的聲明是昂貴和耗時的 ,結果不可預測。此外,與專利相比,法院有時更不願意保護商業祕密。此外,我們的競爭對手可以自主開發同等的知識、方法和訣竅。
如果 我們無法為我們的候選產品或我們的技術獲得或維護專利保護或商業祕密保護,第三方 可能會使用我們的專有信息,這可能會削弱我們在市場上的競爭能力,並對我們創造 收入和實現盈利的能力產生不利影響。
我們的 候選產品可能會侵犯他人的知識產權,這可能會增加我們的成本,延遲或阻礙我們的開發和商業化努力。
我們的成功在一定程度上取決於避免侵犯他人的專有技術。製藥業的特點是涉及專利和其他知識產權的訴訟頻繁。識別可能與我們的專有技術相關的第三方專利權是困難的,因為專利搜索由於 專利之間的術語差異、數據庫不完整以及難以評估專利權利要求的含義而不完善。此外,由於專利申請 在申請發佈之前一直保密,我們可能不知道我們的任何候選產品或任何未來候選產品的商業化 可能會侵犯第三方專利。可能會有某些已頒發的專利和專利申請聲稱 我們可能需要獲得許可才能對我們的任何候選產品進行研究、開發或商業化,而我們 不知道這些專利和專利申請是否可以按商業合理的條款獲得許可,或者根本不知道。第三方提出的任何專利侵權索賠都將非常耗時,並且可能:
| ● | 結果 訴訟費用高昂; | |
| ● | 轉移我們技術人員和管理人員的時間和注意力; | |
| ● | 防止 我們將產品商業化,直到主張的專利到期或最終被法院裁定為無效或未被法院侵犯; | |
| ● | 要求我們停止或修改我們對該技術的使用和/或開發非侵權技術; 或 | |
| ● | 要求 我們簽訂版税或許可協議。 |
第三方 可能擁有可能阻止我們的任何候選產品上市的專有權利。任何針對我們要求損害賠償並試圖禁止與我們的任何候選產品或我們的工藝有關的商業活動的專利相關法律訴訟都可能 使我們承擔潛在的損害賠償責任,並要求我們獲得許可證才能繼續製造或銷售我們的任何候選產品或任何未來的候選產品。我們無法預測我們是否會在任何此類訴訟中獲勝,也無法預測這些專利所需的任何許可證是否會以商業上可接受的條款提供(如果有的話)。此外,如果有必要,我們不能確定我們 是否可以重新設計我們的候選產品或任何未來的候選產品或流程,以避免侵權。因此, 司法或行政訴訟中的不利裁決,或未能獲得必要的許可證,可能會阻止我們 開發和商業化我們的任何候選產品或未來的候選產品,這可能會損害我們的業務、財務狀況和經營業績。
| 56 |
我們 預計還有其他公司,包括主要的生物製藥公司,在與我們推薦的候選產品競爭的領域開展工作,這些領域已經或可能導致提交可能被認為與我們的活動相關的專利申請。 如果我們要在法庭上挑戰這些或任何已發佈的美國專利的有效性,我們將需要克服適用於每一項已發佈的美國專利的法定有效性推定 。這意味着,為了勝訴,我們必須就專利權利要求的無效性提出明確而令人信服的證據。如果我們要在USPTO的專利審判和上訴委員會的行政審判中質疑這些或任何已頒發的美國專利的有效性,我們將必須證明 權利要求是不可專利的,因為證據佔優勢。不能保證陪審團和/或法院會在侵權、有效性或可執行性問題上做出有利於我們的裁決。即使我們成功了,訴訟也可能導致鉅額成本,並 分散管理層的注意力。
我們 可能會受到以下指控:我們錯誤地從競爭對手那裏僱傭了一名員工,或者我們或我們的員工錯誤地使用了 ,或者泄露了他們前僱主的所謂機密信息或商業祕密。
由於 在我們的行業中很常見,我們將聘用以前在其他生物製藥公司工作過的人員,包括我們的競爭對手或潛在競爭對手。雖然目前沒有針對我們的索賠待決,但我們未來可能會受到索賠 ,即我們的員工或潛在員工對其前僱主負有持續義務(例如競業禁止義務或非徵集義務),或者我們的員工或我們無意或以其他方式使用或泄露其前僱主的商業祕密或 其他專有信息。可能有必要提起訴訟來抗辯這些指控。即使我們成功地對這些索賠進行了辯護,訴訟也可能導致鉅額成本,並分散管理層的注意力。
與擁有我們的普通股有關的風險
我們股票的市場價格可能會受到波動和波動的影響。你可能會失去全部或部分投資.
我們普通股的市場價格受各種因素的影響而波動很大,其中有些因素超出了我們的控制範圍。 自2023年6月首次公開募股(IPO)以每股5美元的價格出售我們的普通股股份以來, 我們的普通股報告的 在2024年2月29日之前,我們的普通股的高、低銷售價格範圍從5. 18美元到0. 20美元不等。我們在紐交所美國股票的市場價格 可能會因多種因素而波動,其中一些因素超出了我們的控制範圍,包括但不限於 :
| ● | 我們和我們的競爭對手的經營結果和財務狀況的實際或預期變化 ; | |
| ● | 如果我們的股票在分析師的跟蹤範圍內,證券分析師的收益預期或推薦發生變化 ; | |
| ● | 市場對我們候選產品的接受度; | |
| ● | 他人開發技術創新或有競爭力的新產品; | |
| ● | 我們發佈的技術創新或新產品公告 ; | |
| ● | 發佈我們的候選產品的臨牀前或臨牀試驗結果; | |
| ● | 我們未能實現公開宣佈的里程碑; | |
| ● | 我們開發和營銷新的或增強的產品的支出與這些產品產生的銷售之間的延遲 ; | |
| ● | 有關知識產權的發展 ,包括參與由我們提起或針對我們提起的訴訟 ; | |
| ● | 監管事態發展和監管當局關於批准或拒絕新產品或改良產品的決定。 | |
| ● | 更改我們用於開發、獲取或許可新產品、技術或業務的金額 ; | |
| ● | 更改我們用於推廣候選產品的支出 ; | |
| ● | 我們的 出售或建議出售,或我們的主要股東在未來出售我們的股票或其他證券; |
| 57 |
| ● | 關鍵人員變動 ; | |
| ● | 我們或競爭對手的研發項目的成功或失敗; | |
| ● | 我們股票的交易量;以及 | |
| ● | 一般 經濟和市場狀況以及其他因素,包括與我們的經營業績無關的因素。 |
這些 因素和任何相應的價格波動可能會對我們股票的市場價格產生重大不利影響,並導致我們的投資者遭受重大損失。在過去,在市場波動之後,上市公司股東經常提起證券集體訴訟。如果我們捲入證券訴訟,可能會給我們帶來鉅額成本,並將我們管理層的資源和注意力從我們的業務上轉移出去。
我們的 未能滿足紐約證券交易所美國人的持續上市要求可能會導致我們的普通股退市。
如果 我們未能滿足NYSE American的持續上市要求,例如公司治理要求或最低收盤價要求,NYSE American可能會採取措施將我們的普通股退市。這樣的退市可能會對我們的普通股價格產生負面的 影響,並會削弱您在您願意的時候出售或購買我們的普通股的能力。如果發生退市事件,我們不能保證我們為恢復遵守上市要求而採取的任何行動將 允許我們的普通股重新上市,穩定市場價格或提高我們普通股的流動性,防止我們的普通股 跌破NYSE American的最低出價要求,或防止未來不遵守NYSE American的 上市要求。
未來的增資可能會稀釋您的所有權和/或對我們的運營產生其他不利影響.
如果 我們通過發行股權證券籌集額外資本,我們現有股東的所有權百分比將會減少,這些 股東可能會經歷大幅稀釋。如果我們通過發行債務證券籌集更多資金,這些債務證券將 擁有優先於我們普通股的權利,而發行的債務證券的條款可能會對我們的業務施加重大限制,包括對我們資產的留置權。如果我們通過協作和許可安排籌集更多資金,我們可能會被要求 放棄對我們的知識產權或候選產品的某些權利,或按對我們不利的條款授予許可。
有資格未來出售的股票 可能會對我們普通股的市場產生不利影響.
截至本報告日期,我們有28,804,643股已發行和流通的普通股,所有這些股票都有資格根據《證券法》頒佈的規則144通過公開市場的普通經紀交易進行銷售,但須遵守規則144下的某些 限制,約925,我們的管理人員和董事持有的774股普通股, 受IPO禁售,將於2024年8月到期。我們已授予可轉換 優先股和可轉換承兑票據的前持有人索購和附帶登記權,據此,他們可要求登記轉售最多9,542,519股普通股 。根據第144條或根據任何轉售報告出售我們的普通股的任何實質性出售可能對我們的普通股的市場價格產生重大不利影響。
根據《就業法案》,我們 是一家“新興成長型公司”,我們不能確定適用於新興成長型公司的披露要求的降低是否會降低我們的普通股對投資者的吸引力.
根據《就業法案》的定義,我們 是“新興成長型公司”,我們可以利用適用於非“新興成長型公司”的其他上市公司的各種 報告要求的某些豁免,包括但不限於:
| ● | 未要求遵守《薩班斯-奧克斯利法案》第404節的審計師認證要求; |
| 58 |
| ● | 在我們的定期報告和代理聲明中減少了關於高管薪酬的披露義務 ; | |
| ● | 免除 就高管薪酬進行不具約束力的諮詢投票和 股東批准任何黃金降落傘付款的要求;以及 | |
| ● | 延長了 可用於遵守新的或修訂的會計準則的過渡期。 |
我們 已選擇利用《就業法案》提供的所有福利,包括上文討論的豁免。我們無法預測投資者是否會因為我們可能依賴這些豁免而發現我們的普通股吸引力下降。如果一些投資者因此發現我們的普通股吸引力下降,我們的普通股可能會出現不那麼活躍的交易市場,我們的股價可能會更加波動。
我們 將在五年內保持“新興成長型公司”的地位,但如果我們的收入超過 12.35億美元,如果我們在三年期內發行超過10億美元的不可轉換債券,或者如果非關聯公司持有的普通股 市值在未來任何一年的6月30日超過7億美元,我們將很快失去這一地位。
根據《就業法案》,我們作為“新興成長型公司”的身份可能會使我們在需要時籌集資金變得更加困難 .
由於我們作為一家“新興成長型公司”獲得了各種報告要求的豁免,因此我們對投資者的吸引力可能會降低 ,因此我們可能很難在需要時籌集更多資本。如果投資者認為我們的報告不如行業中的其他公司透明,他們可能無法將我們的業務與行業內的其他公司進行比較。 如果我們無法在需要時籌集額外資本,我們的財務狀況和運營結果可能會受到實質性的 和不利影響。
我們 過去沒有為我們的普通股支付股息,目前也沒有支付此類股息的計劃.
我們 計劃在我們有收益的範圍內,將所有收益再投資,以支付運營成本,否則將成為並保持競爭力。 在可預見的將來,我們不打算就我們的普通股支付任何現金股息。我們不能向您保證,我們將在任何時候, 產生足夠的盈餘現金,將可用於分配給我們的普通股持有人作為股息。 因此,您不應期望從我們的普通股中獲得現金股息。
如果股票研究分析師不發表關於我們業務的研究或報告,或者如果他們發表不利評論或下調我們的股票評級,我們的股票價格可能會下跌.
我們股票的交易市場將部分依賴股票研究分析師發佈的關於我們和我們業務的研究和報告。 如果有的話。我們對這些分析師沒有控制權,他們也沒有承諾要寫關於我們的研究報告。如果沒有發佈關於我們或我們業務的研究報告,或者如果一個或多個股票研究分析師 下調了我們的股票評級,或者如果這些分析師發佈了其他不利的評論或停止發佈關於我們或我們業務的報告,則我們的股票價格可能會下跌。
我們 可能面臨更高的證券集體訴訟風險。
從歷史上看, 證券集體訴訟通常是在證券市場價格下跌後針對公司提起的。 這種風險對我們尤其重要,因為生物技術和製藥公司近年來經歷了重大的股價波動 。如果我們被起訴,可能會導致大量成本,並轉移管理層的注意力和資源, 這可能會損害我們的業務。我們為董事和高級管理人員購買了保險,我們認為該保險足以保護我們免受潛在的 索賠;但是,我們有責任滿足保單規定的某些免賠額,並且在任何情況下,我們無法向您保證 保險範圍將充分保護我們免受索賠。此外,保險成本可能會增加, 承保範圍可能會減少。因此,我們可能無法以合理的成本維持目前的保險水平,或根本無法維持。
| 59 |
我們的章程文件和特拉華州法律可能會阻止股東認為有利的收購。
本公司經修訂和重述的公司註冊證書、經修訂和重述的公司章程以及特拉華州法律的適用條款 可能會 延遲或阻礙涉及實際或潛在的控制權變更或管理層變更的交易,包括 股東可能會因其股份獲得溢價的交易,或本公司股東可能會認為 符合其最佳利益的交易。我們修訂和重述的公司註冊證書和修訂和重述的章程中的規定:
| ● | 限制可以召開股東大會的人; | |
| ● | 限制 我們的股東向我們的年度股東大會提出事項,或者如果沒有遵循適當的程序,則禁止 在我們的年度股東大會上提名董事。 | |
| ● | 是否沒有規定股東通過書面同意採取行動; | |
| ● | 是否沒有規定累積投票權;以及 | |
| ● | 提供 所有董事會空缺可由當時在任的大多數董事投贊成票填補 ,即使不足法定人數。 |
DGCL第 203條可能會限制我們與實益擁有我們已發行 有表決權股票15%或更多的人進行任何業務合併的能力,除非滿足某些條件。這一限制在股份收購後持續三年。 這些規定可能會加強我們的管理團隊,並可能剝奪您以高於當前價格的溢價將您的股份出售給 潛在收購者的機會。這種可能無法獲得控制權溢價的情況可能會降低我們普通股的價格 。
一般風險因素
會計準則的變化以及管理層與複雜會計事項相關的主觀假設、估計和判斷可能會對我們的財務狀況和經營結果的報告產生重大影響。
會計 美國普遍接受的會計原則以及相關的會計聲明、實施指南和解釋 我們適用於與我們的業務相關的廣泛事項,如長期資產減值會計和基於股份的薪酬,這些都是複雜的,涉及我們管理層的主觀假設、估計和判斷。這些規則或其解釋的變化,或我們管理層對基本假設、估計或判斷的變化,可能會顯著改變我們的報告或預期財務業績,或使其大幅波動。
如果未能根據《薩班斯-奧克斯利法案》第404條對財務報告進行有效的內部控制,可能會對我們的業務、財務狀況和經營結果產生重大不利影響。
我們的管理層負責建立和維護對財務報告的充分內部控制。財務報告內部控制是一個旨在根據美國公認會計原則(GAAP)對財務報告的可靠性和財務報表的編制提供合理保證的過程。根據上市公司會計監督委員會(PCAOB)制定的標準,當控制的設計或操作不允許管理人員或人員在正常履行其指定職能的過程中防止或及時發現錯誤陳述時,財務報告的內部控制存在缺陷。PCAOB將重大缺陷定義為財務報告內部控制的缺陷或缺陷的組合,因此有合理的可能性年度或中期財務報表的重大錯報將不會得到及時防止或發現和糾正。
| 60 |
根據薩班斯-奧克斯利法案第404條,我們 必須為我們向美國證券交易委員會提交的第二份10-K表格年度報告以及此後每年提交一份關於我們財務報告內部控制有效性的報告,其中包括管理層的報告。 我們的審計師還需要在我們是加速申報公司或大型加速申報公司而不再是新興成長型公司或較小的報告公司時證明我們財務報告內部控制的有效性。如果我們無法 斷言我們對財務報告的內部控制是有效的,或者在未來需要時,如果我們的獨立註冊會計師事務所無法對我們的財務報告內部控制的有效性發表無保留意見, 投資者可能會對我們財務報告的準確性和完整性失去信心,我們普通股的市場價格可能會受到不利影響,我們可能會成為我們普通股上市交易所、美國證券交易委員會或其他監管機構的訴訟或調查對象。這可能需要額外的財務和管理資源,並可能對我們的業務、財務狀況和運營結果產生重大不利影響。
我們管理團隊有限的上市公司經驗可能會對我們遵守美國證券法的報告要求的能力產生不利影響 ,這可能會對我們的業務產生實質性的不利影響。
我們的 官員的上市公司經驗有限,這可能會削弱我們遵守法律和監管要求的能力,例如 薩班斯-奧克斯利法案規定的要求。此類責任包括遵守聯邦證券法並及時披露所需信息。 任何此類缺陷、弱點或不合規性都可能對我們遵守1934年《證券交易法》或《交易法》的報告要求的能力產生重大不利影響,《交易法》是維持我們的上市公司地位所必需的。如果我們未能履行這些義務,我們繼續作為美國上市公司的能力將處於危險之中 ,在這種情況下,您可能會失去對我們公司的全部投資。
我們 發現了我們在財務報告內部控制方面的重大弱點,我們可能會在未來發現其他重大弱點,這些弱點可能會導致我們無法履行報告義務或導致我們的財務報表出現重大錯報。 如果我們未能糾正任何重大弱點,或者如果我們未能建立和保持對財務報告的有效控制, 我們準確及時報告財務業績的能力可能會受到不利影響。
有效的財務報告內部控制對於我們提供可靠的財務報告是必要的,再加上充分的披露 控制和程序旨在防止欺詐。任何未能實施所需的新的或改進的控制措施,或在實施過程中遇到困難,都可能導致我們無法履行我們的報告義務。此外,我們根據《薩班斯-奧克斯利法案》第404條進行的任何測試,或在需要時由我們的獨立註冊會計師事務所進行的後續測試, 可能會揭示我們在財務報告內部控制方面的缺陷,這些缺陷被認為是重大弱點,或可能需要對我們的財務報表進行 前瞻性或追溯性更改,或確定需要進一步關注或改進的其他領域。劣質的內部控制還可能導致投資者對我們報告的財務信息失去信心,這可能對我們普通股的交易價格產生負面影響 。還有一個風險是,我們和我們的獨立註冊公共會計師事務所(如果將來適用)都不能在規定的時間範圍內得出結論,即財務報告的內部控制 按照第404條的要求有效。因此,投資者可能會對我們的財務和其他公開報告失去信心,這 將損害我們的業務和我們普通股的交易價格。
在編制本報告所包含的財務報表的過程中,我們和我們的獨立註冊會計師事務所發現了一個重大弱點,因為它與會計職能缺乏充分的分離有關。我們正在實施旨在改善財務報告內部控制並彌補這一重大弱點的措施 。我們打算在我們的會計基礎設施內增加人員 ,以促進會計職能的適當分離。
我們 可能在財務報告的內部控制中發現未來的重大弱點,或無法滿足上市公司對我們提出的要求,包括薩班斯-奧克斯利法案的要求,我們可能無法準確報告我們的財務 結果,或在法律或證券交易所法規要求的時間範圍內報告這些結果。我們不能保證我們現有的材料缺陷將得到補救,或者不會存在或以其他方式發現其他材料缺陷,任何可能對我們的聲譽、財務狀況和運營結果產生不利影響的情況 。
| 61 |
作為一家向美國證券交易委員會報告的上市公司,我們 已經並將繼續大幅增加成本,我們的管理層將被要求投入大量時間來履行合規義務.
作為一家向美國證券交易委員會報告的上市公司,我們將繼續產生重大的法律、會計和其他費用,這是我們作為私營公司沒有發生的 。我們受《交易所法案》的報告要求、《薩班斯-奧克斯利法案》和《多德-弗蘭克華爾街改革與保護法》的報告和治理條款以及美國證券交易委員會隨後實施的規則的約束,這些規則對上市公司提出了重大要求,包括要求建立和維持有效的 披露和財務控制,以及改變公司治理做法。這些法律中有重要的公司治理和報告 條款,這將增加我們的法律和財務合規成本,使一些活動更加困難、耗時 或成本高昂,還可能給我們的人員、系統和資源帶來不必要的壓力。我們的管理層和其他人員將需要投入大量時間來制定這些規定。此外,我們預計這些規章制度將使我們獲得董事和高級職員責任保險變得更加困難和更加昂貴,我們可能被要求接受降低的保單限額和承保範圍 或產生更高的費用才能獲得相同或類似的承保範圍。因此,我們可能更難吸引和留住合格的人員加入我們的董事會我們的董事會委員會或擔任高管。
不利的 地緣政治和宏觀經濟發展可能對我們的業務、財務狀況或經營業績產生不利影響。
我們的業務可能會受到美國和全球經濟、美國和全球金融市場狀況以及 不利的地緣政治和宏觀經濟發展的不利影響,包括通貨膨脹率上升、新冠肺炎疫情的持續不利影響、烏克蘭/俄羅斯和以色列/巴勒斯坦衝突和相關制裁、銀行倒閉以及與這些狀況相關的經濟不確定性。
例如,通貨膨脹率,特別是美國的通貨膨脹率最近上升到了多年未見的水平,通貨膨脹的加劇可能會導致我們的運營成本增加(包括我們的勞動力成本),流動性減少,我們獲得信貸或以其他可接受的條件籌集資本的能力受到限制 。為了應對不斷上升的通脹,美國聯邦儲備委員會已經提高了利率,並可能再次提高利率,再加上政府支出的減少和金融市場的波動,可能會產生進一步增加經濟不確定性和加劇這些風險的影響。
此外,在2022年2月俄羅斯入侵烏克蘭和2023年10月以色列/巴勒斯坦衝突爆發後,全球金融市場經歷了波動,包括對俄羅斯的經濟制裁和出口管制以及俄羅斯採取的反措施。這些制裁和反措施的全面經濟和社會影響,加上烏克蘭和加沙正在發生的 軍事衝突,可以想象,這種衝突可能會擴大,仍然不確定;然而,衝突和相關制裁 已經並可能繼續導致歐洲和全球貿易、商業、價格穩定性、信貸可用性和/或供應鏈 連續性中斷,並給全球市場帶來了巨大的不確定性。雖然我們目前 不在俄羅斯、烏克蘭或中東開展業務,但由於這些衝突的不利影響將繼續影響我們的業務, 經營業績可能會受到不利影響。
項目 1B。未解決的員工意見
不適用 。
項目 1C。網絡安全
風險 管理和戰略。我們採用流程來評估、識別和管理來自網絡安全威脅的重大風險。 我們與EBM,Inc.合作,在終端採用一流的終端檢測和響應功能,提供全天候SOC。我們還在可能的情況下使用MFA和地理位置強制執行。我們持續監控和維護我們的網絡基礎設施,包括一致的 漏洞監控和修復。我們還每季度開展網絡釣魚活動,並對我們的最終用户進行網絡安全意識培訓 ,以保持他們對威脅的警惕。
| 62 |
儘管我們開發和維護旨在防止網絡安全威脅發生的系統和控制,並且我們有識別和緩解威脅的流程,但這些系統、控制和流程的開發和維護成本高昂,需要持續監控 ,並隨着技術變化和克服安全措施的努力變得日益複雜而不斷更新。此外,儘管我們做出了努力,但這些事件發生的可能性無法完全消除。隨着我們將更多的信息系統外包給 供應商,與服務提供商和患者進行更多的電子交易,並更多地依賴基於雲的信息系統, 相關的安全風險將會增加,我們將需要花費額外的資源來保護我們的技術和信息系統。 此外,不能保證我們的內部信息技術系統或我們的第三方承包商的系統,或者我們的 顧問為實施適當的安全和控制措施所做的努力,將足以保護我們免受系統故障、服務中斷、數據惡化或丟失的影響,或防止數據在發生網絡攻擊、安全漏洞、工業間諜攻擊或內部威脅攻擊時被竊取或損壞,這些攻擊可能導致財務、法律、商業或聲譽損害。
截至本報告日期 ,我們不知道網絡安全威脅的任何風險,包括之前的任何網絡安全事件 已經或很可能對我們產生重大影響的任何風險,包括我們的業務戰略、 運營結果或財務狀況。
治理. 我們的高級管理團隊定期評估和管理來自網絡安全威脅的重大風險,包括與我們的IT團隊和第三方服務提供商進行審查 。所有員工和顧問都應向我們的高級管理層報告任何 可能表明網絡安全威脅或事件的不正常或可疑活動。我們董事會的審計委員會 評估我們的網絡安全評估和管理政策,包括每季度與我們的高級管理人員和獨立 註冊會計師事務所面談。
第 項2.屬性
我們的行政辦公室位於康涅狄格州06405號布蘭福德商業園大道21號約12,030平方英尺的租賃辦公和實驗室空間內。租約將於2027年到期,取決於我們是否選擇將租約再延長兩次,為期五年。根據租約,我們目前每月支付14,035美元,到2024年將增加到14,385美元,外加我們按比例分攤的某些物業運營費用 。
我們 還租用了約1,093平方英尺的額外實驗室空間,位於康涅狄格州格羅頓申內科塞特路93號 06340。租約將於2024年4月到期,視我們是否選擇將租約再延長一年而定。根據租約,我們每月支付7,235美元,外加我們按比例分攤的某些物業運營費用。
我們 還租用了約1,868平方英尺的辦公和實驗室空間,位於加拿大魁北克省拉瓦爾的卡地亞大道500號。根據租約,我們每月支付6,515美元。租約將於2024年4月到期,取決於我們是否選擇將租約再延長 一年。
我們 相信我們的設施足以滿足我們目前的需求,並且可以根據需要以商業上合理的條款獲得更多空間。
第 項3.法律訴訟
截至本報告日期 ,我們或我們的財產沒有受到任何法律程序的影響。我們可能會不時地捲入在其正常業務過程中產生的法律程序和索賠。此類事項受許多不確定因素和結果的影響,不能有把握地預測。
第 項4.礦山安全信息披露
不適用 。
| 63 |
第 第二部分
第 項5.註冊人普通股市場、相關股東事項和發行人回購股權證券
市場信息
我們的 普通股在紐約證券交易所的交易代碼為"AZTR"。
記錄持有者
截至2024年3月15日,共有34名普通股持有人。
分紅政策
我們 從未宣佈或支付過普通股的現金股息。我們目前打算保留收益,為我們業務的運營和擴張提供資金。
權益 薪酬計劃信息
我們 採用了Azitra,Inc. 2016年股票激勵計劃,或2016年計劃,規定授予非合格股票期權和獎勵 股票期權以購買我們的普通股股份,並授予限制性和無限制性股票授予和限制性股票 單位。我們目前已根據2016年計劃保留242,340股普通股。2016年計劃的目的是為 符合條件的參與者提供獲得本公司所有權權益的機會。我們公司的所有管理人員、董事、員工和顧問 都有資格參加2016年計劃。2016年計劃規定,購股權的行使價不得低於本公司普通股股份於授出日期的公平市價。
2023年3月,我們的董事會和股東批准並採納了Azitra,Inc. 2023年股票激勵計劃,或2023年計劃,規定授予 非合格股票期權和獎勵股票期權以購買我們的普通股股份,並授予限制性的 和非限制性的股票授予和限制性的股票單位。我們目前已根據2023年計劃預留2,000,000股普通股。2023年計劃的目的是為合資格參與者提供收購本公司所有權權益的機會。 本公司的所有高級管理人員、董事、員工和顧問都有資格參加2023年計劃。2023年計劃規定 購股權不得以低於授出日期我們普通股股份的公平市值的行使價授出。
下表載列截至2023年12月31日有關我們的2016年計劃和2023年計劃的某些信息,根據該計劃,我們的股本證券 獲授權發行。
| 計劃類別 | (a)行使未行使購股權時將予發行的證券數目 | (b) 加權的- 未行使期權的平均行使價 | (c) 根據股權補償計劃可供日後發行的證券數目(不包括(a)欄反映的證券) | |||||||||
| 證券持有人批准的股權補償計劃 | 1,288,255 | $ | 1.37 | 2,202,340 | ||||||||
| 未經證券持有人批准的股權補償計劃 | - | - | - | |||||||||
| 總計 | 1,288,255 | $ | 1.37 | 2,202,340 | ||||||||
| 64 |
未登記 股權證券的銷售和收益的使用
未登記 股權證券銷售
在2023年6月21日我們首次公開發行結束之際,我們發行了8,951,526股普通股,用於 優先股可換股票據的所有流通股的轉換。我們認為,根據《證券法》第4(a)(2)條和《證券法》第506條,我們對上述證券的要約、銷售和發行 作為不涉及公開發行的交易,豁免了《證券法》下的登記。所有投資者都是老練的、經認證的投資者,其定義見《證券法》第501條,並表示他們購買證券的意圖僅用於投資,而不是考慮 或出售與其任何分銷有關的證券,並且在這些交易中發行的股票證書、票據和 權證上放置了適當的圖例。
IPO所得款項的用途
2023年6月15日,我們在表格S—1上的註冊聲明,經修訂(文件編號333—269876)已被美國證券交易委員會宣佈生效, 與我們的首次公開發行普通股有關,根據該計劃,我們於2023年6月15日發行並出售了1,500股,000股普通股 ,以每股5美元的公開發行價,總收益為750萬美元,淨收益為600萬美元,扣除承銷折扣和發行費用後, 。IPO由ThinkEquity LLC承銷
截至2023年12月31日 ,我們估計我們已將IPO所得款項淨額中約4,661,707美元用於臨牀試驗 和產品開發、研發、臨牀製造以及營運資金和其他一般企業用途 。絕大部分未動用的發行淨所得款項都存放在計息賬户中。根據《證券法》 第424(b)(4)條於2023年6月21日向SEC提交的最終招股説明書中所述,我們對IPO所得款項淨額的使用沒有重大 變化。除了在日常業務過程中支付高級職員薪酬以及支付給非僱員 董事作為董事會或董事會委員會服務的薪酬外,我們使用的首次公開募股所得款項淨額均不直接或間接 支付給(i)我們的董事或高級職員或其聯繫人,(ii)擁有我們10%或以上普通股的人士,或 (iii)我們的關聯公司。
第 項6.保留
| 65 |
項目 7.管理層對財務狀況及經營業績的討論與分析
以下討論和分析應與本報告其他部分所載的綜合經審計財務報表及其相關附註一併閲讀。本年度報告表格10—K中包含的信息並不完整描述 我們的業務或與我們普通股投資相關的風險。我們敦促您仔細審查和考慮我們在本報告和我們向美國證券交易委員會(SEC)提交的其他文件中所做的各種 披露。
在 本報告中,我們就我們的業務和前景作出並不時作出書面和口頭陳述,例如 未來業績預測、管理層計劃和目標陳述、市場趨勢預測,以及其他事項 1933年《證券法》第27A條和《證券法》第21E條所指的前瞻性陳述 1934年的交易法。包含"將可能導致"、"預計"、"將 繼續"、"預計"、"估計"、"項目"、"相信"、"預期"、"預期"、"打算"、"目標"、"計劃"、"目標"、"目標"、"計劃"、"目標"、"應該"或類似表述的聲明,即為前瞻性聲明,這些聲明可能出現在我們的文件、報告、向SEC提交 的文件、新聞稿、高級管理人員或其他代表向分析師、股東、 投資者、新聞機構和其他人所作的書面或口頭報告,以及與管理層和我們的其他代表進行的討論。
我們的 未來業績(包括與前瞻性陳述相關的業績)涉及許多風險和不確定性,包括本報告“風險因素”一節中包含的那些 風險。無法保證任何 前瞻性陳述中反映的結果將得以實現。任何前瞻性聲明僅限於作出該聲明之日。 我們的前瞻性聲明基於假設,有時這些假設基於供應商、政府機構和其他來源的估計、數據、通信和其他信息 ,這些信息可能會被修改。除法律要求外,我們不承擔 任何義務更新或保持最新(i)任何前瞻性聲明,以反映 此類聲明日期之後發生的事件或情況,或(ii)可能導致我們未來業績與歷史業績 或趨勢、我們預期或計劃的業績有重大差異的重要因素,或不時反映在任何前瞻性陳述中。
一般信息
我們 成立於2014年1月,是一家生物製藥公司,專注於使用 工程蛋白質和活生物製劑產品開發精準皮膚病的創新療法。我們是一家早期臨牀生物製藥公司,尚未開始 商業運營。
迄今為止,我們主要通過一系列可轉換優先股和可轉換承兑票據的私人配售以及於2023年6月21日結束的首次公開發行(IPO)普通股,將我們的業務資本化。與我們的首次公開募股有關, 我們以每股5美元的公開發行價發行了150萬股普通股。在IPO結束的同時,我們所有 的可轉換優先股和可轉換承兑票據已轉換為總共8,951,526股普通股 。
2024年2月15日,我們完成了16,667,000股普通股的公開發行,發行價為每股0.30美元。扣除承銷折****r}和發行相關費用後,我們 收到的總收益約為500萬美元,淨收益約為440萬美元。我們已授予承銷商超額配售權,以公開發行減去承銷商折扣的方式購買額外2,500,000股我們普通股,為期45天,截至2024年3月29日。
除 另有説明外,本報告中的所有股份及股價金額均適用於2023年5月17日按7. 1比1的比率進行的遠期股票拆分。
| 66 |
概述
我們 專注於開發使用工程蛋白質和局部活性生物製劑的精準皮膚科創新療法。 我們已經建立了一個專有平臺,其中包括一個微生物庫,由大約1500種獨特的細菌菌株組成, 可以對這些菌株進行獨特的治療特性篩選。該平臺通過人工智能和機器學習技術進行了增強,該技術分析、預測並幫助篩選我們的菌株庫中的藥物類分子。該平臺還利用了獲得許可的 基因工程技術,可以轉化以前遺傳上難以處理的菌株。我們最初的重點是 開發基因工程菌株, 表皮葡萄球菌或S.表皮,我們認為是皮膚病治療工程的最佳候選治療物種。該特定物種在皮膚中表現出許多 描述良好的特性。截至本報告之日,我們已在微生物庫中確定了超過60種不同的 細菌物種,我們認為這些細菌物種能夠被改造以產生具有顯著 治療效果的活生物體或工程蛋白質。
我們 是皮膚科治療用基因工程細菌的先驅。我們的目標是利用我們的平臺和內部微生物庫細菌菌株來創造新的療法,這些療法要麼是工程生物,要麼是工程蛋白質或多肽,用於治療皮膚病。我們最初的重點是開發我們目前的候選產品,包括:
| ● | ATR—12, 一種轉基因菌株。用於治療孤兒病的表皮,Netherton 綜合徵,一種慢性且有時致命的皮膚疾病,估計影響大約 每100,000人中就有一人,但其患病率可能因誤診而被低估 與其他皮膚病相似2022年12月,我們提交了一份研究報告 ATR—12治療Netherton綜合徵的Ib期臨牀試驗的新藥申請(IND) 2023年1月,我們收到FDA的通知,稱"研究 “可以繼續進行”關於擬議的1b期臨牀試驗。提交 後 IND後生產報告,我們開始了1b期臨牀的運營活動 2023年12月審判。我們預計將在下半年報告初步安全性結果 2024. |
| ● | ATR—04, 一種轉基因菌株。表皮用於治療丘疹膿皰性皮疹 接受表皮生長因子受體抑制劑(或EGFRi)靶向治療的癌症患者 療法我們打算為某些癌症患者的1b期臨牀試驗提交IND 2024年年中接受EGFRi靶向治療。根據FDA對IND的批准,我們希望 我們將於2024年第四季度開始1b期臨牀試驗。 |
| ● | ATR-01,一種用於治療尋常型魚鱗病的工程重組人細絲蛋白,這是一種慢性、乾燥(異常乾燥)、鱗片狀皮膚病,估計在250人中的發病率和患病率為1。這表明美國的患者總數為130萬。 我們計劃在2024年完成Lead優化和IND啟用研究,以支持計劃於2025年下半年提交的IND申請。 |
| ● | 兩個 我們和拜耳消費者正在研究和開發的單獨的細菌微生物菌株 Care AG,拜耳公司的消費品部門,或拜耳,國際生命科學公司 公司我們於2019年12月與拜耳簽訂了聯合開發協議(JDA)。 根據JDA的條款,我們負責測試我們的細菌菌株庫 以及它們的天然產物的關鍵臨牀前特性。在篩選了數百個 我們和拜耳選擇了兩種特殊的菌株,以進一步推進 發展拜耳擁有這些菌株專利權的獨家選擇權。 2020年12月,拜耳購買了800萬美元的B輪優先股,將 1,449,743股普通股,約佔我們流通股的4.5% 截至本報告日期的普通股。 |
| 67 |

我們 還與卡內基梅隆大學和弗雷德哈欽森癌症中心(Fred Hutchson Cancer Center)的團隊建立了合作關係,這兩個 美國首屈一指的學術中心。我們與卡內基梅隆大學團隊的合作也充分利用了全基因組測序的威力。這一合作關係正在挖掘我們專有的細菌菌株庫,以獲取新的藥物,如肽 和蛋白質。該團隊開發的人工智能/機器學習技術可以預測微生物 根據其基因序列製造的分子。然後,該系統將預測結果與通過串聯質譜 和/或核磁共振成像實際得到的產物進行比較,以完善未來的預測。這些預測可以與公開可用的2D和3D蛋白質數據庫進行比較,以選擇類似藥物的結構。
我們 擁有Fred Hutch在全球範圍內的獨家許可,將其專利的SyngenicDNA微環質粒(SyMPL)技術用於所有基因工程領域 ,包括髮現、開發和商業化工程微生物療法和用於皮膚病的微生物衍生肽和蛋白質。我們正在利用我們的專利權來構建質粒,以便進行以前從未實現的基因轉化 。迄今為止,我們的團隊已成功設計了不使用SyMPL 技術的主要治療候選藥物。然而,我們相信SyMPL將打開對擴大的微生物 物種進行基因轉化的能力,我們預計我們未來的部分或所有候選產品將採用SyMPL技術。我們與 Fred Hutch的合作由微生物工程專家Christopher Johnston博士領導,也是SyMPL技術背後的創新者。
我們的 戰略
除了我們的三個主要候選產品和與拜耳的合作之外,我們的目標是開發廣泛的候選產品組合, 專注於擴展我們的精確皮膚病平臺的應用。我們相信,我們已經在推動精準皮膚病生物製劑的開發方面確立了獨特的地位。
我們 打算通過開發從我們的專利微生物庫中挑選的約1,500種獨特細菌菌株中挑選出來的基因工程 蛋白質,為精密皮膚病創造廣泛的候選產品組合。我們的策略如下:
| ● | 生成 一家可持續的精密皮膚科公司.我們的目標是打造領先的精度 皮膚科公司擁有可持續的候選產品管道。為此,我們 專注於快速推進我們目前的活體生物多樣性候選人管道,同時 積極開發新的產品。我們當前的每個候選產品 是所有的,並受待決專利申請的限制。我們預計,如果不是全部的話, 我們開發的基因工程候選產品將符合專利保護的資格。 |
| 68 |
| ● | 預付款 我們的主要候選產品ATR—12和ATR—04通過臨牀試驗,.我們希望 報告在Netherton進行ATR—12的Ib期臨牀試驗的初步安全性結果 綜合徵患者將於2024年下半年開始治療,目前正計劃開始一個階段 1b在第二次接受EGFRi治療的某些癌症患者中進行的ATR—04試驗 2024年的一半。我們已批准ATR—12的IND,並預計在2024年年中提交ATR—04的IND。 |
| ● | 通過有選擇地探索戰略合作伙伴關係,最大限度地發揮我們精準皮膚科項目的潛力, 拓寬我們的平臺。我們打算保留對我們所有核心技術和候選產品的重要權利。但是,我們將繼續評估 戰略合作伙伴可以幫助我們加快技術和候選產品開發的合作機會,提供獲得協同組合的途徑,或者 提供專業知識,使我們能夠擴展到不同類型皮膚病的治療 。我們還可以通過選擇性地許可技術或候選產品來擴大我們平臺的覆蓋範圍。此外,我們還將考慮將我們的某些專有技術授權給我們自己並不追求的適應症和行業 。我們相信,我們的基因工程技術和技術在醫藥領域之外具有適用性,包括化粧品,以及清潔燃料的生成和生物修復。 |
| ● | 利用我們的學術合作伙伴關係。我們目前與弗雷德·哈欽森癌症中心、耶魯大學、傑克遜基因組醫學實驗室和卡內基梅隆大學的研究人員建立了合作伙伴關係。我們希望利用這些合作伙伴關係,並可能 擴大它們或形成其他學術合作伙伴關係,以支持我們的工程平臺並 擴大我們的研發渠道。 |
| ● | 擴展 我們的其他潛在候選產品。除了我們的三個主要候選產品外, 我們的目標是開發廣泛的候選產品組合,專注於擴大我們的精確皮膚病平臺的應用 。我們擁有發現和開發精準皮膚病治療產品的專有平臺。我們的平臺圍繞由大約1,500個獨特細菌菌株組成的微生物文庫構建,以篩選獨特的治療特性,並利用微生物基因技術來分析、預測和設計皮膚微生物產生的蛋白質、多肽和分子。我們對難處理的微生物物種進行基因工程的能力由我們獲得SyMPL技術的獨家許可 獨一無二地加以利用。 |
運營結果
我們 是一家早期臨牀生物製藥公司,成立於2014年1月,運營歷史有限。除了通過與拜耳的JDA獲得的有限服務收入外,我們尚未開始 創收業務。根據JDA的條款,我們 負責測試我們的微生物菌株庫及其天然產物的關鍵臨牀前特性,拜耳將 補償我們的開發成本。迄今為止,我們的業務包括開發我們的專有微生物庫,從我們的微生物庫中鑑定、 表徵和測試我們認為能夠被改造 以提供顯著治療效果的某些細菌物種,以及開發我們的初始候選產品。
| 69 |
截至2023年12月31日的年度與截至2022年12月31日的年度比較
下表概述了我們在截至2023年12月31日和2022年12月31日的年度內與以下項目相關的運營結果以及這些項目的百分比變化。
| 截至十二月三十一日止的年度: | ||||||||||||||||
| 2023 | 2022 | $Change | 更改百分比 | |||||||||||||
| 服務收入關聯方 | $ | 686,000 | $ | 284,000 | $ | 402,000 | 142 | % | ||||||||
| 總收入 | 686,000 | 284,000 | 402,000 | 142 | % | |||||||||||
| 運營費用: | ||||||||||||||||
| 一般和行政 | 4,493,332 | 3,639,666 | 853,666 | 23 | % | |||||||||||
| 研發 | 3,809,063 | 6,097,938 | (2,288,875 | ) | (38 | )% | ||||||||||
| 總運營費用 | 8,302,395 | 9,737,604 | (1,435,212 | ) | (15 | )% | ||||||||||
| 運營虧損 | (7,616,395 | ) | (9,453,604 | ) | 1,837,209 | (19 | )% | |||||||||
| 營業外收入(支出) | ||||||||||||||||
| 利息收入 | 1,577 | 4,818 | (3,241 | ) | (67 | )% | ||||||||||
| 利息支出 | (167,726 | ) | (251,891 | ) | 84,165 | (33 | )% | |||||||||
| 員工留任積分 | — | 229,813 | (229,813 | ) | (100 | )% | ||||||||||
| 其他收入 | — | 65,849 | (65,849 | ) | (100 | )% | ||||||||||
| 應付賬款的寬免 | 56,285 | — | 56,285 | 100 | % | |||||||||||
| 可轉換票據公允價值變動 | (3,630,100 | ) | (1,250,000 | ) | (2,380,100 | ) | 100 | % | ||||||||
| 其他收入(費用) | 89,886 | (25,351 | ) | 115,237 | (455 | )% | ||||||||||
| 營業外費用合計 | (3,650,078 | ) | (1,226,762 | ) | (2,423,316 | ) | 198 | % | ||||||||
| 所得税前虧損 | (11,266,473 | ) | (10,680,366 | ) | (586,107 | ) | 5 | % | ||||||||
| 所得税費用 | (17,308 | ) | — | (17,308 | ) | 100 | % | |||||||||
| 淨虧損 | (11,283,781 | ) | (10,680,366 | ) | (603,415 | ) | 6 | % | ||||||||
| 優先股股息 | (1,355,347 | ) | (2,768,984 | ) | 1,413,637 | (51 | )% | |||||||||
| 普通股股東應佔淨虧損 | $ | (12,639,128 | ) | $ | (13,449,350 | ) | $ | 810,222 | (6 | )% | ||||||
服務 收入相關方
截至2023年12月31日止年度,我們 在拜耳JDA下產生了70萬美元的服務收入,而截至2022年12月31日止年度,JDA下的服務收入為 30萬美元。服務收入增加40萬美元是由於 2023年可償還開發費用增加。
| 70 |
常規 和管理
截至2023年12月31日止年度的一般 及行政成本較上年同期增加854,000美元,或23%,至450萬美元。 這一增長主要是由於與上市公司的出現有關的費用增加了856,000美元,包括與會計和財務有關的額外行政費用216,000美元,增加的法律費用200,000美元, 紐約證券交易所美國證券交易所上市費用110,000美元,董事和高級管理人員保險費增加000美元,投資者和公共關係費用增加97,000美元。與去年同期相比,一般和行政費用的增加還包括知識產權法律費用354,000美元,這是由於某些專利族的減值和費用化,但由於某些職位 部分年份未填補,工資和相關費用減少378,000美元,以及其他間接費用淨增加22,000美元。
研究和開發
研究和開發費用包括所有研究人員的工資和福利、支付給合同研究機構的費用、支付給研究顧問的費用和購買實驗室用品的費用。這些支出被政府撥款支付的收入所抵消。 我們通過與各種聯邦機構和非營利研究機構簽訂合同,為我們進行的一般研究創造撥款收入 。這些贈款安排也不符合收入確認的標準,根據這些贈款合同賺取的金額 被記錄為負研究和開發費用。
截至2023年12月31日止年度,研發費用較上年同期減少230萬美元,或37%,至380萬美元。減少的主要原因是,由於我們的Netherton計劃向診所過渡, 研發相關成本減少了190萬美元, 由於員工減少,工資和相關成本淨減少了556 000美元,減少了183美元,由於顧問使用率下降,被由於推進CTAR計劃而導致的研發費用增加 378,000美元以及其他費用淨增加39,000美元所抵消。在2023或2022財年,我們分別收到了0美元和4,426美元的政府和非營利組織贈款收入。
我們 預計我們的研發費用將在未來大幅增加,主要原因是我們計劃的臨牀試驗活動 和持續開發候選產品。
營業外 收入(費用)
我們的 營業外收入(支出)包括可退還的研發信貸、認股權證估值、債務發行攤銷 成本、免除應付賬款、外幣換算損失、僱員留用信貸、 可轉換票據公允價值變動、利息收入和利息支出。截至2023年12月31日止年度,非營業收入(費用)較2022財年同期增加240萬美元,或198%。增加的主要原因是 可換股票據公允價值變動導致的增加240萬美元,以及員工留用信貸導致的收入減少20萬美元。這一增加額被免除應付賬款導致的收入增加10萬美元和其他收入(支出)導致的淨增加10萬美元所部分抵消。
財務狀況
As of December 31, 2023, we had total assets of approximately $5.1 million and working capital of approximately $0.9 million. As of December 31, 2023, our liquidity included approximately $1.8 million of cash and cash equivalents. On February 15, 2024, we completed a public offering of 16,667,000 shares of our common stock, at an offering price of $0.30 per share, in which we received net proceeds of approximately $4.4 million, after deducting underwriting discounts and offering-related expenses. After giving effect to the February 2024 public offering, we believe that our cash on hand as of the date of this report will not be sufficient to cover our proposed plan of operations over the next 12 months. We intend to seek additional funds through various financing sources, including the sale of our equity, licensing fees for our technology and joint ventures with industry partners. In addition, we will consider alternatives to our current business plan that may enable us to achieve revenue producing operations and meaningful commercial success with a smaller amount of capital. However, there can be no guarantees that such funds will be available on commercially reasonable terms, if at all. If such financing is not available on satisfactory terms, we may be unable to further pursue our business plan and we may be unable to continue operations, in which case you may lose your entire investment.
| 71 |
如果 我們通過出售股權或可轉換債務證券籌集額外資本,我們普通股股東的 所有權權益將被稀釋,這些證券的條款可能包括清算或其他對 普通股股東權利產生不利影響的優先權。債務融資和優先股權融資(如有)可能涉及協議,這些協議包括限制或限制我們採取特定行動的能力,例如產生額外債務、進行收購或資本支出 或宣佈股息。如果我們通過與第三方的合作、戰略聯盟或營銷、分銷或許可安排籌集額外資金,我們可能不得不放棄對我們的技術、未來收入來源、研究項目 或候選產品的寶貴權利,或以可能不利於我們的條款授予許可。如果我們無法在需要時通過 股權或債務融資或其他安排籌集額外資金,我們可能會被要求延遲、限制、減少或終止我們的研究、產品開發或未來的商業化努力,或授予開發和銷售我們本來希望 自己開發和銷售的候選產品的權利。
截至本申請之日,管理層已確定,基於我們缺乏商業運營收入、重大虧損以及 需要籌集額外資金以支持持續運營, 對我們繼續作為持續經營企業的能力存在重大疑問。
現金流
下表顯示了我們在所示時期的現金流摘要:
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 用於經營活動的現金淨額 | $ | (7,362,375 | ) | $ | (8,349,469 | ) | ||
| 用於投資活動的現金淨額 | $ | (318,259 | ) | $ | (336,761 | ) | ||
| 融資活動提供的現金淨額 | $ | 5,983,967 | $ | 4,134,624 | ||||
| 現金淨減少 | $ | (1,696,667 | ) | $ | (4,551,606 | ) | ||
操作 活動
截至2023年12月31日止年度,經營活動使用了740萬美元現金,主要是由於我們的淨虧損1130萬美元, 被390萬美元的非現金項目抵消。在2022財年的可比期間,經營活動使用了830萬美元的現金,主要原因是我們1070萬美元的淨虧損被240萬美元的非現金項目抵消。
投資 活動
截至2023年12月31日止年度,投資活動使用了30萬美元現金,主要由30萬美元遞延專利成本以及專利和商標成本驅動。在2022財年的可比期間,投資活動使用了30萬美元的現金,主要 由30萬美元的遞延專利成本以及專利和商標成本驅動。
為 活動提供資金
在截至2023年12月31日的一年中,融資活動提供了600萬美元的現金,主要由我們首次公開募股的收益推動。在2022財年的可比期間,融資活動提供了410萬美元的現金,主要由可轉換票據的收益推動。
| 72 |
關鍵的會計政策和重要的判斷和估計
我們的 財務報表和相關公共財務信息基於美國公認的會計原則的應用 (“GAAP”)。GAAP要求使用對報告的資產、負債、收入和費用金額有影響的會計原則的估計、假設、判斷和主觀解釋 。這些估計還可能影響我們的外部披露中包含的補充信息,包括有關意外情況、風險和財務狀況的信息 。我們相信,我們對估計和基本會計假設的使用符合公認會計準則,並得到一致和保守的應用。我們的估計基於歷史經驗和我們認為在這種情況下合理的各種其他假設。 在不同的假設或條件下,實際結果可能與這些估計大不相同。我們將繼續監測在編制財務報表過程中做出的重大估計。
我們的財務報表附註2總結了我們的重要會計政策。雖然所有這些重要的會計政策都會對我們的財務狀況和運營結果產生影響,但我們認為其中某些政策至關重要。被確定為 關鍵的政策是那些對我們的財務報表有最重大影響並要求管理層使用更大程度的判斷和估計的政策。實際結果可能與這些估計不同。我們的管理層認為,鑑於目前的事實和 情況,應用任何其他合理的判斷或估計方法不太可能對本報告所述期間的運營業績、財務狀況或流動資金造成影響。
財務報告內部控制
財務報告內部控制是一個旨在為財務報告的可靠性和根據美國公認會計準則編制財務報表提供合理保證的過程。根據上市公司會計監督委員會(PCAOB)建立的標準,當控制的設計或操作 不允許管理層或人員在履行其指定職能的正常過程中及時防止或發現錯誤陳述 時,財務報告的內部控制存在缺陷。PCAOB將重大缺陷定義為財務報告內部控制的缺陷或缺陷的組合,使得年度或中期財務報表的重大錯報有可能無法得到及時防止或發現和糾正。
在編制截至2023年12月31日和2022年12月31日的年度財務報表期間,我們和我們的獨立註冊會計師事務所 發現了一個重大弱點,因為它與會計職能缺乏充分分離有關。我們正在 實施旨在改善財務報告內部控制並彌補這一重大缺陷的措施。 我們打算在我們的會計基礎設施中增加足夠的人員,以促進會計職能的適當分離 並對我們內部編制的財務報表進行適當的審查。
收入 確認
正如本報告其他部分所載經審計財務報表附註2所述,根據會計準則編撰,或ASC,606,與客户簽訂合同的收入,實體在其客户獲得對承諾的貨物或服務的控制權時確認收入,其金額反映該實體預期從這些貨物或服務交換中獲得的對價。
為了確定確定在ASC606範圍內的安排應確認的適當收入金額,我們執行以下五個步驟:(I)確定與客户的合同(S),(Ii)確定合同中承諾的貨物或服務,並確定承諾的貨物或服務是否為履約義務,(Iii)計量交易價格,(Iv)將交易價格分配給履約義務,以及(V)當(或作為)我們滿足每項履約義務時確認收入。我們僅在實體可能收取其有權獲得的對價以換取其轉讓給客户的商品或服務時,才將五步模型應用於合同。
當提供可選商品或服務時,我們評估選項以確定選項是否授予客户物質權利。此 確定包括選項的定價是否為客户在沒有簽訂 合同的情況下不會收到的金額。如果我們得出結論,期權傳達了一項實質性權利,它將作為一項單獨的履行義務入賬。在確定合同中的 履約義務時,我們確定了那些不同的承諾。當客户可以單獨或與現成的資源一起從貨物或服務中受益,並且貨物或服務可與合同中的其他承諾分開識別時,承諾的貨物或服務被視為不同的 。如果承諾不明確,則將其與合同中的其他承諾合併,直到合併後的承諾組能夠區分。
| 73 |
我們 根據轉讓合同中承諾的貨物或服務預期收到的對價金額來估計交易價格 。對價可以包括固定對價和變動對價。在每個包含可變對價的安排開始時,我們評估潛在付款的金額和收到付款的可能性。 如果很可能不會發生重大收入逆轉,則可變對價包括在交易價格中。 對於包括基於許可化合物的基於銷售的版税的合同,我們在相關銷售發生的日期確認收入。 最後,我們通過分析相對於承諾商品和服務的獨立銷售價格的承諾對價,以及相對於承諾商品和服務轉讓的付款時間,來確定合同是否包含重要的融資部分。在每個報告日期,我們重新評估交易價格和履約義務實現的可能性以及對交易價格的相關限制。如有必要,我們會調整交易價格,根據之前受限制的金額的進度記錄累計追趕進度。
收入 在(或作為)履行義務控制權轉移到客户時確認。當綜合履約義務 包含承諾的許可證和相關服務或其他承諾時,需要管理層判斷以確定收入確認的適當時間 。為此,我們必須確定合同中的一個或多個主要承諾,以確定收入是在某個時間點確認還是在某個時間確認。如果隨着時間的推移,我們必須確定適當的進展衡量標準。如果許可證被認為是履行義務中的主要承諾,我們必須確定許可證的性質,無論是功能性的還是象徵性的 知識產權,以得出時間點或長期收入確認最合適的結論。確定功能性 或象徵性知識產權需要評估客户是否能夠在其當前狀態下利用許可證並從中受益,或者許可證的效用是否依賴於我們正在進行的活動或受我們的影響或與我們相關聯。
在每個報告日期,我們都會計算一段時間內轉移的履約義務的進度。計算一般採用基於迄今發生的費用與估計總費用之比的投入計量,以完成履約義務的轉移。
研究和開發費用
研究和開發費用主要包括與我們的候選產品開發相關的成本。我們會按實際發生的費用來支付研發費用。
我們 根據對已完成工作的比例的估計,為我們的供應商執行的臨牀前研究和臨牀試驗活動計提費用。我們通過審查合同、供應商協議和採購訂單,並通過與我們的內部臨牀人員和外部服務提供商討論試驗或服務的進度或完成階段以及為此類服務支付的商定費用來確定估計數。然而,臨牀試驗的實際成本和時間是高度不確定的,受到風險的影響,可能會根據包括我們的臨牀開發計劃在內的許多因素而變化。
我們 根據當時已知的事實和情況,在財務報表中對截至每個資產負債表日期的預付/應計費用進行估計。如果服務執行的實際時間或工作水平與估計值不同,我們將相應地調整應計項目。不可退還的商品和服務預付款,包括將在未來研發活動中使用的臨牀試驗費用、工藝開發費用或臨牀用品的製造和分銷費用,將延期 並在相關商品或服務被消費或提供服務期間確認為費用。
| 74 |
基於股份的薪酬
我們 根據授予日基於股票的獎勵的估計公允價值來衡量所有基於股票的獎勵的薪酬支出。 我們使用Black-Scholes期權定價模型對基於股票的獎勵進行估值。我們以直線方式確認所需服務期內的補償費用 ,這通常是獎勵的授權期。我們尚未根據市場或業績條件頒發獎勵,其歸屬取決於市場或業績條件。
柏力克—舒爾斯期權定價模式要求使用主觀假設,其中包括預期股價波動率和 相關普通股在授出日期的公允價值。請參閲 本報告其他部分的經審計財務報表附註10,瞭解我們在應用柏力克—舒爾斯期權定價模型時使用的某些特定假設 以確定我們授予的獎勵的估計公允價值。
評估權證的公允價值
我們 採用布萊克-斯科爾斯方法在每個報告期對我們的未償還認股權證進行估值,公允價值的變化在 經營報表中確認。認股權證負債的估計公允價值是使用第3級投入確定的。布萊克-斯科爾斯模型中固有的假設與預期股價波動、預期壽命、無風險利率和股息收益率有關。我們根據市場參與者的假設估計我們普通股的波動率,並與用於評估我們股票期權的波動率相匹配。 無風險利率基於授予日的美國財政部零息收益率曲線,到期日與認股權證的預期剩餘期限相似。我們的未清償認股權證的預期壽命假設與其剩餘的合同期限相等。股息率基於歷史利率,公司預計歷史利率將保持在零。
最近 會計聲明
請參閲 本報告其他地方的經審計財務報表附註2,瞭解適用於我們財務報表的最新會計聲明的描述 。
第 7A項。關於市場風險的定量和定性披露
不適用 。
| 75 |
第 項財務報表和補充數據
合併財務報表索引
| 獨立註冊會計師事務所報告(PCAOB ID號 |
F-1 |
| 截至2023年12月31日和2022年12月31日的合併資產負債表 | F-2 |
| 截至2023年12月31日和2022年12月31日的合併業務報表 | F-3 |
| 截至2023年及2022年12月31日止年度的股東虧損綜合變動表 | F-4 |
| 截至2023年12月31日和2022年12月31日的合併現金流量表 | F-5 |
| 合併財務報表附註 | F-6 |
| 76 |
獨立註冊會計師事務所報告{br
致 公司股東和董事會
Azitra, Inc.
Grassi & Co. CPA,P.C.
紐約傑里科
對財務報表的意見
我們 審計了隨附的Azitra,Inc.的資產負債表。(the截至2023年12月31日及2022年12月31日止年度的相關 經營、股東權益和現金流量表以及相關附註(統稱 財務報表)。我們認為,財務報表在所有重大方面公允列報了公司截至2023年和2022年12月31日的財務狀況,以及截至該日止年度的經營成果和現金流量, 符合美利堅合眾國公認的會計原則。
對公司作為持續經營企業的持續經營能力有很大的懷疑
隨附財務報表的編制假設Azitra,Inc.,將繼續經營下去如財務報表附註 1所述,公司的重大經營虧損對該實體的持續經營能力產生了重大疑問。管理層對事件和條件的評估,以及管理層關於 這些事項的計劃,也在附註1中描述。財務報表不包括可能由這種不確定性的結果導致的任何調整 。我們的意見不會就此事作出修改。
徵求意見的依據
這些 財務報表由公司管理層負責。我們的責任是根據我們的審計對公司的財務報表發表意見。我們是一家在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券 法律以及美國證券交易委員會和PCAOB的適用規則和法規,我們必須與公司保持獨立。
我們 按照PCAOB的標準進行審計。這些標準要求我們計劃和執行審計,以獲得關於財務報表是否沒有重大錯報的合理保證,無論是由於錯誤還是舞弊。公司 不需要對其財務報告的內部控制進行審計,也沒有聘請我們進行審計。作為我們審計的一部分,我們需要了解財務報告的內部控制,但不是為了對公司財務報告內部控制的有效性發表意見。因此,我們不表達這樣的意見。
我們的 審計包括執行程序,以評估財務報表重大錯報的風險,無論是由於錯誤 還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查與財務報表中的金額和披露有關的證據。我們的審計還包括評估管理層使用的會計原則和作出的重大估計,以及評估財務報表的整體列報。我們相信,我們的審計 為我們的觀點提供了合理的基礎。

我們 自2022年以來一直擔任本公司的審計師。
2024年2月23日
| F-1 |
AZITRA, Inc.
合併資產負債表
| 2023年12月31日 | 2022年12月31日 | |||||||
| 資產 | ||||||||
| 流動資產: | ||||||||
| 現金和現金等價物 | $ | $ | ||||||
| 應收賬款 | ||||||||
| 應收賬款關聯方 | ||||||||
| 應收税額抵免 | ||||||||
| 應收所得税 | ||||||||
| 遞延發售成本 | ||||||||
| 預付費用 | ||||||||
| 流動資產總額 | ||||||||
| 財產和設備,淨額 | ||||||||
| 融資租賃使用權資產 | ||||||||
| 經營性租賃使用權資產 | ||||||||
| 無形資產,淨額 | ||||||||
| 遞延專利成本 | ||||||||
| 其他資產 | ||||||||
| 總資產 | $ | $ | ||||||
| 負債、優先股和股東權益 | ||||||||
| 流動負債: | ||||||||
| 應付帳款 | $ | $ | ||||||
| 流動融資租賃負債 | ||||||||
| 當期經營租賃負債 | ||||||||
| 應計費用 | ||||||||
| 合同責任-關聯方 | ||||||||
| 流動負債總額 | ||||||||
| 長期融資租賃負債 | ||||||||
| 長期經營租賃負債 | ||||||||
| 認股權證法律責任 | ||||||||
| 可轉換應付票據,淨額 | ||||||||
| 總負債 | ||||||||
| 承付款和或有事項(附註14) | ||||||||
| 優先股: | ||||||||
| A系列可轉換優先股;美元票面價值;2023年12月31日和2022年12月31日授權的股票;和分別於2023年12月31日和2022年12月31日發行和發行的股份;清算價值為$ | ||||||||
| A系列-1可轉換優先股;$票面價值;2023年12月31日和2022年12月31日授權的股票;和分別於2023年12月31日和2022年12月31日發行和發行的股份;清算價值為$ | ||||||||
| B系列可轉換優先股;美元票面價值;2023年12月31日和2022年12月31日授權的股票;和分別於3023年12月31日及2022年12月31日發行及發行在外的股份;清盤價值為美元 | ||||||||
| 股東權益(虧損) | ||||||||
| 普通股;美元面值,2023年12月31日和2022年12月31日授權的股票,和於二零二三年及二零二二年十二月三十一日已發行及流通股 | ||||||||
| 額外實收資本 | ||||||||
| 累計赤字 | ( | ) | ( | ) | ||||
| 股東權益合計(虧損) | ( | ) | ||||||
| 負債、優先股和股東權益總額(赤字) | $ | $ | ||||||
附註是這些合併財務報表的組成部分。
| F-2 |
AZITRA, Inc.
合併的 運營報表
| 截至12月31日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 服務收入關聯方 | $ | $ | ||||||
| 總收入 | ||||||||
| 運營費用: | ||||||||
| 一般和行政 | ||||||||
| 研發 | ||||||||
| 總運營費用 | ||||||||
| 運營虧損 | ( | ) | ( | ) | ||||
| 營業外收入(費用) | ||||||||
| 利息收入 | ||||||||
| 利息支出 | ( | ) | ( | ) | ||||
| 員工留任積分 | ||||||||
| 其他收入 | ||||||||
| 應付賬款的寬免 | ||||||||
| 可轉換票據公允價值變動 | ( | ) | ( | ) | ||||
| 其他收入(費用) | ( | ) | ||||||
| 營業外費用合計 | ( | ) | ( | ) | ||||
| 所得税前虧損 | ( | ) | ( | ) | ||||
| 所得税費用 | ( | ) | ||||||
| 淨虧損 | ( | ) | ( | ) | ||||
| 優先股股息 | ( | ) | ( | ) | ||||
| 普通股股東應佔淨虧損 | $ | ( | ) | $ | ( | ) | ||
| 每股基本和稀釋後淨虧損 | ) | ) | ||||||
| 加權平均已發行普通股、基本普通股和稀釋普通股 | ||||||||
附註是這些合併財務報表的組成部分。
| F-3 |
AZITRA, Inc.
合併的股東虧損變動表
| A系列可轉換優先股 | A-1系列可轉換優先股 | B系列可轉換優先股 | 普通股 | 額外的實收- | 累計 |
股東總數 股權 | ||||||||||||||||||||||||||||||||||||||
| 股票 | 金額 | 股票 | 金額 | 股票 | 金額 | 股票 | 金額 | 資本 | 赤字 | (赤字) | ||||||||||||||||||||||||||||||||||
| 餘額-2021年12月31日 | $ | | $ | $ | $ | $ | $ | ( | ) | $ | ( | ) | ||||||||||||||||||||||||||||||||
| 基於股票的薪酬 | — | — | — | — | ||||||||||||||||||||||||||||||||||||||||
| 股票期權的行使 | — | — | — | |||||||||||||||||||||||||||||||||||||||||
| 淨虧損 | — | — | — | — | ( | ) | ( | ) | ||||||||||||||||||||||||||||||||||||
| 餘額-2022年12月31日 | $ | $ | $ | $ | $ | ( | ) | $ | ( | ) | ||||||||||||||||||||||||||||||||||
| 發行B系列可轉換優先股 | — | — | — | |||||||||||||||||||||||||||||||||||||||||
| 轉換可轉換應付票據 | — | — | — | |||||||||||||||||||||||||||||||||||||||||
| 轉換優先股 | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||||||||||||||||||||||
| 首次公開發行,扣除發行成本 | — | — | — | |||||||||||||||||||||||||||||||||||||||||
| 基於股票的薪酬 | — | — | — | — | ||||||||||||||||||||||||||||||||||||||||
| 淨虧損 | — | — | — | — | ( | ) | ( | ) | ||||||||||||||||||||||||||||||||||||
| 餘額-2023年12月31日 | $ | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||||||||||||||||
附註是這些合併財務報表的組成部分。
| F-4 |
AZITRA, Inc.
合併現金流量表
| 截至12月31日止年度, | ||||||||
| 2023 | 2022 | |||||||
| 經營活動的現金流: | ||||||||
| 淨虧損 | $ | ( | ) | $ | ( | ) | ||
| 對淨虧損與經營活動中使用的現金淨額進行的調整: | ||||||||
| 折舊及攤銷 | ||||||||
| 債務貼現攤銷 | ||||||||
| 使用權資產攤銷 | ||||||||
| 可轉換票據的應計利息 | ||||||||
| 基於股票的薪酬 | ||||||||
| 認股權證負債的公允價值變動 | ( | ) | ( | ) | ||||
| 可轉換票據公允價值變動 | ||||||||
| 應付賬款的寬免 | ( | ) | ||||||
| 財產和設備處置損失 | ||||||||
| 無形資產減值和遞延專利成本 | ||||||||
| 經營性資產和負債變動情況: | ||||||||
| 應收賬款 | ( | ) | ||||||
| 預付費用 | ( | ) | ( | ) | ||||
| 其他資產 | ( | ) | ||||||
| 應收税額抵免 | ( | ) | ||||||
| 應付賬款和應計費用 | ( | ) | ||||||
| 應收所得税 | ( | ) | ||||||
| 經營租賃負債 | ( | ) | ( | ) | ||||
| 合同責任 | ( | ) | ||||||
| 用於經營活動的現金淨額 | ( | ) | ( | ) | ||||
| 投資活動產生的現金流: | ||||||||
| 購置財產和設備 | ( | ) | ( | ) | ||||
| 出售財產和設備所得收益 | ||||||||
| 遞延專利成本的資本化 | ( | ) | ( | ) | ||||
| 許可證的資本化 | ( | ) | ||||||
| 專利和商標費用的資本化 | ( | ) | ( | ) | ||||
| 用於投資活動的現金淨額 | ( | ) | ( | ) | ||||
| 融資活動產生的現金流 | ||||||||
| 可換股票據所得款項(扣除發行成本) | ||||||||
| 支付遞延發售費用 | ( | ) | ||||||
| 融資租賃本金支付 | ( | ) | ||||||
| 扣除交易成本後的首次公開募股所得款項 | ||||||||
| 行使股票期權所得收益 | ||||||||
| 融資活動提供的現金淨額 | ||||||||
| 現金和現金等價物淨變化 | ( | ) | ( | ) | ||||
| 期初現金及現金等價物 | ||||||||
| 期末現金及現金等價物 | $ | $ | ||||||
| 補充披露非現金投融資信息: | ||||||||
| 取得使用權資產以換取租賃負債 | $ | $ | ||||||
| 獲得使用權資產以換取融資租賃負債 | $ | $ | ||||||
| 將票據轉換為普通股 | $ | $ | ||||||
| 票據轉換為B系列可轉換優先股 | $ | $ | ||||||
| 將A、A—1和B系列可轉換優先股轉換為普通股 | $ | $ | ||||||
附註是這些合併財務報表的組成部分。
| F-5 |
AZITRA, Inc.
合併財務報表附註
截至二零二三年及二零二二年十二月三十一日止年度
1. 業務的組織和性質
Azitra, Inc.成立於2014年1月2日。這是一家合成生物學公司,專注於篩選和基因工程的 皮膚微生物。我們的使命是發現和開發新的療法,創造治療皮膚病的新範式。該公司的 發現平臺篩選了具有有益效果的天然細菌細胞。然後對這些微生物進行基因組測序 並進行工程改造以製造細胞療法、重組治療蛋白質、肽和小分子,用於精確治療 皮膚病。2023年5月17日,公司更名為“Azitra Inc”。
公司在加拿大蒙特利爾設有辦事處,用於開展某些研究活動。在2022年和2023年期間,該地點和在那裏進行的操作保持一致。本公司亦於二零二一年在康涅狄格州格羅頓開設製造及實驗室。
遠期 股票拆分、面值變動和首次公開發行
2023年6月,公司完成了首次公開募股(IPO),發行並出售 以
對公眾的價格,每股該股於2023年6月16日開始在紐約美國證券交易所交易,代碼為“AZTR”。
本公司從發售中收到的淨所得款項為美元
緊接
公司註冊聲明生效前,公司實施了
去 關注事項
綜合財務報表乃按持續經營基準編制,該基準假設本公司將於可預見將來繼續經營
,並預期在正常業務過程中變現資產及清償負債。
然而,管理層已確定以下條件和事件,這些條件和事件對公司
的持續經營能力造成了不確定性。截至2023年12月31日止年度,本公司累計虧損為美元。
管理層 計劃繼續通過股權和債務融資籌集資金,為運營和營運資金需求提供資金;然而,公司 將需要大量額外資金來完成其產品的開發,併為 公司預計在未來幾年內產生的額外損失提供資金,因為公司尚未獲得產品收入。無法保證 公司將成功獲得額外融資以滿足其運營需要。
這些 條件和事件對公司自財務報表可供發佈之日起12個月內持續經營的能力造成了不確定性。財務報表不包括如果公司無法持續經營,則可能需要進行的任何調整 。
| F-6 |
AZITRA,INC.
合併財務報表附註
截至二零二三年及二零二二年十二月三十一日止年度
2. 重要會計政策摘要
會計基礎
公司的財務報表是根據美國公認會計原則(“美國公認會計原則”)編制的。
使用預估的
按照美利堅合眾國公認的會計原則編制財務報表需要 管理層作出影響資產負債表日期資產和負債報告金額的估計和假設。 這些估計和假設是基於當前事實、歷史經驗和在當時情況下被認為是合理的各種其他因素 ,這些結果構成了對資產和負債賬面值作出判斷的基礎,以及 記錄無法從其他來源顯而易見的費用。雖然管理層認為估計和假設是適當的,但實際結果可能與這些估計存在重大不利差異。
現金 和現金等價物
就資產負債表及現金流量表而言,本公司將所有手頭現金、活期存款及所有原始到期日為三個月或以下的高流動性投資視為現金等價物。
財產 和設備
財產和設備按成本入賬。折舊是在估計使用年限內使用直線法計算的,其範圍為
應收賬款
公司的應收賬款按成本減去預期信用損失準備金計提。本公司定期評估其應收賬款,並根據過去的核銷、催收和當前狀況計提預期信貸損失準備。在2023年12月31日和2022年12月31日,沒有信貸損失撥備。
延期的 產品成本
公司將遞延發售成本資本化,這些成本主要包括與公司首次公開募股相關的直接、遞增法律、專業、會計和其他 第三方費用。2023年6月,本公司完成首次公開募股,並在股東權益表中將該等金額與首次公開募股的總收益相抵銷。在第四季度,該公司產生了67,859美元的與後續發行相關的成本。
租契
2016年2月,財務會計準則委員會(“FASB”)發佈了ASU第2016-02號租賃(“主題842”)。ASU 2016-02要求承租人在資產負債表上列報所有租期超過12個月的使用權資產和租賃負債 。
在計算ASU 2016-02的影響時,公司選擇了過渡方法,因此沒有重述可比期間。本公司 選擇將非租賃組成部分作為其相關租賃組成部分的一部分進行會計處理。租賃會計處理涉及重大 判斷,包括對租賃期、租賃付款和貼現率作出估計。根據該指引, 本公司就所有租期超過12個月的租賃確認使用權資產及租賃負債。租賃根據協議的經濟實質分類為 經營租賃或融資租賃。
| F-7 |
AZITRA,INC.
合併財務報表附註
截至二零二三年及二零二二年十二月三十一日止年度
2. 重要會計政策摘要(續)
公司擁有建築物的運營租約。目前,該公司有3個經營性租賃,ROU資產和租賃負債總額為
$
截至2023年12月31日,公司擁有經營性使用權資產,淨價值為$
於
2023年,本公司就若干設備的使用訂立租賃,該租賃被分類為融資租賃。融資租賃的期限為
無形資產
無形資產包括商標和專利。與專利和商標申請的提交和起訴直接相關的所有成本都是資本化的。專利在正式批准後在其各自的剩餘使用壽命內攤銷。商標具有無限的生命期 。
公司按照ASC主題350對其他無限期無形資產進行核算,商譽及其他無形資產
(ASC 350)。ASC 350要求,具有無限使用壽命的無形資產必須至少每年進行一次減值測試
,或者當事件或情況變化表明賬面值可能無法收回時。使用壽命有限的無形資產將繼續在其使用壽命內攤銷。與許可協議有關的減值損失為美元
延期的專利成本
遞延
專利費用是指與提交待批准專利申請有關的法律和歸檔費用。
這些遞延成本將在專利獲得正式批准後在其估計使用壽命內開始攤銷。如果專利
未被頒發,則與專利相關的費用將在專利被駁回的年份計入費用。截至2023年12月31日和2022年12月31日止年度,與遞延專利成本相關的減值損失為美元
長期資產減值
根據ASC主題360-10《長期資產減值或處置會計》(ASC 360-10),本公司的政策 是在發生事件或環境變化表明資產的賬面價值可能無法收回時,審查其長期資產的減值。為配合本次審核,本公司亦會重新評估該等資產的折舊期。 當資產的使用及最終處置所產生的未貼現預期未來現金流量總和少於其賬面金額時,本公司確認減值虧損。如果一項資產被視為減值,應確認的減值按該資產的賬面價值超過該資產的公允價值的金額計量,該金額是根據該資產產生的未來營運現金流量淨值的現值 確定的。
| F-8 |
AZITRA,INC.
合併財務報表附註
截至二零二三年及二零二二年十二月三十一日止年度
2. 重要會計政策摘要(續)
可轉換債務和權證會計
認股權證
根據對權證具體條款的評估和ASC 480中適用的權威指導,公司將權證作為股權分類或負債分類工具進行會計處理。區分負債與股權(“ASC 480”)和ASC 815,衍生工具和套期保值(“ASC 815”)。評估考慮認股權證是否為ASC 480所指的獨立財務工具,是否符合ASC 480所指的負債定義,以及認股權證是否符合ASC 815中有關股權分類的所有要求,包括權證是否與本公司本身的普通股掛鈎,以及其他股權分類條件。這項評估需要使用專業判斷,在權證發行時以及在權證尚未結清的每個季度結束日進行。
對於 滿足所有股權分類標準的已發行認股權證,認股權證必須在發行時記錄為額外 實繳資本的一部分。對於不符合所有權益分類標準的已發行認股權證,認股權證 須按其於發行日期及其後各結算日的初始公允價值入賬。認股權證的估計公允價值的變動在經營報表中確認為其他收入項下的非現金收益或虧損。
可轉換債務
When the Company issues debt with a conversion feature, it first assesses whether the debt should be accounted for in accordance with ASC 480 – Distinguishing Liabilities from Equity. If the debt does not meet the criteria of an ASC 480 liability, the note’s conversion features require bifurcation in accordance with ASC 815 – Derivatives and Hedging. If the Company determines the embedded conversion feature requires bifurcation in accordance with ASC 815, the Company also considers if it can elect the fair value option. The Convertible Notes were converted into the Company’s common stock on the Closing Date of the Company’s IPO. Under 815-15-25, the election can be at the inception of a financial instrument to account for the instrument under the fair value option under ASC 825. The Company has made such election for the 2022 Convertible Notes. Using the fair value option, the convertible promissory note is to be recorded at its initial fair value on the date of issuance, and each balance sheet date thereafter. The Company evaluates the change based on the conversion price at the current market value. When recognized, changes in the estimated fair value of the notes are recognized as a non-cash gain or loss in Other Income (Expense) on the statements of operations. The Company elected the fair value option for the 2022 Convertible Notes and recorded the notes at their initial fair values with subsequent changes in fair value recorded in earnings.
可轉換 優先股
由於 可轉換優先股股東在發生被視為清盤事件時擁有清算權,而在某些情況下, 並非完全在本公司的控制範圍內,需要贖回當時尚未發行的可轉換優先股,因此,本公司將可轉換優先股歸入資產負債表夾層股權。
如附註8所述,於本公司首次公開招股截止日期,可換股優先股轉換為本公司的普通股。
收入
公司遵循五根據ASC 606確認與客户的合同收入的步驟 (“ASC 606”),包括:
| ● | 步驟 1:確定與客户的合同(S) |
| F-9 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
2.主要會計政策摘要(續)
| ● | 步驟 2:確定合同中的履約義務 | |
| ● | 步驟 3:確定成交價格 | |
| ● | 步驟 4:將交易價格分攤到合同中的履約義務 | |
| ● | 步驟 5:在履行履約義務時(或作為)確認收入 |
該公司通過與一家研究合作伙伴簽訂的聯合開發協議獲得服務收入。隨着合同工作的完成,公司使用輸入法確認與協議研究和開發方面相關的收入。
公司還產生贈款收入,這是從與各聯邦機構和非營利性研究機構簽訂的合同中收到的款項,用於公司為進一步產品開發而進行的一般研究,因此被視為對公司的貢獻 。合同的期限一般為一年或更長時間,任何一方都可以取消。本公司的結論是,由於本公司 是該安排的唯一積極參與者,因此贈款安排不符合被視為FASB ASC主題808項下的合作安排的標準。贈款安排也不符合主題606下的收入確認標準,因為美國政府不符合客户的定義。
如果發生了符合條件的費用,並且可實現或已實現並賺取了支付權,則根據這些贈款合同賺取的金額 將作為研發費用的減少額入賬。本公司相信這一政策與主題606一致,以確保 確認反映了向客户轉讓承諾的商品或服務的金額,反映了 公司希望有權獲得的對價,以換取這些商品或服務,即使沒有主題606中定義的交換。 此外,公司已確定,將收到的金額確認為已產生的成本和可實現的金額 類似於主題606下的隨着時間推移轉移服務控制權的概念。
預付補助金的收據 如果未按照贈款中與允許成本有關的條件使用,或在執行合同之前從研究合作伙伴收取與服務收入安排有關的資金時,應返還給供資機構,在隨附的資產負債表中被歸類為合同負債。
研究和開發
本公司按照會計準則編纂(ASC)小標題730-10核算研發費用,研究和開發
。因此,內部研究和開發成本在發生時計入費用。研發成本包括與人力、材料和用品相關的成本。將用於未來研發活動的貨物和服務的預付款在活動完成或收到貨物時計入費用。發生的研發成本
為$
截至2023年12月31日和2022年12月31日,該公司有一筆應收州税收抵免美元
公司根據ASC 718對股票薪酬進行核算,薪酬--股票薪酬(ASC 718)。ASC 718要求 員工的股票期權和根據股票參與計劃購買股票的權利必須按公允價值入賬。ASC 718要求 與以股份為基礎的支付交易相關的補償成本在財務報表中確認為運營費用。 根據該方法,所有授予或修改的獎勵的補償成本均按授予日的估計公允價值計量,並 計入員工提供服務以換取獎勵的歸屬期間的補償費用。對於績效條件影響歸屬的獎勵 ,公司在確定可能達到績效條件時確認補償費用。當沒收發生時,本公司確認沒收的影響。
| F-10 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
2.主要會計政策摘要(續)
該公司使用布萊克-斯科爾斯期權定價模型來確定其股票期權的公允價值。布萊克-斯科爾斯模型包括各種假設,包括標的普通股的價值、股票期權的預期壽命、預期波動率和預期無風險利率。這些假設反映了公司的最佳估計,但它們涉及基於一般不受公司控制的市場情況的固有不確定性 。因此,如果使用其他假設,基於股票的薪酬成本可能會受到重大影響。此外,如果公司對未來的贈款使用不同的假設,基於股票的薪酬成本可能會在未來期間受到重大影響。
公司按照會計準則更新(ASU)2018-07號更新的ASC 718的規定,對發行給非員工的股權工具進行會計核算。對非員工股份支付會計的改進,這將ASC 718的範圍擴大到包括對非員工的基於股票的支付交易。
在對使用Black-Scholes期權定價模型發行的期權進行估值時,使用了以下假設:
預期波動 。本公司股票的預期波動率是根據同行公司的平均波動率估計的。
預期的 期限。期權的預期期限採用簡化方法估計,該方法基於每個授予的歸屬期限和合同 期限,或者對於具有分級歸屬的獎勵的每個歸屬部分。
基礎 普通股價值。在公司首次公開募股之前,公司股票的基本普通股價值由第三方估值專家進行估計,當時公司利用其在授予日在紐約證券交易所美國證券交易所的交易價格。
無風險利率 。該公司的無風險利率以美國國庫券的隱含收益為基礎,其條款等於標的授權書的預期期限。
股息 收益率。布萊克-斯科爾斯估值模型要求以單一的預期股息收益率作為輸入。本公司過去沒有就普通股支付股息 ,近期也不會對普通股支付股息。因此,公司使用的股息 收益率百分比為零。
所得税 税
公司採用ASC 740中規定的所得税責任會計方法,所得税會計。根據此方法,遞延税項資產及負債按資產及負債的賬面值及計税基準之間的暫時性差異及經營虧損結轉淨額的預期未來税務後果確認,均按現行的税率計算。
管理層 已評估了與不確定所得税狀況相關的ASC指引的影響,並得出結論認為,本公司於2023年12月31日和2022年12月31日沒有重大 不確定所得税狀況風險。截至2023年12月31日,税務機關尚未審查公司的所得税 納税申報表。
| F-11 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
2.主要會計政策摘要(續)
公司使用本期發行在外的普通股加權平均股數 計算歸屬於普通股股東的每股加權平均股基本淨虧損。本公司使用本期發行在外的普通股和潛在攤薄普通股的加權平均數計算歸屬於普通股股東的每股加權平均股的攤薄淨虧損。 潛在發行在外的普通股包括股票期權、認股權證和優先股,如果其影響具有反攤薄作用,則不包括在內。 截至2023年及2022年12月31日止財政年度,攤薄加權平均普通股不包括任何增量股份。
某些 風險和不確定性
公司的活動受到重大風險和不確定性的影響,包括無法獲得額外資金 以正確執行公司的業務計劃的風險。本公司面臨製藥行業公司常見的風險 ,包括但不限於本公司或其競爭對手開發新技術創新、依賴 關鍵人員、依賴第三方製造商、保護專利技術以及遵守法規要求。
公允價值計量
公司按公允價值經常性地承擔某些負債。使用由三個級別組成的公允價值層次結構來確定公允價值評估技術的輸入的優先順序:
| ● | 級別 1-投入基於在活躍市場交易的相同工具的可觀察或報價 。 | |
| ● | 第2級-投入基於活躍市場中類似工具的報價, 非活躍市場中相同或類似工具的報價,以及基於模型的估值技術,其所有重要假設均可在市場上觀察到,或可由資產或負債的基本完整期限的可觀察市場數據來證實。 | |
| ● | 級別 3-投入通常是不可觀察的,通常反映了管理層對市場參與者在為資產或負債定價時將使用的假設的估計。因此,公允價值是使用基於模型的技術來確定的,這些技術包括期權定價模型、貼現現金流模型和類似技術。 |
在確定公允價值時,本公司採用估值技術,最大限度地利用可觀察到的投入和最大限度地減少使用不可觀察到的投入,並在評估公允價值時考慮交易對手信用風險。
金融工具
公司的金融工具主要包括應收賬款、應付賬款、應計負債和長期債務。對於應收賬款、應付賬款和應計負債,由於該等票據的短期到期日,賬面金額接近公允價值。本公司長期債務的估計公允價值接近賬面價值。
信貸風險和資產負債表外風險集中
可能使公司面臨集中信貸風險的金融工具主要包括現金和現金等價物。現金 等價物偶爾投資於存單。公司將其每項現金餘額與高質量和 認可的金融機構保持,因此,此類資金不會面臨超出與商業銀行關係相關的正常信貸風險 之外的異常信貸風險。在金融機構的存款可能不時超過聯邦保險限額。 公司未經歷任何現金存款損失。本公司以貨幣市場賬户的形式在管理層認為信譽良好的金融機構保存部分現金和現金等價物餘額。
| F-12 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
2.主要會計政策摘要(續)
最近 會計聲明
2019年12月,FASB發佈了ASU第2019-12號,所得税(話題740):簡化所得税的會計核算. 本標準通過刪除以前規定的各種例外情況,以及提供 額外的所得税報告要求,簡化了所得税的會計處理。會計準則於二零二二年一月一日對本公司生效。本公司已於2022年1月1日採用 該準則,該準則對財務報表沒有重大影響。
2016年6月,FASB發佈了ASU編號1026—13, 金融工具—信用損失(主題326):金融工具信用損失的度量(ASC 326)以預期損失方法取代已發生損失方法。此標準稱為 當前預期信貸損失(“CECL”)方法。CECL本準則自2023年1月1日起對本公司生效。本公司已採納該準則,自二零二三年一月一日起生效,對財務報表並無重大影響。
管理層 不認為最近發佈但尚未生效的任何其他會計準則會對隨附的財務報表產生實質性影響。隨着新的會計公告的發佈,公司將採用在這種情況下適用的會計公告。
3. 員工留任積分
CARES法案提供了員工留用抵免("CARES員工留用抵免"),這是一種針對
某些就業税的可退還税收抵免,最高可達$
4. 財產和設備
於2023年12月31日及2022年12月31日,物業 及設備包括以下各項:
| 2023年12月31日 | 2022年12月31日 | |||||||
| 實驗室設備 | $ | $ | ||||||
| 計算機和辦公設備 | ||||||||
| 傢俱和固定裝置 | ||||||||
| 租賃權改進 | ||||||||
| 建築設備 | ||||||||
| 總資產和設備 | ||||||||
| 減累計折舊和攤銷 | ( | ) | ( | ) | ||||
| 財產、廠房和設備合計(淨額) | $ | $ | ||||||
| F-13 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
4.物業及設備(續)
折舊
費用為$
截至2023年12月31日和2022年12月31日止年度,處置物業和設備的損失記錄為美元,
5. 無形資產
無形資產 由以下資產組成:
2023年12月31日:
| 預計使用壽命 | 總金額 | 累計攤銷 | 減損 | 淨額 | ||||||||||||||
| 商標 | $ | $ | $ | $ | ||||||||||||||
| 專利 | ||||||||||||||||||
| 許可協議 | ||||||||||||||||||
| 無形資產 | $ | $ | $ | $ | ||||||||||||||
2022年12月31日 :
| 預計使用壽命 | 總金額 | 累計攤銷 | 減損 | 淨額 | ||||||||||||||
| 商標 | $ | $ | $ | $ | ||||||||||||||
| 專利 | ||||||||||||||||||
| 許可協議 | ||||||||||||||||||
| 無形資產 | $ | $ | $ | $ | ||||||||||||||
截至2023年12月31日和2022年12月31日止年度,與無形資產有關的攤銷費用為美元,
6. 應計費用
應計費用 包括以下費用:
| 2023年12月31日 | 2022年12月31日 | |||||||
| 應計費用: | ||||||||
| 員工工資單和獎金 | $ | $ | ||||||
| 休假 | ||||||||
| 研究和開發項目 | ||||||||
| 利息 | ||||||||
| 專業費用 | ||||||||
| 其他 | ||||||||
| 應計費用總額 | $ | $ | ||||||
| F-14 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
6.應計費用(續)
公司根據對收到的服務的評估和根據合同安排的條款支出的工作,計提與第三方開展的開發活動有關的費用。根據其中一些合同支付的費用取決於研究和非臨牀試驗里程碑。在某些情況下,向公司供應商支付的款項可能會超過所提供的服務水平,從而導致預付費用。在應計服務費時,公司估計將提供服務的時間段 以及每個時間段需要花費的工作量。如果實際執行服務的時間或努力程度與估計值不同,公司將相應調整應計或預付費用。本公司自成立以來並未 應計成本與實際成本之間出現任何重大差異。
7. 可轉債
自2021年1月5日起,本公司訂立票據購買協議,發行最多$
於
二零二二年九月,本公司訂立可換股票據購買協議(該協議),以發行最多$
於
二零二三年一月,本公司選擇轉換二零二一年可換股票據,包括應計但尚未支付的利息,
於
二零二三年二月,二零二二年可換股票據經修訂,將到期日延長至
| F-15 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
7.可換股債券(續)
於
二零二三年四月及六月,二零二二年可換股票據經進一步修訂,將到期日延長至
2023年6月21日起,2022年可換股票據,包括應計利息$
公司評估了與2021年可轉換票據相關的票據購買協議的條款和條件,以評估ASC 480-區分負債與股權以及ASC 815-衍生品和對衝項下的會計考慮事項。 公司認定可轉換票據不符合根據ASC 480負債進行會計處理的任何標準。公司 還根據ASC 815中的指導對嵌入式功能進行了評估,並確定嵌入式功能不符合任何分支標準 。
可轉換 應付票據包括以下內容:
| 2023年12月31日 | 2022年12月31日 | |||||||
| 2021年可轉換票據 | $ | $ | ||||||
| 2022年可轉換票據 | ||||||||
| 可轉換票據總額 | $ | $ | ||||||
利息
費用為$
8. 股東權益
2023年5月17日,公司實施了一項
普通股 股票
2023年和2022年12月31日,根據公司修訂和重述的公司註冊證書,公司被授權 簽發 $的股票面值普通股。
公司目前有 為未來發行而預留的普通股股份,用於潛在行使於2023年12月31日尚未行使的股票期權和認股權證 。
| F-16 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
8.股東權益(續)
優先股 股票
2023年12月31日和2022年12月31日,根據公司修訂和重述的公司註冊證書,公司已授權 股$面值優先股。
2023年1月,公司發佈了其B系列優先股股份與轉換2021年可換股票據有關,轉換價為
系列A、系列A—1和系列B優先股具有以下權利、優先權和特權:
轉換
優先股根據持有人的選擇權根據預定義的公式轉換為普通股。優先股持有人在公司首次公開募股時將這些股份轉換為普通股。出於轉換目的,初始轉換價格
為$
在 公司於2023年6月首次公開募股時,所有未發行優先股轉換為普通股,導致 , ,以及分別以普通股換取A系列、A—1系列和B系列優先股, 。轉換時並無損益。
投票權 權利
A系列、A-1系列和B系列優先股的持有人有權就提交給公司股東以供其在公司的任何股東大會上採取行動或審議的任何事項投票(或經股東書面同意以代替會議),每名優先股流通股持有人有權投出的投票數等於該股東持有的優先股的全部普通股股數 截至確定有權就該事項投票的股東的記錄日期為止。A系列和A-1系列優先股的持有者每人有權選擇公司的一隻董事。B系列股票的持有者有權選舉兩名董事會成員。在公司註冊證書所述的特定情況下,每類優先股可將該等董事免職,並填補因該等董事辭職、死亡或免任而造成的任何空缺 。
分紅
A系列優先股的持有者有權按以下比率獲得股息
A-1系列股票的持有者有權按以下比率獲得股息
| F-17 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
8.股東權益(續)
B系列股票的持有者有權按以下比率獲得股息
清算
在本公司發生任何清算、解散或清盤的情況下,優先股持有人有權在普通股持有人之前並優先於普通股持有人獲得相當於A系列、A系列1或B系列優先股的原始發行價的金額,外加已宣佈和/或應計但未支付的股息。在發生任何此類清算事件時,在支付需要支付給優先股股東的所有優先金額後,公司可供分配給其股東的剩餘資產應根據每個優先股和普通股持有人持有的股份數量按比例分配給優先股和普通股股東,為此將所有此類證券視為已根據緊接該清算事件之前的公司註冊證書的條款轉換為普通股。
9. 認股權證
該公司發行了認股權證以購買
該公司亦於2016及2019年發行認股權證,但該等認股權證不符合ASC 480分類為負債的標準,而是符合股權分類標準。這個2016年發行的權證的加權平均行使價格為1美元。和加權的 平均期限三年,於2023年6月首次公開招股時屆滿。
下表彙總了有關2023年12月31日未到期認股權證的信息:
| 未清償認股權證 | 可撤銷的令狀 | |||||||||||||||||||||||||||||
| 授予的年份 | 行權價格 | 截至2023年12月31日的認股權證數目 | 加權平均剩餘合同壽命 | 體重平均鍛鍊價格 | 截至2023年12月31日的認股權證數目 | 加權平均剩餘合同壽命 | 加權平均行權價 | |||||||||||||||||||||||
| 2018 | $ | 年份 | $ | 年份 | $ | |||||||||||||||||||||||||
| 2019 | $ | 年份 | $ | 年份 | $ | |||||||||||||||||||||||||
| 2023 | $ | 年份 | $ | 年份 | $ | |||||||||||||||||||||||||
| $ | $ | |||||||||||||||||||||||||||||
| F-18 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
10. 股票期權
2023年3月,公司董事會和股東批准了2023年股票激勵計劃(簡稱2023年計劃)。 2023年計劃允許委員會授予以激勵性和非法定股票期權、限制性股票獎勵、限制性股票單位和其他基於股票的獎勵形式向員工、董事和非員工發放的普通股股票。截至2023年12月31日,購買選項普通股已被授予,並根據2023年計劃和根據該計劃,普通股 可供授予。
2016年,公司制定了Azitra Inc.2016股票激勵計劃(以下簡稱計劃),規定向公司員工、高級管理人員、董事、顧問和顧問授予股票期權和限制性股票。截至2023年12月31日,購買選項 普通股已被授予,並根據2016年計劃和根據該計劃,普通股 可供授予。
在截至2023年12月31日的年度內,公司確認股票薪酬支出為$
| 未完成的期權 | 可行使的期權 | |||||||||||||||||||||||||
| 行權價格 | 截至2023年12月31日的期權數量 | 加權平均剩餘合同壽命 | 體重平均鍛鍊價格 | 截至2023年12月31日的期權數量 | 加權平均剩餘合同壽命 | 加權平均行權價 | ||||||||||||||||||||
| $ | 年份 | $ | 年份 | $ | ||||||||||||||||||||||
| $ | 年份 | $ | 年份 | $ | ||||||||||||||||||||||
| $ | 年份 | $ | 年份 | $ | ||||||||||||||||||||||
| $ | 年份 | $ | 年份 | $ | ||||||||||||||||||||||
| 股票 | 加權平均行權價 | |||||||
| 截至2021年12月31日的未償還債務 | $ | |||||||
| 已鍛鍊 | ( | ) | ||||||
| 被沒收 | ( | ) | ||||||
| 在2022年12月31日未償還 | $ | |||||||
| 授與 | ||||||||
| 已鍛鍊 | ||||||||
| 被沒收 | ( | ) | ||||||
| 截至2023年12月31日的未償還債務 | $ | |||||||
| F-19 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
10.股票期權(續)
有 2016年計劃下可供未來授出的股份, 在2023年12月31日的2023年計劃中。
| 2023年12月31日未償還的期權 | 在2023年12月31日可行使的期權 | |||||||
| 2023年12月31日的股票價值 | $ | $ | ||||||
| 行權價格 | ||||||||
| 每股內在價值 | ||||||||
| 選項O/S | ||||||||
| 2023年12月31日的內在價值 | $ | $ | ||||||
11. 公允價值計量
下表彙總了公允價值層次中的公允價值和水平,其中公允價值計量屬於按經常性基礎計量的資產和負債,截至以下日期:
2023年12月31日
| 描述 | 1級 | 2級 | 3級 | 總計 | ||||||||||||
| 負債 | ||||||||||||||||
| 普通股認股權證 | $ | $ | $ | $ | ||||||||||||
| 總計 | $ | $ | $ | $ | ||||||||||||
2022年12月31日
| 描述 | 1級 | 2級 | 3級 | 總計 | ||||||||||||
| 負債 | ||||||||||||||||
| 普通股認股權證 | $ | $ | $ | $ | ||||||||||||
| 2022年可轉換票據 | ||||||||||||||||
| 總計 | $ | $ | $ | $ | ||||||||||||
下表呈列截至2023年12月31日止期間按經常性基準計量的第三級工具變動:
| 2021年12月31日的餘額 | $ | |||
| 認股權證公允價值變動 | ( | ) | ||
| 發行2022年可轉換票據 | ||||
| 2022年可轉換票據公允價值變動 | ||||
| 2022年12月31日的餘額 | ||||
| 認股權證公允價值變動 | ( | ) | ||
| 2022年可換股票據公允價值變動 | ||||
| 2022年可換股票據的轉換 | ( | ) | ||
| 2023年12月31日的餘額 |
| F-20 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
11.公平值計量(續)
| 2023年12月31日 | 2022年12月31日 | |||||||
| 基礎普通股價值 | $ | $ | ||||||
| 預期期限(年) | ||||||||
| 預期波動率 | % | % | ||||||
| 無風險利率 | % | % | ||||||
| 股息率 | % | % | ||||||
公司普通股公允價值的波動 是每年普通股認股權證負債估值變化的主要驅動因素 。隨着普通股公允價值的增加,票據持有人的價值通常也會增加。
贖回前,各種輸入數據的波動(包括企業價值、變現時間、波動性及貼現率 )為二零二二年可換股票據各報告期間估值變動的主要驅動因素。隨着 企業價值的公允價值、估計變現時間、波動性及貼現率增加,二零二二年可換股 票據持有人的價值普遍增加。
基本 和稀釋後每股淨虧損計算如下:
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 淨虧損 | $ | ( | ) | $ | ( | ) | ||
| 優先股股息 | ( | ) | ( | ) | ||||
| 普通股股東應佔淨虧損 | $ | ( | ) | $ | ( | ) | ||
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 加權平均已發行普通股、基本普通股和稀釋普通股 | ||||||||
| $0.01認股權證 | ||||||||
| 總計 | ||||||||
| F-21 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
12.每股淨虧損(續)
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 每股基本和稀釋後淨虧損 | $ | ) | $ | ) | ||||
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 購買普通股股份的期權 | $ | $ | ||||||
| 未清償認股權證 | ||||||||
| 總計 | $ | $ | ||||||
13. 所得税
截至2023年12月31日和2022年12月31日止年度的 所得税(福利)準備金包括:
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 當前 | ||||||||
| 聯邦制 | $ | $ | ||||||
| 外國 | ||||||||
| 狀態 | ||||||||
| 總電流 | ||||||||
| 延期 | ||||||||
| 聯邦制 | ||||||||
| 外國 | ||||||||
| 狀態 | ||||||||
| 延期合計 | ||||||||
| 所得税撥備總額 | $ | |||||||
使用美國聯邦法定税率計算的所得税與截至2023年12月31日和2022年12月31日止年度的營運所得税的 對賬包括:
| 2023 | 2022 | |||||||||||||||
| 金額 | 百分比 | 金額 | 百分比 | |||||||||||||
| 所得税使用美國法定税率 | $ | ( | ) | % | $ | ( | ) | % | ||||||||
| 債務公允價值調整 | ( | )% | ( | )% | ||||||||||||
| 扣除聯邦福利後的州税 | ( | ) | % | ( | ) | % | ||||||||||
| 研發税收抵免 | ( | ) | % | ( | ) | % | ||||||||||
| 更改估值免税額 | ( | )% | ( | )% | ||||||||||||
| 其他,淨額 | ( | )% | ( | )% | ||||||||||||
| $ | $ | ( | )% | $ | % | |||||||||||
| F-22 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
13.所得税(續)
遞延 所得税乃根據財務報告目的資產和負債賬面值與所得税報告目的資產和負債賬面值之間的暫時差異計提。於二零二三年及二零二二年十二月三十一日的遞延所得税資產╱(負債)如下:
| 十二月三十一日, | ||||||||
| 2023 | 2022 | |||||||
| 遞延税項資產: | ||||||||
| 淨營業虧損結轉 | $ | $ | ||||||
| 税收抵免 | ||||||||
| 折舊及攤銷 | ||||||||
| 應計費用 | ||||||||
| 其他 | ||||||||
| 遞延税項資產總額 | $ | |||||||
| 遞延税項負債: | ||||||||
| 折舊及攤銷 | ||||||||
| 遞延税項負債總額 | ||||||||
| 估值免税額 | ( | ) | ( | ) | ||||
| 遞延税項淨資產 | $ | $ | ||||||
公司的聯邦淨經營虧損結轉額約為美元
公司擁有約為美元的聯邦研究税收抵免
美國國税法第382節對所有權超過50%的公司使用其淨營業虧損結轉來減少納税義務的能力進行了年度限制。 如果未來本公司的所有權變更超過第382條規定的50%限制門檻,則本公司結轉的淨營業虧損在特定年度的使用量方面可能受到顯著限制。此外,本公司在2018年前產生的全部或部分淨營業虧損結轉 可能到期而未使用。
| F-23 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
13.所得税(續)
遞延税項資產的變現取決於公司在臨時差額可扣除期間產生未來應納税所得額的能力。根據公司最近的盈利歷史和預計的美國未來收益,管理層認為,在可預見的未來,其聯邦和州遞延税項資產更有可能無法完全變現 。作為這項評估的結果,管理層認為需要對其聯邦和州遞延税項淨資產進行全額估值扣除。
公司適用ASC 740-10的規定來處理不確定的税務狀況。ASC 740-10解決了是否應在財務報表中記錄在納税申報單上申報或預期申報的税收優惠的確定問題。根據美國會計準則第740-10條,公司只有在税務機關根據税務機關的技術價值審查後更有可能不會維持該税務頭寸的情況下,才可確認來自不確定税務頭寸的税收優惠。本公司已確定其 並無重大不確定税務狀況需要根據美國會計準則740-10予以確認和計量。
該公司需繳納美國聯邦所得税、康涅狄格州所得税和加拿大分行税。本公司尚未接受美國國税局、州或外國税務機關與所得税有關的審計。本公司的納税年度將繼續接受所有聯邦和州税務事項的審查 ,直到其淨營業虧損結轉使用且適用的訴訟時效已過期 。
如果適用,公司將確認與未確認的税收優惠相關的利息和罰款,作為所得税費用的組成部分。
14. 承付款和或有事項
法律
該公司在正常業務過程中受到法律程序或索賠的約束。雖然偶爾會出現不利的決定或和解,但本公司相信該等事宜的最終處置不應對其財務狀況、經營業績或流動資金造成重大不利影響。
許可證 協議
自2022年1月26日起,本公司與無關第三方訂立獨家許可協議(許可協議)。根據許可協議,本公司被授予某些專利的獨家許可和某些專有技術的非獨家許可。 許可協議持續到最後一個許可專利到期或第一個許可治療或非治療產品商業銷售 後十年。公司可通過向第三方提供至少30天的書面通知,隨時終止許可協議。如果違反協議規定的重大義務或破產,許可協議也將終止。許可協議終止後,任何一方均不得解除終止前產生的義務 。
在截至2023年12月31日和2022年12月31日的年度內,公司將根據本許可協議支付的款項資本化為$
15. 經營租約
該公司在康涅狄格州布蘭福德、康涅狄格州格羅頓和魁北克省拉瓦爾租用辦公和實驗室空間。本公司的租約將於 至2027年5月31日的不同日期到期。大多數租約都是固定期限和固定金額的。
於2019年,本公司於加拿大拉瓦爾簽訂了一份新的辦公及實驗室空間租賃協議。Laval租賃需要每月
支付$
| F-24 |
AZITRA,INC.
合併財務報表附註
截至2023年12月31日及2022年12月31日止年度
15.經營租約(續)
在
2020年期間,公司就公司位於康涅狄格州布蘭福德的主要辦公和實驗室空間簽訂了新的租賃協議。Branford租約需要每月支付$
2021年5月,公司與康涅狄格州格羅頓的辦公室和實驗室簽訂了新租約。格羅頓租約需要每月支付$
未來 在接下來的 五年中,每年初始或剩餘期限超過一年的不可取消經營租賃的最低付款如下:
| 2024 | $ | |||
| 2025 | ||||
| 2026 | ||||
| 2027 | ||||
| 2028 | ||||
| 此後 | ||||
| 未來未貼現的租賃付款總額 | ||||
| 更少的興趣 | ( | ) | ||
| 最低租賃付款現值 | $ |
租金
所有經營租賃的費用為$
融資 租賃
2023年,公司與惠普簽訂了租賃設備的協議。租賃要求每月支付美元
未來 在接下來的 五年中,每年初始或剩餘期限超過一年的不可取消經營租賃的最低付款如下:
| 2024 | $ | |||
| 2025 | ||||
| 2026 | ||||
| 2027 | ||||
| 此後 | ||||
| 未來未貼現的租賃付款總額 | ||||
| 更少的興趣 | ( | ) | ||
| 最低租賃付款現值 | $ |
融資租賃的租賃
費用為美元
| F-25 |
AZITRA,INC.
合併財務報表附註
截至二零二三年及二零二二年十二月三十一日止年度
16. 退休計劃
2019年1月1日起,
17. 關聯方
關聯方總收入為$
於
二零二二年九月,本公司訂立總額為美元的可換股承兑票據
18. 後續事件
2024年2月15日,公司完成了公開募股, 其普通股的發行價為美元每
股。本公司收到的所得款項總額約為美元。
| F-26 |
第 項9.會計和財務披露方面的變更和與會計師的分歧
不適用 。
第 9A項。控制和程序
(A) 對披露控制和程序的評價。
截至2023年12月31日,我們的 管理層在首席執行官和首席財務官的參與下,評估了我們根據《交易法》第13a—15(e)條的披露控制措施和程序的有效性。在評估過程中, 我們發現了一個重大缺陷,因為它與會計職能缺乏適當的分離有關。我們打算在會計基礎設施內增加人員 ,以便於適當分離會計職能,並對內部編制的財務報表進行適當審查 。基於上述,我們的首席執行官和首席財務官得出結論, 我們的披露控制和程序截至2023年12月31日尚未生效。
(b) 財務報告內部控制的變化。
在截至2023年12月31日的季度, 我們對財務報告的內部控制(定義見《交易法》第13a—15(f)條)沒有發生 的變化,這些變化對我們對財務報告的內部控制產生了重大影響,或合理可能對我們對財務報告的內部控制產生重大影響 。
(c) 管理層關於財務報告內部控制的報告。
本 年度報告不包括管理層對財務報告內部控制的評估報告或我們註冊會計師事務所的證明報告 ,因為美國證券交易委員會規則為新上市公司設定了過渡期。
第 9B項。其他信息
不適用 。
第 9C項。關於妨礙檢查的外國司法管轄區的披露
不適用 。
| 77 |
第 第三部分
項目 10.董事、高管和公司治理
本項目下所需的 信息將包含在2024年委託書中,並在此以引用方式併入。
第 項11.高管薪酬
本項目下所需的 信息將包含在2024年委託書中,並在此以引用方式併入。
項目 12.某些實益所有人和管理層的擔保所有權及相關股東事項
本項目下所需的 信息將包含在2024年委託書中,並在此以引用方式併入。
第 項13.某些關係和關聯交易,以及董事獨立性
本項目下所需的 信息將包含在2024年委託書中,並在此以引用方式併入。
第 項14.總會計師費用和服務
本項目所需的 信息將包含在2024年委託書中,並在此通過引用併入。
第四部分
第 項15.證物和財務報表附表
(a)財務報表
參照本文件第二部分第8項下的指數和財務報表,其中列出了這些文件。
(B) 財務報表附表
財務 報表明細表不是必需的,或者所要求的信息包含在本文件第二部分第8項下提交的合併財務報表或附註中。
| 78 |
(C) 個展品
本年度報告的表格10-K的展品如下。展品索引表示需要作為展品備案的每個管理合同或補償性計劃或安排。
| 數 | 附件 説明 | 備案方式 | ||
| 3.1 | 二次修訂和重新註冊的註冊人註冊證書 | 已註冊 本公司於2023年6月21日提交的8—K表格的當前報告。 | ||
| 3.2 | 第二次修訂和重新修訂註冊人章程 | 已註冊 本公司於2023年6月21日提交的8—K表格的當前報告。 | ||
| 4.1 | 代表普通股股份的證書樣本 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 4.2 | 向私募投資者發出的認股權證格式 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 4.3 | 2023年6月20日發佈給ThinkEquity LLC的代表權證表格 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 4.4 | 2024年2月16日向ThinkEquity LLC頒發的代表人認股權證表格(附於2024年2月13日註冊人與ThinkEquity,LLC簽訂的承銷協議) | 已註冊 本公司於2024年2月14日提交的表格8—K當前報告。 | ||
| 4.5 | 股本説明 | 在此以電子方式提交。 | ||
| 10.1+ | 阿茲特拉公司2016年股票激勵計劃 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 10.2+ | 阿茲特拉公司2023年股票激勵計劃 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 10.3+ | 2021年4月22日註冊人與Francisco D簽訂的行政僱傭協議。薩爾瓦 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 10.4+ | 註冊人和Travis Whitfill之間的行政僱傭協議2023年7月5日 | 已註冊 本公司於2024年1月19日提交的S—1表格。 | ||
| 10.5+ | 註冊人與其每一位董事和執行官之間的賠償協議的形式 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 10.6 | 第二次修訂和重申的投資者權利協議,日期為2020年9月10日,由註冊人和其中所列的每個投資者 | 已註冊 本公司於2023年6月13日提交的S—1表格。 | ||
| 21.1 | 註冊人的子公司名單 | 本文件通過參考公司於2023年3月20日提交的S—1表而併入本文件。 | ||
| 23.2 | Grassi & Co.的同意,註冊會計師,獨立註冊會計師事務所 | 在此以電子方式提交。 | ||
| 31.1 | 2002年《薩班斯—奧克斯利法案》第302條規定的認證 | 在此以電子方式提交。 | ||
| 31.2 | 2002年《薩班斯—奧克斯利法案》第302條規定的認證 | 在此以電子方式提交。 | ||
| 32.1 | 根據2002年《薩班斯—奧克斯利法案》第906條的認證,18 U.S.C.部1350 | 在此以電子方式提交。 | ||
| 97.1 | Azitra公司執行官回扣政策 | 在此以電子方式提交。 |
| + | 指管理層補償計劃、合同或安排。 |
第 項16.表格10-K總結
未提供 。
| 79 |
簽名
根據 1934年《證券交易法》第13或15(d)節的要求,註冊人已正式促使下列簽署人代表註冊人簽署10—K表格的年度報告 ,並經正式授權。
| AZITRA, Inc. | ||
| 日期: 2024年3月15日 | 發信人: | /S/ 弗朗西斯科·D·薩爾瓦 |
| 弗朗西斯科·D·薩爾瓦, | ||
| 首席執行官兼董事 | ||
根據1934年《證券交易法》的要求,本報告已由以下人員以註冊人的身份在指定日期簽署。
| 簽名 | 標題 | 日期 | ||
| /S/ 弗朗西斯科·D·薩爾瓦 | 總裁, 首席執行官兼董事 |
三月 2024年15月15日 | ||
| 弗朗西斯科·D·薩爾瓦 | (首席執行官 ) | |||
| /S/ 諾曼·斯塔斯基 | 首席財務官、財務主管兼祕書 | 三月 2024年15月15日 | ||
| 諾曼·斯塔斯基 | (首席財務會計官 ) | |||
| /S/ 特拉維斯·惠特菲爾 | 首席運營官兼董事 | 三月 2024年15月15日 | ||
| 特拉維斯 惠特菲爾 | ||||
| /S/ 安德魯·麥克拉利 | 董事 | 三月 2024年15月15日 | ||
| 安德魯·麥克拉利 | ||||
| /S/ 芭芭拉·瑞安 | 董事 | 三月 2024年15月15日 | ||
| 芭芭拉 瑞安 | ||||
| S/ 約翰·施羅爾 | 董事 | 三月 2024年15月15日 | ||
| 約翰·施羅爾 |
| 80 |