BDTX—20231231假象財年20230001701541Http://fasb.org/us-gaap/2023#IncomeLossFromEquityMethodInvestmentsHttp://fasb.org/us-gaap/2023#IncomeLossFromEquityMethodInvestments1Http://fasb.org/us-gaap/2023#AccruedLiabilitiesCurrentHttp://fasb.org/us-gaap/2023#AccruedLiabilitiesCurrentP5YP5YP5Y00017015412023-01-012023-12-3100017015412023-06-30ISO 4217:美元00017015412024-03-05Xbrli:共享00017015412023-12-3100017015412022-12-31ISO 4217:美元Xbrli:共享00017015412022-01-012022-12-3100017015412021-12-310001701541美國-美國公認會計準則:普通股成員2021-12-310001701541US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001701541Us-gaap:AccumulatedOtherComprehensiveIncomeMember2021-12-310001701541美國-公認會計準則:保留預付款成員2021-12-310001701541美國-美國公認會計準則:普通股成員2022-01-012022-12-310001701541US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001701541Us-gaap:AccumulatedOtherComprehensiveIncomeMember2022-01-012022-12-310001701541美國-公認會計準則:保留預付款成員2022-01-012022-12-310001701541美國-美國公認會計準則:普通股成員2022-12-310001701541US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001701541Us-gaap:AccumulatedOtherComprehensiveIncomeMember2022-12-310001701541美國-公認會計準則:保留預付款成員2022-12-310001701541美國-美國公認會計準則:普通股成員2023-01-012023-12-310001701541US-GAAP:AdditionalPaidInCapitalMembers2023-01-012023-12-310001701541Us-gaap:AccumulatedOtherComprehensiveIncomeMember2023-01-012023-12-310001701541美國-公認會計準則:保留預付款成員2023-01-012023-12-310001701541美國-美國公認會計準則:普通股成員2023-12-310001701541US-GAAP:AdditionalPaidInCapitalMembers2023-12-310001701541Us-gaap:AccumulatedOtherComprehensiveIncomeMember2023-12-310001701541美國-公認會計準則:保留預付款成員2023-12-310001701541bdtx:shelfRegistrationStatementMember2022-11-142022-11-140001701541bDTX:OpenMarketSaleMember2022-11-142022-11-140001701541bDTX:FollowOnOfferingMember2023-07-052023-07-050001701541bDTX:FollowOnOfferingMember2023-07-050001701541bDTX:LaunchpadTherapeuticsIncMember2023-12-310001701541美國-GAAP:設備成員2023-12-310001701541美國-GAAP:傢俱和固定設備成員2023-12-310001701541美國-GAAP:OfficeEquipmentMembers2023-12-31BDTX:段0001701541美國公認會計準則:MoneyMarketFundsMembers美國-公認會計準則:公允價值輸入級別1成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國公認會計準則:MoneyMarketFundsMembers美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國公認會計準則:MoneyMarketFundsMembers美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國公認會計準則:MoneyMarketFundsMembers美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-公認會計準則:公允價值輸入級別1成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2023-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2023-12-310001701541美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2023-12-310001701541美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2023-12-310001701541美國-公認會計準則:公司債券證券成員美國-公認會計準則:公允價值輸入級別1成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國-公認會計準則:公司債券證券成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-公認會計準則:公司債券證券成員美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-公認會計準則:公司債券證券成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-GAAP:公允價值衡量遞歸成員美國-公認會計準則:公允價值輸入級別1成員2023-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國-GAAP:公允價值衡量遞歸成員2023-12-310001701541美國公認會計準則:MoneyMarketFundsMembers美國-公認會計準則:公允價值輸入級別1成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國公認會計準則:MoneyMarketFundsMembers美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國公認會計準則:MoneyMarketFundsMembers美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國公認會計準則:MoneyMarketFundsMembers美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-公認會計準則:公允價值輸入級別1成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2022-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2022-12-310001701541美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2022-12-310001701541美國-GAAP:公允價值衡量遞歸成員Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2022-12-310001701541美國-公認會計準則:公司債券證券成員美國-公認會計準則:公允價值輸入級別1成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國-公認會計準則:公司債券證券成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-公認會計準則:公司債券證券成員美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-公認會計準則:公司債券證券成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-公認會計準則:公允價值輸入級別1成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:USGovernmentAgenciesDebtSecuritiesMember2022-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:USGovernmentAgenciesDebtSecuritiesMember2022-12-310001701541美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員Us-gaap:USGovernmentAgenciesDebtSecuritiesMember2022-12-310001701541美國-GAAP:公允價值衡量遞歸成員Us-gaap:USGovernmentAgenciesDebtSecuritiesMember2022-12-310001701541美國-GAAP:公允價值衡量遞歸成員美國-公認會計準則:公允價值輸入級別1成員2022-12-310001701541美國-公認會計準則:公允價值輸入級別2成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-公認會計準則:公允價值投入級別3成員美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541美國-GAAP:公允價值衡量遞歸成員2022-12-310001701541Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2023-12-310001701541美國-公認會計準則:公司債券證券成員2023-12-310001701541Us-gaap:CommercialPaperNotIncludedWithCashAndCashEquivalentsMember2022-12-310001701541美國-公認會計準則:公司債券證券成員2022-12-310001701541Us-gaap:USGovernmentAgenciesDebtSecuritiesMember2022-12-310001701541美國-GAAP:設備成員2022-12-310001701541美國-GAAP:傢俱和固定設備成員2022-12-310001701541美國-GAAP:OfficeEquipmentMembers2022-12-310001701541美國-公認會計準則:租賃改進成員2023-12-310001701541美國-公認會計準則:租賃改進成員2022-12-310001701541bDTX:LaunchpadTherapeuticsIncMember2022-12-31Xbrli:純0001701541bDTX:LaunchpadTherapeuticsIncMember2022-12-010001701541bDTX:LaunchpadTherapeuticsIncMember2022-01-012022-12-310001701541bDTX:A2020PlanMember2020-01-140001701541bDTX:A2020PlanMember2023-12-310001701541美國公認會計準則:次要事件成員bDTX:A2020PlanMember2024-01-012024-01-010001701541bdtx:A2020bstockpurasePlanMember2020-01-140001701541bdtx:A2020bstockpurasePlanMember2023-12-310001701541美國公認會計準則:次要事件成員bdtx:A2020bstockpurasePlanMember2024-01-012024-01-010001701541美國-公認會計準則:受限的股票成員2023-01-012023-12-310001701541美國-公認會計準則:受限的股票成員2022-12-310001701541美國-公認會計準則:受限的股票成員2023-12-310001701541美國-公認會計準則:受限的股票成員2022-01-012022-12-310001701541美國公認會計準則:績效共享成員2022-12-310001701541美國公認會計準則:績效共享成員2023-01-012023-12-310001701541美國公認會計準則:績效共享成員2023-12-310001701541bdtx:性能共享兩里程碑會員2023-01-012023-12-310001701541美國公認會計準則:績效共享成員2022-01-012022-12-310001701541美國-公認會計準則:員工股票期權成員2023-01-012023-12-310001701541美國-公認會計準則:員工股票期權成員2022-01-012022-12-310001701541美國-GAAP:受限股票單位RSU成員2023-01-012023-12-310001701541美國-GAAP:受限股票單位RSU成員2022-01-012022-12-310001701541bdtx:AwardTypeMember2023-01-012023-12-310001701541bdtx:AwardTypeMember2022-01-012022-12-310001701541Us-gaap:ShareBasedPaymentArrangementNonemployeeMemberbDTX:A2020PlanMember2023-01-012023-12-310001701541Us-gaap:ShareBasedPaymentArrangementNonemployeeMemberbDTX:A2020PlanMember2022-01-012022-12-310001701541美國-公認會計準則:研究和開發費用成員2023-01-012023-12-310001701541美國-公認會計準則:研究和開發費用成員2022-01-012022-12-310001701541美國-公認會計準則:一般和行政費用成員2023-01-012023-12-310001701541美國-公認會計準則:一般和行政費用成員2022-01-012022-12-310001701541美國-公認會計準則:員工斯托克成員2023-01-012023-12-310001701541美國-公認會計準則:員工斯托克成員2023-12-310001701541美國-公認會計準則:員工斯托克成員2022-01-012022-12-310001701541美國-GAAP:國內/地區成員2023-12-310001701541bDTX:TaxYear2036Member美國-GAAP:國內/地區成員2023-12-310001701541美國-公認會計準則:州和地方法律法規成員2023-12-310001701541美國-公認會計準則:研究成員美國-GAAP:國內/地區成員2023-12-310001701541美國-公認會計準則:員工股票期權成員2023-01-012023-12-310001701541美國-公認會計準則:員工股票期權成員2022-01-012022-12-310001701541美國-公認會計準則:受限的股票成員2023-01-012023-12-310001701541美國-公認會計準則:受限的股票成員2022-01-012022-12-310001701541美國-公認會計準則:員工斯托克成員2023-01-012023-12-310001701541美國-公認會計準則:員工斯托克成員2022-01-012022-12-310001701541美國公認會計準則:績效共享成員2023-01-012023-12-310001701541美國公認會計準則:績效共享成員2022-01-012022-12-310001701541美國公認會計準則:保修成員2023-01-012023-12-310001701541美國公認會計準則:保修成員2022-01-012022-12-31BDTX:合約0001701541bdtx:OperatingLeasePrincipalCooperation TwoMember2020-07-31Utr:SQFT0001701541bdtx:OperatingLeasePrincipalCooperation TwoMember2023-08-310001701541bDTX:OperatingLeaseBurySpaceNYMember2020-12-31 美國
美國證券交易委員會
華盛頓特區,20549
___________________________________________
表格10-K
___________________________________________ | | | | | |
| ☒ | 根據1934年《證券交易法》第13或15(D)條提交的年度報告 |
截至本財政年度止12月31日, 2023
或 | | | | | |
| ☐ | 根據1934年《證券交易法》第13或15(D)條提交的過渡報告 |
從_年至_年過渡期
佣金文件編號001-38501
___________________________________________
BLACK DIAMOND THERAPEUTICS,INC.
(註冊人的確切姓名載於其章程)
___________________________________________ | | | | | |
| 特拉華州 | 81-4254660 |
(國家或其他司法管轄區 指公司或組織) | (税務局僱主 識別號碼) |
1 Main Street,14樓 劍橋, 馬薩諸塞州 (主要執行辦公室地址) | 02142 (郵政編碼) |
(617)252-0848 (註冊人的電話號碼,包括區號) |
根據該法第12(B)條登記的證券: | | | | | | | | |
| 每個班級的標題 | 交易代碼 | 註冊的每個交易所的名稱 |
| 普通股,面值0.0001美元 | BDTX | 納斯達克全球精選市場 |
___________________________________________
根據該法第12(G)條登記的證券:無。
用複選標記表示註冊人是否為證券法規則405中定義的知名經驗豐富的發行人。☐ 不是 ☒
如果註冊人不需要根據該法第13節或第15(D)節提交報告,請用複選標記表示。☐ 不是 ☒
用複選標記表示註冊人(1)是否在過去12個月內(或在要求註冊人提交此類報告的較短期限內)提交了1934年《證券交易法》第13條或15(D)節要求提交的所有報告,以及(2)在過去90天內一直遵守此類提交要求。是 ☒*
用複選標記表示註冊人是否在過去12個月內(或在註冊人被要求提交此類文件的較短時間內)以電子方式提交了根據S-T規則第405條(本章232.405節)要求提交的每個交互數據文件。是 ☒*
用複選標記表示註冊人是大型加速申報公司、加速申報公司、非加速申報公司、較小的報告公司或新興成長型公司。請參閲《交易法》第12b-2條規則中“大型加速申報公司”、“加速申報公司”、“較小申報公司”和“新興成長型公司”的定義。 | | | | | | | | | | | |
| 大型加速文件服務器 | ☐ | 加速的文件管理器 | ☐ |
|
|
|
|
| 非加速文件服務器 | ☒ | 規模較小的新聞報道公司 | ☒ |
|
|
|
|
|
| 新興成長型公司 | ☒ |
如果是一家新興的成長型公司,用複選標記表示註冊人是否已選擇不使用延長的過渡期來遵守根據《交易所法》第13(A)節提供的任何新的或修訂的財務會計準則。☐
用複選標記表示註冊人是否提交了一份報告,證明其管理層根據《薩班斯-奧克斯利法案》(《美國聯邦法典》第15編,第7262(B)節)第404(B)條對其財務報告的內部控制的有效性進行了評估,該評估是由編制或發佈其審計報告的註冊會計師事務所進行的。他説:☐
如果證券是根據該法第12(B)條登記的,應用複選標記表示登記人的財務報表是否反映了對以前發佈的財務報表的錯誤更正。☐
用複選標記表示這些錯誤更正中是否有任何重述需要對註冊人的任何執行人員在相關恢復期間根據第240.10D-1(B)條收到的基於激勵的補償進行恢復分析。☐
用複選標記表示註冊人是否是空殼公司(如交易法第12b-2條所定義)。☐*☒
截至2023年6月30日,也就是註冊人最近完成的第二財季的最後一個工作日,註冊人的非關聯公司持有的註冊人普通股的總市值約為$114,544,206根據納斯達克全球精選市場截至該日所報每股5.05美元的收盤價計算。在確定非附屬公司普通股的市場價值時,登記人的普通股股份由管理人員、董事和附屬公司實益擁有已被排除在外。對於其他目的,這種附屬機構地位的確定不一定是決定性的確定。
截至2024年3月5日,註冊人已51,717,849普通股,每股面值0.0001美元,已發行。
引用成立為法團的文件
10—K表格年度報告的第三部分通過引用納入了註冊人2024年股東年會的最終委託書或委託書中的某些信息,註冊人打算根據第14A條在註冊人截至2023年12月31日的財政年度後不遲於120天內向美國證券交易委員會提交。除以引用方式特別納入的信息外,委託聲明不被視為作為10—K表格的本年度報告的一部分提交。
與我們的業務相關的重大風險和其他風險摘要
我們的業務受到許多重大和其他風險和不確定性的影響,閣下在評估我們的業務時應瞭解,包括第二部分第IA項所述的風險。“風險因素”在本年度報告表10—K。這些風險包括但不限於以下:
•我們的開發工作還處於早期階段,在很大程度上依賴於我們的臨牀階段候選產品BDTX—1535和BDTX—4933。如果我們無法通過臨牀開發推進BDTX—1535、BDTX—4933或我們的任何其他候選產品,獲得監管部門的批准並最終將BDTX—1535、BDTX—4933或我們的任何其他候選產品商業化,或者如果我們在這方面遇到重大延誤,我們的業務將受到重大損害。
•患者入組困難可能會延遲或阻止我們候選產品的臨牀試驗。我們可能會發現,很難在BDTX—1535的II期臨牀試驗或BDTX—4933的I期臨牀試驗中招募患者,這些候選產品針對的基因突變。
•如果我們無法為我們的候選產品獲得所需的監管批准,或者如果延遲獲得所需的監管批准,我們將無法將我們的候選產品商業化,或者將推遲將我們的候選產品商業化,我們的創收能力將受到嚴重損害。
•我們的臨牀試驗可能無法充分證明我們的任何候選產品的安全性和有效性,這將阻止或推遲監管部門的批准和商業化。
•我們專注於為患有基因定義癌症的患者開發精準藥物,這是一個快速發展的科學領域,我們已經採取的發現和正在採取的開發藥物的方法是新穎的,可能永遠不會導致適銷對路的產品。
•商業或經濟中斷或全球健康問題可能嚴重損害我們的發展努力,並增加我們的成本和開支。
•我們有限的經營歷史可能會使您難以評估我們業務迄今的成功程度,也難以評估我們未來的生存能力。
•我們自成立以來已產生重大虧損,我們預計未來數年將產生虧損,未來可能無法實現或維持收入或盈利能力。
•我們沒有從我們的候選產品中產生任何收入,可能永遠不會盈利。
•我們將需要大量的額外資金。如果我們無法在需要的時候籌集資金,我們將被迫推遲、減少或取消我們的產品開發計劃或商業化努力。
•如果我們無法獲得和維護BDTX—1535、BDTX—4933、我們的MAP藥物發現引擎和我們的其他候選產品和技術,或我們可能開發的任何其他候選產品或技術的專利和其他知識產權保護,或者如果獲得的知識產權保護範圍不夠廣泛,我們的競爭對手可能開發和商業化與我們相似或相同的產品和技術,我們商業化BDTX—1535、BDTX—4933或任何其他候選產品或技術的能力可能會受到不利影響。
•我們依賴第三方進行臨牀前研究和臨牀試驗。如果這些第三方未能正確和成功地履行其合同義務或在預期期限內完成,我們可能無法獲得監管部門的批准或將我們的候選產品商業化。
•我們可能會在未來形成或尋求合作或戰略聯盟,或達成額外的許可安排,但我們可能沒有意識到此類合作、聯盟或許可安排的好處。
•我們高度依賴我們的關鍵人員,並預計將招聘新的關鍵人員。如果我們不能成功地吸引和留住高素質的人才,我們就可能無法成功地實施我們的商業戰略。
•我們的股票價格波動很大,你可能會損失全部或部分投資。
•數據收集受到有關個人信息的使用、處理和跨境轉移的限制性規定的約束。
•美國和外國司法管轄區專利法的變化可能會降低專利的整體價值,從而削弱我們保護產品的能力。
•税法的變化可能會對我們的業務和財務狀況產生不利影響。
•我們可能無法充分保護我們的信息系統免受網絡攻擊,網絡攻擊可能導致包括個人數據在內的機密或專有信息被泄露,損害我們的聲譽,並使我們面臨重大的財務和法律風險。
以上總結的材料和其他風險應與標題為“風險因素”以及本年度報告Form 10-K中列出的其他信息,包括我們的合併財務報表和相關附註,以及我們提交給美國證券交易委員會的其他文件。如果實際發生任何此類重大和其他風險和不確定因素,我們的業務、前景、財務狀況和經營結果可能會受到重大不利影響。以上概述的風險或本Form 10-K年度報告中在其他地方完整描述的風險並不是我們面臨的唯一風險。我們目前不知道或我們目前認為無關緊要的其他風險和不確定因素也可能對我們的業務、前景、財務狀況和經營結果產生重大不利影響。
BLACK DIAMOND THERAPEUTICS,INC.
目錄 | | | | | |
| 頁面 |
第一部分 | 7 |
項目1.業務 | 8 |
第1A項。風險因素 | 46 |
項目1B。未解決的員工意見 | 117 |
項目1C。網絡安全 | 117 |
項目2.財產 | 119 |
項目3.法律訴訟 | 119 |
項目4.礦山安全信息披露 | 119 |
第II部 | 120 |
項目5.註冊人普通股市場、相關股東事項和發行人購買股權證券 | 120 |
項目6.保留 | 120 |
項目7.管理層對財務狀況和經營成果的討論和分析 | 120 |
項目7A.關於市場風險的定量和定性披露 | 132 |
項目8.財務報表和補充數據 | 133 |
項目9.會計和財務披露方面的變更和與會計師的分歧 | 158 |
項目9A.控制和程序 | 159 |
項目9B.其他信息 | 160 |
項目9C。關於妨礙檢查的外國司法管轄區的披露 | 160 |
第三部分 | 161 |
項目10.董事、高管和公司治理 | 161 |
項目11.高管薪酬 | 161 |
項目12.某些實益所有人和管理層的擔保所有權及相關股東事項 | 161 |
第十三項:特定關係和關聯交易與董事獨立性 | 161 |
項目14.首席會計師費用和服務 | 161 |
第四部分 | 162 |
項目15.證物和財務報表附表 | 162 |
項目16.表格10-K摘要 | 164 |
我們已申請多個商標,我們在業務運營中使用。本年報表格10—K或年報也可能包含第三方的商標、服務標記和商號,這些都是其各自所有人的財產。本公司在本年報中使用或展示第三方商標、服務標記、商號或產品並非有意且不暗示與本公司有任何關係、或由本公司認可或贊助。僅為方便起見,本年度報告中提及的商標、服務商標和商號可能不使用®, TM或SM本公司不對任何商標、服務商標和商品名的所有者或所有人在適用法律的最大範圍內行使其權利,但省略此類引用並不意味着我們不會在適用法律的最大範圍內行使其權利。
我們可能不時使用我們的網站或我們的LinkedIn個人資料在www.example.com分發重要信息。我們的財務和其他材料信息通常張貼在我們網站的投資者部分,並可在www.blackdiamondtherapeutics.com查閲。我們鼓勵投資者查看我們網站的投資者部分,因為我們可能會在該網站上發佈我們不會以其他方式傳播的重要信息。我們的網站或我們的LinkedIn頁面所包含的信息並不包含在本年度報告中,也不構成本年度報告的一部分。
關於前瞻性陳述的特別説明
本年度報告包含根據經修訂的1933年證券法第27A條(證券法)和經修訂的1934年證券交易法第21E條(交易法)的安全港條款作出的前瞻性陳述。除歷史事實陳述外,本年報所載的所有陳述均為前瞻性陳述。在某些情況下,您可以通過諸如“可能”、“將”、“可能”、“應該”、“預期”、“打算”、“計劃”、“預期”、“相信”、“估計”、“預測”、“潛在”、“繼續”等術語或其他類似術語的負面術語來識別前瞻性陳述。該等陳述並非對未來業績或表現的保證,且涉及重大風險及不確定性。本年度報告中的前瞻性陳述包括但不限於關於以下方面的陳述:
•BDTX—1535、BDTX—4933和任何其他候選產品臨牀試驗的進展、時間和成功,包括這些試驗的數據和結果的可用性、時間和公佈;
•我們的臨牀試驗和研究性新藥(IND)申請、開發工作和其他監管提交的範圍、時間、進展和結果;
•我們獲得和維持BDTX—1535和BDTX—4933或我們可能識別或開發的任何未來候選產品的監管批准的能力;
•與BDTX—1535、BDTX—4933或我們任何其他當前或未來的候選產品競爭的影響,以及我們行業中當前和未來競爭對手的創新;
•我們對BDTX—4876和其他一個臨牀前項目的戰略替代方案的評估,包括我們執行和實現我們可能尋求的任何戰略替代方案的預期益處的能力;
•我們需要籌集額外資金,然後才能從產品銷售中獲得任何收入;
•我們開發目前用於治療各種癌症的候選產品的能力;
•我們可能開發的任何當前或未來候選產品的市場接受率和程度以及臨牀實用性;
•實施我們的業務戰略計劃,以及我們可能基於我們的突變—變異—藥理學(MAP)藥物發現引擎開發的任何候選產品;
•我們有能力成功開發與我們當前或未來的候選產品配套使用的診斷程序;
•我們的知識產權狀況,包括我們能夠建立、維護和執行的知識產權保護範圍,涵蓋我們的候選產品和藥物發現引擎;
•我們有能力在需要時為我們的運營獲得額外資金,包括如果獲得批准,完成我們候選產品的進一步開發和商業化所需的資金;
•我們預計現有現金、現金等價物和投資將足以支付我們的運營費用和資本支出要求的期間;
•我們對費用、未來收入、資本需求和額外融資需求的估計的準確性;
•我們未來的財務業績和有效管理預期增長的能力;
•我們對候選產品的市場機會的估計,包括我們的競爭地位和已有或可能獲得的競爭療法的成功;
•我們需要和有能力吸引和留住關鍵的科學、管理和其他人員,以及確定、聘用和留住更多合格的專業人員;
•我們的業務發展努力的潛力,以最大化我們的平臺和候選產品的價值;
•我們候選產品的市場規模和增長潛力,以及我們單獨或與其他公司合作服務這些市場的能力;
•我們建立或維持合作或戰略關係的能力,以及我們的第三方戰略合作伙伴開展與我們當前或未來候選產品相關的研究和開發活動的能力和意願;
•我們對2012年JumpStart Our Business Startups Act(JOBS Act)規定的新興成長型公司的期望值;
•我們維持有效的內部控制制度的能力;
•全球經濟和政治發展對我們業務的影響,包括通貨膨脹上升和資本市場中斷、經濟制裁和經濟放緩或衰退,這些發展可能會損害我們的研發努力以及我們普通股的價值和我們進入資本市場的能力;
•衞生流行病、流行病和其他廣泛爆發的傳染病的最終影響,包括緩解措施和經濟影響,對我們業務運營的上述任何方面或其他方面的最終影響,包括但不限於我們的臨牀試驗、研究計劃、醫療保健系統或全球經濟整體;以及
•其他重大風險和不確定性,包括本年度報告第一部分第1A項“風險因素”中討論的風險和不確定性。
本年度報告中的任何前瞻性陳述反映了我們對未來事件和我們未來財務表現的當前看法,涉及已知和未知的風險、不確定性和其他因素,可能會導致我們的實際結果、業績或成就與這些前瞻性陳述明示或暗示的任何未來結果、業績或成就大不相同。可能導致實際結果與當前預期大相徑庭的因素包括但不限於第I部分第1a項“風險因素”和本年度報告其他部分所述的因素。鑑於這些不確定性,您不應過度依賴這些前瞻性陳述。除非法律要求,我們沒有義務以任何理由更新或修改這些前瞻性陳述,即使未來有新的信息可用。
我們所有的前瞻性陳述僅限於截至本年度報告之日。在每一種情況下,實際結果都可能與這些前瞻性信息大不相同。我們不能保證這樣的期望或前瞻性陳述將被證明是正確的。本年度報告中提及或包含在我們的其他公開披露或其他定期報告或其他文件或提交給美國證券交易委員會或美國證券交易委員會的其他文件或文件中提到的一個或多個風險因素或風險和不確定因素的發生或任何重大不利變化,可能會對我們的業務、前景、財務狀況和運營結果產生重大不利影響。不可能預測或識別所有此類風險。除法律另有規定外,我們不承諾或計劃更新或修改任何此類前瞻性表述,以反映本年度報告日期後發生的實際結果、計劃、假設、估計或預測的變化或其他影響此類前瞻性表述的情況,即使此類結果、變化或情況明確表明任何前瞻性信息將無法實現。我們在本年度報告之後所作的任何公開聲明或披露,如果修改或影響本年度報告中包含的任何前瞻性陳述,將被視為修改或取代本年度報告中的此類陳述。
本年報載有本年報所述部分文件所載若干條文的摘要,但有關完整資料請參閲實際文件。所有摘要均由實際文件完整地限定。本報告所述部分文件的副本已作為本年度報告的證據存檔。
我們可能會不時提供有關我們的行業、一般商業環境和某些疾病的市場的估計、預測和其他信息,包括對這些市場的潛在規模和某些疾病的估計發病率和流行率的估計。基於估計、預測、預測、市場研究或類似方法的信息本身就會受到不確定因素的影響,實際事件、情況或數字,包括實際的疾病患病率和市場規模,可能與本年度報告中反映的信息大不相同。除非另有明確説明,否則我們從市場研究公司和其他第三方、行業、醫療和一般出版物、政府數據和類似來源準備的報告、研究調查、研究和類似數據中獲得本行業、商業信息、市場數據、流行率信息和其他數據,在某些情況下應用我們自己的假設和分析,這些假設和分析在未來可能被證明不準確。
第一部分
除上下文另有要求或另有説明外,本年報中的術語“Black Diamond”、“Black Diamond Therapeutics”、“我們”、“我們的”和類似名稱均指Black Diamond Therapeutics,Inc.。並在適當情況下,其附屬公司。
項目1.業務
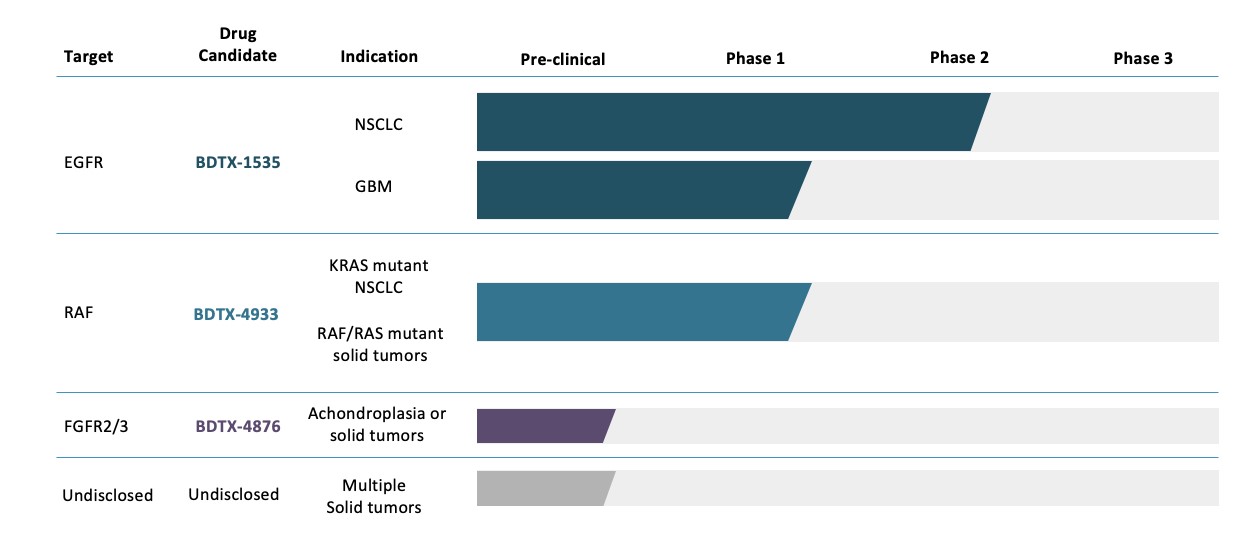
我們是一家臨牀階段的腫瘤公司,專注於開發MasterKey療法,以治療遺傳腫瘤患者。我們公司的基礎是建立在對癌症遺傳學、癌蛋白結構和功能以及藥物化學的深刻理解之上。我們的MasterKey療法旨在解決廣泛的基因定義腫瘤,克服耐藥性,最大限度地減少野生型介導的毒性,併成為腦滲透劑以治療中樞神經系統(CNS)疾病。我們的化合物靶向臨牀驗證途徑中的致癌突變家族。我們正在推進兩個臨牀階段的項目:BDTX—1535,一種腦滲透劑,第四代表皮生長因子受體(EGFR)MasterKey抑制劑,靶向表皮生長因子受體突變體(EGFRm)非小細胞肺癌(NSCLC)和膠質母細胞瘤(GBM),和BDTX—4933,一種腦滲透劑,RAF MasterKey抑制劑靶向實體瘤中的KRAS,NRAS和BRAF改變。
黑鑽石療法
我們的目標是為治療選擇有限的基因定義癌症患者提供靶向腫瘤治療。我們的藥物開發努力利用了我們的新發現:
•整個基因的突變可以驅動致癌激活並改變其活性位點的藥物選擇性特徵;
•這些致癌突變可以分為家族,因為它們驅動相似的蛋白質結構變化,並表現出共同的選擇性特徵;
•因此,一個致癌蛋白家族可以被靶向活性位點的單一分子抑制,而不管它出現在蛋白質上的何處。
我們的MasterKey療法是使用我們專有的MAP藥物發現引擎發現的,該引擎建立在三個中心支柱之上:識別蛋白激酶中的致癌突變,基於細胞和腫瘤模型確認突變的致癌性,以及在保留野生型的同時對相關突變進行藥理學抑制。批准的靶向療法,如激酶抑制劑,已經改變了癌症的治療,並顯示出通過治療單一腫瘤類型的活性位點突變在某些患者中的顯著益處。人類癌症基因測序的改進導致了其他致癌基因改變的發現。這些基因改變以前沒有得到解決,沒有成功靶向或被忽視。我們的MasterKey療法旨在通過利用其共享的激活構象來靶向致癌驅動突變家族。我們相信,我們的MasterKey方法提供了一個巨大的機會,以擴大可以受益於靶向腫瘤藥物的患者數量。
Black Diamond Therapeutics
我們有一個口服,有效和選擇性的小分子MasterKey抑制劑的管道,靶向單個癌基因的驅動突變家族,用於治療癌症和遺傳疾病。我們的產品線包括我們正在進行臨牀試驗的兩個候選產品,以及我們正在評估潛在戰略合作伙伴關係的其他候選產品。我們的候選產品線概述如下表所示。
BDTX—1535:一種腦穿透、不可逆的EGFR MasterKey抑制劑,具有廣泛的突變覆蓋率
我們相信,BDTX-1535有潛力在早期和晚期治療EGFRm非小細胞肺癌患者,基於BDTX-1535‘S處理大約50個癌基因突變的能力,比其他EGFR酪氨酸激酶抑制劑(TKI)更有效,並且唯一針對C797S耐藥突變,可以在用奧西美替尼治療後獲得。從歷史上看,EGFR抑制劑在具有經典的EGFR激活突變的患者中顯示出顯著的臨牀益處,是目前的一線治療標準。然而,隨着時間的推移,幾乎所有的患者都會獲得耐藥性突變並復發。此外,多達一半的非小細胞肺癌患者要麼在確診時就有中樞神經系統轉移,要麼在治療過程中發生轉移,這增加了對標準治療的抵抗力和不良預後的風險。大多數第一代和第二代EGFR TKI不能充分滲透中樞神經系統,第三代EGFR抑制劑osimertinib表現出有限的中樞滲透能力。當患者對第三代EGFR TKIs產生耐藥性時,他們也幾乎沒有選擇了。耐藥性可由獲得性C797S耐藥突變和/或無數其他致癌的非經典EGFR驅動突變引起。目前還沒有批准的治療方法來治療攜帶獲得性耐藥C797S突變的EGFRm非小細胞肺癌患者。根據不斷髮展的真實世界證據,我們認為非經典突變也越來越多地出現在新診斷的NSCLC患者中,正如下一代腫瘤測序所檢測到的那樣。Afatanib是唯一被批准用於非經典突變的EGFR TKI,其標籤僅限於S768I、L861Q和G719X。我們的BDTX-1535臨牀前數據顯示,包括S768I、L861Q和G719X在內的廣泛非經典EGFR突變(約50)具有有效的抑制作用。
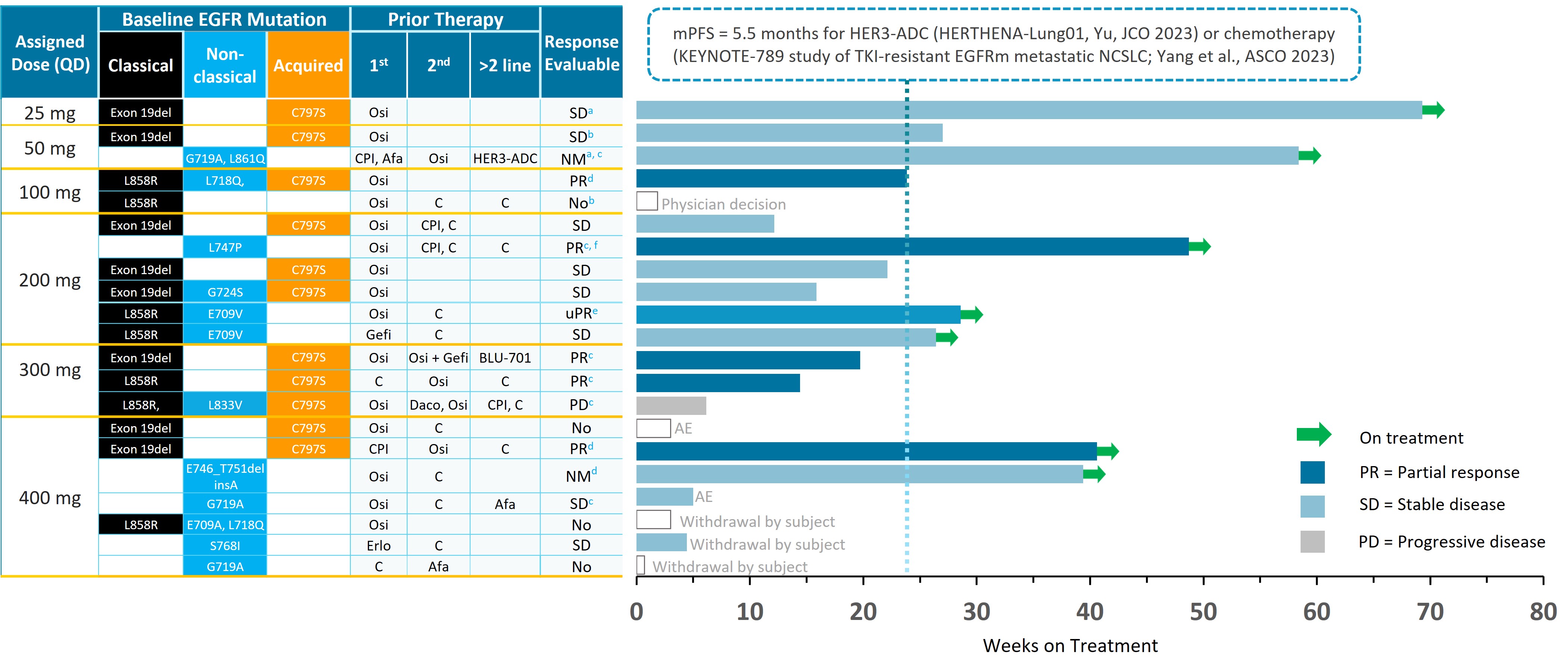
在我們對晚期/轉移性EGFRm NSCLC患者進行的1期試驗中,BDTX-1535被證明耐受性良好,在腫瘤表現出一系列突變亞型的患者中取得了持久的臨牀反應,包括獲得性C797S耐藥性突變和一系列非經典突變。BDTX-1535獲得美國食品和藥物管理局(FDA)的快速通道指定,用於治療轉移性EGFR C797S突變陽性、沒有T790M突變的非小細胞肺癌患者,其疾病在第三代EGFR TKI治療前後進展。我們目前正在第二階段臨牀試驗中評估BDTX-1535,在具有非經典驅動程序突變和獲得性C797S耐藥性突變的第二和第三線環境中,以及在具有非經典EGFR突變的患者的第一線環境中,對EGFRm NSCLC患者進行評估。我們預計將在2024年第三季度公佈二線和三線隊列的結果,並在2025年公佈一線隊列的結果。我們還在評估Osimertinib輔助治療後BDTX-1535對EGFRm NSCLC患者的潛在開發,其中C797S的BDTX-1535的廣泛突變和非經典突變可能是有益的。
我們在2023年第四季度發佈了BDTX—1535 I期劑量遞增研究的頂級複發性GBM結果,顯示在重度預治療GBM患者中具有臨牀活性。BDTX—1535通常耐受良好,未觀察到新的安全性信號。
2023年第四季度,BDTX—1535在複發性高級別膠質瘤患者中的"機會窗"0/1期試驗開始入組。該試驗由亞利桑那州鳳凰城的常春藤腦瘤中心贊助,正在計劃手術切除前招募患者。在腫瘤的釓非增強區域達到足夠藥物水平的患者將在手術後繼續治療。本研究主要旨在評估腦組織中BDTX—1535的藥物水平,並確認EGFR突變狀態,該突變狀態可能會因既往治療(如放療和化療)而改變。我們預計將在2024年第二季度公佈第一階段數據和“機會窗口”結果,這將為BDTX—1535在GBM中開發的潛在後續步驟提供信息。
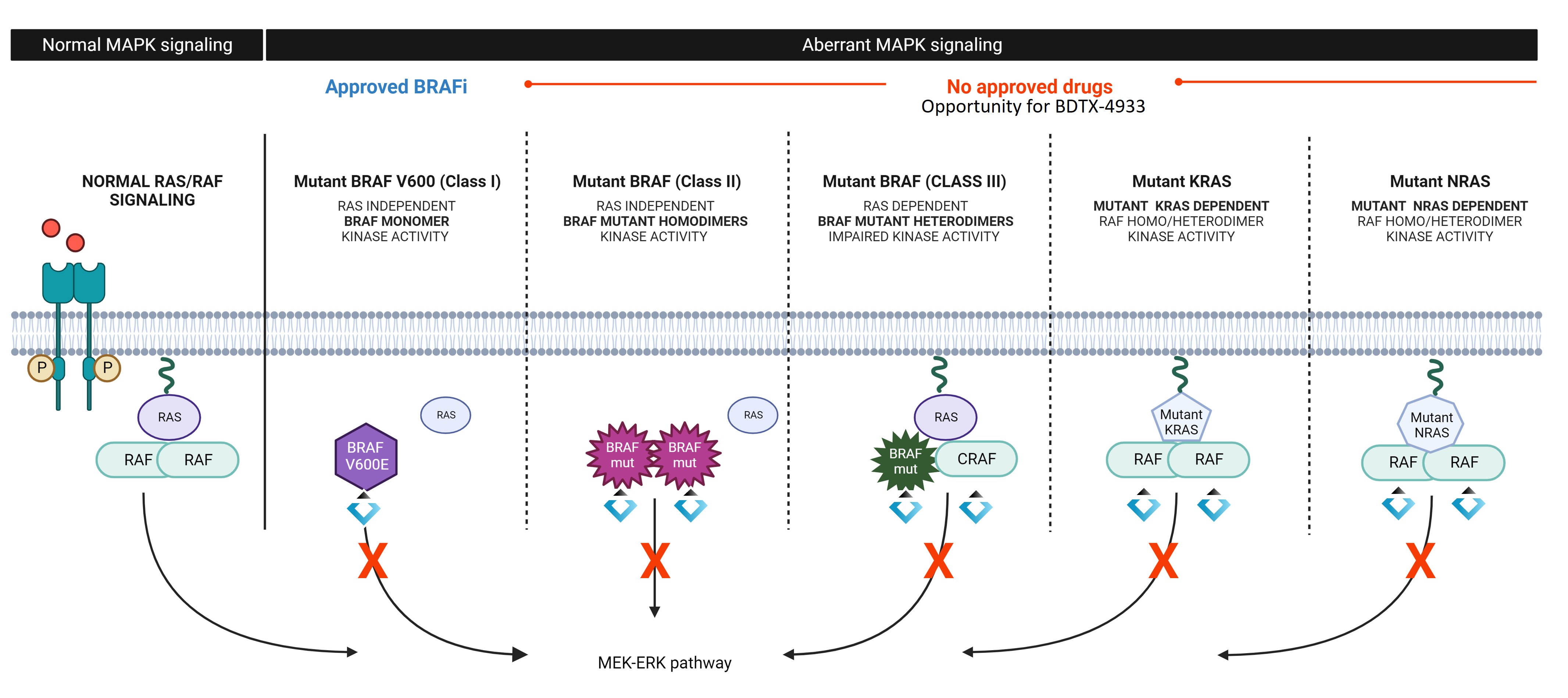
BDTX—4933:一種高選擇性腦滲透RAF MasterKey抑制劑
BRAF突變是腫瘤中最常見的突變之一。第一代BRAF抑制劑專注於典型V600E(I類)突變,但對非典型致癌BRAF突變沒有活性。非典型致癌突變,包括BRAF融合,可驅動RAS非依賴性(II類)或RAS依賴性(III類)RAF二聚體。目前的BRAF抑制劑可以誘導不需要的矛盾激活,限制其活性的廣度,並可能導致皮膚毒性。第一代BRAF抑制劑在KRAS突變的背景下也不起作用,目前還沒有獲批的精確治療藥物來解決表達非G12C KRAS突變的腫瘤。此外,BRAF和KRAS突變的表達通常發生在CNS腫瘤或腦轉移的患者中,但目前批准的BRAF抑制劑具有較差的內在腦滲透。因此,對於廣泛的突變譜和CNS滲透RAF抑制劑來治療表達BRAF突變和相關RAS依賴性改變的患者,仍然存在高度未滿足的臨牀需求。
BDTX—4933被設計為一種強效、選擇性、可逆的口服抑制劑,靶向廣泛的致癌BRAF、KRAS和NRAS改變家族。BDTX—4933選擇性靶向由BRAF突變或其他上游致癌MAPK通路改變(如KRAS和NRAS改變)產生的組成性活性RAF二聚體。在臨牀前腫瘤模型中,我們觀察到BDTX—4933表現出腦滲透活性,並實現了攜帶廣譜KRAS突變、NRAS突變以及BRAF I、II和III類突變的腫瘤消退。
我們於2023年第二季度在BRAF患者中啟動了BDTX—4933的I期臨牀試驗,並選擇KRAS和NRAS突變陽性癌症,重點是非G12C KRAS突變NSCLC患者。該試驗目前正在進行劑量遞增,預計2024年第四季度公佈數據。
早期方案
我們正在為我們的FGFR2/3選擇性開發候選物BDTX—4876以及另一種針對未公開、經驗證的癌基因的開發候選物尋求全球合作機會。
我們的戰略
我們的願景是建立一個差異化的全球生物製藥公司,開發和商業化針對基因定義腫瘤患者的新藥。我們正在推進通過改進對突變蛋白質構象的理解而發現的化合物,以識別新型致癌驅動突變,並使用MasterKey療法靶向致癌突變家族,以解決更多患者的問題。我們的策略是探索這些化合物的開發,從後期的治療開始,並基於結果,將開發擴展到早期的治療環境,其中具有這些突變的患者幾乎沒有治療選擇,並且耐受良好的口服治療與靜脈給藥化療,抗體或結合物治療相比對患者具有潛在優勢。我們戰略的關鍵組成部分包括:
•生成BDTX—1535在2L/3L EGFRm NSCLC中的II期臨牀試驗結果,以實現潛在的關鍵性試驗。 我們認為,BDTX—1535是開發中最先進的第四代EGFR TKI,其獨特地靶向獲得性C797S耐藥突變以及可導致第三代TKI疾病進展的非經典突變。
•在1L非經典EGFRm NSCLC中快速推進BDTX—1535的II期開發,以最大限度地提高BDTX—1535的治療潛力。 我們相信,BDTX—1535的目標約為50 現有療法不能充分解決的致癌突變,以及其口服給藥和耐受性特徵以及腦滲透率,為一線治療非經典突變患者提供了巨大的潛力。
•概述BDTX—1535在1L新診斷EGFR改變的GBM患者中的潛在開發路徑。 基於BDTX—1535的I期數據和“機會窗”試驗的結果,我們將確定BDTX—1535作為新診斷EGFR改變GBM患者一線治療的潛在下一步開發步驟。
•評估BDTX—4933的早期劑量遞增數據,以評價未來開發潛力。 我們認為,BDTX—4933可以提供一種改進的方法來解決腫瘤KRAS、NRAS和所有類型的BRAF改變在有或沒有中樞神經系統腫瘤的患者中表達,我們最初的重點是非G12C KRAS突變的NSCLC。
•評估潛在的戰略合作伙伴關係,以最大限度地發揮我們的管道潛力。 我們可能會考慮並適時地圍繞特定目標、候選產品和疾病領域建立戰略合作伙伴關係。我們的FGFR項目和另一個未公開的實體瘤項目已經達到開發候選階段,我們正在評估進一步開發的許可機會。
我們的歷史和團隊
我們成立於2014年,並於2017年與Versant Ventures一起,開始構建MAP藥物發現引擎,以分析致癌突變並創建MasterKey Therapies。我們已經組建了一支在藥物開發方面具有重要專業知識的團隊,特別是在小分子蛋白激酶抑制劑和通過臨牀試驗和監管批准推進腫瘤候選藥物方面具有優勢。mark a.韋萊卡醫學博士,博士學位,我們的董事長、總裁兼首席執行官之前是G1 Therapeutics,Inc.的首席執行官,在那裏,他領導了多個治療領域的多個候選產品的發展,包括領導其第一個治療從研究新藥(IND)申請到FDA批准。伊麗莎白·巴克博士我們的首席科學官,之前在OSI製藥公司領導臨牀前藥理學和腫瘤學轉化研究。Sergey Yurasov醫學博士博士學位,我們的首席醫療官,之前在Nuvation Bio擔任首席醫療官。Melanie Morrison,我們的首席開發官,曾擔任高級副總裁,項目管理和臨牀運營在Nuvation Bio。我們的首席運營官兼總法律顧問布倫特·哈茨斯—肖克曾任Radius Health公司的總法律顧問。方妮,藥學博士,我們的首席業務官和首席財務官曾擔任過Versant Ventures的首席執行官和首席財務官,並曾擔任Versant Ventures的投資團隊成員。Elizabeth Montgomery,我們的首席人事官,之前擔任首席人事官ClearView Healthcare Partners。
我們的候選產品和開發計劃
我們有一個口服的,有效的和選擇性的小分子MasterKey療法的管道,靶向幾種癌症的基因驅動器。我們擁有所有候選產品的全球商業權利。
BDTX—1535:一種腦穿透、突變選擇性、不可逆EGFR MasterKey抑制劑,靶向NSCLC中EGFR經典、非經典和獲得性耐藥突變以及GBM中表達的EGFR改變
當前EGFR抑制劑的背景和侷限性
在NSCLC中,EGFR抑制劑已在典型EGFR激活突變(外顯子19del,L858R)患者中表現出顯著的臨牀獲益,是當前的一線標準治療。然而,隨着時間的推移,幾乎所有患者都會獲得抵抗和復發。對於第三代EGFR抑制劑奧希替尼,獲得性耐藥可能與非經典突變的獲得有關(例如,L747P、L718Q)或獲得性C797S耐藥突變,奧希替尼對其無活性。此外,在初步診斷時,很大一部分NSCLC患者攜帶非經典EGFR突變,包括當前治療方法難以解決的複雜突變。此外,多達一半的NSCLC患者要麼在診斷時患有CNS轉移,要麼在治療過程中發生轉移。大多數第一代和第二代EGFR抑制劑不能充分滲透CNS,雖然第三代腦滲透EGFR抑制劑如奧希替尼可能延緩CNS轉移的進展,但當不可避免地出現耐藥性時,患者幾乎沒有選擇。因此,診斷時攜帶非經典突變的患者或在當前EGFR靶向藥物治療中進展且伴有獲得性耐藥突變的患者(包括腦轉移患者)的治療仍然是NSCLC中醫療需求高度未滿足的領域。
我們的解決方案:BDTX—1535
BDTX—1535是一種強效、選擇性、不可逆、口服和腦滲透小分子抑制劑,旨在解決EGFR改變驅動的NSCLC和GBM的關鍵未滿足需求。優化了BDTX—1535的藥理活性,以抑制導致耐藥的廣譜EGFR突變,並通過其高腦暴露的潛力靶向CNS腫瘤。
EGFR是一種強癌基因,通常在許多癌症中發生改變,包括NSCLC和GBM。NSCLC中的EGFR突變通常影響激酶結構域,而GBM中的EGFR突變主要發生在細胞外結構域。在基於細胞的試驗中,與奧希替尼相比,BDTX—1535實現了對致癌EGFR突變家族的強效抑制,並實現了對正常表達EGFR WT的選擇性。這包括經典、非經典、獲得性C797S耐藥突變和NSCLC中表達的複雜突變。BDTX—1535不是外顯子20插入或T790M耐藥突變的有效抑制劑。在基於細胞的試驗中,BDTX—1535對GBM和EGFR擴增中表達的致癌EGFR變體家族實現了強效MasterKey抑制,且選擇性高於正常表達的EGFR WT。
臨牀發展
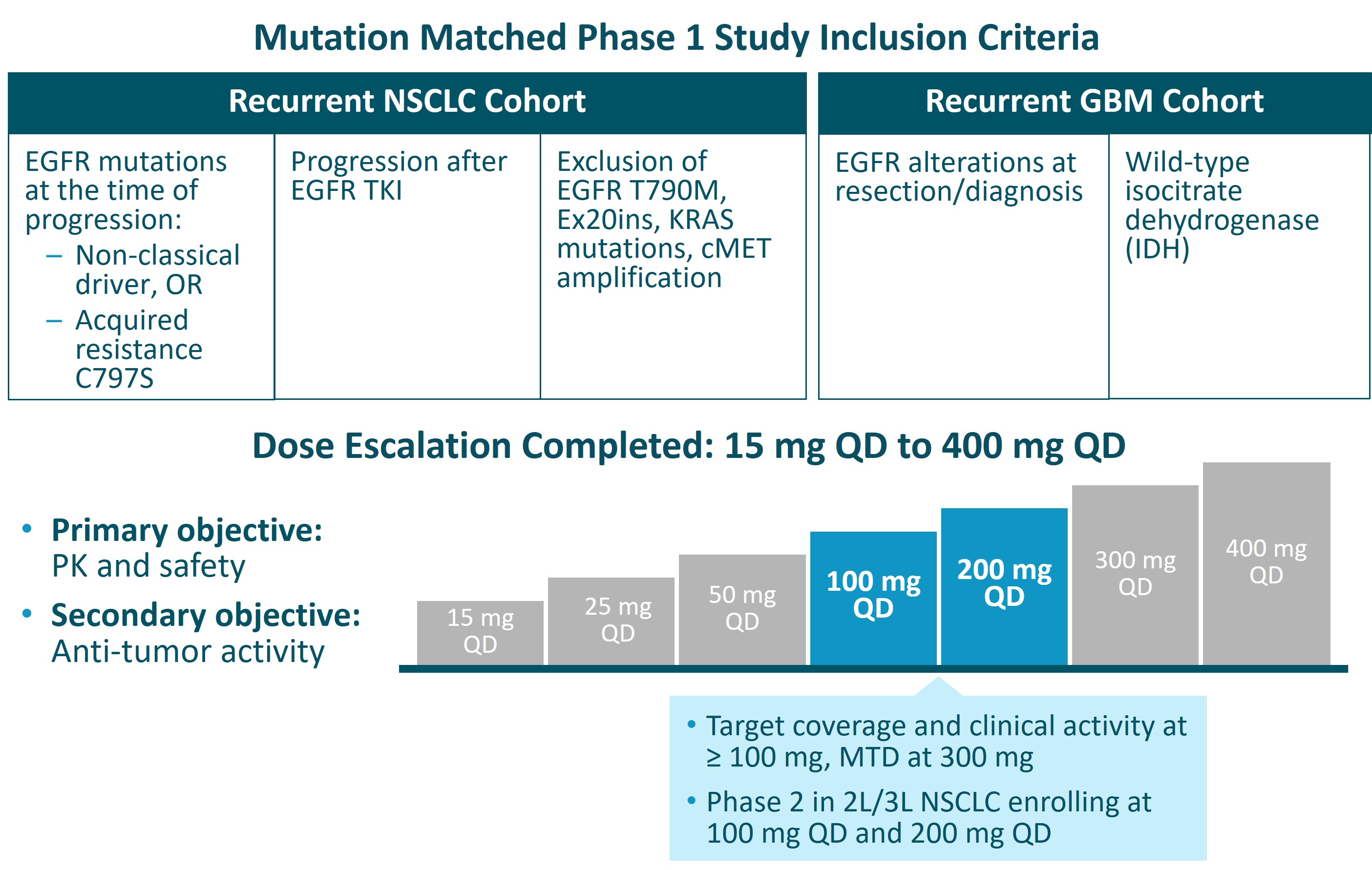
BDTX—1535的IND申請於2022年第一季度獲得FDA批准,首個人體臨牀試驗(BDTX 1535—101)也於2022年第一季度啟動。本試驗的I期劑量遞增部分入組了NSCLC和GBM中攜帶EGFR致癌性改變的患者。
BDTX 1535—101是一項開放標籤、多中心I/II期試驗,包括I期劑量遞增部分(已完成)和多隊列II期劑量擴展部分(入組)。I期部分旨在評估BDTX—1535在攜帶致敏EGFR突變的晚期/轉移性NSCLC患者(伴或不伴腦轉移)中的安全性、耐受性、藥代動力學和初步抗腫瘤活性,這些患者在經批准的EGFR抑制劑治療後出現進展,或複發性GBM表達EGFR改變。合格的NSCLC患者在既往接受第三代EGFR抑制劑治療後在外顯子18或21處存在非經典EGFR突變或獲得性C797S突變。劑量遞增部分基於貝葉斯自適應設計,允許在每個劑量水平入組不同數量的患者,以評估BDTX—1535的安全性、耐受性和藥代動力學,以確定最大耐受劑量(MTD)。
非小細胞肺癌
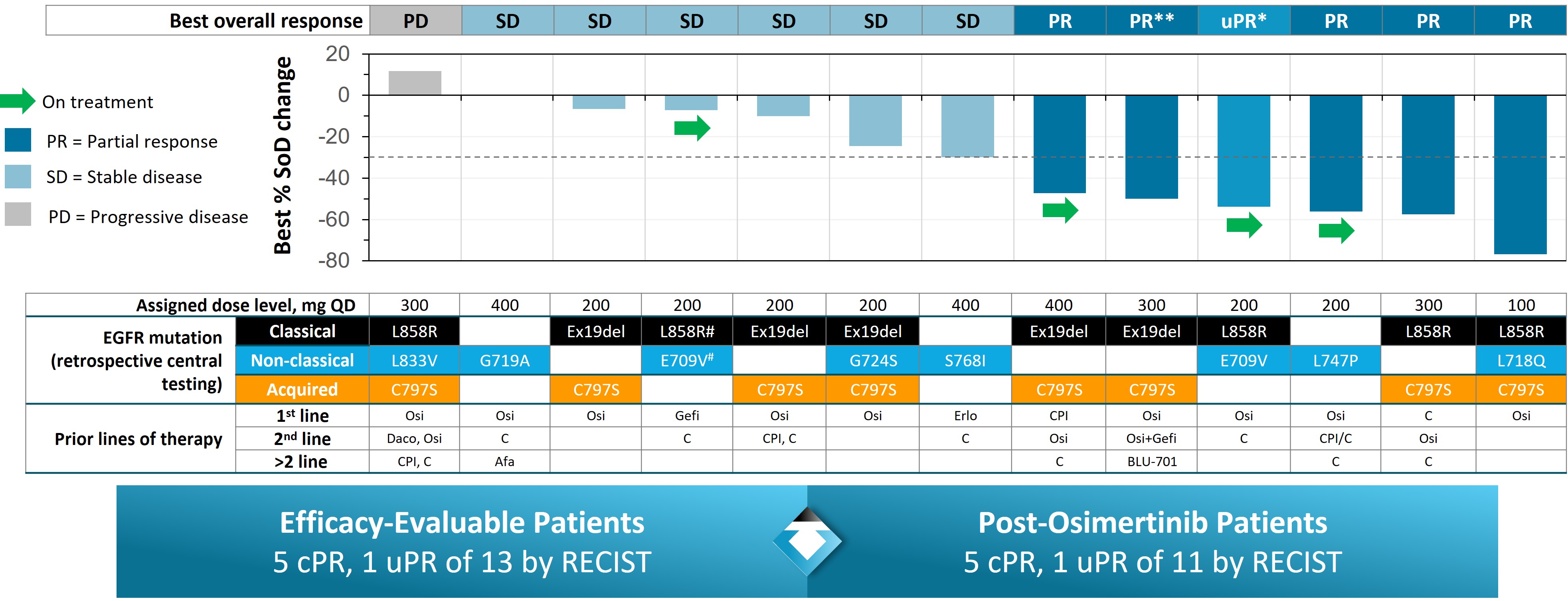
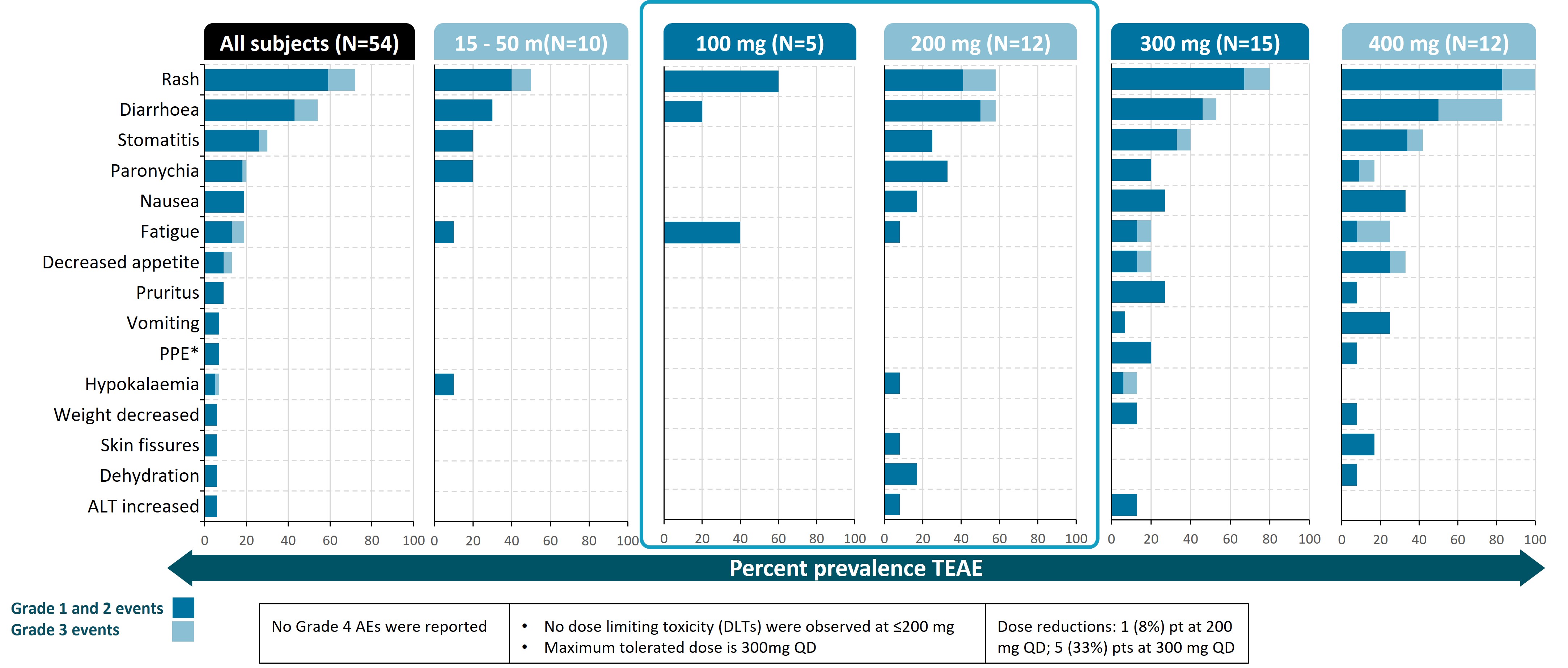
我們於2023年6月發佈了I期劑量遞增試驗的一線NSCLC結果,並於2023年10月在歐洲癌症研究和治療組織—國家癌症研究所—美國癌症研究協會(EORTC—NCI—AACR)分子靶點和癌症治療研討會上展示了更新的臨牀數據。會議上披露的數據來自27名晚期/轉移性NSCLC患者,他們接受了25 mg至400 mg的每日一次劑量。
在既往接受多線治療的NSCLC患者中,在起始劑量為100 mg每日一次或以上時觀察到持久的臨牀應答。在13名患者中,5名患者患有非經典驅動因素、獲得性C797S耐藥突變或複雜突變,在研究開始時具有可測量的疾病並接受基線後腫瘤評估,經RECIST1.1證實部分緩解(PR)。觀察到腦轉移減少的證據,包括一名既往接受超過三線治療的患者。結果顯示,3名應答者繼續接受治療超過6個月(2名確認PR,1名未確認PR),1名確認PR的患者繼續接受治療6個月。另外兩名病情穩定的患者繼續接受治療超過12個月。在不同劑量水平的BDTX—1535治療患者中,還觀察到所有NSCLC EGFR突變亞型的靶向變異等位基因根除和循環腫瘤DNA顯著減少。
Osi =奧希替尼;Afa = Afatinib;吉菲=吉非替尼;Daco =達克替尼;Erlo =厄洛替尼;CPI =檢查點抑制劑,C =化療;#—確證性試驗中不存在突變;* uPR =未經證實的部分緩解—患者在基線後掃描中出現PR,但放射科醫生無法在後續掃描中確認緩解;該患者繼續接受研究治療,無PD證據。 * * % SoD更新為先前數據發佈的—50%;2023年7月24日BDTX—1535—101臨牀數據提取;數據來自EORTC/AACR/NCI分子靶點和癌症治療國際會議海報,2023年10月
a)劑量遞增至100 mg QD;b)劑量遞增至200 mg QD;c)既往接受了兩條以上治療線;d)劑量降至300 mg QD;e)患者基線後掃描中出現PR,但放射科醫生無法確認後續掃描中的緩解;該患者仍在接受研究治療,無PD;f)患者在第11週期的靶病變增加> 20%,然而,繼續研究治療;數據來自EORTC/AACR/NCI分子靶點和癌症治療國際會議的海報,2023年10月
不良事件結果包括NSCLC和GBM隊列。證實了良好的耐受性特徵,未發現非預期安全性信號,100 mg和200 mg每日一次劑量組的大多數不良事件為輕度或中度。在200 mg每日一次或更低劑量下未觀察到劑量限制性毒性。
≥ 6%患者發生的治療後出現的不良事件(TEAE);300 mg隊列中的所有患者均接受皮疹預防治療;皮疹組術語:皮疹、斑丘疹性皮疹、痤瘡樣皮炎;* PPE =掌跖紅斑性感覺障礙綜合徵;數據來自EORTC/AACR/NCI分子靶點和癌症治療國際會議2023年10月的海報
第一階段的審判現已完成。2023年9月,我們對II期試驗中的首批患者進行了給藥,以評估兩個隊列中EGFRm NSCLC患者的總體緩解率(ORR)和緩解持久性(DOR):一個隊列在第三代EGFR TKI治療進展後出現EGFR獲得性C797S耐藥突變,另一個隊列在EGFR TKI治療進展後出現非經典驅動突變。100 mg和200 mg劑量的兩個隊列繼續入組,我們預計將在2024年第三季度披露II期試驗這兩個隊列的初步結果。
在2023年底收到FDA的反饋後,在2024年第一季度,我們在攜帶非經典EGFR突變的一線NSCLC患者中啟動了II期隊列。預計II期試驗的三個隊列中的每一個隊列將招募多達40名患者。
BDTX—1535獲得FDA快速通道認證,用於治療轉移性EGFR C797S突變陽性NSCLC患者,無T790M突變,其疾病在第三代EGFR TKI治療期間/之後發生進展。我們計劃在NSCLC患者II期擴展隊列的結果獲得後與FDA會面,以討論BDTX—1535在EGFRm NSCLC中的潛在註冊途徑。
GBM
GBM是一種難以治療的侵襲性中樞神經系統惡性腫瘤。診斷時的標準治療包括手術切除,然後放療和化療。預後仍然很差,只有大約25%的新診斷患者在診斷後存活兩年或更長時間。在診斷時,約52%的GBM腫瘤表達一種或多種EGFR致癌改變,這些改變影響受體酪氨酸激酶的細胞外區域,從而促進致癌活化。在臨牀前模型中,我們已經表明,這些EGFR致癌性改變的激活機制涉及組成型二聚體的形成,該二聚體表現出導致GBM中表達的胞外結構域EGFR改變家族共享的配體非依賴性信號傳導的構象。我們認為,目前的EGFR靶向療法在治療GBM方面不成功,原因是(i)個體患者中同時表達不同EGFR致癌性改變,(ii)不同EGFR致癌性改變的藥物效力不足,(iii)由早期抑制劑引起的GBM中常見的EGFRm反常激活,以及(iv)低水平的腦滲透。BDTX—1535旨在克服這些挑戰,解決GBM患者對新治療方法的重大未滿足需求。
2023年12月,我們公佈了22名接受≥ 100 mg每日一次劑量治療的GBM患者的劑量遞增結果,證明在重度預治療患者中有臨牀活性,包括19名根據RANO標準可測量疾病的患者中有1名確認部分緩解和8名疾病穩定患者。在22例療效可評價的患者中,3例患者的治療時間超過10個月,1例患者的治療時間超過6個月,5例患者的治療時間超過4個月。重要的是,該人羣的歷史無進展生存期(PFS)預計將持續約2—4個月。BDTX—1535通常耐受良好,未觀察到新的安全性信號。值得注意的是,在本試驗給藥前無法確認患者的EGFR狀態,這是未來開發的重要考慮因素。
一項研究者申辦的BDTX—1535的"機會窗"0/1期試驗正在接受顱內腫瘤手術切除術的複發性高級別膠質瘤患者中進行。該試驗將提供腦中BDTX—1535藥物水平的數據,並確認患者腫瘤的EGFR突變狀態。GBM是高度多態性的腫瘤,已知隨着治療治療如放療和化療而演變,從而可能隨着時間的推移改變EGFR突變狀態。我們預計將在2024年第二季度的醫學會議上公佈劑量遞增研究和“機會窗”研究的臨牀數據。這些結果將為新診斷的攜帶EGFR改變的GBM患者的潛在進一步開發提供信息。
我們認為,在確認EGFR改變狀態的新診斷GBM患者中進行的隨機試驗可能是評價BDTX—1535治療該適應症潛在獲益的最合適策略。
BDTX—4933:一種靶向KRAS、NRAS和BRAF I、II、III類致癌突變的高選擇性腦滲透RAF MasterKey抑制劑
RAF抑制劑的背景和侷限性
BRAF突變是腫瘤中最常見的突變之一。影響BRAF的致癌性改變包括V600E突變(I類)活性位點突變以及作為二聚體活性的非典型BRAF突變家族(II類和III類)。雖然V600E I類突變已成功靶向黑色素瘤和其他實體瘤,但目前還沒有獲批的治療方法靶向黑色素瘤和一系列其他實體瘤中表達的II類和III類突變的全譜。此外,所有類型的BRAF突變的表達通常發生在患有CNS腫瘤或腦轉移的患者中,由於其腦滲透性差,目前尚未被批准的藥物解決。獲批的BRAF抑制劑可能導致不必要的反常激活,這可能導致療效差和繼發性惡性腫瘤。
我們的解決方案:BDTX—4933
BDTX—4933被設計為一種腦滲透劑,口服小分子MasterKey抑制劑,抑制致癌KRAS、NRAS和BRAF I、II和III類突變,同時避免了反常激活。我們相信BDTX—4933可以提供一種改進的治療方法,用於治療表達活化MAPK通路改變的實體瘤,包括腦轉移瘤。
在基於細胞的試驗中,BDTX—4933顯示出對包括融合在內的廣譜BRAF改變的強效抑制作用,並表現出對細胞增殖的劑量依賴性抑制作用。在表達KRAS、NRAS和BRAF I、II和III類突變的臨牀前腫瘤模型中,BDTX—4933每日給藥顯示劑量依賴性腫瘤生長抑制、腫瘤消退和生存優勢,與強效靶向和通路抑制一致。BDTX—4933在表達I類V600E突變的顱內小鼠腫瘤模型中也表現出強大的腦滲透特性和活性。
我們於2023年10月在EORTC—NCI—AACR分子靶點和癌症治療研討會上展示了BDTX—4933的作用機制數據,證明BDTX—4933通過阻斷上游激活RAS突變並將其鎖定為失活形式來形成“RAS/RAF鉗”。我們認為這是RAF和RAS景觀中的一種不同的作用機制。
1. Zhang,W.,Cell Res.(2002);2.袁,J.,J Hematol Oncol 13,113(2020);3.姚Z,癌細胞(2015);4. Karoulia Z,Cancer Cell(2016);5. J. Wang,Pharmacol.第129、414—423(2018)號決議; 6. H.艾倫斯,藥物代謝處置45,646—656(2017); 7. R. K. Mittapalli,J. Pharmacol. exp. ther. 342,33—40(2012); 8. R. K. Mittapalli,J. Pharmacol. exp. ther. 344,655—664(2013); 9.貝魯姆虛擬現實,安·昂科爾。(2015年); 10.蘇F.,N Engl J Med.(2012); 11. Hatzivassiliou G,Nature.(2010年); 12. Poulikakos PI.,《自然》(2010)
臨牀發展
BDTX—4933的IND於2023年第一季度獲得FDA批准。2023年第二季度,我們啟動了BDTX—4933的I期臨牀試驗。I期試驗目前正在招募患者參加試驗的劑量遞增部分,重點是非G12C KRAS突變NSCLC患者。本試驗的劑量遞增部分旨在評價BDTX—4933的安全性、耐受性、藥代動力學和初步抗腫瘤活性。基於這些結果,我們將確定該候選產品開發的潛在後續步驟。
早期方案
FGFR計劃
影響FGFR2和FGFR3的致癌突變(包括短變異點突變和融合)在一系列癌症中表達,如膀胱癌和膽管癌。雖然這些突變已被三種第一代泛FGFR抑制劑(erdafitinib、pemigatinib和infigratinib)靶向,但與靶向抑制FGFR1相關的劑量限制性毒性阻礙了臨牀成功,這導致了高磷血癥,需要顯著的劑量中斷和劑量降低,甚至停藥。這些限制限制了當前一代FGFR靶向治療的療效。
BDTX—4876是致癌FGFR2/3突變的MasterKey抑制劑,相對於FGFR1/4具有選擇性。在臨牀前腫瘤模型中,證實了劑量依賴性腫瘤消退,並且在臨牀前模型中也觀察到骨生長,支持BDTX—4876在肌肉骨骼發育不良中的潛在發展。我們在2023年提名BDTX—4876為開發候選人,目前正在探索進一步開發該項目的潛在合作伙伴關係。
未公開程序
在2023年,我們還提名了一個開發候選人,用於實體瘤靶點未公開的項目,並正在評估潛在的合作伙伴關係,以進一步開發該項目。
競爭
我們的工業競爭激烈,並受到迅速和重大的技術變革。雖然我們相信我們的知識、經驗和科學資源為我們提供了競爭優勢,但我們面臨着來自全球主要製藥公司和生物技術公司的巨大競爭。我們的許多競爭對手擁有更大的財政、技術和人力資源。規模較小和處於早期階段的公司也可能成為重要的競爭對手,特別是通過與大型和老牌公司的合作安排。因此,我們的競爭對手可能會比我們更成功地發現、開發、授權或商業化產品。
我們目前的候選產品面臨競爭,未來的候選產品也將面臨競爭,這些競爭來自制藥、生物技術和其他相關市場,這些市場追求針對基因定義癌症患者的靶向治療。目前有一些化合物已獲批和正在開發,這些化合物靶向EGFR通路,我們預計BDTX—1535將與之競爭,例如:
•EGFR獲得性耐藥患者:阿ivantamab或Rybrevant ®和lazertinib的聯合用藥,前者由Janssen Biotech,Inc.上市,後者由Janssen Biotech,Inc.開發;默克公司正在開發的patritumab deruxtecan,公司,和Daiichi Sankyo Co.;德魯替康(datopotamab deruxtecan),由阿斯利康(AstraZeneca)和第一株式會社(Daiichi Sankyo Co.)開發;BBT—207,由Bridge Biotherapeutics公司開發;JIN—A02正在由J Ints Bio開發。
•EGFR非經典突變患者:阿法替尼或Gilotrif ®(Boehringer Ingelheim International GmbH),並獲批作為具有S768I、L861Q和/或G719X突變的NSCLC患者的一線治療;奧希替尼或Tagrisso ®(阿斯利康公司),可為具有外顯子18突變的NSCLC患者處方標籤外;以及由Arrivent Biocyma和上海Allist製藥公司開發的furmonertinib。
•在GBM中存在EGFR改變的患者中:ERAS—801,由Erasca,Inc.開發;WSD—0922—FU,由Wayshine Biopharm International Ltd.開發;和TAS—2940,由Taiho Oncology,Inc.開發。
目前有幾家公司正在開發針對RAS—RAF途徑的化合物,我們預計BDTX—4933將與之競爭,例如:
•BRAF II/III類突變和其他RAS突變患者:Day One BiopharmPharmaceuticals,Inc.;Jazz Pharmaceuticals plc;Erasca,Inc.;Mirati Therapeutics公司;江蘇恆瑞醫藥股份有限公司;Fore Biotherapeutics Inc.;Incyte Corporation和Astellas Pharmaceuticals。
此外,還有其他以小分子和精密腫瘤學為重點的公司,我們最終可能會與之競爭,包括禮來Loxo腫瘤學;沃諾諾伊公司;Deciphera Pharmaceuticals;Inc. Verastem公司;Relay Therapeutics,Inc;拜耳公司;和Quanta Therapeutics。
我們的競爭對手可能比我們更快地獲得監管機構對其產品的批准,或者可能獲得專利保護或其他知識產權,從而限制了我們開發或商業化候選產品的能力。我們的競爭對手也可能開發出比我們產品更有效、更方便、使用更廣泛、成本更低或安全性更好的藥物,這些競爭對手也可能比我們更成功地生產和銷售他們的產品。
此外,我們可能需要與診斷公司合作開發我們的候選產品,在建立這些合作時,我們將面臨來自其他公司的競爭。我們的競爭對手還將與我們競爭,招聘和保留合格的科學、管理和商業人員,建立臨牀試驗中心和臨牀試驗患者登記,以及獲取補充或必要的技術,我們的計劃。
此外,我們還面臨更廣泛的競爭,以獲得成本效益和可償還的癌症治療。治療癌症患者的最常見方法是手術、放療和藥物治療,包括化療、激素治療和靶向藥物治療或這些方法的組合。有多種可用的癌症藥物療法上市。在許多情況下,這些藥物聯合施用以增強療效。雖然我們的候選產品(如果有的話)可能與這些現有藥物和其他療法競爭,但在最終與這些療法聯合使用或作為這些療法的輔助使用的程度上,我們的候選產品可能不具有競爭力。其中一些藥物是品牌的,並受專利保護,而其他藥物是仿製藥。保險公司和其他第三方付款人也可能鼓勵使用仿製產品或特定品牌產品。我們預計,如果我們的候選產品獲得批准,其定價將比競爭性仿製藥(包括品牌仿製藥)高出顯著溢價。因此,我們成功推出市場的任何候選產品,獲得市場認可,並在市場上獲得顯著份額將構成挑戰。此外,許多公司正在開發新的治療方法,我們無法預測隨着我們的候選產品通過臨牀開發的進展,護理標準將是什麼。
醫藥產品的收購或許可也是非常有競爭力的。如果我們尋求收購或授權產品,我們將面臨來自多個較成熟公司的激烈競爭,其中一些公司承認了授權或收購產品的戰略,其中許多公司比我們更大,擁有比我們更多的機構經驗和更大的現金流。這些較成熟的公司可能比我們具有競爭優勢,其他新興公司也可能在產品許可和/或收購方面採取類似或不同方法。此外,一些已建立的研究型製藥和生物技術公司可能會收購處於開發後期階段的產品,以擴大其內部產品線,這可能為這些公司提供更大的競爭優勢。
製造和供應
我們沒有擁有或經營任何生產設施,目前也沒有計劃建立任何生產設施。我們目前依賴並預計將繼續依賴第三方來生產正在進行臨牀前測試的候選產品,以及如果我們的候選產品獲得上市批准,則用於臨牀測試和商業生產。
我們所有的候選產品都是小分子,並通過合成工藝從可用的起始材料生產。這種化學反應似乎可以擴大規模,目前在生產過程中不需要特殊的設備。我們希望繼續開發可在第三方合同製造組織(CMO)中以成本效益生產的候選產品。
我們通常希望依靠一個或多個潛在合作伙伴為我們的產品生產伴隨診斷,這些伴隨診斷是用於識別適當患者人羣的分析或測試。
商業化
在獲得上市批准後,我們預計將通過在美國建立一個專注的銷售和市場營銷組織來開始商業化活動,以銷售我們的產品。我們相信,這樣一個組織將能夠滿足腫瘤學家社區的需求,他們是治療我們正在開發的候選產品的患者人羣的關鍵專家。在美國境外,我們可能會就獲得上市批准的任何候選產品與第三方達成分銷和其他營銷安排。
我們還計劃建立一個營銷和銷售管理組織,為我們通過自己的銷售組織營銷的任何產品制定和實施營銷戰略,並監督和支持我們的銷售隊伍。營銷組織的責任將包括制定與批准的產品有關的教育倡議,並與相關醫學領域的研究人員和從業者建立關係。
知識產權
我們尋求保護我們認為對我們業務重要的知識產權和專有技術,包括通過尋求涵蓋我們候選產品和使用方法的專利申請,以及被認為對我們業務發展具有商業重要意義的任何其他相關發明和改進。我們還依賴商業祕密、專業知識和持續的技術創新來發展和維護我們的專有和知識產權地位。我們的商業成功部分取決於我們是否有能力獲取、維護、執行和保護我們認為對我們業務重要的技術、發明和改進的知識產權和其他所有權,以及捍衞我們可能擁有或將來獲得許可的任何專利,防止他人侵犯我們可能擁有或將來獲得許可的任何專利,保護我們的商業祕密的機密性,並不侵犯、盜用或以其他方式侵犯第三方有效和可執行的專利和所有權。
與其他生物技術和製藥公司一樣,我們維持和鞏固我們在候選產品和技術方面的專利和知識產權地位的能力將取決於我們能否成功獲得有效的專利申請,並在獲得專利申請的情況下執行這些申請。然而,我們正在申請的專利申請,以及我們將來可能提交的任何專利申請或從第三方獲得的許可,可能不會導致專利的頒發,我們可能獲得的任何頒發專利並不保證我們在產品商業化方面實踐我們的技術的權利。我們也無法預測將來我們可能擁有或許可的任何專利中可能允許或強制執行的權利要求的廣度。我們擁有的、或將來可能擁有的或在許可中的任何已發佈的專利都可能受到挑戰、無效、規避或其權利要求的範圍縮小。例如,我們無法確定待審第三方專利申請所涵蓋的發明的優先權。如果第三方在美國準備並提交專利申請,同時也聲稱我們擁有權利的技術或療法,我們可能不得不參與USPTO的干涉程序,以確定發明的優先權,這可能會導致我們付出巨大的成本,即使最終結果對我們有利,這是高度不可預測的。此外,由於我們可能開發的候選產品的臨牀開發和監管審查需要很長時間,因此,在我們的任何候選產品商業化之前,任何相關專利可能會在商業化後的短時間內到期或有效,從而限制了該專利為相應產品提供的保護以及該專利可能提供的任何競爭優勢。
專利權的期限取決於專利申請的提交日期、專利權的發佈日期和專利權在獲得國家的法律期限。在包括美國在內的大多數國家,專利有效期為自非臨時專利申請的最早提交日起20年。在美國,專利期限可能會因專利期限調整而延長,以補償專利權人在審查和授予專利時的行政延誤,或者如果專利被終止放棄,則可能會縮短專利期限。當FDA批准時,要求新藥品的專利期限也可能有資格獲得有限的專利期限延長,前提是滿足法定和監管要求。專利的恢復期通常是涉及人類的臨牀研究開始生效日期和申請提交日期之間的時間的一半,加上申請提交日期和最終批准日期之間的時間。恢復期不得超過5年,包括恢復期在內的總專利期限不得超過FDA批准後的14年。只有一項專利適用於已批准的產品才有資格獲得延期,並且只有那些涵蓋已批准產品、其使用方法或其製造方法的權利要求才可以延期。專利申請應當在專利期滿前提交。一項專利涵蓋多個產品,並尋求批准,只能與其中一個批准有關。美國專利商標局與FDA協商,審查和批准任何專利期限延長或恢復的申請。未來,如果我們的候選產品獲得FDA的批准,我們預計將根據每個產品的臨牀研究時間和其他因素,對涵蓋這些產品的任何已發佈專利申請專利期限延長。我們不能保證我們的未決專利申請將發佈,也不能保證我們將受益於任何專利期限的延長或對我們將來可能擁有或正在授權的任何專利條款的有利調整。此外,專利所提供的實際保護因國家而異,取決於許多因素,包括專利的類型、覆蓋範圍、與監管相關的擴展的可用性、在特定國家是否有法律補救措施以及專利的有效性和可轉讓性。專利期限可能不足以在足夠的時間內保護我們產品的競爭地位。
截至2024年2月23日,我們擁有14項美國臨時專利申請,7項未決美國專利申請,1項已發佈美國專利。我們還擁有6項專利合作條約(PCT)專利申請和45項外國專利申請。根據這些專利申請發佈的任何美國或外國專利將計劃在2039年至2044年到期,不包括任何額外的專利期限調整或專利期限延長期限,並假設轉換是根據美國臨時專利申請及時進行的,國家階段項目是根據未決PCT申請及時進行的,以及支付所有適用的贍養費或年金費。以下是涵蓋BDTX—1535、BDTX—4933、我們的FGFR項目和我們的MAP藥物發現引擎的專利申請概述。
BDTX-1535
截至2024年2月23日,我們擁有8項美國專利申請,1項PCT專利申請,以及29項外國專利申請,涵蓋我們的非小細胞肺癌和膠質母細胞瘤項目,包括BDTX—1535的物質組成,BDTX—1535的代謝物,BDTX—1535的製劑,BDTX—1535的多晶型物,以及使用和製備BDTX—1535的方法。根據這些待審申請發佈的任何美國或外國專利將在2040年至2044年之間到期,前提是國家階段的進入是根據待審PCT申請及時完成的,不包括任何專利期限調整或專利期限延長的額外期限。
BDTX—4933
截至2024年2月23日,我們擁有兩項美國臨時專利申請,兩項PCT專利申請和七項外國專利申請,涵蓋我們的BRAF項目,包括BDTX—4933的物質組成以及BDTX—4933的使用和製造方法。根據這些待審申請發佈的任何美國或外國專利將在2042年至2043年之間到期,假設轉換是根據美國臨時專利申請及時進行的,國家階段進入是根據待審PCT申請及時進行的,不包括任何專利期限調整或專利期限延長的額外期限。
FGFR計劃
截至2024年2月23日,我們擁有一項未決的美國專利申請,一項美國臨時專利申請和九項外國專利申請,涵蓋了我們的FGFR計劃,該計劃涉及該計劃的化合物的物質組成,其類似物,這些化合物的多晶型物,以及使用和製備這些化合物的方法。根據本申請發佈的任何美國或外國專利將在2042年至2044年之間到期,假設轉換是根據美國臨時專利申請及時進行的,國家階段進入是根據未決PCT申請及時進行的,不包括任何專利期限調整或專利期限延長的額外期限。
MAP藥物發現引擎
截至2024年2月23日,我們擁有一項美國專利申請,涵蓋了我們的MAP藥物發現引擎及其在開發和應用療法中的用途。根據該美國專利申請發佈的任何美國專利將於2040年到期,不包括任何專利期限調整或專利期限延長的額外期限。
起訴是一個漫長的過程,在此期間,最初提交給USPTO審查的索賠範圍往往在他們發佈時顯着縮小,如果他們發佈在所有。我們的任何未決PCT專利申請都沒有資格成為已頒發專利,除非我們在30個月內向我們尋求專利保護的國家提交國家階段專利申請。如果我們沒有及時提交任何國家階段專利申請,我們可能會失去我們的PCT專利申請的優先權日以及對此類PCT專利申請中披露的發明的任何專利保護。我們的臨時專利申請可能永遠不會產生已發佈的專利,也沒有資格成為已發佈的專利,除非我們在提交相關臨時專利申請後的12個月內提交非臨時專利申請。如果我們不及時提交非臨時專利申請,我們可能會失去臨時專利申請的優先權日期以及臨時專利申請中披露的發明的任何專利保護。雖然我們打算及時提交與我們的臨時和PCT專利申請有關的非臨時和國家階段專利申請,但我們無法預測我們未來的任何專利申請BDTX—1535,BDTX—4933或我們的任何其他候選產品或技術是否會導致專利的發佈,有效保護BDTX—1535。BDTX—4933或我們的其他候選產品或技術。如果我們未能成功獲得專利保護,或者即使我們獲得了專利保護,如果我們或我們的潛在許可人獲得的關於BDTX—1535、BDTX—4933或我們的其他候選產品或技術的專利保護範圍不夠廣泛,我們將無法阻止他人使用我們的技術或開發或商業化與我們相似或相同的技術和產品,其他競爭產品和技術。有關知識產權相關風險的更多信息,請參閲“風險因素—與知識產權相關的風險”。
除了專利申請外,我們還依賴非專利的商業祕密、專業知識和持續的技術創新來發展和保持我們的競爭地位。然而,商業祕密和機密技術難以保護。特別是,我們預計,關於我們的複合圖書館的建設,我們的商業祕密和專門知識將隨着時間的推移通過獨立開發和描述方法的公開演示在行業內傳播。我們尋求保護我們的專有信息,部分方式是與我們的合作者和科學顧問簽訂保密協議,以及與我們的員工和顧問簽訂非競爭、非徵集、保密和發明轉讓協議。我們還與選定的顧問、科學顧問和合作者簽訂了要求轉讓發明的協議。我們訂立的保密協議旨在保護我們的專有信息,而要求將發明轉讓給我們的協議或條款旨在授予我們通過與相關對手方的關係開發的技術的所有權。我們不能保證我們將與所有適用的員工和承包商簽署該等協議,或者這些協議將為我們的知識產權和專有信息權提供足夠的保護。此外,我們的商業祕密和/或機密技術可能會被第三方所知或獨立開發,或被我們披露此類信息的任何合作者濫用。這些協議也可能被違反,我們可能沒有足夠的補救措施來應對任何此類違反。儘管採取了任何措施來保護我們的知識產權,未經授權的方可能會試圖複製我們的產品的某些方面,或獲取或使用我們視為專有的信息。雖然我們採取措施保護我們的專有信息,但第三方可能會獨立開發相同或類似的專有信息,或以其他方式訪問我們的專有信息。因此,我們可能無法有效地保護我們的商業祕密和專有信息。有關知識產權相關風險的更多信息,請參閲“風險因素—與知識產權相關的風險”。
政府監管
FDA和聯邦、州和地方各級的其他監管機構以及包括歐盟在內的外國監管機構廣泛監管研究、開發、檢測、生產、質量控制、進口、出口、安全性、有效性、標籤、包裝、儲存、分銷、記錄保存、批准、廣告、促銷、營銷、藥物的批准後監測和批准後報告。我們與我們的供應商、合同研究組織和合同製造商一起,將被要求滿足我們希望開展研究或尋求候選產品批准的國家的監管機構的各種臨牀前、臨牀、生產和商業批准要求。獲得藥物監管批准並確保隨後遵守適當的聯邦、州、地方和外國法規和法規的過程需要花費大量的時間和財政資源。
在美國,我們最初專注於藥物開發,FDA根據美國聯邦食品、藥品和化粧品法案(FD & C Act)及其實施條例和其他法律對藥品進行監管。我們的候選產品處於早期階段,我們的候選產品都沒有獲得FDA批准在美國上市。如果我們在任何時候未能遵守與產品開發、臨牀測試、批准或與產品製造、加工、處理、儲存、質量控制、安全、營銷、廣告、促銷、包裝、標籤、出口、進口、分銷或銷售有關的任何其他法律要求,我們可能會受到行政或司法制裁或其他法律後果。這些制裁或後果可能包括,除其他外,FDA拒絕批准待決申請,對正在進行的研究發佈臨牀擱置,暫停或撤銷已批准的申請,警告或無標題信件,產品撤回或召回,產品扣押,重新標籤或重新包裝,全部或部分暫停生產或分銷,禁令,罰款,FDA和美國司法部或其他政府實體提起的民事處罰或刑事起訴。
在我們的候選產品被批准為治療適應症藥物並可能在美國上市之前,FDA要求的流程通常包括以下內容:
•按照適用法規完成廣泛的臨牀前研究,包括按照GLP要求進行的研究;
•向FDA提交IND申請,該申請必須在臨牀試驗開始前生效;
•在每個臨牀試驗開始之前,由機構審查委員會或IRB或每個臨牀試驗地點的獨立倫理委員會批准;
•根據適用的IND法規、良好的臨牀實踐或GCP要求以及其他與臨牀試驗相關的法規進行充分和良好控制的臨牀試驗,以確定研究產品對每個建議適應症的安全性和有效性;
•向FDA提交新藥申請或NDA;
•FDA在收到保密協議後60天內決定接受申請複審;
•令人滿意地完成FDA對將生產藥物的一個或多個製造設施的一次或多次批准前檢查,以評估符合當前良好製造實踐或cGMP要求的情況,以確保設施、方法和控制足以保持藥物的特性、強度、質量和純度;
•FDA可能對產生支持NDA的數據的臨牀試驗地點進行審計;
•支付FDA審查NDA的使用費;以及
•在藥物在美國進行任何商業營銷或銷售之前,FDA對NDA的審查和批准,包括考慮任何FDA顧問委員會的意見。
測試及批准過程需要大量時間、精力及財政資源,我們無法確定是否會及時批准候選產品。
藥物的臨牀前和臨牀試驗
在人體上測試任何藥物之前,候選產品必須經過嚴格的臨牀前測試。臨牀前研究包括藥物化學、製劑和穩定性的實驗室評估,以及體外培養和動物研究,以評估安全性,並在某些情況下建立治療使用的理由。臨牀前研究的進行要遵守聯邦和州的法規和要求,包括GLP對安全/毒理學研究的要求。臨牀前研究的結果以及生產信息和分析數據必須作為IND的一部分提交給FDA。IND是FDA授權給人類使用研究產品的請求,必須在臨牀試驗開始之前生效。在IND提交後,一些長期的臨牀前試驗可能會繼續進行。IND在FDA收到後30天自動生效,除非FDA在30天內對臨牀試驗的進行提出擔憂或問題,包括擔心人類研究對象將面臨不合理的健康風險,並強制臨牀擱置。在這種情況下,IND贊助商和FDA必須在臨牀試驗開始之前解決任何懸而未決的問題。提交IND可能導致FDA不允許臨牀試驗開始或不允許臨牀試驗按照IND中最初指定的條款開始。在候選產品的產品開發期間進行的每個後續臨牀試驗也必須單獨提交給現有的IND,並且FDA必須在每個臨牀試驗開始之前以不反對的方式明確或隱含地給予許可。
臨牀開發階段涉及到在合格研究人員的監督下,根據GCP要求給健康志願者或患者服用候選產品,這些調查人員通常是不受試驗贊助商僱用或控制的醫生,其中包括要求所有研究對象對他們參與任何臨牀試驗提供知情同意。臨牀試驗是在詳細説明臨牀試驗的目標、劑量程序、受試者選擇和排除標準以及用於監測安全性和評估有效性的參數和標準的方案下進行的。作為IND的一部分,每項議定書以及隨後對議定書的任何修改都必須提交給FDA。此外,每項臨牀試驗必須由進行臨牀試驗的每間機構的內部評審委員會審核和批准,以確保參與臨牀試驗的個人所面對的風險減至最低,並與預期的效益合理相關。IRB還批准必須提供給每個臨牀試驗受試者或其法律代表的知情同意書,並必須監督臨牀試驗直到完成。FDA、IRB或贊助商可以隨時以各種理由暫停或中止臨牀試驗,包括髮現受試者暴露在不可接受的健康風險中。還有關於向公共註冊機構報告正在進行的臨牀試驗和已完成的臨牀試驗的要求。有關臨牀試驗的信息,包括臨牀試驗結果,必須在特定的時間框架內提交,以便在www.Clinicaltrials.gov網站上發佈。
雖然我們計劃在未來根據我們從FDA獲得的IND進行任何國際臨牀試驗,但希望在美國以外進行臨牀試驗的贊助商可以但不需要獲得FDA的授權,以IND進行臨牀試驗。如果國外的臨牀試驗不是在IND下進行的,贊助商必須向FDA提交臨牀試驗的數據,以支持NDA。如果研究是根據GCP要求進行的,FDA將接受不是在IND下進行的設計良好和進行良好的外國臨牀研究,如果認為有必要,FDA能夠通過現場檢查來驗證數據。
評估治療適應症以支持NDA上市批准的臨牀試驗通常分三個連續階段進行,可能會重疊。
•階段1-第一階段臨牀試驗包括將研究產品初步引入健康的人類志願者或患有目標疾病或疾病的患者。這些研究通常旨在測試研究產品在人體內的安全性、劑量耐受性、吸收、新陳代謝和分佈,排泄與增加劑量相關的副作用,並在可能的情況下獲得有效性的早期證據。
•第二階段—II期臨牀試驗通常涉及將試驗用藥物給予特定疾病或病症的有限患者人羣,以評估初步療效、最佳劑量和給藥方案,並確定可能的不良副作用和安全風險。
•第三階段—III期臨牀試驗通常涉及將試驗用藥物用於擴大的患者人羣,以進一步評估劑量,提供臨牀療效的統計學顯著證據,並進一步測試安全性,通常在多個地理位置分散的臨牀試驗中心進行。這些臨牀試驗旨在確定試驗用藥物的總體風險/受益比,併為產品批准和醫生標籤提供充分的依據。
2022年3月,FDA發佈了題為“擴展隊列:用於首次人體臨牀試驗以加速腫瘤藥物和生物製品的開發”的最終指南,概述了藥物開發人員如何在腫瘤藥物開發的早期階段利用適應性試驗設計,通常稱為無縫試驗設計(即,第一次人體臨牀試驗)將傳統的三個階段的試驗壓縮成一個連續的試驗,稱為擴展隊列試驗。支持個體擴展隊列設計的信息包含在IND申請中,並由FDA評估。擴展隊列試驗可能會提高藥物開發效率,減少開發成本和時間。
批准後試驗,有時稱為4期臨牀試驗,可能在首次上市批准後進行。這些試驗用於從預期治療適應症患者的治療中獲得額外經驗,通常用於生成關於臨牀環境中使用產品的額外安全性數據。在某些情況下,FDA可能會要求進行4期臨牀試驗,作為批准NDA的條件。
詳細説明臨牀試驗結果的進展報告以及其他信息,必須至少每年向FDA提交,並且必須在試驗申辦者確定信息符合報告嚴重和非預期疑似不良事件、其他研究或動物的發現後15天向FDA和研究者提交書面IND安全性報告。 體外培養提示人類志願者存在重大風險的檢測,以及嚴重疑似不良反應發生率高於方案或研究者手冊中列出的任何臨牀重要增加。申辦者還必須儘快通知FDA任何非預期致死性或危及生命的可疑不良反應,但無論如何不得遲於申辦者首次收到信息後的七個日曆日。
在臨牀試驗的同時,公司通常完成額外的動物研究,還必須開發關於候選產品的化學和物理特性的額外信息,並根據cGMP要求確定商業化生產製劑的工藝。生產工藝必須能夠始終如一地生產候選產品的質量批次,生產商必須開發(除其他外)用於檢測最終制劑的鑑別、規格、質量和純度的方法。此外,必須選擇和測試適當的包裝,並進行穩定性研究,以證明候選產品在有效期內不會發生不可接受的變質。
美國藥品上市批准
假設成功完成所需的臨牀試驗,臨牀前研究和臨牀試驗的結果,連同與產品的化學、生產、控制和擬議標籤等相關的詳細信息,將作為NDA的一部分提交給FDA,要求批准產品用於一個或多個適應症的上市。NDA是一個申請批准上市的新藥用於一個或多個指定的適應症,必須包含藥物的安全性和有效性的證據。上市申請可能包括臨牀前研究和臨牀試驗的陰性和模糊結果,以及陽性結果。數據可能來自公司申辦的旨在測試產品使用的安全性和有效性的臨牀試驗,或來自許多替代來源,包括研究者發起的研究。為支持上市批准,提交的數據必須在質量和數量上足夠,以確定試驗用藥物的安全性和有效性,並達到FDA滿意的要求。藥品必須在美國上市前獲得FDA批准。
FDA在接受提交的所有NDA提交之前會對其進行審查,並可能要求提供更多信息,而不是接受NDA提交。FDA必須在收到NDA後60天內做出接受提交的決定,該決定可能包括FDA拒絕提交。一旦提交被接受備案,FDA將開始對NDA進行深入的實質性審查。FDA審查NDA,以確定,除其他事項外,藥物是否安全和有效,生產,加工,包裝或保存的設施是否符合旨在確保產品持續安全,質量和純度的標準。根據FDA根據《處方藥用户費用法案》(PDUFA)達成的目標和政策,FDA的目標是從申請之日起10個月內完成對新分子實體NDA的初步審查並回復申請人,以及從申請之日起6個月內進行優先審查。FDA並不總是達到其標準或優先NDA的PDUFA目標日期,並且FDA要求提供更多信息或澄清,因此審查過程通常會延長。
此外,根據經修訂的PDUFA,每項保密協議必須附有用户費。FDA每年調整PDUFA用户費用。在某些情況下,費用減免或減免是可用的,包括對小企業首次提交申請的申請費減免。此外,對於指定為孤兒藥的產品,不對NDA進行用户費用評估,除非該產品還包括非孤兒適應症。
FDA還可能要求提交風險評估和緩解策略(REMS)計劃,以確保藥物的益處超過其風險。REMS計劃可包括藥物指南、醫生溝通計劃、評估計劃和/或確保安全使用的要素,如限制分配方法、患者登記或其他風險最小化工具。
FDA可能會將新藥的申請提交給諮詢委員會。諮詢委員會是一個由獨立專家組成的小組,包括臨牀醫生和其他科學專家,負責審查、評估申請是否應獲得批准以及在何種條件下獲得批准並提供建議。FDA不受諮詢委員會建議的約束,但在作出決定時會仔細考慮這些建議。
在批准NDA之前,FDA通常會檢查生產產品的設施。FDA將不會批准申請,除非其確定生產工藝和設施符合cGMP要求,並足以確保申辦者產品在要求的質量標準範圍內一致生產。此外,在批准NDA之前,FDA可能會檢查一個或多個臨牀試驗中心,以確保符合GCP和其他要求以及提交給FDA的臨牀數據的完整性。
在評估NDA和所有相關信息(包括諮詢委員會的建議(如有)以及關於生產設施和臨牀試驗中心的檢查報告)後,FDA可能會發出批准函,或在某些情況下,發出完整的回覆函。一封完整的回覆函通常包含必須滿足的特定條件的聲明,以確保NDA的最終批准,並可能需要額外的臨牀或臨牀前測試,以便FDA重新考慮申請。即使提交了這些附加信息,FDA最終也可能決定申請不符合批准的監管標準。如果這些條件得到FDA滿意的滿足,FDA通常會發出批准函。批准函授權藥物的商業銷售,並附有特定適應症的特定處方信息。
即使FDA批准了一種產品,但取決於要解決的特定風險,它可能會限制產品的批准適應症,要求產品標籤中包含禁忌症、警告或注意事項,要求進行批准後研究,包括4期臨牀試驗,以進一步評估批准後藥物的安全性,要求進行測試和監督計劃,以在商業化後監測產品,或施加其他條件,包括分銷和使用限制或REMS下的其他風險管理機制,這可能會嚴重影響產品的潛在市場和盈利能力。FDA可以根據上市後研究或監督計劃的結果,阻止或限制產品的進一步上市。批准後,對已批准產品的某些類型的變更,如添加新的適應症、生產變更和附加標籤聲明,將受到進一步的測試要求和FDA審查和批准。
孤兒藥指定和排他性
根據《孤兒藥法案》,FDA可以授予用於治療罕見疾病或病症的藥物孤兒稱號,該疾病或病症在美國影響不到20萬人的疾病或病症,或者如果它在美國影響超過20萬人,沒有合理的期望,開發和製造該產品在美國用於該疾病或病症的成本將從該產品的銷售中收回。必須在提交保密協議之前申請孤兒身份。孤兒指定並不意味着監管審查和批准過程的任何好處或縮短其持續時間,儘管開發孤兒產品的公司有資格獲得某些獎勵,包括合格臨牀試驗的税收抵免和豁免申請費。
如果具有孤兒稱號的產品隨後獲得FDA首次批准,用於其具有此類稱號的疾病或病症,則該產品有權享有七年的上市獨佔期,在此期間,FDA不得批准針對相同適應症銷售相同治療劑的任何其他申請,除非在有限的情況下,如後續產品表現出優於孤兒產品的臨牀優越性,或原申請人無法生產足夠數量的產品。然而,競爭對手可能獲得針對孤兒產品具有排他性的適應症的不同治療劑的批准,或獲得針對與孤兒產品具有排他性的適應症的相同治療劑的批准。如果競爭對手在我們之前獲得相同適應症的相同治療劑的批准,孤兒產品的排他性可能會阻止我們的一個產品的批准七年,除非我們能夠證明我們的產品在臨牀上具有優越性。如果孤兒指定產品獲得上市批准,其適應症範圍比指定範圍更廣,則可能無權獲得孤兒專用權。此外,如果FDA後來確定指定請求存在重大缺陷,或獲批產品的製造商無法確保足夠數量的產品來滿足罕見疾病或病症患者的需求,則孤兒藥在美國的獨家營銷權可能會喪失。
罕見兒科疾病指定和優先審查憑證
根據FD & C法案,FDA鼓勵開發符合“罕見兒科疾病”定義的藥物,定義為嚴重或危及生命的疾病,其中嚴重的危及生命的表現主要影響從出生到18歲的個體,該疾病影響的人少於20萬,或影響超過200人。在美國,沒有合理預期在美國開發和製造治療此類疾病或病症的藥物的成本將來自美國銷售此類藥物。罕見兒科疾病候選產品的申辦者可能有資格獲得一張代金券,該代金券可用於在罕見兒科疾病藥品批准之日之後獲得後續人用藥品申請的優先審評,稱為優先審評代金券或PRV。申辦者可在提交NDA之前向FDA申請罕見兒科疾病認定。罕見兒科疾病指定並不保證申辦者在其NDA批准後將收到PRV。此外,選擇不提交罕見兒科疾病認定申請的申辦者在其原始上市申請中要求此類憑證並符合所有資格標準,則仍可在其上市申請批准時獲得PRV。如果收到一個PRV,它可以被出售或轉讓無限次。國會已將PRV計劃延長至2024年9月30日,有可能批准PRV至2026年9月30日。
藥物的快速開發和審查計劃
FDA維持了幾個旨在促進和加快新藥開發和審查的項目,以解決在治療嚴重或危及生命的疾病或病症方面未滿足的醫療需求。這些項目包括快速通道指定、突破療法指定、優先審查和加速批准,這些項目的目的是加快重要新藥的開發或審查,以便在FDA標準開發和審查程序之前將其交付給患者。
如果一種新藥旨在治療嚴重或危及生命的疾病或狀況,並顯示出解決此類疾病或狀況的未得到滿足的醫療需求的潛力,則有資格獲得快速通道指定。快速通道指定增加了贊助商在臨牀前和臨牀開發期間與FDA互動的機會,此外,一旦提交營銷申請,FDA還有可能進行滾動審查,這意味着該機構可以在贊助商提交完整申請之前審查部分營銷申請,以及下文討論的優先審查。此外,如果一種新藥旨在治療一種嚴重或危及生命的疾病或狀況,並且初步臨牀證據表明,該藥物可能在一個或多個臨牀重要終點表現出比現有療法顯著的改善,例如在臨牀開發早期觀察到的重大治療效果,則該新藥可能有資格獲得突破性治療指定。突破性治療指定提供了快速通道指定的所有功能,此外,早在第一階段就開始了對高效藥物開發計劃的密集指導,以及FDA對加快開發的組織承諾,包括在適當的情況下讓高級管理人員和經驗豐富的審查人員參與跨學科審查。
任何提交FDA審批的產品,包括具有快速通道或突破療法稱號的產品,也可能有資格獲得FDA旨在加快審查和批准過程的額外計劃,包括優先審查指定和加速批准。如果產品有可能在治療、診斷或預防嚴重疾病或狀況方面提供顯著的安全性或有效性,則有資格接受優先審查。根據優先審查,FDA必須在6個月內審查申請,而標準審查為10個月。此外,如果產品能夠被證明對替代終點具有合理地可能預測臨牀益處的影響,或者對臨牀終點的影響可以比對不可逆發病率或死亡率的影響更早地被測量,並且考慮到病情的嚴重性、稀有性或流行率以及可用或缺乏替代治療,則有資格獲得加速批准。
加速批准通常取決於贊助商同意進行額外的批准後研究,以驗證和描述該產品的臨牀益處。根據《2022年食品和藥物綜合改革法案》(FDORA),FDA可酌情要求此類試驗在批准之前或在獲得加速批准的產品獲得批准之日後的特定時間段內進行。根據FDORA,FDA增加了加快程序的權力,例如,如果驗證性試驗未能驗證產品的預期臨牀益處,則可以撤回在加速批准下批准的藥物或適應症的批准。此外,對於正在考慮加速批准的產品,FDA通常要求,除非FDA另有通知,否則所有打算在上市批准後120天內傳播或發佈的廣告和促銷材料都應在批准前審查期間提交給該機構進行審查。此外,在批准上市後120天后,所有廣告和促銷材料必須至少在最初傳播或出版的預定時間前30天提交。
即使一種產品符合一個或多個這些計劃的條件,FDA也可能在以後決定該產品不再符合資格條件,或者FDA審查或批准的時間段可能不會縮短。此外,快速通道指定、突破性治療指定、優先審查和加速批准不會改變批准的科學或醫學標準,也不會改變支持批准所需的證據質量,但可能會加快開發或審查過程。
兒科信息與兒科排他性
根據《兒科研究公平法案》(PREA),某些NDA和NDA的某些補充必須包含數據,以評估藥物在所有相關兒科亞羣中聲明適應症的安全性和有效性,並支持該產品安全有效的每個兒科亞羣的劑量和給藥。FDA可以批准推遲提交兒科數據或全部或部分豁免。美國食品藥品監督管理局(FDA)安全與創新法案(FDASIA)修訂了FD & C法案,要求計劃提交包含新活性成分、新適應症、新劑型、新給藥方案或新給藥途徑的藥物上市申請的申辦者在II期會議結束後60天內提交初始兒科研究計劃(PSP),或如果沒有此類會議,則應在III期或II/III期研究開始前儘早進行。初始PSP必須包括申辦方計劃進行的兒科研究的概要,包括研究目的和設計、年齡組、相關終點和統計方法,或不包括此類詳細信息的理由,以及任何推遲兒科評估的請求,或全部或部分放棄提供兒科研究數據和支持性信息的要求。FDA和申辦者必須就PSP達成協議。如果需要根據從臨牀前研究、早期臨牀試驗和/或其他臨牀開發項目收集的數據考慮兒科計劃的變更,申辦者可以隨時提交對商定的初始PSP的修正案。
一種藥物也可以在美國獲得兒科市場獨家經營權。如果獲得兒科專利,將在現有專利期和專利期基礎上增加六個月。6個月的排他性,從其他排他性保護或專利期結束時開始,可以根據FDA發佈的針對此類研究的“書面請求”,在兒科研究的自願完成的基礎上授予此類研究,前提是在授予兒科排他性時有不少於9個月的剩餘期限。
美國藥品批准後要求
根據FDA批准生產或分銷的藥物受FDA普遍和持續的監管,其中包括與記錄保存、定期報告、產品抽樣和分銷、產品不良反應報告、遵守促銷和廣告要求有關的要求,其中包括限制將產品用於未經批准的用途或患者人羣(稱為"標籤外使用"),以及限制行業贊助的科學和教育活動。雖然醫生可以處方合法可用的產品用於標籤外用途,但製造商不得銷售或推廣此類用途。FDA和其他機構積極執行禁止推廣標籤外使用的法律法規,一家被發現不當推廣標籤外使用的公司可能會承擔重大責任,包括聯邦和州當局的調查。處方藥宣傳材料必須在首次使用或首次出版時一併提交給FDA。此外,如果對藥物進行任何修改,包括適應症、標籤或生產工藝或設施的變更,申請人可能需要提交併獲得FDA對新的NDA或NDA補充的批准,這可能需要開發額外的數據或臨牀前研究和臨牀試驗。
FDA可能會施加一些批准後的要求,作為批准NDA的條件。例如,FDA可能要求進行上市後測試,包括第四階段臨牀試驗和監測,以進一步評估和監測產品在商業化後的安全性和有效性。
此外,參與生產和分銷批准藥品的藥品製造商及其分包商必須向FDA和某些州機構註冊其機構,並接受FDA和某些州機構的定期突擊檢查,以確保其遵守正在進行的監管要求,包括cGMP,這些要求對我們和我們的合同製造商施加了某些程序和文件要求。處方藥產品的製造商和其他參與藥品供應鏈的各方還必須遵守產品跟蹤和追蹤要求,並向FDA通報假冒、轉移、盜竊和故意摻假的產品或本來不適合在美國分銷的產品。不遵守法律和法規要求的製造商可能面臨法律或法規行動,例如警告信、暫停生產、產品扣押、禁令、民事處罰或刑事起訴。此外,還有持續的、每年一次的處方藥產品計劃使用費。
後來發現產品存在以前未知的問題,包括預料不到的嚴重程度或頻率的不良事件,或生產工藝,或未能遵守監管要求,可能導致修訂批准的標籤,以添加新的安全信息,要求上市後研究或臨牀試驗,以評估新的安全風險,或根據REMS實施分銷或其他限制。除其他外,其他潛在後果包括:
•限制產品的銷售或製造,完全從市場上撤回產品或召回產品;
•安全警報、親愛的醫療保健提供者信函、新聞稿或包含有關產品的警告或其他安全信息的其他通信;
•對批准後的臨牀試驗處以罰款、警告信或暫停;
•FDA拒絕批准已批准的申請或對已批准的申請進行補充,或暫停或撤銷產品批准;
•扣押、扣押產品,或者拒不允許產品進出口的;
•禁止令或施加民事或刑事處罰;以及
•同意法令、公司誠信協議、禁止參加聯邦醫療保健計劃或將其排除在聯邦醫療保健計劃之外;或強制修改宣傳材料、標籤和發佈更正信息。
對伴隨診斷的監管
我們認為,我們某些候選產品的成功可能在一定程度上取決於配套診斷軟件的開發和商業化。伴隨診斷確定最有可能從特定治療產品中受益的患者;確定可能因使用特定治療產品治療而增加嚴重副作用風險的患者;或監測特定治療產品治療的反應,目的是調整治療以實現更高的安全性或有效性。伴隨診斷被FDA作為醫療設備進行監管。在美國,《食品和藥物管理局法案》及其實施條例以及其他聯邦和州法律法規對醫療器械設計和開發、臨牀前和臨牀試驗、上市前批准或批准、註冊和上市、製造、標籤、儲存、廣告和促銷、銷售和分銷、出口和進口以及上市後監督等方面進行管理。除非獲得豁免或FDA行使執法自由裁量權,否則診斷測試通常需要在商業化之前獲得市場許可或FDA的批准。適用於醫療器械的FDA營銷授權的主要類型是批准上市前通知或510(K)、提交、批准上市前批准或PMA、申請或批准從頭分類請求。
要獲得醫療設備的510(K)許可,或對已獲得510(K)許可的設備進行某些修改,製造商必須提交上市前通知,證明建議的設備基本上等同於先前批准的510(K)設備,或1976年5月28日之前已在商業銷售中的修訂前設備,或FDA尚未要求提交PMA的謂詞設備。在確定該裝置基本上等同於謂詞裝置時,FDA將建議的裝置與一個或多個述語裝置進行比較,並評估主語裝置在預期用途、技術、設計和其他可能影響安全性和有效性的特徵方面是否與述語裝置或述語裝置相媲美。如果FDA確定主體設備實質上等同於一個或多個謂詞設備,則主體設備可被批准上市。510(K)上市前通知途徑通常需要自申請完成之日起3至12個月,但可能需要更長的時間。
PMA申請必須得到有效的科學證據的支持,這通常需要大量的數據,包括技術、臨牀前、臨牀和生產數據,以證明FDA滿意的器械的安全性和有效性。對於診斷測試,PMA申請通常包括有關分析和臨牀驗證研究的數據。作為PMA審查的一部分,FDA將對生產設施進行批准前檢查,以確保符合質量體系法規(QSR),該法規要求製造商遵循設計、測試、控制、文件和其他質量保證程序。FDA對初始PMA申請的審查根據法規需要6至10個月,儘管該過程通常需要更長的時間,並且可能需要數年時間才能完成。如果FDA對PMA申請和生產設施的評估均為有利,FDA將發佈批准函或可批准函,其中通常包含一些必須滿足的條件,以確保PMA最終獲得批准。如果FDA對PMA或生產設施的評估不有利,FDA將拒絕PMA的批准或發出不予批准的信函。不可批准的信函將概述申請中的缺陷,並在可行的情況下確定使PMA獲得批准的必要條件。一旦獲得批准,如果不符合批准後要求、批准條件或其他監管標準,或在首次上市後發現問題,FDA可能會撤銷PMA批准。
2014年7月31日,FDA發佈了一份最終指導文件,闡述了“體外伴隨診斷器械”的開發和批准過程。根據指南文件,對於依賴於診斷測試的使用的新型治療產品,並且診斷器械對於相應治療產品的安全有效使用是必不可少的,應開發伴隨診斷器械的上市前申請,並與治療同時獲得批准或批准,儘管FDA認識到,在某些情況下,可能無法同時開發。然而,在沒有伴隨診斷的情況下,藥物不能安全或有效地使用的情況下,FDA的指南表明,如果沒有診斷設備的批准或許可,通常不會批准藥物。FDA還於2016年7月發佈了一份指南草案,闡述了體外伴隨診斷器械與治療產品共同開發的原則。指南草案描述了指導治療產品及其相應體外伴隨診斷產品的開發和同期上市許可的原則。
到目前為止,FDA已經要求幾乎所有癌症治療的伴隨診斷都獲得上市前批准。2024年1月,FDA宣佈打算啟動大多數體外診斷(包括伴隨診斷)的重新分類程序。此外,FDA表示,除了重新分類程序外,FDA將繼續在個體體外診斷的初始分類中採取基於風險的方法,以確定新的檢測是否可以通過重新分類程序被分類為II類。在此過程中,FDA表示,它可能會將未來的大多數伴隨診斷作為II類器械進行監管。
一旦獲得批准或批准,伴隨診斷器械必須遵守上市後要求,包括FDA質量體系法規、不良事件報告、召回和糾正以及產品營銷要求和限制的要求。與藥品製造商一樣,伴隨診斷產品製造商在任何時候都要接受未經宣佈的FDA檢查,在此期間FDA將對產品和公司的設施進行審計,以符合其權威。
其他監管事項
在產品批准(如適用)或商業化後,候選產品的生產、銷售、推廣和其他活動也受美國許多監管機構的監管,除FDA外,這些監管機構可能包括醫療保險和醫療補助服務中心(CMS)、衞生與公眾服務部的其他部門或HHS、司法部,藥品執法管理局、消費品安全委員會、聯邦貿易委員會、職業安全與健康管理局、環境保護局以及州和地方政府和政府機構。
其他醫療保健和隱私法
醫療保健提供者、醫生和第三方支付者將在我們獲得上市批准的任何產品的推薦和處方中發揮主要作用。我們的業務運營以及與第三方付款人、醫療保健提供者和醫生的任何當前或未來安排可能會使我們面臨廣泛適用的欺詐和濫用以及其他醫療保健法律法規,這些法律法規可能會限制我們開發、營銷、銷售和分銷我們獲得上市批准的任何藥物的業務或財務安排和關係。在美國,這些法律包括但不限於州和聯邦反回扣、虛假索賠、醫生透明度以及患者數據隱私和安全法律法規,包括但不限於下述法律法規。
•《聯邦反回扣法》,除其他外,禁止個人和實體故意索取、提供、接受或提供報酬。(包括任何回扣、賄賂或回扣),直接或間接以現金或實物形式,誘使或獎勵轉介某人購買、租賃、訂購、安排或推薦任何貨品、設施、物品或服務,可根據聯邦和州的醫療保健計劃,如醫療保險和醫療補助。一個人或實體不需要實際瞭解聯邦反回扣法(AKS)或違反它的具體意圖,就可以實施違法行為。違規行為將被處以民事和刑事罰款,並對每一項違規行為處以最高三倍的罰款,監禁,並被排除在政府醫療保健計劃之外。此外,政府可以聲稱,包括違反AKS導致的物品或服務的索賠構成聯邦虛假索賠法(FCA)或聯邦民事罰款的目的的虛假或欺詐索賠。
•聯邦民事和刑事虛假索賠法,包括FCA,以及可以通過民事舉報人或qui tam行動執行的民事罰款法,其中對故意向聯邦政府提交或導致提交醫療保險支付或批准的個人或實體施加民事和刑事處罰,醫療補助或其他政府付款人虛假或欺詐,或作出虛假陳述以避免,減少或隱瞞向聯邦政府支付的義務,潛在責任包括強制性三倍損害賠償和重大每次索賠罰款。根據FCA,即使製造商不直接向政府付款人提交索賠,如果他們被認為“導致”提交虛假或欺詐性索賠,也可以追究他們的責任。《FCA》還允許作為“舉報人”的個人代表聯邦政府提起訴訟,指控違反《FCA》,並分享任何資金回收。
•《1996年聯邦健康保險流通和責任法案》(HIPAA),其中禁止,除其他外,故意執行或試圖執行,欺詐任何醫療福利計劃的計劃或手段,或通過虛假或欺詐性的藉口,陳述或承諾,獲得任何醫療福利計劃擁有的,或在其保管或控制下的任何金錢或財產,而不管付款人(例如,公開或私下),以及明知而故意偽造、隱瞞或以任何詭計或手段掩蓋重要事實,或作出任何重大虛假、虛構或欺詐性陳述,以提供或支付醫療福利、與醫療福利有關的項目或服務、與醫療事宜有關的項目或服務。與AKS類似,一個人或實體不需要實際瞭解法規或違反法規的具體意圖即可實施違法行為。
•HIPAA,經2009年《健康信息技術經濟和臨牀健康法案》(HITECH)及其各自的實施條例進一步修訂,包括2013年1月公佈的最終綜合規則,該規則對受該規則約束的實體(如健康計劃、醫療信息交換所和某些醫療保健提供者)施加了某些要求,包括強制性合同條款,以及他們各自的業務夥伴和他們為他們提供服務的分包商,這些服務涉及創建、維護、接收、使用或披露個人可識別健康信息,涉及個人可識別健康信息的隱私、安全和傳輸。HITECH還建立了新的民事罰款等級,修訂了HIPAA,使民事和刑事處罰直接適用於商業夥伴,並賦予州檢察長新的權力,以在聯邦法院提起民事損害賠償訴訟或禁令,以執行聯邦HIPAA法律,並尋求與進行聯邦民事訴訟相關的律師費和費用。此外,在某些情況下,可能會有其他聯邦、州和非美國法律來管理健康和其他個人信息的隱私和安全,其中許多法律在很大程度上彼此不同,可能產生不同的效果,從而使合規工作複雜化。
•《美國醫師支付陽光法案》及其實施條例,要求某些藥品、設備、生物製品和醫療用品製造商(除特定例外)每年向CMS報告與某些支付和其他向醫生、執業護士、註冊護士麻醉師、醫師助理、臨牀專科護士、註冊護士助產士以及教學醫院。製造商還必須披露醫生及其直系親屬持有的所有權和投資權益。自2022年1月1日起,這些報告義務延伸至包括向某些非醫生提供者(醫生助理、護士執業、臨牀護士專家、認證註冊護士麻醉師和麻醉師助理,以及認證護士助產士)的價值轉移。此外,許多州還要求報告付款或其他價值轉移,其中許多付款或其他轉移在很大的方面彼此不同,往往沒有先發制人,可能比陽光法案更具禁止性,從而進一步使合規工作複雜化。
•聯邦政府價格報告法要求我們計算複雜的價格指標,並以準確和及時的方式向政府項目報告。
•聯邦消費者保護法和不正當競爭法,廣泛規範市場活動和可能損害消費者的活動。
此外,我們受上述每一項醫療保健法律和法規的州和外國等同條款的約束,其中一些法律和法規的範圍可能更廣,並可能適用於支付人。美國許多州已經採納了與AKS和FCA類似的法律,並可能適用於我們的商業實踐,包括但不限於研究、分銷、銷售或營銷安排以及涉及非政府支付方(包括私人保險公司)報銷的醫療保健項目或服務的索賠。此外,一些州還通過了法律,要求製藥公司遵守2003年4月《藥品製造商合規計劃指南》和/或《美國藥品研究和製造商與醫療保健專業人員互動守則》。一些州還實施了其他營銷限制,或要求製藥公司向州政府披露營銷或價格,並要求藥品銷售代表註冊。國家和外國法律,包括2018年5月生效的歐盟通用數據保護條例(GDPR),也在某些情況下管理健康信息的隱私和安全,其中許多在重大方面彼此不同,並且通常不會被HIPAA搶先,從而使合規工作複雜化。關於遵守這些州要求的要求存在模糊不清,如果我們未能遵守適用的州法律要求,我們可能會受到處罰。最後,有國家和外國的法律管理健康信息的隱私和安全,其中許多法律在很大的方面彼此不同,往往沒有被HIPAA搶先,從而使合規工作複雜化。
歐盟禁止向醫生提供利益或好處,以誘導或鼓勵處方、推薦、認可、購買、供應、訂購或使用藥品。向醫生提供利益或好處也受歐盟成員國的國家反賄賂法律的管轄,例如2010年英國反賄賂法。違反這些法律可能導致鉅額罰款和監禁。
向某些歐盟成員國的醫生支付的費用必須公開披露。此外,與醫生的協議通常必須事先通知醫生的僱主、其主管專業組織和/或歐盟成員國監管當局並批准。這些要求在歐盟成員國適用的國家法律、行業守則或專業行為守則中有規定。不遵守這些要求可能導致聲譽風險、公開譴責、行政處罰、罰款或監禁。
這些法律的範圍和執行不確定,在當前醫療改革的環境下,特別是在缺乏適用的先例和法規的情況下,這些法律的執行情況很不確定。聯邦和州的執法導致了醫療保健行業的一系列調查,起訴,定罪和和解。確保我們的內部營運及未來與第三方的業務安排符合適用的醫療保健法律及法規將涉及大量成本。政府當局可能會得出結論,認為我們的業務實踐不符合當前或未來的法規、法規、機構指南或涉及適用欺詐和濫用的案例法或其他醫療保健法律法規。如果我們的運營被發現違反了上述任何法律或可能適用於我們的任何其他政府法律和法規,我們可能會受到重大處罰,包括行政、民事和刑事處罰、損害賠償、罰款、沒收、禁止參與聯邦和州醫療保健計劃、名譽損害以及我們的運營縮減或重組。以及額外的報告義務和監督,如果我們成為企業誠信協議或其他協議的約束,以解決不遵守這些法律的指控。此外,防範任何此類行動可能是昂貴和耗時的,可能需要大量的財政和人力資源。因此,即使我們成功抵禦可能針對我們的任何該等訴訟,我們的業務仍可能受到損害。如果我們希望與之開展業務的任何醫生或其他供應商或實體被發現不遵守適用法律,他們可能會受到刑事、民事或行政制裁,包括排除在政府資助的醫療保健項目之外和個人監禁。倘發生上述任何情況,我們的業務經營能力及經營業績可能受到不利影響。
保險範圍和報銷
在美國和其他國家的市場,為他們的病情接受處方治療的患者和提供處方服務的提供者通常依賴第三方支付者償還全部或部分相關醫療費用。因此,即使候選產品獲得批准,該產品的銷售將部分取決於第三方支付者(包括美國聯邦醫療保險和醫療補助等政府醫療計劃、商業醫療保險公司和管理式醫療機構)為該產品提供覆蓋範圍和建立足夠的報銷水平。在美國,關於新藥報銷的主要決定通常由衞生和衞生部下屬機構CMS做出。CMS決定是否以及在多大程度上一種新藥將在醫療保險下得到覆蓋和報銷,私人支付者傾向於在很大程度上遵循CMS。第三方付款人之間沒有統一的藥品保險和報銷政策。因此,藥品的覆蓋範圍和報銷因付款人而異。用於確定第三方付款人是否將為產品提供保險的過程可以與用於設置付款人將在保險被批准後為產品支付的價格或補償率的過程分開。第三方支付者越來越多地質疑收費的價格,審查醫療必要性,審查醫療產品和服務的成本效益,並實施控制來管理成本。第三方付款人可能會將承保範圍限制在批准清單(也稱為處方集)上的特定產品,該清單可能不包括特定適應症的所有批准產品。
為了確保任何可能被批准銷售的產品的覆蓋範圍和報銷,公司可能需要進行昂貴的藥物經濟學研究,以證明該產品的醫療必要性和成本效益,以及獲得FDA或其他類似監管批准所需的費用。此外,公司還可能需要向購買者、私人健康計劃或政府醫療計劃提供折扣。然而,候選產品可能不被認為是醫療必要或成本效益。第三方付款人決定不支付產品,一旦產品獲得批准,可能會減少醫生的使用,並對銷售、我們的運營和財務狀況產生重大不利影響。此外,第三方付款人為產品提供保險的決定並不意味着將批准適當的報銷率。此外,一個付款人決定為產品提供保險並不保證其他付款人也將為該產品提供保險和補償,並且保險和補償的水平可能因付款人而異。
控制醫療成本已成為聯邦、州和外國政府的優先事項,產品價格一直是這一努力的重點。各國政府對實施成本控制計劃表現出了極大的興趣,包括價格控制、限制報銷和要求替代仿製藥。採取價格控制和成本控制措施,以及在具有現有控制和措施的司法管轄區採取更具限制性的政策,可能會進一步限制公司從銷售任何經批准的產品中獲得的收入。承保政策和第三方付款人報銷率可能隨時發生變化。即使一家公司或其協作者獲得監管批准的一個或多個產品獲得了有利的承保和報銷狀態,未來也可能實施不太有利的承保政策和報銷費率。此外,由於持續的新冠肺炎疫情,數以百萬計的個人已經或將失去僱主保險,這可能會對我們的產品商業化能力產生不利影響。
當前和未來的醫療改革立法
在美國和一些外國司法管轄區,關於醫療保健系統的多項立法和監管改革以及擬議的改革,已經並可能繼續存在,旨在擴大醫療保健的可獲得性,提高醫療保健的質量,並控制或降低醫療保健的成本。例如,2010年3月,美國國會頒佈了ACA,其中包括改變政府醫療保健計劃下產品的覆蓋範圍和支付方式。ACA包括對我們的潛在產品候選產品至關重要的條款,這些條款包括:
•對生產或進口指定品牌處方藥和生物製品的任何實體制定不可扣除的年度費用,根據這些實體在某些政府醫療保健計劃中的市場份額在這些實體之間進行分配;
•擴大了醫療補助計劃的資格標準,從而潛在地增加了製造商的醫療補助回扣責任;
•擴大了醫療補助藥品退税計劃下製造商的退税責任,提高了品牌和仿製藥的最低退税,並修改了用於計算和報告門診處方藥價格的醫療補助藥品退税的“平均製造商價格”或AMP的定義;
•擴大了符合340B藥品折扣計劃的實體類型;
•建立了聯邦醫療保險D部分承保缺口折扣計劃,要求製造商在承保間隔期內向符合條件的受益人提供適用品牌藥品談判價格的銷售點折扣,作為製造商的門診藥物在聯邦醫療保險D部分承保的條件;以及
•創建了一個以患者為中心的結果研究所,以監督、確定優先事項,並進行臨牀有效性比較研究,以及為此類研究提供資金。
自ACA頒佈以來,美國還提出並通過了其他立法修改:
•2011年8月,除其他事項外,2011年《預算控制法》包括將向醫療保險提供者支付的醫療保險付款每財年總計減少2%,該法案於2013年4月生效,由於隨後對該法規的立法修訂,除非國會採取進一步行動,否則該法案將一直有效到2030年。
•2013年1月,《2012年美國納税人救濟法》簽署成為法律,其中包括進一步減少了向包括醫院、成像中心和癌症治療中心在內的幾家醫療服務提供者支付的醫療保險,並將政府追回向醫療服務提供者多付款項的訴訟時效從三年延長到五年。
•2017年4月13日,CMS發佈了一項最終規則,賦予各州在個人和小團體市場為保險公司設定基準方面更大的靈活性,這可能會放寬ACA對通過此類市場銷售的保險計劃所要求的基本健康福利。
•2018年5月30日,《審判權法案》簽署成為法律。除其他事項外,該法律還為某些患者提供了一個聯邦框架,允許他們獲得某些已完成第一階段臨牀試驗並正在進行調查以獲得FDA批准的研究用新藥產品。在某些情況下,符合條件的患者可以在不參加臨牀試驗和根據FDA擴大准入計劃獲得FDA許可的情況下尋求治療。根據《試用權法案》,製藥商沒有義務將其藥品提供給符合條件的患者。
•2019年5月23日,CMS發佈了一項最終規則,允許 Advantage計劃從2020年1月1日開始對B部分藥物使用階梯療法。
•2019年12月20日,《進一步綜合撥款法案》簽署成為法律(H.R.1865),廢除了凱迪拉克税、醫療保險提供者税和醫療器械消費税。不可能確定未來是否會開徵類似的税。
•2021年3月11日,總裁·拜登簽署了《2021年美國救援計劃法案》,從2024年1月1日起,取消了針對單一來源和創新多來源藥物的法定醫療補助藥品退税上限,目前該上限為藥品平均製造商價格的100%。由於2010年法定現收現付法、2021年美國救援計劃法案造成的預算赤字估計增加以及隨後的立法,從2025年開始,在沒有進一步立法的情況下,向提供者支付的醫療保險金額將進一步減少。
•2022年8月,《2022年降低通貨膨脹率法案》(IRA)簽署成為法律,其中包括幾項可能在不同程度上影響我們業務的條款,其中包括從2025年開始將聯邦醫療保險D部分受益人的自付上限降低至2,000美元;對聯邦醫療保險D部分下的某些藥物規定新的製造商財務責任;允許美國政府就某些沒有仿製藥或生物相似競爭的高成本藥物和生物製品的聯邦醫療保險B部分和D部分價格上限進行談判,包括小分子藥物;並要求公司就某些價格增長快於通脹的藥物,也包括小分子藥物,向聯邦醫療保險支付回扣。
此外,美國對藥品定價做法的立法和執法興趣也越來越大。具體地説,政府對製造商為其銷售產品設定價格的方式進行了更嚴格的審查,導致美國國會進行了幾次調查,並提出並頒佈了聯邦和州立法,旨在提高藥品定價的透明度,降低聯邦醫療保險制度下處方藥的成本,並審查定價與製造商患者計劃之間的關係。在聯邦一級,總裁·拜登於2021年7月9日簽署了一項行政命令,確認了政府的政策,即(I)支持降低處方藥和生物製品價格的立法改革,包括允許聯邦醫療保險談判藥品價格,設定通脹上限,支持低成本仿製藥和生物仿製藥的開發和進入市場;以及(Ii)支持制定公共醫療保險選項。除其他事項外,行政命令還指示HHS提供一份報告,説明為打擊處方藥定價過高、加強國內藥品供應鏈、降低聯邦政府為藥品支付的價格、以及解決行業價格欺詐而採取的行動;並指示FDA與提議根據2003年《聯邦醫療保險處方藥、改進和現代化法案》和FDA的實施條例制定第804條進口計劃的州和印第安人部落合作。FDA於2020年9月24日發佈了此類實施條例,並於2020年11月30日生效,為各州制定和提交加拿大藥品進口計劃提供了指導。2020年9月25日,CMS聲明,根據這一規則進口的州的藥品將沒有資格根據社會保障法第1927條獲得聯邦退税,製造商不會出於“最佳價格”或平均製造商價格的目的報告這些藥品。由於這些藥物不被認為是覆蓋的門診藥物,CMS進一步表示,它不會公佈這些藥物的全國平均藥物採購成本。如果實施,從加拿大進口藥品可能會對我們的任何候選產品的價格產生實質性和不利的影響。
2020年11月30日,HHS發佈了一項規定,取消了藥品製造商對D部分下計劃贊助商降價的安全港保護,直接或通過藥房福利經理,除非法律要求降價。該規定還為反映在銷售點的降價創造了一個新的安全港,以及為藥房福利經理和製造商之間的某些固定費用安排創造了一個安全港。根據法院命令,上述安全港的移除和增加被推遲,最近的立法將該規則的實施暫停到2026年1月1日。****進一步延長了在2032年之前實施這一規則的延遲時間。儘管其中一些措施和其他擬議中的措施可能需要通過額外的立法獲得授權才能生效,拜登政府可能會撤銷或以其他方式改變這些措施,但拜登政府和國會都表示,他們將繼續尋求新的立法措施來控制藥品成本。
在美國以外,確保產品的覆蓋範圍和足夠的付款也面臨挑戰。在許多國家,處方藥的定價受到政府的管制。與政府當局的定價談判可能遠遠超出產品獲得監管批准的範圍,可能需要進行臨牀試驗,將產品的成本效益與其他可用的療法進行比較。進行這樣的臨牀試驗可能代價高昂,並導致商業化延遲。
我們的一些製造商位於美國以外的地方。目前,美國與包括中國在內的其他國家在貿易政策、條約、政府法規和關税方面的未來關係存在重大不確定性。增加關税可能會擾亂我們現有的供應鏈,並給我們的業務帶來額外的成本。此外,可能會徵收更多關税,從而影響我們候選產品中使用的活性藥物成分或原料藥的進口,或者我們的業務可能會受到中國或其他國家採取的報復性貿易措施的不利影響,包括限制獲取我們候選產品中使用的此類原材料。鑑於中國和美國不可預測的監管環境,以及美國或外國政府將如何在關税、國際貿易協議和政策方面採取行動的不確定性,未來可能會發生與關税、附加税、監管變化或其他報復性貿易措施相關的進一步政府行動,對我們的業務和財務狀況產生相應的不利影響。
在歐盟,不同國家的定價和補償方案差別很大。一些國家規定,只有在商定了補償價格之後,才能銷售產品。一些國家可能要求完成額外的研究,將特定候選產品的成本效益與目前可用的療法或所謂的衞生技術評估進行比較,以獲得報銷或定價批准。例如,歐盟為其成員國提供了各種選擇,以限制其國家健康保險制度提供報銷的產品範圍,並控制供人使用的醫療產品的價格。歐盟成員國可以批准一種產品的具體價格,也可以對將該產品投放市場的公司的盈利能力採取直接或間接控制制度。其他成員國允許公司確定自己的產品價格,但監測和控制處方數量,並向醫生發佈指導意見,以限制處方。最近,歐盟許多國家提高了藥品折扣要求,隨着各國試圖管理醫療支出,這些努力可能會繼續下去,特別是在歐盟許多國家經歷嚴重財政危機和債務危機的情況下。總體上,醫療成本,特別是處方藥的下行壓力變得很大。因此,對新產品的進入設置了越來越高的壁壘。政治、經濟和監管方面的事態發展可能會使定價談判進一步複雜化,在獲得補償後,定價談判可能會繼續進行。歐盟各成員國使用的參考定價,以及平行貿易,即低價和高價成員國之間的套利,可以進一步降低價格。不能保證任何對藥品實行價格管制或報銷限制的國家,如果在這些國家獲得批准,將允許對任何產品作出有利的報銷和定價安排。
符合其他聯邦和州法律或要求的;改變法律要求的
如果我們可能開發的任何產品提供給總務署聯邦供應時間表的授權用户,則適用其他法律和要求。產品必須符合美國《防止毒物包裝法》中適用的兒童保護包裝要求。製造、標籤、包裝、分銷、銷售、促銷和其他活動也可能受到聯邦和州消費者保護和不正當競爭法律的約束,以及我們可能受到的其他要求。
醫藥產品的分銷須遵守額外的規定和條例,包括廣泛的記錄保存、許可、儲存和安全要求,以防止未經授權銷售醫藥產品。
如果不遵守這些法律或監管要求中的任何一項,公司將面臨可能的法律或監管行動。根據情況,未能滿足適用的監管要求可能會導致刑事起訴、罰款或其他處罰、禁令、被排除在聯邦醫療保健計劃之外、請求召回、扣押產品、完全或部分暫停生產、拒絕或撤回產品批准、重新標記或重新包裝,或拒絕允許公司簽訂供應合同,包括政府合同。任何針對我們違反這些法律的索賠或行動,即使我們成功地進行了辯護,也可能導致我們招致鉅額法律費用,並轉移我們管理層對業務運營的注意力。禁止或限制營銷、銷售或撤回我們銷售的未來產品可能會以不利的方式對我們的業務產生重大影響。
法規、法規或現有法規的解釋的變化可能會影響我們未來的業務,例如,要求:(I)改變我們的製造安排;(Ii)增加或修改產品標籤或包裝;(Iii)召回或停產我們的產品;或(Iv)額外的記錄保存要求。如果強制實施任何此類變化,可能會對我們的業務運營產生不利影響。
其他美國環境、健康和安全法律法規
我們可能受到許多環境、健康和安全法律和法規的制約,包括那些管理實驗室程序以及危險材料和廢物的處理、使用、儲存、處理和處置的法律和法規。有時和將來,我們的業務可能涉及使用危險和易燃材料,包括化學品和生物材料,還可能產生危險廢物產品。即使我們與第三方簽訂了處置這些材料和廢品的合同,我們也不能完全消除這些材料造成污染或傷害的風險。在使用或處置我們的危險材料造成污染或傷害的情況下,我們可能要對由此造成的任何損害負責,任何責任都可能超出我們的資源範圍。我們還可能招致與民事或刑事罰款以及不遵守此類法律和法規的懲罰相關的鉅額費用。
我們維持工人補償保險,以支付我們因員工受傷而可能產生的費用和費用,但該保險可能不足以應對潛在的責任。然而,我們不為可能對我們提出的環境責任或有毒侵權索賠提供保險。
此外,為了遵守當前或未來的環境、健康和安全法律法規,我們可能會產生鉅額成本。當前或未來的環境法律法規可能會損害我們的研究、開發或生產努力。此外,不遵守這些法律法規可能會導致鉅額罰款、處罰或其他制裁。
美國境外藥物管制
為了在美國以外地區銷售任何產品,我們將需要遵守其他國家關於安全性和有效性以及監管(其中包括)臨牀試驗、上市許可或替代監管途徑的識別、生產、商業銷售和分銷我們產品的眾多和不同的監管要求。例如,在歐盟,藥品受到歐盟和國家一級監管機構廣泛的上市前和上市後監管。
•集中程序—如果在集中程序下尋求治療適應症候選產品的上市許可,則根據歐洲藥品管理局(EMA)、人用藥品委員會(CHMP)的意見,歐盟委員會將頒發一份在整個歐盟以及歐洲經濟區其他成員國(冰島、列支敦士登和挪威)有效的上市許可。對於生物技術工藝或高級治療藥品衍生的人用藥品,集中程序是強制性的(如基因治療、體細胞治療和組織工程產品),含有新活性物質的產品,指示用於治療某些疾病,如HIV、AIDS、癌症、神經變性疾病、糖尿病、自身免疫疾病和其他免疫功能障礙、病毒性疾病,和指定的孤兒藥對於不屬於這些類別的藥物,申請人可以選擇向EMA提交集中上市許可申請,只要有關藥物含有尚未在歐盟獲得授權的新活性物質,是一項重大的治療、科學或技術創新,或者其授權符合歐盟的公共健康利益。根據集中程序,EMA評價上市許可申請或MAA的最長時限為210天(不包括時鐘停止),此時申請人將提供額外的書面或口頭信息以回答CHMP提出的問題。時鐘停止可能會延長MAA評估的時間範圍,大大超過210天。如果CHMP給出了肯定的意見,它將意見連同支持文件一起提供給歐盟委員會,由歐盟委員會做出授予上市許可的最終決定,上市許可將在收到EMA建議後67天內發佈。在特殊情況下,當一種藥品預計會對公共衞生產生重大影響時,特別是從治療創新的角度來看,CHMP可能會批准加速評估。如果CHMP接受該要求,210天的時限將減少至150天,不包括時鐘停止,但如果CHMP確定申請不再適合進行加速評估,則可能會恢復到集中程序的標準時限。
•國家授權程序-還有另外兩種可能的途徑在幾個國家授權用於治療適應症的產品,這些途徑適用於不屬於集中程序範圍的產品:
◦分散程序—使用分散程序,申請人可以在一個以上的歐盟國家申請同時授權尚未在任何歐盟國家獲得授權,並且不屬於集中程序強制性範圍的藥品。
◦互認程序—在相互承認程序中,一種藥物首先根據一個歐盟成員國的國家程序在該國獲得批准。在此之後,可以通過相關國家承認原始國家上市許可的有效性的程序從其他歐盟國家尋求額外的上市許可。
根據上述程序,在授予上市許可之前,EMA或歐盟成員國主管當局根據有關產品質量、安全性和有效性的科學標準對產品的風險—受益平衡進行評估。
由於聯合王國(包括大不列顛及北愛爾蘭)已退出歐盟,大不列顛將不再受集中上市許可的覆蓋(根據北愛爾蘭議定書,集中上市許可將繼續在北愛爾蘭得到承認)。所有擁有當前集中上市許可的藥品於2021年1月1日自動轉換為英國上市許可。從2021年1月1日起的兩年時間內,英國藥品監管機構藥品和保健產品監管局(MHRA)可能會依賴歐盟委員會在集中程序中批准新上市許可的決定,以便更快地授予新的英國上市許可。但仍需另行提出申請。MHRA還有權考慮通過分散或相互承認程序在歐盟成員國批准的上市許可,以便更快地在英國或英國授予上市許可。
在歐盟,被授權上市的治療適應症新產品(即參考產品)有資格獲得八年的數據獨佔和額外兩年的市場獨家銷售授權。如果授予數據專有期,仿製藥或生物相似藥申請人在歐盟申請仿製藥或生物相似藥上市授權時,不得依賴參考產品檔案中包含的臨牀前和臨牀試驗數據,自參考產品首次在歐盟獲得授權之日起八年內。在額外的兩年市場排他期內,可以提交仿製藥或生物相似產品的營銷授權,並可以參考創新者的數據,但在市場排他期到期之前,任何仿製藥或生物相似產品都不能在歐盟銷售。如果在十年的頭八年中,營銷授權持有人獲得了對一個或多個新治療適應症的授權,在授權之前的科學評估期間,這些適應症被認為與目前批准的療法相比能夠帶來顯著的臨牀益處,則十年的市場專營期最多可以延長到十一年。不能保證一個產品會被EMA視為創新的醫藥產品,而且產品可能沒有資格獲得數據獨佔性。即使一種產品被認為是一種創新的醫藥產品,因此創新者獲得了規定的數據獨佔期,但如果另一家公司獲得了基於MAA的營銷授權,以及藥物測試、臨牀前測試和臨牀試驗的完整、獨立的數據包,該公司也可以銷售該產品的另一個版本。
歐盟對“孤兒藥品”的認定標準原則上與美國相似。在歐盟,符合以下標準的醫藥產品可被指定為孤兒醫藥產品:(1)其目的是診斷、預防或治療危及生命或慢性衰弱的疾病;(2)或者(A)當提出申請時,這種疾病在歐盟影響不超過10,000人中的5人,或者(B)如果沒有孤兒身份帶來的好處,該藥物的營銷不太可能在歐盟產生足夠的回報,以證明對其開發的必要投資是合理的;以及(3)沒有令人滿意的診斷、預防或治療這種疾病的方法授權在歐盟上市,或者如果有這樣的方法,產品將對受該疾病影響的人有重大好處。孤兒醫藥產品有資格獲得財政獎勵,如降低費用或免除費用,並在獲得營銷授權後,有權獲得經批准的治療適應症的十年市場排他性。在這十年的孤兒市場專營期內,不接受MAA,也不允許類似的醫藥產品進入市場。“類似醫藥產品”的定義是含有與批准的孤兒醫藥產品中所含的一種或多種類似活性物質的醫藥產品,其目的是用於相同的治療適應症。孤兒產品還可以在歐盟獲得額外兩年的兒科研究市場排他性。如果在第五年結束時確定該產品不再符合指定孤兒的標準,例如,如果該產品的利潤足夠高,不足以證明維持市場排他性是合理的,則十年的市場排他性可以減少到六年。否則,只有在非常特殊的情況下,才可以撤銷孤兒藥品的銷售排他性,例如:(I)確定類似的藥品比授權產品更安全、更有效或在臨牀上更好;(Ii)授權孤兒產品的營銷授權持有人同意第二次申請孤兒藥品;或(Iii)授權孤兒產品的營銷授權持有人不能供應足夠的孤兒藥品。在提交上市審批申請之前,必須要求指定為孤兒。孤兒指定不會在監管審查和批准過程中傳遞任何優勢,也不會縮短監管審查和批准過程的持續時間。
自2021年1月1日起,英國開始採用單獨的孤兒指定程序。英國現在沒有上市前授權孤兒指定(歐盟有),孤兒指定的申請將在英國或英國營銷授權MAA時由MHRA審查。指定孤兒的標準與歐盟相同,只是它們只適用於英國(例如,與歐盟相反,在英國必須沒有令人滿意的診斷、預防或治療有關疾病的方法,並且相關疾病在英國的流行率不得超過萬分之五)。2017年5月,歐盟通過了關於體外診斷醫療器械的(EU)2017/746號條例,該條例將於2022年5月26日生效,並將廢除關於體外診斷醫療器械的第98/79/EC號指令。符合IVDR要求的設備將有權帶有CE符合性標誌,表明該設備符合IVDR的一般安全和性能要求,因此可以在整個歐盟範圍內進行商業分銷(沒有CE標誌,體外診斷醫療設備不能在歐盟銷售)。評估符合性的方法因產品類別而異,但通常涉及由“通知機構”進行的第三方評估。這種第三方評估可能包括對製造商的質量體系的審計和對製造商產品的具體測試。
與美國類似,歐盟的非臨牀和臨牀研究的各個階段都受到重要的監管控制。
2014年4月,通過了新的《臨牀試驗條例》(歐盟)第536/2014號(《臨牀試驗條例》),於2022年1月31日取代了《臨牀試驗指令2011/20/EC》。臨牀試驗條例直接適用於所有歐盟成員國,這意味着不需要國家實施立法。如果臨牀試驗的授權請求是在新法規生效後的一年內提交的,新法規的暫時性條款使發起人有可能在以前的指令和新法規的要求之間做出選擇。如一項臨牀試驗自《臨牀試驗規例》生效之日起計持續超過3年,則《臨牀試驗規例》屆時將開始適用於該臨牀試驗。新的臨牀試驗條例旨在簡化和精簡歐盟臨牀試驗的審批。該條例的主要特點包括:通過單一入口點簡化申請程序,即臨牀試驗信息系統,或“CTIS”;為申請準備和提交的單一文件以及簡化的臨牀試驗贊助商報告程序;以及統一的臨牀試驗申請評估程序,分為兩部分。第一部分是通過對提交了臨牀試驗授權申請的所有歐盟成員國(相關成員國)的主管當局對參考成員國的審查進行協調評估而進行的。第二部分由每個有關成員國單獨評估。已經為臨牀試驗申請的評估設定了嚴格的最後期限。有關道德操守委員會在評估程序中的作用將繼續由有關歐盟成員國的國家法律管轄。然而,總體相關的時間表將由臨牀試驗條例定義。
上述歐盟規則普遍適用於由歐盟成員國加上挪威、列支敦士登和冰島組成的歐洲經濟區(EEA)。
EEA個人數據的收集和使用受2018年5月25日生效的《通用數據保護條例》(GDPR)管轄。GDPR具有域外適用性,適用於歐洲經濟區以外為歐盟居民提供商品或服務的組織。這一擴展將包括歐盟成員國的任何臨牀試驗活動。GDPR對個人數據的控制者和處理者提出了嚴格的要求,包括對“敏感信息”的特殊保護,其中包括居住在歐洲經濟區的數據主體的健康和遺傳信息。GDPR授予個人一系列數據保護權利,他們可以行使與個人信息有關的權利。此外,GDPR允許個人就侵權行為提出賠償要求,並引入非營利組織代表數據主體提出索賠的權利。此外,GDPR對將個人數據從歐洲經濟區轉移到美國或其他未被視為提供“充分”隱私保護的地區實施了嚴格的規定。不遵守GDPR和歐洲經濟區成員國相關國家數據保護法的要求,可能與GDPR略有偏離,可能導致高達全球收入4%的罰款,或2000萬歐元,以較大者為準。由於實施GDPR,我們可能需要建立額外的機制,以確保遵守新的數據保護規則。此外,繼英國於2020年1月31日退出歐盟後,GDPR於2020年12月31日過渡期結束時停止在英國適用。然而,截至2021年1月1日,英國的《2018年歐盟(退出)法案》將GDPR(2020年12月31日存在,但受某些英國特定修訂)納入英國法律,稱為英國GDPR。《英國通用數據保護條例》和《2018年英國數據保護法》規定了英國的數據保護制度,該制度獨立於歐盟的數據保護制度,但與歐盟的數據保護制度保持一致。不遵守英國GDPR可能導致高達1750萬英鎊或全球收入的4%的罰款,以較高者為準。雖然英國被視為歐盟GDPR下的第三國,但歐盟委員會現在發佈了一項決定,承認英國在歐盟GDPR下提供了充分的保護,因此,來自歐盟的個人數據傳輸到英國仍然不受限制。與歐盟GDPR一樣,英國GDPR限制將個人數據傳輸到英國不認為提供足夠保護的國家。英國政府已確認,個人數據從英國傳輸到歐洲經濟區仍然是自由流動的。
數據保護機構將尋求強制遵守GDPR的方式存在不確定性。例如,目前尚不清楚當局是否會對在歐洲經濟區開展業務的公司進行隨機審計,或者當局是否會等待聲稱其權利受到侵犯的個人提出投訴。執法的不確定性以及與確保GDPR合規相關的成本是繁重的,可能對我們的業務、財務狀況、經營業績和前景造成不利影響。
如果我們使用第三方分銷商,遵守此類外國政府法規通常將是此類分銷商的責任,他們可能是我們有限控制的獨立承包商。
英國脱歐與英國的監管框架
2016年6月23日,英國選民投票贊成脱離歐盟(俗稱脱歐)。英國於2020年1月31日正式脱離歐盟。有一個最初的過渡期,在此期間,歐盟的規則繼續適用於聯合王國,於2020年12月31日結束。英國和歐盟簽署了歐盟-英國貿易與合作協定,即TCA,自2021年1月1日起暫時適用,自2021年5月1日起正式適用。TCA包括有關藥品的具體條款,其中包括相互承認GMP,檢查醫藥產品的製造設施和發佈的GMP文件,但沒有預見英國和歐盟藥品法規的大規模相互承認。目前,英國已通過《2012年人類藥品條例》(經修訂)(根據北愛爾蘭議定書,歐盟監管框架將繼續適用於北愛爾蘭)實施歐盟關於醫藥產品營銷、推廣和銷售的立法。因此,英國的監管制度在很大程度上與歐盟現行的監管制度一致,然而,由於英國的監管制度獨立於歐盟,而且TCA沒有規定相互承認英國和歐盟的藥品立法,這些制度未來可能會有所不同。
人力資本資源
為了實現公司的目標和期望,我們繼續吸引和留住頂尖人才是至關重要的。為了吸引和留住人才,我們努力使黑鑽石成為一個安全和有回報的工作場所,讓我們的員工有機會在他們的職業生涯中成長和發展,得到強有力的薪酬、福利和健康計劃的支持,並通過在我們員工之間建立聯繫的計劃來支持。
截至2024年2月15日,我們有54名全職員工。我們的員工中有13人擁有博士學位,4人擁有藥學博士學位,3人擁有醫學博士學位。下表顯示了截至2024年2月15日從事研發或行政職能的全職員工數量。我們所有的員工都在美國。 我們的員工中沒有一個是工會代表,也沒有集體談判協議的覆蓋範圍。我們認為我們與員工的關係很好。
黑鑽石採取了促進包容性工作環境和多樣化勞動力的政策和倡議。我們對包容性的承諾反映在我們的企業目標中,並支撐着我們的社會、文化和慈善倡議。我們與外部組織合作,通過確保我們擁有包容所有人的文化來吸引、留住和發展多樣化的人才。
2023年,我們約69%的新員工來自代表性較低的類別,包括女性和少數族裔。截至2024年2月15日,公司約54%的員工和48%的管理人員被確認為女性。截至2024年2月15日,我們大約22%的員工和19%的管理人員被確定為種族或民族多元化。
我們業務的成功從根本上與我們員工的福祉有關。因此,我們致力於他們的健康、安全和健康。我們為我們的員工及其家人提供各種創新、靈活和方便的健康和健康計劃,包括提供保護和保障的福利,以便他們可以安心應對可能需要離開工作時間或影響其財務健康的事件;通過提供工具和資源幫助他們改善或保持健康狀況並鼓勵參與健康行為來支持他們的身心健康;以及在可能的情況下提供選擇,以便他們可以定製自己的福利以滿足他們的需求和家庭的需要。
我們提供強大的薪酬和福利計劃,以幫助滿足員工的需求。除了工資外,這些計劃還包括潛在的年度可自由支配獎金、股票獎勵、401(K)計劃、醫療和保險福利、健康儲蓄和靈活支出賬户、帶薪休假、探親假和靈活工作時間安排等。除了我們基礎廣泛的股權獎勵計劃外,我們還使用具有歸屬條件的有針對性的股權獎勵計劃,以促進留住人員。
設施
我們租用了一個擁有約25,578平方英尺辦公空間的設施,用於我們的主要辦公室,該辦公室位於馬薩諸塞州坎布里奇市主街一號,郵編02142。租約將於2028年8月31日到期,但有權將租約再延長五年。2022年12月,我們簽訂了馬薩諸塞州劍橋市一層約14,439平方英尺辦公空間的轉租合同,該合同也將於2028年8月31日終止。我們還在紐約東29街430號租用了約18,120平方英尺的辦公和實驗室空間,郵編為10016。租約將於2032年6月30日到期,但有權將租約再延長五年。
我們相信,我們現有的設施足以滿足我們目前的需要,並將按商業上合理的條款提供合適的額外或替代空間,以容納我們未來的業務擴張。
法律程序
我們可能不時捲入日常業務過程中產生的法律訴訟。於本年報日期,吾等並非任何重大法律事宜或申索之當事方,亦無知悉任何重大法律事宜或申索。未來,我們可能會在日常業務過程中成為法律事宜及索償的一方,而我們預期有關解決方案不會對我們的財務狀況、經營業績或現金流量造成重大不利影響。
企業信息
我們於2014年12月成立為有限責任公司,並於2016年9月根據特拉華州法律以ASET Therapeutics,Inc.的名稱轉換為公司。2018年1月2日,我們更名為Black Diamond Therapeutics,Inc.。我們的主要行政辦公室位於One Main Street,Cambridge,MA 02142,我們的電話號碼是617—252—0848。截至2023年12月31日,我們有一家子公司Black Diamond Therapeutics Security Corporation,於2019年註冊成立。我們的第二個子公司,Black Diamond Therapeutics(Canada)Inc.,該公司於2018年成立,於2023年10月解散。
我們是一家“新興增長型公司”,定義在2012年的《快速啟動我們的商業創業法案》。我們將繼續是一家新興增長型公司,直至以下日期的較早時間:(i)(a)首次公開發售(IPO)完成五週年後的財政年度最後一天,(b)我們每年總收入至少為12.35億美元,或(c)我們被視為大型加速申報人,這意味着截至之前的6月30日,非關聯公司持有的普通股的市值超過7億美元,以及(ii)我們在前三年期間發行了超過10億美元的不可轉換債券的日期。
財務信息和細分市場
本第1項所要求的財務資料,通過引用本年度報告中標題為“第二部分—項目8—財務報表和補充數據."本公司將其業務作為單一分部管理,以評估表現及作出經營決策。該公司的唯一重點是為患有由變構突變激活的癌基因驅動的遺傳定義癌症患者開發選擇性藥物。請參閲本年報所載之綜合經審核財務報表附註2。有關我們業務的財務信息,請參閲“第二部分—項目7—管理層對財務狀況和經營成果的討論和分析”及我們的綜合經審核財務報表及本年報其他部分所載的相關附註。
可用信息
我們的網址是www.blackdiamondtherapeutics.com。我們的年度報告表10—K,季度報告表10—Q,當前報告表8—K,包括證據,委託書和信息聲明,以及根據1934年證券交易法第13(a),第14和第15(d)節提交或提供的這些報告的修訂,在我們以電子方式向美國證券交易委員會提交此類材料或提供給美國證券交易委員會後,在合理可行的範圍內儘快免費通過我們網站的“投資者與新聞”部分獲得。本公司網站上的信息並非本年報或本公司任何其他證券備案的一部分,除非以引用方式明確納入本年報。我們於本年報中僅載列網站地址作為非活動文字參考。我們向SEC提交的文件可通過SEC網站www.sec.gov訪問。我們在任何證券文件中所作的所有聲明,包括所有前瞻性聲明或信息,均在包含聲明的文件日期作出,除非法律要求我們這樣做,否則我們不承擔或承擔更新任何這些聲明或文件的義務。
第1A項。風險因素
在評估公司和我們的業務時,除了本年度報告和我們向SEC提交的其他文件中所列的其他信息外,還應仔細考慮以下風險因素。投資我們的普通股風險很大.倘實際發生以下任何風險及不確定因素,我們的業務、前景、財務狀況及經營業績可能受到重大不利影響。下文概述及描述的風險及不確定性並非詳盡無遺,亦並非我們面對的唯一風險及不確定性。我們目前未知或我們目前認為不重大的額外風險及不確定因素亦可能損害我們的業務、前景、財務狀況及經營業績。本年報中的若干陳述為前瞻性陳述。另請參閲題為"關於前瞻性陳述的特別説明"的一節。
與我們的候選產品開發相關的風險
臨牀開發相關風險
我們的開發工作還處於早期階段,在很大程度上依賴於我們的臨牀階段候選產品BDTX—1535和BDTX—4933。如果我們無法通過臨牀開發推進BDTX—1535、BDTX—4933或我們的任何其他候選產品,獲得監管部門的批准,並最終將BDTX—1535、BDTX—4933或我們的任何其他候選產品商業化,或者在這方面遇到重大延誤,我們的業務將受到重大損害。
我們的發展工作還處於早期階段。目前,我們正在EGFRm NSCLC患者的II期臨牀試驗以及GBM患者的I期臨牀試驗和研究者申辦的0/I期臨牀試驗中評估BDTX—1535,我們正在I期臨牀試驗中評估BDTX—4933。我們的其他候選產品仍處於臨牀前開發階段,從未在人體受試者中進行過測試。我們創造產品收入的能力,我們預計這將在很多年內實現,如果有的話,將在很大程度上取決於BDTX—1535,BDTX—4933和我們的一個或多個其他候選產品的成功臨牀開發和最終商業化。此外,我們的藥物開發計劃考慮開發伴隨診斷,這是用於確定適當患者人羣的分析或測試。伴隨診斷作為醫療器械受監管,必須在我們將候選產品商業化之前獲得FDA或某些其他外國監管機構的上市批准。我們候選產品的成功取決於幾個因素,包括:
•圓滿完成臨牀前研究;
•批准IND用於我們計劃的臨牀試驗或未來的臨牀試驗;
•FDA接受我們的臨牀開發策略;
•成功啟動臨牀試驗;
•成功的患者登記和完成臨牀試驗;
•成功開發配套診斷,用於我們的候選產品;
•我們候選產品的安全性、耐受性和有效性符合FDA或任何外國監管機構的上市審批要求;
•收到適用監管機構對我們候選產品和任何伴隨診斷的上市批准;
•向適用的監管機構作出任何必要的上市後批准承諾的程度;
•為我們的候選產品獲得並維護專利和商業祕密保護以及法規排他性;
•與第三方製造商安排,或建立製造能力,為我們的候選產品的臨牀和商業供應,如果任何候選產品獲得批准;
•建立銷售、營銷和分銷能力,並在獲得批准後單獨或與他人合作啟動我們產品的商業銷售;
•如果患者、醫療界和第三方付款人批准了我們的產品,則接受我們的產品;
•有效地與其他癌症療法競爭;
•獲得並維持第三方保險和適當的補償;
•在獲得批准後,保持我們產品的持續可接受的安全狀況;以及
•我們可能無法控制的因素,例如當前或潛在的大流行可能會限制患者、主要研究人員或工作人員或臨牀地點的可用性。
我們不能保證目前臨牀前研究或正在進行的BDTX—1535和BDTX—4933臨牀試驗中獲得的結果足以獲得此類候選產品的監管批准或上市許可。我們的主要候選產品開發過程中的負面結果也可能影響我們獲得監管部門批准的能力,無論是在根本上還是在預期時間範圍內,因為儘管其他候選產品可能針對不同的適應症,但我們所有候選產品的基礎技術平臺、生產工藝和開發工藝都是相同的。因此,任何一個項目的失敗都可能影響獲得監管機構批准以繼續或開展其他候選產品臨牀項目的能力。此外,抗腫瘤活性在每種不同的腫瘤類型和我們計劃在臨牀試驗中評估的不同基因突變中可能不同,並且可能與我們臨牀前研究中看到的結果不同。因此,與其他癌症相比,患有某些癌症的患者的腫瘤反應可能較低。這可能導致因臨牀獲益不足而停止為這些腫瘤類型和/或突變患者開發候選產品,同時繼續為更有可能受益的患者人羣開發。因此,我們可能不得不與FDA協商,以確定最佳患者人羣、研究設計和規模,以獲得監管部門的批准,其中任何一項都可能需要大量額外資源,並推遲我們臨牀試驗的時間,最終推遲我們任何候選產品的批准(如果有的話)。
此外,由於我們的財力和人力資源有限,並將重點放在臨牀階段候選產品的開發上,我們可能會放棄或推遲追求其他未來產品候選產品的機會,這些產品後來被證明具有更大的商業潛力。我們的資源分配決策可能會導致我們無法利用可行的商業產品或有利可圖的市場機會。我們在當前和未來的研發計劃以及其他特定適應症的未來候選產品上的支出可能不會產生任何商業上可行的未來候選產品。如果我們沒有準確評估特定未來候選產品的商業潛力或目標市場,我們可能會通過合作、許可或其他特許權使用費安排向這些未來候選產品放棄寶貴的權利,而在這種情況下,我們保留這些未來候選產品的獨家開發權和商業化權利會更有利。
招募患者的困難可能會推遲或阻止我們的候選產品的臨牀試驗。我們可能會發現很難招募患者參加我們針對BDTX-1535的第二階段臨牀試驗或BDTX-4933的第一階段臨牀試驗,這些候選產品都是針對基因突變設計的。
確定患者並使其有資格參與我們候選產品的臨牀研究對我們的成功至關重要。我們臨牀研究的完成時間在一定程度上取決於我們招募患者參與測試我們候選產品的速度,如果我們在登記時遇到困難,我們可能會在臨牀試驗中遇到延誤。如果我們無法按照FDA或美國以外的類似監管機構的要求找到並招募足夠數量的合格患者參與這些試驗,我們可能無法啟動或繼續對我們的候選產品進行臨牀試驗。特別是,由於我們專注於具有特定基因突變的患者,我們招募合格患者的能力可能會受到限制,或者可能導致登記速度比我們預期的要慢。例如,對於BDTX-1535和BDTX-4933,我們不能確定有多少患者將具有這些候選產品針對的每個基因突變,或者每個突變的登記患者數量將足以獲得監管部門的批准並將每個此類突變包括在批准的標籤中。此外,我們的一些競爭對手正在對與我們的候選產品具有相同適應症的候選產品進行臨牀試驗,本來有資格參加我們臨牀試驗的患者可以轉而參加我們競爭對手的候選產品的臨牀試驗。
除了潛在的少數人羣,我們計劃的臨牀試驗的資格標準將進一步限制可用的研究參與者池,因為我們將要求患者具有我們可以測量的特定特徵,以確保他們的疾病足夠嚴重或不太嚴重,不足以將他們納入研究。此外,發現和診斷患者的過程可能被證明是昂貴的。我們也可能無法識別、招募和招募足夠數量的患者來完成我們的臨牀研究,原因包括正在研究的候選產品的已知風險和好處、競爭療法和臨牀試驗的可用性和有效性、潛在患者的臨牀研究地點的鄰近和可用性、患者腫瘤的基因測序信息的可用性以便我們能夠識別具有目標基因突變的患者以及醫生的患者轉介做法。如果患者出於任何原因不願參與我們的研究,招募患者、進行研究和獲得監管部門對潛在產品的批准的時間可能會推遲。
我們打算聘請第三方開發用於我們臨牀試驗的配套診斷方法,但這些第三方可能無法成功開發此類配套診斷方法,從而進一步增加了為我們的臨牀試驗識別具有目標基因突變的患者的難度。此外,如果我們無法將具有目標基因突變的患者包括在內,這可能會影響我們尋求參與FDA的快速審查和開發計劃的能力,包括突破性治療指定和快速通道指定,或者以其他方式尋求加快臨牀開發和監管時間表。
患者的登記還取決於許多因素,包括:
•患者與臨牀試驗地點的距離;
•臨牀試驗的設計;
•我們有能力招聘具有適當能力和經驗的臨牀試驗研究人員;
•我們獲得和維護患者同意的能力;
•任何大流行或流行病對臨牀試驗地點激活和患者登記的影響;
•報告我們任何臨牀試驗的初步結果;以及
•參加臨牀試驗的患者在臨牀試驗結束前退出臨牀試驗的風險。
此外,我們的臨牀試驗將與其他臨牀試驗競爭,爭奪與我們候選產品處於相同治療領域的候選產品,這種競爭將減少我們可用的患者數量和類型,因為一些可能選擇參加我們的臨牀試驗的患者可能會選擇參加我們競爭對手正在進行的臨牀試驗。由於合格臨牀研究者的數量有限,我們預計將在我們的一些競爭對手使用的相同臨牀試驗中心進行部分臨牀試驗,這將減少在這些臨牀試驗中心進行臨牀試驗的患者數量。此外,由於我們的候選產品代表了對癌症治療更常用方法的背離,並且由於我們的大多數候選產品之前從未在人體中進行過測試,潛在患者及其醫生可能傾向於使用常規療法,如化療,而不是在未來的任何臨牀試驗中招募患者。此外,由於我們的臨牀試驗是在複發性/難治性癌症患者中進行的,患者通常處於疾病晚期,可能會發生與我們候選產品無關的疾病進展,因此無法進行臨牀試驗評估,需要額外的患者入組。
如果我們在完成或終止候選產品的任何臨牀試驗方面遇到延誤,候選產品的商業前景將受到損害,並且我們從任何候選產品中產生產品收入的能力可能會受到延誤或阻礙。
作為一家公司,我們在進行臨牀試驗方面的經驗有限。
作為一家公司,我們在進行臨牀試驗方面的經驗有限。部分由於經驗有限,我們無法確定我們正在進行的臨牀前研究和臨牀試驗將按時完成,或者計劃的臨牀前研究和臨牀試驗是否會按時開始或完成(如果有的話)。大規模臨牀試驗將需要大量額外的財政和管理資源,並依賴於第三方臨牀研究者、合同研究組織或CRO和顧問。依賴第三方臨牀研究者、CRO和顧問可能會迫使我們遇到超出我們控制範圍的延誤。我們可能無法及時或根本無法確定足夠的調查人員、CRO和顧問並與之簽約。對於BDTX—1535和BDTX—4933,我們與CRO簽訂了主服務協議,以進行我們的首次人體臨牀試驗。我們無法保證我們將能夠在必要時與其他CRO協商並訂立任何額外的主服務協議,條款為我們及時接受或根本無法接受。
我們的臨牀前研究和臨牀試驗可能無法充分證明我們任何候選產品的安全性、效價、純度和療效,這將阻礙或延遲開發、監管批准和商業化。
在我們的候選產品(包括BDTX-1535和BDTX-4933)的商業銷售獲得監管批准之前,我們必須通過漫長、複雜和昂貴的臨牀前研究和臨牀試驗證明,我們的候選產品在每個目標適應症中都是安全有效的。臨牀前和臨牀試驗費用昂貴,可能需要數年時間才能完成,其結果本身也不確定。失敗可能在臨牀前研究和臨牀試驗過程中的任何時候發生,而且由於我們的候選產品處於開發的早期階段,失敗的風險很高,我們可能永遠不會成功開發適銷對路的產品。
我們候選產品的臨牀前研究和早期臨牀試驗的結果可能不能預測後期臨牀試驗的結果。儘管候選產品可能在臨牀前研究和早期臨牀試驗中顯示出有希望的結果,但在隨後的臨牀試驗中可能被證明不是有效的。例如,在動物身上進行測試的條件與在人類身上進行測試的條件不同,因此,動物研究的結果可能無法準確預測人類的體驗。通過臨牀前研究和臨牀試驗的候選產品失敗通常會導致極高的流失率。儘管在臨牀前研究和初步臨牀試驗中取得了進展,但臨牀試驗後期階段的候選產品可能無法顯示出所需的安全性、有效性、純度和有效性。同樣,早期較小規模的臨牀試驗可能不能預測大規模關鍵臨牀試驗的最終安全性或有效性。生物製藥行業的一些公司在高級臨牀試驗中遭受了重大挫折,原因是缺乏效力或效力、效力或效力的持久性不足或不可接受的安全問題,儘管在早期試驗中取得了令人振奮的結果。大多數開始臨牀前研究和臨牀試驗的候選產品從未被批准為產品。
我們可能進行的任何臨牀前研究或臨牀試驗可能無法證明獲得監管部門批准將我們的候選產品推向市場所需的安全性、有效性、純度和有效性。如果我們正在進行的或未來的臨牀前研究和臨牀試驗的結果對於我們的候選產品的安全性、有效性、純度和有效性沒有定論,如果我們沒有達到具有統計和臨牀意義的臨牀終點,或者如果我們的候選產品存在安全問題,我們可能會阻止或推遲獲得此類候選產品的上市批准。在某些情況下,由於許多因素,同一候選產品的不同臨牀前研究和臨牀試驗之間的安全性、有效性、純度或療效結果可能存在顯著差異,包括方案中規定的試驗程序的變化、患者羣體的大小和類型的差異、臨牀試驗方案的變化和遵守以及臨牀試驗參與者的退學率。就像所有腫瘤藥物一樣,很可能會有與使用它們相關的副作用。我們的試驗結果可能會揭示這些或其他副作用的嚴重程度和流行程度,這是不可接受的。在這種情況下,我們的試驗可能被暫停或終止,FDA或類似的外國監管機構可以命令我們停止進一步開發或拒絕批准我們的任何或所有目標適應症的候選產品。與藥物相關的副作用也可能影響患者招募或納入患者完成試驗的能力,或導致潛在的產品責任索賠。任何這些情況都可能對我們的業務、財務狀況和前景造成重大損害。
此外,我們的候選產品可能會在與靶標毒性相關的臨牀試驗中引起不良副作用。例如,其他EGFR抑制劑由於患者皮疹而出現劑量限制毒性,儘管我們將我們的候選產品設計為“野生型”節約型,以限制類似毒性的風險,但臨牀結果可能不同,患者也可能經歷類似或不同的毒性,從而限制我們候選產品的劑量和/或療效。如果觀察到靶標毒性,或者如果我們的候選產品具有意想不到的特性,我們可能需要放棄它們的開發,或者將開發限制在更狹隘的用途或子羣中,在這些用途或子羣中,從風險-收益的角度來看,不良副作用或其他特性不那麼普遍、不那麼嚴重或更容易接受。許多化合物最初在治療癌症的早期測試中表現出了希望,但後來被發現會產生副作用,阻止這種化合物的進一步發展。
我們可能無法在我們預期的時間內提交IND或IND修正案來開始額外的臨牀試驗,即使我們能夠,FDA也可能不允許我們繼續進行。
我們於2021年12月提交了BDTX—1535的IND,該產品於2022年第一季度獲得FDA的許可,並於2022年12月提交了BDTX—4933的IND,該產品於2023年第一季度獲得FDA的許可。然而,我們可能無法在預期的時間表上為其他候選產品提交IND。例如,我們可能會遇到製造延遲或其他延遲,因為IND使能研究。此外,我們不能確定提交IND將導致FDA允許進一步的臨牀試驗開始,或者一旦開始,不會出現暫停或終止臨牀試驗的問題。此外,即使此類監管機構同意IND中規定的臨牀試驗的設計和實施,我們也不能保證此類監管機構將來不會改變其要求。這些考慮因素也適用於我們可能提交的新臨牀試驗,作為現有IND或新IND的修正案。任何未能在我們預期的時間表提交IND或未能獲得監管部門對我們的試驗的批准,都可能妨礙我們完成臨牀試驗或及時將我們的產品商業化。
未能成功驗證、開發和獲得監管部門批准的候選產品的伴隨診斷可能會損害我們的藥物開發策略和運營結果。
作為我們業務策略和方法的核心要素之一,我們尋求篩選和識別可能從我們的開發產品候選物中獲得有意義的益處的遺傳變異患者子集。為了實現這一目標,我們的產品開發計劃依賴於我們或第三方合作者對配套診斷產品的開發和商業化。伴隨診斷是與相關產品的臨牀項目一起開發的,並作為醫療器械受監管。批准候選產品的每個機構將獨立地需要在批准候選產品之前或同時批准伴隨診斷產品,並且在產品可以商業化之前。作為產品標籤的一部分,伴隨診斷的批准也將限制候選產品的使用,僅限於那些表達特定基因改變的患者。
伴隨診斷作為醫療器械受FDA和類似的外國監管機構的監管,並且在商業化之前需要單獨的上市許可。我們和我們的第三方合作者在開發和獲得我們的配套診斷產品的上市許可時可能會遇到困難。我們或第三方合作者在開發或獲得配套診斷產品的監管批准方面的任何延遲或失敗都可能延遲或阻止我們相關候選產品的批准。
由於我們計劃在BDTX—1535的II期臨牀試驗和BDTX—4933的I期臨牀試驗中給藥的患者數量少於將入組註冊試驗的患者數量,因此此類臨牀試驗一旦完成,其結果可能不如大型臨牀試驗結果可靠。這可能會阻礙我們為候選產品獲得監管部門批准的努力。
我們計劃在最初的臨牀試驗中給藥的患者數量很少。樣本量較小的臨牀試驗的初步結果可能會受到與進行小規模臨牀試驗相關的各種偏倚的不成比例的影響,例如樣本量較小可能無法準確描述更廣泛患者人羣的特徵,這限制了在更廣泛的社區推廣結果的能力,從而使臨牀試驗結果不如使用大量患者的臨牀試驗可靠。因此,在未來的臨牀試驗中,這些候選產品可能會獲得統計學顯著效果的確定性較低。如果我們在未來進行任何BDTX—1535或BDTX—4933的臨牀試驗,我們可能無法獲得統計學顯著性結果或相同水平的統計學顯著性(如果有的話),我們可能會根據我們在初始臨牀試驗中觀察到的結果預期。
此外,臨牀試驗的性質是利用潛在患者人羣的樣本。由於患者數量有限,暴露持續時間有限,我們候選產品的罕見和嚴重副作用只有在暴露於候選藥物的患者數量顯著增加時才可能被發現。如果我們的候選產品獲得上市批准,並且我們或其他人在批准後發現該候選產品(或任何其他類似藥物)引起的不良副作用,則可能會導致許多潛在的重大負面後果,包括:
•監管部門可以撤回或限制對這類產品候選產品的批准;
•監管當局可能要求添加標籤聲明,如“方框”警告或禁忌症;
•我們可能會被要求改變這些候選產品的分配或管理方式,進行額外的臨牀試驗或改變候選產品的標籤;
•監管當局可能要求制定REMS計劃以降低風險,其中可能包括用藥指南、醫生溝通計劃或確保安全使用的要素,如受限分配方法、患者登記和其他風險最小化工具;
•我們可能會受到監管調查和政府執法行動的影響;
•我們可能會決定從市場上刪除此類候選產品;
•我們可能會被起訴,並對接觸或服用我們的候選產品的個人造成的傷害承擔責任;以及
•我們的聲譽可能會受損。
我們認為,任何該等事件可能會阻礙我們實現或維持市場對受影響候選產品的接受度,並可能大幅增加候選產品的商業化成本(如獲得批准),並嚴重影響我們成功商業化候選產品和產生收入的能力。
臨牀開發涉及一個漫長而昂貴的過程,結果不確定,早期研究和試驗的結果可能無法預測未來的臨牀試驗結果。我們可能會在臨牀試驗中遇到重大延誤,或者可能無法在預期時間表上進行或完成臨牀試驗(如果有的話)。如果我們的臨牀前研究和臨牀試驗不足以支持我們任何候選產品的監管批准,我們可能會產生額外成本或延遲完成或最終無法完成該候選產品的開發。
我們所有的主要候選產品都處於早期臨牀開發或臨牀前開發階段,其失敗風險很高。無法預測我們的候選產品何時或是否會在人體內證明有效和安全,或獲得監管部門的批准。在從監管機構獲得任何候選藥物的上市批准之前,我們必須完成臨牀前研究,然後進行廣泛的臨牀試驗,以證明我們的候選產品在人體中的安全性和有效性。一個或多個臨牀試驗的失敗可能發生在任何測試階段。臨牀前開發測試和早期臨牀試驗的結果可能無法預測後期臨牀試驗的成功,臨牀試驗的中期結果不一定能預測最終結果。此外,臨牀前和臨牀數據往往容易受到不同的解釋和分析,許多公司認為其候選產品在臨牀前研究和臨牀試驗中表現令人滿意,但未能獲得其候選產品的上市批准。我們的臨牀前研究和未來的臨牀試驗可能不會成功。
我們不能確定我們的臨牀前研究和臨牀試驗結果是否足以支持我們候選產品的監管批准。臨牀測試是昂貴的,可能需要多年的時間才能完成,其結果本質上是不確定的。人體臨牀試驗昂貴,設計和實施困難,部分原因是它們受到嚴格的監管要求。臨牀試驗過程中的任何時候都可能發生失敗或延遲。
此外,我們進行的一些臨牀試驗在研究設計上可能是開放標籤的,並且可能在有限數量的臨牀中心對有限數量的患者進行。“開放標籤”臨牀試驗是指患者和研究者都知道患者是否正在接受候選試驗藥物或現有獲批藥物或安慰劑的臨牀試驗。最典型的是,開放標籤臨牀試驗只檢測候選研究藥物,有時可能在不同的劑量水平下進行。開放標籤臨牀試驗受各種限制,可能會誇大任何治療效果,因為開放標籤臨牀試驗中的患者在接受治療時都知道。開放標籤臨牀試驗可能會受到“患者偏見”的影響,患者認為他們的症狀已經改善,只是因為他們意識到接受實驗性治療。此外,早期臨牀研究的患者往往包括最嚴重的患者,儘管採用了新的治療方法,他們的症狀可能會有所改善。此外,開放標籤臨牀試驗可能會受到"研究者偏倚"的影響,即那些評估和審查臨牀試驗的生理結局的人知道哪些患者接受了治療,並可能更有利地解釋治療組的信息。鑑於我們在EGFRm NSCLC患者中進行的BDTX—1535 II期臨牀試驗和BDTX—4933 I期臨牀試驗包括開放標籤給藥設計,當在對照環境中使用安慰劑或活性對照進行研究時,這些臨牀試驗的結果可能無法預測這些或其他候選產品的未來臨牀試驗結果。
我們可能會在獲得FDA授權以啟動未來IND下的臨牀試驗、完成正在進行的其他候選產品的臨牀前研究以及啟動我們計劃的臨牀前研究和臨牀試驗方面遇到延誤。此外,我們無法確定候選產品的臨牀前研究或臨牀試驗是否會按時開始,不需要重新設計,按時入組足夠數量的受試者,或如期完成。
臨牀試驗可能會因各種原因而延遲或終止,包括與以下相關的延遲或失敗:
•FDA或類似的外國監管機構對我們臨牀試驗的設計或實施持不同意見;
•FDA或類似的外國監管機構不同意我們的臨牀開發策略;
•延遲獲得監管機構批准以開始臨牀試驗;
•與未來的CRO和臨牀試驗地點就可接受的條款達成協議,這些條款可以進行廣泛的談判,不同的CRO和臨牀試驗地點的條款可能會有很大差異;
•在每個臨牀試驗中心獲得IRB批准;
•招募足夠數量的合適患者參加臨牀試驗;
•我們候選產品的臨牀試驗所需的患者數量可能比我們預期的要多;
•受試者完成臨牀試驗或返回接受治療後隨訪;
•臨牀試驗地點偏離臨牀試驗方案或者退出臨牀試驗的;
•解決臨牀試驗過程中出現的受試者安全問題;
•增加足夠數量的臨牀試驗地點;或
•從第三方供應商處獲得足夠的候選產品供應,用於臨牀前研究或臨牀試驗。
我們可能會在臨牀前研究和臨牀試驗過程中或由於這些研究和臨牀試驗而發生許多不良或不可預見的事件,這些事件可能會延遲或阻止我們獲得上市批准或將候選產品商業化的能力,包括:
•我們可能會收到監管部門的反饋,要求我們修改臨牀試驗的設計;
•我們的候選產品的臨牀試驗可能會產生負面或不確定的結果,我們可能會決定或監管機構可能會要求我們進行額外的臨牀試驗或放棄我們對其他候選產品的研究工作;
•我們候選產品的臨牀試驗可能不會在腫瘤類型或適應症中產生差異或臨牀顯著的結果;
•我們候選產品臨牀試驗所需患者數量可能比我們預期的多,這些臨牀試驗的入組速度可能比我們預期的慢,或者參與者可能比我們預期的高退出臨牀試驗的比率;
•我們的第三方承包商可能未能遵守監管要求,未能保持足夠的質量控制,或無法為我們提供足夠的產品供應,以及時或根本無法進行和完成候選產品的臨牀前研究或臨牀試驗;
•我們或我們的研究人員可能因各種原因而不得不暫停或終止我們候選產品的臨牀試驗,包括不符合監管要求、發現我們候選產品具有不良副作用或其他非預期特徵或發現參與者暴露於不可接受的健康風險;
•我們候選產品的臨牀試驗成本可能高於我們的預期,例如,如果我們在識別具有臨牀試驗所需突變的患者方面遇到延誤或挑戰,我們可能不得不向研究中心報銷基因測序成本,以鼓勵對更多患者進行測序;
•我們的候選產品或進行候選產品臨牀前研究或臨牀試驗所需的其他材料的質量可能不足或不充分,並且任何生產活動的轉移可能需要不可預見的生產或配方變更;
•監管機構可能會修改批准我們的候選產品的要求,或者這些要求可能與我們預期的不同;以及
•未來的合作者可能會以他們認為對他們有利但對我們不利的方式進行臨牀試驗。
如果我們被要求或選擇對我們的候選產品進行額外的臨牀試驗或其他測試,如果我們無法成功完成候選產品的臨牀試驗或其他測試,如果這些試驗或測試的結果不呈陽性或僅為中度陽性,或如果存在安全性問題,我們的業務及經營業績可能會受到不利影響,我們可能會產生重大額外成本。
如果臨牀試驗被我們、正在進行此類臨牀試驗的機構的IRB、數據安全監測委員會(如有)或FDA或其他監管機構暫停或終止,我們也可能遇到延誤。此類監管機構可能會因多種因素而暫停或終止臨牀試驗,包括未能按照監管要求或我們的臨牀試驗方案進行臨牀試驗、FDA或其他監管機構對臨牀試驗操作或試驗地點的檢查導致臨牀暫停、不可預見的安全問題或不良副作用,未能證明候選產品的受益,政府法規或行政措施的變化,或缺乏足夠的資金繼續臨牀試驗。
此外,我們未來臨牀試驗的主要研究者可能會不時擔任我們的科學顧問或顧問,並就這些服務獲得報酬。在某些情況下,我們可能需要向FDA或類似的外國監管機構報告其中的一些關係。FDA或類似的外國監管機構可能會得出結論,認為我們與主要研究者之間的財務關係已產生利益衝突或以其他方式影響研究的解釋。因此,FDA或類似的外國監管機構可能會質疑在適用的臨牀試驗中心生成的數據的完整性,並且可能危及臨牀試驗本身的效用。這可能導致FDA或類似的外國監管機構(視情況而定)推遲批准或拒絕我們的上市申請,並可能最終導致我們的一個或多個候選產品的上市批准被拒絕。
如果我們在完成或終止候選產品的任何臨牀前研究或臨牀試驗方面出現延誤,候選產品的商業前景可能會受到損害,我們從任何候選產品中產生收入的能力將被延遲或根本無法實現。此外,完成臨牀前研究或臨牀試驗的任何延誤都可能增加我們的成本,減慢我們的候選產品開發和批准過程,並危及我們開始產品銷售和產生收入的能力。任何此類事件都可能嚴重損害我們的業務、財務狀況和前景。此外,許多導致或導致臨牀試驗開始或完成延遲的因素也可能最終導致我們候選產品得不到監管批准。如果我們的一個或多個候選產品通常被證明無效、不安全或商業上不可行,我們的整個管道和MAP藥物開發引擎可能沒有什麼價值(如果有的話),這將對我們的業務、財務狀況、經營業績和前景產生重大不利影響。
我們正在美國以外的候選產品進行臨牀試驗,FDA和類似的外國監管機構可能不接受此類試驗的數據。
我們正在美國以外的地區為我們的候選產品進行臨牀試驗。FDA或類似的外國監管機構接受在美國或其他司法管轄區以外進行的臨牀試驗的研究數據可能受到某些條件的限制,也可能根本不接受。如果外國臨牀試驗的數據擬用作在美國上市批准的依據,FDA通常不會僅基於外國數據批准申請,除非(i)數據適用於美國人羣和美國醫療實踐;(ii)試驗由具有公認能力的臨牀研究者執行,並符合GCP法規。此外,必須滿足FDA的臨牀試驗要求,包括足夠的患者人羣規模和統計功效。許多外國監管機構也有類似的審批要求。此外,此類外國審判將受進行審判的外國司法管轄區的適用當地法律的約束。無法保證FDA或任何類似的外國監管機構將接受來自美國或適用司法管轄區以外進行的試驗的數據。如果FDA或任何類似的外國監管機構不接受這些數據,將導致需要進行額外的試驗,這可能是昂貴和耗時的,並可能導致我們可能開發的候選產品在適用的司法管轄區無法獲得商業化批准。
與我們的方法有關的風險
我們專注於為患有基因定義癌症的患者開發精準藥物,這是一個快速發展的科學領域,我們已經採取的發現和正在採取的開發藥物的方法是新穎的,可能永遠不會導致適銷對路的產品。
為基因定義的癌症患者發現和開發精準藥物是一個新興領域,而構成我們發現和開發候選產品基礎的科學發現相對較新。支持基於這些發現開發候選產品的可行性的科學證據是初步的和有限的。雖然我們認為,基於我們的臨牀前工作,我們的計劃靶向突變是致癌的驅動因素,但臨牀結果可能無法證實這一假設,或可能僅證實某些突變或某些腫瘤類型。我們候選產品的患者人羣僅限於那些具有特定靶點突變的患者,可能無法完全定義,但遠遠小於一般治療的癌症人羣,我們將需要篩選和識別這些具有靶點突變的患者。患者的成功識別取決於幾個因素,包括確定特定的基因改變如何響應我們的候選產品,並開發伴隨診斷來識別此類基因改變。此外,即使我們成功識別患者,我們也不能確定每個突變產生的患者羣體是否足夠大,以使我們能夠成功獲得每個突變類型的批准,並將我們的產品商業化並實現盈利。此外,即使我們的方法成功地顯示出對攜帶我們當前臨牀試驗中靶向突變的腫瘤的臨牀益處,我們可能永遠不會成功地識別出其他受體酪氨酸激酶的其他致癌突變。因此,我們不知道我們治療基因定義癌症患者的方法是否會成功,如果我們的方法不成功,我們的業務將受到影響。
我們開發候選產品的方法未經證實,我們可能無法成功開發具有商業價值的候選產品。
我們戰略的一個關鍵要素是使用我們的MAP藥物發現引擎來建立一個候選產品管道,並通過臨牀開發來發展這些候選產品,以治療各種癌症。雖然我們迄今為止的研發努力已經導致我們發現和開發了BDTX—1535和BDTX—4933,但這些臨牀階段的候選藥物作為癌症治療可能不安全或有效,我們可能無法開發任何其他候選藥物。我們的MAP藥物發現引擎在未來可能無法支持我們候選產品管道的持續擴展。我們的候選產品和潛在的未來候選產品可能不適合進一步的臨牀開發或生成可接受的臨牀數據,包括由於被證明具有不可接受的毒性或其他特性,表明它們不太可能成為獲得FDA或其他監管機構上市批准或獲得市場認可的產品。倘我們未能成功開發及商業化候選產品,未來將無法產生產品收益,這可能會對我們的財務狀況造成重大損害,並對我們的股價造成不利影響。
我們候選產品的市場機會可能相對較小,僅限於那些不合格或既往治療失敗的患者,我們對目標患者人羣患病率的估計可能不準確。
癌症療法有時被描述為一線、二線或三線,FDA通常最初僅批准用於特定用途的新療法。當癌症被發現足夠早,一線治療有時足以治癒癌症或延長生命而不治癒。當一線治療,通常是化療,抗體藥物,腫瘤靶向小分子,激素治療,放療,手術,或這些的組合,證明不成功時,可以給予二線治療。二線治療通常包括更多的化療,放療,抗體藥物,腫瘤靶向小分子,或它們的組合。三線治療可以包括化療、抗體藥物和小分子腫瘤靶向治療、更具侵入性的手術形式和新技術。我們希望最初尋求批准我們的候選產品,在大多數情況下至少作為二線或三線治療,用於複發性或難治性轉移性癌症患者。隨後,對於那些被證明足夠安全和有益的候選產品(如有),我們希望尋求批准作為二線治療和潛在的一線治療,但不能保證我們的候選產品,即使被批准作為二線或三線或後續治療,將被批准用於更早的治療線,並且,在任何此類批准之前,我們可能要進行更多的臨牀試驗。
我們對患有我們靶向癌症的人數、可能對其腫瘤進行了基因測序的人數、以及患有這些癌症的人羣中有可能接受特定治療線並且有可能從我們候選產品的治療中受益的人數的預測都是基於我們的信念和估計的。這些估計數來自各種來源,包括科學文獻、診所調查、患者基金會或市場研究,可能被證明是不正確的。此外,新療法可能會改變我們所針對的癌症的估計發病率或流行率。因此,即使我們的候選產品獲批用於二線或三線治療,可能有資格接受我們候選產品治療的患者數量可能會遠低於預期。
與全球事件有關的風險
商業、經濟或地緣政治中斷或全球健康問題可能嚴重損害我們的發展努力,並增加我們的成本和開支。
廣泛的業務、經濟或地緣政治中斷或全球健康問題可能會對我們正在進行或計劃中的研發活動造成不利影響。任何此類中斷或擔憂都可能影響廣泛的利益相關者,包括我們的目標患者人羣、我們進行任何臨牀試驗的醫院和臨牀研究中心、與我們接觸的第三方(包括我們的CRO)、供應商和監管機構。此類影響可能會對我們按照目前計劃的方式或時間表開展業務的能力產生重大負面影響,導致臨牀試驗的入組、候選產品的生產和供應、實驗和研究的進行以及其他中斷,以及我們能夠收集的數據的質量、完整性和可解釋性受到潛在限制。例如,如果我們在中國的原料藥和製劑第三方生產商的運營受到負面影響,可能會導致我們候選產品的供應以及實驗和研究的進行延遲或中斷。對患者入組或治療、臨牀前研究或臨牀試驗的時間和執行的任何負面影響都可能導致我們的開發項目成本高昂的延誤,這可能對我們獲得監管部門批准和將候選產品商業化的能力產生不利影響,增加我們的運營開支,並對我們的業務和財務業績產生重大不利影響。
我們或我們所依賴的第三方可能會受到自然災害及╱或全球健康流行病的不利影響,我們的業務、財務狀況及經營業績可能會受到不利影響。
不可預見或災難性事件的發生,包括極端天氣事件及其他自然災害、人為災害或流行病的出現,視乎其規模而定,可能對國家和地方經濟造成不同程度的損害,並可能導致我們的業務中斷,並對我們的財務狀況和經營業績造成重大不利影響。人為災害、流行病和其他與我們活動所在地區有關的事件也可能產生類似的影響。如果發生自然災害、健康流行病或其他超出我們控制範圍的事件,導致我們無法使用全部或大部分辦公室及╱或實驗室空間,損壞關鍵基礎設施(例如我們的製造設施或我們的第三方合約製造商的製造設施),或以其他方式中斷運營,則我們可能難以在相當長的一段時間內繼續開展業務。
與製造和供應有關的風險
製造我們的候選產品是複雜的,我們可能會在生產中遇到困難。我們將依賴第三方生產臨牀前和臨牀產品供應,如果獲得批准,我們可能會依賴第三方生產和加工我們的候選產品。如果我們遇到這些困難,我們為臨牀前研究和臨牀試驗或商業目的提供候選產品的能力可能會被推遲或停止。
我們候選產品的製造過程複雜且嚴格監管。我們目前沒有擁有任何可能用作臨牀規模生產設施的設施,並依賴外部供應商生產我們候選產品的供應品。我們將需要與該等外部供應商就供應我們的候選產品進行磋商並維持合約安排,但我們可能無法以優惠條款這樣做。我們尚未促使任何候選產品以商業規模生產。我們的合同製造商可能會將他們自己的專有工藝納入我們的候選產品製造工藝中。我們對第三方合同製造商的專有流程的控制和監督有限,第三方合同製造商可以在未經我們同意或知情的情況下選擇修改其流程。這些修改可能會對我們的生產產生負面影響,包括需要額外生產運行或更換製造商的產品損失或故障,這兩種情況都可能顯著增加候選產品的成本並顯著延遲其生產。
隨着我們的候選產品通過臨牀前研究和臨牀試驗向批准和商業化邁進,預計生產工藝的各個方面將有所改變,以努力優化工藝和結果。該等變更可能需要對監管申請進行修訂,這可能進一步延遲我們任何候選產品使用經修訂的生產工藝的時間框架,並可能需要進行額外的橋接研究或試驗。
我們的合同製造商用於生產我們候選產品的設施必須在我們向FDA或其他外國監管機構提交申請後進行的檢查後獲得FDA或其他外國監管機構的批准。我們可能無法控制生產過程,並可能完全依賴我們的合同生產合作夥伴,以符合FDA或其他監管機構對我們候選產品生產的任何其他監管要求。除了定期審核外,我們無法控制我們的合同製造商維持足夠的質量控制、質量保證和合格人員的能力。如果FDA或類似的外國監管機構不批准這些設施用於生產我們的候選產品,或者如果它在未來撤回任何批准,我們可能需要尋找替代生產設施,這將需要產生大量額外成本,並嚴重影響我們開發、獲得監管批准或營銷我們的候選產品(如果獲得批准)的能力。同樣,倘我們依賴的任何第三方製造商未能以足以滿足監管要求的質量水平及足以滿足預期需求的規模以使我們能夠實現盈利的成本生產大量候選產品,則我們的業務、財務狀況及前景可能受到重大不利影響。
如果與我們簽訂合同的任何合同製造商未能履行其義務,我們可能被迫自行生產材料,我們可能沒有能力或資源,或與不同的合同製造商簽訂協議,我們可能無法在合理的條件下這樣做。在任何一種情況下,我們的臨牀試驗供應都可能被顯著推遲,因為我們建立了替代供應來源。在某些情況下,製造我們的產品或候選產品所需的技術技能可能是原始合同製造商獨有的或專有的,我們可能會遇到困難,或者可能有合同限制禁止我們將這些技能轉讓給後備或替代供應商,或者我們可能根本無法轉讓這些技能。此外,如果我們因任何原因需要更換合同製造商,我們將被要求核實新合同製造商維護的設施和程序符合質量標準和所有適用法規。我們還需要驗證,例如通過生產可比性研究,任何新的生產工藝都將根據之前提交給FDA或其他監管機構的質量標準生產我們的候選產品。我們可能無法證明臨牀供應品的可比性,這可能需要進行額外的臨牀試驗。與驗證新合同製造商相關的延遲可能會對我們及時或在預算內開發候選產品或將產品商業化的能力產生負面影響。
與銷售、營銷和競爭有關的風險
我們目前沒有市場營銷和銷售組織,也沒有產品營銷經驗。如果我們無法建立市場營銷和銷售能力,或與第三方達成協議以營銷和銷售我們的候選產品,如果獲得批准,我們可能無法產生產品收入。
我們目前沒有銷售、營銷或分銷能力,也沒有產品營銷經驗。我們打算髮展內部營銷組織和銷售隊伍,這將需要大量的資本開支、管理資源和時間。我們將不得不與其他製藥和生物技術公司競爭,招聘、僱用、培訓和留住市場和銷售人員。
如果我們無法或決定不建立內部銷售、營銷和分銷能力,我們將尋求與第三方銷售、營銷和分銷合作者就我們產品的銷售和營銷達成協議(如果獲得批准)。然而,我們無法保證我們將能夠以有利的條款建立或維持該等安排,或如果我們能夠這樣做,該等第三方安排將提供有效的銷售力量或營銷和分銷能力。我們獲得的任何收入將取決於該等第三方的努力,但這可能不會成功。我們可能對該等第三方的營銷及銷售工作幾乎或根本沒有控制權,而我們的產品銷售收入可能低於我們自己將候選產品商業化的情況。我們在尋找第三方協助我們進行候選產品的銷售和營銷工作方面也面臨競爭。
不能保證我們能夠發展內部銷售和分銷能力,或與第三方合作伙伴建立或保持關係,以便在美國或海外將任何產品商業化。
與在國際上推廣我們的候選產品有關的各種風險可能會對我們的業務造成重大不利影響。
我們計劃尋求美國以外的監管機構批准我們的候選產品,因此,我們預計,如果我們獲得必要的批准,我們將面臨與在外國運營相關的額外風險,包括:
•外國的監管要求不同,例如,除美國外,沒有任何國家有加速藥物批准的途徑,因此在美國以外獲得監管批准將比在美國獲得批准花費更長的時間和更高的成本;
•關税、貿易壁壘、價格和外匯管制等監管要求的意外變化;
•經濟疲軟,包括通貨膨脹,或特別是外國經濟體和市場的政治不穩定;
•在國外居住或旅行的員工遵守税收、就業、移民和勞動法;
•外國税,包括預扣工資税;
•外匯波動,這可能導致經營費用增加和收入減少,以及在另一國開展業務所附帶的其他義務;
•海外業務人員配備和管理困難;
•在勞工騷亂比美國更普遍的國家,勞動力的不確定性;
•根據1977年《反海外腐敗法》或類似的外國法規可能承擔的責任;
•挑戰執行我們的合同和知識產權,特別是在那些不像美國那樣尊重和保護知識產權的外國;
•因任何影響國外原材料供應或製造能力的事件而造成的生產短缺;以及
•包括戰爭和恐怖主義在內的地緣政治行動造成的商業中斷。
這些風險以及與國際業務相關的其他風險可能會對我們實現或維持盈利業務的能力產生重大不利影響。
我們可能會花費有限的資源來追求特定的候選產品或適應症,而無法利用可能更有利可圖或成功可能性更大的候選產品或適應症。
由於我們的財務和管理資源有限,我們必須專注於有限數量的研究項目和候選產品以及特定的適應症。因此,我們可能會放棄或推遲尋找其他候選產品或後來被證明具有更大商業潛力的其他跡象的機會。我們的資源分配決策可能會導致我們無法利用可行的商業產品或有利可圖的市場機會。我們在當前和未來的發現和臨牀前開發計劃以及特定適應症的候選產品上的支出可能不會產生任何商業上可行的產品。
即使我們的候選產品獲得監管部門的批准,這些產品也可能無法獲得醫生、患者、醫院、癌症治療中心和醫學界其他人的市場接受。
使用精確藥物作為潛在的癌症治療是最近的發展,可能不會被醫生、患者、醫院、癌症治療中心和醫學界的其他人廣泛接受。影響我們的候選產品是否被市場接受的因素有很多,包括:
•我們的候選產品獲得許可的臨牀適應症;
•醫生、醫院、癌症治療中心和患者認為我們的產品候選是安全有效的治療方法;
•我們的候選產品相對於替代療法的潛在和可感知的優勢;
•我們有能力展示我們的候選產品相對於其他抗癌藥物的優勢;
•任何副作用的流行率和嚴重程度;
•其他精準藥物副作用的發生率和嚴重程度,以及公眾對其他精準藥物的看法;
•FDA或其他監管機構的產品標籤或產品插入要求;
•FDA批准的標籤中包含的限制或警告;
•我們的候選產品和競爭產品的上市時機;
•與替代治療相關的治療費用;
•第三方付款人和政府當局提供足夠的保險、補償和定價;
•在第三方付款人和政府當局沒有保險的情況下,患者願意自付費用;
•相對方便和易於管理,包括與替代療法和競爭性療法相比;以及
•我們的銷售和營銷努力的有效性。
如果我們的候選產品獲得許可,但未能獲得醫生、患者、醫院、癌症治療中心或醫療界其他人的市場認可,我們將無法產生可觀的收入。
此外,儘管我們的候選產品與其他精準醫學方法在某些方面有所不同,但在涉及精準醫學的其他臨牀試驗中發生的嚴重不良事件或死亡事件,即使最終並非歸因於我們的產品或候選產品,也可能導致政府監管增加、不利的公眾認知和宣傳、我們候選產品的測試或許可的潛在監管延遲,對獲得許可的候選產品的標籤要求更嚴格,對任何候選產品的需求減少。
即使我們的產品獲得市場認可,但如果引入的新產品或技術比我們的產品更受歡迎、更具成本效益或使我們的產品過時,我們可能無法長期保持市場認可。
我們面臨着激烈的競爭,這可能會導致其他人比我們更成功地發現、開發或商業化產品。
生物技術和製藥業利用迅速發展的技術,具有激烈競爭的特點。雖然我們相信我們的科學知識、平臺技術和開發專業知識為我們提供了競爭優勢,但我們面臨着來自許多不同來源的潛在競爭,包括主要製藥、特種製藥和生物技術公司、學術機構和政府機構,以及進行研究、開發、製造和商業化的公共和私人研究機構。我們的許多競爭對手在研發、製造、臨牀前測試、監管批准和產品營銷方面擁有比我們更多的財政資源和專業知識。我們的競爭對手可能會在招聘和留住合格的科學和管理人員、建立臨牀試驗中心和臨牀試驗患者登記以及獲取補充或必要的技術方面與我們競爭。因此,我們的競爭對手可能會比我們更成功地發現、開發、授權或商業化產品。
我們成功開發和商業化的候選產品將與現有療法和未來可能出現的新療法競爭。特別是對於BDTX—1535,我們預計競爭主要在EGFRm NSCLC和GBM患者人羣中,包括:amivantamab或Rybrevant ®和lazertinib的聯合用藥,前者由Janssen Biotech,Inc.上市,後者由Janssen Biotech,Inc.開發;默克公司正在開發的patritumab deruxtecan,Inc.和Daiichi Sankyo Co.;德魯替康(datopotamab deruxtecan),由阿斯利康(AstraZeneca)和第一株式會社(Daiichi Sankyo Co.)開發;BBT—207,由Bridge Biotherapeutics公司開發;JIN—A02,由J Ints Bio、阿法替尼或Gilotrif ®開發(Boehringer Ingelheim International GmbH),並獲批作為具有S768I、L861Q和/或G719X突變的NSCLC患者的一線治療;奧希替尼或Tagrisso ®(阿斯利康公司),可為具有外顯子18突變的NSCLC患者處方標籤外;furmonertinib,由Arrivent Biocyma和上海Allist Pharmaceuticals開發,ERAS—801,由Erasca,Inc.開發;WSD—0922—FU,由Wayshine Biopharm International Ltd.開發;和TAS—2940,由Taiho Oncology,Inc.開發。
對於BDTX—4933,我們預計競爭主要在BRAF II/III類突變和其他RAS突變患者人羣中,包括:Day One BiopharmPharmaceuticals,Inc.;Jazz Pharmaceuticals plc;Erasca,Inc.;Mirati Therapeutics公司;江蘇恆瑞醫藥股份有限公司;Fore Biotherapeutics Inc.;Incyte Corporation和Astellas Pharmaceuticals。
如果我們的候選藥物(包括BDTX—1535和BDTX—4933)被批准用於我們目前計劃進行臨牀試驗的適應症,它們可能會與上述競爭藥物以及目前正在開發的其他藥物競爭。會影響我們與其他治療藥物有效競爭能力的關鍵產品特徵包括我們產品的有效性、安全性和便利性。我們的競爭對手可能會獲得專利保護或其他知識產權,從而限制我們開發或商業化候選產品的能力。政府和其他第三方支付者的補償也將顯著影響我們產品的定價和競爭力。我們的競爭對手也可能更快地獲得FDA或其他監管機構的批准,這可能會導致我們的競爭對手在我們能夠進入市場之前建立強大的市場地位。有關我們競爭的更多信息,請參閲“業務競爭”。
與我們的財務狀況和資本要求有關的風險
與過去財務狀況有關的風險
我們有限的經營歷史可能會使您難以評估我們業務迄今的成功程度,也難以評估我們未來的生存能力。
我們是一家生物技術公司,經營歷史有限。我們於2014年12月開始運營,到目前為止,我們的運營僅限於組織和人員配備我們的公司、業務規劃、籌集資金、開展發現和研究活動、提交專利申請、識別潛在候選產品、開展臨牀前研究以及與第三方就我們候選產品和組件材料的初始數量的生產建立安排。我們的大多數候選產品仍處於早期臨牀或臨牀前開發階段。我們尚未證明我們有能力成功進行或完成任何臨牀試驗、獲得上市批准、生產商業規模產品或安排第三方代表我們這樣做,或進行成功產品商業化所需的銷售、營銷和分銷活動。因此,您對我們未來的成功或可行性所做的任何預測可能不像我們有更長的運營歷史時那樣準確。
此外,作為一個年輕的企業,我們可能會遇到不可預見的費用,困難,併發症,延誤和其他已知和未知的因素。我們需要在某個時候從一個專注於研發的公司過渡到一個能夠支持商業活動的公司。我們在這樣的過渡中可能不會成功。
我們自成立以來已產生重大虧損,我們預計未來數年將產生虧損,未來可能無法實現或維持收入或盈利能力。
生物製藥產品開發的投資是一項高度投機性的事業,需要大量的前期資本支出和重大風險,即任何潛在的候選產品將無法證明足夠的療效或可接受的安全性,獲得監管部門的批准併成為商業可行性。我們仍處於候選產品開發的早期階段。我們最先進的候選產品BDTX—1535目前僅處於II期臨牀試驗階段。我們並無獲批准作商業銷售的產品,迄今為止亦無任何產品銷售收入,我們繼續產生與持續經營有關的重大研發及其他開支。
自2014年12月開始營運以來,我們於各期間均錄得重大淨虧損。截至2023年及2022年12月31日止年度,我們分別錄得淨虧損8240萬美元及9120萬美元。截至2023年12月31日,我們的累計赤字為4.174億美元。我們預期在可預見的將來將繼續產生重大虧損,而我們預期,如果我們:
•根據我們的突變—藥理學(MAP)藥物發現引擎,為我們當前和未來的候選產品進行臨牀前研究和臨牀試驗;
•為任何成功完成臨牀試驗的候選產品尋求市場批准;
•遇到上述任何一項的任何延誤或遇到任何問題,包括但不限於研究失敗、結果複雜、安全問題或其他監管挑戰;
•建立銷售、營銷和分銷基礎設施以及擴大製造能力,無論是單獨還是與第三方合作,將我們可能獲得監管部門批准的任何候選產品商業化;
•獲取、擴大、維護、執行和保護我們的知識產權組合;
•聘用更多的臨牀、監管和其他科學人員;以及
•作為一家上市公司運營。
由於與藥品開發相關的眾多風險和不確定性,我們無法準確預測我們將承擔的費用增加的時間或金額,或何時(如果有的話)我們將能夠實現盈利。即使我們成功地將一個或多個候選產品商業化,我們將繼續承擔大量的研發和其他支出,以開發、尋求監管部門批准和銷售其他候選產品。我們可能會遇到不可預見的費用、困難、併發症、延誤及其他可能對我們業務造成不利影響的未知因素。我們未來淨虧損的規模將部分取決於我們未來開支的增長率以及我們創造收入的能力。我們的過往虧損及預期未來虧損已經並將繼續對我們的股東權益及營運資金產生不利影響。
我們沒有從我們的候選產品中產生任何收入,可能永遠不會盈利。
我們盈利的能力取決於我們創造收入的能力。迄今為止,我們尚未從任何候選產品中產生任何收入。除非或直至我們成功完成臨牀開發,並獲得監管部門批准,併成功商業化,至少我們的一個候選產品,否則我們預計不會產生重大收入。我們的大多數候選產品處於早期臨牀或臨牀前開發階段,需要額外的臨牀前研究、臨牀開發、監管審查和批准、大量投資、獲得足夠的商業生產能力和重大的營銷努力,才能從產品銷售中獲得任何收入。我們最先進的候選產品BDTX—1535目前僅處於II期臨牀試驗階段。我們產生收益的能力取決於多個因素,包括但不限於:
•及時完成我們的臨牀前研究和臨牀試驗,這可能比我們目前預期的要慢得多或成本更高,並將在很大程度上取決於第三方承包商的表現;
•FDA或類似的外國監管機構是否要求我們進行額外的臨牀試驗或其他研究,而不是計劃支持我們的候選產品或任何未來候選產品的批准和商業化;
•我們有能力證明我們的候選產品或任何未來候選產品的安全性、效價、純度、療效和可接受的受益風險,並使FDA和類似的外國監管機構滿意,以及這些監管機構對我們臨牀開發策略的接受(即,我們尋求批准的依據是生物標誌物,而不是特定的癌症適應症);
•我們的候選產品或未來候選產品(如果有的話)遇到的潛在副作用或其他安全問題的流行率、持續時間和嚴重程度;
•及時收到FDA和類似外國監管機構的必要上市批准;
•醫生、診所經營者和患者願意使用或採用我們的任何候選產品或未來的候選產品,而不是替代或更傳統的療法,如化療,以治療實體腫瘤;
•如果我們的候選產品獲得批准,相對於現有和未來的替代癌症療法和競爭產品和技術,我們的候選產品的實際和預期的可用性、成本、風險概況和副作用和有效性;
•我們的能力以及與我們簽訂合同的第三方為我們的候選產品或任何未來候選產品生產足夠的臨牀和商業供應品,在監管機構中保持良好信譽,並開發、驗證和維護符合cGMP的商業可行生產工藝;
•我們有能力成功地制定商業戰略,然後在美國和國際上將我們的候選產品或任何未來的候選產品商業化,無論是單獨還是與其他公司合作,在這些國家和地區獲得營銷、報銷、銷售和分銷批准;
•對我們的候選產品和任何未來候選產品的耐心需求,如果獲得批准;以及
•我們在候選產品或任何未來候選產品中建立和實施知識產權的能力。
上述許多因素超出了我們的控制範圍,可能導致我們經歷重大延誤或阻止我們獲得監管部門批准或將候選產品商業化。即使我們能夠商業化我們的候選產品,我們可能不會在產品銷售後很快實現盈利,如果有的話。倘我們無法透過銷售候選產品或任何未來候選產品產生足夠收益,則在沒有持續資金的情況下,我們可能無法繼續經營。
與未來財務狀況有關的風險
我們將需要大量額外資金。如果我們無法在需要時籌集資金,我們將被迫推遲、減少或取消我們的產品開發計劃或商業化努力。
我們預計,我們的開支將與我們正在進行的活動同步增加,特別是當我們繼續進行臨牀開發活動併為候選產品尋求上市批准時。此外,如果我們的任何候選產品獲得上市批准,我們預計將產生與產品銷售、營銷、製造和分銷相關的重大商業化開支。因此,我們將需要為我們的持續經營獲得大量額外資金。然而,我們根據可能被證明是錯誤的假設估計了我們目前的額外資金需求。此外,不斷變化的環境可能會導致我們消耗資本的速度比我們目前的預期要快得多,而且由於我們無法控制的情況,我們可能需要花費比目前預期更多的資金。例如,我們的普通股和其他生物製藥公司的交易價格一直高度波動。因此,我們可能會面對透過出售股本或債務證券籌集資本的困難,或有關出售可能會以不利的條款出售。同樣地,不利的市場或宏觀經濟狀況或由全球經濟發展、政治動盪、高通脹、利率上升、新型冠狀病毒後環境、未來公共衞生疫情或其他因素導致的市場波動,可能對我們以優惠條款完成股權或債務融資的能力造成重大不利影響,或根本不會影響。在此之前(如有的話),由於我們能夠產生可觀的產品收益,我們預期通過公開或私人股本發行、債務融資、政府融資、合作、戰略夥伴關係和聯盟或與第三方的營銷、分銷或授權安排的組合為我們的業務提供資金。如果我們無法在需要時或在有吸引力的條件下籌集資金,我們將被迫推遲、減少或取消我們的發現和臨牀前開發項目或任何未來的商業化努力。
截至2023年12月31日,我們擁有現金、現金等價物和投資1.314億美元。我們相信,根據我們目前的運營計劃,我們現有的資本資源將足以為我們的預期運營提供資金至二零二五年第二季度。我們未來的資本需求將取決於許多因素,包括:
•我們候選產品的發現、臨牀前開發和臨牀試驗的範圍、進展、結果和成本;
•我們就產品發現或獲取或授權產品或技術達成合作安排的程度;
•我們有能力以有利的條件建立合作,如果有的話;
•對我們的候選產品進行監管審查的成本、時間和結果;
•未來商業化活動的成本,包括產品銷售、營銷、製造和分銷,我們獲得上市批准的任何候選產品;
•如果我們的任何候選產品獲得上市批准,從我們候選產品的商業銷售中獲得的收入;以及
•準備、提交和起訴專利申請,獲取、維護、執行和保護我們的知識產權,以及為知識產權相關索賠辯護的費用。
識別潛在候選產品並進行臨牀前測試和臨牀試驗是一個耗時、昂貴且不確定的過程,需要數年才能完成,我們可能永遠無法生成獲得上市批准和實現產品銷售所需的必要數據或結果。此外,我們的候選產品,如果獲得批准,可能無法取得商業成功。我們的商業收入(如有的話)將來自銷售我們預計多年內不會上市的產品(如有的話)。因此,我們將需要繼續依賴額外融資以實現我們的業務目標。我們可能無法以可接受的條件或根本無法獲得足夠的額外融資。
與政府監管有關的風險
我們的發展工作還處於早期階段。我們的大多數候選產品仍處於早期臨牀開發階段。如果我們無法通過臨牀開發推進候選產品、獲得監管部門的批准並最終將候選產品商業化,或者在這樣做過程中遇到重大延誤,我們的業務將受到重大損害。
我們的開發工作處於非常早期的階段,我們的大多數候選產品仍處於早期臨牀或臨牀前開發階段。我們已經投入了幾乎所有的精力和財力來確定我們的候選產品和臨牀前開發,包括開發我們的臨牀階段候選產品BDTX-1535和BDTX-4933。我們創造產品收入的能力將取決於我們候選產品的成功開發、批准和最終商業化,而這可能永遠不會發生。我們預計這種情況在很多年內都不會發生。我們目前沒有任何產品的銷售收入,我們可能永遠無法開發或商業化適銷對路的產品。我們候選產品的成功將取決於以下幾個因素:
•圓滿完成臨牀前研究;
•批准IND用於我們計劃的臨牀試驗或未來的臨牀試驗;
•FDA接受我們的臨牀開發策略;
•成功登記參加當前和未來的臨牀試驗;
•當前或未來臨牀試驗的陽性結果,支持對預期患者羣體的安全性和有效性;
•成功開發與我們的某些候選產品配套使用的診斷程序;
•收到適用監管機構的監管批准;
•建立商業製造能力或與第三方製造商安排臨牀供應和商業製造;
•為我們的候選產品獲得並維護專利和商業祕密保護或法規排他性;
•如果我們的候選產品獲得批准,無論是單獨還是與其他公司合作,都可以開始商業銷售;
•如果患者、醫療界和第三方付款人批准,則接受產品候選;
•有效地與其他療法競爭;
•獲得並維持第三方保險覆蓋範圍和適當的補償;
•獲取、執行和捍衞知識產權和索賠;以及
•在批准後保持候選產品的持續可接受的安全性特徵。
如果我們不能及時或根本實現這些因素中的一個或多個,我們可能會遇到重大延誤或無法成功地將我們的候選產品商業化,這將對我們的業務造成嚴重損害。如果我們的候選產品得不到監管部門的批准,我們可能無法繼續運營。
如果我們不能為我們的候選產品獲得所需的監管批准,或者如果延遲獲得所需的監管批准,我們將無法將我們的候選產品商業化,或者將延遲將我們的候選產品商業化,我們的創收能力將受到嚴重損害.
我們的候選產品以及與其開發和商業化相關的活動,包括它們的設計、測試、製造、安全、功效、記錄保存、標籤、儲存、批准、廣告、促銷、銷售、分銷、進出口,都受到美國FDA和其他監管機構以及其他國家類似機構的全面監管。在我們可以將任何候選產品商業化之前,我們必須獲得市場批准。我們最先進的候選產品BDTX-1535目前僅處於針對EGFRm NSCLC患者的第二階段臨牀試驗,而BDTX-4933目前正在進行第一階段臨牀試驗。我們目前和未來的臨牀試驗結果是否足以獲得批准將是一個審查問題,FDA可能不會批准,並可能要求我們進行一項或多項受控、隨機的3期臨牀試驗以獲得批准。美國以外的監管機構在批准精確癌症藥物方面的經驗有限。
獲得監管批准還需要向相關監管機構提交有關藥物生產工藝的信息,並由相關監管機構檢查生產設施。此外,我們的候選產品可能無效,可能只有中等有效,或可能被證明具有不良或非預期的副作用,毒性或其他可能妨礙我們獲得上市批准或阻止或限制商業用途的特性。
無論是在美國還是國外,獲得監管批准的過程都是昂貴的,如果需要額外的臨牀試驗,如果獲得批准,可能需要花費很多年時間,並且可能會根據各種因素(包括所涉及的候選產品的類型、複雜性和新穎性)而有很大的差異。開發期間上市批准政策的變更、其他法規或法規的變更或頒佈,或每個提交的IND、NDA或等同申請類型的監管審查變更,都可能導致申請的批准或拒絕延遲。FDA和其他國家的類似機構在批准過程中有很大的自由裁量權,可能拒絕接受任何申請,或可能決定我們的數據不足以獲得批准,並需要進行額外的臨牀前、臨牀或其他研究。我們的候選產品可能因多種原因而延遲或未能獲得監管批准,包括以下原因:
•FDA或類似的外國監管機構可能不同意我們臨牀試驗的設計或實施;
•FDA或類似的外國監管機構可能不同意我們的臨牀開發策略;
•我們可能無法向FDA或類似的外國監管機構證明候選藥物對其擬定適應症是安全有效的,或者相關伴隨診斷適合於確定適當患者人羣;
•臨牀試驗結果可能不符合美國食品藥品監督管理局或類似的外國監管機構批准的統計意義水平;
•我們可能無法證明候選產品的臨牀和其他益處大於其安全風險;
•FDA或類似的外國監管機構可能不同意我們對臨牀前研究或臨牀試驗數據的解釋;
•從我們候選產品的臨牀試驗中收集的數據可能不足以支持提交保密協議或其他提交,或者不足以獲得美國或其他地方的監管批准;
•FDA或類似的外國監管機構可能無法批准與我們簽訂臨牀和商業用品合同的第三方製造商的製造工藝或設施;以及
•FDA或類似的外國監管機構的批准政策或法規可能會發生重大變化,導致我們的臨牀數據不足以獲得批准。
在大量正在開發的藥物中,只有一小部分成功地完成了FDA或外國監管機構的批准程序,並已商業化。漫長的審批過程以及未來臨牀試驗結果的不可預測性可能會導致我們無法獲得監管部門的批准來銷售我們的候選產品,這將嚴重損害我們的業務、運營結果和前景。
我們的臨牀試驗可能無法充分證明我們任何候選產品的安全性和有效性,這將阻礙或延遲監管部門的批准和商業化。
為了獲得上市和銷售我們的任何候選產品(包括BDTX—1535、BDTX—4933和任何其他未來候選產品)所需的監管批准,我們必須通過廣泛的臨牀前研究和臨牀試驗證明我們的產品在人體中是安全有效的。我們的候選產品可能無法證明在人類中的療效,特別是在腫瘤類型中。臨牀測試是昂貴的,可能需要多年的時間才能完成,其結果本質上是不確定的。臨牀試驗過程中的任何時候都可能發生失敗,我們未來的臨牀試驗結果可能不會成功。此外,獲得監管批准的過程是昂貴的,通常在臨牀試驗開始後需要多年時間,並且可能根據所涉及的候選產品的類型、複雜性和新穎性以及目標適應症、患者人羣和監管機構而有很大差異。在獲得美國或國外候選產品商業化批准之前,我們或我們的潛在未來合作者必須以充分和良好控制的臨牀試驗的實質性證據證明此類候選產品在其預期用途中是安全和有效的,並使FDA、EMA或其他類似的外國監管機構滿意。
我們進行的臨牀試驗可能無法證明獲得監管部門批准以上市候選產品所需的有效性和安全性。在某些情況下,由於許多因素,包括方案中規定的試驗程序的變更、患者人羣規模和類型的差異、臨牀試驗方案的變更和依從性以及臨牀試驗參與者的脱落率,同一候選產品的不同臨牀試驗之間的安全性或療效結果可能存在顯著差異。如果我們正在進行或未來的臨牀試驗的結果不能確定候選產品的療效,如果我們沒有達到具有統計學和臨牀意義的臨牀終點,或者如果我們的候選產品存在安全性問題,我們可能會延遲獲得上市批准(如果有的話)。
即使試驗成功完成,臨牀數據往往容易受到不同的解釋和分析,我們不能保證FDA、EMA或其他類似的外國監管機構會像我們一樣解釋結果,在我們提交候選產品批准之前,可能需要更多的試驗。我們不能保證FDA、EMA或其他類似的外國監管機構將認為我們的候選產品具有足夠的療效來支持目標適應症,即使在臨牀試驗中觀察到了陽性結果。如果試驗結果不符合FDA、EMA或其他類似的國外監管機構的要求,我們候選產品的批准可能會被顯著延遲,或者我們可能需要花費大量額外的資源(我們可能無法獲得)來進行額外的試驗,以支持我們候選產品的潛在批准。此外,在我們的臨牀試驗的任何腫瘤特異性亞組中觀察到的任何安全性或療效問題可能會限制我們的目標適應症候選產品的監管批准的前景,這可能會對我們的業務、財務狀況和運營結果產生重大不利影響。
我們未來可能會為BDTX-1535、BDTX-4933和我們未來的一些其他候選產品申請孤兒藥物地位,但我們可能無法獲得此類稱號或無法維持與孤兒藥物地位相關的好處,包括市場排他性,這可能會導致我們的收入減少(如果有的話)。
根據《孤兒藥品法》,FDA可以將用於治療罕見疾病或疾病的藥物或生物指定為孤兒,這種疾病或疾病的定義是,在美國,患者人數低於20萬人,或在美國患者人數超過20萬人的疾病或疾病,如果沒有合理的預期,在美國開發和提供該藥物或生物藥物的成本將從該藥物或生物藥物或生物的美國銷售中收回。在提交保密協議之前,必須申請指定孤兒藥物。在美國,指定孤兒藥物使一方有權獲得財政激勵,如為臨牀試驗費用、税收優惠和用户費用減免提供贈款資金的機會。在FDA批准孤兒藥物指定後,FDA公開披露該藥物的仿製藥身份及其潛在的孤兒用途。孤兒藥物的指定不會在監管審查和批准過程中傳遞任何優勢,也不會縮短監管審查和批准過程的持續時間。
如果一種具有孤兒藥物指定的產品隨後獲得了FDA對其具有這種指定的疾病的特定有效成分的第一次批准,該產品有權獲得孤兒產品排他性,這意味着FDA不得批准任何其他申請,包括NDA,在七年內銷售相同適應症的同一生物藥物,除非在有限的情況下,例如顯示出相對於具有孤兒藥物排他性的產品的臨牀優勢,或者FDA發現孤兒藥物排他性的持有者沒有證明它可以確保足夠數量的孤兒藥物的供應,以滿足患有該藥物的疾病或狀況的患者的需求。因此,即使我們的一個候選產品獲得了孤兒獨家專利,FDA仍然可以批准其他含有不同有效成分的藥物用於治療相同的適應症或疾病。此外,如果我們無法生產足夠的產品供應,FDA可以放棄孤兒排他性。
我們可能會為BDTX-1535、BDTX-4933以及我們未來的一些或所有其他候選產品尋求孤兒藥物名稱,在其他孤兒適應症中,這些產品的使用有醫學上可信的基礎。即使當我們獲得孤兒藥物指定時,如果我們尋求批准比孤兒指定適應症更廣泛的適應症,在美國的獨家營銷權可能會受到限制,並且如果FDA後來確定指定請求存在重大缺陷,或者如果製造商無法保證足夠數量的產品來滿足患有罕見疾病或疾病的患者的需求,則可能會失去獨家營銷權。此外,儘管我們打算為其他候選產品尋求孤兒藥物稱號,但我們可能永遠不會收到這樣的稱號。例如,FDA對適用於組織不可知性療法的孤兒藥物指定的監管考慮表示擔憂,FDA可能會以限制或阻止我們獲得孤兒藥物指定或孤兒藥物排他性(如果我們的候選產品獲得批准)作為我們的靶向適應症的能力的方式來解釋FD&C法案及其頒佈的法規。
2017年8月3日,國會通過了FDA 2017年重新授權法案,簡稱FDARA。除其他事項外,FDARA還編纂了FDA先前存在的監管解釋,要求藥品贊助商證明一種孤兒藥物的臨牀優越性,該藥物在其他方面與之前批准的治療同一罕見疾病的藥物相同,才能獲得孤兒藥物排他性。這項立法推翻了先前的先例,即《孤兒藥品法》明確要求FDA承認孤兒排他期,無論其臨牀優勢如何。此外,在2021年的《綜合撥款法案》中,國會沒有進一步改變這一解釋,因為它澄清了FDARA中編纂的解釋將適用於FDA在FDARA頒佈之前發佈孤兒指定但產品批准在FDARA頒佈之後的情況。FDA可能會進一步重新評估《孤兒藥物法》及其法規和政策。我們不知道FDA是否、何時或如何在未來改變孤兒藥物的法規和政策,也不確定任何變化可能如何影響我們的業務。根據FDA可能對其孤兒藥物法規和政策做出的變化,我們的業務可能會受到不利影響。
FDA指定的突破性療法,即使被授予我們的任何候選產品,也可能不會導致更快的開發或監管審查或批准過程,也不會增加我們的候選產品獲得上市批准的可能性。
我們可能會為BDTX-1535、BDTX-4933以及我們未來的部分或全部候選產品尋求突破性療法稱號。突破性療法被定義為一種藥物或生物製劑,旨在單獨或與一種或多種其他藥物或生物製品聯合治療嚴重或危及生命的疾病或狀況,初步臨牀證據表明,該藥物或生物製劑可能在一個或多個臨牀重要終點顯示出比現有療法顯著的改善,例如在臨牀開發早期觀察到的實質性治療效果。對於被指定為突破性療法的候選產品,FDA和試驗贊助商之間的互動和溝通可以幫助確定臨牀開發的最有效途徑,同時將無效控制方案中的患者數量降至最低。被FDA指定為突破性療法的藥物也可能有資格獲得其他快速批准計劃,包括加速批准。
指定為突破性療法是FDA的自由裁量權。因此,即使我們認為我們的候選產品之一符合被指定為突破性療法的標準,FDA也可能不同意,而是決定不做出這樣的指定。在任何情況下,與根據非快速FDA審查程序考慮批准的候選產品相比,收到候選產品的突破性治療指定可能不會導致更快的開發過程、審查或批准,也不能確保FDA的最終批准。此外,即使我們的一個或多個候選產品符合突破性療法的條件,FDA稍後也可能決定該產品不再符合資格條件。因此,即使我們可能尋求BDTX-1535、BDTX-4933以及我們未來用於治療各種癌症的部分或全部候選產品的突破性治療指定,也不能保證我們將獲得突破性治療指定。
FDA的快速通道指定可能不會導致更快的開發或監管審查或批准過程,也不會增加我們的候選產品獲得上市批准的可能性。
如果一種藥物用於治療嚴重或危及生命的疾病,並且該藥物顯示出解決這種疾病未得到滿足的醫療需求的潛力,藥物贊助商可以為特定的適應症申請FDA快速通道指定。BDTX-1535獲得了FDA的Fast Track指定,用於治療轉移性EGFRm C797S陽性、沒有T790M突變的非小細胞肺癌患者,這些患者的疾病在接受第三代EGFR TKI治療時/在治療後進展。對於其他適應症、BDTX-4933或我們未來的某些候選產品,我們可能會尋求BDTX-1535的快速通道指定,但不能保證FDA會將此地位授予我們任何其他建議的候選產品。根據FDA提供的政策和程序,Fast Track開發產品的贊助商提交的營銷申請可能有資格獲得優先審查,但Fast Track的指定並不保證任何此類資格或FDA的最終上市批准。FDA擁有廣泛的自由裁量權,是否授予快速通道認證,因此,即使我們認為特定的候選產品有資格獲得這種認證,也不能保證FDA會決定授予它。即使我們獲得了Fast Track認證,與傳統的FDA程序相比,我們可能不會經歷更快的開發過程、審查或批准,而且獲得Fast Track認證並不能保證FDA的最終批准。此外,如果FDA認為我們的臨牀開發項目的數據不再支持快速通道的指定,它可能會撤回該指定。此外,FDA可以隨時撤銷任何Fast Track的指定。
在適用的情況下,我們可以根據FDA的加速審批程序尋求我們的候選產品的批准。這一途徑可能不會帶來更快的開發、監管審查或審批過程,也不會增加我們的候選產品獲得上市批准的可能性。
我們可能會使用FDA的加速審批程序尋求對候選產品的批准。如果一種產品治療了嚴重或危及生命的疾病,並通常提供了比現有療法更有意義的優勢,那麼它可能有資格獲得加速批准。此外,它必須證明對替代終點的影響合理地可能預測臨牀益處。作為批准的一項條件,FDA可能要求獲得加速批准的藥物的贊助商進行充分和良好控制的上市後臨牀試驗。這些驗證性試驗必須以盡職調查的方式完成。根據FDORA,FDA被允許酌情要求在批准之前或在批准加速批准之日後的特定時間段內進行一項或多項批准後驗證性研究。FDORA還要求贊助商每180天向FDA發送此類研究的最新狀態,包括實現登記目標的進展,FDA必須迅速公開發布這些信息。FDORA還賦予FDA更大的權力,如果贊助商未能及時進行此類研究,將必要的更新發送給FDA,或者如果此類批准後的研究未能驗證藥物的預期臨牀益處,FDA可以迅速撤回對獲得加速批准的藥物或生物製劑的批准。根據FDORA,FDA有權採取行動,如對沒有進行盡職調查的公司進行任何批准後的驗證性研究或及時向該機構提交進展報告的公司開出罰款。此外,除非FDA另行通知,否則FDA目前要求對獲得加速批准的產品的促銷材料進行預先批准,這可能會對該產品的商業推出時間產生不利影響。因此,即使我們尋求使用加速審批途徑,我們也可能無法獲得加速審批,即使我們確實獲得了加速審批,我們也可能不會經歷更快的開發或監管審查或審批過程,並且獲得加速審批並不能保證最終獲得FDA的完全批准。
如果我們不能成功地驗證、開發和獲得監管機構對我們候選藥物的配套診斷測試的批准,或者在這樣做方面遇到重大延誤,我們可能無法實現這些候選藥物的全部商業潛力。
關於我們某些適應症的候選藥物的臨牀開發,我們打算聘請第三方開發或獲得 體外培養伴隨診斷測試,以確定某一疾病類別中的患者亞羣,誰可能從我們的候選藥物中獲得選擇性和有意義的益處。此類伴隨診斷將用於我們的臨牀試驗以及FDA對我們候選產品的批准。為了取得成功,我們或我們的合作者將需要解決一系列科學、技術、監管和後勤方面的挑戰。fda規定 體外培養伴隨診斷作為醫療器械,在該監管框架下,將要求該測試進行分析驗證,並用於臨牀試驗中的患者選擇,我們預計如果尚未獲得批准,則在商業化之前將需要單獨的監管批准或批准。
我們打算依賴第三方為我們的候選治療藥物設計、開發和製造可能需要此類測試的配套診斷測試。如果我們達成這樣的合作協議,我們將依賴於我們未來的合作者在開發和獲得對這些伴隨診斷的批准方面的持續合作和努力。在開發和監管審批過程中,可能需要解決相關診斷的選擇性/特異性、分析驗證、重複性或臨牀驗證等問題。此外,即使來自臨牀前研究和早期臨牀試驗的數據似乎支持為候選產品開發伴隨診斷,在後來的臨牀試驗中產生的數據也可能無法支持伴隨診斷的分析和臨牀驗證。我們和我們未來的合作者在開發、獲得監管批准、製造和商業化與我們的候選治療藥物本身類似的伴隨診斷方法方面可能會遇到困難,包括獲得監管許可或批准、以商業規模和適當的質量標準生產足夠數量的產品以及獲得市場認可等問題。如果我們不能成功地為這些候選治療藥物開發配套診斷,或者延遲開發,這些候選治療藥物的開發可能會受到不利影響,這些候選治療藥物可能無法獲得上市批准,我們也可能無法實現這些獲得上市批准的治療藥物的全部商業潛力。因此,我們的業務、運營結果和財務狀況可能會受到實質性的損害。此外,與我們簽約的診斷公司可能決定停止銷售或製造我們預期用於開發和商業化我們的候選產品的配套診斷測試,或者我們與該診斷公司的關係可能會終止。我們可能無法與另一家診斷公司達成安排,以獲得替代診斷測試的供應,用於我們候選產品的開發和商業化,或者以商業合理的條款這樣做,這可能會對我們的候選治療產品的開發或商業化產生不利影響和/或延遲。
我們的候選產品在一個司法管轄區獲得並保持監管批准並不意味着我們的候選產品將在其他司法管轄區成功獲得監管批准。
在一個司法管轄區獲得並保持我們候選產品的監管批准並不保證我們將能夠在任何其他司法管轄區獲得或維持監管批准,而在一個司法管轄區未能或延遲獲得監管批准可能會對其他司法管轄區的監管審批過程產生負面影響。例如,即使FDA批准了候選產品的上市,外國司法管轄區的可比監管機構也必須批准候選產品在這些國家的製造、營銷和推廣。審批程序因司法管轄區而異,可能涉及與美國不同或大於美國的要求和行政審查期限,包括額外的臨牀前研究或臨牀試驗,因為在一個司法管轄區進行的臨牀試驗可能不會被其他司法管轄區的監管機構接受。在美國以外的許多司法管轄區,候選產品必須先獲得報銷批准,然後才能在該司法管轄區批准銷售。在某些情況下,我們打算為我們的產品收取的價格也需要得到批准。
我們也可以在其他國家提交營銷申請。美國以外司法管轄區的監管機構對候選產品的批准有要求,我們在這些司法管轄區上市前必須遵守這些要求。獲得外國監管批准和遵守外國監管要求可能會給我們帶來重大延誤、困難和成本,並可能推遲或阻止我們的產品在某些國家/地區推出。如果我們未能遵守國際市場的監管要求和/或獲得適用的營銷批准,我們的目標市場將會減少,我們充分發揮我們候選產品的市場潛力的能力將受到損害。
與持續監管義務相關的風險
即使我們的候選產品獲得了監管機構的批准,我們也將受到持續的監管義務和持續的監管審查的約束,這可能會導致大量的額外費用,如果我們沒有遵守監管要求或我們的候選產品出現了意想不到的問題,我們可能會受到懲罰。
我們為候選產品獲得的任何監管批准都需要進行監督,以監控候選產品的安全性和有效性。FDA還可能要求REMS以批准我們的候選產品,這可能需要藥物指南、醫生溝通計劃或其他確保安全使用的元素,如限制分銷方法、患者登記和其他風險最小化工具。此外,如果FDA或類似的外國監管機構批准了我們的候選產品,我們的候選產品的生產工藝、標籤、包裝、分銷、不良事件報告、儲存、廣告、促銷、進口、出口和記錄保存將受到廣泛和持續的監管要求的約束。這些要求包括提交安全性和其他上市後信息和報告,註冊,以及持續遵守適用的cGMP、GLP和GCP要求,我們在批准後進行的任何臨牀試驗。對於某些商業處方藥產品,製造商和供應鏈中涉及的其他各方還必須滿足分銷鏈的要求,並建立電子、可互操作的系統,用於產品跟蹤和追蹤,並通知FDA假冒、轉移、被盜和故意摻假的產品或其他不適合在美國分銷的產品。稍後發現我們候選產品之前未知的問題,包括非預期嚴重度或頻率的不良事件,或我們的第三方製造商或製造工藝,或未能遵守監管要求,可能導致(除其他外):
•限制我們候選產品的營銷或生產、從市場上撤回產品或自願或強制產品召回;
•生產延誤和供應中斷,其中監管檢查發現有不符合規定的情況需要補救;
•對標籤的修訂,包括對批准用途的限制或增加額外的警告、禁忌症或其他安全信息,包括方框警告;
•實施可再生能源管理制度,其中可能包括分發或使用限制;
•要求進行額外的上市後臨牀試驗,以評估該產品的安全性;
•罰款、警告函或暫停臨牀試驗的;
•FDA拒絕批准未決申請或對我們提交的已批准申請的補充,或暫停或撤銷批准;
•產品扣押或扣留,或拒絕允許進口或出口我們的候選產品;以及
•禁制令或施加民事或刑事處罰。
此外,根據FDORA,獲批藥物和生物製品的申辦者必須提前6個月通知FDA上市狀態的任何變化,如撤回藥物,否則可能導致FDA將該產品列入停產產品名單,這將取消該產品的上市能力。FDA和其他監管機構的政策可能會發生變化,並且可能會頒佈額外的政府法規,這可能會阻止、限制或延遲我們候選產品的監管批准。我們無法預測未來的立法或行政行動可能引起的政府監管的可能性、性質或程度,無論是在美國或國外。如果我們行動緩慢或無法適應現有要求的變化或採納新要求或政策,或未能維持監管合規,我們可能會失去我們可能已獲得的任何營銷批准,我們可能無法實現或維持盈利能力。
FDA和其他監管機構積極執行禁止推廣非標籤使用的法律法規。
如果我們的任何候選產品獲得批准,並且我們被發現不當地推廣了這些產品的標籤外使用,我們可能會承擔重大責任。FDA和其他監管機構嚴格監管處方藥的促銷聲明,如果批准的話。特別是,雖然FDA允許傳播關於已批准產品的真實和非誤導性信息,但製造商不得將未經FDA或其他監管機構批准的產品推廣到產品的標籤中。如果我們被發現推廣了此類標籤外使用,我們可能會承擔重大責任。聯邦政府已對涉嫌不當推廣標籤外使用的公司徵收鉅額民事和刑事罰款,並禁止幾家公司從事標籤外推廣。林業發展局還要求各公司簽署同意令、公司誠信協議或永久禁令,規定必須改變或減少特定促銷行為。倘吾等未能成功管理候選產品的推廣(如獲批准),吾等可能須承擔重大責任,對吾等的業務及財務狀況造成重大不利影響。
新批產品的投保範圍及報銷狀況不確定。我們的候選產品可能會受到不利的定價法規、第三方覆蓋和報銷慣例或醫療改革舉措的影響,這將損害我們的業務。未能為新產品或現有產品獲得或維持足夠的覆蓋範圍和報銷,可能會限制我們營銷這些產品的能力,並降低我們創造收入的能力。
管理新藥上市批准、定價、覆蓋範圍和報銷的法規因國家而異。在美國,最近頒佈的立法可能大幅改變批准要求,從而可能涉及額外費用,並造成獲得批准的延誤。有些國家要求藥物的銷售價格在上市前得到批准。在許多國家,定價審查期在獲得上市或產品許可批准後開始。在一些外國市場,處方藥定價仍然受到政府的持續控制,即使在獲得初步批准之後。因此,我們可能會在特定國家獲得產品的上市批准,但隨後會受到價格法規的約束,這些法規會延遲我們的產品商業發佈,可能會延長很長時間,並對我們在該國家銷售產品所產生的收入產生負面影響。不利的定價限制可能會阻礙我們收回對一個或多個候選產品的投資,即使我們可能開發的候選產品獲得市場批准。
在美國和其他國家的市場,患者通常依賴第三方支付者來償還與治療相關的全部或部分費用。政府醫療保健計劃(如醫療保險和醫療補助計劃)的充分覆蓋和補償以及商業支付者對新產品的接受至關重要。我們能否成功將候選產品商業化,部分取決於政府衞生管理機構、私人健康保險公司和其他組織為這些產品和相關治療提供的覆蓋範圍和充分補償。政府當局和其他第三方支付者,如私人健康保險公司和健康維護組織,決定他們將支付哪些藥物,並確定報銷水平。政府和私人支付者提供的覆蓋範圍和報銷範圍對於大多數患者能夠負擔得起基因治療產品等治療至關重要。我們可能確定的這些或其他候選產品的銷售將在很大程度上取決於我們候選產品的成本將在多大程度上由健康維護、管理式護理、藥房福利和類似的醫療保健管理組織支付,或由政府衞生管理機構、私人健康保險保險公司和其他第三方支付方報銷。如果沒有覆蓋範圍和足夠的報銷,或僅限於有限的水平,我們可能無法成功地將我們的候選產品商業化。即使提供保險,批准的報銷金額可能不足以讓我們建立或維持足以實現我們投資的充分回報的定價。
第三方付款人的退款可能取決於許多因素,包括但不限於第三方付款人確定產品的使用是:
•在其健康計劃下有保障的福利;
•安全、有效和醫學上必要的;
•適用於特定的患者;
•具有成本效益;以及
•既不是試驗性的,也不是調查性的。
美國醫療保健行業和其他地方的一個主要趨勢是成本控制。政府當局和第三方支付者試圖通過限制特定藥物的覆蓋範圍和報銷金額來控制費用。在許多國家,作為國家衞生系統的一部分,醫療產品的價格受到不同的價格控制機制的制約。一般而言,在這種制度下的藥品價格大大低於美國。其他國家允許公司自行定價藥品,但監督和控制公司利潤。額外的外國價格控制或定價法規的其他變化可能會限制我們對候選產品的收費。因此,在美國以外的市場,產品的補償可能比美國減少,可能不足以產生商業上合理的收入和利潤。
新批准產品的保險範圍和報銷也存在重大不確定性,保險範圍可能比FDA或類似的外國監管機構批准的藥物用途更有限。在美國,關於新藥報銷的主要決定通常由衞生和衞生部下屬的一個機構CMS做出。CMS決定是否以及在多大程度上一種新藥將在醫療保險下得到覆蓋和報銷,私人支付者傾向於在很大程度上遵循CMS。第三方付款人之間沒有統一的產品承保範圍和報銷政策,付款人之間產品承保範圍和報銷水平可能有很大差異。因此,承保範圍的確定過程通常是一個耗時且昂貴的過程,可能需要我們分別向每個付款人提供關於使用我們產品的科學和臨牀支持,而不能保證承保範圍和充分的報銷將得到一致應用或在第一時間獲得。很難預測CMS將如何決定償還像我們這樣的根本新穎的產品。歐洲的報銷機構可能比CMS更保守。例如,一些抗癌藥物在美國已獲準報銷,但在某些歐洲國家尚未獲準報銷。此外,報銷資格並不意味着任何藥物在所有情況下都將得到支付,或以涵蓋我們成本的比率支付,包括研究、開發、生產、銷售和分銷。新藥的臨時報銷水平(如適用)也可能不足以支付我們的費用,並且可能不會永久化。報銷率可能會因藥物的使用和臨牀使用環境而異,也可能會基於已經為較低成本藥物設定的報銷水平,也可能納入其他服務的現有支付中。我們無法就我們可能開發的任何批准產品迅速從政府資助和私人支付方獲得覆蓋範圍和有利可圖的付款率,這可能會對我們的經營業績、我們籌集資金以使候選產品商業化的能力以及我們的整體財務狀況造成重大不利影響。
政府醫療保健計劃或私人支付者要求的強制性折扣或回扣,以及未來任何放寬目前限制從可能以低於美國價格銷售的國家進口藥物的法律,可能會降低藥物的淨價。我們無法及時獲得我們開發的任何獲批准產品的第三方付款人的承保範圍和有利可圖的償還率,可能會對我們的經營業績、我們籌集產品商業化所需資金的能力以及我們的整體財務狀況造成重大不利影響。
越來越多的第三方支付者要求製藥公司向他們提供預定的價格折扣,並挑戰醫療產品的價格。我們不能確定我們商業化的任何候選產品是否可以報銷,如果可以報銷,也不能確定報銷水平。報銷可能會影響我們獲得上市批准的任何候選產品的需求或價格。為了獲得報銷,醫生可能需要證明患者使用我們的產品比標準治療藥物(包括價格較低的標準治療藥物仿製藥)具有更好的治療效果。我們預計,由於管理醫療的趨勢、健康維護組織的影響力不斷增加以及其他立法變化,銷售我們的任何候選產品都將面臨定價壓力。總體醫療保健成本的下行壓力,特別是處方藥和外科手術和其他治療,已經變得非常巨大。因此,新產品進入市場的壁壘越來越高。
此外,我們可能會開發配套的診斷測試,用於我們的候選產品。一旦獲得批准,我們或我們的合作者可能需要為這些測試單獨獲得保險和補償,並且與我們為候選產品尋求的保險和補償之外。即使我們獲得監管部門的批准或批准,但出於適用於我們候選產品的相同原因,我們獲得覆蓋範圍和充分報銷的能力仍存在重大不確定性。醫療保險報銷方法(無論是A部分、B部分或臨牀實驗室費用表)可能會不時修改,我們無法預測這些方法的任何變更會對我們獲得批准的任何候選產品或伴隨診斷產品產生什麼影響。我們無法就我們開發並獲得監管部門批准的伴隨診斷檢測迅速獲得保險範圍和從兩個第三方支付方獲得足夠補償,可能會對我們的業務、財務狀況、經營業績和前景產生重大不利影響。
旨在降低醫療成本的醫療立法措施可能會對我們的業務和運營結果產生實質性的不利影響。
美國和許多外國司法管轄區已經制定或提議了影響醫療保健系統的立法和監管變化,這些變化可能會阻止或推遲我們的候選產品或任何未來候選產品的上市審批,限制或監管審批後活動,並影響我們以盈利方式銷售獲得營銷審批的產品的能力。法規、法規或現有法規的解釋的變化可能會影響我們未來的業務,例如,要求:(I)改變我們的製造安排;(Ii)增加或修改產品標籤;(Iii)召回或停產我們的產品;或(Iv)額外的記錄保存要求。如果強制實施任何此類變化,可能會對我們的業務運營產生不利影響。
在美國,已經並將繼續採取多項立法措施來控制醫療費用。例如,2021年7月9日,拜登總統發佈行政命令,指示FDA除其他事項外,繼續澄清和完善仿製藥的審批框架,識別和解決任何阻礙仿製藥競爭的行為。
此外,2010年3月,ACA獲得通過,極大地改變了政府和私人保險公司為醫療保健提供資金的方式,並對美國製藥業產生了重大影響。ACA,除其他外,使生物產品受到低成本生物仿製藥的潛在競爭,提出了一種新的方法,通過該方法計算製造商根據醫療補助藥物回扣計劃欠下的回扣,用於吸入、輸注、滴注、植入或注射的藥物,增加製造商根據醫療補助藥品回扣計劃所欠的最低醫療補助回扣,並將回扣計劃擴大到註冊的個人,醫療補助管理的護理組織,為某些品牌處方藥的製造商建立年費和税收,並創建了一個新的醫療保險Part D覆蓋缺口折扣計劃,其中製造商必須同意提供70%,(根據2018年兩黨預算法案增加,自2019年起生效)在覆蓋空白期內,向合格受益人提供適用品牌藥物談判價格的銷售點折扣,作為製造商的門診藥物受醫療保險D部分覆蓋的條件。
自頒佈以來,對ACA的某些方面存在司法、行政、行政和國會立法方面的挑戰,我們預計未來還會對ACA提出更多的挑戰和修正。例如. ACA的各個部分目前正在第五巡迴法院和美國最高法院接受憲法挑戰,特朗普政府發佈了各種行政命令,取消了成本分攤補貼和各種條款,這些條款將對各州造成財政負擔,或對個人、醫療保健提供者、醫療保險公司、或藥品或醫療器械的製造商。此外,國會提出了幾項旨在重大修訂或廢除ACA的立法。目前還不清楚ACA是否會被推翻、廢除、取代或進一步修改。我們無法預測ACA的進一步變化會對我們的業務產生什麼影響,特別是考慮到新政府。
立法和行政部門一直在努力從根本上改變或廢除ACA的部分內容。雖然國會迄今尚未通過廢除立法,但2017年減税和就業法案(TCJA)廢除了2019年1月1日生效,ACA對某些未能在一年的全部或部分時間內保持合格健康保險的個人徵收的基於税收的分擔責任支付,這通常被稱為“個人授權”。2021年6月17日,美國最高法院駁回了幾個州對ACA提出的最新司法挑戰,但沒有就ACA的合憲性作出具體裁決。關於ACA的訴訟和立法可能會繼續,結果不可預測和不確定。我們將繼續評估ACA及其可能的廢除和取代對我們業務的影響。
此外,2017年1月20日,特朗普總統簽署了一項行政命令,指示根據ACA擁有權力和責任的聯邦機構放棄,推遲,給予豁免,或延遲實施ACA的任何條款,這些條款將對各州造成財政負擔,或對個人,醫療保健提供者,醫療保險公司,或藥品或醫療器械的製造商。2017年10月13日,特朗普總統簽署了一項行政命令,終止根據ACA償還保險公司的費用分攤補貼。特朗普政府的結論是,根據ACA要求向保險公司支付的成本分攤減少(CSR)尚未從國會獲得必要的撥款,並宣佈將立即停止這些支付,直到這些撥款獲得。企業社會責任付款的損失預計將增加根據ACA由合資格健康計劃發出的若干保單的保費。幾個州的總檢察長提起訴訟,要求阻止政府終止補貼,但他們的限制令請求於2017年10月25日被加州一名聯邦法官駁回。2020年8月14日,美國聯邦巡迴上訴法院在兩個獨立的案件中裁定,聯邦政府應對之前(包括2017年)的全額未付CSR負責。對於健康保險公司在2018年及以後提出的CSR索賠,將需要進一步訴訟以確定到期金額(如有)。此外,2018年6月14日,美國聯邦巡迴上訴法院裁定,聯邦政府不必向第三方支付者支付超過120億美元的ACA風險走廊付款,而這些款項是他們認為欠他們的。2020年4月27日,美國最高法院推翻了美國聯邦巡迴上訴法院的判決,並將案件發回美國聯邦索賠法院,認定政府有義務根據相關公式支付這些風險走廊付款。2020年3月2日,美國最高法院批准了對此案進行復審的令狀申請,並於2020年11月10日舉行口頭辯論。最高法院即將對此案作出裁決。目前尚不清楚償付方面的差距對第三方支付者、ACA市場、供應商以及潛在的我們業務的可行性。
2019年12月20日,《進一步綜合撥款法》(H.R.1865)簽署成為法律,廢除了對某些高成本僱主贊助的保險計劃徵收的所謂“凱迪拉克”税,根據市場份額向某些醫療保險提供者徵收的年費,以及對非豁免醫療器械徵收的醫療器械消費税。不可能確定未來是否會開徵類似的税。2018年兩黨預算法也修訂了ACA,自2019年1月1日起生效,增加了參與聯邦醫療保險D部分的製藥商所欠的銷售點折扣,並縮小了大多數聯邦醫療保險藥物計劃的覆蓋缺口,通常被稱為“甜甜圈洞”。CMS發佈了一項最終規則,允許根據ACA風險調整計劃向某些ACA合格的健康計劃和健康保險發行商進一步收取和支付款項,以迴應聯邦地區法院關於CMS用於確定此風險調整的方法的訴訟結果。此外,CMS發佈了一項最終規則,從2020年起,在為個人和小團體市場的保險公司設定基準方面,給予各州更大的靈活性,這可能會放寬ACA對通過此類市場銷售的保險計劃所要求的基本健康福利。
自ACA頒佈以來,美國還提出並通過了其他立法修改。2011年8月,除其他事項外,2011年《預算控制法》制定了國會削減開支的措施,包括導致每個財政年度向提供者支付的醫療保險總額減少2%,由於隨後的立法修正案,除非國會採取額外行動,否則該法案將一直有效到2030年。2013年1月,《2012年美國納税人救濟法》(American納税人救濟法,簡稱ATRA)簽署成為法律,其中包括減少向包括醫院、影像中心和癌症治療中心在內的幾家醫療服務提供者支付的醫療保險,並將政府追回向醫療服務提供者多付款項的訴訟時效從三年延長到五年。此外,2022年《降低通貨膨脹率法案》(IRA)中的幾項條款可能會對我們的業務產生不同程度的影響,其中包括從2025年起將聯邦醫療保險D部分受益人的自付上限降低至2,000美元;對聯邦醫療保險D部分下的某些藥物規定新的製造商財務責任,允許美國政府就某些高成本藥物和生物製品的聯邦醫療保險B部分和D部分價格上限進行談判,而不存在仿製藥或生物相似競爭,其中可能包括小分子藥物;以及要求公司就某些價格增長快於通脹的藥物(包括小分子藥物)向聯邦醫療保險支付回扣。
在美國,關於特殊藥品定價做法的立法和執法興趣一直在增加。具體地説,美國國會最近進行了幾次調查,並提出了聯邦和州立法,旨在提高藥品定價的透明度,降低聯邦醫療保險下處方藥的成本,審查定價與製造商患者計劃之間的關係,以及改革政府計劃的藥品報銷方法。此外,特朗普政府此前還發布了一份降低藥品價格和降低藥品自付成本的《藍圖》,其中包含了增加製造商競爭、增加某些聯邦醫療保健計劃的談判力、激勵製造商降低產品標價以及降低消費者支付的藥品自付成本的額外建議。衞生和公眾服務部徵求了對其中一些措施的反饋意見,並在其現有權力範圍內實施了其他措施。例如,CMS在2019年5月發佈了一項最終規則,允許Medicare Advantage計劃從2020年1月1日開始選擇對B部分藥物使用階梯療法,這是一種事先授權。
此外,2018年5月30日,《審判權法案》簽署成為法律。除其他事項外,該法律還為某些患者提供了一個聯邦框架,允許他們獲得某些已完成第一階段臨牀試驗並正在進行調查以獲得FDA批准的研究用新藥產品。在某些情況下,符合條件的患者可以在不參加臨牀試驗和根據FDA擴大准入計劃獲得FDA許可的情況下尋求治療。根據《試用權法案》,製藥商沒有義務將其藥品提供給符合條件的患者。
此外,FDA還公佈了一項最終規則,自2020年11月30日起生效,允許從加拿大進口某些處方藥。根據最終規則,各州和印第安人部落,以及在未來某些情況下,藥劑師和批發商可以向FDA提交進口計劃提案,供其審查和授權。2020年9月25日,CMS聲明,各州根據這一規則進口的藥物將沒有資格根據社會保障法第1927條獲得聯邦退税,製造商不會出於“最佳價格”或平均製造商價格的目的報告這些藥物。由於這些藥物不被認為是覆蓋的門診藥物,CMS進一步表示,它不會公佈這些藥物的全國平均藥物採購成本。另外,FDA還發布了一份最終指導文件,概述了製造商為FDA批准的藥物獲得額外的國家藥品代碼(NDC)的潛在途徑,該藥物最初打算在外國銷售,並被授權在該外國銷售。
在州一級,各州越來越積極地通過立法和實施旨在控制藥品和生物產品定價的條例,包括價格或患者報銷限制、折扣、對某些產品准入和營銷成本披露的限制和透明度措施,在某些情況下,旨在鼓勵從其他國家進口和大宗採購。此外,地區衞生保健當局和個體醫院越來越多地使用招標程序來確定哪些藥品和哪些供應商將被納入其處方藥和其他衞生保健計劃。其中一些擬議措施,包括藥品進口和藥房福利經理回扣規則的變化,面臨着行業團體和參與者的法律挑戰。這些措施一旦獲得批准,可能會減少對我們產品的最終需求,或對我們的產品定價造成壓力。
我們預計未來將採取額外的州和聯邦醫療改革措施,其中任何一項措施都可能限制聯邦和州政府為醫療保健產品和服務支付的金額,這可能導致對我們候選產品的需求減少或額外的定價壓力。
我們的收入前景可能會受到美國和海外醫療支出和政策變化的影響。我們在一個高度監管的行業運營,與醫療保健可用性、醫療保健產品和服務的交付或支付方式相關的新法律、法規或司法決定,或對現有法律、法規或決定的新解釋,可能會對我們的業務、運營和財務狀況造成負面影響。
外國、聯邦和州各級已經有並可能繼續有立法和監管提案,旨在擴大醫療保健的可用性,並控制或降低醫療保健成本。我們無法預測未來可能採取的舉措,包括廢除、取代或重大修訂ACA。政府、保險公司、管理式醫療機構和其他醫療服務支付方為控制或降低醫療成本和/或實施價格控制而持續努力可能會對以下方面造成不利影響:
•對我們候選產品的需求,如果我們獲得監管部門的批准;
•我們有能力為我們的產品設定一個我們認為是公平的價格;
•我們獲得產品承保和報銷批准的能力;
•我們創造收入、實現或保持盈利的能力;
•我們須繳交的税項水平;及
•資金的可得性。
聯邦醫療保險或其他政府計劃報銷的任何減少都可能導致私人支付者支付的類似減少,這可能會對我們未來的盈利能力產生不利影響。
FDA和其他政府機構的資金不足可能會阻礙他們聘用和保留關鍵領導層和其他人員的能力,阻止新產品和服務的及時開發或商業化,或者以其他方式阻止這些機構履行我們業務運營可能依賴的正常業務職能,這可能會對我們的業務產生負面影響。
FDA審查和批准新產品的能力可能受到各種因素的影響,包括政府預算和資金水平、僱用和留住關鍵人員以及接受用户費用支付的能力,以及法律、法規和政策變化。因此,該機構的平均審查時間近年來一直在波動。此外,政府對我們行動可能依賴的其他政府機構的資助,包括那些為研發活動提供資金的機構,受到政治進程的影響,這一進程本質上是不穩定和不可預測的。
FDA或其他政府機構的中斷也可能會減緩新藥由必要政府機構審查和/或批准所需的時間,這將對我們的業務造成不利影響。例如,在過去的幾年裏,美國政府多次關閉,某些監管機構,如FDA,不得不解僱關鍵員工並停止關鍵活動。如果政府長期關閉,可能會嚴重影響FDA及時審查和處理我們監管提交的能力,這可能會對我們的業務產生重大不利影響。此外,未來政府關閉可能會影響我們進入公共市場及獲取必要資本以適當資本化及繼續營運的能力。
如果FDA確定批准需要進行檢查,並且由於旅行限制(例如大流行病或流行病)而無法在審查週期內完成檢查,並且FDA認為遠程互動評估不夠充分,FDA可以根據情況發出完整的回覆函或推遲對申請採取行動,直到檢查完成。美國以外的監管機構可能會採取類似的限制或其他政策措施,以應對任何大流行或流行病,並可能會在監管活動中遇到延誤。
我們的員工、獨立承包商、顧問、商業合作伙伴和供應商可能參與不當行為或其他不當活動,包括不遵守監管標準和要求。
我們面臨員工欺詐或其他非法活動的風險,我們的員工、獨立承包商、顧問、商業合作伙伴和供應商。這些當事方的不當行為可能包括故意、魯莽和/或疏忽行為,未能:遵守FDA和其他類似國外監管機構的規定,向FDA和其他類似國外監管機構提供真實、完整和準確的信息,遵守我們制定的生產標準,遵守美國的醫療欺詐和濫用法律以及類似的外國欺詐不當行為法律,或準確報告財務信息或數據,或向我們披露未經授權的活動。如果我們的任何候選產品獲得FDA的批准,並開始在美國商業化這些產品,我們在此類法律和法規下的潛在風險將顯著增加,我們與遵守此類法律和法規相關的成本也可能增加。這些法律可能會影響我們目前與主要研究者和研究患者的活動,以及擬議和未來的銷售、營銷和教育計劃。特別是,醫療保健產品和服務的推廣、銷售和營銷,以及醫療保健行業的某些商業安排,都受到旨在防止欺詐、回扣、自我交易和其他濫用行為的廣泛法律的約束。這些法律法規可能限制或禁止廣泛的定價、折扣、營銷和促銷、結構和佣金、某些客户獎勵計劃和其他一般業務安排。受這些法律約束的活動還涉及不當使用在招募患者進行臨牀試驗過程中獲得的信息。可能影響我們運營能力的法律包括但不限於:
•《聯邦反回扣法》,除其他外,禁止任何人故意索取、接受、提供或支付任何報酬(包括任何回扣、賄賂或回扣)直接或間接、公開或祕密地、以現金或實物方式,誘使或作為回報,轉介某人,或購買、租賃、訂購或推薦任何貨物、設施,根據聯邦醫療保健計劃,如醫療保險和醫療補助計劃,可以全部或部分支付的項目或服務。一個人或實體不需要實際瞭解法規或違反法規的具體意圖,就可以實施違法行為。違規行為將被處以民事和刑事罰款,並對每一項違規行為處以最高三倍的罰款,監禁,並被排除在政府醫療保健計劃之外。此外,政府可以聲稱,包括違反聯邦反回扣法令所導致的物品或服務的索賠構成虛假或欺詐索賠,為虛假索賠法的目的。有一些法定例外和監管安全港保護某些共同活動免受起訴;
•聯邦民事和刑事虛假索賠法和民事罰款法,包括虛假索賠法,對個人或實體施加刑事和民事處罰,包括通過民事"qui tam"或"舉報人"行動,除其他外,故意提出或導致提出,要求支付或批准醫療保險,醫療補助,或其他虛假或欺詐的聯邦醫療保健計劃;故意作出或導致虛假陳述材料的虛假或欺詐性索賠或向聯邦政府支付款項的義務;或故意隱瞞或故意和不當地避免或減少此類義務。根據FCA,即使製造商不直接向政府付款人提交索賠,如果他們被認為“導致”提交虛假或欺詐性索賠,也可以追究他們的責任。《FCA》還允許作為“舉報人”的個人代表聯邦政府提起訴訟,指控違反《FCA》,並分享任何資金回收。當一個實體被確定違反了聯邦民事虛假索賠法案,政府可以對每一個虛假索賠施加民事罰款和處罰,加上三倍的賠償金,並排除該實體參與醫療保險,醫療補助和其他聯邦醫療保健計劃;
•1996年聯邦健康保險流通和責任法案,或HIPAA,該法案創建了新的聯邦刑事法規,禁止故意執行,或試圖執行,欺詐任何醫療福利計劃的計劃,或通過虛假或欺詐性的藉口,陳述或承諾,獲得任何資金或財產的所有,或保管或控制,任何醫療福利計劃,無論支付人(例如,公開或私下),以及明知而故意偽造、隱瞞或以任何詭計或手段掩蓋重要事實,或作出任何重大虛假陳述,就提供或支付與醫療事宜有關的醫療福利、項目或服務。類似於聯邦反回扣法規,一個人或實體在不實際瞭解法規或違反法規的具體意圖的情況下,可被判犯有違反HIPAA的罪行;
•經2009年《經濟和臨牀健康信息技術法案》(Health Information Technology for Economic and Clinical Health Act)或HITECH及其各自的實施條例修訂的HIPAA及其各自的實施條例,其中對某些涵蓋的醫療保健提供者、醫療計劃和醫療保健信息交換所及其各自的業務夥伴實施了要求,這些業務夥伴為他們提供涉及使用或披露個人可識別健康信息的服務,未經適當授權,個人可識別健康信息的隱私、安全和傳輸。HITECH還設立了新的民事罰款等級,修訂了《殘疾人保護法》,使民事和刑事處罰直接適用於商業夥伴,並賦予州檢察長新的權力,以便在聯邦法院提起民事損害賠償訴訟或禁令,以執行聯邦殘疾人保護法的法律,並要求支付與進行聯邦民事訴訟有關的律師費和費用;
•根據ACA及其實施條例制定的聯邦醫師支付陽光法案,要求藥品,設備,生物製品和醫療用品的製造商根據醫療保險,醫療補助或兒童健康保險計劃支付(除某些例外情況外)每年向HHS報告與向醫生支付或其他價值轉移有關的信息(定義包括醫生,牙醫,視光師,足科醫生和脊醫),若干其他持牌醫護專業人員,教學醫院,以及醫生及其直系親屬持有的所有權和投資權益;
•聯邦消費者保護法和不正當競爭法,這些法律廣泛地監管市場活動和可能損害消費者的活動;以及
•類似的州和外國法律和法規,例如州和外國反回扣、虛假聲明、消費者保護和不正當競爭法,這些法律可能適用於製藥商業實踐,包括但不限於,研究、分銷、銷售和營銷安排以及提交涉及任何第三方付款人(包括商業保險公司)報銷的醫療項目或服務的索賠;州法律要求製藥公司遵守制藥行業的自願合規指南和聯邦政府頒佈的相關合規指南,否則限制向醫療保健提供者和其他潛在轉介來源支付款項;州法律要求藥品製造商向各州提交有關定價和營銷信息的報告,如跟蹤和報告提供給醫療保健專業人員和實體的禮物、補償和其他報酬及價值項目;州和地方法律要求藥品銷售代表註冊;以及管理某些情況下健康信息隱私和安全的州和外國法律,其中許多法律在重大方面彼此不同,可能不具有相同的效果,從而使合規工作複雜化。
我們已採納商業行為及道德守則,但並非總能識別及阻止員工不當行為,而我們為偵測及防止不當行為而採取的預防措施未必能有效控制未知或未管理的風險或損失,或保護我們免受政府調查或因未能遵守該等法律或法規而導致的其他行動或訴訟。
確保我們與第三方的業務安排符合適用的醫療法律和法規的努力將涉及大量成本。由於這些法律的範圍廣泛,而法定例外情況和可供選擇的避風港有限,我們的一些商業活動可能會受到一項或多項這類法律的挑戰。政府當局可能會得出結論,我們的業務實踐可能不符合當前或未來涉及適用欺詐和濫用或其他醫療保健法律和法規的現行或未來法規、法規或判例法。如果我們的運營被發現違反了這些法律或任何其他可能適用於我們的政府法規,我們可能會受到重大的刑事、民事和行政制裁,包括罰款、損害賠償、罰款、交還、個人監禁,以及被排除在政府資助的醫療保健計劃(如Medicare和Medicaid)之外,如果我們受到公司誠信協議或類似協議的約束,以解決有關違反這些法律的指控、合同損害、聲譽損害、利潤減少和未來收益,並且我們可能被要求縮減或重組我們的業務,其中任何一項都可能對我們的業務運營能力和運營結果產生不利影響。
任何因違反這些法律而對我們採取的行動,即使我們成功地進行了辯護,也可能導致我們招致鉅額法律費用,並轉移我們管理層對業務運營的注意力。不斷變化的合規環境,以及建立和維護強大且可擴展的系統以符合具有不同合規和/或報告要求的多個司法管轄區的需要,增加了醫療保健公司可能與一項或多項要求發生衝突的可能性。
歐盟也禁止向醫生提供福利或優勢,以誘導或鼓勵醫生開處方、推薦、背書、購買、供應、訂購或使用醫療產品。向醫生提供福利或優勢通常受歐盟成員國的國家反賄賂法和英國2010年《反賄賂法》的管轄。違反這些法律可能會導致鉅額罰款和監禁。歐盟指令2001/83/EC是歐盟關於人用藥品的指令,它進一步規定,如果向有資格開處方或供應藥品的人推銷藥品,則不得向這些人提供、提供或承諾任何禮物、金錢利益或實物利益,除非這些禮物、金錢利益或實物利益不貴且與醫藥或藥房實踐有關。這一條款已被轉移到2012年人類藥物法規中,因此儘管它脱離了歐盟,但仍適用於英國。在某些歐盟成員國向醫生支付的費用必須公開披露。
此外,與醫生達成的協議通常必須事先通知醫生的僱主、醫生的主管專業組織和/或歐盟成員國的監管當局,並予以批准。
這些要求在適用於歐盟成員國的國家法律、行業守則或專業行為守則中作出規定。
不遵守這些要求可能會導致聲譽風險、公開譴責、行政處罰、罰款或監禁。
如果我們不遵守環境、健康和安全法律法規,我們可能會被罰款或罰款,或者產生成本,這可能會對我們的業務成功產生實質性的不利影響。
我們受到許多環境、健康和安全法律和法規的約束,包括那些管理實驗室程序以及危險材料和廢物的處理、使用、儲存、處理和處置的法律和法規。我們的行動涉及使用危險和易燃材料,包括化學品、生物和放射性材料。我們的業務還會產生危險廢物產品。我們通常與第三方簽訂合同,處理這些材料和廢物。我們不能消除這些材料造成污染或傷害的風險。如果我們使用危險材料造成污染或傷害,我們可能要對由此造成的任何損害負責,任何責任都可能超出我們的資源範圍。我們還可能產生與民事或刑事罰款和處罰相關的鉅額費用。
儘管我們已購買工傷保險,以保障我們因使用有害材料導致僱員受傷而可能產生的成本及開支,但該保險可能無法為潛在責任提供足夠的保障。我們不為可能因我們儲存或處置生物、危險或放射性材料而對我們提出的環境責任或有毒侵權索賠投保。
與我們的知識產權有關的風險
與保護知識產權有關的風險
如果我們無法獲得和維護BDTX-1535、BDTX-4933和我們的其他候選產品和技術,或我們可能開發的任何其他候選產品或技術的專利和其他知識產權保護,或者如果獲得的知識產權保護範圍不夠廣泛,我們的競爭對手可能會開發和商業化與我們類似或相同的產品和技術,我們將BDTX-1535、BDTX-4933或任何其他候選產品或技術商業化的能力可能會受到不利影響。
我們的成功在很大程度上取決於我們是否有能力在美國和其他國家/地區獲得並維護關於我們的候選產品的專利和其他知識產權保護,包括BDTX-1535、BDTX-4933、它們各自的組件、配方、聯合療法、用於製造它們的方法以及對我們的業務至關重要的治療和開發方法,以及成功地保護這些專利免受第三方挑戰。如果我們不充分保護我們的知識產權,競爭對手可能會侵蝕或否定我們可能擁有的任何競爭優勢,這可能會損害我們的業務和實現盈利的能力。
我們打算依靠專利申請、保密協議、商業祕密保護和許可協議的組合來保護與我們的候選產品和技術相關的知識產權。任何向第三方披露或盜用我們的機密專有信息,都可能使競爭對手迅速複製或超越我們的技術成果,從而削弱我們在市場上的競爭地位。我們或任何未來的合作伙伴、合作者或被許可人,可能無法識別在開發和商業化活動過程中產生的發明的可專利方面,否則為時已晚,無法獲得專利保護。因此,我們可能會錯過建立我們專利地位的潛在機會。
為了保護我們的專利地位,我們計劃在美國和海外提交與我們業務重要的候選產品相關的專利申請;我們將來也可能授權或購買他人擁有的專利或專利申請。我們阻止未經授權的第三方製造、使用、銷售、提供銷售或進口我們的候選產品的能力取決於我們在涵蓋這些活動的有效且可執行的專利或商業祕密下享有的權利。如果我們無法獲得或維持有關BDTX—1535、BDTX—4933或我們開發的任何其他專有產品和技術的專利保護,我們的業務、財務狀況、經營業績和前景將受到重大損害。
美國臨時專利申請、美國專利申請或PCT專利申請以及我們目前擁有的外國專利申請可能永遠不會導致已發佈的專利。除非我們在12個月內將美國臨時專利申請轉換為一個或多個非臨時專利申請,否則這些美國臨時專利申請可能沒有資格成為已發佈專利。如果我們沒有及時將美國臨時專利申請轉換為任何非臨時申請,我們可能會失去美國臨時專利申請的優先權日期以及該等美國臨時專利申請中披露的發明的任何專利保護。待審PCT專利申請不具備成為已發佈專利的資格,除非我們在30個月內向我們尋求專利保護的國家提交國家階段專利申請。如果我們沒有及時提交任何國家階段專利申請,我們可能會失去我們的PCT專利申請的優先權日以及該PCT專利申請中披露的發明的任何專利保護。雖然我們打算及時將美國臨時專利申請轉換為一個或多個非臨時專利申請,並及時提交與我們的PCT專利申請相關的國家階段專利申請,但我們無法預測我們未來的任何專利申請是否會被BDTX—1535,BDTX—4933或我們的任何其他候選產品將導致專利的發佈,有效保護BDTX—1535,BDTX—4933或我們的其他候選產品。如果我們未能成功獲得專利保護,或者即使我們獲得了專利保護,如果我們或我們的潛在許可人獲得的關於BDTX—1535、BDTX—4933或我們的其他候選產品和技術的專利保護範圍不夠廣泛,我們將無法阻止他人使用我們的技術或開發或商業化與我們相似或相同的技術和產品,其他競爭產品和技術。任何未能獲得或維持有關BDTX—1535、BDTX—4933和我們的其他候選產品的專利保護將對我們的業務、財務狀況、經營業績和前景產生重大不利影響。
在某些情況下,我們為在市場上成功競爭所需的專利保護程度可能無法獲得或受到嚴重限制,可能無法充分保護我們的權利或允許我們獲得或保持任何競爭優勢。我們不能保證我們可能擁有的或將來獲得許可的任何專利,或我們的任何專利申請成熟為已發佈專利將包括範圍足以保護我們當前和未來候選產品或以其他方式提供任何競爭優勢的權利要求。此外,在我們將來許可知識產權的範圍內,我們不能向您保證這些許可將繼續有效。此外,外國法律可能無法像美國法律一樣保護我們的權利。此外,專利的使用壽命有限,我們將來可能擁有或授權的任何專利的期限可能不足以在足夠的時間內保護我們候選產品或技術的競爭地位。在美國,專利的自然到期通常是在提交後20年。專利權的有效期是有限的,但專利權的有效期和保護是有限的。鑑於新產品候選的開發、測試和監管審查需要大量的時間,保護這些候選的專利可能在這些候選產品商業化之前或之後不久到期。
即使沒有受到質疑,我們的專利申請(如果已發出)以及我們將來可能擁有或正在獲得許可的任何專利,可能不會為我們提供任何有意義的保護,也不會阻止競爭對手圍繞我們的專利要求進行設計,以以非侵權的方式開發類似或替代技術或療法來規避我們將來可能擁有或正在獲得許可的任何專利。例如,第三方可能開發一種競爭療法,其益處與我們的一種或多種候選產品相似,但使用的配方和/或器械超出了我們未來可能擁有的任何專利保護範圍。如果我們的專利申請或我們可能就我們的候選產品尋求的任何專利提供的專利保護不夠廣泛,不足以阻礙此類競爭,我們成功將候選產品商業化的能力可能會受到負面影響,從而損害我們的業務。雖然我們目前擁有我們的專利申請,但類似的風險也會適用於我們將來可能擁有或授權的任何專利或專利申請。
生命科學公司的專利地位可能是不確定的,涉及複雜的事實和法律問題。我們尋求專利保護的任何司法管轄區的專利法或其解釋的變更可能會削弱我們保護我們的發明、維護和執行我們的知識產權的能力;更廣泛地説,可能會影響我們的知識產權的價值,包括縮小我們的專利申請的範圍或我們將來可能擁有或許可的任何專利的範圍。
專利申請程序複雜、昂貴、耗時,而且各司法管轄區之間不一致。專利許可證談判也可能是複雜和漫長的,結果不確定。我們可能無法以商業上合理的成本或及時的方式提交、起訴、維護、執行或許可所有必要或可取的專利權。此外,我們可能不會在所有相關市場尋求或獲得專利保護。我們可能無法及時識別我們的研發工作中重要的可專利方面,以獲得適當的或任何專利保護。雖然我們與有權訪問我們研究和開發工作的機密或專利方面的各方(包括例如我們的員工、企業合作者、外部學術科學合作者、CRO、合同製造商、顧問、顧問和其他第三方)簽訂了保密協議和保密協議,但這些各方中的任何一方都可能違反協議並在專利申請提交之前披露結果。從而危及我們尋求專利保護的能力。此外,科學和學術文獻中的發現發表往往落後於實際發現,美國和其他司法管轄區的專利申請通常在申請後18個月才發表,有時甚至根本不發表。因此,我們不能確定我們是第一個就我們專利申請中所要求的發明申請專利保護的人。
在準備或提交我們的專利申請時,或我們可能擁有或將來在許可中的任何專利,可能存在或可能在將來出現的形式缺陷,例如在適當的優先權要求、發明人、權利要求範圍或專利期限調整請求方面。如果我們或我們的合作伙伴、合作者、被許可人或許可人未能建立、維護或保護此類專利和其他知識產權,則此類權利可能會減少或消除。如果我們的合作伙伴、合作者、被許可人或許可人不完全合作或不同意我們對任何專利權的起訴、維護或執行,這些專利權可能會受到損害。如果我們的專利申請或我們將來可能擁有或許可的專利的形式、準備、起訴或執行方面存在重大缺陷,這些專利可能無效和/或不可執行,並且這些申請可能永遠不會產生有效的、可執行的專利。任何該等結果均可能削弱我們防止來自第三方競爭的能力,從而可能對我們的業務造成不利影響。
此外,我們不能確定我們的專利申請中涵蓋我們候選產品或技術的物質組成的權利要求是否被美國專利商標局或外國專利局視為可專利,或者我們可能擁有或在未來獲得許可的任何已發佈專利中的權利要求是否被美國或外國法院視為可專利。
使用方法專利保護特定方法的產品使用。這些類型的專利並不阻止競爭對手製造和銷售與我們產品相同的產品,用於超出專利方法範圍的適應症。此外,即使競爭對手不積極宣傳他們的產品以滿足我們的目標適應症,醫生也可能會開出“標籤外”的處方。雖然標籤外處方可能會誘發或助長對使用方法專利的侵犯,但這種做法很常見,很難防止或起訴此類侵權行為。
製藥和生物技術公司的專利地位一般是高度不確定的,涉及複雜的法律和事實問題,許多法律原則尚未解決。近年來,專利權一直是重大訴訟的主題。因此,我們可能從我們的專利申請中獲得的任何權利的頒發、範圍、有效性、可轉讓性和商業價值是高度不確定的。我們的專利申請可能不會導致在美國或其他司法管轄區頒發保護我們的技術或產品或有效阻止他人將競爭性技術和產品商業化的專利。此外,我們獲得和保持有效和可執行的專利的能力取決於我們的發明與現有技術之間的差異,包括我們自己先前提交的專利申請和科學出版物,是否允許我們的發明相對於現有技術具有專利權。即使我們的專利申請作為專利發佈,第三方可能會根據這些科學出版物質疑這些專利的有效性,我們可能會失去寶貴的專利權。此外,在專利申請中要求保護的發明的範圍在專利發佈之前可以明顯縮小,並且在發佈之後可以重新解釋該範圍。即使我們目前擁有的專利申請或我們將來可能會以專利的形式發佈,它們也可能不會以提供任何有意義的保護、防止競爭對手或其他第三方與我們競爭或以其他方式為我們提供競爭優勢的形式發佈。任何最終發佈的專利都可能被第三方質疑、縮小或無效。因此,我們不知道我們的任何候選產品是否會受到保護或繼續受到有效和可執行的專利權的保護。我們的競爭對手或其他第三方可能會通過以非侵權方式開發新化合物或替代技術或產品來逃避我們在專利申請中可能擁有的任何權利。
專利的頒發或授予在其發明人、範圍、有效性或可轉讓性方面並非無可辯駁的,我們可能擁有或將來許可的任何專利都可能在美國和國外的法院或專利局受到質疑。此類挑戰可能導致我們可能擁有或正在授權的任何專利的專利權要求被縮小、無效或被視為不可執行,這可能限制我們阻止或阻止我們阻止他人使用或商業化類似或相同技術和產品的能力,或限制我們技術和產品的專利保護期限。可能存在我們不知道的現有技術可能影響專利權利要求的有效性或可撤銷性。也可能存在我們所知道的、但我們不認為會影響索賠的有效性或可撤銷性的現有技術,儘管如此,這些現有技術最終可能會影響索賠的有效性或可撤銷性。我們將來可能會受到第三方發佈前提交的現有技術或異議、衍生、撤銷、複審、授權後和各方間審查或干涉程序以及其他類似程序的約束,這些程序質疑我們在美國專利商標局或美國專利商標局或其他外國專利局的專利申請中可能擁有的任何權利,或宣告性判決訴訟或反訴。任何此類提交、訴訟或訴訟中的不利決定可能會減少我們在專利申請中可能擁有的任何權利的範圍或使其無效,允許第三方將我們的技術或產品商業化並直接與我們競爭,而無需向我們支付費用,或消滅我們在不侵犯第三方專利權的情況下生產或商業化產品的能力。
此外,鑑於新候選產品的開發、測試和監管審查需要大量的時間,保護這些候選產品的專利可能在這些候選產品商業化之前或之後不久到期。因此,我們的知識產權可能無法為我們提供足夠的權利,以排除其他人將與我們相似或相同的產品商業化。
此外,我們的部分知識產權,包括我們可能擁有或將來許可的任何專利,可能與第三方共同擁有。如果我們無法為任何該等第三方共有人在該等知識產權(包括專利或專利申請)中的權益獲得獨家許可,則該等共有人可能會將其權利授權給其他第三方,包括我們的競爭對手,而我們的競爭對手可能會銷售競爭產品和技術。此外,我們或我們未來的許可人可能需要我們擁有和正在授權的知識產權(包括專利和專利申請)的任何此類共同所有人的合作,以便針對第三方強制執行該等知識產權,此類合作可能不會提供給我們或我們未來的許可人。上述任何情況均可能對我們的競爭地位、業務、財務狀況、經營業績及前景造成重大不利影響。
我們通常也會面臨與我們許可的知識產權保護有關的所有風險,正如我們對我們擁有的知識產權所承擔的風險,詳情如下。如果我們或我們未來的許可方未能充分保護這些知識產權,我們將產品商業化的能力可能會受到影響。
如果我們未能遵守任何未來協議中的義務,根據該協議,我們可能會向第三方授權知識產權,或以其他方式中斷我們與未來授權人的業務關係,我們可能會失去對我們業務至關重要的許可權。
未來,我們可能會與第三方簽署許可協議或合作協議,以推進我們的研究或允許候選產品的商業化。此類未來協議可能會對我們施加許多義務,例如開發、盡職、付款、商業化、資金、里程碑、版税、分授權、保險、專利申請、執行和其他義務,並可能要求我們遵守開發時間表,或作出商業上合理的努力來開發和商業化許可產品,以維持許可證。儘管我們盡了最大努力,我們未來的許可方可能會認為我們實質上違反了我們未來的許可協議,因此可能終止許可協議,從而取消或限制我們開發和商業化這些許可協議涵蓋的產品和技術的能力。
這些許可的任何終止,或如果基礎專利未能提供預期的排他性,可能導致我們失去重要權利,並可能損害我們將候選產品商業化的能力,競爭對手或其他第三方將有權尋求監管部門批准,並將其推向市場,我們可能被要求停止某些候選產品的開發和商業化。上述任何情況均可能對我們的競爭地位、業務、財務狀況、經營業績及前景產生重大不利影響。
我們和我們未來的許可方之間也可能會發生關於受許可協議約束的知識產權的爭議,包括:
•根據許可協議授予的權利範圍和其他與解釋有關的問題;
•我們的技術和工藝是否以及在多大程度上侵犯、挪用或以其他方式侵犯不受許可協議約束的許可方的知識產權;
•我們在合作開發關係下將專利和其他權利再許可給第三方的權利;
•我們在使用與我們的候選產品開發和商業化相關的許可技術方面的勤勉義務,以及哪些活動符合這些勤勉義務;
•任何專利技術的發明優先權;以及
•由我們未來的許可人以及我們和我們的合作伙伴共同創造或使用知識產權所產生的發明和專有技術的所有權。
此外,我們將來可能向第三方授權知識產權或技術的協議可能很複雜,且該等協議中的某些條款可能會受到多種解釋的影響。解決任何可能產生的合約詮釋分歧可能會縮小我們認為有關知識產權或技術的權利範圍,或增加我們認為有關協議下的財務或其他責任,而上述兩種情況均可能對我們的業務、財務狀況、經營業績及前景造成重大不利影響。此外,如果我們將來可能授權的知識產權糾紛妨礙或損害我們以可接受的條款維持未來授權安排的能力,我們可能無法成功開發和商業化受影響的候選產品,這可能會對我們的業務、財務狀況、經營業績和前景造成重大不利影響。
如果我們不能保護我們的商業祕密的機密性,我們的商業和競爭地位將受到損害。
除了我們可能擁有或將來獲得許可的專利所提供的保護外,我們尋求依靠商業祕密保護、保密協議和許可協議來保護不可申請專利的專有技術、專利難以執行的工藝以及我們產品發現和開發過程中的任何其他元素,包括涉及專有技術的MAP藥物發現引擎。信息或技術不屬於專利範圍。雖然我們要求我們的所有員工、顧問、顧問和任何可以訪問我們專有技術、信息或技術的第三方簽署保密協議,但商業祕密可能難以保護,我們對合作者和供應商使用的商業祕密的保護控制有限。我們不能確定我們在所有情況下都已或將獲得這些協議,我們不能保證我們已與可能或已經訪問我們的商業祕密或專有信息的各方簽訂了此類協議。
此外,任何一方都可能違反協議,故意或無意地披露我們的商業祕密信息,我們可能無法就此類違反行為獲得足夠的補救措施。此外,競爭對手可能會以其他方式獲取我們的商業祕密或獨立開發實質上等同的信息和技術。此外,一些外國的法律並不像美國法律那樣保護所有權和商業祕密。因此,我們可能會在美國和國外在保護和捍衞我們的知識產權方面遇到重大問題。如果我們無法防止未經授權向第三方披露我們的知識產權,我們將無法在市場上建立或維持競爭優勢,這可能會對我們的業務、財務狀況、經營業績和未來前景造成重大不利影響。
強制執行一方非法披露或盜用商業祕密的索賠是困難、昂貴和耗時的,而且結果是不可預測的。如果我們選擇訴諸法院以阻止第三方使用我們的任何商業祕密,我們可能會產生大量費用。這些訴訟可能會消耗我們的時間和其他資源,即使我們成功。例如,我們的MAP藥物發現引擎的重要元素,包括致癌性計算算法、驗證機制和藥理學的體內實驗、藥物設計和相關工藝,都基於未公開披露的非專利商業祕密。雖然我們採取措施保護我們的專有信息和商業祕密,包括通過與我們的員工和顧問的合同方式,但第三方可能獨立開發實質上等同的專有信息和技術,或以其他方式獲取我們的商業祕密或披露我們的技術。如果我們的任何商業祕密被競爭對手或其他第三方合法獲取或獨立開發,我們無權阻止他們使用該技術或信息與我們競爭。
因此,我們可能無法有效地保護我們的商業祕密。我們的政策是要求我們的員工、顧問、外部科學合作者、贊助研究人員和其他顧問在與我們開始僱傭或諮詢關係時簽署保密協議。這些協議規定,在當事人與我們的關係過程中開發或向個人或實體披露的所有有關我們業務或財務事務的機密信息均應保密,除非在特定情況下,不得向第三方披露。此外,我們採取其他適當的預防措施,例如物理和技術安全措施,以防止第三方盜用我們的專有技術。就僱員而言,協議規定,個人構思的所有發明,與我們當前或計劃中的業務或研究與開發有關,或在正常工作時間內,在我們的場所或使用我們的設備或專有信息進行的,均為我們的專有財產。雖然我們要求所有員工將他們的發明轉讓給我們,但我們可能無法與實際上構思或開發我們認為屬於我們的知識產權的每一方執行此類協議。知識產權的轉讓可能無法自動執行,或者轉讓協議可能被違反,我們可能被迫向第三方提出索賠,或為他們可能對我們提出的索賠進行辯護,以確定我們視為我們的知識產權的所有權。該等索償可能對我們的業務、財務狀況、經營業績及前景造成重大不利影響。
我們可能無法成功地通過收購和許可證內許可來獲得或維護我們開發流程中的產品組件和流程的必要權利。
由於開發我們的候選產品可能需要使用第三方持有的所有權,我們業務的增長可能部分取決於我們獲取、授權或使用這些所有權的能力。
我們的候選產品也可能需要特定的配方以有效和高效地工作,這些權利可能由其他人持有。同樣,我們候選產品的高效生產或交付也可能需要特定的成分或方法,這些權利可能由第三方擁有。我們可能無法從第三方處獲取或授權我們認為對我們的業務運營有必要或重要的任何組成物、使用方法、流程或其他第三方知識產權。我們可能無法以合理的成本或合理的條款(如果有的話)獲得這些許可證,這將損害我們的業務。我們可能需要停止使用此類第三方知識產權所涵蓋的組合物或方法,並可能需要尋求開發不侵犯此類知識產權的替代方法,這可能導致額外成本和開發延誤,即使我們能夠開發此類替代方法,這可能不可行。即使我們能夠獲得許可證,它也可能是非排他性的,從而使我們的競爭對手能夠獲得與我們相同的技術。在這種情況下,我們可能需要花費大量的時間和資源來開發或授權替代技術。此外,我們候選產品中使用的分子可能會被其他人的知識產權所覆蓋。
此外,我們有時與學術機構合作,根據與這些機構的書面協議,加速我們的臨牀前研究或開發。在某些情況下,這些機構為我們提供了一個選項,讓我們就合作產生的任何機構技術權利進行談判。無論如何,我們可能無法在指定的時間內或在我們可接受的條款下協商許可證。如果我們無法做到這一點,該機構可能會將知識產權提供給其他人,這可能會阻礙我們繼續執行我們的計劃,並允許第三方與我們競爭。如果我們無法成功取得所需第三方知識產權的權利或維持現有知識產權,我們可能不得不放棄該項目的開發,我們的業務和財務狀況可能受到影響。
第三方知識產權的許可和收購是一個競爭激烈的領域,可能比我們更成熟或擁有更多資源的公司也可能在尋求授權或收購我們可能認為必要或有吸引力的第三方知識產權的戰略,以便將我們的候選產品商業化。由於規模、現金資源和更大的臨牀開發和商業化能力,更多的成熟公司可能比我們具有競爭優勢。此外,認為我們是競爭對手的公司可能不願意向我們轉讓或許可權利。我們也可能無法以允許我們的投資獲得適當回報的條款授權或獲取第三方知識產權。無法保證我們將能夠成功完成該等談判,並最終獲得我們可能尋求收購的其他候選產品的知識產權。如果我們無法成功取得所需第三方知識產權的權利或維持現有知識產權,我們可能不得不放棄該項目的開發,我們的業務、經營業績、財務狀況和前景可能受到影響。
如果在法庭上或在美國或國外的行政機構(包括美國專利商標局)受到挑戰,我們未來可能擁有的或許可中的任何涵蓋我們候選產品的已頒發專利可能會縮小範圍,或被發現無效或不可執行。
如果我們或我們未來的許可人或戰略合作伙伴對第三方提起法律訴訟,以強制執行涵蓋我們的候選產品之一的專利,被告可以反訴覆蓋我們候選產品的專利(如果適用)是無效和/或不可執行的。在美國的專利訴訟中,被告聲稱專利無效和/或不可強制執行的反訴很常見,第三方可以基於多種理由斷言專利無效或不可強制執行。質疑有效性的理由可能是據稱未能滿足幾項法定要求中的任何一項,包括缺乏可申請專利的主題、缺乏書面描述、缺乏新穎性、明顯或無法實施。不可執行性主張的理由可能是,與專利起訴有關的人在起訴期間向美國專利商標局隱瞞了相關信息,或做出了誤導性聲明。第三方也可以向美國或國外的行政機構提出類似的索賠,即使在訴訟範圍之外也是如此。這類機制包括重新審查、當事各方之間的審查、贈款後審查和外國司法管轄區的同等程序(例如反對程序)。此類訴訟可能導致撤銷或修改我們的專利申請,或我們未來可能擁有或許可的任何專利,使其不再涵蓋我們的候選產品。在法律上斷言無效和不可執行之後的結果是不可預測的。任何此類提交、訴訟或訴訟中的不利裁決可能會縮小我們從我們的專利申請中獲得的任何權利的範圍,或使其無效或使其無法強制執行,允許第三方將我們的候選產品或其他技術商業化,並在不向我們付款的情況下與我們直接競爭,或者導致我們無法在不侵犯第三方專利權的情況下製造或商業化產品。此外,我們可能不得不參與美國專利商標局宣佈的干涉程序,以確定發明的優先權,或在授予專利權後的挑戰程序中,例如在外國專利局的異議中,就我們的專利申請和我們可能擁有的或許可中的任何專利,挑戰我們的專利或發明優先權或其他可專利性特徵。此類挑戰可能導致專利權的喪失、排他性的喪失或專利主張的縮小、無效或無法執行,這可能會限制我們阻止他人使用類似或相同的技術和產品或將其商業化的能力,或者限制我們的候選產品和其他技術的專利保護期限。例如,關於有效性問題,我們不能確定沒有無效的先前技術,而我們或我們未來的許可合作伙伴和專利審查員在起訴期間並不知道這一點。如果被告以無效和/或不可強制執行的法律主張獲勝,或者如果我們以其他方式無法充分保護我們的權利,我們將失去對我們候選產品的至少部分甚至全部專利保護。這種專利保護的喪失可能會對我們的業務以及我們將我們的技術和候選產品商業化或獲得許可的能力產生實質性的不利影響。
此類程序也可能導致大量成本,並需要我們的科學家和管理層大量時間,即使最終結果對我們有利。如果我們在任何此類訴訟或其他優先權或發明人權爭議中失敗,我們可能需要從第三方(包括參與任何此類干涉訴訟或其他優先權或發明人權爭議的各方)獲得並維護許可。這些許可證可能不以商業上合理的條款提供,或者根本不提供,或者可能是非排他性的。如果我們無法獲得和維持此類許可,我們可能需要停止開發、製造和商業化一個或多個我們可能開發的候選產品。專利權的喪失或專利申請的縮小可能會限制我們阻止他人使用或商業化類似或相同技術和產品的能力。上述任何情況可能對我們的業務、經營業績、財務狀況及前景造成重大不利影響。
獲得和維持專利保護取決於遵守政府專利機構提出的各種程序、文件提交、費用支付和其他要求,如果不遵守這些要求,專利保護可能會減少或取消。
任何已發佈專利的定期維護費、續期費、年金費和各種其他政府費用都將在專利有效期內分幾個階段支付給美國專利商標局和外國專利機構。美國專利商標局和各種外國政府專利機構要求在專利申請過程中和專利頒發後遵守一些程序、文件、費用支付和其他類似規定。雖然在某些情況下,意外失效可以根據適用規則通過支付逾期費或其他方式來補救,但在某些情況下,不遵守規定可能導致專利或專利申請的放棄或失效,從而導致專利權在相關司法管轄區的部分或全部喪失。可能導致專利放棄或失效的違規事件包括但不限於未能在規定的時限內對官方行為作出迴應、未支付費用以及未能適當合法化和提交正式文件。在此情況下,我們的競爭對手可能會以類似或相同的產品或平臺進入市場,這可能會對我們的業務前景及財務狀況造成重大不利影響。
我們的外國知識產權有限,可能無法在全球範圍內保護我們的知識產權。
我們可能無法在美國以外地區為我們的候選產品提供通用覆蓋。在全世界所有國家對候選產品的專利進行申請、起訴和辯護,費用高昂,而且美國以外的一些國家的知識產權範圍可能不如美國的知識產權那麼廣。此外,一些外國的法律對知識產權的保護程度並不像美國的聯邦和州法律那樣。因此,我們可能無法阻止第三方在美國以外的所有國家實施我們的發明,或在美國或其他司法管轄區銷售或進口使用我們的發明製造的產品。競爭對手可能會在我們尚未獲得專利保護的司法管轄區使用我們的技術來開發自己的產品,進而,可能會將侵權產品出口到我們有專利保護的地區,但執法力度不如美國強。這些產品可能會與我們的候選產品競爭,並且在我們沒有任何已發佈專利的司法管轄區,我們的專利申請或其他知識產權可能不有效或不足以阻止它們競爭。我們的專利組合還處於早期階段。我們將需要在適用的截止日期之前決定是否以及在哪個司法管轄區為我們的產品組合中的各種發明尋求保護。
許多公司在外國司法管轄區保護和捍衞知識產權方面遇到了重大問題。某些國家,特別是某些發展中國家的法律制度不贊成專利、商業祕密和其他知識產權保護的實施,特別是與生物製藥產品有關的保護,這可能使我們難以阻止侵犯我們可能擁有的或在未來獲得許可的任何專利,或在銷售侵犯我們所有權的競爭產品。為了強制執行我們在專利申請中可能擁有的任何權利,或我們將來在外國司法管轄區擁有的任何專利,可能會導致巨大的成本,並轉移我們的努力和注意力,從我們的業務的其他方面,可以把我們擁有的專利我們的專利申請面臨着無法發佈的風險,並可能引發第三方,對我們提出索賠。我們可能不會在我們發起的任何訴訟中獲勝,並且所判的損害賠償或其他補救措施(如有)可能沒有商業意義。因此,我們在世界各地執行知識產權的努力可能不足以從我們開發或許可的知識產權中獲得重大商業優勢。
許多國家都有強制許可法,根據該法律,專利所有人可能被迫向第三方授予許可。此外,許多國家限制專利對政府機構或政府承包商的可轉讓性。在這些國家,專利所有人的補救措施可能有限,這可能會嚴重削弱該專利的價值。倘吾等被迫就吾等可能擁有或日後與吾等業務相關之任何專利授出許可予第三方,吾等之競爭地位可能受損,吾等之業務、財務狀況、經營業績及前景亦可能受到不利影響。
如果我們無法為我們目前或未來可能開發的任何候選產品獲得專利期延長和數據獨佔權,我們的業務可能會受到重大損害。
根據我們可能開發的任何當前或未來候選產品的FDA上市批准的時間、持續時間和細節,我們可能擁有或在未來獲得許可的一項或多項美國專利可能符合1984年《藥品價格競爭和專利期限恢復法案》或哈奇—韋克斯曼修正案的有限專利期限延長。Hatch—Waxman修正案允許專利期限最多延長五年,作為對FDA監管審查過程中損失的專利期限的補償。專利有效期延長不能延長專利的剩餘有效期,自產品批准之日起總共超過14年,只能延長一項專利,並且只有涵蓋已批准藥物、其使用方法或其製造方法的權利要求可以延長。然而,我們可能無法獲得延期,例如,在測試階段或監管審查過程中未能履行盡職調查,未能在適用的期限內申請,未能在相關專利到期前申請,或未能滿足適用的要求。此外,專利保護的適用期限或範圍可能比我們要求的短。如果我們無法獲得專利期限延長或任何此類延長的期限短於我們的要求,我們的競爭對手可能會在我們專利申請中發佈的任何專利到期後獲得競爭產品的批准,我們的業務、財務狀況、經營業績和前景可能會受到重大損害。
如果我們的商標和商號沒有得到充分的保護,那麼我們可能無法在我們感興趣的商標中建立起知名度,我們的業務可能會受到不利影響。
我們的商標或商號可能會受到質疑、侵犯、淡化、規避或宣佈為通用或被認定為侵犯其他商標。我們打算依靠註冊和普通法保護我們的商標。我們可能無法保護我們對這些商標和商號的權利,或可能被迫停止使用這些名稱,我們需要這些名稱,以獲得我們感興趣的市場中的潛在合作伙伴或客户的認可。在商標註冊過程中,我們可能會收到來自USPTO的辦公室行動,反對我們的商標註冊。雖然我們將有機會迴應這些反對意見,但我們可能無法克服這些反對意見。此外,在USPTO和許多外國司法管轄區的類似機構中,第三方有機會反對待審商標申請和/或尋求取消註冊商標。我們可能會對我們的商標提起異議或撤銷訴訟,我們的商標可能無法在此類訴訟中繼續存在。倘我們無法取得註冊商標或基於我們的商標及商號建立知名度,我們可能無法有效競爭,我們的業務可能受到不利影響。
許多因素可能會限制我們的知識產權所提供的任何潛在競爭優勢。
我們的知識產權(無論擁有或授權)未來提供的保護程度並不確定,因為知識產權有侷限性,可能無法充分保護我們的業務,為競爭對手或潛在競爭對手提供進入壁壘,或允許我們保持競爭優勢。此外,如果第三方擁有涵蓋我們技術實踐的知識產權,我們可能無法充分行使知識產權或從中提取價值。以下例子是説明性的:
•我們擁有的專利申請或將來可能獲得許可的專利申請可能不會導致已發佈的專利;
•我們可能擁有或在未來獲得許可的專利,可能不會為我們提供任何競爭優勢,可能縮小範圍,或可能受到質疑並被認定無效或無法執行的專利;
•其他人可能能夠開發和/或實踐技術,包括與我們候選產品的化學成分相似的化合物,與我們的技術或技術的方面相似,但不包括在我們可能擁有的或將來許可的任何專利的權利要求中,如果任何專利發佈;
•第三方可能在我們不尋求和獲得專利保護的司法管轄區與我們競爭;
•我們或我們未來的許可人或合作者可能不是第一個使我們擁有或將來可能獲得許可的專利申請所涵蓋的發明的人;
•我們或我們未來的許可人或合作者可能不是第一個就特定發明提交專利申請的人;
•其他人可以獨立開發類似或替代技術,而不侵犯、盜用或以其他方式侵犯我們的知識產權;
•我們的競爭對手可能會在美國和其他國家進行研究和開發活動,為某些研究和開發活動提供免受專利侵權指控的避風港,以及在我們沒有專利權的國家進行研究和開發活動,然後可能利用從這些活動中獲得的信息來開發有競爭力的產品,在我們的主要商業市場銷售;
•我們可能無法以合理的條款或根本不能獲得和/或保持必要的許可證;
•第三方可能主張我們的知識產權的所有權權益,如果勝訴,此類糾紛可能會阻止我們對該知識產權行使專有權或任何權利;
•我們可能會選擇不提交專利以保留某些商業祕密或專有技術,而第三方隨後可能會提交涵蓋此類商業祕密或專有技術的專利;
•我們可能無法對我們的商業祕密或其他專有信息保密;
•我們可能不會開發或許可其他可申請專利的專有技術;以及
•他人的專利可能會對我們的業務產生不利影響。
如果發生任何此類事件,都可能嚴重損害我們的業務、財務狀況、運營結果和前景。
知識產權訴訟的風險
第三方對知識產權侵權、盜用或其他侵權行為的索賠可能會花費高昂且耗時,並可能阻礙或延遲我們的產品發現和開發工作。
圍繞精準醫療的知識產權環境非常擁擠,第三方可能會提起法律訴訟,指控我們侵犯、盜用或以其他方式侵犯其知識產權,其結果將不確定,並可能對我們的業務成功造成重大不利影響。我們的商業成功取決於我們開發、生產、營銷和銷售我們當前和未來的候選產品的能力,以及在不侵犯、盜用或以其他方式侵犯第三方知識產權的情況下使用我們的專有技術。有大量涉及生物技術和製藥行業的專利和其他知識產權的訴訟,以及質疑專利的行政程序,包括衍生,干涉,複審,各方之間的審查,和授予後審查程序在美國專利商標局或反對和其他類似的程序在外國司法管轄區。我們或我們的任何未來許可人或戰略合作伙伴可能成為未來對抗性訴訟或訴訟的當事方,或面臨或威脅,該訴訟由擁有專利或其他知識產權的第三方提出,指控我們當前或未來的候選產品和/或專有技術侵犯、盜用或以其他方式侵犯其知識產權。我們無法向您保證我們已經開發、正在開發或將來可能開發的候選產品和其他技術不會或不會侵犯、盜用或以其他方式侵犯第三方現有或未來擁有的專利或其他知識產權。在我們開發候選產品的領域中,存在着許多由第三方擁有的美國和外國授權專利和待審專利申請。隨着生物技術和製藥行業的擴張以及更多專利的發佈,我們的候選產品可能引起侵犯他人專利權的索賠的風險增加。此外,包括我們在內的行業參與者並不總是清楚哪些專利涵蓋各種類型的藥物、產品或其使用或製造方法。因此,由於在我們的領域中發佈了大量的專利和提交的專利申請,可能存在第三方聲稱他們擁有涵蓋我們候選產品、技術或方法的專利權的風險。
如果第三方聲稱我們侵犯、盜用或以其他方式侵犯其知識產權,我們可能面臨許多問題,包括但不限於:
•侵權、挪用和其他知識產權索賠,無論案情如何,提起訴訟可能既昂貴又耗時,可能會轉移我們管理層對核心業務的注意力,並可能影響我們的聲譽;
•侵權、挪用或其他侵權行為的實質性損害賠償,如果法院裁定爭議產品或技術侵犯、挪用或侵犯第三方權利,我們可能必須支付,如果法院發現侵權是故意的,我們可能被勒令支付三倍損害賠償金和專利權人的律師費;
•禁止我們開發、生產、營銷或銷售我們的候選產品,包括BDTX—1535或BDTX—4933,或禁止我們使用我們的專有技術,除非第三方以商業上合理的條款或根本不需要這樣做;
•如果從第三方獲得許可,我們可能需要支付大量使用費、預付費用和其他金額,和/或為我們的產品授予知識產權交叉許可,或者我們獲得的許可可能是非排他性的,這將允許第三方使用相同的知識產權與我們競爭;
•重新設計我們的候選產品或流程,使其不侵犯、盜用或侵犯第三方知識產權,這可能是不可能的,或可能需要大量的金錢開支和時間;
•可能會公佈聽證會、動議或其他臨時程序或事態發展的結果,如果證券分析師或投資者認為這些結果是負面的,可能會對我們普通股的價格產生重大不利影響。
我們的一些競爭對手可能比我們更有效地承受複雜專利訴訟的費用,因為他們擁有更多的資源。此外,任何訴訟的發起和繼續產生的任何不確定性都可能對我們籌集繼續運營所需資金的能力產生重大不利影響,或者可能對我們的業務、運營結果、財務狀況和前景產生重大不利影響。上述任何情況的發生都可能對我們的業務、財務狀況、經營結果或前景產生重大不利影響。
我們可以選擇通過請求美國專利商標局在單方面複審、各方間審查或授權後審查程序中審查專利權利要求,來挑戰第三方美國專利中權利要求的可專利性。這些程序是昂貴的,可能會消耗我們的時間或其他資源。我們可以選擇在歐洲專利局或其他外國專利局的專利反對程序中挑戰第三方的專利。這些反對訴訟的費用可能是巨大的,並可能消耗我們的時間或其他資源。如果我們未能在美國專利商標局、歐洲專利局或其他專利局獲得有利的結果,我們可能會面臨第三方的訴訟,指控我們的候選產品或專有技術可能侵犯了我們的專利。
第三方可能會聲稱我們在未經授權的情況下使用他們的專有技術。在美國依法頒發的專利享有有效性推定,只有在證據“清晰和令人信服”的情況下,才能推翻這一推定,這是一種更高的證明標準。可能已授予第三方專利,但我們目前並不知道這些專利對與使用或製造我們的候選產品相關的成分、配方、製造方法或治療方法的權利要求。專利申請可能需要很多年的時間才能發佈。此外,由於美國的一些專利申請可能在專利發佈前保密,美國和許多外國司法管轄區的專利申請通常在提交後18個月才公佈,科學文獻中的出版物往往落後於實際發現,因此我們不能確定其他公司沒有提交涵蓋我們的候選產品或技術的專利申請。如果任何此類專利申請作為專利頒發,並且如果此類專利優先於我們的專利申請或我們可能擁有或許可的專利,我們可能被要求獲得第三方擁有的、可能無法以商業合理的條款獲得或根本無法獲得的權利,或可能僅以非獨家基礎獲得的權利。可能存在當前正在處理的專利申請,這些申請可能會導致我們的候選產品可能會侵犯已頒發的專利。我們知道由第三方擁有的專利,但我們認為這些專利與我們的候選產品或其他技術無關,也有可能被我們的候選產品或其他技術侵犯。此外,第三方可能會在未來獲得專利,並聲稱使用我們的技術侵犯了這些專利。此外,我們可能無法識別相關專利,或錯誤地得出專利無效、不可強制執行、用盡或未被我們的活動侵犯的結論。如果有管轄權的法院持有任何第三方專利,以涵蓋我們的候選產品的製造過程、在製造過程中使用或形成的分子或任何最終產品本身,則任何此類專利的持有者可能能夠阻止我們將候選產品商業化的能力,除非我們根據適用專利獲得了許可,或者直到該等專利到期或最終被確定為無效或不可執行。同樣,如果有管轄權的法院持有任何第三方專利,涵蓋我們的配方、製造工藝或使用方法的各個方面,包括聯合療法或患者選擇方法,則任何此類專利的持有者可能能夠阻止我們開發候選產品並將其商業化的能力,除非我們獲得了許可證,或者直到該專利到期或最終被確定為無效或不可執行。在任何一種情況下,這樣的許可可能都不會以商業上合理的條款或根本不存在。如果我們不能以商業上合理的條款獲得第三方專利的必要許可,或者根本不能,我們將候選產品商業化的能力可能會受到損害或推遲,這反過來可能會嚴重損害我們的業務。即使我們獲得了許可,它也可能是非排他性的,從而使我們的競爭對手能夠訪問向我們許可的相同技術。此外,如果我們的專利申請或我們未來可能擁有或許可的任何專利所提供的保護的廣度或強度受到威脅,可能會阻止公司與我們合作,授權、開發或商業化當前或未來的候選產品。
對我們提出索賠的各方可能會尋求並獲得禁令或其他公平救濟,這可能會有效地阻止我們進一步開發和商業化我們的候選產品。對這些索賠的辯護,無論其是非曲直,都可能涉及鉅額訴訟費用,並將大量轉移我們業務中的員工資源。如果針對我們的侵權、挪用或其他侵權行為索賠成功,我們可能需要支付大量損害賠償金,包括故意侵權的三倍損害賠償金和律師費,從第三方獲得一個或多個許可證,支付版税或重新設計我們的侵權產品,這可能是不可能的,或者需要大量的時間和金錢支出。我們無法預測是否會有這樣的許可證,或者是否會以商業合理的條款提供。此外,即使在沒有訴訟的情況下,我們也可能需要或可能選擇從第三方獲得許可證,以推進我們的研究或允許我們的候選產品商業化。我們可能無法以合理的成本或合理的條款獲得這些許可證中的任何一項,如果有的話。在這種情況下,我們將無法進一步開發和商業化我們的候選產品,這可能會嚴重損害我們的業務。
我們可能會捲入保護或強制執行我們的知識產權的訴訟,包括我們可能擁有的或未來許可中的任何專利,這可能是昂貴、耗時和不成功的。
競爭對手可能會侵犯我們未來可能擁有的或許可中的任何專利。此外,我們可能擁有的或許可中的任何專利也可能涉及發明權、優先權、有效性或不可執行性糾紛。為了對抗侵權或未經授權的使用,我們可能會被要求提出侵權索賠,這可能是昂貴和耗時的。我們可能不會在我們發起的任何訴訟中獲勝,而且所判給的損害賠償或其他補救措施(如果有的話)可能沒有商業意義。此外,在侵權訴訟中,法院可以根據《美國法典》第35篇第271(E)(1)節的規定,裁定我們未來可能擁有或許可的任何專利中的一項或多項無效或不可強制執行,或者另一方使用我們可能獲得專利的技術屬於專利侵權的安全港。還有一種風險是,即使這些專利的有效性得到支持,法院也可能會以我們未來可能擁有的任何專利或許可中的任何專利不涵蓋相關技術或此類第三方的活動不侵犯我們的專利申請或我們未來可能擁有或許可中的任何專利為由,拒絕阻止另一方使用相關技術。任何訴訟或辯護程序中的不利結果可能會使我們未來可能擁有或許可的任何專利中的一項或多項面臨被無效、持有不可執行或狹隘解釋的風險,並可能使我們的專利申請面臨無法發佈的風險。對這些索賠的辯護,無論其是非曲直,都將涉及鉅額訴訟費用,並將大量轉移我們業務中的員工資源。如果針對我們的侵權索賠成功,我們可能必須支付大量損害賠償,包括故意侵權的三倍損害賠償金和律師費、從第三方獲得一個或多個許可證、支付版税或重新設計我們的侵權產品,這可能是不可能的,或者需要大量的時間和金錢支出。此類訴訟或訴訟可能大幅增加我們的運營虧損,並減少可用於開發活動或任何未來銷售、營銷或分銷活動的資源。我們可能沒有足夠的財政或其他資源來適當地進行此類訴訟或訴訟程序。我們的一些競爭對手可能比我們更有效地承擔這類訴訟或法律程序的費用,因為他們有更多的財政資源和更成熟和發展的知識產權組合。專利訴訟或其他訴訟的發起和繼續所產生的不確定性可能會對我們在市場上的競爭能力產生重大不利影響。
由第三方發起或由美國專利商標局提起的授權後訴訟程序可能是必要的,以確定關於我們的專利申請或我們未來可能擁有或許可中的任何專利的發明的有效性或優先權。這些訴訟費用高昂,不利的結果可能會導致我們現有專利權的損失,並可能要求我們停止使用相關技術或試圖從勝利方那裏獲得許可權。如果勝利方不以商業上合理的條件向我們提供許可證,我們的業務可能會受到損害。除了可能的USPTO審查程序外,我們還可能成為歐洲專利局(EPO)專利反對程序的一方,或其他外國專利局的類似程序的一方,在這些程序中,我們的外國專利受到挑戰。這些反對或類似訴訟的費用可能是巨大的,並可能導致某些權利要求的範圍喪失或整個專利的損失。美國專利商標局、歐洲專利局或其他專利局的不利結果可能會導致我們失去排除他人在相關國家或司法管轄區實施我們的一項或多項發明的權利,這可能會對我們的業務產生實質性的不利影響。
訴訟或贈款後訴訟程序可能導致不利於我們利益的決定,即使我們成功,也可能導致鉅額成本,並分散我們的管理層和其他員工的注意力。我們可能無法防止我們的商業祕密或機密信息被盜用,特別是在那些法律可能沒有像美國那樣充分保護這些權利的國家。
此外,由於知識產權訴訟需要大量的披露,在這類訴訟期間,我們的一些機密信息可能會因披露而被泄露。此外,可能會公佈聽證會、動議或其他臨時程序或事態發展的結果。如果證券分析師或投資者認為這些結果是負面的,可能會對我們普通股的價格產生重大不利影響。
我們可能無法檢測到對我們可能擁有的或未來許可中的任何專利的侵權行為。即使我們發現第三方侵犯了我們可能擁有的或未來許可中的任何專利,我們也可以選擇不對第三方提起訴訟或與其達成和解。如果我們後來以專利侵權為由起訴該第三方,該第三方可能有某些法律辯護可用,否則,除了最初發現侵權行為和提起訴訟之間的延遲外,這些辯護是不可用的。這樣的法律辯護可能會使我們無法針對該第三方強制執行我們可能擁有的或許可內的任何專利。
我們可能會受到挑戰任何知識產權的發明權或所有權的索賠,包括我們未來可能擁有的或許可中的任何專利。
我們可能會受到前僱員、合作者或其他第三方作為發明人或共同發明人對我們未來可能擁有或許可的任何專利、商業祕密或其他知識產權的權益的指控。例如,我們可能會因參與開發我們的候選產品或其他技術的員工、顧問或其他人的義務衝突而產生庫存糾紛。我們通常與員工、顧問和承包商簽訂保密和知識產權轉讓協議。這些協議一般規定,當事人在向我們提供服務的過程中構思的發明將是我們的專有財產。然而,這些協議可能不會得到遵守,也可能不會有效地將知識產權轉讓給我們。此外,在某些情況下,我們可能無法就這種所有權進行談判。關於知識產權所有權或發明權的爭端也可能在其他情況下發生,例如合作和贊助研究。如果我們面臨一場挑戰我們在專利或其他知識產權上或對其權利的糾紛,這樣的糾紛可能代價高昂且耗時。訴訟可能是必要的,以對抗這些和其他挑戰我們未來可能擁有的或許可中的任何專利、商業祕密或其他知識產權的庫存的索賠。如果我們失敗了,除了支付金錢損害賠償外,我們還可能失去我們認為是自己的知識產權的寶貴權利,例如對我們的產品候選產品和其他技術非常重要的知識產權的獨家所有權或使用權。即使我們成功地對此類索賠進行了辯護,訴訟也可能導致鉅額成本,並分散管理層和其他員工的注意力。上述任何一項都可能對我們的業務、財務狀況、經營結果和前景產生重大不利影響。
我們可能會受到以下指控的影響:我們的員工、顧問或獨立承包商錯誤地使用或披露了第三方或競爭對手的機密信息或據稱的商業祕密,或者違反了與競爭對手的競業禁止或競標協議。
我們收到了來自第三方的機密和專有信息。此外,在生物技術和製藥行業中常見的情況是,我們僱用的個人以前在大學或其他生物技術或製藥公司,包括我們的競爭對手或潛在競爭對手,在某些情況下直到最近。我們可能會聲稱我們或我們的員工、顧問或獨立承包商無意中或以其他方式使用或披露了這些第三方或我們員工的前僱主或我們的顧問或承包商當前或前客户或客户的機密信息或商業機密。此外,我們過去和將來可能會受到關於我們導致員工違反其不競爭或不邀約協議條款的索賠。訴訟或仲裁可能是必要的,以抗辯這些索賠。如果我們未能為任何此類索賠辯護,除了支付金錢損失外,我們可能會失去寶貴的知識產權或人員。即使我們成功就該等索償作出抗辯,與知識產權索償有關的訴訟或其他法律程序及可能的後果可能會導致高昂成本,並分散我們的管理層及員工的注意力。任何訴訟或相關威脅都可能對我們聘用員工的能力產生不利影響。關鍵人員或其工作產品的流失可能會妨礙或妨礙我們將候選產品商業化的能力,這可能會對我們的業務、經營業績和財務狀況造成不利影響。此外,聽證會、動議或其他臨時程序或事態發展的結果可能會公佈,如果證券分析師或投資者認為這些結果是負面的,它可能會對我們的普通股價格產生重大不利影響。此類訴訟或訴訟可能會大幅增加我們的經營虧損,並減少我們可用於開發活動的資源。我們可能沒有足夠的財務或其他資源來充分進行此類訴訟或程序。我們的部分競爭對手可能比我們更有效地承擔此類訴訟或程序的費用,因為他們的財務資源要大得多。因專利訴訟或其他知識產權相關訴訟的發起及持續而導致的不穩定可能對我們在市場上的競爭能力造成不利影響。
與我們依賴第三方有關的風險
我們依賴第三方進行臨牀前研究和臨牀試驗。如果這些第三方不能正確和成功地履行其合同職責或在預期的最後期限前完成,我們可能無法獲得監管部門對我們的候選產品的批准或將其商業化。
我們利用並依賴獨立的研究人員和合作者,如醫療機構、CRO、合同製造組織或CMO,以及戰略合作伙伴,根據與我們達成的協議進行和支持我們的臨牀前研究和臨牀試驗。我們必須與CRO、試驗點和CMO談判預算和合同,我們可能無法以有利的條件這樣做,這可能會導致我們的開發時間表延遲和成本增加。在我們的臨牀前研究和臨牀試驗過程中,我們將嚴重依賴這些第三方,我們只控制他們活動的某些方面。因此,與完全依靠我們自己的員工相比,我們對這些臨牀前研究和臨牀試驗的進行、時間和完成以及通過臨牀前研究和臨牀試驗開發的數據的管理將不那麼直接控制。然而,我們有責任確保我們的每項研究都按照適用的協議、法律和法規要求以及科學標準進行,並且我們對第三方的依賴不會免除我們的監管責任。我們和這些第三方必須遵守GCP,這是FDA和類似的外國監管機構在臨牀開發中對候選產品執行的法規和指導方針。監管當局通過定期檢查試驗贊助商、主要調查人員和試驗地點來執行這些GCP。如果我們或這些第三方中的任何一方未能遵守適用的GCP法規,在我們的臨牀試驗中產生的臨牀數據可能被認為是不可靠的,FDA或類似的外國監管機構可能會要求我們在批准我們的上市申請之前進行額外的臨牀試驗。我們不能向您保證,在檢查後,這些監管機構將確定我們的任何臨牀試驗是否符合GCP規定。此外,我們的臨牀試驗必須使用根據cGMP規定生產的藥品進行,這將需要大量的測試患者。我們或這些第三方未能遵守這些規定或未能招募足夠數量的患者可能需要我們重複臨牀試驗,這將推遲監管批准過程。此外,如果其中任何第三方違反聯邦或州欺詐和濫用或虛假索賠法律法規或醫療保健隱私和安全法,我們的業務可能會受到牽連。
進行我們臨牀試驗的任何第三方不是、也不會是我們的員工,並且,除了我們與該等第三方達成的協議提供的補救措施外,我們無法控制他們是否將足夠的時間和資源投入到我們正在進行的臨牀和非臨牀候選產品上。這些第三方也可能與其他商業實體有關係,包括我們的競爭對手,他們可能還在為這些實體進行臨牀試驗或其他藥物開發活動,這可能會影響他們代表我們的表現。如果這些第三方未能成功履行其合同職責或義務或在預期期限內完成,如果他們需要更換,或者如果他們獲得的臨牀數據的質量或準確性因未能遵守我們的臨牀方案或監管要求或其他原因而受到影響,我們的臨牀試驗可能會被延長、推遲或終止,我們可能無法完成我們候選產品的開發、獲得監管部門的批准或成功地將其商業化。因此,我們的財務業績和候選產品的商業前景將受到損害,我們的成本可能會增加,我們創造收入的能力可能會被推遲。
更換或增加第三方來進行我們的臨牀前研究和臨牀試驗涉及大量成本,並需要廣泛的管理時間和重點。此外,當新的第三方開始工作時,有一個自然的過渡期。因此,會出現延遲,這可能會對我們滿足期望的臨牀開發時間表的能力產生實質性影響。
我們可能會在未來形成或尋求合作或戰略聯盟,或達成額外的許可安排,但我們可能沒有意識到此類合作、聯盟或許可安排的好處。
我們可能會結成或尋求戰略聯盟,建立合資企業或合作關係,或與第三方達成額外的許可安排,我們相信這些安排將補充或加強我們關於我們的候選產品和任何未來可能開發的候選產品的開發和商業化努力。這些關係中的任何一項都可能要求我們產生非經常性費用和其他費用,增加我們的短期和長期支出,發行稀釋我們現有股東或擾亂我們的管理和業務的證券。
此外,我們在尋找合適的戰略合作伙伴方面面臨着激烈的競爭,談判過程既耗時又複雜。此外,我們為我們的候選產品建立戰略合作伙伴關係或其他替代安排的努力可能不會成功,因為它們可能被認為處於合作努力的開發階段太早,第三方可能不認為我們的候選產品具有展示安全性、有效性、純度和有效性並獲得市場批准的必要潛力。
此外,涉及我們候選產品的合作面臨許多風險,其中可能包括以下幾點:
•協作者在確定他們將應用於協作的努力和資源方面有很大的自由裁量權;
•合作伙伴可能不會對我們的候選產品進行開發和商業化,或者可能會基於臨牀試驗結果、由於收購競爭產品而導致其戰略重點的變化、資金的可用性或其他外部因素(例如轉移資源或創造相互競爭的優先事項的業務合併)而選擇不繼續或更新我們的候選產品的開發或商業化;
•合作者可以推遲臨牀試驗,為臨牀試驗提供足夠的資金,停止臨牀試驗,放棄候選產品,重複或進行新的臨牀試驗,或要求新的候選產品配方進行臨牀測試;
•合作者可以獨立開發或與第三方開發直接或間接與我們的候選產品競爭的產品;
•擁有一個或多個產品的營銷和分銷權利的合作者可能沒有投入足夠的資源用於其營銷和分銷;
•合作者可能沒有正確維護或捍衞我們的知識產權,或可能以某種方式使用我們的知識產權或專有信息,從而導致實際或威脅的訴訟,從而危及我們的知識產權或專有信息或使我們面臨潛在的責任;
•我們與合作者之間可能發生糾紛,導致我們候選產品的研究、開發或商業化的延遲或終止,或導致昂貴的訴訟或仲裁,分散管理層的注意力和資源;
•合作可能被終止,如果終止,可能需要額外的資金來進一步開發適用的候選產品或將其商業化;以及
•合作者可能擁有或共同擁有我們通過與他們合作而產生的產品的知識產權,在這種情況下,我們沒有將此類知識產權商業化的獨家權利。
因此,如果我們達成額外的合作協議和戰略合作伙伴關係或授權我們的候選產品,如果我們無法成功地將這些交易與我們現有的運營和公司文化整合,我們可能無法實現這些交易的好處,這可能會延遲我們的時間表或以其他方式對我們的業務造成不利影響。我們也無法確定,在戰略交易或許可證之後,我們將實現證明該交易合理的收入或特定淨收入。與我們的候選產品相關的新合作或戰略合作協議的任何延遲可能會延遲我們在某些地區針對某些適應症的候選產品的開發和商業化,這將損害我們的業務前景、財務狀況和經營業績。
我們目前依賴並預計未來將依賴於使用第三方設施或第三方的製造套件來製造我們的候選產品。如果我們無法使用第三方製造套件,或者第三方製造商未能向我們提供足夠數量的候選產品,或者未能以可接受的質量水平或價格提供,我們的業務可能受到損害。
我們目前沒有擁有任何可用作臨牀規模生產和加工設施的設施,目前必須依賴外部供應商來生產我們的候選產品。我們尚未使我們的候選產品以商業規模生產,並且可能無法為我們的任何候選產品這樣做。
我們預期對有限數量的第三方製造商的依賴使我們面臨許多風險,包括:
•我們可能無法以可接受的條款或根本無法識別製造商,因為潛在製造商的數量有限,FDA必須檢查任何製造商的當前cGMP合規性,作為我們的上市申請的一部分;
•新的製造商必須接受培訓,或為我們的候選產品的生產開發實質上等同的工藝;
•我們的第三方製造商可能無法及時生產我們的候選產品或生產滿足我們臨牀和商業需求(如有)所需的數量和質量;
•合同製造商可能無法適當執行我們的製造程序和其他後勤支持要求;
•我們未來的合同製造商可能無法按照約定履行職責,可能無法為我們的候選產品投入足夠的資源,或者可能無法在提供臨牀試驗或成功生產、儲存和分銷我們的產品(如有)所需的時間內留在合同製造業務中;
•製造商接受FDA和相應國家機構的定期突擊檢查,以確保嚴格遵守cGMP和其他政府法規以及相應的外國標準,我們無法控制第三方製造商遵守這些法規和標準的情況;
•我們可能不擁有或不得不分享我們的第三方製造商在我們候選產品的製造過程中所做的任何改進的知識產權;
•我們的第三方製造商可能違反或終止與我們的協議;
•生產過程中使用的原材料和組件,特別是我們沒有其他來源或供應商的原材料和組件,可能由於材料或組件缺陷而無法獲得或不適合或不可接受;
•我們的合同製造商和關鍵試劑供應商可能會受到惡劣天氣以及自然或人為災害的影響;
•我們的合同製造商可能受到經濟或地緣政治中斷或全球健康問題的影響;
•我們的合約製造商的產品質量成功率和產量可能無法接受或不一致,而我們並不能直接控制合約製造商維持足夠的品質控制,品質保證和合格員工的能力。
這些風險中的每一個都可能延遲或阻止我們的臨牀試驗或FDA批准我們的任何候選產品,導致成本上升或對我們候選產品的商業化產生不利影響。此外,我們將依賴第三方在交付給患者之前對我們的候選產品進行某些規格測試。如果這些測試沒有正確進行,測試數據不可靠,患者可能會面臨嚴重傷害的風險,FDA可能會對我們的公司施加重大限制,直到缺陷得到糾正。
我們的生產工藝需要符合FDA關於此類工藝質量和可靠性的規定。任何不遵守相關法規的行為都可能導致我們的臨牀項目延遲或終止,以及暫停或撤回任何監管批准。
為了在我們自己的工廠或第三方的工廠商業化生產我們的產品,我們需要遵守FDA的cGMP法規和指南。我們可能會在實現質量控制和質量保證方面遇到困難,並可能會出現合格人員短缺的情況。我們接受FDA和類似的外國監管機構的檢查,以確認符合適用的監管要求。由於我們的設施或第三方的設施或運營未能遵守監管要求或通過任何監管機構檢查而導致我們精密藥品的生產、灌裝—成品、包裝或儲存過程中出現的任何不遵守cGMP或其他監管要求,或延遲、中斷或其他問題,都可能嚴重損害我們開發和商業化候選產品的能力,包括導致我們臨牀試驗的精密藥物供應出現重大延遲,或臨牀試驗終止或暫停,或延遲或阻止我們候選產品的上市申請的提交或批准。重大違規行為亦可能導致實施制裁,包括警告或無標題信件、罰款、禁令、民事處罰、監管機構未能就我們的候選產品授予上市批准、延遲、暫停或撤回批准、吊銷牌照、扣押或召回產品、經營限制及刑事檢控,其中任何情況均可能損害我們的聲譽及業務。
如果我們的第三方製造商以導致傷害或違反適用法律的方式使用有害和生物材料,我們可能會承擔損害賠償責任。
我們的研發活動涉及第三方製造商控制使用潛在危險物質,包括化學和生物材料。我們的製造商受美國聯邦、州和地方法律法規的約束,管理醫療和危險材料的使用、製造、儲存、處理和處置。雖然我們相信我們的製造商使用、處理、儲存和處置這些材料的程序符合法律規定的標準,但我們無法完全消除醫療或有害材料造成的污染或傷害的風險。由於任何此類污染或傷害,我們可能承擔責任,或者地方,城市,州或聯邦當局可能會限制這些材料的使用並中斷我們的業務運營。如果發生事故,我們可能會承擔損害賠償責任或處以罰款,責任可能超出我們的資源。我們並無就醫療或有害材料所產生的責任投保。遵守適用的環境法律及法規成本高昂,而當前或未來的環境法規可能會損害我們的研究、開發和生產努力,從而損害我們的業務、前景、財務狀況或經營業績。
與管理增長和員工事務有關的風險
與我們員工相關的風險
我們高度依賴我們的關鍵人員,並預計將招聘新的關鍵人員。如果我們不能成功地吸引和留住高素質的人才,我們就可能無法成功地實施我們的商業戰略。
我們在競爭激烈的生物技術和製藥行業中的競爭能力取決於我們吸引和留住高素質的管理、科學和醫療人員的能力。我們高度依賴我們的管理層、科學和醫療人員,包括我們的總裁兼首席執行官、首席業務官兼首席財務官、首席科學官和首席醫療官。我們面對與管理層過渡有關的各種風險及不明朗因素,包括管理層的注意力從業務上轉移、未能挽留其他關鍵人員或機構知識流失。此外,我們的任何執行官、其他關鍵員工和其他科學和醫學顧問的服務損失,以及無法找到合適的替代者,都可能導致產品開發的延誤,並損害我們的業務。
我們的主要辦公室位於馬薩諸塞州劍橋。馬薩諸塞州地區是許多其他生物製藥公司和許多學術和研究機構的總部。我們的市場對技術人才的競爭非常激烈,可能會限制我們以可接受的條件或根本僱用和保留高素質人才的能力。美國移民和工作授權法律法規的變化,包括那些限制科學和專業人才流動的法律法規,可能會受到政治力量和經濟活動水平的顯著影響。如果移民或簽證法律法規的立法或行政變更損害了我們的招聘流程和目標或涉及非美國公民人員的項目,我們的業務可能會受到重大不利影響。
為鼓勵有價值的員工留在公司,除了薪酬和現金獎勵外,我們還提供了隨時間推移而歸屬的股票期權。隨時間推移而歸屬的股票期權對僱員的價值可能會受到超出我們控制範圍的股價變動的重大影響,並且在任何時候都可能不足以抵消其他公司更有利可圖的報價。儘管我們努力留住有價值的員工,但我們的管理層、科學和開發團隊成員可能會在短時間內終止與我們的僱傭關係。雖然我們與主要僱員訂立僱傭協議,但該等僱傭協議規定可隨意僱傭,即任何僱員均可隨時離職,不論是否通知。我們的成功還取決於我們繼續吸引、留住和激勵高技能的初級、中級和高級管理人員以及初級、中級和高級科學和醫療人員的能力。
與我們的業務運營和增長相關的風險
我們將需要擴大我們組織的規模,我們在管理這種增長時可能會遇到困難。
截至2023年12月31日,我們共有52名全職員工。我們打算聘請新員工進行未來的發展活動。任何延遲僱用該等新員工可能導致我們的研發活動延遲,並會損害我們的業務。隨着我們的發展和商業化計劃和戰略的制定,我們預計需要額外的管理,運營,銷售,營銷,財務和其他人員來擴大我們的業務。未來的增長將給管理層成員帶來重大額外的責任,包括:
•識別、招聘、整合、維持和激勵更多的員工;
•有效管理我們的內部開發工作,包括對我們的候選產品的臨牀和FDA審查過程,同時遵守我們對承包商和其他第三方的合同義務;以及
•改進我們的業務、財務和管理控制、報告系統和程序。
我們未來的財務表現和我們將候選產品商業化的能力,部分取決於我們有效管理任何未來增長的能力,我們的管理層也可能不得不將不成比例的注意力從日常活動轉移,以便投入大量時間管理這些增長活動。
我們目前並在可預見的將來將繼續在很大程度上依賴某些獨立組織、顧問和顧問來提供某些服務,包括監管批准、臨牀試驗管理和生產的幾乎所有方面。我們無法保證獨立組織、顧問和顧問的服務將繼續在需要時及時為我們提供,也無法保證我們能夠找到合格的替代者。此外,如果我們無法有效管理我們的外包活動,或者如果顧問提供的服務的質量或準確性因任何原因而受到影響,我們的臨牀試驗可能會被延長、延遲或終止,我們可能無法獲得監管部門對候選產品的批准或以其他方式推進我們的業務。我們無法保證我們將能夠管理現有的顧問或以經濟合理的條款找到其他合資格的外部承包商和顧問。
如果我們不能通過僱傭新員工和擴大我們的顧問和承包商團隊來有效地擴大我們的組織,我們可能無法成功地執行進一步開發和商業化我們的候選產品所需的任務,因此可能無法實現我們的研究、開發和商業化目標。
我們的內部計算機系統,或我們的第三方CRO或其他承包商或顧問使用的計算機系統,可能會出現故障或遭受安全漏洞,這可能導致我們候選產品的開發計劃受到重大幹擾。
儘管已實施保安措施,我們及現時及日後的首席工程師及其他承建商及顧問的內部電腦系統,仍可能容易受到電腦病毒、未經授權的存取、自然災害、電訊及電力故障的破壞。雖然我們迄今尚未經歷任何此類重大系統故障或安全漏洞,但如果此類事件發生並導致我們的運營中斷,則可能導致我們的開發計劃和業務運營受到重大幹擾。例如,已完成或未來臨牀前研究和臨牀試驗的數據丟失可能導致監管部門批准工作的延遲,並顯著增加我們恢復或複製數據的成本。同樣,我們依賴第三方生產我們的候選產品和進行臨牀試驗,與他們的計算機系統相關的類似事件也可能對我們的業務造成重大不利影響。如果任何中斷或安全漏洞導致我們的數據或應用程序丟失或損壞,或不當披露機密或專有信息,我們可能會承擔責任,我們候選產品的進一步開發和商業化可能會被推遲。
業務中斷可能會嚴重損害我們未來的收入和財務狀況,並增加我們的成本和支出。
我們的業務,以及我們的CRO、CMO和其他承包商和顧問的業務,可能會受到地震、電力短缺、電信故障、缺水、洪水、颶風、颱風、火災、極端天氣條件、醫療流行病和其他自然或人為災難或業務中斷的影響,我們主要是自我保險。任何這些業務中斷的發生都可能嚴重損害我們的運營和財務狀況,並增加我們的成本和支出。我們依賴第三方製造商來生產我們的候選產品。如果這些供應商的運營受到人為或自然災害或其他業務中斷的影響,我們獲得候選產品的臨牀供應的能力可能會受到幹擾。
如果對我們提起產品責任訴訟,我們可能會承擔大量責任,並可能被要求限制我們候選產品的商業化。
由於我們的候選產品進行有計劃的臨牀測試,我們面臨着固有的產品責任風險,如果我們將任何產品商業化,我們將面臨更大的風險。例如,如果我們的候選產品在臨牀測試、製造、營銷或銷售期間導致或被認為造成傷害,或被發現在其他方面不適合,我們可能會被起訴。任何此類產品責任索賠可能包括對製造缺陷、設計缺陷、未能就產品固有危險發出警告、疏忽、嚴格責任或違反保修的指控。根據州消費者保護法,索賠也可以主張。如果我們不能成功地在產品責任索賠中為自己辯護,我們可能會招致重大責任或被要求限制我們候選產品的商業化。即使是成功的防禦也需要大量的財政和管理資源。無論案情如何或最終結果如何,賠償責任可能會導致:
•對我們的候選產品或我們可能開發的產品的需求減少;
•損害我們的聲譽;
•臨牀試驗參與者的退出;
•由監管機構發起調查;
•相關訴訟的辯護費用;
•轉移管理層的時間和資源;
•對試驗參與者或患者給予鉅額金錢獎勵;
•產品召回、撤回或貼標籤、營銷或促銷限制;
•收入損失;
•耗盡所有可用的保險和我們的資本資源;
•無法將任何候選產品商業化;以及
•我們的股價下跌了。
未能以可接受的成本獲得或保留足夠的產品責任保險,以防範潛在的產品責任索賠,可能會阻止或阻礙我們單獨或與公司合作伙伴開發的產品的商業化。雖然我們有臨牀試驗保險,但我們的保單也有各種排除,我們可能會受到產品責任索賠的影響,而我們沒有承保範圍。我們可能需要支付任何超出我們的承保範圍限制或不在我們的保險覆蓋範圍內的法院裁決或和解協議中達成的任何金額,並且我們可能沒有或能夠獲得足夠的資本來支付這些金額。即使我們與任何未來的公司合作伙伴達成的協議使我們有權獲得損失賠償,如果出現任何索賠,這種賠償可能是不可用的或足夠的。
我們可能無法實現向LaunchPad治療公司提供資產和許可證的部分或全部預期好處。
我們向LaunchPad治療公司或LaunchPad提供的某些早期發現階段抗體計劃的預期財務、戰略和其他好處,以及我們的MAP藥物發現引擎用於某些大分子療法的許可,可能無法實現。
與税務有關的風險
我們利用我們的淨營業虧損結轉和某些其他税務屬性的能力可能是有限的。
根據經修訂的1986年《國內税收法》第382條和第383條,如果一家公司經歷了“所有權變更”,(一般定義為在三年內5%的股東改變其股權所有權(按價值計算)超過50%),公司使用其變動前淨經營虧損結轉和其他變動前税項屬性來抵銷其變動後應納税收入的能力可能受到限制。由於我們最近的私人配售和過去三年發生的其他交易,我們可能已經經歷了,並可能經歷了“所有權變更”。我們也可能會經歷股權變更,因為我們的股權隨後的轉移。截至2023年12月31日,我們的美國聯邦淨經營虧損結轉總額為2.75億美元,州淨經營虧損結轉總額為1.82億美元,美國聯邦研發税收抵免結轉總額為1000萬美元,其中每項都將在2043年的不同日期開始到期,如果我們經歷“所有權變更”,這可能會受到限制。
從2022年開始,TCJA取消了扣除研發支出的選項,並要求納税人根據IRC第174條將其資本化並攤銷為5年的美國支出,或15年的非美國支出。雖然國會正在考慮立法,將攤銷要求推遲到以後幾年,我們不能保證,該條款將被廢除或以其他方式修改。我們已遵循現行立法,在財務報表中將第174條支出資本化,但我們預計,如果廢除或修改立法追溯至二零二二年,我們的實際税率不會發生重大變化,或對我們的經營現金產生重大影響。
與我們普通股所有權相關的風險
與我們證券投資相關的風險
我們的股票價格波動較大,您可能會損失全部或部分投資。
與其他生物製藥公司普通股的交易價格類似,我們的普通股的交易價格會受到各種因素的影響,其中一些因素超出了我們的控制範圍,包括有限的交易量。除本“風險因素”一節及本年報其他章節討論的因素外,該等因素包括:
•我們正在進行的、計劃的或任何未來的臨牀前研究、臨牀試驗或臨牀開發計劃的結果;
•我們候選產品的臨牀試驗的開始、登記或結果,或我們可能進行的任何未來臨牀試驗,或我們候選產品的開發狀態的變化;
•臨牀前研究和臨牀試驗的不良結果或延遲;
•我們決定啟動臨牀試驗,不啟動臨牀試驗,或終止現有的臨牀試驗;
•我們監管申報的任何延遲或任何不利的監管決定,包括未能獲得監管部門對我們的候選產品的批准;
•適用於我們產品的法律或法規的變化,包括但不限於臨牀試驗審批要求;
•關於我們的製造商或我們的製造計劃的不利發展;
•我們無法為任何授權產品獲得足夠的產品供應,或無法以可接受的價格供應產品;
•我們無法在需要時建立合作關係;
•我們未能將我們的候選產品商業化;
•關鍵科學技術人員或管理人員的增減;
•與使用我們的候選產品相關的出乎意料的嚴重安全問題;
•介紹我們或我們的競爭對手提供的新產品或服務;
•我們或我們的競爭對手宣佈重大收購、戰略合作伙伴關係、合資企業或資本承諾;
•我們有能力有效地管理我們的增長;
•我們最初的癌症目標市場的規模和增長;
•我們成功治療其他類型或處於不同階段的癌症的能力;
•季度經營業績的實際或預期變化;
•我們的現金頭寸;
•未能達到投資界的估計和預測,或我們本來可能向公眾提供的估計和預測;
•發表關於我們或我們所在行業的研究報告,特別是免疫療法,或證券分析師的正面或負面建議或撤回研究報道;
•同類公司的市場估值變化;
•股票市場的整體表現;
•我們或我們的股東將來出售我們的普通股;
•本公司普通股成交量;
•會計慣例的變化;
•內部控制不力;
•與知識產權或專有權利有關的糾紛或其他發展,包括專利、訴訟事項以及我們為我們的技術獲得專利保護的能力;
•重大訴訟,包括知識產權或股東訴訟;
•一般政治和經濟條件;以及
•其他事件或因素,其中許多是我們無法控制的。
此外,股票市場,特別是生物製藥公司市場,經歷了極端的價格和數量波動,往往與這些公司的經營業績無關或不相稱。廣泛的市場和行業因素可能會對我們普通股的市場價格產生負面影響,無論我們的實際經營業績如何。過去,證券集體訴訟往往是在公司證券市場價格波動的時期後對公司提起的。此類訴訟如提起,可能導致鉅額成本及轉移管理層的注意力及資源,從而損害我們的業務、財務狀況、經營業績及未來前景。
籌集額外資本可能會稀釋我們現有的股東,限制我們的運營,或者要求我們放棄對我們的技術或候選產品的權利。
我們將通過公開和私人股本發行、債務融資、戰略夥伴關係和聯盟以及許可安排等方式尋求額外資金。在我們通過出售股權或可轉換債務證券籌集額外資本的情況下,您的所有權權益將被稀釋,條款可能包括清算或其他對您作為股東的權利造成不利影響的優惠。產生債務將導致固定付款責任增加,並可能涉及若干限制性契約,例如限制我們產生額外債務的能力、限制我們收購或許可知識產權的能力以及其他可能對我們開展業務能力造成不利影響的經營限制。如果我們通過與第三方的戰略夥伴關係、聯盟和許可協議籌集額外資金,我們可能不得不放棄對我們的技術或候選產品的寶貴權利,或以不利於我們的條款授予許可。
我們不打算為普通股支付股息,因此任何回報將限於我們股票的價值。
我們目前預計我們將保留未來盈利用於業務的發展、運營和擴展,並預計在可預見的將來不會宣派或支付任何現金股息。此外,我們可能會簽訂協議,禁止我們在未經我們的合同方事先書面同意的情況下支付現金股息,或禁止或限制可以宣佈或支付的股息金額的其他條款。因此,股東的任何回報都將限於其股票的升值,這可能永遠不會發生。
我們的主要股東及管理層擁有我們相當比例的股份,並將能夠對須經股東批准的事項施加重大影響。
根據我們截至2023年12月31日的流通普通股,我們的執行官、董事及其關聯公司實益擁有我們流通有表決權的股票的很大一部分。這些股東共同行動,能夠對所有需要股東批准的事項產生重大影響。例如,這些股東能夠對董事選舉、組織文件的修訂、任何合併、出售資產或其他重大公司交易的批准產生重大影響。這可能會阻止或阻止未經請求的收購建議或要約我們的普通股,您可能認為符合您作為我們的股東之一的最佳利益。
我們是一家新興成長型公司和一家規模較小的報告公司,我們不能確定適用於新興成長型公司和規模較小的報告公司的報告要求是否會降低我們的普通股對投資者的吸引力。
我們是一家新興的成長型公司,正如2012年4月頒佈的《創業創業法案》(Jumpstart Our Business Startups Act)所定義的那樣。只要我們繼續是一家新興增長型公司,我們可以利用適用於其他非新興增長型公司的上市公司的各種報告要求的豁免,包括無需遵守2002年《薩班斯—奧克斯利法案》(經修訂)第404條的審計師認證要求,減少本年度報告、定期報告和委託書中有關高管薪酬的披露義務,以及豁免就高管薪酬舉行非約束性諮詢投票的要求,以及股東批准先前未經批准的任何金降落傘付款。在完成首次公開募股(IPO)的第一年後,我們可能會成為一家新興增長型公司,但情況可能會導致我們提前失去這一地位。我們將繼續是一個新興增長型公司,直到(1)財政年度的最後一天(a)完成IPO五週年後,(b)我們的年度總收入至少為12.35億美元,或(c)我們被認為是一個大型加速申報人,這要求截至6月30日,非關聯公司持有的普通股市值超過7億美元,這是,及(2)我們在過去三年內發行超過10億元不可轉換債券的日期。
根據《就業法》,新興增長型公司也可以推遲採用新的或修訂的會計準則,直到這些準則適用於私營公司。吾等已選擇不“選擇退出”遵守新訂或經修訂會計準則之豁免,因此,吾等將於私人公司採納新訂或經修訂會計準則時採納新訂或經修訂會計準則,直至吾等(i)合理地選擇“選擇退出”有關延長過渡期或(ii)不再符合成為新興增長型公司之資格為止。
即使我們不再有資格成為一家新興成長型公司,我們仍有資格成為一家“較小的報告公司”,這將使我們能夠繼續利用許多相同的披露要求豁免,包括不需要遵守薩班斯-奧克斯利法案第2404節的審計師認證要求,以及減少本年度報告和我們的定期報告和委託書中關於高管薪酬的披露義務。我們無法預測投資者是否會因為我們可能依賴這些豁免而發現我們的普通股吸引力下降。如果一些投資者因此發現我們的普通股吸引力下降,我們的普通股可能會有一個不那麼活躍的交易市場,我們的股價可能會更加波動。
作為一家上市公司,我們正在並將繼續招致顯著增加的費用和行政負擔,這可能會對我們的業務、財務狀況和運營結果產生不利影響。
作為一家上市公司,我們正在面臨,並將繼續面臨更多的法律、會計、行政和其他成本和支出,這些成本和支出是我們作為一傢俬人公司沒有發生的。薩班斯-奧克斯利法案,包括其第404節的要求,以及後來由美國證券交易委員會、2010年多德-弗蘭克華爾街改革和消費者保護法以及根據該法案頒佈和即將頒佈的規則和條例、上市公司會計監督委員會和證券交易所實施的規則和條例,規定上市公司必須承擔額外的報告和其他義務。遵守上市公司的要求將增加成本,並使某些活動更加耗時。其中一些要求要求我們執行我們以前沒有做過的活動。此外,還產生了與美國證券交易委員會報告要求相關的額外費用。此外,如果在遵守這些要求方面發現任何問題(例如,如果管理層發現財務報告的內部控制存在重大缺陷或重大缺陷),我們可能會產生糾正這些問題的額外成本,而這些問題的存在可能會對我們的聲譽或投資者對其的看法產生不利影響。作為一家上市公司,獲得和維護董事和高級管理人員責任保險的成本也更高。作為一家上市公司,與我們的地位相關的風險可能會使我們更難吸引和留住合格的人擔任董事會成員或高管。這些細則和條例規定的額外報告和其他義務將增加法律和財務合規成本以及相關法律、會計和行政活動的成本。這些增加的成本將要求我們轉移大量資金,否則這些資金本可以用於擴大業務和實現戰略目標。股東和第三方的宣傳努力也可能促使治理和報告要求發生更多變化,這可能會進一步增加成本。
我們的現有股東在公開市場上出售大量普通股可能會導致我們的股票價格下跌。
在公開市場上出售我們普通股的大量股票,或認為這些出售可能會發生,可能會壓低我們普通股的市場價格,可能會使您更難以您認為合適的時間和價格出售您的普通股,並可能削弱我們通過出售額外股權證券籌集資金的能力。我們無法預測出售可能對我們普通股的現行市場價格產生的影響。
不穩定的市場和經濟狀況可能會對我們的業務、財務狀況和股票價格產生嚴重的不利影響。
正如廣泛報道的那樣,全球信貸和金融市場在過去幾年經歷了極端動盪和混亂,包括流動性和信貸供應嚴重減少、消費者信心下降、經濟增長下降、高通貨膨脹、利率上升、失業率上升以及經濟穩定的不確定性。例如,通貨膨脹通常會增加我們的醫療相關成本和臨牀試驗費用以及其他運營費用,從而影響我們。無法保證信貸和金融市場以及全球經濟和政治狀況不會進一步惡化。此外,不斷變化的環境(其中一些可能超出我們的控制範圍)可能導致我們消耗資本的速度遠遠超過我們目前的預期,我們可能需要比計劃更快地尋求額外資金。我們認為,全球經濟狀況尤其動盪及不確定,這不僅是鑑於新型冠狀病毒後環境及其可能導致的全球經濟衰退,亦由於近期及預期有關(其中包括)國際貿易及税務的政治、立法及監管條件的轉變,不平衡的復甦或全球經濟再度衰退可能會對我們按照預期規模和時間表進行臨牀試驗的能力產生負面影響。利率上升,特別是如果加上政府開支減少和金融市場波動,可能會進一步增加經濟不確定性,加劇這些風險。
我們的整體業務策略可能會受到任何該等經濟衰退、動盪的商業或政治環境或持續不可預測及不穩定的市況的不利影響。例如,烏克蘭—俄羅斯和以色列—哈馬斯的持續衝突可能擾亂或以其他方式對我們和我們依賴或將來可能依賴的第三方的行動造成不利影響。相關制裁、出口管制或其他行動可能由包括美國在內的國家發起,歐盟或俄羅斯(例如,潛在的網絡攻擊、能源流動中斷等),這可能對我們的業務和/或我們的供應鏈、我們的CRO、CMO以及我們與之開展業務或將來可能開展業務的其他第三方造成不利影響。此外,國家支持的網絡攻擊可能會成為衝突的一部分,這將對我們和我們的供應商維持或加強關鍵網絡安全和數據保護措施的能力產生不利影響。我們的財務狀況及經營業績亦可能受到我們可能無法控制的其他因素的影響,例如全球供應鏈中斷、全球貿易爭端或政治不穩定。
如果當前的股票和信貸市場惡化或沒有改善,可能會使獲得任何必要的債務或股票融資變得更加困難、成本更高和稀釋性更大。未能及時以優惠條款獲得任何必要的融資,可能會對我們的增長戰略、財務表現和股價產生重大不利影響,並可能要求我們推遲或放棄臨牀開發計劃。此外,我們目前的一個或多個服務供應商、製造商和其他合作伙伴可能無法在經濟衰退中生存下來,這可能直接影響我們按計劃和預算實現運營目標的能力。倘我們的盈利能力及策略因整體經濟狀況的低迷或波動而受到負面影響,則我們的業務及經營業績可能會受到重大不利影響。
如果證券或行業分析師發表不準確或不利的關於我們業務的研究,我們的股價和交易量可能會下降。
我們普通股的交易市場將部分取決於證券或行業分析師發佈的關於我們或我們業務的研究和報告。如果一位或多位報道我們的分析師下調我們的股票評級,或發表不準確或不利的關於我們業務的研究,我們的股價可能會下跌。如果其中一名或多名分析師停止對本公司的報道,或未能定期發佈有關本公司的報告,對本公司股票的需求可能會減少,這可能會導致本公司股價和交易量下降。
對環境、氣候變化、社會和治理(ESG)計劃的更多關注和不斷變化的預期可能會增加我們的成本,損害我們的聲譽,或者以其他方式對我們的業務產生不利影響。
各行各業的公司都面臨着各種利益相關者對其ESG和可持續發展實踐(包括與氣候變化相關的實踐)的日益嚴格的審查。對自願ESG倡議和披露的預期可能會導致成本增加(包括但不限於與合規、利益相關者參與、合同和保險相關的成本增加),增強合規或披露義務,或對我們的業務、財務狀況或運營結果產生其他不利影響。
雖然我們有時可能會採取自願行動(如自願披露、認證或目標等)來改善公司的ESG形象,但此類行動可能代價高昂,而且可能達不到預期的效果。此外,由於我們無法控制的因素,我們可能無法成功完成這些舉措。即使情況並非如此,我們的行動可能隨後會被各利益相關者認定為不充分,我們可能會受到投資者或監管機構對我們ESG努力的參與,即使此類舉措目前是自願的。
某些市場參與者,包括主要機構投資者和資本提供者,在做出投資或投票決策時,使用第三方基準和評分來評估公司的ESG概況。不利的ESG評級可能會導致投資者對我們的負面情緒增加,這可能會對我們的股價以及我們獲得資金的機會和成本產生負面影響。就ESG事件對我們的聲譽產生負面影響的程度而言,它還可能阻礙我們有效競爭以吸引和留住員工的能力,這可能會對我們的運營產生不利影響。
此外,我們預期有關環境、社會及管治事宜的監管水平可能會有所提高。例如,SEC已經發布了擬議規則,要求公司在定期報告中提供顯著擴大的氣候相關披露,這可能要求我們承擔大量額外的成本來遵守,包括對過去未受此類控制的事項實施重大額外的內部控制流程和程序。並對我們的管理層和董事會施加更大的監督責任。利益相關者期望的這些和其他變化可能會導致成本增加,以及可能加劇該風險因素中確定的所有風險的審查。此外,我們的業務合作伙伴可能會受到類似的期望,這可能會增加或產生額外的風險,包括我們可能不知道的風險。
與我們的章程和細則有關的風險
我們的章程文件和特拉華州法律中的反收購條款可能會推遲或阻止控制權的變更,這可能會限制我們普通股的市場價格,並可能阻止或挫敗我們的股東更換或罷免我們目前管理層的嘗試。
我們修訂和重述的公司註冊證書以及修訂和重述的章程中包含的條款可能會推遲或阻止我們公司的控制權變更或我們的股東可能認為有利的董事會變更。其中一些規定包括:
•董事會分為三個級別,交錯任期三年,不是所有的董事會成員都是一次選舉產生的;
•禁止股東通過書面同意採取行動,這要求所有股東的行動都必須在我們的股東會議上進行;
•要求股東特別會議只能由董事會根據當時在任董事的多數贊成票通過的決議召開;
•股東提名和提名進入董事會的事先通知要求;
•要求我們的股東不得罷免我們的董事會成員,除非是出於法律要求的任何其他投票,並獲得當時有權在董事選舉中投票的我們有表決權股票中不少於三分之二的流通股的批准;
•以股東行動修訂任何附例或修訂本公司公司註冊證書的特定條文,須獲本公司不少於三分之二的已發行股份批准;及
•董事會有權根據董事會決定的條款發行優先股,而無需股東批准,優先股可以包括優於普通股股東權利的權利。
此外,由於我們在特拉華州註冊成立,我們受特拉華州一般公司法第203條的規定管轄,該條可能禁止持有我們15%或以上已發行表決權股份的股東進行某些業務合併。這些反收購條款和我們修訂和重述的公司註冊證書以及修訂和重述的章程中的其他條款可能會使股東或潛在收購者更難獲得我們董事會的控制權,或發起被當時董事會反對的行動,也可能推遲或阻礙涉及我們公司的合併,要約收購或代理權爭奪。這些條款也可能阻礙代理權競爭,使您和其他股東更難選舉您選擇的董事或導致我們採取您希望的其他公司行動。控制權變更交易或董事會變動的任何延遲或阻止都可能導致我們普通股的市場價格下跌。
我們的章程指定某個法院作為我們股東可能發起的某些類型的訴訟和訴訟的唯一和專屬論壇,這可能會限制我們的股東獲得有利的司法論壇與我們或我們的董事,高級職員或員工的爭議。
我們的章程規定,除非我們書面同意另一個法院,否則特拉華州法院將是任何州法律索賠的唯一和專屬法院,以(i)代表我們提起的任何衍生訴訟或程序,(ii)聲稱我們的任何董事、高級職員和員工違反對我們或我們的股東的誠信義務的任何訴訟,(iii)根據特拉華州普通公司法、我們修訂和重述的公司註冊證書或我們修訂和重述的章程的任何條款提出索賠的任何訴訟,或(iv)任何主張受內部事務原則管轄的索賠的訴訟,在每一案件中,由大法官法院對其中指定為被告的不可或缺的當事方擁有屬人管轄權。此專屬法院條款不適用於根據證券法或交易法產生的任何訴訟原因。此外,我們的修訂和重申的細則將規定,任何購買或以其他方式獲得我們普通股股份的任何權益的個人或實體被視為已通知並同意上述規定。我們認識到,我們章程中的法院選擇條款可能會對股東在尋求任何此類索賠時施加額外的訴訟費用,特別是如果股東不居住在特拉華州或附近。此外,本公司經修訂和重述的章程中的法院選擇條款可能會限制本公司股東在其認為有利於與本公司或本公司董事、高級職員或員工發生糾紛的論壇上提出索賠的能力,這可能會阻止對本公司及其董事、高級職員和員工的此類訴訟,即使訴訟成功,可能會使本公司股東受益。特拉華州高等法院也可能作出與其他法院不同的判決或結果,包括考慮訴訟的股東可能所在的法院或以其他方式選擇提起訴訟的法院,這些判決可能對我們比我們的股東更有利或更不利。
與財務報告內部控制有關的風險
如果我們不能建立和保持對財務報告的適當和有效的內部控制,我們的經營業績和我們經營業務的能力可能會受到損害。
對財務報告的充分內部監控對於我們提供可靠的財務報告是必要的,同時,有效的披露監控和程序旨在防止或發現由於欺詐或錯誤而導致的重大錯誤陳述。任何未能實施所需的新的或改進的控制措施,或在實施過程中遇到的困難,都可能導致我們未能履行報告義務。此外,我們根據《薩班斯—奧克斯利法案》第404條進行的任何測試,或我們獨立註冊會計師事務所的任何後續測試,都可能揭示我們對財務報告的內部控制存在的缺陷,這些缺陷被視為重大弱點,或可能需要對我們的財務報表進行前瞻性或追溯性更改,或確定需要進一步關注或改進的其他領域。內部監控不足亦可能導致投資者對我們呈報的財務資料失去信心,從而對我們股票的交易價格產生負面影響。
對我們的內部控制進行任何適當的更改可能會分散我們的管理人員和員工的注意力,修改我們現有的流程需要大量的成本,並需要大量的時間來完成。然而,這些變更可能無法有效維持我們內部控制的充分性,任何未能維持充分性,或因此無法及時編制準確的財務報表,都可能增加我們的運營成本並損害我們的業務。此外,投資者認為我們的內部控制不足或我們無法及時編制準確的財務報表,可能會損害我們的股價,並使我們更難以有效地向新客户和現有客户推銷和銷售我們的服務。
一般風險因素
數據收集受到有關個人信息的使用、處理和跨境轉移的限制性規定的約束。
如果我們決定進行臨牀試驗或繼續在我們正在進行的或未來的臨牀試驗中招募受試者,我們可能會受到額外的隱私限制。收集、使用、存儲、披露、轉移或以其他方式處理與歐洲經濟區個人有關的個人數據,包括個人健康數據,受2018年5月25日生效的GDPR管轄。GDPR的範圍很廣,對處理個人數據的公司提出了許多要求,包括與處理個人數據具有法律依據有關的要求,在GDPR要求的情況下處理敏感數據(如健康數據)的更嚴格要求,向個人提供有關數據處理活動的信息,實施保護個人數據安全和保密的保障措施,提供數據違規通知,要求對高風險處理進行數據保護影響評估,以及在聘用第三方處理者時採取某些措施。GDPR允許數據保護當局對違反GDPR的行為施加鉅額罰款,包括可能高達2000萬歐元或全球年收入的4%的罰款,以金額較大者為準。GDPR還賦予數據主體和消費者協會一項私人訴訟權利,可以向監管當局提出投訴,尋求司法補救,並就違反GDPR造成的損害獲得賠償。GDPR增加了我們在處理受GDPR約束的個人數據方面的責任和責任,我們可能需要建立額外的機制來確保遵守GDPR,包括個別國家實施的機制。遵守GDPR將是一個嚴格且耗時的過程,可能會增加我們的業務成本或要求我們改變業務做法,儘管我們做出了這些努力,但我們可能面臨與我們的歐洲活動相關的罰款和處罰、訴訟和聲譽損害的風險。
GDPR規定,歐洲經濟區成員國可以制定自己的關於基因、生物識別或健康數據處理的進一步法律和法規,這可能會導致成員國之間的差異,限制我們使用和共享個人數據的能力,或者可能導致我們的成本增加,並損害我們的業務和財務狀況。
GDPR還對向包括美國在內的歐洲經濟區以外的國家轉移個人數據實施了嚴格的規則。在將個人數據從歐洲經濟區轉移到美國等第三國方面,我們受到不斷演變和嚴格的規則的約束。除非目的地國家/地區是一個適當的國家/地區(歐盟委員會認可),否則我們可能需要將GDPR轉移機制(例如歐盟委員會批准的標準合同條款(“SCCs”))納入我們與第三方的協議中,以管理將個人數據轉移到歐洲經濟區以外的地區。SCC還可能影響我們的業務,因為總部位於歐洲經濟區的公司可能不願利用新條款將個人數據轉移到第三國合法化,因為轉移影響評估的繁重要求以及新SCC對出口商施加的重大義務。此外,歐盟和美國已經通過了其關於歐盟-美國數據隱私框架的充分性決定,該框架於2023年7月11日生效。該框架規定,對歐盟和美國之間轉移的個人數據的保護與歐盟提供的保護相當。這為確保按照GDPR進行向美國的轉移提供了另一條途徑。該框架可能會像其前身框架一樣受到挑戰。這種複雜性和額外的合同負擔增加了我們的總體風險敞口。
此外,繼英國退出歐盟之後,英國2018年《歐盟(退出)法案》將GDPR納入英國法律,簡稱英國GDPR。英國GDPR和2018年英國數據保護法規定了英國的數據保護制度,該制度獨立於歐盟的數據保護制度,但目前仍與歐盟的數據保護制度保持一致。違反英國GDPR可能會導致高達1750萬GB或全球收入4%的罰款,以金額較高者為準。儘管英國被視為歐盟GDPR下的第三個國家,但歐盟委員會現在發佈了一項決定,承認英國在歐盟GDPR下提供了足夠的保護,因此,源自歐盟的個人數據轉移到英國仍然不受限制。與歐盟GDPR一樣,英國GDPR將個人數據轉移到英國以外的國家,這些國家不被英國視為提供了足夠的保護。將個人數據轉移到英國以外的地區不受新形式的SCC的約束,但英國已經發布了自己的轉移機制--英國國際數據轉移協議--與SCC一樣,該協議要求出口商進行轉移影響評估。此外,該框架還進行了擴展,以涵蓋英國向美國的轉移。英國政府已經證實,從英國到歐洲經濟區的個人數據傳輸仍然是自由流動的。英國政府現在還將數據保護和數字信息法案(或稱英國法案)引入英國立法程序,目的是在英國退歐後改革英國的數據保護制度。如果獲得通過,英國法案的最終版本可能會進一步改變英國和歐盟數據保護制度之間的相似性。這可能會導致額外的合規成本,並可能增加我們的總體風險。
此外,某些州法律在某些情況下管理健康信息的隱私和安全,其中一些法律比HIPAA更嚴格,其中許多法律在很大程度上彼此不同,可能產生不同的效果,從而使合規工作複雜化。例如,於2020年1月1日生效的《加州消費者隱私法》(CCPA)賦予加州居民更大的訪問和刪除個人信息的權利,選擇不共享某些個人信息,並獲得有關如何使用其個人信息的詳細信息。CCPA規定了對違規行為的民事處罰,以及對數據泄露行為的私人訴訟權,預計這將增加數據泄露訴訟。CCPA可能會增加我們的合規成本和潛在責任。一些觀察人士指出,CCPA可能標誌着美國更嚴格的隱私立法趨勢的開始,這可能會增加我們的潛在責任並對我們的業務造成不利影響。
此外,2023年1月1日生效的《加州隱私權法案》(CPRA)對該法案涵蓋的公司施加了額外的義務。《公民權利法》對《公民和消費者保護法》進行了重大修改,包括擴大消費者對某些敏感個人信息的權利。《公民權利法》還設立了一個新的國家機構,負責實施和執行《公民和社會保護法》。經《公民權利法》修訂的《公民和公民權利法》的許多方面及其解釋仍然不明確。因此,其對我們業務及營運的全面影響仍不明朗。
其他許多州也通過了類似的法律。雖然許多現有的州隱私法豁免了由HIPAA管理的臨牀試驗信息和健康信息,但未來的隱私和數據保護法可能會在範圍更廣。此外,其他州也提出了類似的新隱私法。此類擬議立法,如果頒佈,可能會增加額外的複雜性、要求、限制和潛在的法律風險,需要在合規計劃、影響策略和以前有用的數據的可用性方面投入額外的資源,並可能導致合規成本增加和/或業務慣例和政策的改變。美國不同州的全面隱私法的存在將使我們的合規義務更加複雜和昂貴,並可能增加我們可能受到執法行動或以其他方式承擔不遵守責任的可能性。除了這些全面的消費者隱私法和提案外,其他一些州也通過或提出了更有限的隱私法,重點關注生物識別數據和健康和醫療信息隱私等特定隱私問題,如華盛頓州的《我的健康我的數據法案》,該法案擁有私人行動權,進一步增加了相關合規風險。康涅狄格州和內華達州也通過了類似的法律來規範消費者健康數據。在聯邦一級,聯邦貿易委員會利用其對“不公平或欺騙性行為或做法”的權力,對收集和披露敏感類別的個人信息,包括健康信息施加嚴格要求。此外,聯邦貿易委員會根據其《健康違約通知規則》對"違約"的擴大解釋可能會強加新的披露義務,這些義務將適用於限定性違約的情況。這些不同的隱私和安全法律可能會影響我們的業務活動,包括我們對研究對象的識別、與業務合作伙伴的關係以及最終產品的營銷和分銷。州法律正在迅速變化,美國國會正在討論一項新的全面聯邦數據隱私法,如果頒佈,我們可能會成為該法律的主體。
在中國,隱私和數據安全方面也有了重大進展。2021年6月10日,中華人民共和國全國人民代表大會常務委員會公佈了《中華人民共和國數據安全法》(《數據安全法》),自2021年9月1日起施行。《數據安全法》要求數據處理(包括數據的收集、存儲、使用、處理、傳輸、提供和發佈)以合法和適當的方式進行。《數據安全法》對從事數據處理活動的實體和個人規定了數據安全和隱私義務,並根據數據在經濟和社會發展中的重要性,以及數據被篡改、銷燬,泄露、非法獲取或非法使用。需要對每一類數據採取適當程度的保護措施。
同樣在中國,2021年8月20日,中華人民共和國全國人大常委會頒佈了《個人信息保護法》,自2021年11月1日起施行。《個人信息保護法》提出了處理個人信息的保護要求,《個人信息保護法》的許多具體要求尚待明確。我們可能需要對我們的業務慣例作出進一步重大調整,以遵守中國的個人信息保護法律法規,包括《個人信息保護法》。
此外,由於我們已開始在韓國進行試驗,我們亦須遵守有關試驗受試者隱私及使用機密資料的韓國當地法律及法規,包括《個人資料保護法》及相關法例、法規及命令(“PIPA”)。PIPA要求個人同意其數據的使用,並要求負責管理個人數據的人員採取必要的技術和管理措施,防止數據泄露,除其他外,在24小時內通知個人信息保護委員會任何數據泄露事件。如果以任何方式不遵守PIPA,這些責任人可能會因未能以適當方式獲得此類同意或此類違規行為(包括甚至疏忽違規行為)而承擔個人責任,違反者將面臨從罰款到監禁不等的處罰。我們努力採取必要的技術和管理措施來遵守PIPA,然而,儘管我們努力遵守PIPA,但這些規則仍然複雜且不斷演變,受政府監管機構的解釋可能會隨着時間的推移而改變,因此我們面臨監管機構聲稱未能遵守PIPA的風險。我們未能遵守該等政策、法律、法規及其他法律義務及監管指引,或被視為未能遵守,可能會對我們的聲譽、品牌及業務造成不利影響,並可能導致政府實體或其他人對我們及我們的某些行政人員提出索賠、訴訟或行動(包括刑事訴訟)或其他責任。任何此類索賠、訴訟或行動可能損害我們的聲譽、品牌和業務,迫使我們為此類訴訟進行辯護而承擔重大費用,分散我們的管理層的注意力,增加我們的業務成本,導致客户和商家的損失,並可能對我們的業務、財務狀況和經營業績產生不利影響。
遵守美國和國際數據保護法律和法規可能要求我們在合同中承擔更繁重的義務,限制我們收集、使用和披露數據的能力,或者在某些情況下,影響我們在某些司法管轄區的運營能力。不遵守美國和國際數據保護法律和法規可能導致政府執法行動(可能包括民事或刑事處罰)、私人訴訟或負面宣傳,並可能對我們的經營業績和業務產生負面影響。此外,我們或我們的潛在合作者獲取有關信息的臨牀試驗受試者,以及與我們共享這些信息的提供者,可能會在合同上限制我們使用和披露這些信息的能力。聲稱我們侵犯了個人隱私權、未能遵守數據保護法或違反了我們的合同義務,即使我們沒有被發現負有責任,也可能是昂貴和耗時的辯護,並可能導致不利的宣傳,從而損害我們的業務。
美國和外國司法管轄區專利法的修改可能會降低專利的總體價值,從而削弱我們保護產品的能力。
與其他生物製藥公司一樣,我們的成功在很大程度上依賴於知識產權,特別是專利。在生物製藥行業中獲得和執行專利涉及技術和法律的複雜性,因此成本高昂、耗時且固有的不確定性。美國最高法院最近的裁決縮小了在某些情況下可用的專利保護範圍,並削弱了專利所有人在某些情況下的權利。除了我們未來獲得專利的能力增加不確定性外,這些事件的組合也對專利一旦獲得的價值造成了不確定性。根據美國國會、聯邦法院和美國專利商標局的決定,管理專利的法律法規可能會以不可預測的方式發生變化,這將削弱我們獲得新專利的能力,或削弱我們將來可能獲得的專利的能力。為例 分子病理學協會訴Myriad Genetics,Inc., 美國最高法院認為,某些對DNA分子的要求是不可申請專利的。其他司法管轄區專利法的任何不利變動均可能對我們的業務及財務狀況造成重大不利影響。其他司法權區管轄專利的法律及法規的變動同樣可能對我們取得並有效執行我們在專利申請中可能擁有的任何權利或我們將來可能擁有或授權的任何專利的能力造成不利影響。
最近或未來的專利改革立法也可能增加圍繞我們專利申請的起訴以及未來我們可能擁有或許可的任何專利的執行或保護的不確定性和成本。美國已經制定並實施了範圍廣泛的專利改革立法。2011年9月16日,《萊希-史密斯美國發明法》或《美國發明法》簽署成為法律,其中包括對美國專利法的多項重大修改。這些條款包括影響專利申請起訴方式的條款,重新定義現有技術,可能影響專利訴訟,建立新的授權後審查制度,以及將美國專利制度從“先發明”制度轉變為“先申請”制度。在“先提交文件”制度下,假設其他可專利性要求得到滿足,第一個提交專利申請的發明人通常將有權獲得該發明的專利,而無論是否有另一位發明人較早地作出了該發明。由於美國和大多數其他國家/地區的專利申請在提交後或發佈之前的一段時間內是保密的,我們不能確定我們是第一個(I)提交與我們的候選產品或其他技術相關的任何專利申請,或(Ii)發明我們的專利申請中要求的任何發明或我們可能擁有的或許可中的任何專利。這些變化還允許第三方在專利訴訟期間向美國專利商標局提交先前技術,以及由美國專利商標局管理的授權後程序(包括授權後審查)攻擊專利有效性的額外程序,各方間審查和派生程序。由於USPTO程序中的證據標準低於美國聯邦法院宣佈專利權利要求無效所需的證據標準,第三方可能會在USPTO程序中提供足以使USPTO裁定權利要求無效的證據,即使同樣的證據如果首先在地區法院訴訟中提交將不足以使權利要求無效。因此,第三方可能試圖使用美國專利商標局的程序來宣佈我們的專利主張無效,如果我們的專利主張首先被第三方作為被告在地區法院訴訟中提出質疑,我們的專利主張就不會無效。任何此類訴訟中的不利裁決可能會縮小我們專利權的範圍或使其無效,允許第三方將我們的技術或產品商業化並直接與我們競爭,而無需向我們付款,或者導致我們無法在不侵犯第三方專利權的情況下製造或商業化產品。因此,美國發明法及其實施可能會增加圍繞我們專利申請的起訴以及我們未來可能擁有或許可的任何已發佈專利的執行或保護的不確定性和成本,所有這些都可能對我們的業務和財務狀況產生重大不利影響。
税法的變化可能會對我們的業務和財務狀況產生不利影響。
涉及美國聯邦、州和地方所得税的規則不斷受到參與立法過程的人員以及美國國税局和美國財政部的審查。税法的變化(這些變化可能具有追溯力)可能會對我們或我們普通股的持有者產生不利影響。近年來,這樣的變化已經發生了許多,而且未來可能還會繼續發生變化。未來税法的變化可能會對我們的業務、現金流、財務狀況或運營結果產生實質性的不利影響。我們敦促投資者就税法的潛在變化對投資我們普通股的影響諮詢他們的法律和税務顧問。
銀行系統和金融市場的狀況,包括銀行和金融機構的倒閉,可能對我們的運營和財務業績產生不利影響。
涉及流動性有限、違約、業績不佳或影響金融服務業或金融服務業其他公司的其他不利發展的實際事件,或對任何此類事件或其他類似風險的擔憂或傳言,過去和未來可能會導致整個市場的流動性問題。
我們目前無法預測金融服務業不斷變化的環境所造成的影響的程度或性質。例如,如果某些銀行和金融機構因影響銀行體系和金融市場的金融狀況而進入接管或在未來破產,我們獲取現有現金、現金等價物和投資的能力可能受到威脅。雖然目前無法預測市場高度波動及銀行業不穩定對經濟活動尤其是我們的業務造成的影響程度,但其他銀行及金融機構的倒閉以及政府、企業及其他組織為應對該等事件而採取的措施可能會對我們的業務、財務狀況及經營業績造成不利影響。
聯邦預算的下降、美國政府支出或預算優先事項的變化、美國政府長期停擺或合同授予的延遲可能會對我們未來的收入、現金流和財務業績產生重大和不利的影響。
近年來,美國政府撥款受到美國政府預算問題和相關立法的影響。因此,國防部的資金水平波動不定,難以預測。未來的支出水平取決於一系列因素,包括國會的行動。此外,近年來,美國政府一直無法在本財年結束前完成預算程序,導致政府關門,以及繼續通過決議,延長足夠的資金只供美國政府機構繼續運作。此外,美國國債最近有可能在2023年達到法定債務上限,未來幾年發生此類事件可能導致美國政府債務違約。
因此,由於許多因素,包括外部威脅環境、未來政府優先事項和政府財政狀況,政府支出水平在短期內很難預測。政府支出的重大變化或美國政府優先事項、政策和要求的變化可能會對我們的運營結果、財務狀況或流動性產生實質性的不利影響。
與網絡安全有關的風險
我們可能無法充分保護我們的信息系統免受網絡攻擊,網絡攻擊可能導致包括個人數據在內的機密或專有信息被泄露,損害我們的聲譽,並使我們面臨重大的財務和法律風險。
我們依賴我們或我們的第三方供應商運營的信息技術系統來處理、傳輸和存儲我們的日常運營中的電子信息。在我們的產品開發工作中,我們可能會收集和使用各種個人數據,例如姓名、郵寄地址、電子郵件地址、電話號碼和臨牀試驗信息。成功的網絡攻擊可能導致知識產權、數據或其他盜用資產的行為被竊取或破壞,或以其他方式危害我們的機密或專有信息並擾亂我們的運營。網絡攻擊的頻率、複雜程度和強度都在增加,而且越來越難以發現。網絡攻擊可能包括敵對外國政府的不法行為、工業間諜活動、電信欺詐和其他形式的網絡欺詐、有害惡意軟件的部署、拒絕服務、社會工程欺詐或其他威脅數據安全、機密性、完整性和可用性的手段。成功的網絡攻擊可能會對我們造成嚴重的負面後果,包括但不限於業務中斷、機密商業信息(包括財務信息、商業祕密)被盜用、財務損失以及公司戰略計劃的披露。雖然我們投入資源保護我們的信息系統,但我們意識到網絡攻擊是一種威脅,無法保證我們的努力將防止信息安全漏洞,這些漏洞會導致我們的業務、法律、財務或聲譽受到損害,或會對我們的經營業績和財務狀況造成重大不利影響。任何未能防止或減輕安全漏洞或不當訪問、使用或披露我們的臨牀數據或患者的個人數據可能導致重大責任,根據國家(例如,州違反通知法),聯邦(例如,HITECH修訂的HIPAA)和國際法(例如,GDPR),並可能對我們的聲譽造成重大不利影響,影響我們進行新研究的能力,並可能破壞我們的業務。
一些網絡安全事件可能很難預防。例如,涉及廣泛使用的軟件中以前未知的漏洞的供應鏈事件正變得越來越普遍,Log4j事件就是其中的一個例子。雖然我們目前還不知道供應鏈漏洞的任何影響,包括但不一定限於Log4j,但這些都是最近發生的事件,目前還不清楚攻擊的全部範圍。因此,我們可能會遇到Log4j和其他供應鏈漏洞引起的安全漏洞的剩餘風險。
此外,雖然我們維持保險範圍,但我們不能保證該等保險範圍將足夠或以其他方式保護我們免受或充分減輕因我們的隱私和安全慣例引起的索賠、成本、開支、訴訟、罰款、罰款、商業損失、數據丟失、監管行動或重大不利影響的責任或損害。或該等保險將繼續以可接受的條款提供或根本提供。網絡保險市場正在收緊,勒索軟件、數據泄露和其他類型的網絡攻擊的覆蓋範圍可能會減少或消除。成功向我們提出一項或多項超出我們現有保險範圍的大額索賠,或導致我們的保單發生變更(包括保費增加或徵收大額免賠額或共同保險要求),可能會對我們的業務產生不利影響。此外,我們不能確定我們現有的保險範圍將繼續以可接受的條款提供,或我們的保險公司不會拒絕就任何未來的索賠提供保險。
雖然我們投入資源保護我們的信息系統,但我們意識到網絡攻擊是一種威脅,無法保證我們的努力將防止信息安全漏洞,這些漏洞會導致我們的業務、法律、財務或聲譽受到損害,或會對我們的經營業績和財務狀況造成重大不利影響。任何未能防止或減輕安全漏洞或不當訪問、使用或披露我們的臨牀數據或患者的個人數據可能導致重大責任,根據國家(例如,州違反通知法),聯邦(例如,HITECH修訂的HIPAA)和國際法(例如,GDPR),並可能對我們的聲譽造成重大不利影響,影響我們進行新研究的能力,並可能破壞我們的業務。
此外,我們所依賴的各種第三方(包括我們的CRO和其他承包商、顧問、法律和會計師事務所)的計算機系統可能會受到計算機病毒、未經授權的訪問、數據泄露、網絡釣魚攻擊、網絡犯罪分子、自然災害(包括颶風和地震)、恐怖主義、戰爭、電信和電力故障的損害。我們依賴第三方供應商實施有效的安全措施,並識別並糾正任何此類故障、缺陷或違規行為。如果我們或我們的第三方提供商未能有效維護或保護我們的信息技術系統和數據完整性,或未能預測、規劃或管理我們的信息技術系統的重大中斷,我們或我們的第三方提供商可能難以預防、檢測和控制此類網絡攻擊,任何此類攻擊都可能導致上述損失以及與醫生的糾紛。患者和我們的合作伙伴、監管制裁或處罰、運營開支增加、開支或收入損失或其他不利後果,其中任何一項可能對我們的業務、運營業績、財務狀況、前景和現金流產生重大不利影響。該等第三方未能防止或減輕安全漏洞或不當訪問或披露該等信息的任何情況,都可能對我們造成類似的不利後果。如果我們無法防止或減輕此類安全或數據隱私泄露的影響,我們可能會面臨訴訟和政府調查,這可能導致我們的業務受到潛在幹擾。
項目1B。未解決的員工意見
沒有。
項目1C。網絡安全
與網絡安全風險相關的治理
董事會對風險管理負有全面監督責任,並將其對風險評估及管理指引的監督委託給董事會審核委員會。審核委員會成員每年都會收到高級管理層關於網絡安全事宜的最新資料。這些討論可能包括管理層為應對和緩解網絡安全風險所做的努力、網絡安全事件(如有)以及關鍵信息安全舉措的狀態等方面的最新信息。
在首席執行官(CEO)和行政管理團隊的監督下,我們成立了信息技術(IT)指導委員會,主要負責監督我們對網絡安全風險的管理。資訊科技督導委員會由我們的執行董事兼資訊科技主管(“資訊科技主管”)擔任主席,並直接向我們的首席營運官及法律總顧問彙報。IT指導委員會的其他成員包括臨牀開發、技術運營、財務、人力資源、業務運營和法律部門的代表。
我們的IT主管與我們的第三方網絡安全公司和IT指導委員會合作,評估和管理我們的網絡安全威脅管理流程。我們的IT主管擁有40年的信息技術經驗,包括30年的製藥、生物技術和化工行業團隊建設和領導經驗,並曾在多個機構工作,以實施、管理和發展信息技術職能,包括網絡安全計劃。這些實體包括大型上市公司和小型初創公司。他的經驗還包括開發和維護工具和流程,以保護內部網絡,研究和臨牀數據庫,供應商支付信息和財務系統。在我們的IT主管的指導下,我們聘請了一家第三方網絡安全公司,為治理和安全運營提供網絡安全支持服務。
資訊科技督導委員會定期開會,並視情況需要,討論及監察網絡安全威脅風險的預防、偵測、緩解及補救措施。資訊科技主管向行政管理團隊及審核委員會(如有需要)提供有關網絡安全發展的最新資料。
此外,我們已成立IT安全團隊,以檢討我們的網絡安全評估結果及相關網絡安全策略,以及網絡安全環境中出現的威脅。IT安全團隊定期開會,成員包括我們的網絡安全公司和內部IT資源。
網絡風險管理與策略
在資訊科技督導委員會及資訊科技主管的指導下,我們已採納網絡安全風險管理程序,旨在處理識別潛在面臨網絡安全威脅風險的資產、識別網絡安全威脅的潛在來源、評估應對網絡安全威脅的保護措施以及管理網絡安全風險。
我們的網絡安全公司負責監控我們的信息系統,並在IT總監的監督下實施降低網絡風險的程序。網絡安全公司通過各種方式(包括威脅情報和研究來源、與行業同行的討論、安全警報以及安全會議和活動(視情況而定),讓公司瞭解網絡安全環境中的威脅。
該網絡安全公司還管理我們的網絡監控,旨在識別潛在的安全風險,並定期進行測試、掃描和其他漏洞分析。我們之前聘請了第三方進行信息技術審計,該審計遵循了行業標準。我們還實施了一項流程,要求員工在入職時和每年完成一項網絡安全教育計劃,旨在通過培訓和模擬提高對網絡安全威脅和風險的認識。
我們有一個流程來審查安全功能是否符合適用的監管要求和財務控制,然後購買某些第三方技術或其他涉及暴露於公司資產或電子信息的解決方案。在技術到位後,我們還可能不時對可用的安全文檔進行定期審查,例如審計報告和認證。
儘管截至本報告表格10—K之日,網絡安全威脅的風險並未對我們的業務策略、經營業績或財務狀況造成重大影響,且我們不認為這些風險合理可能對我們的業務策略、經營業績或財務狀況造成重大影響,但我們可能不時遇到與我們和我們的第三方供應商的信息系統有關的威脅和安全事故。詳情請見題為"項目1A。風險因素”。
項目2.財產
我們租賃一個擁有約25,578平方英尺辦公空間的設施作為我們的主要辦事處,其位於One Main Street,Cambridge,MA 02142。租約於2028年8月31日到期,但可選擇將租約延長五年。於2022年12月,我們就馬薩諸塞州劍橋市辦公室的一層樓(約14,439平方英尺)訂立分租協議,亦於2028年8月31日終止。
我們還租賃了約18,120平方英尺的辦公室和實驗室空間,位於430 East 29th Street,New York,New York 10016。租約將於2032年6月30日到期,但可選擇將租約延長五年。我們相信,我們現有的設施足以滿足我們當前和近期的需求。
項目3.法律訴訟
我們可能不時捲入日常業務過程中產生的法律訴訟。我們目前並不知悉任何我們認為會個別或整體對我們的業務、財務狀況或經營業績造成重大不利影響的此類訴訟或索賠。無論結果如何,訴訟都可能因辯護和和解成本、管理資源的轉移和其他因素而對我們造成不利影響。
項目4.礦山安全信息披露
不適用。
第II部
項目5.註冊人普通股市場、相關股東事項和發行人購買股權證券
關於我們普通股交易的某些信息
我們的普通股在納斯達克全球精選市場以代碼“BDTX”交易,並自2020年1月30日起公開交易。在此之前,我們的普通股沒有公開市場。
我們普通股持有者
截至2024年3月5日,約有30名持有我們普通股股份的記錄持有人。該數字不包括以“代名人”或“街道”名稱持有股份的股東。
分紅
我們從未就股本宣佈或支付任何現金股息。我們目前打算保留任何未來收益,以資助我們的業務的發展和擴展,因此,我們預計不會在可預見的將來支付現金股息。任何未來派付股息的決定將由董事會酌情決定,並視乎我們的經營業績、財務狀況、資本要求、合約限制及董事會認為相關的其他因素而定。
根據股權補償計劃獲授權發行的證券
表格10-K第5項所要求的有關股權薪酬計劃的資料在此併入本年度報告第三部分第12項。
發行人及關聯購買人購買股權證券
於本年報所述期間,吾等並無購買任何註冊股本證券。
項目6.保留
項目7.管理層對財務狀況和經營成果的討論和分析
以下討論及分析應與本年報其他部分所載之經審核綜合財務報表及相關附註一併閲讀。本年度報告的討論和分析以及其他部分包含基於當前信念、計劃和預期的前瞻性陳述,涉及風險、不確定性和假設,例如關於我們的計劃、目標、預期、意圖和預測的陳述。我們的實際結果和選定事件的時間可能與這些前瞻性陳述中的預期有重大差異,原因是多個因素,包括第一部分第1A項“風險因素”和本年報其他地方所述。閣下應仔細閲讀本年報的“風險因素”一節,以瞭解可能導致實際結果與我們的前瞻性陳述有重大差異的重要因素。另請參閲題為"關於前瞻性陳述的特別説明"的一節。
概述
我們是一家臨牀階段的腫瘤公司,專注於開發MasterKey療法,以治療遺傳腫瘤患者。我們公司的基礎是建立在對癌症遺傳學、癌蛋白結構和功能以及藥物化學的深刻理解之上。我們的MasterKey療法旨在解決廣泛的基因定義腫瘤,克服耐藥性,最大限度地減少野生型介導的毒性,併成為腦滲透劑以治療中樞神經系統(CNS)疾病。我們的化合物靶向臨牀驗證途徑中的致癌突變家族。我們正在推進兩個臨牀階段的項目:BDTX—1535,一種腦滲透劑,第四代EGFR MasterKey抑制劑,靶向表皮生長因子受體突變體(EGFRm)非小細胞肺癌(NSCLC)和膠質母細胞瘤(GBM),以及BDTX—4933,一種腦滲透劑,RAF MasterKey抑制劑,靶向實體瘤中的KRAS,NRAS和BRAF改變。
我們認為,我們的主要候選產品BDTX—1535在早期和後期環境中具有治療EGFR突變(EGFRm)NSCLC患者的潛力,基於BDTX—1535能夠解決約50個致癌突變的能力,其效力高於其他EGFR TKI,並且獨特地靶向奧希替尼治療後可能獲得的C797S耐藥突變。在我們在晚期/轉移性EGFR突變NSCLC患者中進行的I期試驗中,BDTX—1535在腫瘤表達一系列突變亞型(包括獲得性C797S耐藥突變和一系列非經典突變)的患者中表現出良好的耐受性並實現持久的臨牀應答。我們目前正在II期臨牀試驗中評估BDTX—1535,這些臨牀試驗在具有非經典驅動突變和獲得性C797S耐藥突變的二線和三線環境中,以及在具有非經典EGFR突變的EGFRm NSCLC患者中的一線環境中。我們預計將於2024年第三季度公佈二線和三線隊列的結果,並於2025年公佈一線隊列的結果。我們還在評估Osimertinib輔助治療後BDTX—1535在EGFRm NSCLC患者中的潛在發展,其中C797S的BDTX—1535和非經典突變的廣泛突變覆蓋率可能是有益的。
我們在2023年第四季度發佈了BDTX—1535 I期劑量遞增研究的一線GBM結果,顯示在重度預治療GBM患者中具有臨牀活性。BDTX—1535通常耐受良好,未觀察到新的安全性信號。2023年第四季度,BDTX—1535在複發性高級別膠質瘤患者中的"機會窗"0/1期試驗開始入組。我們預計將在2024年第二季度公佈第一階段數據和“機會窗口”結果,這將為BDTX—1535在GBM中開發的潛在後續步驟提供信息。
我們的第二個候選產品BDTX—4933被設計為一種強效、選擇性、可逆的口服抑制劑,靶向廣泛的致癌BRAF、KRAS和NRAS改變家族。BDTX—4933選擇性靶向由BRAF突變或其他上游致癌MAPK通路改變(如KRAS和NRAS改變)產生的組成性活性RAF二聚體。在臨牀前腫瘤模型中,我們觀察到BDTX—4933表現出腦滲透活性,並實現了攜帶廣譜KRAS突變、NRAS突變以及BRAF I、II和III類突變的腫瘤消退。我們於2023年第二季度在BRAF患者中啟動了BDTX—4933的I期臨牀試驗,並選擇KRAS和NRAS突變陽性癌症,重點是非G12C KRAS突變NSCLC患者。該試驗目前正在進行劑量遞增,預計2024年第四季度公佈數據。
自2014年成立以來,我們將幾乎所有的努力和財務資源投入到公司的組織和人員配備、業務規劃、籌集資金、發現候選產品和保護相關知識產權上,同時為我們的項目進行研究和開發活動。我們沒有任何產品被批准銷售,也沒有從產品銷售中獲得任何收入。我們可能永遠無法開發或商業化適銷對路的產品。我們還沒有成功地完成任何關鍵的臨牀試驗、獲得任何監管批准、生產商業規模的藥物或進行銷售和營銷活動。
到目前為止,我們的運營資金來自出售普通股和優先股的收益。自成立以來,我們發生了重大的運營虧損。截至2023年12月31日和2022年12月31日的年度,我們的淨虧損分別為8240萬美元和9120萬美元。截至2023年12月31日,我們的累計赤字為4.174億美元。我們能否產生足夠的產品收入來實現盈利,將在很大程度上取決於我們當前或未來的一個或多個候選產品的成功開發和最終商業化。我們預計,由於我們正在進行的活動,我們的費用和資本需求將大幅增加,特別是如果我們:
•BDTX-1535和BDTX-4933的高級臨牀試驗;
•獲取、維護、擴大和保護我們的知識產權組合;
•吸引和留住關鍵的臨牀、科學、管理和商業人才;
•為我們成功完成臨牀試驗的候選產品尋求市場批准;以及
•獲取或許可其他候選產品。
因此,我們將需要大量額外資金來支持我們的持續運營和實施我們的增長戰略。在我們能夠從產品銷售中獲得可觀的收入之前,我們預計將通過出售股權、債務融資或其他資本來源來為我們的運營提供資金,其中可能包括與其他公司的合作或其他戰略交易。我們可能無法在需要時以優惠條款籌集額外資金或達成此類其他協議或安排,或者根本無法。如果我們未能在需要時籌集資金或達成此類協議,我們可能不得不大幅推遲、縮減或停止我們一個或多個候選產品的開發和商業化,並減少員工人數以及一般和管理成本。
由於與產品開發相關的許多風險和不確定性,我們無法預測增加費用的時間或金額,也無法預測我們何時或是否能夠實現或保持盈利。即使我們能夠創造產品銷售,我們也可能無法盈利。如果我們無法實現盈利或無法持續盈利,那麼我們可能無法繼續按計劃運營,並被迫減少或終止我們的運營。
此外,我們繼續積極監測全球經濟發展、政治動盪、高通脹、資本市場中斷、國際貿易關係變化和軍事衝突以及健康危機造成的宏觀經濟狀況和市場波動。雖然我們認為這些因素在本報告所述期間沒有對我們的業務或財務業績產生重大影響,但未來的發展和對我們業務的潛在影響是不確定的,無法充滿信心地預測。
截至2023年12月31日,我們擁有1.314億美元的現金、現金等價物和投資,我們相信這將使我們能夠為2025年第二季度的運營費用和資本支出需求提供資金。我們基於可能被證明是錯誤的假設做出了這一估計,我們可能會比預期更早耗盡可用的資本資源。見“-流動資金和資本資源“要為超出這一點的業務提供資金,我們將需要籌集額外的資本,這一點無法保證。如果我們無法以我們可以接受的條件籌集足夠的額外資本,我們可能不得不大幅推遲、縮減或停止我們的候選產品或其他研發計劃的開發或商業化。
我們運營結果的組成部分
收入
到目前為止,我們沒有從任何來源獲得任何收入,包括產品銷售,我們預計在可預見的未來不會從產品銷售中產生任何收入。如果我們對候選產品的開發工作取得成功,並獲得監管部門的批准,或與第三方達成許可協議,我們未來可能會從產品銷售中獲得收入。然而,我們不能保證何時才能產生這類收入,如果真的能產生的話。
運營費用
研發費用
研究和開發費用主要包括我們的研究活動產生的成本,包括我們的藥物發現努力和我們的候選產品開發。我們按發生的方式支出研究和開發成本,包括:
•進行必要的臨牀前研究和臨牀試驗以獲得監管機構批准所需的費用;
•根據與合同研究組織(CRO)簽訂的協議產生的費用,合同研究組織(CRO)主要負責監督和實施我們的藥物發現工作、臨牀前研究和臨牀試驗,以及根據與合同生產組織(CMO)簽訂的協議產生的費用,合同生產組織(CMO)主要負責為我們的研究和開發項目提供臨牀前和臨牀原料藥和產品;
•與開展臨牀前研究、臨牀試驗和我們的藥物研發工作有關的其他費用,包括獲取和生產材料、生產驗證批次、研究中心和進行我們臨牀試驗、臨牀前研究和其他科學開發支持服務的顧問費用;
•根據第三方許可、收購和期權協議以現金或股權證券支付的款項;
•與薪酬相關的費用,包括從事研發職能的員工的薪金和福利、差旅費和股票補償費;
•與遵守法規要求有關的成本;以及
•分配的設施相關成本、折舊和其他費用,包括租金和水電費。
我們根據使用服務提供商提供給我們的信息對完成特定任務的進度進行評估,確認外部開發成本。此過程涉及審閲未結合同及採購訂單、與我們的人員溝通以識別代表我們提供的服務,以及在我們尚未收到發票或以其他方式通知實際成本時,估計所提供的服務水平及服務產生的相關成本。我們就將來收到的用於研發活動的貨品或服務而作出的任何不可退還預付款項均記錄為預付費用。該等金額於交付相關貨品或提供相關服務時,或直至預期不再交付貨品或提供服務時支銷。
我們的直接外部研發開支主要包括外部成本,例如就臨牀前開發、工藝開發、生產和臨牀開發活動向外部顧問、CRO、CMO和研究實驗室支付的費用。我們的直接研發開支亦包括根據許可證、收購及期權協議產生的費用。我們不會將員工成本、與我們的發現工作相關的成本、實驗室用品和設施(包括折舊或其他間接成本)分配給特定項目,因為這些成本分佈在多個項目中,因此不會單獨分類。我們主要使用內部資源進行研究和發現,以及管理我們的臨牀前開發、工藝開發、生產和臨牀開發活動。這些員工在多個項目中工作,因此,我們不會按項目跟蹤他們的成本。
開發活動是我們商業模式的核心。處於臨牀開發後期的候選產品通常比處於臨牀開發早期的候選產品具有更高的開發成本,主要是由於後期臨牀試驗的規模和持續時間增加。因此,我們預計,隨着我們繼續進行BDTX—1535和BDTX—4933的臨牀試驗,我們的研發費用將在未來幾年大幅增加。此外,我們可能會產生與里程碑相關的額外費用,以及支付給第三方的特許權使用費,我們可能會與第三方訂立許可、收購和期權協議,以獲取未來候選產品的權利。
目前,我們無法合理估計或瞭解完成任何候選產品臨牀開發所需努力的性質、時間和成本,或何時(如有)我們的任何候選產品可能開始重大淨現金流入。我們候選產品的成功開發和商業化是高度不確定的。這種不確定性是由於與產品開發和商業化相關的許多風險和不確定性,包括以下方面的不確定性:
•我們的臨牀試驗和其他開發活動的範圍、進展、結果和成本;
•成功入組患者以及臨牀試驗的啟動和完成;
•適用監管機構(包括美國食品藥品監督管理局(FDA)和非美國監管機構)的任何上市批准的時間、接收和條款;
•向適用的監管機構作出任何必要的上市後批准承諾的程度;
•建立臨牀和商業生產能力或與第三方製造商作出安排,以確保我們或我們的第三方製造商能夠成功生產產品;
•開發並及時交付臨牀級和商業級藥物製劑,這些製劑可用於我們的臨牀試驗和商業上市;
•取得、維護、捍衞和執行專利權利要求和其他知識產權;
•重要的和不斷變化的政府監管;
•如果我們的候選產品獲得批准,無論是單獨還是與其他公司合作,都可以啟動商業銷售;以及
•在我們的候選產品獲得批准(如果有的話)後,保持我們候選產品的持續可接受的安全狀況。
與我們的候選產品開發相關的這些變量中的任何一個結果的任何變化都可能意味着與這些候選產品開發相關的成本和時間的重大變化。例如,如果FDA或其他監管機構推遲我們計劃的臨牀試驗開始,或要求我們進行超出我們目前預期的臨牀試驗或其他測試,或者如果我們在任何計劃的臨牀試驗中遇到重大延遲,我們可能需要花費大量額外的財政資源和時間來完成該候選產品的臨牀開發。
一般和行政費用
一般和行政費用主要包括行政、業務發展、財務、人力資源、法律、信息技術、商務前和支助人事職能人員的薪金和福利、差旅和股票報酬費用。一般和行政費用還包括與設施有關的直接費用和分攤費用,以及法律、專利、諮詢、投資者和公共關係、會計和審計服務的保險費和專業費用。
我們預計,隨着我們增加員工人數以支持候選產品的持續開發併為潛在的商業化活動做準備,我們的一般和管理費用未來將會增加。此外,如果我們認為有可能獲得監管機構對候選產品的批准,我們預計,由於我們為商業運營做準備,尤其是與該候選產品的銷售和營銷有關的支出,工資和其他與員工相關的費用將會增加。
其他收入(費用)
其他收入(支出)主要包括我們的現金等價物和投資餘額所賺取的利息收入、轉租收入、已實現和未實現的外幣交易損益以及與權益法投資有關的知識產權銷售收益(虧損)。
未合併實體的權益(虧損)
未合併實體之權益(虧損)由吾等按權益持有率計算之權益法投資虧損份額及因基差而產生之知識產權研發費用組成。
行動的結果
截至2023年、2023年和2022年12月31日止年度比較
下表彙總了我們在截至2023年12月31日和2022年12月31日的年度的運營結果: | | | | | | | | | | | | | | | | | |
| 截至十二月三十一日止的年度: |
|
|
| 2023 |
| 2022 |
| 變化 |
| (單位:千) |
| 運營費用: | | | | | |
| 研發 | $ | 59,350 | | | $ | 64,437 | | | $ | (5,087) | |
| 一般和行政 | 27,110 | | | 28,391 | | | (1,281) | |
| 總運營費用 | 86,460 | | | 92,828 | | | (6,368) | |
| 運營虧損 | (86,460) | | | (92,828) | | | 6,368 | |
| 其他收入(支出): | | | | | |
| | | | | |
| 利息收入 | 1,924 | | | 2,031 | | | (107) | |
| | | | | |
| 其他收入(費用) | 2,094 | | | (354) | | | 2,448 | |
| 知識產權銷售收益 | — | | | 2,232 | | | (2,232) | |
| 其他收入(費用)合計,淨額 | 4,018 | | | 3,909 | | | 109 | |
| 未合併實體的權益(虧損) | — | | | (2,250) | | | 2,250 | |
| 淨虧損 | $ | (82,442) | | | $ | (91,169) | | | $ | 8,727 | |
研發
截至2023年12月31日止年度的研發費用為5940萬美元,而截至2022年12月31日止年度則為6440萬美元。下表概述我們截至二零二三年及二零二二年十二月三十一日止年度的研發開支: | | | | | | | | | | | | | | | | | |
| 截至十二月三十一日止的年度: |
|
|
| 2023 |
| 2022 |
| 變化 |
| (單位:千) |
| BDTX—1535研發費用 | $ | 21,141 | | | $ | 8,414 | | | $ | 12,727 | |
| BDTX—4933研發費用 | 6,342 | | | 6,934 | | | (592) | |
| BDTX—189研發費用 | — | | | 7,082 | | | (7,082) | |
| 其他研究項目和平臺開發費用 | 7,916 | | | 13,466 | | | (5,550) | |
| 人員費用 | 18,408 | | | 22,889 | | | (4,481) | |
| 分配設施費用 | 3,605 | | | 4,088 | | | (483) | |
| 其他費用 | 1,938 | | | 1,564 | | | 374 | |
| $ | 59,350 | | | $ | 64,437 | | | $ | (5,087) | |
減少510萬美元主要是由於BDTX—1535臨牀試驗進展相關的1270萬美元增加,被其他研究項目和平臺開發相關支出減少560萬美元抵消,因為我們加深對臨牀階段資產的關注,減少了早期發現項目的支出。此外,BDTX—189支出減少了710萬美元,原因是BDTX—189的開發停止,專注於BDTX—1535和BDTX—4933的開發。人事開支減少450萬元,乃由於我們於2022年4月重組員工隊伍,專注於臨牀試驗即將到來的里程碑。
一般和行政
截至2023年12月31日止年度的一般及行政開支為27. 1百萬美元,而截至2022年12月31日止年度則為28. 4百萬美元。減少130萬美元的主要原因是法律和其他專業費用減少。
其他收入(費用)
截至2023年12月31日止年度的其他收入為400萬美元,而截至2022年12月31日止年度則為390萬美元。儘管10萬美元的增長同比較低,但2023年的組成主要為分租收入和投資增加,而2022年主要為與權益法投資Launchpad相關的知識產權銷售收益。
未合併實體的權益(虧損)
截至2023年12月31日止年度,未合併實體並無權益(虧損),而截至2022年12月31日止年度則為2. 3百萬美元。該增加乃由於二零二三年並無權益法投資,而二零二二年我們按權益所有權百分比報告應佔權益法投資對象虧損以及因基準差異產生的知識產權及開發費用。
流動資金和資本資源
流動資金來源
自我們成立以來,我們並無從任何產品銷售或任何其他來源產生任何收入,並已產生重大經營虧損及經營負現金流量。我們尚未將任何候選產品商業化,我們預計未來幾年內不會從任何候選產品的銷售中產生收入(如果有的話)。迄今為止,我們的運營資金主要來自出售普通股和優先股的收益。
2020年2月3日,我們完成了12,174,263股普通股的首次公開募股,包括承銷商完全行使其購買最多1,587,947股額外普通股的選擇權,總所得款項為2.313億美元。扣除承銷折扣及佣金以及我們應付的其他估計發行費用後,我們收到2.12億美元的所得款項淨額。截至2023年12月31日,我們已從先前出售優先股獲得現金收益淨額2.006億美元,截至2023年12月31日,我們擁有現金、現金等價物和投資1.314億美元。
2022年11月14日,我們向美國證券交易委員會提交了表格S—3(“貨架登記聲明”),其中涵蓋了我們的普通股、優先股、債務證券、認股權證和/或其任何組合的發行、發行和銷售,最高價格為5億美元。我們同時簽署了一份公開市場銷售協議SM(the本公司與Jefferies LLC(Jefferies)(作為銷售代理)簽訂銷售協議),規定我們不時通過Jefferies作為銷售代理(ATM計劃)發行和銷售高達1.5億美元的普通股或股份。《貨架登記聲明》於2022年11月22日生效。在配售通知書交付後,在銷售協議的條款和條件的規限下,傑富瑞可按法律允許的任何方法出售股份,該方法被視為根據證券法頒佈的規則415(a)(4)所界定的“在市場上發售”。吾等可按吾等不時釐定之金額及時間出售股份,惟吾等並無責任根據銷售協議出售任何股份。我們或傑富瑞可在通知另一方後暫停或終止股份發售,並受其他條件規限。截至2023年12月31日,並無根據ATM計劃進行銷售。
2023年7月5日,我們完成了15,000,000股普通股的承銷公開發行(後續發行),價格為每股5美元。扣除承銷折扣和佣金以及其他發行費用後,後續發行所得款項淨額總額約為7160萬美元。承銷商沒有行使其30天超額配售權的任何部分以公開發行價購買最多額外2,250,000股本公司普通股,該公開發行價於2023年7月29日到期,因此沒有收到後續發行的額外所得款項。
現金流
下表概述我們於各呈列期間的現金來源及用途(以千計): | | | | | | | | | | | |
| 截至2013年12月31日止的年度, |
| 2023 |
| 2022 |
| 用於經營活動的現金 | $ | (66,717) | |
| $ | (85,082) | |
投資活動提供的現金 | 16,346 | |
| 53,366 | |
| 融資活動提供的現金 | 71,932 | |
| 177 | |
| 現金及現金等價物淨增(減) | $ | 21,561 | |
| $ | (31,539) | |
經營活動
截至2023年12月31日止年度,我們在經營活動中使用現金6670萬美元,主要原因是我們的淨虧損8240萬美元,部分被與股票補償費用相關的非現金費用960萬美元、預付費用和其他流動資產因開發服務而減少以及應付賬款增加所抵消,應計費用及其他流動負債。
截至2022年12月31日止年度,我們在經營活動中使用現金8510萬美元,主要由於我們的淨虧損9120萬美元,部分被與股票補償費用相關的非現金費用1220萬美元以及應付賬款、應計費用和其他流動負債減少所抵銷。
應付賬款及應計費用於所有期間的變動一般是由於業務增長、候選產品的發展以及供應商開具發票及付款的時間。
投資活動
截至2023年12月31日止年度,我們的投資活動提供現金1630萬美元,主要來自投資的銷售和到期日。
截至2022年12月31日止年度,我們的投資活動提供現金53. 4百萬美元,主要來自投資的銷售及到期日。
融資活動
截至2023年12月31日止年度,我們的融資活動提供現金7190萬美元,包括2023年7月後續發售的所得款項以及參與員工購股計劃。
截至2022年12月31日止年度,我們的融資活動提供的現金為20萬美元,包括行使股票期權所得款項。
資金需求
我們預計我們的開支將因我們正在進行的活動而大幅增加,特別是隨着我們推進候選產品的臨牀試驗。此外,我們預計將產生與作為上市公司運營相關的額外成本,包括重大的法律、會計、投資者關係和其他開支。我們營運開支的時間和金額將在很大程度上取決於我們的能力:
•通過臨牀試驗,推進BDTX—1535和BDTX—4933;
•生產或代表我們生產我們的原料藥,並開發後期和商業生產的工藝;
•為任何成功完成臨牀試驗的候選產品尋求監管部門的批准;
•建立銷售、市場營銷、醫療事務和分銷基礎設施,以將我們可能獲得市場營銷批准並打算自行商業化的任何候選產品商業化;
•增聘臨牀、質量控制和科學人員;以及
•獲取、維護、擴大和保護我們的知識產權組合。
截至2023年12月31日,我們擁有1.314億美元的現金、現金等價物和投資,我們相信這將為我們的運營費用和資本支出需求提供資金,直到2025年第二季度。我們的估計是基於可能被證明是錯誤的假設,我們可以比預期更快地利用可用的資本資源。我們預計,當我們尋求監管機構批准我們的候選產品,以及如果我們選擇尋求內授權或收購其他候選產品時,我們將需要額外的資本。如果我們的任何候選產品獲得監管部門的批准,我們預計將產生與產品製造、銷售、營銷和分銷相關的重大商業化費用,具體取決於我們選擇的商業化地點。
由於與候選產品的研究、開發和商業化相關的眾多風險和不確定性,我們無法預測增加開支的時間或金額,或何時或是否能夠實現或維持盈利能力。倘我們未能盈利或無法持續維持盈利能力,則我們可能無法按計劃水平繼續營運,並被迫進一步縮減或終止營運。我們未來的資金需求將取決於並可能因許多因素而大幅增加,包括:
•開發我們候選產品和進行臨牀試驗的範圍、進度、結果和成本;
•對我們的候選產品進行監管審查的成本、時間和結果;
•生產候選產品的成本、時間和能力,以滿足我們的臨牀開發和臨牀試驗的需要;
•對於我們獲得上市批准的任何候選產品,未來活動的成本,包括產品銷售、醫療事務、市場營銷、製造和分銷;
•根據監管部門的批准,我們候選產品的商業化活動的成本,如果此類成本不是任何未來合作伙伴的責任,包括建立產品銷售、營銷、分銷和製造能力的成本和時間;
•獲得額外非稀釋性資金的能力;
•如果我們的任何候選產品獲得上市批准,從我們產品的商業銷售中獲得的收入;
•準備、提交和起訴專利申請,獲取、維護、擴大和執行我們的知識產權,以及為知識產權相關索賠辯護的費用;
•我們在有利條件下建立和維持合作的能力,如果有的話;
•我們獲得或許可其他候選產品和技術的程度;以及
•作為上市公司的運營成本。
因此,我們將需要大量額外資金來支持我們的持續經營和追求我們的增長戰略。在此之前(如有的話),由於我們可以從產品銷售中產生可觀的產品收入,我們預期通過公開或私募股權發行、債務融資、合作、戰略夥伴關係及聯盟或與第三方的營銷、分銷或授權安排或其他融資來源為我們的業務提供資金。此外,由於有利的市場條件或戰略考慮,我們可能尋求額外的資本,即使我們相信我們有足夠的資金用於我們目前或未來的經營計劃。然而,我們的普通股和其他生物製藥公司的交易價格一直高度波動。因此,我們可能會面臨通過出售普通股籌集資金的困難,而且這種出售可能會在不利的條件下進行。同樣,全球經濟發展、政治動盪、高通脹、全球衞生危機或其他因素導致的不利宏觀經濟狀況和市場波動可能對我們以優惠條件或根本完成股權或債務融資的能力產生重大不利影響。我們可能無法籌集額外資金或在需要時以優惠條款或根本無法達成其他協議或安排。
在我們通過出售私募股權或公共股權或可轉換債務證券籌集額外資本的情況下,我們股東的所有權權益可能會被重大稀釋,而這些證券的條款可能包括清算或其他優惠以及可能對我們普通股股東權利產生不利影響的反稀釋保護。債務融資和優先股權融資(如有)可能涉及協議,其中包括限制或限制我們採取特定行動的能力,例如產生額外債務、進行資本開支或宣佈股息,這可能對我們開展業務的能力造成不利影響。此外,債務融資可能涉及重大現金支付責任,而特定財務比率可能限制我們經營業務的能力,將導致固定付款責任。
如果我們通過與第三方的合作、戰略夥伴關係和聯盟或營銷、分銷或許可安排籌集額外資金,我們可能不得不放棄對我們的技術、未來收入來源、研究項目或候選產品的寶貴權利,或以可能對我們不利的條款授予許可。如果我們無法在需要時通過股權或債務融資或其他安排籌集額外資金,我們可能會被要求延遲、限制、減少或終止我們的研究、產品開發或未來的商業化努力,或授予開發和營銷我們原本希望自己開發和營銷的候選產品的權利。通過與合作者訂立的協議對我們不利的條款獲得資金,或尋求合併或收購策略,所有這些都可能對我們股東的持股或權利造成不利影響。
關鍵會計政策和重大判斷以及估計的使用
我們的綜合財務報表是根據美國公認會計原則(GAAP)編制的。編制綜合財務報表及相關披露要求我們作出影響資產、負債、成本及開支之呈報金額之估計及判斷。吾等根據過往經驗、已知趨勢及事件以及吾等認為在有關情況下屬合理的各種其他因素作出估計,其結果構成對無法從其他來源顯而易見的資產及負債賬面值作出判斷的基礎。我們持續評估我們的估計和假設。根據不同假設或條件,我們的實際業績可能與該等估計有所不同。
雖然我們的主要會計政策在綜合財務報表附註2中有更詳細的描述,但我們相信以下會計政策對編制財務報表所用的判斷和估計最為關鍵。
應計研究與開發費用
作為編制綜合財務報表過程的一部分,吾等須估計應計研發開支。此過程涉及審閲未結合同及採購訂單、與我們的相關人員溝通以識別代表我們提供的服務,以及在我們尚未收到發票或以其他方式通知實際成本時,估計所提供的服務水平及服務產生的相關成本。我們的大多數服務提供商會根據預先確定的時間表或在達到合同里程碑時向我們開具欠款的發票;然而,有些服務提供商要求預付款。吾等根據吾等當時所知之事實及情況,估計於各結算日於綜合財務報表內之應計開支。我們定期與服務提供商確認估計的準確性,並在必要時作出調整。估計應計研發費用的例子包括支付給下列人員的費用:
•供應商,包括研究實驗室,與臨牀前開發活動有關;
•與臨牀前研究和臨牀試驗有關的CRO和研究地點;以及
•與臨牀前研究和臨牀試驗材料的原料藥和製劑製劑有關的CMO。
我們根據與代表我們供應、實施和管理臨牀前研究和臨牀試驗的多個研究機構和CRO的報價和合同,對收到的服務和花費的努力的估計,來計算與臨牀前研究和臨牀試驗相關的費用。這些協議的財務條款有待談判,不同的合同各不相同,可能導致付款不均衡。在某些情況下,向我們的供應商支付的款項可能會超過所提供的服務水平,從而導致提前支付費用。其中一些合同下的付款取決於患者的成功登記和臨牀試驗里程碑的完成等因素。在應計服務費時,我們估計將提供服務的時間段和每段時間的努力程度。如果服務執行的實際時間或努力程度與估計值不同,我們會相應地調整應計或預付費用。儘管我們預計我們的估計不會與實際發生的金額有實質性差異,但我們對所提供服務的狀態和時間相對於所提供服務的實際狀態和時間的理解可能會有所不同,並可能導致報告的金額在任何特定時期過高或過低。到目前為止,我們對應計研究和開發費用的先前估計沒有任何重大調整。
基於股票的薪酬
我們根據授予僱員、非僱員及董事的購股權及其他以股票為基礎的獎勵於授出日期的公平值計量,並於所需服務期(一般為各獎勵的歸屬期)內確認該等獎勵的相應補償開支。我們一般只發行附有服務歸屬條件的購股權及受限制股票單位,並以直線法記錄該等獎勵的開支。對於以業績為基礎的歸屬條件發行的股票期權或受限制股票單位,當認為很可能達到業績條件時,根據授予日的公允價值確認相關股票補償費用。分級歸屬法將適用於所有附有表現歸屬條件的股份獎勵,或適用於附有服務及表現歸屬條件的獎勵。
我們以往授予的股票期權的行使價相當於我們普通股於授出日期的公允價值。就授出受限制股票單位而言,吾等按授出日期之股票價格釐定公平值。
我們將授予僱員及非僱員的以股票為基礎的獎勵按公平值入賬,該公平值使用柏力克—舒爾斯期權定價模式計量。獎勵之計量日期一般為授出日期。以股份為基礎的補償成本於所需服務期(一般為歸屬期)以直線法就所有時間歸屬獎勵確認為開支。
我們使用柏力克—舒爾斯期權定價模型估計每份購股權授出的公平值,該模型使用我們普通股的公平值,以及我們就普通股波動率、購股權的預期期限、與購股權預期期限相近的期間的無風險利率以及我們的預期股息率所作的假設作為輸入數據。
最近發佈的會計聲明
可能影響我們財務狀況及經營業績的近期發佈的會計公告的説明,已於本年報其他部分的綜合財務報表附註2披露。
新興成長型公司和較小的報告公司地位
JumpStart Our Business Startups Act of 2012(JOBS Act)允許像我們這樣的“新興成長型公司”利用延長的過渡期遵守適用於上市公司的新會計準則或修訂後的會計準則,直到這些準則適用於非上市公司。我們已選擇不“選擇退出”這一條款,因此,我們將在私人公司採用新的或修訂的會計準則時採用新的或修訂的會計準則,並將一直這樣做,直到我們(I)不可撤銷地選擇“選擇退出”延長的過渡期或(Ii)不再符合新興成長型公司的資格。
我們也是一家“較小的報告公司”,這意味着我們非關聯公司持有的股票的市值不到7億美元,在最近結束的財年中,我們的年收入不到1億美元。如果(I)非關聯公司持有的我們股票的市值低於2.5億美元,或(Ii)在最近結束的財年中,我們的年收入低於1億美元,並且非關聯公司持有的我們股票的市值低於7億美元,我們可能會繼續成為一家規模較小的報告公司。如果我們是一家較小的報告公司,當我們不再是一家新興的成長型公司時,我們可能會繼續依賴較小的報告公司可以獲得的某些披露要求的豁免。具體地説,作為一家較小的報告公司,我們可能會選擇在我們的Form 10-K年度報告中只公佈最近兩個財政年度的經審計財務報表,與新興成長型公司類似,較小的報告公司減少了有關高管薪酬的披露義務。
項目7A。關於市場風險的定量和定性披露
根據交易法第12b-2條的定義,我們是一家較小的報告公司,不需要提供本項目所要求的信息。
項目8.合併財務報表和補充數據
黑鑽石治療公司。
合併財務報表索引 | | | | | |
| 第…頁,第 |
獨立註冊會計師事務所報告(PCAOB ID238) | 134 |
|
|
合併資產負債表 | 135 |
|
|
合併經營報表和全面虧損 | 136 |
|
|
合併現金流量表 | 137 |
| |
股東權益合併報表 | 138 |
獨立註冊會計師事務所報告
致本公司董事會及股東
黑鑽石治療公司。
對財務報表的幾點看法
我們已審計隨附的Black Diamond Therapeutics,Inc.合併資產負債表。本公司已審閲本公司及其附屬公司(“本公司”)於二零二三年及二零二二年十二月三十一日之相關綜合經營及全面虧損表、股東權益表及現金流量表,包括相關附註(統稱“綜合財務報表”)。我們認為,綜合財務報表在所有重大方面均符合美利堅合眾國公認會計原則,公允列報貴公司於二零二三年及二零二二年十二月三十一日的財務狀況,以及截至該日止年度的經營成果及現金流量。
意見基礎
這些合併財務報表由公司管理層負責。我們的責任是根據我們的審計對公司的綜合財務報表發表意見。我們是一家在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券法以及美國證券交易委員會和PCAOB的適用規則和法規,我們必須與公司保持獨立。
我們按照PCAOB的標準對這些合併財務報表進行了審計。這些準則要求我們計劃和執行審計,以獲得關於合併財務報表是否沒有重大錯報的合理保證,無論是由於錯誤還是舞弊。本公司並無被要求對其財務報告的內部控制進行審計,我們也沒有受聘進行審計。作為我們審計的一部分,我們被要求瞭解財務報告的內部控制,但不是為了表達對公司財務報告內部控制有效性的意見。因此,我們不表達這樣的意見。
我們的審計包括執行評估合併財務報表重大錯報風險的程序,無論是由於錯誤還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查關於合併財務報表中的金額和披露的證據。我們的審計還包括評價管理層使用的會計原則和作出的重大估計,以及評價合併財務報表的整體列報。我們相信,我們的審計為我們的觀點提供了合理的基礎。
物質的側重點
誠如綜合財務報表附註1所述,本公司將需要額外融資以資助未來營運。管理層對事件和條件的評估以及緩解這一問題的計劃也在附註1中説明。
| | | | | |
| |
| /s/ | 普華永道會計師事務所 |
|
|
| 波士頓,馬薩諸塞州 |
| 2024年3月12日 |
自2019年以來,我們一直擔任本公司的審計師。
黑鑽石治療公司。
合併資產負債表
(以千為單位,不包括每股和每股數據) | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
| 資產 |
|
|
|
| 流動資產: |
|
|
|
| 現金和現金等價物 | $ | 56,221 | |
| $ | 34,315 | |
| 投資 | 75,179 | | | 88,492 | |
| 預付費用和其他流動資產 | 2,634 | |
| 4,899 | |
| 流動資產總額 | 134,034 | |
| 127,706 | |
| 財產和設備,淨額 | 1,730 | |
| 2,587 | |
| 受限現金 | 823 | |
| 1,168 | |
| | | |
| 使用權資產 | 21,980 | | | 24,794 | |
| | | |
| | | |
| 總資產 | $ | 158,567 | |
| $ | 156,255 | |
| 負債與股東權益 | | | |
| 流動負債: | | | |
| 應付帳款 | $ | 2,324 | |
| $ | 1,877 | |
| | | |
| 應計費用和其他流動負債 | 17,322 | |
| 13,384 | |
| 流動負債總額 | 19,646 | |
| 15,261 | |
| | | |
| 非流動經營租賃負債 | 22,185 | | | 25,299 | |
| 總負債 | 41,831 | |
| 40,560 | |
| 承付款和或有事項(附註12) | — | |
| — | |
| 股東權益: | |
| |
優先股,$0.0001票面價值;10,000,000股票和10,000,000分別於2023年、2023年和2022年12月31日授權的股份;不是於2023年及2022年12月31日發行或發行的股份 | — | | | — | |
普通股;美元0.0001票面價值;500,000,000於2023年12月31日獲授權的股份及500,000,0002022年12月31日授權的股票;51,645,557於2023年12月31日發行及發行的股份及36,434,297於2022年12月31日發行及發行的股份 | 7 | |
| 5 | |
| 額外實收資本 | 534,187 | |
| 452,503 | |
| 累計其他綜合(虧損)收入 | (27) | | | (1,824) | |
| 累計赤字 | (417,431) | |
| (334,989) | |
| 股東權益總額 | 116,736 | |
| 115,695 | |
| 總負債和股東權益 | $ | 158,567 | |
| $ | 156,255 | |
附註是這些合併財務報表的組成部分。
黑鑽石治療公司。
合併經營報表和全面虧損
(以千為單位,不包括每股和每股數據) | | | | | | | | | | | |
| 截至十二月三十一日止的年度: |
| 2023 | | 2022 |
| 運營費用: | | | |
| 研發 | $ | 59,350 | | | $ | 64,437 | |
| 一般和行政 | 27,110 | | | 28,391 | |
| 總運營費用 | 86,460 | | | 92,828 | |
| 運營虧損 | (86,460) | | | (92,828) | |
| 其他收入(支出): | | | |
| | | |
| 利息收入 | 1,924 | | | 2,031 | |
| 其他收入(費用) | 2,094 | | | (354) | |
| 知識產權銷售收益 | — | | | 2,232 | |
| 其他收入(費用)合計,淨額 | 4,018 | | | 3,909 | |
| 未合併實體權益(虧損) | — | | | (2,250) | |
| 淨虧損 | $ | (82,442) | | | $ | (91,169) | |
| 每股基本和稀釋後淨虧損 | $ | (1.88) | | | $ | (2.52) | |
| 加權平均已發行普通股、基本普通股和稀釋後普通股 | 43,954,649 | | | 36,325,586 | |
| | | |
| 綜合損失: | | | |
| 淨虧損 | $ | (82,442) | | | $ | (91,169) | |
| 其他綜合(虧損)收入: | | | |
| 投資未實現(損失)收益變動淨額 | 1,797 | | | (1,410) | |
| 綜合損失 | $ | (80,645) | | | $ | (92,579) | |
附註是這些合併財務報表的組成部分。
黑鑽石治療公司。
合併現金流量表
(單位:千) | | | | | | | | | | | |
| 截至十二月三十一日止的年度: |
| 2023 |
| 2022 |
| 經營活動的現金流: |
|
|
|
| 淨虧損 | $ | (82,442) | | | $ | (91,169) | |
| 對淨虧損與經營活動中使用的現金淨額進行調整: | | | |
| 基於股票的薪酬費用 | 9,604 | | | 12,197 | |
| | | |
| 折舊費用 | 437 | | | 508 | |
| (累加)投資攤銷 | (1,174) | | | 536 | |
| 非現金租金費用 | 2,814 | | | 2,730 | |
| | | |
| | | |
| 財產和設備處置損失 | 358 | | | — | |
| 出售財產和設備的收益 | — | | | (1) | |
| 知識產權銷售收益 | — | | | (2,232) | |
| 未合併實體虧損中的權益 | — | | | 2,250 | |
| 經營性資產和負債變動情況: | | | |
| 預付費用和其他流動資產 | 2,265 | | | 1,018 | |
| 其他非流動資產 | — | | | 16 | |
| 應付帳款 | 597 | | | (2,230) | |
| | | |
| 應計費用和其他流動負債 | 3,938 | | | (5,864) | |
| 非流動經營租賃負債 | (3,114) | | | (2,841) | |
| 用於經營活動的現金淨額 | (66,717) | | | (85,082) | |
| | | |
| 投資活動產生的現金流: | | | |
| 購買設備 | (33) | | | (192) | |
| 處置設備所得收益 | 95 | | | 9 | |
| 銷售收益和投資到期日 | 78,171 | | | 113,690 | |
| 購買投資 | (61,887) | | | (60,141) | |
| | | |
| 投資活動提供的現金淨額 | 16,346 | | | 53,366 | |
| | | |
| 融資活動的現金流: | | | |
| | | |
| 行使普通股期權和EPP所得款項 | 82 | | | 177 | |
| | | |
| | | |
| 發行普通股所得收益,扣除發行成本 | 71,850 | | | — | |
| 融資活動提供的現金淨額 | 71,932 | | | 177 | |
| 現金及現金等價物淨增(減) | 21,561 | | | (31,539) | |
| 現金、現金等價物和受限現金,年初 | 35,483 | | | 67,022 | |
| 現金、現金等價物和受限現金,年終 | $ | 57,044 | | | $ | 35,483 | |
| | | |
| 現金和現金等價物,年終 | $ | 56,221 | | | $ | 34,315 | |
| 受限現金,年終 | 823 | | | 1,168 | |
| 現金、現金等價物和受限現金,年終 | $ | 57,044 | | | $ | 35,483 | |
| | | |
| 補充披露非現金投資和融資活動: | | | |
| | | |
| | | |
| | | |
| 以經營性租賃義務換取的使用權資產 | $ | — | | | $ | (181) | |
| | | |
| | | |
| 以非現金代價收購的權益法投資 | $ | — | | | $ | 18 | |
| | | |
| | | |
附註是這些合併財務報表的組成部分。
黑鑽石治療公司。
股東權益合併報表
(單位:千,共享數據除外) | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 普通股 | | 其他內容 實收資本 | | 累計其他綜合收益(虧損) | | 累計赤字 | | 總計 股東的 股權 |
| 股票 |
| 面值 | | | | |
| 餘額-2021年12月31日 | 36,234,624 | | | $ | 5 | | | $ | 440,129 | | | $ | (414) | | | $ | (243,820) | | | $ | 195,900 | |
| 普通股期權的行使 | 4,973 | | | — | | | 16 | | | — | | | — | | | 16 | |
| 有限制股份單位的歸屬 | 62,196 | | | — | | | — | | | — | | | — | | | — | |
| 為繳税而交出股份 | (11,428) | | | — | | | (28) | | | — | | | — | | | (28) | |
| 發行與ESPP相關的普通股 | 53,662 | | | — | | | 189 | | | — | | | — | | | 189 | |
| 基於股票的薪酬 | 90,270 | | | — | | | 12,197 | | | — | | | — | | | 12,197 | |
| 投資未實現(虧損)收益 | — | | | — | | | — | | | (1,410) | | | — | | | (1,410) | |
| 淨虧損 | — | | | — | | | — | | | — | | | (91,169) | | | (91,169) | |
| 餘額-2022年12月31日 | 36,434,297 | | | $ | 5 | | | $ | 452,503 | | | $ | (1,824) | | | $ | (334,989) | | | $ | 115,695 | |
| 普通股發行 | 15,000,000 | | | 2 | | | 71,998 | | | — | | | — | | | 72,000 | |
| 普通股期權的行使 | 5,370 | | | — | | | 20 | | | — | | | — | | | 20 | |
| 有限制股份單位的歸屬 | 90,872 | | | — | | | — | | | — | | | — | | | — | |
| 為繳税而交出股份 | (18,457) | | | — | | | (46) | | | — | | | — | | | (46) | |
| 發行與ESPP相關的普通股 | 69,005 | | | — | | | 108 | | | — | | | — | | | 108 | |
| 基於股票的薪酬 | 64,470 | | | — | | | 9,604 | | | — | | | — | | | 9,604 | |
| 投資未實現(虧損)收益 | — | | | — | | | — | | | 1,797 | | | — | | | 1,797 | |
| 淨虧損 | — | | | — | | | — | | | — | | | (82,442) | | | (82,442) | |
| 餘額-2023年12月31日 | 51,645,557 | | | $ | 7 | | | $ | 534,187 | | | $ | (27) | | | $ | (417,431) | | | $ | 116,736 | |
附註是這些合併財務報表的組成部分。
黑鑽石治療公司。
合併財務報表附註
(以千為單位,不包括每股和每股)
1. 業務性質和列報依據
黑鑽石治療公司(該公司)是一家臨牀階段的腫瘤學公司,專注於開發MasterKey療法來治療遺傳定義的腫瘤患者。該公司於2014年12月成立,最初是一家有限責任公司,名稱為ASET治療有限責任公司。2016年9月,根據特拉華州法律,本公司改名為ASET治療公司。2018年1月,公司更名為黑鑽石治療公司。自成立以來,該公司投入了幾乎所有的努力來籌集資金,獲得資金,併產生與其突變-變構-藥理學(MAP)藥物發現引擎確定的候選產品的開發和進步相關的研究和開發成本。
該公司受到生物技術行業臨牀階段公司常見的風險和不確定性的影響。不能保證公司的研究和開發將成功完成,不能保證公司的技術將獲得足夠的保護,不能保證開發的任何產品將獲得必要的政府監管批准,或任何產品,如果獲得批准,將是商業上可行的。該公司在快速技術創新和來自制藥和生物技術公司的激烈競爭的環境中運營。此外,公司還依賴於其員工、顧問和服務提供商的服務。即使公司的產品開發努力取得了成功,公司何時(如果有的話)將從產品銷售中獲得可觀的收入也是不確定的。
2022年11月14日,本公司向美國證券交易委員會(The Securities and Exchange Commission,簡稱美國證券交易委員會)提交了一份S-3表格(《擱置登記表》)的擱置登記表,其中涵蓋了公司普通股、優先股、債務證券、權證和/或上述各項的任何組合單位的發售、發行和銷售,最高發行價為$5001000萬美元。本公司同時訂立公開市場銷售協議SM以Jefferies LLC(Jefferies)為銷售代理,為公司發行和銷售最高可達$150通過Jefferies(自動取款機計劃)不時獲得100萬股普通股。《貨架登記聲明》於2022年11月22日生效。截至2023年12月31日,尚未根據ATM計劃進行任何銷售。
2023年7月5日,本公司完成承銷公開發行(續發)15,000,000公司普通股,向公眾公佈的價格為$5.00每股。後續發售的淨收益總額約為$71.9萬美元,扣除承銷折扣和佣金以及其他發行費用後。
隨附的綜合財務報表是根據業務的連續性、資產的變現以及正常業務過程中的負債和承諾的清償情況編制的。從歷史上看,該公司的運營資金主要來自出售普通股和優先股的收益。該公司自成立以來的所有時期都有經常性虧損和負現金流,累計虧損#美元。417.4截至2023年12月31日,為100萬。該公司預計在可預見的未來將繼續產生營業虧損。
截至2024年3月12日,即綜合財務報表的發佈日期,公司預計其現金、現金等價物和投資將足以為其目前計劃的運營提供資金,至少在這些經審計的綜合財務報表提交日期起計的未來12個月內。
該公司將通過私募或公開股權融資、債務融資、合作、戰略聯盟以及營銷、分銷或許可安排尋求更多資金。該公司可能無法以可接受的條款獲得融資,或者根本無法獲得融資,並且該公司可能無法達成合作或其他安排。任何融資條款都可能對公司股東的持股或權利產生不利影響。如果公司無法獲得資金,公司可能被迫推遲、減少或取消部分或全部研發計劃、產品組合擴展或商業化努力,或減少員工人數以及一般和管理成本,這可能對其業務前景產生不利影響。儘管管理層繼續執行這些計劃,但不能保證公司將成功地以公司可以接受的條款獲得足夠的資金,為持續運營提供資金,如果有的話。
2. 重要會計政策摘要
合併原則
所附的綜合財務報表是根據美利堅合眾國公認的會計原則編制的,其中包括公司及其全資子公司黑鑽石治療安全公司和黑鑽石治療(加拿大)公司在剔除所有重大公司間賬户和交易後的賬目。2023年10月10日,黑鑽石治療(加拿大)有限公司以自願解散的方式解散。
預算的使用
按照公認會計原則編制公司的綜合財務報表時,管理層需要作出估計和假設,以影響報告期內報告的資產和負債金額以及報告的費用金額。這些合併財務報表中反映的重大估計和假設包括但不限於研發費用的應計和股票獎勵的估值。本公司根據過往經驗、已知趨勢及其他其認為在當時情況下屬合理的特定市場因素或其他相關因素作出估計。根據情況、事實和經驗的變化,定期審查估計數。估計的變化被記錄在它們被知道的時間段。實際結果可能與這些估計或假設不同。
該公司繼續監測全球經濟發展、政治動盪、高通脹、資本市場混亂、國際貿易關係變化和軍事衝突以及健康危機對其業務各個方面的影響,並在其財務報表中考慮了這些因素對估計的影響。未來的發展對公司的業務、經營結果或財務狀況的影響程度是不確定的,也不能有把握地預測,未來的估計可能會發生變化。於本綜合財務報表刊發日期,本公司並未因該等因素而經歷重大業務中斷或資產賬面值減值損失,亦不知悉任何需要其更新估計的具體相關事件或情況。
後續事件
該公司考慮在資產負債表日期之後但在最終財務報表發佈之前發生的事件或交易,以提供與某些估計有關的額外證據,或確定需要額外披露的事項。
外幣和貨幣折算
該公司的全資外國子公司黑鑽石治療(加拿大)於2023年10月解散。在解散之前,黑鑽石治療(加拿大)公司的功能貨幣是美元。以當地貨幣以外貨幣計價的交易因匯率變動而產生的調整計入發生的其他收入(費用)、綜合業務報表淨額和發生的全面虧損。
現金和現金等價物
本公司將在銀行的存款、貨幣市場基金以及在購買時暫時投資於期限不超過三個月的各種工具的現金歸類為現金和現金等價物。截至2023年12月31日、2023年12月31日和2022年12月31日,現金和現金等價物包括商業銀行的存款現金和投資於美國政府證券的貨幣市場基金。
投資
投資包括原始到期日超過90天的有價證券。本公司根據其高流動性,將其期限超過一年的投資歸類為短期投資,因為此類有價證券代表可用於當前業務的現金投資。本公司認為其有價證券投資組合可供出售。因此,這些投資按公允價值計入,公允價值以市場報價為基礎。未實現損益作為股東權益中累計的其他綜合項目列報。溢價和折扣的攤銷和增加計入其他收入(費用)。債務證券的已實現收益或虧損分別計入利息收入或利息支出。
如果對公允價值的任何調整反映了投資價值的下降,本公司將考慮所有可用證據來評估下降的程度,如果是,則將投資按市價計入公司的綜合經營報表和全面虧損。
權益法投資
當公司有能力對被投資公司的經營和財務決策施加重大影響而不是控制時,公司使用權益法對投資進行會計處理。一般來説,當投資者擁有被投資公司超過20%的投票權權益時,就可以推定有能力施加重大影響。這一推定可根據表明不具備施加重大影響的能力的具體事實和情況予以推翻。本公司對非合併實體的普通股投資適用權益法。
在應用權益法時,本公司的投資最初在綜合資產負債表中按公允價值入賬。本公司出資進行知識產權研發以換取其投資,因此也在合併經營報表中確認了出售知識產權研發的收益和交易日的全面虧損。隨後,本公司根據本公司在報告期內所佔普通股的百分比,按本公司應佔被投資方淨虧損的比例調整了投資的賬面金額。本公司在合併經營報表中將其應佔被投資方的虧損計入被投資方的權益投資損失和全面虧損。
然後,本公司評估了本公司所佔被投資公司相關淨資產比例的賬面價值和公允價值之間是否存在基差。被投資方不被視為ASC 805-企業合併中定義的企業,因此公司立即將基礎差額計入與知識產權研發相關的程度。
本公司沒有義務為其權益法投資作出額外的出資,也沒有對被投資人的擔保義務或額外的財務支持要求。因此,它只記錄了高達其總投資額的損失。本公司累計應佔權益法被投資人的虧損超過了其總投資額,因此本公司終止了權益法虧損確認。如果被投資方隨後報告淨收益,並且本公司在權益法被投資方的收益中的份額等於本公司在暫停期間未確認的虧損份額,本公司將在未來期間恢復記錄其應佔虧損。
權益法投資於各報告期間均會檢討是否有非暫時性減值跡象,並倘有證據顯示出現非暫時性減值虧損,則撇減至公平值。本公司呈列來自股權投資的收入╱虧損及與股權法投資有關的任何減值, 權益法投資損失綜合經營報表及全面虧損。本公司權益法投資之賬面值為: 零截至2023年12月31日,無需進行減值評估。有關本公司權益法投資的其他資料,請參閲我們的綜合經審核財務報表附註6。
受限現金
就其經營租賃承擔而言,本公司維持若干擔保按金結餘,該等結餘在綜合資產負債表中分類為受限制現金,。截至2023年12月31日和2022年12月31日,該公司擁有823及$1,168分別為受限制現金(已於綜合資產負債表分類為非流動資產)。
信用風險集中
可能使本公司面臨集中信貸風險的金融工具主要包括現金、現金等價物和有價證券。該公司在認可的金融機構為超過聯邦保險限額的所有現金和現金等價物保持賬户。本公司不認為其受到超出與商業銀行關係相關的正常信貸風險的異常信貸風險。
財產和設備
物業及設備按成本減累計折舊入賬。 折舊開支乃按各項資產之估計可使用年期以直線法確認,詳情如下: | | | | | |
| 預計使用壽命 |
實驗室設備 | 5年份 |
傢俱及固定裝置 | 5年份 |
計算機及辦公設備 | 3年份 |
| 租賃權改進 | 使用年限或剩餘租賃期較短 |
當資產報廢或以其他方式出售時,出售資產的成本及相關累計折舊自賬目中剔除,而任何由此產生的收益或虧損計入出售期間的綜合經營報表及全面虧損。維修及保養開支於發生時計入費用。
長期資產減值準備
長期資產包括財產和設備。倘有事件或業務情況變動顯示資產賬面值可能無法全數收回,則會對將持有及使用之長期資產進行可收回性測試。本公司於決定何時進行減值檢討時所考慮的因素包括業務表現在預期、重大負面行業或經濟趨勢以及資產用途方面的重大變動或計劃變動。倘進行減值檢討以評估長期資產組的可收回性,本公司會將使用及最終出售長期資產組預期產生的未貼現現金流量預測與其賬面值進行比較。倘預期使用資產組產生之估計未貼現未來現金流量低於其賬面值,則減值虧損將於經營虧損確認。減值虧損將按減值資產組賬面值超逾其公平值之差額計算,並按貼現現金流量釐定。於呈列期間,本公司並無就長期資產錄得任何重大減值虧損。
公允價值計量
根據公認會計原則,某些資產和負債按公允價值列賬。公允價值被定義為在計量日市場參與者之間的有序交易中,為資產或負債在本金或最有利的市場上轉移負債而收取或支付的交換價格。用於計量公允價值的估值技術必須最大限度地利用可觀察到的投入,最大限度地減少使用不可觀察到的投入。按公允價值列賬的金融資產和負債應在公允價值層次的下列三個級別之一進行分類和披露,其中前兩個級別被視為可見,最後一個級別被視為不可見:
•第1級 - 於計量日期,報告實體可取得相同資產及負債於活躍市場之未經調整報價。
•二級 - 於資產或負債的大部分整個年期內可直接或間接觀察的輸入數據(不包括相同資產及負債於活躍市場的報價)。第二級輸入數據包括以下各項:
•活躍市場上類似資產和負債的報價
•在不活躍的市場中相同或類似資產或負債的報價
•資產或負債估值所使用的報價以外的可觀察輸入數據(例如,利率和收益率曲線報價在通常報價的區間)
•主要來自可觀察市場數據或通過相關性或其他方法得到證實的輸入數據
•第三級 - 資產或負債之不可觀察輸入數據(即,市場活動很少或沒有市場活動)。第3級輸入數據包括管理層本身對市場參與者將用於定價資產或負債的假設(包括風險假設)的假設。
本公司預付費用及其他流動資產、應付賬款及應計費用的賬面值與其公允價值相若,由於這些資產及負債的短期性質。
細分市場信息
本公司將其業務作為單一經營分部管理,以評估表現及作出經營決策。該公司的唯一重點是為患有由變構突變激活的癌基因驅動的遺傳定義癌症患者開發選擇性藥物。
研發成本
研發成本於產生時支銷。研發費用包括髮現、研究及開發候選藥物所產生的成本,包括人員費用、股票補償費用、分配的設施相關費用及折舊費用、第三方許可費以及從事臨牀前及臨牀開發活動的外部供應商的外部成本。將用於或提供用於未來研發活動之貨品或服務之不可退還預付款項列作預付開支。該等金額於交付貨物或提供相關服務時確認為開支,或直至預期不再交付貨物或提供服務為止。
研究合同費用和應計費用
本公司已與美國境內及境外的公司訂立多項研發相關合約。相關成本於產生時入賬為研發開支。公司記錄估計正在進行的研究費用的應計費用。在評估應計負債的充足性時,本公司分析研究的進展,包括事件的階段或完成、已收到的發票及訂約成本。於任何報告期末釐定應計結餘時會作出重大判斷及估計。實際結果可能與公司的估計有重大差異。本公司的歷史應計估計數與實際成本並無重大差異。
專利費用
由於不確定收回開支,所有與專利申請有關的專利相關費用均於產生時支銷。所產生之金額分類為一般及行政開支。
基於股票的薪酬
本公司根據授出日期的公平值計量所有授予僱員、非僱員及董事的以股份為基礎的獎勵,並於所需服務期(一般為各獎勵的歸屬期)內確認該等獎勵的補償開支。一般而言,本公司發行購股權及受限制股份單位僅附帶服務歸屬條件,並以直線法記錄該等獎勵的開支。對於以業績為基礎的歸屬條件發行的股票期權或受限制股票單位,當認為有可能達到業績條件時,與該等獎勵有關的股票補償費用按授予日期的公允價值確認。本公司將對所有附有表現歸屬條件的股份獎勵或附有服務及表現歸屬條件的獎勵應用分級歸屬法。沒收行為在發生時予以核算。
每項購股權授出之公平值乃於授出日期採用柏力克—舒爾斯期權定價模式估計。本公司缺乏足夠的公司特定歷史和隱含波動率資料。因此,本集團根據一組公開交易的同行公司的歷史波動率估計其預期股票波動率,並預期將繼續作出估計,直至本集團有足夠的歷史數據有關其本身交易股票價格波動率。公司採用簡化方法根據證券交易委員會工作人員會計公告第107號規定, 股份支付,以計算授予僱員、非僱員和董事的期權的預期期限。無風險利率是通過參考授予獎勵時生效的美國國債收益率曲線確定的,時間段大致等於獎勵的預期期限。預期股息收益率是基於本公司從未支付過現金股息,並且預計在可預見的未來不會支付任何現金股息。
公司在其綜合經營報表中對基於股票的補償費用和全面損失進行分類,其方式與對獲獎者的工資成本進行分類或對獲獎者的服務付款進行分類的方式相同。
所得税
本公司採用資產負債法核算所得税,該法要求就合併財務報表或本公司納税申報表中確認的事件的預期未來税務後果確認遞延所得税資產和負債。遞延税項資產及負債乃按財務報表與資產及負債之税基間之差異釐定,而該等差異預期可撥回之年度生效之已頒佈税率。遞延税項資產及負債之變動計入所得税撥備。本公司評估其遞延税項資產將從未來應課税收入中收回的可能性,並根據可得證據的權重,在其相信全部或部分遞延税項資產較有可能無法變現的情況下,則透過自所得税開支扣除估值撥備。遞延税項資產之收回潛力乃透過估計預期未來應課税溢利及考慮審慎及可行之税務規劃策略來評估。
本公司通過應用兩步程序確定將確認的税務利益金額,對綜合財務報表中確認的所得税的不確定性進行會計處理。首先,必須對税收狀況進行評估,以確定税務當局在外部審查後維持這種狀況的可能性。倘税務狀況被視為較有可能維持,則會評估税務狀況以釐定於綜合財務報表確認之利益金額。可予確認之利益金額為於最終結算時變現之可能性超過50%之最大金額。所得税撥備包括任何所得税儲備或被認為適當之未確認税務優惠之影響,以及相關淨利息及罰款。迄今為止,本公司並無採取任何不確定税務狀況或記錄任何儲備、利息或罰款。
綜合損失
綜合虧損由淨虧損和其他綜合收益(虧損)組成。其他全面收益(虧損)包括投資未實現收益及虧損。
每股淨收益(虧損)
由於本公司已發行符合參與證券定義之股份,故本公司於計算每股淨收入(虧損)時遵循兩類法。兩類法根據已宣佈或累積的股息以及未分配收益的參與權,確定各類普通股和參與證券的每股淨收益(虧損)。兩類方法要求普通股股東在該期間可獲得的收入根據其各自收取股息的權利在普通股和參與證券之間分配,猶如該期間的所有收入已經分配。
歸屬於普通股股東的每股基本淨收益(虧損)是將歸屬於普通股股東的淨收益(虧損)除以該期間發行在外的普通股加權平均數計算的。應佔普通股股東之攤薄淨收益(虧損)乃根據潛在攤薄證券之影響調整應佔普通股股東之淨收益(虧損)以重新分配未分配收益而計算。普通股股東應佔每股攤薄淨收益(虧損)的計算方法是將普通股股東應佔的攤薄淨收益(虧損)除以該期間已發行普通股(包括潛在攤薄普通股)的加權平均數。就此計算而言,尚未行使的購股權、未歸屬的受限制普通股及根據僱員購股計劃可發行的股份被視為具有潛在攤薄作用的普通股,且當其影響具有反攤薄作用時,不計入每股淨收入(虧損)的計算。截至2023年及2022年12月31日止年度,本公司錄得歸屬於普通股股東的淨虧損。
租契
本公司於合約開始時釐定安排是否為租賃。經營租賃資產指本公司在租賃期內使用相關資產的權利,而經營租賃負債指本公司支付因租賃產生的租賃付款的責任。經營租賃資產及負債於租賃開始日期根據租賃期內租賃付款現值確認。於釐定租期時,本公司包括在合理確定本公司將行使該選擇權時延長或終止租賃的選擇權。可能需要就已收到獎勵等項目對使用權資產作出若干調整。本公司於可輕易釐定時使用隱含利率,並於根據於開始日期可得之資料難以釐定隱含利率時使用本公司之增量借貸利率,以釐定租賃付款之現值。
用於確定本公司經營租賃資產的租賃付款可能包括租賃獎勵、陳述租金增加和與通貨膨脹率相關的上漲條款,當可確定時,並在本公司綜合資產負債表中確認為本公司經營租賃資產。
本公司的經營租賃反映在本公司合併資產負債表中的使用權經營資產、經營租賃負債、流動部分和非流動經營租賃負債中。最低租賃付款之租賃開支於租期內以直線法確認。短期租賃(定義為於開始日期租期為12個月或以下的租賃)不包括在此處理範圍內,並於租期內以直線法確認。
可變租賃付款是指本公司欠出租人的不固定金額,例如償還公共區域維護費用以及設施租賃和維護的水電費。可變租賃付款於產生時支銷。
本公司於開始日期作出的假設於發生若干事件(包括租賃修訂)時重新評估。當租賃修訂授予承租人原租賃中未包括的額外使用權,且租賃付款增加與額外使用權的獨立價格成比例時,租賃修訂構成一份單獨合同。倘租賃修訂導致獨立合約,則按與新租賃相同的方式入賬。
最近發佈的會計聲明
2023年12月,FASB發佈了ASU 2023-09, 所得税(專題740):所得税披露的改進(ASU 2023—09)。ASU 2023—09要求公共商業實體每年(1)在税率調節中披露特定類別,並(2)為調節符合數量閾值的項目提供額外信息(如果這些調節項目的影響等於或大於通過將税前收入(或損失)乘以適用的法定所得税税率計算的金額的5%)。該準則於二零二四年十二月十五日後開始的年度及中期期間生效。採納該準則須於未來作出若干變動,而若干變動須追溯作出。預期採納該等準則不會對本公司之綜合財務報表產生重大影響。
2023年11月,FASB發佈了ASU 2023-07,改進可報告段披露(主題280) (ASU於2023—07年度),要求加強披露(1)定期向主要營運決策者提供並計入各呈報分部損益計量的重大分部開支,(2)與分部損益對賬的其他分部項目的組成金額及描述,及(3)實體主要經營決策者的職務及職位,以及主要經營決策者如何使用分部損益的呈報方法評估分部表現及分配資源的解釋。該等修訂亦擴大中期分部披露規定。該新指引於2024年10月1日開始的年度期間和2025年10月1日開始的中期期間對本公司有效。允許提前收養。本會計準則單位之修訂追溯適用於財務報表呈列之所有過往期間。本公司正在評估採納新指引及採納新指引的期間對其財務報表的影響。
2023年10月,FASB發佈了ASU 2023-06,改進披露—響應SEC的披露更新和簡化計劃的編纂修正案 (ASU 2023—06)。該準則於二零二四年十二月十五日後開始的年度及中期期間生效。採納該準則須於未來作出若干變動,而若干變動須追溯作出。預期採納該等準則不會對本公司之綜合財務報表產生重大影響。
3. 公允價值計量
下表呈列有關本公司按經常性基準按公平值計量之金融資產及負債之資料,並顯示用以釐定該等公平值之公平值層級: | | | | | | | | | | | | | | | | | | | | | | | |
| 2023年12月31日的公允價值計量使用: |
| 1級 |
| 2級 | | 第三級 | | 總計 |
| 資產: |
|
|
| |
| |
|
| 現金等價物: | | | | | | | |
| 貨幣市場基金 | $ | 30,803 | | | $ | — | | | $ | — | | | $ | 30,803 | |
| 投資: | | | | | | | |
| 商業票據 | — | | | 44,871 | | | — | | | 44,871 | |
| 公司債券 | — | | | 30,308 | | | — | | | 30,308 | |
| | | | | | | |
| 總計 | $ | 30,803 | | | $ | 75,179 | | | $ | — | | | $ | 105,982 | |
| | | | | | | | | | | | | | | | | | | | | | | |
| 於2022年12月31日的公平值計量使用: |
| 1級 |
| 2級 | | 第三級 | | 總計 |
| 資產: |
|
|
| |
| |
|
| 現金等價物: | | | | | | | |
| 貨幣市場基金 | $ | 32,278 | | | $ | — | | | $ | — | | | $ | 32,278 | |
| 投資: | | | | | | | |
| 商業票據 | — | | | 3,747 | | | — | | | 3,747 | |
| 公司債券 | — | | | 45,643 | | | — | | | 45,643 | |
| 美國政府機構 | — | | | 39,102 | | | — | | | 39,102 | |
| 總計 | $ | 32,278 | | | $ | 88,492 | | | $ | — | | | $ | 120,770 | |
在制定公允價值估計時,公司最大限度地使用可觀察到的投入,最大限度地減少使用不可觀察到的投入。當可用時,該公司使用報價的市場價格來衡量公允價值。用於計量本公司第一級和第二級資產公允價值的估值技術是一種市場方法,使用涉及相同或可比資產的市場交易產生的價格和其他相關信息。如果沒有市場價格,公允價值計量是基於主要使用基於市場的參數的模型,這些參數包括收益率曲線、波動性、信用評級和匯率。在某些市場利率假設不可用的情況下,本公司須就市場參與者將用來估計金融工具公允價值的假設作出判斷。
在本報告所述期間,沒有調入或調出三級類別。
4. 投資
截至2023年12月31日,投資包括以下內容:
| | | | | | | | | | | | | | | | | | | | | | | |
| 攤銷成本 |
| 未實現收益 | | 未實現虧損 | | 公允價值 |
| 商業票據 | $ | 44,880 | | | $ | 4 | | | $ | (13) | | | $ | 44,871 | |
| 公司債券 | 30,326 | | | — | | | (18) | | | 30,308 | |
| | | | | | | |
| 總計 | $ | 75,206 | | | $ | 4 | | | $ | (31) | | | $ | 75,179 | |
截至2022年12月31日,投資包括以下內容:
| | | | | | | | | | | | | | | | | | | | | | | |
| 攤銷成本 |
| 未實現收益 | | 未實現虧損 | | 公允價值 |
| 商業票據 | $ | 3,748 | | | $ | — | | | $ | (1) | | | $ | 3,747 | |
| 公司債券 | 46,443 | | | — | | | (800) | | | 45,643 | |
| 美國政府機構 | 40,125 | | | — | | | (1,023) | | | 39,102 | |
| 總計 | $ | 90,316 | | | $ | — | | | $ | (1,824) | | | $ | 88,492 | |
截至2023年12月31日,本公司持有的所有有價證券的剩餘合同到期日為一年或更短時間。
截至2022年12月31日,公司持有的虧損有價證券的剩餘合同到期日為一年或更短時間,但美國政府機構、公司債券和公允價值為#美元的商業票據除外。13,687這些債券的期限為一到三年。
截至2023年12月31日、2023年12月31日和2022年12月31日,該公司審查了其投資組合,以評估其可供出售投資的未實現虧損。在評估這些證券的價值時,本公司評估了其是否打算出售該證券,以及是否更有可能要求本公司在收回其攤銷成本基礎之前出售該證券。該公司還確定,未實現損失中沒有任何部分與信貸損失有關。曾經有過不是本公司截至2023年、2023年及2022年12月31日止年度按公允價值計量及列賬的資產減值。
5. 財產和設備
財產和設備,淨額包括: | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
| 實驗室設備 | $ | — | | | $ | 770 | |
| 傢俱和固定裝置 | 17 | | | 17 | |
| 計算機和辦公設備 | — | | | 38 | |
| 租賃權改進 | 2,512 | | | 2,512 | |
| | | |
| 財產和設備 | 2,529 | | | 3,337 | |
| 減去:累計折舊 | (799) | | | (750) | |
| 財產和設備合計(淨額) | $ | 1,730 | | | $ | 2,587 | |
截至2023年及2022年12月31日止年度的折舊開支為$437及$508,分別為。
6. 權益法投資
2022年12月,本公司收到 9,000,000新成立的專注於抗體的精密腫瘤學公司Launchpad Therapeutics,Inc.的普通股股份。(Launchpad),以換取貢獻早期發現階段抗體項目,並授予Launchpad使用其MAP藥物發現引擎來發現,開發和商業化大分子療法的許可證。截至交易日期及截至2023年12月31日,本公司擁有 39.1在Launchpad的投票權和Launchpad董事會的一個席位,這使公司對Launchpad具有重大影響力。Launchpad的剩餘投票權由Versant Ventures和New Enterprise Associates(NEA)持有,他們均為本公司股東。
本公司按權益法對交易進行會計處理,並記錄本公司在Launchpad普通股投資的賬面值為美元,2,250合併資產負債表中的權益法投資。在交易前,貢獻的在製品研發(TIR & D)在本公司的賬面上為零,因此,本公司確認銷售TIR & D的收益為美元,2,232於截至2022年12月31日止年度的綜合經營報表及全面虧損中。本公司亦確認以權益法投資被投資公司之虧損,1,540在截至2022年12月31日止年度的綜合經營報表和全面虧損中,與公司按比例應佔Launchpad虧損有關。本公司出資之資產主要為知識產權及發展,並不被Launchpad視為一項業務,因此本公司釐定其剩餘基準差額為美元。710截至2022年12月31日,Launchpad投資的賬面值減少至 零。由於本公司沒有義務向LaunchPad提供融資支持,因此本公司不需要記錄超過投資賬面價值的進一步虧損。該公司還認定,其對LaunchPad的投資對其運營或財務狀況並不重要或重大。截至2023年12月31日,LaunchPad投資的賬面價值為零.
7. 應計費用
應計費用和其他流動負債包括: | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
| 簽約研究服務 | $ | 8,071 | | | $ | 4,713 | |
| 工資單及相關費用 | 5,175 | | | 4,648 | |
| 專業和諮詢費 | 963 | | | 1,182 | |
| 經營租賃負債的當期部分 | 3,113 | | | 2,841 | |
| 應計費用和其他流動負債總額 | $ | 17,322 | | | $ | 13,384 | |
8. 基於股票的薪酬
2020年股票期權和激勵計劃
2020年股票期權及激勵計劃(以下簡稱2020年計劃)於2019年12月5日獲本公司董事會批准,本公司股東於2020年1月14日通過,並於緊接本公司首次公開發行股票註冊書宣佈生效之日的前一天生效。2020年計劃規定向公司高級管理人員、員工、董事和顧問授予激勵性股票期權、非限制性股票期權、股票增值權、限制性股票單位、限制性股票獎勵、非限制性股票獎勵、現金獎勵和股息等值權利。根據2020年計劃初步預留供發行的股份數目為6,665,891,在2021年1月1日累計增加,此後每年1月1日增加4公司已發行普通股數量的百分比,或公司董事會或董事會薪酬委員會決定的較少數量的股票。截至2023年12月31日,4,585,580根據2020年計劃,股票仍可供發行。根據2020年計劃為發行保留的授權股數增加了2,065,822股票於2024年1月1日生效。
2020年員工購股計劃
2020年員工股票購買計劃(2020年ESPP)已於2019年12月5日獲公司董事會批准,並於2020年1月14日獲公司股東批准,並於緊接公司首次公開募股登記聲明宣佈生效之日的前一天生效。共 326,364根據該計劃,普通股最初保留用於發行,並於2021年1月1日累計增加,此後每年1月1日, 1公司已發行普通股數量的百分比,或公司董事會或董事會薪酬委員會決定的較少數量的股票。截至2023年12月31日,1,176,627根據2020年計劃,股票仍可供發行。根據2020年計劃為發行保留的授權股數增加了326,364股票於2024年1月1日生效。
期權估值
本公司用以釐定授出購股權於授出日期之公平值之假設如下,並按加權平均基準呈列: | | | | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
|
| 無風險利率 | 4.03 | % |
| 2.49 | % |
|
| 預期期限(以年為單位) | 5.9 |
| 6.0 |
|
| 預期波動率 | 80.1 | % |
| 76.2 | % |
|
| 預期股息收益率 | 0 | % |
| 0 | % |
|
選項
下表概述本公司股權獎勵計劃下的購股權活動: | | | | | | | | | | | | | | | | | | | | | | | |
| 選項 |
| 加權 平均值 鍛鍊 價格 |
| 加權 平均值 剩餘 生命 (單位:年) |
| 固有的 價值 (單位:千) |
| 未償債務,2022年12月31日 | 5,359,400 | |
| $ | 12.40 | |
| 7.8 |
| $ | 76 | |
| 授與 | 4,496,050 | |
| $ | 2.90 | |
| |
| |
| 已鍛鍊 | (5,370) | | | $ | 3.79 | | | | | |
| 取消或沒收 | (1,646,245) | | | $ | 8.31 | | | | | |
| 過期 | (68,124) | | | $ | 28.26 | | | | | |
| 2023年12月31日到期 | 8,135,711 | |
| $ | 7.85 | |
| 8.0 |
| $ | 1,146 | |
| 在2023年12月31日歸屬或預期歸屬的期權 | 8,135,711 | | | $ | 7.85 | | | 8.0 | | $ | 1,146 | |
| 在2023年12月31日可行使的期權 | 3,620,395 | | | $ | 12.78 | | | 6.6 | | $ | 303 | |
期權的總內在價值計算為行使價格低於公司普通股公允價值的期權的行權價格與公司普通股公允價值之間的差額。
於截至2023年、2023年及2022年12月31日止年度內授出的購股權之加權平均授出日每股公允價值為$2.05及$2.11,分別為。
截至2023年及2022年12月31日止年度歸屬購股權的總公允價值為美元。8,473及$15,392,分別為。
限制性股票
根據涵蓋普通股的受限制股票協議的條款,受限制普通股股份須遵守歸屬時間表。大多數限制性股票都是在 三年制在此期間,如果收件人和公司之間的關係終止,所有未歸屬的股票將立即沒收給公司。在繼續僱用(或受限制性股票協議中所述的公司接受其他僱用)的情況下,所有受限制性普通股股份將完全歸屬於 三年歸屬開始日期。
下表概述了限制性股票活動: | | | | | | | | | | | |
| 數量: 股票 | | 加權 平均值 授予日期 公允價值 |
| | | |
| | | |
| | | |
| | | |
| 截至2022年12月31日的未歸屬限制性普通股 | 101,397 | | | $ | 5.92 | |
| | | |
| 既得 | (63,397) | | | $ | 8.13 | |
| 取消或沒收 | (17,201) | | | $ | 2.14 | |
| 截至2023年12月31日的未歸屬限制性普通股 | 20,799 | | | $ | 2.41 | |
截至2023年及2022年12月31日止年度歸屬的受限制股票的總公允價值為美元。513及$556,分別為。
該公司擁有239,475截至2023年12月31日止年度年初尚未發行的表現受限制股票單位。截至2023年12月31日止年度,本公司授予 不是向員工發放業績限制股票單位, 27,475由於實現了某些臨牀開發和/或融資里程碑, 193,000業績受限股票單位到期, 不是被沒收的表現受限制股票單位。截至2023年12月31日,本公司已 19,000業績受限制的股票單位尚未上市。
當業績條件被認為有可能實現時,使用管理層的最佳估計(考慮到有關里程碑未來結果的內在風險和不確定性),開始確認與業績受限股票單位相關的基於股票的補償開支。
截至2023年和2022年12月31日,對於尚未發行的基於業績的限制性股票單位,認為有可能實現里程碑, 不是股票和3,063分別為股票。
截至2023年12月31日止年度,實現了兩個里程碑的表現受限制股票單位,公司確認與這些里程碑相關的股票補償費用為美元,52.沒有達到的里程碑被認為是不可能實現的,因此 不是截至2023年及2022年12月31日止年度,已確認與該等獎勵有關的開支。
基於股票的薪酬費用
本公司於綜合經營報表及全面虧損內按下列獎勵類型分類記錄以股票為基礎的補償開支:
| | | | | | | | | | | |
| 十二月三十一日, |
| 2023 | | 2022 |
| 股票期權 | $ | 8,975 | | | $ | 11,365 | |
| 限制性股票單位 | 270 | | | 559 | |
| 員工股票購買計劃及其他 | 359 | | | 273 | |
| $ | 9,604 | | | $ | 12,197 | |
截至二零二三年及二零二二年十二月三十一日止年度,本公司發行 64,470和90,270根據公司政策,非僱員董事可選擇以普通股代替現金的形式獲得報酬。
公司將與股票期權和限制性股票單位有關的股票補償費用計入合併經營報表的下列費用類別和全面虧損: | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
| 研發 | $ | 3,050 | |
| $ | 5,277 | |
| 一般和行政 | 6,554 | |
| 6,920 | |
| $ | 9,604 | |
| $ | 12,197 | |
截至2023年12月31日,與未歸屬股票期權有關的未確認補償成本總額為美元,9,859,預計將在加權平均期間內確認2.6好幾年了。
截至2023年12月31日,與未歸屬限制性股票單位有關的未確認補償成本總額為美元,22,預計將在加權平均期間內確認0.3好幾年了。
員工購股計劃
2020年ESPP使符合條件的員工能夠在每個年底購買公司普通股, 六個月以等於 85股份於發售期第一個營業日或最後一個營業日的公平市值的百分比,以較低者為準。合資格僱員一般包括所有僱員。發售期從每年1月和7月的第一個交易日開始,到每年6月和12月的最後一個交易日結束。股票購買的資金來自工資扣除, 10每個工資期僱員合格薪酬的百分比,最高為$25每個日曆年。
截至2023年12月31日和2022年12月31日的年度,有69,005和53,662分別根據2020年EPP發行的股份。
9. 所得税
除所得税開支前收入(虧損)包括以下各項: | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 | | 2022 |
| 國內 | $ | (82,639) | | | $ | (91,270) | |
| 外國 | 197 | | | 101 | |
所得税前總虧損 | $ | (82,442) | | | $ | (91,169) | |
截至二零二三年及二零二二年十二月三十一日止年度,本公司錄得 不是由於不確定從這些項目中實現收益,因此每年產生的淨經營虧損的所得税優惠。 使用美國聯邦法定税率計算的所得税與截至2023年12月31日及2022年12月31日的營運反映的所得税對賬如下: | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
美國聯邦法定所得税率 | 21.0 | % |
| 21.0 | % |
州税和地方税,扣除聯邦福利 | 5.3 | % |
| 4.4 | % |
永久性差異 | 0.0 | % |
| 0.0 | % |
| 股票薪酬 | (1.6) | % | | (1.7) | % |
研究和開發信貸 | 3.2 | % |
| 2.7 | % |
估值備抵變動 | (28.6) | % |
| (26.5) | % |
其他 | 0.7 | % | | 0.1 | % |
實際所得税率 | 0.0 | % |
| 0.0 % |
產生重大部分遞延税項資產之暫時性差異之税務影響如下: | | | | | | | | | | | |
| | 截至12月31日的納税年度, |
| 2023 | | 2022 |
| 遞延税項資產(負債): | | | |
| 淨營業虧損結轉 | $ | 69,194 | | | $ | 60,651 | |
| 研發税收抵免 | 10,766 | | | 7,934 | |
| 資本化R&D | 22,139 | | | 11,559 | |
| 經營租賃負債 | 6,784 | | | 7,194 | |
| 應計項目及其他 | 1,170 | | | 1,463 | |
| | | |
| 基於股票的薪酬 | 6,638 | | | 5,275 | |
| 遞延税項資產總額 | 116,691 | | | 94,076 | |
| 評税免税額 | (110,761) | | | (87,496) | |
| 小計 | 5,930 | | | 6,580 | |
| 使用權資產 | (5,843) | | | (6,387) | |
| 固定資產淨值 | (87) | | | (193) | |
| 遞延税項淨資產 | $ | — | | | $ | — | |
截至2023年12月31日,該公司的聯邦淨經營虧損結轉總額為美元,275,423,其中$2,5562036年開始到期,其餘的不到期,但受80%的限制。截至2023年12月31日,該公司的國家淨經營虧損結轉為美元,181,733將於2036年到期此外,該公司有聯邦研發税收抵免結轉美元,9,804到2043年的不同日期到期
於評估遞延所得税資產淨額之可變現性時,本公司會考慮所有相關正面及負面證據,以釐定部分或全部遞延所得税資產是否更有可能無法變現。遞延税項資產總額的實現取決於多個因素,包括在結轉經營虧損淨額到期前產生足夠的應課税收入。管理層認為,本公司遞延所得税資產很可能無法變現。因此,於2023年及2022年12月31日,遞延税項資產淨額已作全額估值撥備。估值備抵增加美元23,265截至2023年12月31日止年度,主要由於期內產生經營虧損淨額所致。
淨經營虧損結轉和研發税收抵免結轉的使用可能會受到1986年國內税收法典第382條和州法律的相應規定的年度限制,原因是以前發生的或將來可能發生的所有權變更。該等所有權變動可能會限制每年可用於抵銷未來應課税收入的結轉金額。一般來説,所有權變更,如第382條所定義,是指在三年內,某些股東或公眾團體在公司股票中的所有權增加了50%以上的交易。本公司尚未進行研究,以評估是否發生控制權變更或自開始以來是否發生多項控制權變更,原因是該研究的重大複雜性和相關成本。如果公司自成立以來的任何時候發生了控制權變更,如第382條所定義,則淨經營虧損結轉或研發税收抵免結轉的使用將受到第382條規定的年度限制,該限制是通過首先將公司股票在所有權變更時的價值乘以適用的長期免税税率來確定的,然後根據需要進行額外調整。任何限制可能導致部分淨經營虧損結轉或研發税收抵免結轉在使用前到期。此外,在研究完成及任何限制已知之前,概無金額呈列為不確定税務狀況。
本公司亦未對其研發信貸結轉進行研究,這可能導致研發信貸結轉調整。已就公司的研發信貸提供全額估值備抵,如需調整,此項調整將被估值備抵的調整所抵銷。因此,如果需要調整,對資產負債表或業務報表不會產生影響。此外,在研究完成及任何限制已知之前,概無金額呈列為不確定税務狀況。
本公司採用ASC 740中有關所得税不確定性會計處理的會計準則。本公司與税收相關的準備金是基於確定本公司在其税務申報或頭寸中獲得的税收優惠是否以及有多少在解決與税收優惠相關的任何潛在或有事項後更有可能實現。截至2023年及2022年12月31日,本公司已 不是未確認的税收優惠。
本公司將於所得税開支中確認與不確定税務狀況有關的利息及罰款。截至2023年及2022年12月31日,本公司已 不是與不確定的税務狀況相關的應計利息或罰金。
本公司根據其經營所在司法權區的税法規定提交納税申報表。在正常業務過程中,本公司受聯邦和州司法管轄區(如適用)的審查。目前沒有待處理的税務審查。截至2023年12月31日及2022年12月31日,本公司的納税年度仍根據法規開放,從2020年至今。
該公司的外國子公司自成立以來一直存在虧損, 不是截至2023年12月31日的未分配收益。
10. 每股淨虧損
每股淨虧損
下表總結了公司普通股股東應佔每股基本淨虧損和攤薄淨虧損的計算方法(以千計,不包括股票和每股金額): | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
| 普通股股東應佔淨虧損 | $ | (82,442) | |
| $ | (91,169) | |
| 加權平均已發行普通股、基本普通股和稀釋後普通股 | 43,954,649 | |
| 36,325,586 | |
| 每股基本和稀釋後淨虧損 | $ | (1.88) | |
| $ | (2.52) | |
本公司於2023年及2022年12月31日未歸屬的受限制普通股已被排除在普通股股東應佔每股基本淨虧損的計算之外。
本公司的潛在攤薄證券,包括期權、未歸屬的限制性股票、根據僱員購股計劃可發行的股份和購買普通股的認股權證,已被排除在每股攤薄淨虧損的計算之外,因為其影響將減少每股淨虧損。因此,用於計算每股基本及攤薄淨虧損的已發行普通股加權平均數相同。 在計算所指期間的稀釋後每股淨虧損時,該公司不包括根據每個期間末已發行金額列報的下列潛在普通股,因為計入這些股份會產生反攤薄的效果: | | | | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
|
| 購買普通股的期權 | 8,135,711 | |
| 5,359,400 | |
|
| 未歸屬限制性股票 | 20,799 | |
| 101,397 | |
|
| 根據員工購股計劃可發行的股票 | 28,780 | | | 48,805 | |
|
未歸屬的表現受限制股票單位 | 19,000 | | | 239,475 | | |
| 購買普通股股份的認股權證 | 10,757 | |
| 10,757 | |
|
| 8,215,047 | |
| 5,759,834 | |
|
11. 租契
本公司過往已就其設施訂立租賃安排。截至2023年12月31日,本公司已 二經營租賃,規定未來最低付款額。於應用ASC 842項下的過渡指引時,本公司將該等租賃分類為經營租賃,並於生效日期記錄使用權資產及租賃負債。本公司的租賃一般不包括終止或購買選擇權。
經營租約
於二零二零年七月,本公司訂立 七年制一項可選擇延長的協議, 五額外租用兩層樓,共計約 25,578其主要辦公室位於馬薩諸塞州劍橋市。一樓之租約於二零二零年八月一日開始,二樓之租約於二零二一年三月九日開始。本公司於各樓層開始租賃時於綜合資產負債表確認各自的租賃結餘。根據租賃條款,本公司鬚髮行一份美元,1,168信用證作為租賃的擔保,779於二零二三年八月根據租賃協議條款。此外,於2022年12月12日,本公司就其馬薩諸塞州劍橋市辦公空間的一層樓訂立分租協議。轉租於2028年8月31日終止,該日也是公司租賃終止之日。分租收入於分租協議年期內以直線法確認。本公司並無因分租而解除其於劍橋辦公室租約項下之主要責任。
於二零二零年十二月,本公司訂立一項 十一歲一項可選擇延長的協議, 五額外租賃年數約 18,120辦公室和實驗室的辦公室和實驗室空間。本公司有權選擇延長租約, 五更多的年。租賃於二零二一年八月二十六日開始,相關租賃結餘已於綜合資產負債表確認。
下表載列根據ASC 842確認的租賃成本概要及截至2023年及2022年12月31日止年度與本公司經營租賃有關的其他資料: | | | | | | | | | | | |
| 十二月三十一日, |
| 2023 |
| 2022 |
| 租賃費 | | | |
| 經營租賃成本 | $ | 4,217 | | | $ | 4,228 | |
| 短期租賃成本 | 59 | | | 88 | |
| 可變租賃成本 | 860 | | | 1,012 | |
| 轉租收入 | (1,138) | | | — | |
| 總租賃成本 | $ | 3,998 | | | $ | 5,328 | |
| | | | | | | | | | | |
| 十二月三十一日, |
| 其他經營租賃信息 | 2023 |
| 2022 |
| 為計量租賃負債所包括的金額支付的現金 | $ | 4,244 | | | $ | 2,935 | |
| 加權平均剩餘租期 | 6.9 | | 7.8 |
| 加權平均貼現率 | 5.3 | % | | 5.3 | % |
截至2023年12月31日止年度的可變租賃成本包括公共區域維護及其他經營費用。由於本公司的租賃不提供隱含利率,本公司利用其增量借款利率貼現租賃付款,該利率反映了本公司在類似經濟環境下以相同貨幣、類似期限、類似經濟環境下以擔保方式借入租賃付款金額的固定利率。
截至2023年12月31日,公司經營租賃的未來最低租賃支付如下: | | | | | |
| 2024 | $ | 4,359 | |
| 2025 | 4,477 | |
| 2026 | 4,599 | |
| 2027 | 4,724 | |
| 2028 | 3,926 | |
| 此後 | 8,324 | |
| 租賃付款總額 | 30,409 | |
| 減去:利息 | (5,110) | |
| 租賃總負債 | $ | 25,299 | |
截至2023年12月31日和2022年12月31日止年度的租金開支為5,218及$5,342,分別為。
12. 承付款和或有事項
該公司在正常業務過程中與合同研究機構(CRO)、合同製造機構(CMO)和其他第三方就臨牀前研究、臨牀試驗以及測試和製造服務簽訂合同。這些合同不包含最低購買承諾,如事先書面通知,可取消。取消時應支付的款項僅包括對所提供服務的付款或發生的費用,包括服務提供者截至取消之日的不可取消的義務。
許可協議
該公司是許可協議的一方,其中包括或有付款。如果達到某些開發、監管和商業里程碑,這些付款將成為可支付的。截至2023年12月31日,或有付款的滿意度和時間尚不確定,也無法合理評估。
賠償協議
在正常業務過程中,公司可以就某些事項向供應商、出租人、業務合作伙伴和其他各方提供不同範圍和條款的賠償,包括但不限於因違反此類協議或第三方提出的知識產權侵權索賠而產生的損失。此外,本公司已與其董事會成員及高級管理人員訂立彌償協議,要求本公司(其中包括)就他們作為董事或高級管理人員的身份或服務而可能產生的若干責任作出彌償。根據這些賠償協議,公司未來可能需要支付的最大潛在金額在許多情況下是無限制的。到目前為止,本公司尚未因該等賠償而產生任何重大成本。本公司並不知悉任何可能對其財務狀況、經營業績或現金流產生重大影響的賠償安排,亦未於截至2023年12月31日或2022年12月31日的綜合財務報表中應計任何與該等債務相關的負債。
法律程序
本公司目前並未參與任何重大法律程序,亦不知道有任何重大法律程序。於每個報告日期,本公司評估潛在虧損金額或潛在虧損範圍是否根據權威性指引處理或有事項的規定而可能及合理地評估。本公司在發生與該等法律訴訟有關的費用時支出.
13. 福利計劃
該公司有一個符合税務條件的401(K)和利潤分享固定繳款計劃(401(K)計劃)。根據401(K)計劃,公司向僱主提供相當於100參與者的合格捐款的百分比,最高可達6符合條件的補償的百分比,受1986年修訂的《國税法》及其頒佈的任何條例(《國税法》)所規定的限制。所有匹配的捐款在作出時都將完全歸屬。在截至2023年12月31日及2022年12月31日的年度內,公司貢獻了916及$1,146分別添加到401(K)計劃。
* * * * * *
項目9.會計和財務披露方面的變更和與會計師的分歧
沒有。
項目9A。控制和程序
信息披露控制和程序的評估
我們的管理層在首席執行官和首席財務官的參與下,評估了截至本報告所述期間結束時我們的披露控制和程序(如交易所法案第13a-15(E)條所定義)的有效性。基於這一評估,我們的首席執行官和首席財務官得出結論,截至2023年12月31日,我們的披露控制和程序在合理的保證水平下是有效的。公司的披露控制和程序旨在提供合理的保證,以確保我們根據交易法提交或提交的報告中要求披露的信息(I)在美國證券交易委員會規則和表格中指定的時間段內被記錄、處理、彙總和報告;以及(Ii)積累並傳達給管理層,包括我們的首席執行官和首席財務官,以便及時討論所需披露的信息。我們認為,無論控制系統的設計和運作如何良好,都不能絕對保證控制系統的目標得以實現,而任何控制措施的評估都不能絕對保證公司內部的所有控制問題和舞弊事件(如果有)都已被發現。
管理層關於財務報告內部控制的報告
我們的管理層負責建立和維護《交易法》第13 a-15(f)條和第15 d-15(f)條規定的對財務報告的充分內部控制。我們對財務報告的內部控制是一個過程,旨在為財務報告的可靠性提供合理的保證,並根據公認會計原則編制財務報表供外部使用。由於其固有的侷限性,財務報告的內部控制可能無法防止或發現錯報。此外,對未來期間的任何有效性評估的預測都存在風險,即控制措施可能因情況變化而變得不充分,或遵守政策或程序的程度可能惡化。
我們的管理層根據特雷德韋委員會贊助組織委員會在其2013年內部控制-綜合框架中提出的標準,評估了截至2023年12月31日我們對財務報告的內部控制的有效性。基於這一評估,我們的管理層得出結論,我們對財務報告的內部控制自2023年12月31日起有效。
這份10-K表格的年度報告不包括我們的註冊會計師事務所關於我們財務報告的內部控制的證明報告。根據美國證券交易委員會規則,我們不需要,也沒有聘請我們的獨立註冊會計師事務所對我們的財務報告進行內部控制審計,該規則允許我們在本Form 10-K年度報告中僅提供管理層報告。
財務報告內部控制的變化
在截至2023年12月31日的財政季度內,我們對財務報告的內部控制(如交易法規則13a-15(F)和15d-15(F)所定義)沒有發生重大影響或合理地很可能對我們的財務報告內部控制產生重大影響的變化。
項目9B。其他信息
修訂及重訂附例
於2024年3月7日,本公司董事會通過並通過了本公司第二次修訂及修訂附例(“附例”),並於即日起生效。本附例整體取代及取代在緊接附例生效前生效的本公司經修訂及重新修訂的附例。
附例及其他事項包括:
•澄清和更新股東會議的程序機制,並明確規定董事會和股東會議主席規範會議行為的權力;
•對《預告章程》中對股東提名董事和提交商業建議書的程序和披露要求進行一定程度的更新;
•反映最近對《特拉華州公司法》的修訂和更新;以及
•納入其他某些管理、技術、澄清和一致性更改。
前述描述並不聲稱是完整的,而是通過參考本章程的全文進行限定的,其副本作為附件3.2附於本説明書,並通過引用結合於此。
項目9C。關於妨礙檢查的外國司法管轄區的披露
不適用。
第三部分
項目10.董事、高級管理人員和公司治理
本項目所要求的信息通過參考我們2024年股東年會委託書中的信息併入,我們將在與本年度報告相關的財政年度結束後120天內向美國證券交易委員會提交該委託書。
項目11.高管薪酬
本項目要求提供的信息(不包括“薪酬與績效”副標題下的信息)通過參考我們為2024年股東周年大會提交的委託書中的信息而併入,我們將在與本年度報告相關的財政年度結束後120天內向美國證券交易委員會提交該委託書。
項目12.某些實益所有人的擔保所有權和管理層及有關股東事項
本項目所要求的信息通過參考我們2024年股東年會委託書中的信息併入,我們將在與本年度報告相關的財政年度結束後120天內向美國證券交易委員會提交該委託書。
第13項:某些關係和關聯交易,以及董事獨立性
本項目所要求的信息通過參考我們2024年股東年會委託書中的信息併入,我們將在與本年度報告相關的財政年度結束後120天內向美國證券交易委員會提交該委託書。
項目14.主要會計費用和服務
本項目所要求的信息通過參考我們2024年股東年會委託書中的信息併入,我們將在與本年度報告相關的財政年度結束後120天內向美國證券交易委員會提交該委託書。
第IV部
項目15.證物和財務報表附表
(a) 1.財務報表
有關本報告所載財務報表清單,請參閲本年報第133頁的合併財務報表索引,並以引用方式納入本項目。
2.財務報表明細表
財務報表附表已被省略,因為它們要麼不是必需的,要麼不適用,或者這些信息已列入合併財務報表或其附註。
3.陳列品
法規S—K第601項和本年度報告第15(b)項要求的證物列於下文證物索引中。展覽索引中列出的展覽以引用的方式併入本文。
(b)展覽索引 | | | | | | | | |
展品 不是的。 |
| 展品索引 |
| 3.1 |
| 註冊人的第四次修訂和重述註冊證書,目前有效(通過引用註冊人於2020年2月3日提交的表格8—K(文件編號001—39200)的當前報告的附件3.1納入) |
| 3.2* |
| 第二次修訂及重訂註冊人附例 |
| 4.1 |
| 2019年11月25日,註冊人與其某些股東之間的第二次修訂和重申投資者權利協議(通過引用2020年1月3日提交的註冊人表格S—1(文件編號333—235789)的附件4.1納入) |
| 4.2 | | 2016年9月21日,由註冊人向羅氏金融有限公司發出的股票購買權證(通過引用2020年1月3日提交的註冊人表格S—1(文件號333—235789)的附件4.3合併) |
| 4.3* | | 證券説明 |
| 10.1# |
| 2017年員工、董事和顧問股權激勵計劃,經修訂和重述,及其項下的獎勵協議形式(通過引用2020年1月3日提交的註冊人關於S—1的註冊聲明的附件10.1(文件編號:333—235789) |
| 10.2# | | 2020年股票期權和激勵計劃及其項下的獎勵協議形式(通過引用2020年1月21日提交的註冊人關於S—1/A(文件編號:333—235789)的註冊聲明的附件10.2納入) |
| 10.3# | | 高級管理人員現金獎勵獎金計劃(通過參考2020年1月3日提交的註冊人表格S—1(文件編號333—235789)的附件10.3合併) |
| 10.4#* | | 2020年員工股票購買計劃,經修訂 |
| 10.5# | | 官方賠償協議的表格(通過引用2020年1月3日提交的註冊人在表格S—1上的註冊聲明的附件10.5(文件編號333—235789)合併) |
| 10.6# | | 董事賠償協議的表格(通過引用2020年1月3日提交的註冊人在表格S—1上的註冊聲明的附件10.6(文件編號333—235789)合併) |
| 10.7# | | 註冊人和Brent Hatzis—Schoch之間的僱傭協議(通過引用2020年1月3日提交的註冊人表格S—1註冊聲明的附件10.8(文件號333—235789)) |
| 10.8# | | 註冊人與Elizabeth Buck之間的僱傭協議(通過引用2021年8月12日提交的註冊人關於表格10—Q的季度報告(文件編號001—39200)的附件10.1合併) |
| 10.9# | | 註冊人和Sergey Yurasov之間的僱傭協議(通過引用註冊人於2022年8月9日提交的季度報告10—Q(文件號001—39200)的附件10.1合併) |
| 10.10# | | 註冊人與Elizabeth Montgomery之間的僱傭協議(通過引用註冊人於2023年3月9日提交的10—K表格年度報告(文件編號001—39200)的附件10.11合併) |
| 10.11#* | | 註冊人與Melanie Morrison之間的僱傭協議 |
| 10.12# | | 註冊人與方妮之間的僱傭協議,經註冊人與方妮之間的僱傭協議第1號修正案修訂(通過引用註冊人於2023年3月9日提交的表格10—K(文件編號001—39200)年度報告附件10. 12合併) |
| 10.13# | | 註冊人與Mark A之間的僱傭協議。Velleca(通過引用2023年9月18日提交的註冊人當前表格8—K報告(文件編號001—39200)的附件10.2合併) |
| 10.14# | | 註冊人與David Epstein之間的離職協議,日期為2023年9月17日(通過引用2023年9月18日提交的註冊人當前表格8—K報告(文件編號001—39200)的附件10.2合併) |
| 10.15#+* | | 修訂和重申的非僱員董事薪酬計劃,2024年2月14日生效 |
| 10.16+ | | 租賃協議,日期為2020年7月24日,由RREEF America REIT II Corp. PPP和註冊人(通過引用註冊人於2020年8月11日提交的表格10—Q季度報告的附件10.1(文件編號:001—39200)合併) |
| 21.1* | | 註冊人的子公司 |
| 23.1* | | 獨立註冊會計師事務所普華永道律師事務所同意 |
| 31.1* | | 根據2002年《薩班斯—奧克斯利法案》第302條通過的《1934年證券交易法》第13a—14(a)條或第15d—14(a)條認證首席執行官。 |
| | | | | | | | |
| 31.2* | | 根據2002年《薩班斯—奧克斯利法案》第302條通過的《1934年證券交易法》第13a—14(a)條或第15d—14(a)條對首席財務官的認證。 |
| 32.1** | | 根據2002年《薩班斯-奧克斯利法案》第906條通過的《美國法典》第18編第1350條的認證。 |
| 97.1* | | 黑鑽石治療公司補償回收政策 |
| 101英寸* |
| 內聯XBRL實例文檔-實例文檔不顯示在交互數據文件中,因為其XBRL標記嵌入在內聯XBRL文檔中。 |
| 101SCH* |
| 內聯XBRL分類擴展架構文檔。 |
| 101CAL * |
| 內聯XBRL分類擴展計算鏈接庫文檔。 |
| 101LAB * |
| 內聯XBRL分類擴展標籤Linkbase文檔。 |
| 101年前 * |
| 內聯XBRL分類擴展演示文稿Linkbase文檔。 |
| 101DEF * |
| 內聯XBRL分類擴展定義Linkbase文檔。 |
| 104* | | 封面交互數據文件(格式為內聯XBRL,包含附件101中包含的適用分類擴展信息)。 |
| | | | | | | | |
|
|
|
| # |
| 指管理合同或任何補償計劃、合同或安排。 |
| + | | 根據第S—K條第601(b)(2)項,非重要附表和證物已被省略。本公司特此承諾,應美國證券交易委員會的要求,提供任何遺漏的附表和證物的書面副本。 |
| * |
| 現提交本局。 |
| ** |
| 本證明將不被視為“提交”的目的,或以其他方式受該條款的責任。此類認證將不被視為通過引用納入根據證券法或交易法提交的任何文件中,除非在此類文件中以引用的方式具體納入。 |
第16項:表格10-K摘要
該公司已選擇不包括概要信息。
簽名
根據修訂後的1934年《證券交易法》第13或15(D)節的要求,註冊人已正式安排由正式授權的以下籤署人代表其簽署本報告。 | | | | | | | | |
| 黑鑽石治療公司 |
|
|
|
| 日期:2024年3月12日 | 發信人: | /s/Mark A.韋萊卡 |
|
| mark a.韋萊卡 總裁與首席執行官 |
授權委託書
通過這些在場的所有人,每個人的個人簽名出現在下面,特此授權和指定標記A。Velleca和Brent Hatzis—Schoch,以及他們中的每一個,作為他或她的真實和合法的實際代理人和代理人,以他或她的名義、地點和代替行事,並以每個人的名義和代表每個人單獨和以下述每一種身份執行,並以表格10—K提交對本年度報告的任何及所有修訂,並將其連同所有證物以及與之相關的其他文件提交給證券交易委員會,授予上述實際律師和代理人,以及他們中的每個人,全權作出和執行每項作為和事情,批准和確認所有上述事實律師和代理人或其中任何人或其替代人可憑藉該等法律而合法作出或安排作出的一切。
根據1934年證券交易法(經修訂)的要求,本10—K表格年度報告由以下人士代表註冊人並於2024年3月12日以所示身份簽署。
| | | | | |
| 簽名 | 標題 |
| /s/Mark A.韋萊卡 | 總裁、首席執行官、主席兼董事 (首席行政主任) |
mark a.韋萊卡 | |
| /s/方妮 | 首席業務官兼首席財務官 (首席財務官) |
芳妮 | |
| /s/Erika Jones | 高級副總裁,財務和公司總監 (首席會計主任) |
埃裏卡·瓊斯 | |
| /S/Ali·貝赫巴哈尼 | 董事 |
| Ali·貝赫巴哈尼 | |
| /S/薩瑪斯·庫爾卡爾尼 | 董事 |
| 薩瑪斯·庫爾卡爾尼 | |
| /s/Alexander Mayweg | 董事 |
| 亞歷山大·梅韋格 | |
| /s/Garry E.門澤爾 | 董事 |
| 加里·E.門澤爾 | |
| /s/卡皮爾·丁格拉 | 董事 |
| 卡皮爾·丁格拉 | |
| Wendy Dixon | 董事 |
| 温迪·迪克森 | |
| /s/David M.愛潑斯坦 | 董事 |
| David M.愛潑斯坦 | |