
2023 年全年財務業績和業務更新 2024 年 3 月 14 日 EX-99.2

免責聲明 2開發下一代程序化T細胞療法這些幻燈片包含1995年《私人證券訴訟改革法》“安全港” 條款所指的前瞻性陳述。前瞻性陳述是不是歷史事實的陳述,在某些情況下,可以用 “可能”、“將”、“可能”、“期望”、“計劃”、“預期” 和 “相信” 等術語來識別。這些陳述包括但不限於有關Autolus開發其候選產品的聲明,包括obe-cel計劃;obe-cel在其他疾病環境中的概況和潛在應用;公司候選產品的未來臨牀開發、療效、安全性和治療潛力,包括進展、對數據報告的預期、行為和時機以及未來的潛在臨牀和臨牀前活動和里程碑;對數據啟動、設計和報告的預期來自臨牀試驗和臨牀前研究;將產品線擴展到obe-cel以外的領域;對任何候選產品的監管審批程序的預期;Autolus與BioNTech合作的好處,包括戰略合作條款規定的里程碑付款和特許權使用費的可能性和時機;公司當前和未來的製造能力;以及公司預期的現金跑道。任何前瞻性陳述均基於管理層當前的觀點和假設,涉及風險和不確定性,可能導致實際業績、業績或事件與此類陳述中表達或暗示的結果存在重大差異。這些風險和不確定性包括但不限於Autolus的臨牀前或臨牀項目無法及時或根本無法推進或導致批准產品的風險;早期臨牀試驗的結果並不總是可以預測未來的結果;臨牀試驗的成本、時間和結果;許多候選產品無法及時或具有成本效益的基礎上或根本沒有成為批准的藥物;招收患者參與臨牀試驗的能力;以及可能的安全性和有效性問題。有關其他風險和不確定性以及其他重要因素的討論,其中任何一個都可能導致Autolus的實際業績與前瞻性陳述中包含的有所不同,請參閲Autolus於2023年3月7日向美國證券交易委員會(SEC)提交的20-F表年度報告以及Autolus於2023年11月9日向美國證券交易委員會提交的10-Q表季度報告中標題為 “風險因素” 的章節作為對Autolus中潛在風險、不確定性和其他重要因素的討論隨後向美國證券交易委員會提交的文件。本演示文稿中的所有信息均截至演示之日,除非法律要求,否則Autolus沒有義務公開更新任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。因此,您不應依賴這些前瞻性陳述來代表本演示之日後任何日期的公司觀點。
議程 • 歡迎和簡介:投資者關係董事奧利維亞·曼瑟 • 運營亮點:首席執行官克里斯蒂安·伊廷博士 • 財務業績:首席財務官羅布·多爾斯基 • 即將到來的里程碑和結論:首席執行官克里斯蒂安·伊廷博士 • 問答:克里斯蒂安·伊廷博士和羅伯·多爾斯基 3開發下一代程序化T細胞療法

戰略最新進展開發下一代程序化T細胞療法 4 強勁的現金狀況:2023年底現金為2.4億美元,2024年2月活動總收益為6億美元 • 2024年2月完成了承保的註冊直接股權融資,總收益為3.5億美元 • 同時與BioNTech建立了戰略合作,旨在推進兩家公司的自體CAR T項目——2億美元股權,5000萬美元預付現金——再增加高達5.82億美元期權行使和里程碑付款 — BioNTech 支持 obe 的推出和擴展-cel 成人 ALL 按淨銷售額收取特許權使用費 — BioNTech 可以選擇使用 Autolus 的 BNT211 製造能力 — BioNTech 為 Autolus 的 AUTO1/22 和 AUTO6NG 計劃提供聯合商業化選項,還有 Autolus 靶向粘合劑和細胞編程技術的期權融資 BioNTech 合作

Obe-cel 在 r/r B-ALL 開發下一代程序化 T 細胞療法 5 FELIX 數據、監管審查和上市準備工作中重點介紹 • Obe-cel 在復發/難治性 (r/r) 成人 ALL 中——彙總分析於 2023 年 12 月在 ASH 上發表——FELIX 1b/2 期研究——所有隊列的無事件存活時間延長,總體免疫毒性低,尤其是淋巴消耗導致白血病負擔低的患者 — ALLCAR19 研究和 FELIX 階段 1b-在中位隨訪後,將obe-cel作為獨立療法對一部分患者進行持久緩解>3 年 • 穩健的製造工藝和最先進的商業製造——於 2024 年 2 月完成了首次設施檢查——斯蒂夫尼奇的 Nucleus 製造工廠已獲得製造商進口授權 (MIA) 和隨附的 GMP 證書 — 在 ASH 上展示了 obe-cel 製造業績的海報 • 美國食品藥品監督管理局 (FDA) 接受生物製劑許可申請 (BLA) — PDUFA 目標行動日期為 2024 年 11 月 16 日 • 營銷最近向 EMA 提交的授權申請 (MAA)• 商業能力和基礎設施準備工作步入正軌 — 商業系統建設步入正軌 — 專注於臨牀中心入職和醫療事務臨牀製造監管商業準備情況

其他研發項目亮點開發下一代程序化 T 細胞療法 6 擴大機會 • Obe-cel 在 B 細胞介導的自身免疫性疾病中 — 1 期 CARLYSLE 研究 — 難治性系統性紅斑狼瘡患者 1 期劑量確認研究 — 首個試驗地點於 2024 年第一季度開放入組 — 基於 FELIX 針對多發性骨髓瘤成人 ALL 8 的關鍵性試驗 — 1 期 MCARTY 研究 OBE-CEL 的數據,潛在的最佳風險/收益概況多發性骨髓瘤中的自身免疫性疾病 AUTO8 AUTO6NG • AUTO8 — 1 期 MCARTY 研究 — 多項初步數據2023 年 12 月在 ASH 上發表的骨髓瘤表明 AUTO8 耐受性良好,所有患者均觀察到反應 • 神經母細胞瘤中的 AUTO6NG — 1 期 MAGNETO 研究 — 一項針對復發/難發性神經母細胞瘤患兒的 1 期臨牀研究已於 2023 年第四季度開放報名

組織變革 • 克里斯·威廉姆斯博士晉升為首席商務官,亞歷克斯·德里格斯晉升為高級副總裁、法律事務兼總法律顧問 • 埃德加·布倫德爾博士將辭去首席開發官職務,尋求其他機會。埃德加將繼續通過BLA和MAA審查程序為公司提供建議 • 高級副總裁兼obe-cel項目負責人米蘭達·內維爾將管理開發團隊 • 任命伊麗莎白(Lis)萊德曼博士和羅伯特·阿澤爾比博士開發下一代程序化T細胞療法,以加強董事會 7
Obe-cel 首席臨牀項目獨立的、可能是同類最佳的 CD19 CAR T 細胞療法候選藥物

我們認為 obe-cel 具有獨特的作用機制 • 避免 CAR T 細胞過度激活 • 增加 CAR T 峯值擴張 • 避免 CAR T 細胞耗盡 9 增強細胞毒性和增殖關閉率:Kd [S-1]]1-S 1 - [M aK:e Ra t-在其他 CD19 粘合劑上 obe-cel 粘合劑關閉率:Kd [S-1]O n-Ra te: K a [M -1 S-1 ]與經批准的產品中使用的粘合劑相比,相互作用的半衰期更短 • obe-cel = 9.8 秒 • Kymriah® = 21 分鐘% T um 或 C el l L K 在 g Pro ol life ra tio n Ghorashian 等人身上。Nature Medicine 2019 快速脱離速率的CD19粘合劑專為提高活性和降低毒性而設計開發下一代程序化T細胞療法差異化CD19粘合劑可能提高效力,降低毒性降低毒性降低持久性改善移植改善持久性

Obe-cel 合併分析 ASH 2023 FELIX 1b/2 期試驗

FELIX 1b/2 期合併分析:患者傾向於開發下一代程序化 T 細胞療法 11 127/153 (83%) 入組患者接受了 obe-cel* 已停產 n (%) 26 (17) 死亡 15 (10) 製造相關的 7 (5) 不良事件 2 (1) 醫生決定 1 (0.7) 進展性疾病 1 (0.7) *七名患者僅接受 1 劑量;**所有資格標準均符合,白血球菌被接受制造業;obe-cel、obecabtagene autoleucel;Roddie 等人,ASH 2023,數據截止日期:2023 年 9 月 13 日注入 N = 127 (83%) 已註冊** N = 153 個隊列A n = 107 (84%) 篩查時有 ≥ 5% BM 爆發 ≥ 5% 隊列 B n = 13 (10%) MRD 陽性隊列 C n = 7 (6%) 篩查時分離的 EMD 形態學疾病*** (n = 98) • 74% 的患者有 CR/CRI (n = 73) • 95% 的受訪者為 MRD 陰性‡ 無形態學疾病(n = 29)• 100% 的患者有 CR/CRI(n = 73)• 100% 的患者有 CR/CRI(n = 73)• 95% 的受訪者是 MRD 陰性‡ 無形態學疾病(n = 29)• 100% 的可評估患者是 MRD 陰性§ ***形態學疾病定義為無論骨髓爆炸狀態如何 ≥ 5% 的 BM 細胞或存在 EMD;經 NGS 或流式細胞儀評估,64/73 名患者可獲得 MRD 狀態;§27/29 名患者可獲得 MRD 狀態,由NGS 或流式細胞術;BM,骨髓;CR,完全緩解;血液學恢復不完全的 CRi、CR;EMD,髓外疾病;MRD,可測量的殘留疾病;NGS,下一代測序;obe-cel,obecabtagene autoleucel
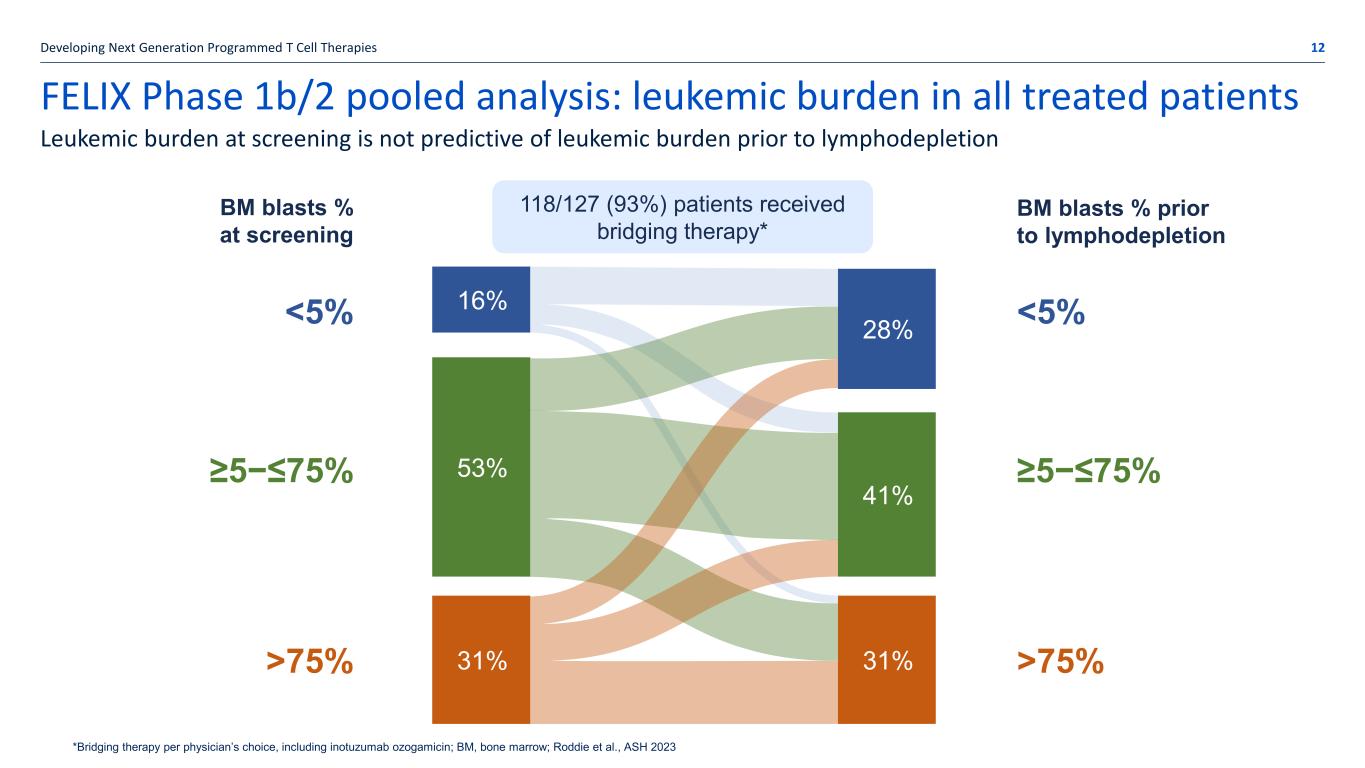
FELIX 1b/2 期合併分析:所有接受治療的患者的白血病負擔開發下一代程序化 T 細胞療法 12 篩查時的白血病負擔無法預測淋巴消耗前的白血病負擔 *每個醫生選擇的橋接療法,包括伊諾妥珠單抗奧佐加黴素;BM,骨髓;Roddie 等人,ASH 2023 16% 28% 53% 31% 31% 篩查時的 31% BM blasts% 淋巴消耗前 BM 母細胞百分比 118/127 (93%) 患者接受橋接療法* 75% 53% 31% 31% 31% 75% 28% 41% 16%

FELIX pH1b/2 彙總:按淋巴消耗前的白血病負擔計算的EFS*開發下一代程序化T細胞療法 13 降低白血病負擔與更好的療效相關 BM 母細胞百分比淋巴消耗前 75%(n = 40)中位數(95% 置信區間),NE 15.0(6.6,NE)4.5(1.5,9.0)6個月EFS(95% CI),% 83(65,92)72(57、82) 40 (23、56) 12 個月 EFS(95% 置信區間),% 65(44、80)55(38、69)27(12、44)事件,n:75% 27 中位數(95% 置信區間):75% 4.5(1.5、9.0)風險患者 75%(n = 40)75%(n = 40)0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 17 18 20 2122 23 24 25 26 27 28 29 30 31 32 33 34 35 36 36 34 31 28 25 24 22 20 19 18 14 13 11 11 11 11 11 11 11 8 8 7 6 2 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 41 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 18 17 13 10 10 10 10 9 5 5 5 4 4 2 2 2 2 2 2 2 1 1 1 1 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 10 10 10 9 9 90 Pr ob ab ili ty (%) *審查新的非協議抗癌療法,包括 SCT 和 IRRC 的疾病評估(數據截止日期:2023 年 9 月 13 日);BM,骨髓;CI,置信區間;EFS,無事件存活;IRRC,獨立應對審查委員會;NE,不可評估;SCT,幹細胞移植;Roddie 等人,ASH 2023

FELIX 第 1b/2 階段合併分析:CRS 和 ICANS 正在開發下一代程序化 T 細胞療法 14 觀察到淋巴消耗時 BM 母細胞百分比為 2% 7% 20 0 40 60 80 100 在 ci de nc e,% CRS ICANS 0% 4% 3% 20 0 40 60 80 100 In ci de nc e,% 7% 0% 6% 15% 20 0 40 60 80 100 In ci de nc e,百分比75%所有患者中的CRS和ICANS按BM爆炸百分比計算ICANS按BM爆炸百分比計算淺色 = ≤2級深色 = 等級 ≥3 69% 23% 47% 69% 88% 8% 18% 43% •
患者未觀察到等級 ≥3 CRS和/或ICANS

Obe-cel 合併分析 ASH 2023 ALLCAR19 第 1b 階段 /FELIX Ph 1b

R/R B-ALL的長期隨訪顯示,開發下一代程序化T細胞療法的EF和操作系統有利 16中位隨訪36.5個月;合併分析第1b期Allcar19/Phase 1b FELIX *審查了allo-HSCT和其他抗癌治療。研究者評估的疾病評估是通過對B-ALL的CT和BM活檢在局部進行的。allo-HSCT,異基因造血幹細胞移植;B-ALL,B 細胞急性淋巴細胞白血病;BM,骨髓;CI,置信區間;CT,計算機斷層掃描;EFS,無事件存活;N/A,不可用;obe-cel,obecabtagene autoleucel;OS,總存活率;復發/難治性。羅迪等人,ASH 2023,海報 2114。操作系統中位數:16.4 個月(95% 置信區間:7.1—N/A)36 個月操作系統費率:41%(95% 置信區間:24—56)含審查*:• EFS 中位數:9.0 個月(95% 置信區間:5.1—N/A)• 36 個月 EFS 率:45%(95% 置信區間:27—62)未經審查:• EFS 中位數:9.6 個月(95% 置信區間:5.1—N/A)• 36 個月 EFS 率:36%(95% 置信區間:27—62)(95% 置信區間:21—51)
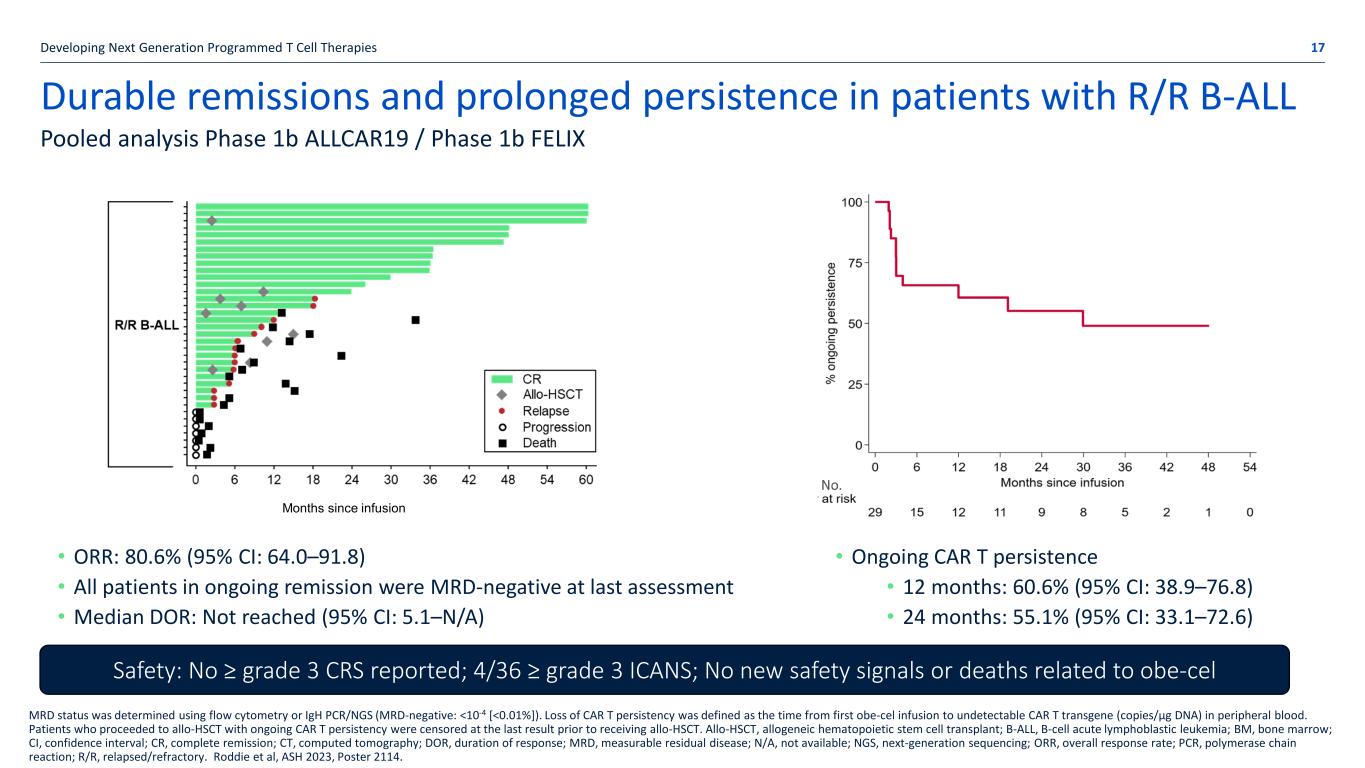
開發下一代程序化 T 細胞療法的 R/R B-ALL 患者的持久緩解和長期持續耐藥性 17 彙總分析 1b 期 ALLCAR19/1b 期 FELIX MRD 狀態是使用流式細胞術或 iGH PCR/NGS(MRD 陰性:

商業發佈準備情況
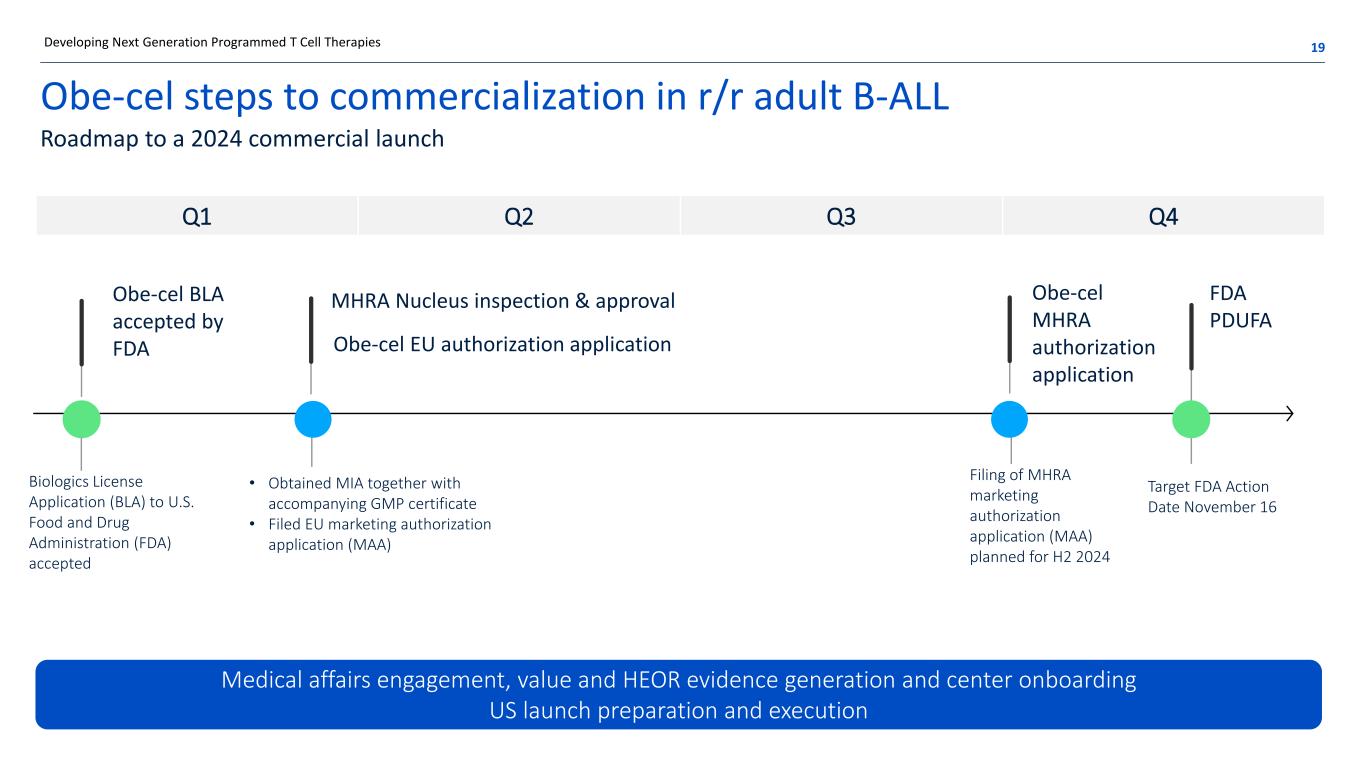
Obe-cel 在 r/r 成人 B-ALL 19 中實現商業化的步驟 2024 年商業上市路線圖 Obe-CEL BLA 獲得 FDA 接受 Obe-cel 歐盟授權申請 MHRA Nucleus 檢驗和批准醫療事務參與、價值和 HEOR 證據生成和中心入職美國上市準備和執行開發下一代程序化 T 細胞療法 FDA PDUFA 行動日期 11 月 16 日美國食品藥品監督管理局向美國食品藥品監督管理局申請生物製劑許可證 (BLA) (BLA) FDA) 接受了 Obe-CEL MHRA 授權申請 MHRA 上市申請計劃於 2024 年下半年提交授權申請 (MAA) • 獲得 MIA 以及隨附的 GMP 證書 • 第一季度第二季度第三季度第四季度提交了歐盟上市許可申請 (MAA)

擴大具有潛在廣泛適用性的obe-cel機會深度價值計劃
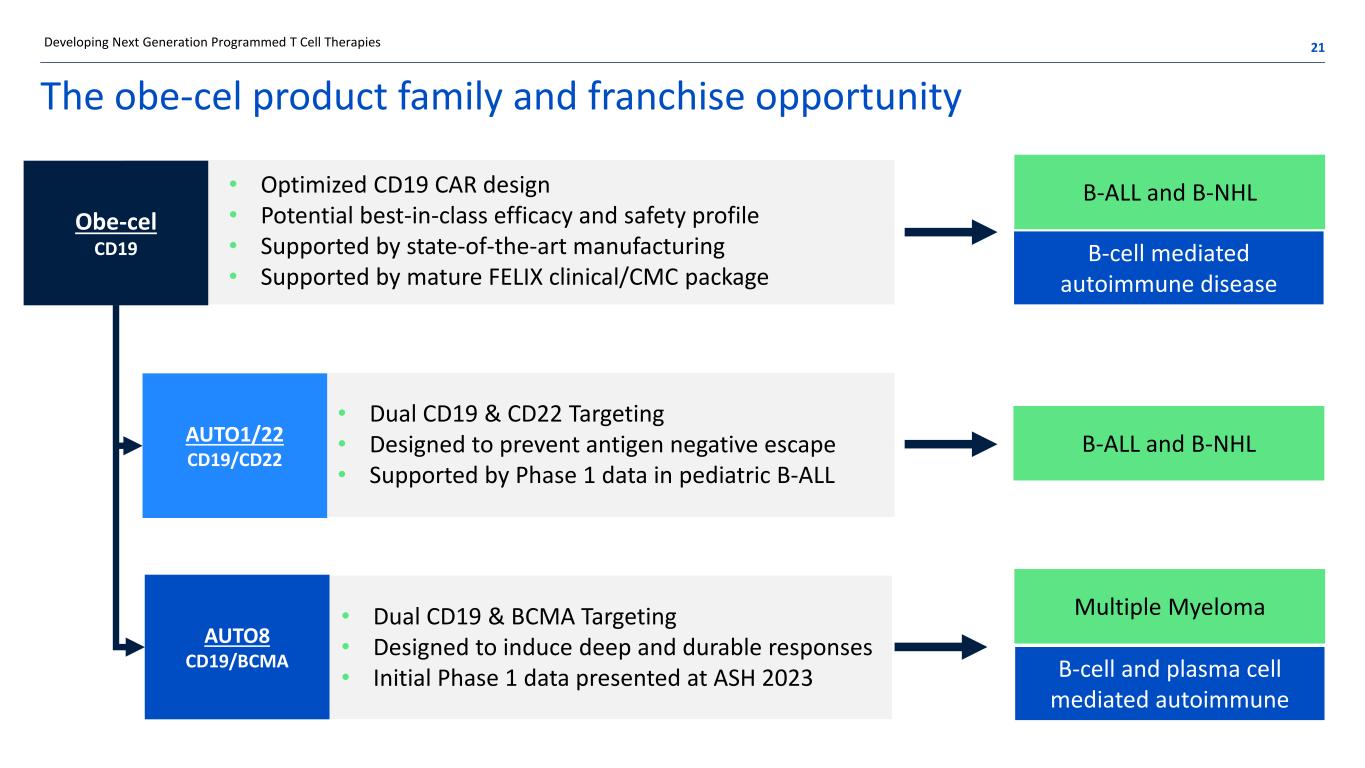
obe-cel 產品系列和特許經營機會 • 優化的 CD19 CAR 設計 • 潛在的一流療效和安全性 • 由最先進的製造技術支持 • 由成熟的 FELIX 臨牀/CMC 套餐支持 • 雙向 CD19 和 CD22 靶向 • 專為防止抗原陰性逃逸而設計 • 由兒科 B-ALL 的 1 期數據支持 • 雙重 CD19 和 BCMA 靶向 • 旨在誘發深度持久反應 • 在 ASH 2023 B-ALL 上公佈的初期 1 期數據以及 B-NHL B 細胞介導的自身免疫性疾病 B-ALL 和 B-NHL 多發性骨髓瘤 B 細胞和漿細胞介導的自身免疫開發下一代程序化 T 細胞療法 21 OBE-CEL CD19 AUTO1/22 CD19/CD22 AUTO8 CD19/BCMA

1期系統性紅斑狼瘡(SLE)研究——開發下一代程序化T細胞療法的CARLYSLE試驗 22 一項單臂、開放標籤的I期研究,旨在確定Obecabtagene Autoleucel對重度、難治性系統性紅斑狼瘡(SLE)患者的安全性、耐受性和初步療效 • 研究詳情 — 患者數量:6-(可選擇再增加6名患者)— 主要終點:確定 obe-cel 對嚴重難治性系統性紅斑狼瘡患者的耐受性和安全性 — 次要終點:評估其初步療效obe-cel 使用系統性紅斑狼瘡疾病活性測量 — 劑量:50 x 106 (± 20%) CD19 CAR陽性 T 細胞 — 隨訪:多發性骨髓瘤長達 12 個月 8 — 1 期 MCARTY 研究

其他研發項目和技術廣泛的潛在下一代模塊化T細胞療法組合
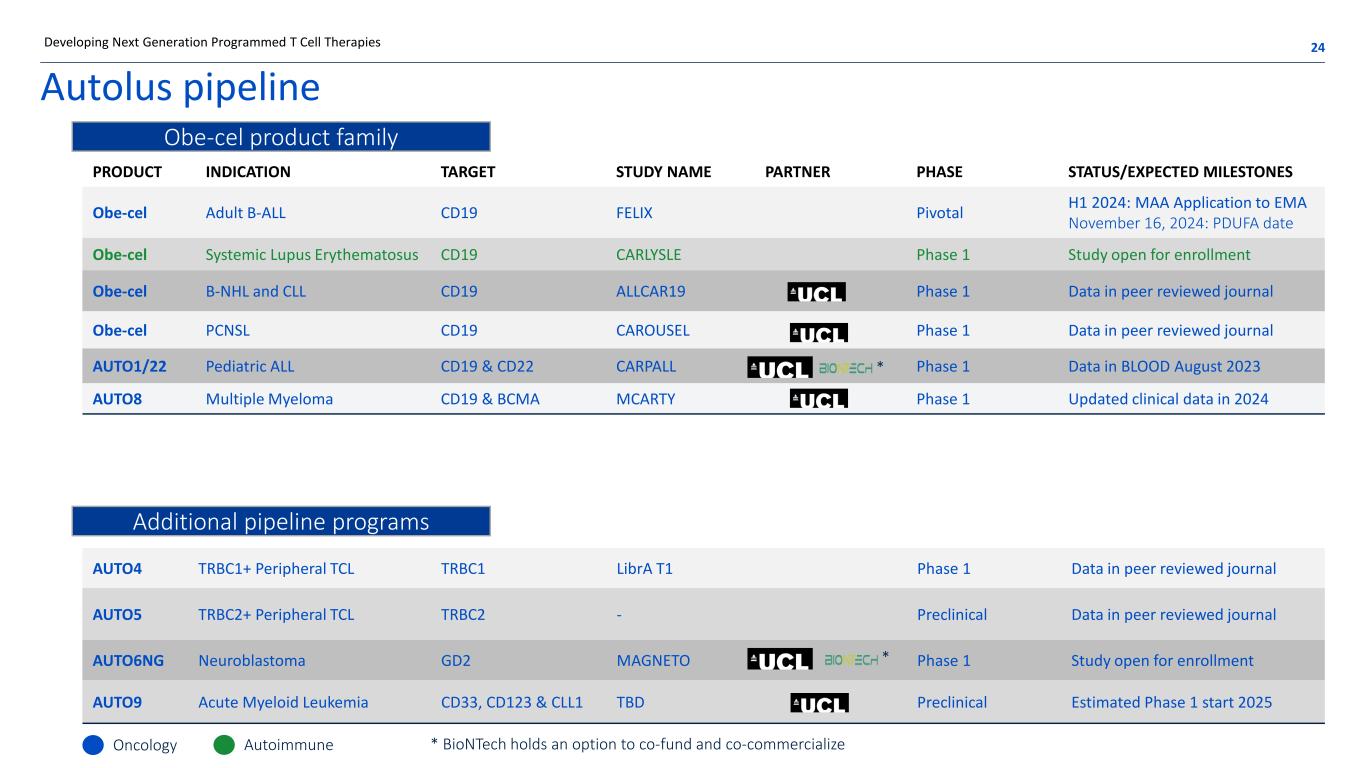
產品適應症目標研究名稱合作伙伴階段狀態/預期里程碑 OBE-CEL 成人 B-ALL CD19 FELIX Pivotal H1 2024:MAA 向 EMA 申請 2024 年 11 月 16 日:PDUFA 日期 Obe-cel 系統性紅斑狼瘡 CD19 CARLYSLE 1 期研究開放入組 OBE-CEL B-NHL 和 CLL CD19 ALLCAR19 1 期數據中的第 1 期數據在同行評審期刊 AUTO1/22 Pediacrial ALL CD19 和 CD22 CARPALL 血液中的 1 期數據 2023 年 8 月 AUTO8 多發性骨髓瘤 CD19 和 BCMA MCARTY 第 1 階段 2024 年更新的臨牀數據 Autolus管道 24開發下一代程序化 T 細胞療法 AUTO4 TRBC1+ 外圍 TCL TRBC1 Libra T1 1 期同行評審期刊 AUTO5 TRBC2+ 外圍設備 TCL TRBC2-同行評審期刊 AUTO6NG 神經母細胞瘤 GD2 MAGNETO 1 期研究開放報名 AUTO9 急性髓系白血病 CD33、CD123 和 CLL1 待定臨牀前估計 1 期開始腫瘤學自身免疫 Obe-cel 產品系列其他管道項目 * BioNTech 可以選擇共同資助和共同商業化 * *

財務業績
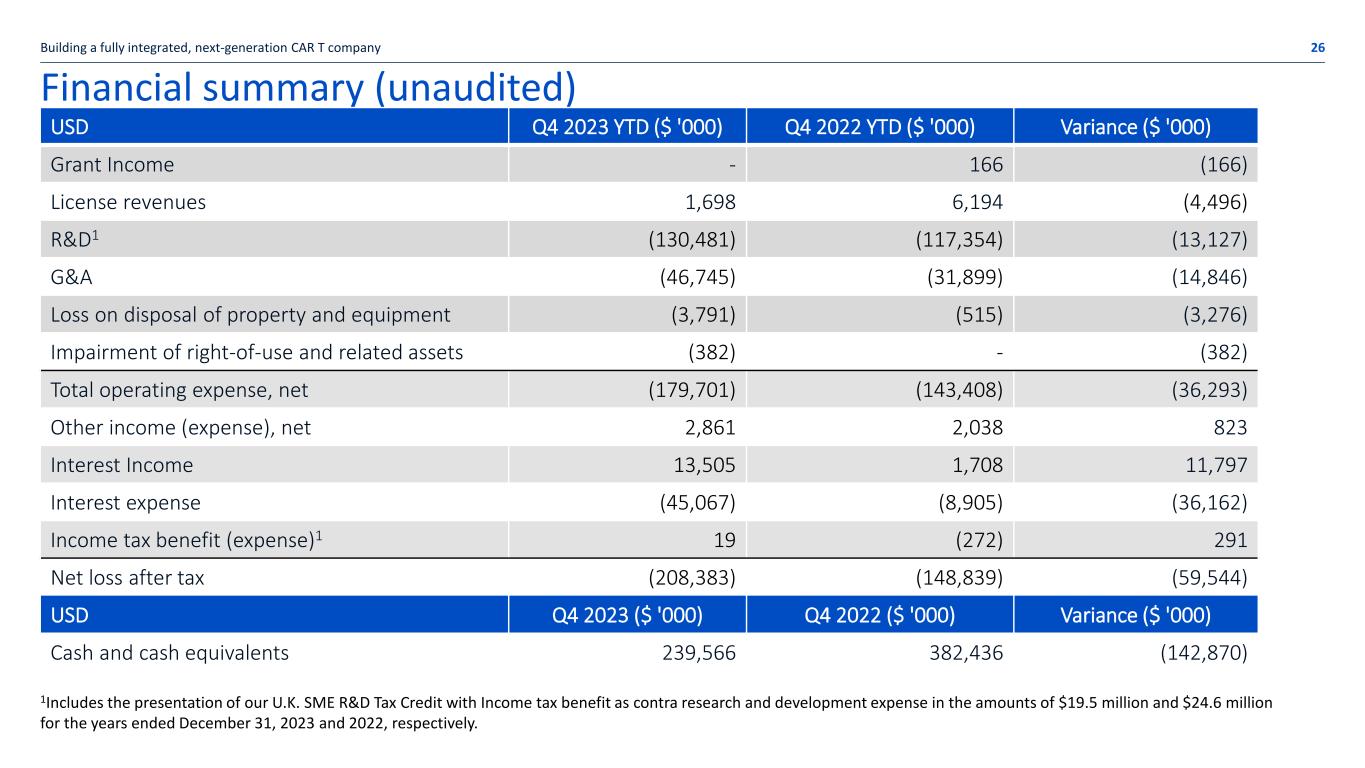
財務摘要(未經審計)2023年第四季度美元年初至今(000美元)2022年第四季度年初至今(000美元)差異(000美元)補助金收入——166(166)許可收入 1,698 6,194(4,496)R&D1(130,481)(117,354)(13,127)G&A(46,745)(31,899)(14,846)處置財產和設備損失 (3,791) (515) (3,276) 使用權及相關資產減值 (382)-(382) 總營業費用,淨額 (179,701) (143,408) (36,293) 其他收入(支出),淨額 2,861 2,038 823 利息收入 13,505 1,708 11,797 利息支出 (45,067) (8,905) (36,162) 所得税優惠(支出)1 19 (272) 291税後淨虧損 (208,383) (148,839) (59,544) 2023年第四季度美元(000美元)2022年第四季度(000美元)差異(000美元)現金及現金等價物 239,566 382,436(142,870)建立一個完全整合的下一代CAR T公司 26 1包括介紹我們的英國中小企業研發税收抵免以所得税優惠作為對照截至2023年12月31日和2022年12月31日止年度的研發費用分別為1,950萬美元和2,460萬美元。

即將發佈的新聞流
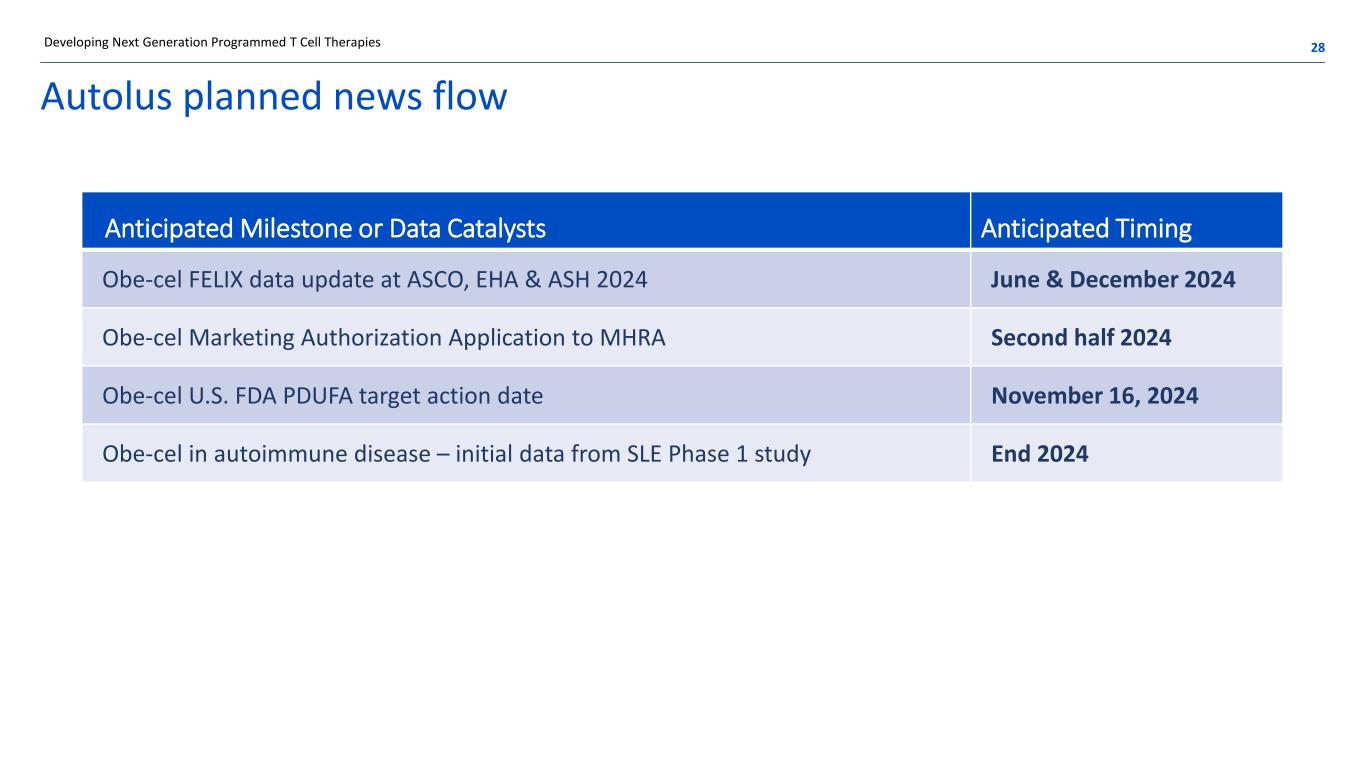
Autolus 計劃的新聞流 28開發下一代程序化 T 細胞療法的預期里程碑或數據催化劑預計時間 2024 年 6 月和 12 月 Obe-cel FELIX 在 ASCO、EHA 和 ASH 2024 年 6 月和 12 月更新 Obe-cel 向 MHRA 申請上市許可 Obe-cel 2024 年下半年 Obe-cel 美國食品藥品管理局PDUFA的目標行動日期 2024年11月16日 Obe-Cel 在自身免疫性疾病中的目標行動日期 2024 年 11 月 16 日 Obe-Cel 第 1 期研究的初步數據

摘要

建立一家開發癌症和自身免疫性疾病療法的領先的 CAR T 公司 30 • FELIX 關鍵試驗顯示 ORR 高、令人鼓舞的 EF 和良好的耐受性,而高級 CRS 和 ICANS 水平較低 • PDUFA 日期 2024 年 11 月 16 日 • EMA 文件已提交 • 與 BioNTech 的戰略多平臺研發合作 • 與 Moderna、BMS 和 Cabaletta 建立了長期的學術合作 • 與倫敦大學學院的長期學術合作 • 擴大 B 細胞 obe-cel 的機會惡性腫瘤、自身免疫性疾病和生命週期策略 — SLE —B-NHL 適應症 — 雙特異性療法(CD19/CD22;CD19/BCMA)• 單獨或與合作伙伴一起使用新型 CAR T 療法擴展到其他適應症 • 顯示出可靠的臨牀試驗供應(FELIX 關鍵研究達到 96% 的目標劑量)• 新的商用細胞製造設施處於資格認證階段;計劃年產能超過 2,000 批次 • OBE-Cel 推出時的預計靜脈交付時間約為 16 天 Obe-cel 可能是復發用 CAR T 中同類最佳 r adult ALL 戰略合作管道擴張戰略可擴展的製造和內部設施 •2.4億美元現金(2023年第四季度)以及來自融資和BioNTech交易的6億美元總收益 • 為obe-cel的啟動提供全額資金並允許加速自身免疫計劃強勁的現金狀況擴大公司走向商業化 $ 開發下一代程序化T細胞療法縮寫和註釋:r/r ALL-復發/難治性急性淋巴細胞白血病;B-NHL — B細胞非霍奇金淋巴瘤;SLE — 系統性紅斑狼瘡。

autolus.com 謝謝