
2023 年第四季度財報電話會議 2024 年 3 月 13 日附錄 99.2

2 前瞻性陳述本演示文稿及任何隨附的口頭陳述由ADC Therapeutics SA(“ADC Therapeutics”、“我們” 或 “我們”)編寫,僅供參考,不用於任何其他目的。本演示文稿中包含的任何內容都不是,也不應被解釋為主講人或ADC Therapeutics或ADC Therapeutics的任何高管、董事、員工、代理人或顧問的建議、承諾或陳述。本演示並不旨在包羅萬象,也不包含您可能想要的所有信息。本演示和任何隨附的口頭陳述中提供的信息僅適用於截至本文發佈之日。本演示文稿包含1995年《私人證券訴訟改革法》安全港條款所指的前瞻性陳述。在某些情況下,您可以使用 “可能”、“假設”、“將”、“應該”、“將”、“期望”、“打算”、“計劃”、“預期”、“相信”、“估計”、“預測”、“潛在”、“看起來”、“尋找”、“未來”、“繼續” 或 “出現” 或否定這些術語或類似術語的否定詞語來識別前瞻性陳述表達式,儘管並非所有前瞻性陳述都包含這些識別詞。前瞻性陳述受某些風險和不確定性的影響,這些風險和不確定性可能導致實際結果與所描述的結果存在重大差異。可能導致這種差異的因素包括但不限於:公司更新後的公司戰略的成功;2025年第四季度初的預期現金流、新商業進入市場戰略的有效性、來自新技術的競爭、公司在美國增加ZYNLONTA® 收入的能力;瑞典Orphan Biovitrum AB(Sobi®)成功將ZYNLONTA® 在美國商業化的能力歐洲經濟區和市場接受度、充足的報銷範圍以及由此產生的未來收入;批准Overland ADCT BioPharma提交的中國ZYNLONTA® BLA的NMPA及其未來收入,我們的戰略合作伙伴,包括三菱田邊製藥公司,在外國司法管轄區獲得監管部門批准ZYNLONTA® 的能力,以及此類合作伙伴未來收入和向我們付款的時間和金額;公司或其合作伙伴的研發項目或臨牀試驗(包括LOA)的時間和結果 TIS 5 和 7、ADCT 601 和 602 以及 FL 和 MZL 的 IIT 以及對某些固體的早期研究具有不同靶標、連接劑和有效載荷的腫瘤;公司產品或候選產品的監管申報的時間和結果;食品和藥物管理局或外國監管機構的行動;預計的收入和支出;公司進行業務開發或研究合作交易的能力;公司的債務,包括醫療保健特許權使用費管理以及藍貓頭鷹和橡樹設施,以及此類債務對公司活動施加的限制、遵守能力各種條款達成協議並償還此類債務以及償還此類債務所需的大量現金;以及公司為其研究、開發、臨牀和商業活動獲得財務和其他資源的能力。有關這些因素和其他可能導致實際業績與前瞻性陳述中的預期存在重大差異的因素的更多信息載於公司10-K表年度報告的 “風險因素” 部分以及公司向美國證券交易委員會提交的其他定期和當前報告以及文件中。這些陳述涉及已知和未知的風險、不確定性和其他因素,這些因素可能導致實際結果、業績、成就或前景與此類前瞻性陳述中表達或暗示的任何未來業績、業績、成就或前景存在重大差異。該公司提醒投資者不要過分依賴本文件中包含的前瞻性陳述。前瞻性陳述基於我們管理層的信念和假設以及管理層目前可獲得的信息。無法保證將來會取得這樣的結果。本演示文稿中包含的此類前瞻性陳述僅代表截至本演講之日。除非適用法律要求,否則公司明確表示不承擔任何義務或承諾更新本演示文稿中包含的這些前瞻性陳述以反映我們預期的任何變化或此類陳述所依據的事件、條件或情況的任何變化。對於任何此類前瞻性陳述的準確性,不作任何陳述或保證(明示或暗示)。本演示文稿中包含的某些信息涉及或基於來自第三方來源的研究、出版物、調查和其他數據以及我們自己的內部估計和研究。儘管我們認為截至本演示之日這些第三方來源是可靠的,但我們尚未獨立核實,對於從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性,我們也沒有做出任何陳述。此外,本演示文稿中包含的所有市場數據都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。最後,儘管我們認為自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。

3 議程 02 商業亮點克里斯汀·哈靈頓-史密斯首席商務官 03 臨牀亮點穆罕默德·扎基首席醫療官 05 財務更新佩佩·卡莫納首席財務官 01 簡介 Ameet Mallik 首席執行官 04 研究亮點帕特里克·範·伯克爾首席科學官 01 簡介 Ameet Mallik 首席執行官 04 研究亮點帕特里克·範·伯克爾首席科學官
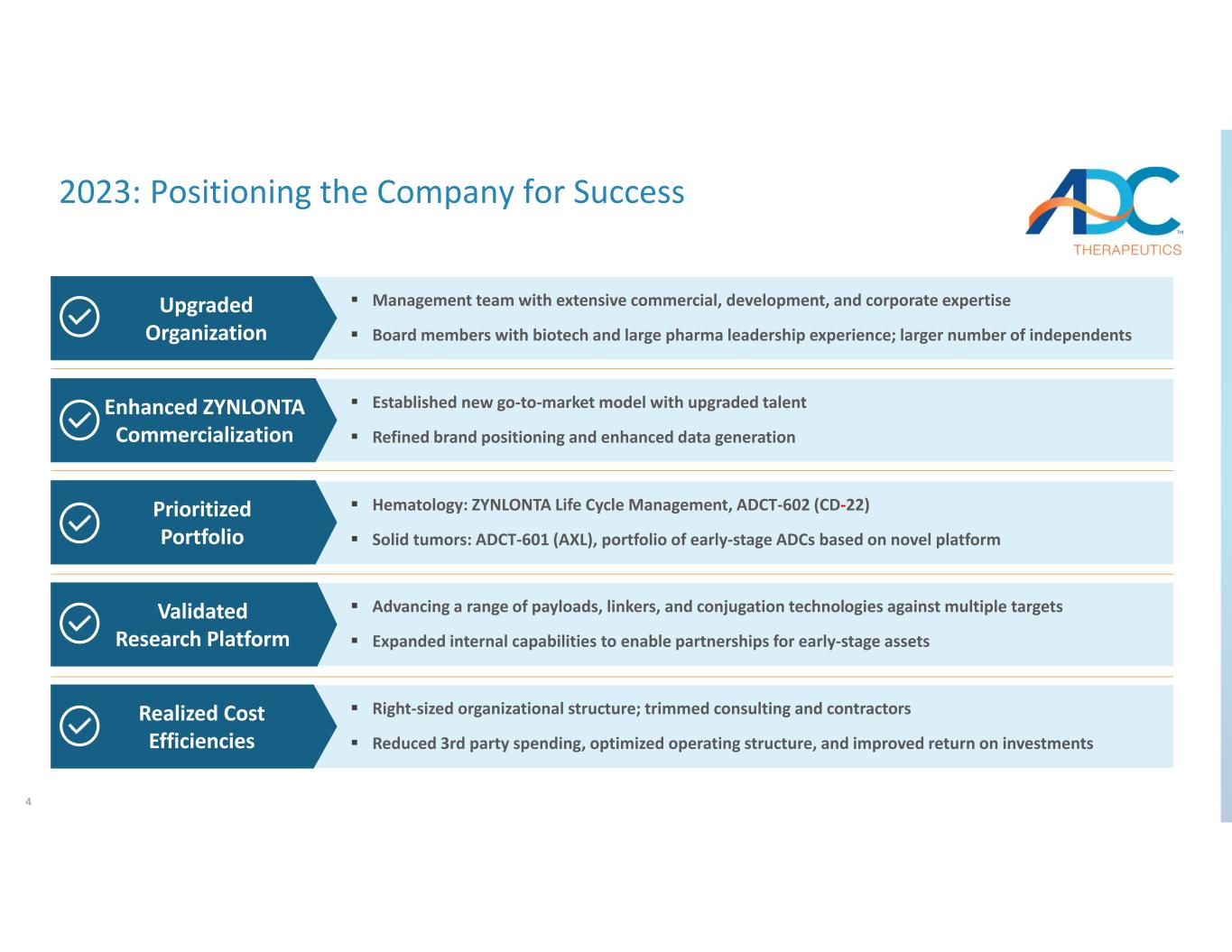
2023 年 4 月 4 日:憑藉豐富的商業、開發和企業專業知識為公司打造成功管理團隊;擁有生物技術和大型製藥公司領導經驗的董事會成員;更多的獨立人士;通過升級人才建立新的市場進入模式完善的品牌定位和增強的數據生成血液學:ZYNLONTA生命週期管理,ADCT‐602(CD‐22)實體瘤:ADCT‐601(AXL),基於早期ADC的產品組合在新平臺上推進一系列有效載荷、連接劑和偶聯技術以防止多個目標擴大內部能力,為早期資產建立合作伙伴關係適當規模的組織結構;精簡諮詢和承包商減少了第三方支出,優化了運營結構,提高了投資回報率升級的組織增強了ZYNLONTA商業化優先投資組合驗證的研究平臺實現了成本效率

5 基於血液學和實體瘤雙支柱的企業和資本配置策略 DLBCL:瀰漫性大B細胞淋巴瘤;佛羅裏達州:濾泡性淋巴瘤;MZL:邊緣區淋巴瘤;NSCLC:非小細胞肺癌;ALL:急性淋巴細胞白血病。短期中長期血液學投資組合實體瘤投資組合 ZYNLONTA 資本配置的主要重點去風險資產峯值銷售潛力超過5億美元投資以優化3L+DLBCL的商業執行,並有可能擴展到早期產品線(LOTIS-5:利妥昔單抗組合,LOTIS-7:雙特異性組合)和其他適應症(FL,MZL)其他資產 ADCT‐602(CD22)) 在肉瘤、胰腺癌和非小細胞肺癌所有關鍵資產中的第一階段 ADCT‐601 (AXL) 處於以高價值靶標為重點的研究性ADC組合的1期,利用基於exatecan的新型平臺COLLABORATION STRATEGY 夥伴關係/協作方法來支持廣泛的早期投資組合的發展,來自合作伙伴的非稀釋性資本,為特定實體瘤項目的內部開發提供資金
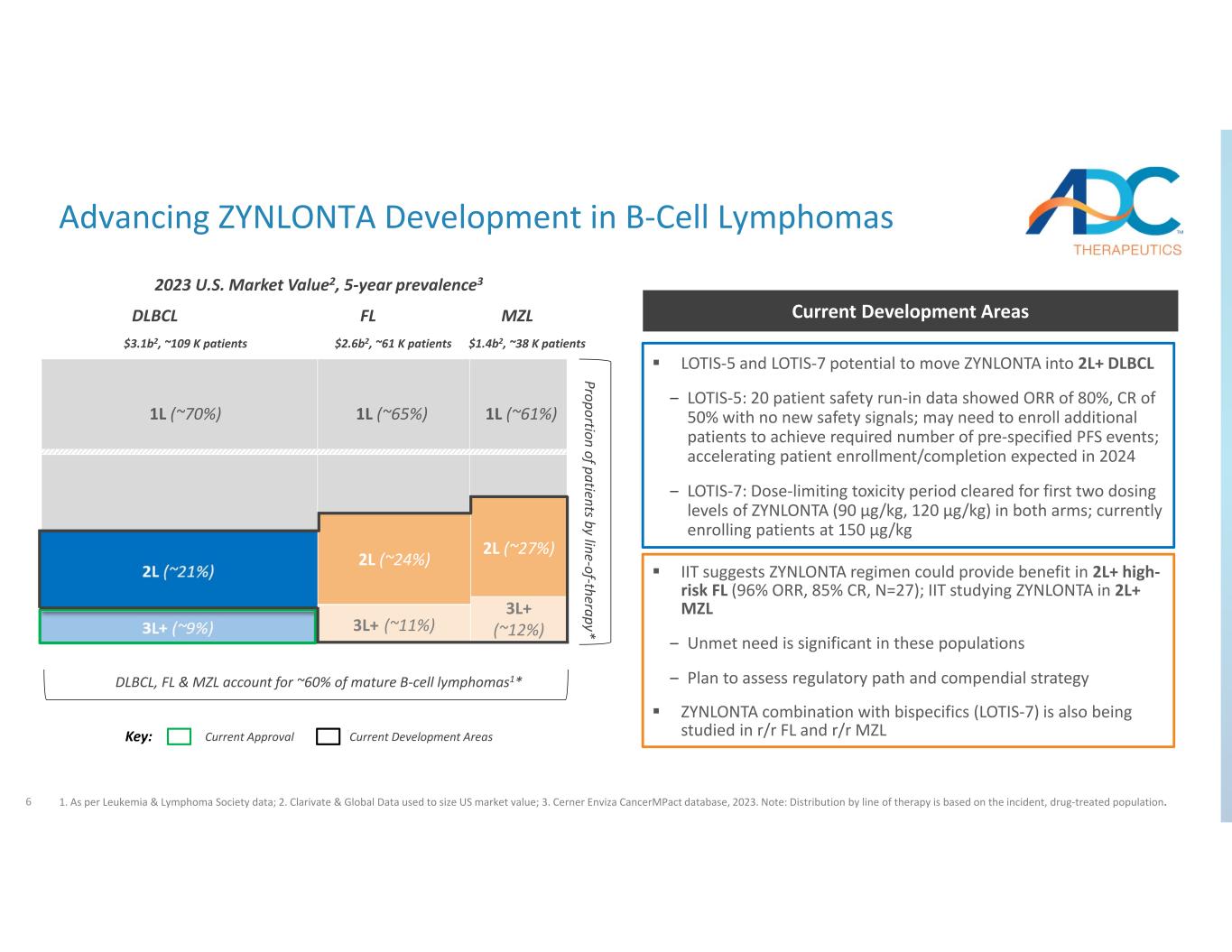
6 按治療系列劃分的患者比例* DLBCL、FL 和 MZL 佔成熟 B 細胞淋巴瘤的約 60% 1* 1L (~ 70%) 1L (~ 65%) 1L (~ 61%) MZLFLDLBCL 關鍵:目前批准的當前開發領域推進 B-Cell 淋巴瘤的 ZYNLONTA 開發 2L (~ 24%) 2L (~ 27%)) 3L+ (~ 11%) 3L+ (~ 12%) 2023年美國市值2,5年患病率3 LOTIS‐5和LOTIS‐7有可能使ZYNLONTA進入2L+ DLBCL:20名患者安全性磨合數據顯示ORR為80%,CR為50%,沒有新的安全信號;可能需要招募更多患者才能達到所需的預診人數特定的PFS事件;預計將在2024年加快患者入組/完成患者入組——LOTIS‐7:兩組ZYNLONTA的前兩個劑量水平(90 µg/kg,120 µg/kg)的劑量限制毒性期已被清除;目前的患者註冊量為150 µg/kg 當前開發區域 IIT 表明ZYNLONTA方案可以為2L以上的高風險 FL(96% ORR,85% CR,N=27)帶來益處); IIT 正在研究 2L+ MZL 中的 ZYNLONTA — 這些人羣中未得到滿足的需求非常重要 − 評估監管路徑和綱要策略 ZYNLONTA 與雙特異性藥物 (LOTIS−7) 組合的計劃是還在 r/r FL 和 r/r MZL 3.1b2 美元中進行研究,約 10.9 萬名患者 2.6b2 美元,約 61 萬名患者 1.4b2 美元,約 38 K 名患者 1.根據白血病和淋巴瘤協會的數據;2.Clarivate & Global Data 用於估算美國的市場價值;3.Cerner Enviza CancerMpact 數據庫,2023 年。注意:按療法線劃分的分佈基於發病率、接受藥物治療的人羣。
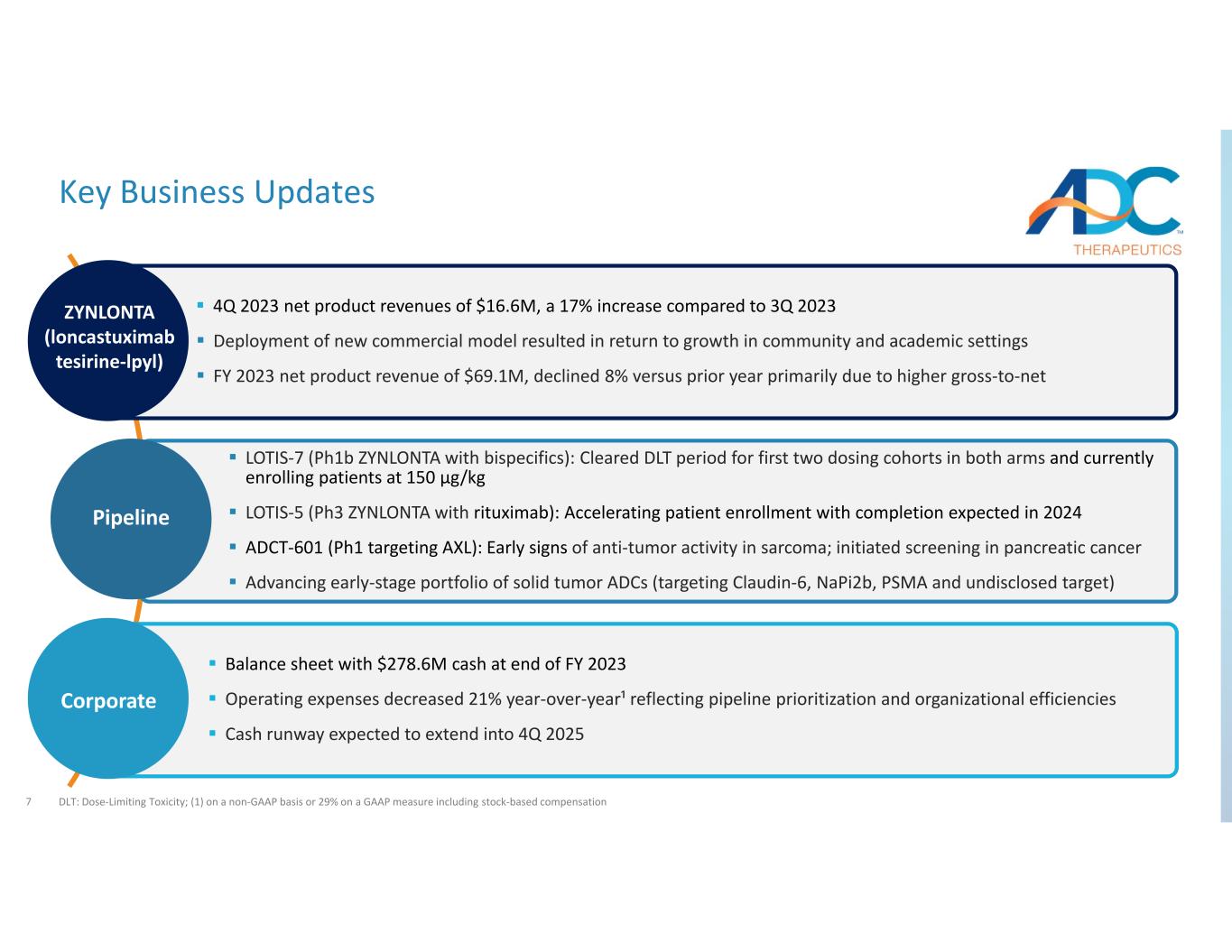
7項關鍵業務更新DLT:劑量限制毒性;(1)按非公認會計準則計算,佔29%,包括股票薪酬資產負債表,2023財年末現金為2.786億美元運營費用同比下降21%¹,反映了管道優先順序和組織效率現金流預計將延伸到2025年第四季度LOTIS−7(採用雙特異性貨幣的PH1b ZYNLONTA):兩組前兩個給藥組的DLT期已完成,目前患者入組的劑量為150 µg/kg LOTIS‐5(使用利妥昔單抗的Ph3 ZYNLONTA):加速患者預計於2024年完成入組 ADCT‐601(Ph1靶向AXL):肉瘤抗腫瘤活性的早期跡象;啟動胰腺癌篩查推進實體瘤ADC的早期產品組合(針對Claudin‐6、Napi2b、PSMA和未公開目標)2023年第四季度淨產品收入為1,660萬美元,與2023年第三季度相比增長了17%,新商業模式的部署導致 2023財年社區和學術環境恢復增長,淨產品收入為6,910萬美元,與上年相比下降了8%,這主要是由於總淨收入的增加Pipeline Corporate ZYNLONTA(隆卡妥昔單抗泰西林‐lpyl)

8 ZYNLONTA在學術環境中起着重要作用對於不適合雙特異性藥物/CAR‐T或在這些療法上取得進展的患者來説,ZYNLONTA處於有利地位。戰略利用思想領袖的積極經驗幫助社區醫生了解在哪裏使用ZYNLONTA ZYNLONTA淨銷售額:2023年第四季度1660萬美元ZYNLONTA非常適合臨牀概況的大部分機會:安全性可控的高效單一療法在門診環境中給藥處方行為變化緩慢由於老年人和/或效果較低的藥劑 AcademicCommunity • 儘管競爭加劇,但2023年第四季度社區和學術環境的銷量連續增長 • 平均藥瓶/日均量在2023年上半年回升至2023年上半年的水平,但被GTN從上半年到下半年的高個位數百分比增長所部分抵消 • 我們有正確的團隊和策略在3L/3L+ DLBCL GTN:總量對淨增長3L/3L+: 三線和三線以上;DLBCL:瀰漫性大型 B 細胞淋巴瘤商業執行力得到改善
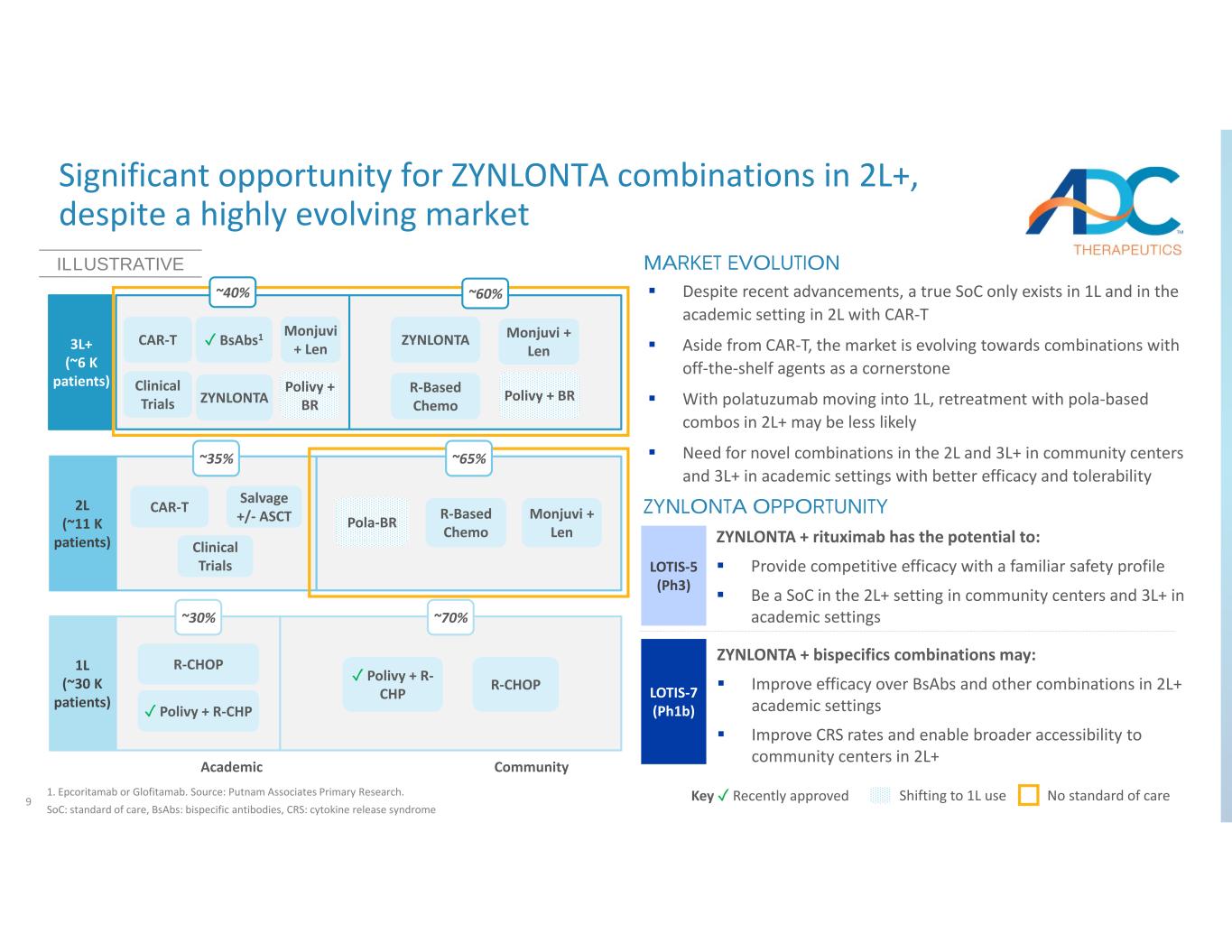
9 儘管市場高度發展,但ZYNLONTA在2L+中的組合仍有巨大的機遇 1.Epcoritamab 或 Glofitamab。資料來源:普特南協會初步研究。SoC:護理標準,bsaB:雙特異性抗體,CRS:細胞因子釋放綜合徵 Key ✓ 最近批准改用 1L 使用無標準護理學術社區 1L(約 30 K 名患者)2L(約 11 K 名患者)3L+(約 6 K 名患者)R‐CHOP ~ 35% ✓ Polivy + R‑CHP R‐T 臨牀試驗 YNLONTA ✓ bsABS1 Monjuvi + Len Polivy + BR ZYNLONTA Monjuvi + Len Polivy + Brr-based Chemo ~ 30% ~ 70% R 基化療 Monjuvi + Len Pola-BR ~ 65% ~ 60% ~ 40% CAR‐T 臨牀試驗挽救 +/‐ASCT 説明性市場演變儘管最近取得了進展,但只有真正的 SoC ✓存在於1L中,在學術環境中存在於2L中,CAR‐T除了CAR-T之外,市場正在向以現成藥物為基石的組合發展。隨着polatuzumab進入1L,在2L+中使用基於pola的組合進行再治療的可能性可能較小。社區中心的2L和3L+需要新組合,在學術環境中需要具有更好療效和耐受性的3L+ YNLONTA OPPORTINITY LOTIS‐5 (Ph3) LOTIS‐7 (pH1b) ZYNLONTA + 雙特異性組合可能:在 2L+ 學術環境中提高與 bsaB 和其他組合相比的療效提高 CRS 率,讓更多人可以訪問 2L+ 的社區中心 ZYNLONTA + 利妥昔單抗有可能:以熟悉的安全特徵提供具有競爭力的療效成為社區中心 2L+ 環境中的 SoC,在學術環境中成為 3L+

10 LOTIS‐5 概述 IDMC:獨立數據監測委員會,操作系統:總存活率,ORR:總體緩解率,CRR:完全緩解率,DoR:緩解持續時間患者羣體:2L+ DLBCL,不符合ASCT資格摘要:與利妥昔單抗聯合的Ph3確認性試驗研究設計:ZYNLONTA聯合的隨機、開放標籤、兩部分、雙臂、多中心臨牀試驗利妥昔單抗與免疫化療對比治療復發或難治性 DLBCL 患者的主要和次要終點:— 主要終點——用於評估 DLBCL 的療效ZYNLONTA聯合利妥昔單抗與標準免疫化療相比——按PFS測量,次要終點包括OS、ORR、CRR、DoR、不良事件的頻率和嚴重程度、安全實驗室和臨牀變量與基線的變化、ZYNLONTA的濃度和藥代動力學參數、免疫原性以及患者報告結局的變化初始數據:SOHO 2023年更新的安全領先結果:ORR為80%,沒有新的安全信號的CR為50%現狀和後續步驟 LOTIS−5:開發ZYNLONTA成為美國的首選組合劑早期療法的目標定位具有競爭力的2L+療效,具有良好的安全性和便捷的給藥時間表,非常適合在學術和社區環境中使用 *截至2024年3月13日 • 按隨機部分進行入組;超過三分之二的患者入組 • 在臨牀小組觀察到審查高於預期並得到IDMC確認後,除了最初計劃的350名患者外,可能需要招募更多患者,才能達到所需的預備人數指定的無進展生存事件 • 2024 年 1 月,IDMC 沒有注意到安全問題,建議繼續進行研究 • 預計在 2024 年實現全員入學 • 視事件而定,潛在數據將在 2025 年底之前出現

11 Ar m E Ar m F 治療週期(21 天週期)r/r DLBCL、FL、MZL 兩組可能包括 r/r DLBCL、FL 和 MZL ZYNLONTA 將在研發時針對第 1 部分中確定的特定組合和亞羣 T En d 在 m en t Pa rt 1 3+ 3 Do se e sc al at io n (Z YN LO N TA 9 0, 1 20),a d 15 0 μg/k g) Pa rt 2 Do se ex pa ns io n 篩查期 (≤28 d) Mosunetuzumab + ZYNLONTA Q3W2 的遞增劑量從 2023 年 7 月開始 Glofitamab + ZYNLONTA Q3W1 註冊的遞增劑量從 2023 年 7 月 1 日開始。Obinutuzumab 在 C1D1 上預處理 1000 mg;在 C1D2 上給藥 ZYNLONTA;靜脈注射格洛非他單抗(C1D8 為 2.5mg,C1D15 為 10mg);在 C2D1 及以後使用 ZYNLONTA 加上格洛菲他單抗 30 毫克(如果起始劑量,則在 C3 時將 ZYNLONTA 降至 75 微克/千克為 120 微克/千克或更高)2.ZYNLONTA 加皮下 mosunetuzumab 在 C1D1 上的第一次升壓劑量為 5 mg,其次是 mosunetuzumab 的第二步上升劑量,C1D8 和 C1D15 的目標劑量為 45 mg;ZYNLONTA 加上 45 mg 皮下注射 Mosunetuzumab,C2D1 及以上的劑量為 75 μg/kg(將 ZYNLONTA 降至 75 μg/kg)如果起始劑量為 120 ug/kg 或更高)LOTIS‐7:將ZYNLONTA與雙特異性抗體(格洛非他單抗或莫蘇尼妥珠單抗)聯合使用終點主要:安全性和耐受性;MTD 和/或次要研發:療效:ORR、DOR、CRR、PFS、RFS、OS;藥代動力學和免疫原性研究人羣復發或難治性B‐NHL患者並已接受:第1部分:>2種全身治療方案;第2部分:>1種全身治療方案允許使用先前的自體SCT(>100天)或CAR‐T(>30天)。理由除中性粒細胞減少外,除中性粒細胞減少外,DLBCL ZYNLONTA在glofitamta之前批准使用的單劑藥物有不同的MOA和非重疊毒性 ab可以減輕腫瘤體積並減少外周B細胞,從而降低CRS發生率。在大量預治療的患者中,成功完成了前兩次劑量隊列且兩組均無DLT的治療迄今為止給藥的患者沒有或低等級的CRS在混合組織學中出現抗腫瘤活性的早期跡象初始數據

佛羅裏達州12個ZYNLONTA IIT(邁阿密大學)和MZL IIT:研究者發起的試驗;佛羅裏達州:濾泡性淋巴瘤;MZL:邊緣區淋巴瘤;ORR:總體緩解率;CR:完全反應;PFS:無進展生存高風險復發/難治性濾泡性淋巴瘤研究:ZYNLONTA + 利妥昔單抗Ambition的2期研究:有可能解決高危患者羣體未得到滿足的需求現狀:在ASH 2023上公佈的數據:n=33名受試者,目標39名(27名可評估療效,32名可評估安全性)最佳ORR 96%,CR率為85%;12個月PFS 93%佔多數1 級 3 級不良事件包括中性粒細胞減少症(n=2),以及高血糖、ALT 升高、疲勞、呼吸困難和皮膚感染各一例。中性粒細胞減少症僅為4級AE(n=1)下一步:邁阿密大學計劃將試驗參與者人數擴大到100人,並增加其他癌症研究中心數據將在醫學會議上公佈未來路徑將與監管機構和綱要討論復發/難治性邊緣區淋巴瘤研究:ZYNLONTA Ambition的2期開放標籤研究:通過批准的療法,有可能解決因低CR率而導致的重大需求未得到滿足:將對 n=19 名患者進行無效性分析下一步:預計將進行徒勞性分析2024年第二季度進行數據將在即將舉行的醫學會議上共享邁阿密大學計劃增加其他癌症研究中心,以加快50名試驗參與者的註冊人數
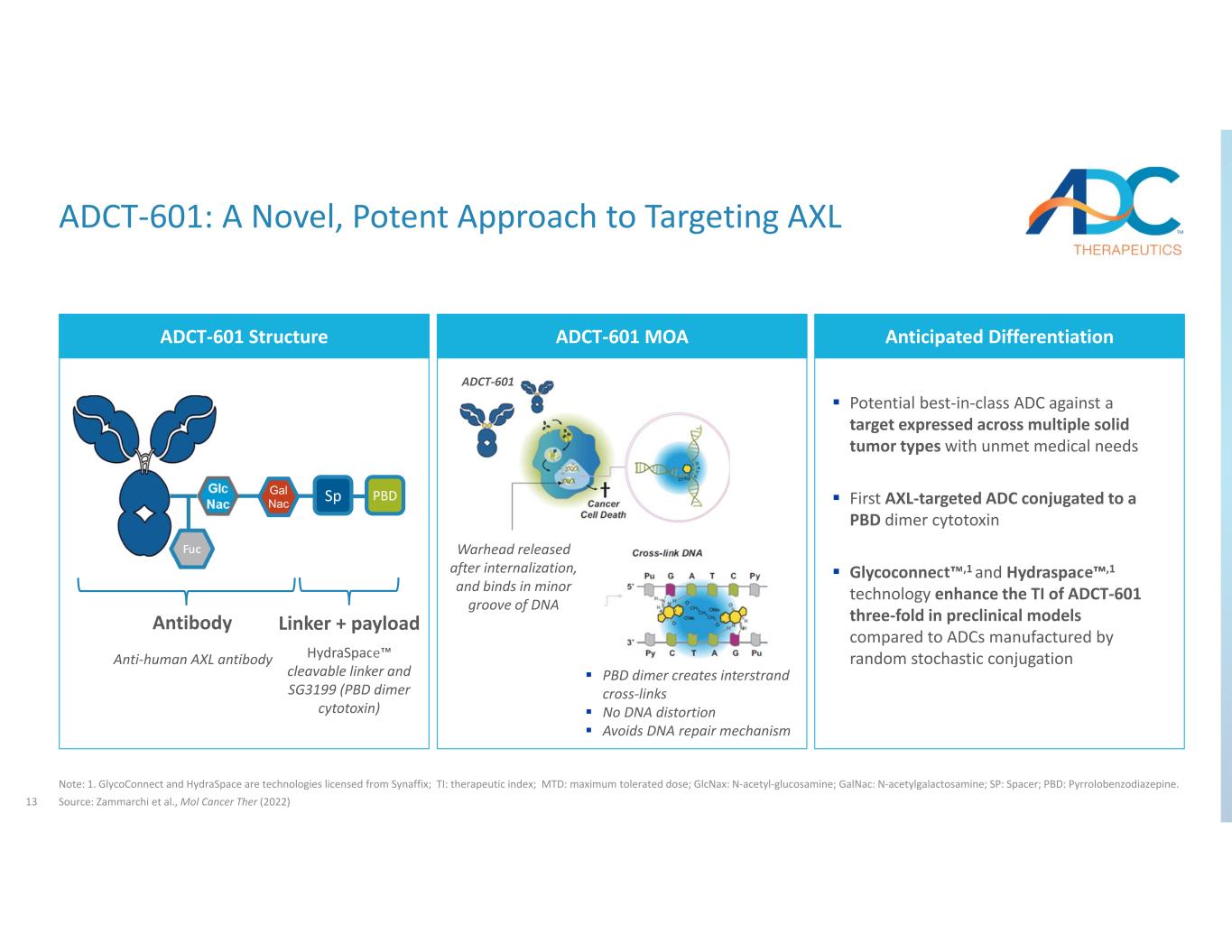
13 ADCT-601:一種靶向 AXL 的新型、有效的方法注:1.GlycoConnect和HydraSpace是Synaffix授權的技術;TI:治療指數;MTD:最大耐受劑量;glcNax:N‐乙酰氨基葡萄糖;GalnaC:N‐乙酰半乳糖胺;SP:間隔;PBD:吡咯苯二氮卓類。資料來源:Zammarchi等人,《Mol Cancer Ther》(2022年)ADCT‐601結構針對在多種實體瘤類型中表達但醫療需求未得到滿足的靶標的預期分化潛力。與PBD二聚體細胞毒素糖連接1和Hydraspace 1技術相比,臨牀前模型中ADCT‐601的TI提高了三倍隨機隨機偶聯 pbdspGAL Nac Fuc Fuc HydraSpace 可分解連接劑和 SG3199(PBD 二聚體細胞毒素)抗人 AXL 抗體抗體連接器 + 有效載荷ADCT-601 MOA 彈頭在內化後釋放,並在 DNA 的小凹槽中結合 PBD 二聚體產生鏈間交聯無 DNA 失真避免 DNA 修復機制 ADCT‐601

14 ADCT‐601靶向AXL:基本原理和區別一項1b期研究正在進行中,包括一個單一療法組招募肉瘤、胰腺癌和表達AXL的非小細胞肺癌患者,以及使用吉西他濱對肉瘤和胰腺癌患者進行聯合治療達到13mg的推薦劑量;劑量優化正在進行中。在肉瘤中,在單一療法和聯合治療中已出現抗腫瘤活性的早期跡象測試劑量範圍內的可耐受安全性概況在胰腺癌中,最近開始對單一療法進行篩查arm 臨牀研究現狀和後續步驟 AXL 在多種腫瘤類型中表達,包括非小細胞肺癌、胰腺和肉瘤 AXL 的高表達與這些癌症類型的患者總體存活率下降相關 AXL 表達量高病例的百分比2 ~ 90% ~ 30% 肉瘤 (STS) 60 — 70% ~ 35% 胰腺腺癌 50 — 60% 20 — 25% 非小細胞肺癌 g3 目標相關性 AXL EXPRESSION1 1.截至 2024 年 9 月 2 日的數據;2.根據601‐102號試驗中用於確定高表達/陽性患者的評分算法和截止值:STS = AXL+腫瘤細胞 2+/ 3+ 強度 ≥ 75%,PAAD = AXL+ 腫瘤細胞 2+/ 3+ 強度 ≥ 10%。NSCLC = 膜 AXL+ 腫瘤細胞(任何強度)≥ 1%;3.膜表達通常與 2+/3+ 腫瘤細胞的表達相關
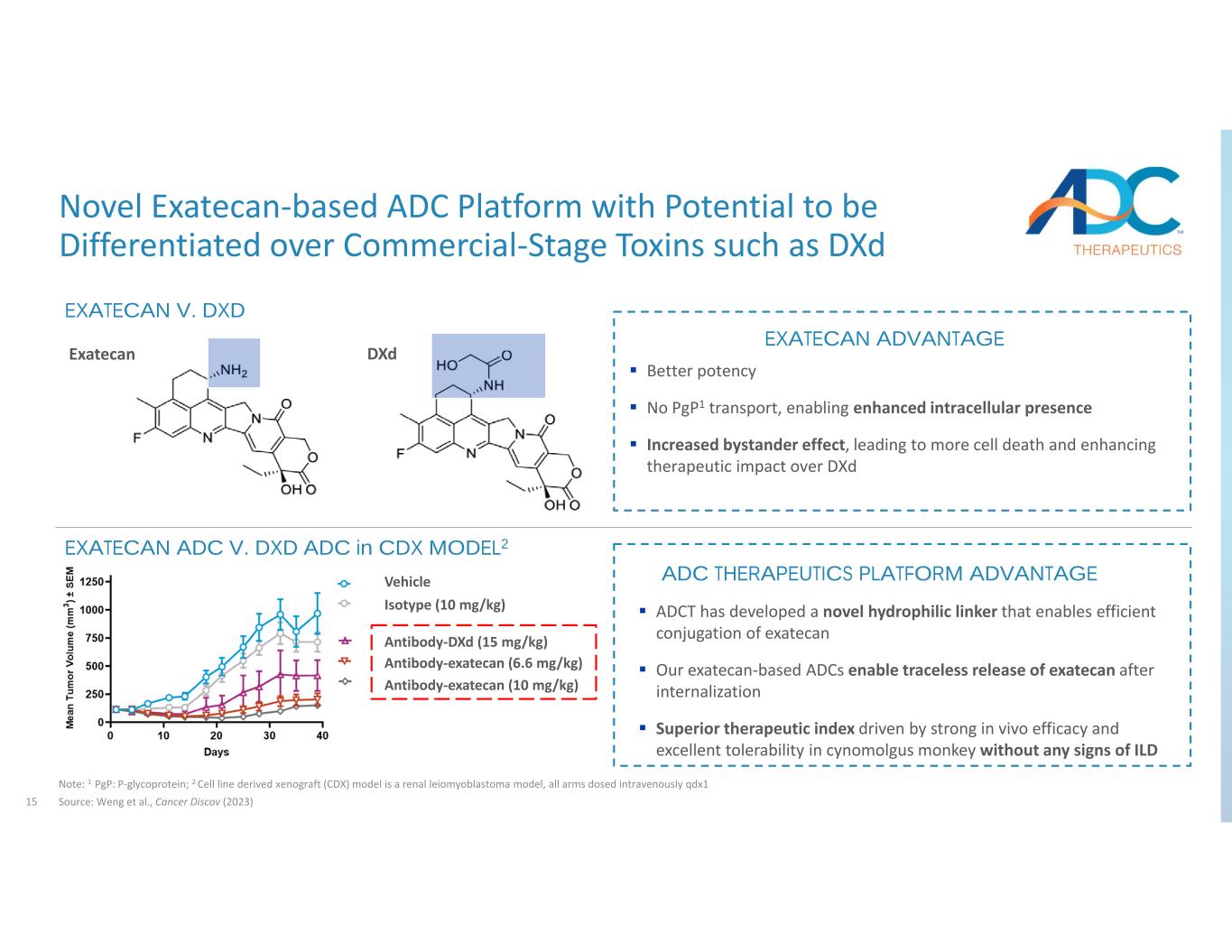
15 種基於 Exatecan 的新型 ADC 平臺有可能與 dxD 等商業階段毒素區分開來注意:1 pgP:p‐糖蛋白;2 細胞系衍生異種移植 (CDX) 模型是腎平滑肌母細胞瘤模型,所有手臂靜脈注射 qdx1 來源:Weng 等人,Cancer Discov (2023) EXATECAN V. PGXD 更好的效力否 p1 轉運,增強細胞內存在感增強旁觀者效應,導致更多細胞死亡,增強治療效果與 dxD Exatecan DxD 載體同型(10 mg/kg)抗體‐DxD(15 mg/kg)抗體 Exatecan 相比(6.6 mg/kg)抗體-Exatecan(10 mg/kg)ADCT 開發了一種新型的親水性連接劑,可實現依沙替康的有效偶聯我們的依沙替康在內化後可實現無痕釋放,其卓越的體內療效和出色的耐受性驅動的治療指數在於 CDX MODEL2 EXATECAN ADVANTANGE 中沒有任何ILD EXATECAN ADC V. DXD ADC 的跡象 ADC 療法平臺的優勢
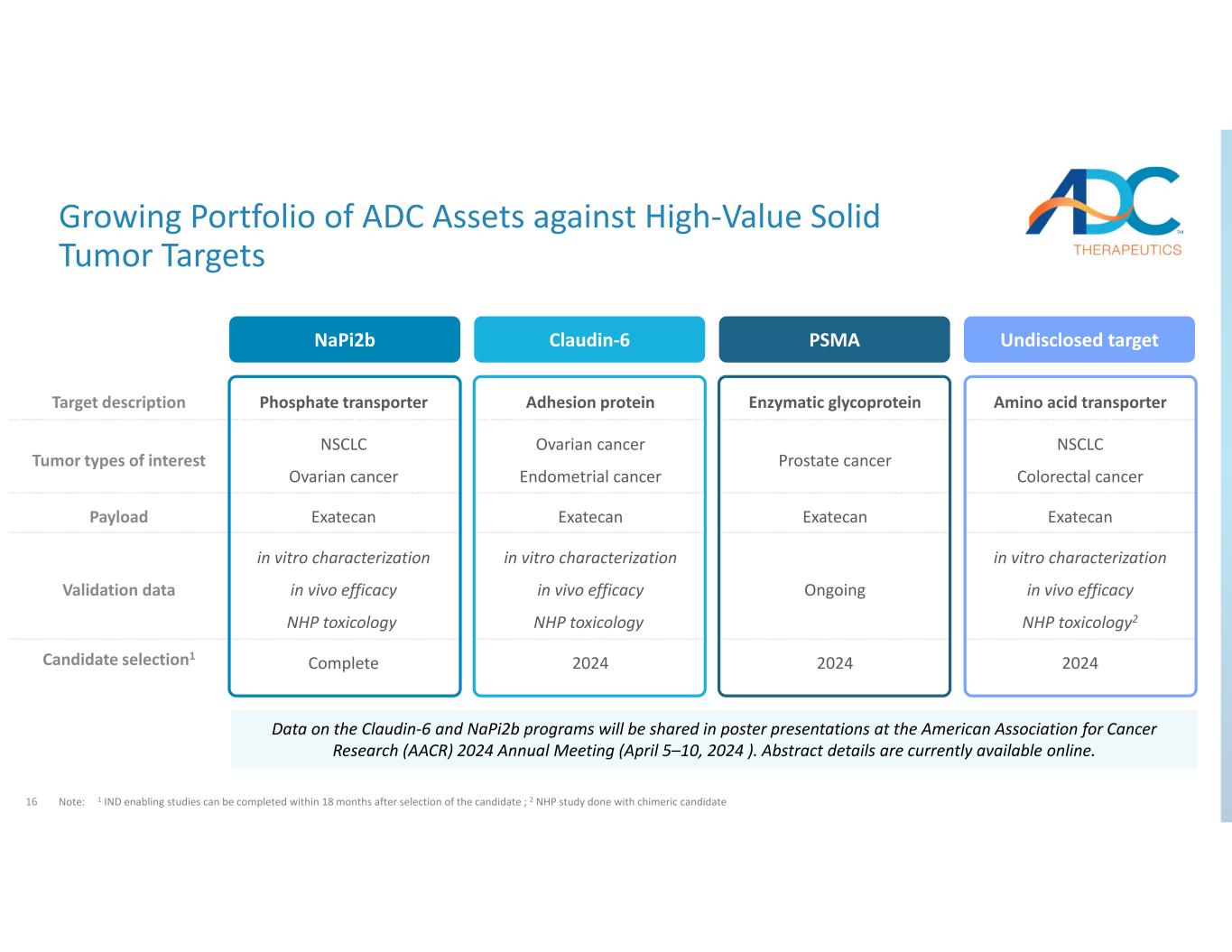
16 氨基酸轉運體酶糖蛋白粘附蛋白磷酸轉運蛋白目標描述 NSCLC 結直腸癌前列腺癌卵巢癌子宮內膜癌 NSCLC 卵巢癌關注的腫瘤類型 exateCanexateCanexatecanexatecanepayload 體外表徵體內功效 NHP 毒理學體外表徵 NHP 毒理學體外功效 NHP 毒理學驗證數據 202420242024完成候選人選擇1 抗高價值實體瘤的 ADC 資產組合不斷增長目標註:1項支持IND的研究可以在候選人選出後的18個月內完成;2項針對嵌合候選人Napi2b Claudin‐6 PSMA的NHP研究未公開的靶向數據將在美國癌症研究協會(AACR)2024年年會(2024年4月5日至10日)的海報展示中共享。摘要詳細信息目前可在線獲取。
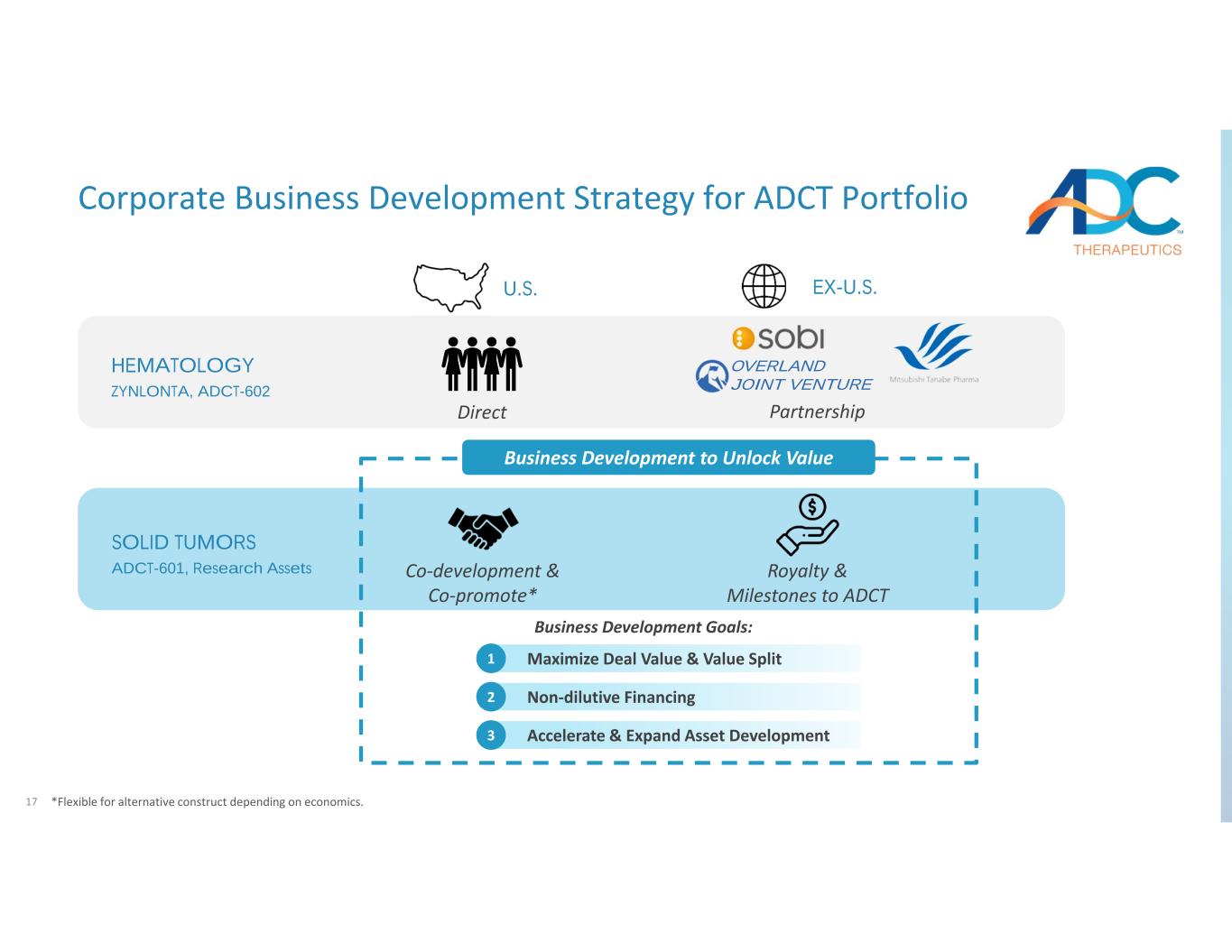
17 ADCT 投資組合的企業業務發展戰略 HEMETALOGY ZYNLONTA、ADCT-602 實體瘤 ADCT-601、解鎖價值的研究資產業務開發業務發展目標:美國(除美國)共同開發與共同推廣* ADCT的特許權使用費和里程碑加速和擴大資產開發3 非稀釋性融資2 最大化交易價值和價值分割1 直接合作夥伴關係 *根據經濟狀況靈活選擇替代結構。陸路合資企業
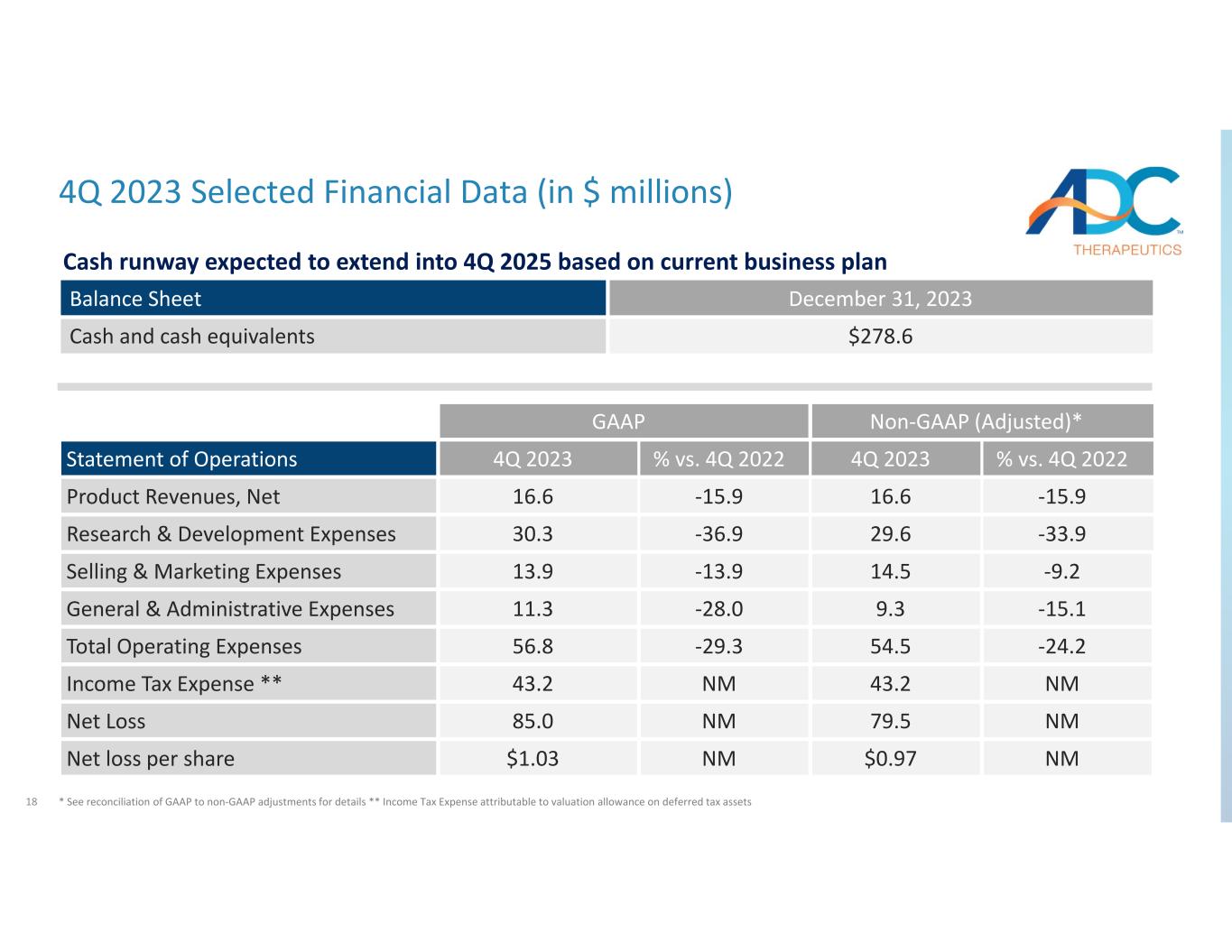
18 2023 年第四季度精選財務數據(百萬美元)非公認會計準則(調整後)*GAAP 百分比與 20224 年第四季度 2023 年第 4 季度對比 2023 年第四季度運營報表 −15.916.6−15.916.6產品收入,淨 −33.929.6−36.930.3 研發費用 −9.214.5−13.913.9 銷售和營銷費用 −15.19.3−28.011.3General 和管理費用 −24.254.5−29.356.8總運營支出 nm43.2nm43.2所得税支出 ** nm79.5nm85.0淨虧損NM0.97nm85.0淨虧損NM0.97nm1.03每股淨虧損1.03美元資產負債表278.6現金及現金等價物現金流預計將延續到2025年第四季度關於當前的業務計劃 * 詳情參見 GAAP 與非公認會計準則調整的對賬** 歸屬於遞延所得税資產估值補貼的所得税支出

19 Cash Runway 將支持多種潛在的短期價值——推動催化劑 ZYNLONTA:在 2024 年實現商業品牌盈利能力 LOTIS‐5:2024 年完成註冊 LOTIS‐7:2024 年佛羅裏達州和 MZL IIT 的劑量增加和擴張更新:2024 年醫學會議最新動態 ADCT-602 (CD22):2024 年第 1 階段研究的其他數據更新探索潛在的合作伙伴關係和許可協議 Cash Runway 到 2025 年第四季度支持公司度過創造價值的里程碑* H em at ol ol og y ADCT‐601 (AXL):其他數據2024年肉瘤、胰腺癌和非小細胞肺癌的1期研究的最新進展臨牀前:推進研究性ADC的投資組合;2024年第二季度的研究投資者活動所以 lid t um 或 s *Cash runway 假設根據公司的合作協議收到預期的監管里程碑付款,並使用貸款協議要求維持的金額

2023 年第四季度財報電話會議
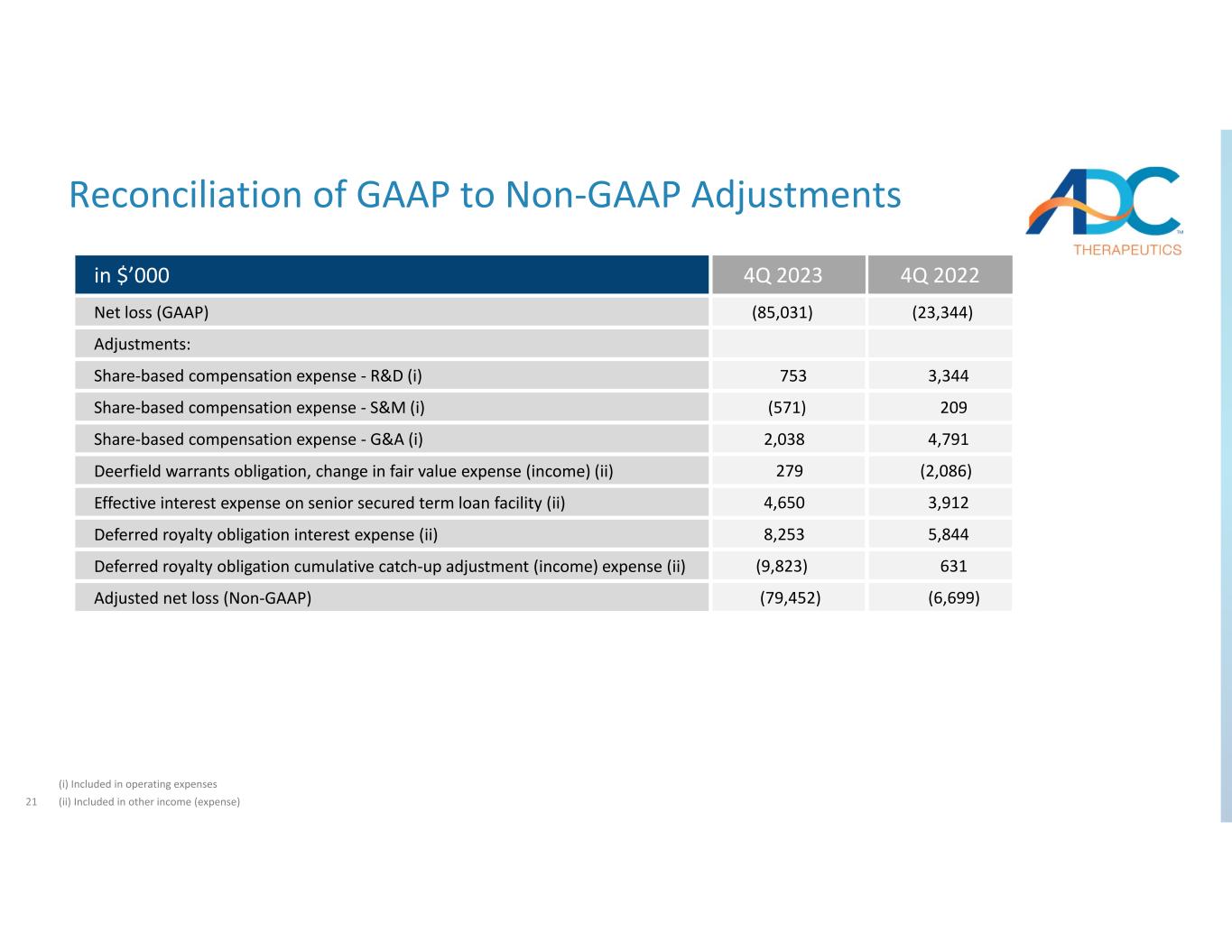
21 GAAP與非公認會計準則調整的對賬(i)包含在運營費用中(ii)2023年第四季度以000美元(23,344)(85,031)淨虧損(GAAP)調整:3,344 753基於股份的薪酬支出研發—(i)209(571)基於股份的薪酬支出——S&M(i)4,791 2,091 38 基於股份的薪酬支出‐G&A (i) (2,086) 279Deerfield 認股權證債務、公允價值支出(收益)變動 (ii) 3,912 4,650 優先有擔保定期貸款機制的實際利息支出 (ii) 5,844 8,253 遞延特許權使用費債務利息費用 (ii) 631 (9,823) 遞延特許權使用費債務累計補繳調整(收益)支出 (ii) (6,699) (79,452) 調整後淨虧損(非公認會計準則)