
附錄 99.1

ADC Therapeutics 業務概覽 Cowen 會議,2024 年 3 月 5 日

2 前瞻性陳述本演示文稿及任何隨附的口頭陳述由ADC Therapeutics SA(“ADC Therapeutics”、“我們” 或 “我們”)編寫,僅供參考,不用於任何其他目的。本演示文稿中包含的任何內容都不是,也不應被解釋為主講人或ADC Therapeutics或ADC Therapeutics的任何高管、董事、員工、代理人或顧問的建議、承諾或陳述。本演示文稿並不旨在包羅萬象,也不包含您可能想要的所有信息。本陳述中提供的信息以及隨附的任何口頭陳述僅適用於截至本文發佈之日。本演示文稿包含1995年《私人證券訴訟改革法》安全港條款所指的前瞻性陳述。在某些情況下,您可以使用 “可能”、“假設”、“將”、“應該”、“將”、“期望”、“打算”、“計劃”、“預期”、“相信”、“估計”、“預測”、“潛在”、“看起來”、“尋找”、“未來”、“繼續” 或 “出現” 或否定這些術語或否定詞語來識別前瞻性陳述類似的表達方式,儘管並非所有前瞻性陳述都包含這些識別詞。前瞻性陳述受某些風險和不確定性的影響,這些風險和不確定性可能導致實際結果與所描述的結果存在重大差異。可能導致這種差異的因素包括但不限於:Zynlonta2023年第四季度的實際收入,公司更新後的公司戰略的成功;2025年第四季度初的預期現金流,新商業進入市場戰略的有效性,來自新技術的競爭,Comp Any在美國增長ZYNLONTA® 收入的能力;瑞典Orphan Biovitrum AB(Sobi)®) 有能力在歐洲經濟區成功實現ZYNLONTA® 商業化,市場接受度高,報銷範圍充足,以及未來的收入;國家藥監局批准了Overland ADCT BioPharma在中國提交的ZYNLONTA® 的BLA及其未來收入;我們的戰略合作伙伴,包括麻省理工學院田邊製藥公司,在外國司法管轄區獲得監管部門批准ZYNLONTA® 的能力,以及此類合作伙伴關係未來收入和向我們付款的時間和金額;公司的時機和結果或其合作伙伴的研發項目或臨牀試驗,包括LOTIS 5和7、ADCT 601和602以及IIT在佛羅裏達州和馬裏蘭州,以及對某些具有不同靶標、連接劑和有效載荷的實體瘤的早期研究;公司產品或候選產品的監管申報的時間和結果;FDA或外國監管機構的行動;預計的收入和支出;公司的債務,包括醫療保健特許權使用費管理以及藍貓頭鷹和橡樹設施,以及此類債務對公司活動施加的限制,遵守能力各種年齡補助金的條款並償還此類債務以及償還此類債務所需的大量現金;以及公司為其研究、開發、臨牀和商業活動獲得財務和其他資源的能力。有關這些因素和其他可能導致實際業績與前瞻性陳述中的預期存在重大差異的因素的更多信息載於公司20-F表年度報告的 “風險因素” 部分以及公司向美國證券交易委員會提交的其他定期和當前報告以及文件中。這些陳述涉及已知和未知的風險、不確定性和其他因素,這些因素可能導致實際業績、業績、成就或前景與此類前瞻性陳述所表達或暗示的任何未來業績、業績、成就或前景存在重大差異。該公司提醒投資者不要過分依賴本文件中包含的前瞻性陳述。前瞻性陳述基於我們管理層的信念和假設以及管理層目前可獲得的信息。無法保證將來會取得這樣的結果。本演講中所載的此類前瞻性陳述僅代表截至本次演講之日。除非適用法律要求,否則公司明確披露任何義務或承諾更新本演示文稿中包含的這些前瞻性陳述,以反映我們期望的任何變化或此類聲明所依據的事件、條件或情況的任何變化。對於任何此類前瞻性陳述的準確性,不作任何陳述或保證(明示或暗示)。本演示文稿中包含的某些信息涉及或基於第三方來源的研究、出版物、調查和其他數據以及我們自己的內部估計和研究。儘管我們認為截至本演示之日這些第三方來源是可靠的,但我們尚未獨立核實,對於從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性,我們也沒有做出任何陳述。此外,本演示文稿中包含的所有市場數據都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。最後,儘管我們認為自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。

3 ADC 治療概覽實體瘤在臨牀中推進靶向 AXL 的 ADCT-601 和多個在研的 ADC 血液學在 3L+ DLBCL 中最大化 ZYNLONTA®,並尋求擴展到早期的 DLBCL 和惰性淋巴瘤系列;將靶向 CD22 企業現金跑道的 ADCT-602 推進 2025 年第四季度,在 2024 年使用多種催化劑平臺憑藉強大的技術工具箱和專業終端開創性 ADC 領域-終端能力 ADC:抗體藥物偶聯物;DLBCL:瀰漫性大 B 細胞淋巴瘤

4 個關鍵業務更新 DLT:劑量——限制毒性;MTD:最大耐受劑量。注意:財務狀況未經審計。▪ 截至2023財年末現金流約為2.785億美元 ▪ 現金流預計將延續至2025年第四季度;與2022年相比,2023年運營支出下降兩位數 ▪ LOTIS-7(使用雙特異性劑的ZYNLONTA):清除了前兩個劑量隊列,沒有DLT且有抗腫瘤活性的早期跡象 ▪ LOTIS-5(ZYNLONTA含利妥昔單抗的ZYNLONTA)): 2023 年加速入組,完成了三分之二以上的入組 ▪ ADCT-601(靶向 AXL):R 已達到 MTD,目前處於劑量優化階段;e 單一療法和單一療法均出現抗腫瘤活性的早期跡象肉瘤組合 ▪ ADCT-901(靶向 KAAG1):由於劑量增加的療效跡象有限,停止向優先項目重新分配資金 ▪ 2023 年第四季度收入預計約為 1650 萬美元,與 2023 年第三季度管道企業 ZYNLONTA(隆卡妥昔單抗泰西林——lpyl)相比增長了兩位數的百分比注:截至 2024 年 3 月 4 日的更新

5 釋放強大的 ADC 產品組合在血液學和實體瘤領域的價值 DLBCL:瀰漫性大 B 細胞淋巴瘤;FL:濾泡性淋巴瘤;MZL:邊緣區淋巴瘤;NSCLC:非小細胞肺癌;ALL:急性淋巴細胞白血病。短期-中期、中長期血液學產品組合實體瘤產品組合 ZYNLONTA ▪ 在 3L+ DLBCL 中最大化 ZYNLONTA ▪ 尋求將 ZYNLONTA 擴展到早期的 DLBCL 和其他惰性淋巴瘤(例如 FL、MZL)作為首選單劑和組合藥物 ZYNLONTA + 利妥昔單抗(LOTIS-5)YNLONTA + 雙特異性 (LOTIS-7) ADCT-602 (CD22) ▪ 逐步增加和擴大 r/r ALL ADCT-601 (AXL) 的 1 期劑量 ▪ 優化肉瘤、胰腺和 NSCLC 下一代 ADC 中的單一藥物和/或組合擴張劑量 ▪推進研究型 ADC 產品組合 — 基於差異化 exatecan 的有效載荷和新型親水性連接劑 − 靶向 Claudin-6、napi2b、PSMA ▪ 繼續使用一系列有效載荷、連接劑和偶聯技術對未公開靶標進行研究

6 按治療系列劃分的患者比例* DLBCL、FL 和 MZL 佔成熟 B 細胞淋巴瘤的約 60% 1 * 1L (~ 70%) 1L (~ 65%) 1L (~ 61%) DLBCL FL MZL 關鍵:目前批准的當前開發領域推進 B-細胞淋巴瘤 ZYNLONTA 的開發 2L (~ 24%) 2L (~ 27%)) 3L+ (~ 11%) 3L+ (~ 12%) 2023 年美國市值 2、5 年患病率 3 31億美元 2,~10.9 萬名患者 26億美元 2,~61 萬名患者 14億美元 2,約 38 萬名患者 1.根據白血病和淋巴瘤協會的數據;2.Clarivate & Global Data 用於估算美國的市場價值;3.Cerner Enviza CancerMpact 數據庫,2023 年。注意:按療法線劃分的分佈基於發病率、藥物治療人羣。▪ LOTIS-5和LOTIS-7有可能使ZYNLONTA進入2L+ DLBCL。LOTIS-5:20 患者安全運行——數據顯示 ORR 為 80%,CR 為 50%,無新的安全信號;預計在 2024 年加快患者入組/完成——LOTIS-7:劑量——前兩個給藥水平的限制毒性期已獲批准兩組的 ZYNLONTA(90 µg/kg,120 µg/kg);目前在 150 µg/kg 當前發展區域招收患者 ▪ IIT 表明 ZYNLONTA 方案可以提供在 2L+ 高風險 FL(96% ORR,85% CR,N=27)中獲益;印度理工學院研究 2L+ MZL 中的 ZYNLONTA ——這些人羣中未得到滿足的需求意義重大 − 評估監管路徑和綱要策略 ▪ ZYNLONTA 與雙特異性藥物(LOTIS-7)的組合目前正在研究 r/r FL 和 r/r MZL

7 儘管市場高度發展,但Zynlonta在2L+中的組合仍然存在重大機遇 1.Epcoritamab或Glofitamab。資料來源:普特南協會初步研究。關鍵最近批准改用 1L 使用無標準護理學術界 1L(約 30 K 名患者)2L(約 11 萬名患者)3L+(約 6 K 名患者)R-CHOP ~ 35% Polivy + R-CHP R-CHOP Polivy + R-CHP CAR-T 臨牀試驗 Zynlonta CAR-T 臨牀試驗 Zynlonta BSABs 1 Monjuvi + Len Polivy + BR Zynlonta Monjuvi + Len Polivy + BR R-Based Chemo ~ 30% ~ 70% R-Based Chemo Monjuvi + Len Pola-BR ~ 65% ~ 60% ~ 40% CAR-T 臨牀試驗 Salvage +/-ASCT 説明性市場演變 ▪ 儘管最近取得了進步,但真正的 SoC 只存在於 1L 和學術環境中 CAR-T ▪除CAR-T外,市場正在向以現成藥物為基石的組合發展 ▪ 隨着波拉妥珠單抗進入1L,在2L+中使用基於pola的組合進行再治療的可能性可能較小 ▪ 需要在社區中心的2L和3L+以及學術環境中的3L+中使用具有更好療效和耐受性的新組合 ZYNLONTA OPPORTUNITY LOTIS-5 LOTIS-7 ZYNLONTA OPPORTINITY LOTIS-5 LOTIS-7 ZYNLONTA OPPORTINITY LOTIS-5 LOTIS-7 ZYNYNTA Lonta + Bispecifics 組合可以:▪ 在 2L+ 學術環境中與 bsaB 和其他組合相比,可提高療效 ▪ 提高 CRS 率,擴大社區的可及性2L+ Zynlonta + R 的中心有潛力:▪ 以熟悉的安全配置提供具有競爭力的功效 ▪ 成為社區中心的 2L+ 環境中的 SoC,在學術環境中成為 3L+ 環境中的 SoC
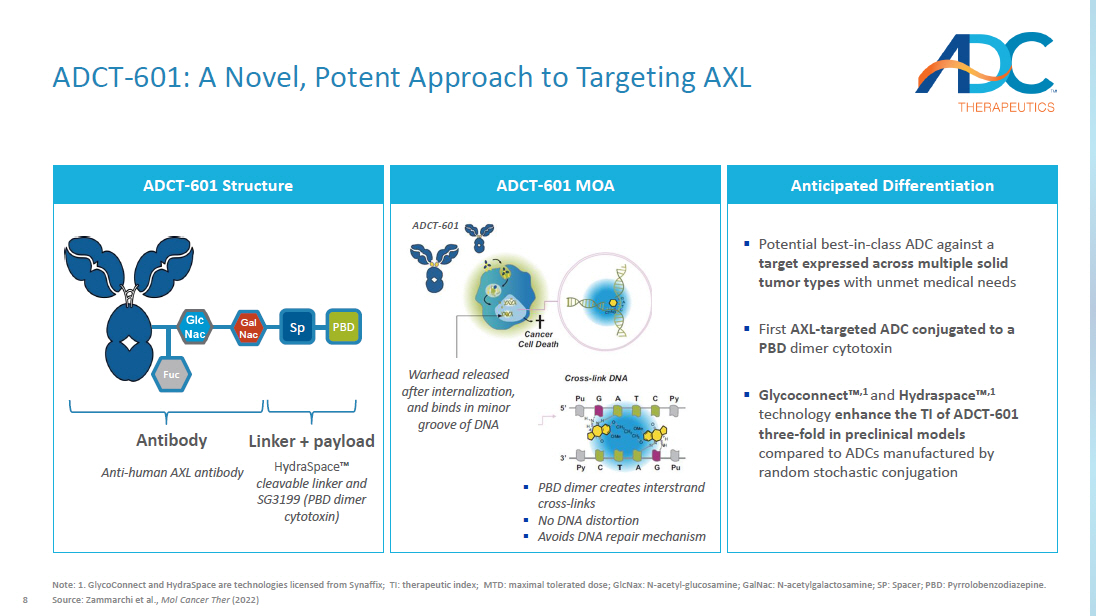
8 ADCT-601:一種靶向 AXL 的新型、有效的方法注:1.GlycoConnect 和 HydraSpace 是 Synaffix 授權的技術;TI:治療指數;MTD:最大耐受劑量;glcNax:N-乙酰-葡萄糖胺;GalnaC:N-乙酰半乳糖胺;SP:間隔;PBD:吡咯苯二氮卓類。來源:Zammarchi 等人,《Mol Cancer Ther》(2022年)ADCT-601 結構預期分化 ▪ 針對在多種未滿足醫療需求的實體瘤類型中表達的靶標的潛在同類最佳抗藥劑 ▪ 第一個 AXL-靶向 ADC 偶聯與 PBD 二聚體細胞毒素 ▪ Glyconnect 適用於由隨機偶聯法制造的 ADC PBD Sp Gal Nac Fuc Fuc HydraSpace Ω 可分解連接劑和 SG3199(PBD 二聚體細胞毒素)抗人類 AXL 抗體抗體鏈接器 + 有效載荷 ADCT-601 MOA 彈頭在內化後釋放,並在 DNA 的小凹槽中結合 ▪ PBD 二聚體產生鏈間交叉鏈接 ▪ 無 DNA 失真 ▪ 避免 DNA 修復機制 ADCT-601

9 ADCT-601 靶向 AXL:理由和區別説明:1 數據截至 2024 年 9 月 2 日。2 基於試驗 601-102 中用於確定高表達/陽性患者的評分算法和截止值:STS = AXL+ 腫瘤 ce lls 2+/ 3+ 強度 ≥ 75%,PAAD = AXL+ 腫瘤細胞 2+/ 3+ 強度 ≥ 10%,NSCLC = 膜 AXL+ 腫瘤細胞 (任何強度)≥ 1%。3 膜表達通常與 2+/3+ 腫瘤細胞的表達相關。▪ 一項 1b 期研究正在進行中,包括一個單一療法組招募肉瘤、胰腺癌和表達 NS 的 AXL 患者對於肉瘤和胰腺癌患者,CLC和與吉西他濱的複方組合 ▪ 達到13mg的推薦劑量;劑量優化正在進行中 o 在肉瘤中,在單一療法中已出現抗腫瘤活性的早期跡象,在測試的劑量範圍內具有可耐受的安全性 ▪ 在胰腺癌中,單一療法組最近啟動了篩查臨牀研究現狀和後續步驟 ▪ AXL在多種腫瘤類型中表達-包括非小細胞肺癌、胰腺和肉瘤 ▪ AXL 的高表達與病情惡化相關這些癌症類型的總存活率高 AXL 表達的病例百分比任何 AXL 表達肉瘤 (STS) 病例的 2% ~ 30% ~ 90% 胰腺腺癌 ~ 35% 60 — 70% 非小細胞肺部 3 20 — 25% 50 — 60% 目標相關性 AXL 表達 1

10 具有一系列有效載荷、連接劑和偶聯技術的成長型工具箱注:1 DAR:藥物抗體比率 Antiby ▪ 在識別和推進具有高度未滿足需求的引人注目的靶標方面擁有豐富的經驗 ▪ 專注於掩蓋結合、條件結合部分、雙特異性和雙偏熱性連接劑 ▪ 專有連接劑,可通過可調的 DAR 1 提高血漿穩定性並控制有效載荷釋放不可分割的連接器 Payload ▪ 將下一代多溴聯苯偽造為新彈頭;第一個帶來 PBD ADC 的彈頭從概念到市場 ▪ 推進下一代有效載荷以提高選擇性、效力、治療指數 — 喜樹鹼衍生物 — DNA 損傷劑 — 免疫調節劑 — 雙有效載荷偶聯技術 ▪ 可實現精確定位的技術 — 不同有效載荷的特定附着 — 正交偶聯方法

11 Exatecan 有可能與 dxD 等商用階段毒素進行差異化注意:1 pgP:P-糖蛋白;2 細胞系衍生異種移植 (CDX) 模型是一種腎平滑肌母細胞瘤模型,全臂靜脈注射 qdx1 來源:Weng 等人,Cancer Discov (2023) EXATECAN V. DXD ▪ 效力更好 ▪ 沒有 pGP 1 運輸,增強細胞內存在感 ▪ 增加旁觀者效應,導致更多細胞死亡,增強治療效果與 dxD Exatecan DxD 載體同型(10 mg/kg)抗體——D Xd(15 mg/kg)抗體——exatecan(6.6 mg/ kg)抗體——exatecan(6.6 mg/ kg)kg) 抗體——依沙替康(10 mg/kg)▪ ADCT 開發了一種新型的親水性連接劑,可實現依沙替康的有效偶聯 ▪ 我們的基於依沙替康的 ADC 可在內化後實現無痕釋放 ▪ 優異的體內療效和出色的耐受性,在 CDX MODEL 2 EXATECAN ADVANTE 中沒有任何跡象的 ILD EXATECAN ADC V. DXD ADC ADC。ADC 療法平臺的優勢

12 目標描述磷酸轉運蛋白粘附蛋白酶糖蛋白氨基酸轉運蛋白腫瘤感興趣的類型 NSCLC 卵巢癌子宮內膜癌前列腺癌 NSCLC 結直腸癌有效載荷 Exatecan Exatecan Exatecan Exatecan Exatecan Exatecan 體外驗證數據體外功效 NHP 毒理學體外表徵 NHP 毒理學正在進行的體外表徵 NHP 毒理學體內功效 NHP 毒理學正在進行的體外表徵 NHP 毒理學 ology 2 候選人選擇 1 完成 2024 年 2024 年 2024 年 ADC 資產對照經驗證的目標高未滿足需求的適應症注意:1項支持IND的研究可以在選擇候選人後的18個月內完成;2項使用嵌合候選藥物Napi2b Claudin完成的NHP研究-6 PSMA未公開的靶標

13 ADCT投資組合的企業業務發展戰略 HEMETALOGY ZYNLONTA,ADCT-602 SOLID TUMOL S ADCT-601,解鎖價值的研究資產業務發展目標:美國EX-美國公司開發與公司-推廣*特許權使用費和里程碑加速和擴大資產開發 3 非稀釋性融資 2 最大化交易價值和價值拆分 1 直接夥伴關係 *可根據經濟狀況靈活選擇其他結構。陸路合資企業

14 Cash Runway 將支持多種潛在的近期價值——推動因素 □ ZYNLONTA:□ 在 2024 年實現商業品牌盈利 □ LOTIS-5:2024 年完成註冊 □ LOTIS-7:2024 年全年的劑量升級和擴張更新 □ 佛羅裏達州和 MZL IIT:2024 年 ADCT-602 (CD22):2024 年 1 期研究的其他數據更新 ▪ 探索潛在的合作伙伴關係和許可協議 ▪ 到2025年第四季度的現金流將支持公司實現價值創造里程碑*血液學 □ ADCT-601(AXL):2024年肉瘤、胰腺和非小細胞肺癌的1期研究的更多數據更新 □ 臨牀前:推進在研的ADC實體瘤產品組合 * Cash runway 假設根據公司的合作協議收到預期的監管里程碑付款,並使用貸款協議要求維持的金額