附錄 99.1
Olema Oncology公佈2023年第四季度和全年財務業績,並提供公司最新情況
舊金山,2024 年 3 月 11 日 — 奧萊馬製藥公司(“Olema”,“Olema Oncology”,納斯達克股票代碼:OLMA)是一家臨牀階段的生物製藥公司,專注於女性癌症靶向療法的發現、開發和商業化,今天公佈了截至2023年12月31日的第四季度和全年財務業績,並提供了公司最新情況。
“2023年,我們展示了palazestrant未來的難得機會,可以對改善ER+/HER2-乳腺癌女性的治療選擇產生有意義的影響。我們認為,palazestrant對野生型和ESR1突變乳腺癌的活性及其安全地與ribociclib聯合使用的能力使這種新興的雌激素受體靶向療法具有高度差異。” Olema Oncology總裁兼首席執行官肖恩·博恩醫學博士説。“我們最近完成了對60名患者的120毫克palazestrant與600毫克ribociclib聯合使用的2期研究的入組,我們期待在2024年ESMO乳腺癌年度大會上分享這項研究的最新情況。除了 palazestrant 之外,我們最近還宣佈了 KAT6 項目 OP-3136 的候選開發項目,並且我們正朝着在今年年底之前提交IND申請的方向邁進。我們在Olema的使命是改善患有癌症的女性的生活,我們對所取得的進展感到非常滿意。”
近期企業要聞
即將舉行的里程碑
第四季度和2023年全年財務業績
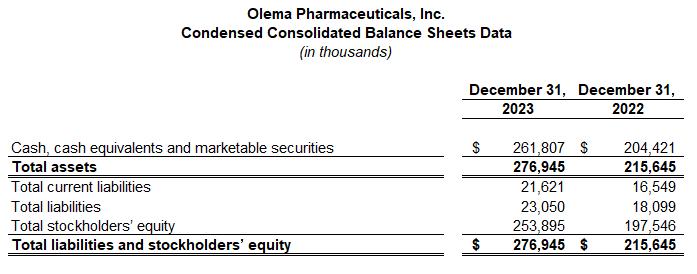
截至2023年12月31日,現金、現金等價物和有價證券為2.618億美元。
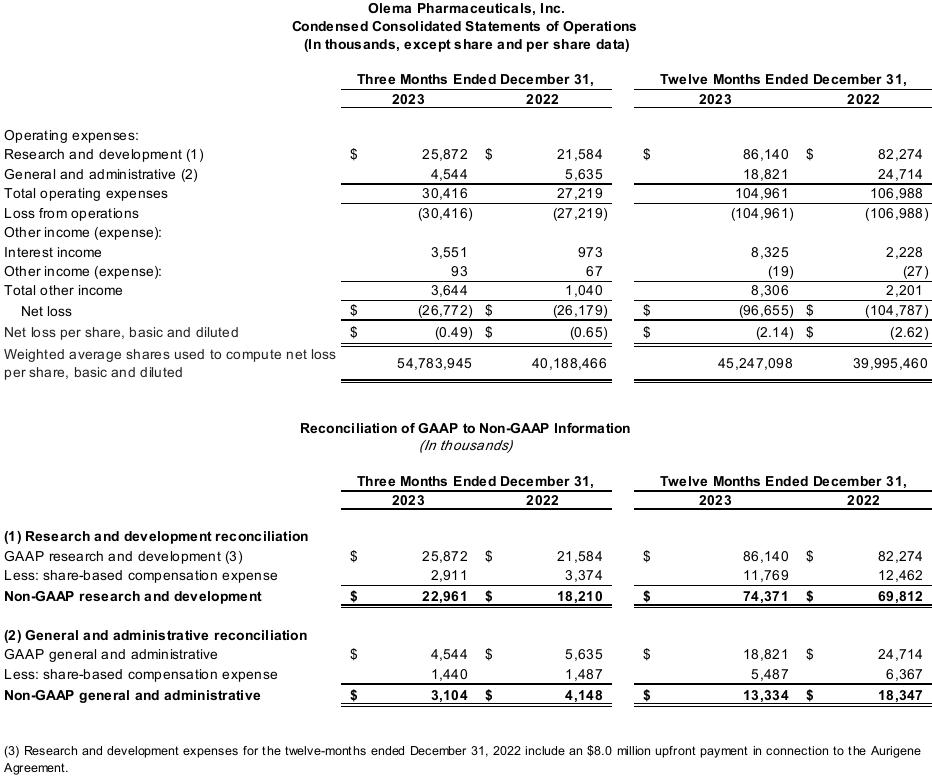
截至2023年12月31日的季度和年度的淨虧損分別為2680萬美元和9,670萬美元,而截至2022年12月31日的季度和年度的淨虧損分別為2620萬美元和1.048億美元。隨着Olema繼續將palazestrant推進到後期臨牀試驗,第四季度淨虧損的增加主要與臨牀運營和開發相關活動的支出增加有關,包括人事相關費用。這一增長被一般和行政活動支出的減少以及有價證券的利息收入增加所抵消。2023年全年淨虧損的減少主要是由於有價證券的利息收入增加。
截至2023年12月31日的季度和年度,GAAP研發(R&D)支出分別為2590萬美元和8,610萬美元,而截至2022年12月31日的季度和年度的GAAP研發(研發)支出分別為2,160萬美元和8,230萬美元。的增加
研發費用主要是由於隨着Olema繼續將palazestrant推進到後期臨牀開發階段,臨牀運營和開發相關活動的支出增加,包括人事相關成本,但這被研究相關活動支出的減少所抵消。
截至2023年12月31日的季度和年度的非公認會計準則研發費用分別為2300萬美元和7,440萬美元,其中分別不包括290萬美元和1180萬美元的非現金股票薪酬支出。截至2022年12月31日的季度和年度的非公認會計準則研發費用分別為1,820萬美元和6,980萬美元,其中分別不包括340萬美元和1,250萬美元的非現金股票薪酬支出。本新聞稿中使用的GAAP與非GAAP財務指標的對賬可以在本新聞稿的末尾找到。
截至2023年12月31日的季度和年度,GAAP併購支出分別為450萬美元和1,880萬美元,而截至2022年12月31日的季度和年度的GAAP併購支出分別為560萬美元和2,470萬美元。併購費用的減少主要是由於公司和法律相關費用以及人事相關支出減少。
截至2023年12月31日的季度和年度的非公認會計準則併購支出分別為310萬美元和1,330萬美元,其中分別不包括140萬美元和550萬美元的非現金股票薪酬支出。截至2022年12月31日的季度和年度,非公認會計準則併購支出為410萬美元和1,830萬美元,分別不包括150萬美元和640萬美元的非現金股票薪酬支出。本新聞稿中使用的GAAP與非GAAP財務指標的對賬可以在本新聞稿的末尾找到。
關於 Palazestrant (OP-1250)
Palazestrant(OP-1250)是一種新型的口服小分子,具有雙重活性,既是完整的雌激素受體(ER)拮抗劑(CERAN),又是選擇性ER降解劑(SERD)。目前正在復發、局部晚期或轉移性ER陽性(ER+)、人類表皮生長因子受體2陰性(HER2-)乳腺癌患者中進行研究。在臨牀研究中,palazestrant完全阻斷了野生型和突變型轉移性ER+乳腺癌中ER驅動的轉錄活性,並顯示出抗腫瘤活性以及誘人的藥代動力學和暴露量、良好的耐受性、中樞神經系統穿透性以及與CDK4/6抑制劑的組合性。Palazestrant已被美國食品藥品監督管理局(FDA)授予快速通道資格,用於治療ER+/HER2-轉移性乳腺癌,該轉移性乳腺癌在一條或多條內分泌治療中至少有一條藥物與CDK4/6抑制劑聯合使用。目前正在進行的 3 期臨牀試驗 OPERA-01 和使用 CDK4/6 抑制劑(palbociclib 和 ribociclib)和 pi3KA 抑制劑(alpelisib)的 2 期聯合研究中,它既是作為單一藥物進行評估。欲瞭解更多信息,請訪問 www.opera01study.com。
關於 Olema Oncol
Olema Oncology是一家處於臨牀階段的生物製藥公司,致力於改變癌症女性的護理標準並改善其療效。Olema利用我們對內分泌驅動的癌症、核受體和獲得性耐藥機制的深刻理解,正在推進一系列新療法。除了我們的主要候選產品palazestrant(OP-1250)(一種專有的口服完全雌激素受體(ER)拮抗劑(CERAN)和選擇性ER降解劑(SERD)外,Olema還在開發一種有效的KAT6抑制劑。Olema 總部位於舊金山,在馬薩諸塞州劍橋開展業務。欲瞭解更多信息,請訪問我們的網站 www.olema.com。
非公認會計準則財務信息
本新聞稿中公佈的結果包括GAAP信息和非GAAP信息。在本新聞稿中,Olema將非公認會計準則研發費用定義為不包括股票薪酬支出在內的GAAP研發費用,而非GAAP併購支出由Olema定義為不包括股票薪酬支出在內的GAAP併購費用。我們使用這些非公認會計準則財務指標來評估我們的持續運營以及內部規劃和預測目的。我們認為,非公認會計準則財務信息合起來可能會對投資者有所幫助,因為它提供了與過去財務表現的一致性和可比性。但是,非公認會計準則財務信息僅用於補充信息的目的,作為分析工具存在侷限性,不應孤立地考慮,也不能作為根據公認會計原則提供的財務信息的替代品。其他公司,包括我們行業中的公司,可能會以不同的方式計算標題相似的非公認會計準則指標,或者可能使用其他指標來評估其業績,所有這些都可能降低我們的非公認會計準則財務指標作為比較工具的用處。鼓勵投資者審查相關的GAAP財務指標以及這些非GAAP財務指標與其最直接可比的GAAP財務指標的對賬情況,不要依賴任何單一財務指標來評估我們的業務。
前瞻性陳述
根據1933年《證券法》第27A條和1934年《證券交易法》第21E條的定義,本新聞稿中包含的有關非歷史事實事項的陳述是 “前瞻性陳述”。諸如 “預期”、“相信”、“可能”、“期望”、“目標”、“可能”、“潛力”、“意願” 等詞語和類似表達(以及其他提及未來事件、條件或情況的詞語或表達)旨在識別前瞻性陳述。這些陳述包括與Olema的財務狀況和資源、經營業績、現金狀況、Olema關鍵的3期單一療法臨牀試驗(OPERA-01)的時間表、潛在臨牀研究的啟動和註冊時間表,以及作為單一療法和聯合試驗的palazestrant(OP-1250)臨牀試驗結果,潛在的有益特徵,包括但不限於palazezestrant()的安全性、耐受性、療效和治療效果 palazestrant 的改善潛力ER+/HER2-乳腺癌女性的治療選擇或結果、palazestrant 與其他藥物的複用性,以及 Olema 臨牀前計劃的充足性和時機,包括其潛在的有益特徵
其KAT6抑制劑化合物,對乳腺癌和其他癌症的適用性以及潛在的IND申請時機。由於此類聲明涉及未來事件並基於Olema當前的預期,因此它們受到各種風險和不確定性的影響,並且Olema的實際業績、表現或成就可能與本新聞稿中聲明中描述或暗示的結果存在重大差異。這些前瞻性陳述受風險和不確定性的影響,包括但不限於Olema截至2023年12月31日止年度的10-K表年度報告中標題為 “風險因素” 的部分中討論的風險和不確定性,以及Olema不時向美國證券交易委員會提交的未來文件和報告。除非法律要求,否則Olema沒有義務更新這些前瞻性陳述,包括在實際業績與前瞻性陳述中的預期有重大差異的情況下。

# # #
投資者關係和媒體聯繫人:
Geoffrey Mogilner,投資者關係與傳播副總裁
ir@olema.com