

開發應對癌症免疫耐藥性的下一代免疫療法 KA(納斯達克)2024 年 3 月附錄 99.2

免責聲明和其他信息關於前瞻性陳述的警示性陳述本演示文稿包含1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”。使用但不限於 “相信”、“期望”、“估計”、“計劃”、“打算”、“未來”、“潛在”、“繼續”、“可能”、“可能”、“計劃”、“將”、“應該”、“尋求”、“預測” 或 “可能” 等詞語以及其他類似的詞語或表述旨在識別前瞻性陳述。前瞻性陳述既不是歷史事實,也不是對未來表現的保證。相反,它們基於Kineta當前對Kineta業務未來、未來計劃和戰略、臨牀結果和其他未來狀況的信念、期望和假設。新的風險和不確定性可能會不時出現,因此不可能預測所有的風險和不確定性。對於任何此類前瞻性陳述的準確性,不作任何陳述或保證(明示或暗示)。此類前瞻性陳述受許多重大風險和不確定性的影響,包括但不限於:Kineta支持其未來運營的資金是否充足,以及成功啟動和完成臨牀試驗的能力;難以預測Kineta候選產品的開發時間和成本;Kineta研究、開發和商業化其當前和未來候選產品的計劃,包括但不限於 KVA12123;Kineta的時機和預期結果 Eta計劃的臨牀前研究以及臨牀試驗,以及Kineta臨牀前研究和臨牀試驗的結果可能無法預測與未來研究或臨牀試驗相關的未來結果的風險;Kineta臨牀試驗數據可用時間;任何計劃中的研究性新藥申請或新藥申請的時間;停止或推遲任何正在進行或計劃中的Kineta或其合作者的臨牀試驗的風險;臨牀效用、潛在益處和市場接受度 Kineta的候選產品;Kineta的候選產品商業化、營銷和製造能力和戰略;與Kineta競爭對手及其行業相關的發展和預測;政府法律法規的影響;Kineta計劃與監管機構互動的時間和結果;Kineta保護其知識產權地位的能力;Kineta對未來收入、支出、資本要求和額外融資需求的估計;與生物技術公司資本市場波動性和不確定性相關的風險;可用性哪些合適的第三方可以進行預期的戰略交易;Kineta是否能夠進行戰略交易,或者任何交易如果進行,是否將以有吸引力的條件或完全完成;以及Kineta於2023年3月31日向美國證券交易委員會(“SEC”)提交的最新10-K表年度報告和向美國證券交易委員會提交的10-Q表季度報告中 “風險因素” 標題下列出的風險 2023 年 5 月 11 日、2023 年 8 月 11 日和 2023 年 11 月 3 日,以及關於潛在風險的討論,Kineta隨後向美國證券交易委員會提交的文件中的不確定性和其他重要因素。任何前瞻性陳述僅代表其發表之日。除非法律要求,否則Kineta沒有義務公開更新或修改任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。

KVA12123:VISTA阻斷單抗以解決TME正在進行的1/2期臨牀研究中的免疫抑制問題,該研究評估了單獨使用 KVA12123 以及與pembrolizumab聯合治療晚期實體瘤的前 5 個單一療法隊列和前兩個組合隊列,無劑量限制毒性,超過 90% 的VISTA受體佔用率生物標誌物顯示與療效相關的細胞因子分泌以及在單一療法中觀察到的抗腫瘤免疫細胞亞羣的顯著變化長期穩定疾病以及聯合療法的部分反應 2Q24:額外的單一療法24 年第 2 季度安全性和有效性數據:初始聯合療法數據以先天免疫為重點的產品線預計的 KVA12123 催化劑 Kineta 正在開發下一代免疫療法,以解決癌症免疫耐藥性,潛在的里程碑式付款加上淨銷售的特許權使用費合作伙伴目前正在探索戰略替代方案
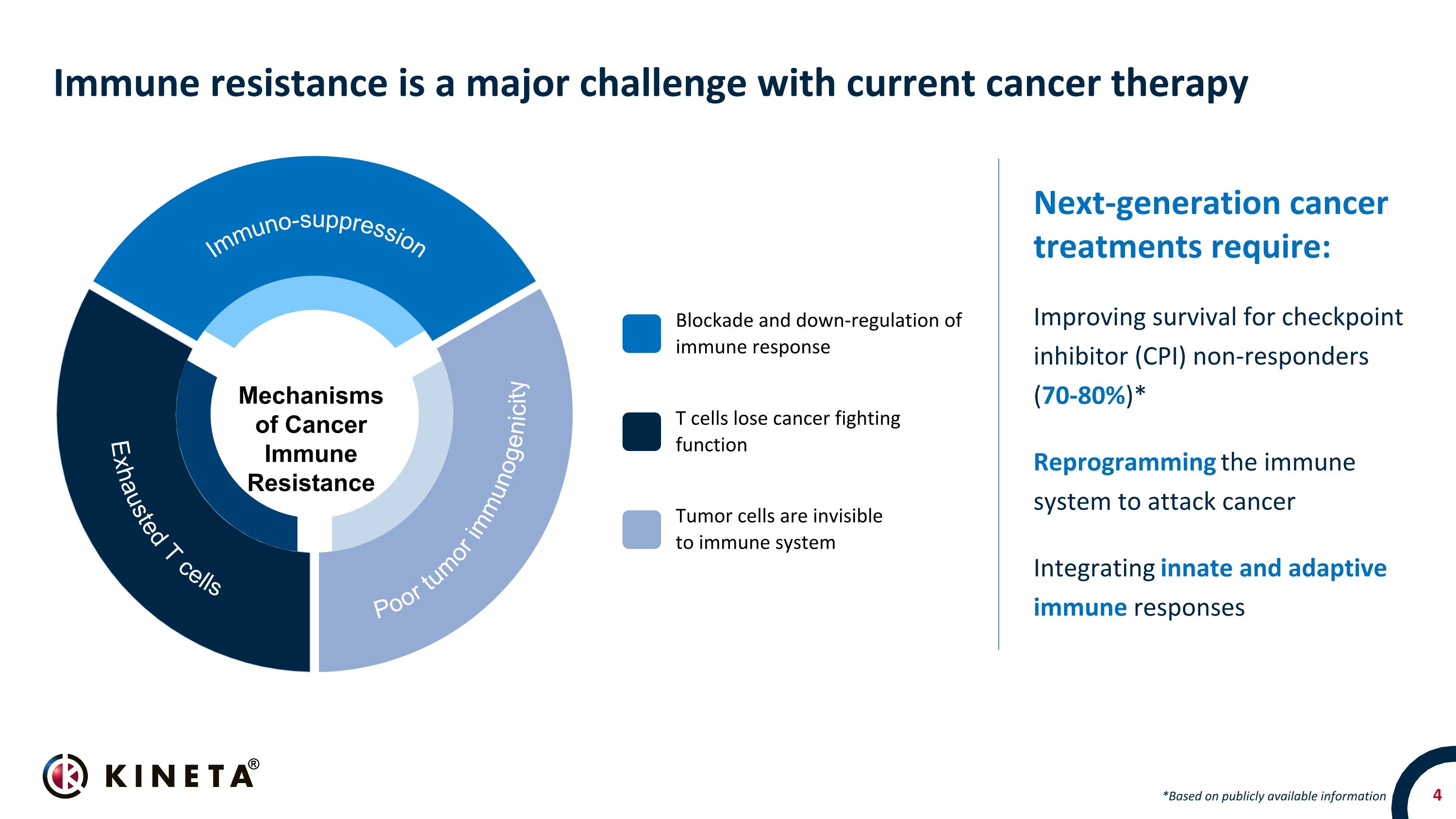
免疫耐藥性是當前癌症療法的主要挑戰下一代癌症治療需要:提高檢查點抑制劑(CPI)無反應者的存活率(70-80%)* 重編免疫系統以攻擊癌症整合先天和適應性免疫反應 *根據公開信息 T 細胞失去抗癌功能癌症免疫耐藥機制腫瘤免疫原性不佳免疫抑制
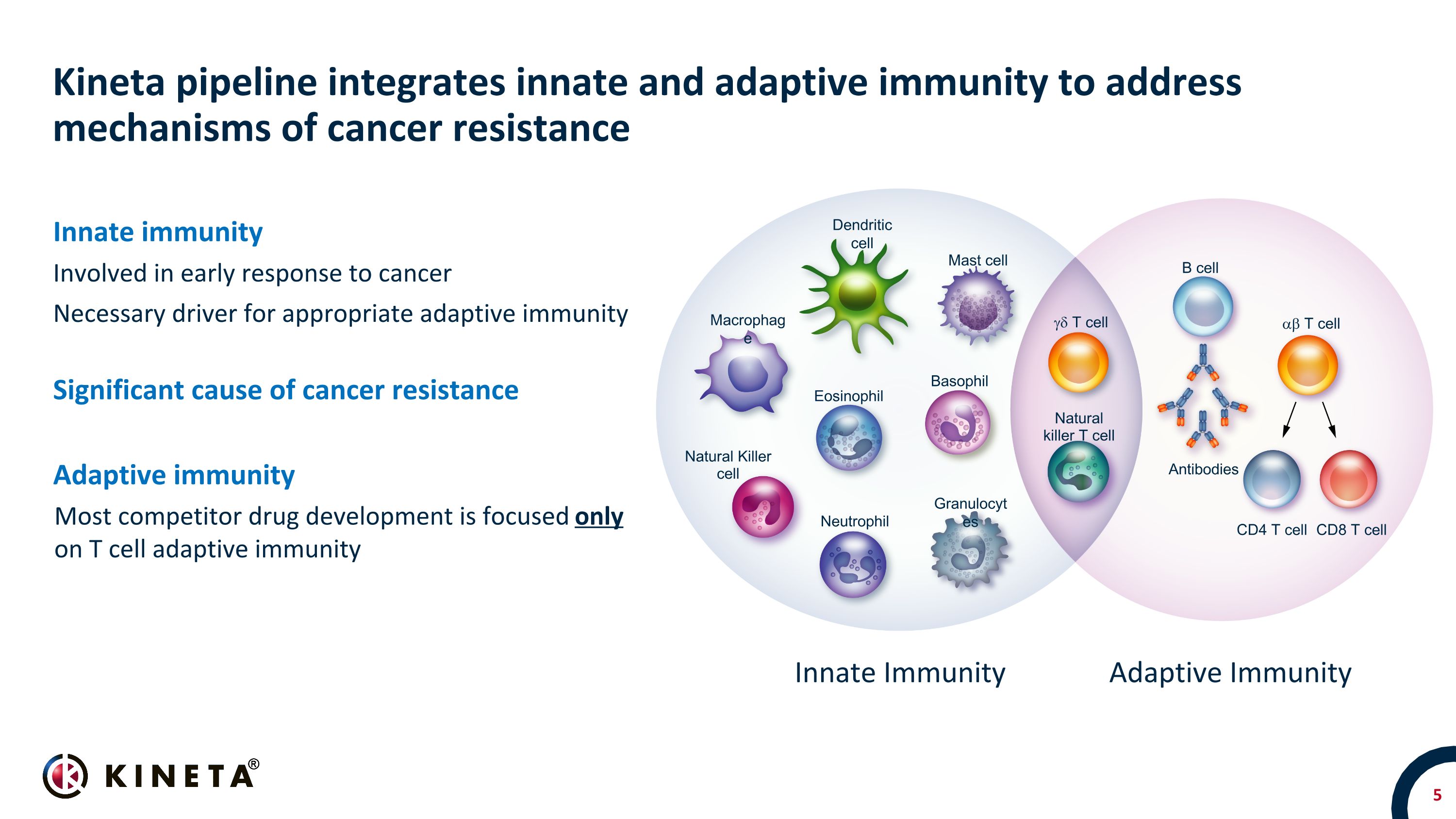
Kineta 管道整合了先天免疫和適應性免疫以解決癌症耐藥機制先天免疫參與癌症早期反應的適當適應性免疫的必要驅動因素癌症耐藥的重要原因適應性免疫大多數競爭對手的藥物研發僅專注於先天免疫適應性免疫樹突狀細胞巨噬細胞肥大細胞嗜酸粒細胞中性粒細胞自然殺傷細胞粒細胞 gd t 細胞自然殺傷 CD細胞 B 細胞抗體 4 T 細胞 CD8 T 細胞 ab T 細胞
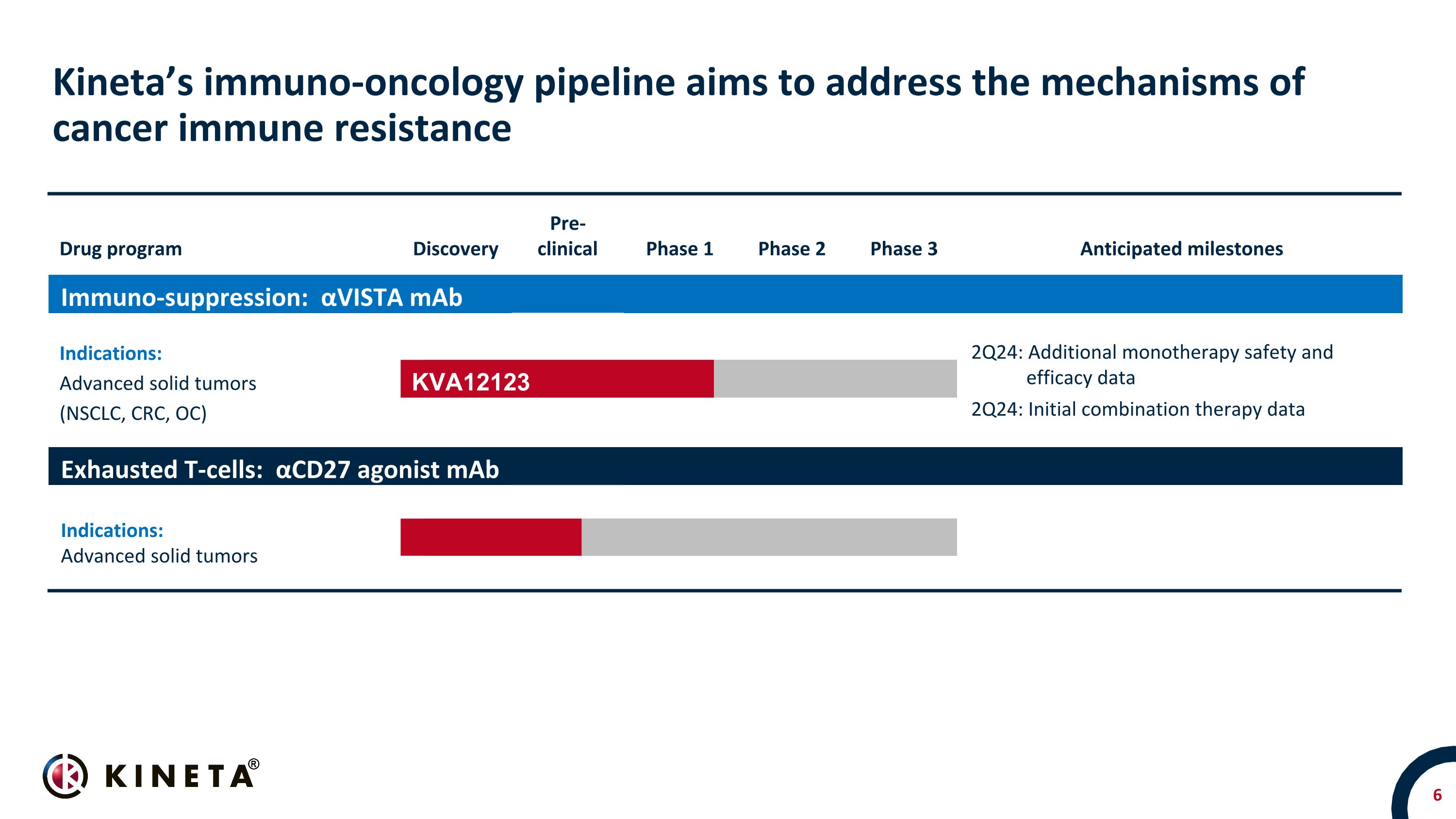
Kineta的免疫腫瘤學產品線旨在解決癌症免疫耐藥性的機制藥物項目發現臨牀前1期2期3期預期里程碑免疫抑制:αVista mAb適應症:晚期實體瘤(NSCLC、CRC、OC)晚期實體瘤 NSCLC、CRC、OC、RCC和SCCHN* 2Q24:其他單一療法安全性和有效性數據 2Q24:初始組合療法數據耗盡 T 細胞:αCD27 激動劑 mAb 適應症:晚期實體瘤晚期實體瘤 KVA12123

KVA12123潛在差異化的 VISTA 阻斷免疫療法
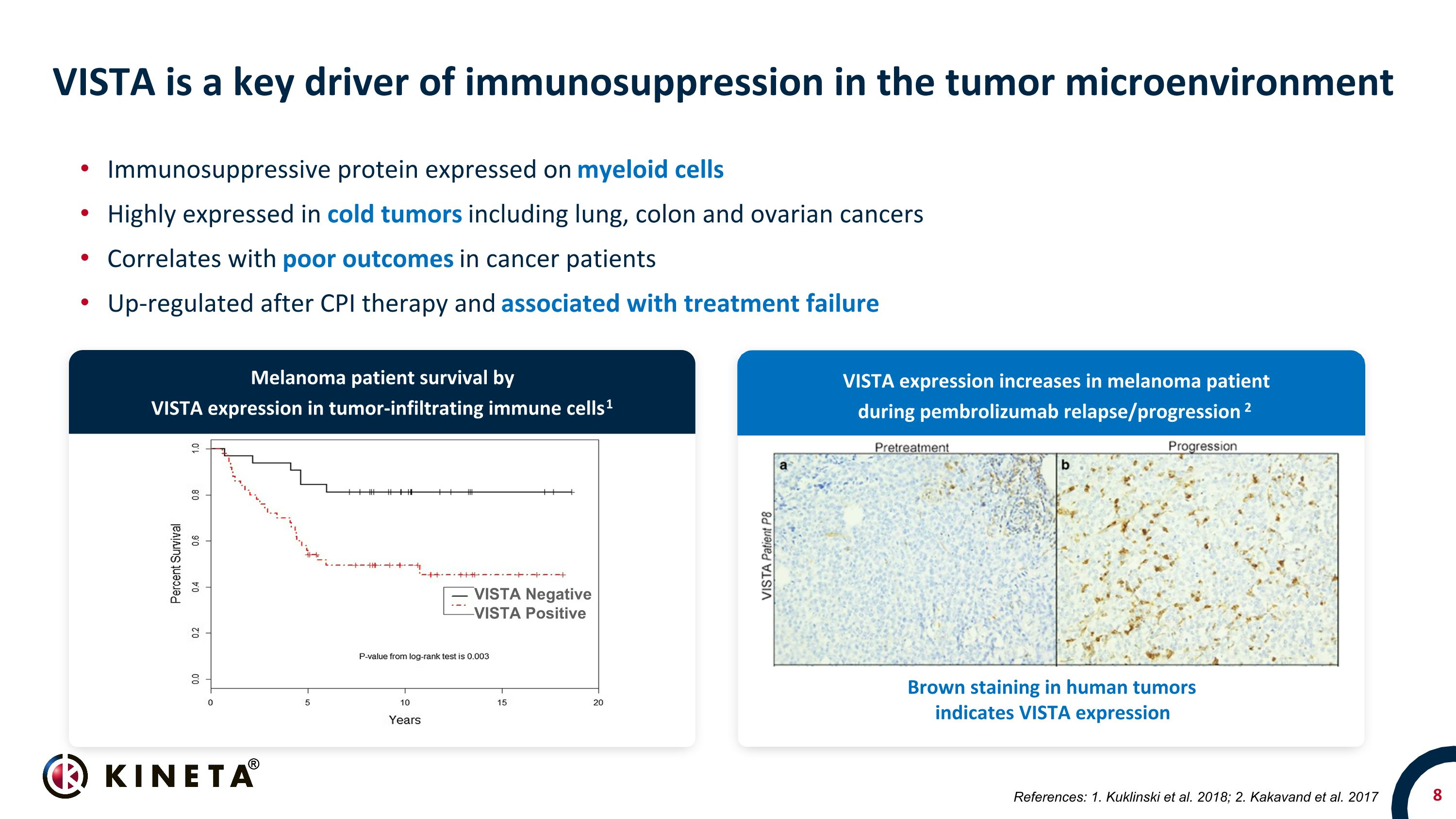
VISTA 是腫瘤微環境中免疫抑制的關鍵驅動因素骨髓細胞上表達的免疫抑制蛋白在包括肺癌、結腸癌和卵巢癌在內的冷腫瘤中高度表達與癌症患者預後不良相關 CPI 治療後出現上調且與治療失敗有關 VISTA 陰性 VISTA 人腫瘤浸潤免疫細胞中的表達 VISTA 表達表明黑色素瘤患者存活率 1 黑色素瘤患者的 VISTA 表達增加在 pembrolizumab 復發期間/進展 2 參考文獻:1.庫克林斯基等人,2018 年;2.Kakavand 等人。2017
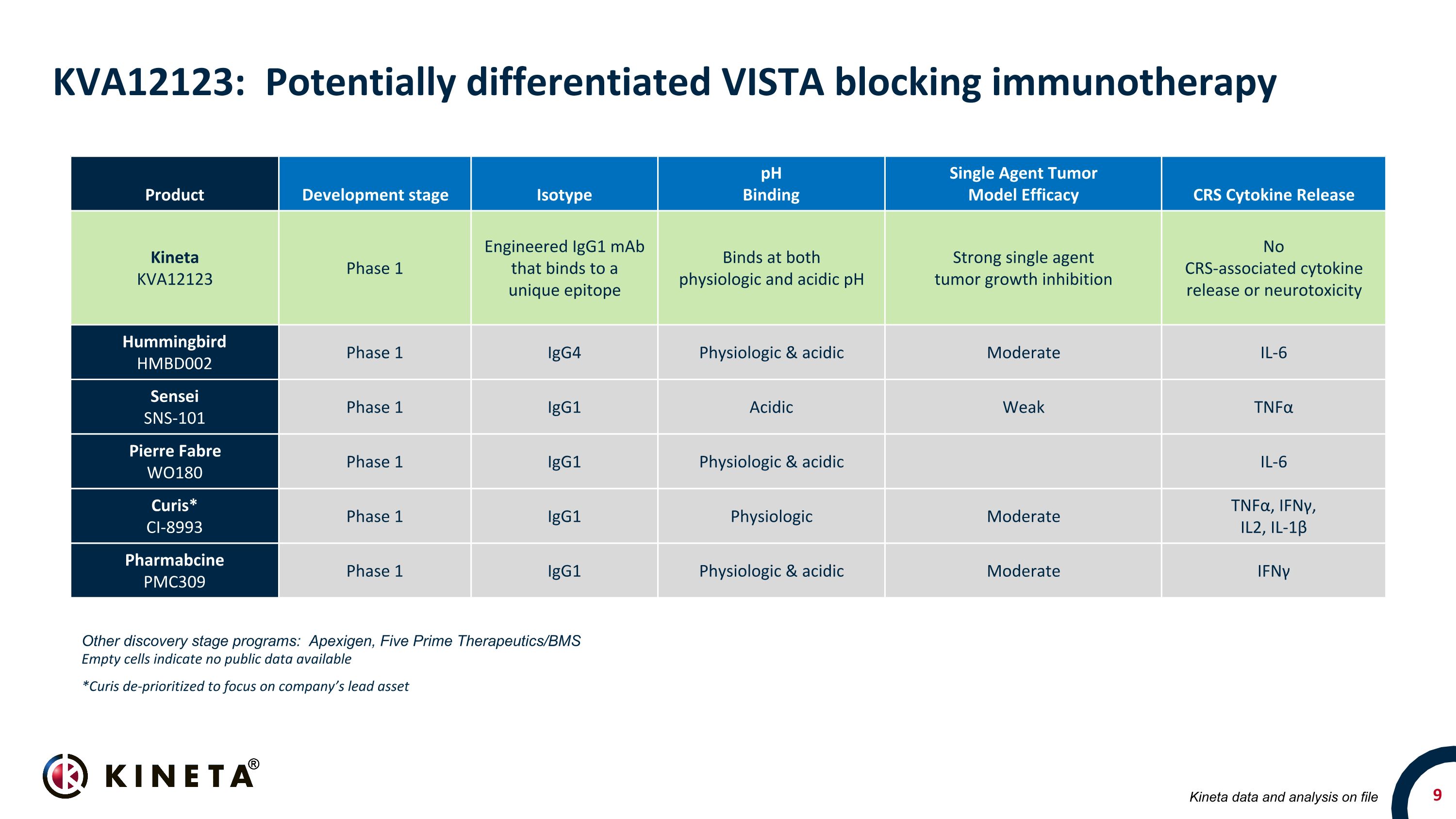
KVA12123:潛在差異化的 VISTA 阻斷免疫療法產品開發階段同型 pH 結合單藥腫瘤模型功效 CRS 細胞因子釋放 Kineta KVA12123 1 期工程化的 IgG1 單抗在生理和酸性 pH 值下結合強力單藥腫瘤生長抑制沒有 CRS 相關的細胞因子釋放或神經毒性蜂鳥 HMBD002 第 1 期 IgG4 生理和酸性中度 IL-6 Sensei SNS-101 第 1 階段 IgG1 酸性弱 TNFα Pierre Fabre WO180 第 1 期 IgG1 生理和酸性 IL-6 Curis* CI-8993 階段 1IgG1 生理中度腫瘤壞死因子α、IFNγ和IL-1β Pharmaccine PMC309 第一期 IgG1 生理和酸性中度 IFNγ其他發現階段項目:Apexigen、Five Prime Therapeutics/BMS 空細胞表示沒有公開數據 *Curis 將重點放在存檔的公司主要資產 Kineta 數據和分析上
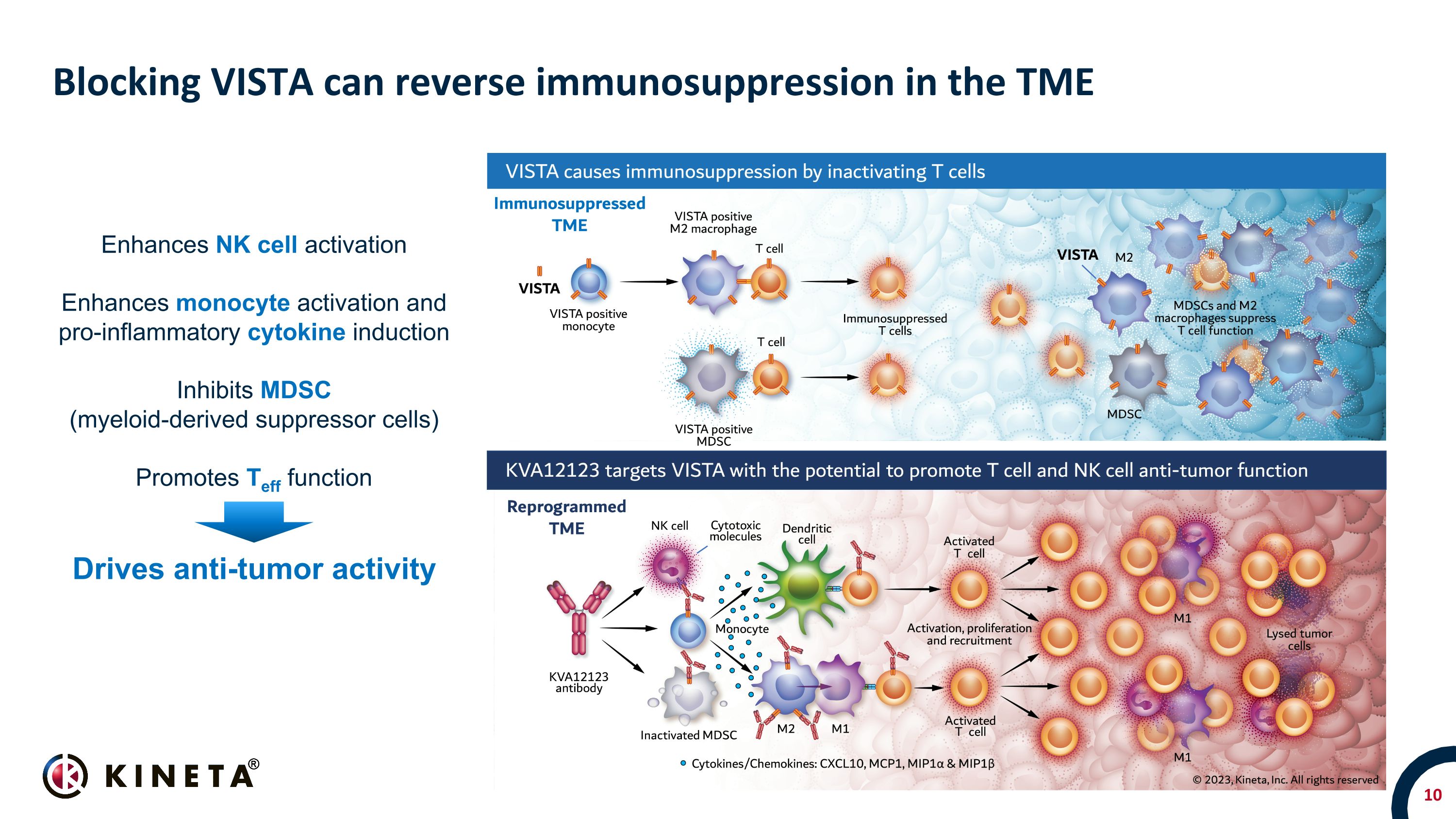
阻斷 VISTA 可以逆轉 TME 中的免疫抑制增強 NK 細胞活化增強單核細胞激活和促炎細胞因子誘導抑制 MDSC(骨髓衍生抑制細胞)促進 Teff 功能推動抗腫瘤活性
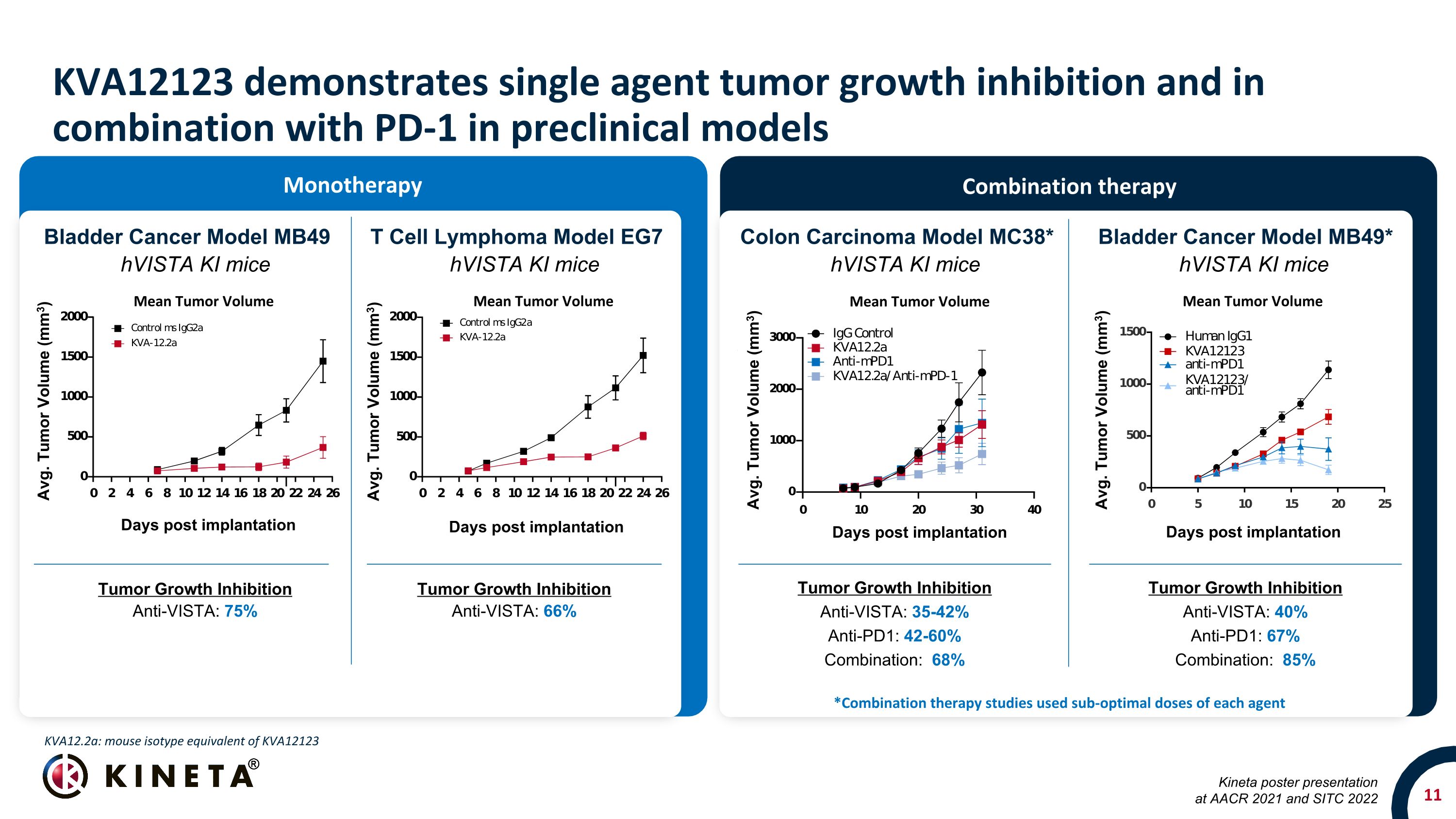
KVA12123 表現出單一藥物腫瘤生長抑制作用,在臨牀前模型中與 PD-1 聯合使用腫瘤生長抑制劑:35-42% 抗 PD1:42-60% 組合:68% 結腸癌模型 MC38* 膀胱癌模型 MB49 T 細胞淋巴瘤模型 EG7 HVista KI 小鼠 hVista KI 小鼠 hVista KI 小鼠膀胱癌模型 MB49* hVista KI 小鼠腫瘤生長抑制抗體:40% 抗 PD1:67% 組合:85% 腫瘤生長抑制抗 VISTA:75% 腫瘤生長抑制抗 VISTA:66% *組合療法研究使用的每種藥物的劑量都不理想Kva12.2a:在 AACR 2021 上發佈的 KVA12123 Kineta 海報和 SITC 2022 單一療法聯合療法植入後的平均腫瘤體積天數的小鼠同種型平均值。腫瘤體積 (mm3) 植入後的平均腫瘤體積天數平均值腫瘤體積 (mm3) 平均值腫瘤體積 (mm3) 植入後天數平均值腫瘤體積 (mm3) 植入後的平均腫瘤體積天數平均值腫瘤體積 (mm3) 平均腫瘤體積
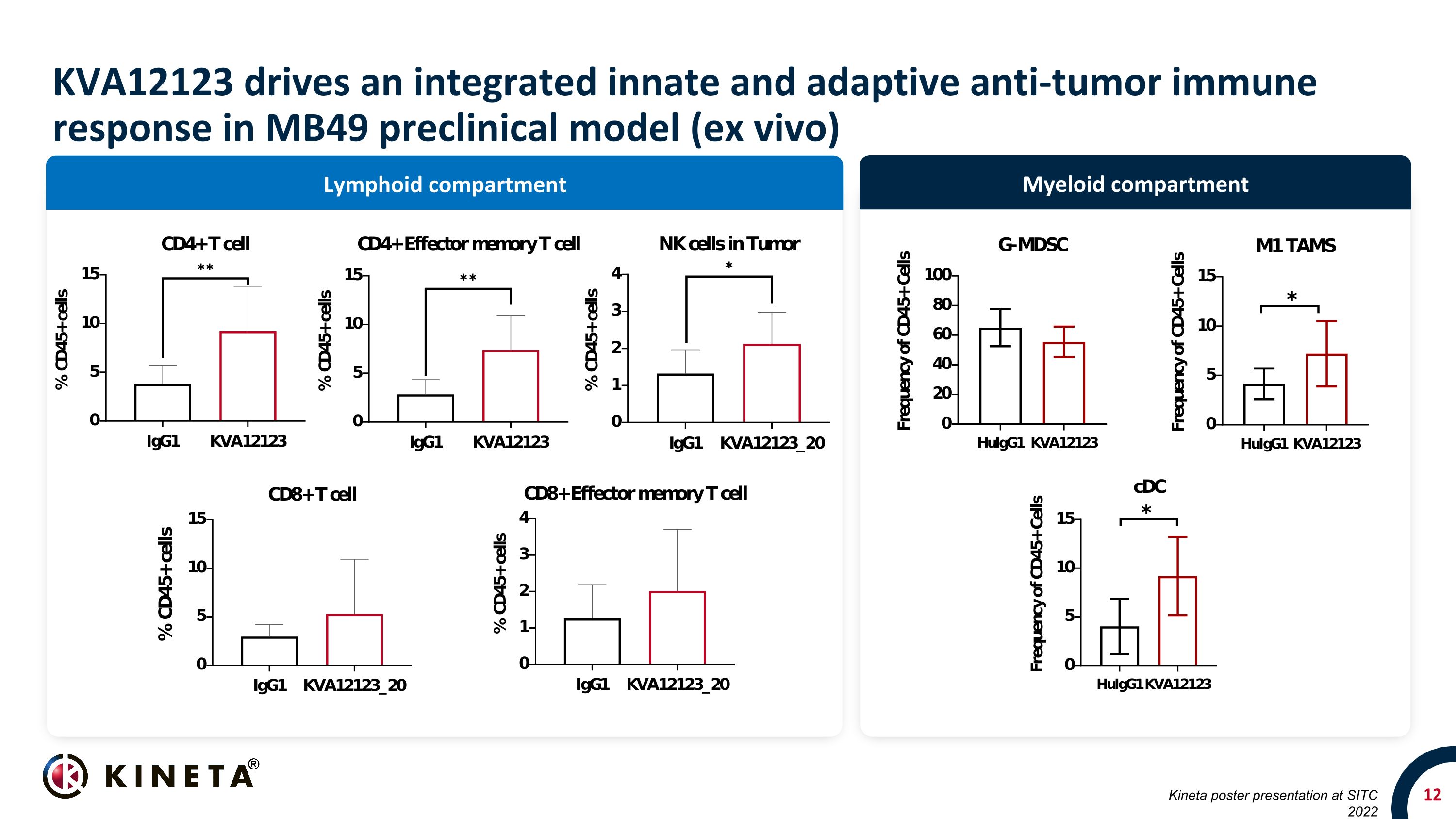
骨髓隔室淋巴隔間 KVA12123 在 SITC 2022 上發佈的 MB49 臨牀前模型(體外)Kineta 海報展示中推動集成的先天和適應性抗腫瘤免疫反應
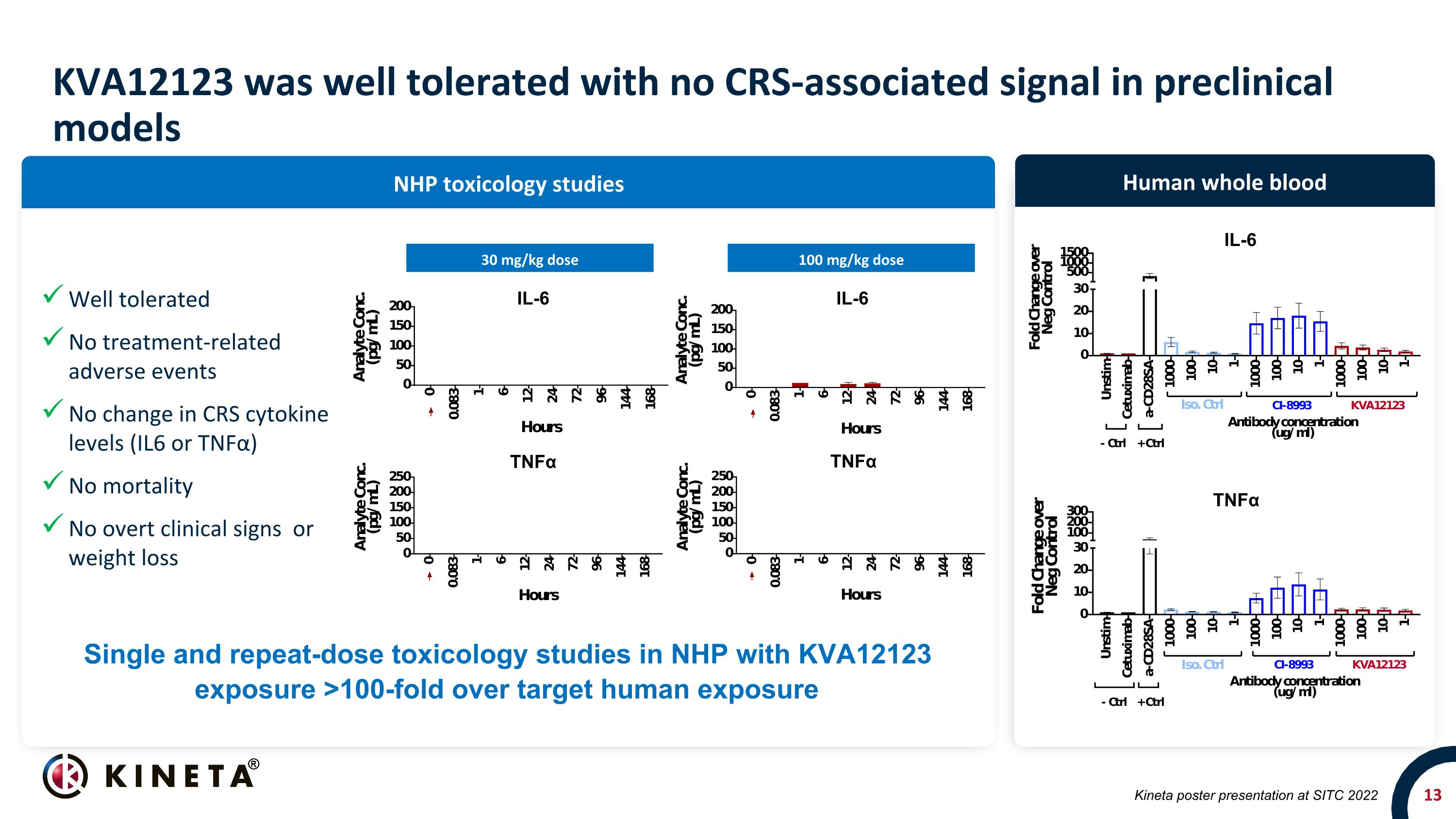
KVA12123 耐受性良好,臨牀前模型中沒有 CRS 相關信號 NHP 毒理學研究人類全血 30 mg/kg 劑量 100 mg/kg 劑量 TNFα IL-6 Kineta 在 SITC 2022 上發佈的單劑量和重複劑量毒理學研究單劑量和重複劑量毒理學研究 KVA12123 暴露量超過目標人體暴露量 100 倍耐受性良好無治療相關不良事件 CRS 細胞因子水平(IL6 或 TNFα)無死亡率變化無明顯臨牀症狀或體重減輕 IL-6 IL-6 TNFα TNFα TNFα
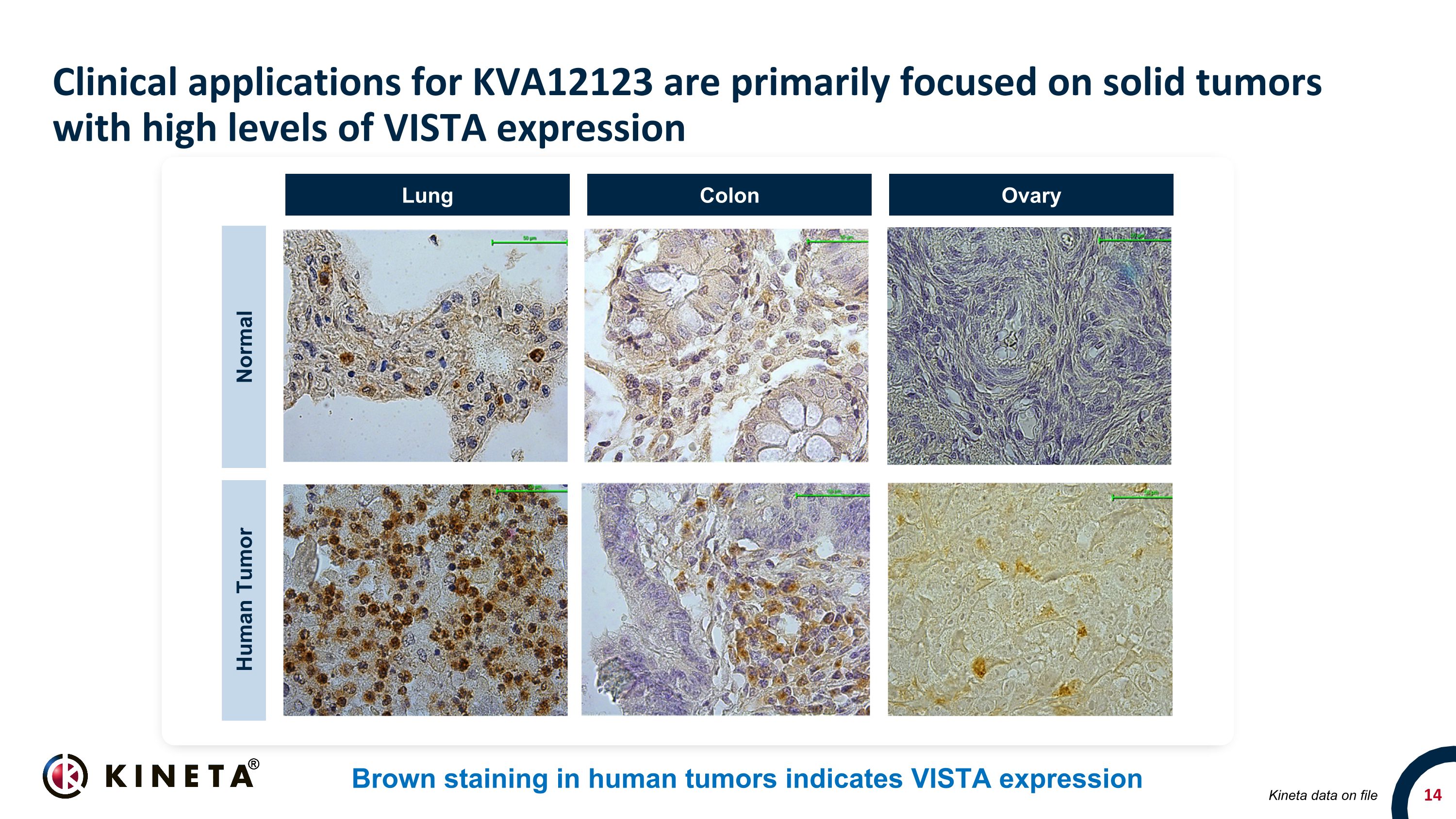
KVA12123 的臨牀應用主要集中在 VISTA 表達水平高的實體瘤人類腫瘤中的棕色染色顯示 VISTA 表達 20x 20x 20x 20x 正常人體腫瘤肺結腸卵巢存檔的 Kineta 數據

VISTA-101:在晚期實體瘤患者中單獨使用 KVA12123 以及聯合pembrolizumab的1/2期開放標籤臨牀試驗患者羣體:針對晚期實體瘤患者(最多60名患者)的1期籃子試驗針對非小細胞肺癌、HNSCC、OC、CRC、RCC和待定其他患者的2期研究目標:主要:安全性和耐受性,推薦的2期劑量(RP2D)或最大耐受劑量(MTD))KVA12123 次要的:根據 ireCist (ORR) 探索性研究晚期實體瘤受試者的藥代動力學、免疫原性、腫瘤反應:生物標誌物和受體佔用率默沙東研究合作臨牀試驗合作和KEYTRUDA® 供應協議

KVA12123 3 mg Q2W KVA12123 10 mg Q2W KVA12123 30 mg Q2W KVA12123 100 mg Q2W KVA12123 300 mg Q2W KVA12123 1000 mg Q2W VISTA-101:清除了五個單一療法隊列和前兩個隊列與派姆羅利珠單抗聯合使用 2 名患者 5 名患者 3-6 名患者 4 名患者 4 名患者 1 期劑量升級* 3 名患者 6 名患者 3-6 名患者 2 期劑量擴展 CLC SCCHN OC CRC RCC NSCLC SCCHN 單一療法(A 部分)最多 36 名患者聯合療法(B 部分)最多 24 名患者單一療法(C 部分)聯合療法(D 部分)A 部分 RP2D B 部分RP2D KVA12123 Q2W pembro 400mg Q6W KVA12123 Q2W 經過改進的 BOIN 設計加速滴定劑量已批准截至 24 年 2 月 29 日 Kineta 檔案中的數據和分析 KVA12123 30 mg Q2W pembro 400 mg q6W KVA12123 100 mg Q2W pembro 400 mg Q6W KVA12123 KVA12123
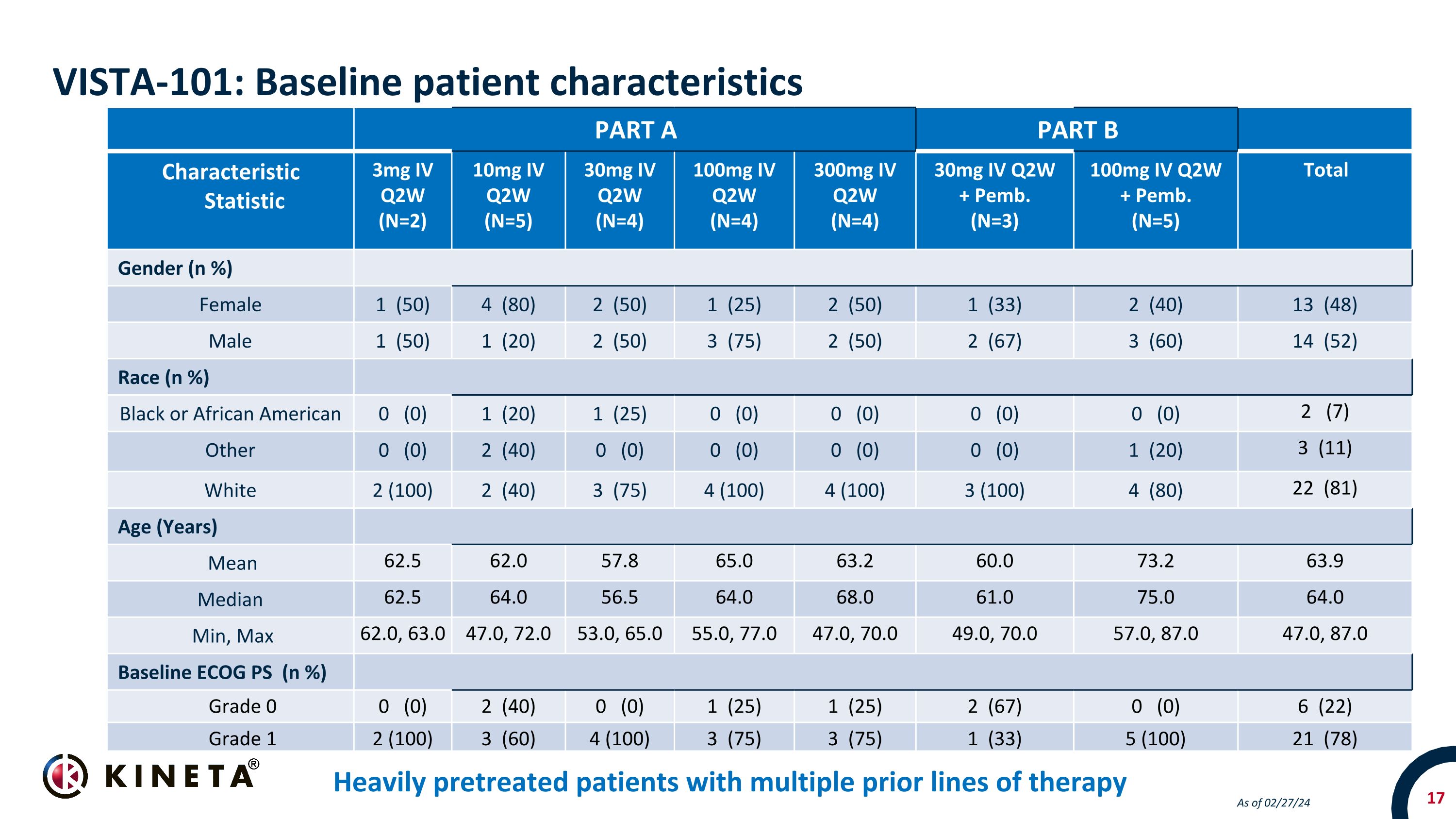
A 部分 B 部分特性統計量 3mg IV Q2W (N=2) 10mg IV Q2W (N=5) 30mg IV Q2W (N=4) 100mg IV Q2W (N=4) 100mg IV Q2W (N=4) 300mg IV Q2W (N=4) 30mg IV Q2W + Pemb。(N=3) 100mg IV Q2W + Pemb。(N=5) 性別總數 (n%) 女 1 (50) 4 (80) 2 (50) 1 (25) 2 (50) 1 (33) 2 (40) 13 (48) 男 1 (50) 1 (50) 1 (20) 2 (50) 3 (75) 2 (50) 2 (67) 3 (60) 14 (52) 種族 (n%) 黑人或非裔美國人 0 (0) 1 (20) 1 (20) 1 (20) 1 (75) 2 (50) 3 (50) 2 (60) 14 (52) 種族 (n%) (25) 0 (0) 0 (0) 0 (0) 0 (0) 2 (7) 其他 0 (0) 2 (40) 0 (0) 0 (0) 0 (0) 1 (20) 3 (11) 白人 2 (100) 2 (40) 3 (75) 4 (100) 4 (100) 3 (100) 4 (80) 22 (81) 年齡(歲)平均值 66 2.5 62.0 57.8 65.0 63.2 60.0 73.2 63.9 中位數 62.5 64.0 64.0 68.0 61.0 75.0 64.0 分鐘,最大 62.0,63.0 47.0,72.0 53.0,65.0 55.0,77.0 47.0,77.0 47.0,87.0 47.0,87.0基線 ECOG PS (n%) 等級 0 0 (0) 2 (40) 0 (0) 1 (25) 1 (25) 2 (67) 0 (0) 6 (22) 1 級 2 (100) 3 (60) 4 (100) 3 (75) 3 (75) 1 (33) 5 (100) 21 (78) VISTA-101:基線患者特徵截至02/0接受過多種治療路線的嚴重預處理患者 27/24

A 部分 B 部分特性統計量 3mg IV Q2W (N=2) 10mg IV Q2W (N=5) 30mg IV Q2W (N=4) 100mg IV Q2W (N=4) 100mg IV Q2W (N=4) 300mg IV Q2W (N=4) 30mg IV Q2W + Pemb。(N=3) 100mg IV Q2W + Pemb。(N=5) 總癌症類型 (n%) 膀胱 1 (50) 1 (20) 1 (25) 0 (0) 0 (0) 0 (0) 0 (0) 3 (11) 乳房 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 1 (25) 1 (25) 1 (25) 2 (50) 0 (0) 0 (0) 4 (15) 子宮內膜 0 (0) 0 (0) 0 (0) 1 (25) 0 (0) 1 (0) 1 (4) 肺 0 (0) 1 (20) 1 (20) 1 (25) 0 (0) 0 (0) 0 (0) 1 (25) 0 (0) 0 (0) 1 (0) 1 (50) 0 (0) 0 (0) 其他 1 (50) 0 (0) (0) 3 (75) 0 (0) 1 (33) 5 (100) 10 (37) 胰腺 0 (0) 1 (20) 2 (50) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 3 (11) 腎臟 0 (0) 1 (20) 0 (0) 0 (0) 0 (0) 2 (7) 腎臟 0 (0) 1 (0) 0 (0) 2 (7) TNM 階段初始 Dx (n%) I 0 (0) 1 (20) 0 (0) 1 (25) 0 (0) 1 (25) 0 (0)0 (0) 2 (7) II 0 (0) 1 (20) 1 (25) 0 (0) 1 (33) 1 (20) 4 (15) III 0 (0) 0 (0) 0 (0) 0 (0) 2 (50) 1 (33) 0 (0) 1 (33) 0 (0) 3 (11) IV 1 (50) 3 (60) 2 (50) 2 (50) 0 (0) 2 (50) 1 (33) 0 (0) 1 (33) 2 (40) 11 (41) 失蹤 1 (50) 0 (0) 1 (25) 2 (50) 1 (25) 0 (0) 2 (40) 7 (26) VISTA-101:截至 24 年 2 月 27 日的人口統計數據
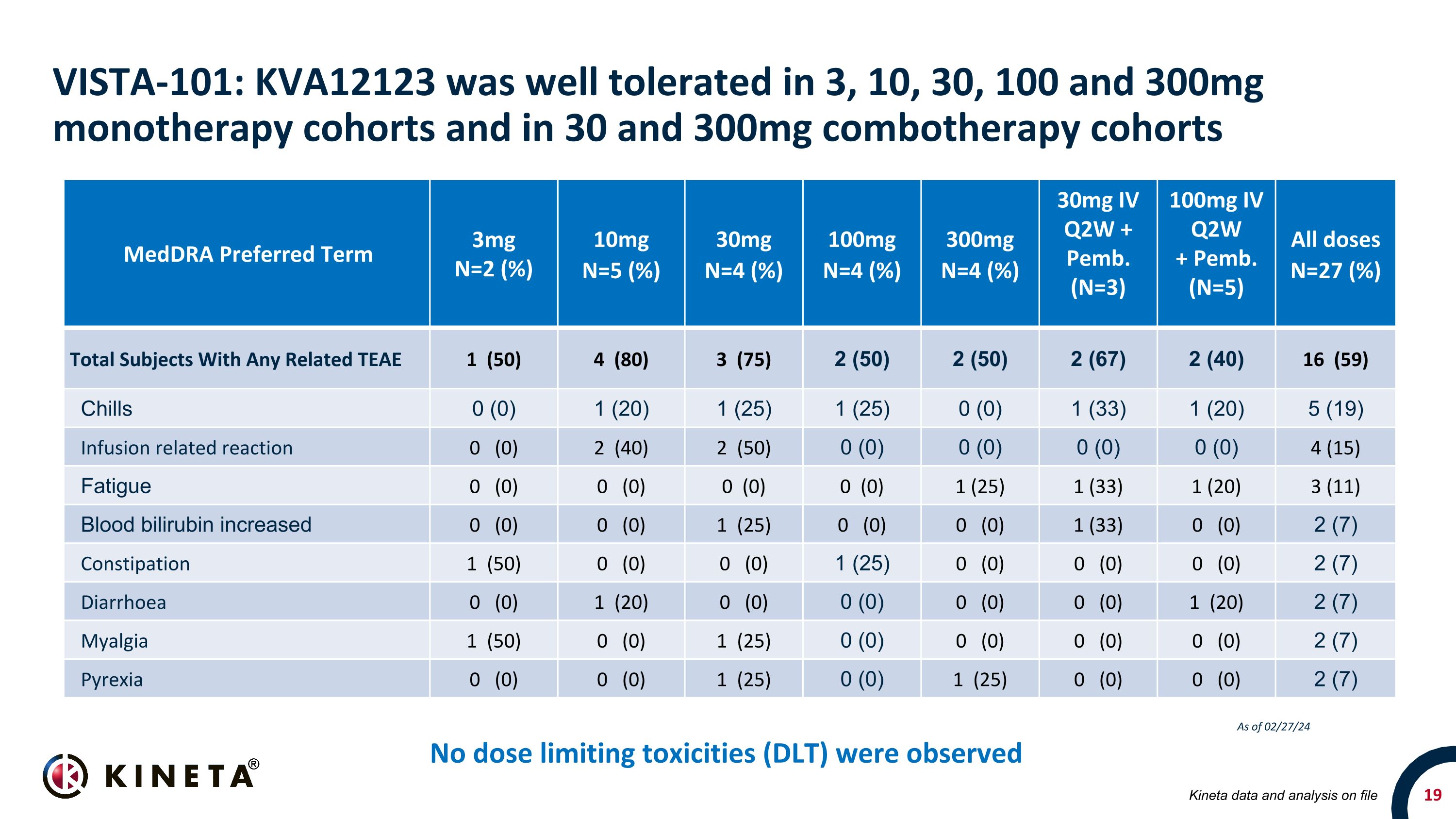
VISTA-101:在 3、10、30、100 和 300 毫克單一療法隊列以及 30 和 300 毫克組合療法隊列中,KVA12123 的耐受性良好。未觀察到劑量限制毒性 (DLT) medDRA 首選術語 3mg N=2 (%) 10mgn=5 (%) 30mg N=4 (%) 30mg N=4 (%) 30mg N=4 (%) 30mg N=4 (%) 30mg N=4 (%) 30mg N=4 (%) 30mg IV 2W + Pemb。(N=3) 100mg IV Q2W + Pemb。(N=5) 所有 dosesn=27 (%) 受試者總數 1 (50) 4 (80) 3 (75) 2 (50) 2 (50) 2 (67) 2 (67) 2 (40) 16 (59) 16 (59) 寒戰 0 (0) 1 (25) 1 (25) 0 (0) 1 (33) 1 (20) 5 (19) 輸液相關反應 0 (0) 2 (0) 2 (40) 2 (50) 0 (0) 0 (0) 0 (0) 0 (0) 4 (15) 疲勞 0 (0) 0 (0) 0 (0) 1 (25) 1 (33) 1 (20) 3 (11) 血液膽紅素升高 0 (0) 0 (0) 1 (33) 1 (20) 3 (11) 1 (0) 0 (0) 2 (7) 便祕 1 (50) 0 (0) 1 (25) 0 (0) 0 (0) 0 (0) 2 (7) 腹瀉 0 (0) 1 (20) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 1 (20) 2 (7) 肌痛 1 (50) 0 (0) 1 (25) 0 (0) 0 (0) 0 (0) 0 (0) 2 (7) Pyrexia 0 (0) 0 (0) 1 (25) 0 (0) 1 (25) 0 (0) 0 (0) 2 (7) 存檔的 Kineta 數據和分析截至 24 年 2 月 27 日

VISTA-101:沒有證據表明 KVA12123 給藥後有 CRS 相關的細胞因子誘導 Kineta 數據和分析存檔
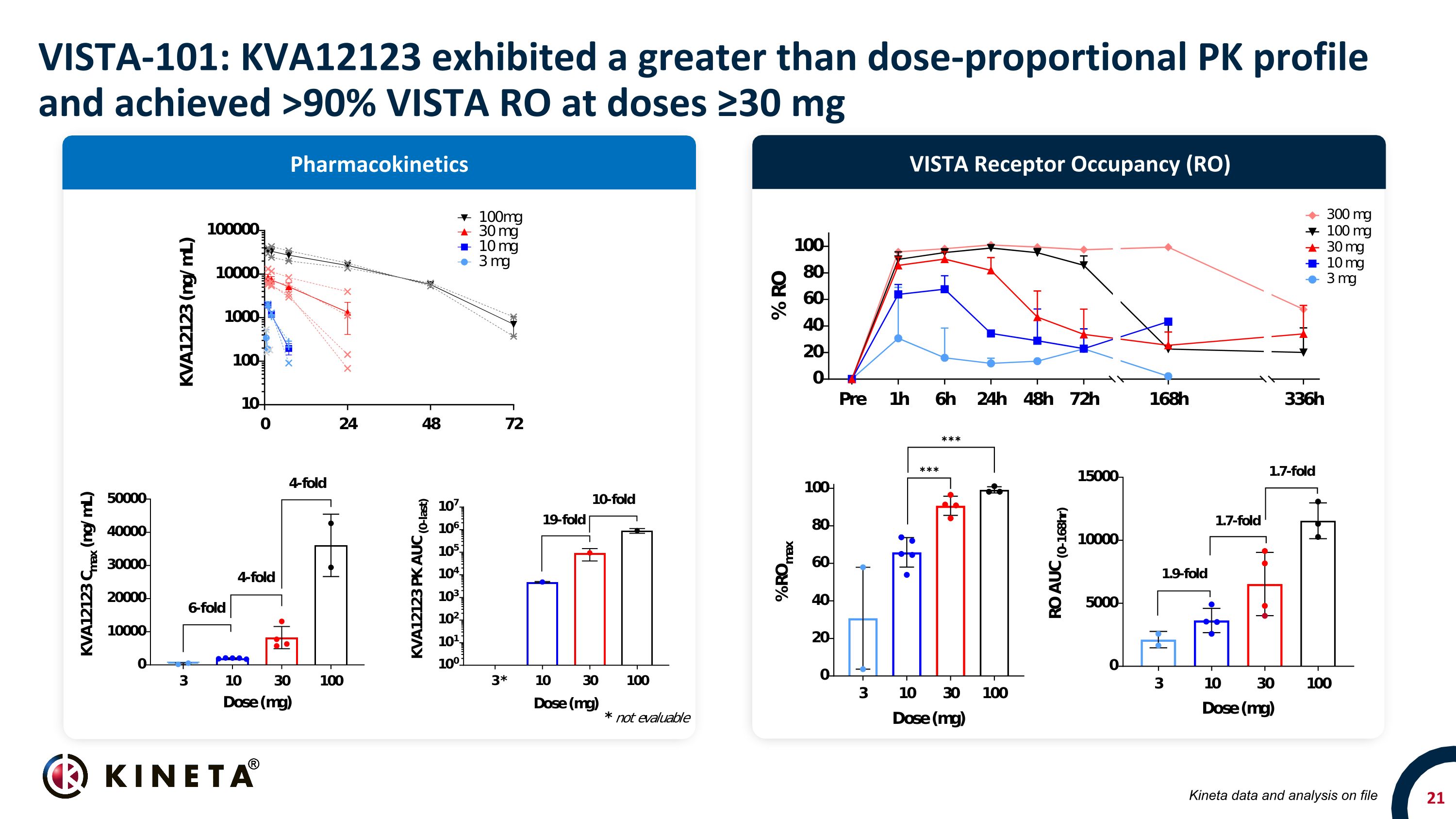
VISTA-101:KVA12123 表現出高於劑量比例的 PK 曲線,在劑量 ≥ 30 mg 時,VISTA RO 達到 90% 以上 VISTA 受體佔用 (RO) 藥代動力學 Kineta 數據和存檔分析

VISTA-101:KVA12123 臨牀概況摘要經安全認證 3、10、30、100 和 300 mg KVA12123 單一療法隊列以及 30mg 和 100mg kva12123/pembrolizumab 組合隊列在任何劑量水平下均耐受性良好,無劑量限制毒性 (DLT) 未檢測到 CRS 相關細胞因子(IL-6、TNFα 和 IL-10)藥代動力學和受體佔用率 (RO) KVA12123 給藥在劑量≥30 mg時達到超過90%的VISTA RO藥代動力學分析表明,在所有評估劑量中,藥物暴露量的增加幅度均大於劑量成比例,與較低劑量的靶介導藥物處置一致。估計 RP2D 約為 600 mg 生物標誌物 CXCL10、IfNG、CCL2、CCL2、CCL3、CCL4 和 CXCL8 的細胞因子分泌在治療後觀察到抗腫瘤免疫細胞亞羣的顯著變化

VISTA-101:臨牀研究摘要單一療法組(3 — 300 mg KVA12123,Q2W)21 名患者入組 12 名患者同時接受了基線掃描和至少一次隨訪掃描 12 名患者中有 9 名實現了最佳總體反應(75%)穩定疾病的平均持續時間為 15 周(9 名患者仍在接受治療)在持續 CPI 失敗的 NSCLC 患者中,有 6 個先前系的組合臂(30 — 100 mg KVA12123 Q2W)最長的 SD 持續時間為 28 周; 400 mg pembro (Q6W) 9 名患者入組 3 名患者同時接受了基線掃描和至少一次隨訪掃描,三次中的 1 次可評估患者獲得部分緩解,3例患者中有1例為穩定疾病(67%),RCC患者目標病變的BOR降低了23.7%,目標病變粘表皮樣癌患者目標病變的BOR為52.7%
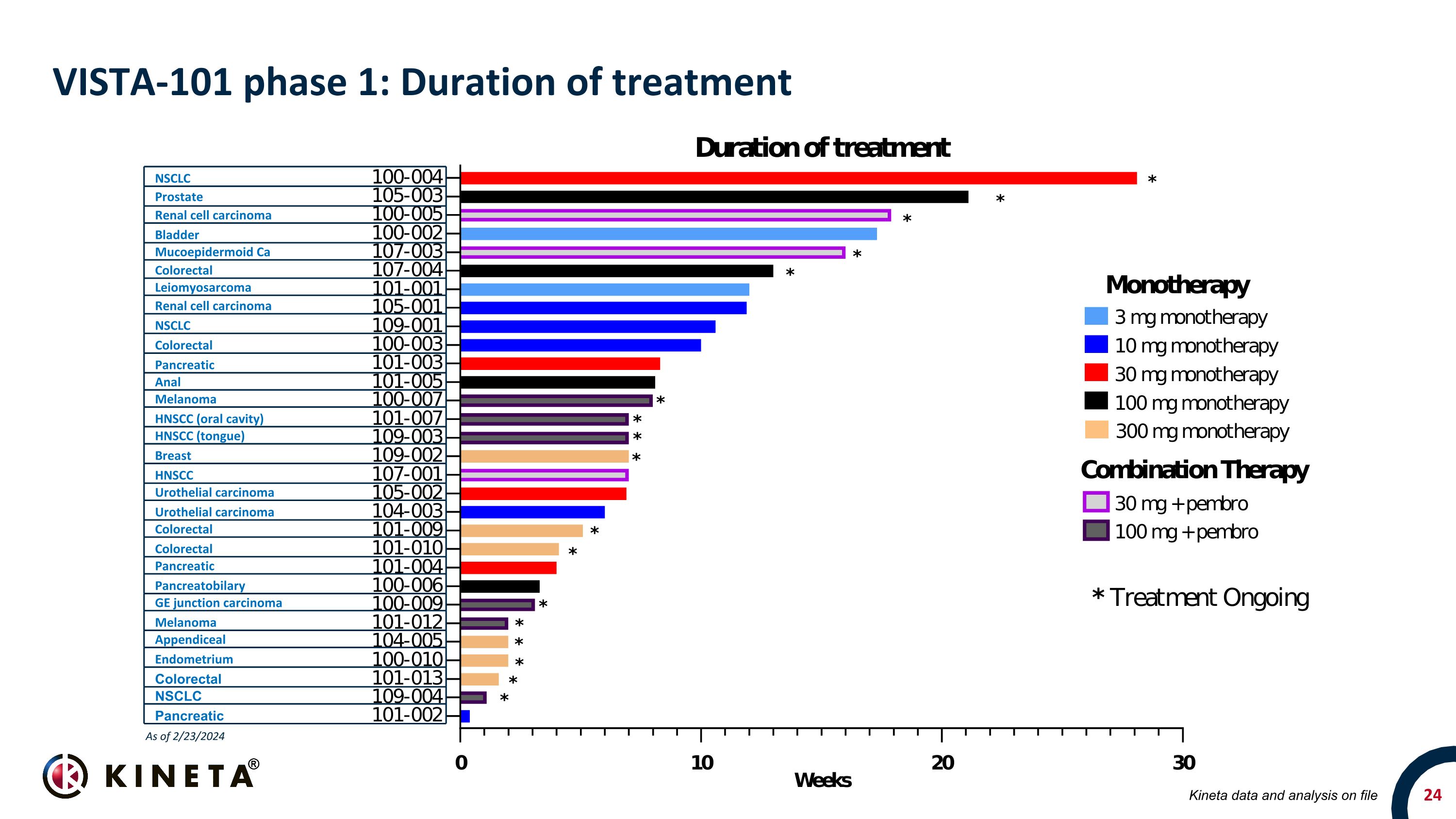
VISTA-101 第 1 階段:治療時間 NSCLC 前列腺腎細胞癌膀胱粘膜表皮樣鈣結直腸平滑肌肉瘤腎細胞癌 NSCLC 結直腸胰腺****黑色素瘤 HNSCC(舌頭)乳房 HNSCC(舌頭)乳房 HNSCC 尿路上皮癌尿路上皮癌結直腸胰腺胰腺結腸炎 GE 交界處癌黑素瘤 Anoma 闌尾子宮內膜結直腸非小細胞肺癌胰腺動力學數據和分析存檔截至 2024 年 2 月 23 日
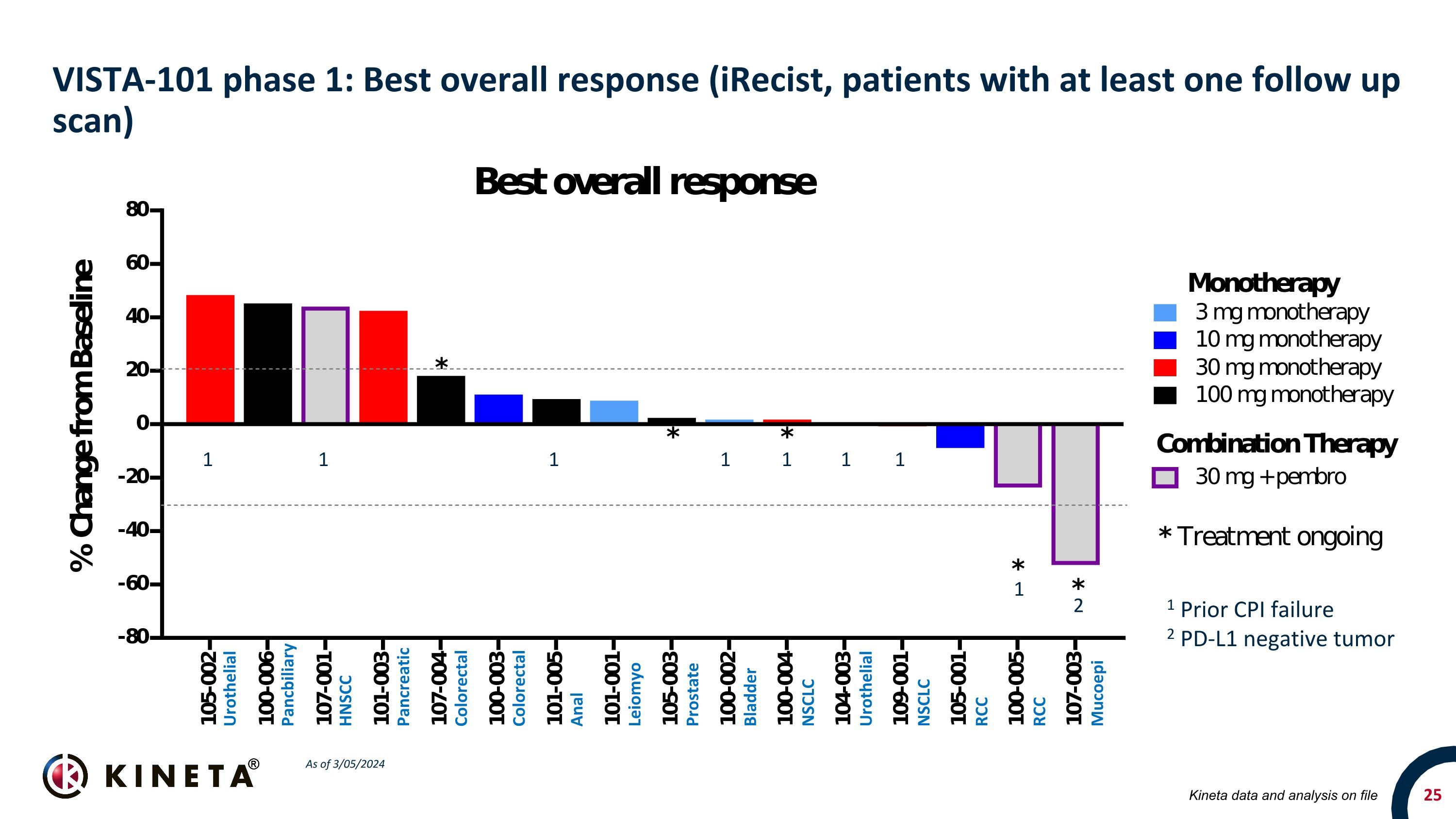
VISTA-101 第 1 階段:最佳總體反應(ireCist,至少接受過一次隨訪掃描的患者)尿路上皮胰腺 HNSCC 胰腺結直腸結直腸**** Leiomyo 前列腺膀胱 NSCLC 尿路上皮 NSCLC RCC Mucoepi Kineta 存檔的數據和分析截至 2024 年 3 月 5 日 1 1 1 1 1 1 PD-L1
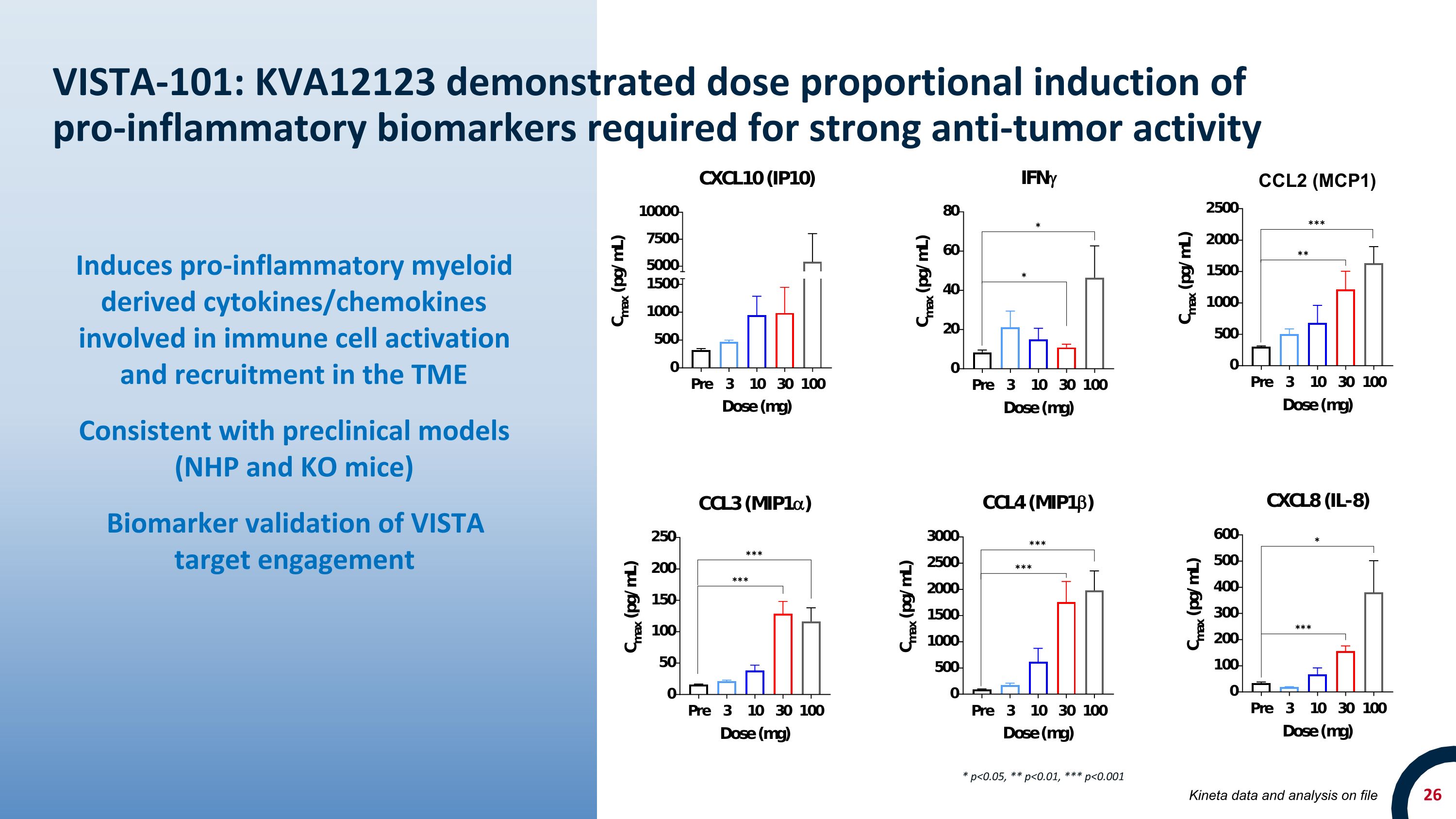
VISTA-101:KVA12123 顯示出強抗腫瘤活性所需的促炎生物標誌物的劑量成比例誘導促炎性髓系衍生細胞因子/趨化因子參與免疫細胞激活和招募,與臨牀前模型(NHP 和 KO 小鼠)一致 VISTA 靶點參與的生物標誌物驗證 * p
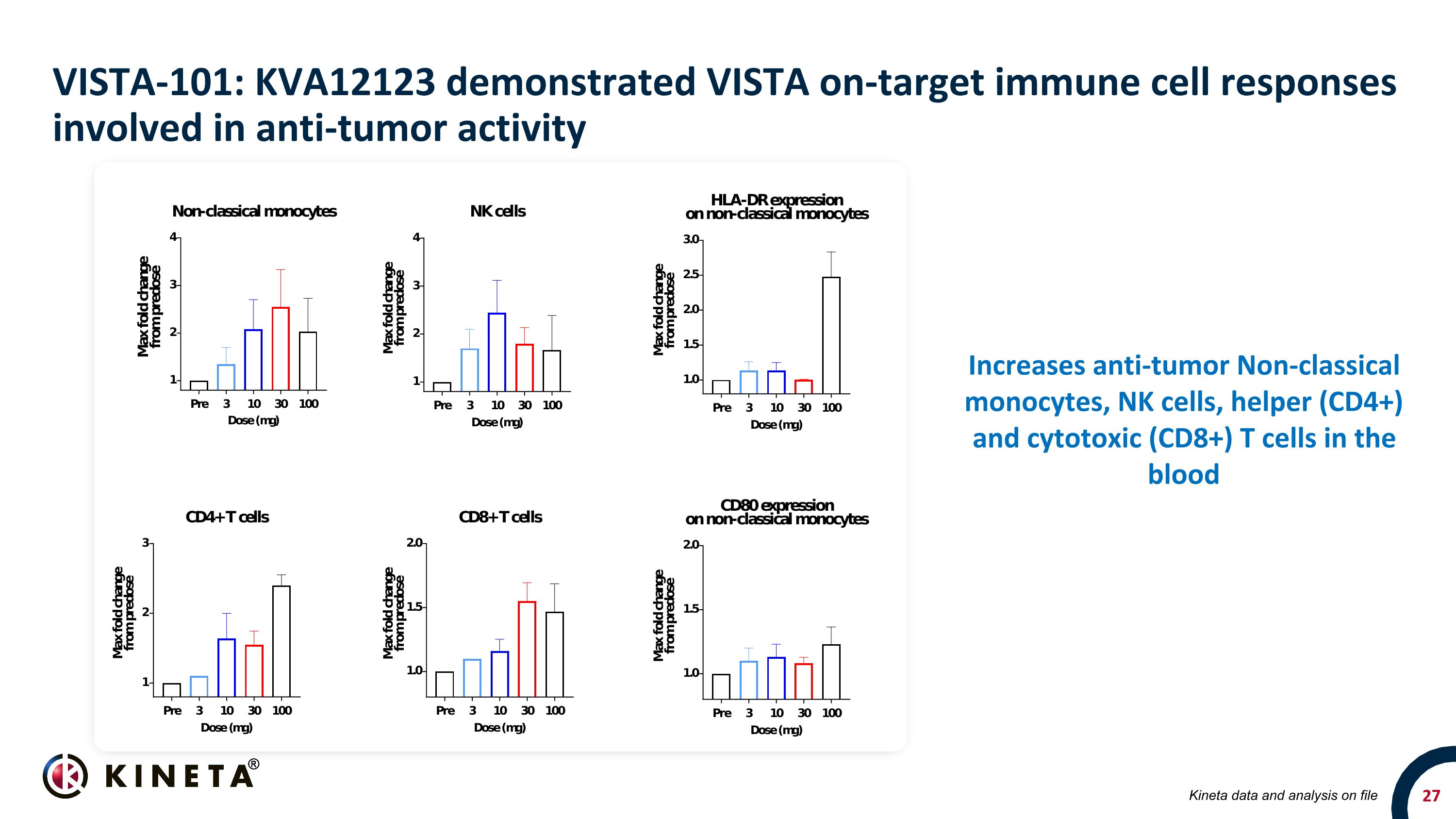
VISTA-101:KVA12123 顯示出參與抗腫瘤活性的 VISTA 靶向免疫細胞反應增加血液中的抗腫瘤非經典單核細胞、NK 細胞、輔助 (CD4+) 和細胞毒性 (CD8+) T 細胞 Kineta 存檔數據和分析
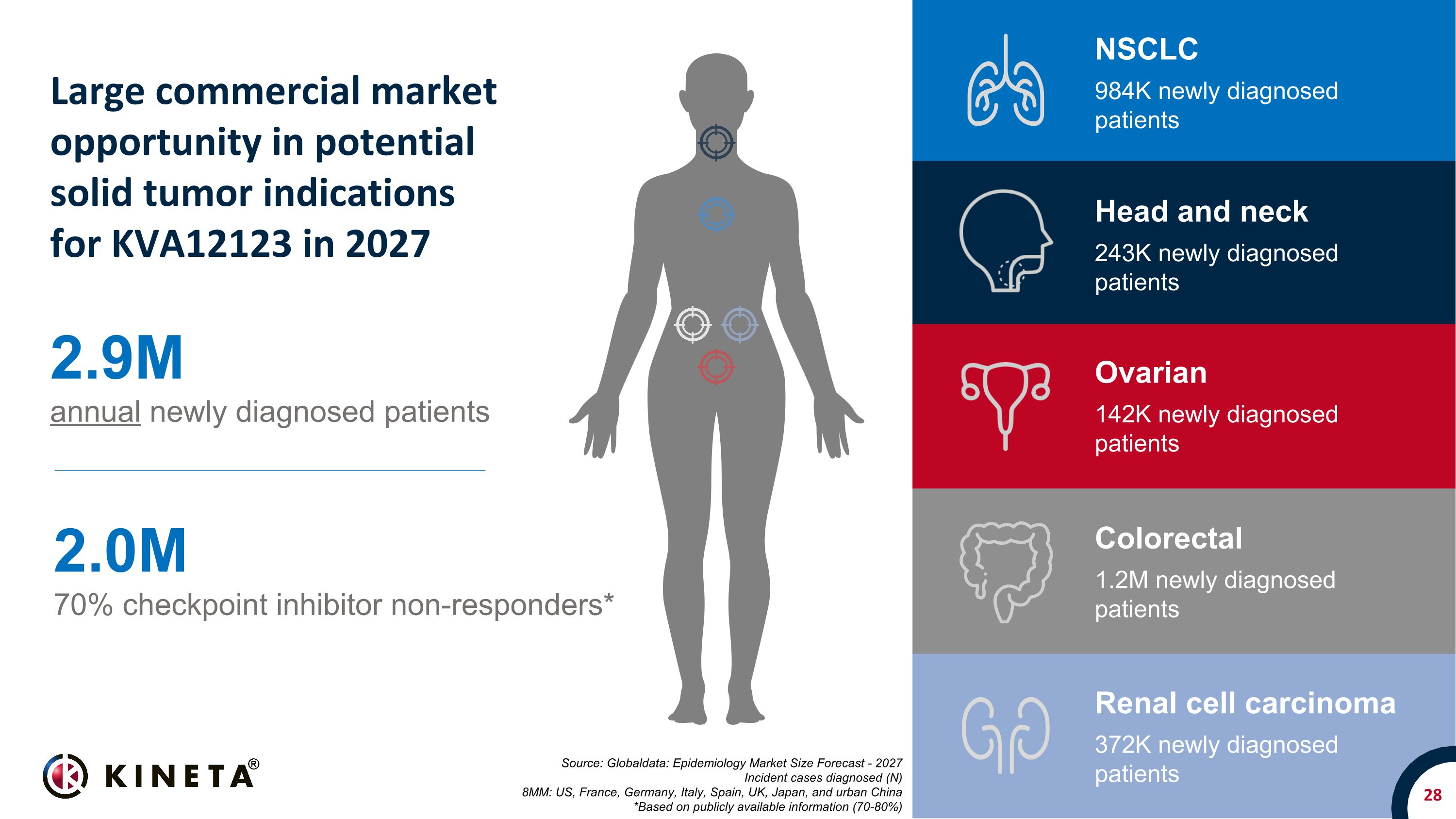
28 來源:Globaldata:流行病學市場規模預測——2027 年確診的發病病例(N)800 萬例:美國、法國、德國、意大利、西班牙、英國、日本和中國城市 *基於公開信息 (70-80%) 每年新診斷的患者290萬人 70% 的檢查點抑制劑無反應者* 2027 年 KVA12123 潛在實體瘤適應症的巨大商業市場機會 NSCLC 984K 新診斷患者結直腸癌 1.2M 新診斷患者卵巢 142K 新診斷患者頭頸部 243K 新診斷患者腎細胞癌 372K新診斷的患者

抗 CD27 激動劑 mAb 免疫療法
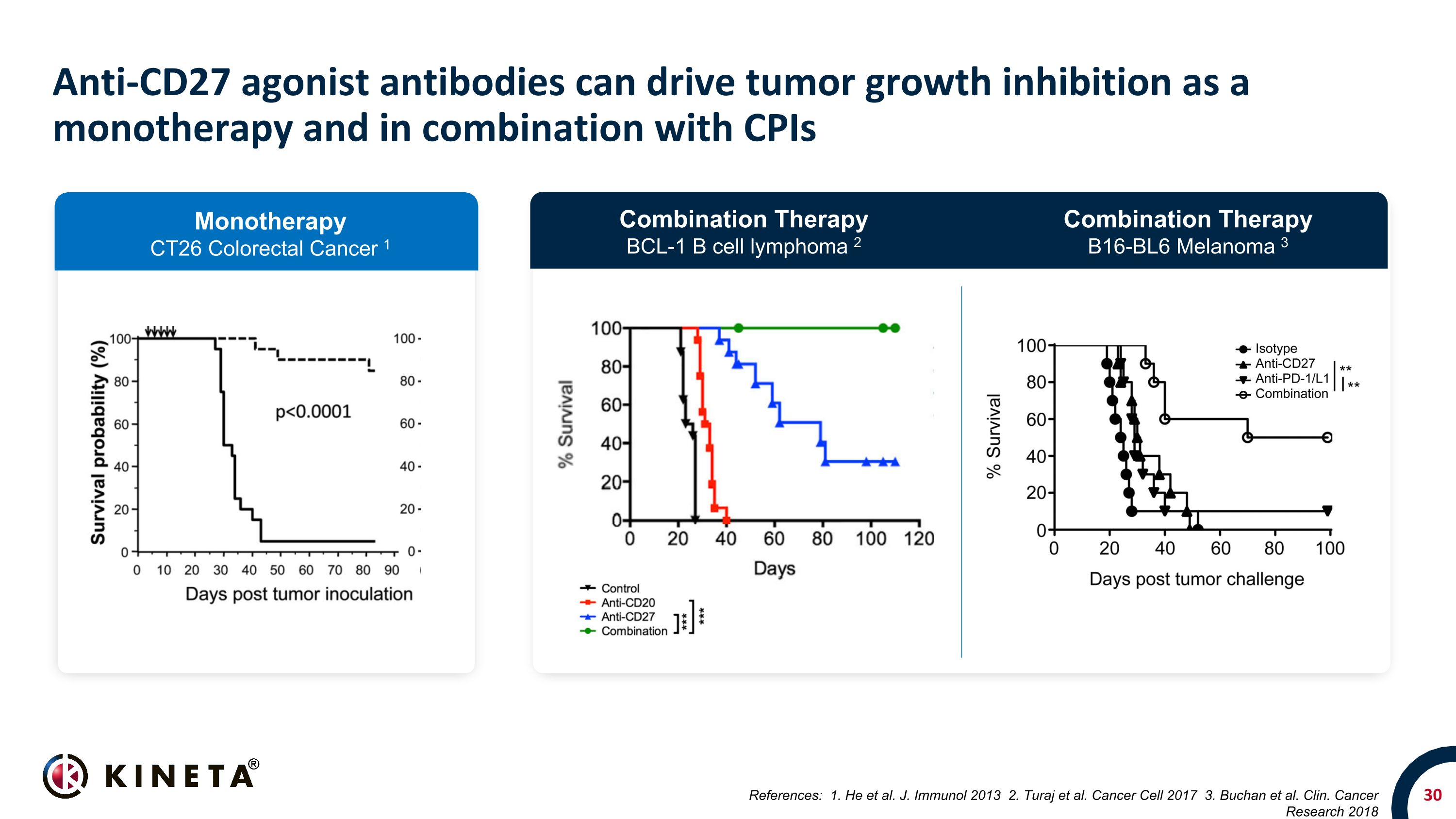
抗CD27激動劑抗體可以作為單一療法和與CPIs聯合使用來推動腫瘤生長抑制參考文獻:1.他等人J. Immunol 2013 2.Turaj 等人癌細胞 2017 3.Buchan 等克林。癌症研究 2018 單一療法 CT26 結直腸癌 1 聯合療法 BCL-1 B 細胞淋巴瘤 2 聯合療法 B16-BL6 黑色素瘤 3
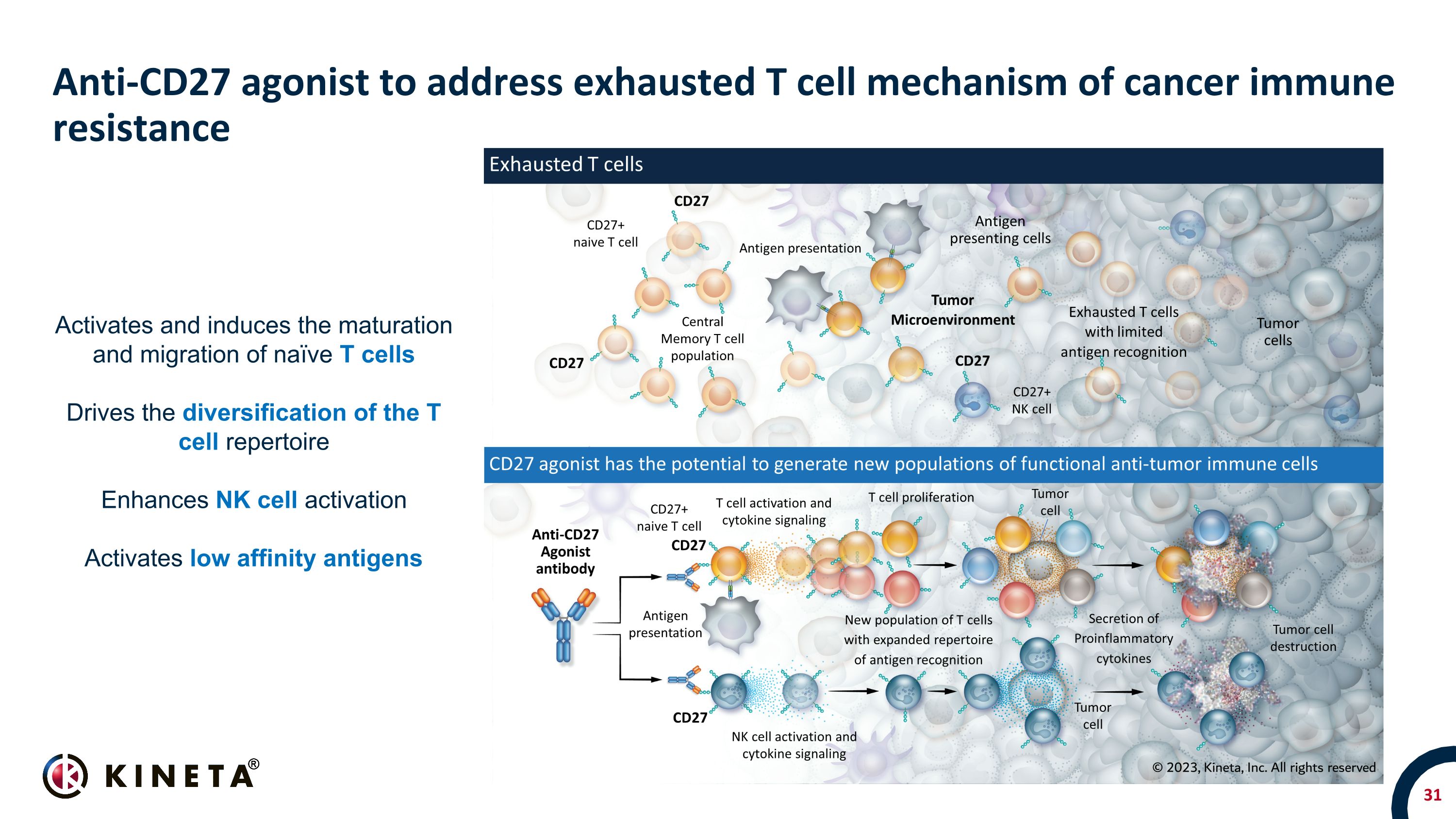
抗CD27激動劑可解決已耗盡的癌症免疫耐藥性T細胞激活和誘導天真 T 細胞的成熟和遷移驅動 T 細胞庫的多樣化增強 NK 細胞活化激活低親和力抗原
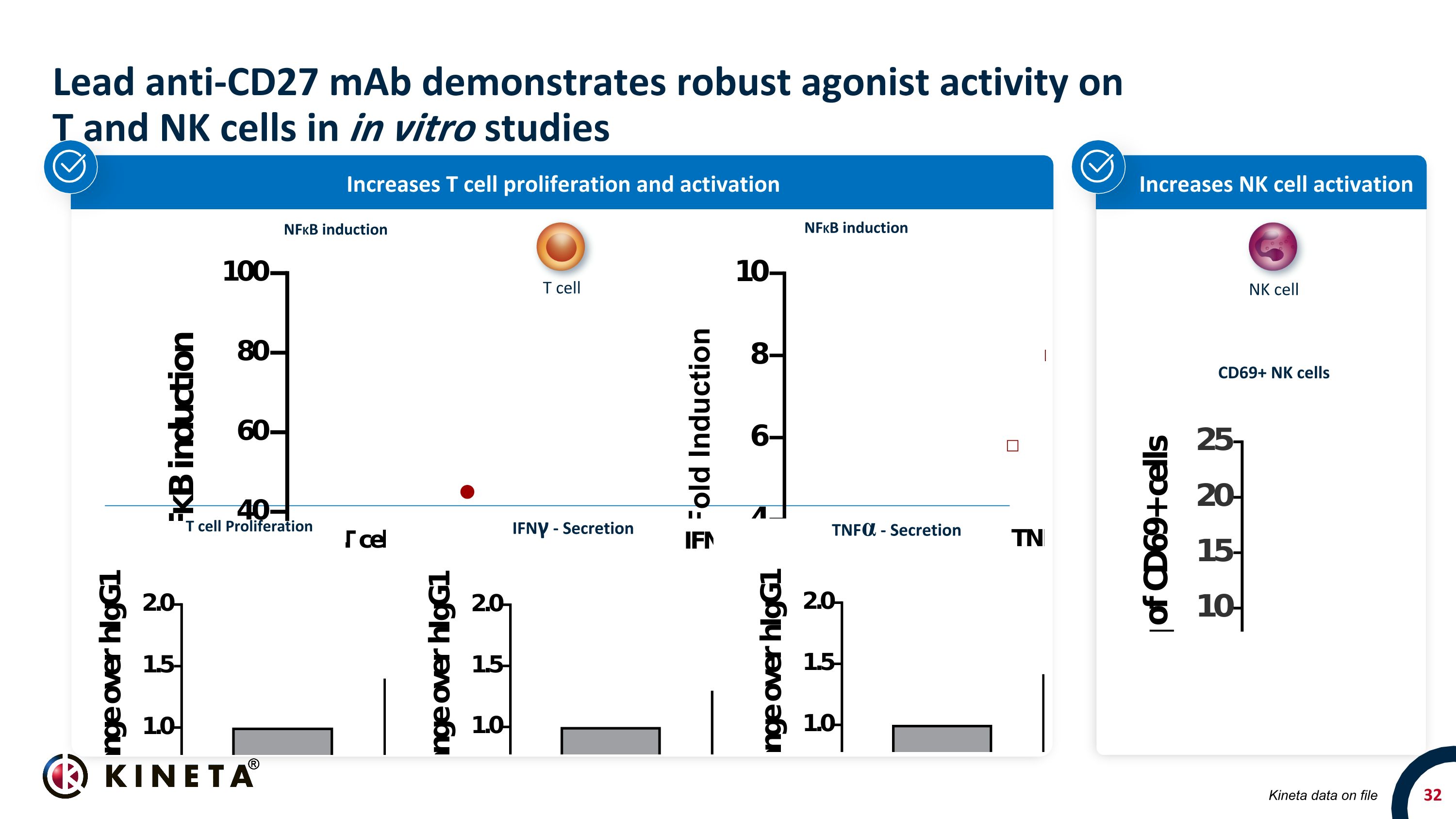
Lead Anti-CD27 mAb 在體外研究中對 T 和 NK 細胞表現出強大的激動劑活性增加 NK 細胞活化增加 T 細胞增殖和激活 IFNγ-分泌 TNFα-Secretion Kineta 檔案中的數據 CD69+ NK 細胞 T 細胞 NKB 細胞 NFKB 誘導 NFKB 誘導 NFKB 誘導
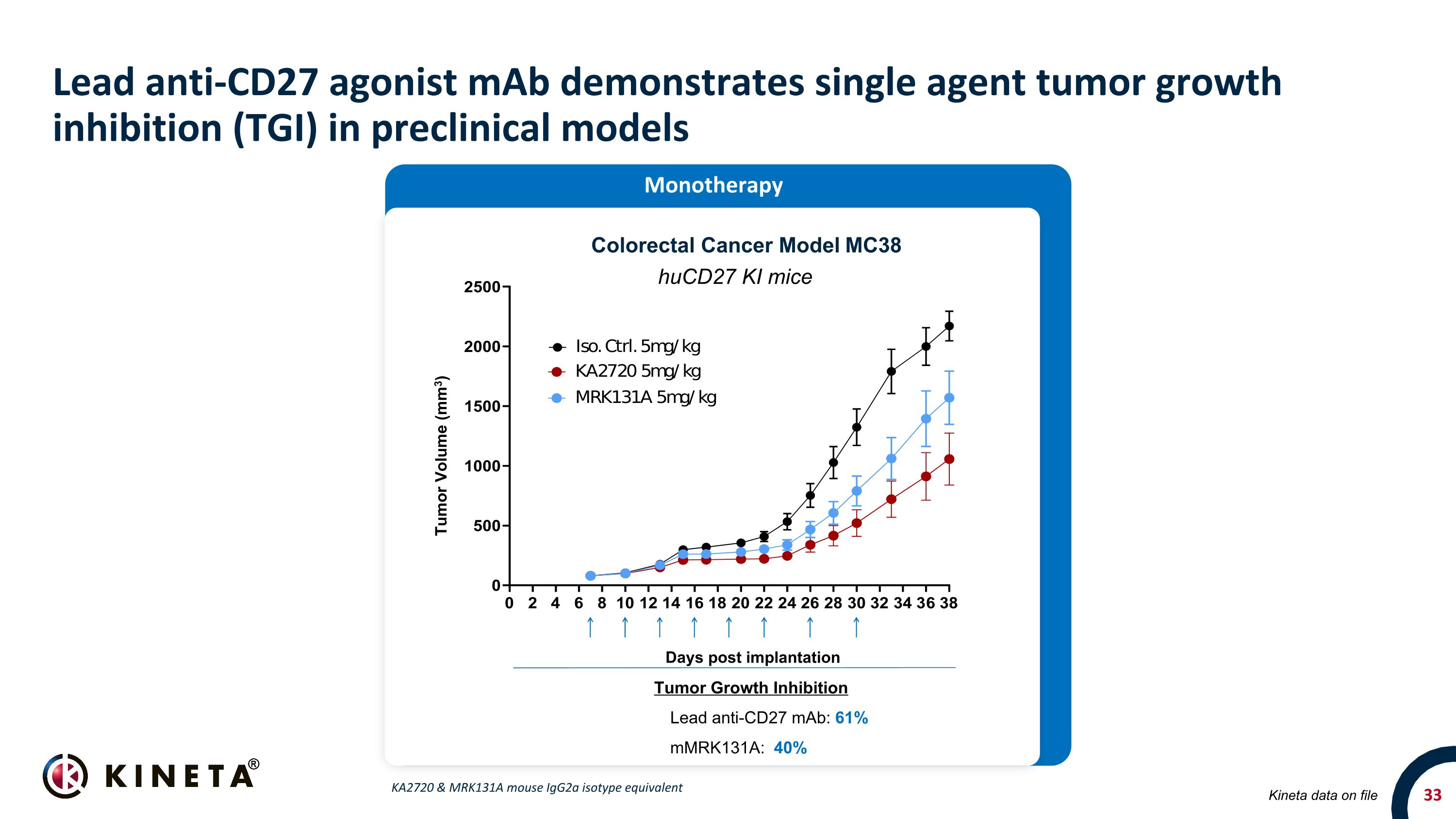
領先的抗 CD27 激動劑 maB 在臨牀前模型中表現出單藥腫瘤生長抑制 (TGI) Kineta 數據存檔結直腸癌模型 MC38 huCD27 KI 小鼠腫瘤生長抑制鉛抗 CD27 單抗:61% mmrk131a:40% 植入後單一療法天數腫瘤體積 (mm3) KA2720 和 MRK131A 小鼠 IgG2A 同種型當量
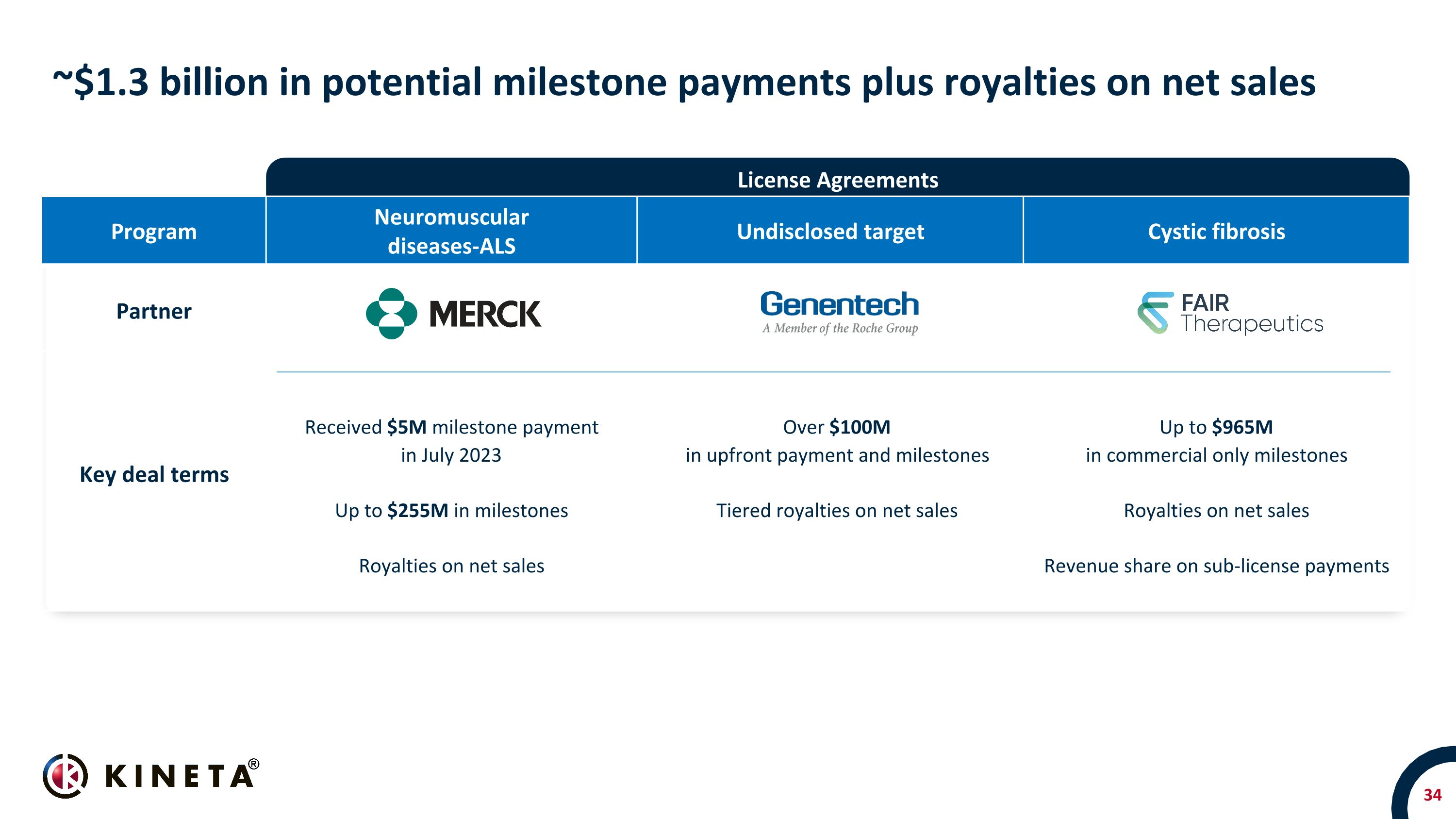
項目 Neuromuscural Diseases-ALS 未公開目標囊性纖維化合作伙伴關鍵交易條款在 2023 年 7 月獲得了 500 萬美元的里程碑式付款淨銷售額特許權使用費超過 1 億美元預付款和里程碑淨銷售額的分級特許權使用費淨銷售額高達 9.65 億美元的分成許可付款的收入份額以及淨銷售許可協議的特許權使用費

目前正在評估戰略替代方案已完成對我們業務的審查,並將評估公司和資產的戰略替代方案以實現股東價值最大化經董事會批准。根據當前的融資環境,公司立即採取了幾項行動削減了64%的生效力停止招收新患者參加正在進行的1期臨牀試驗(VISTA-101)有關我們資產的潛在戰略和/或財務合作伙伴戰略選擇可能包括但不限於收購、合併、反向合併、出售資產、戰略夥伴關係、清算或其他交易

KVA12123:VISTA阻斷單抗以解決TME正在進行的1/2期臨牀研究中的免疫抑制問題,該研究評估了單獨使用 KVA12123 以及與pembrolizumab聯合治療晚期實體瘤的前 5 個單一療法隊列和前兩個組合隊列,無劑量限制毒性,超過 90% 的VISTA受體佔用率生物標誌物顯示與療效相關的細胞因子分泌以及在單一療法中觀察到的抗腫瘤免疫細胞亞羣的顯著變化長期穩定疾病以及聯合療法的部分反應 2Q24:額外的單一療法24 年第 2 季度安全性和有效性數據:初始聯合療法數據以先天免疫為重點的產品線預計的 KVA12123 催化劑 Kineta 正在開發下一代免疫療法,以解決癌症免疫耐藥性,潛在的里程碑式付款加上淨銷售的特許權使用費合作伙伴目前正在探索戰略替代方案

為癌症患者開發下一代免疫療法www.kinetabio.com