
Izokibep 銀屑病關節炎全球第 2b/3 期業績2024 年 3 月 11 日附錄 99.3

2 本演示文稿包含非歷史事實的陳述,根據經修訂的1933年《證券法》第27A條和經修訂的1934年《證券交易法》第21E條的定義,這些陳述被視為前瞻性陳述。前瞻性陳述包括但不限於關於我們的候選產品izokibep治療潛力的陳述,包括關於izokibep進行長期治療以提供持續改善的可能性的陳述;izokibep的長期安全性;臨牀試驗數據的時機和可用性;我們正在追求的某些適應症的潛在患者羣體的潛在市場規模和規模,以及我們的候選產品。這些前瞻性陳述基於ACELYRIN當前的計劃、目標和預測,本質上受風險和不確定性的影響,這些風險和不確定性可能導致我們的實際業績與此類前瞻性陳述中的預期存在重大不利差異。此類風險和不確定性包括但不限於與成功完成候選產品的開發和監管活動相關的風險和不確定性;我們的臨牀試驗的時間和結果,包括未來結果可能與先前結果存在不利差異(如果適用);我們及時確保候選產品充足供應的能力;充足的資金;法律訴訟及其結果;競爭風險;市場波動;宏觀經濟狀況和其他風險和不確定性影響ACELYRIN,包括在 “風險因素” 標題下不時描述的內容,以及我們向美國證券交易委員會(“SEC”)提交的當前和未來定期報告和其他報告,包括我們最新的截至2023年9月30日的季度10-Q表季度報告。這些文件可在美國證券交易委員會的網站www.sec.gov上查閲。此外,隨時可能出現新的風險,我們預計後續的事態發展可能會導致我們的觀點發生變化。此處對本演示文稿的日期作了前瞻性陳述,除非適用法律要求,否則ACELYRIN沒有義務在出現新信息、未來發展或其他情況時更新這些陳述。提醒本演示文稿的任何讀者不要過分依賴這些前瞻性陳述。Izokibep目前正在臨牀研究中,沒有對我們的候選產品的安全性或有效性作出任何陳述。除了我們自己的內部研究外,本演示文稿還包含與研究相關或基於從第三方來源獲得的其他數據的信息。儘管我們認為截至本演示文稿之日這些第三方來源是可靠的,但我們尚未獨立核實,也沒有就其充分性、公平性、準確性或完整性做出任何陳述。此外,市場數據(例如市場規模)涉及對我們未來表現和我們經營所在市場的未來表現的許多預測、假設和估計。無法保證其準確性或可靠性,因為它們必然受到高度的不確定性和風險的影響。本演示文稿中的信息截至本演示之日,如有更改,恕不另行通知。商標:本演示文稿包含 ACELYRIN 和其他公司的商標、服務標記、商品名稱和版權,這些都是其各自所有者的財產。前瞻性聲明和免責聲明
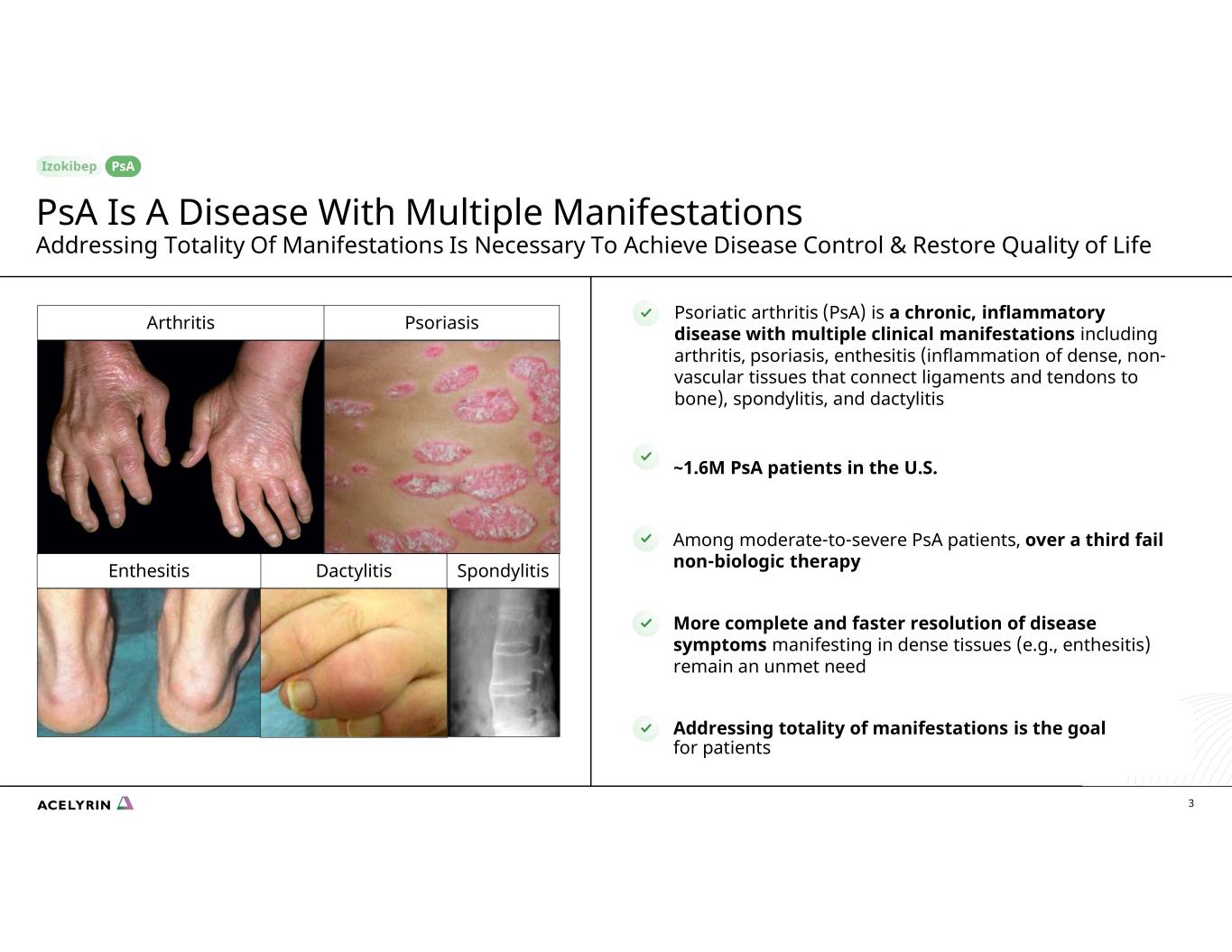
dactyLitisenthesitis 脊柱炎銀屑病關節炎 (psA) 是一種慢性炎症性疾病,具有多種臨牀表現,包括關節炎、牛皮癬、附着炎(連接韌帶和肌腱與骨骼的緻密非血管組織的炎症)、脊柱炎和指關節炎。在美國,約有160萬名psA患者,在中度至重度psA患者中,超過三分之一非生物治療失敗更完整、更快地解決密集組織(例如附着點炎)中表現出的疾病症狀仍未得到滿足 3 解決所有表現形式是患者的目標關節炎銀屑病 psA 是一種具有多種表現的疾病,解決所有表現是實現疾病控制和恢復生活質量的必要條件 psA

4 psA • 僅 Izokibep IL-17A 抑制劑即可快速提高各種疾病表現的分辨率 • 預先指定的分析支持附着炎分辨率的差異化潛力 • 臨牀反應比 IL-17A 藥物報告的更高 • 結果與 IL-17A&F 藥物報告的結果相當,但沒有相關的安全責任 • 研究在 16 周時達到 ACR50 的主要終點,具有很高的統計學意義 • 高障礙取得了顯著的多域反應 ACR70、PASI90、PASI100 和 MDA 的 •鑑於2b/3期的疾病負擔增加,相對於2期的反應強度顯著改善 • 預計將成為銀屑病關節炎兩項註冊試驗中的第一項;160mg Q2W似乎是最佳劑量 • 高障礙複合終點(ACR50/PASI100和MDA)的臨牀反應強勁 • 迄今為止對長期治療沒有安全限制 • 更長的治療時間此前表明,隨着時間的推移,有可能進一步改善積極的標題結果差異化概況深刻而持久的迴應積極的Izokibep 全球第 2b/3 期在 pSa 中的結果
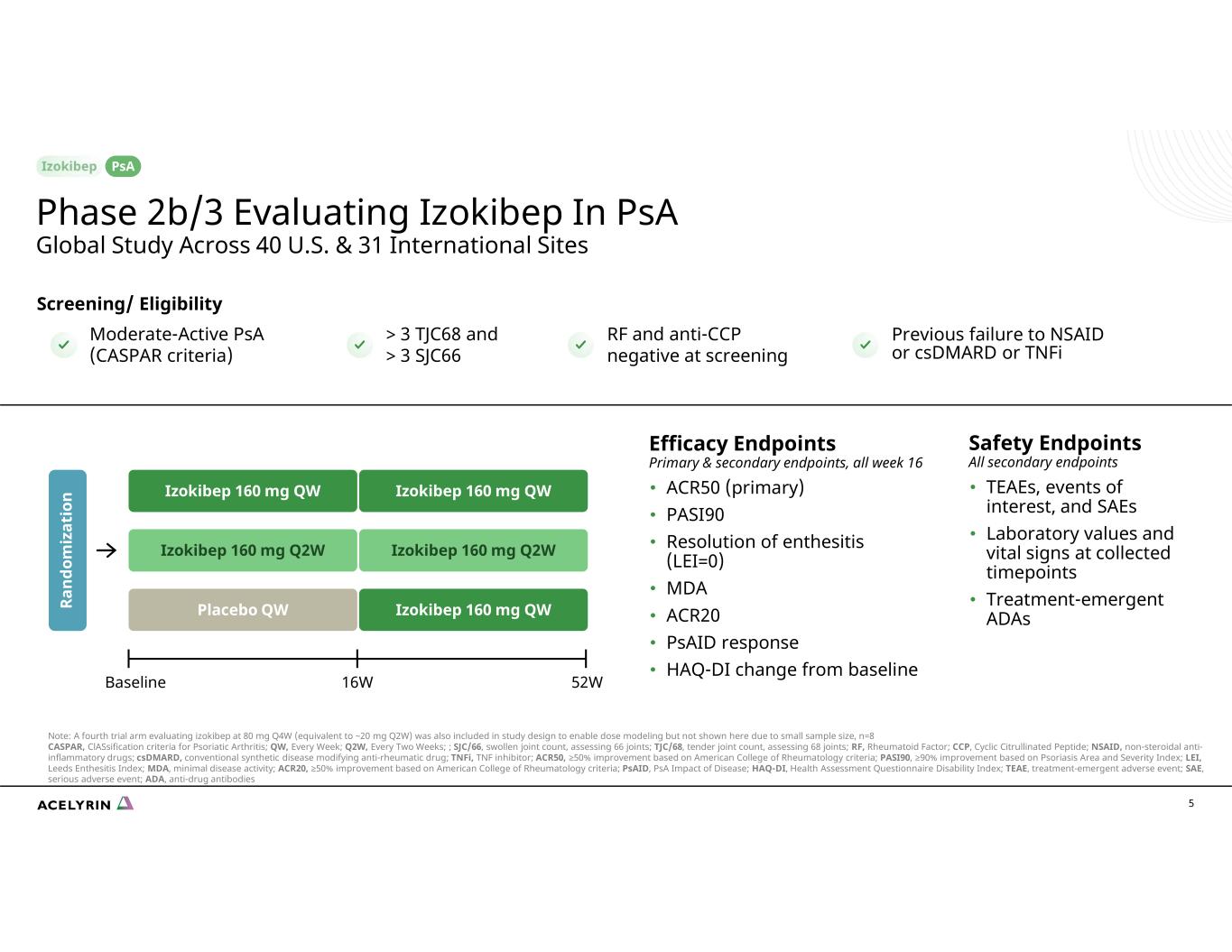
5 個療效終點主要和次要終點,整週 16 • ACR50(主要)• PASI90 • 附着點炎消退(LEI=0)• MDA • ACR20 • PSAID 反應 • HAQ-DI 與基線中度活性 pSA(CASPAR 標準)篩查/資格 > 3 TJC68 和 > 3 SJC66 RF 和抗CCP陰性先前的 NSAID 或 CSDMARD 或 TNFi 16wBaseline 52W Izokieline 52W 160 mg QW Ra nd om iz at io n Izokibep 160 mg Q2W 安慰劑 QW 安全終點所有次要終點 • TEAE、關注事件和 SAE • 收集的實驗室值和生命體徵時間點 • 治療緊急的 ADAs Izokibep 160 mg QW Izokibep 160 mg Q2W Izokibep 160 mg QW 2b/3 階段 2b/3 期評估橫跨美國 40 個和 31 個國際地點的全球研究 psA 注意:第四個試驗組評估艾佐基貝普在 80 mg Q4W(相當於約 20 mg Q2W)的研究設計中也包括在研究設計中,以啟用劑量建模,但由於樣本量小,此處未顯示,n=8 CASPAR,銀屑病關節炎的分類標準;QW,每週;Q2W,每兩週;;SJC/66,關節腫脹,評估 66 個關節;TJC/68,招標關節數,評估 68關節;射頻,類風濕因子;CCP,環瓜氨酸肽;非甾體抗炎藥,非甾體抗炎藥;csDMARD,常規合成疾病改良類抗風濕藥物;TNFi,腫瘤壞死因子抑制劑;ACR50,根據美國風濕病學會標準,改善 ≥ 50%;PASI90,根據銀屑病面積和嚴重程度指數,改善≥ 90%;LEI,利茲附着炎指數;MDA,最低的疾病活性;ACR20,根據美國風濕病學會的標準,改善 ≥ 50%;pSAID,psA 疾病影響;HAQ-DI,殘疾健康評估問卷指數;TEAE,治療緊急不良事件;SAE,嚴重不良事件;ADA,抗藥抗體

6 種相似的 psA Ph 2b/3 Q2W 和 HS Ph 2b Q2W 的 PK 暴露量 • 所有患者均接受了正確的藥物和安慰劑總量 • 每次就診時收集的 PK 樣本顯示:-160 mg Q2W psA PK 暴露與 160 mg Q2W HS PK 相似-160 mg Q2W PK 遠低於預期的每劑量水平的 160 mg Q2W-重疊度低 160 mg Q2W 可解釋性 160 mg Q2W psA PK 暴露量相當於 160mg Q2W HS PK psA PK,藥代動力學;HS,化膿性汗腺炎 psA 第 2b/3 期 HS 第 2b 期

7 Izokibep 160 mg QW n=112 Izokibep 160 mg Q2W n=113 安慰劑 n=118 51.8 (12.2) 49.5 (13.3) 52.6 (11.7) 年齡、平均值 (SD)、64 歲 (57.1) 67 (59.3) 51 (43.2) 男性,n (%) 109 (97.3) 108 (95.6) 110 (93.2) 白人,n (%) 29.1 (5.9) 30.5 (6.6) 29.7 (6.0) BMI,平均值 (SD),kg/m2 103 (92.0) 105 (92.9) 106 (89.8) pSO,n (%) 7.2 (8.2) 6.5 (7.0) 7.3 (7.0) pSa 持續時間、平均值 (SD)、年份 52.748.745.8Any csdMard,% 24.121.22% 3.7Prior TnFi,% 16.8 (13.0) 16.4 (13.0) 16.4 (12.4) TJC/68,平均值 (SD) 9.3 (6.9) 8.1 (5.8) 9.3 (6.9) SJC/66,平均值 (SD) 39.4 (17.8) 37.3 (18.1) 38.3 (18.2) DAPSA,平均值 (SD) b 58.9/(2.9)1.6) 60.2/2.8 (1.7) 63.6/2.9 (1.6) LEI 附着點炎,%/LEI,meana (SD) 66.1/5.0 (3.9) 70.8/5.0 (3.9) 66.9/5.5 (3.7) SPARCC 附着炎,%/SPARCC,meana (SD) 52.7/8.4 (8.8) 56.6/6.9 (6.5) 50.8/6.7 (5.6) pSO BSA ≥ 3%,%/PASI,平均值(SD)5.6(1.9)5.5(2.0)5.2(2.1)PSAID,平均值(SD)1.0(0.6)0.9(0.6)HAQ-DI,平均值(SD)患者人口統計學和基線特徵 psA 完整分析集。亞羣(LEI >0,SPARCC >0,PSO-BSA 在基線 ≥ 3%)。SD,標準差;BMI,體重指數;pSO,牛皮癬;BSA,體表面積;csdMard,常規合成治療疾病的抗風濕藥物;DAPSA,psA 中的疾病活性;SPARCC,加拿大脊柱關節炎研究聯盟;PASI、PASI90,牛皮癬面積和嚴重程度指數;pSAID,pSa 對疾病的影響

8 篩選 N=457 隨機 N=351 安慰劑 n=118 Izokibep 160 mg Q2W n=113 已完成第 16 周 n=116 完成第 16 周 n=106 pSa 患者心態 Izokibep 160 mg QW n=112 已完成第 16 周 n=111 注意:第四個試驗組評估 izokibep 在 80 mg Q4W(相當於約 20 mg Q2W)時為還包括在研究設計中以實現劑量建模,但由於樣本量較小,此處未顯示,n = 8 有兩名患者停止了安慰劑組的治療,兩名患者停止了IZO 160mg Q2W組的治療,還有六名患者停止了IZO 160mg Q2W組的治療已停止對 IZO 160mg QW 手臂的治療。

陽性階段 2b/3 主要結果 9
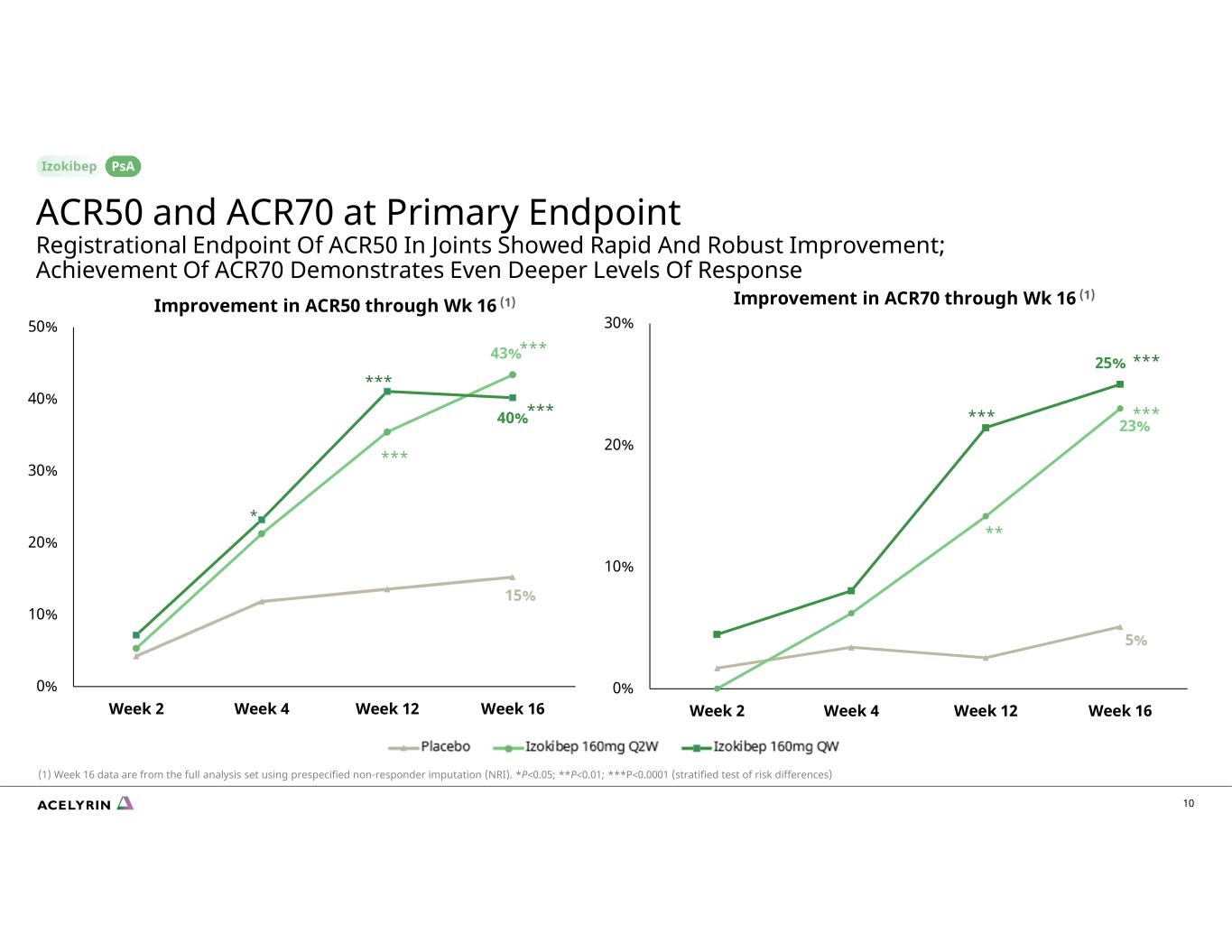
5% 23% 25% 0% 10% 20% 30% 第 2 周第 4 周第 12 周 16% 15% 43% 40% 0% 10% 30% 50% 第 2 周第 4 周 12 周第 16 周 ACR50 的改善到第 16 周 (1) * *** *** *** *** *** (1) 第 16 週數據來自使用預先指定的非響應者估算 (NRI) 的完整分析集。ACR70*P
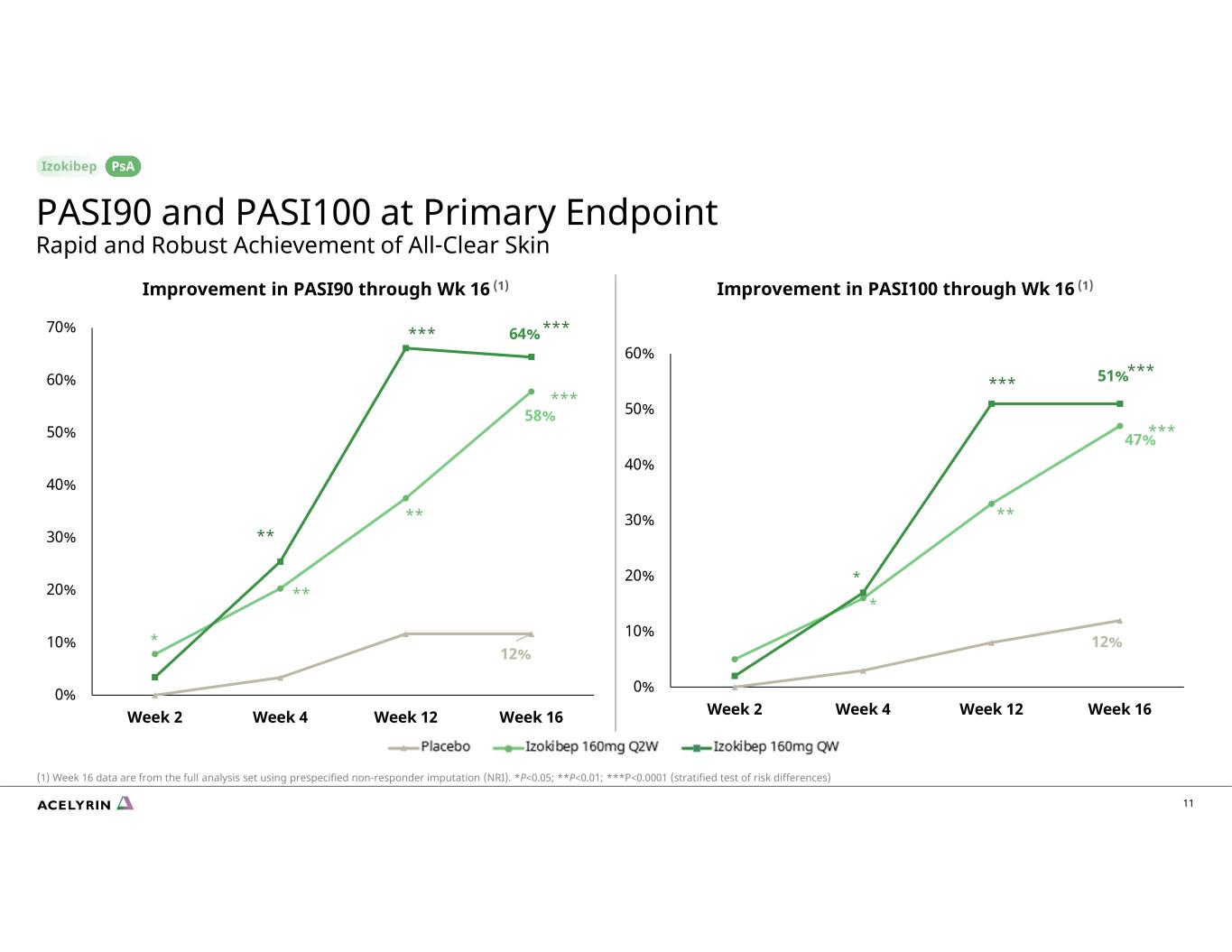
12% 47% 51% 0% 10% 20% 30% 50% 60% 第 2 周第 4 周第 12 周 16 12% 58% 64% 0% 10% 20% 40% 60% 70% 第 2 周第 4 周 12 周 16 * * *** *** *** ***** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** *** 16 個數據來自使用預先指定的非響應器插補 (NRI) 的完整分析集。PASI90 PASI100 PASI90 PASI100*P
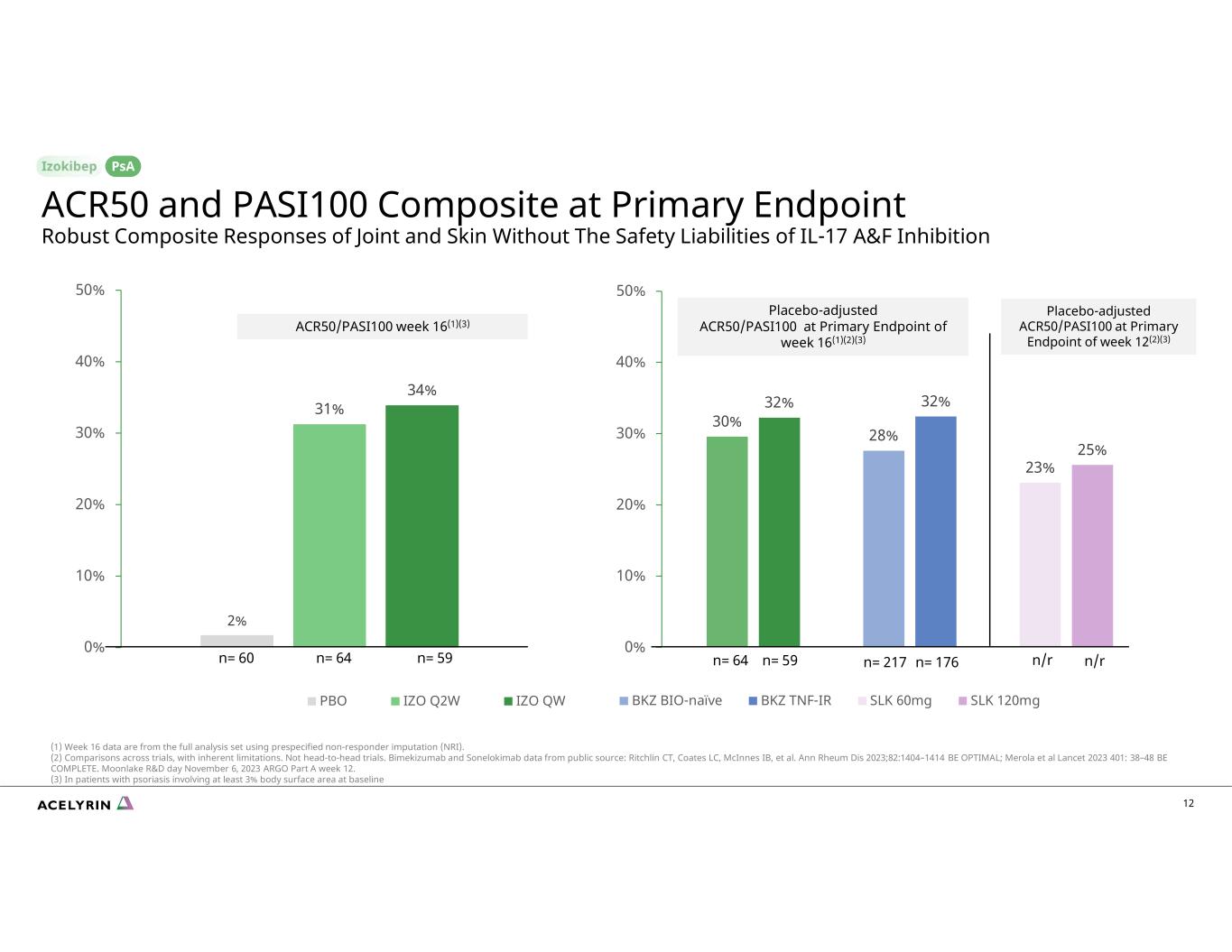
30% 32% 28% 32% 23% 25% 0% 10% 20% 30% 50% BKZ BIO-Naieve BKZ TNF-IR SLK 60mg SLK 120mg 12 ACR50 和 PASI100 複合材料無安全負擔 IL-17 A&F 抑制劑的安全負擔 psA 2% 31% 34% 0% 10% 20% 40% PBO IZO QW 安慰劑調整後的 ACRPA50/QW QW 安慰劑調整後 ACRPA50/QW 第 16 周 (1) (2) (3) ACR50/PASI100 第 16 周 (1) (3) n= 217 n= 176n= 60 n= 64 n= 59 n= 64 n= 59 n= 64 n= 59 n= 64 n= 59 (1) 第 16 周的數據來自使用預先指定的無反應者插補 (NRI) 的完整分析集。(2) 各項試驗的比較,有固有的侷限性。不是正面交鋒的試驗。Bimekizumab和Sonelokimab的數據來自公共來源:康涅狄格州里奇林、Coates LC、McInnes IB等Ann Rheum Dis 2023;82:1404 —1414 是最佳選擇;Merola 等人 Lancet 2023 401:38—48 BE COMPLETE。2023 年 11 月 6 日 Moonlake 研發日 ARGO 第 A 部分第 12 周。(3) 對於基線時體表面積至少為 3% 的牛皮癬患者 n/r n/r 在第 12 周 (2) (3) 的主要終點經安慰劑調整的 ACR50/PASI100
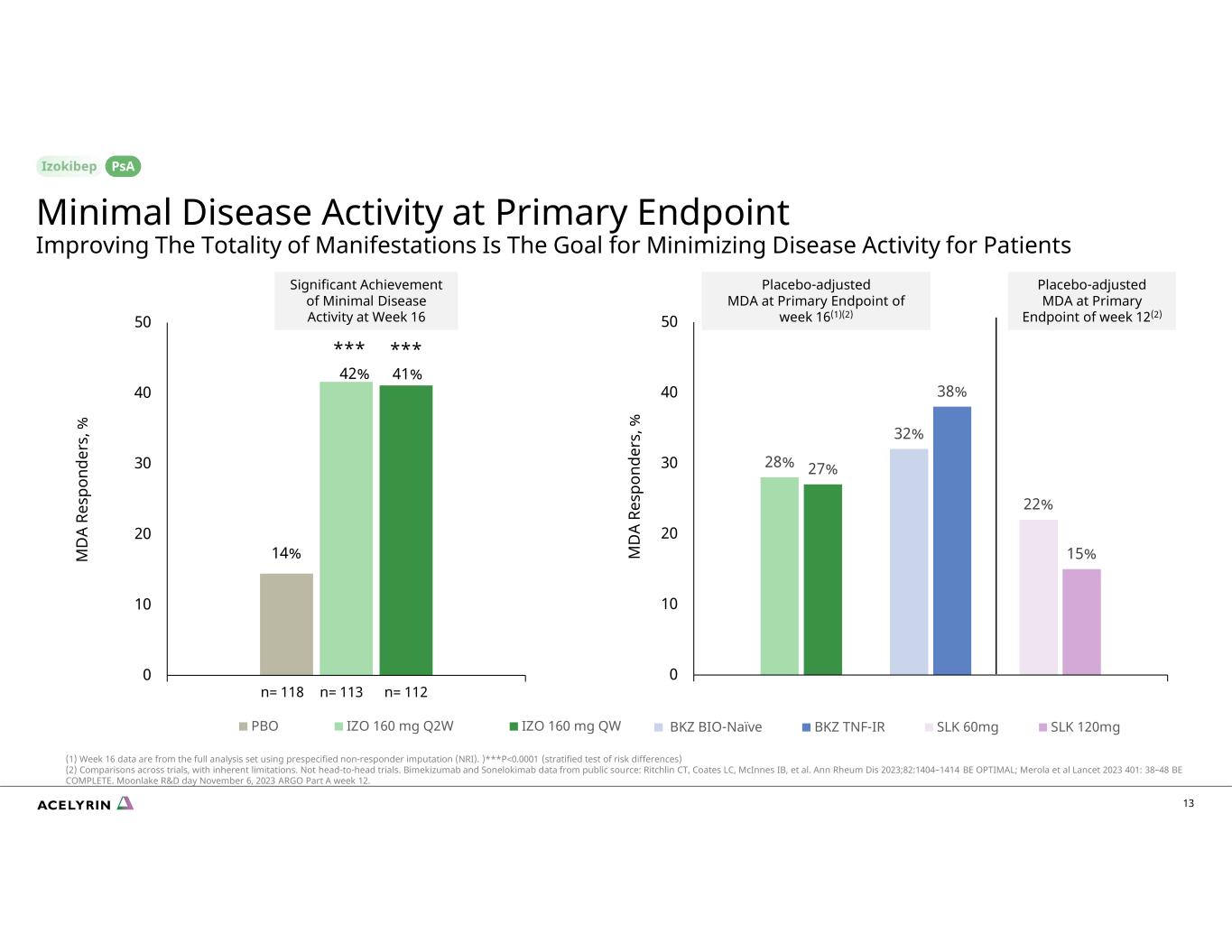
14% 42% 41% 0 10 20 30 40 50 周 16 M D A Re sp on de rs,% PBO IZO 160 mg Q2W IZO 160 mg QW 13 28% 27% 38% 22% 15% 10 20 30 40 50 周 16 M D A Re sp on de rs,% BKZ BIO-Naieve BKZ TNF-IR SLK 60mg SLK 120mg *** 重大成就微乎其微第 16 周的疾病活動最小主要終點的疾病活動改善總體表現是最大限度地減少患者疾病活動的目標 psA n= 118 n= 113 n= 112 在第 12 周的主要終點時安慰劑調整的 MDA (2) 在第 16 周 (1) (2) (1) (1) (1) (1) 的主要終點) 第 16 周的數據來自使用預先指定的非響應者估算 (NRI) 的完整分析集。) ***P
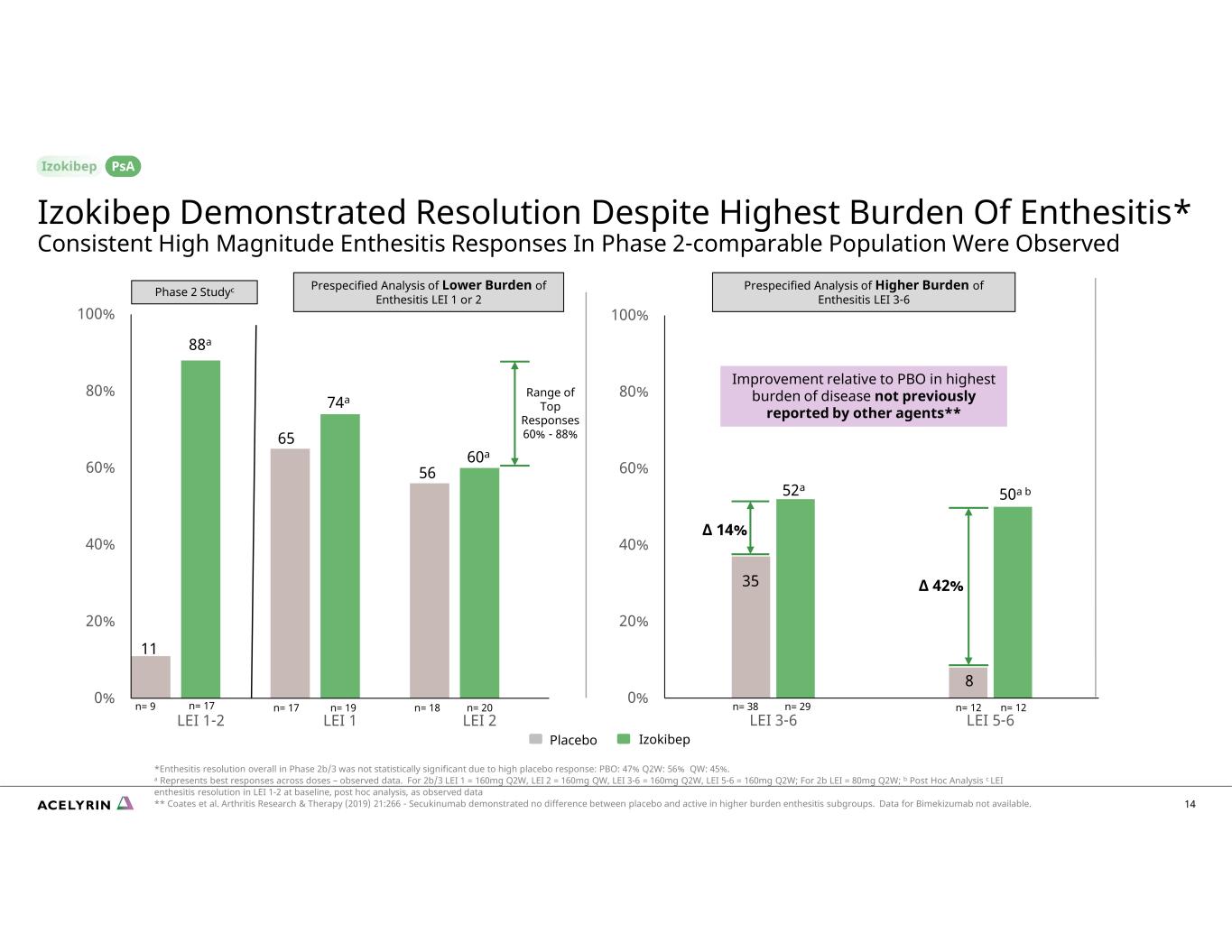
0% 20% 40% 60% 80% 100% LEI 3-6 0% 20% 40% 80% 100% LEI 1-2 LEI 1 LEI 2 熱門回覆範圍 60%-88% 35 88a 11 65 74a 56 60a 52a 14% izokibepPlacebo n= 12n= 12 8 50a b n= 17 n= 17 n= 17 n= 17 n= 19 n= 20 n= 29n= 9 n= 17 β 42% BO 處於其他機構此前未報告的最高疾病負擔** 14 Izokibep 儘管附着炎負擔最高,但仍表現出緩解效果* 在 2 期可比人羣中觀察到持續的高強度附着炎反應 *第 2b/3 期的總體附着炎解決率未達到由於安慰劑反應高,因此具有統計學意義:PBO:47% Q2W:56% QW:45%。a 代表不同劑量的最佳反應——觀測數據。對於 2b/3 LEI 1 = 160mg Q2W,LEI 2 = 160mg QW,LEI 3-6 = 160mg Q2W,LEI 5-6 = 160mg Q2W;對於 2b LEI = 80mg Q2W;b 事後分析 c LEI 1-2 中基線的 LEI 附着炎分辨率,如觀測數據所示 ** Coates 等人關節炎研究與治療(2019)21:266-Secukinumab顯示,在較高負擔的附着點炎亞組中,安慰劑和活性藥物之間沒有區別。Bimekizumab 的數據不可用。psA 對較高附着點炎負擔的預先設定分析 LEI 3-6 第 2 階段研究降低附着點炎負擔的預設分析 LEI 1 或 2

15 Izokibep 160 mg QW n=112 Izokibep 160 mg Q2W n=113 安慰劑 n=118 n (%) 81 (72.3) 75 (66.4) 48 (40.7) 任何 TEAE 3 (2.7) 2 (1.8) 1 (0.8) 1 (0.8) 嚴重的 8 (7.1) 5 (4.4) 0TEAES 導致研究停止 5 (4.5) 1 (0.9) 0 一般障礙和給藥導致研究停止的部位狀況a 000死亡人數首選術語 (≥ 5%) b 60 (53.6) 44 (38.9) 0注射部位紅斑 24 (21.4) 19 (16.8) 1 (0.8) 注射部位瘙癢 9 (8.0) 8 (7.1) 0注射部位腫脹 7 (6.3) 6 (5.3) 1 (0.8) 注射部位疼痛 6 (5.4) 3 (2.7) 4 (3.4) 上呼吸道感染 2 (1.8) 7 (6.2) 0注射部位皮疹 6 (5.4) 2 (1.8) 1 (0.8) 注射部位反應 2 (1.8) 7 (6.2) 0疲勞 6 (5.4) 5 (4.4) 2 (1.7) 任何具有特殊興趣的 TEAE c (0.9) 00口腔念珠菌病 001 (0.8) 皮膚念珠菌病 1 (0.9) 1 (0.9) 0 結腸炎潰瘍性第 16 周安全摘要 psA 安全套裝 a 包括注射部位反應,紅斑和瘙癢。b 最常報告的 TEAE 發生在第 16 周的任何組中,≥ 5.0% 的患者身上。c 僅顯示某些特別感興趣的 TEAE。

16 psA • 僅 Izokibep IL-17A 抑制劑即可快速提高各種疾病表現的分辨率 • 預先指定的分析支持附着炎分辨率的差異化潛力 • 臨牀反應比 IL-17A 藥物報告的更高 • 結果與 IL-17A&F 藥物報告的結果相當,但沒有相關的安全責任 • 研究在 16 周時達到 ACR50 的主要終點,具有很高的統計學意義 • 高障礙取得了顯著的多域反應 ACR70、PASI90、PASI100 和 MDA 的 •鑑於2b/3期的疾病負擔增加,相對於2期的反應強度顯著改善 • 預計將成為銀屑病關節炎兩項註冊試驗中的第一項;160mg Q2W似乎是最佳劑量 • 高障礙複合終點(ACR50/PASI100和MDA)的臨牀反應強勁 • 迄今為止對長期治療沒有安全限制 • 更長的治療時間此前表明,隨着時間的推移,有可能進一步改善積極的標題結果差異化概況深刻而持久的迴應積極的Izokibep 全球第 2b/3 期在 pSa 中的結果

Izokibep 化膿性汗腺炎 2b 期長期 32 週數據 2024 年 3 月 11 日

18 本演示文稿包含非歷史事實的陳述,根據經修訂的1933年《證券法》第27A條和經修訂的1934年《證券交易法》第21E條的定義,這些陳述被視為前瞻性陳述。前瞻性陳述包括但不限於關於我們的候選產品izokibep治療潛力的陳述,包括關於izokibep為患者提供具有臨牀意義的差異化益處的能力,以及izokibep的長期治療可能會隨着時間的推移加深反應而不會出現針對亞單位的藥物的重要安全考慮;izokibep的長期安全性;izokibep的時機和可用性來自臨牀試驗的數據;潛在的市場規模 IL-17A以及我們正在研究的某些適應症的潛在患者羣體的規模,以及其他非歷史事實的陳述。這些前瞻性陳述基於ACELYRIN當前的計劃、目標和預測,本質上受風險和不確定性的影響,這些風險和不確定性可能導致我們的實際業績與此類前瞻性陳述中的預期存在重大不利差異。此類風險和不確定性包括但不限於與成功完成候選產品的開發和監管活動相關的風險和不確定性;我們的臨牀試驗的時間和結果,包括未來結果可能與先前結果存在不利差異(如果適用);我們及時確保候選產品充足供應的能力;充足的資金;法律訴訟及其結果;競爭風險;市場波動;宏觀經濟狀況和其他風險和不確定性影響ACELYRIN,包括在 “風險因素” 標題下不時描述的內容,以及我們向美國證券交易委員會(“SEC”)提交的當前和未來定期報告和其他報告,包括我們最新的截至2023年9月30日的季度10-Q表季度報告。這些文件可在美國證券交易委員會的網站www.sec.gov上查閲。此外,隨時可能出現新的風險,我們預計後續的事態發展可能會導致我們的觀點發生變化。此處的前瞻性陳述是關於本演示日期的,除非適用法律要求,否則ACELYRIN沒有義務在出現新信息、未來發展或其他情況時更新這些陳述。提醒本演示文稿的任何讀者不要過分依賴這些前瞻性陳述。Izokibep目前正在臨牀研究中,沒有對我們的候選產品的安全性或有效性作出任何陳述。除了我們自己的內部研究外,本演示文稿還包含與研究相關或基於從第三方來源獲得的其他數據的信息。儘管我們認為截至本演示文稿之日這些第三方來源是可靠的,但我們尚未獨立核實,也沒有就其充分性、公平性、準確性或完整性做出任何陳述。此外,市場數據(例如市場規模)涉及對我們未來表現和我們經營所在市場的未來表現的許多預測、假設和估計。無法保證其準確性或可靠性,因為它們必然受到高度的不確定性和風險的影響。本演示文稿中的信息截至本演示之日,如有更改,恕不另行通知。商標本演示文稿包含 ACELYRIN 和其他公司的商標、服務標記、商品名稱和版權,這些都是其各自所有者的財產。前瞻性聲明和免責聲明
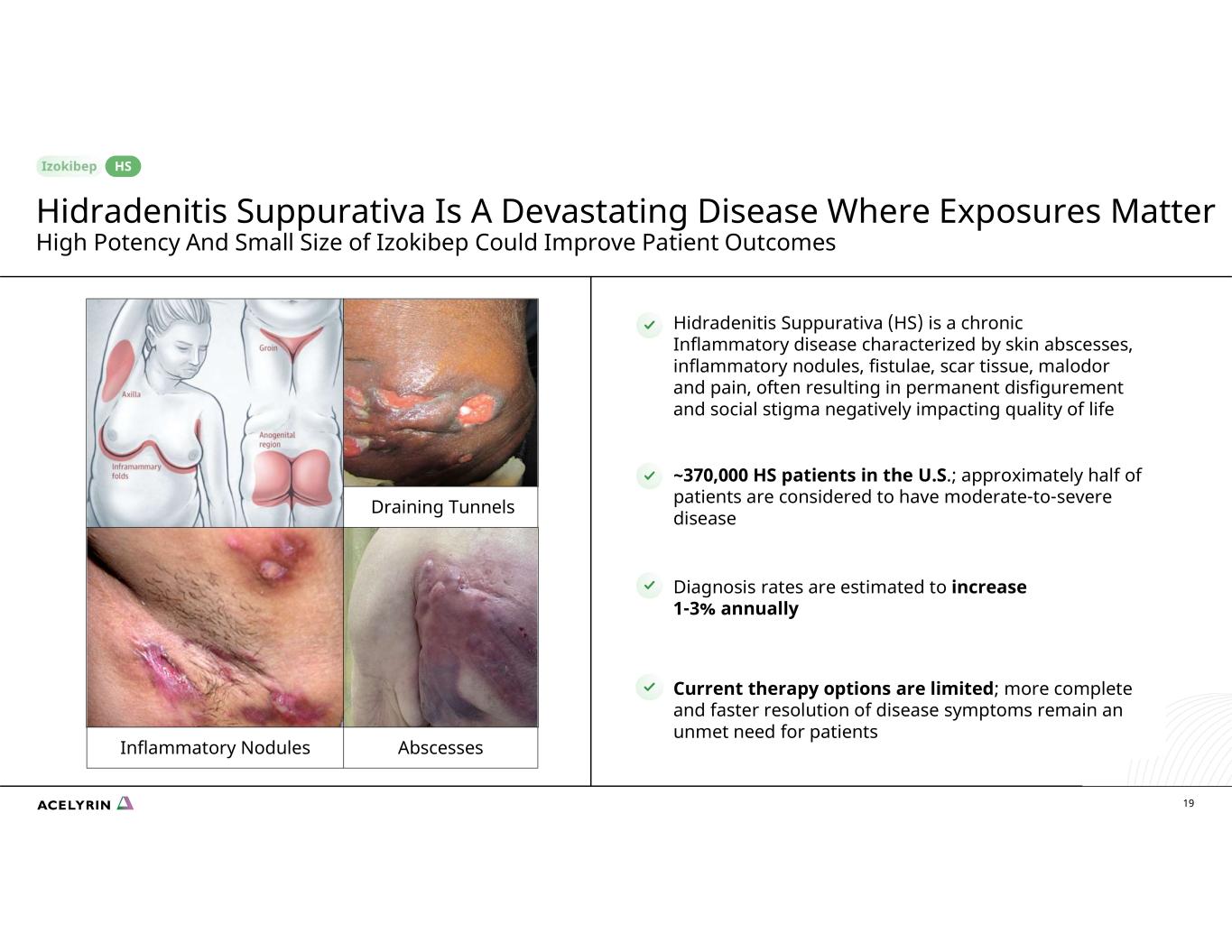
美國有19~37萬名HS患者;大約一半的患者被認為患有中度至重度疾病診斷率估計每年增長1-3%目前的治療選擇有限;更完整、更快地解決疾病症狀仍未得到滿足的患者需求化膿性汗腺炎(HS)是一種慢性炎性疾病,其特徵是皮膚膿腫、炎性結節、瘻管、疤痕組織、惡臭和疼痛,常常導致永久毀容和社會恥辱,對生活質量產生負面影響炎性結節引流隧道膿腫 HS 化膿性汗腺炎是一種毀滅性的疾病,其暴露很重要 Izokibep 的高效力和小體積可以改善患者的預後

20 • 反應的幅度和深度支持這樣的假設,即 izokibep 的特性——包括單獨對 IL-17A 的體積小和強效抑制——可以帶來差異化的臨牀益處 • 膿腫和結節 (Hiscr100) 的解決速度比其他 IL-17A 藥物更快,沒有相關的安全責任,例如劑量依賴性增加的真菌感染風險,HS 患者容易患上這種風險 • 直至第 32 周,所有表現形式都迅速得到劑量順序改善 • hiscr100大約三分之一的患者服用160mg QW,包括從第16周開始改用pbo,持續改善膿腫、結節和排水隧道 • 皮膚疼痛明顯減輕,整體生活質量顯著改善 • HS的3期試驗正在進行中,預計將於2024年底公佈頭條數據 • 我們計劃對大約400名患者進行一項確認性3期試驗,以滿足美國食品藥品管理局的指導方針 HS 對疾病表現的改善差異化概況前進之路 HS 32 週數據顯示持續且深化迴應
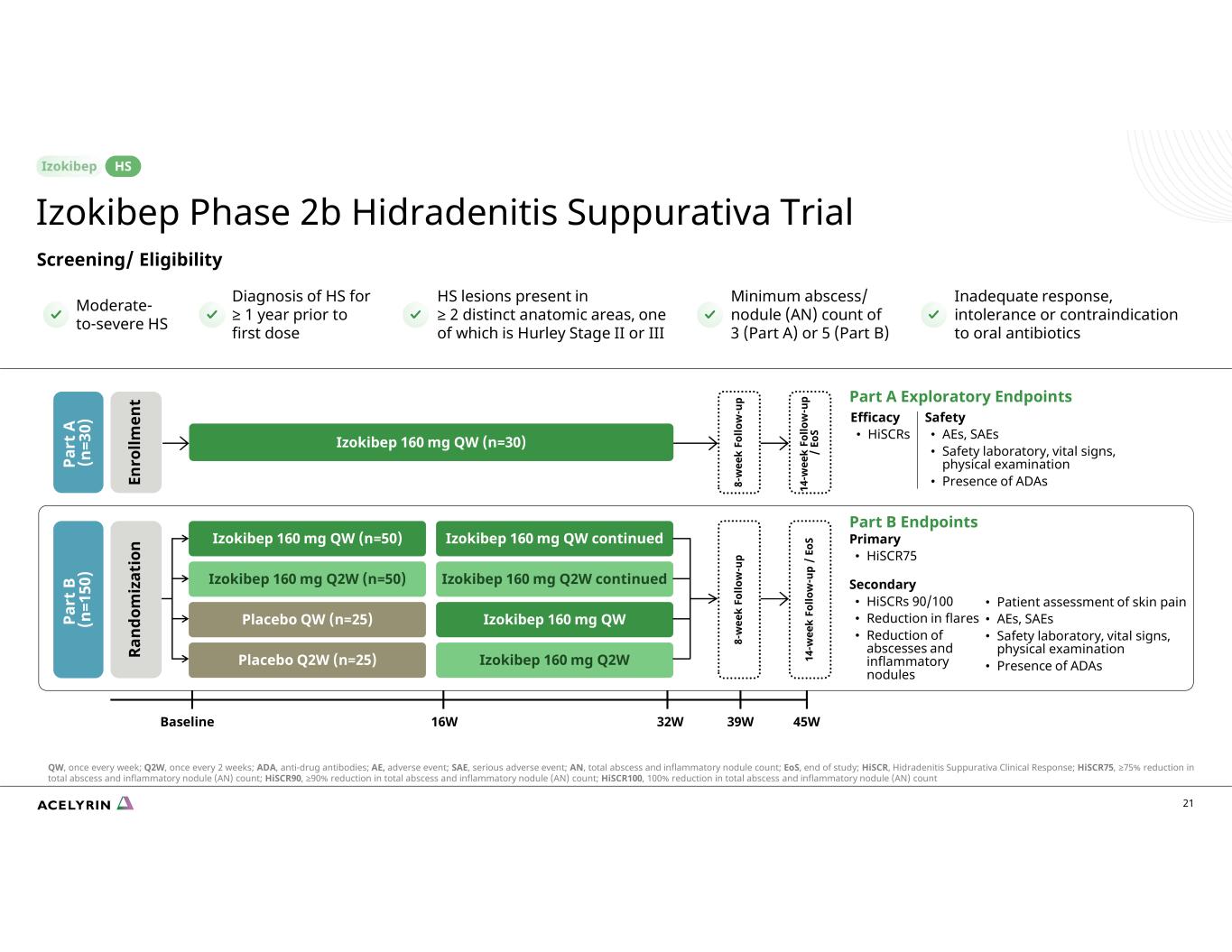
21 篩查/資格 A 部分探索性終點功效 • HiSCRS 16wBaseline 32W 45W39W 8-w ee k Fo llo w-u p 14-w ee k Fo llo w-u p/Eo S Izokibep 160 mg QW (n=30) 安全 • AE、SAE • 安全實驗室、生命體徵、體格檢查 • ADAS B 部分終點的存在主要 • Hiscr75 次要的 • HisCRS 90/s 100 • 減少發作 • 減少膿腫和炎性結節 8-w ee k Fo lo lo w-u p 14-w ee k Fo llo w-u p/Eo sizokibep 160 mg QW (n=50) Izokibep 160 mg QW (n=50) Izokibep 160 mg Q2W 續 Izokibep 160 mg Q2W(n=50)Izokibep 160 mg Q2W(續)Izokibep 160 mg Q2W(n=50)Izokibep 160 mg Q2W 續安慰劑 QW (n=25) Izokibep 160 mg QW 安慰劑 Q2W (n=25) Izokibep 160 mg Q2W • 患者皮膚疼痛評估 • AEs、SAE • 安全實驗室、生命體徵、體格檢查 • ADAS Pa rt A (n =3 0) En ro llm en t Pa rt B (n =1 50) Ra nd om 處於反應不足、不耐受狀態或口服抗生素的禁忌症最低膿腫/結節 (AN) 計數為 3 個 (A 部分) 或 5 個 (B 部分) HS 病變,位於 ≥ 2 個不同的解剖區域,其中之一是 Hurley II 期或 III 期 HS 在首次給藥前 ≥ 1 年中度至重度 HS 的診斷Izokibep 2b 期化膿性汗腺炎試驗 HS QW,每週一次;Q2W,每兩週一次;ADA,抗藥抗體;AE,不良事件;SAE,嚴重不良事件;AN,總膿腫和炎性結節數;EO,研究結束;HisCR,化膿性汗腺炎臨牀反應;HisCR75,總膿腫減少 75% 和炎性結節 (AN) 計數;HisCr90,膿腫和炎性結節 (AN) 總數減少 ≥ 90%;Hiscr100,膿腫和炎性結節 (AN) 總數減少 100%
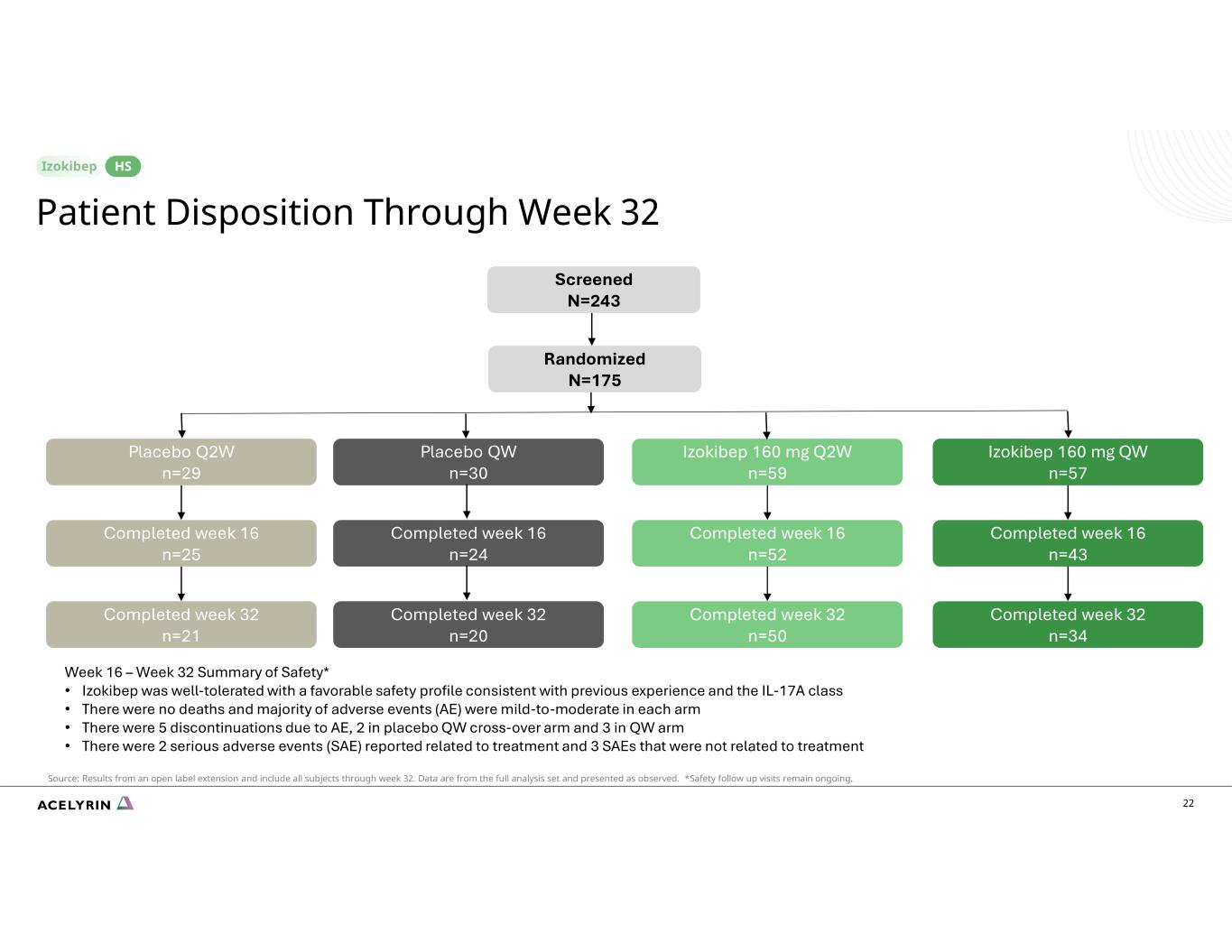
22 名患者在第 32 周 HS 篩查 N=243 隨機 N=175 安慰劑 Q2W n=29 Izokibep 160 mg Q2W n=59 Izokibep 160 mg QW n=57 已完成 16 周 n=25 已完成 16 周 n=52 已完成 16 周 n=43 完成第 32 周 n=50 完成第 32 周 n=50 完成第 32 周 n=34 安慰劑 QW n=30 完成第 16 周 n=30 24 已完成第 32 周 n=20 來源:開放標籤延期的結果,包括截至第 32 周的所有科目。數據來自完整的分析集,按觀察結果顯示。*安全後續訪問仍在進行中。第 16 周 — 第 32 周安全摘要* • Izokibep 耐受性良好,安全性狀況良好,與之前的經驗和 IL-17A 類別一致 • 沒有死亡,大多數不良事件 (AE) 在每個組中為輕度至中度 • 有 5 次因 AE 而停藥,2 例在安慰劑 QW 交叉組,3 例 QW 組 • 報告了 2 起與治療相關的嚴重不良事件 (SAE),3 起與治療無關的
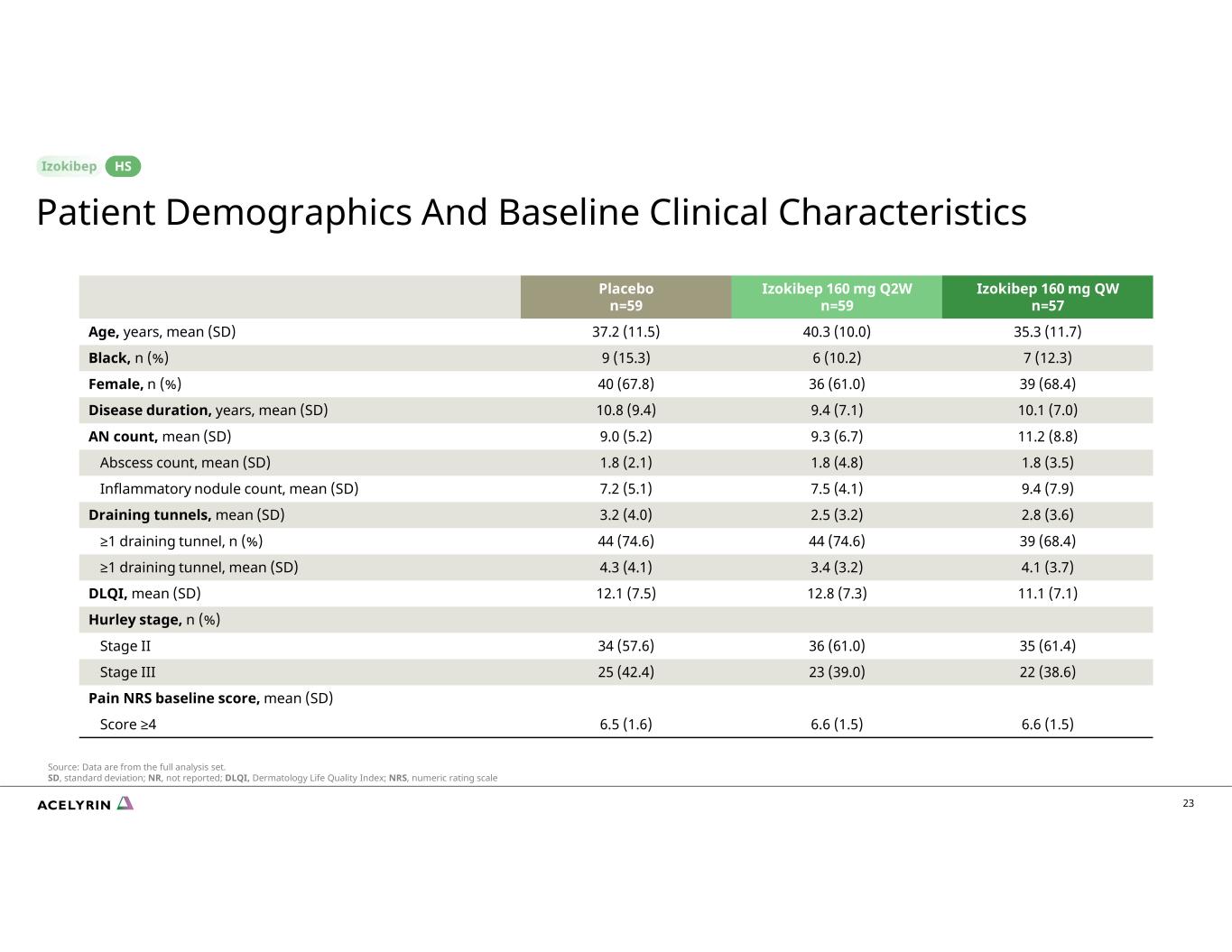
23 Izokibep 160 mg QW n=57 Izokibep 160 mg Q2W n=59 安慰劑 n=59 35.3 (11.7) 40.3 (10.0) 37.2 (11.5) 年齡、年齡、平均值 (SD) 7 (12.3) 6 (10.2) 9 (15.3) 黑人,n (%) 39 (68.4) 36 (61.0) 40 (67.8) 女,n (%) 10.1 (7.0) 9.4 (7.1) 10.8 (9.4) 疾病持續時間、年份、平均值 (SD) 11.2 (8.8) 9.3 (6.7) 9.0 (5.2) AN 計數,平均值 (SD) 1.8 (3.5) 1.8 (4.8) 1.8 (2.1) 膿腫數,平均值 (SD) 9.4 (7.9) 7.5 (4.1) 7.2 (5.1) 炎性結節數,平均值 (SD) 9.4 (7.9) 7.2 (5.1) 炎性結節數,平均值 (SD) 9.4 (7.9) 7.2 (5.1) SD) 2.8 (3.6) 2.5 (3.2) 3.2 (4.0) 排水隧道,平均值 (SD) 39 (68.4) 44 (74.6) 44 (74.6) ≥1 個排水隧道,n (%) 4.1 (3.7) 3.4 (3.2) 4.3 (4.1) ≥1排水隧道,平均值(SD)11.1(7.1)12.8(7.3)12.1(7.5)DLQI,平均值(SD)Hurley 階段,n(%)35(61.4)36(61.0)34(57.6)第二階段 22(38.6)23(39.0)25(42.4)III 階段疼痛 NRS 基線分數,平均值(SD)6.6(1.5)6.6(1.5)6.6(1.5)6.6(1.5)6.5(1.6) 分數 ≥4 患者人口統計學和基線臨牀特徵 HS 來源:數據來自完整分析集。SD,標準差;NR,未報告;DLQI,皮膚科生命質量指數;NRS,數字評級量表
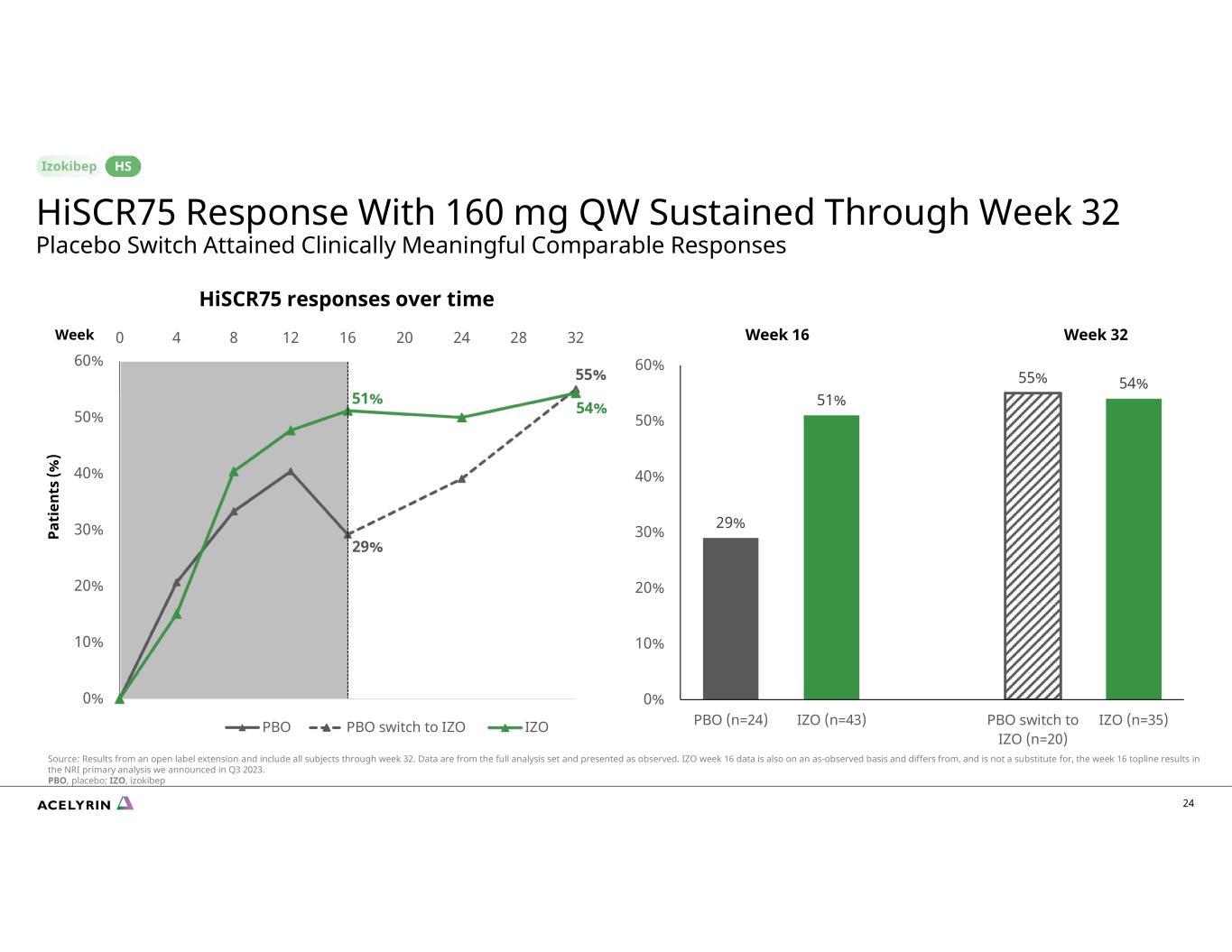
29% 55% 51% 54% 0% 10% 20% 30% 50% 60% 60% 0 4 8 12 16 20 24 28 32 Hiscr75 Hiscr75 隨着時間的推移回復 PBO PBO 切換到 IZO IZO 24 29% 51% 55% 54% 0% 10% 30% 50% 60% 60% PBO (n=43) IZO (n=20) IZO (n=35) 第 32 周 Pa ti en ts (%) 第 16 周 HisCR75 反應,體重為 160 mg QW 持續到第 32 周安慰劑切換獲得了具有臨牀意義的可比反應 HS 來源:開放標籤延期的結果,涵蓋了截至第 32 周的所有受試者。數據來自完整的分析集,按觀察結果顯示。IZO 第 16 周的數據也以觀測結果為基礎,與我們在2023年第三季度公佈的 NRI 初步分析中第 16 周的頭條結果不同,但不能取而代之。PBO、安慰劑;IZO、izokibep
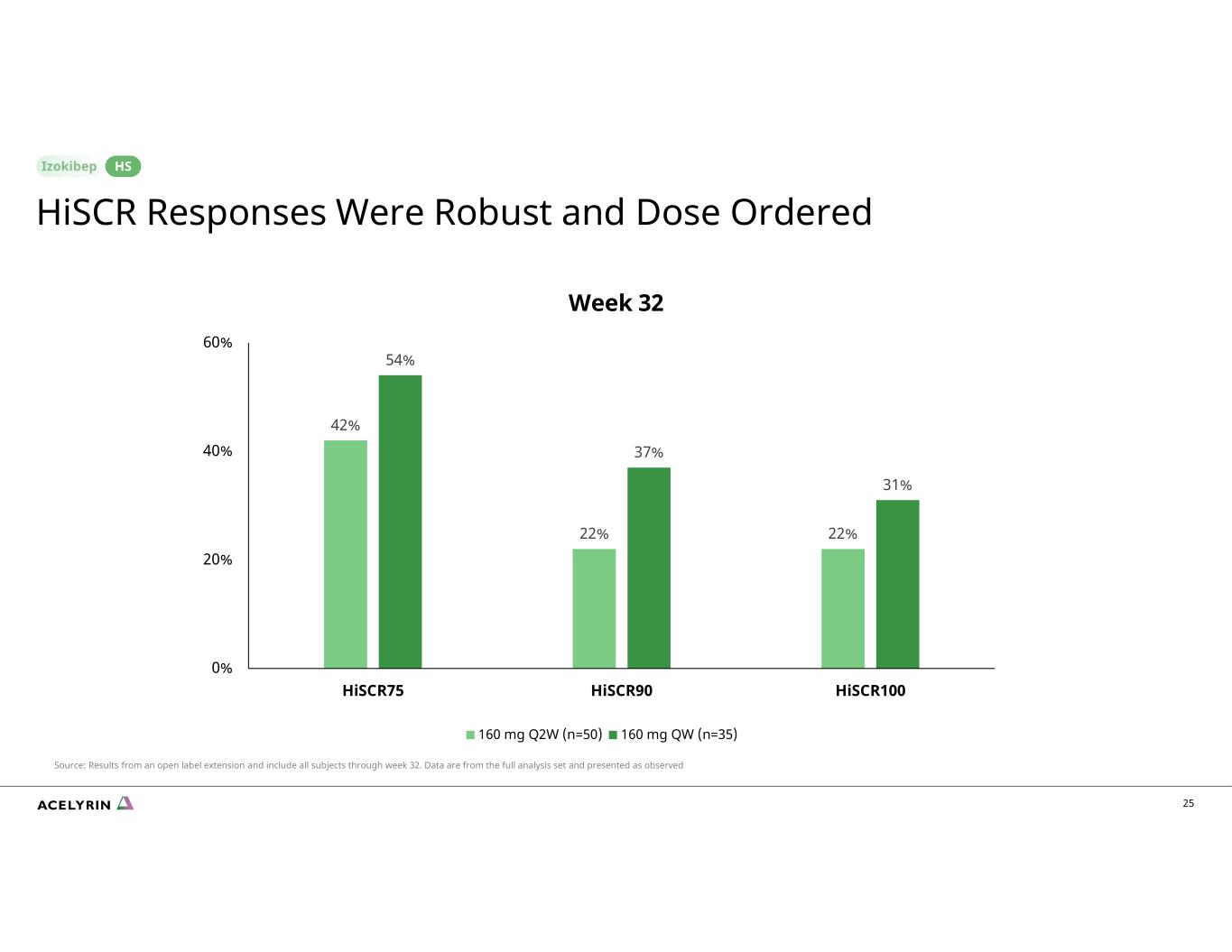
25 42% 22% 22% 54% 37% 31% 0% 20% 40% 60% Hiscr75 Hiscr90 Hiscr90 160 mg Q2W (n=50) 160 mg Q2W (n=35) 第 32 周 HiSCR 反應強勁且劑量有序 HS 來源:開放標籤延期的結果,包括截至第 32 周的所有受試者。數據來自完整的分析集,按觀察結果顯示
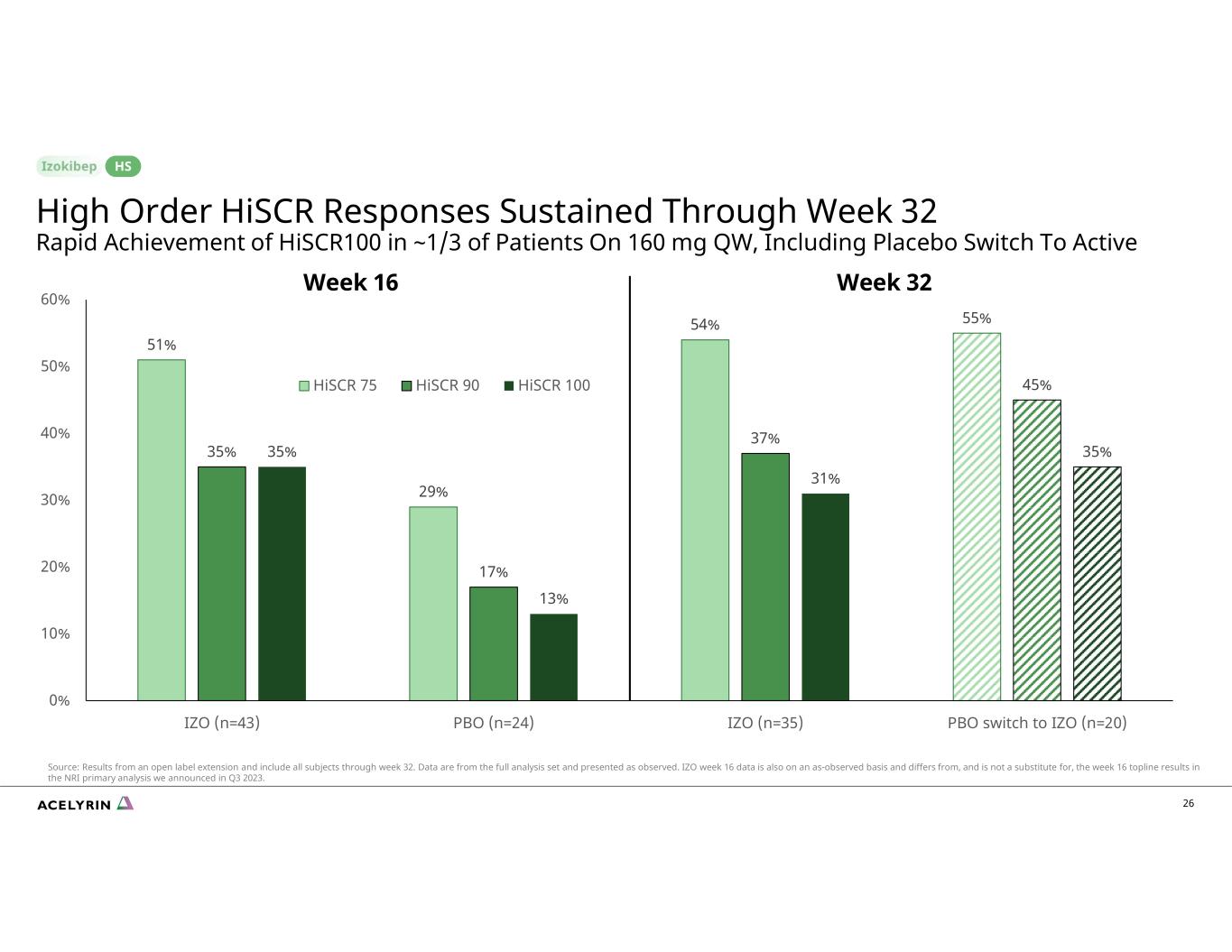
51% 29% 54% 55% 35% 17% 37% 45% 35% 31% 0% 10% 20% 30% 40% 60% IZO (n=43) PBO (n=24) IZO (n=35) PBO (n=35) PBO (n=35) PBO 切換到 IZO (n=20) HiSCR 75 HiSCR 90 HiSCR 100 26 周 32 周高級 HiSCR 反應持續到第 32 周,大約 1/3 的患者快速達到 Hiscr100 160 mg QW,包括安慰劑切換到活性 HS 來源:開放標籤延期的結果,包括截至第 32 周的所有受試者。數據來自完整的分析集,按觀察結果顯示。IZO 第 16 周的數據也以觀察為基礎,與我們在2023年第三季度公佈的 NRI 初步分析中第 16 周的頭條結果不同,但不能取而代之。
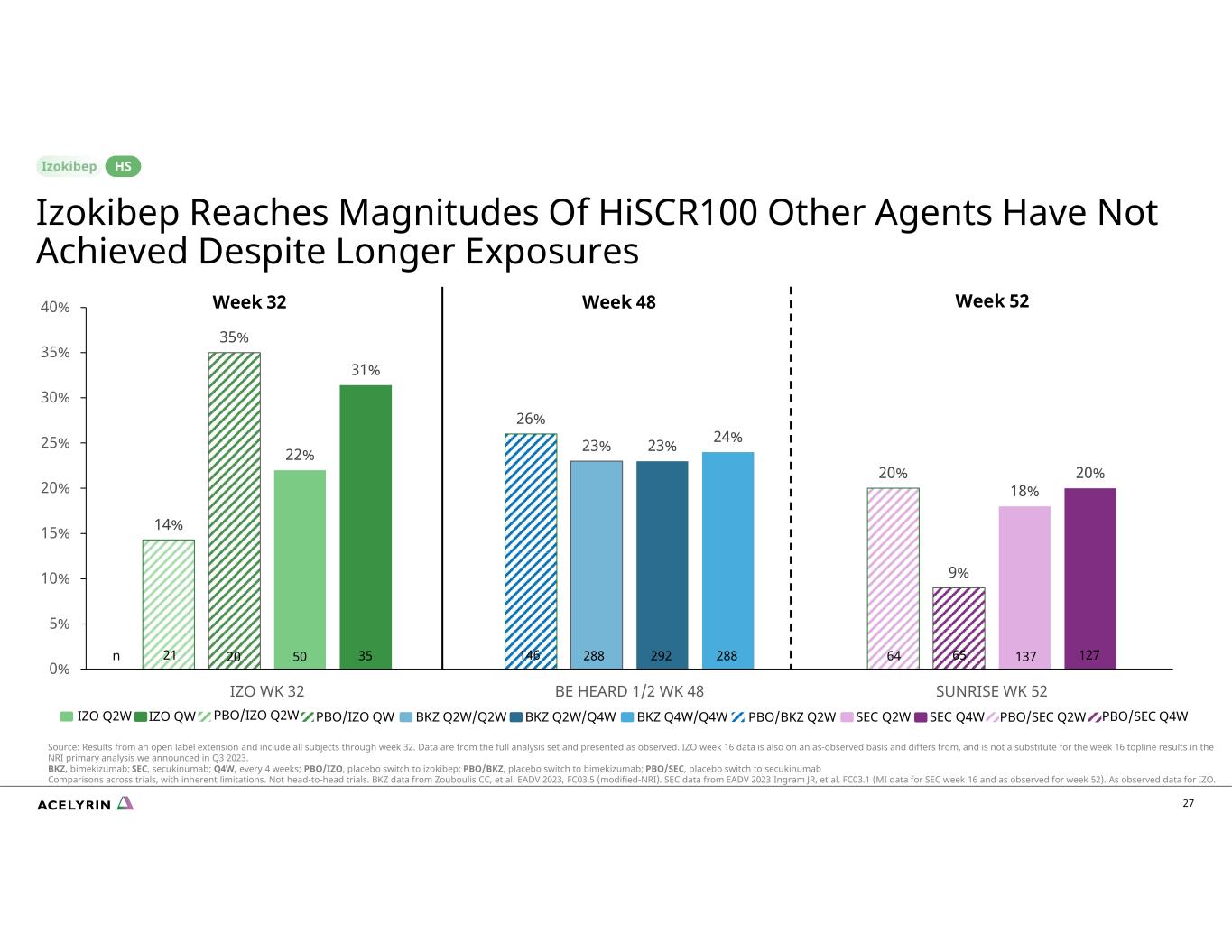
27 14% 26% 20% 35% 23% 9% 22% 23% 31% 24% 20% 5% 15% 20% 30% 35% 40% IZO WK 32 聽見 1/2 周 48 日出 52 周 IZO Q2W 第 52 周 IZO Q2W IZO Q2W QKZ Q2W/Q4W BKZ Q2W/Q4W SEC Q4W/Q4W SEC Q4W/Q4W SEC Q4W/Q4W SEC Q4W/Q4W IZO Q2W PBO/IZO QW 第 48 周 PBO/BKZ Q2W Q2W PBO/SEC Q2W Q2W QBO/SEC Q4W Izokibep 達到了 Hiscr100 的規模,儘管曝光時間更長,但其他代理商仍未達到目標 Hiscr100 來源:公開標籤延期的結果,包括截至第 32 周的所有主題。數據來自完整的分析集,按觀察結果顯示。IZO 第 16 周的數據也以觀測結果為基礎,不同於我們在2023年第三季度公佈的 NRI 初步分析中第 16 周的頭條結果,但不能取而代之。BKZ,bimekizumab;SEC,secukinumab;Q4W,每4週一次;PBO/IZO,安慰劑切換到izokibep;PBO/BKZ,安慰劑切換到比美珠單抗;PBO/SEC,安慰劑切換到secukinumab進行跨試驗比較,但存在固有的侷限性。不是正面交鋒的試驗。來自 Zouboulis CC 等人的 BKZ 數據EADV 2023,FC03.5(修改後的 NRI)。美國證券交易委員會數據來自EADV 2023 Ingram JR等人。FC03.1(美國證券交易委員會第16周的密歇根州數據以及第52周的觀測數據)。正如觀測到的 IZO. 64 65 137 127146 288 292 28821 20 50 35n
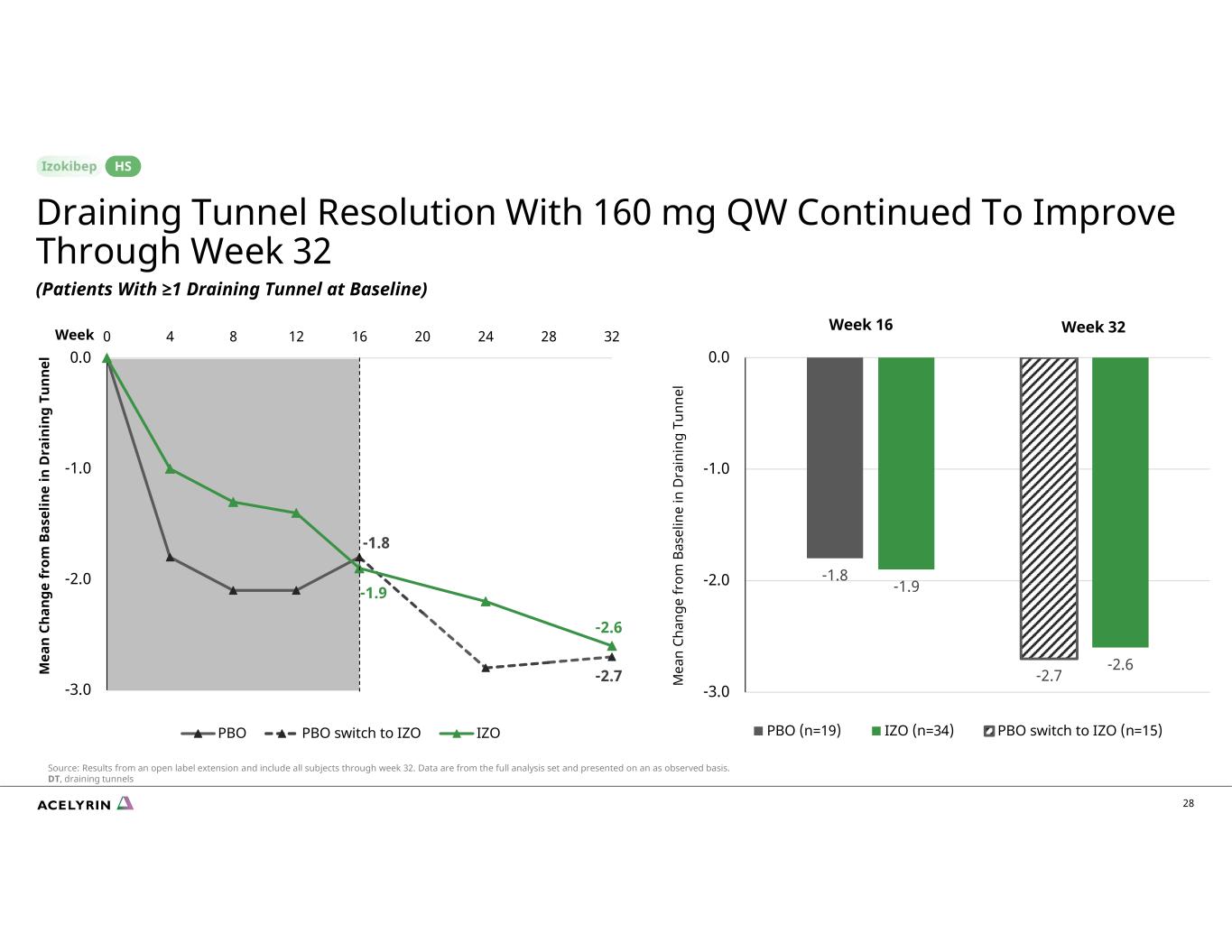
-1.8 -2.7 -1.9 -2.6 -2.0 -2.0 -1.0 0.0 0 4 8 12 16 20 24 28 32 PBO PBO PBO 切換到 IZO IZO -1.8 -1.9 -2.7 -2.0 -1.0 -1.0 0.0 0.0 PBO (n=19) IZO (n=34) PBO 切換到 IZO (n=15) 28 周 16 周 32 M ea n Chan 在 D 時代獲得 om B in in g Tu nn el m ea n Chan ge for om b as el in e in D ra in g g Tu nn el 排水隧道分辨率在 160 mg QW(基線時排水隧道≥1 的患者)持續改善 HS 來源:開放標籤延期的結果,包括截至第 32 周的所有受試者。數據來自完整的分析集,並在觀察的基礎上呈現。DT,排水隧道周
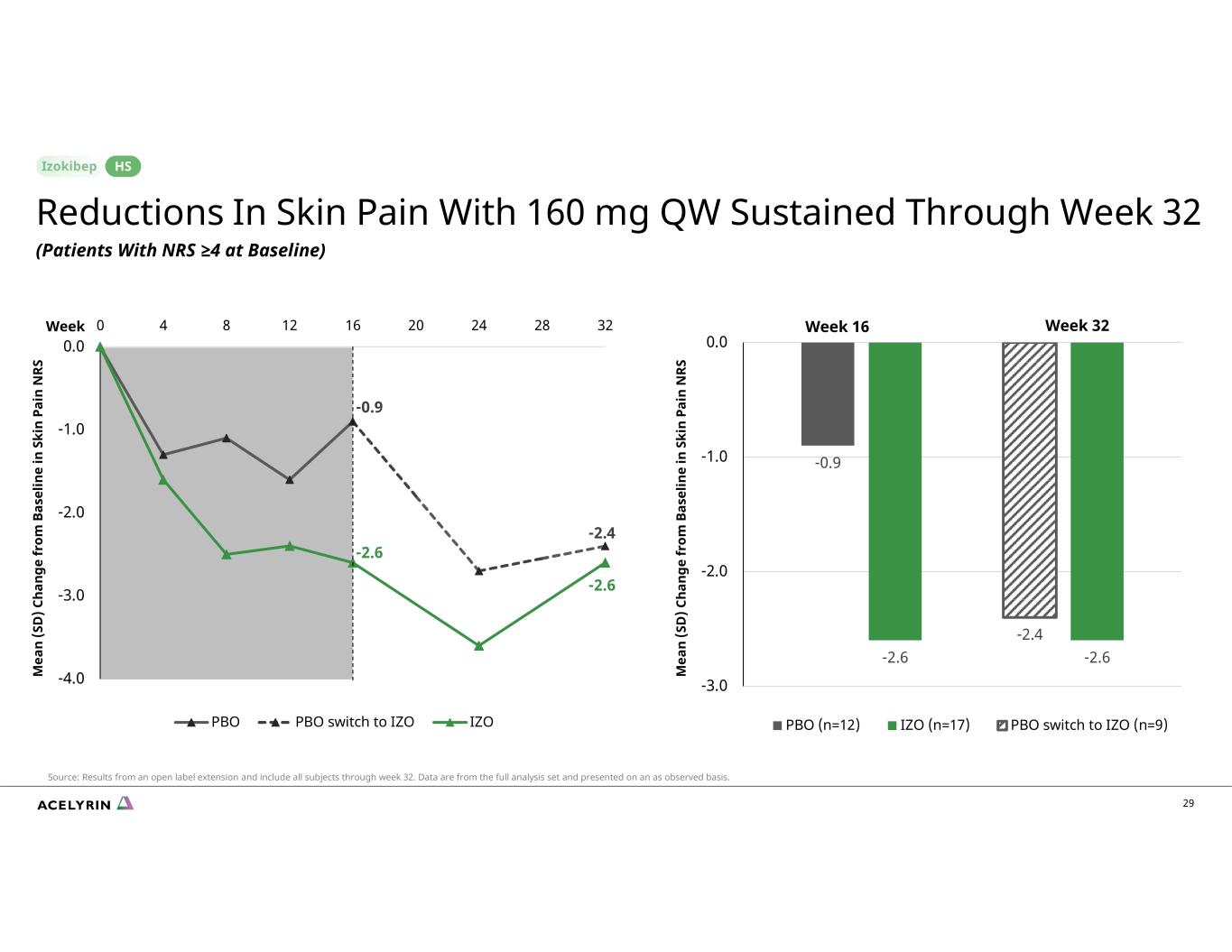
29 周 16 周 32 -0.9 -2.6 -2.6 -2.4 -2.6 -3.0 -2.0 -1.0 0.0 PBO (n=12) IZO (n=17) PBO 切換到 IZO (n=9) M ea n (S D) C 有 ng e 作為我在 S ki n Pa 在 S ki n Pa 中 E 在 S ki n Pa 中 M ea n Pa 在 N RS M ea n (S D) C 有 ng e 在 S ki n Pa 中 M ea n pa 在 S ki n Pa 中 M ea n pa 在 N RS M ea n (S D) C 有 e 在 S ki n Pa 中 N RS -0.9 -2.4 -2.6 -2.6 -2.6 -4.0 -2.0 -1.0 0.0 0 0 4 8 12 16 20 24 28 32 PBO PBO PBO 改用 IZO IZO 減輕皮膚疼痛,持續到第 32 周(基線 NRS ≥4 的患者)HS 來源:開放標籤延期的結果,包括截至第 32 周的所有受試者。數據來自完整的分析集,並在觀察的基礎上呈現。一週
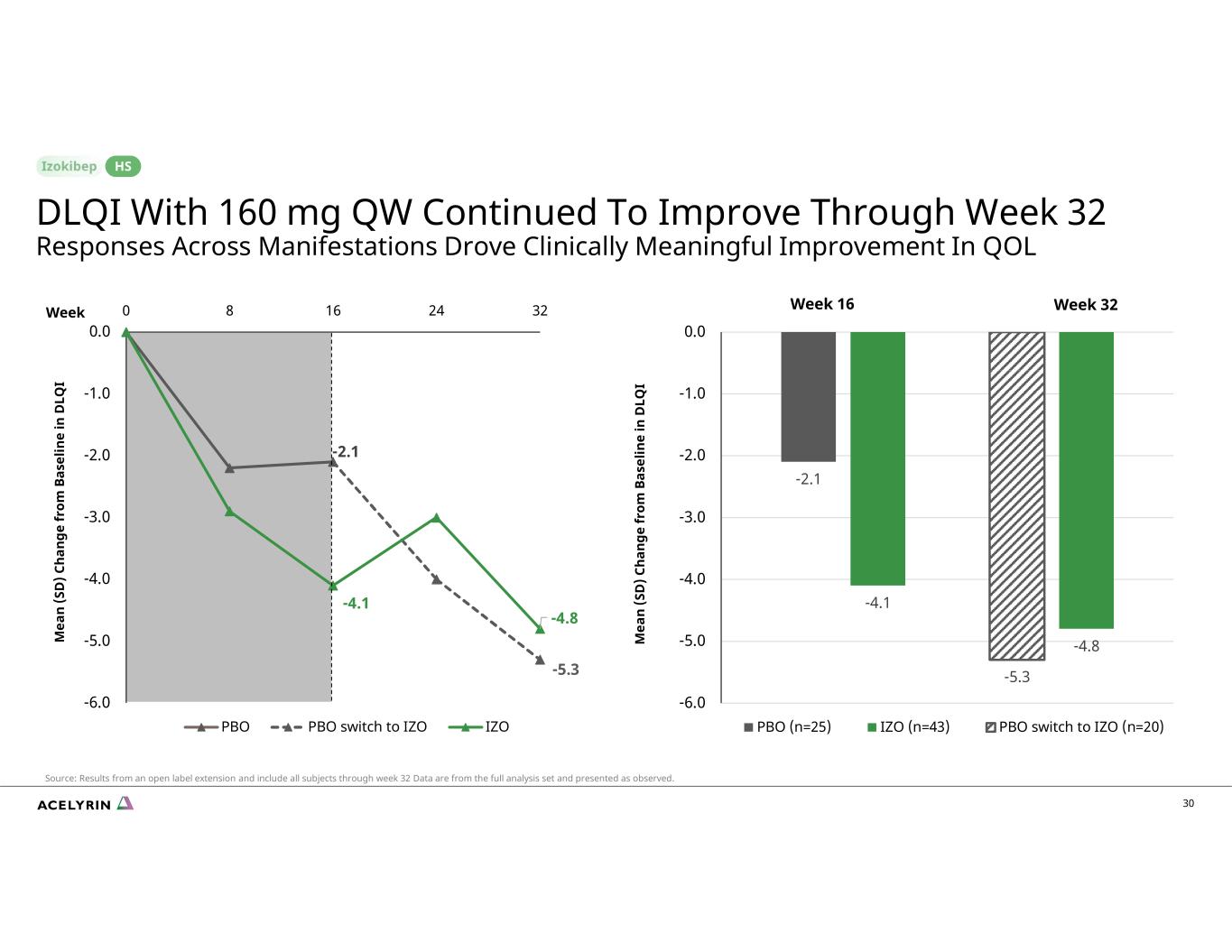
30 -2.1 -5.3 -4.1 -4.8 -6.0 -5.0 -4.0 -3.0 -2.0 -1.0 0.0 0 8 16 24 32 PBO PBO PBO 切換到 IZO IZO 第 16 周 32 M ea n (S D) C 有 ng e for om B as elin e in d D LQ I I -2.1 -5.3 -4.8 -6.0 -5.0 -4.0 -3.0 -2.0 -1.0 0.0 PBO (n=25) IZO (n=43) PBO 切換到 IZO (n=20) QW 為 160 mg 的 DLQI 在第 32 周持續改善所有表現形式的反應推動了 QOL HS 的臨牀意義改善來源:開放標籤延期的結果,包括截至第 32 周的所有受試者數據均來自完整數據分析集合並按觀察結果顯示。一週

31 • 反應的幅度和深度支持這樣的假設,即 izokibep 的特性——包括單獨對 IL-17A 的體積小和高效抑制——可以帶來差異化的臨牀益處 • 膿腫和結節的消除 (Hiscr100) 的速度比其他 IL-17A 藥物更快,沒有相關的安全責任,例如劑量依賴性增加的真菌感染風險,HS 患者容易患上這種風險 • 直至第 32 周,所有表現形式都迅速得到劑量順序改善 • hiscr100大約三分之一的患者服用160mg QW,包括從第16周開始改用pbo,持續改善膿腫、結節和排水隧道 • 皮膚疼痛明顯減輕,整體生活質量顯著改善 • HS的3期試驗正在進行中,預計將於2024年底公佈頭條數據 • 我們計劃對大約400名患者進行一項確認性3期試驗,以滿足美國食品藥品管理局的指導方針 HS 對疾病表現的改善差異化概況前進之路 HS 32 週數據顯示持續且深化迴應