

附錄 99.1 開發治療尿路上皮癌的創新藥物 2024 年 3 月,僅限投資者觀眾。不可用於醫療保健專業人員的促銷用途。

前瞻性陳述本投資者演示文稿包含 1995 年《私人證券訴訟改革法》中定義的 前瞻性陳述,包括但不限於:LG-UTUC 中 Jelmyto、LG-IR-NMIBC 中的 UGN-102 和 HG-NMIBC 中的 UGN-301 的潛在潛在患者羣體以及市場和收入機會;UroGen的專有RTGel® 技術平臺在改善現有藥物治療狀況以推進治療方面的潛力特種癌症和泌尿系統疾病; 對以下方面的期望JELMYTO 收入的年度和長期增長;Jelmyto 的預期收入趨勢;UroGen 支持長期可持續增長的產品線;Jelmyto®、UGN-102 和 UGN-301 分別有可能改變 LG-UTUC、LG-IR-NMIBC 和 HG-NMIBC 的 治療模式;ATLAS 和 ENVISION 的臨牀結果為美國食品藥品管理局可能批准 UGN-102 提供了樂觀情緒;該公司待處理的專利申請,可能不成功,而且 在這種情況下,我們的知識產權保護期限將更加有限;潛力預先給藥 Jelmyto 的優勢;處方者的潛在行為、對處方的預期興趣以及 對 JELMYTO 的認識和採用率不斷提高;預計 UGN-102 將成為 UroGen 未來增長的重要推動力;UGN-102 有可能成為 LG-IR-NMIBC 中首種非手術化療法; UGN-102 與 TURBT 相比的潛在優勢;計劃提交 NDA UGN-102 將於 2024 年向 FDA 提交;對 ENVISION 2024 年第二季度響應時間數據的預期;對安全和劑量數據的預期從第一支機構在 2024 年中期將 UGN-301 評估為單一療法開始; UroGen 的優先事項包括推進 UGN-102 的商業前活動、資本保值計劃、使用銷售策略加速採用 Jelmyto、關注泌尿外科腫瘤學專業知識,以及關注 UGN-301 作為單一療法 和聯合療法以推進免疫腫瘤學產品線;延長了 JELMYTO 穩定期的 2022 年標籤更新所帶來的重要性和運營效率外加劑及其將運營障礙減少到 {br 的潛力} UGN-102 推出時的接受程度;對 JELYMYTO 未來的信心;將 JelmyTO 用作護理標準的可能性;奧林巴斯第 3 期、OPTIMA 2b 期、ATLAS 和 ENVISION 試驗結果的解釋和摘要;SharedjelMyto 和 UGN-102 處方藥庫的規模和 重要性;以及 UGN-301 與 UGN-201 (UGN-302) 合併所產生的令人鼓舞的效果。這些陳述受許多風險、不確定性和假設的影響,包括但不限於: 臨牀試驗的時機和成功以及其中遇到的潛在安全性或其他併發症;先前或正在進行的臨牀試驗的結果可能無法預示將來可能觀察到的結果;可能 影響臨牀試驗進展和報告數據時機的不可預見的延遲;潛在處方者的行為基於初步反饋,這些反饋可能會發生變化新數據、標籤限制的結果,或其他因素;在預期的時間範圍內獲得監管 批准的能力;維持監管部門批准的能力;與產品開發和商業化活動相關的複雜性;任何批准產品的標籤和包裝;UroGen產品和候選產品開發和商業化的範圍、 進展和擴展;市場規模和增長以及市場相對於替代產品的接受率和程度療法;rtGel 技術的表現可能不盡如人意預期和UroGen可能無法成功開發除採用其rtGel技術以及UroGen吸引或留住關鍵 管理層、董事會成員和人員的能力之外的任何候選產品並獲得監管部門的批准。鑑於這些風險和不確定性,以及UroGen於2023年11月14日向證券和 交易委員會(SEC)提交的10-Q表的風險因素部分中描述的其他風險和不確定性,以及UroGen不時向美國證券交易委員會提交的其他文件(可在 http://www.sec.gov 獲得),此類前瞻性陳述中討論的事件和情況可能不會發生, 和UroGen的實際業績可能有所不同與由此預期或暗示的內容相牴觸和不利影響。任何前瞻性陳述僅代表截至本演講之日,並基於UroGen截至本演講之日 獲得的信息。僅適用於投資者受眾。不可用於醫療保健專業人員的促銷用途。

成功的商業產品:UroGen是開創性的 JELMYTO 是第一個 也是唯一一款經美國食品藥品管理局批准的 LG-UTUC 患者非手術治療新療法,可以滿足患者的獨特需求。後期臨牀資產:尿路上皮 UGN-102 被開發為一種微創的非手術選擇,有可能利用 IR-NMIBC 為LG-癌症設定新的護理標準。計劃於2024年提交臨牀保密協議。專有潛在患者人數是LG-UTUC的10倍。有望增強免疫腫瘤學產品線的技術: UGN-301 是一種經過驗證的抗CTLA 4單克隆抗體,用於高檔NMIBC藥物,其交付方式符合泌尿科醫生強勁資產負債表的方式:2023年9月30日在 實踐中提供1.54億美元現金
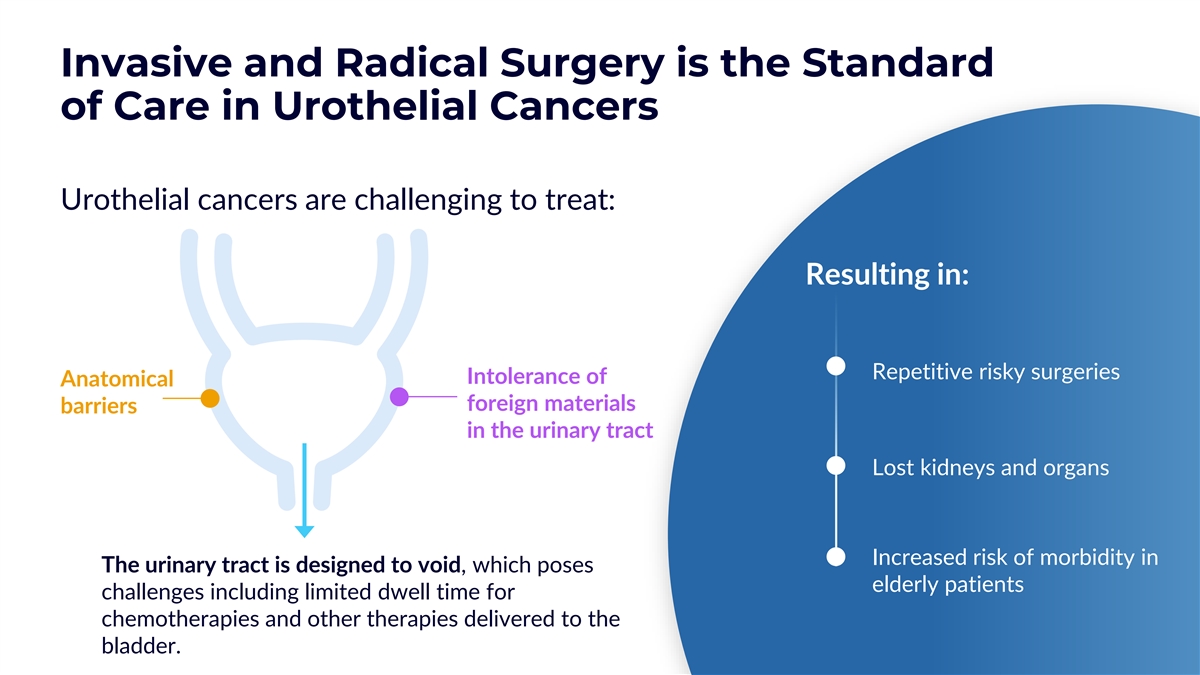
侵入性和根治性手術是尿路上皮癌的護理標準 癌症難以治療:導致:重複的高風險手術不耐受尿路中的解剖學異物屏障失去腎臟和器官的發病風險增加尿路的發病風險增加 旨在避免,這給老年患者帶來了挑戰,包括化療和其他膀胱療法的停留時間有限。

® rtGel 專有的逆熱水凝膠技術獨特 設計用於藥物的局部輸送,可延長活性藥物的停留時間和暴露量。潛在地改善了治療性 rtGel 在較低温度下作為現有產品的液體效應存在,並在體內 温度下轉化為凝膠。利用尿液的生理流動,自然排出體外

解鎖支持長期 可持續增長的強大基礎渠道 JELMYTO UGN-102 UGN-301 (UGN-101) 第 3 階段 1 ~6K — 7K ~18,700 ~82,000 1 個可尋址美國人口可尋址美國人口 20億美元以上市場 30億美元以上市場 7億美元以上市場低級中級 風險低度上路尿路上皮高級非肌肉非肌肉浸潤性膀胱癌 (LG-UTUC) 浸潤性膀胱癌 (LG-IR-NMIBC) (HG-NMIBC) 1.seer*Stat 數據庫(2019)監測研究計劃;Curr Urol Rep(2016)17: 68;Ther Adv Urol。2012 年 2 月;4(1):13—32;UroGen 市場研究。
改變尿路上皮癌的治療模式 JELMYTO (UGN-101)

LG-UTUC 是一種罕見的疾病,在美國每年新診斷的復發患者中,通常會有 6,000-7,000 2,800-3,200 3,000 名符合條件的患者復發,包括:治療方案治療選項 RNU RNU 額外內窺鏡管理管理 70%-80% UC 是美國成本最高的癌症。 LG-UTUC 患者的醫療保健最終每位患者有 4 個系統 3 個接受腎小球腎炎直腸切除術 1.Upfill-Brown 2018,2.Cutress 2012,3.Grasso 等人 (2012) BJU International,4。Yeung 等人(2014)藥物經濟學 RNU = 根治性 腎小管切除術

JELMYTO 首次也是唯一獲得 FDA 批准的 患者 LG-UTUC 1 的非手術治療具有臨牀意義的奧林巴斯第 3 期數據 2 在 3 個月時的完全緩解率 58% 12 個月時的反應持續時間 82% 2 KM 估計中位反應持續時間(14.6 至 47.6 29 個月 3,4 個月)數據來自 長期隨訪研究 1 的數據。重要安全信息和完整的處方信息請訪問 https://www.urogen.com/download/pdf/jelmyto_prescribing.pdf 2。Matin,Surena F. J Urol。2022 年 4 月;207 (4): 779-778 3.Pierorazio,Philip M. UGN-101 治療的長期療效。SUO 2022,#158 4。長期隨訪研究的侷限性包括 N=16。有關此類限制的披露,請參閲參考引文。
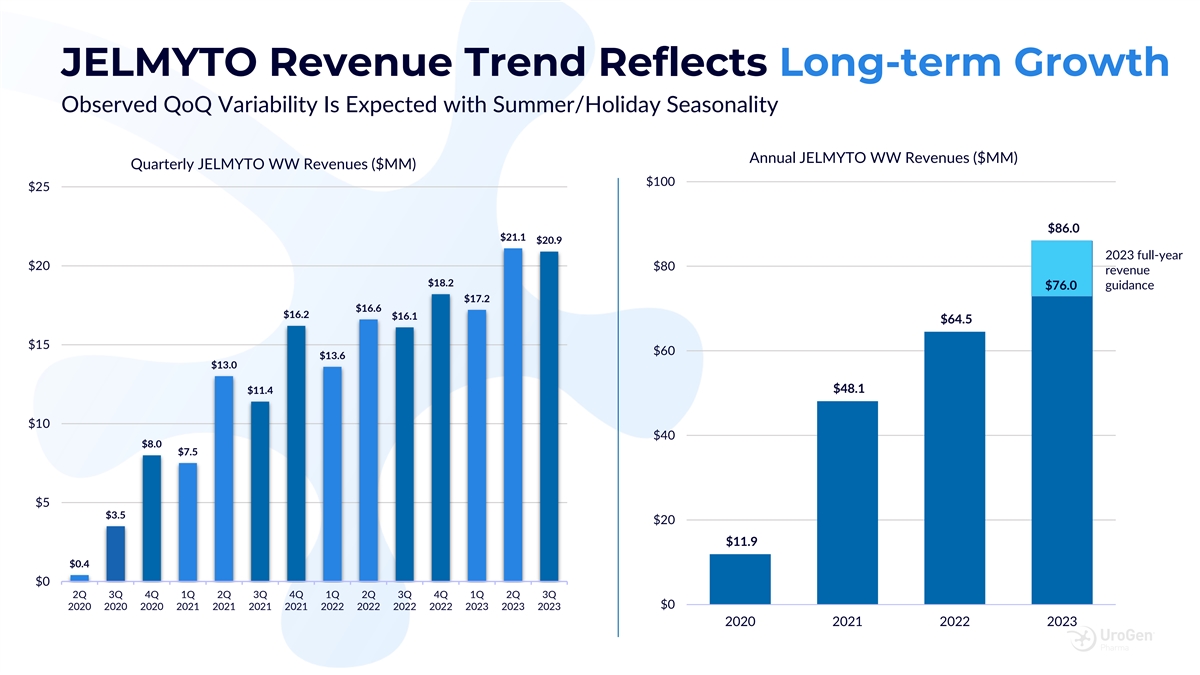
JELMYTO 收入趨勢反映了觀測到的長期增長 預計將出現可變性,夏季/假日季節性 JELMYTO WW 年度收入(百萬美元)季度 JELMYTO WW 收入(百萬美元)100 美元 25 美元 86.0 美元 21.1 美元 20.9 美元 2023 年全年收入 20 美元 80 美元收入 18.2 美元 17.2 美元 16.2 美元 16.1 美元 64.5 美元 60 美元 13.0 美元 48.1 美元 $10 $40 $8.0 $7.5 $3.5 $3.5 $20 $11.9 $0.4 $0 第二季度第三季度第一季度第二季度第四季度第一季度第二季度第三季度第三季度第四季度第一季度第一季度第一季度第二季度第三季度第四季度第一季度第二季度第三季度 $0 2020 2020 2021 2021 2021 2021 2021 2021 2022 2023 2021 2021 2023 2021 2021 2021 2023 2021 2021 2021 2023 2021 2021 2021 2023 2021 2021 2021 2023 2021 2021 2023 2021 202
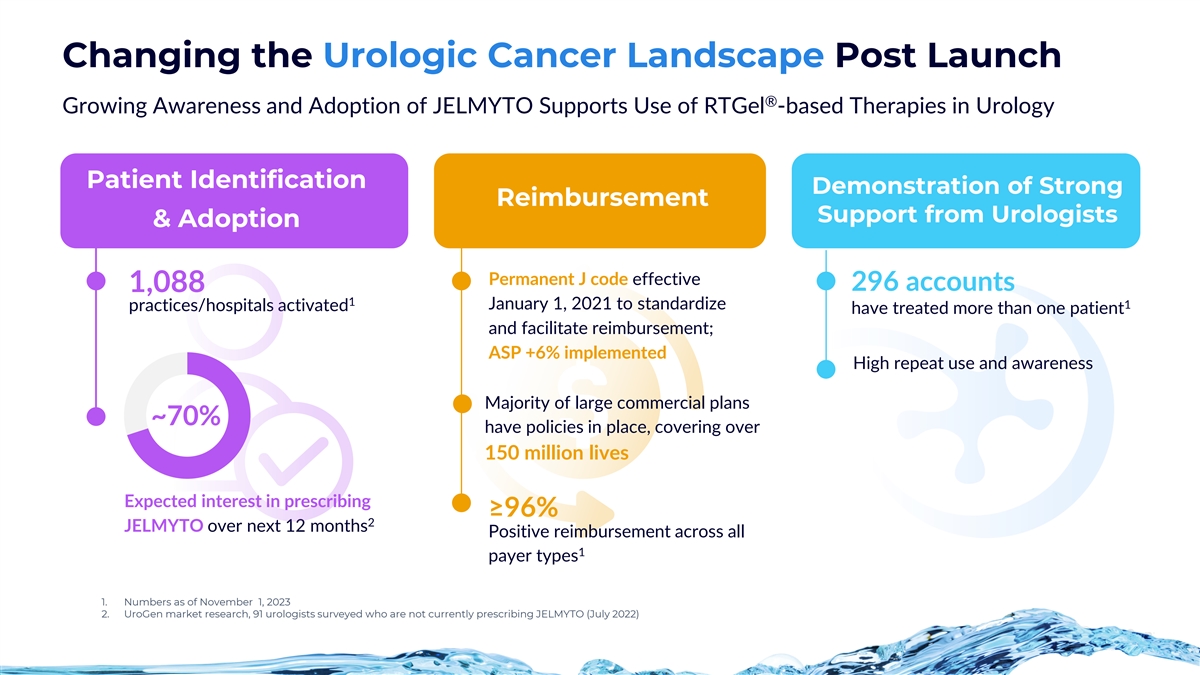
發佈後改變泌尿系統癌症格局® JELMYTO的認識和採用率不斷提高 支持在泌尿科患者識別中使用基於rtGel的療法證明泌尿科醫生的強大報銷支持和採用永久J代碼生效296個賬户 1,088 1 2021 年 1 月 1 日為標準化診所/醫院已啟動治療了多名患者並促進了報銷;ASP +6% • 高重複使用率和認知度 • 大多數大型商業計劃約70%都有政策到位,覆蓋 超過 • 1.5 億在未來 12 個月內,預計有興趣開處方 •≥ 96% 2 JELMYTO • 所有 1 種付款人類型的正向報銷 1.5 億條生命 1.截至 2023 年 11 月 1 日的數字 2.UroGen市場研究,91位受訪的泌尿科醫生目前沒有開JELMYTO處方(2022年7月)

越來越多的真實世界證據*支持JELMYTO 上市2年以上的數據的用例增強了JELMYTO的療效和安全性選擇結果獨立多中心評論支持JELMYTO的真實療效——69% 23%的全球有效性,包括作為化療消融劑和輸尿管治療殘留疾病 當JELMYTO與各種腫瘤類型的評估結果相比,JELMYTO與治療殘留腫瘤的結果進行比較;證據奧林巴斯為44%。對於接受激光治療的低容量疾病患者反應良好,大約1/2的患者 在給藥前進行殘留性疾病消融(奧林巴斯治療的總CR為59%)。不同的練習模式,通過腎造口管進行預先給藥的方法顯示為可行 Woldu 等人。 使用 UGN-101 治療上路尿路上皮癌的早期經驗 — 對實踐模式和結果的多中心評估。UroLoncol。*現實世界的回顧性研究有固有的證據侷限性。有關 對此類限制的披露,請參閲參考引文。

UGN-102:UroGen未來增長的預期主要驅動力 UGN-102 有可能改變低度中等風險非肌肉浸潤性膀胱癌的治療模式 (LG-IR-NMIBC)

UGN-102 有可能成為 低度中等風險疾病中首種非手術化療低級 IR NMIBC 高級 NMIBC 問題:慢性復發;罕見問題:進展、轉移和死亡進展為高級別疾病 SOC:TURBT、BCG、根治性膀胱切除術、SOC:重複性 TURBT 臨牀 試驗與新診斷的對比:約 22K 年發病率:~25K 復發:~60K k/年 BCG-Refractory:18.7K 限量競爭:UGN-102 是臨牀開發人羣中正在進行的 BCG 耐火藥物臨牀試驗。作為非手術 化療鑑於治療反應率和耐久性較低,需求仍有大量未得到滿足的需求卡介苗未被廣泛用於低度目標是避免根治性膀胱切除術疾病 1.ACS 癌症事實與數據 2023 2.SEER、AUA/SUO 聯合指南 3.Babjuk 等 等。歐洲泌尿外科(2019),西蒙(2019),
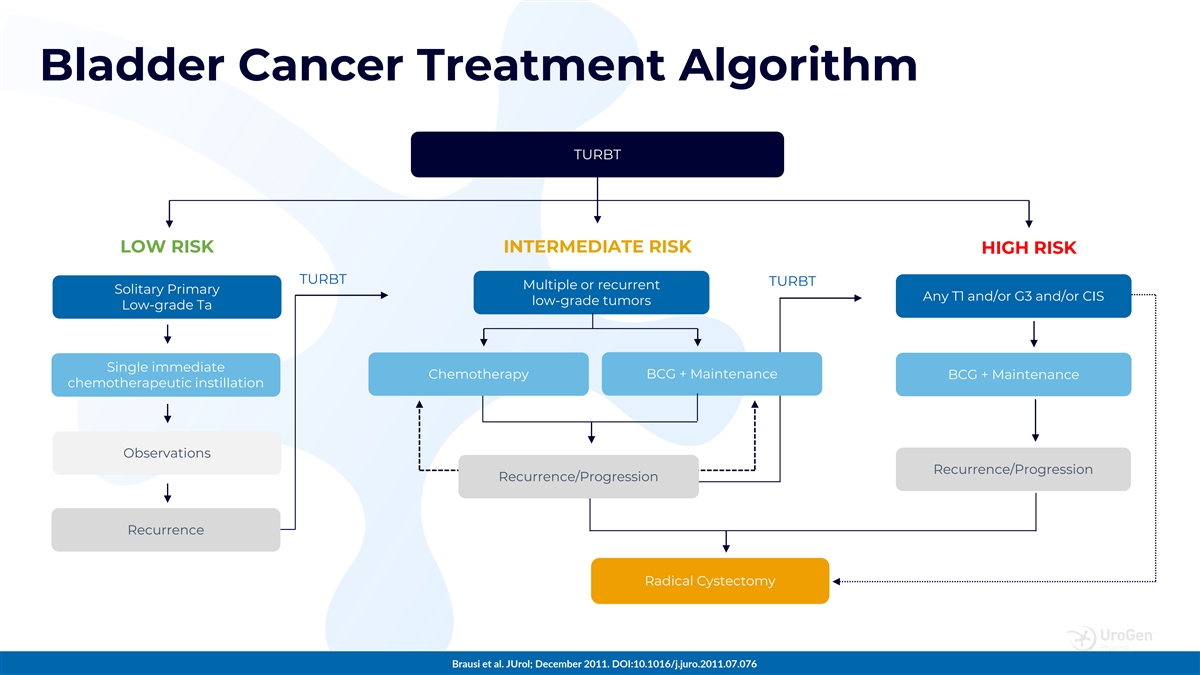
膀胱癌治療算法 TURBT 低風險中等風險 高風險 TURBT TURBT 多發性或複發性孤立原發性任何 T1 和/或 G3 和/或 CIS 低度腫瘤低級 Ta 單次立即化療 BCG + 維持性化療滴注觀察 復發/進展復發根治性囊腫切除術 Brausi 等人JuroL;2011 年 12 月。DOI: 10.1016/j.juro.2011.07.076
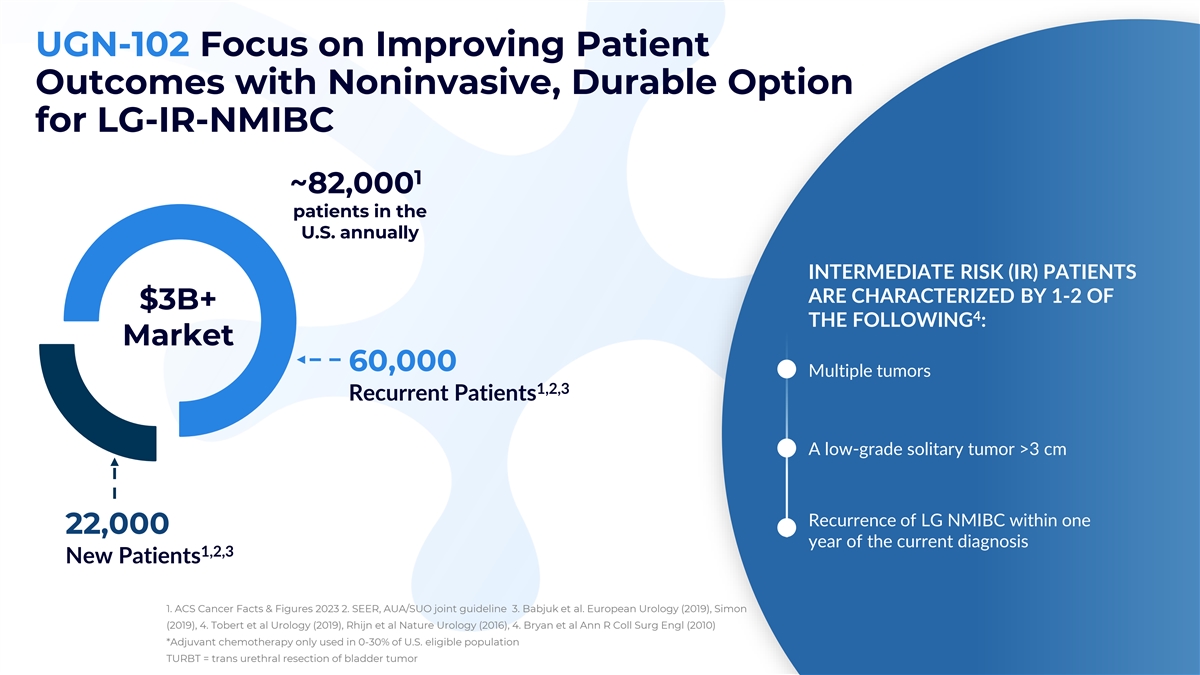
UGN-102 專注於通過針對LG-IR-NMIBC的無創耐用 選項來改善患者的預後 1 ~82,000 名美國每年約有 82,000 名患者,其特徵是 30 億美元以上 4:市場 60,000 多發腫瘤 1,2,3 復發患者 LG NMIBC 在 22,000 年內復發 >3 cm 的低度孤立性腫瘤 在當前診斷後的22,000年內復發 1,2,3 名新患者 1.ACS 癌症事實與數據 2023 2.SEER、AUA/SUO 聯合指南 3.Babjuk 等人。歐洲泌尿外科(2019),西蒙(2019),4。Tobert 等人(2019 年),Rhijn 等 al Nature Urology(2016),4。Bryan 等人 Ann R Coll Surg Engl (2010) *輔助化療僅用於 0-30% 的美國符合條件的人羣 TURBT = 膀胱腫瘤的經尿道切除術
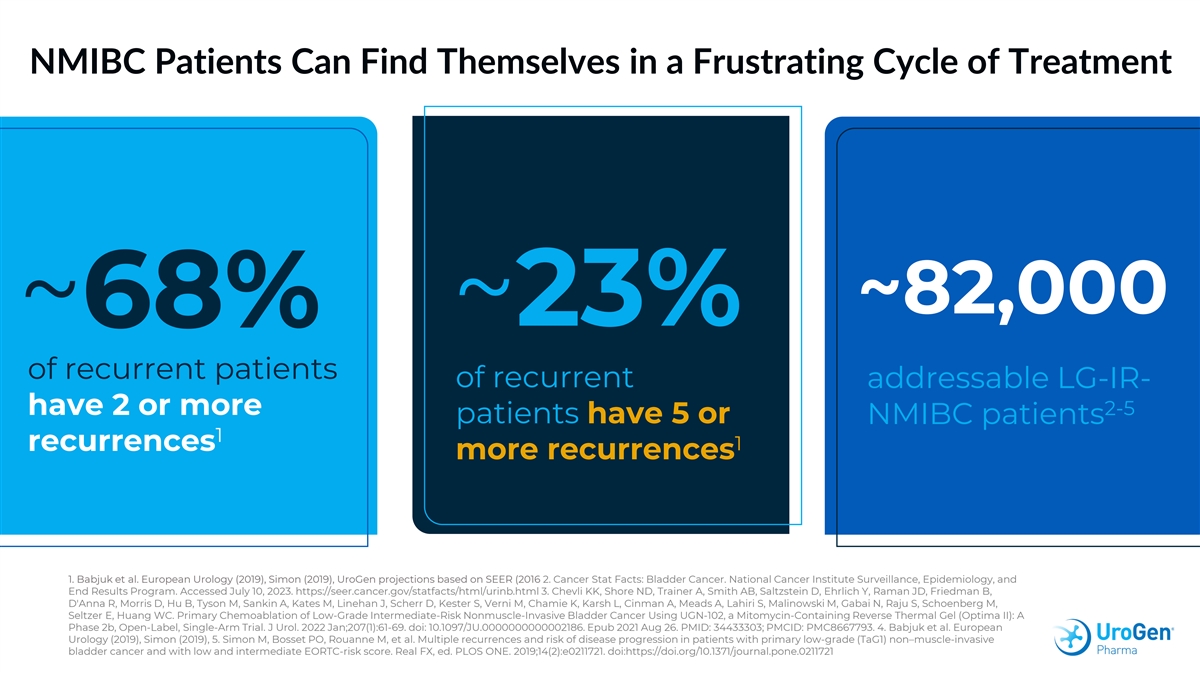
NMIBC 患者可能會發現自己處於令人沮喪的治療週期 ~82,000 ~ 23% ~ 23% ~ 68% 的復發患者有 2 個或更多 2-5 個患者有 5 個,或者 NMIBC 患者 1 1 復發更多 1。Babjuk 等人。歐洲泌尿外科(2019年),西蒙(2019年),基於SEER (2016)的UroGen預測 2.癌症統計事實:膀胱癌。國家癌症研究所監測、流行病學和最終結果計劃。已於 2023 年 7 月 10 日訪問。https://seer.cancer.gov/statfacts/html/urinb.html 3.Chevli KK、Shore ND、Trainer A、Smith AB、 Saltzstein D、Ehrlich Y、Raman JD、Friedman B、D'Anna R、Morris D、Hu B、Tyson M、Sankin A、Kates M、Linehan J、Kester S、Verni M、Chamie K、Karsh L、Cinman A、Meads A、Lahiri S、Malinowski M、Gabai N、Raju S、Schoenberg M、Seltzer E、 Huang WC。使用含絲裂黴素的反向熱凝膠(Optima II)UGN-102 對低度中等風險非肌肉浸潤性膀胱癌進行初步化療:一項2b期開放標籤的單臂試驗。J Urol. 2022 年 1 月;207 (1): 61-69. doi: 10.1097/JU.000000000000002186。Epub 2021 年 8 月 26 日。PMID:34433303;PMCID:PMC8667793。4.Babjuk 等人。歐洲泌尿外科(2019),西蒙(2019),5。Simon M、Bosset PO、Rouanne M 等。 原發性低級 (tag1) 非肌肉浸潤性膀胱癌以及低和中等 EORTC 風險評分的患者的多次復發和疾病進展風險。Real FX,編輯PLOS ONE。2019;14 (2): e0211721. doi: https://doi.org/10.1371/journal.pone.0211721

預計快速採用 UGN-102 1 的患者羣體多次 復發在最近的一項調查中,92% 的泌尿科醫生表示他們 3 人會使用 UGN-102 1 不符合手術資格 1。需求未得到滿足的領域,2019年9月2日進行的定性深度訪談(N = 19 URO,8名患者)早期復發 2. 使用可能性最高,2023 年 9 月進行的定量調查(N = 111)3.基於UroGen在2023年第三季度對111位獲得董事會認證的泌尿科醫生進行的調查。供應商 IQVIA

ENVISION 患者體驗對日常生活產生了積極影響患者 偏好 TurbT 影響了大約一週的日常活動大多數患者報告説,他們每天都會推薦 UGN-102 至 UGN-102 並不會影響其他患者,理由是:大多數患者的責任 • 對日常生活缺乏幹擾 需求未得到滿足 • 侵入性較小 • 痛苦較少 • 耗時幾乎所有患者都強烈認為 • 沒有術後導管的非手術治療比手術工作更可取作者:UNC-Chapel Hill 教師(Stover AM 和Smith AB)採訪了參與ENVISION三期試驗的NMIBC(N=31)患者。論文正在編寫中。

UGN-102:利用相似之處具有明顯優勢® JELMYTO 和 UGN-102 UGN-102® • rtgel 和絲裂黴素 • 患者羣體潛在製劑增加 10 倍® • 絲裂黴素 rtGel • 膀胱給藥組合 UGN-102 比上道給藥更簡單 • 遺傳和突變 JELMYTO 的類似疾病 • 泌尿科辦公室和 UGN-102 非常熟悉的駕駛級診所常規手術 • 共享95%的處方者基礎 • 沒有像 透視這樣的特殊設備
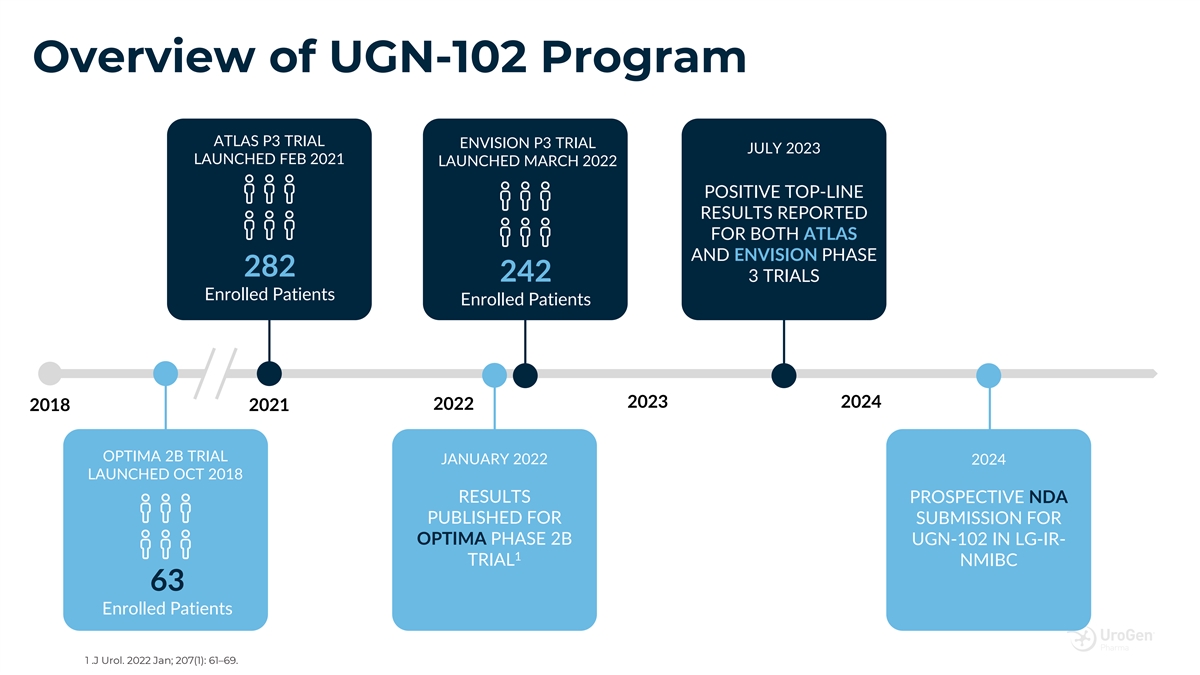
UGN-102 項目概述 ATLAS P3 試驗 2023 年 7 月啟動的 ENVISION P3 試驗於 2021 年 2 月啟動 2022 年 3 月啟動 ATLAS 和 ENVISION 282 期均報告了陽性 242 3 項試驗入組患者 2024 年 2 月 2021 年 1 月 OPTIMA 2B 試驗 2024 年 1 月發佈了 LG-IR-1 試驗中 OPTIMA 2B 期 UGN-102 的前瞻性保密協議 NMIBC 63 入組患者 1 .J Urol 2022 一月; 207 (1): 61—69。

ENVISION:3 個月疾病評估的迴應率摘要 UGN-102 (N = 240) n (%) CRR (95% CI) 完全迴應率完全迴應 190 (79.2) 79.2 (73.5、84.1) 非完全反應 50 (20.8) 79.2% 殘留疾病 35 (14.6) 進展至 HG 疾病 6 (2.5) 不確定 4 (1.7) 缺少 5 (2.1) 存檔的 UroGen 數據 3 個月疾病評估的迴應率摘要

UGN-102 在兩項三期臨牀試驗 4 4 Endpoint ENVISION ENVISION ATLAS ITT ATLAS 復發亞組中均顯示出令人信服的臨牀結果。新診斷和之前被診斷為之前有 TURBT 1 的 TURBT 復發患者 79% 74% 對 53% 65% 對 64% 相似的CRR;為患者 2 2 66% 與 40% 對比 80% 與 68% 的緩解持續時間 (DOR) 待定 CR 後 12 個月 HR = 0.34(風險降低 66%)HR = 0.46(風險降低 54%)3 3 無病生存 (DFS) 72% 對比 37% 72% 對比不適隨機分配 12 個月時為 50% HR=0.295(風險降低 70%)HR= 0.45(風險降低 55%)未達到與未達到無病存活率中位數(DFS)7.2 個月 14.8 個月 Prasad 等人JuroL,2023 年 8 月 7 日,1. 完全緩解定義為在接受治療後的3個月評估中膀胱中沒有可檢測到的疾病(NDD)UroGen存檔數據,來源:表 14.2.2.2.1a 2。 Kaplan-Meier 分析(共計 15 個月)在 CR 後 12 個月維持持久反應的可能性 3.定義為從隨機分組到事件最早發生日期的時間(總計 12 個月)4.治療組的患者接受了 UGN-102 +/-TURBT 對比單獨接受 TURBT

展望未來:預計計劃在 2024 年第二季度前 2024 年第四季度提交的 NDA 中提供 ENVISION DOR 數據

UGN-103:下一代新型絲裂黴素基配方的潛力 優勢與medac GmbH簽訂許可協議,將生產下一代新型絲裂黴素基配方商業化。將UroGen的rtGel® 技術與美達克的專有絲裂黴素成本相結合 uroGen 計劃在 2024 年啟動一項第 3 階段研究,評估 UGN-103 在 LG-IR-NMIBC 產品便利性方面的潛在知識產權保護 2041 年

將潛在的單一療法和組合療法擴展到免疫腫瘤學 JELMYTO UGN-102 UGN-301 (UGN-101)
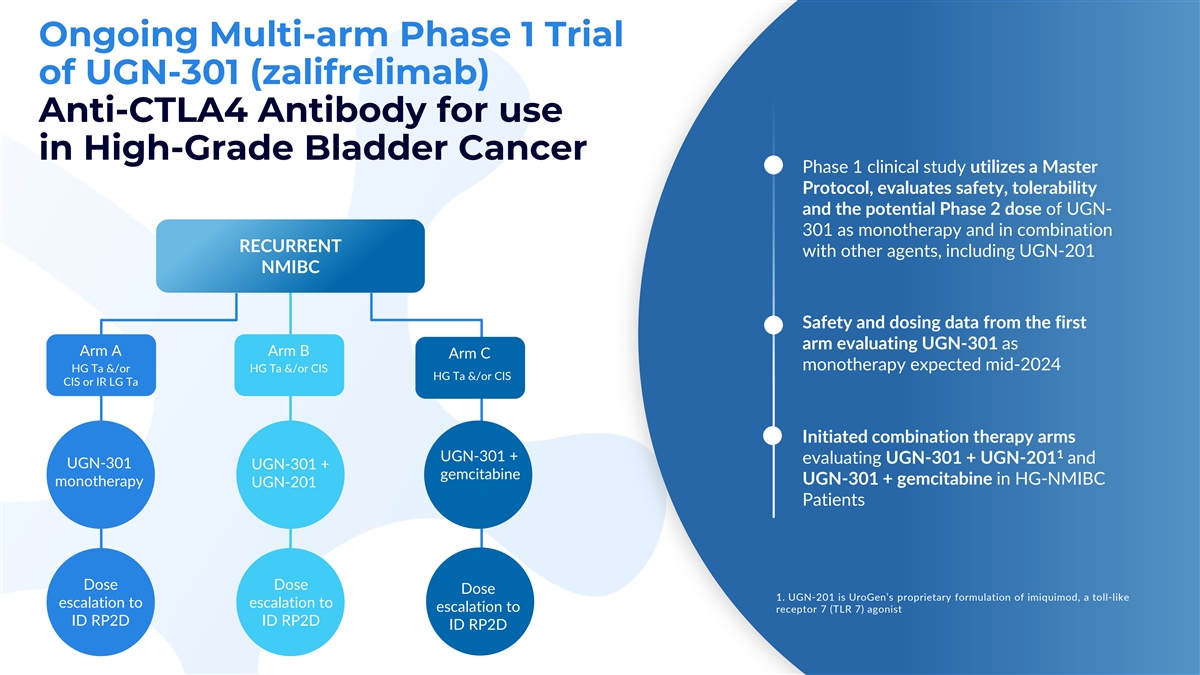
正在進行的用於高級膀胱癌 1 期臨牀研究的 UGN-301 (zalifrelimab) 抗 CTLA4 抗體多臂 1 期試驗利用主方案,評估了安全性、耐受性和 UGN-301 作為單一療法以及與其他藥物聯合復發的潛在二期劑量,包括 UGN-201 NMIBC 安全性以及第一個 V 組將 UGN-301 評估為 Arm A Arm B Arm C 單一療法的給藥數據預計在 2024 年中期 HG Ta 和/或 HG Ta 和/或 CIS HG Ta 和/或 CIS CIS CIS 或 IR LG Ta V 啟動的聯合療法分支 1 UGN-301 + 正在評估 UGN-301 + UGN-201 和 UGN-301 UGN-301 + 吉西他濱 UGN-301 + HG-NMIBC 單一療法中的吉西他濱 UGN-201 患者劑量劑量 1。UGN-201 是 UroGen 的專有咪喹莫德配方,類似於通話升級為 升級為受體 7 (TLR 7) 激動劑 ID RP2D ID RP2D RP2D RP2D ID RP2D RP2D

展望未來

UroGen Priorities 在 LG-IR-NMIBC 中推進 UGN-102 的商業前活動;預計將於 2024 年第二季度提交 12 個月的應對數據;在 2024 年第四季度之前提交潛在的保密協議;利用調整後的銷售策略支持資產負債表,重點是戰略和 美元的資本部署,包括優先考慮 UGN-102 商業化前和啟動計劃評估具有增長意識的業務發展機會,重點利用泌尿外科腫瘤學專業知識先進的免疫腫瘤學產品線, 專注於 UGN-301 作為單一療法和聯合療法 29
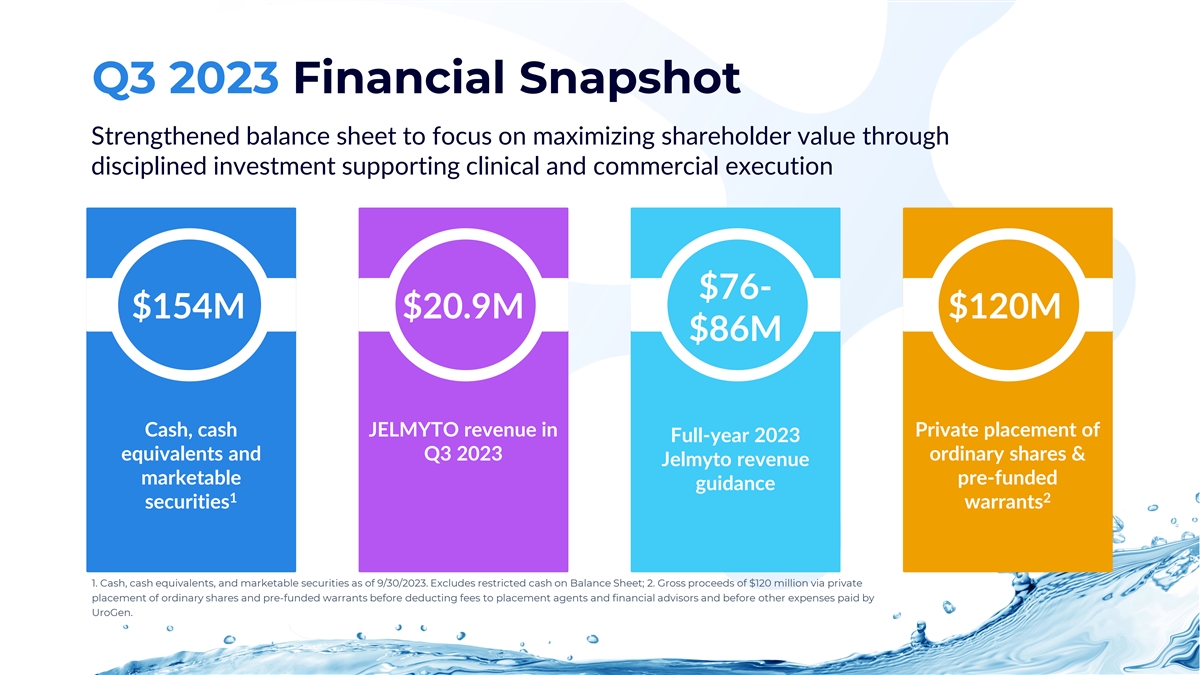
2023 年第三季度財務快照加強資產負債表,專注於 通過嚴格的投資實現股東價值最大化 76—1.54 億美元 2,090 萬美元 1.2 億美元 8600 萬美元現金、2023 年全年等價物私募和 2023 年第三季度普通股的 JELMYTO 收入和 Jelmyto 收入有價預先籌資指導 1 2 證券認股權證 1.截至2023年9月30日的現金、現金等價物和有價證券。不包括資產負債表上的限制性現金;2.在扣除向配售代理人和財務顧問支付的費用以及扣除UroGen支付的其他費用之前,通過私募的 普通股和預先籌資的認股權證獲得1.2億美元的總收益。

2024 年 3 月感謝您,僅限投資者受眾。不適用於醫療保健專業人員的促銷 。

附錄

延長96小時保質期提高運營效率 2022年9月標籤更新將JELMYTO外加劑的穩定期從8小時延長至96小時縮小了未來的差距增加了靈活性治療的可用性為藥劑師提供了更多重新參與的機會 更長的保質期可以更靈活地處理行駛時間不冷的潛在客户,延長地理封鎖和印刷產品標籤由於涵蓋混合合作伙伴物流挑戰而表示猶豫不決的潛在客户。靈活 滴注時間安排優化區域商業時間對患者雙方都有好處,並有可能減少運營經理(TBM)在現場提供商(TBM)的時間。UGN-102 推出後,Rx 合作伙伴可以在前一天混合並交付

對JELMYTO的未來前景充滿信心高績效且不斷增長的 Antegrade 管理機構 JELMYTO 2022年標籤開發多中心現實世界的增長提供了有效的更新模式,包括擴展的區域反射和長期後續管理和保質期增加了採用 數據支持用例良好的安全概況運營效率 JELMYTO 作為 JELMYTO 的 SOC,並有可能減少吸收障礙
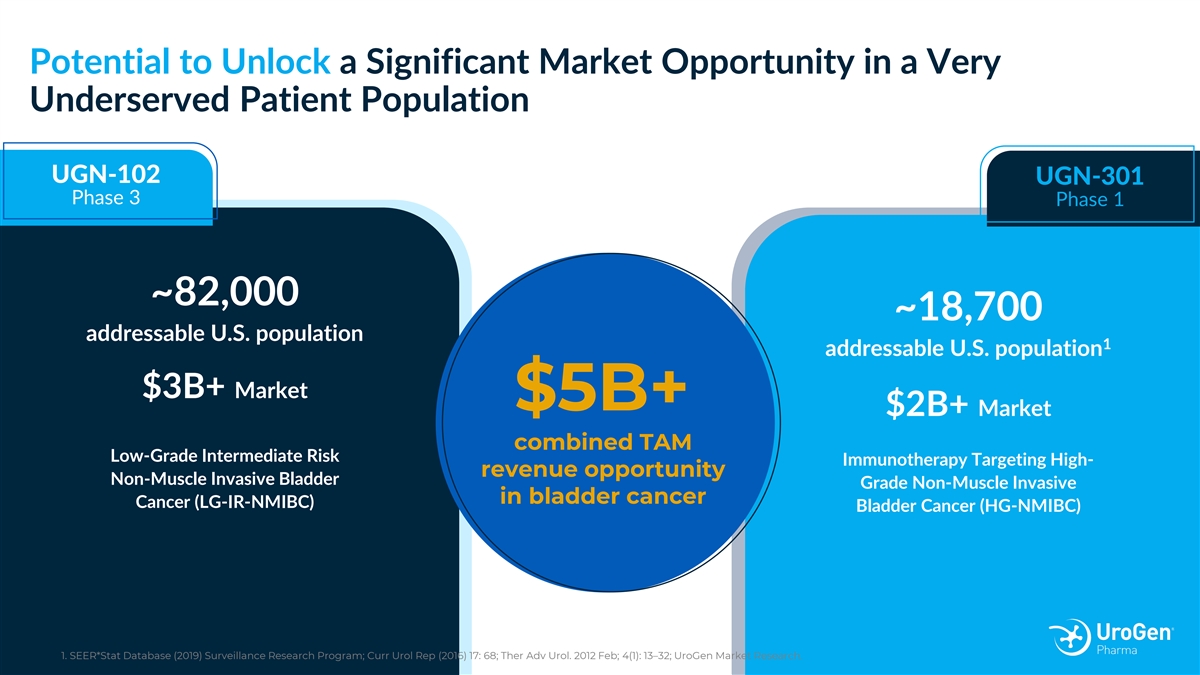
有可能在非常 得不到充分服務的患者羣體中釋放巨大的市場機會 UGN-102 UGN-301 第 3 階段 1 期約 82,000 ~18,700 個可尋址的美國人口 1 個可尋址的美國人口 30 億美元以上的市場 50 億美元+ 20億美元以上的市場組合 TAM 低等級中等風險免疫療法針對高收入 機會非肌肉浸潤性膀胱癌的非肌肉侵入性 (LG-IR-NMIBC) 膀胱癌 (HG-NMIBC) 膀胱癌 (HG-NMIBC)) 1。seer*Stat 數據庫(2019)監測研究計劃;Curr Urol Rep(2016)17:68;Ther Adv Urol。2012 年 2 月; 4 (1):13—32;UroGen 市場研究。
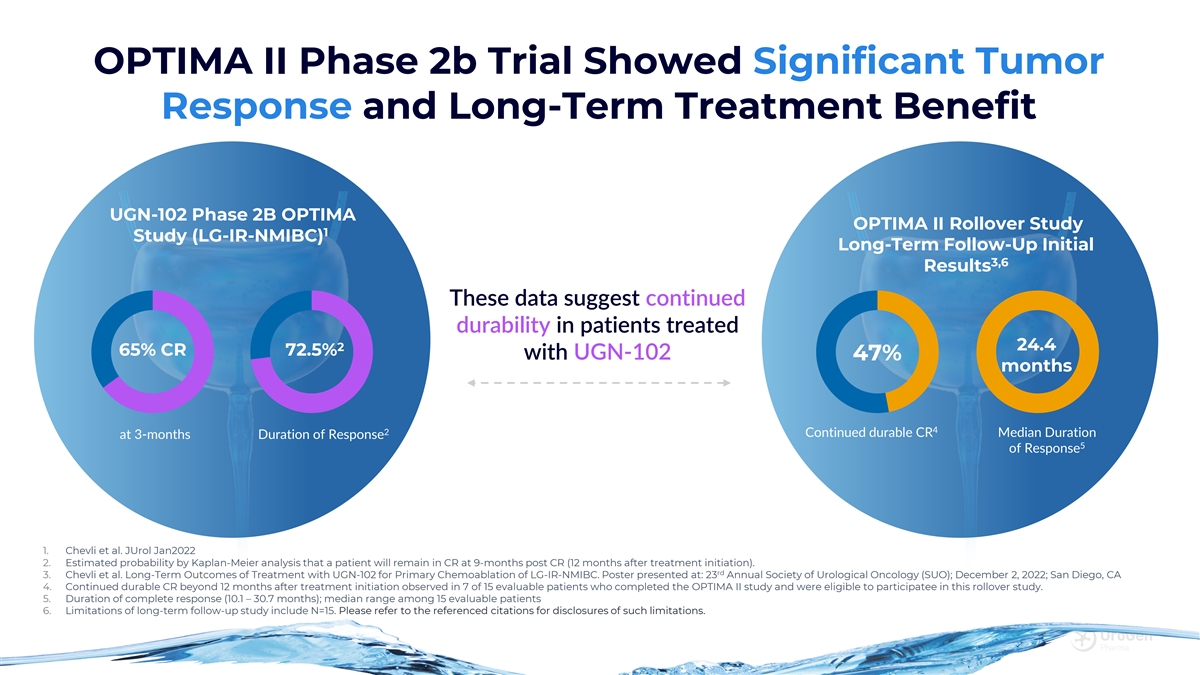
OPTIMA II 2b 期試驗顯示出顯著的腫瘤反應和 長期治療益處 UGN-102 2B 期 OPTIMA OPTIMA II 展期研究 1 項研究 (LG-IR-NMIBC) 長期隨訪初步 3,6 結果這些數據表明,接受治療 2 24.4 65% CR 72.5% 和 UGN-102 47% 的患者持續耐久性 4 2 反應持續時間 3 個月緩解持續時間 5雪佛利等Jurol 2022年1月 2.Kaplan-Meier 分析估計,患者在 CR 後 9 個月(開始治療 後 12 個月)仍在 CR 中的概率。rd 3。雪佛利等使用 UGN-102 治療 LG-IR-NMIBC 初級化療的長期療效。海報發表於:泌尿外科腫瘤學會(SUO)23屆年會;2022年12月2日;加利福尼亞州聖地亞哥 4。在完成OPTIMA II研究並有資格參與本次展期研究的15名可評估患者中,有7名觀察到CR 在治療開始後的12個月後持續耐用。5.完全緩解持續時間(10.1 — 30.7 個月);15 名可評估患者的中位數範圍 6.長期隨訪研究的侷限性包括 N=15。有關此類限制的披露,請參閲參考引文。

地圖集 37
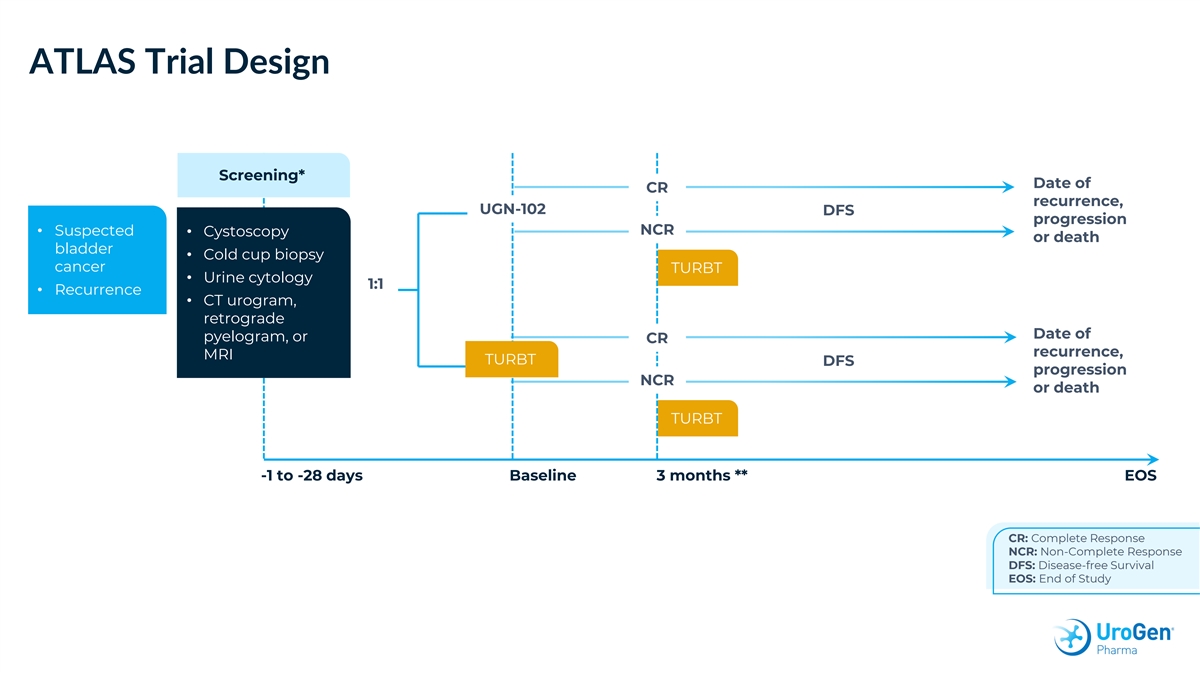
ATLAS 試驗設計篩查* CR 復發日期、UGN-102 DFS 進展 NCR • 疑似 • 膀胱鏡檢查或死亡 • 冷杯活檢癌症 TURBT • 尿液細胞學 1:1 • 復發 • CT 尿路造影、腎盂造影逆行日期或 CR 復發、MRI TURBT DFS 進展 NCR 或死亡 TURBT -1 至 -28 天基線 3 個月 ** EOS CR:完整反應 NCR:非完全響應 DFS:無病生存 EOS:研究結束

ATLAS 研究終點主要終點 (ITT):• 無病 存活率 (DFS),定義為從隨機分組到以下任何事件最早發生日期的時間:ü 3個月評估時的殘留疾病 üReprogress üDeath 關鍵次要終點:• 3個月就診時的完整 反應率 (CRR) • 緩解持續時間 (DOR),定義為從首次記錄 CR 到最早復發日期的時間低度疾病、進展為高級別疾病或因任何原因導致的死亡(3 個月 CR 分析集)侷限性為這項研究表明,由於入組的患者人數不到計劃人數的一半,因此提前停止了入組,以尋求替代發展策略,這使得該試驗無法確定 使用 UGN-102 進行初級化療在統計學上是否優於 TURBT 單一療法

ATLAS 人口統計學和安全概況 • 新發治療不良反應 通常為輕度至中度人口統計學和基線特徵均衡 • 與其他治療組間的 UGN-102 研究相似 • 任何與治療或手術相關的嚴重 TEAE 在兩個組中都具有可比性 ——UGN-102 +/-TURBT:1.4% ——單獨使用 TURBT:0.8% 存檔的 UroGen 數據人口統計學和 AE 的總體摘要可在附錄中引用
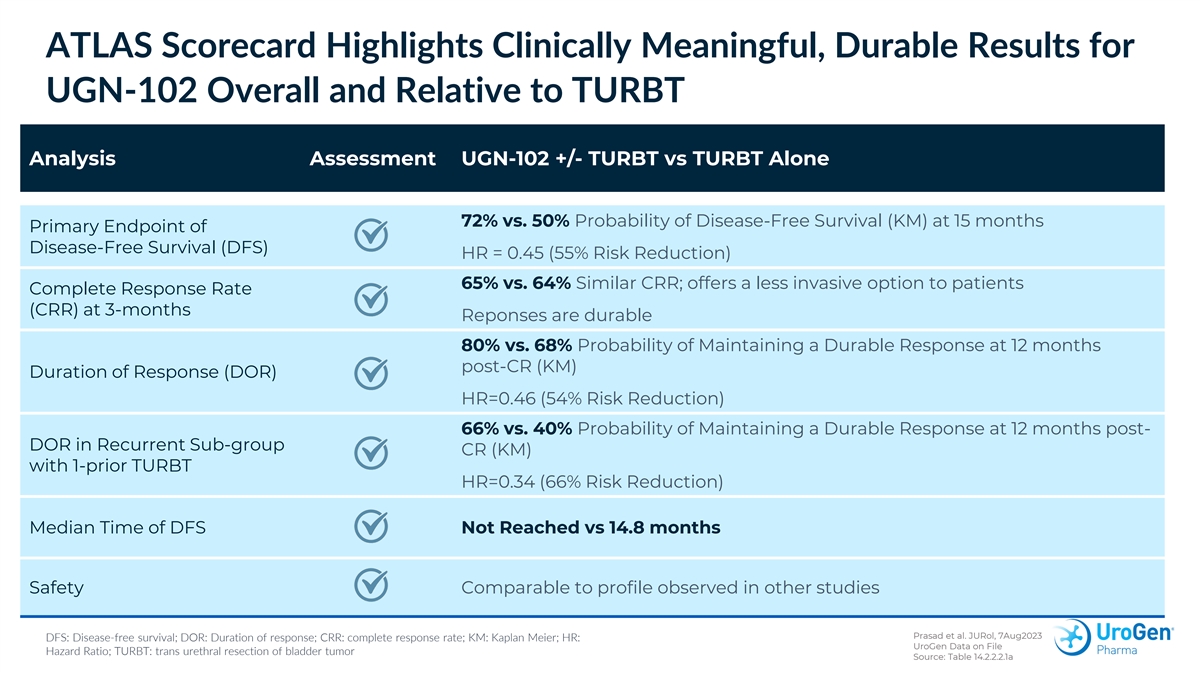
ATLAS 記分卡重點介紹了 UGN-102 總體上以及與 TURBT 分析評估相關的具有臨牀意義的持久結果 UGN-102 +/-TURBT 與單獨的 TURBT 對比 72% 與 50% 無病存活 (KM) 概率 (KM) 基本終點 HR = 0.45(風險降低 55%)65% 與 64% 相似 CRR;為患者提供侵入性較小的選擇完全緩解率 (CRR) R) 在 3 個月後 CR (KM) 反應持續時間 (DOR) 後 12 個月內保持持久反應的概率為 80%,而 68% 的概率為 68% HR=0.46 (54% 風險) 降低)在複發性子組CR(KM)中,在DOR後12個月維持持久反應的概率為66%,而之前的TURBT HR=0.34(風險降低了66%)未達到DFS的中位時間對比14.8個月安全性與在其他研究中觀察到的概況 相當 Prasad 等人。JuroL,2023 年 8 月 7 日 DFS:無病存活;DOR:反應持續時間;CRR:完全緩解率;KM:Kaplan Meier;HR:UroGen 檔案危險率數據;TURBT:膀胱腫瘤的經尿道切除術 來源:表 14.2.2.2.1a

ATLAS DFS-ATLAS H HR R: 0:0.4 .46 5 ((0.2 0.29 4, 0.6, 0.88 6)) Prasad 等人羣的復發、進展或死亡風險降低 55% Jurol 7Aug2023 UroGen 存檔數據來源:表 14.2.1.1a Kaplan-Meier 無病生存圖
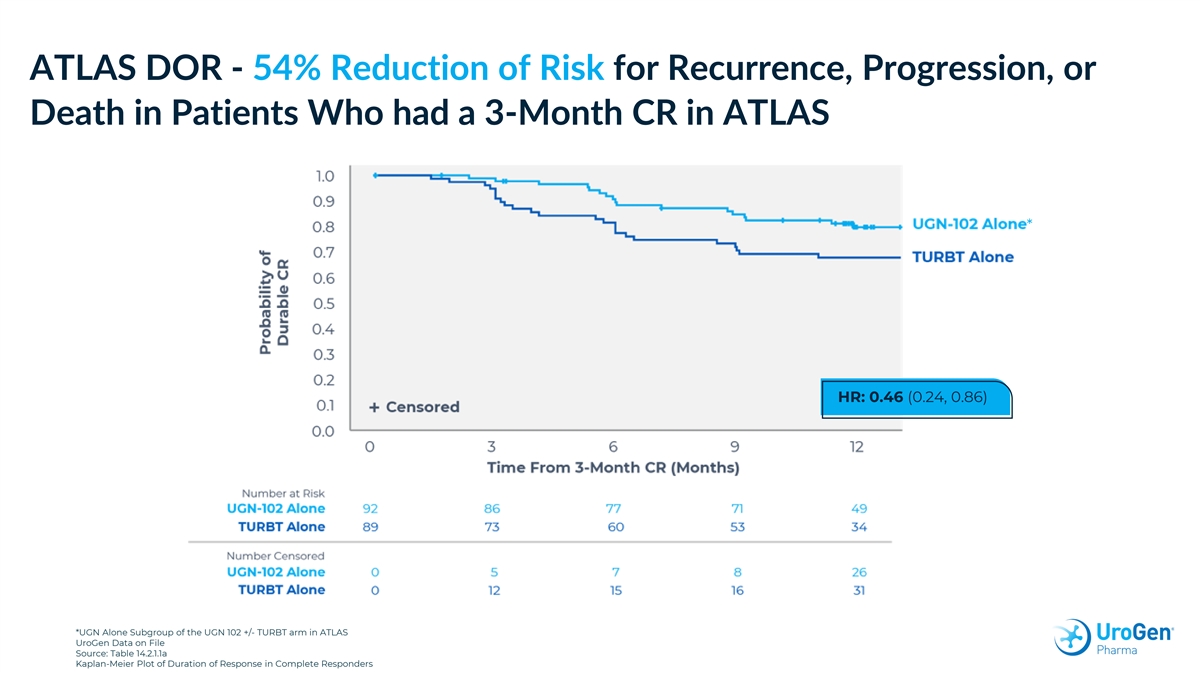
ATLAS DOR-ATLAS UroGen 存檔數據中 CR 為 3 個月的患者的復發、進展或死亡風險降低 54% * HR:0.46(0.24,0.86)*存檔數據中 UGN 102 +/-TURBT 組的 UGN 單獨子組來源:表 14.2.1.1a Kaplan-Meier 完整反應持續時間圖
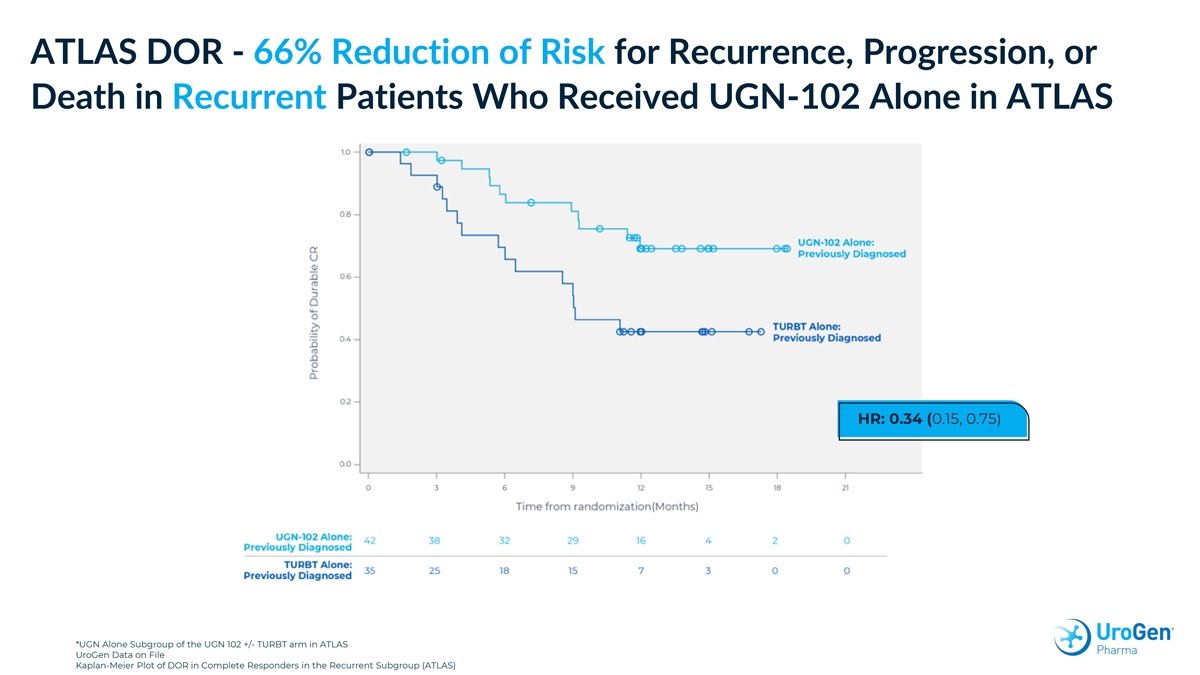
ATLAS DOR-在 ATLAS 中單獨接受 UGN-102 的復發患者復發、進展或死亡的風險降低 66% * HR: 0.34 (0.15, 0.75) *ATLAS UroGen 檔案中完全應答者復發、進展或死亡 (ATLAS) 中 UGN 102 +/-TURBT 組的 UGN 單獨子組

無病存活率摘要:單獨使用 TURBT 組的總復發 和進展明顯增加 UGN-102 +/-TURBT TURBT 單獨使用 (N = 140)/n (%) (N = 142)/n (%) 有事件的患者,n (%) 37 (26.1) 55 (39.3) LG 病的復發 20 (14.1) 39 (27.9) 進展為 HG 病 17 (12.0) 15 (10.0) 7) 死亡 0 1 (0.7) 接受審查的患者,n (%) 105 (73.9) 85 (60.7) 危險率(95% 置信區間)0.45(0.29,0.68)存檔的 UroGen 數據來源:表 14.2.1.1 附錄中的完整表格
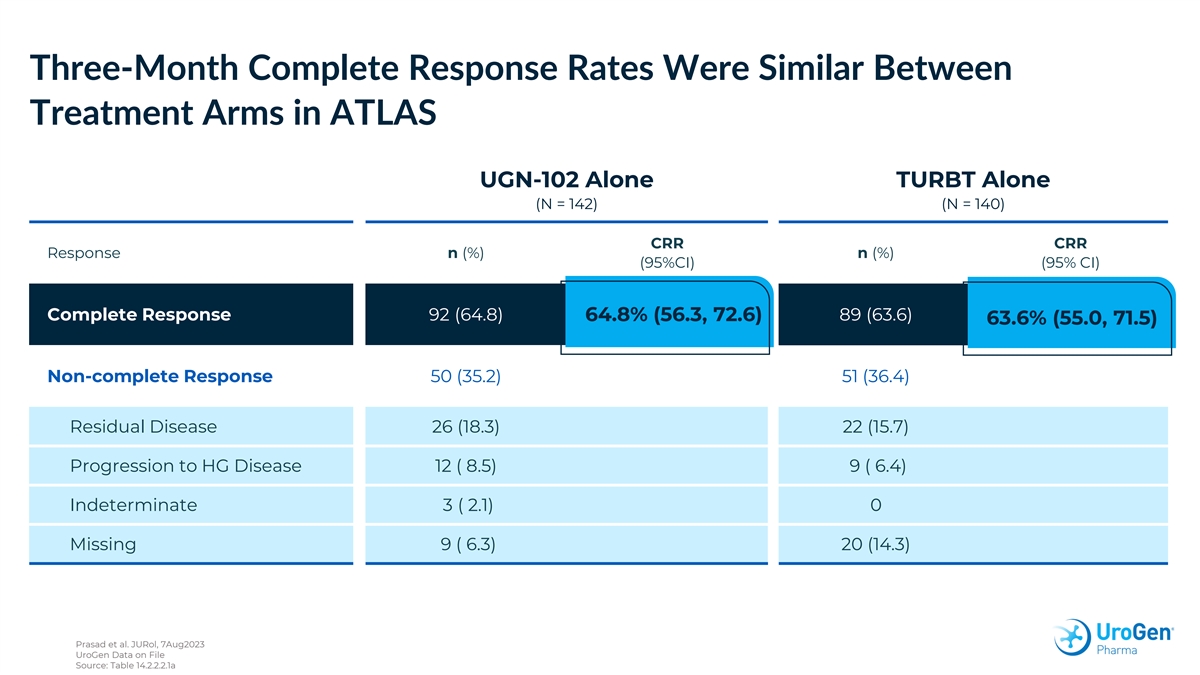
ATLAS UGN-102 單獨治療 TURBT(N = 142)(N = 142)(N = 142)(N = 140)CRR CRR 反應 n(%)n(%)(95% 置信區間)(95% 置信區間)(95% 置信區間)64.8%(56.3,72.6)89(63.6)63.6%(55.0,71.5)非完全反應 50(35.2)51(36.4)) 殘留疾病 26 (18.3) 22 (15.7) HG 病進展 12 (8.5) 9 (6.4) 不確定 3 (2.1) 0 失蹤 9 (6.3) 20 (14.3) Prasad 等人JuroL,2023 年 8 月 7 日 UroGen 文件中的數據來源:表 14.2.2.2.1a
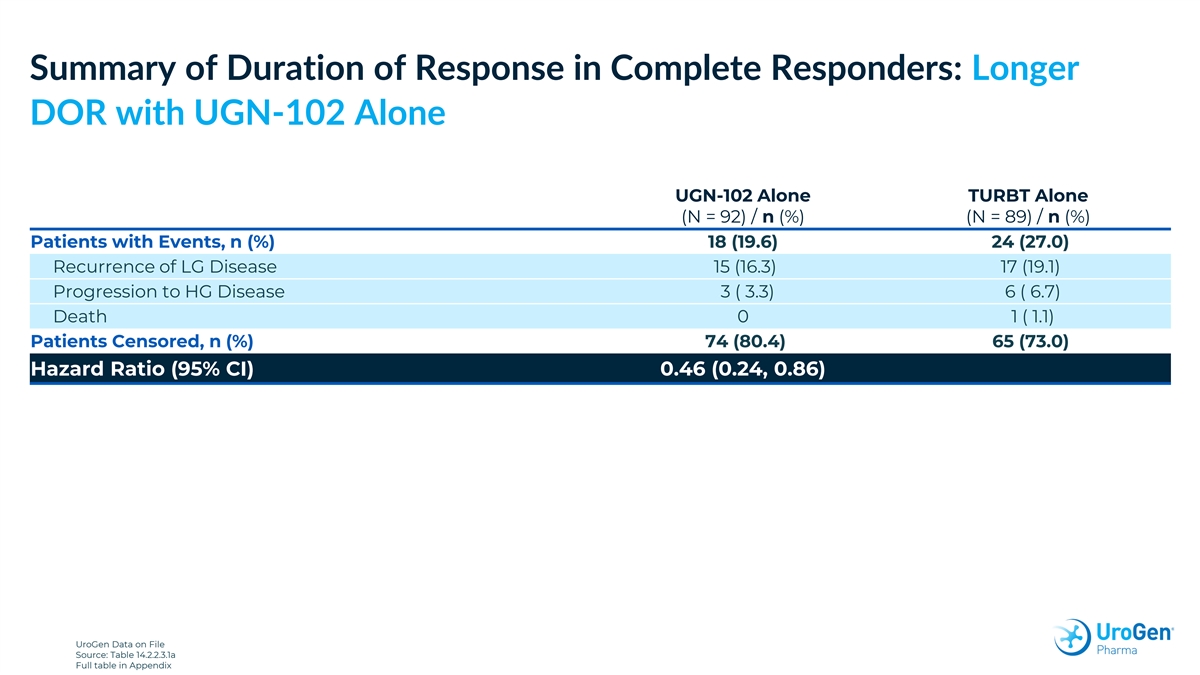
完全應答者的反應持續時間摘要:單獨使用 UGN-102 時延長 UGN-102 單獨單獨使用 TURBT (N = 92)/n (%) (N = 89)/n (%) 有事件的患者,n (%) 18 (19.6) 24 (27.0) LG 病復發 15 (16.3) 17 (19.1) 進展為 HG 病 3 (3.3) 6 (6.7) 死亡 0 1 (1.1) 受檢查的患者,n (%) 74 (80.4) 65 (73.0) 危險比 (95% 置信區間) 0.46 (0.24, 0.86) UroGen 檔案數據來源:表 14.2.2.3.1a 附錄中的完整表格
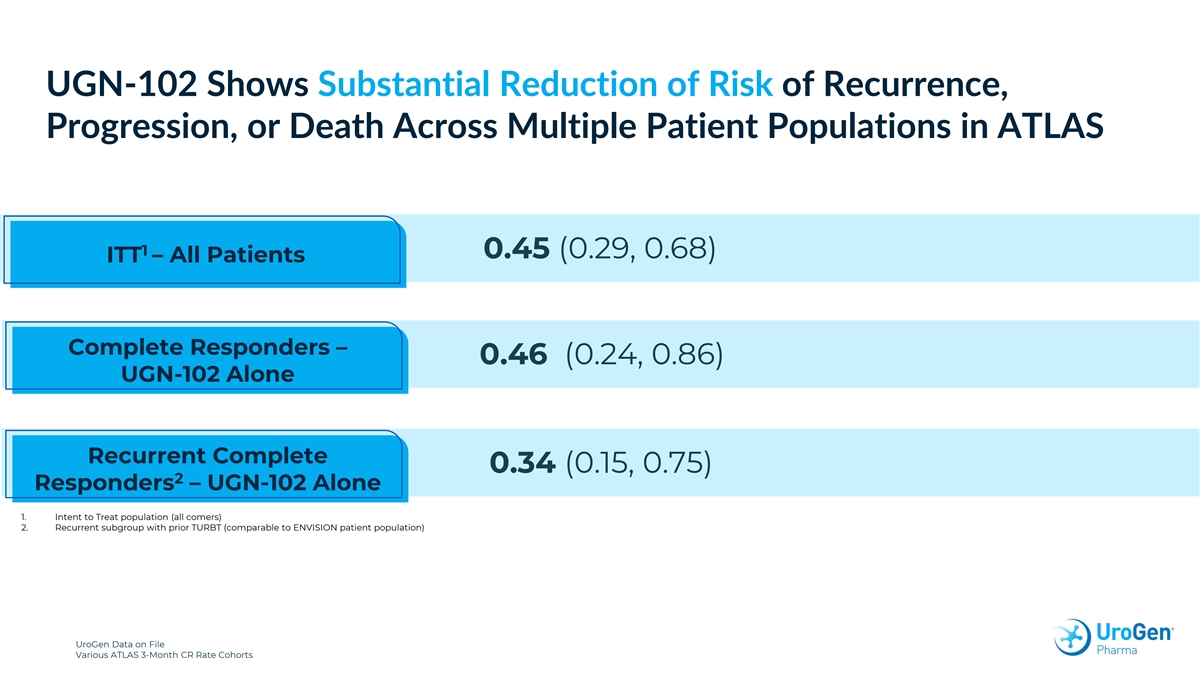
UGN-102 在 ATLAS 1 0.45 (0.29, 0.68) ITT 中顯示多個患者羣體的復發、進展、 或死亡風險大幅降低 — 所有患者完全反應者 — 0.46 (0.24, 0.86) UGN-102 單獨復發完成 0.34 (0.15, 0.75) 2 個反應者 — UGN-102 單獨使用 1。意圖治療 人羣(所有來者)2.以前有 TURBT(與 ENVISION 患者羣體相當)的復發亞組存檔的 UroGen 數據各種 ATLAS 3 個月 CR 率隊列

UroGen 有望改變膀胱癌的治療方式 #1 95% 的治療方式 UGN-102 可能成為共享處方基礎第一種獲得 JELMYTO 批准用於治療 LG-IR-NMIBC 30億美元+TAM 1.2 億美元引人注目的臨牀私募股份 LG-IR-NMIBC 市場數據包,來自 3 個經驗豐富的創新試驗時機和 565 名患者生物技術投資者
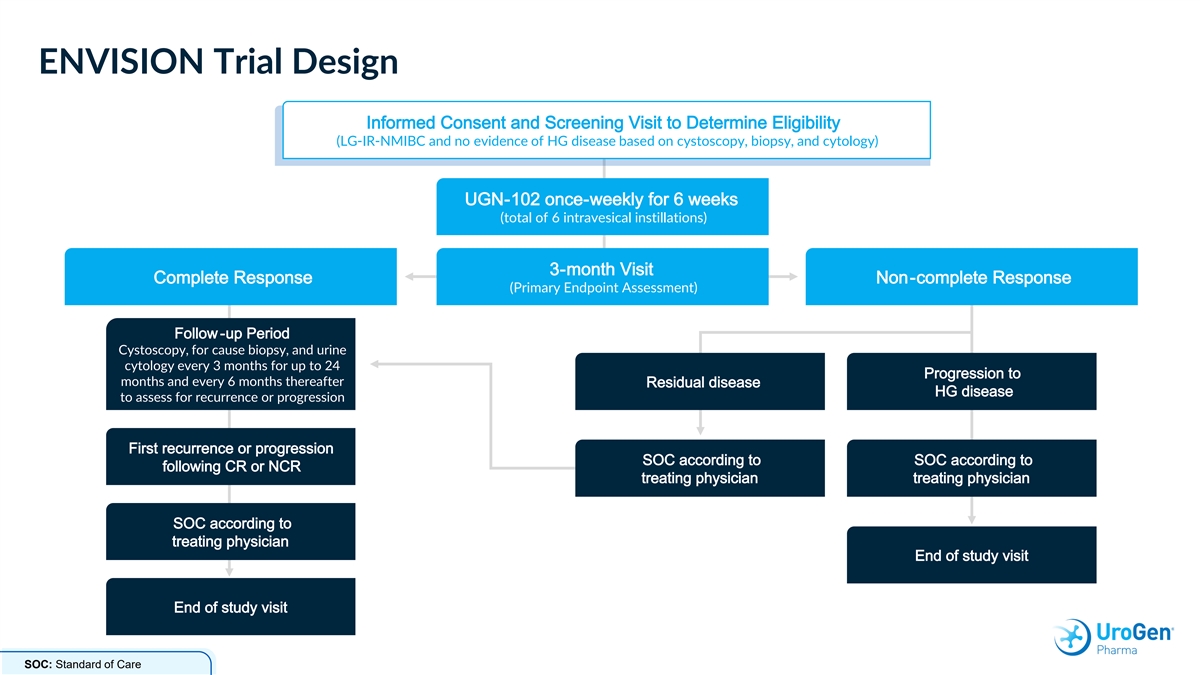
ENVISION 試驗設計知情同意和篩查就診以確定 資格(LG-IR-NMIBC,沒有基於膀胱鏡檢查、活檢和細胞學的血液學證據)UGN-102 每週一次,持續 6 周(總共 6 次膀胱內滴注)3 個月訪視完全反應非完全反應(主要終點 評估)隨訪期膀胱鏡檢查,用於病因活檢和尿液細胞學檢查每 3 個月持續最多 24 個月,之後每 6 個月進行一次殘留疾病 HG 病以評估復發或進展首次復發或 根據以下 CR 或 NCR 根據 SOC 進展 SOC 主治醫師根據主治醫生 SOC 研究結束訪問研究結束訪問 SOC:護理標準

ENVISION 單臂研究描述主要終點:• 3個月就診時的完全緩解率 (CRR) 關鍵次要終點:• 緩解持續時間 (DOR),定義為從首次記錄 CR 到最早日期的時間:üRecurency üProgression üDeath 患者羣體:• 先前診斷的機密
ENVISION 人口統計學和安全概況人口統計學和基線 特徵反映了 • 緊急治療的 AE 是典型的 LG-IR-NMIBC 患者,通常是輕度至中度人羣 • 與其他 UGN-102 研究相似的 UroGen 存檔數據統計學總體摘要 和 AE 可以在附錄中引用
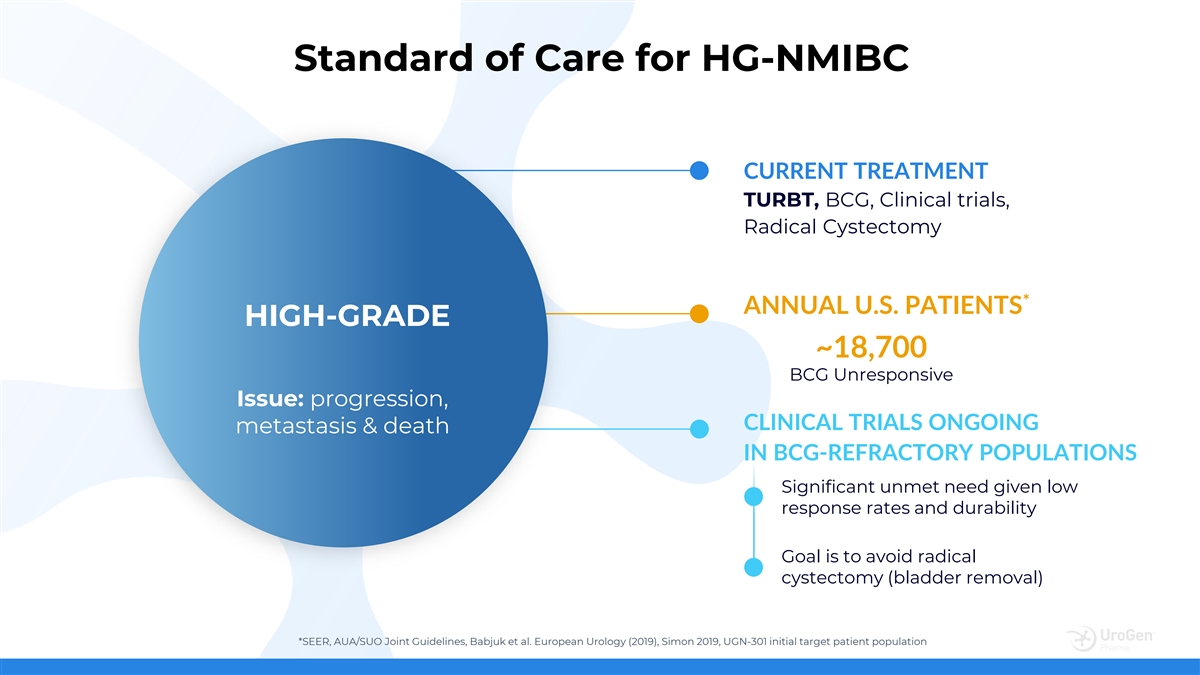
HG-NMIBC 當前治療的護理標準 TURBT、卡介苗、臨牀 試驗、根治性囊腫切除術 * 年度美國患者高等級 ~18,700 卡介苗無反應問題:進展、臨牀試驗卡介苗難治人羣的持續轉移和死亡 目標是避免根治性膀胱切除術(膀胱切除)*SEER,AUA/SUA O 聯合指南,Babjuk 等人。歐洲泌尿外科(2019),Simon 2019,UGN-301 初始目標患者羣體
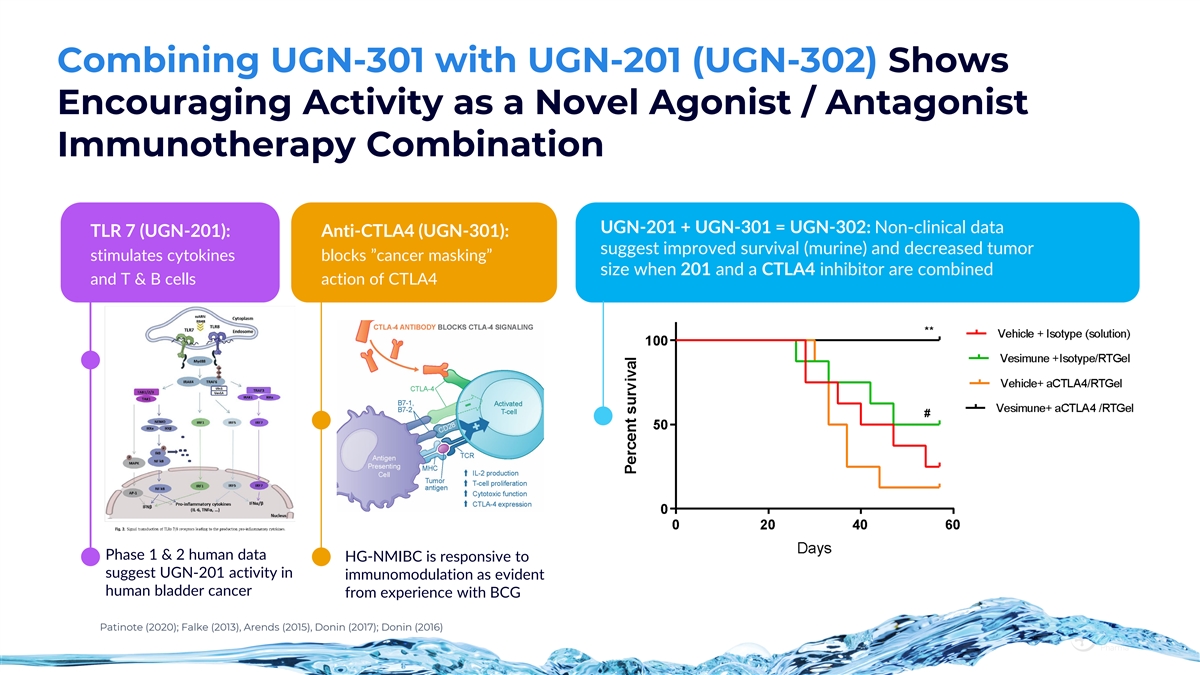
UGN-301 與 UGN-201 (UGN-302) 聯合使用顯示出令人鼓舞的活性,因為 一種新的激動劑/拮抗劑免疫療法組合 UGN-201 + UGN-301 = UGN-302:非臨牀數據 TLR 7 (UGN-201):抗 CTLA4 (UGN-301):提示存活率提高(小鼠),腫瘤刺激減少,當 201 和 CTLA4 抑制劑結合時,細胞因子阻止 “癌症 屏蔽” 的大小,以及 T 和 B 細胞的作用第 1 和第 2 階段人體數據 HG-NMIBC 對提示免疫調節中有個活性的反應是明顯的人體膀胱癌 使用卡介苗 Patinote(2020);CTLA4 UGN-201Falke (2013)、Arends (2015)、Donin (2017);Donin (2016)

UroGen 取得了重大進展關鍵成就 JELMYTO FDA 批准並在美國上線公佈了 3 期試驗的積極頭條數據,並通過 1.2 億美元的 NIMBC 私人配售 NIMBC 高級免疫腫瘤學項目 成功與加強型資產負債表 FDA 舉行了新一代新型絲裂黴素基配方 UGN-103 和 medac GmbH 的許可協議 2041 年之前的知識產權保護 UGN-102

越來越多的證據表明 JELMYTO的腎造口管給藥對醫生有效且具有良好的安全性 ANTEGRADE 給藥不需要透視檢查最大限度地減少治療期間可能由訓練有素的輸尿管進行的操作,在 腎鏡檢查確認第一次滴注時進行乾淨後,護理專業人員在清潔的情況下可以限制狹窄的形成,而不是與重複上尿路儀器相關的無菌症狀回顧性分析 的真實數據支持優勢行前給藥,使其成為逆行給藥的有吸引力的替代方案 1,2,3 1.Murray K 等人。J Urol. 2022 年 2 月 7 日;101097JU;2.Rose K 等人。J Urol. 2022 年 5 月 1 日;doi.org/10.1097/ju.000000000000002643.06 3.Rose K 等人。BJUI。 2022 年 10 月 26 日;DOI:10.1111/bju.15925