
投資者和分析師活動系列 — 第 8 卷轉變肌強直性營養不良症全球第 3 期 HARBOR 試驗和長期的 MARINA-OLE 數據 2024 年 3 月 4 日納斯達克:RNA | aviditybio.com

2 前瞻性陳述我們提醒讀者,本演示文稿包含涉及重大風險和不確定性的前瞻性陳述。本演示文稿中除歷史事實陳述以外的所有陳述均為前瞻性陳述。前瞻性陳述包括但不限於以下方面的陳述:我們未來的經營業績;我們的業務戰略;我們正在進行的臨牀試驗的預期時間、設計和進行;我們正在進行的臨牀項目數據的發佈時間;臨牀試驗數據和結果的特徵以及從中得出的結論;研發計劃;AOC 1001、AOC 1020和AOC 1044的計劃和預計時間表;安全性和耐受性概況我們的候選產品;AOC 平臺的潛力;我們的候選產品治療罕見疾病的能力;成功的時機和可能性;潛在的產品;產品批准;未來運營的管理計劃和目標;以及預期產品開發工作的未來結果。在某些情況下,讀者可以通過諸如 “可能”、“將”、“應該”、“預期”、“計劃”、“預期”、“可能”、“打算”、“目標”、“項目”、“考慮”、“相信”、“估計”、“潛在” 或 “繼續” 等術語來識別前瞻性陳述,或者這些術語或其他類似表述的否定詞。納入前瞻性陳述不應被視為Avidity對我們任何計劃將實現的陳述。由於我們的業務固有風險和不確定性,無法控制,實際結果可能與本演示文稿中列出的有所不同,包括但不限於:我們可能無法完全解決與AOC 1001相關的部分臨牀擱置問題,這可能會導致AOC 1001的臨牀開發延遲;與部分臨牀擱置相關的額外數據請求或其他可能導致大量額外費用和時間延遲;向FDA交付的相關數據部分臨牀封存可能不是令美國食品藥品管理局滿意;持續可用的與AOC 1001相關的其他參與者數據可能與截至最近截止日期的數據不一致,對現有數據的進一步分析和對新數據的分析可能會得出與截止日期不同的結論;我們的候選產品的意外不良副作用或療效不足可能會延遲或限制其開發、監管批准和/或商業化,或可能導致額外的臨牀擱置,召回或產品責任聲明;我們處於開發初期;我們在AOC平臺上發現和開發候選產品的方法尚未得到證實,我們不知道我們是否能夠開發出任何具有商業價值的產品;我們的臨牀前研究和候選產品的臨牀試驗的成功;早期臨牀試驗的結果不一定能預測未來的結果;臨牀試驗的開始、註冊和完成可能出現延遲;我們對第三方的依賴與臨牀前和臨牀前有關臨牀測試和產品製造;我們可能無法意識到與第三方合作的預期收益,我們現有的合作可能比預期更早終止,或者我們可能無法形成新的合作;美國和國外的監管發展,包括接受IND和類似的外國監管文件以及我們對未來臨牀試驗的擬議設計;FDA的快速通道指定可能無法加快開發或監管審查或批准程序;我們的獲得能力和維持對候選產品和專有技術的知識產權保護;我們可能比預期更快地耗盡資本資源,無法籌集額外的所需資金;以及我們在向美國證券交易委員會提交的文件中描述的其他風險,包括我們在2024年2月28日向美國證券交易委員會提交的截至2023年12月31日的10-K表格以及隨後向美國證券交易委員會提交的文件中 “風險因素” 標題下的風險。提醒讀者不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本文發佈之日。除非適用法律要求,否則我們不計劃公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、情況變化還是其他原因。本警示聲明是根據1995年《私人證券訴訟改革法》的安全港條款作出的,對所有前瞻性陳述進行了全面的限定。本演示文稿還包含獨立方和我們提供的與市場規模和增長相關的估計和其他統計數據,以及有關我們行業的其他數據。這些數據涉及許多假設和侷限性,提醒讀者不要過分重視此類估計。此外,對我們未來表現的預測、假設和估計以及我們經營的市場的未來表現必然受到高度的不確定性和風險的影響。這些因素和其他因素可能導致結果與獨立各方和我們在估計中表達的結果存在重大差異。本演示不應構成賣出要約或徵求購買證券要約,在根據任何此類州或司法管轄區的證券法進行註冊或獲得資格認證之前,在任何州或司法管轄區出售證券是非法的,也不得出售任何證券。

3 我們的願景通過革新 RNA 療法的交付來深刻改善人們的生活 Luke Living with DM1

4 AOC 1044 在 DMD44 中約有 900 名患者在 2024 年交付:在 3 種罕見疾病的 3 個臨牀項目中讀出 3 個數據 AOC 1044 在 DMD44 中約有 900 名患者 1020 個 FSHD 約16,000-38,00 名患者預計 2024 年第二季度約一半參與者的 1/2 期 FORTITUDE 初步數據在 DM1 中讀取 >40,000 名患者 2024 年第一季度美國 MARINA-OLE 數據 2024 年第二季度全球三期 HARBOR 試驗的啟動軌跡預計 2024 年下半年 1/2 期 EXPLORE44 患者數據

每日的 5 個目標分享全球 3 期 HARBORTM 試驗設計 • 研究設計監管協議 • 有望在 2024 年第二季度啟動來自 MARINA-OLETM 的長期數據 • 包括 vHOT、手抓力、肌肉力量和日常生活活動在內的多種指標的持續和持久改善 • 良好的長期安全性和耐受性 END-DM1 自然史研究的首次數據表明,與自然史相比,疾病進展出現逆轉 delpacibart etedesiran 縮寫:-desiran(原名為 AOC 1001)

6 Avidity 管理團隊 John W. Day,醫學博士,斯坦福大學醫學院神經病學和兒科教授兼神經肌肉醫學部主任 G U E S P E A K E R Steve Hughes,醫學博士首席醫學官莎拉·博伊斯總裁兼首席執行官 W. Michael Flanagan 博士首席科學和技術官傑夫·格蘭德投資者關係與企業傳播轉型副總裁肌強直性營養不良

7 議程/大綱徹底改變核糖核糖核酸的交付 Sarah Boyce,總裁兼首席執行官進入第三階段:HARBORTM 試驗 Steve Hughes,醫學博士,首席營銷官 • MARINA-OLETM 長期療效和安全性數據 John W. Day,博士,斯坦福大學醫學院神經病學和兒科教授兼神經肌肉醫學部主任 • 為DM1患者提供服務 Steve Hughes,醫學博士首席營銷官閉幕詞莎拉·博伊斯,總裁兼首席執行官問答環節 Avidity Management 和戴博士,斯坦福大學主持人:IR/CC 副總裁傑夫·格蘭德

8 0 獲批准的療法 DM1:患者負擔沉重且需求未得到滿足 >40,000 美國有 DM1 的人 • 主要影響骨骼、心臟和平滑肌的神經肌肉疾病未被充分認識、進行性且往往是致命的 • 嚴重程度代代增加 • 對生活質量的重大影響 • del-Desiran 旨在解決 DM1 的根本原因 Loraine、Kristl & Zen 使用 DM1 生活
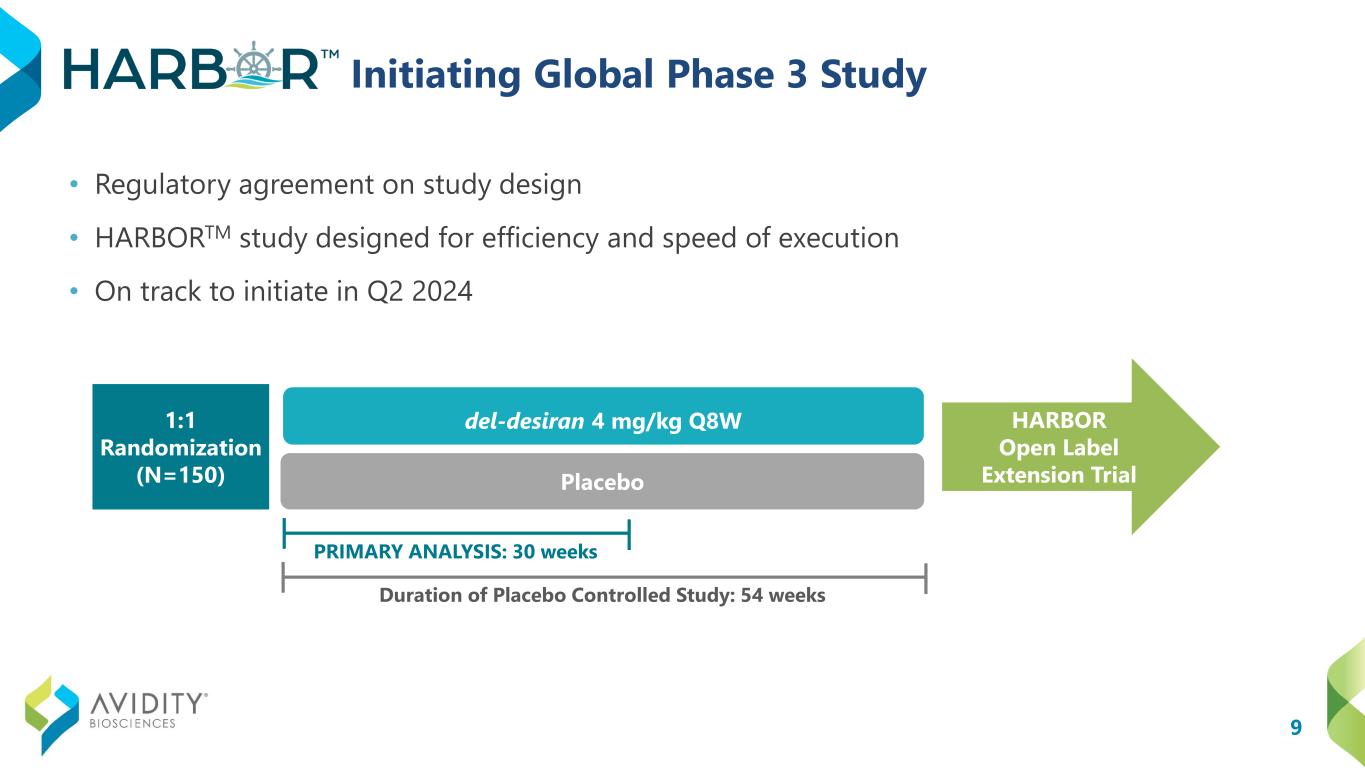
9 啟動全球 3 期研究 • 研究設計監管協議 • HARBORTM 研究旨在提高執行效率和速度 • 有望在 2024 年第二季度啟動 del-desiran 4 mg/kg Q8W 安慰劑安慰劑對照研究時間:54 周 HARBOR 開放標籤延期試驗 1:1 隨機化(N=150)主要分析:30 周
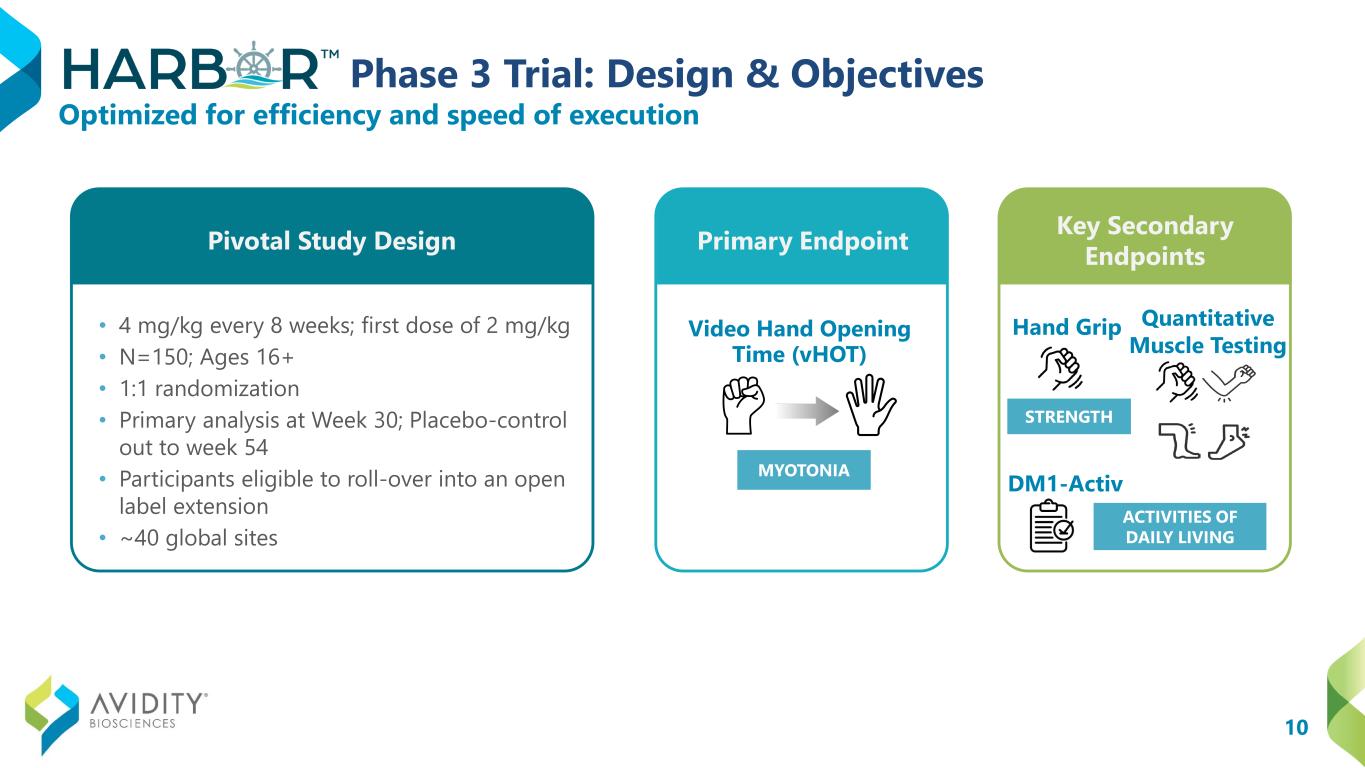
10 期 3 期試驗:設計與目標 • 每 8 周 4 mg/kg;第一劑量 2 mg/kg • N = 150;年齡 16 歲以上 • 1:1 隨機分配 • 第 30 周初步分析;安慰劑對照至第 54 周 • 參與者有資格延長開放標籤期限 • 約 40 個全球站點視頻手掌定量肌肉測試 dm1-Activ 針對執行效率和速度進行了優化日常生活活動關鍵研究設計主要終點關鍵次要終點

11 議程/大綱徹底改變核糖核糖核酸的交付 Sarah Boyce,總裁兼首席執行官進入第三階段:HARBORTM 試驗 Steve Hughes,醫學博士,首席營銷官 • MARINA-OLETM 長期療效和安全性數據 John W. Day,博士,斯坦福大學醫學院神經病學和兒科教授兼神經肌肉醫學部主任 • 為DM1患者提供服務 Steve Hughes,醫學博士首席營銷官閉幕詞莎拉·博伊斯,總裁兼首席執行官問答環節 Avidity Management 和戴博士,斯坦福大學主持人:IR/CC 副總裁傑夫·格蘭德

John W. Day,醫學博士,斯坦福大學醫學院神經病學、兒科(遺傳學)和病理學教授,神經肌肉醫學部主任 John W. Day 是斯坦福大學神經病學、兒科(遺傳學)和病理學教授兼神經肌肉醫學系主任。戴博士在明尼蘇達大學獲得醫學博士學位,在阿爾伯特·愛因斯坦醫學院獲得神經科學博士學位,在那裏他研究了突觸生理學和可塑性。在加州大學舊金山分校完成神經病學和神經肌肉訓練後,他被明尼蘇達大學招募到明尼蘇達大學,作為神經病學、兒科和遺傳學教授,他創立並領導了保羅和希拉·韋爾斯通肌肉萎縮症中心。2011年,他被斯坦福大學招募到斯坦福大學,成立了全面的神經肌肉醫學部。戴博士研究了神經肌肉疾病的遺傳原因和多系統影響,在設計和指導包括反義寡核苷酸和基因替代療法在內的新療法的臨牀試驗方面擁有30多年的經驗。12

識別 DM1 13 的頻譜
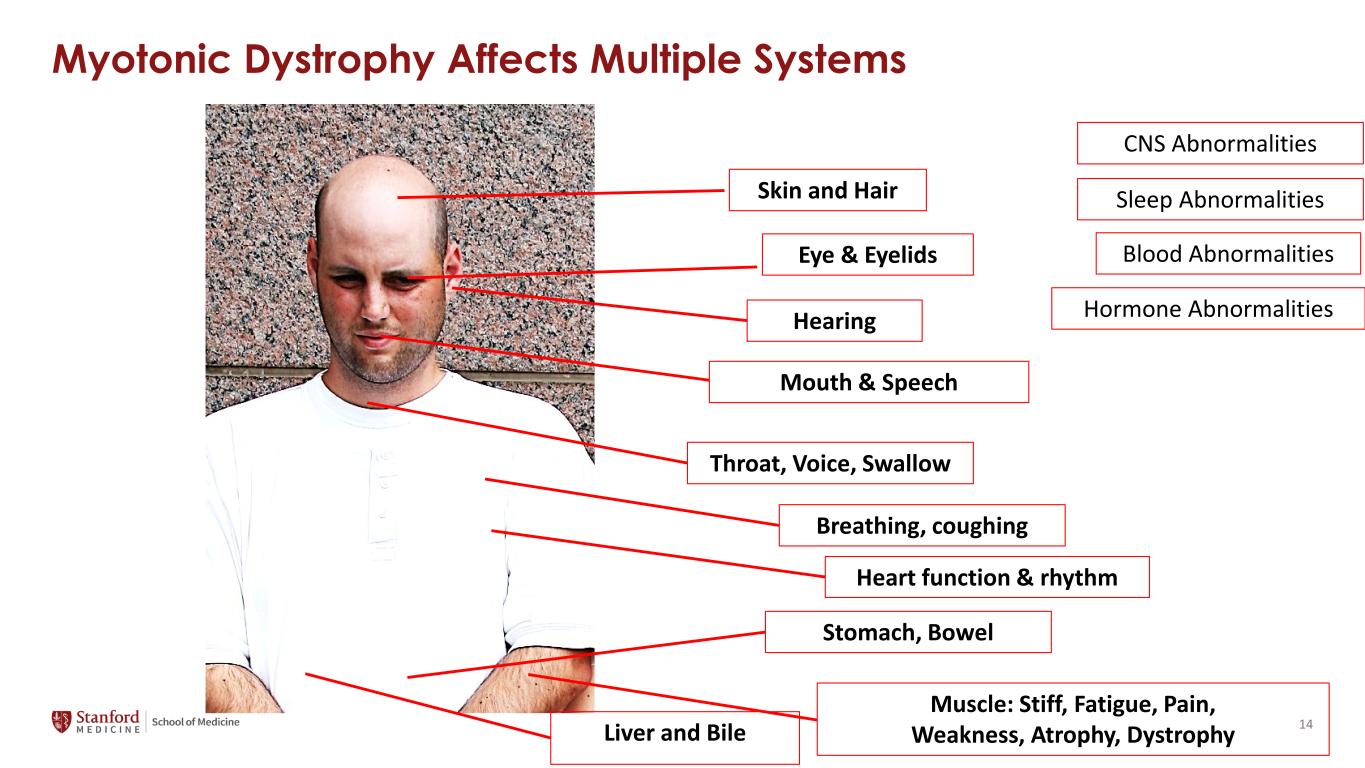
肌強性營養不良會影響多個系統眼睛和眼皮:聽力、口腔和言語、皮膚和頭髮、喉嚨、聲音、吞嚥呼吸、咳嗽、心臟功能和節奏胃、腸胃和肝臟和膽汁:僵硬、疲勞、疼痛、虛弱、萎縮、營養不良睡眠異常血液異常激素異常中樞神經系統異常 14
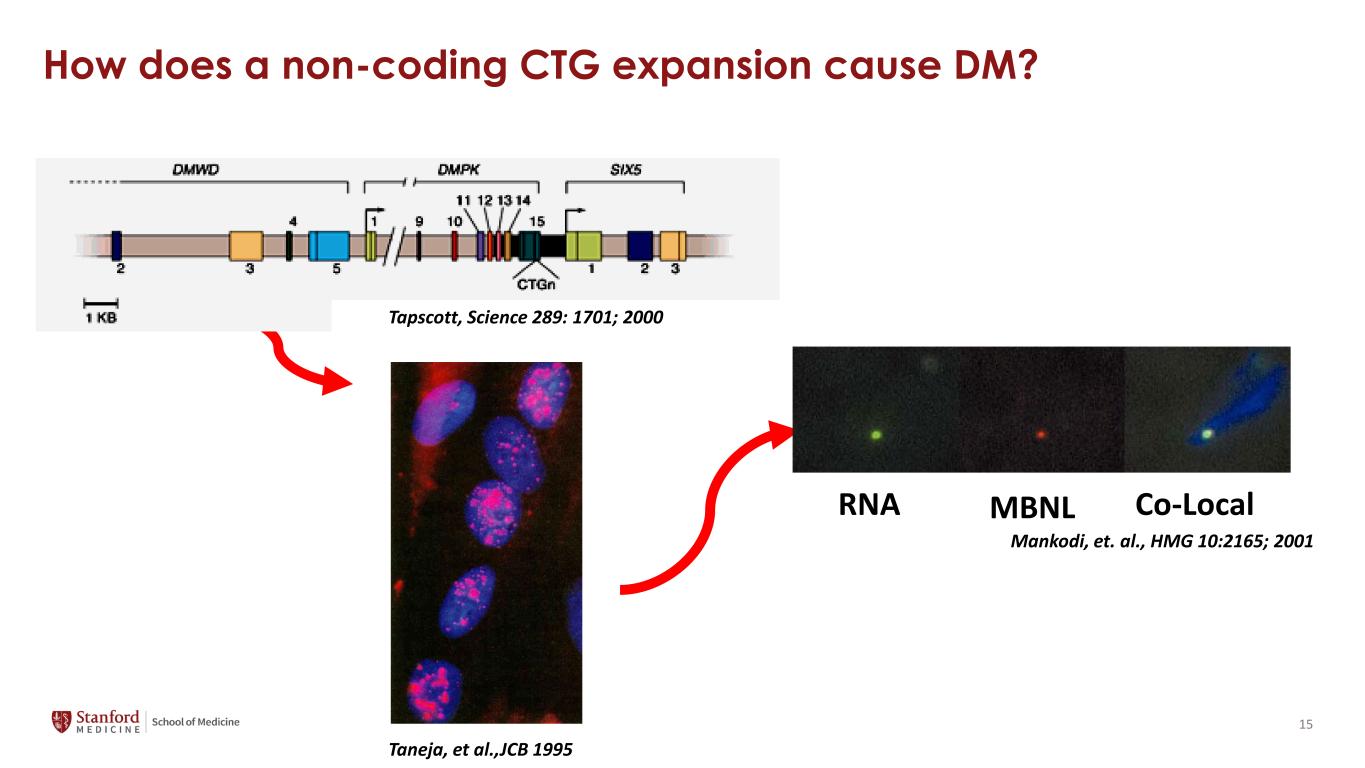
非編碼 CTG 擴展如何導致 DM?Taneja 等人,JCB 1995 RNA MBNL Co-Local Mankodi 等人,HMG 10:2165;2001 Tapscott,Science 289:1701;2000 15
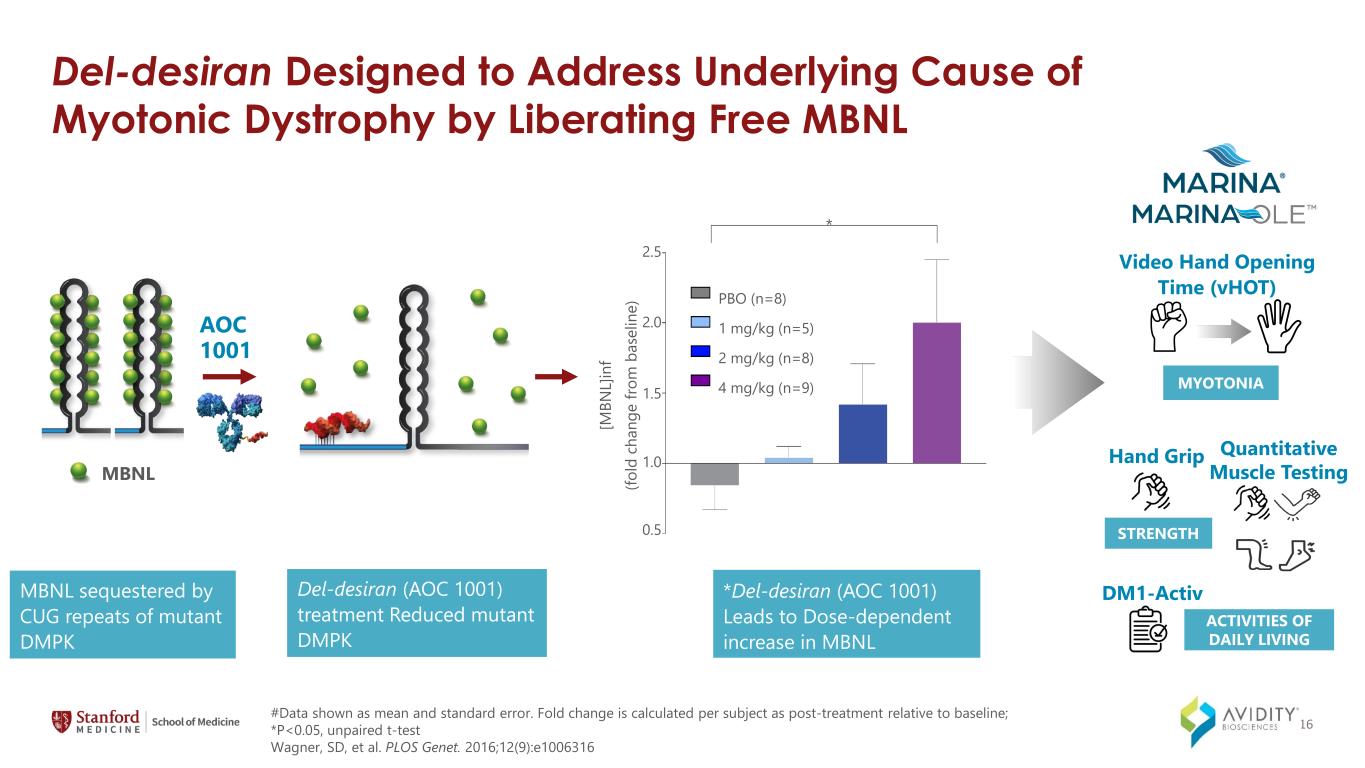
del-Desiran 旨在通過釋放遊離 MBNL del-Desiran (AOC 1001) 治療來解決肌強直性營養不良症的根本原因 del-Desiran (AOC 1001) 治療被突變體 DMPK AOC 1001 MBNL 的 CUG 重複序列隔離 DMPK MBNL [M BN L]在 f (fo ld c ha ng e from m b as el in e) 2.5 2.0 1.5 1.0 0.5 * PBO (n=8) 1 mg/kg (n=5) 2 mg/kg (n=8) 2 mg/kg (n=8) 4 mg/kg (n=9) #Data 顯示為平均誤差和標準誤差。摺疊變化是根據每個受試者的治療後相對於基線計算的;*P

來自針對 DM1 17 患者的MARINA-OLE試驗的長期安全性和有效性數據
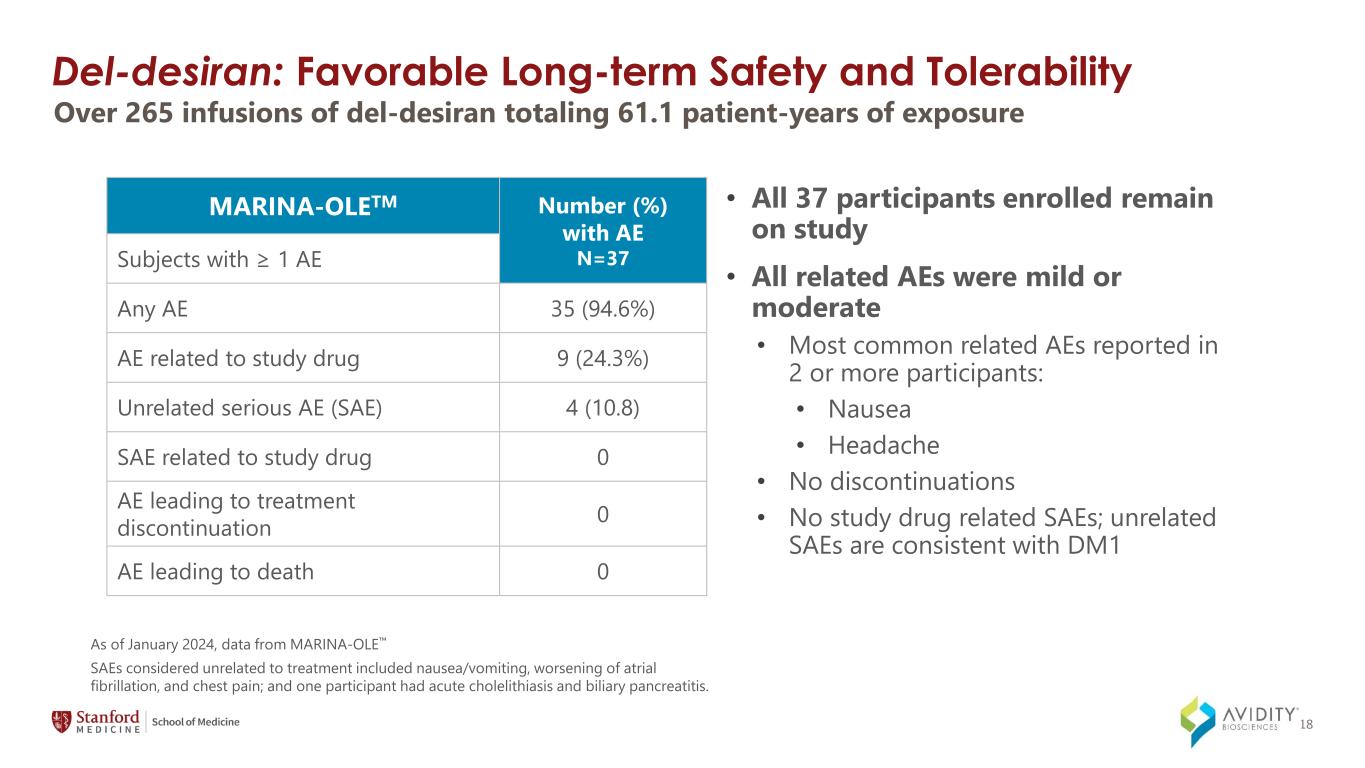
18 del-Desiran:良好的長期安全性和耐受性截至2024年1月,來自MARINA-OLE的數據 • 所有37名受試者仍在研究中 • 所有相關不良反應均為輕度或中度 • 在2名或更多參與者中報告的最常見的相關不良反應:• 噁心 • 頭痛 • 未停藥 • 無研究藥物相關SAE;與治療無關的DM1 SAE一致,包括噁心/嘔吐、心房顫動惡化,以及胸痛;一名參與者患有急性膽石症和膽源性胰腺炎。超過 265 次 del-desiran 注射總計 61.1 個患者年數 MARINA-OLETM 數量 (%),AE N=37 AE ≥ 1 的受試者任何 AE 35 (94.6%) AE 與研究藥物 9 (24.3%) 無關的重度 AE (SAE) 4 (10.8) SAE 導致中止治療 0 AE 導致死亡

19 • 非介入性 NHS 旨在增進對 DM1 患者疾病進展的理解 • 側重於臨牀結果評估,以支持 DM1 療法的開發 • 700 名患者,2 年研究,約 20 箇中心 • 由肌張力萎縮症臨牀研究網絡 (DMCRN) 設計和運營 • 獲得 FDA、MDA、MDF 支持;Avidity 是多個贊助組織之一 END-DM1 自然史研究:瞭解 DM1 疾病進展

20 個 END-DM1 數據依據設計 MARINA® 和 3 期 HARBOR 試驗的相同終點測得出的臨牀試驗地點與 MARINA® 和 HARBOR 基於護理標準的當代數據集重疊在 END-DM1 自然史研究中接受了至少一年的隨訪數百名患者今天首次公佈了為期一年的數據
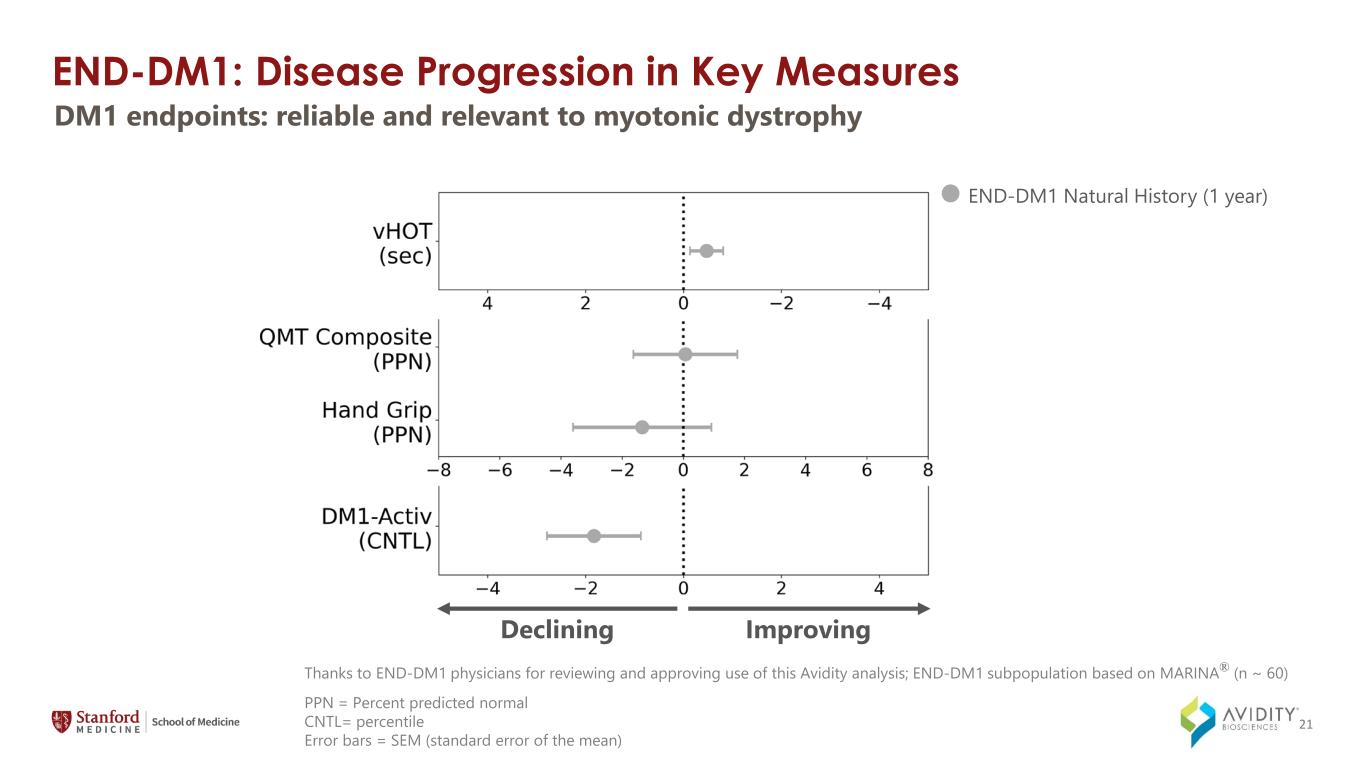
END-DM1:關鍵指標中的疾病進展 END-DM1 自然史(1 年)4 mg/kg Q12W(1 年)改善/下降的 DM1 終點:可靠且與肌強直性營養不良相關 PPN = 預測正常 CNTL= 百分位誤差條 = SEM(平均值的標準誤差)感謝 END-DM1 醫生審查並批准使用此 Avidity 分析;END-DM1 亞羣基於 MARINA® (n ~ 60) 21
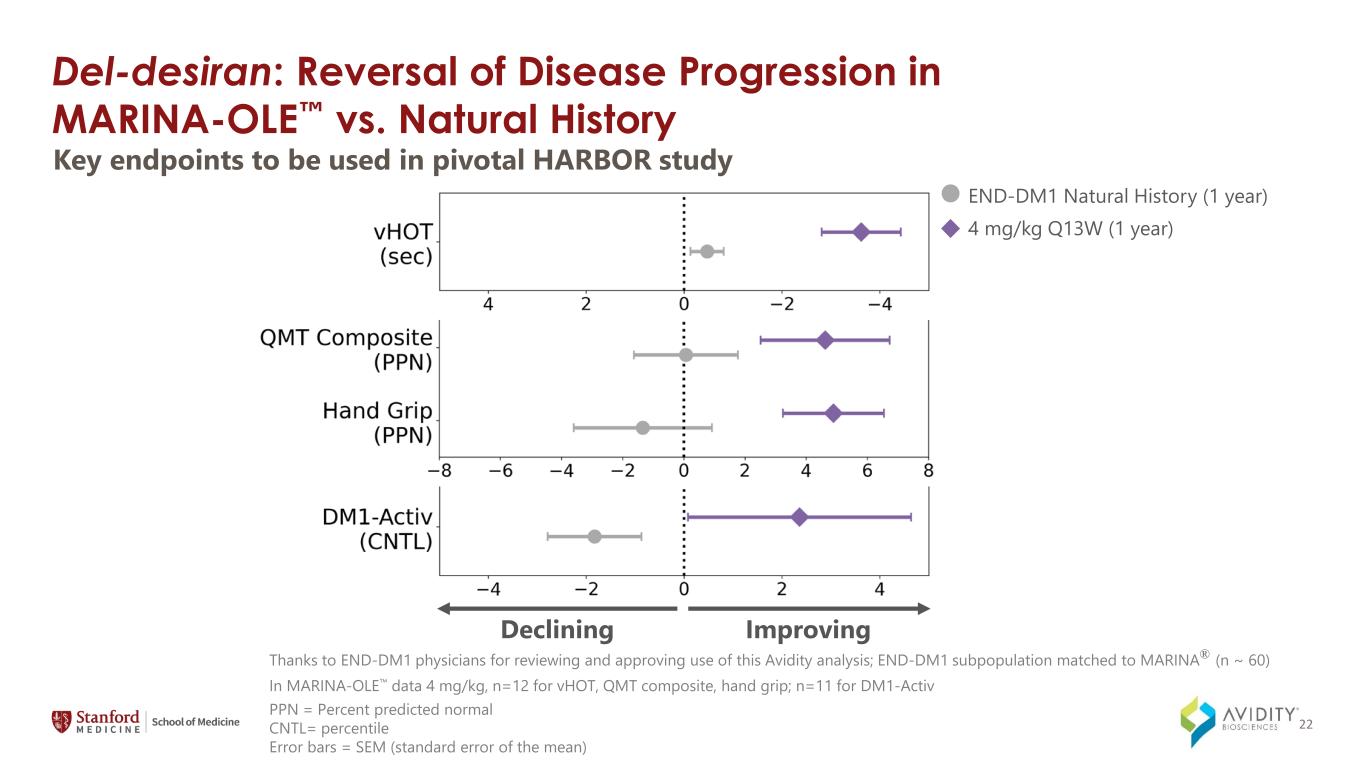
del-Desiran:MARINA-OLE 與自然史的疾病進展逆轉關鍵終點將用於關鍵的 HARBOR 研究改善/下降的 PPN = 預測的正常 CNTL 百分比誤差條 = SEM(平均值的標準誤差)感謝 END-DM1 醫生審查並批准使用這種 Avidity 分析;END-DM1 亞羣與 MARINA®(n ~ 60)相匹配,在 MARINA-OLE 數據中 4 mg/kg,vHOT,QMT 的 n=12 複合材料,握把;對於 DM1-Activ END-DM1 自然歷史(1 年)4 mg/kg Q13W(1 年),n=11
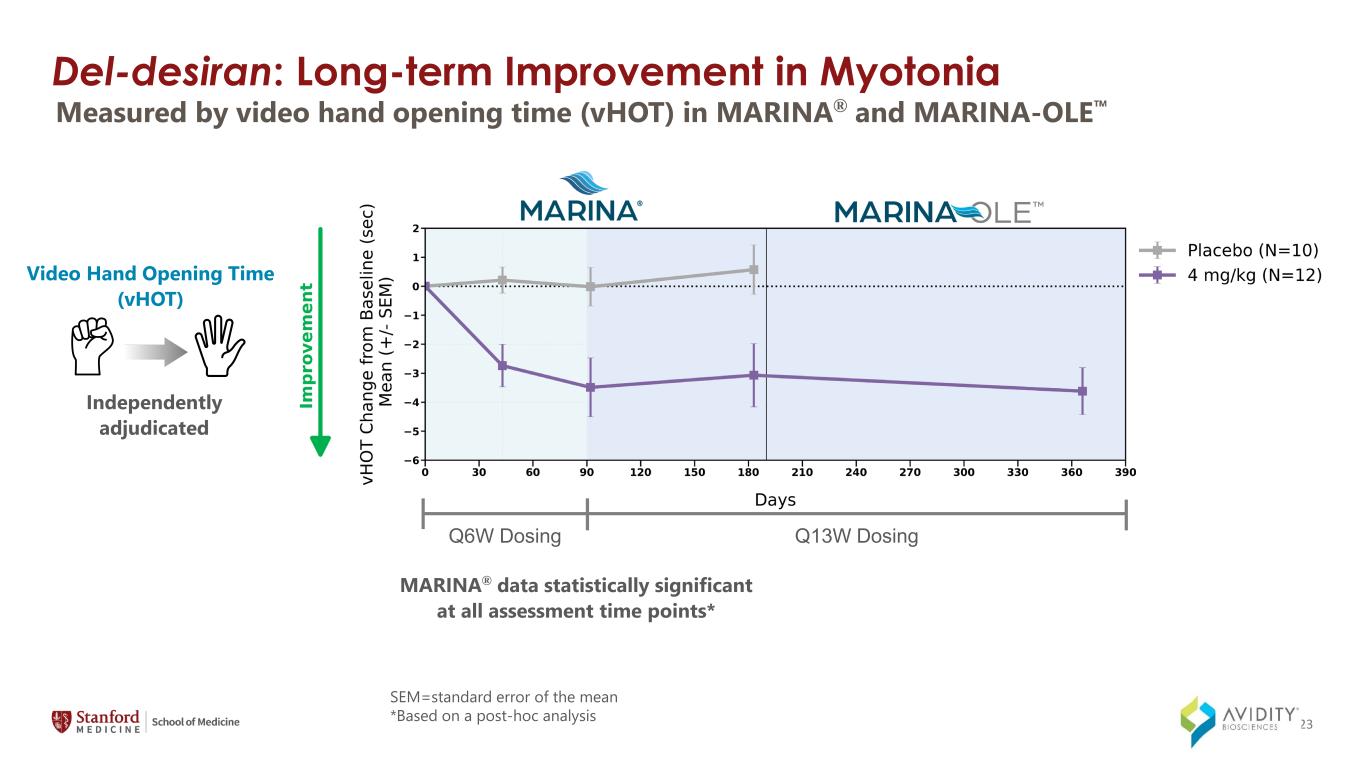
del-Desiran:肌張力長期改善以視頻手開時間 (vHOT) 衡量的 MARINA® 和 MARINA-OLE MARINA® 數據在所有評估時間點均具有統計學意義* 視頻開手時間 (vHOT) 獨立裁定 Q6W 劑量 Q13W 劑量 SEM=平均值的標準誤差 *基於事後分析 23
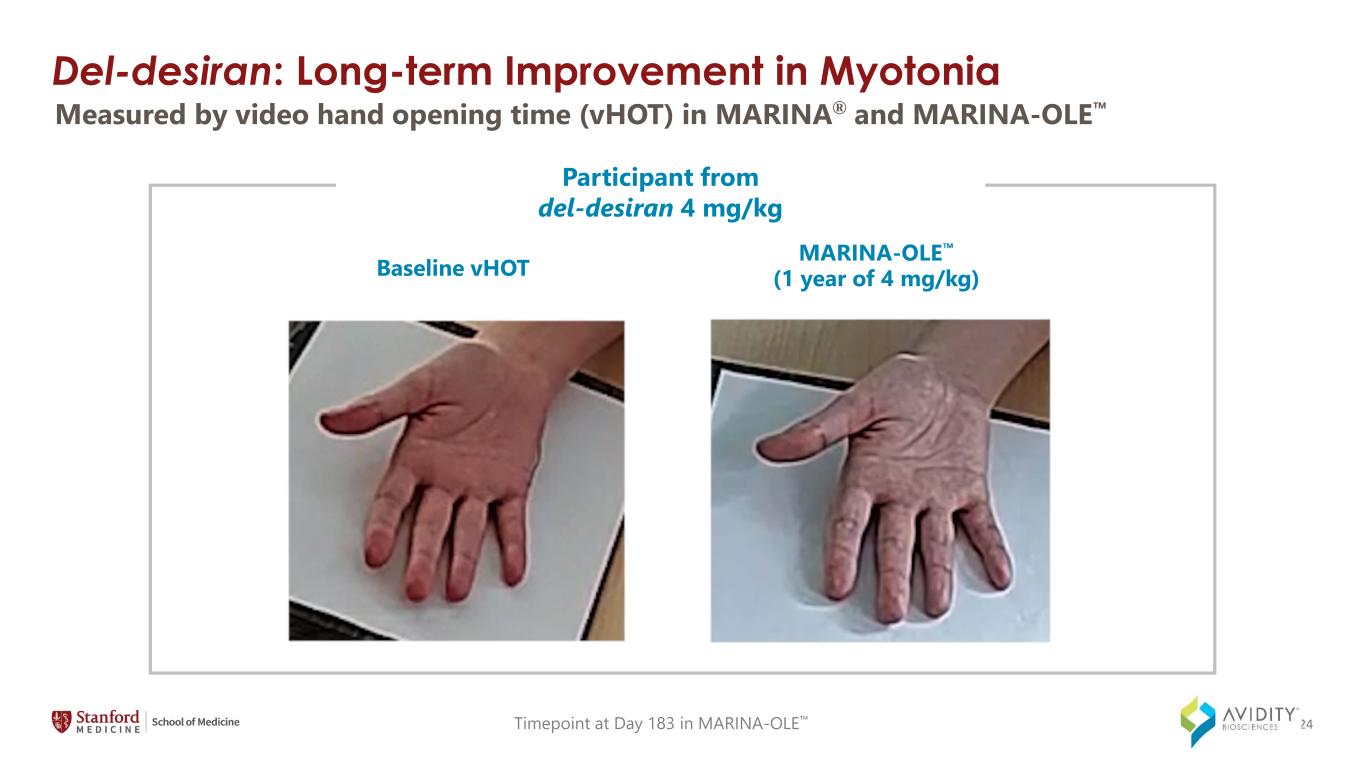
del-Desiran:肌張力基線 vHOT MARINA-OLE(1 年 4 mg/kg)的長期改善 `來自 del-Desiran 的參與者在 MARINA-OLE 第 183 天的 4 mg/kg 時間點以 MARINA® 和 MARINA-OLE 24 中的視頻開手時間 (vHOT) 測量
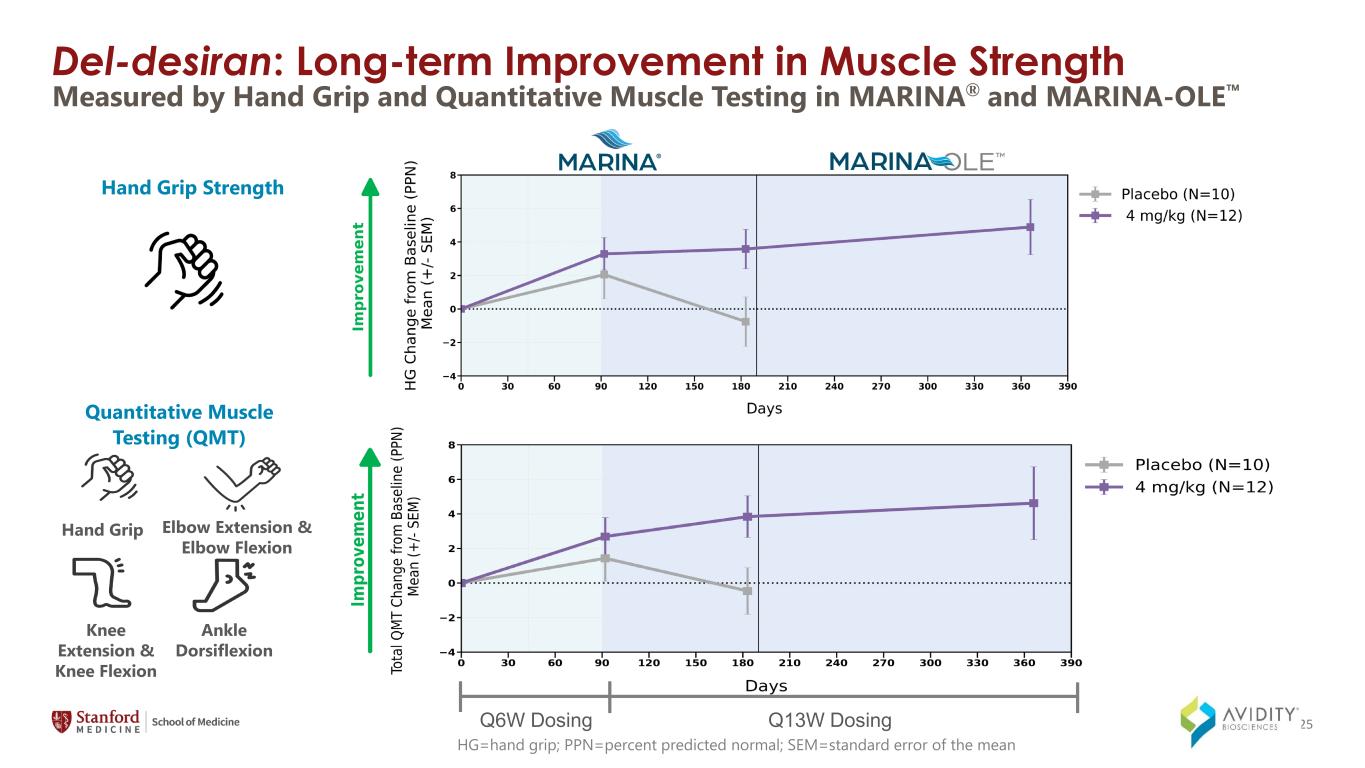
del-Desiran:肌肉力量的長期改善 hg=手部握力;PPN=預測正常百分比;sem=平均定量肌肉測試 (QMT) 手握肘部伸展和肘部屈曲膝蓋伸展和膝蓋屈曲腳踝背屈手握力 Q6W 劑量 Q13W 劑量通過MARINA® 和 MARINA-OLE 25 中的手握和定量肌肉測試測量
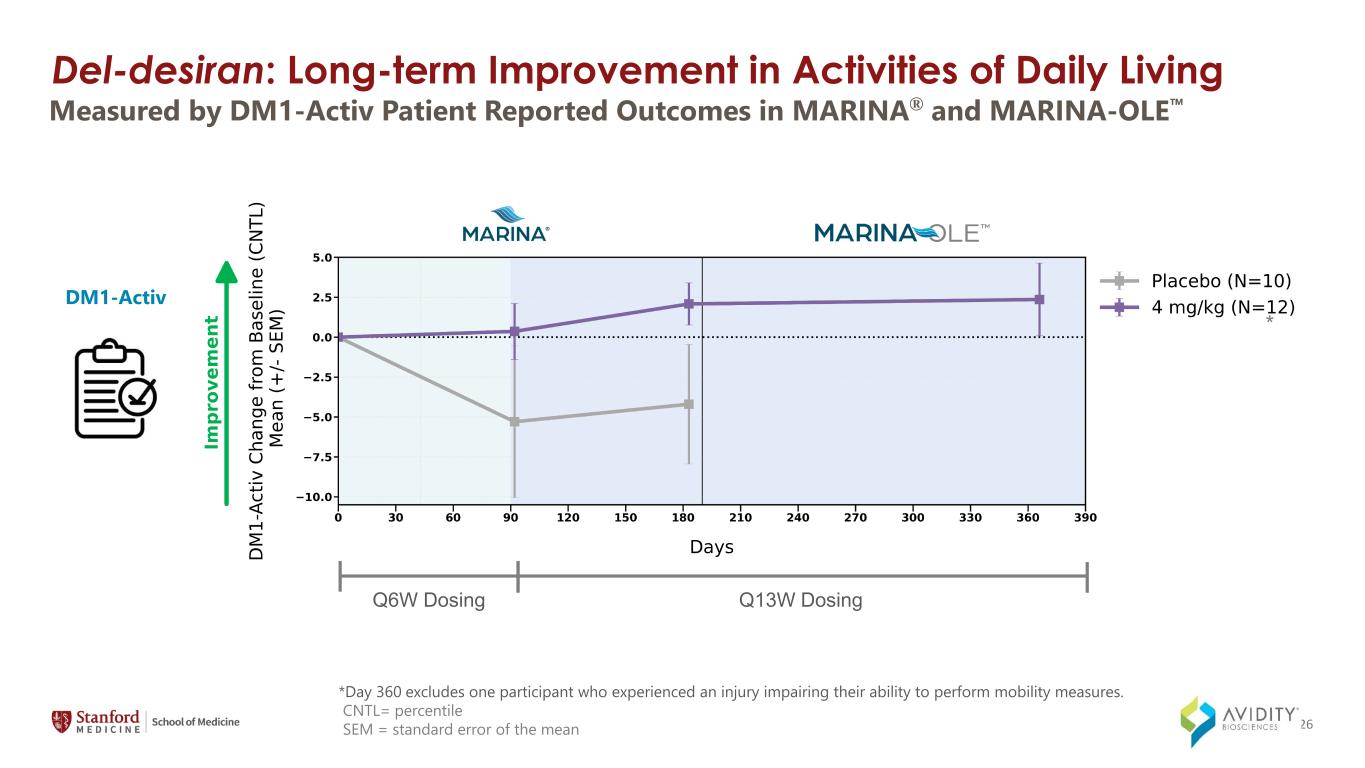
*第 360 天不包括一名因受傷而無法採取行動措施的參與者。CNTL= 百分位數 SEM = 由 DM1-Activ 患者報告的 MARINA® 和 MARINA-OLE DM1-Activ Q6W 劑量 Q13W 劑量 Q13W 劑量測得的平均值的標準誤差 * 26 del-Desiran:日常生活活動的長期改善

27 del-Desiran 4 mg/kg • 表現出良好的長期安全性和耐受性 • 與 END-DM1 自然史數據相比,MARINA® 和 MARINA-OLE 的疾病進展出現逆轉 • 對多個臨牀終點進行了持續而持久的改進 Global HARBOR 試驗啟動 2024 年第二季度 MARINA-OLE 數據摘要 del-desiran 有可能成為 DM1 患者的變革性療法 END-DM1 自然史(1 年)4 mg/kg Q13W(1 年)

28 議程/概要徹底改變核糖核酸的交付 Sarah Boyce,總裁兼首席執行官進入第三階段:HARBORTM 試驗 Steve Hughes,醫學博士,首席營銷官 • MARINA-OLE 長期療效和安全性數據 John W. Day,醫學博士,斯坦福大學醫學院神經病學和兒科教授兼神經肌肉醫學部主任 • 為DM1患者提供服務 Steve Hughes,醫學博士,首席營銷官閉幕詞莎拉·博伊斯,總裁兼首席執行官問答環節 Avidity Management 和戴博士,斯坦福大學主持人:IR/CC 副總裁傑夫·格蘭德

29 患者體驗:del-desiran 對他們生活的影響我在 6 月份開始服用這種藥物,大概在我第一次輸液兩週後,我打開了一個氣泡瓶,這是我永遠做不到的。那是一個扭曲的流行酒瓶... 它馬上就打開了。我的力量更好了,我的視野更好了,我的雙手也在工作。我有更多的力量,我可以把它們伸出來。我可以打開東西,我可以打開門把手以及所有這些更難的東西。比如,我的上臂力量好多了。我能走得更好。我不需要一直戴護頸,一切都改善了很多。“”

30 位患者體驗:del-desiran 對他們生活的影響在研究之前我無法站穩腳跟,自從我恢復鍛鍊以來,我實際上可以重新站起來了。所以希望能增強一些力量。肌張力障礙,如果我能揮出拳頭,我就無法張開手... 我能夠毫無問題地擠出拳頭張開手。我説話的時候我的舌頭會抽筋,而且自從第一次服藥以來我就沒有出現過任何這種情況的跡象。“”

31 患者體驗:del-desiran 對他們生活的影響我注意到一個非常大的不同,那就是在我出現更多症狀之前,我曾經是一個非常活躍的人。經過幾輪輸液,我實際上已經能夠回到健身房開始鍛鍊身體,與教練一起工作。這都是因為我的機動性肯定提高了。我的活動範圍也擴大了。我認為令人驚訝的是,當我被診斷出來時,我被告知沒有治療方法,沒有治癒方法。這項研究給了我很多希望。我希望能夠與社區中擁有 DM1 的其他人分享。“”

32 議程/大綱徹底改變核糖核酸的交付 Sarah Boyce,總裁兼首席執行官進入第三階段:HARBORTM 試驗 Steve Hughes,醫學博士,首席營銷官 • MARINA-OLE 長期療效和安全性數據 John W. Day,醫學博士,斯坦福大學醫學院神經病學和兒科教授兼神經肌肉醫學部主任 • 為DM1患者提供服務 Steve Hughes,醫學博士,首席營銷官閉幕詞莎拉·博伊斯,總裁兼首席執行官問答環節 Avidity Management 和戴博士,斯坦福大學主持人:IR/CC 副總裁傑夫·格蘭德

33 我們的願景通過革新 RNA 療法的交付來深刻改善人們的生活 Luke Living with DM1

投資者和分析師活動系列 — 第 8 卷轉變肌強直性營養不良症全球第 3 期 HARBOR 試驗和長期 MARINA-OLE 數據問答 2024 年 3 月 4 日納斯達克:RNA | aviditybio.com

投資者和分析師活動系列 — 第 8 卷轉變肌強直性營養不良症全球第 3 期 HARBOR 試驗和長期的 MARINA-OLE 數據 2024 年 3 月 4 日納斯達克:RNA | aviditybio.com